Как правильно разбавлять протеин, разводить протеины и готовить коктейли
7 ноября 2019
Протеин – это одна из самых востребованных и популярных добавок в спортивном питании, поскольку он, являясь по сути белком, способствует наращиванию мышечной массы, созданию красивого рельефа мускулатуры, а также помогает атлетам сделать тренировки более эффективными.
Однако, впервые покупая протеиновый порошок, многие задумываются о том, как правильно приготовить коктейль из него, не нарушая главных полезных свойств и основных качественных характеристик. На самом деле это не сложно, нужно лишь придерживаться рекомендаций по приготовлению и употреблению.
Как и в какой жидкости растворять протеин
Обычно протеин выпускается в виде порошка, который перед употреблением необходимо растворить в какой-либо жидкости. Это может быть обычная вода, сок или молоко, но обязательно комнатной температуры. Не рекомендуется разводить протеин в горячей жидкости, так как белок может свернуться и потерять свои полезные свойства.
В чем именно растворять протеин порошок, каждый выбирает в зависимости от своих предпочтений. Кому-то нравятся натуральные соки, а кто-то выбирает молоко, которое должно иметь жирность 0,5-1,5%. И это никак не повлияет ни на вкусовые качества, ни на пользу протеина.
Чтобы порошок хорошо растворился, необходимо использовать шейкер для спортивного питания, купить который по лучшей цене в Украине можно в магазине спортивных товаров Mordex.Net. В нем готовый протеин коктейль можно взять с собой на тренировку, либо приготовить его прямо в спортзале. Для этого в шейкер заливается 200-300 мл жидкости, засыпается протеиновый порошок в количестве 30 г (3 ст. ложки) и тщательно перемешивается путем взбалтывания и перемещением шейкера вверх-вниз несколько раз. Придать коктейлю более насыщенный вкус можно добавлением в него меда, какао или фруктового сиропа.
Чтобы определиться с нужной густотой коктейля, можно увеличить количество жидкости до 400-500 мл, не увеличивая при этом порцию протеинового порошка. При выборе подходящего варианта консистенции каждый спортсмен ориентируется на свои вкусовые предпочтения.
При выборе подходящего варианта консистенции каждый спортсмен ориентируется на свои вкусовые предпочтения.
Чтобы приготовить протеиновый коктейль в домашних условиях, можно использовать блендер или миксер, в которых масса получается более однородной и без комочков. К тому же, в этом случае можно добавить кусочки свежих фруктов, что существенно улучшит вкус добавки.
Рекомендации как разбавлять и пить протеин
Перед решением начать принимать протеиновые коктейли, необходимо обратиться к своему тренеру за консультацией. Он поможет правильно составить рацион питания и подберет суточную дозировку протеина. Обычно она рассчитывается индивидуально по определенной формуле и зависит от веса спортсмена, поставленных целей и общего состояния организма. Чаще всего рекомендуется употреблять не более 1-2 коктейлей в сутки.
Одной из главных ошибок новичков является то, что они принимают протеин вместо основных приемов пищи. Такое просто недопустимо, поскольку не принесет нужных результатов и не даст желаемого эффекта. Протеиновый коктейль необходимо пить между основными приемами пищи, употреблять в качестве перекуса, либо принимать через час после интенсивного тренировочного процесса.
Протеиновый коктейль необходимо пить между основными приемами пищи, употреблять в качестве перекуса, либо принимать через час после интенсивного тренировочного процесса.
Рассказать
Поделиться
Поделится
Поделится
Как разводить протеин с водой и молоком? Пропорции, правила приема
Протеин — это белковая пищевая добавка. Прием протеина обусловлен необходимостью набора дневной нормы белка. Это особенно касается бодибилдеров и людей, которые стремятся к построению рельефного и мощного мышечного корсета. Купив порошок в спортивном магазине, люди задаются вопросом: «А как разводить протеин?».
Как выбрать основу для разведения протеина?
Протеин обычно разводиться молоком или водой. Иногда протеин замешивают на соке, компоте, кефире, чае, лимонаде и т. д. Молоко является идеальным вариантом. Оно богато кальцием, белком и полезными углеводами. Но если есть непереносимость лактозы, то от молока придется отказаться в пользу воды или другой основы.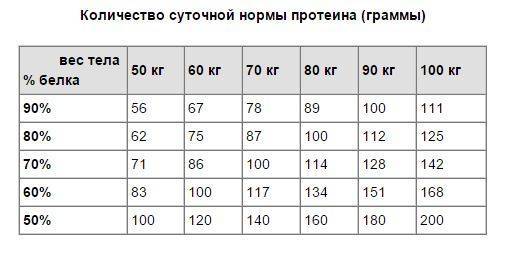 Даже если с лактозой у вас все в порядке, учитывайте следующее:
Даже если с лактозой у вас все в порядке, учитывайте следующее:
- молоко добавит калорийности;
- на молоко организм реагирует резким скачком инсулина.
При всем при этом молоко улучшает вкус коктейля. Если вы соблюдаете диету, то учитывайте калорийность молока и инсулиновый ответ организма. Вам необходимо держать инсулин на низком уровне. Однако протеиновый коктейль с утра — это хорошая идея даже для худеющих, так как чувствительность к инсулину с утра высокая, и углеводная толерантность тоже высока. Если вы хотите набрать мышечную массу, то коктейль на молоке — отличное решение.
Как принимать протеин?
На упаковке продукта производитель обязательно пишет инструкцию по применению. На всех банках с протеином можно найти информацию о количестве микронутриентов и других питательных веществ, содержащихся в одной мерной ложке. Прежде чем начинать принимать, стоит ознакомиться с инструкцией к продукту. Некоторые протеины низкоуглеводные, в других достаточно много углеводов. В некоторых протеиновых порошках больше белка, чем в других.
В некоторых протеиновых порошках больше белка, чем в других.
Только ознакомившись с составом и учитывая свои дневные нормы, можно высчитать необходимое количество протеина. Однако, вне зависимости от этого, существуют общие рекомендации. Например, в дни тренировок протеин рекомендуется принимать дважды. Первый раз — за один час до начала тренировки. Это позволит защитить мышцы от распада и подкормит их во время тренировки. Второй раз — сразу после тренировки в течение получаса. В это время организму для восстановления сил нужны питательные вещества и особенно белок.
Вообще, получить дневную норму белка из протеина очень легко. Но профессионалы не рекомендуют этого делать. Лучше всего получать белок по схеме 50/50, т. е. 50 % из натуральной белковой пищи, и 50 % из протеинового порошка.
Схема приема протеина
Построение спортивного тела невозможно без белков. Все белковые смеси делятся на быстрые, медленные и комплексные.
Быстрые протеиновые смеси пьют утром и после тренировки для восполнения запасов аминокислот. Медленный протеин принимают на ночь, чтобы обеспечить клетки и ткани необходимым запасом питательных веществ. Если вы стремитесь сбросить вес, то можете заменить медленным протеином один прием пищи. Комплексные смеси можно употреблять как после тренировки, так и перед сном.
Медленный протеин принимают на ночь, чтобы обеспечить клетки и ткани необходимым запасом питательных веществ. Если вы стремитесь сбросить вес, то можете заменить медленным протеином один прием пищи. Комплексные смеси можно употреблять как после тренировки, так и перед сном.
Количество белка в сутки
После тренировки «на массу» рекомендуется принять 20-40 грамм белка в течение получаса. Количество белка зависит от мышечной массы. Есть рекомендация: не принимать более 30 грамм белка за один прием пищи. Этот показатель индивидуальный. Все зависит от здоровья организма, в частности, почек, и от способности организма переварить определенное количество белка. Знайте, что съедая, например, 200 грамм куриной грудки, вы потребляете за раз 46 грамм белка.
Как рассчитать свою норму белка в сутки?
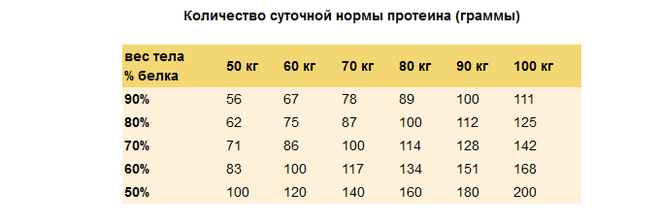
Рекомендуется в сутки потреблять 2-3 грамма белка на 1 кг веса. Для женщин эта норма немного меньше, чем для мужчин. Так, если вы женщина весом 60 кг, то дневная норма белка для вас составляет 120 грамм. Из них 60 грамм вы можете получать из протеинового порошка. Если вы мужчина, весом 60 кг, то вы вполне можете потреблять 180 грамм белка в сутки. Из них 90 грамм должны приходиться на натуральную пищу (куриная грудка, сыр, творог, молоко, яйца и прочие высокобелковые продукты).
Из них 60 грамм вы можете получать из протеинового порошка. Если вы мужчина, весом 60 кг, то вы вполне можете потреблять 180 грамм белка в сутки. Из них 90 грамм должны приходиться на натуральную пищу (куриная грудка, сыр, творог, молоко, яйца и прочие высокобелковые продукты).
Как разводить протеин?
Обычно одна мерная ложка протеинового порошка составляет 30 грамм. Стандартов по пропорциям не существует. Все зависит от вкусовых предпочтений. Чем больше порошка и меньше основы, тем слаще будет коктейль. Многое зависит и от самой основы. Например, коктейли на молоке слаще, чем на воде.
Итак, как разводить протеин с молоком? пропорции и количество указаны ниже.
На молоке протеиновая смесь получается достаточно сладкой, поэтому рекомендуется одну мерную ложку, т. е. около 30 грамм, разводить в 500 мл молока. Если вы собираетесь выпить две мерные ложки, то вам потребуется литр молока. Если говорить о том, как правильно разводить протеин с молоком, то можно рекомендовать либо использовать большой объем жидкости (1 литр), либо смешать молоко с водой, чтобы не было приторно сладко.
Для приготовления коктейля нужно брать молоко невысокой жирности.
Второй по популярности основой для разведения протеинового порошка является вода.
Как разводить протеин с водой? Точно так же, как и с молоком, только нужно учитывать вкусовые особенности. Разводить протеин с водой, как рекомендуют это профессиональные атлеты и производители протеиновых смесей, лучше всего в ручном шейкере. Шейкеры можно купить в тех же спортивных магазинах, что и протеин.
Как разводить протеин с водой? Пропорции и количество очень важны. На воде протеин получается менее сладким. На одну мерную ложку будет достаточно 200-250 мл воды. А для двух мерных ложек хватит и 500 мл. Для этого используется негазированная минеральная, очищенная либо кипяченая вода.
Как разводить протеин в шейкере?
Почему многие рекомендуют пользоваться шейкером для приготовления протеиновых коктейлей? Потому что благодаря шейкеру можно получить максимально однородную массу, которая по консистенции не будет напоминать манную кашу из детского сада с жуткими комочками. Как правильно разводить протеин в шейкере? Достаточно просто налить в шейкер молоко, насыпать необходимое количество протеина, закрыть крышку и трясти шейкер до тех пор, пока масса не станет однородной. В ручных шейкерах для этого предусмотрены специальные шарики или сетки.
Как правильно разводить протеин в шейкере? Достаточно просто налить в шейкер молоко, насыпать необходимое количество протеина, закрыть крышку и трясти шейкер до тех пор, пока масса не станет однородной. В ручных шейкерах для этого предусмотрены специальные шарики или сетки.
Состав коктейля
Если протеин разводится на молоке, тогда в состав коктейля, кроме белка, входят еще и углеводы с жирами. Многие производители обогащают свой продукт витаминами, например, витамином В. Смысла в этом мало, так как потребность в витаминах покрывается пищей и витаминными добавками. Как разводить протеин, обогащенный минеральными добавками и витаминами? Лучше всего такой протеин принимать с водой. Почему? Все очень просто. Если протеин обогащен, например, железом, то его нельзя принимать с молоком. В самом молоке содержится достаточно большое количество витаминов. Некоторые компоненты молока могут нейтрализовать компоненты протеина. Зачем же производители обогащают протеин? Ради прибыли, все просто. Если и говорить об обогащении протеина, то лучше всего добавлять в него аминокислоты.
Если и говорить об обогащении протеина, то лучше всего добавлять в него аминокислоты.
Качество протеинового порошка
Идеальный белок для человека содержит на 1 грамм:
- Изолейцин — 40 мг.
- Лейцин — 70 мг.
- Лизин — 55 мг.
- Метионин и цистин в сумме — 35 мг.
- Фенилаланин и тирозин в сумме — 60 мг.
Идеальным для роста считается белок, соответствующий молоку матери. Ближе всего к нему подошел сывороточный протеин. На рынке сегодня присутствуют: сыворотки, яичный белок, казеин, соя, пшеничный белок. Растительный белок является неполноценным, так, например, в пшеничном белке содержится мало лизина.
Как разводить сывороточный протеин? Так же, как и любой другой. Сывороточный протеин — это не что иное, как белки, полученные из молочной сыворотки.
Усвояемость протеина
Усвояемость обычно напрямую связана с источником белка и с аминокислотным составом. Сывороточные протеины относятся к быстроусвояемым протеинам. Они перевариваются организмом в течение 2-3 часов. Казеин — это медленный белок, хотя он усваивается быстрее соевого. Но вы не найдете белок, который будет усваиваться более 5-6 часов. Медленные белки имеют преимущество перед быстрыми в том, что они оказывают постоянное и равномерное поступление аминокислот.
Они перевариваются организмом в течение 2-3 часов. Казеин — это медленный белок, хотя он усваивается быстрее соевого. Но вы не найдете белок, который будет усваиваться более 5-6 часов. Медленные белки имеют преимущество перед быстрыми в том, что они оказывают постоянное и равномерное поступление аминокислот.
Изолят сывороточного протеина
Изолят сывороточного протеина характеризуется высокой степенью очистки (более 85 % белка), в котором нет жиров и углеводов. При изготовлении изолята молочную сыворотку обезвоживают, удаляют лактозу, вредный холестерин, животный жир. Изолят помогает быстро восстановить мышцы после силовой тренировки, препятствует катаболизму и усиливает анаболизм.
Изолят, благодаря высокой очистке, менее аллергенный, чем концентрированные протеины. Эта добавка является незаменимой для бодибилдеров с непереносимостью лактозы. По сравнению с обычными изолятами, сывороточный лучше усваивается, оказывает антиоксидантное воздействие, повышает иммунитет.
100 % Whey Gold Standard — это сывороточный протеин, который достаточно распространен среди атлетов. Он идеально подходит после анаэробной тренировки. Как разводить протеин 100 % Whey Gold Standard с молоком? Для начала посчитайте, сколько белка в день вам нужно. Разделите пополам дневную норму. И из протеина потребляйте не больше половины. В идеале соотношение природного белка к протеину должно быть 2:1.
Он идеально подходит после анаэробной тренировки. Как разводить протеин 100 % Whey Gold Standard с молоком? Для начала посчитайте, сколько белка в день вам нужно. Разделите пополам дневную норму. И из протеина потребляйте не больше половины. В идеале соотношение природного белка к протеину должно быть 2:1.
Заключение
Если вы пьете протеин 2-3 раза в день, разделите норму на эти приемы. Обычно за один прием не принимается больше одной мерной ложки, т. е. 30 грамм. Мерная ложка, кстати, обычно идет в комплекте с протеином (внутри банки), но в этом лучше лишний раз убедиться, если вы покупаете продукт неизвестного вам ранее производителя. Для наращивания мышечной массы протеин делят на 5-6 приемов. Но обычно протеин пьют 1-2 раза в день. Если вы съели блюдо, богатое белками, то протеин лучше принимать через 3-4 часа после еды.
Протеин не заменяет приемы пищи. За исключением случаев, когда вам необходимо похудеть. Тогда можно заменить тяжелым протеином, например, казеиновым, один прием пищи. За основу лучше взять кефир. Как разводить протеин с кефиром? В 250 мл кефира растворите одну ложку порошка. Воспользуйтесь шейкером (лучше всего автоматическим), чтобы порошок качественно растворился в густой основе. Размешивать протеин можно и обычной вилкой, если хорошо постараться.
За основу лучше взять кефир. Как разводить протеин с кефиром? В 250 мл кефира растворите одну ложку порошка. Воспользуйтесь шейкером (лучше всего автоматическим), чтобы порошок качественно растворился в густой основе. Размешивать протеин можно и обычной вилкой, если хорошо постараться.
Если вы собираетесь взять коктейль на тренировку, чтобы выпить его сразу после тренировки, то перелейте его в термос, чтобы он не успел закиснуть в жару или замерзнуть в сильный холод. Готовый коктейль нужно выпить в течение 3 часов. Даже если он хранится в холодильнике, лучше использовать его в течение 5 часов. Протеиновые порошки, в составе которых находится креатин, выпиваются сразу после смешивания. При длительном контакте с жидкостью аминокислота креатин быстро деградирует.
Помните, что даже самый высокоочищенный, обогащенный и дорогой протеин не сравнится с натуральной пищей. Атлеты пытались заменить приемы пищи протеином. Они выяснили, как разводить протеин, пропорции тоже были соблюдены, но вот роста мышечной массы не последовало. Это значит только то, что протеин не заменит природного белка, который должен присутствовать в ежедневном рационе.
Это значит только то, что протеин не заменит природного белка, который должен присутствовать в ежедневном рационе.
Перед тем как начать пить протеин, посоветуйтесь со своим тренером. Он распишет ваш режим питания с учетом протеиновой добавки. Кроме этого, тренер может посоветовать вам хорошего производителя и расскажет, когда лучше употреблять сывороточный протеин, а когда казеиновый.
Если вы вегетарианец, вам подойдет соевый или пшеничный протеин. Но учитывайте то, что они, как и растения, не содержат все необходимые аминокислоты. Кроме того, соя и пшеница являются генномодифицированными растениями. А пшеница — это глютеновый белок, на который у многих есть скрытая, т. е. не установленная, аллергия. Если после приема соевого или пшеничного протеина у вас появляются неприятные ощущения (боль, вздутие, понос/запор), прекратите прием.
Протокол подготовки образцов для вестерн-блоттинга | Thermo Fisher Scientific
Хорошая подготовка образца имеет решающее значение для успешного разделения белковых полос при электрофорезе и вестерн-блоттинге. Ни один метод пробоподготовки или буфер не подходят для всех типов проб из-за разнообразия белковых проб. Однако приведенные ниже общие рекомендации и протоколы должны стать хорошей отправной точкой при подготовке образцов для электрофореза белков и последующего вестерн-блоттинга.
Ни один метод пробоподготовки или буфер не подходят для всех типов проб из-за разнообразия белковых проб. Однако приведенные ниже общие рекомендации и протоколы должны стать хорошей отправной точкой при подготовке образцов для электрофореза белков и последующего вестерн-блоттинга.
Поиск по всем доступным буферам для лизиса клеток
Важные замечания:
- Чтобы свести к минимуму вариабельность образцов, сохраняйте простые рабочие процессы подготовки образцов и используйте реагенты, оптимизированные для конкретного типа образца и целевых белков.
- Лизис клеток разрушает клеточные мембраны и органеллы, что приводит к нерегулируемой ферментативной активности, которая может снизить выход белка и привести к его деградации. Для предотвращения этих негативных эффектов к лизирующим реагентам следует добавлять ингибиторы протеаз и фосфатаз.
- Некоторые компоненты буфера могут мешать выбранной химической системе гель-электрофореза (например, трис-глицин, бис-трис) и вызывать различные артефакты при работе с гелем.
 Выбор химии гель-электрофореза, совместимой с буфером, в котором готовится образец, является самым простым путем. Однако, если нельзя изменить химическую систему гель-электрофореза, может потребоваться выполнить очистку образца, чтобы сделать образец совместимым с данной системой.
Выбор химии гель-электрофореза, совместимой с буфером, в котором готовится образец, является самым простым путем. Однако, если нельзя изменить химическую систему гель-электрофореза, может потребоваться выполнить очистку образца, чтобы сделать образец совместимым с данной системой. - Чтобы избежать недостаточного количества или перегрузки образцов, определите концентрацию белка в каждом образце перед электрофорезом с помощью совместимого анализа белка.
- Подготовка образцов клеточной культуры
- Подготовка образцов тканей
Приготовление лизата из клеточной культуры для вестерн-блоттинга
Материалы
| Cell lysis buffer (see table below for recommendations) | Sample buffer (loading buffer) (e.g., LDS Sample Buffer, 4x, Cat. No. NP0007) |
Protease и коктейль ингибиторов фосфатазы (например, Halt Protease and Phosphatase Inhibitor Cocktail, кат. № 78440 или Pierce Protease and Phosphatase Inhibitor Tablet, кат. № A32961) № 78440 или Pierce Protease and Phosphatase Inhibitor Tablet, кат. № A32961) | Дополнительно: восстановитель пробы № по каталогу NP0004) |
| Холодный фосфатно-солевой буфер (PBS) (например, пакеты с фосфатно-солевым буфером, № по каталогу 28372) | Tris-Glycine Native Sample Buffer, № по каталогу LC2673) |
| Анализ белка (например, анализ белка Pierce BCA, № по каталогу 23225) |
Рекомендации по буферу для лизиса
| Расположение целевого белка0039 | Реагент для экстракции белка млекопитающих M-PER | Неденатурирующий детергент в 25 мМ бициновом буфере (pH 7,6) |
|---|---|---|
| Целая клетка (полная экстракция белка) (белок связан с мембраной, ядерный или митохондриальный) 90PA0039 Buffer | 25 mM Tris-HCl pH 7.6 150 mM NaCl 1% NP-40 or Triton X-100 1% sodium deoxycholate 0.  | |
| Cytoplasmic | NP-40 Cell Lysis Buffer | 50 мМ Трис, рН 7,4 250 мМ NaCl 5 мМ ЭДТА 50 мМ NaF 1 мМ Na 3 VO 4 1% NP-40 |
3 90 буферы для лизиса.
Процедура
| 1. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. |
Для прикрепленных клеток
2. Поместите чашку для клеточных культур на лед, осторожно удалите культуральную среду и промойте клетки ледяным PBS. |
| 3. Аспирируйте PBS и добавьте охлажденный льдом буфер для лизиса (~1 мл на 10 7 клеток или 100-мм планшет; ~0,5 мл для 60-мм планшета; ~200-400 мкл для 6-луночного культурального планшета). . Аккуратно встряхните или взболтайте в течение 5 минут на льду. В качестве альтернативы : Клетки можно обработать трипсином и промыть PBS перед ресуспендированием в лизирующем буфере в микроцентрифужной пробирке. |
| 4. Соберите лизат и перенесите в микроцентрифужную пробирку. Образцы центрифуги при ~ 14 000 х г в течение 15 минут для осаждения клеточного мусора. |
| 5. Перенесите супернатант в новую микроцентрифужную пробирку и выбросьте осадок. |
Для суспензионно-культивируемых клеток
| 2. Осаждать клеточную суспензию центрифугированием при 2500 g в течение 10 минут. Откажитесь от супернатанта. |
3. Промойте клетки один раз, ресуспендировав клеточный осадок в охлажденном льдом PBS. Осадок клеток путем центрифугирования при 2500 x g в течение 10 минут. Осадок клеток путем центрифугирования при 2500 x g в течение 10 минут. |
| 4. Добавьте охлажденный льдом лизирующий буфер (~1 мл на 100 мг или ~100 мкл влажного клеточного осадка). Внесите смесь вверх и вниз, чтобы ресуспендировать осадок. |
| 5. Осторожно встряхивайте смесь в течение 10 минут. Удалите клеточный мусор путем центрифугирования при ~ 14 000 x g в течение 15 минут. |
| 6. Перенесите надосадочную жидкость в новую микроцентрифужную пробирку и выбросьте осадок. |
Определение концентрации белка с помощью BCA Protein Assay
| 7. Приготовленные разведенные стандарты альбумина (BSA). В качестве альтернативы : используйте предварительно разбавленные стандарты BSA. |
| 8. Приготовьте рабочий реагент, смешав 50 частей реагента BCA A с 1 частью реагента BCA B (50:1 реагент A:B). |
9. Внесите пипеткой по 25 мкл каждого стандарта или повторения неизвестного образца в лунку микропланшета (рабочий диапазон = 20–2000 мкг/мл). |
| 10. Добавьте по 200 мкл рабочего реагента в каждую лунку и тщательно перемешайте планшет на шейкере в течение 30 секунд. |
| 11. Накройте планшет и инкубируйте при 37°C в течение 30 минут. |
| 12. Охладить планшет до комнатной температуры. Измерьте поглощение при длине волны 562 нм или около нее на планшет-ридере. |
| 13. Определите концентрацию белка. |
Подсказка к протоколу
Анализы белков BCA имеют уникальное преимущество перед анализами Брэдфорда (анализы на основе красителя Кумасси), поскольку они совместимы с образцами, которые содержат до 5% детергентов, и на них гораздо меньше влияют различия в составе белков. , обеспечивая большую однородность и точность между белками.
Подготовка образцов для электрофореза белков
Денатурирующий электрофорез (SDS-PAGE)
- Подготовьте образец в соответствующем буфере для образцов, чтобы конечная концентрация буфера для образцов была 1X.
 Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| SDS/LDS sample buffer (4X)* | 2,5 мкл | 2.5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Total volume | 10 мкл* | 10 мкл* |
*Для трициновых гелей рекомендуется использовать буфер для образцов Tricine SDS.
- 2. Нагрейте образцы при 70°C в течение 10 минут.
- 3. Нанесите образцы на белковый гель бис-трис, трис-ацетат или трис-глицин.
Наконечник протокола
Нагревание образца при 100°C в SDS-содержащем буфере может привести к протеолизу.
Неденатурирующий электрофорез (Native-PAGE)
- Подготовьте образец в соответствующем буфере для образцов, чтобы конечная концентрация буфера для образцов была 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| Native sample buffer (2X) | 5 μL | 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Общий объем | 10 мкл* | 10 мкл* |
- 2.
 Загрузите образцы трис-глицина протеина.
Загрузите образцы трис-глицина протеина.
Приготовление лизата из тканей для вестерн-блоттинга
Материалы
| Буфер для лизиса клеток (рекомендации см. в таблице ниже) | Буфер для образцов (загрузочный буфер) (например, LDS Sample Buffer, 4x, кат. № NP0007) |
| Смесь ингибиторов протеазы и фосфатазы (например, Halt Protease and Phosphatase Inhibitor Cocktail, кат. Кат. № A32961) | Дополнительно: восстановитель пробы (например, NuPAGE Sample Reduction Agent (10X), кат. № NP0004) |
| Холодный фосфатно-солевой буфер (PBS) | Выполнение нативного PAGE: буфер для нативных образцов (например, Tris-Glycine Native Sample Buffer, № по каталогу LC2673) |
| Анализ белка (например, анализ белка Pierce BCA, № по каталогу 3) 9025 2325 |
Просмотр или загрузка рецептов буфера
Рекомендации по буферу для лизиса
| Местоположение целевого белка | Рекомендуемый буфер | Описание |
|---|---|---|
| Целая клетка (экстракция общего белка) | T-PER Tissue Protein Extraction Reagent (мягкий лизирующий буфер для сохранения белок-белковых взаимодействий и минимизации денатурации) хлорид (рН 7,6) | |
| Цельная клетка (экстракция общего белка) (белок мембраносвязанный, ядерный или митохондриальный) | Лизисный буфер RIPA (содержит культовые детергенты, помогающие перевести белки в раствор) | 25 мМ Tris-HCl pH 7,6 150 мМ NaCl 1% NP-40 или Triton X-100 1% дезоксихолат натрия 0,1% SDS |
02
02 Процедура
1. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. |
| 2. Препарируйте интересующую ткань на льду и взвесьте образцы. Используйте соотношение ~ 50 мг ткани к 1000 мкл ледяного лизирующего буфера. Используйте меньший объем лизирующего буфера, если требуется более концентрированный белковый экстракт. |
| 3. Добавьте необходимое количество охлажденного льдом лизирующего буфера к образцу ткани и гомогенизируйте на льду. |
4. Центрифугируйте образец при 10 000 g в течение 5 минут для осаждения остатков клеток/тканей. |
| 5. Перенесите надосадочную жидкость в новую микроцентрифужную пробирку и выбросьте осадок. |
Определение концентрации белка с помощью BCA Protein Assay
| 6. Приготовленные разведенные стандарты альбумина (BSA). В качестве альтернативы : используйте предварительно разбавленные стандарты BSA. |
| 7. Приготовьте рабочий реагент, смешав 50 частей реагента BCA A с 1 частью реагента BCA B (50:1 реагент A:B). |
| 8. Внесите пипеткой по 25 мкл каждого стандарта или повторения неизвестного образца в лунку микропланшета (рабочий диапазон = 20–2000 мкг/мл). |
| 9. Добавьте по 200 мкл рабочего реагента в каждую лунку и тщательно перемешайте планшет на шейкере в течение 30 секунд. |
| 10. Накройте планшет и инкубируйте при 37°C в течение 30 минут. |
11. Охладить планшет до комнатной температуры. Измерьте поглощение при длине волны 562 нм или около нее на планшет-ридере. |
| 12. Определите концентрацию белка в каждом лизате клеток. Определите, сколько белка нужно загрузить (рекомендуется <50 мкг/лунку). |
Подсказка к протоколу
Анализы белков BCA имеют уникальное преимущество перед анализами Брэдфорда (анализы на основе красителя Кумасси), поскольку они совместимы с образцами, которые содержат до 5% детергентов, и на них гораздо меньше влияют различия в составе белков. , обеспечивая большую однородность и точность между белками.
Подготовка образцов для электрофореза белков
Денатурирующий электрофорез (SDS-PAGE)
- 1. Подготовьте образец в соответствующем буфере для образцов так, чтобы конечная концентрация буфера для образцов была 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| SDS/LDS sample buffer (4X)* | 2,5 мкл | 2. 5 μL 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Total volume | 10 мкл* | 10 мкл* |
*Для трициновых гелей рекомендуется использовать буфер для образцов Tricine SDS.
- 2. Нагрейте образцы при 70°C в течение 10 минут.
- 3. Нанесите образцы на белковый гель бис-трис, трис-ацетат или трис-глицин.
Неденатурирующий электрофорез (Native-PAGE)
- 1. Подготовьте образец в нативном буфере для образцов таким образом, чтобы конечная концентрация буфера для образцов составляла 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Реагент | Снижение образца | Неокрашенная образец |
|---|---|---|
| Протеиновый образец | x мкл | x x x x x x ° | x мкл | x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x. 0035 0035 | Native sample buffer (2X) | 5 μL | 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | Отдо 10 мкл |
| Общий объем | 10 мкл* | 10 мкл* |
- 2. Нагрузки на протекание Tris-Glycine или Tris-Acetate.
Наконечник протокола
Нагревание образца при 100°C в SDS-содержащем буфере может привести к протеолизу. Мы рекомендуем нагревать образцы для денатурирующего электрофореза (восстановленного или невосстановленного) при 70°C в течение 2–10 минут для получения оптимальных результатов. Не нагревайте образцы для неденатурирующего (нативного) электрофореза.
Совет по протоколу
Не храните уменьшенные образцы. Подготовьте запас образцов (как в таблице примеров, за исключением восстановителя) и храните его при температуре -20ºC или -80ºC. Разбавьте образец восстановителем (10X) перед использованием.
Разбавьте образец восстановителем (10X) перед использованием.
Подготовка образцов клеточной культуры
Приготовление лизата из клеточной культуры для вестерн-блоттинга
Материалы
| Cell lysis buffer (see table below for recommendations) | Sample buffer (loading buffer) (e.g., LDS Sample Buffer, 4x, Cat. No. NP0007) |
| Protease и коктейль ингибиторов фосфатазы (например, Halt Protease and Phosphatase Inhibitor Cocktail, кат. № 78440 или Pierce Protease and Phosphatase Inhibitor Tablet, кат. № A32961) | Дополнительно: восстановитель пробы № по каталогу NP0004) |
| Холодный фосфатно-солевой буфер (PBS) (например, пакеты с фосфатно-солевым буфером, № по каталогу 28372) | Tris-Glycine Native Sample Buffer, № по каталогу LC2673) |
| Анализ белка (например, анализ белка Pierce BCA, № по каталогу 23225) |
Рекомендации по буферу для лизиса
| Расположение целевого белка0039 | Реагент для экстракции белка млекопитающих M-PER | Неденатурирующий детергент в 25 мМ бициновом буфере (pH 7,6) |
|---|---|---|
| Целая клетка (полная экстракция белка) (белок связан с мембраной, ядерный или митохондриальный) 90PA0039 Buffer | 25 mM Tris-HCl pH 7. 6 6 150 mM NaCl 1% NP-40 or Triton X-100 1% sodium deoxycholate 0.1% SDS | |
| Cytoplasmic | NP-40 Cell Lysis Buffer | 50 мМ Трис, рН 7,4 250 мМ NaCl 5 мМ ЭДТА 50 мМ NaF 1 мМ Na 3 VO 4 1% NP-40 |
3 90 буферы для лизиса.
Процедура
| 1. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. |
Для прикрепленных клеток
2. Поместите чашку для клеточных культур на лед, осторожно удалите культуральную среду и промойте клетки ледяным PBS. Поместите чашку для клеточных культур на лед, осторожно удалите культуральную среду и промойте клетки ледяным PBS. |
| 3. Аспирируйте PBS и добавьте охлажденный льдом буфер для лизиса (~1 мл на 10 7 клеток или 100-мм планшет; ~0,5 мл для 60-мм планшета; ~200-400 мкл для 6-луночного культурального планшета). . Аккуратно встряхните или взболтайте в течение 5 минут на льду. В качестве альтернативы : Клетки можно обработать трипсином и промыть PBS перед ресуспендированием в лизирующем буфере в микроцентрифужной пробирке. |
| 4. Соберите лизат и перенесите в микроцентрифужную пробирку. Образцы центрифуги при ~ 14 000 х г в течение 15 минут для осаждения клеточного мусора. |
| 5. Перенесите супернатант в новую микроцентрифужную пробирку и выбросьте осадок. |
Для суспензионно-культивируемых клеток
2. Осаждать клеточную суспензию центрифугированием при 2500 g в течение 10 минут. Откажитесь от супернатанта. Откажитесь от супернатанта. |
| 3. Промойте клетки один раз, ресуспендировав клеточный осадок в охлажденном льдом PBS. Осадок клеток путем центрифугирования при 2500 x g в течение 10 минут. |
| 4. Добавьте охлажденный льдом лизирующий буфер (~1 мл на 100 мг или ~100 мкл влажного клеточного осадка). Внесите смесь вверх и вниз, чтобы ресуспендировать осадок. |
| 5. Осторожно встряхивайте смесь в течение 10 минут. Удалите клеточный мусор путем центрифугирования при ~ 14 000 x g в течение 15 минут. |
| 6. Перенесите надосадочную жидкость в новую микроцентрифужную пробирку и выбросьте осадок. |
Определение концентрации белка с помощью BCA Protein Assay
| 7. Приготовленные разведенные стандарты альбумина (BSA). В качестве альтернативы : используйте предварительно разбавленные стандарты BSA. |
8. Приготовьте рабочий реагент, смешав 50 частей реагента BCA A с 1 частью реагента BCA B (50:1 реагент A:B). |
| 9. Внесите пипеткой по 25 мкл каждого стандарта или повторения неизвестного образца в лунку микропланшета (рабочий диапазон = 20–2000 мкг/мл). |
| 10. Добавьте по 200 мкл рабочего реагента в каждую лунку и тщательно перемешайте планшет на шейкере в течение 30 секунд. |
| 11. Накройте планшет и инкубируйте при 37°C в течение 30 минут. |
| 12. Охладить планшет до комнатной температуры. Измерьте поглощение при длине волны 562 нм или около нее на планшет-ридере. |
| 13. Определите концентрацию белка. |
Подсказка к протоколу
Анализы белков BCA имеют уникальное преимущество перед анализами Брэдфорда (анализы на основе красителя Кумасси), поскольку они совместимы с образцами, которые содержат до 5% детергентов, и на них гораздо меньше влияют различия в составе белков. , обеспечивая большую однородность и точность между белками.
Подготовка образцов для электрофореза белков
Денатурирующий электрофорез (SDS-PAGE)
- Подготовьте образец в соответствующем буфере для образцов, чтобы конечная концентрация буфера для образцов была 1X.
 Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| SDS/LDS sample buffer (4X)* | 2,5 мкл | 2.5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Total volume | 10 мкл* | 10 мкл* |
*Для трициновых гелей рекомендуется использовать буфер для образцов Tricine SDS.
- 2. Нагрейте образцы при 70°C в течение 10 минут.
- 3. Нанесите образцы на белковый гель бис-трис, трис-ацетат или трис-глицин.
Наконечник протокола
Нагревание образца при 100°C в SDS-содержащем буфере может привести к протеолизу.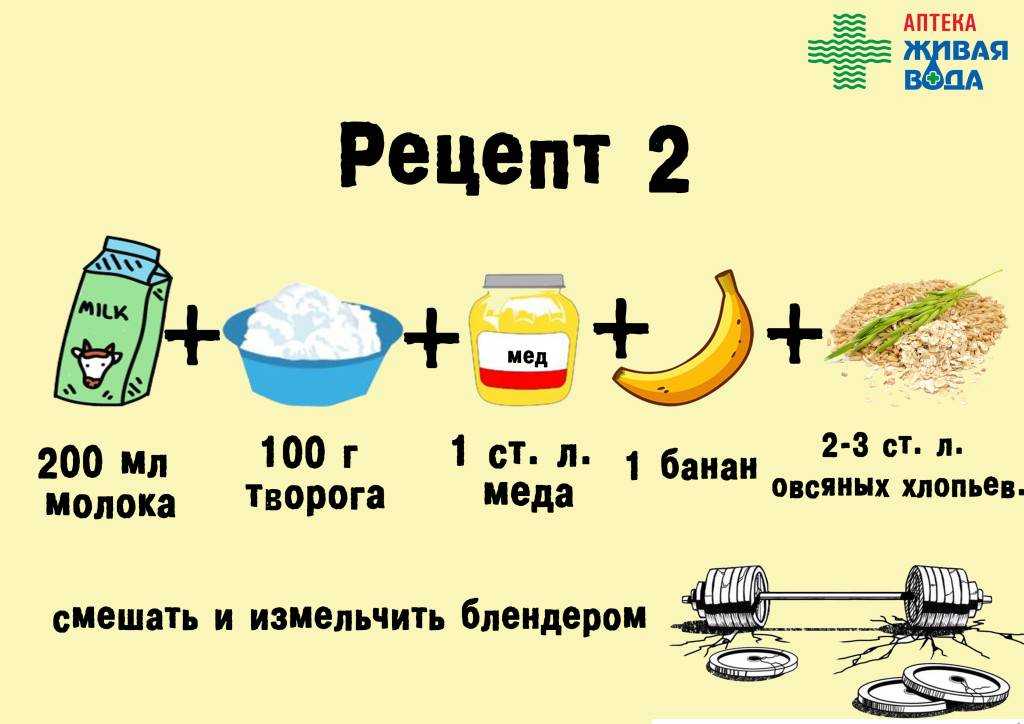 Мы рекомендуем нагревать образцы для денатурирующего электрофореза (восстановленного или невосстановленного) при 70°C в течение 2–10 минут для получения оптимальных результатов. Не нагревайте образцы для неденатурирующего (нативного) электрофореза.
Мы рекомендуем нагревать образцы для денатурирующего электрофореза (восстановленного или невосстановленного) при 70°C в течение 2–10 минут для получения оптимальных результатов. Не нагревайте образцы для неденатурирующего (нативного) электрофореза.
Неденатурирующий электрофорез (Native-PAGE)
- Подготовьте образец в соответствующем буфере для образцов, чтобы конечная концентрация буфера для образцов была 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| Native sample buffer (2X) | 5 μL | 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Общий объем | 10 мкл* | 10 мкл* |
- 2.
 Загрузите образцы трис-глицина протеина.
Загрузите образцы трис-глицина протеина.
Подготовка образца ткани
Приготовление лизата из тканей для вестерн-блоттинга
Материалы
| Буфер для лизиса клеток (рекомендации см. в таблице ниже) | Буфер для образцов (загрузочный буфер) (например, LDS Sample Buffer, 4x, кат. № NP0007) |
| Смесь ингибиторов протеаз и фосфатаз (например, Halt Protease and Phosphatase, Cat. Inhibitor Cocktail. 78440 или таблетки ингибитора протеазы и фосфатазы Pierce, кат. № A32961) | Дополнительно: восстановитель пробы (например, NuPAGE Sample Reduction Agent (10X), кат. № NP0004) |
| Холодный фосфатный буфер физиологический раствор (PBS) (например, пакеты солевого буфера с фосфатным буфером, № по каталогу 28372) | Выполнение нативного PAGE: Буфер для нативных образцов (например, Трис-глициновый буфер для нативных образцов, № по каталогу LC2673) |
Просмотр или загрузка рецептов буферов
Рекомендации по буферу для лизиса
| Расположение целевого белка | Buffer Рекомендуется | Описание |
|---|---|---|
| Целая клетка (общая экстракция белка) | детергент в 25 мМ бицине, 150 мМ хлорида натрия (pH 7,6) | |
| Целая клетка (общая экстракция белка) (белок мембраносвязанный, ядерный или митохондриальный) | Лизирующий буфер RIPA (содержит знаковые детергенты, помогающие перевести белки в раствор) | 25 мМ Tris-HCl pH 7,6 150 мМ NaCl 1% NP-40 или Triton X-100 1% дезоксихолат натрия 0 9,0 % ДСН |
Процедура
1. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. Приготовьте буфер для лизиса, добавив ингибиторы протеазы и фосфатазы. Если вы используете коктейль ингибиторов протеазы и фосфатазы Halt 100x, добавьте 10 мкл/мл коктейля непосредственно в буфер для лизиса клеток. Если вы используете таблетку ингибитора протеазы и фосфатазы Pierce, выдавите таблетку из флакона и поместите в 10 мл лизирующего буфера и перемешайте на вортексе для растворения. Дополнительно : Для ингибирования металлопротеаз добавьте ЭДТА (0,5 М) в количестве 10 мкл/мл буфера для лизиса. |
| 2. Препарируйте интересующую ткань на льду и взвесьте образцы. Используйте соотношение ~ 50 мг ткани к 1000 мкл ледяного лизирующего буфера. Используйте меньший объем лизирующего буфера, если требуется более концентрированный белковый экстракт. |
| 3. Добавьте необходимое количество охлажденного льдом лизирующего буфера к образцу ткани и гомогенизируйте на льду. |
4. Центрифугируйте образец при 10 000 g в течение 5 минут для осаждения остатков клеток/тканей. |
| 5. Перенесите надосадочную жидкость в новую микроцентрифужную пробирку и выбросьте осадок. |
Определение концентрации белка с помощью BCA Protein Assay
| 6. Приготовленные разведенные стандарты альбумина (BSA). В качестве альтернативы : используйте предварительно разбавленные стандарты BSA. |
| 7. Приготовьте рабочий реагент, смешав 50 частей реагента BCA A с 1 частью реагента BCA B (50:1 реагент A:B). |
| 8. Внесите пипеткой по 25 мкл каждого стандарта или повторения неизвестного образца в лунку микропланшета (рабочий диапазон = 20–2000 мкг/мл). |
| 9. Добавьте по 200 мкл рабочего реагента в каждую лунку и тщательно перемешайте планшет на шейкере в течение 30 секунд. |
| 10. Накройте планшет и инкубируйте при 37°C в течение 30 минут. |
11. Охладить планшет до комнатной температуры. Измерьте поглощение при длине волны 562 нм или около нее на планшет-ридере.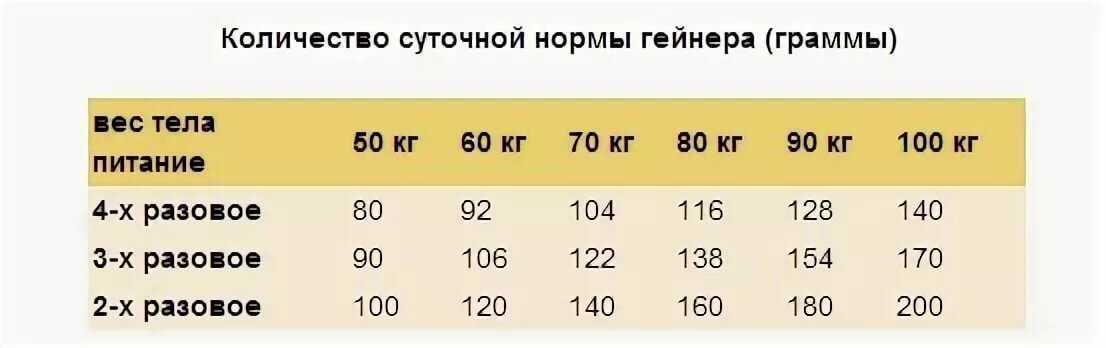 |
| 12. Определите концентрацию белка в каждом лизате клеток. Определите, сколько белка нужно загрузить (рекомендуется <50 мкг/лунку). |
Подсказка к протоколу
Анализы белков BCA имеют уникальное преимущество перед анализами Брэдфорда (анализы на основе красителя Кумасси), поскольку они совместимы с образцами, которые содержат до 5% детергентов, и на них гораздо меньше влияют различия в составе белков. , обеспечивая большую однородность и точность между белками.
Подготовка образцов для электрофореза белков
Денатурирующий электрофорез (SDS-PAGE)
- 1. Подготовьте образец в соответствующем буфере для образцов так, чтобы конечная концентрация буфера для образцов была 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Reagent | Reduced sample | Non-reduced sample |
|---|---|---|
| Protein sample | x μL | x μL |
| SDS/LDS sample buffer (4X)* | 2,5 мкл | 2. 5 μL 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | to 10 μL |
| Total volume | 10 мкл* | 10 мкл* |
*Для трициновых гелей рекомендуется использовать буфер для образцов Tricine SDS.
- 2. Нагрейте образцы при 70°C в течение 10 минут.
- 3. Нанесите образцы на белковый гель бис-трис, трис-ацетат или трис-глицин.
Неденатурирующий электрофорез (Native-PAGE)
- 1. Подготовьте образец в нативном буфере для образцов таким образом, чтобы конечная концентрация буфера для образцов составляла 1X. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
| Реагент | Снижение образца | Неокрашенная образец |
|---|---|---|
| Протеиновый образец | x мкл | x x x x x x ° | x мкл | x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x x. 0035 0035 | Native sample buffer (2X) | 5 μL | 5 μL |
| Reducing agent (10X) | 1 μL | — |
| Deionized water | to 10 μL | Отдо 10 мкл |
| Общий объем | 10 мкл* | 10 мкл* |
- 2. Нагрузки на протекание Tris-Glycine или Tris-Acetate.
Наконечник протокола
Нагревание образца при 100°C в SDS-содержащем буфере может привести к протеолизу. Мы рекомендуем нагревать образцы для денатурирующего электрофореза (восстановленного или невосстановленного) при 70°C в течение 2–10 минут для получения оптимальных результатов. Не нагревайте образцы для неденатурирующего (нативного) электрофореза.
Совет по протоколу
Не храните уменьшенные образцы. Подготовьте запас образцов (как в таблице примеров, за исключением восстановителя) и храните его при температуре -20ºC или -80ºC.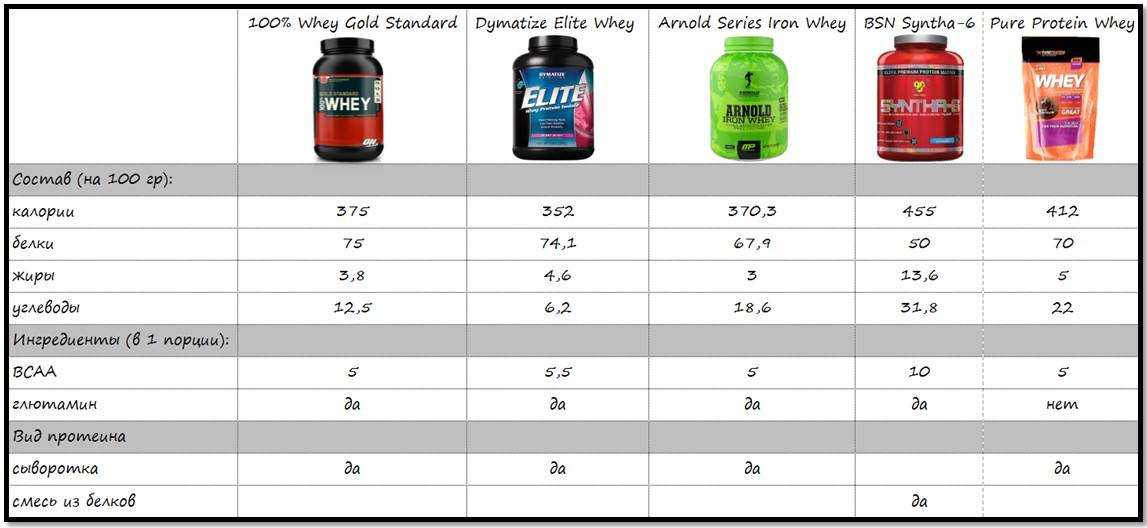 Разбавьте образец восстановителем (10X) перед использованием.
Разбавьте образец восстановителем (10X) перед использованием.
Вестерн-блоттинг: подготовка проб | Био-Рад
Клеточные лизаты
Сырые клеточные лизаты являются наиболее распространенным прямым источником исходного материала, используемого в вестерн-блоттинге. Они могут быть получены из иммортализованных клеточных линий, о которых известно, что они экспрессируют белок-мишень, или из трансфицированных клеток, несущих вектор экспрессии белка. Многие различные типы клеток (млекопитающие, насекомые, дрожжи или бактерии) могут быть использованы для получения необходимого белка с небольшими изменениями в процедуре приготовления.
В большинстве случаев клетки собирают, промывают и лизируют для высвобождения целевого белка. Для достижения наилучших результатов все эти шаги следует проводить в холодной комнате или на льду. Это сведет к минимуму протеолиз, дефосфорилирование и денатурацию, поскольку все они начинают происходить после разрушения клеток. Можно просто лизировать клетки непосредственно в буфере для загрузки геля, если требуется быстрая проверка. Однако обработка ультразвуком может быть необходима для разрушения высоковязкой клеточной ДНК. Обычно 20-50 мг клеточного лизата загружают на дорожку для гель-электрофореза.
Однако обработка ультразвуком может быть необходима для разрушения высоковязкой клеточной ДНК. Обычно 20-50 мг клеточного лизата загружают на дорожку для гель-электрофореза.
Рисунок 6 : Клетки собирают, промывают и лизируют для высвобождения белков
Выбор правильного лизирующего буфера и определение соответствующего объема часто является процессом проб и ошибок, на который влияет тип выделяемого белка, а также конкретные клетки, используемые в качестве источника. Буферы для лизиса варьируются от очень мягких без детергента до более агрессивных растворов, таких как буфер rIPA (радиоиммунопреципитационный анализ), который является денатурирующим и содержит несколько детергентов.
Обычно для выделения растворимых цитоплазматических белков используют лизирующий буфер NP-40 (Nonidet P-40) с более мягким неионным детергентом. В других случаях буфер rIPA выбирают, потому что он снижает фон, а иногда требуется несколько детергентов для полного высвобождения связанных с мембраной или ядерных белков.
Следует также учитывать взаимодействие антитело-антиген, на которое могут повлиять изменения в целевом белке во время лизиса.
Количество буфера для лизиса определяют на основе подсчета клеток или же его оценивают на основе размера сосуда для тканевой культуры. В прилагаемой таблице приведены некоторые рекомендуемые отправные точки.
Иногда для полного высвобождения белков из определенных образцов клеток и тканей требуется механическое разрушение, например, при обработке ультразвуком или гомогенизации. Обработка ультразвуком также используется для разрушения клеточной ДНК, которая может мешать либо из-за ее высокой вязкости, либо из-за неспецифического связывания. После лизиса и центрифугирования измеряют количество белка в каждом лизате.
Рекомендации по объему лизиса клеток
| Тип ячеек | Количество материала | Объем лизирующего буфера |
|---|---|---|
| Культура тканей | 10 7 кюветы или тарелка 100 мм | 1мл |
| Целая ткань | 100 мг | Добавьте 2 мл и обработайте ультразвуком или гомогенизируйте. |
| Бактерии | Спиновый образец, оценка объема | Добавить 10 томов и вихрь |
| Дрожжи | Спиновый образец, оценка объема | Добавьте 10 объемов, затем обработайте ультразвуком или вортексом со стеклянными шариками. |
Образцы тканей
Образцы тканей демонстрируют более высокую степень структуры, чем культивируемые клетки, и поэтому могут потребоваться более высокие уровни механического вмешательства для высвобождения интересующего белка. Они также могут содержать несколько типов клеток, которые по-разному реагируют на выбранный буфер для лизиса.
Меньшие образцы твердых тканей (до 100 мг) помещают в охлажденный льдом буфер для экстракции и гомогенизируют на льду, обычно с помощью ультразвука или стержня для облегчения разрушения клеток.
В качестве альтернативы и чаще в случае больших образцов ткани используется блендер для гомогенизации ткани в PBS, а затем добавляется буфер для лизиса клеток. После гомогенизации и лизиса ткани солюбилизированные клеточные компоненты осветляются центрифугированием и проверяются на концентрацию белка перед нанесением на гель.
После гомогенизации и лизиса ткани солюбилизированные клеточные компоненты осветляются центрифугированием и проверяются на концентрацию белка перед нанесением на гель.
Очищенные или полуочищенные экстракты
Простейшим источником исходного материала для вестерн-блоттинга являются очищенные или полуочищенные образцы белков, полученные в ходе очистки белков. Эти образцы редко требуют каких-либо дополнительных манипуляций и просто смешиваются с загрузочным буфером для гель-электрофореза (буфер для образцов Лэммли).
При использовании очищенного или полуочищенного белкового препарата можно нанести на гель гораздо меньшее количество общего белка. Обычно 0,5-1 мг очищенного или полуочищенного белка достаточно для наблюдения сильного сигнала. Если вы не уверены, результаты можно улучшить, загрузив несколько разведений образца.
Определение концентрации белка
Чтобы гарантировать, что образцы находятся в надлежащем диапазоне обнаружения для анализа, и чтобы их можно было сравнивать на эквивалентной основе, важно знать концентрацию общего белка в каждом образце. Существуют различные методы определения концентрации белка с использованием собственных или коммерческих наборов и реагентов.
Существуют различные методы определения концентрации белка с использованием собственных или коммерческих наборов и реагентов.
Самый простой метод заключается в измерении оптической плотности раствора лизата при 280 нм или 205 нм. В качестве альтернативы доступны несколько анализов белка, которые основаны на восстановлении ионов металлов пептидной связью, например, анализы Лоури и ВСА; или путем связывания красителя, как в анализе Брэдфорда.
Во всех случаях изменение цвета пропорционально количеству белка в образце. Концентрацию белка определяют путем сравнения целевых образцов с известным стандартом, таким как BSA (бычий сывороточный альбумин), разведенным в лизирующем буфере. Чтобы получить наиболее точное измерение концентрации белка, рекомендуется протестировать несколько разведений образца, убедившись, что результаты лежат в линейном диапазоне анализа белка.
Загрузка буфера
После определения концентрации белка образцы разводят в буфере для загрузки геля, также называемом 2x буфером для образцов Лэммли. Этот буфер содержит глицерин, так что образцы легко погружаются в лунки геля, и отслеживающий краситель (бромфеноловый синий), который сначала мигрирует через гель, чтобы показать, насколько далеко продвинулось разделение.
Этот буфер содержит глицерин, так что образцы легко погружаются в лунки геля, и отслеживающий краситель (бромфеноловый синий), который сначала мигрирует через гель, чтобы показать, насколько далеко продвинулось разделение.
Для большинства рутинных вестерн-блоттингов SDS (додецилсульфат натрия) и восстанавливающий агент также присутствуют в буфере для загрузки геля/образца, чтобы полностью денатурировать белок и удалить все структуры более высокого порядка. См. сопроводительную таблицу, в которой указаны варианты загрузочного буфера и содержащиеся в них дополнения.
Образцы нагревают в гелевой загрузке/буфере для образцов либо в течение 5 минут при 100°C, либо в течение 10 минут при 70°C для облегчения денатурации. В этот момент образцы могут оставаться при комнатной температуре, если их нужно использовать немедленно, или храниться при температуре 4°C или -20°C для последующего анализа.
Образец условий буфера
| Условия геля | Паспорт безопасности | DTT или ßME | Комментарии |
|---|---|---|---|
| Денатурация и восстановление | + | + | Удаляет все структуры более высокого порядка, включая дисульфидные связи |
| Денатурация | + | — | Структура более высокого порядка разрушается, но дисульфидные связи сохраняются. |
| Сокращение | — | + | Дисульфиды удаляются, но структура более высокого порядка остается. |
| Родной | — | — | Белок сохраняет структуру более высокого порядка. Мультимеры и белок-белковые взаимодействия могут быть обнаружены |
Контроль и стандарты
Может быть очень полезно включить положительный и отрицательный контроль в гель вместе с образцами, которые оцениваются. Для положительного контроля обычно используют известный источник целевого белка, такой как очищенный белок или контрольный лизат, в условиях, когда он будет обнаруживаться антителом, используемым в эксперименте.
Положительный контроль важен для подтверждения идентичности мишени, поскольку он будет давать эталонную полосу на пятне, показывающую ожидаемую миграцию целевого белка и подтверждающую активность антител. Положительные контроли также полезны для устранения неполадок и для сравнения данных между отдельными пятнами.
Готовые клеточные и тканевые лизаты теперь коммерчески доступны от ряда поставщиков, включая Bio-Rad, и могут использоваться в качестве удобного положительного контроля. Кроме того, имеющиеся в продаже лизаты тканей и клеток подходят для протоколов устранения неполадок.
Если возможно, также полезно включить отрицательный контрольный образец, такой как известная нулевая клеточная линия, как средство подтверждения того, что сигнал является специфичным для желаемого белка.
Последним компонентом, необходимым для геля, является стандарт молекулярной массы, поскольку ключевой особенностью вестерн-блоттинга является предоставление информации о размере белка. Также известные как маркеры молекулярной массы, они представляют собой готовые смеси белков с известной молекулярной массой, обычно 5-6 белков в диапазоне от 10 кДа до 200 кДа.
Стандарты молекулярной массы поставляются в различных форматах, включая неокрашенные, предварительно окрашенные, многоцветные или непосредственно помеченные для западного обнаружения.
 Выбор химии гель-электрофореза, совместимой с буфером, в котором готовится образец, является самым простым путем. Однако, если нельзя изменить химическую систему гель-электрофореза, может потребоваться выполнить очистку образца, чтобы сделать образец совместимым с данной системой.
Выбор химии гель-электрофореза, совместимой с буфером, в котором готовится образец, является самым простым путем. Однако, если нельзя изменить химическую систему гель-электрофореза, может потребоваться выполнить очистку образца, чтобы сделать образец совместимым с данной системой. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.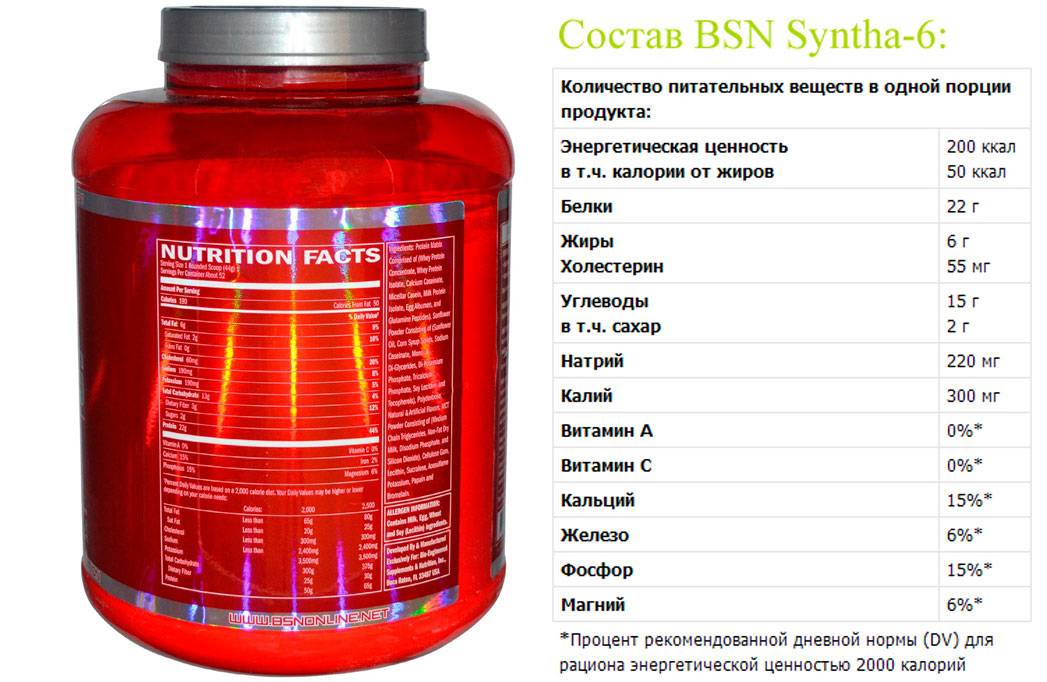 Загрузите образцы трис-глицина протеина.
Загрузите образцы трис-глицина протеина. Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины.
Масштабируйте приведенные ниже объемы в зависимости от объема загрузки скважины. Загрузите образцы трис-глицина протеина.
Загрузите образцы трис-глицина протеина.