Что такое липолиз
«А Клиника» — клиника эстетической медицины, косметологии и дерматологии
8 (495) 781-73-72
Мы работаем с 09:00 до 21:00
г. Москва, Садовническая ул., д.11 стр.2
А Клиника
Блог о косметологии
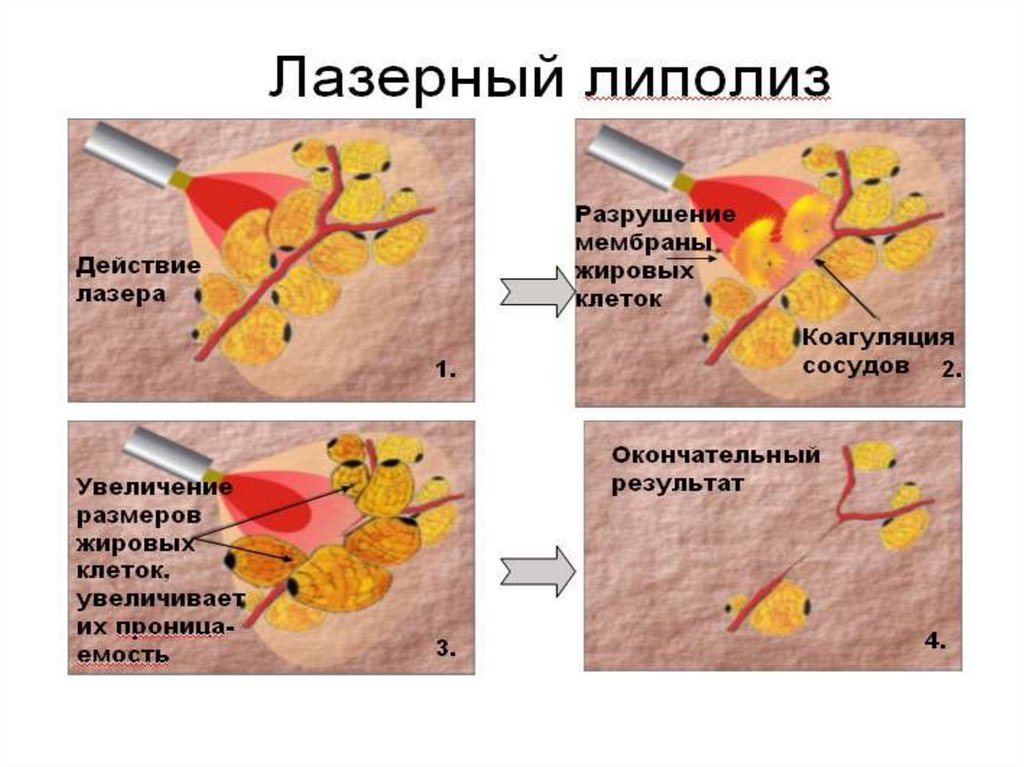
Ультразвуковой липолиз
Услуги Врачи Результаты Отзывы
Проверено экспертом
Гуценко Лилия Анатольевна
Врач-дерматовенеролог, косметолог
Дата публикации: 02 июля 2019г.
Дата проверки: 02 ноября 2021г.
Содержание
- Чем липолиз отличается от липосакции?
- Технологии липолиза
По научному липолиз – это метаболический процесс расщепления жиров на составляющие их жирные кислоты и глицерин под действием липазы.
Фермент триглицеридлипаза расщепляет триглицериды на диглицериды и жирные кислоты, на следующей стадии активны диглицеридлипаза и моноглицеридлипаза. В результате работы этих ферментов и образуются конечные продукты липолиза — глицерин и жирные кислоты.
Что это означает на практике? Когда организм человека в норме, происходит естественное расщепление поступающих с пищей жиров. У грудных детей липаза вырабатывается специальными железами, которые расположены в ротовой полости. С возрастом эти железы атрофируются,так как в организме появляются другие источники липазы. Вырабатывается липаза сразу несколькими органами: кишечником, поджелудочной железой, легкими, печенью. Однако у многих людей этого фермента недостаточно, поэтому жиры не расщепляются или расщепляются крайне медленно, оседая на различных частях тела. У мужчин, как правило, в области живота, у женщин – в области бедер, ягодиц, коленей и на других частях тела.
Снижение уровня липазы в крови у взрослых может происходить по разным причинам – и в результате заболеваний, и в результате малоподвижного образа жизни и неправильного питания. Однако естественный процесс расщепления жиров, то есть процесс липолиза, можно стимулировать различными инъекционными и аппаратными методиками. То есть естественный процесс липолиза в организме можно перенастроить и перезапустить.
Однако естественный процесс расщепления жиров, то есть процесс липолиза, можно стимулировать различными инъекционными и аппаратными методиками. То есть естественный процесс липолиза в организме можно перенастроить и перезапустить.
Чем липолиз отличается от липосакции?
Многие считают, что липолиз и липосакция – это одно и тоже. На самом деле — это две совершенно разные методики. Липосакция подразумевает операционное вмешательство, а липолиз – это нехирургический метод избавления от жировых запасов. Процедура липолиза «подстегивает» процесс биохимического расщепления жира. Ее можно проводить на разных участках тела, в том числе в области «второго подбородка». Но чаще всего липолиз проводят на таких проблемных зонах, как живот, внутренняя поверхность бедра, плечи, спина, ягодицы.
Технологии липолиза
Инъекционный липолиз
Ученые выяснили, что некоторые вещества справляются с функцией расщепления жиров не хуже липазы.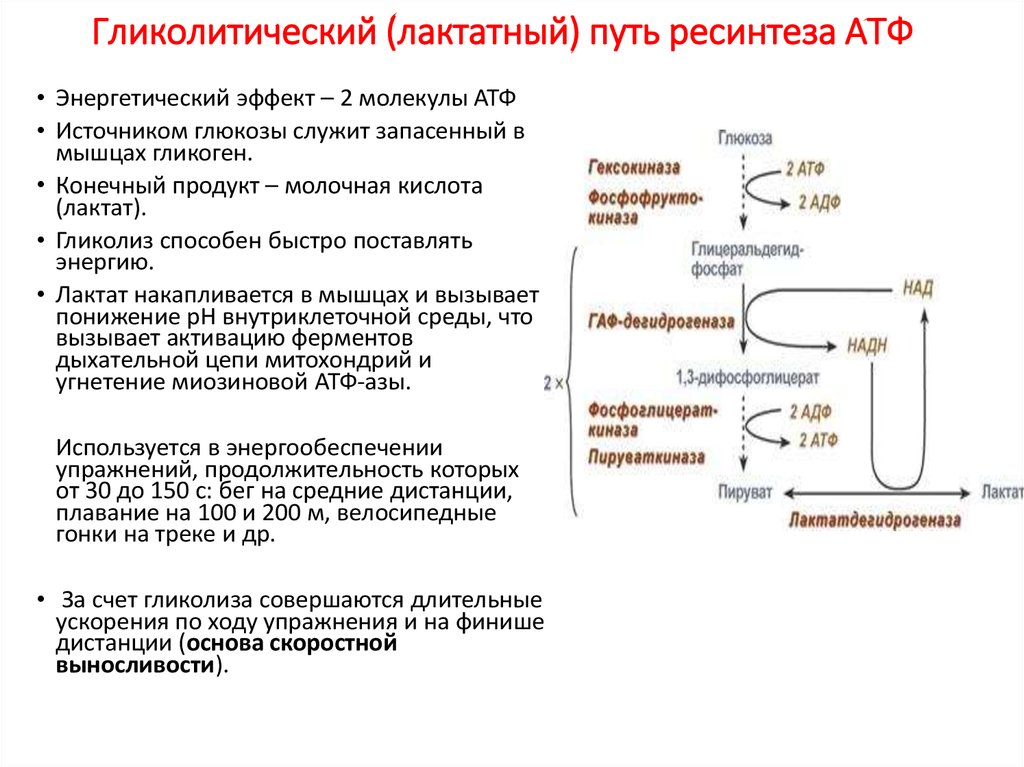 К таким веществам относятся фосфатидилхолин в комплексе с дезоксихолатом, L-карнитином, экстрактом сосны. Все эти компоненты являются составной частью мезотерапевтичекого «коктейля», который вводится в подкожный жировой слой. Мезотерапевтические «коктейли» обладают меньшей плотностью, поэтому легче вводятся в организм, но для того, чтобы они расщепили максимальное количество жиров, потребуется не один курс процедур. В то же время в липолические «коктейли» входят витамины, микроэлементы, которые работают на улучшение качества кожи.
К таким веществам относятся фосфатидилхолин в комплексе с дезоксихолатом, L-карнитином, экстрактом сосны. Все эти компоненты являются составной частью мезотерапевтичекого «коктейля», который вводится в подкожный жировой слой. Мезотерапевтические «коктейли» обладают меньшей плотностью, поэтому легче вводятся в организм, но для того, чтобы они расщепили максимальное количество жиров, потребуется не один курс процедур. В то же время в липолические «коктейли» входят витамины, микроэлементы, которые работают на улучшение качества кожи.
Существует также липолитическая биоревитализация. В состав «коктейля», который вводится в жировой слой, входит концентрированная гиалуроновая кислота. Препараты для биоревитализации вводятся более глубоко, поэтому они задерживаются в организме на несколько дней, на протяжении которых активно борются с жировыми отложениями. Гиалуроновая же кислота, как известно, является мощным омолаживающим средством. Ее молекулы притягивают к себе молекулы воды, создавая вокруг себя прочный водный баланс, необходимый для регенерации клеток кожи.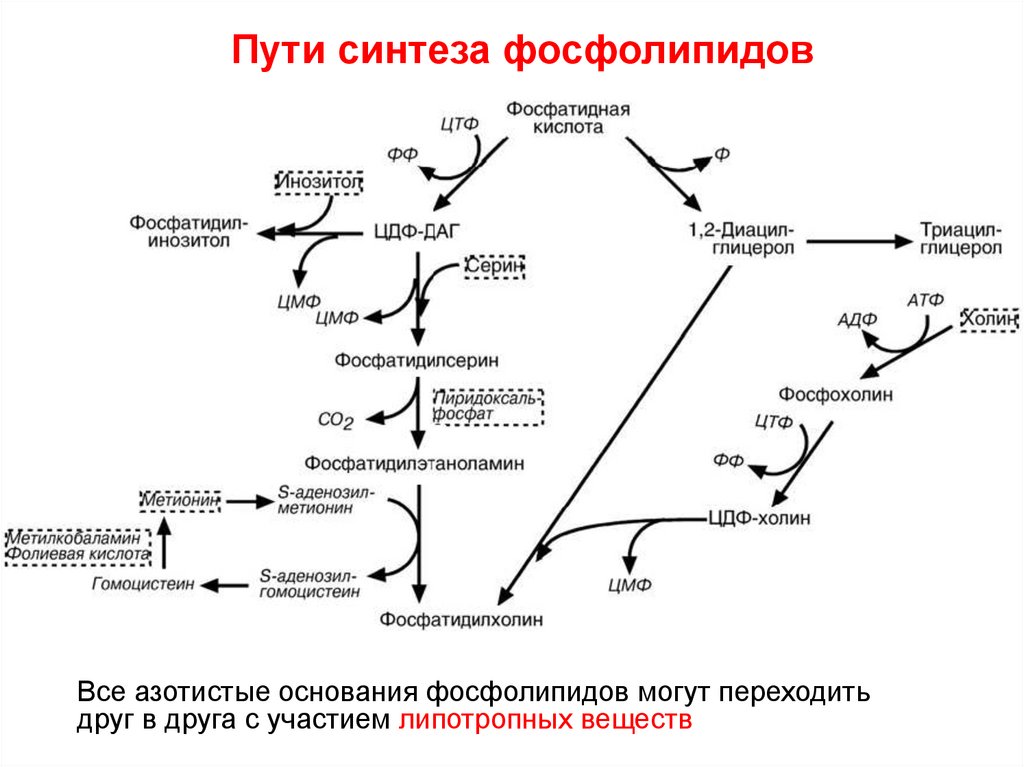
Аппаратный липолиз
Если инъекции проникают внутрь жировых клеток – адипоцитов, то аппаратные методики воздействуют на них снаружи. Поэтому аппаратные технологии менее травматичны , не оставляют следов и не требуют реабилитации. Наиболее действенные из них – ультразвуковые. Доктора «А Клиники» давно и успешно применяют такую технологию, как ультразвуковая липосакция Целлу Программ (Cellu Program).
Это эксклюзивная разработка израильских ученых. В сотрудничестве с французскими и итальянскими специалистами они создали уникальную аппаратную систему, которая помогает избавиться от глубинных жировых отложений – абдоминального (висцерального) жира.Такой жир плотным толстым слоем покрывает внутренние органы – печень, сердце, желудок, почки, создавая значительную нагрузку на них и приводя к заболеваниям.
Ультразвуковые волны высокой и низкой частоты свободно растворяют абдоминальный жир и подкожные жировые отложения.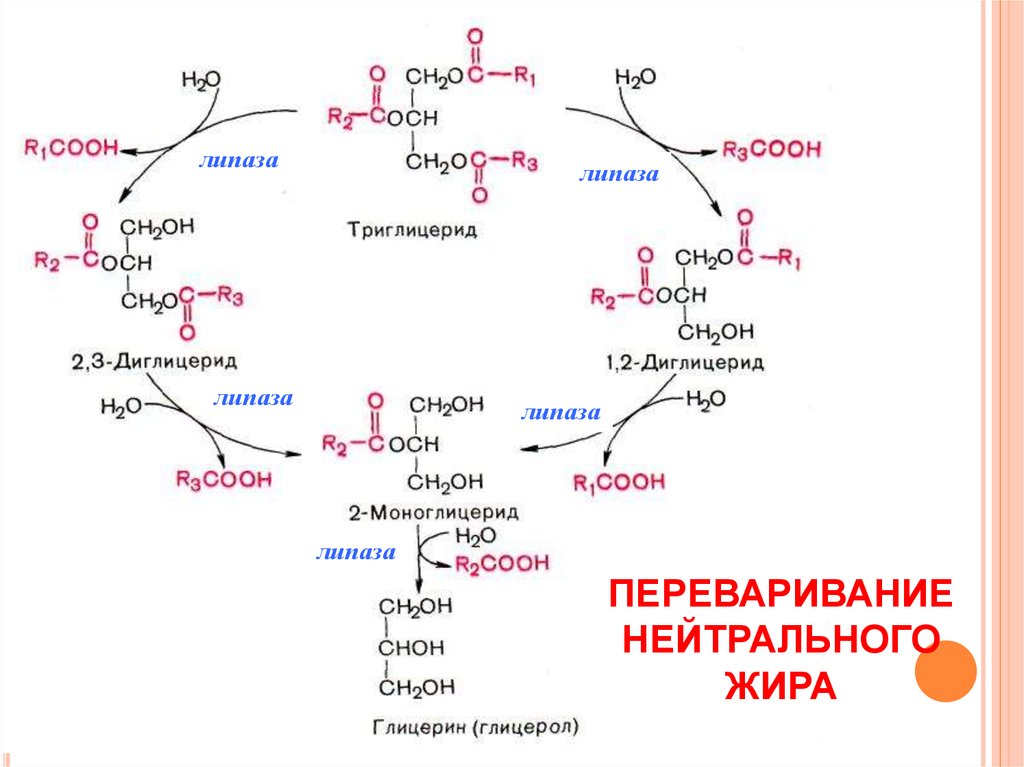 После этого они выводится из организма через лимфатическую систему. Такой процесс называется висцеральным липолизом.
После этого они выводится из организма через лимфатическую систему. Такой процесс называется висцеральным липолизом.
Коррекция фигуры по технологии Целлу Программ (Cellu Program) настолько эффективна, что уже за 3-4 процедуры можно уменьшить объем талии на 4-8 сантиметра, а вес тела на 5-7 килограммов!
В этом сезоне в арсенале докторов клиники появился еще один совершенный аппарат для ультразвукового липолиза – Ульфит (Ulfit) из Южной Кореи.
При воздействии на жировые клетки сфокусированным ультразвуком с частотой 2Мгц происходит их нагрев до 55 градусов. Этоприводит к разрушению клеточной мембраны жировой клетки. Далее происходит распад адипоцитов и, как следствие, расщепление триглицеридов (содержимого клеток) на глицерин и свободные жирные кислоты с участием гормоно-чувствительной липазы. Разрушенные элементы жировой клетки попадают во внеклеточное пространство и выводятся организмом с помощью лимфатической системы и иммунных клеток.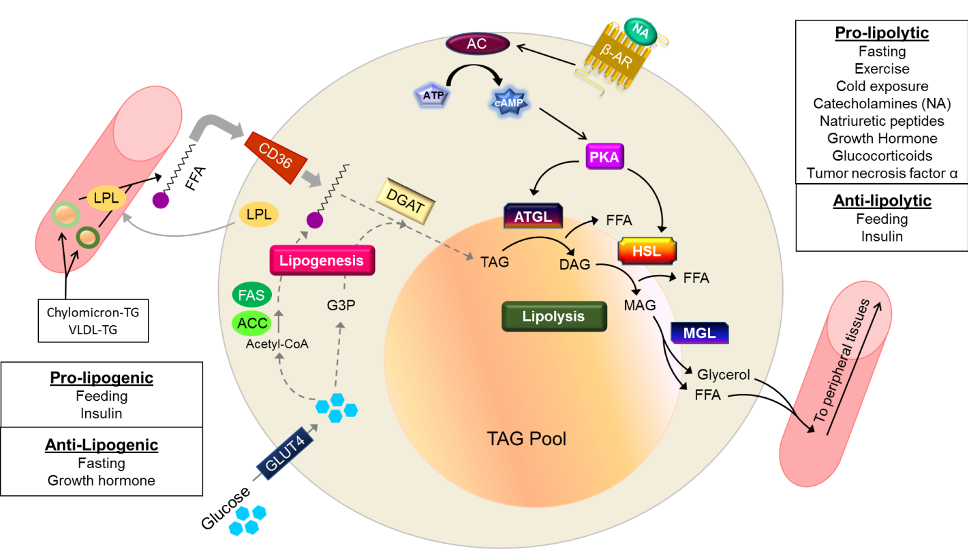
Эффект от процедуры наступает мгновенно. Одежда, которая была на пациенте, сразу же становится ему на размер больше.Но весь процесс выведения разрушенных адипоцитов занимает от 4 недель. Поэтому по прошествии месяца после процедуры объемы тела еще больше сокращаются.
Авдеюк Елена Владимировна
Врач-дерматовенеролог, косметолог
Ульфит помогает убрать жировые отложения на руках, спине, животе, талии, боках, ягодицах, бедрах, коленях. За одну процедуру можно сократить объем жировой складки на 20%. А через месяц после процедуры жировая складка уменьшится ВДВОЕ!
Помимо этого, Ульфит-терапия – ЕДИНСТВЕННАЯ методика, которая разрушает жировую ткань и одновременно подтягивает кожу! Ультразвук воздействует на кожные клетки фибробласты, активизируя в них процесс выработки коллагена и эластина, отвечающих за упругость и подтянутость (тургор) кожи. В результате пациент получает идеальную фигуру БЕЗ ЛИШНЕГО ЖИРА и ГЛАДКУЮ ПОДТЯНУТУЮ КОЖУ! И все это без разрезов, шрамов, реабилитации!
Специалисты
Смотреть всех специалистов
Подписка на новости
Хотите быть в курсе всех новостей и выгодных предложений «А Клиники»?
Подпишитесь на нашу рассылку и первыми получайте всю информацию по новинкам и акциям!
Даю согласие на обработку персональных данных.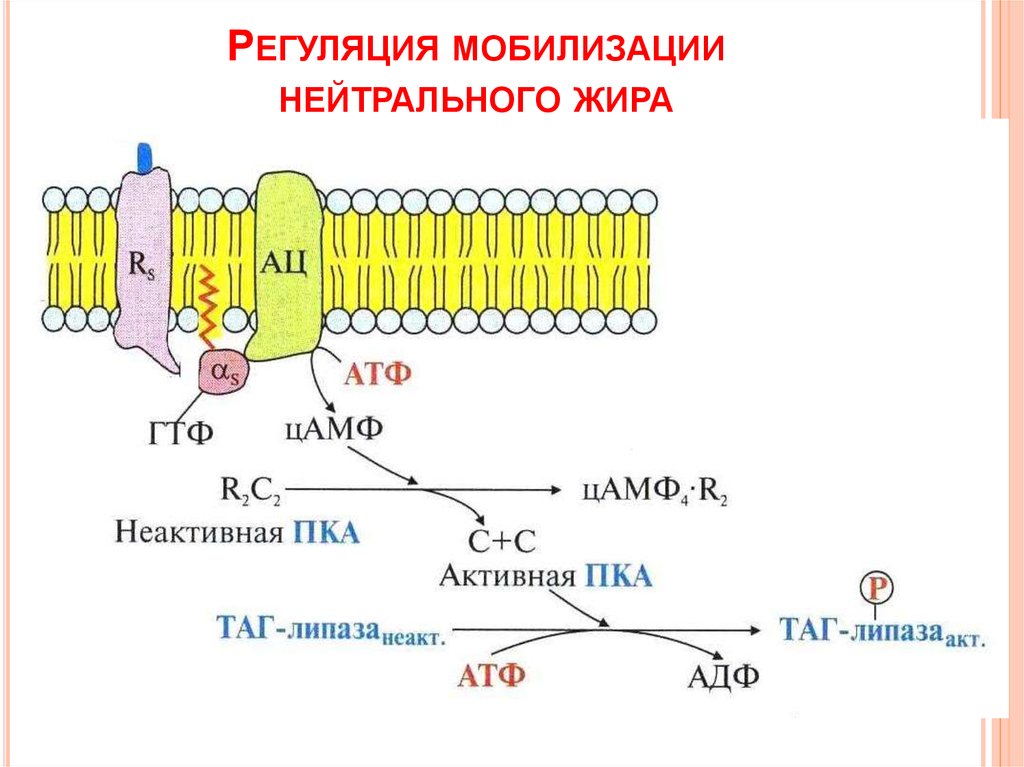 С положением конфиденциальности и защите персональных данных ознакомлен и согласен
С положением конфиденциальности и защите персональных данных ознакомлен и согласен
Обращение главного врача «А Клиники» Натальи Борисовны Жмуриной
Наши дорогие, любимые и уважаемые пациенты!
Я и моя команда создавали этот сайт, а также все площадки в социальных сетях для того, чтобы не только делиться с вами полезной информацией, но и научить вас разбираться во всех тонкостях косметологии. Чтобы вы своими глазами могли увидеть, как проводятся процедуры, какие тренды косметологии сегодня присутствуют в мире, посмотреть работы «до» и «после». Чтобы всегда быть на связи с вами. А у вас чтобы всегда была возможность задать вопросы напрямую главному врачу и всем врачам нашей клиники — в любое удобное для вас время бесплатно получить онлайн-консультацию и записаться на приём.
Благо, мы живём в такие времена, когда всегда есть выбор. Теперь мы с вами на постоянной связи еще и в соцсети «ВКонтакте»
https://vk.com/a_klinika и в Телеграм-канале https://t.
Настало время перемен! Уверена, что они к лучшему! Мира и добра вам! А мы всегда с вами на связи!
Липолиз и липогинез — образование и расщепление жиров в жировой ткани
Процесс синтеза (накопления) жиров, называется липогенез, а расщепления — липолиз.
Синтез жиров регулируется реакциями углеводного обмена и, что очень важно, количество запасаемых жировых клеток определяется количеством содержащихся в рационе углеводов, а не жиров. Проще говоря, если вы употребляете в пищу много углеводов – кондитерские изделия, сладости, макароны, колбасы – велика вероятность отложения новых жировых запасов.
Товары, которые упоминаются в статье
Заочное обучение «КОРРЕКЦИЯ ФИГУРЫ» с сертификатом
5 000
Заочное обучение «RF — LIFTING» с сертификатом
7 500
Кавитация
3 500
RF лифтинг в коррекции фигуры
3 500
Гель для RF-лифтинга с эластином и Aloe Vera, RF LIFTING
от 1 070 В наличии
Липолитический аппаратный гель c L-карнитином и кофеином LIPO SLIM
2 270 В наличии
Набор Аппаратная КОРРЕКЦИЯ ФИГУРЫ — все для миостимуляции, RF и кавитации
7 608 В наличии
Аппарат KIM 8 SLIMMING SYSTEM (кавитация, RF лифтинг, вакуумный массаж) с ОБУЧЕНИЕМ
43 000 В наличии
Аппарат для RF лифтинга и кавитации 3 в 1 (WL 515S) с обучением
39 800 В наличии
Что влияет на образование и расщепление жиров?
Липогенез и липолиз — сложные многоступенчатые процессы.![]() В них принимает участие множество ферментов и некоторые гормоны. На мембранах жировых клеток существуют молекулярные структуры — рецепторы, активация которых запускает биохимические процессы. За накопление жира отвечают Альфа-2 рецепторы, а за выделение — Бета-рецепторы.
В них принимает участие множество ферментов и некоторые гормоны. На мембранах жировых клеток существуют молекулярные структуры — рецепторы, активация которых запускает биохимические процессы. За накопление жира отвечают Альфа-2 рецепторы, а за выделение — Бета-рецепторы.
Жировая ткань женщин содержит очень много Альфа-рецепторов и очень мало Бета-рецепторов. Таким образом, сама природа создала женщину идеально приспособленной для накопления жиров. Из-за этого низкокалорийные диеты практически не способны помочь женщинам.
Приведенная ниже таблица позволяет понять, почему мы худеем, когда нервничаем, то есть, у нас повышается в крови уровень адреналина, и толстеем, когда курим. Нелишним будет заметить, что чашечка кофе действительно способствует расщеплению жиров.
| Способствуют выведению жира из клеток: | адреналин, норадреналин и гормоны, сходные с ними по действию, гормоны щитовидной железы, кофеин.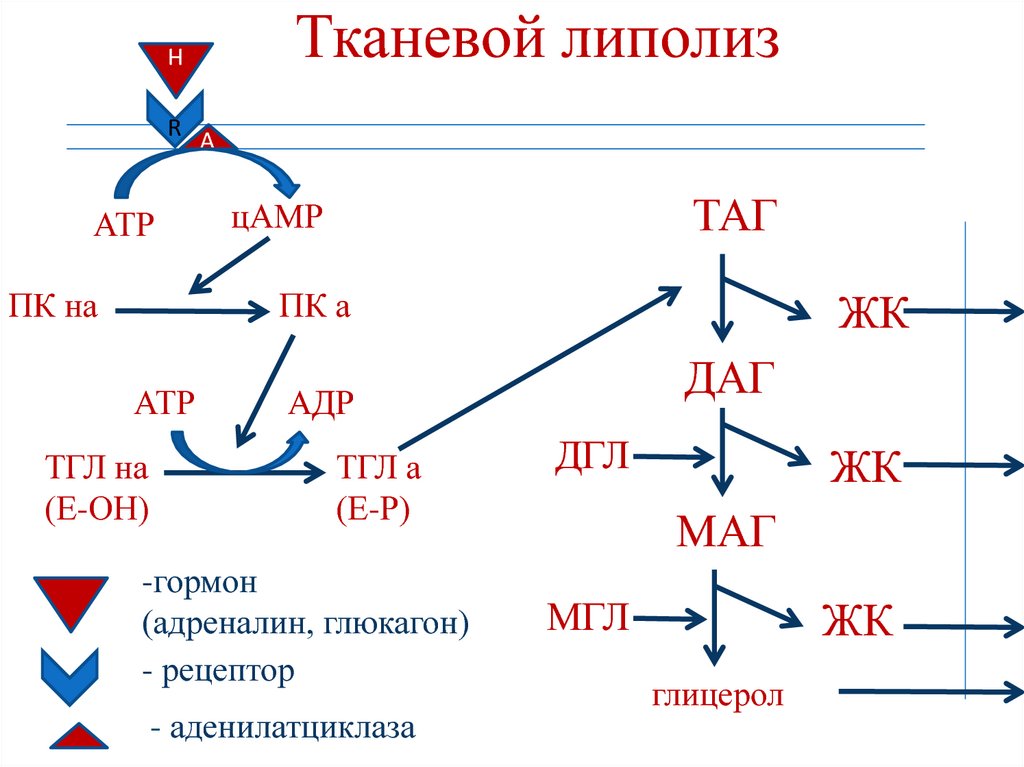 |
| Способствуют накоплению жира: | инсулин, салицилаты, никотиновая кислота. |
Таблетки для снижения веса
Всевозможные таблетки для похудения, которые поступают к нам, например, из Китая либо Кореи, содержат гормоны щитовидной железы, которые способствуют расщеплению жирового слоя. И вы действительно похудеете после приема таких таблеток. Но не забывайте, что организм уменьшает выработку гормонов, если они поступают извне. Таким образом, после прекращения курса приёма таблеток щитовидная железа может оказаться «в шоке».
Как правильно проводить липолиз?
Липолиз необходим при лечении целлюлита и локального ожирения. Но прежде, чем пытаться разнообразными методами расшевелить этот «целлюлитный» жир, надо подумать как утилизировать продукты липолиза. Если об этом не позаботиться заранее, образовавшиеся триглицериды просто перекочуют в другое место. Хорошо, если этим местом будет жировая ткань.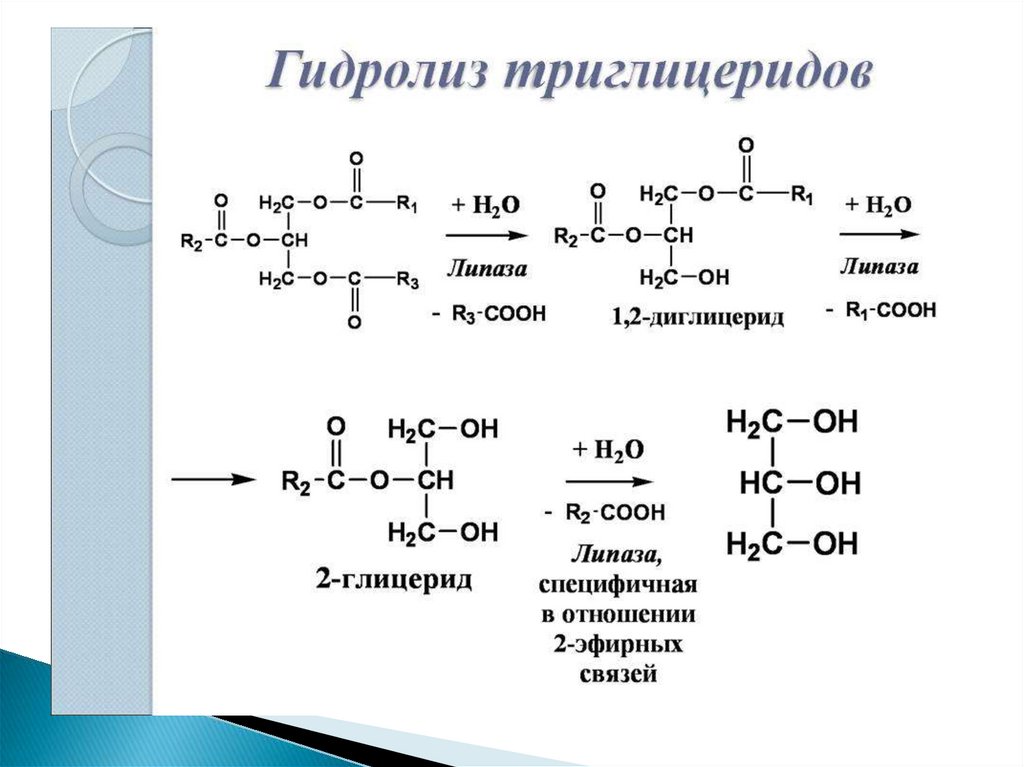 А возможно отложение продуктов липолиза в виде атеросклеротических бляшек на стенках сосудов.
А возможно отложение продуктов липолиза в виде атеросклеротических бляшек на стенках сосудов.
Каким образом происходит утилизация жиров? Через движение! Именно в «топке» работающей мышцы сгорают свободные триглицериды. Делая липолиз, мы обязательно включаем в комплекс процедур миостимуляцию и/или физические упражнения.
Липолиз и кровообращение
Больше всего на обмен в жировой ткани влияет её кровообращение. А, как мы с вами уже поняли, именно застойные явления приводят к увеличению слоя жировой ткани. Обильный кровяной поток обеспечивает быстрое удаление жиров, выделяемых адипоцитами. Поэтому чем лучше и обильнее кровоснабжение тканей, тем скорее жир попадёт туда, где он необходим. Следовательно, чтобы уменьшить жировую складку, необходимо улучшать кровообращение, в том числе и аппаратными средствами.
Итак, жировая ткань – это нормальная, полезная составляющая организма. Она выполняет множество функций и совершенно необходима каждому человеку.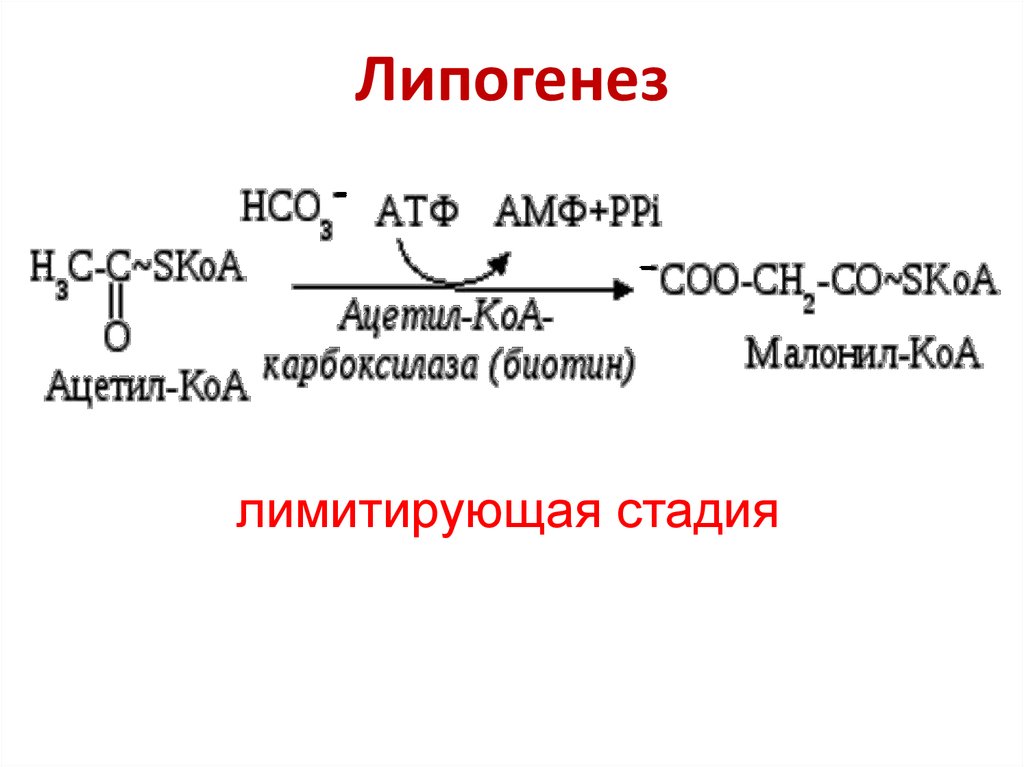 Жир образуется не только под кожей. Поэтому не нужно стремиться к тому, чтобы избавиться от всего жира и везде.
Жир образуется не только под кожей. Поэтому не нужно стремиться к тому, чтобы избавиться от всего жира и везде.
Оцените материал:
Средний рейтинг: 4.5 / 5
Наталия Баховец
Автор статьи: кандидат медицинских наук, физиотерапевт, косметолог, аспирант кафедры физиотерапии СПбГМА им. И.М. Мечникова, автор многочисленных книг и методических пособий по аппаратной косметологии, руководитель и методолог учебного центра АЮНА.
Сравнение методов изучения липолиза in vitro и in situ
На этой странице
РезюмеВведениеЗаключениеБлагодарностиСсылкиАвторское правоСтатьи по теме
Липолиз является строго регулируемым процессом и контролируется нервной системой, гормонами и паракринными/аутокринными факторами. Нарушение регуляции липолиза связано с некоторыми патофизиологическими состояниями, включая диабет, метаболический синдром и ожирение. Поэтому в настоящее время особое внимание уделяется изучению липолиза на различных экспериментальных моделях. В данном обзоре обобщены современные экспериментальные методы изучения липолиза. Культивирование клеточных линий преадипоцитов, использование дифференцированных стромально-сосудистых клеток, первичная культура адипоцитов, органная культура жировой ткани и метод микродиализа являются наиболее широко используемыми методами исследования липолиза. Обсуждаются преимущества и ограничения использования этих методов.
В данном обзоре обобщены современные экспериментальные методы изучения липолиза. Культивирование клеточных линий преадипоцитов, использование дифференцированных стромально-сосудистых клеток, первичная культура адипоцитов, органная культура жировой ткани и метод микродиализа являются наиболее широко используемыми методами исследования липолиза. Обсуждаются преимущества и ограничения использования этих методов.
1. Введение
Жировая ткань является одним из крупнейших компартментов организма, выполняющим различные физиологические функции, включая переработку липидов и секрецию гормонов. Он отвечает за накопление жира в виде триглицеридов (путем липогенеза) в периоды избытка энергии и за мобилизацию триглицеридов (путем липолиза) в периоды дефицита калорий [1]. Гормоночувствительная липаза, фермент, ограничивающий скорость, и моноглицеридлипаза катализируют гидролиз триглицеридов с высвобождением жирных кислот и глицерина. В отличие от жирных кислот, глицерин не утилизируется адипоцитами, поскольку эти клетки содержат очень мало глицеролкиназы [2]. Поэтому измерение глицерина дает хорошую оценку уровня липолиза [3]. Липолиз является строго регулируемым процессом и контролируется нервной системой, гормонами (например, инсулином и катехоламинами) и паракринными/аутокринными факторами (например, аденозином, простагландинами, оксидом азота и TNF-9).0011 α ) [1, 3–5]. Физическая активность, питание, пол, возраст и генетика также являются важными определяющими факторами липолиза [2, 4].
Поэтому измерение глицерина дает хорошую оценку уровня липолиза [3]. Липолиз является строго регулируемым процессом и контролируется нервной системой, гормонами (например, инсулином и катехоламинами) и паракринными/аутокринными факторами (например, аденозином, простагландинами, оксидом азота и TNF-9).0011 α ) [1, 3–5]. Физическая активность, питание, пол, возраст и генетика также являются важными определяющими факторами липолиза [2, 4].
Нарушение регуляции липолиза связано с рядом патофизиологических состояний, таких как ожирение, диабет, метаболический синдром, семейная комбинированная гиперлипидемия и синдром поликистозных яичников [4]. Поэтому в настоящее время особое внимание уделяется изучению липолиза и других аспектов метаболизма жировой ткани. В то время как методы изотопной трассировки и метод артериовенозной разности позволяют in vivo оценка липолиза, культура клеточных линий преадипоцитов, первичная культура адипоцитов, органная культура жировой ткани и микродиализ являются наиболее часто используемыми методами для изучения липолиза in vitro и in situ . В этом обзоре обобщены методы in vitro и in situ для изучения липолиза у животных и человека. Кроме того, обсуждаются преимущества и недостатки использования каждого метода (таблица 1).
В этом обзоре обобщены методы in vitro и in situ для изучения липолиза у животных и человека. Кроме того, обсуждаются преимущества и недостатки использования каждого метода (таблица 1).
2. Экспериментальные методы
2.1. Культура клеточных линий преадипоцитов
Существует несколько клеточных линий преадипоцитов мыши и человека для изучения метаболизма адипоцитов, например, 3T3-L1, 3T3-F422A, LS14, LiSa-2 и HPB-AML-I [6–9]. Среди них клетки 3T3-L1 лучше всего охарактеризованы и широко используются в исследованиях липогенеза и липолиза уже более 30 лет. Первоначально клетки были выделены из эмбрионов мышей Swiss 3T3 Green и Kehinde [6]. Клеточные линии преадипоцитов имеют фибробластоподобную морфологию. Однако, когда они входят, стадия слияния подвергается дифференцировке до фенотипа, подобного адипоцитам, путем добавления стандартного коктейля дифференцировки, содержащего инсулин, дексаметазон и неселективный ингибитор фосфодиезетраз-3 [10]. Эти клетки чувствительны к липолитическим (например, β -агонисты адренорецепторов) и антилиполитические (например, инсулин) средства [10, 11]. Достигнув слияния, клетки 3T3-L1 начинают экспрессировать маркеры, характерные для дифференцировки, с 3-х суток и обычно завершают процесс дифференцировки к 8-м суткам [10-12]. Поэтому потребовалось более одной недели, пока клетки были готовы к исследованию липолиза. Тем не менее, клетки часто остаются многокамерными (множественные липидные капли) и могут не полностью дифференцироваться в однокамерные адипоциты. Далее способность к дифференцировке клеток 3T3-L1 снижается с увеличением числа пассажей [13]. В дополнение к другим ограничениям метода культивирования клеток, результаты Исследования in vitro могут не полностью отражать in vivo состояние из-за физиологических реакций, активных во всем организме. С другой стороны, одним из преимуществ этого метода является то, что преадипоциты представляют собой прикрепленные клеточные линии и поэтому подходят для изучения молекулярных механизмов и факторов транскрипции, участвующих в процессе липолиза. Кроме того, культура этих клеточных линий обеспечивает изобилие однородных клеток, что делает ее подходящей моделью для скрининга соединений на предмет их возможного липолитического или антилиполитического действия.
Достигнув слияния, клетки 3T3-L1 начинают экспрессировать маркеры, характерные для дифференцировки, с 3-х суток и обычно завершают процесс дифференцировки к 8-м суткам [10-12]. Поэтому потребовалось более одной недели, пока клетки были готовы к исследованию липолиза. Тем не менее, клетки часто остаются многокамерными (множественные липидные капли) и могут не полностью дифференцироваться в однокамерные адипоциты. Далее способность к дифференцировке клеток 3T3-L1 снижается с увеличением числа пассажей [13]. В дополнение к другим ограничениям метода культивирования клеток, результаты Исследования in vitro могут не полностью отражать in vivo состояние из-за физиологических реакций, активных во всем организме. С другой стороны, одним из преимуществ этого метода является то, что преадипоциты представляют собой прикрепленные клеточные линии и поэтому подходят для изучения молекулярных механизмов и факторов транскрипции, участвующих в процессе липолиза. Кроме того, культура этих клеточных линий обеспечивает изобилие однородных клеток, что делает ее подходящей моделью для скрининга соединений на предмет их возможного липолитического или антилиполитического действия.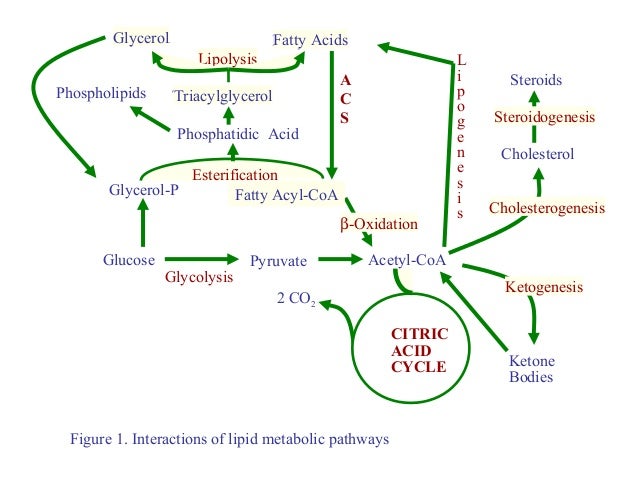 Кроме того, недавно дифференцированные жировые клетки представляют собой монослойную культуру и могут быть использованы для изучения долгосрочной регуляции функций адипоцитов [14].
Кроме того, недавно дифференцированные жировые клетки представляют собой монослойную культуру и могут быть использованы для изучения долгосрочной регуляции функций адипоцитов [14].
2.2. Использование дифференцированных стромально-сосудистых клеток
Адипоциты составляют только 25% от общей клеточной популяции жировой ткани. Следовательно, нежировые клетки составляют значительную часть жировой массы. Эта часть известна как стромально-васкулярная фракция и включает фибробласты, макрофаги, эндотелиальные клетки, клетки крови, перициты, преадипоциты и мезенхимальные стволовые клетки [15]. Культивирование стромально-васкулярных клеток в среде для дифференцировки адипоцитов приводит к накоплению липидных капель в преадипоцитах и мезенхимальных стволовых клетках [16]. Затем дифференцированные адипоциты можно использовать для исследований липолиза (рис. 1, зеленый путь). Использование дифференцированных стромально-сосудистых клеток в целом имеет те же преимущества и ограничения по сравнению с исследованиями на клеточных линиях преадипоцитов. Тем не менее, поскольку стромально-васкулярная фракция содержит различные типы клеток, эта модель может имитировать in vivo условия сложности жировой ткани более близки, чем метод культуры клеток преадипоцитов [13].
Тем не менее, поскольку стромально-васкулярная фракция содержит различные типы клеток, эта модель может имитировать in vivo условия сложности жировой ткани более близки, чем метод культуры клеток преадипоцитов [13].
2.3. Первичная культура адипоцитов
Первичная культура жировых клеток была впервые описана Родбеллом [17]. В этой процедуре образцы жировой ткани, взятые у человека или животных, нарезаются на мелкие фрагменты и расщепляются коллагеназой. После центрифугирования плавающие адипоциты собирают и инкубируют в присутствии тестируемых соединений в соответствующем буфере, обычно бикарбонатном буфере Кребса-Рингера (рис. 1, красный путь) [18].
Главным преимуществом этого метода является возможность изучения липолиза в полностью дифференцированных адипоцитах [19]. Кроме того, использование первичных клеток обеспечивает быструю методику тестирования острого действия соединения на липолиз. С другой стороны, использование первичных адипоцитов ограничено присущим им старением и межиндивидуальными вариациями [7]. Поскольку неочищенная коллагеназа может влиять на функцию клеточной мембраны, любая серия исследований должна проводиться с одной и той же партией этого фермента [20]. Тем не менее, свежеприготовленные адипоциты могут проявлять широкий спектр липолиза изо дня в день после их выделения. Эту проблему можно решить, добавив в среду аденозиндезаминазу, чтобы свести на нет антилиполитический эффект эндогенного аденозина [21]. Кроме того, длительное культивирование изолированных адипоцитов может быть связано с потерей чувствительности к инсулину и утратой экспрессии специфических для адипоцитов генов, например, GLUT4 [22, 23]. Из-за нескольких сообщений о связанных с жировым депо изменениях экспрессии гормональных рецепторов, секреторного профиля адипокинов, размера клеток адипоцитов, поглощения глюкозы и липолиза, следует выбрать подходящее депо для выделения адипоцитов в соответствии с целью исследования [24-28]. Например, сообщалось, что подкожные адипоциты по сравнению с внутрибрюшными адипоцитами более чувствительны к антилиполитическому действию инсулина и менее чувствительны к липолитическому действию катехоламинов [29].
Поскольку неочищенная коллагеназа может влиять на функцию клеточной мембраны, любая серия исследований должна проводиться с одной и той же партией этого фермента [20]. Тем не менее, свежеприготовленные адипоциты могут проявлять широкий спектр липолиза изо дня в день после их выделения. Эту проблему можно решить, добавив в среду аденозиндезаминазу, чтобы свести на нет антилиполитический эффект эндогенного аденозина [21]. Кроме того, длительное культивирование изолированных адипоцитов может быть связано с потерей чувствительности к инсулину и утратой экспрессии специфических для адипоцитов генов, например, GLUT4 [22, 23]. Из-за нескольких сообщений о связанных с жировым депо изменениях экспрессии гормональных рецепторов, секреторного профиля адипокинов, размера клеток адипоцитов, поглощения глюкозы и липолиза, следует выбрать подходящее депо для выделения адипоцитов в соответствии с целью исследования [24-28]. Например, сообщалось, что подкожные адипоциты по сравнению с внутрибрюшными адипоцитами более чувствительны к антилиполитическому действию инсулина и менее чувствительны к липолитическому действию катехоламинов [29].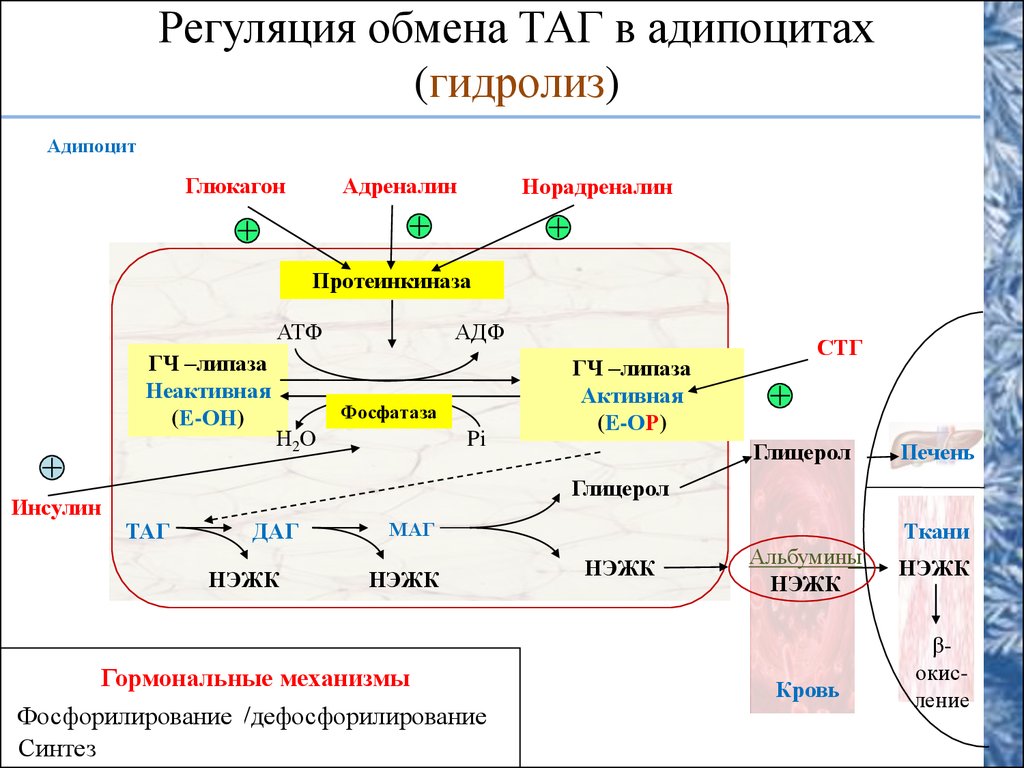 –31].
–31].
2.4. Органная культура жировой ткани
Система органной культуры жировой ткани была впервые описана Славиным и Элиасом [32]. В этом методе образцы жировой ткани нарезают на мелкие кусочки и распределяют в культуральную чашку, содержащую питательные вещества и электролиты (например, среду M199), и выдерживают в инкубаторе (рис. 1, синяя дорожка) [33–35]. Хотя Геста и его коллеги показали, что культивирование жировой ткани приводит к изменению экспрессии генов адипоцитов, несколько исследований показали, что жировую ткань можно культивировать in vitro с сохранением гормональной реактивности и поддержанием экспрессии генов до 2 недель [36–39]. Исследование липолиза можно проводить на самой культивируемой ткани органа или на адипоцитах, выделенных из культивируемой ткани [40–43].
Система органной культуры жировой ткани сохраняет внеклеточный матрикс и паракринные взаимодействия между различными типами клеток, которые могут влиять на метаболизм адипоцитов. Таким образом, данные, полученные этим методом, имеют хорошую корреляцию с данными in vivo и полезен для исследований хронического липолиза. Даже для неотложных исследований ткани можно культивировать за 24–48 часов до лечения, что позволяет факторам уравновеситься с культуральной средой и, следовательно, свести к минимуму индивидуальную вариабельность, вызванную факторами субъекта, такими как текущее состояние здоровья, гормональный статус и прием лекарств [33]. , 34, 40]. Устранение межиндивидуальной вариабельности обеспечивает хорошую воспроизводимость результатов. Кроме того, ряду исследователей удалось выявить эффекты соединений с использованием системы культур органов в случаях, когда изолированные жировые клетки не реагировали [15, 19]., 33, 34]. Тем не менее, при использовании органной культуры невозможно определить, вызвано ли липолитическое или антилиполитическое действие соединений, добавляемых в культуральную среду, их прямым действием на сами адипоциты или опосредовано другими типами клеток [19].
Таким образом, данные, полученные этим методом, имеют хорошую корреляцию с данными in vivo и полезен для исследований хронического липолиза. Даже для неотложных исследований ткани можно культивировать за 24–48 часов до лечения, что позволяет факторам уравновеситься с культуральной средой и, следовательно, свести к минимуму индивидуальную вариабельность, вызванную факторами субъекта, такими как текущее состояние здоровья, гормональный статус и прием лекарств [33]. , 34, 40]. Устранение межиндивидуальной вариабельности обеспечивает хорошую воспроизводимость результатов. Кроме того, ряду исследователей удалось выявить эффекты соединений с использованием системы культур органов в случаях, когда изолированные жировые клетки не реагировали [15, 19]., 33, 34]. Тем не менее, при использовании органной культуры невозможно определить, вызвано ли липолитическое или антилиполитическое действие соединений, добавляемых в культуральную среду, их прямым действием на сами адипоциты или опосредовано другими типами клеток [19].
В методе культуры органов, подобно первичной культуре адипоцитов, следует выбирать подходящие жировые депо для изучения липолиза при рассмотрении связанных с депо изменений в ответной реакции адипоцитов [24–28].
2.5. Микродиализ жировой ткани
Техника микродиализа была внедрена более 40 лет назад для измерения нейротрансмиттеров головного мозга в исследованиях на животных. Затем этот метод был адаптирован для жировой ткани к непрерывному отбору метаболитов (глюкозы, глицерина, лактата, аденозина и т. д.) из внеклеточного пространства у животных или человека. Для микродиализа жировой ткани специальные зонды вводятся чрескожно после легкой внутрикожной анестезии в подкожно-жировую клетчатку. Зонды подсоединяют к микроинъекционной помпе и вводят раствор Рингера, дополненный этанолом (для мониторинга местного кровотока). Для оценки липолиза определяют концентрацию глицерина в диализате и наносят на график зависимость от скорости перфузии [44, 45]. Хотя количественная оценка высвобождения глицерина с помощью этого метода затруднена, он является мощным методом фармакологических исследований липолиза при использовании полуколичественного метода [46]. Микродиализ позволяет вводить экзогенные химические вещества в жировую ткань для исследования результирующих локальных изменений липолиза без общего воздействия на организм. Кроме того, этот метод позволяет непрерывно изучать местный ответ внутри ткани после системного введения химических веществ [45]. Это также многообещающий инструмент в фармакокинетических исследованиях препаратов, влияющих на метаболизм жировой ткани [47]. Одним из основных недостатков методов микродиализа является то, что его применение у человека ограничено подкожно-жировым депо и трудно оценить метаболизм внутрибрюшной жировой ткани [46]. Кроме того, микродиализ занимает много времени и неудобен для пациента, а также может быть связан с риском инфицирования. Кроме того, на результаты микродиализа могут влиять различные факторы (скорость перфузии, состав перфузата, размер пор диализной мембраны, температура внутри и снаружи зонда и т. д.), и исследователь должен уметь контролировать эти переменные.
Микродиализ позволяет вводить экзогенные химические вещества в жировую ткань для исследования результирующих локальных изменений липолиза без общего воздействия на организм. Кроме того, этот метод позволяет непрерывно изучать местный ответ внутри ткани после системного введения химических веществ [45]. Это также многообещающий инструмент в фармакокинетических исследованиях препаратов, влияющих на метаболизм жировой ткани [47]. Одним из основных недостатков методов микродиализа является то, что его применение у человека ограничено подкожно-жировым депо и трудно оценить метаболизм внутрибрюшной жировой ткани [46]. Кроме того, микродиализ занимает много времени и неудобен для пациента, а также может быть связан с риском инфицирования. Кроме того, на результаты микродиализа могут влиять различные факторы (скорость перфузии, состав перфузата, размер пор диализной мембраны, температура внутри и снаружи зонда и т. д.), и исследователь должен уметь контролировать эти переменные.
3. Заключение
Учитывая возросшее в последнее время внимание к изучению метаболизма жировой ткани, этот обзор был предпринят для сравнения преимуществ и недостатков современных методов исследования липолиза. Несколько экспериментальных методов адипоцитов и жировой культуры были описаны в litterateur. Методы подразделяются на пять основных категорий: культивирование клеточных линий преадипоцитов, использование дифференцированных стромально-сосудистых клеток , первичная культура свежевыделенных адипоцитов, органная культура жировой ткани и метод микродиализа. Использование клеточных линий преадипоцитов, дифференцированных стромально-сосудистых клеток или свежевыделенных адипоцитов обеспечивает обильное поступление жировых клеток, что подходит для скрининга веществ на их липолитическую или антилиполитическую активность и для изучения молекулярных механизмов липолиза. Поэтому, когда возможное действие вещества проверяется впервые, предпочтение отдается этим методам. Тем не менее, клеточные линии или изолированные клетки могут не точно отражать реактивность и полный спектр метаболических характеристик жировой ткани [8]. С другой стороны, культура органов и микродиализ сохраняют внеклеточный матрикс и паракринные взаимодействия, и данные, полученные с помощью этих методов, хорошо коррелируют с in vivo исследований.
Несколько экспериментальных методов адипоцитов и жировой культуры были описаны в litterateur. Методы подразделяются на пять основных категорий: культивирование клеточных линий преадипоцитов, использование дифференцированных стромально-сосудистых клеток , первичная культура свежевыделенных адипоцитов, органная культура жировой ткани и метод микродиализа. Использование клеточных линий преадипоцитов, дифференцированных стромально-сосудистых клеток или свежевыделенных адипоцитов обеспечивает обильное поступление жировых клеток, что подходит для скрининга веществ на их липолитическую или антилиполитическую активность и для изучения молекулярных механизмов липолиза. Поэтому, когда возможное действие вещества проверяется впервые, предпочтение отдается этим методам. Тем не менее, клеточные линии или изолированные клетки могут не точно отражать реактивность и полный спектр метаболических характеристик жировой ткани [8]. С другой стороны, культура органов и микродиализ сохраняют внеклеточный матрикс и паракринные взаимодействия, и данные, полученные с помощью этих методов, хорошо коррелируют с in vivo исследований.
В совокупности этот настоящий обзор представляет собой первоначальное сравнение различных методов in vitro и in situ для изучения липолиза в надежде, что будет рассмотрен выбор соответствующего метода для данной цели исследования.
Благодарности
Поддержка заработной платы была предоставлена Мешхедским университетом медицинских наук и Гуйланским университетом медицинских наук. Авторы не имеют никакой другой соответствующей принадлежности или финансового участия в какой-либо другой организации.
Ссылки
M. Ahmadian, Y. Wang, and H.S. Sul, «Липолиз в адипоцитах», International Journal of Biochemistry and Cell Biology , vol. 42, нет. 5, стр. 555–559, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
V. Large, O. Peroni, D. Letexier, H. Ray и M. Beylot, «Метаболизм липидов в белых адипоцитах человека», Diabetes and Metabolism , vol.
 30, нет. 2004. Т. 4. С. 294–309.
30, нет. 2004. Т. 4. С. 294–309.View at:
Google Scholar
S. Viswandha and C. Londos, «Определение липолиза в изолированных первичных адипоцитах», в Adipose Tissue Protocols , K. Yang, Ed., стр. 299–306, Humana Press, Тотова, Нью-Джерси, США, 2-е издание, 2008 г.
Просмотр по адресу:
Google Scholar
П. Арнер, «Липолиз жировых клеток человека: биохимия, регулирование и клиническая роль», Передовая практика и исследования , том. 19, нет. 4, стр. 471–482, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г.-Ю. Кармен и С.-М. Виктор, «Сигнальные механизмы, регулирующие липолиз», Cellular Signaling , vol. 18, нет. 4, стр. 401–408, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х.
 Грин и О. Кехинде, «Устоявшаяся преджировая клеточная линия и ее дифференцировка в культуре. II. Факторы, влияющие на конверсию жира», Cell , vol. 5, нет. 1, стр. 19–27, 1975.
Грин и О. Кехинде, «Устоявшаяся преджировая клеточная линия и ее дифференцировка в культуре. II. Факторы, влияющие на конверсию жира», Cell , vol. 5, нет. 1, стр. 19–27, 1975.Посмотреть по адресу:
Google Scholar
Э. Р. Хьюго, Т. Д. Брандебург, К. Э. С. Комсток, К. С. Герсин, Дж. Дж. Сассман и Н. Бен-Джонатан, «LS14: новая человеческая клеточная линия, которая вырабатывает пролактин», Endocrinology , vol. 147, нет. 1, стр. 306–313, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Вабич, С. Брудерляйн, И. Мельцнер, М. Браун, Г. Мехтершаймер и П. Моллер, «LiSa-2, новая клеточная линия липосаркомы человека с высокой способностью к терминальной жировой дифференцировке. », Международный журнал рака , том. 88, pp. 889–894, 2000.
Просмотр по адресу:
Google Scholar
I.
 Тории, С. Морикава, А. Накано и К. Морикава, «Создание линии клеток человека, предрасположенной к ожирению, HPB -AML-I: рефрактерность к PPAR γ , опосредованная адипогенной стимуляцией», Journal of Cellular Physiology , vol. 197, нет. 1, стр. 42–52, 2003 г.
Тории, С. Морикава, А. Накано и К. Морикава, «Создание линии клеток человека, предрасположенной к ожирению, HPB -AML-I: рефрактерность к PPAR γ , опосредованная адипогенной стимуляцией», Journal of Cellular Physiology , vol. 197, нет. 1, стр. 42–52, 2003 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
R. Li, H. Guan и K. Yang, «Нейропептид Y усиливает бета-адренергическую стимуляцию липолиза в 3T3-L1 адипоцитах», Регуляторные пептиды , vol. 178, pp. 16–20, 2012.
Просмотр по адресу:
Google Scholar
L. Zhou, X. Wang, Y. Yang et al., «Берберин ослабляет цАМФ-индуцированный липолиз за счет снижения ингибирования фосфодиэстеразы в адипоцитах 3T3-L1», Biochimica et Biophysica Acta , vol. 1812, нет. 4, стр. 527–535, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
X.
 Го и К. Ляо, «Анализ профиля экспрессии генов во время дифференцировки преадипоцитов 3T3-L1», Ген , том. 251, нет. 1, стр. 45–53, 2000.
Го и К. Ляо, «Анализ профиля экспрессии генов во время дифференцировки преадипоцитов 3T3-L1», Ген , том. 251, нет. 1, стр. 45–53, 2000.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. П. Пулос, М. В. Додсон и Г. Дж. Хаусман, «Модели клеточных линий для дифференцировки: преадипоциты и адипоциты», Experimental Biology and Medicine , vol. 235, нет. 10, стр. 1185–1193, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D. C. Adler-Wailes, E. L. Guiney, N. E. Wolins и J. A. Yanovski, «Долговременное воздействие ритонавира увеличивает рециркуляцию жирных кислот и глицерина в адипоцитах 3T3-L1 как компенсаторные механизмы для повышенного гидролиза триацилглицерина», Эндокринология , том. 151, нет. 5, стр. 2097–2105, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
G.
 Fruhbeck, «Обзор жировой ткани и ее роль в ожирении и нарушениях обмена веществ», в Adipose Tissue Protocols , K. Yang, Ed., стр. 1–22, Humana Press, Totowa, Нью-Джерси, США, 2-е издание, 2008 г.
Fruhbeck, «Обзор жировой ткани и ее роль в ожирении и нарушениях обмена веществ», в Adipose Tissue Protocols , K. Yang, Ed., стр. 1–22, Humana Press, Totowa, Нью-Джерси, США, 2-е издание, 2008 г.Просмотр по адресу:
Google Scholar
А. Горбани, М. Р. Хаджзаде, З. Раджаи и С. Б. Зендехбад, «Влияние семян пажитника на адипогенез и крысы», Пакистанский журнал биологических наук . Под давлением.
Посмотреть по адресу:
Google Scholar
М. Родбелл, «Метаболизм изолированных жировых клеток: влияние гормонов на метаболизм глюкозы и липолиз», Журнал биологической химии , том. 239, pp. 375–380, 1964.
Просмотр по адресу:
Google Scholar
Дж. Р. Монзон, Р. Базиле, С. Хенеган, В. Удупи и А.
 Грин, «Липолиз в адипоцитах, выделенных из глубоких и поверхностная подкожная жировая клетчатка» Исследования ожирения , том. 10, нет. 4, pp. 266–269, 2002.
Грин, «Липолиз в адипоцитах, выделенных из глубоких и поверхностная подкожная жировая клетчатка» Исследования ожирения , том. 10, нет. 4, pp. 266–269, 2002.Посмотреть по адресу:
Google Scholar
С. К. Фрид и Н. Мустейд-Мусса, «Культура жировой ткани и изолированных адипоцитов», Methods in Molecular Biology, 901 . 155, стр. 197–212, 2001.
Посмотреть по адресу:
Google Scholar
Р. Тейлор, «Использование жировой ткани для метаболических исследований», Bailliere’s Clinical Endocrinology and Metabolism , vol. 1, нет. 4, стр. 1023–1035, 1987.
Посмотреть по адресу:
Google Scholar
R. C. Honnor, G. S. Dhillon, and C. Londos, «цАМФ-зависимая протеинкиназа и липолиз в крысиных адипоцитах.
 I. Подготовка клеток, манипуляции и предсказуемость поведения», Journal of Biological Chemistry , vol. 260, нет. 28, стр. 15122–15129, 1985.
I. Подготовка клеток, манипуляции и предсказуемость поведения», Journal of Biological Chemistry , vol. 260, нет. 28, стр. 15122–15129, 1985.Посмотреть по адресу:
Google Scholar
К. А. Карсвелл, М.-Дж. Lee и S.K. Fried, «Культура изолированных адипоцитов человека и изолированная жировая ткань», Методы молекулярной биологии , том. 806, стр. 203–214, 2012 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
П. М. Герритс, А. Л. Олсон и Дж. Э. Пессин, «Регулирование мРНК переносчика глюкозы GLUT4/мышечно-жировой клетчатки в жировой ткани диабетических крыс с дефицитом инсулина», Journal of Biological Chemistry , vol. 268, нет. 1, pp. 640–644, 1993.
Посмотреть по адресу:
Google Scholar
К.
 Т. Монтегю, Дж. Б. Принс, Л. Сандерс, Дж. Э. Дигби и С. О’Рахилли, «Depot-and sex-specific различия в экспрессии мРНК лептина человека: последствия для контроля регионального распределения жира» Диабет , том. 46, нет. 3, стр. 342–347, 1997.
Т. Монтегю, Дж. Б. Принс, Л. Сандерс, Дж. Э. Дигби и С. О’Рахилли, «Depot-and sex-specific различия в экспрессии мРНК лептина человека: последствия для контроля регионального распределения жира» Диабет , том. 46, нет. 3, стр. 342–347, 1997.Посмотреть по адресу:
Google Scholar
П. Арнер, «Различия в липолизе между подкожной и сальниковой жировой тканью человека», Annals of Medicine , vol. 27, нет. 4, pp. 435–438, 1995.
Просмотр по адресу:
Google Scholar
М. Столик, А. Рассел, Л. Хатли и др., «Поглощение глюкозы и действие инсулина в жировой ткани человека — влияние ИМТ, анатомических депо и распределения жира в организме» Международный журнал ожирения , том. 26, нет. 1, стр. 17–23, 2002 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.
 Горбани, М. Вареди и Г. Р. Омрани, «Влияние увеличения веса, связанного со старением, на размер клеток и гетерогенность различных жировых отложений у крыс», Иранский журнал эндокринологии и метаболизма , том . 11, pp. 713–720, 2009.
Горбани, М. Вареди и Г. Р. Омрани, «Влияние увеличения веса, связанного со старением, на размер клеток и гетерогенность различных жировых отложений у крыс», Иранский журнал эндокринологии и метаболизма , том . 11, pp. 713–720, 2009.Посмотреть по адресу:
Google Scholar
А. Горбани, М. Вареди, М.-А.-Р. Хаджзаде и Г. Х. Омрани, «Диабет 1 типа вызывает специфичные для депо изменения диаметра адипоцитов и массы жировой ткани у крыс», Экспериментальная и клиническая эндокринология и диабет , том. 118, нет. 7, стр. 442–448, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
B. Richelsen, S.B. Pedersen, T. Moller-Pedersen и JF Bak, «Региональные различия в распаде триглицеридов в жировой ткани человека: эффекты катехоламинов, инсулина и простагландина E2», Metabolism , vol.
 . 40, нет. 9, стр. 990–996, 1991.
. 40, нет. 9, стр. 990–996, 1991.Посмотреть по адресу:
Сайт издателя | Академия Google
JR Zierath, JN Livingston, A. Thörne et al., «Региональные различия в ингибировании инсулином высвобождения неэтерифицированных жирных кислот из адипоцитов человека: связь с фосфорилированием рецептора инсулина и внутриклеточной передачей сигналов через путь субстрата рецептора инсулина-1» », Diabetologia , vol. 41, нет. 11, стр. 1343–1354, 1998.
Посмотреть по адресу:
Сайт издателя | Google Scholar
G. Tavernier, J. Galitzky, P. Valet et al., «Молекулярные механизмы, лежащие в основе региональных вариаций индуцированного катехоламинами липолиза в адипоцитах крыс», Американский журнал физиологии. Эндокринология и метаболизм , том. 268, нет. 6, стр. E1135–E1142, 1995.
Просмотр по адресу:
Google Scholar
Б.
 Г. Славин и Дж. Дж. Элиас, «Влияние гипофизарных гормонов и норадреналина на размер жировых клеток в культуре органов», Запись , том. 164, нет. 2, pp. 141–151, 1969.
Г. Славин и Дж. Дж. Элиас, «Влияние гипофизарных гормонов и норадреналина на размер жировых клеток в культуре органов», Запись , том. 164, нет. 2, pp. 141–151, 1969.Посмотреть по адресу:
Google Scholar
А. Горбани, Г. Р. Омрани, М. А. Р. Хаджзаде и М. Вареди, «Влияние крысиного С-пептида и II на липолиз потребления глюкозы в культивируемой жировой ткани крысы», Экспериментальная и клиническая эндокринология и диабет , том. 119, нет. 6, стр. 343–347, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Горбани, Г. Х. Омрани, М. Р. Хаджзаде и М. Вареди, «Проинсулин С-пептид ингибирует липолиз в жировой ткани крыс с диабетом посредством фермента фосфодиэстразы-3В», Hormone and Metabolic Research , vol. 45, стр. 221–225, 2013.
Посмотреть по адресу:
Google Scholar
B.
 Alinejad, R. Shafiee-Nick и A. Ghorbani, «Влияние производных цилостамида на липолиз забрюшинной жировой ткани крыс», Clinical Biochemistry , vol. 44, с. S248, 2011.
Alinejad, R. Shafiee-Nick и A. Ghorbani, «Влияние производных цилостамида на липолиз забрюшинной жировой ткани крыс», Clinical Biochemistry , vol. 44, с. S248, 2011.Просмотр по адресу:
Google Scholar
S. Gesta, K. Lolmède, D. Daviaud et al., «Культура эксплантатов жировой ткани человека приводит к глубокому изменению экспрессии генов адипоцитов», Исследование гормонов и метаболизма , vol. 35, нет. 3, стр. 158–163, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
У. Смит и Б. Якобссон, «Исследования жировой ткани человека в культуре. II. Влияние инсулина и глюкозы в среде на липолиз и размер клеток», Anatomical Record , vol. 176, нет. 2, pp. 181–183, 1973.
Просмотр по адресу:
Google Scholar
Р.
 Г. Вернон, Р. А. Клегг и Д. Дж. Флинт, «Метаболизм жировой ткани овец во время беременности и лактации. Адаптация и регулирование», Биохимический журнал , том. 200, нет. 2, pp. 307–314, 1981.
Г. Вернон, Р. А. Клегг и Д. Дж. Флинт, «Метаболизм жировой ткани овец во время беременности и лактации. Адаптация и регулирование», Биохимический журнал , том. 200, нет. 2, pp. 307–314, 1981.Просмотр по адресу:
Google Scholar
Робертсон Дж. П., Фолкнер А. и Вернон Р. Г. Регуляция гликолиза и синтеза жирных кислот из глюкозы в жировой ткани овец. Биохимический журнал , том. 206, нет. 3, pp. 577–586, 1982.
Просмотр по адресу:
Google Scholar
M. Cifuentes, C. Albala и C. V. Rojas, «Различия в липогенезе и липолизе у взрослых людей с ожирением и без ожирения». », Биологические исследования , том. 41, нет. 2, pp. 197–204, 2008.
Посмотреть по адресу:
Google Scholar
Д. Ньюби, А.
 Гертлер и Р. Г. Вернон, «Влияние рекомбинантного овечьего лептина на липолиз in vitro и липолиз in vitro подкожная жировая ткань лактирующих и нелактирующих овец», Journal of Animal Science , vol. 79, нет. 2, pp. 445–452, 2001.
Гертлер и Р. Г. Вернон, «Влияние рекомбинантного овечьего лептина на липолиз in vitro и липолиз in vitro подкожная жировая ткань лактирующих и нелактирующих овец», Journal of Animal Science , vol. 79, нет. 2, pp. 445–452, 2001.Посмотреть по адресу:
Google Scholar
М. Оттоссон, П. Лённрот, П. Бьернторп и С. Эден, «Влияние кортизола и гормона роста на липолиз в жировая ткань человека» Журнал клинической эндокринологии и метаболизма , том. 85, нет. 2, стр. 799–803, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Y. Wang, S. K. Fried, R. N. Petersen и P. A. Schoknecht, «Соматотропин регулирует метаболизм жировой ткани у новорожденных свиней», Journal of Nutrition , vol. 129, нет. 1, pp. 139–145, 1999.
Посмотреть по адресу:
Google Scholar
П.
 Арнер и Дж. Болиндер, «Микродиализ жировой ткани», Журнал внутренних болезней , том. 230, нет. 4, стр. 381–386, 1991.
Арнер и Дж. Болиндер, «Микродиализ жировой ткани», Журнал внутренних болезней , том. 230, нет. 4, стр. 381–386, 1991.Просмотр по адресу:
Google Scholar
П. Барбе, К. Даримон, П. Сен-Марк и Дж. Галицки, «Измерения метаболизма белой жировой ткани с помощью метод микродиализа», Methods in Molecular Biology , vol. 155, pp. 305–321, 2001.
Просмотр по адресу:
Google Scholar
К. Н. Фрейн, Б. А. Филдинг и Л. К. М. Саммерс, «Исследование метаболизма жировой ткани человека in vivo », Journal of Endocrinology , vol. 155, нет. 2, стр. 187–189, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T. Zornoza, M. J. Cano-Cebrian, A. Polache и L. Granero, «Quantitative in vivo microdialysis in Pharmakinetic Studies», Microdialysis Techniques in Neuroscience , vol.
 75, стр. 103–120, 2013.
75, стр. 103–120, 2013.Посмотреть по адресу:
Сайт издателя | Академия Google
Copyright
Copyright © 2013 Ахмад Горбани и Махмуд Абединзаде. Эта статья находится в открытом доступе и распространяется в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Липолиз адипоцитов: от молекулярных механизмов регуляции к болезни и терапии | Биохимический журнал
Пропустить пункт назначения
Обзорная статья| 13 марта 2020 г.
Александр Ян;
Эмилио П. Моттильо
Biochem J (2020) 477 (5): 985–1008.
https://doi.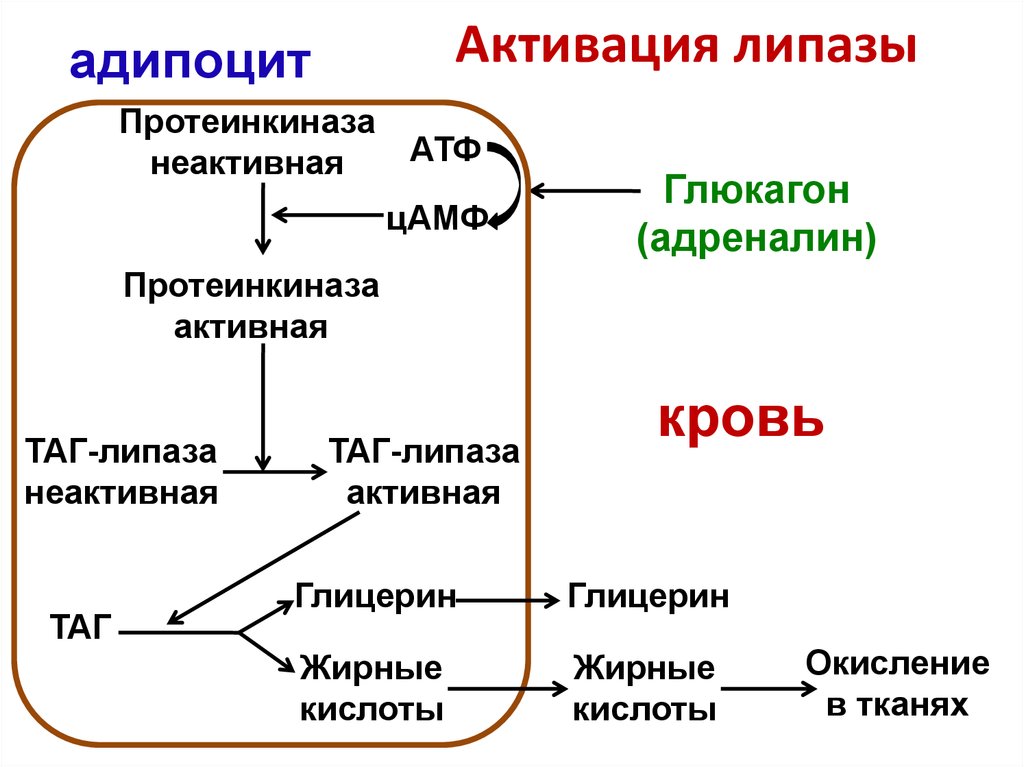 org/10.1042/BCJ201
org/10.1042/BCJ201
История статьи
Получено:
11 декабря 2019 г.
Пересмотр получено:
19 февраля 2020 г. Просмотры
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
- Твиттер
- MailTo
Иконка Цитировать Цитировать
Получить разрешения
Цитата
Александр Ян, Эмилио П. Моттильо; Липолиз адипоцитов: от молекулярных механизмов регуляции до болезней и терапии. Biochem J 13 марта 2020 г.; 477 (5): 985–1008. doi: https://doi.org/10.1042/BCJ201
Моттильо; Липолиз адипоцитов: от молекулярных механизмов регуляции до болезней и терапии. Biochem J 13 марта 2020 г.; 477 (5): 985–1008. doi: https://doi.org/10.1042/BCJ201
Скачать файл цитаты:
- Ris (Zotero)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
Расширенный поиск
Жирные кислоты (ЖК) безопасно хранятся в форме триацилглицерина (ТАГ) в органеллах липидных капель (ЛД) профессиональными запасающими клетками, называемыми адипоцитами. Эти липиды мобилизуются во время липолиза адипоцитов, основного процесса гидролиза ТАГ до ЖК для внутреннего или системного использования энергии. Наше понимание липолиза адипоцитов значительно расширилось за последние 50 лет от основного ферментативного процесса до динамического регуляторного процесса, включающего сборку и разборку белковых комплексов на поверхности LD.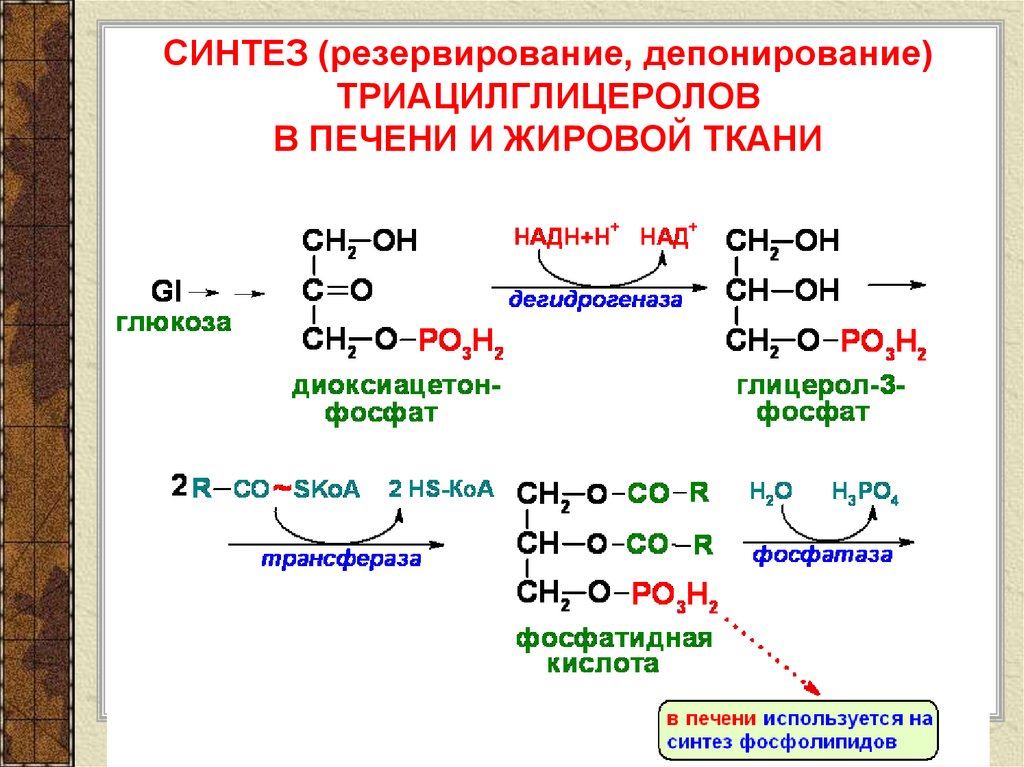 Эти динамические взаимодействия регулируются гормональными сигналами, такими как катехоламины и инсулин, которые оказывают противоположное влияние на липолиз. При стимуляции пататин-подобная фосфолипаза, содержащая домен 2 (PNPLA2)/триглицеридлипаза адипоцитов (ATGL), фермент, ограничивающий скорость гидролиза ТАГ, активируется за счет взаимодействия с его коактиватором, белком 5, содержащим альфа/бета-гидролазный домен. ABHD5), который обычно связан с перилипином 1 (PLIN1). Недавно идентифицированные негативные регуляторы липолиза включают ген 2 переключения G0/G1 (G0S2) и PNPLA3, которые взаимодействуют с PNPLA2 и ABHD5 соответственно. В этом обзоре основное внимание уделяется динамическим межбелковым взаимодействиям, участвующим в липолизе, и обсуждаются некоторые из новых концепций контроля липолиза, которые включают аллостерическую регуляцию и обмен белков. Кроме того, недавние исследования показывают, что многие из белков, участвующих в липолизе адипоцитов, являются многофункциональными ферментами и что липолиз может опосредовать гомеостатические метаболические сигналы как на клеточном уровне, так и на уровне всего тела, способствуя межорганной коммуникации.
Эти динамические взаимодействия регулируются гормональными сигналами, такими как катехоламины и инсулин, которые оказывают противоположное влияние на липолиз. При стимуляции пататин-подобная фосфолипаза, содержащая домен 2 (PNPLA2)/триглицеридлипаза адипоцитов (ATGL), фермент, ограничивающий скорость гидролиза ТАГ, активируется за счет взаимодействия с его коактиватором, белком 5, содержащим альфа/бета-гидролазный домен. ABHD5), который обычно связан с перилипином 1 (PLIN1). Недавно идентифицированные негативные регуляторы липолиза включают ген 2 переключения G0/G1 (G0S2) и PNPLA3, которые взаимодействуют с PNPLA2 и ABHD5 соответственно. В этом обзоре основное внимание уделяется динамическим межбелковым взаимодействиям, участвующим в липолизе, и обсуждаются некоторые из новых концепций контроля липолиза, которые включают аллостерическую регуляцию и обмен белков. Кроме того, недавние исследования показывают, что многие из белков, участвующих в липолизе адипоцитов, являются многофункциональными ферментами и что липолиз может опосредовать гомеостатические метаболические сигналы как на клеточном уровне, так и на уровне всего тела, способствуя межорганной коммуникации.
 30, нет. 2004. Т. 4. С. 294–309.
30, нет. 2004. Т. 4. С. 294–309. Грин и О. Кехинде, «Устоявшаяся преджировая клеточная линия и ее дифференцировка в культуре. II. Факторы, влияющие на конверсию жира», Cell , vol. 5, нет. 1, стр. 19–27, 1975.
Грин и О. Кехинде, «Устоявшаяся преджировая клеточная линия и ее дифференцировка в культуре. II. Факторы, влияющие на конверсию жира», Cell , vol. 5, нет. 1, стр. 19–27, 1975.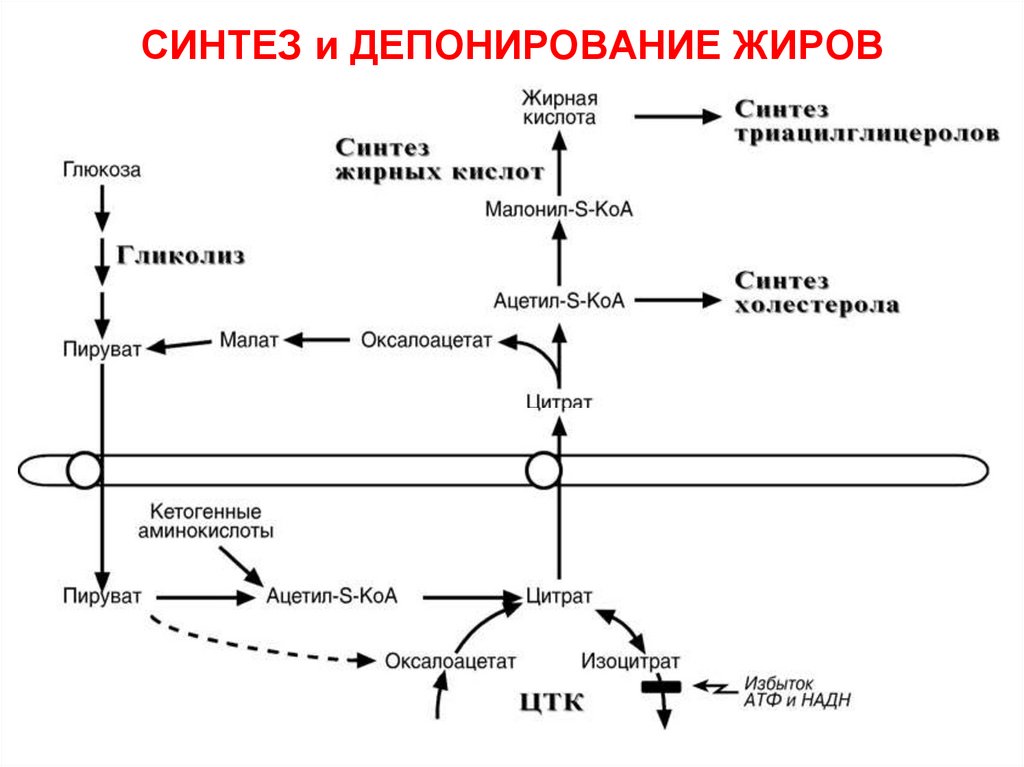 Тории, С. Морикава, А. Накано и К. Морикава, «Создание линии клеток человека, предрасположенной к ожирению, HPB -AML-I: рефрактерность к PPAR γ , опосредованная адипогенной стимуляцией», Journal of Cellular Physiology , vol. 197, нет. 1, стр. 42–52, 2003 г.
Тории, С. Морикава, А. Накано и К. Морикава, «Создание линии клеток человека, предрасположенной к ожирению, HPB -AML-I: рефрактерность к PPAR γ , опосредованная адипогенной стимуляцией», Journal of Cellular Physiology , vol. 197, нет. 1, стр. 42–52, 2003 г.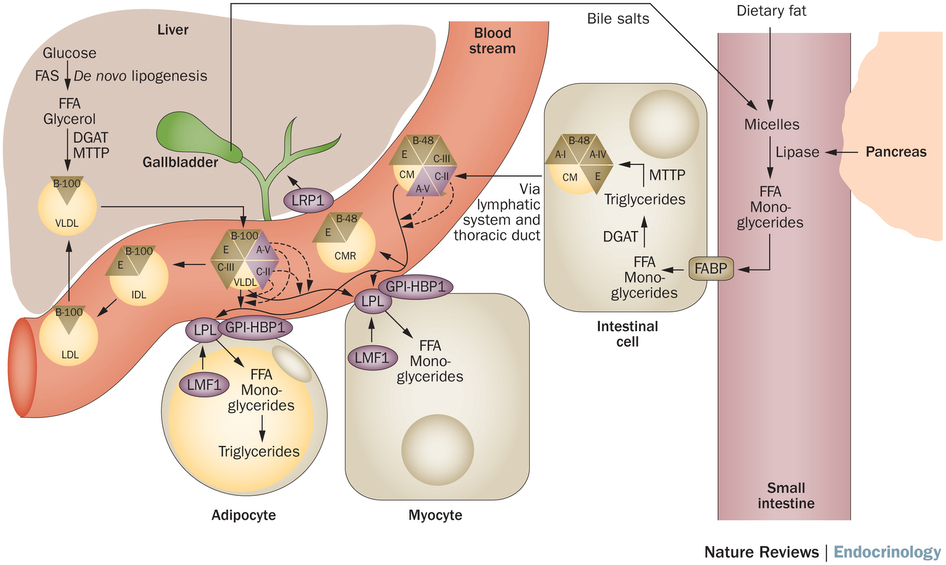 Го и К. Ляо, «Анализ профиля экспрессии генов во время дифференцировки преадипоцитов 3T3-L1», Ген , том. 251, нет. 1, стр. 45–53, 2000.
Го и К. Ляо, «Анализ профиля экспрессии генов во время дифференцировки преадипоцитов 3T3-L1», Ген , том. 251, нет. 1, стр. 45–53, 2000.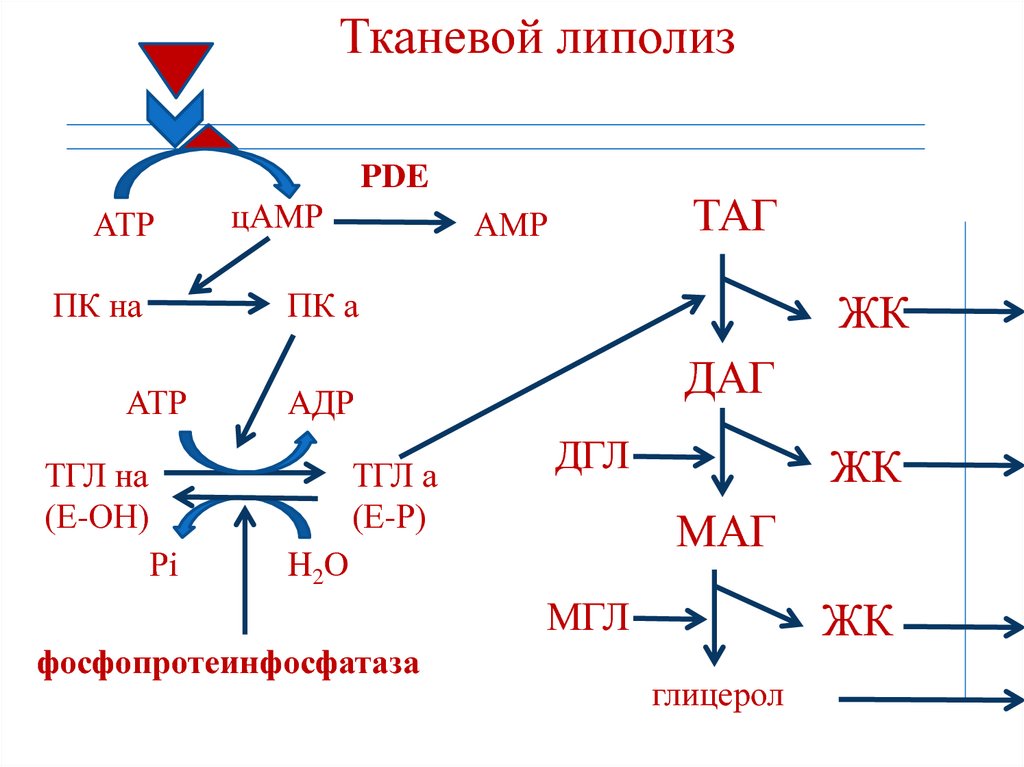 Fruhbeck, «Обзор жировой ткани и ее роль в ожирении и нарушениях обмена веществ», в Adipose Tissue Protocols , K. Yang, Ed., стр. 1–22, Humana Press, Totowa, Нью-Джерси, США, 2-е издание, 2008 г.
Fruhbeck, «Обзор жировой ткани и ее роль в ожирении и нарушениях обмена веществ», в Adipose Tissue Protocols , K. Yang, Ed., стр. 1–22, Humana Press, Totowa, Нью-Джерси, США, 2-е издание, 2008 г. Грин, «Липолиз в адипоцитах, выделенных из глубоких и поверхностная подкожная жировая клетчатка» Исследования ожирения , том. 10, нет. 4, pp. 266–269, 2002.
Грин, «Липолиз в адипоцитах, выделенных из глубоких и поверхностная подкожная жировая клетчатка» Исследования ожирения , том. 10, нет. 4, pp. 266–269, 2002.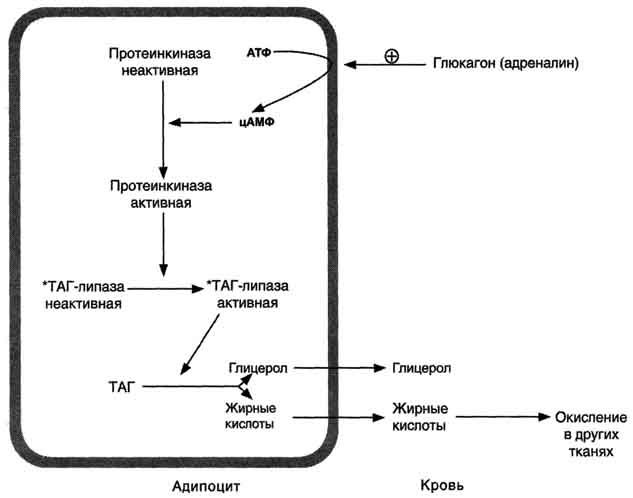 I. Подготовка клеток, манипуляции и предсказуемость поведения», Journal of Biological Chemistry , vol. 260, нет. 28, стр. 15122–15129, 1985.
I. Подготовка клеток, манипуляции и предсказуемость поведения», Journal of Biological Chemistry , vol. 260, нет. 28, стр. 15122–15129, 1985. Т. Монтегю, Дж. Б. Принс, Л. Сандерс, Дж. Э. Дигби и С. О’Рахилли, «Depot-and sex-specific различия в экспрессии мРНК лептина человека: последствия для контроля регионального распределения жира» Диабет , том. 46, нет. 3, стр. 342–347, 1997.
Т. Монтегю, Дж. Б. Принс, Л. Сандерс, Дж. Э. Дигби и С. О’Рахилли, «Depot-and sex-specific различия в экспрессии мРНК лептина человека: последствия для контроля регионального распределения жира» Диабет , том. 46, нет. 3, стр. 342–347, 1997.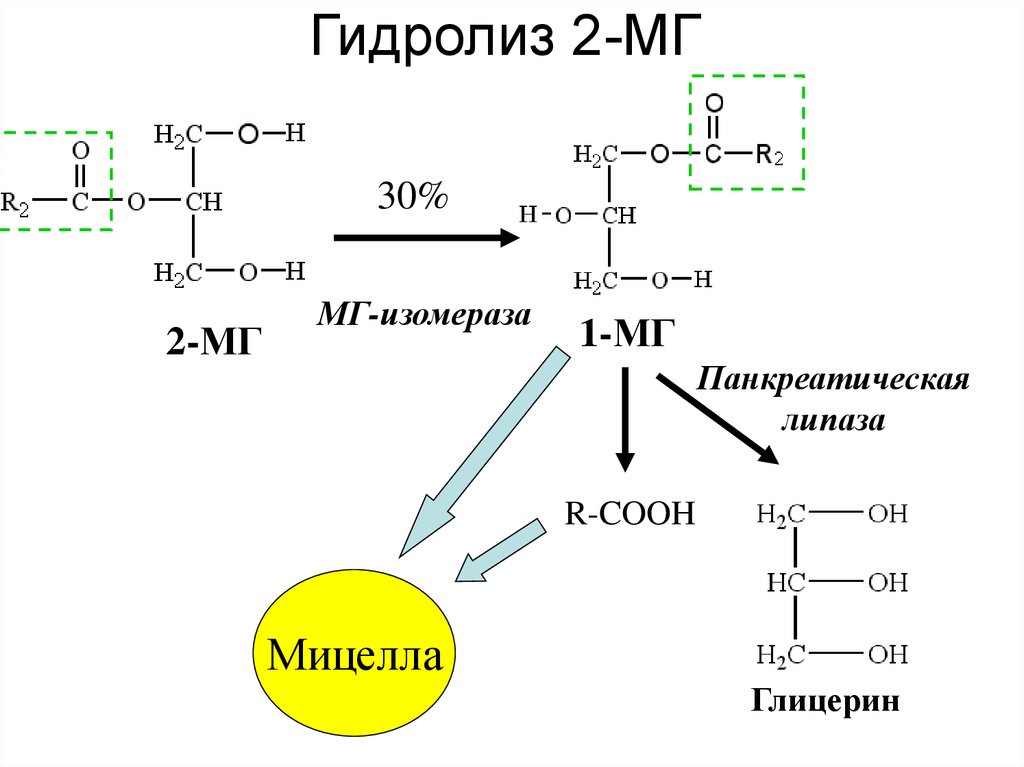 . 40, нет. 9, стр. 990–996, 1991.
. 40, нет. 9, стр. 990–996, 1991.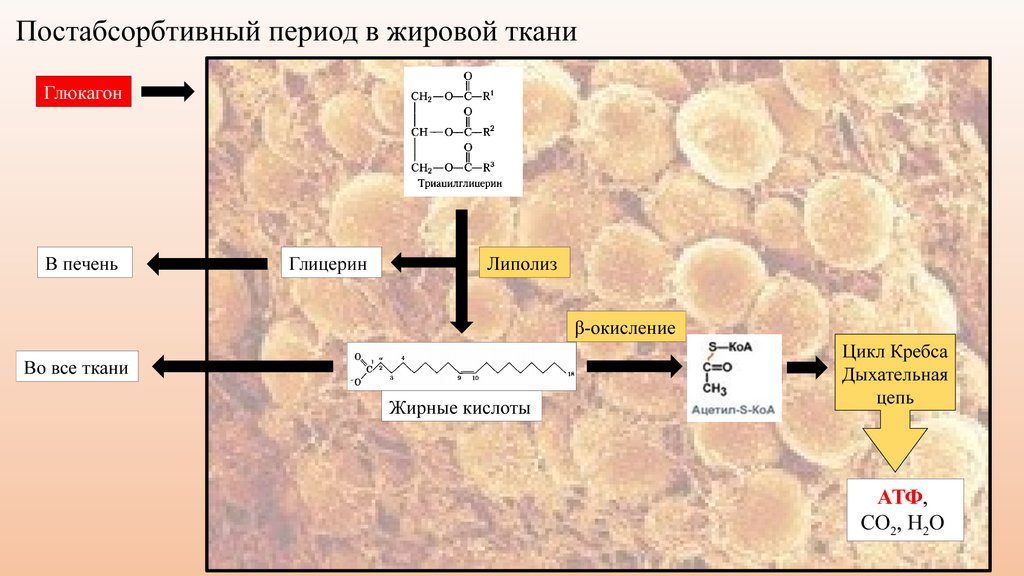 Г. Славин и Дж. Дж. Элиас, «Влияние гипофизарных гормонов и норадреналина на размер жировых клеток в культуре органов», Запись , том. 164, нет. 2, pp. 141–151, 1969.
Г. Славин и Дж. Дж. Элиас, «Влияние гипофизарных гормонов и норадреналина на размер жировых клеток в культуре органов», Запись , том. 164, нет. 2, pp. 141–151, 1969. Alinejad, R. Shafiee-Nick и A. Ghorbani, «Влияние производных цилостамида на липолиз забрюшинной жировой ткани крыс», Clinical Biochemistry , vol. 44, с. S248, 2011.
Alinejad, R. Shafiee-Nick и A. Ghorbani, «Влияние производных цилостамида на липолиз забрюшинной жировой ткани крыс», Clinical Biochemistry , vol. 44, с. S248, 2011. Г. Вернон, Р. А. Клегг и Д. Дж. Флинт, «Метаболизм жировой ткани овец во время беременности и лактации. Адаптация и регулирование», Биохимический журнал , том. 200, нет. 2, pp. 307–314, 1981.
Г. Вернон, Р. А. Клегг и Д. Дж. Флинт, «Метаболизм жировой ткани овец во время беременности и лактации. Адаптация и регулирование», Биохимический журнал , том. 200, нет. 2, pp. 307–314, 1981.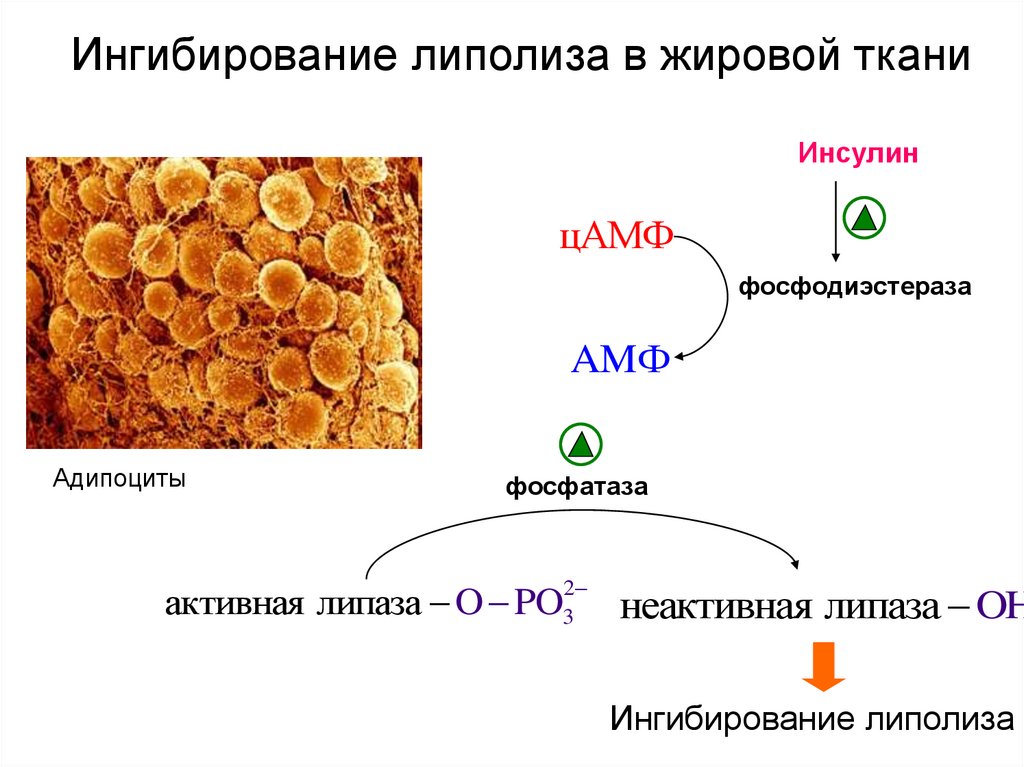 Арнер и Дж. Болиндер, «Микродиализ жировой ткани», Журнал внутренних болезней , том. 230, нет. 4, стр. 381–386, 1991.
Арнер и Дж. Болиндер, «Микродиализ жировой ткани», Журнал внутренних болезней , том. 230, нет. 4, стр. 381–386, 1991.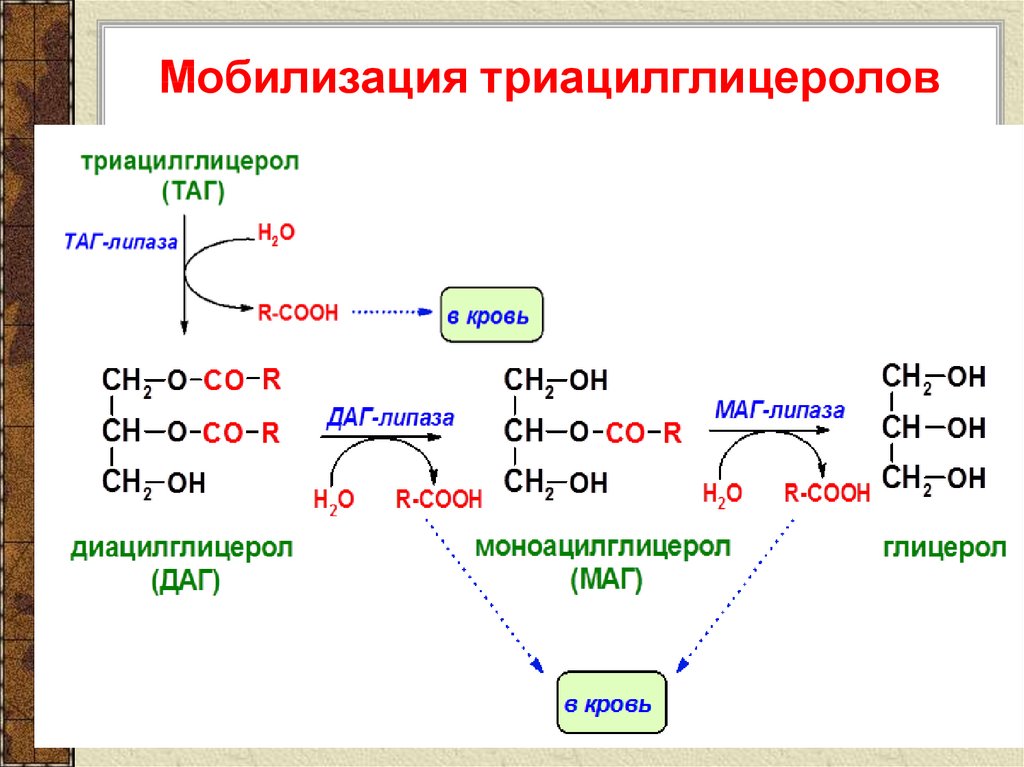 75, стр. 103–120, 2013.
75, стр. 103–120, 2013.