Бактериальное загрязнение воздуха: источники, показатели
Атмосферный воздух наполнен спорами грибов, цистами простейших, микробами, вирусами, бактериями. Но благодаря солнцу атмосфера очищается, микробы гибнут при отсутствии питания и от ультрафиолета (УФ). Показатели бактериального загрязнения воздуха — общее количество микробов на 1 метр кубический и наличие санитарно-показательных микроорганизмов. За параметром важно следить, чтобы беречь здоровье людей.
Содержание статьи:
Источники загрязнения
Чем ближе к земле, тем атмосфера больше заражена.
Источники загрязнения:
- почва;
- человек;
- растения и животные;
- выбросы производств.
Количество вирусов зависит от времени года: зимой микроклимат чище, летом — наиболее загрязнен. В жару верхние слои земли пересыхают, бактерии поднимаются.
Плохой показатель чистоты воздушного потока будет в мало проветриваемых помещениях, где постоянно большое количество людей.
Появился современный разносчик бактерий — кондиционер. На поверхности расселяются колонии микробов и попадают прямо в цель — человеческий организм.
Нормы засорения воздушного потока
Оценка микробного загрязнения кислорода в комнате производится путем расчета всех микроорганизмов, приходящихся на 1 м3 воздуха, и нахождения гемолитических стрептококков и стафилококков — жителей человеческих дыхательных путей.
Больничные учреждения требуют контролировать вирусный баланс. Для каждого отделения свои уровни микробного загрязнения воздуха:
- В операционной, помещении для новорожденных, родильном зале до начала работы составляет не более 200 КОЕ/м3, во время работы — не более 500 КОЕ/м3.
- В послеродовых комнатах, палатах для новорожденных до начала работы — не более 500 КОЕ/м3, во время работы — не более 750 КОЕ/м3.
Норма загрязнения микроклимата в жилых комнатах составляет 20 000 КОЕ/м3.
Пути распространения инфекции
Заразиться вирусом, летающим в атмосфере, просто.
Пути передачи инфекции через воздух:
- капельный — заражение происходит путем вдыхания мелких капель слюноотделения, мокроты, выделяемой при кашле, чихании, общении с инфицированными людьми;
- пылевым способом — пыль летает с микроорганизмами, люди вдыхают ее.
Для предотвращения массового распространения инфекций требуется своевременно делать хлорирование, стерилизацию, кварцевание помещений.
Методы уменьшения бактериального загрязнения воздушного потока
Уменьшению засорения микроклимата в помещениях способствует:
- Кондиционирование воздушных масс.
- Применение УФ-ламп.
- Тщательная уборка помещений, практически 24 часа в сутки.
- Обеззараживание атрибутов ухода за больными.
- Соблюдение норм по притоку, вытяжке воздуха.
- Выделение помещений для грязных и чистых работ.
Выполнение инструкций не даст привести к массовым заражениям и повлечь за собой эпидемии.
Воздушные массы кишат микробами, бактериями. Чтобы оградиться от инфекций, нужно соблюдать личную гигиену, проветривать почаще комнаты, кабинеты, делать своевременно влажную уборку. И не забывать гулять на свежем воздухе под лучами солнца.
Чтобы оградиться от инфекций, нужно соблюдать личную гигиену, проветривать почаще комнаты, кабинеты, делать своевременно влажную уборку. И не забывать гулять на свежем воздухе под лучами солнца.
5. Бактериальное загрязнение воздуха. Санитарно-показательные микроорганизмы. Санация воздушной среды.
Воздух непригоден для размножения микроорганизмов, так как в нем недостаточно влаги и питательных веществ, а солнечная радиация и высушивание оказывают бактерицидное действие.
Бактерии попадают в воздух в основном из почвы, с поверхности растений и животных, от человека воздушно-капельным путем, с отходами некоторых производств.
В атмосферном воздухе преобладают споры грибов, актиномицетов, бацилл, пигментообразующие виды аспорогенных бактерий.
В воздухе плохо
проветриваемых и перенаселенных
помещений содержится большое
количество микроорганизмов. В основном,
это микрофлора дыхательных путей и кожи
человека.
В основном,
это микрофлора дыхательных путей и кожи
человека.
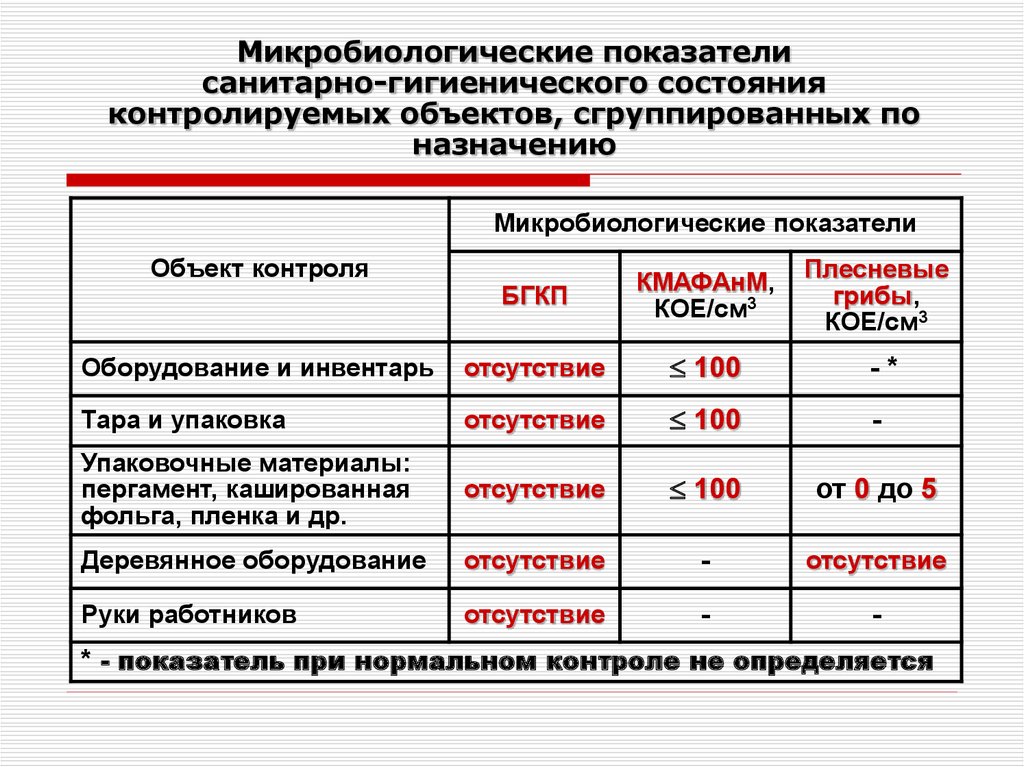
Санитарно-микробиологическое состояние воздуха помещений оценивают по следующим показателям:
1) Микробное число — количество микроорганизмов, обнаруженных в 1 м3 воздуха.
2)
Наличие санитарно-показательных
бактерий — представителей
микрофлоры дыхательных путей {гемолитические
стрептококки, золотистый стафилококк).
Для определения микробного числа воздуха в помещениях применяют следующие методы:
1) Седиментационный метод — основан на принципе осаждения (седиментации). Две чашки Петри с питательным агаром оставляют открытыми в течение 60 минут, после чего инкубируют при 37°С 1 сутки. Результаты оценивают по суммарному числу колоний, выросших в обеих чашках:
менее 250 колоний — воздух чистый 250-500 — загрязненный в средней степени 500 — загрязненный.
2) Аспирационный метод. Более точный метод. Посев производится автоматически с помощью специальных аппаратов. Примером может служить
аппарат Кротова. Он устроен таким образом, что воздух с заданной скоростью просасывается через щель пластины, которая при этом вращается. Под пластиной находится чашка Петри. Таким образом, происходит равномерное распределение микроорганизмов по питательной среде. Расчет производят по формуле: X = а /V * 1000, где а — количество выросших колоний V — объем пропущенного воздуха, дм3 (л) 1000 — искомый объем, дм (л)
Нормы микробного числа: —
Операционные до начала работы — не более 500 Операционные во время работы — не более 1000 Родильные комнаты — не более 1000
Палаты для недоношенных детей — не более 750
Воздух
является важным фактором распространения
патогенных микроорганизмов. Через
воздух передаются возбудители многих
заболеваний, таких как грипп,
ОРЗ, ангина, дифтерия, туберкулез, коклюш,
чума и
др.
Через
воздух передаются возбудители многих
заболеваний, таких как грипп,
ОРЗ, ангина, дифтерия, туберкулез, коклюш,
чума и
др.
Санация воздушной среды.
Наибольшее практическое значение’ имеет санация воздуха закрытых помещений с большим скоплением людей.
Очистка и дезинфекция (санация) воздушной среды закрытых помещений производится с помощью специальных очистителей и бактерицидных ламп.
Используют воздухоочистители передвижные рециркуляционные (ВОПР-0.9, ВОПР-1.5).
Из бактерицидных ламп применяют источники ультрафиолетового коротковолнового излучения. Наиболее удобны лампы БУВ.
Возможно два способа применения бактерицидных ламп БУВ:
1. В присутствии людей
2. Без людей
Более удобным и
эффективным является облучение воздуха
в присутствии людей. При этом лампы
располагают на высоте 2.5 м в местах
наиболее мощного конвекционного потока
воздуха (над отопительными приборами,
дверьми и тд). Необходимое число ламп
БУВ зависит от объема помещения и
мощности ламп. При расчете количества
ламп исходят из того, что на каждый
метр кубический воздуха должно приходится
0.75-1 Вт мощности, потребляемой лампой
из сети. Время облучения воздуха не
должно превышать 8 ч в сутки. Лучше
проводить облучение 3-4 раза в день с
перерывами для проветривания помещения.
Необходимое число ламп
БУВ зависит от объема помещения и
мощности ламп. При расчете количества
ламп исходят из того, что на каждый
метр кубический воздуха должно приходится
0.75-1 Вт мощности, потребляемой лампой
из сети. Время облучения воздуха не
должно превышать 8 ч в сутки. Лучше
проводить облучение 3-4 раза в день с
перерывами для проветривания помещения.
При санации воздуха в отсутствие людей (операционные, перевязочные и тд.) лампы размещают равномерно или с преобладанием над рабочими поверхностями. При этом на кубометр воздуха необходима потребляемая мощность не менее 1.5 Вт, а минимальное время облучения составляет 15-20 минут.
Кроме ламп БУВ применяют также лампы ПРК.
Нормативы:
21
1. При людях: высота — 1.7 м, мощность — 2-3 Вт/кубометр, облучение -несколько раз в день по 30 минут с интервалами для проветривания.
2. Без
людей: мощность
— 5-10 Вт/кубометр, время облучения —
максимально возможное.
В некоторой степени снижают микробную загрязненность воздуха помещений правильно организованная вентиляция, регулярные проветривания.
Бактериальные сообщества как индикаторы загрязнения окружающей среды СОЗ в морских отложениях
. 2021 1 января; 268 (Pt A): 115690.
doi: 10.1016/j.envpol.2020.115690. Epub 2020 25 сентября.
Хуанхо Родригес 1 , Кристин М. Дж. Галлампуа 2 , Питер Хаглунд 2 , Сари Тимонен 3 , Оуэн Роу 4
Принадлежности
- 1 Кафедра микробиологии Хельсинкского университета, Хельсинки, Финляндия.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Химический факультет Университета Умео, Умео, Швеция.
- 3 Кафедра микробиологии Хельсинкского университета, Хельсинки, Финляндия.
- 4 Кафедра микробиологии, Хельсинкский университет, Хельсинки, Финляндия; Хельсинкская комиссия (ХЕЛКОМ), Комиссия по защите морской среды Балтийского моря, Хельсинки, Финляндия.
- PMID: 33045590
- DOI: 10.1016/j.envpol.2020.115690
Хуанхо Родригес и др.
Загрязнение окружающей среды.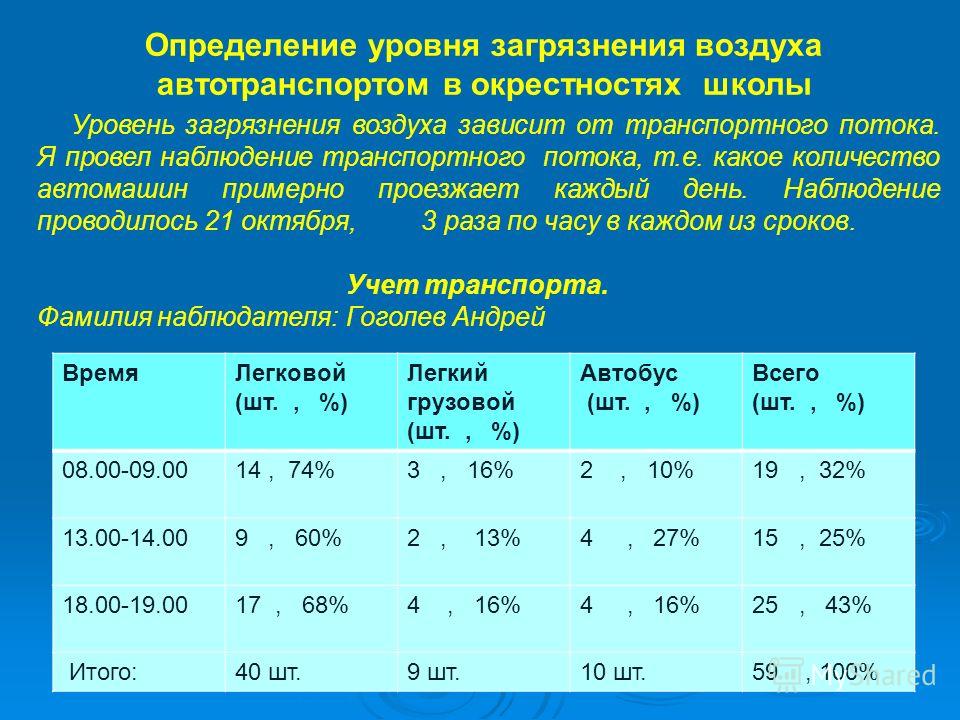 .
.
. 2021 1 января; 268 (Pt A): 115690.
doi: 10.1016/j.envpol.2020.115690. Epub 2020 25 сентября.
Авторы
Хуанхо Родригес 1 , Кристин М.Дж. Галлампуа 2 , Питер Хаглунд 2 , Сари Тимонен 3 , Оуэн Роу 4
Принадлежности
- 1 Кафедра микробиологии Хельсинкского университета, Хельсинки, Финляндия. Электронный адрес: [email protected].
- 2 Химический факультет Университета Умео, Умео, Швеция.

- 3 Кафедра микробиологии Хельсинкского университета, Хельсинки, Финляндия.
- 4 Кафедра микробиологии, Хельсинкский университет, Хельсинки, Финляндия; Хельсинкская комиссия (ХЕЛКОМ), Комиссия по защите морской среды Балтийского моря, Хельсинки, Финляндия.
- PMID: 33045590
- DOI: 10.1016/j.envpol.2020.115690
Абстрактный
Десятилетия интенсивных промышленных выбросов в прибрежные системы привели к накоплению различных стойких органических загрязнителей (СОЗ) в морских водах и донных отложениях, оказывающих пагубное воздействие на водные экосистемы и местную биоту. СОЗ относятся к наиболее опасным химическим веществам, образующимся в результате промышленной деятельности, из-за их биотоксичности и устойчивости к разложению в окружающей среде. Известно, что бактериальные сообщества расщепляют многие из этих ароматических соединений, и было описано, что различные члены встречающихся в природе бактериальных консорциумов работают в синтрофической ассоциации, чтобы процветать в сильно загрязненных водах и отложениях, что делает их потенциальными кандидатами в качестве биоиндикаторов загрязнения окружающей среды. В этом исследовании отбор проб окружающей среды сочетался с химическим анализом загрязняющих веществ и секвенированием бактериальных сообществ с высоким разрешением с использованием инструментов молекулярной биологии Next Generation Sequencing. Целью настоящего исследования было описание бактериальных сообществ из морских отложений, содержащих большое количество СОЗ, и выявление соответствующих членов резидентных микробных сообществ, которые могут выступать в качестве биоиндикаторов загрязнения.
СОЗ относятся к наиболее опасным химическим веществам, образующимся в результате промышленной деятельности, из-за их биотоксичности и устойчивости к разложению в окружающей среде. Известно, что бактериальные сообщества расщепляют многие из этих ароматических соединений, и было описано, что различные члены встречающихся в природе бактериальных консорциумов работают в синтрофической ассоциации, чтобы процветать в сильно загрязненных водах и отложениях, что делает их потенциальными кандидатами в качестве биоиндикаторов загрязнения окружающей среды. В этом исследовании отбор проб окружающей среды сочетался с химическим анализом загрязняющих веществ и секвенированием бактериальных сообществ с высоким разрешением с использованием инструментов молекулярной биологии Next Generation Sequencing. Целью настоящего исследования было описание бактериальных сообществ из морских отложений, содержащих большое количество СОЗ, и выявление соответствующих членов резидентных микробных сообществ, которые могут выступать в качестве биоиндикаторов загрязнения.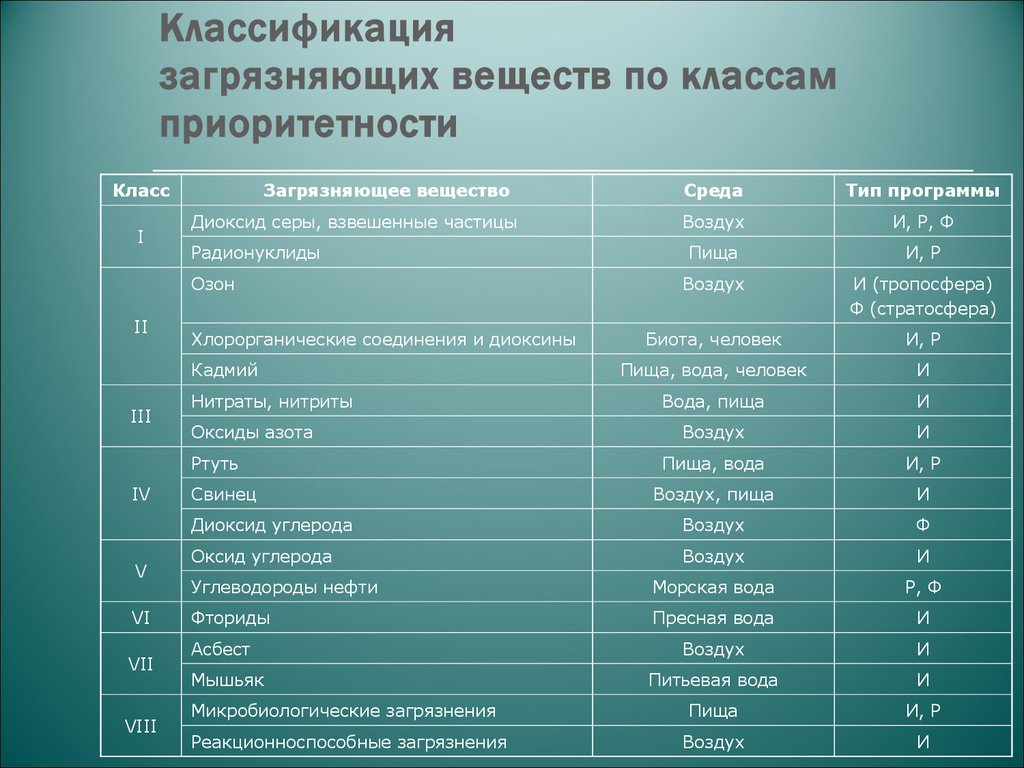 Морские отложения были собраны в районе прибрежной бухты Балтийского моря, исторически находившейся под влиянием интенсивной промышленной деятельности, включая выплавку металлов, переработку нефти и производство целлюлозы и бумаги. Различные типы СОЗ были обнаружены в высоких концентрациях. Было обнаружено, что отложения волокнистых отложений, возникшие в результате исторической деятельности бумажной промышленности, содержат четко обособленное бактериальное сообщество, включая ряд таксонов бактерий, способных к целлюлозолитической и дехлорирующей активности. Наши результаты показывают, что определенные члены бактериальных сообществ процветают при повышении уровня СОЗ в морских отложениях, и что обилие определенных таксонов коррелирует с конкретными СОЗ (или группами), которые потенциально могут быть использованы в целях мониторинга, оценки состояния и управления окружающей средой. .
Морские отложения были собраны в районе прибрежной бухты Балтийского моря, исторически находившейся под влиянием интенсивной промышленной деятельности, включая выплавку металлов, переработку нефти и производство целлюлозы и бумаги. Различные типы СОЗ были обнаружены в высоких концентрациях. Было обнаружено, что отложения волокнистых отложений, возникшие в результате исторической деятельности бумажной промышленности, содержат четко обособленное бактериальное сообщество, включая ряд таксонов бактерий, способных к целлюлозолитической и дехлорирующей активности. Наши результаты показывают, что определенные члены бактериальных сообществ процветают при повышении уровня СОЗ в морских отложениях, и что обилие определенных таксонов коррелирует с конкретными СОЗ (или группами), которые потенциально могут быть использованы в целях мониторинга, оценки состояния и управления окружающей средой. .
Ключевые слова: Бактериальные сообщества; Балтийское море; экологические показатели; Загрязнение окружающей среды; Стойкие органические загрязнители.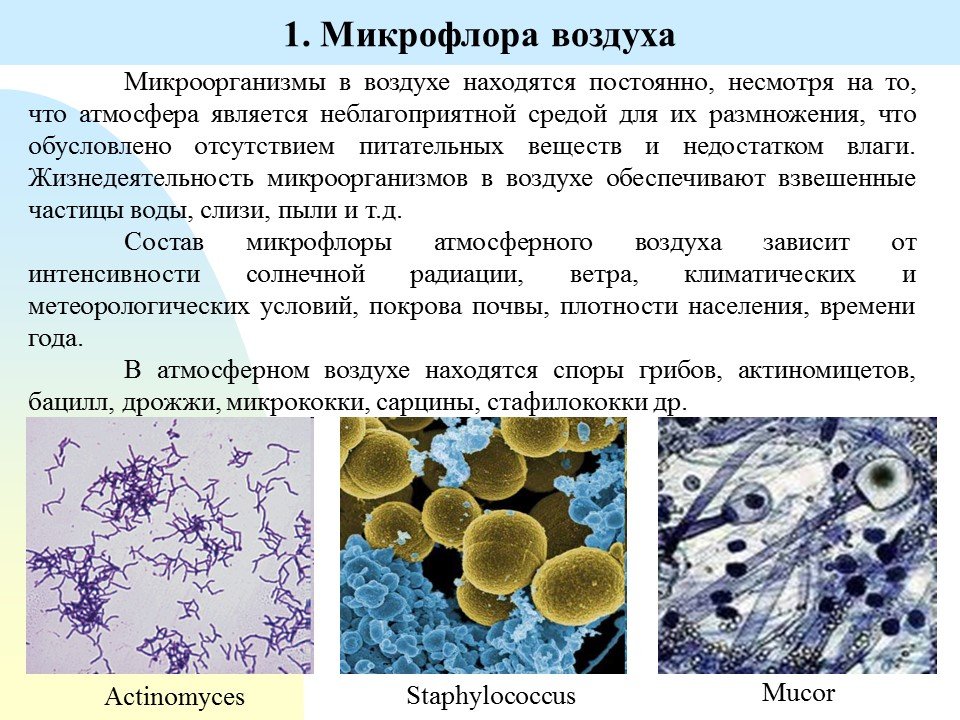
Copyright © 2020 Elsevier Ltd. Все права защищены.
Заявление о конфликте интересов
Декларация о конкурирующих интересах Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье.
Похожие статьи
Химическая, биологическая и экотоксикологическая оценка пестицидов и стойких органических загрязнителей в реке Бахлуй, Румыния.
Нямту М., Чумасу И.М., Костика Н., Костика М., Бобу М., Никоара М.Н., Катринеску С., ван Слоотен К.Б., Де Аленкастро Л.Ф. Нямту М. и соавт. Environ Sci Pollut Res Int. 2009 авг; 16 Приложение 1: S76-85. doi: 10.1007/s11356-009-0101-0.
 Электронная книга 2009 г.20 фев.
Environ Sci Pollut Res Int. 2009.
PMID: 19229579
Электронная книга 2009 г.20 фев.
Environ Sci Pollut Res Int. 2009.
PMID: 19229579Источники, пути и относительные риски загрязнения поверхностных и подземных вод: перспектива, подготовленная для расследования Уокертона.
Риттер Л., Соломон К., Сибли П., Холл К., Кин П., Матту Г., Линтон Б. Риттер Л. и соавт. J Toxicol Environ Health A. 2002 Jan 11;65(1):1-142. дои: 10.1080/152873
3338572.
J Toxicol Environ Health A. 2002.
PMID: 11809004
Рассмотрение.Органические загрязнители в морских отложениях и морской воде: обзор для проведения диагностики окружающей среды и поиска информативных предикторов.
Авеллан А., Дуарте А., Роша-Сантос Т. Авеллан А. и др. Научная общая среда. 2022, 20 февраля; 808:152012.
 doi: 10.1016/j.scitotenv.2021.152012. Epub 2021 29 ноября.
Научная общая среда. 2022.
PMID: 34856284
Рассмотрение.
doi: 10.1016/j.scitotenv.2021.152012. Epub 2021 29 ноября.
Научная общая среда. 2022.
PMID: 34856284
Рассмотрение.Роль загрязнения металлами в формировании микробных сообществ в сильно загрязненных морских отложениях.
Ди Чезаре А., Пьевац П., Эккерт Э., Курков Н., Мико Шпарица М., Корно Г., Орлич С. Ди Чезаре А. и др. Загрязнение окружающей среды. 2020 окт; 265 (Pt B): 114823. doi: 10.1016/j.envpol.2020.114823. Epub 2020 2 июня. Загрязнение окружающей среды. 2020. PMID: 32512474
Предварительное исследование распространения металлов и стойких органических загрязнителей (СОЗ), включая перфторалкилированные кислоты (ПФАС), в водной среде вблизи Морогоро, Танзания, и потенциальных рисков для здоровья человека.
Гроффен Т.
 , Рейндерс Дж., Ван Дорн Л., Йориссен С., Де Боргер С.М., Луттихуис Д.О., де Дейн Л., Ковачи А., Бервоетс Л.
Гроффен Т. и др.
Окружающая среда Рез. 2021 Январь; 192:110299. doi: 10.1016/j.envres.2020.110299. Epub 2020 13 октября.
Окружающая среда Рез. 2021.
PMID: 33058811
, Рейндерс Дж., Ван Дорн Л., Йориссен С., Де Боргер С.М., Луттихуис Д.О., де Дейн Л., Ковачи А., Бервоетс Л.
Гроффен Т. и др.
Окружающая среда Рез. 2021 Январь; 192:110299. doi: 10.1016/j.envres.2020.110299. Epub 2020 13 октября.
Окружающая среда Рез. 2021.
PMID: 33058811
Посмотреть все похожие статьи
Цитируется
Как просто и эффективно проводить скрининг микробных штаммов, способных к анаэробному биосинтезу биосурфактантов: разработка метода, влияющие факторы и оценка примера применения.
Чжао Ф, Ван И, Ху С, Хуан С. Чжао Ф и др. Фронт микробиол. 2022, 12 сентября; 13:989998. дои: 10.3389/fmicb.2022.989998. Электронная коллекция 2022. Фронт микробиол. 2022. PMID: 36171744 Бесплатная статья ЧВК.
Использование социологических теорий и методов для анализа решений и мер по проблемам загрязнения окружающей среды.

Чен С. Чен С. J Окружающая среда Общественное здравоохранение. 2022 5 сентября; 2022:9904222. дои: 10.1155/2022/9904222. Электронная коллекция 2022. J Окружающая среда Общественное здравоохранение. 2022. PMID: 36105513 Бесплатная статья ЧВК.
термины MeSH
вещества
Микробы и их использование в качестве индикаторов загрязнения
ПОЛУЧИТЬ ПРИЛОЖЕНИЕ
Микробы и их использование в качестве индикаторов загрязненияISSN: 2375-4397
Editorial — (2013) Volume 1, Issue 1
Посмотреть PDF Скачать PDF
- Габриэлла Карузо *
- Институт прибрежной морской среды (IAMC), Итальянский национальный исследовательский совет (CNR), Spianata S. Raineri, 86, 98122 Мессина, Италия
* Автор, ответственный за переписку: Габриэлла Карузо, Институт прибрежной морской среды (IAMC), Итальянский национальный исследовательский совет (CNR), Spianata S.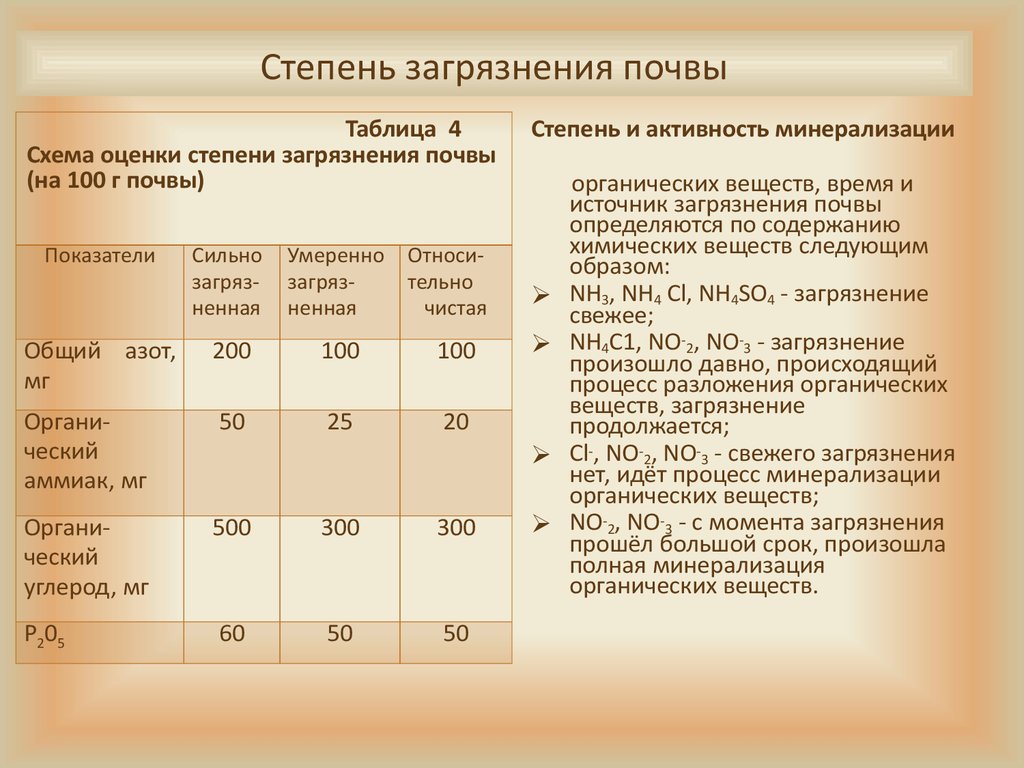 Raineri, 86, 98122 Мессина, Италия Электронная почта:
Raineri, 86, 98122 Мессина, Италия Электронная почта:
% воды на этой планете содержится в океанах и морях. Морские экосистемы являются важным ресурсом не только для необычайного разнообразия жизни, в которой они обитают, но и для многочисленных видов деятельности, происходящих в них (т.е. рекреационной и производственной деятельности, такой как туризм, аквакультура и рыболовство, морские перевозки и перевозки, эксплуатация энергетических ресурсов, таких как добыча нефти и газа, расположение трубопроводов и подводных кабелей, использование в военных целях и др.). Антропогенное воздействие на морскую среду особенно проявляется в прибрежных районах, наиболее уязвимых к нагрузкам [1] и подверженных воздействию городских, сельскохозяйственных и промышленных стоков с их загрязнением органическими и неорганическими частицами, ксенобиотиками и другими загрязняющими веществами. , разлив нефти, тяжелые металлы и т. д. — с последующим ухудшением качества воды и изменением функционирования экосистемы. Осознание растущих угроз, вызванных антропогенным давлением на морскую экосистему, объясняет растущий интерес к защите морской среды, который недавно проявился в выпуске Рамочной директивы Европейской морской стратегии (2008/56/EC) [2]. .
Осознание растущих угроз, вызванных антропогенным давлением на морскую экосистему, объясняет растущий интерес к защите морской среды, который недавно проявился в выпуске Рамочной директивы Европейской морской стратегии (2008/56/EC) [2]. .
Настоящая Директива касается разработки планов мониторинга и принятия мер для достижения хорошего экологического статуса (GES) к 2020 году. GES – это экологический статус морских вод, при котором экологическое разнообразие и жизнеспособность морей и океаны сохраняются, чтобы они оставались чистыми, здоровыми и продуктивными; использование морской среды должно быть устойчивым, с сохранением ее потенциала для использования и деятельности для настоящего и будущих поколений. Определение GES варьируется в зависимости от различных субрегионов (например, для Средиземного моря, западной части Средиземного моря, Адриатического моря, а также Ионического и Центрального Средиземного морей). Определенные критерии и индикаторы устанавливаются для достижения качественных и количественных целей, воздействуя на давление и снижая воздействие.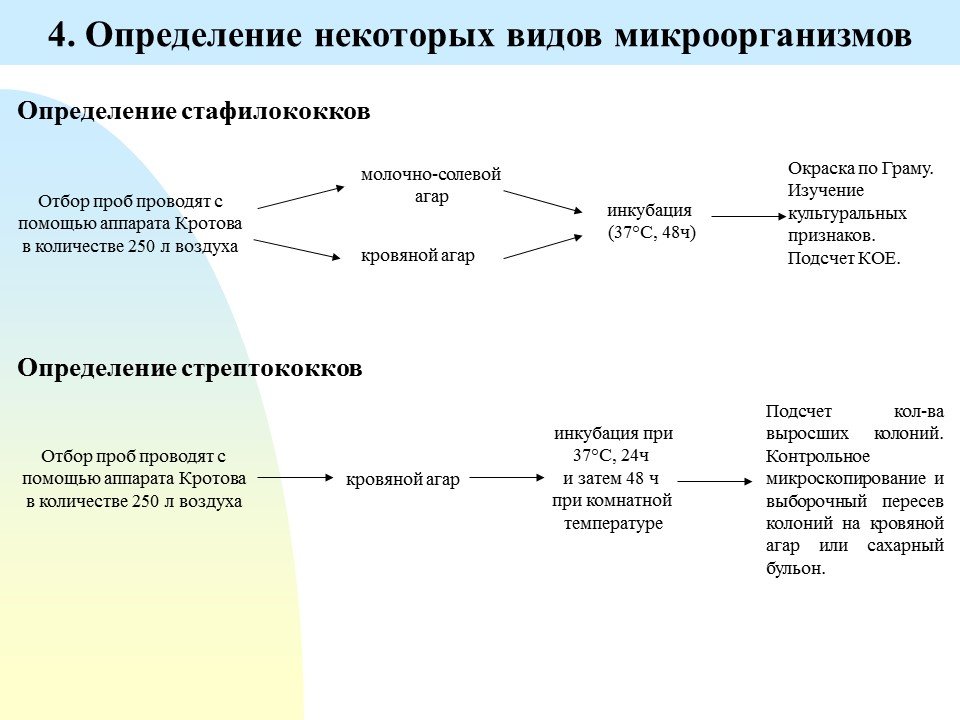 Морская стратегия основана на интегрированном «экосистемном» подходе и направлена на то, чтобы стать экологическим столпом будущей морской политики Европейского Союза. Сохранение вод Средиземного моря от загрязнения особенно необходимо в связи с центральной ролью этого бассейна для большинства стран Европы, Африки и Ближнего Востока.
Морская стратегия основана на интегрированном «экосистемном» подходе и направлена на то, чтобы стать экологическим столпом будущей морской политики Европейского Союза. Сохранение вод Средиземного моря от загрязнения особенно необходимо в связи с центральной ролью этого бассейна для большинства стран Европы, Африки и Ближнего Востока.
Использование природных ресурсов должно соответствовать поддержанию оптимального уровня продуктивности и состояния здоровья. Для достижения такой цели необходимо определить некоторые пределы устойчивости морских экосистем, которые должны соблюдаться во всех видах деятельности человека.
Охрана и защита районов риска должны основываться на постоянном наблюдении за параметрами, характеризующими состояние здоровья каждой морской экосистемы. В связи с этим предлагается мониторинг биологических индикаторов, поскольку они играют фундаментальную роль в описании и прогнозировании изменений окружающей среды. В частности, рекомендуется использовать морские микроорганизмы для оценки качества морских экосистем, параллельно с физическими и химическими параметрами, в связи с их повсеместным распространением в морских водах, высоким оборотом биомассы и быстрой реакцией на изменения окружающей среды [3]. Бактерии или их антигены, гены или метаболические пути могут быть использованы в качестве подходящих маркеров контаминации [4].
Бактерии или их антигены, гены или метаболические пути могут быть использованы в качестве подходящих маркеров контаминации [4].
В этой записке основное внимание уделяется некоторым приложениям «на месте», разработанным в IAMC в Мессине, которые призваны дать представление о двух различных характеристиках загрязнения морской среды:
а) Определение бактериальных индикаторов фекального загрязнения посредством установки и применения экспресс-методы анализа.
b) Оценка микробной метаболической активности и изменений ее скорости в ответ на присутствие загрязнителей или органических материалов (т. е. органических полимеров в качестве субстратов, подвергающихся микробному разложению).
В этой последней теме (буква b) исследуются изменения активности некоторых микробных ферментов, таких как лейцинаминопептидаза и щелочная фосфатаза, вызванные присутствием органических (аллохтонных или автохтонных) примесей или загрязняющих веществ (т.е. углеводородов), чтобы предложить их пригодность в качестве маркеров экологического качества и потенциальных индикаторов для раннего предупреждения об эвтрофикации и разливах нефти.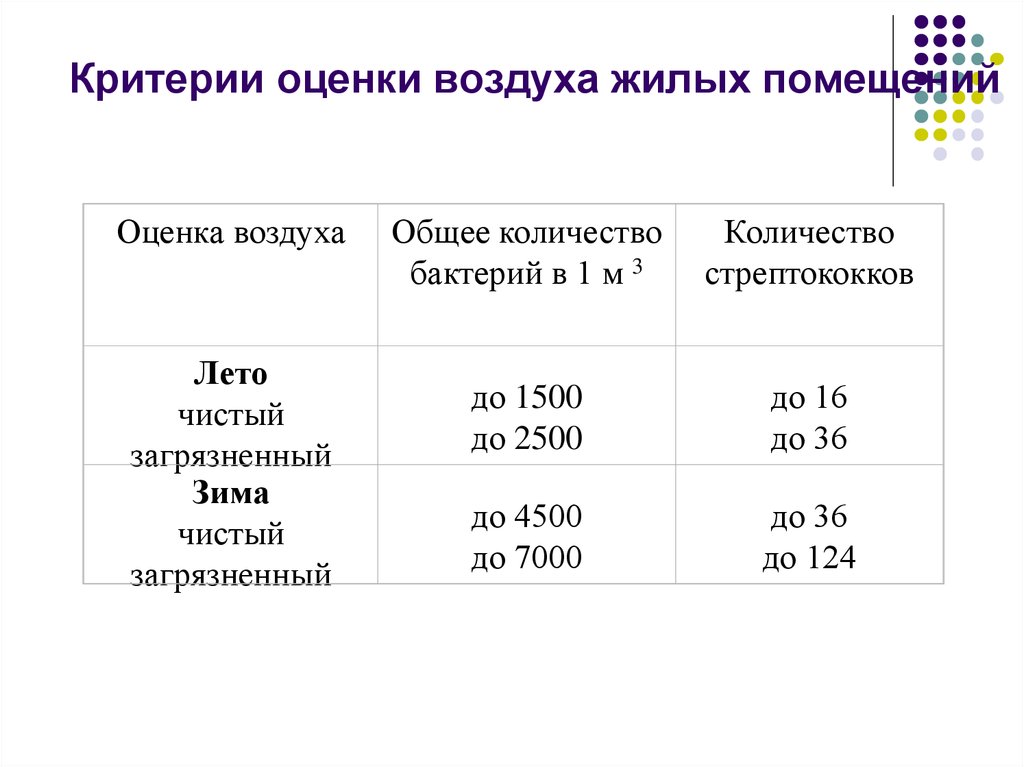
Акцентируя внимание на пункте а) микробиологическое качество прибрежных вод обычно оценивают путем определения фекальных индикаторных бактерий. Разработка быстрых протоколов для обнаружения и подсчета индикаторов фекального загрязнения в бактериальном сообществе, населяющем природные воды, была целью исследований, проведенных в течение последних десятилетий в IAMC-CNR в Мессине; данная тема представляет большой интерес для сохранения здоровья человека от гигиенико-санитарных рисков. Микроскопические подсчеты дают количественную оценку всего микробного сообщества, но не дают подробной информации о его видовом составе. Иммунологические методы (такие как метод флуоресцентных антител) предлагают трудоемкий и экономичный подход к обнаружению и идентификации целевых бактериальных клеток непосредственно «на месте» в соответствии с их морфологическими и антигенными свойствами. Этот метод нашел несколько применений в морской и солоноватой среде, а также с использованием автоматических устройств [5,6] для поиска отдельных видов микроорганизмов, что имеет гигиенически-санитарное значение, как индикаторы фекального загрязнения, Escherichia coli [7-12] или Enterococcus faecium [13] или бактерии, являющиеся патогенами для человека (S almonella spp . [14]) или животных ( Vibrio anguillarum и e . piscicida [15]). Также хорошо известно, что постоянный процент бактерий может преодолевать неблагоприятные условия окружающей среды, переходя в « жизнеспособное, но не культивируемое состояние» (VBNC), которое считается стратегией выживания; метод флуоресцентных антител можно сочетать с ферментативным анализом или окрашиванием жизнеспособности для оценки жизнеспособности патогена [16]. микроскопический Подсчет E. coli можно использовать для подпитки и проверки предварительных моделей, чтобы проследить судьбу индикаторов фекального загрязнения в море [17,18].
[14]) или животных ( Vibrio anguillarum и e . piscicida [15]). Также хорошо известно, что постоянный процент бактерий может преодолевать неблагоприятные условия окружающей среды, переходя в « жизнеспособное, но не культивируемое состояние» (VBNC), которое считается стратегией выживания; метод флуоресцентных антител можно сочетать с ферментативным анализом или окрашиванием жизнеспособности для оценки жизнеспособности патогена [16]. микроскопический Подсчет E. coli можно использовать для подпитки и проверки предварительных моделей, чтобы проследить судьбу индикаторов фекального загрязнения в море [17,18].
Касательно пункта b) микробы и их метаболическая активность также могут использоваться в качестве чувствительных маркеров возмущений окружающей среды. Благодаря имеющимся у них спектрам гидролитических ферментов микроорганизмы способны катализировать гидролиз органических полимеров, играя ключевую роль в биогеохимических циклах и регулируя потоки вещества и энергии в морских экосистемах [19]. ,20]. Поскольку микробное сообщество способно диверсифицировать свои метаболические спектры в связи с различной природой и составом органических полимеров, имеющихся в водах, определение активности ферментов было предложено в качестве простого инструмента для характеристики экологического состояния переходных территорий [21, 22], а также для оценки состояния почвы [23]. Ферментативная активность, участвующая в трансформации органического вещества, является функциональным атрибутом микробного сообщества, реагирующим на изменения окружающей среды; обнаружение значимых взаимосвязей между некоторыми ферментативными активностями (лейцинаминопептидазой, щелочной фосфатазой и бета-глюкозидазой) и абиотическими или биотическими показателями предполагает использование измерений ферментативной активности в качестве дополнительных параметров для характеристики качественного состояния природных экосистем с особым упором на их трофику. условия. Значительные корреляции, обнаруженные между уровнями активности лейцинаминопептидазы и щелочной фосфатазы и твердым органическим углеродом или хлорофиллом- и как дескрипторы трофического состояния и продуктивности водных экосистем указывают на оба этих фермента как на подходящие и быстрые маркеры для различения различных водоемов в соответствии с их трофическим состоянием.
,20]. Поскольку микробное сообщество способно диверсифицировать свои метаболические спектры в связи с различной природой и составом органических полимеров, имеющихся в водах, определение активности ферментов было предложено в качестве простого инструмента для характеристики экологического состояния переходных территорий [21, 22], а также для оценки состояния почвы [23]. Ферментативная активность, участвующая в трансформации органического вещества, является функциональным атрибутом микробного сообщества, реагирующим на изменения окружающей среды; обнаружение значимых взаимосвязей между некоторыми ферментативными активностями (лейцинаминопептидазой, щелочной фосфатазой и бета-глюкозидазой) и абиотическими или биотическими показателями предполагает использование измерений ферментативной активности в качестве дополнительных параметров для характеристики качественного состояния природных экосистем с особым упором на их трофику. условия. Значительные корреляции, обнаруженные между уровнями активности лейцинаминопептидазы и щелочной фосфатазы и твердым органическим углеродом или хлорофиллом- и как дескрипторы трофического состояния и продуктивности водных экосистем указывают на оба этих фермента как на подходящие и быстрые маркеры для различения различных водоемов в соответствии с их трофическим состоянием.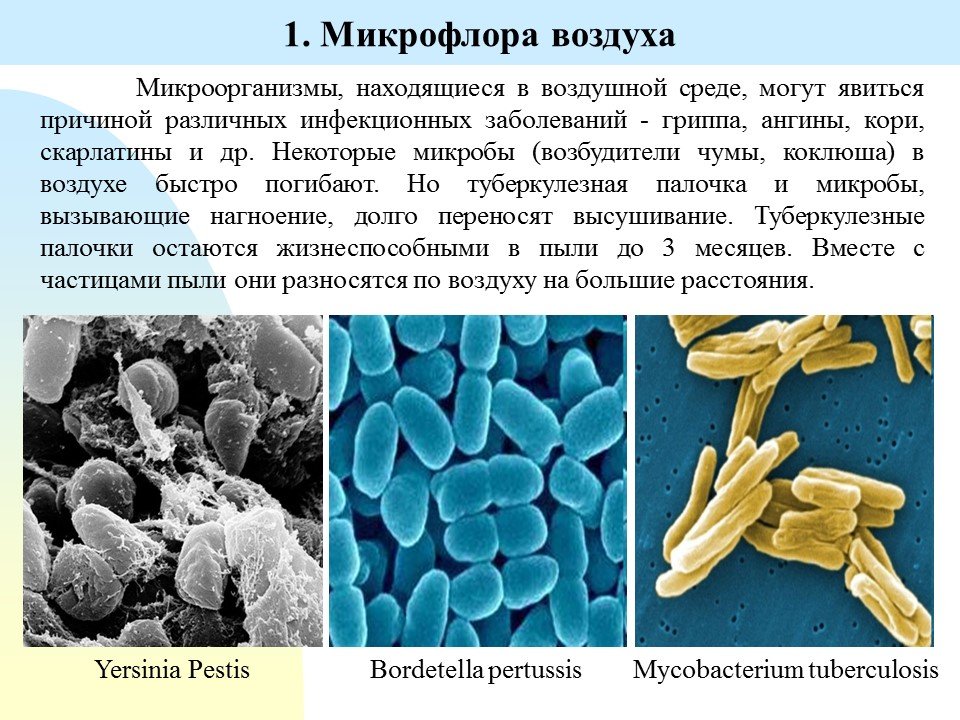 Активность микробных ферментов может быть предложена в качестве индикатора для обнаружения присутствия органических материалов [24-26], а также продуктов рыбоводства [27]. Мониторинг уровня микробной ферментативной активности может быть особенно важен в прибрежных районах, где большое количество доступного органического вещества поддерживает жизнеспособность бактерий и стимулирует синтез ферментов; здесь все ферменты действуют синергически, расщепляя новые органические соединения, образующиеся в результате фотосинтеза.
Активность микробных ферментов может быть предложена в качестве индикатора для обнаружения присутствия органических материалов [24-26], а также продуктов рыбоводства [27]. Мониторинг уровня микробной ферментативной активности может быть особенно важен в прибрежных районах, где большое количество доступного органического вещества поддерживает жизнеспособность бактерий и стимулирует синтез ферментов; здесь все ферменты действуют синергически, расщепляя новые органические соединения, образующиеся в результате фотосинтеза.
Микробный метаболизм органических полимеров может быть успешно применен также для отслеживания эволюции микробного сообщества с точки зрения структуры (конкретный состав) и функций (характер деградации) [28]. Капелло и др. [29] в микрокосмах, искусственно добавленных углеводородами с целью имитации разливов нефти, обнаружили значительное повышение активности лейцинаминопептидазы и щелочной фосфатазы после воздействия нефти.
Повышение активности лейцинаминопептидазы и бета-глюкозидазы было измерено в загрязненной нефтью поверхностной морской воде после разлива нефти Deepwater Horizon во время эксперимента по биоаугментации/биостимуляции [30]. Хотя это и не связано конкретно с разложением масла, определение такой микробной ферментативной активности, активной в разложении органических полимеров, таких как белки, полисахариды и органические фосфаты, не менее важно, поскольку оно дает представление о влиянии, вызываемом нефтью и бактериальной модификацией на бактериальный сообщество, способное расщеплять эти органические субстраты в водной среде.
Хотя это и не связано конкретно с разложением масла, определение такой микробной ферментативной активности, активной в разложении органических полимеров, таких как белки, полисахариды и органические фосфаты, не менее важно, поскольку оно дает представление о влиянии, вызываемом нефтью и бактериальной модификацией на бактериальный сообщество, способное расщеплять эти органические субстраты в водной среде.
С другой стороны, органические соединения также могут быть преобразованы путем микробной деградации и разложения [31], а скорость микробной активности обычно оценивается для оценки качества почвы [32]. Анализы ингибирования щелочной фосфатазы были предложены в качестве сигналов раннего предупреждения о токсичности из-за тяжелых металлов и фенолов в пресноводной среде [33]. Помимо АП, другие ферментативные активности (такие как лейцинаминопептидаза, сульфатаза, хитиназа) являются полезными зондами для оценки экологического ущерба из-за органических галогенов в отложениях, загрязненных промышленными сбросами [34].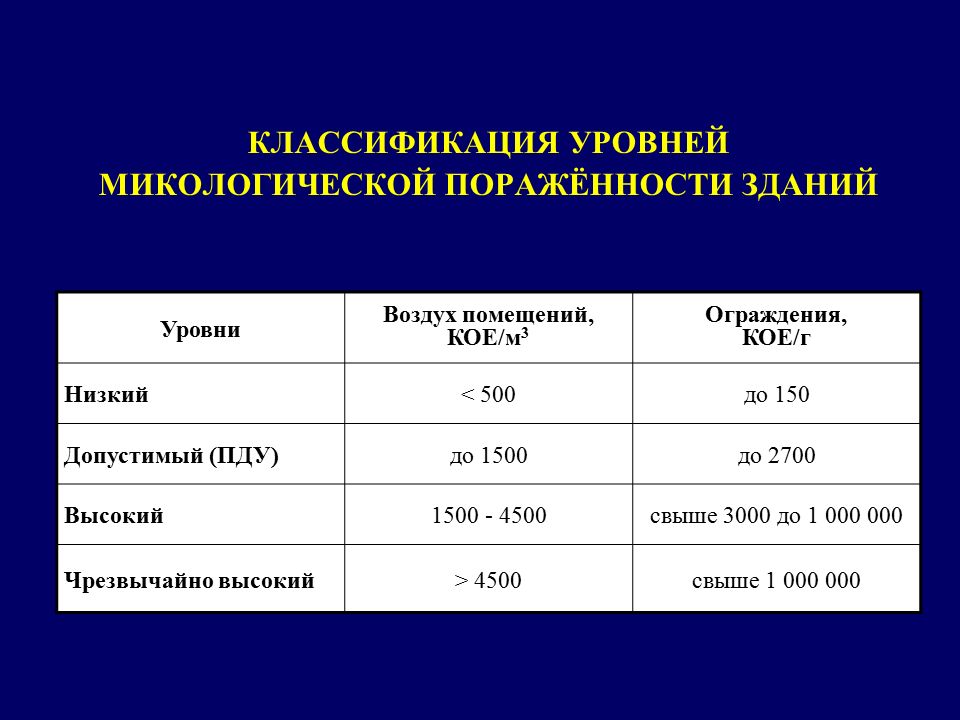 В прибрежных районах, сильно пострадавших от антропогенного воздействия, Misic et al. [35,36] сообщили о высокой степени ферментативной активности органических полимеров.
В прибрежных районах, сильно пострадавших от антропогенного воздействия, Misic et al. [35,36] сообщили о высокой степени ферментативной активности органических полимеров.
В заключение, помимо общих экологических показателей качества (макрофиты, диатомовые водоросли, макробентос и рыбы), также заслуживает изучения микробное сообщество в связи с его функциональной ролью. Приведенные выше примеры являются лишь некоторыми методологическими подходами, основанными на использовании микробов и связанных с ними молекул в качестве биоиндикаторов в мониторинге морской среды. И протоколы метода флуоресцентных антител, и анализы ферментативной активности представляют собой подходящие инструменты для оценки антропогенного давления на морские экосистемы; они могут быть предоставлены научному сообществу и местным администраторам или заинтересованным сторонам в качестве быстрых методов контроля состояния окружающей среды вместо обычных.
Ссылки
- Stewart JR, Gast RJ, Fujioka RS, Solo-Gabriele HM, Meschke JS, et al.
 (2008) Прибрежная среда и здоровье человека: микробные индикаторы, патогены, дозорные и резервуары. Здоровье окружающей среды 7: S3.
(2008) Прибрежная среда и здоровье человека: микробные индикаторы, патогены, дозорные и резервуары. Здоровье окружающей среды 7: S3. - Директива 2008/56/EC Европейского парламента и Совета от 17 июня 2008 г., устанавливающая основу для действий сообщества в области морской экологической политики (Рамочная директива о морской стратегии). В: Официальный журнал Европейского Союза L164: 19-40.
- Джулиано Л., Крисафи Э., Карузо Г. (2004) Monitoraggio dell»ambiente marino: utilizzo dei parametri microbiologici. Биол Мар Меди 11: 108-115.
- Карузо Г., Денаро Р., Дженовезе М., Джулиано Л., Манкузо М. и др. (2004) Новые методологические стратегии для обнаружения бактериальных индикаторов. Хим. экол. 20: 167-181.
- Zappalà G, Caruso G, Crisafi E (2004) Мониторинг загрязнения побережья с помощью автоматического мультисэмплера в сочетании с флуоресцентным анализом антител. В: Прибрежная среда V, Brebbia CA, Saval Perez JM, Garcia Andion L & Villacampa Y (ред.
 ). WIT Press, Саутгемптон (Великобритания): 125–133.
). WIT Press, Саутгемптон (Великобритания): 125–133. - Zappalà G, Caruso G, Azzaro F, Crisafi E (2006) Мониторинг морской среды в прибрежных водах Сицилии. В: Загрязнение воды VIII: Моделирование, мониторинг и управление, Brebbia CA (ред.) Болонья. WIT Press, Саутгемптон (Великобритания): 337–346.
- Закконе Р., Крисафи Э., Карузо Г. (1995) Оценка фекального загрязнения прибрежных вод Италии методом иммунофлуоресценции. Акват Микроб Экол 9: 79-85.
- Карузо Г., Закконе Р., Крисафи Э. (2000) Использование метода непрямой иммунофлуоресценции для обнаружения и подсчета кишечной палочки в пробах морской воды. Lett Appl Microbiol 31: 274-278.
- Caruso G, Crisafi E, Mancuso M (2002) Иммунофлуоресцентное обнаружение Escherichia coli в морской воде: сравнение различных коммерческих антисывороток. J Immunoassay Immunochem 23: 479-496.
- Caruso G, Mancuso M, Crisafi E (2003) Комбинированный анализ флуоресцентных антител и окрашивание жизнеспособности для оценки физиологического состояния Escherichia coli в морской воде.
 J Appl Microbiol 95: 225-233.
J Appl Microbiol 95: 225-233. - Caruso G, De Pasquale F, Mancuso M, Zampino D, Crisafi E (2006)Флуоресцентное окрашивание жизнеспособности антител и анализ бета-глюкуронидазы как быстрые методы мониторинга жизнеспособности Escherichia coli в прибрежных морских водах. J Immunoassay Immunochem 27: 1-13.
- Карузо Г., Карузо Р., Крисафи Э., Заппала Г. (2008) Достижения в области мониторинга бактериального загрязнения морской среды. В: Тенденции исследований в области микробиологии окружающей среды, Курладзе Г.В. (ред.) Глава 10. Nova Science Publishers Inc., Нью-Йорк, США, 273-287.
- Карузо Г., Монтичелли Л.С., Карузо Р., Бергамаско А. (2008) Разработка метода флуоресцентных антител для обнаружения Enterococcus faecium и его потенциала для мониторинга прибрежной водной среды. Мар Поллут Бык 56: 318-324.
- Могери Т.Л., Закконе Р., Карузо Г., Крисафи Э., Гульяндоло К. (1992) Examen de la qualité de l’eau de mer par иммунофлуоресценция. Rapp Comm Int Mer Médit 33: 199.

- Закконе Р., Карузо Г., Зампино Д., Манкузо М., Дженовезе Л. и др. (2004) Раннее обнаружение Vibrio anguillarum в водах: сложный опыт с Dicentrarchus labrax в микрокосме. Специальная публикация EAS 34: 849-850.
- Карузо Г., Заппала Г., Карузо Р., Крисафи Э. (2006) Оценка жизнеспособности Escherichia coli в прибрежных водах Сицилии с помощью методов флуоресцентных антител и активности ß-глюкуронидазы. В: Экологические проблемы в прибрежных регионах VI, Brebbia CA (ред.), Родос (Греция), WIT Press, Саутгемптон (Великобритания), 57-66.
- Заппала Г., Бонамано С., Мадония А., Карузо Г., Марселли М. (2012) Оценка микробиологического риска в прибрежной морской среде с использованием математических моделей. В: Загрязнение воды XI, Brebbia CA (ред.), WIT Press, Саутгемптон, 3-14.
- Заппала Г., Карузо Г., Бонамано С., Мадония А., Пьерматтеи В. и др. (2013) Комплексные морские измерения в районе Чивитавеккья (Рим). В: CMEM 2013, 16-я Международная конференция по вычислительным методам и экспериментальным измерениям, Carlomagno GM, Brebbia CA, Hernandez S (ред.
 ). WIT Press, Саутгемптон (Великобритания): 1746–4064.
). WIT Press, Саутгемптон (Великобритания): 1746–4064. - Hoppe H, Arnosti C, Herndl GF (2002) Экологическое значение бактериальных ферментов в морской среде. В: Ферменты в окружающей среде: активность, экология и применение, Бернс Р.Г. и Дик Р.П. (ред.). CRC, Бока-Ратон, Флорида: 73-107.
- Шодер Д-р Д.К. (2010 г.) Серия технических докладов Группы фактических данных о здоровых и биологически разнообразных морях: Оценка и анализ пробелов в существующих и потенциальных индикаторах для микробов. JNCC, Питерборо, 1-23.
- Карузо Г., Леонарди М., Монтичелли Л.С., Децембрини Ф., Аззаро Ф. и др. (2010) Оценка экологического состояния переходных вод Сицилии (Италия): первая характеристика и классификация в соответствии с многопараметрическим подходом. Мар Поллут Бык 60: 1682-1690.
- Маццола А., Бергамаско А., Кальво С., Карузо Г., Чемелло Р. и др. (2010) Сицилийские переходные воды: текущее состояние и будущее развитие. Хим. экол. 26: 267-283.
- Дик Р.
 П., Брейкуэлл Д.П., Турко Р.Ф. (1996) Активность почвенных ферментов и измерения биоразнообразия как интегральные микробиологические индикаторы. В: Методы оценки качества почвы, Доран Дж. В., Джонс А. Дж. (ред.). Американское общество почвоведов, Мэдисон, Висконсин, 247–271.
П., Брейкуэлл Д.П., Турко Р.Ф. (1996) Активность почвенных ферментов и измерения биоразнообразия как интегральные микробиологические индикаторы. В: Методы оценки качества почвы, Доран Дж. В., Джонс А. Дж. (ред.). Американское общество почвоведов, Мэдисон, Висконсин, 247–271. - Карузо Г., Децембрини Ф., Карузо Р., Заппала Г., Бергамаско А. и др. (2011) Являются ли активности микробных ферментов чувствительными индикаторами трофического состояния морских экосистем? В: Мониторинг загрязнения, Ортис А.С. и Гриффин Н.Б. (ред.), глава 10. Издательство NOVA, Hauppauge, NY. США: 195-210.
- Kiersztyn B, Siuda W, Chrost RJ (2002) Микробная эктоферментная активность: полезные параметры для характеристики трофических условий озер. Польский J Environ Stud 11: 367-373.
- Chrost RJ, Siuda W (2006) Микробное производство, утилизация и ферментативное разложение органического вещества в верхнем трофогенном слое в пелагиальной зоне озер вдоль градиента эвтрофикации. Лимнол Океаногр 51: 749-762.

- Карузо Г., Заппала Г. (2010) Микробные параметры как индикаторы воздействия марикультуры на морскую среду. В: Загрязнение воды X, Маринов А.М. и Бреббиа К.А. (ред.). WIT Press, Саутгемптон (Великобритания): 219-230.
- Бахо Д.Л., Питер Х., Транвик Л.Дж. (2012) Устойчивость и устойчивость микробных сообществ — временная и пространственная защита от возмущений. Environ Microbiol 14: 2283-2292.
- Капелло С., Карузо Г., Зампино Д., Монтичелли Л.С., Маймоне Г. и др. (2007) Динамика микробного сообщества во время анализа биоремедиации разливов нефти в гавани: исследование моделирования на микроуровне. J Appl Microbiol 102: 184-194.
- Ziervogel K, McKay L, Rhodes B, Osburn CL, Dickson-Brown J, et al. (2012) Микробная активность и динамика растворенного органического вещества в загрязненных нефтью поверхностных морских водах с места разлива нефти Deepwater Horizon. PLoS One 7: e34816.
- Доелман П. (1995) Микробиология почвы и отложений. В: Биогеодинамика загрязнителей в почвах и отложениях, Salomons S, Stigliani WM (ред.
 ). Спрингер, Берлин, Германия: 31-52.
). Спрингер, Берлин, Германия: 31-52. - Trasar-Cepeda C, Leiròs MC, Gil-Sotres F (2008) Активность гидролитических ферментов в сельскохозяйственных и лесных почвах. Некоторые последствия их использования в качестве индикаторов качества почвы. Soil Biol Biochem 40: 2146-2155.
- Durrieu C, Badreddine I, Daix C (2003) Система диализа с фитопланктоном для мониторинга химического загрязнения в пресноводных экосистемах с помощью анализа щелочной фосфатазы. J Appl Phycol 15: 289-295.
- Виттманн С., Суоминен К.П., Салкиноя-Салонен М.С. (2000) Оценка экологических нарушений и собственного биоремедиационного потенциала озерных отложений, загрязненных целлюлозным заводом, с использованием ключевых ферментов в качестве зондов. Загрязнение окружающей среды 107: 255-261.
- Misic C, Covazzi Harriague A (2009) Характеристика и оборот органических веществ в отложениях и морской воде туристической гавани. Mar Environ Res 68: 227-235.
- Misic C, Castellano M, Covazzi Harriague A (2011) Особенности органического вещества, деградация и реминерализация на двух прибрежных участках в Лигурийском море (северо-запад Средиземного моря), на которые по-разному повлияло антропогенное воздействие.

 Электронный адрес:
Электронный адрес: 
 Электронная книга 2009 г.20 фев.
Environ Sci Pollut Res Int. 2009.
PMID: 19229579
Электронная книга 2009 г.20 фев.
Environ Sci Pollut Res Int. 2009.
PMID: 19229579 doi: 10.1016/j.scitotenv.2021.152012. Epub 2021 29 ноября.
Научная общая среда. 2022.
PMID: 34856284
Рассмотрение.
doi: 10.1016/j.scitotenv.2021.152012. Epub 2021 29 ноября.
Научная общая среда. 2022.
PMID: 34856284
Рассмотрение. , Рейндерс Дж., Ван Дорн Л., Йориссен С., Де Боргер С.М., Луттихуис Д.О., де Дейн Л., Ковачи А., Бервоетс Л.
Гроффен Т. и др.
Окружающая среда Рез. 2021 Январь; 192:110299. doi: 10.1016/j.envres.2020.110299. Epub 2020 13 октября.
Окружающая среда Рез. 2021.
PMID: 33058811
, Рейндерс Дж., Ван Дорн Л., Йориссен С., Де Боргер С.М., Луттихуис Д.О., де Дейн Л., Ковачи А., Бервоетс Л.
Гроффен Т. и др.
Окружающая среда Рез. 2021 Январь; 192:110299. doi: 10.1016/j.envres.2020.110299. Epub 2020 13 октября.
Окружающая среда Рез. 2021.
PMID: 33058811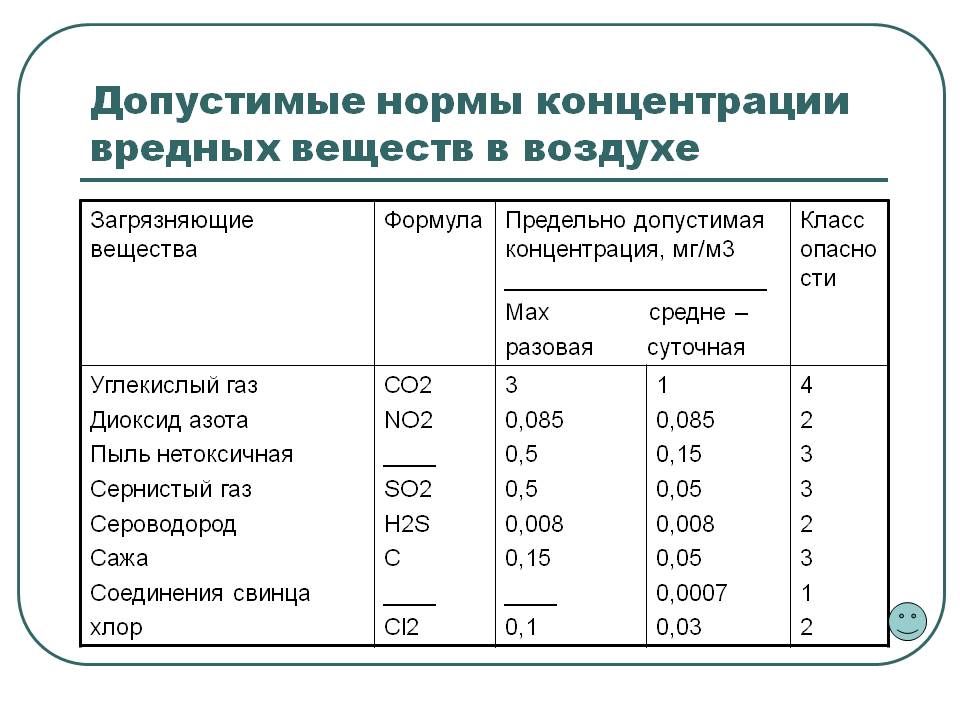
 (2008) Прибрежная среда и здоровье человека: микробные индикаторы, патогены, дозорные и резервуары. Здоровье окружающей среды 7: S3.
(2008) Прибрежная среда и здоровье человека: микробные индикаторы, патогены, дозорные и резервуары. Здоровье окружающей среды 7: S3. ). WIT Press, Саутгемптон (Великобритания): 125–133.
). WIT Press, Саутгемптон (Великобритания): 125–133. J Appl Microbiol 95: 225-233.
J Appl Microbiol 95: 225-233.
 ). WIT Press, Саутгемптон (Великобритания): 1746–4064.
). WIT Press, Саутгемптон (Великобритания): 1746–4064.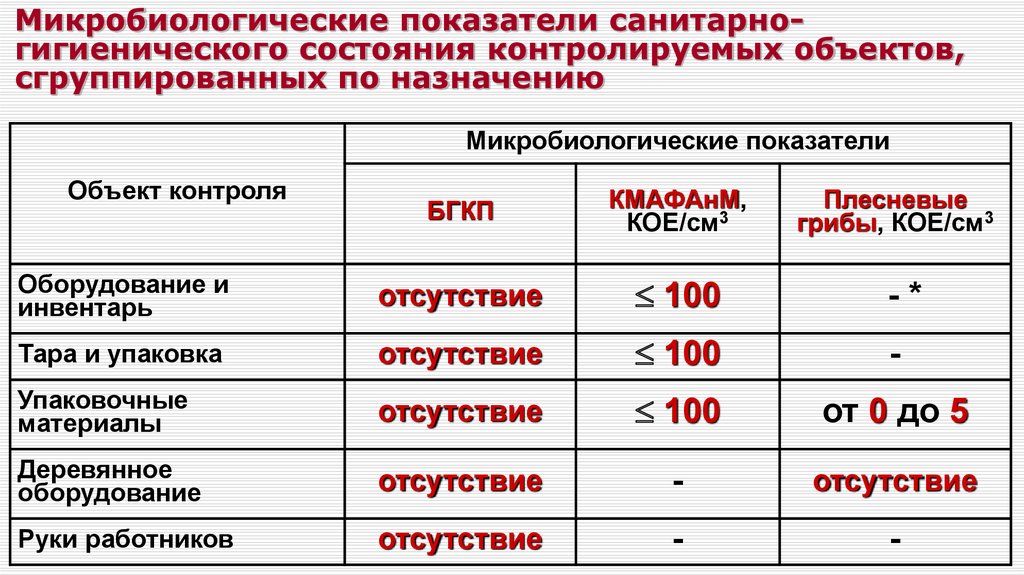 П., Брейкуэлл Д.П., Турко Р.Ф. (1996) Активность почвенных ферментов и измерения биоразнообразия как интегральные микробиологические индикаторы. В: Методы оценки качества почвы, Доран Дж. В., Джонс А. Дж. (ред.). Американское общество почвоведов, Мэдисон, Висконсин, 247–271.
П., Брейкуэлл Д.П., Турко Р.Ф. (1996) Активность почвенных ферментов и измерения биоразнообразия как интегральные микробиологические индикаторы. В: Методы оценки качества почвы, Доран Дж. В., Джонс А. Дж. (ред.). Американское общество почвоведов, Мэдисон, Висконсин, 247–271.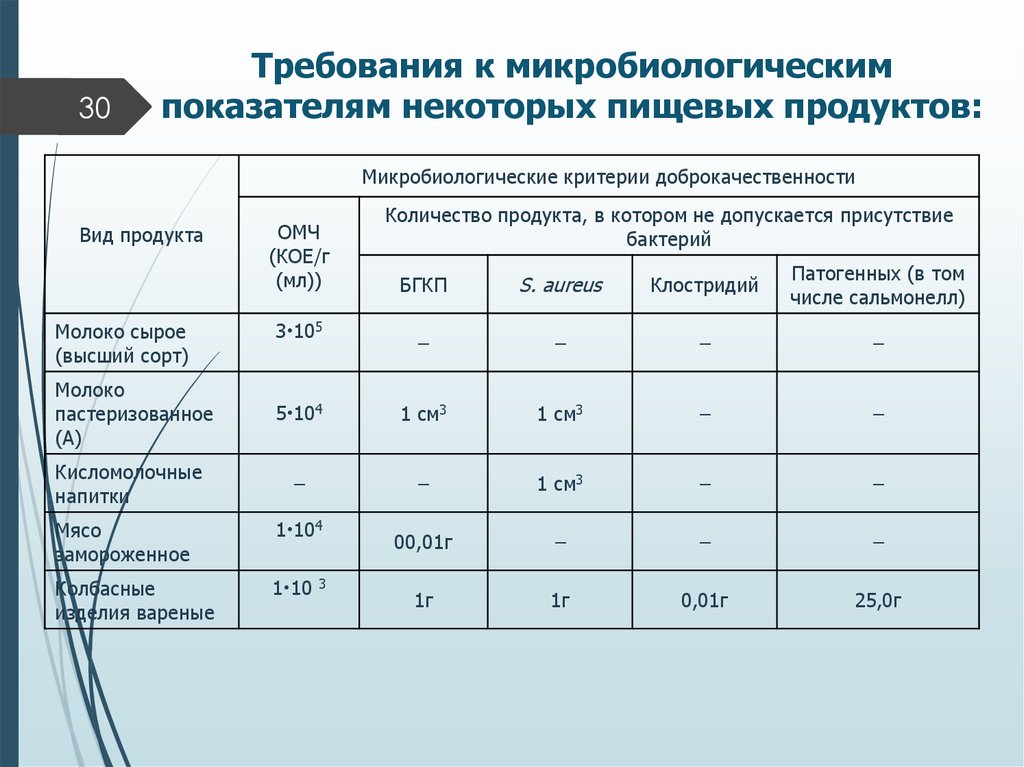
 ). Спрингер, Берлин, Германия: 31-52.
). Спрингер, Берлин, Германия: 31-52.