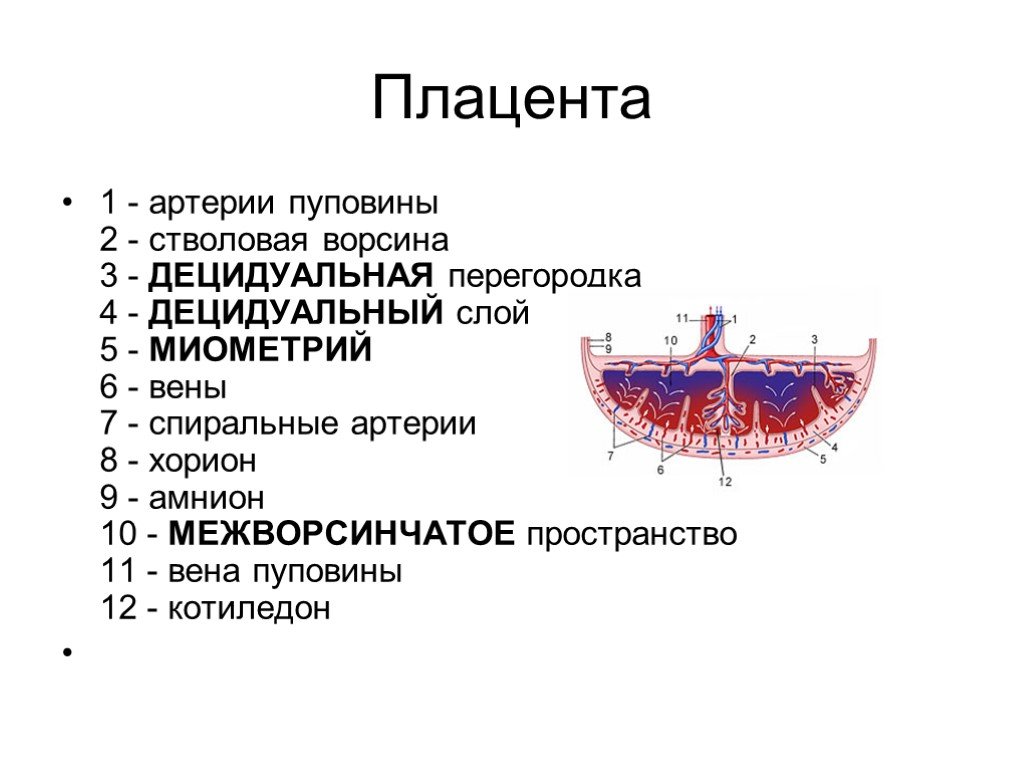
109. Плацента и ее функции. Значение узи в диагностики патологии плаценты.
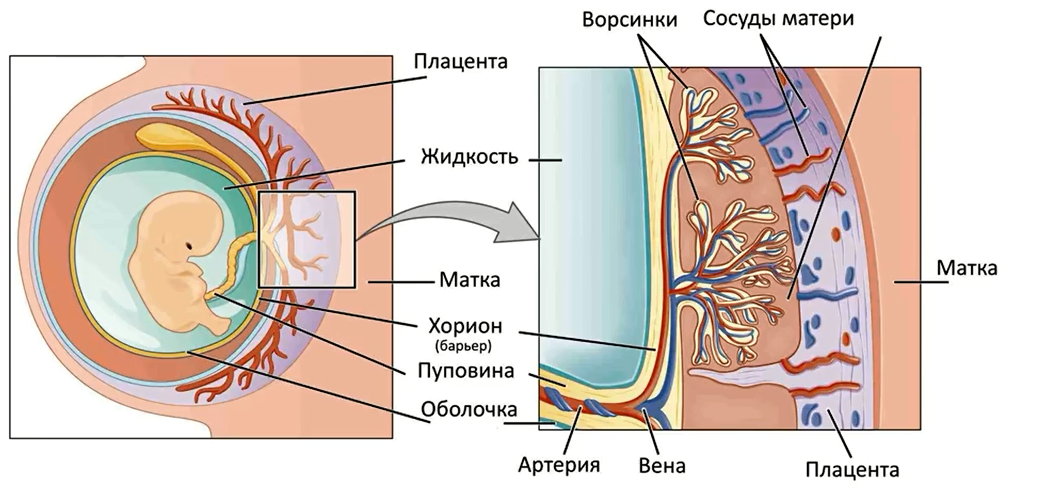
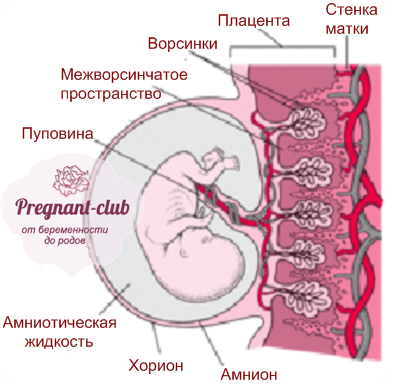
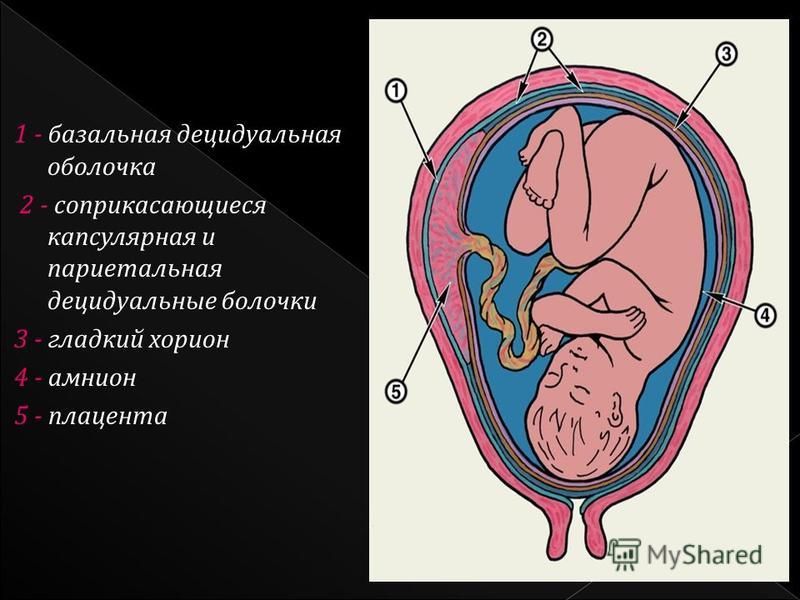
Плацента (placenta — детское место). Плацента является чрезвычайно важным органом, объединяющим функциональные системы матери и плода. По внешнему виду плацента похожа на круглый плоский диск. К началу родов масса плаценты составляет 500—600 г, диаметр — 15—18 см, толщина — 2—3 см. В плаценте различают две поверхности: материнскую, прилегающую к стенке матки, и плодовую, обращенную в полость амниона.
Основной
структурно-функциональной единицей
плаценты считают котиледон (плацентой)
— дольку плаценты, образованную стволовой
ворсиной I
порядка с отходящими от нее ветвями
— ворсинами II
и III
порядка (рис. 18). Таких долек в плаценте
насчитывается от 40 до 70. В каждом
котиледоне часть ворсин, называемых
якорными, прикрепляется к децидуальной
оболочке; большинство — свободно
плавает в материнской крови, циркулирующей
в межворсинчатом пространстве.
В межворсинчатом пространстве различают 3 отдела: артериальный (в центральной части котиледона), капиллярный (при основании котиледона), венозный (соответствует субхориальному и междолевому пространствам).
Из спиральных
артерий матки кровь под большим давлением
впадает в центральную часть котиледона,
проникая через капиллярную сеть в
субхориальный и междолевой отделы,
откуда поступает в вены, расположенные
у основания котиледона и по периферии
плаценты. Материнский и плодовый кровоток
не сообщаются друг с другом. Их разделяет
плацентарный барьер. Плацентарный
барьер состоит из следующих компонентов
ворсин: трофобласт, базальная мембрана
трофобласта, строма, базальная мембрана
эндотелия плодовых капилляров, эндотелий
капилляров. На субклеточном уровне в
плацентарном барьере выделяют 7 слоев
различной электронной плотности. В
терминальных ворсинах через
плацентарный барьер осуществляется
обмен между кровью матери и плода.
Наиболее благоприятные условия
для обмена создаются во вторую половину
беременности, когда капилляры
перемещаются к периферии ворсин и тесно
прилегают к синцитию с образованием
синцитиокапиллярных мембран, в области
которых непосредственно происходит
транспорт и газообмен.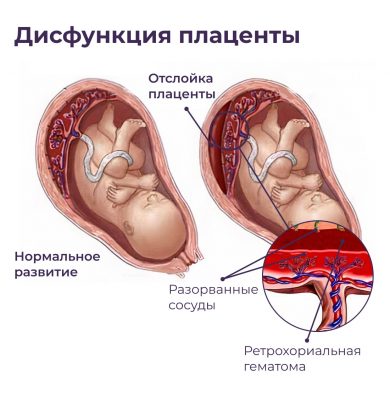
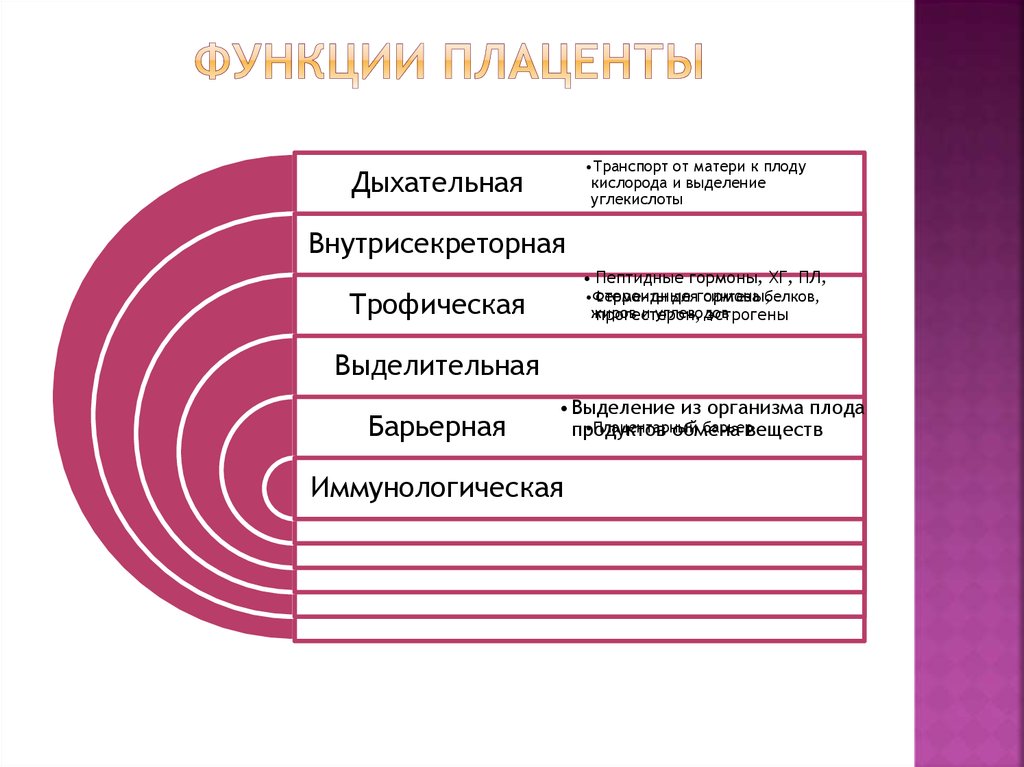
Функции плаценты сложны и многообразны.
Дыхательная функция заключается в доставке кислорода от матери к плоду и в удалении углекислого газа в обратном направлении. Газообмен осуществляется по законам простой диффузии.
Питание плода и выведение продуктов обмена осуществляется за счет более сложных процессов.
Синцитиотрофобласт
плаценты продуцирует специфические
протеины и гликопротеиды, обладает
способностью дезаминировать и
переаминировать аминокислоты,
синтезировать их из предшественников
и активно транспортировать к плоду.
Среди липидов плаценты 1/3 составляют
стероиды, 2/3 — фосфолипиды, наибольшую
часть — нейтральные жиры. Фосфолипиды
участвуют в синтезе белков, транспорте
электролитов, аминокислот, способствуют
проницаемости клеточных мембран
плаценты. Обеспечивая плод продуктами
углеводного обмена, плацента выполняет
гликогенообразовательную функцию до
начала активного функционирования
печени плода (IV
месяц).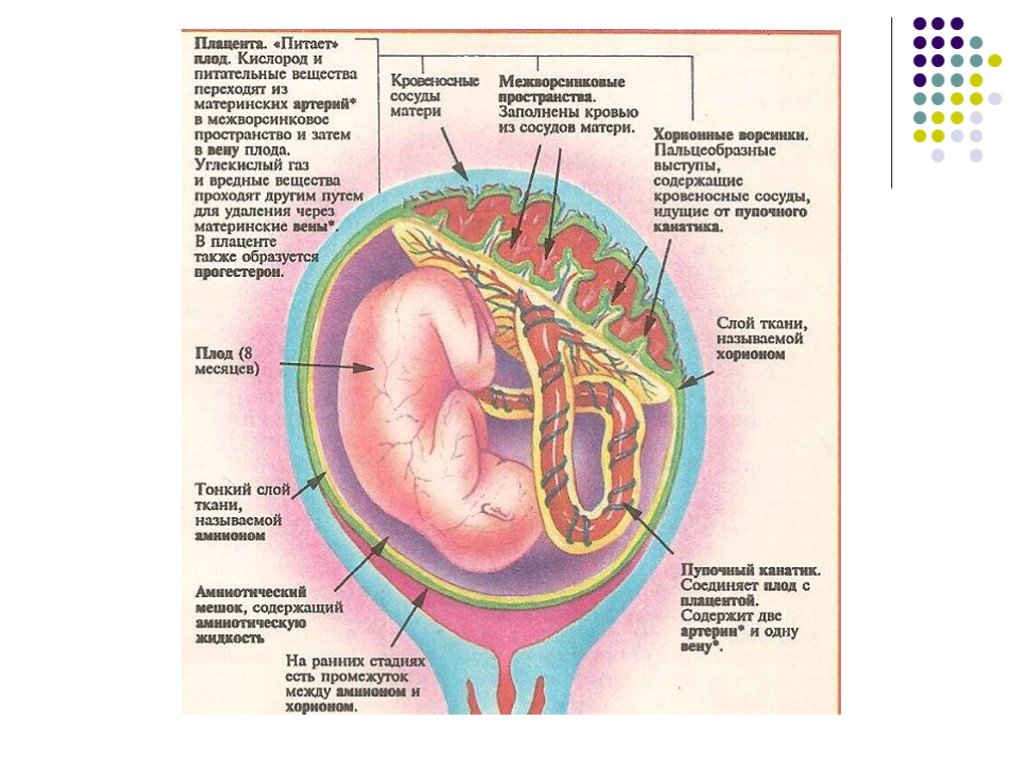
Токоферол и витамин К через плаценту не проходят. К плоду проникают только их синтетические препараты.
Плацента обладает транспортной, депонирующей и выделительной функциями в отношении многих электролитов, в том числе важнейших микроэлементов (железо, медь, марганец, кобальт и др.). В транспорте питательных веществ к плоду и выведении продуктов обмена плода участвуют ферменты плаценты.
Выполняя гормональную
функцию, плацента
вместе с плодом образует единую
эндокринную систему (фетоплацентарная
система). В плаценте осуществляются
процессы синтеза, секреции и превращения
гормонов белковой и стероидной
природы. Продукция гормонов происходит
в синцитии трофобласта, децидуальной
ткани. Среди гормонов белковой природы
в развитии беременности важное
значение имеет плацентарный лактоген
(ПЛ), который синтезируется только в
плаценте, поступает в кровь матери,
поддерживает функцию плаценты.
Хорионический гонадотропин (ХГ)
синтезируется плацентой, поступает в
кровь матери, участвует в механизмах
дифференцировки пола плода. Определенную
роль в образовании сурфактанта легких
играет пролактин, синтезируемый плацентой
и децидуальной тканью.
Продукция гормонов происходит
в синцитии трофобласта, децидуальной
ткани. Среди гормонов белковой природы
в развитии беременности важное
значение имеет плацентарный лактоген
(ПЛ), который синтезируется только в
плаценте, поступает в кровь матери,
поддерживает функцию плаценты.
Хорионический гонадотропин (ХГ)
синтезируется плацентой, поступает в
кровь матери, участвует в механизмах
дифференцировки пола плода. Определенную
роль в образовании сурфактанта легких
играет пролактин, синтезируемый плацентой
и децидуальной тканью.
Из холестерина, содержащегося в крови матери, в плаценте образуются прегненолон и прогестерон. К стероидным гормонам плаценты относятся также эстрогены (эстрадиол, эстрон, эстриол). Эстрогены плаценты вызывают гиперплазию и гипертрофию эндометрия и миометрия.
Кроме указанных
гормонов, плацента способна продуцировать
тестостерон, кортикостероиды, тироксин,
трийодтиронин, паратиреоидный гормон,
кальцитонин, серотонин, релаксин,
окситоциназу и др.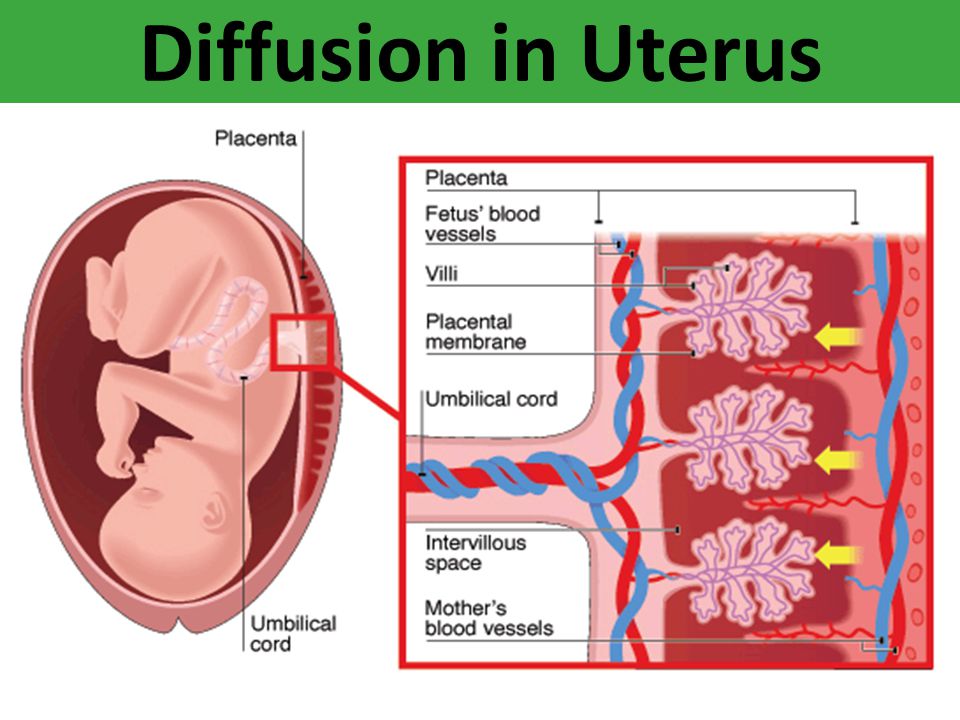
Обладая системами синтеза гуморальных факторов, тормозящих иммунoкомпетентные клетки матери, плацента является компонентом системы иммунобиологигеской защиты плода. Плацента как иммунный барьер разделяет два генетически чужеродных организма (мать и плод), предотвращая тем самым возникновение между ними иммунного конфликта. Определенную регулирующую роль при этом играют тучные клетки стромы ворсин хориона. Плацентарный барьер обладает избирательной проницаемостью для иммунных факторов. Через него легко проходят цитотоксические антитела к антигенам гистосовместимости и антитела класса 1gС.
Плацента обладает способностью защищать организм плода от неблагоприятного воздействия вредных факторов, попавших в организм матери (токсические вещества, некоторые лекарственные средства, микроорганизмы и др.). Однако барьерная функция плаценты избирательна, и для некоторых повреждающих веществ она оказывается недостаточной.
Механизмы и факторы, влияющие на трансплацентарную передачу антител класса IgG в системе мать-плацента-плод
В первые месяцы жизни ребенка, пока его собственная иммунная система недостаточно развита, гуморальный иммунитет осуществляется за счет материнских антител, пассивно передавшихся во время беременности.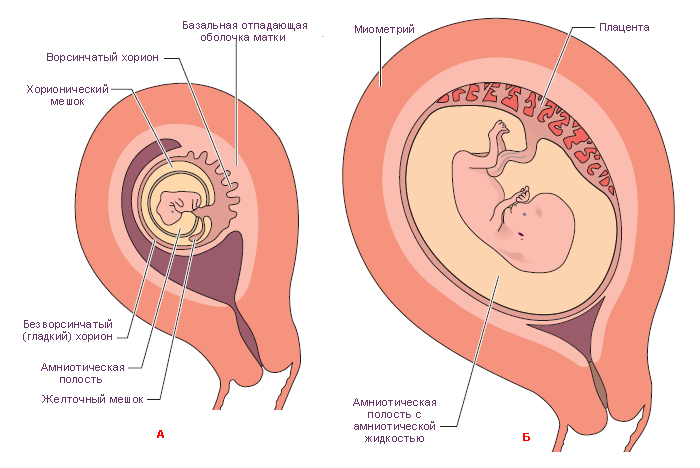
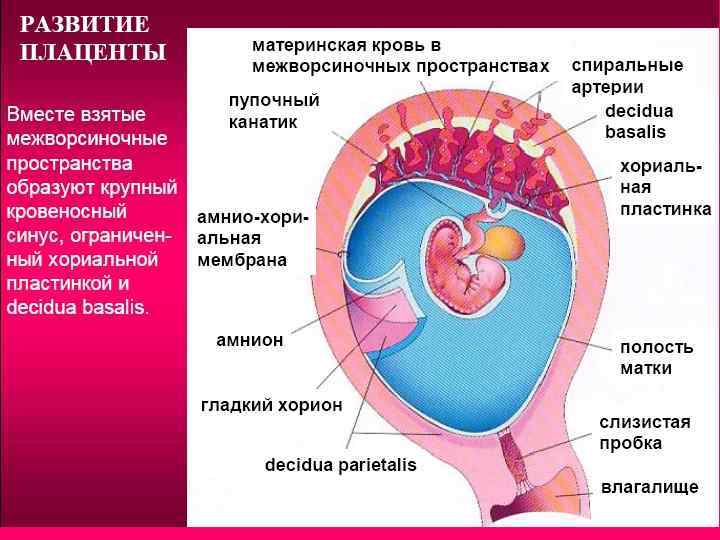
Плацента человека имеет гемомонохориальный виллезно-лабиринтный тип строения, что обеспечивает взаимодействие между кровью плода в капиллярах ворсин и кровью матери в межворсинчатом пространстве. Плацента состоит из хориальной и базальной пластин с расположенными между ними ворсинами хориона и представляет собой 15-40 однотипно устроенных долек — котиледонов. Функциональная специализация плаценты обеспечивается структурным многообразием хориального эпителия, который включает три вида тканей: СТБ, клеточный и экстравиллезный трофобласт [1, 5].
Известно, что динамика развития ворсинчатого хориона отражает состояние плаценты в разные сроки беременности. В начале III триместра стволовые ворсины дифференцируются в зрелые, промежуточные и терминальные. Последние составляют 45-50% всех ворсин и являются результатом конечного ветвления виллезного дерева. По мере формирования терминальных ворсин капилляры приближаются к базальной мембране, исчезает слой трофобласта и уменьшается толщина синцития. Все капилляры терминальных ворсин превращаются в широкие синусоиды, которые концентрируются под тонкими безъядерными участками СТБ, в результате образуются истинные синцитиокапиллярные мембраны. Все эти изменения приводят к истончению плацентарного барьера по мере увеличения срока беременности, а значит и к упрощению прохождения веществ через плаценту [1, 22].
Несмотря на то что плацентарный барьер отделяет кровь матери от кровообращения плода, это не простой физический барьер. Широкий спектр веществ, в том числе питательных, эффективно передается активно или пассивно через плаценту, что необходимо для нормального роста и развития плода.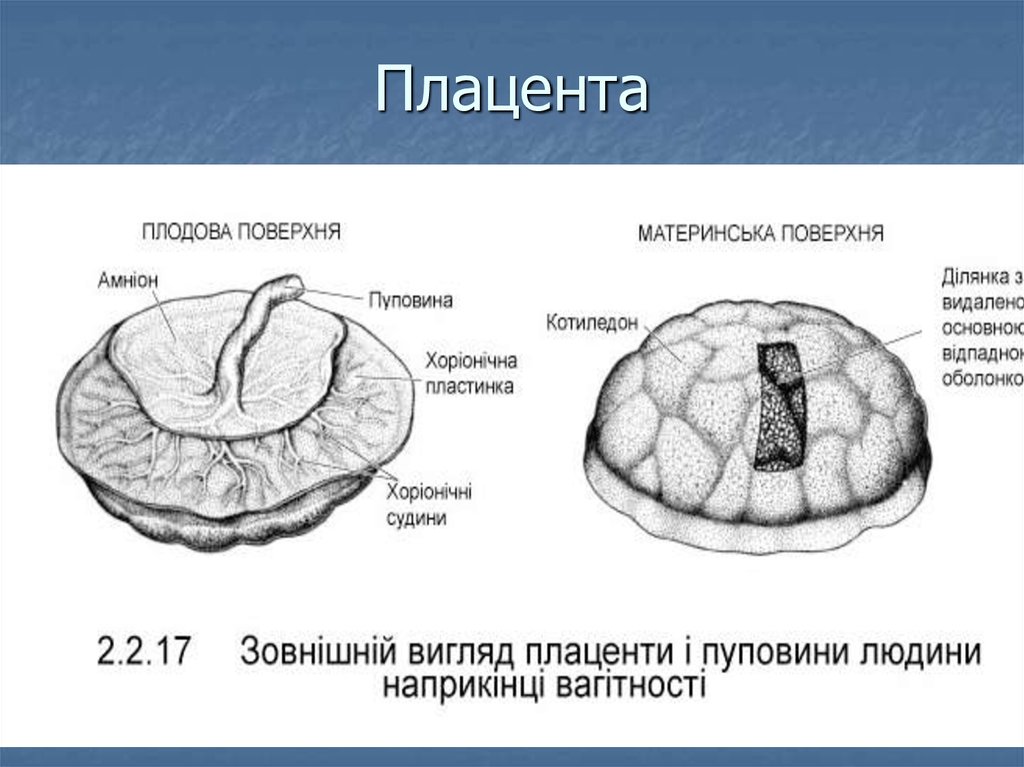 Большинство низкомолекулярных соединений (<500 Да) просто диффундируют через плацентарные ткани. Вещества с очень высокой молекулярной массой обычно не проходят через плацентарный барьер, но есть несколько исключений, например IgG, имеющий молекулярную массу около 160 кДа. Среди 5 классов антител только значительное количество IgG передается через плаценту [38]. На основании наблюдений, что Fc-фрагменты молекулы IgG проходят в кровь плода легче, чем Fab-фрагменты, было сделано предположение, что Fc-рецептор IgG (FcgRs), расположенный на плацентарных клетках, может участвовать в передаче IgG через плаценту. Позже было установлено, что данный транспорт IgG проводится неонатальным рецептором Fc (FcRn) [15, 32].
Большинство низкомолекулярных соединений (<500 Да) просто диффундируют через плацентарные ткани. Вещества с очень высокой молекулярной массой обычно не проходят через плацентарный барьер, но есть несколько исключений, например IgG, имеющий молекулярную массу около 160 кДа. Среди 5 классов антител только значительное количество IgG передается через плаценту [38]. На основании наблюдений, что Fc-фрагменты молекулы IgG проходят в кровь плода легче, чем Fab-фрагменты, было сделано предположение, что Fc-рецептор IgG (FcgRs), расположенный на плацентарных клетках, может участвовать в передаче IgG через плаценту. Позже было установлено, что данный транспорт IgG проводится неонатальным рецептором Fc (FcRn) [15, 32].
На клетках тканей плаценты расположены различные типы Fc-рецепторов, в том числе FcγRI, FcγRII, FcγRIII [39]. Однако функциональная роль в трансплацентарной передаче IgG от матери к плоду была продемонстрирована только для рецептора FcRn [22]. Иммуногистохимический анализ показал экспрессию рецептора FcRn на клетках СТБ и эндотелиальных клетках [39], но остается по-прежнему спорным вопрос о функционировании FcRn на клетках эндотелия сосудов плаценты, так как есть доказательства возможного действия альтернативных Fc-рецепторов [21, 22, 28, 29, 40, 46].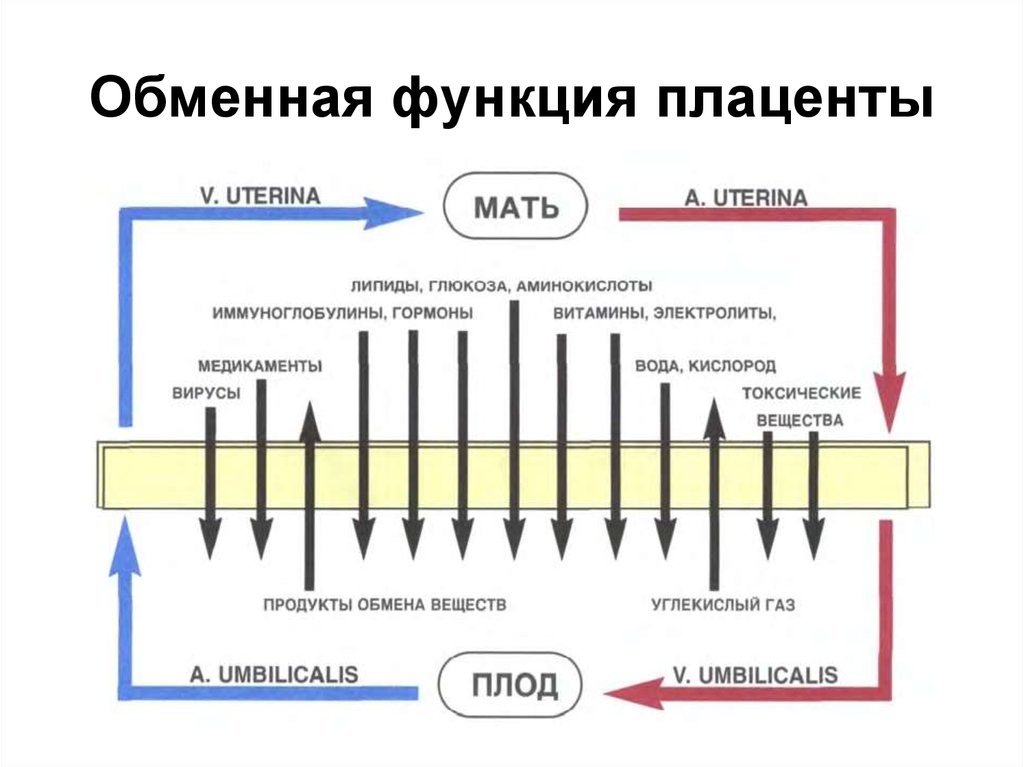
FcRn — это гетеродимерный рецептор, состоящий из тяжелой α-цепи гликопротеина, с молекулярной массой 40-45 кДа [49, 50]. Рецептор узнает участок, соединяющий Ch3 и Ch4 домены IgG, что отличает его от классического FcgRs и компонента системы комплемента C1q и сближает с бактериальными белками A и G, которые связываются с тем же участком. В отличие от других Fc γ-рецепторов, неонатальный Fc-рецептор обладает характерной pH-зависимостью, связывая IgG при низких значениях pH порядка 6,0 и демонстрируя в 100 раз более низкое сродство при физиологическом значении pH (7,4) [22, 32]. Таким образом, FcRn не способен связать IgG на апикальной поверхности СТБ, контактирующей с материнской кровью. Предполагается, что антитела IgG, присутствующие в высокой концентрации в крови матери (10-20 мг/мл), поглощаются на поверхности СТБ путем пиноцитоза, а затем связываются с FcRn в кислой среде эндосом [30]. Связанные антитела IgG транспортируются к базолатеральной поверхности, где высвобождаются при контакте с кровью плода, которая имеет более высокий pH.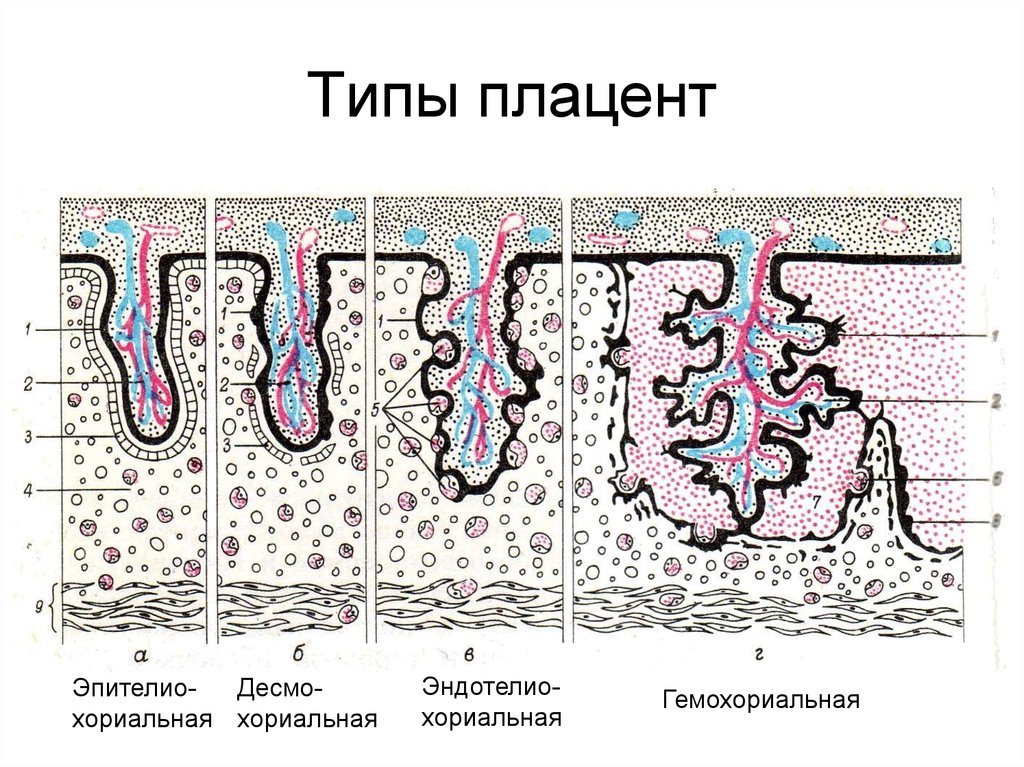
Таким образом, новорожденный приобретает антитела, аналогичные материнским, в результате чего происходит распознавание идентичных антигенов организмом женщины и ее потомства.
Существуют доказательства того, что передача антител IgG зависит от следующих факторов: 1) материнского уровня общих и специфических антител IgG; 2) гестационного возраста новорожденного; 4) подклассов IgG; 5) природы антигена; 3) патологии плаценты [32].
Большинство антител новорожденного являются материнскими по происхождению, поэтому их концентрация в пуповинной крови напрямую отражает трансплацентарный транспорт [43]. На момент рождения ребенка уровни антител IgG в его крови обычно соответствуют уровню материнских или несколько превышают их. Однако J. Michaux и соавт. [цит. по 32] показали, что при высоком (15 г/л) содержании общего IgG в крови матери, неонатальное значение оказывается ниже. Это согласуется и с другими работами, в том числе проведенными в Африке, представившими аналогичную закономерность, как для общего, так и для специфических антител IgG на примере вирусов гриппа, кори, лептоспироза, вируса простого герпеса (ВПГ-1), столбняка и других антигенов. Предположительно такая картина может наблюдаться из-за насыщенности неонатальных FcRn-рецепторов антителами. Количество антител IgG, передаваемых трансплацентарно от матери к плоду, зависит от количества рецепторов на поверхности клеток, так как не связанные с рецепторами молекулы IgG перевариваются под действием ферментов внутри эндосом [44].
На момент рождения ребенка уровни антител IgG в его крови обычно соответствуют уровню материнских или несколько превышают их. Однако J. Michaux и соавт. [цит. по 32] показали, что при высоком (15 г/л) содержании общего IgG в крови матери, неонатальное значение оказывается ниже. Это согласуется и с другими работами, в том числе проведенными в Африке, представившими аналогичную закономерность, как для общего, так и для специфических антител IgG на примере вирусов гриппа, кори, лептоспироза, вируса простого герпеса (ВПГ-1), столбняка и других антигенов. Предположительно такая картина может наблюдаться из-за насыщенности неонатальных FcRn-рецепторов антителами. Количество антител IgG, передаваемых трансплацентарно от матери к плоду, зависит от количества рецепторов на поверхности клеток, так как не связанные с рецепторами молекулы IgG перевариваются под действием ферментов внутри эндосом [44].
Передача антител IgG от матери к плоду начинается уже с 13-й недели беременности и происходит в линейном порядке по мере ее развития с наибольшим пиком в III триместре. В своей работе A. Malek и соавт. [цит. по 32] показали, что между 17-й и 41-й неделями беременности наблюдается непрерывное повышение уровня антител IgG в крови плода. При этом на 17-22-й неделе концентрация IgG составляет только 5-10% от материнского уровня и достигает 50% в сроке 28-32 нед. Большинство антител IgG плод приобретает в течение последних 4 нед беременности [32, 39]. Следует отметить, что примерно в это же время (после 36-й недели гестации) происходит резкое увеличение объема пуповинной крови, а также истончение плацентарного барьера, достигающего 1-2 мкм на 40-й неделе беременности [5] и состоящего на некоторых участках только из СТБ и эндотелиальных клеток, в связи с чем облегчается трансплацентарная передача веществ между матерью и плодом [22].
В своей работе A. Malek и соавт. [цит. по 32] показали, что между 17-й и 41-й неделями беременности наблюдается непрерывное повышение уровня антител IgG в крови плода. При этом на 17-22-й неделе концентрация IgG составляет только 5-10% от материнского уровня и достигает 50% в сроке 28-32 нед. Большинство антител IgG плод приобретает в течение последних 4 нед беременности [32, 39]. Следует отметить, что примерно в это же время (после 36-й недели гестации) происходит резкое увеличение объема пуповинной крови, а также истончение плацентарного барьера, достигающего 1-2 мкм на 40-й неделе беременности [5] и состоящего на некоторых участках только из СТБ и эндотелиальных клеток, в связи с чем облегчается трансплацентарная передача веществ между матерью и плодом [22].
Исследователи van den Berg и соавт. [48] обнаружили более низкую трансплацентарную передачу антител IgG против дифтерии, столбняка, коклюша, гемофильной инфекции типа b (Hib), N. meningitidis у недоношенных детей (<32 нед), по сравнению с доношенными (>37 нед).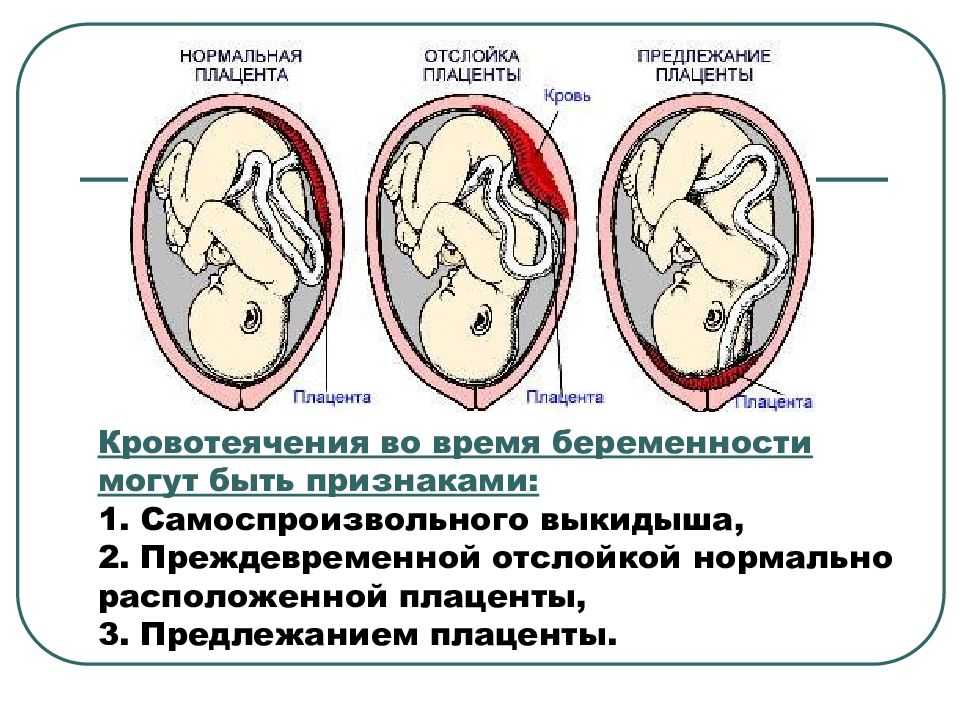
В свою очередь A. Silveira Lessa и соавт. [43] провели собственное исследование, оценив трансплацентарную передачу антител против Klebsiella, Pseudomonas, и E. coli и получив аналогичную закономерность. Из этого был сделан вывод, что концентрация антител IgG в крови у новорожденных непосредственно связана с гестационным возрастом и у недоношенных детей, рожденных менее чем в 33 нед беременности, имеет более низкий уровень по сравнению с доношенными. Так как экспрессия рецептора FcRn зависит от срока беременности и имеет более высокий показатель в III триместре, при рождении ребенка в более раннем сроке гестации наблюдается сокращение передачи трансплацентарных антител. Таким образом, недоношенные дети менее защищены от инфекций, чем дети, рожденные в срок [47].
В ряде исследований было показано, что различные подклассы антител IgG по-разному передаются через плаценту. Наиболее эффективно происходит транспорт антител подкласса IgG1, затем IgG4, IgG3 наименее активно IgG2, для которых FcRn-рецепторы имеют самое низкое сродство [22, 23, 31]. Отчасти поэтому передача антител против вирусных белков подкласса IgG1 происходит с большей готовностью, чем против инкапсулированных бактерий (пневмококк, гемофильная палочка и др.), в которых преобладают антитела подкласса IgG2 [22, 48].
Отчасти поэтому передача антител против вирусных белков подкласса IgG1 происходит с большей готовностью, чем против инкапсулированных бактерий (пневмококк, гемофильная палочка и др.), в которых преобладают антитела подкласса IgG2 [22, 48].
Трансплацентарная передача антител IgG к тимусзависимым антигенам (белки, столбнячный анатоксин) выше, чем к тимуснезависимым (полисахариды, липополисахариды стенок бактерий), на что в своей работе указывает C. Siegrist [42].
Доказано, что трансплацентарная передача антител IgG во время беременности может быть изменена в связи с наличием у матери некоторых инфекционных заболеваний и патологических состояний [32]. При возникновении или обострении инфекционного процесса в период беременности послед играет роль центрального звена, выполняя весьма сложные и многообразные функции барьерного органа и являясь своеобразным экстракорпоральным органом иммунитета плода. Число случаев воспалительных изменений в последе при инфекционных заболеваниях, по данным разных авторов [6], колеблется от 11 до 78,4%.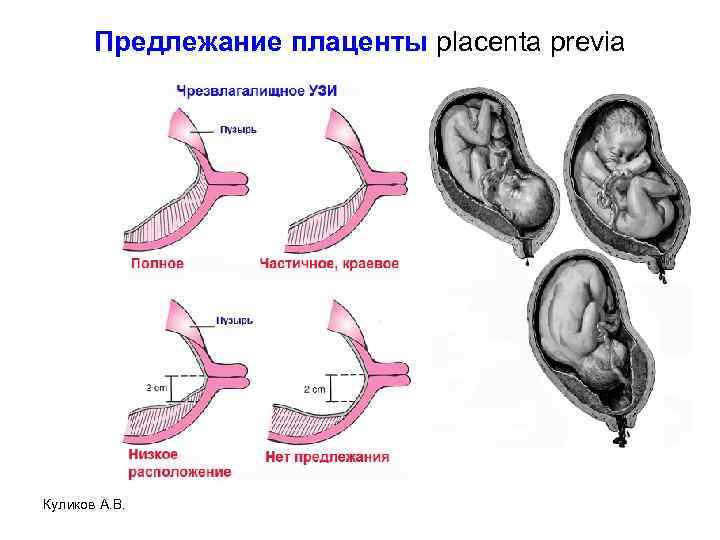
Существуют единичные исследования, свидетельствующие о влиянии патологии плаценты на передачу антител IgG. В частности, при поражении плаценты малярийными плазмодиями, вирусом иммунодефицита человека отмечается снижение транспорта антител IgG от матери к плоду [3, 18, 24, 38]. Наличие у женщины во время беременности экстрагенитальной патологии (гипертоническая болезнь, сахарный диабет, заболевания почек и др.) и акушерской патологии (угроза прерывания, преэклампсия, эклампсия и др.) может привести к рождению недоношенного ребенка с более низкими титрами защитных антител IgG [32]. Однако следует отметить, что перечисленные патологические состояния являются не только факторами прогноза преждевременных родов, но и возможной причиной формирования плацентарной недостаточности (ПН) как одного из наиболее распространенных осложнений беременности [2].
Распространенность патологии плаценты, включая ее недостаточность, не имеет тенденции к снижению; эта патология составляет от 20 до 60% в структуре причин перинатальной заболеваемости и смертности [8].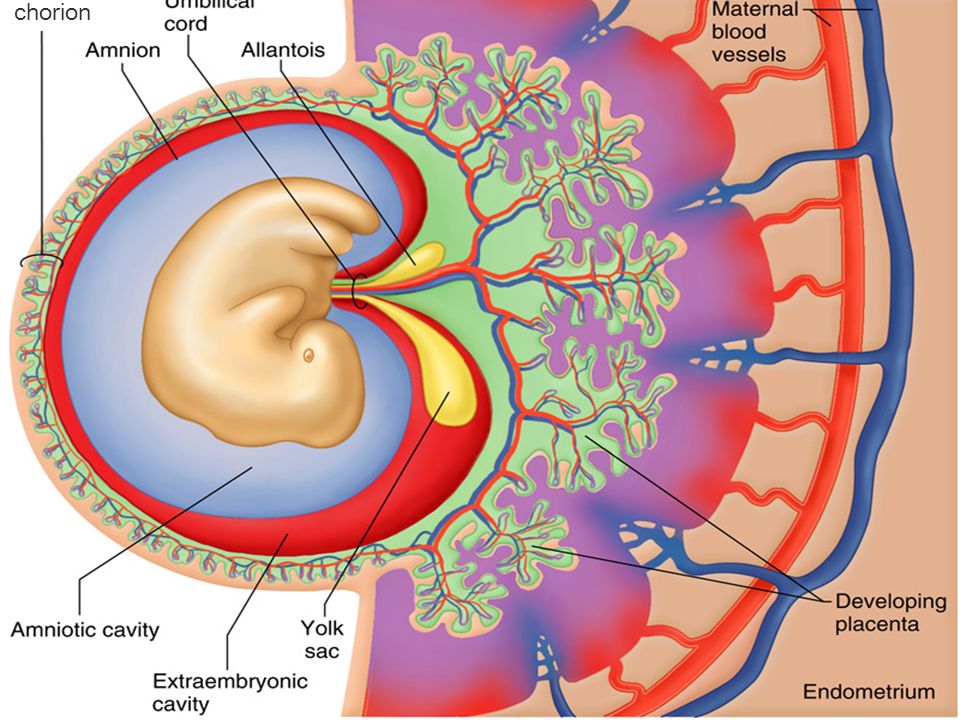
Правильное развитие плаценты напрямую зависит от удачной инвазии трофобласта, а также процессов васкуло- и ангиогенеза [9, 17, 19]. Несмотря на то что оба термина в переводе имеют одно значение: vasculum (лат.) — сосуд, angeion (греч.) — сосуд, genesis (греч.) — рождение, возникновение, происхождение, исторически принято в научной литературе разделять эти два процесса. Васкулогенез — это образование и развитие кровеносных сосудов de novo из мезодермальных клеток-предшественников (цит. по W. Risau, 1988), тогда как ангиогенез — создание новых сосудов из уже существующих [34]. Оба процесса имеют решающее значение, потому что от них зависят эффективная транспортировка кислорода, питательных веществ и выведение продуктов обмена [11, 27, 35, 36].
Формирование первых фетальных капилляров путем васкулогенеза происходит в конце 3-й недели гестации. В пределах ворсинок клетки мезенхимы дифференцируются в гемангиобласты, а затем часть из них — в эндотелиальные клетки, образующие примитивную сосудистую сеть.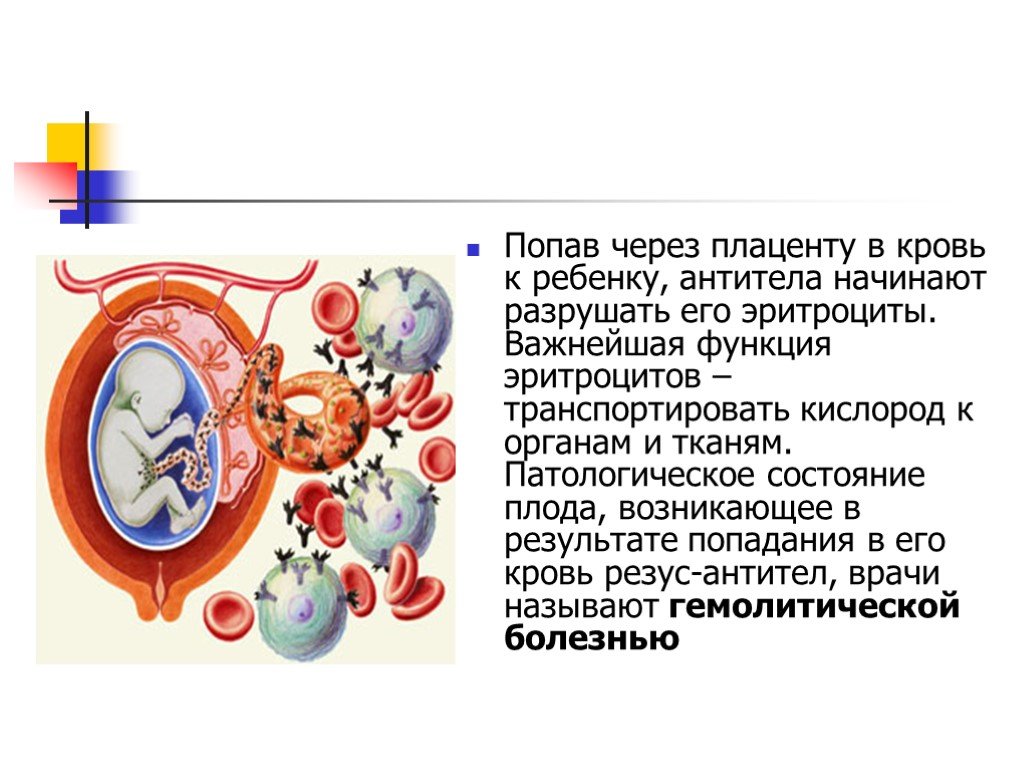 В дальнейшем формируется зрелая сеть сосудов путем образования новых и ремоделирования существующих сосудов, что происходит в основном за счет процессов ангиогенеза и апоптоза [4, 11, 13, 14, 17, 19, 20]. Таким образом, после 3-й недели внутриутробного развития большинство ворсинок должны содержать кровеносные сосуды. Одновременно происходит рост кровеносных сосудов со стороны аллантоиса. В среднем на 32-й день происходит соединение аллантоисных сосудов с капиллярами ворсинок. Ворсинки превращаются в третичные и устанавливается кровообращение между плодом и плацентой — фетоплацентарное кровообращение [5].
В дальнейшем формируется зрелая сеть сосудов путем образования новых и ремоделирования существующих сосудов, что происходит в основном за счет процессов ангиогенеза и апоптоза [4, 11, 13, 14, 17, 19, 20]. Таким образом, после 3-й недели внутриутробного развития большинство ворсинок должны содержать кровеносные сосуды. Одновременно происходит рост кровеносных сосудов со стороны аллантоиса. В среднем на 32-й день происходит соединение аллантоисных сосудов с капиллярами ворсинок. Ворсинки превращаются в третичные и устанавливается кровообращение между плодом и плацентой — фетоплацентарное кровообращение [5].
Перед формированием примитивных сосудов в мезенхиме вторичных ворсинок появляются мезенхимальные макрофаги (клетки Кащенко-Гофбауэра), которые секретируют ангиогенные факторы роста, обеспечивая регуляцию васкулогенеза. Секреция ангиогенных факторов децидуальными клетками и материнскими макрофагами обеспечивает регуляцию, определяющую инвазию трофобласта в материнские кровеносные сосуды.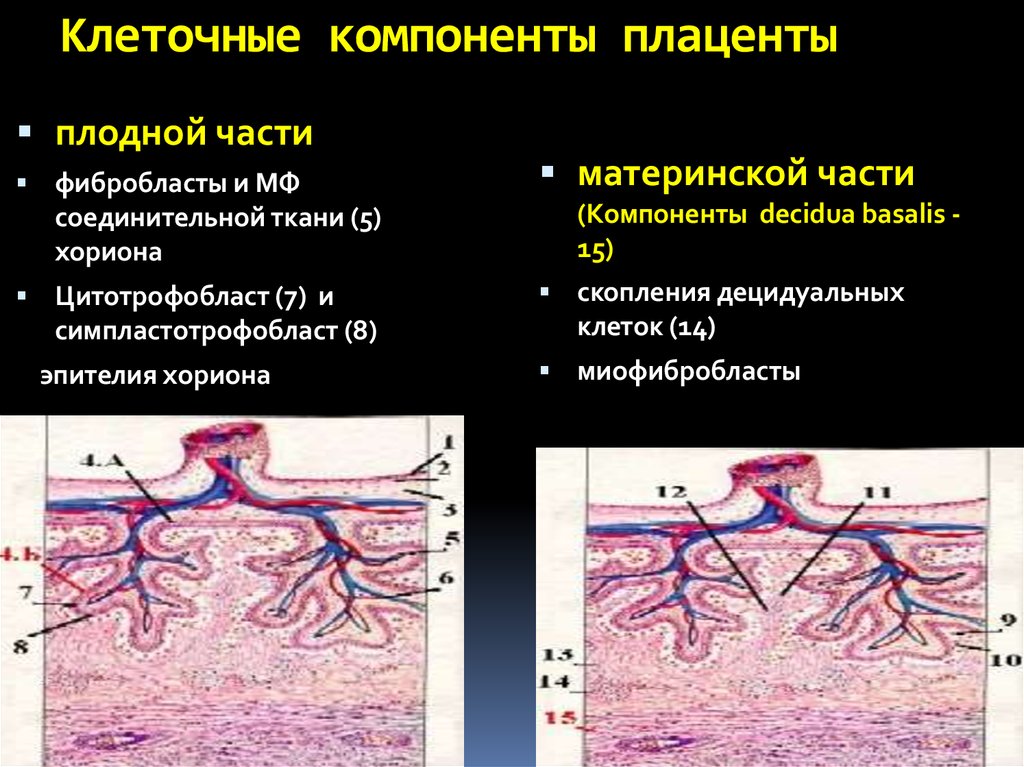 Начиная с этой стадии развития, в течение I и II триместров новые фетальные сосуды образуются путем разветвляющего ангиогенеза (почкование и инвагинация капилляров), а затем — с III триместра и до конца беременности путем неразветвляющего ангиогенеза (элонгация и внедрение эндотелиальных клеток в стенку сосуда) [4, 11, 17, 27].
Начиная с этой стадии развития, в течение I и II триместров новые фетальные сосуды образуются путем разветвляющего ангиогенеза (почкование и инвагинация капилляров), а затем — с III триместра и до конца беременности путем неразветвляющего ангиогенеза (элонгация и внедрение эндотелиальных клеток в стенку сосуда) [4, 11, 17, 27].
Все стадии развития плаценты контролируются различными цитокинами и ростовыми факторами, образующими цитокиновую сеть плаценты [10]. Образование сосудов сначала в ходе васкулогенеза, а затем — ангиогенеза контролируется в основном VEGF (фактор роста эндотелия сосудов) и его рецепторами VEGFR-1 и VEGFR-2, а также белками семейства ангиопоэтина — Ang-1 и Ang-2, действующими на эндотелиальные клетки через рецепторы Tie-1 и Tie-2 [10, 26, 41, 51].
Источниками указанных факторов в плаценте являются клетки трофобласта, эндотелиальные клетки, клетки стромы, а также плацентарные макрофаги [10].
Установлено, что паракринная регуляция ремоделирования сосудов плаценты обеспечивается отношениями VEGF/VEGF-R1 и Ang1/Tie-2, которые контролируют дифференцировку и инвазию трофобласта, а также отношениями VEGF/VEGF-R2 и Ang-1/Tie-2, определяющими развитие фетоплацентарных сосудов, и Ang-2/Tie-2, регулирующими процессы ремоделирования материнских сосудов [11, 13].
Таким образом, VEGF играет важную роль в обеспечении нормального формирования и развития плаценты, формирования ее сосудистого русла, роста и развития эмбриона. VEGF оказывает ангиогенное действие, стимулируя миграцию, пролиферацию и протеолитическую активность эндотелиальных клеток [25], увеличивает их жизнеспособность, защищая от апоптотической гибели в течение эмбрионального развития [20], особенно на последних его этапах, когда происходит прогрессивное усиление интенсивности процессов апоптоза [45]. Ангиопоэтин-1 обеспечивает ремоделирование сосудистой сети плаценты [11], совместно с VEGF обеспечивает переключение разветвляющего ангиогенеза на неразветвляющий в начале III триместра беременности [26], помимо ангиогенного, оказывает также мощное антиапоптотическое действие [11, 41, 51].
Выживание и апоптоз эндотелиальных клеток — процессы, которые регулируются балансом проангиогенных и антиангиогенных факторов. К числу проангиогенных молекул можно отнести VEGF и Ang-1 [9,13,19], к числу антиангиогенных — TGFβ (трансформирующий фактор роста β), который также оказывает ингибирующее действие в отношении цитотоксических лимфоцитов [16].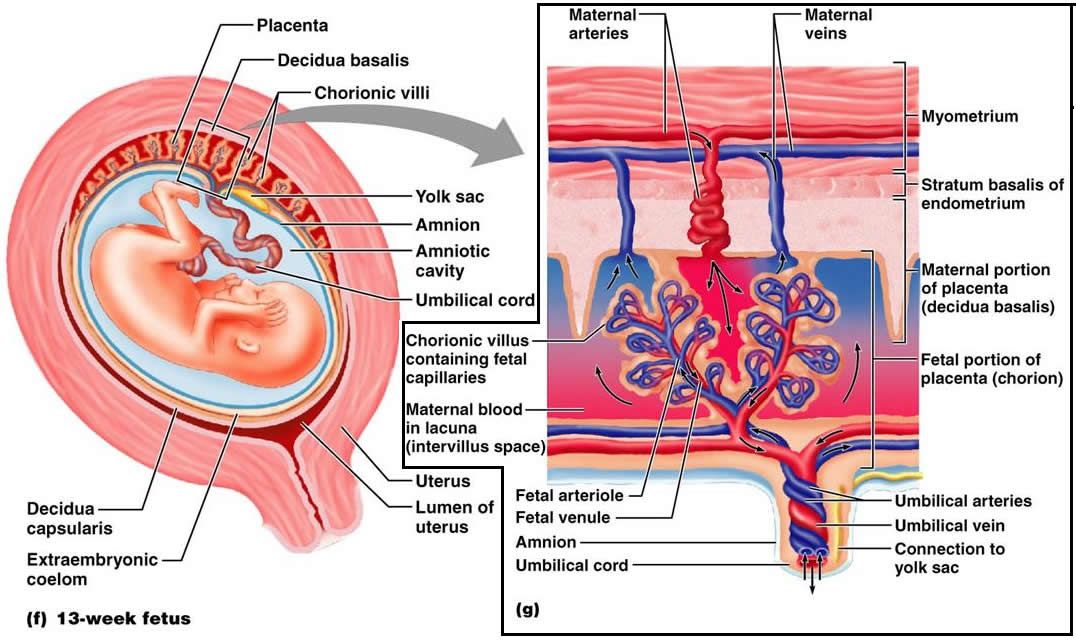 В норме апоптоз эндотелиальных клеток обеспечивает ремоделирование сосудистой сети на всех этапах ее развития [27], в том числе играет важную роль при переключении разветвляющего ангиогенеза на неразветвляющий на конечных этапах существования плаценты [20, 27]. Неконтролируемый ангиогенез может привести к нарушению строения ткани плаценты [14, 45]. Однако, противодействуя пролиферации, чрезмерный апоптоз эндотелиальных клеток в свою очередь может привести к регрессии сосудистой сети [10, 17]. Таким образом, нормальное развитие сосудистой сети плаценты регулируется балансом проангиогенных и антиангиогенных стимулов в отношении эндотелиальных и других клеток плаценты [10, 27].
В норме апоптоз эндотелиальных клеток обеспечивает ремоделирование сосудистой сети на всех этапах ее развития [27], в том числе играет важную роль при переключении разветвляющего ангиогенеза на неразветвляющий на конечных этапах существования плаценты [20, 27]. Неконтролируемый ангиогенез может привести к нарушению строения ткани плаценты [14, 45]. Однако, противодействуя пролиферации, чрезмерный апоптоз эндотелиальных клеток в свою очередь может привести к регрессии сосудистой сети [10, 17]. Таким образом, нормальное развитие сосудистой сети плаценты регулируется балансом проангиогенных и антиангиогенных стимулов в отношении эндотелиальных и других клеток плаценты [10, 27].
В своем исследовании Д.И. Соколову и С.А. Селькову [11] удалось доказать, что именно патологическое формирование сосудистой сети плаценты лежит в основе нарушений ее развития, приводящих к такой патологии, как ПН и преэклампсия.
ПН относят к полиэтиологическим заболеваниям. Число случаев ее возникновения колеблется в широких пределах и зависит от основных ее причин: при невынашивании ПН наблюдается в 50-77%, гестозе (преэклампсии) — в 32% (в 48,4-54,6% по данным Л.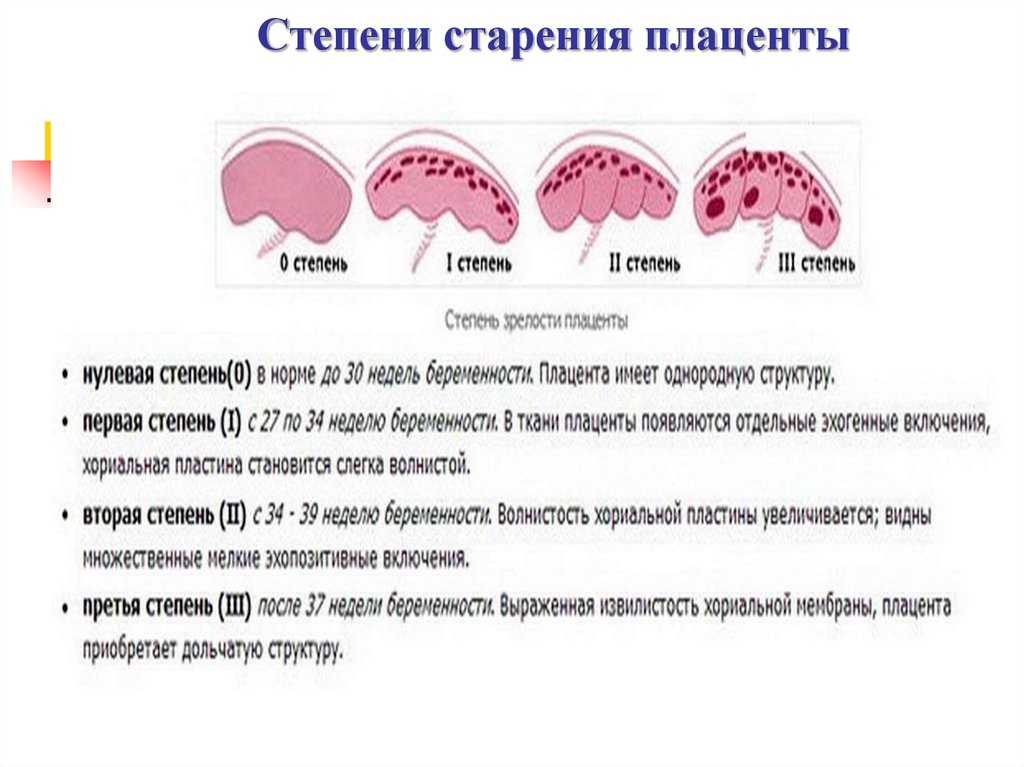 Е. Мурашко [7]), сочетании беременности с экстрагенитальной патологией — в 25-45%, у беременных, перенесших вирусную и бактериальную инфекцию, — более чем в 60% наблюдений [2]. Действия различных факторов и причин сводятся к возникновению анатомических нарушений строения, расположения, прикрепления плаценты, а также к дефектам васкуло- и ангиогенеза, неполному преобразованию спиральных артерий и нарушению дифференцировки ворсин хориона. Последнее имеет большое значение в патогенезе ПН, проявляется замедленным развитием, преждевременным старением или неравномерным созреванием в плаценте ворсин всех типов. При этом нарушаются процессы формирования синцитиокапиллярных мембран и происходит утолщение плацентарного барьера, в результате чего нарушается транспорт кислорода и питательных веществ через плаценту. Доставка плоду кислорода происходит путем простой или облегченной диффузии и зависит от интенсивности кровотока в межворсинчатом пространстве. Снижение оксигенации тканей плаценты приводит к энергетическому дефициту, нарушению систем активного транспорта, посредством которого осуществляется перенос через плацентарный барьер аминокислот, белков, пептидных гормонов, витаминов и других веществ [2, 6], в том числе антител класса IgG.
Е. Мурашко [7]), сочетании беременности с экстрагенитальной патологией — в 25-45%, у беременных, перенесших вирусную и бактериальную инфекцию, — более чем в 60% наблюдений [2]. Действия различных факторов и причин сводятся к возникновению анатомических нарушений строения, расположения, прикрепления плаценты, а также к дефектам васкуло- и ангиогенеза, неполному преобразованию спиральных артерий и нарушению дифференцировки ворсин хориона. Последнее имеет большое значение в патогенезе ПН, проявляется замедленным развитием, преждевременным старением или неравномерным созреванием в плаценте ворсин всех типов. При этом нарушаются процессы формирования синцитиокапиллярных мембран и происходит утолщение плацентарного барьера, в результате чего нарушается транспорт кислорода и питательных веществ через плаценту. Доставка плоду кислорода происходит путем простой или облегченной диффузии и зависит от интенсивности кровотока в межворсинчатом пространстве. Снижение оксигенации тканей плаценты приводит к энергетическому дефициту, нарушению систем активного транспорта, посредством которого осуществляется перенос через плацентарный барьер аминокислот, белков, пептидных гормонов, витаминов и других веществ [2, 6], в том числе антител класса IgG.
Таким образом, данные литературы свидетельствуют о том, что рецепторы, участвующие в трансплацентарной передаче антител IgG от матери к плоду, находятся на клетках СТБ и эндотелия сосудов, формирование которых и фетоплацентарного кровообращения в целом, напрямую зависит от процессов васкуло- и ангиогенеза. Дальнейшие исследования по установлению взаимосвязи между этими процессами и состоянием фетоплацентарного комплекса являются актуальными, так как позволят оптимизировать комплекс лечебно-профилактических мероприятий для плода, новорожденного и ребенка первых месяцев жизни.
Плацента: многогранный преходящий орган
1. Croft Long E. 1963 год. Плацента в преданиях и легендах. Бык. Мед. Либр. доц. 51, 233–241. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Yoshizawa RS. 2013. Обзор: общественные взгляды на использование плаценты человека в научных исследованиях и медицине. Плацента 34, 9–13. ( 10.1016/j.placenta.2012.10.014) [PubMed] [CrossRef] [Google Scholar]
3. Mossman HW.
1937 год.
Сравнительный морфогенез плодных оболочек и дополнительных структур матки. вклад Эмбриол.
26, 129–246. [PubMed] [Google Scholar]
Mossman HW.
1937 год.
Сравнительный морфогенез плодных оболочек и дополнительных структур матки. вклад Эмбриол.
26, 129–246. [PubMed] [Google Scholar]
4. Burton GJ, Kaufmann P, Huppertz B. 2006. Анатомия и генезис плаценты. В Knobil and Neill’s physiology of воспроизводства (изд. Neill JD.), стр. 189–243, 3-е изд. Амстердам, Нидерланды: Academic Press. [Google Scholar]
5. Benirschke K, Burton GJ, Baergen RN. 2012. Патология плаценты человека, 6-е изд. Гейдельберг, Германия: Springer. [Google Scholar]
6. Симпсон Р.А., Mayhew TM, Barnes PR. 1992. От 13 недель до срока трофобласт плаценты человека растет за счет непрерывного набора новых пролиферативных единиц: исследование количества ядер с помощью диссектора. Плацента 13, 501–512. ( 10.1016/0143-4004(92)
-X) [PubMed] [CrossRef] [Google Scholar] 7. Роббинс Дж.Р., Скшипчинская К.М., Зельдович В.Б., Капиджич М., Бакарджиев А.И.
2010.
Плацентарный синцитиотрофобласт представляет собой основной барьер для вертикальной передачи Listeria monocytogenes . PLoS Патог.
6, e1000732 ( 10.1371/journal.ppat.1000732) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Патог.
6, e1000732 ( 10.1371/journal.ppat.1000732) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Carter AM. 2000. Плацентарное потребление кислорода. Часть I: исследований in vivo, обзоров. Плацента 21 (Прил. А), С31–С37. ( 10.1053/мест.1999.0513) [PubMed] [CrossRef] [Google Scholar]
9. Burton GJ, Tham SW. 1992. Формирование сосудисто-синцитиальных мембран в плаценте человека. Дж. Дев. Физиол. 18, 43–47. [PubMed] [Google Scholar]
10. Ockleford CD, Whyte A. 1977. Дифференцированные участки поверхности клеток плаценты человека, связанные с обменом веществ между кровью матери и плода: покрытые везикулы. Дж. Клеточные науки. 25, 293–312. [PubMed] [Google Scholar]
11. Gauster M, Huppertz B. 2010. Парадокс каспазы 8 в слиянии трофобласта ворсин человека. Плацента 31, 82–88. ( 10.1016/j.placenta.2009.12.007) [PubMed] [CrossRef] [Google Scholar]
12. Rote NS, Wei BR, Xu C, Luo L.
2010.
Каспаза 8 и дифференцировка цитотрофобласта ворсин человека.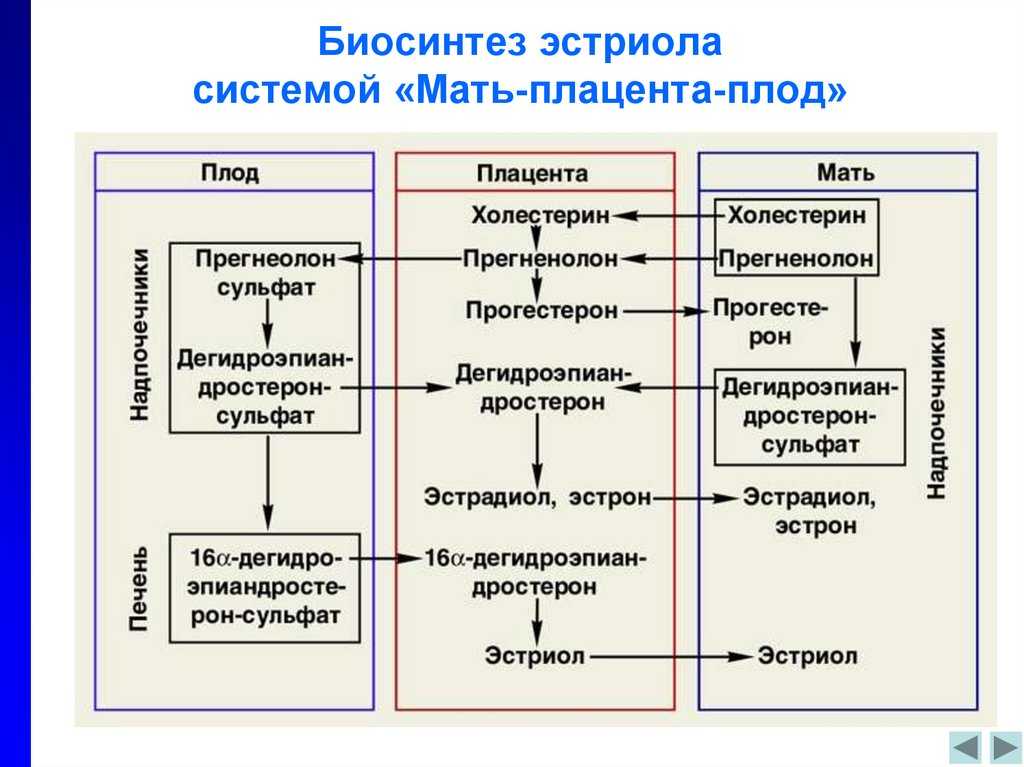 Плацента
31, 89–96. (10.1016/j.placenta.2009.12.014) [PubMed] [CrossRef] [Google Scholar]
Плацента
31, 89–96. (10.1016/j.placenta.2009.12.014) [PubMed] [CrossRef] [Google Scholar]
13. Willis DM, O’Grady JP, Faber JJ, Thornburg KL. 1986 год. Диффузионная проницаемость цианокобаламина в плаценте человека. Являюсь. Дж. Физиол. 250, Р459–Р464. [PubMed] [Google Scholar]
14. Торнбург К.Л., Берри К.Дж., Адамс А.К., Кирк Э.П., Фабер Дж.Дж. 1988. Проницаемость плаценты для инулина. Являюсь. Дж. Обст. Гинекол. 158, 1165–1169. ( 10.1016/0002-9378(88)
- -3) [PubMed] [CrossRef] [Google Scholar]
- Дыхательную, выделительную, пищевую, эндокринную, барьерную функцию, иммунологическую функцию.
- Поставка кислорода и выделение СО2 осуществляется путем простой диффузии (дыхательный) и питательных веществ к плоду через пуповину (питательный).
- Выведение из плода продуктов жизнедеятельности, таких как мочевина, креатинин, мочевая кислота (выделительные).

- Метаболизм и выделение пищевых веществ и необходимых продуктов в кровоток матери и плода.
- Защита плода от ксенобиотиков (соединений, включающих пищевые добавки, лекарства и загрязнители окружающей среды).
- Выработка стероидных и пептидных гормонов, способствующих росту и развитию ребенка (эндокринная система).
- Защита плода от инфекций (бактериальных) и болезней матери.
- Плодная оболочка защищает от переноса вредных веществ менее 500 дальтон, кроме антител и антигенов (барьер).
- Вырабатывает различные ферменты, такие как диаминоксидаза и окситоциназа (ферментативный).
- Возраст матери: У матерей, зачавших в возрасте после 35 лет, могут возникнуть проблемы с плацентой (4).
- Двойная или многоплодная беременность: У матерей, вынашивающих более одного ребенка, может развиться слабая плацента. Это может повысить риск ранней отслойки плаценты (5).
- Преждевременный разрыв плодных оболочек: Ваш ребенок обычно защищен амниотической оболочкой (заполненной жидкостью). Если он порвется или подтекает перед родами, у вас может быть риск плацентарных инфекций (хориоамнионита) и отслойки плаценты (преждевременное отделение плаценты от матки) (6).
- Нарушения свертывания крови: Свертывание крови в результате генетической предрасположенности, ожирения, повышенного материнского возраста, соматических заболеваний, длительной неподвижности и т. д. также может образовываться внутри плаценты.
 Иногда это может привести к прекращению кровоснабжения и представлять опасность для ребенка (7).
Иногда это может привести к прекращению кровоснабжения и представлять опасность для ребенка (7). - Травма живота: Падение или любой другой удар, вызывающий травму живота, повышает риск отслойки плаценты (8).
- Проблемы с плацентой в анамнезе: Если у вас были проблемы с плацентой во время предыдущей беременности, они могут развиться снова (9).
- Предыдущая операция на матке: Любая предыдущая операция, такая как кесарево сечение или операция по удалению миомы матки, может увеличить риск плацентарных заболеваний (10).
- Артериальное давление: Высокое кровяное давление или гипертония могут повлиять на функцию плаценты (11).
- Злоупотребление психоактивными веществами: Если вы курите или принимаете наркотики, вы можете подвергаться риску плацентарных заболеваний (12).

- Отслойка плаценты: Это состояние, при котором плацента отделяется от стенки матки перед родами. Это может лишить плод кислорода и питательных веществ и привести к преждевременным родам, мертворождению и проблемам роста; это может вызвать сильное кровотечение (13). Треть случаев отслойки связана с какой-либо формой артериальной гипертензии.
- Предлежание плаценты: Это происходит, когда плацента располагается низко в нижнем маточном сегменте матки и частично или полностью закрывает отверстие шейки матки. Таким образом, это может заблокировать выход ребенка из матки, что приведет к преждевременным родам, разрыву плаценты и дородовому и интранатальному кровотечению (14) (15).
- Приращение плаценты: Это редкое осложнение возникает, когда плацента врастает в стенку матки и не может правильно отделиться во время родов.
 Это может привести к вагинальному кровотечению во время и после родов (16).
Это может привести к вагинальному кровотечению во время и после родов (16). - Задержанная плацента: Часть плаценты или оболочек остаются интактными в матке после родов. Это может произойти, когда плацента застревает позади мышцы матки. Это может быть опасным для жизни состоянием и требует ручного удаления плаценты (MROP) через несколько часов после родов (17).
- Плацентарная недостаточность: Плацента может не доставлять питательные вещества плоду. Это может привести к задержке роста плода (ЗРП), мертворождению и низкой массе тела при рождении (18).
- Передняя часть плаценты: Плацента развивается в передней части матки, а плод позади нее. Это может затруднить для вас ощущение толчков плода, а для специалистов по УЗИ — определение сердцебиения. Это может привести к отслойке плаценты, задержке внутриутробного развития и гибели плода (19).).
- Вагинальное кровотечение
- Боль в спине
- Боль в животе
- Постоянные сокращения матки
- Снижение подвижности плода
- Ходите на регулярные предродовые осмотры.
- Лечение таких заболеваний, как артериальное давление и гестационный диабет.
- Откажитесь от курения и употребления запрещенных наркотиков.

- Сообщите своему врачу, если у вас были какие-либо проблемы с плацентой во время предыдущей беременности или если у вас была какая-либо операция на матке.
- Рецензент
- Автор
Прогестерон во время беременности: безопасность и его уровни
Прогестерон во время беременности: безопасность и его уровни
Первый месяц беременности: симптомы, стадии и развитие плода
Первый месяц беременности: симптомы, стадии и развитие ребенка
10033 Общие правила безопасности
15. Bain MD, Copas DK, Taylor A, Landon MJ, Stacey TE. 1990. Проницаемость плаценты человека in vivo для четырех неметаболизированных гидрофильных молекул. Дж. Физиол. 431, 505–513. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Kaufmann P, Schroder H, Leichtweiss HP. 1982. Смещение жидкости через плаценту: II. Фето-материнская передача пероксидазы хрена морской свинке. Плацента 3, 339–348. ( 10.1016/S0143-4004(82)80027-1) [PubMed] [CrossRef] [Google Scholar]
17. Burton GJ.
1987.
Тонкая структура плаценты человека по данным сканирующей электронной микроскопии. Сканировать. микроск.
1, 1811–1828 гг. [PubMed] [Google Scholar]
Burton GJ.
1987.
Тонкая структура плаценты человека по данным сканирующей электронной микроскопии. Сканировать. микроск.
1, 1811–1828 гг. [PubMed] [Google Scholar]
18. Burton GJ, Watson AL. 1997. Структура плаценты человека: значение для инициирования и защиты от вирусных инфекций. преподобный мед. Вирол. 7, 219–228. ( 10.1002/(SICI)1099-1654(199712)7:4<219::AID-RMV205>3.0.CO;2-E) [PubMed] [CrossRef] [Google Scholar]
19. Браунбилл П., Эдвардс Д., Джонс С., Махендран Д., Оуэн Д., Сибли С., Джонсон Р., Суонсон П., Нельсон Д.М. 1995. Механизмы переноса альфафетопротеина в перфузируемых семядолях плаценты человека при неосложненной беременности. Дж. Клин. Вкладывать деньги. 96, 2220–2226. ( 10.1172/JCI118277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Mayhew TM, Jackson MR, Boyd PA.
1993.
Изменения диффузионной проводимости кислорода плаценты человека в период гестации (10–41 нед) соизмеримы с прибавкой массы плода. Плацента
14, 51–61. ( 10. 1016/S0143-4004(05)80248-6) [PubMed] [CrossRef] [Google Scholar]
1016/S0143-4004(05)80248-6) [PubMed] [CrossRef] [Google Scholar]
21. Решетникова О.С., Бертон Г.Дж., Милованов А.П. 1994. Влияние гипобарической гипоксии на фетоплацентарную единицу: морфометрическая диффузионная способность ворсинчатой оболочки на большой высоте. Являюсь. Дж. Обст. Гинекол. 171, 1560–1565. ( 10.1016/0002-9378(94)-2) [PubMed] [CrossRef] [Google Scholar]
22. Stulc J, Svihovec J, Drabkova J, Stribrny J, Kobilkova J, Vido I, Dolezal A. 1978 год. Разность электрических потенциалов через среднесрочную плаценту человека. Acta Obstet. Гинекол. Сканд. 57, 125–126. ( 10.3109/00016347809155889) [PubMed] [CrossRef] [Google Scholar]
23. Mellor DJ, Cockburn F, Lees MM, Blagden A. 1969. Распределение ионов и разность электрических потенциалов между матерью и плодом у человека в срок. Дж. Обст. Гинеколь. бр. Общ. 76, 993–998. ( 10.1111/j.1471-0528.1969.tb09465.x) [PubMed] [CrossRef] [Google Scholar]
24. Atkinson DE, Boyd RDH, Sibley CP.
2006.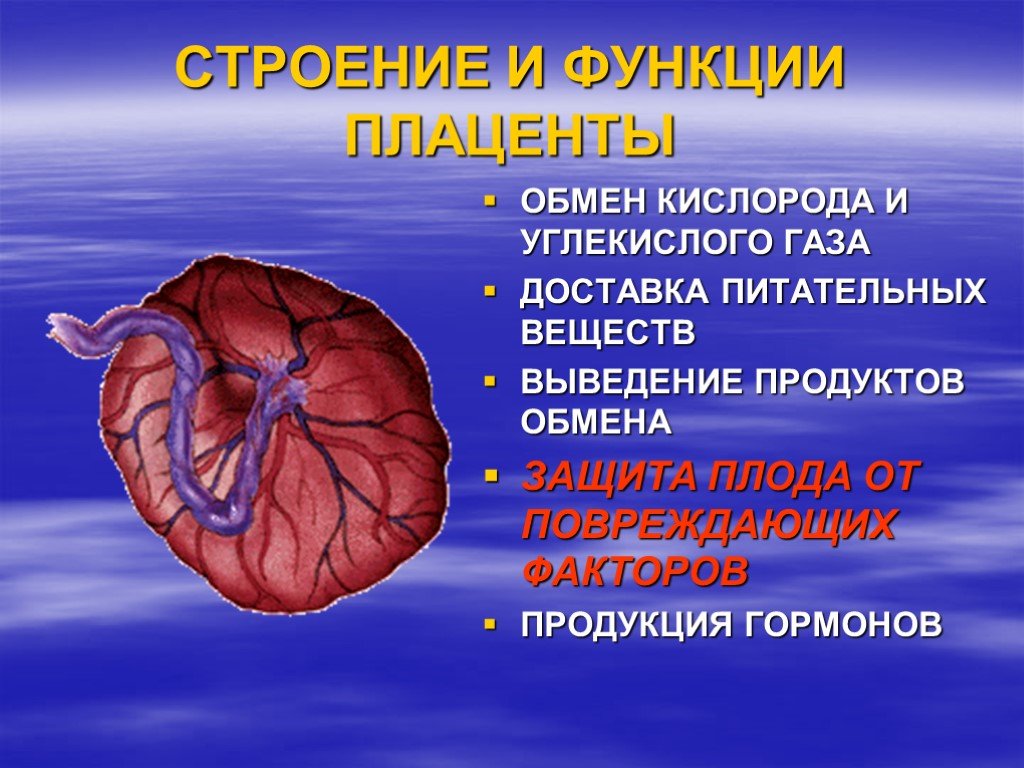 Плацентарный перенос. В физиологии репродукции Кнобила и Нейла (изд. Neill JD.), стр. 2787–2846. Амстердам, Нидерланды: Elsevier. [Академия Google]
Плацентарный перенос. В физиологии репродукции Кнобила и Нейла (изд. Neill JD.), стр. 2787–2846. Амстердам, Нидерланды: Elsevier. [Академия Google]
25. Тессье Д.Р., Ферраро З.М., Груслин А. 2013. Роль лептина при беременности: последствия материнского ожирения. Плацента 34, 205–211. (10.1016/j.placenta.2012.11.035) [PubMed] [CrossRef] [Google Scholar]
26. Fowden AL, Sferruzzi-Perri AN, Coan PM, Constancia M, Burton GJ. 2009. Плацентарная эффективность и адаптация: эндокринная регуляция. Дж. Физиол. 587, 3459–3472. ( 10.1113/jphysiol.2009.173013) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Sibley CP, et al. 2004. Плацентарно-специфический инсулиноподобный фактор роста 2 ( Igf2 ) регулирует характеристики диффузионного обмена плаценты мыши. проц. Натл акад. науч. США 101, 8204–8208. ( 10.1073/pnas.0402508101) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Coan PM, Vaughan OR, Sekita Y, Finn SL, Burton GJ, Constancia M, Fowden AL. 2010.
Адаптации плацентарного фенотипа поддерживают рост плода при недостаточном питании беременных мышей. Дж. Физиол.
588, 527–538. ( 10.1113/jphysiol.2009.181214) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2010.
Адаптации плацентарного фенотипа поддерживают рост плода при недостаточном питании беременных мышей. Дж. Физиол.
588, 527–538. ( 10.1113/jphysiol.2009.181214) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Sferruzzi-Perri AN, Vaughan OR, Coan PM, Suciu MC, Darbyshire R, Constancia M, Burton GJ, Fowden AL. 2011. Дефицит плацентарно-специфического Igf2 изменяет адаптацию развития к недоеданию у мышей. Эндокринология 152, 3202–3212. ( 10.1210/en.2011-0240) [PubMed] [CrossRef] [Google Scholar]
30. King BF. 1982. Поглощение иммуноглобулина G, конъюгированного с пероксидазой, плацентой человека: исследование in vitro . Плацента 3, 395–406. ( 10.1016/S0143-4004(82)80032-5) [PubMed] [CrossRef] [Google Scholar]
31. Хэмпсток Дж., Синдрова-Дэвис Т., Жонио Э., Бертон Г.Дж.
2004.
Эндометриальные железы как источник питательных веществ, факторов роста и цитокинов в первом триместре беременности человека: морфологическое и иммуногистохимическое исследование. Воспр. биол. Эндокринол.
2, 58 (10.1186/1477-7827-2-58) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Воспр. биол. Эндокринол.
2, 58 (10.1186/1477-7827-2-58) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Jauniaux E, Gulbis B. 2000. Жидкие компартменты эмбриональной среды. Гум. Воспр. Обновлять 6, 268–278. ( 10.1093/humupd/6.3.268) [PubMed] [CrossRef] [Google Scholar]
33. Кариму А.Л., Бертон Г.Дж. 1994. Влияние материнского сосудистого давления на размеры плацентарных капилляров. бр. Дж. Обст. Гинеколь. 101, 57–63. ( 10.1111/j.1471-0528.1994.tb13011.x) [PubMed] [CrossRef] [Google Scholar]
34. Hutchinson ES, Brownbill P, Jones NW, Abrahams VM, Baker PN, Sibley CP, Crocker IP. 2009. Маточно-плацентарная гемодинамика в патогенезе преэклампсии. Плацента 30, 634–641. ( 10.1016/j.placenta.2009.04.011) [PubMed] [CrossRef] [Google Scholar]
35. Бертон Г.Дж., Вудс А.В., Жонио Э., Королевство Дж.К.
2009.
Реологические и физиологические последствия преобразования спиральных артерий матери для маточно-плацентарного кровотока при беременности человека. Плацента
30, 473–482. ( 10.1016/j.placenta.2009.02.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Плацента
30, 473–482. ( 10.1016/j.placenta.2009.02.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Wooding FP, Burton GJ. 2008. Сравнительная плацентация. Структуры, функции и эволюция. Берлин, Германия: Springer. [Google Scholar]
37. Harris JWS, Ramsey EM. 1966. Морфология маточно-плацентарной сосудистой системы человека. вклад Эмбриол. 38, 43–58. [Google Scholar]
38. Pijnenborg R, Vercruysse L, Hanssens M. 2006. Спиральные артерии матки при беременности человека: факты и противоречия. Плацента 27, 939–958. (10.1016/j.placenta.2005.12.006) [PubMed] [CrossRef] [Google Scholar]
39. Whitley GS, Cartwright JE. 2010. Клеточная и молекулярная регуляция ремоделирования спиральных артерий: уроки сердечно-сосудистой системы. Плацента 31, 465–474. ( 10.1016/j.placenta.2010.03.002) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Кам EPY, Гарднер Л., Локе Ю.В., Кинг А.
1999.
Роль трофобласта в физиологических изменениях децидуальных спиральных артерий. Гум. Воспр.
14, 2131–2138. ( 10.1093/humrep/14.8.2131) [PubMed] [CrossRef] [Google Scholar]
Гум. Воспр.
14, 2131–2138. ( 10.1093/humrep/14.8.2131) [PubMed] [CrossRef] [Google Scholar]
41. Harris LK. 2010. Взаимодействия трофобласт-сосудистые клетки на ранних сроках беременности: как реконструировать сосуд. Плацента 31, С93–С98. (10.1016/j.placenta.2009.12.012) [PubMed] [CrossRef] [Google Scholar]
42. Hanna J, et al. 2006. Децидуальные NK-клетки регулируют ключевые процессы развития на границе плода и матери человека. Нац. Мед. 12, 1065–1074. ( 10.1038/nm1452) [PubMed] [CrossRef] [Google Scholar]
43. Xiong S, et al. 2013. Рецептор KIR2DS1, активирующий NK-клетки матери, усиливает плацентацию. Дж. Клин. Вкладывать деньги. 123, 4264–4272. ( 10.1172/JCI68991) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Moffett A, Colucci F. 2014. NK-клетки матки: активные регуляторы взаимодействия матери и плода. Дж. Клин. Вкладывать деньги. 124, 1872–1879 гг. ( 10.1172/JCI68107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Hiby SE, et al.
2010.
Материнские активирующие KIR защищают от репродуктивной недостаточности человека, опосредованной фетальным HLA-C2. Дж. Клин. Вкладывать деньги.
120, 4102–4110. ( 10.1172/JCI43998) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Hiby SE, et al.
2010.
Материнские активирующие KIR защищают от репродуктивной недостаточности человека, опосредованной фетальным HLA-C2. Дж. Клин. Вкладывать деньги.
120, 4102–4110. ( 10.1172/JCI43998) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Brosens I, Pijnenborg R, Vercruysse L, Romero R. 2011. «Большие акушерские синдромы» связаны с нарушениями глубокой плацентации. Являюсь. Дж. Обст. Гинекол. 204, 193–201. (10.1016/j.ajog.2010.08.009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Redman CW, Sargent IL. 2005. Последние достижения в понимании преэклампсии. Наука 308, 1592–1594. ( 10.1126/science.1111726) [PubMed] [CrossRef] [Google Scholar]
48. Levine RJ, et al. 2004. Циркулирующие ангиогенные факторы и риск преэклампсии. Н. англ. Дж. Мед. 350, 672–683. ( 10.1056/NEJMoa031884) [PubMed] [CrossRef] [Google Scholar]
49. Циндрова-Дэвис Т., Спасич-Боскович О., Жонио Э., Чарнок-Джонс Д.С., Бертон Г.Дж.
2007.
Ядерный фактор-каппа B, p38 и стресс-активируемая протеинкиназа, митоген-активируемая протеинкиназа, сигнальные пути регулируют провоспалительные цитокины и апоптоз в эксплантатах плаценты человека в ответ на окислительный стресс: эффекты витаминов-антиоксидантов. Являюсь. Дж. Патол.
170, 1511–1520. ( 10.2353/ajpath.2007.061035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Патол.
170, 1511–1520. ( 10.2353/ajpath.2007.061035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Yung HW, Atkinson D, Campion-Smith T, Olovsson M, Charnock-Jones DS, Burton GJ. 2014. Дифференциальная активация плацентарных путей ответа на несвернутые белки предполагает гетерогенность причин преэклампсии с ранним и поздним началом. Дж. Патол. 234, 262–276. ( 10.1002/path.4394) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Yung HW, Calabrese S, Hynx D, Hemmings BA, Cetin I, Charnock-Jones DS, Burton GJ. 2008. Доказательства ингибирования плацентарной трансляции и стресса эндоплазматического ретикулума в этиологии ограничения внутриутробного развития человека. Являюсь. Дж. Патол. 173, 451–462. ( 10.2353/ajpath.2008.071193) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Burton GJ, Yung HW, Cindrova-Davies T, Charnock-Jones DS.
2009.
Стресс плацентарного эндоплазматического ретикулума и окислительный стресс в патофизиологии необъяснимой задержки внутриутробного развития и ранней преэклампсии. Плацента
30 (Прил. А), С43–С48. (10.1016/j.placenta.2008.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Плацента
30 (Прил. А), С43–С48. (10.1016/j.placenta.2008.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Zhang K, Kaufman RJ. 2008. От стресса эндоплазматического ретикулума до воспалительной реакции. Природа 454, 455–462. ( 10.1038/nature07203) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Абитбол ММ. 1993. Рост плода в брюшной полости. Являюсь. Дж. Физ. Антропол. 91, 367–378. ( 10.1002/ajpa.1330910309) [PubMed] [CrossRef] [Google Scholar]
55. Kauppila A, Koskinen M, Puolakka J, Tuimala R, Kuikka J. 1980. Снижение межворсинчатого и неизмененный миометриальный кровоток в положении лежа на спине. Обст. Гинекол. 55, 203–205. ( 10.1097/00006250-198003001-00050) [PubMed] [CrossRef] [Google Scholar]
56. Hung TH, Burton GJ. 2006. Гипоксия и реоксигенация: возможный механизм плацентарного окислительного стресса при преэклампсии. Тайвань Дж. Обстет. Гинекол. 45, 189–200. ( 10.1016/S1028-4559(09)60224-2) [PubMed] [CrossRef] [Google Scholar]
57. Burton GJ, Charnock-Jones DS, Jauniaux E.
2009.
Регуляция роста и функции сосудов в плаценте человека. Воспроизведение
138, 895–902. (10.1530/REP-09-0092) [PubMed] [CrossRef] [Google Scholar]
Burton GJ, Charnock-Jones DS, Jauniaux E.
2009.
Регуляция роста и функции сосудов в плаценте человека. Воспроизведение
138, 895–902. (10.1530/REP-09-0092) [PubMed] [CrossRef] [Google Scholar]
58. Lash GE, Naruse K, Innes BA, Robson SC, Searle RF, Bulmer JN. 2010. Секреция ангиогенных факторов роста ворсинчатым цитотрофобластом и вневорсинчатым трофобластом на ранних сроках беременности человека. Плацента 31, 545–548. ( 10.1016/j.placenta.2010.02.020) [PubMed] [CrossRef] [Google Scholar]
59. Лич Л., Бабавале М.О., Андерсон М., Ламмиман М. 2002. Васкулогенез, ангиогенез и молекулярная организация эндотелиальных соединений в ранней плаценте человека. Дж. Васк. Рез. 39, 246–259. ( 10.1159/000063690) [PubMed] [CrossRef] [Google Scholar]
60. Jirkovska M, Janacek J, Kalab J, Kubinova L. 2008. Трехмерное расположение капиллярного русла и его связь с микрореологией в терминальных ворсинах доношенной плаценты. Плацента 29, 892–897. ( 10.1016/j.placenta.2008.07.004) [PubMed] [CrossRef] [Google Scholar]
61. Мятт Л.
1992.
Контроль сосудистого сопротивления в плаценте человека. Плацента
13, 329–341. ( 10.1016/0143-4004(92)
Мятт Л.
1992.
Контроль сосудистого сопротивления в плаценте человека. Плацента
13, 329–341. ( 10.1016/0143-4004(92)
62. Барбер А., Робсон С.К., Мятт Л., Балмер Дж.Н., Лайалл Ф. 2001. Экспрессия гемоксигеназы в плаценте и плацентарном ложе человека: снижение экспрессии эндотелиальной HO-2 плаценты при преэклампсии и задержке роста плода. ФАСЭБ Дж. 15, 1158–1168. ( 10.1096/fj.00-0376com) [PubMed] [CrossRef] [Google Scholar]
63. Cindrova-Davies T, Herrera EA, Niu Y, Kingdom J, Giussani DA, Burton GJ. 2013. Снижение цистатионин-гамма-лиазы и повышенная экспрессия миР-21 связаны с повышенным сосудистым сопротивлением при беременности с ограничением роста: сероводород как плацентарный вазодилататор. Являюсь. Дж. Патол. 182, 1448–1458. ( 10.1016/j.ajpath.2013.01.001) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Петралья Ф., Флорио П., Торричелли М.
2006.
Плацентарная эндокринная функция. В физиологии воспроизводства Кнобила и Нейла (изд. Neill JD.), стр. 2847–289.7, 3-е изд.
Амстердам, Нидерланды: Elsevier. [Google Scholar]
Neill JD.), стр. 2847–289.7, 3-е изд.
Амстердам, Нидерланды: Elsevier. [Google Scholar]
65. Брантон П.Дж., Рассел Дж.А. 2010. Эндокринные изменения функции головного мозга во время беременности. Мозг Res. 1364, 198–215. ( 10.1016/j.brainres.2010.09.062) [PubMed] [CrossRef] [Google Scholar]
66. Фримарк М. 2006. Регуляция метаболизма матери гипофизарными и плацентарными гормонами: роль в развитии плода и метаболическом программировании. Горм. Рез. 65 (прил. 3), 41–49. ( 10.1159/000091505) [PubMed] [CrossRef] [Google Scholar]
67. Ньюберн Д., Фримарк М. 2011. Плацентарные гормоны и контроль метаболизма матери и роста плода. Курс. мнение Эндокринол. Диабет Ожирение. 18, 409–416. (10.1097/MED.0b013e32834c800d) [PubMed] [CrossRef] [Google Scholar]
68. Papper Z, et al. 2009. Древнее происхождение плацентарной экспрессии генов гормона роста человекообразных приматов. проц. Натл акад. науч. США 106, 17 083–17 088. ( 10.1073/pnas.0908377106) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Кросс Дж. К., Бачик Д., Добрич Н., Хембергер М., Хьюз М., Симмонс Д. Г., Ямамото Х., Kingdom JCP.
2003.
Гены, развитие и эволюция плаценты. Плацента
24, 123–130. ( 10.1053/plac.2002.0887) [PubMed] [CrossRef] [Google Scholar]
Кросс Дж. К., Бачик Д., Добрич Н., Хембергер М., Хьюз М., Симмонс Д. Г., Ямамото Х., Kingdom JCP.
2003.
Гены, развитие и эволюция плаценты. Плацента
24, 123–130. ( 10.1053/plac.2002.0887) [PubMed] [CrossRef] [Google Scholar]
70. Ladyman SR, Augustine RA, Grattan DR. 2010. Гормональные взаимодействия, регулирующие энергетический баланс во время беременности. Дж. Нейроэндокринол. 22, 805–817. [PubMed] [Google Scholar]
71. Barbour LA, Shao J, Qiao L, Leitner W, Anderson M, Friedman JE, Draznin B. 2004. Плацентарный гормон роста человека увеличивает экспрессию регуляторной единицы p85 фосфатидилинозитол-3-киназы и вызывает тяжелую резистентность к инсулину в скелетных мышцах. Эндокринология 145, 1144–1150. ( 10.1210/en.2003-1297) [PubMed] [CrossRef] [Google Scholar]
72. Caufriez A, Frankenne F, Hennen G, Copinschi G. 1993. Регуляция материнского IGF-I плацентарным GH при нормальной и аномальной беременности у человека. Являюсь. Дж. Физиол. 265, Е572–577. [PubMed] [Google Scholar]
73. Sferruzzi-Perri AN, Owens JA, Pringle KG, Roberts CT.
2011.
Забытая роль инсулиноподобных факторов роста в материнском кровообращении, регулирующая рост плода. Дж. Физиол.
589, 7–20. ( 10.1113/jphysiol.2010.198622) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Sferruzzi-Perri AN, Owens JA, Pringle KG, Roberts CT.
2011.
Забытая роль инсулиноподобных факторов роста в материнском кровообращении, регулирующая рост плода. Дж. Физиол.
589, 7–20. ( 10.1113/jphysiol.2010.198622) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Блоксам Д.Л. 1985. Энергетический метаболизм плаценты человека: его отношение к перфузии in vitro . вклад Гинекол. Обст. 13, 59–69. [PubMed] [Google Scholar]
75. Jauniaux E, Jurkovic D, Gulbis B, Collin WP, Zaidi J, Campbell S. 1994. Исследование кислотно-щелочного баланса целомической и амниотической жидкостей на ранних сроках беременности человека. Являюсь. Дж. Обст. Гинекол. 170, 1359–1365. ( 10.1016/S0002-9378(94)70156-3) [PubMed] [CrossRef] [Google Scholar]
76. Schneider H. 2000. Плацентарное потребление кислорода. Часть II: in vitro исследований-обзор. Плацента 21 (Прил. А), С38–С44. ( 10.1053/plac.1999.0512) [PubMed] [CrossRef] [Google Scholar]
77. Jauniaux E, Hempstock J, Teng C, Battaglia F, Burton GJ.
2005.
Концентрации полиолов в жидкостных отделах человеческого зародыша в течение первого триместра беременности: поддержание окислительно-восстановительного потенциала в среде с низким содержанием кислорода. Дж. Клин. Эндокринол. Метаб.
90, 1171–1175. ( 10.1210/jc.2004-1513) [PubMed] [CrossRef] [Google Scholar]
Jauniaux E, Hempstock J, Teng C, Battaglia F, Burton GJ.
2005.
Концентрации полиолов в жидкостных отделах человеческого зародыша в течение первого триместра беременности: поддержание окислительно-восстановительного потенциала в среде с низким содержанием кислорода. Дж. Клин. Эндокринол. Метаб.
90, 1171–1175. ( 10.1210/jc.2004-1513) [PubMed] [CrossRef] [Google Scholar]
78. Coller HA. 2014. Является ли рак метаболическим заболеванием? Являюсь. Дж. Патол. 184, 4–17. ( 10.1016/j.ajpath.2013.07.035) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Бойд Д.Д. 1959. Гликоген в местах ранней имплантации человека. Воспоминания Соц. Эндокринол. 6, 26–34. [Google Scholar]
80. Burton GJ, Watson AL, Hempstock J, Skepper JN, Jauniaux E. 2002. Железы матки обеспечивают гистиотрофное питание плода человека в первом триместре беременности. Дж. Клин. Эндокринол. Метаб. 87, 2954–2959. ( 10.1210/jcem.87.6.8563) [PubMed] [CrossRef] [Google Scholar]
81. McTernan CL, Draper N, Nicholson H, Chalder SM, Driver P, Hewison M, Kilby MD, Stewart PM. 2001.
Снижение уровней мРНК плацентарной 11бета-гидроксистероиддегидрогеназы 2 типа при беременности человека, осложненной задержкой внутриутробного развития: анализ возможных механизмов. Дж. Клин. Эндокринол. Метаб.
86, 4979–4983. [PubMed] [Google Scholar]
2001.
Снижение уровней мРНК плацентарной 11бета-гидроксистероиддегидрогеназы 2 типа при беременности человека, осложненной задержкой внутриутробного развития: анализ возможных механизмов. Дж. Клин. Эндокринол. Метаб.
86, 4979–4983. [PubMed] [Google Scholar]
82. Dy J, Guan H, Sampath-Kumar R, Richardson BS, Yang K. 2008. Плацентарная 11бета-гидроксистероиддегидрогеназа 2 типа снижена при беременности, осложненной идиопатической задержкой внутриутробного развития: доказательства того, что это связано со сниженным соотношением кортизона к кортизолу в пупочной артерии. Плацента 29, 193–200. (10.1016/j.placenta.2007.10.010) [PubMed] [CrossRef] [Google Scholar]
83. Baron-Cohen S, et al. В прессе. Повышенная стероидогенная активность плода при аутизме. Мол. Психиатрия. ( 10.1038/mp.2014.48) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Старк М.Дж., Райт И.М., Клифтон В.Л.
2009.
Специфические для пола изменения активности плацентарной 11бета-гидроксистероиддегидрогеназы 2 и раннее послеродовое клиническое течение после антенатального введения бетаметазона.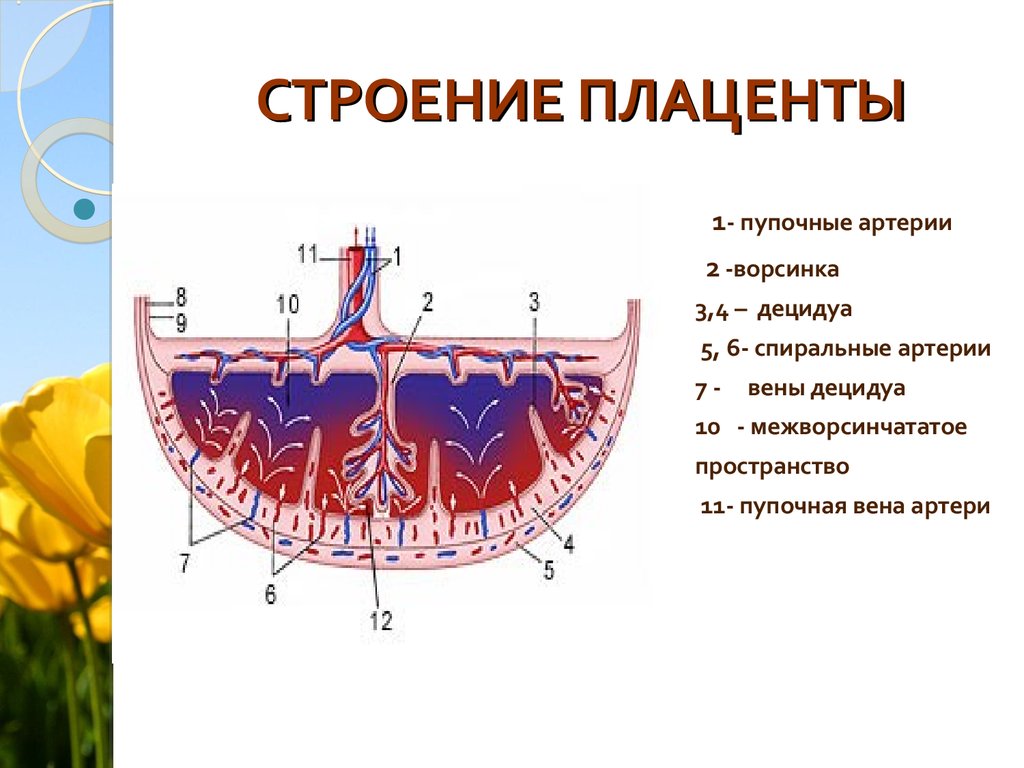 Являюсь. Дж. Физиол. Регул. интегр. Комп. Физиол.
297, Р510–Р514. ( 10.1152/ajpregu.00175.2009) [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Физиол. Регул. интегр. Комп. Физиол.
297, Р510–Р514. ( 10.1152/ajpregu.00175.2009) [PubMed] [CrossRef] [Google Scholar]
85. Сен-Пьер М.В., Серрано М.А., Масиас Р.И., Дабс У., Хечли М., Лаупер У., Мейер П.Дж., Марин Дж.Дж. 2000. Экспрессия членов семейства белков множественной лекарственной устойчивости в доношенной плаценте человека. Являюсь. Дж. Физиол. Регул. интегр. Комп. Физиол. 279, Р1495–Р1503. [PubMed] [Google Scholar]
86. Burton GJ, Fowden AL. 2012. Обзор: плацента и программирование развития: баланс потребностей плода в питательных веществах с распределением материнских ресурсов. Плацента 33, С23–С27. (10.1016/j.placenta.2011.11.013) [PubMed] [CrossRef] [Google Scholar]
87. Картер А.М. 2011. Сравнительные исследования плацентации и иммунологии у приматов, отличных от человека, предлагают сценарий эволюции глубокой инвазии трофобласта и объяснение нарушений беременности у человека. Воспроизведение 141, 391–396. ( 10.1530/REP-10-0530) [PubMed] [CrossRef] [Google Scholar]
88. Martin RD.
2007.
Эволюция репродукции человека: приматологическая перспектива. Являюсь. Дж. Физ. Антропол.
45, 59–84. ( 10.1002/ajpa.20734) [PubMed] [CrossRef] [Google Scholar]
Martin RD.
2007.
Эволюция репродукции человека: приматологическая перспектива. Являюсь. Дж. Физ. Антропол.
45, 59–84. ( 10.1002/ajpa.20734) [PubMed] [CrossRef] [Google Scholar]
89. Crosley EJ, Elliot MG, Christians JK, Crespi BJ. 2013. Плацентарная инвазия, риск преэклампсии и адаптивная молекулярная эволюция при происхождении человекообразных обезьян: данные полногеномного анализа. Плацента 34, 127–132. ( 10.1016/j.placenta.2012.12.001) [PubMed] [CrossRef] [Google Scholar]
90. Jauniaux E, Poston L, Burton GJ. 2006. Заболевания беременных, связанные с плацентой: участие окислительного стресса и последствия в эволюции человека. Гум. Воспр. Обновлять 12, 747–755. ( 10.1093/humupd/dml016) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6 Функции плаценты во время беременности и проблемы с плацентой
Плацента отвечает за обеспечение жизненно важным кислородом и питательными веществами, в которых нуждается растущий плод. .
Подтверждено исследованиями
MomJunction верит в предоставление вам надежной информации, подтвержденной исследованиями. В соответствии с нашими строгими требованиями редакционной политики мы основываем наши статьи о здоровье на ссылках (цитатах), взятых с авторитетных сайтов, международных журналов и научных исследований. Однако, если вы обнаружите какие-либо несоответствия, не стесняйтесь писать нам.
В соответствии с нашими строгими требованиями редакционной политики мы основываем наши статьи о здоровье на ссылках (цитатах), взятых с авторитетных сайтов, международных журналов и научных исследований. Однако, если вы обнаружите какие-либо несоответствия, не стесняйтесь писать нам.
Изображение: Shutterstock
Плацента — это орган, который развивается в стенке матки, когда женщина беременна. Важнейшие функции плаценты во время беременности включают рост и развитие плода (1). Он отвечает за перенос кислорода и питательных веществ к плоду и удаление отходов из крови плода.
Плацента – орган жизнеобеспечения растущего плода; однако иногда его функции могут быть нарушены из-за нескольких факторов, таких как тромбы, травма живота и артериальное давление. Эти факторы могут привести к осложнениям беременности.
Этот пост информирует вас о функциях плаценты, проблемах, связанных с ней, симптомах таких осложнений и способах снижения риска.
Почему важна плацента?
Плацента является системой жизнеобеспечения будущего ребенка и играет ключевую роль в его развитии.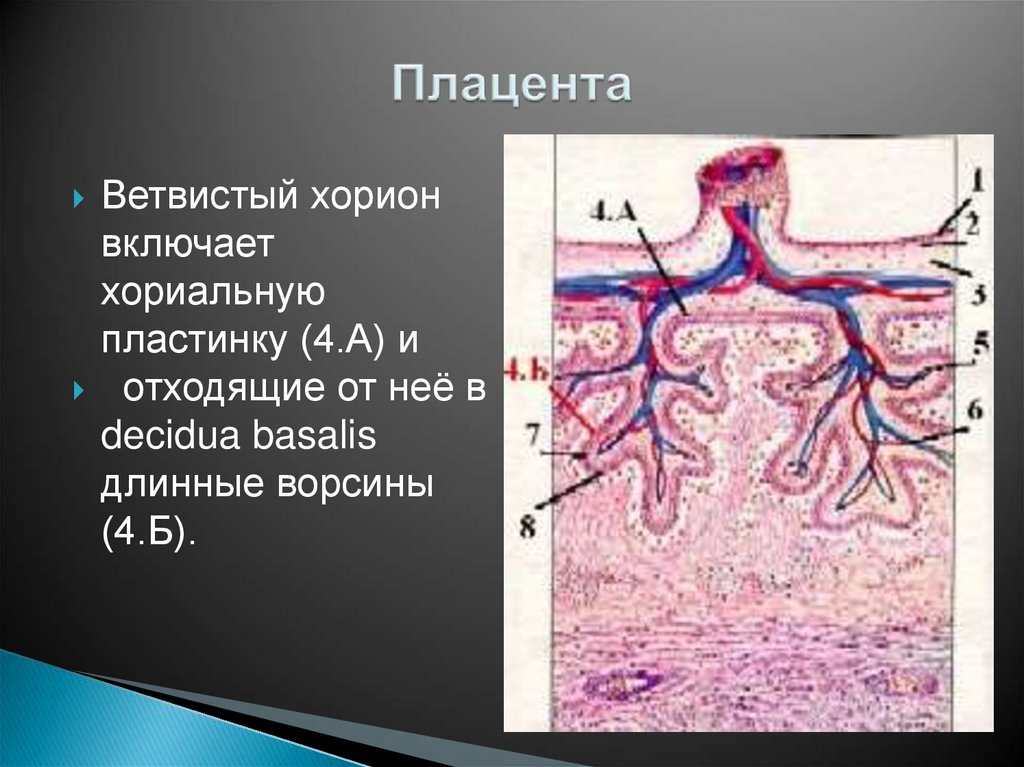 Он соединяет мать с плодом через пуповину и выполняет функции, которые ваш плод не может выполнять сам по себе (2).
Он соединяет мать с плодом через пуповину и выполняет функции, которые ваш плод не может выполнять сам по себе (2).
Краткий факт
К концу первого триместра плацента берет на себя производство гормонов из желтого тела. У большинства женщин тошнота при беременности проходит, как только плацента начинает вырабатывать гормоны (23).
Функции плаценты во время беременности
Плацента выполняет функции таких органов, как легкие, почки и печень, пока они не разовьются у плода. Некоторые из основных функций, которые выполняет плацента, включают (1) (3):
Изображение: iStock
Что нужно знать
Плацента вырабатывает гормон, подавляющий выработку молока во время беременности (23).
Связанный: Задержка роста плода: причины, диагностика и связанные с этим риски
Факторы, влияющие на функцию плаценты
Изображение: Shutterstock
Различные факторы могут влиять на функцию плаценты во время беременности и подвергать мать определенным рискам. Они могут включать:
Они могут включать:
См. также: Планы диеты для беременных женщин с избыточным весом – все, что вам нужно знать
Проблемы, связанные с плацентой
Некоторые из возможных проблем, связанных с плацентой, включают:
Связанный: Таблица раскрытия шейки матки: признаки, этапы и процедура проверки
Краткая информация
Если у вас проблемы с плацентой, врачи могут посоветовать индукцию родов, преждевременные роды, постельный режим и кесарево сечение, в зависимости от тяжести состояния (23).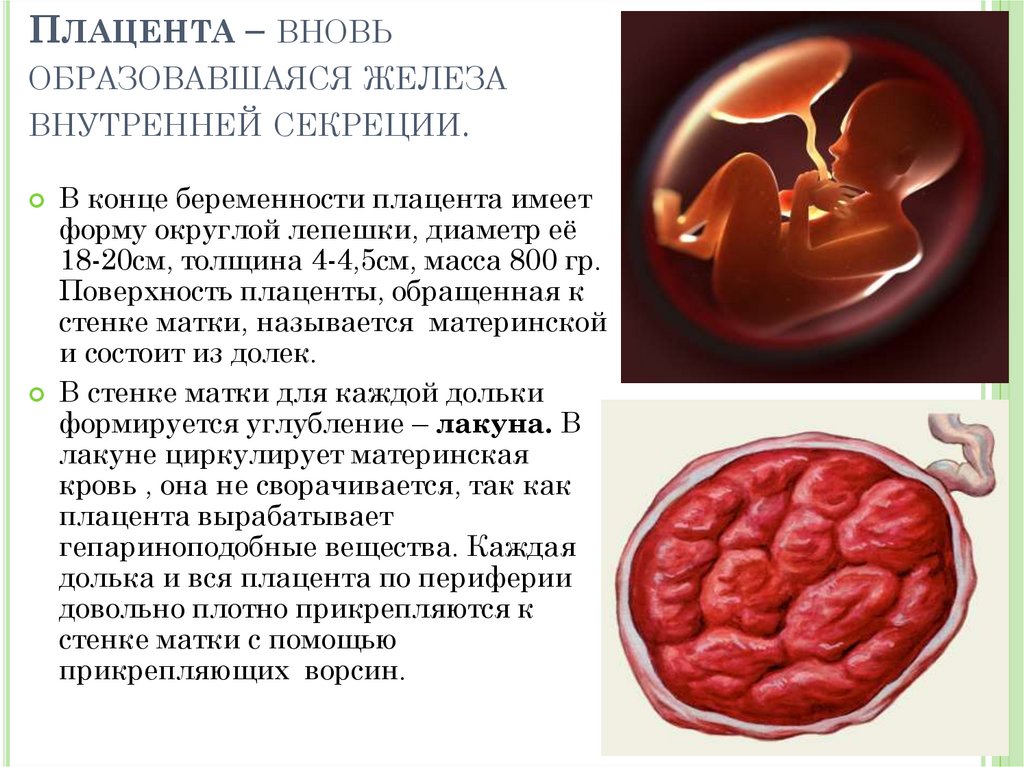
Каковы признаки и симптомы проблем с плацентой?
Изображение: Shutterstock
Признаки и симптомы, которые могут указывать на проблемы с плацентой, включают:
Вам следует обратиться к врачу, если вы начинаете испытывать эти симптомы внезапно и часто.
Связанный: Боль в животе во время беременности: причины и как ее облегчить
Можете ли вы снизить риск плацентарных проблем?
Возможно, вы не сможете предотвратить некоторые проблемы с плацентой. Но вы можете принять несколько мер для здоровой беременности.
Изображение: iStock
Как доставляется плацента?
Обычно бывают легкие сокращения (иногда их может и не быть), которые могут помочь плаценте отделиться от стенки матки и пройти по родовым путям.
При вагинальных родах третий период родов начинается с родов и заканчивается плацентарным родоразрешением. Ваш лечащий врач может ввести вам питоцин (окситоцин), чтобы вызвать сокращение матки и ускорить изгнание плаценты (20).
При кесаревом сечении врач физически удаляет плаценту перед закрытием разреза. Оставшиеся фрагменты удаляют, чтобы предотвратить инфекцию и кровотечение (21).
Проверяет ли врач наличие аномалий плаценты даже при отсутствии симптомов?
Изображение: iStock
Во время регулярных ультразвуковых исследований лечащий врач проверяет наличие всех возможных аномалий плаценты. Плацентарные заболевания, вероятно, связаны с вагинальным кровотечением, и важно обратиться за медицинской помощью.
Плацентарные заболевания, вероятно, связаны с вагинальным кровотечением, и важно обратиться за медицинской помощью.
1. Когда полностью формируется плацента?
Плацента полностью формируется к 18–20 неделям беременности и продолжает расти на протяжении всей беременности. Во время доставки он, вероятно, будет весить около одного фунта (22).
2. Является ли плацента частью ребенка или матери?
Плацента является фетоматеринским органом, состоящим из двух частей: плодной плаценты, развивающейся из той же бластоцисты, которая образует плод (ворсинчатый хорион), и материнской плаценты, развивающейся из ткани материнской матки (decidua basalis).
3. Какое положение плаценты лучше всего подходит для нормальных родов?
В некоторых случаях положение плаценты может не вызывать беспокойства. Переднее положение плаценты — плацента перед желудком — может затруднить прослушивание тонов сердца плода.
Плацента поддерживает жизнь ребенка в утробе матери. Он предлагает ребенку питание и выполняет все необходимые функции, которые ребенок не может сделать сам. Следовательно, обеспечение правильного функционирования плаценты имеет важное значение для жизнеспособности беременности. Регулярные предродовые осмотры и отказ от курения, алкоголя и запрещенных наркотиков — вот несколько способов предотвратить некоторые проблемы с плацентой. Держите своего врача в курсе любых проблем с плацентой или маткой, чтобы он мог лучше направлять вас.
Он предлагает ребенку питание и выполняет все необходимые функции, которые ребенок не может сделать сам. Следовательно, обеспечение правильного функционирования плаценты имеет важное значение для жизнеспособности беременности. Регулярные предродовые осмотры и отказ от курения, алкоголя и запрещенных наркотиков — вот несколько способов предотвратить некоторые проблемы с плацентой. Держите своего врача в курсе любых проблем с плацентой или маткой, чтобы он мог лучше направлять вас.
Ссылки:
Статьи MomJunction написаны на основе анализа исследовательских работ авторов-экспертов и учреждений. Наши ссылки состоят из ресурсов, установленных властями в соответствующих областях. Вы можете узнать больше о достоверности информации, которую мы представляем в нашей редакционной политике.
1. Гудэ Н.М. и др.; Рост и функция нормальной плаценты человека; Исследование тромбоза (2004).
2. Ван И и Чжао С; Глава 2 – Плацентарное кровообращение; Сосудистая биология плаценты; Морган и Клейпул Лайф Сайенсиз; (2010).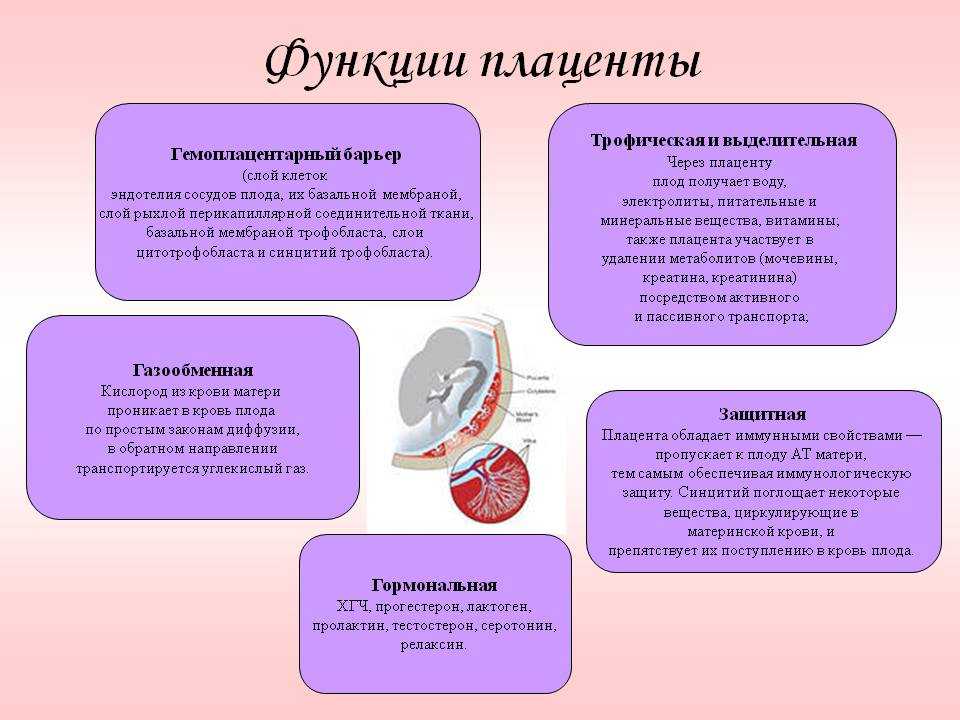
3. Грэм Дж. Бертон и Эбигейл Л. Фоуден; Плацента: многогранный преходящий орган; Философские труды Королевского общества B: биологические науки (2015).
4. Преклонный возраст матери; Детская больница Техаса – павильон для женщин
5. Осложнения многоплодной беременности; Медицинский центр Университета Рочестера
6. Преждевременный разрыв плодных оболочек (PROM)/Преждевременный преждевременный разрыв плодных оболочек (PPROM); Детская больница Филадельфии
7. Свертывание крови и беременность; Американское общество гематологов
8. Lavin JP и Polsky SS; травма живота во время беременности; Клиника перинатологии (1983).
9. Кимберли М. Ратбан и Джейсон П. Хильдебранд; Аномалии плаценты; Остров сокровищ (Флорида): StatPearls Publishing (2020).
10. Тайяба Маджид и др.; Частота предлежания плаценты в матке с ранее рубцами и без рубцов; Пакистанский журнал медицинских наук (2015 г. ).
).
11. Хаттак С.Н. и др.; Ассоциация материнской гипертонии с отслойкой плаценты; Журнал Аюбского медицинского колледжа в Абботтабаде (2012 г.).
12. Пунам Сачдева, Б.Г. Патель и Б.К. Патель; Употребление наркотиков во время беременности; точка для размышления; Индийский журнал фармацевтических наук (2009 г.).
13. Отслойка плаценты; Лучший канал здоровья; Правительство штата Виктория, Австралия
14. Предлежание плаценты; Министерство здравоохранения и социальных служб США, Национальные институты здравоохранения Abdulrahman Abdulelah Almnabri et al.; Управление предлежанием плаценты во время беременности; Египетский журнал больничной медицины (2017)
15. Приросшая плацента; USF Health Obstetrics and Gynecology
16. Эндрю Д. Уикс; Задержанная плацента; Африканские науки о здоровье (2001 г.).
17. Уша Кришна и Сарита Бхалерао; плацентарная недостаточность и задержка роста плода; J Obstet Gynaecol Индия (2011).
18. Шумайла Зия; расположение плаценты и исход беременности; Журнал Турецко-немецкой гинекологической ассоциации (2013 г.).
19. Модуль родовспоможения: 6. Активное ведение третьего периода родов; Открытый университет
20. Кесарево сечение; Stanford Children’s Health
21. Стадии развития плода; Руководство Merck
22. Плацента и экстраэмбриональные оболочки; Анатомия; Медицинская школа Мичиганского университета
23. Плацента; Клиника Кливленда
Следующие две вкладки изменяют содержимое ниже.
10 общих правил безопасности, которым вы должны научить своих детей
Что такое молочница у младенцев? Причины, симптомы и лечение
Что такое молочница у младенцев? Причины, симптомы и лечение
Первый период после выкидыша: сроки и советы, чтобы следовать
Первый период после выкидыша: сроки и советы, чтобы следовать
23 Советы для путешествий с ребенком

 Иногда это может привести к прекращению кровоснабжения и представлять опасность для ребенка (7).
Иногда это может привести к прекращению кровоснабжения и представлять опасность для ребенка (7).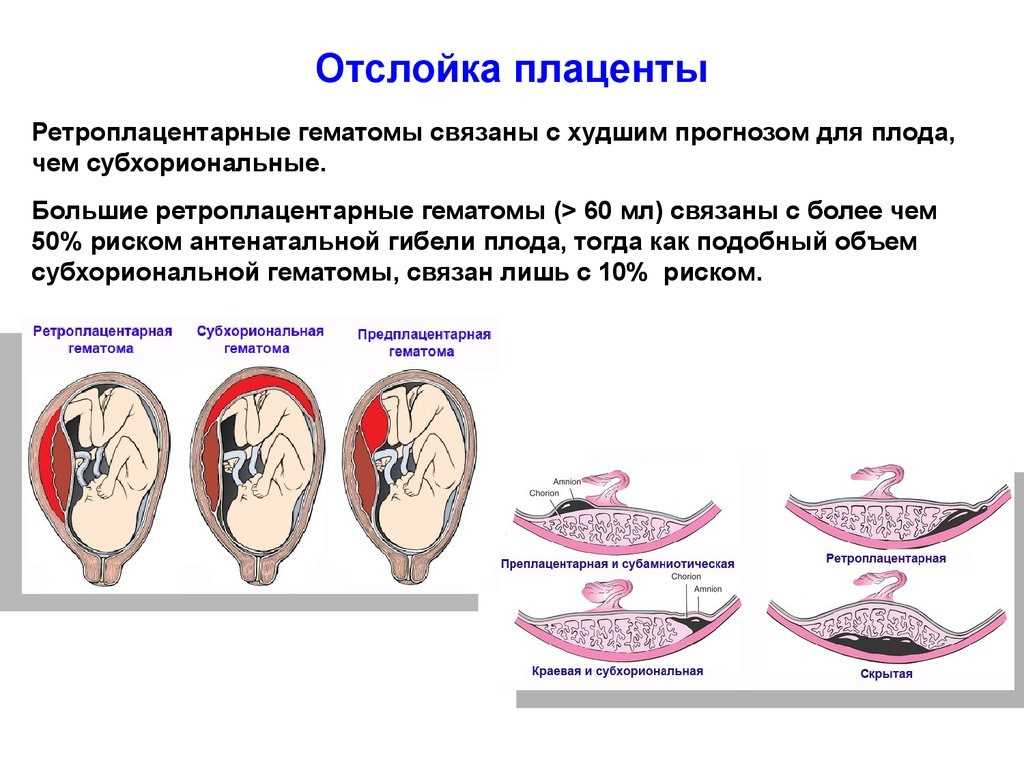
 Это может привести к вагинальному кровотечению во время и после родов (16).
Это может привести к вагинальному кровотечению во время и после родов (16).