Никотиновая кислота и ее производные » Справочник ЛС
ГлавнаяСправочник АТХ
C10AD
C10AГипохолестеринемические и гипотриглицеридемические препараты
C10ADНикотиновая кислота и ее производные
C10AD01Niceritrol
C10AD02Nicotinic acid
C10AD03Nicofuranose
C10AD04Aluminium nicotinate
C10AD05Nicotinyl alcohol (pyridylcarbinol)
C10AD06Acipimox
C10AD52Никотиновая кислота в комбинациях
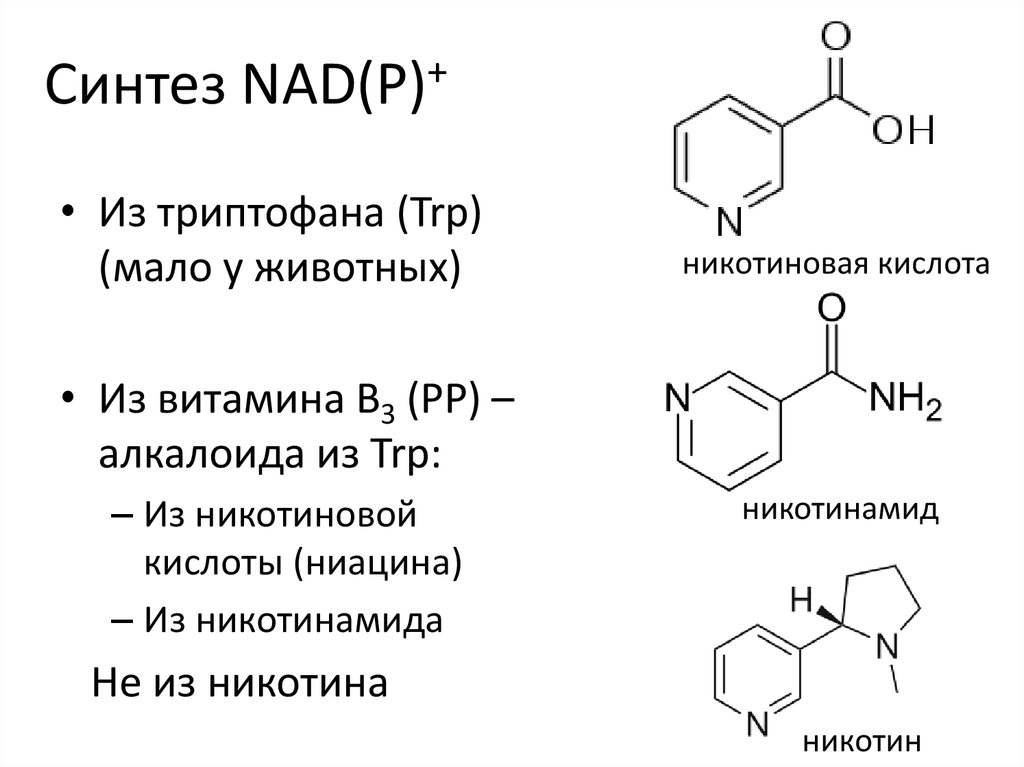
Никотиновая кислота (НК) (ниацин) уменьшает содержание в плазме крови ЛПОНП, в меньшей степени ЛПНП и ЛППП. Уровень триглицеридов начинает снижаться раньше (через 1-4 дня), чем холестерина (на 5-7-й день). Кислота никотиновая угнетает липолиз в жировой ткани (благодаря активации фосфодиэстеразы уменьшается содержание цАМФ, что понижает активность внутриклеточной липазы). При этом содержание в крови жирных кислот и их поступление к печени снижаются. Естественно, это сказывается на биосинтезе триглицеридов и ЛПОНП2. Содержание ЛПОНП и ЛПНП в плазме уменьшается. При длительном применении кислота никотиновая повышает уровень ЛПВП. Основными показаниями к назначению этого ЛС являются гипертриглицеридемия, умеренно повышенный уровень ХС ЛПНП и гипоальфалипопротеинемия. В клинической практике применяют саму НК, ее производные (аципимокс) и формы с медленным высвобождением лекарственного вещества. В США используется фиксированная комбинация НК и ловастатина.
Содержание ЛПОНП и ЛПНП в плазме уменьшается. При длительном применении кислота никотиновая повышает уровень ЛПВП. Основными показаниями к назначению этого ЛС являются гипертриглицеридемия, умеренно повышенный уровень ХС ЛПНП и гипоальфалипопротеинемия. В клинической практике применяют саму НК, ее производные (аципимокс) и формы с медленным высвобождением лекарственного вещества. В США используется фиксированная комбинация НК и ловастатина.
Механизм действия НК связан с ингибированием липолиза в адипоцитах. В результате чего происходит снижение поступления в печень свободных жирных кислот, которые являются субстратом для синтеза ЛПОНП. Таким образом, НК влияет на обмен липидов за счет ингибирования в печени продукции ЛПОНП, что приводит к снижению уровня ХС ЛПНП. Повышение уровня ХС ЛПВП (в основном за счет фракции ЛПВП2) на фоне применения НК максимально. Возможно и относительное повышение уровня ХС ЛПВП за счет уменьшения пула частиц насыщенных ТГ. Прием НК в суточной дозе 3,0—6,0 г приводит к снижению уровней общего ХС и ХС ЛПНП на 10—20%; ТГ — на 20—80%, ЛП- а — на 30% и повышению уровня ХС ЛПВП на 25—50%.
Плейотропные эффекты НК связаны с периферической вазодилатацией, которая в основном проявляется в кожных сосудах, а не в артериях мелкого и среднего калибра. Дилатация кожных сосудов — следствие выброса простагландинов (простациклин, простагландин D2
 В больших дозах НК снижает экскрецию мочевой кислоты (может спровоцировать приступ подагры) и ухудшает толерантность к глюкозе.
В больших дозах НК снижает экскрецию мочевой кислоты (может спровоцировать приступ подагры) и ухудшает толерантность к глюкозе.НК хорошо и быстро всасывается из желудочно-кишечного тракта, быстро абсорбируется — примерно 60—76% от принятой дозы. Максимальная концентрация в плазме крови достигается через 30—60 мин после приема обычных форм НК и через 4—5 ч после приема форм с замедленным высвобождением НК. До 90% принятого внутрь ЛС выделяются с мочой, как в неизменном виде, так и в виде метаболитов. Клиническое действие НК более выражено у женщин, чем у мужчин, ввиду половых различий в метаболизме этого ЛС. Как витамин НК назначают в дозах 1— 5 мг/сут. Для получения гиполипидемического эффекта требуются гораздо более высокие дозы.
Применение НК в терапии и кардиологии показано при лечении I, III, IV и V типов дислипидемий, изолированной гипоальфалипопротеинемии (снижение уровня ХС ЛПВП). НК может успешно применяться при смешанной ГЛП с умеренным повышением уровня общего ХС плазмы, особенно если при этом концентрация ХС ЛПВП снижена. При выраженной гиперхолестеринемии НК может быть назначена с аспирином, нитратами, β- блокаторами и ингибиторами ангиотензинпревращающего фермента при лечении больных со стабильной стенокардией напряжения и сопутствующем повышении уровня ХС ЛПНП более 130 мг/дл (3,4 ммоль/л). НК показана при лечении больных с дислипидемией и атеросклерозом нижних конечностей. Для повышения уровня ХС ЛПВП достаточно ежедневного приема 1 г НК. Для воздействия на другие фракции липопротеидов требуются гораздо более высокие дозы 4—6 г/сут.
При выраженной гиперхолестеринемии НК может быть назначена с аспирином, нитратами, β- блокаторами и ингибиторами ангиотензинпревращающего фермента при лечении больных со стабильной стенокардией напряжения и сопутствующем повышении уровня ХС ЛПНП более 130 мг/дл (3,4 ммоль/л). НК показана при лечении больных с дислипидемией и атеросклерозом нижних конечностей. Для повышения уровня ХС ЛПВП достаточно ежедневного приема 1 г НК. Для воздействия на другие фракции липопротеидов требуются гораздо более высокие дозы 4—6 г/сут.
Применение кислоты никотиновой ограничивают ее побочные эффекты – гиперемия кожи, зуд, рвота, диарея, дисфункция печени, чувство жара. Покраснение кожи и чувство жара могут проявляться настолько сильно, что способны вызвать артериальную гипотонию и обмороки. Побочные действия на печень проявляются повышением активности аминотрансфераз (у 3—5% больных), в отдельных случаях развитием печеночной недостаточности. Неблагоприятные метаболические побочные эффекты включают ухудшение углеводного обмена (у 10% пациентов), гиперурикемию (у 5—10% пациентов), вплоть до обострения подагры. Миопатия встречается нечасто на фоне монотерапии НК, но развивается гораздо чаще при комбинированной терапии со статинами и фибратами.
Миопатия встречается нечасто на фоне монотерапии НК, но развивается гораздо чаще при комбинированной терапии со статинами и фибратами.
Другие побочные эффекты, включая обострение язвенной болезни желудка, наджелудочковые аритмии, абдоминальный дискомфорт, наблюдаются у 20% пациентов. На фоне лечения НК нередко возникают кожные побочные эффекты — сухость, ихтиоз и acantosis nigricans. Кроме того, у НК описаны такие побочные эффекты, как головокружение, головная боль (у 4—11% пациентов), мигрень, астения, повышенная нервная возбудимость, панические эпизоды, тошнота, рвота, холестаз, токсическая амблиопия, двоение в глазах, ослабление и потеря центрального зрения, импотенция.. Для снижения выраженности побочного действия кислоты никотиновой синтезированы ее малорастворимые соли, эфиры, амиды, медленно гидролизующиеся до кислоты, но длительно поддерживающие определенный ее уровень в крови. Наиболее эффективными из них оказались пиридилкарбинол (роникол), холексамин.
Кроме того, нашли применение такие производные кислоты никотиновой, как ксантинола никотинат и инозитолникотинат, а также более точного выполнения больными назначенной схемы лечения – рекомендовано размельчить таблетку НК перед употреблением и принимать ЛС только с пищей.
До назначения НК в качестве гиполипидемического средства следует активно использовать все немедикаментозные методы нормализации уровня. Перед назначением НК необходимо оценить липидный спектр крови, проводить анализы для оценки активности ферментов печени и тщательно контролировать эти показатели в течение всего периода лечения.
Лечение НК противопоказано при язве желудка, желудочных кровотечениях в анамнезе. Особую осторожность при назначении следует соблюдать, если в анамнезе у пациента имеются указания на рабдомиолиз, болезни печени, нестабильную стенокардию, геморрагический диатез. Относительными противопоказаниями к назначению НК служат артериальная гипотония, подагра, сахарный диабет 2-го типа. Формы с замедленным высвобождением НК не должны назначаться людям моложе 18 лет, а комбинированные ЛС, содержащий НК и статины — лицам моложе 21 года.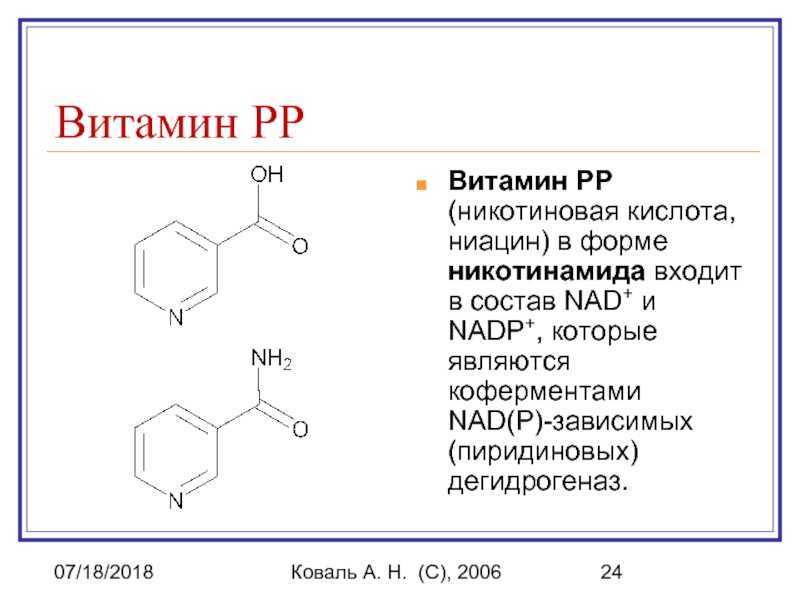
Механизм действия НК связан с ингибированием липолиза в адипоцитах. В результате чего происходит снижение поступления в печень свободных жирных кислот, которые являются субстратом для синтеза ЛПОНП. Таким образом, НК влияет на обмен липидов за счет ингибирования в печени продукции ЛПОНП, что приводит к снижению уровня ХС ЛПНП. Повышение уровня ХС ЛПВП (в основном за счет фракции ЛПВП2) на фоне применения НК максимально. Возможно и относительное повышение уровня ХС ЛПВП за счет уменьшения пула частиц насыщенных ТГ. Прием НК в суточной дозе 3,0—6,0 г приводит к снижению уровней общего ХС и ХС ЛПНП на 10—20%; ТГ — на 20—80%, ЛП- а — на 30% и повышению уровня ХС ЛПВП на 25—50%. Формы с замедленным высвобождением НК несколько лучше переносятся, но менее эффективны. Повышение уровня ХС ЛПВП зависит от исходной концентрации этого липопротеида в крови; этот эффект максимален при нормальном уровне ХС ЛПВП. Снижение уровня ЛП- а зависит от дозы и достигает 36—40%. Снижение уровня ТГ проявляется в первые 1—4 дня, а уровней общего ХС и ХС ЛПНП — гораздо позднее (после 3— 5 нед лечения НК).
Плейотропные эффекты НК связаны с периферической вазодилатацией, которая в основном проявляется в кожных сосудах, а не в артериях мелкого и среднего калибра. Дилатация кожных сосудов — следствие выброса простагландинов (простациклин, простагландин D
«Политика конфиденциальности»
Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
Использование никотинамида при лечении инсулинзависимого сахарного диабета в дебюте заболевания | Горелышева
В последние годы стало очевидным, что ведущую роль в развитии инсулинзависимого сахарного диабета (ИЗСД) играют аутоиммунные механизмы. По современным представлениям ИЗСД является классическим органоспецифическим аутоиммунным заболеванием, при котором р-клет- ки разрушаются с участием механизмов, опосредованных Т-лимфоцитами и циркулирующими аутоантителами. Однако имеются экспериментальные доказательства, что первичным механизмом повреждения р-клетки является действие цитокинов. Таким образом, разрушение р-клеток происходит в две фазы: первая — независимая от лимфоцитов, начальная, вторая — опосредованная действием Т-лимфоцитов.
Согласно Копенгагенской модели патогенеза ИЗСД {38], факторы внешней и внутренней среды (вирусы, химические вещества, пищевые факторы, интерлейкин-1) вызывают активацию процесса свободнорадикального окисления в р-клетках. Под воздействием свободных радикалов (О2 , NO) белки р-клетки меняют свои природные свойства («денатурируют») и становятся антигенами для собственной иммунной системы. —) и окись азота (NO) вызывают нарушения в структуре ДНК инсулинпродуцирующих клеток, стимулируют патологическую активацию по- ли(АДф-рибоз)синтетазы, ответственной за репликацию ДНК, что приводит к повышению утилизации НАД+ с последующим истощением его запасов в клетке: это является причиной снижения синтеза протеинов, включая проинсулин, и последующей гибели р-клетки.
—) и окись азота (NO) вызывают нарушения в структуре ДНК инсулинпродуцирующих клеток, стимулируют патологическую активацию по- ли(АДф-рибоз)синтетазы, ответственной за репликацию ДНК, что приводит к повышению утилизации НАД+ с последующим истощением его запасов в клетке: это является причиной снижения синтеза протеинов, включая проинсулин, и последующей гибели р-клетки.
Среди возможных средств фармакологической регуляции свободнорадикальных процессов в организме могут быть использованы различные вещества, в частности витамины (сс-токоферола ацетат, никотинамид, аскорбиновая кислота) и др.
Одним из наиболее интересных и перспективных препаратов, которые могут быть применены не только для лечения ИЗСД, но и для его профилактики, является никотинамид. В 1947 г. A. Lazarow [32] первым сообщил о том, что введение крысам никотинамида предотвращает развитие аллоксанового диабета. Дальнейшее изучение препарата стало возможным после разработки экспериментальных моделей ИЗСД [43].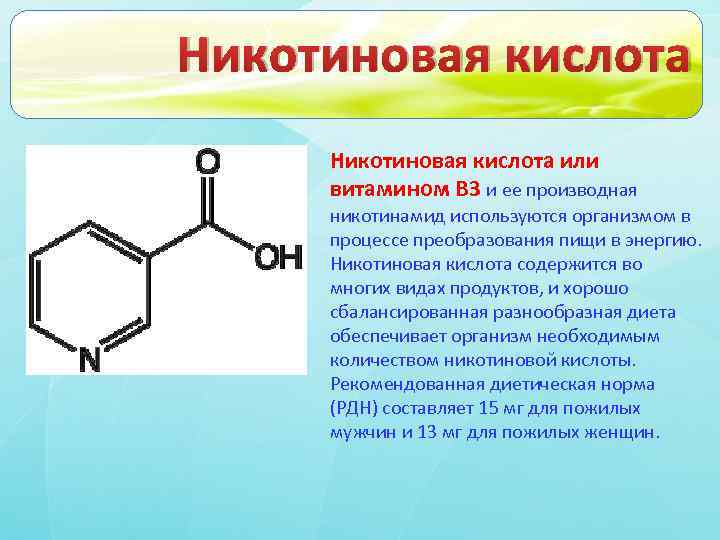
Никотинамид (амид никотиновой кислоты) по строению и действию близок к никотиновой кислоте и рассматривается как витамин РР. Суточная потребность в никотинамиде составляет около 20 мг. Фармакокинетика препарата в настоящее время изучается. Известно, что период полувыведения составляет 9 ч. Никотинамид накапливается преимущественно в печени и эритроцитах [45].
Имеется много экспериментальных данных, подтверждающих, что никотинамид в отличие от никотиновой кислоты замедляет или приостанавливает развитие диабета у NOD-мышей [20, 37], а также развитие инсулита под действием малых доз стрептозотоцина [51].
Установлено также, что никотинамид подавляет отторжение пересаженных р-клеток у NOD- мышей [39] и благоприятствует регенерации островковых клеток у крыс с частичной панкреатэк- томией [27, 61].
Одним из механизмов действия никотинамида является ингибирование патологической активности полиаденозиндифосфатрибозсинтетазы, следующей за поражением ДНК р-клеток свободными радикалами кислорода [40, 51]. Такое подавление позволяет избежать уменьшение содержания НАД+ в р-клетке, что благоприятно влияет на синтез проинсулина. Доказано, что никотинамид также ингибирует (in vitro) активированные макрофаги, выделяющие огромное количество свободных радикалов, повреждающих р-клетки [29, 31, 36]. Экспериментально установлено, что преинкубация с никотинамидом защищает ДНК и митохондрии р-клеток от повреждения свободными радикалами [15, 30].
Такое подавление позволяет избежать уменьшение содержания НАД+ в р-клетке, что благоприятно влияет на синтез проинсулина. Доказано, что никотинамид также ингибирует (in vitro) активированные макрофаги, выделяющие огромное количество свободных радикалов, повреждающих р-клетки [29, 31, 36]. Экспериментально установлено, что преинкубация с никотинамидом защищает ДНК и митохондрии р-клеток от повреждения свободными радикалами [15, 30].
Высокие дозы никотинамида не оказывают токсического действия на островковые клетки. Напротив, никотинамид способствует сохранению структуры клетки, стимулирует синтез инсулина и является сильным ингибитором роста соединительной ткани [55].
Недавно были получены данные о том, что никотинамид способен блокировать nitric oxide (NO)-синтетазу, препятствуя таким образом накоплению токсичных NO-радикалов — важного элемента аутоиммунного поражения р-клеток [13, 17, 28].
Исследования ряда авторов [1, 2, 4] подтверждают, что способность никотинамида тормозить окисление липидов в микросомах обусловлена взаимодействием его с цитохромом Р-450. Однако связывание цитохрома Р-450 с никотинамидом, по-видимому, не является единственным механизмом его антиокислительного действия. Никотинамид в концентрациях 50 и 100 мМ способен значительно подавлять хемилюминесценцию не только в микросомальной фракции, но и в плазме крови. На основании этих данных можно предположить, что одним из механизмов антиоксидантного действия никотинамида является его способность непосредственно взаимодействовать с гидроперекисями липидов с образованием в этих реакциях N-оксида никотинамида [1]. Имеются сообщения о том, что никотинамид служит блокатором гидроксильных радикалов (ОН—) [24, 33, 59].
Однако связывание цитохрома Р-450 с никотинамидом, по-видимому, не является единственным механизмом его антиокислительного действия. Никотинамид в концентрациях 50 и 100 мМ способен значительно подавлять хемилюминесценцию не только в микросомальной фракции, но и в плазме крови. На основании этих данных можно предположить, что одним из механизмов антиоксидантного действия никотинамида является его способность непосредственно взаимодействовать с гидроперекисями липидов с образованием в этих реакциях N-оксида никотинамида [1]. Имеются сообщения о том, что никотинамид служит блокатором гидроксильных радикалов (ОН—) [24, 33, 59].
Таким образом, никотинамид, тормозя аутоиммунные процессы и снижая активность перекисного окисления липидов, оказывает защитное действие на р-клетки, воздействуя тем самым на два направления патогенетической цепи в развитии заболевания.
Помимо указанных свойств, никотинамид является одним из активных ингибиторов липаз и фосфолипаз [8]. Он предотвращает рост концентрации свободных жирных кислот и тем самым их повреждающее действие на клеточные мембраны. Препарат способствует нормализации внутриклеточной регуляции углеводного обмена [9]. Составными частями гипогликемизирующего действия никотинамида являются ингибирование ключевых ферментов глюконеогенеза в печени крыс, что определяется повышением окислительных свойств NAD-nap цитоплазмы гепатоцитов; повышение чувствительности инсулиновых рецепторов; интенсификация процессов окисления глюкозы в инсулиннечувствительных тканях; усиление биосинтеза и секреции инсулина в неповрежденных р-клетках; участие в гормонально-постре- цепторных взаимодействиях. Никотинамид относят также к группе «антисорбитоловых» препаратов. Никотинамид повышает содержание окисленных форм (НАД и НАДФ) при практически неизмененном уровне восстановленных форм. Он вызывает сдвиг окислительно-восстановительного состояния никотинамидных коферментов в сторону возрастания окислительных свойств, что обусловливает угнетение образования сорбитола в альдозо-редуктазной реакции и активации его окисления в сорбитол-дегидрогеназной реакции.
Препарат способствует нормализации внутриклеточной регуляции углеводного обмена [9]. Составными частями гипогликемизирующего действия никотинамида являются ингибирование ключевых ферментов глюконеогенеза в печени крыс, что определяется повышением окислительных свойств NAD-nap цитоплазмы гепатоцитов; повышение чувствительности инсулиновых рецепторов; интенсификация процессов окисления глюкозы в инсулиннечувствительных тканях; усиление биосинтеза и секреции инсулина в неповрежденных р-клетках; участие в гормонально-постре- цепторных взаимодействиях. Никотинамид относят также к группе «антисорбитоловых» препаратов. Никотинамид повышает содержание окисленных форм (НАД и НАДФ) при практически неизмененном уровне восстановленных форм. Он вызывает сдвиг окислительно-восстановительного состояния никотинамидных коферментов в сторону возрастания окислительных свойств, что обусловливает угнетение образования сорбитола в альдозо-редуктазной реакции и активации его окисления в сорбитол-дегидрогеназной реакции. Это в конечном счете приводит к снижению содержания сорбитола [3, 10].
Это в конечном счете приводит к снижению содержания сорбитола [3, 10].
Таким образом, в настоящее время описано несколько механизмов действия никотинамида: уменьшение токсичного действия свободных радикалов кислорода [33, 59], улучшение секреции инсулина путем повышения содержания NAD+ в клетке. Никотинамид также способствует регенерации [3-клетки [42], предотвращает токсическое влияние NO на островковые клетки [28], а также снижает тормозящее влияние интерлейкина-lb на выделение инсулина р-клетками [16, 45]. Никотиновая кислота подобного действия не оказывает.
Никотинамид дает выраженный лечебный эффект при сахарном диабете. Опыт его использования у больных диабетом с ангиопатиями показал хорошие результаты [7].
Вместе с тем нам практически не встретилось отечественных работ, посвященных изучению действия никотинамида у больных с впервые выявленным ИЗСД, тогда как в современной зарубежной литературе этому вопросу уделяется большое внимание. Работы проводятся для изучения защитного действия никотинамида с целью сохранения секреторной способности р-клеток [18, 23, 35, 43, 45, 52, 53].
Хотя в экспериментальных работах давно была установлена способность никотинамида предотвращать разрушение р-клеток [32], клиническое его применение при сахарном диабете начато в середине 80-х годов. Одними из первых были опубликованы данные [52, 54] о том, что высокие дозы никотинамида (3 г в сутки) способствуют повышению частоты клинической ремиссии у больных с впервые выявленым ИЗСД, при этом отмечается значительное снижение суточной потребности в инсулине и достоверное увеличение секреции инсулина.
Спонтанное увеличение инсулиновой секреции, оцененное по уровню С-пептида, наблюдается у больных с впервые выявленным ИЗСД в начале лечения экзогенным инсулином [54], и это затрудняет оценку терапевтического эффекта никотинамида. Однако через 6 мес после клинического начала заболевания обычно отмечается неуклонное снижение секреции инсулина [50].
Р. Vague и соавт. применяли высокие дозы никотинамида у больных ИЗСД по истечении 2-лет- него периода болезни тогда, когда период ремиссии закончился [59]. Было отмечено, что и в этом случае уровень HbAlc был значительно ниже, а уровень базального и стимулированного С- пептида — существенно выше в группе больных, получавших 3 г никотинамида в сутки, по сравнению с группой контроля.
Было отмечено, что и в этом случае уровень HbAlc был значительно ниже, а уровень базального и стимулированного С- пептида — существенно выше в группе больных, получавших 3 г никотинамида в сутки, по сравнению с группой контроля.
Диапазон доз никотинамида, применяемых в лечебных целях при ИЗСД, довольно широк и колеблется от 200 мг/сут [46] до 3 г/сут [53]. Сообщается об эффективности других доз никотинамида: 1 г/сут [18], 1,5 г/сут [35]. Результаты, полученные исследователями, неоднозначны.
Большинство авторов отмечают значительное улучшение метаболического контроля, снижение потребности в инсулине, повышение уровней базального и стимулированного С-пептида, увеличение частоты ремиссии. Однако после отмены никотинамида все эти показатели значительно ухудшаются [5, 35, 46, 52, 53].
В то же время Н. Chase и соавт. [18] не обнаружили существенных различий в уровнях базального и стимулированного С-пептида, суточной потребности в инсулине, уровне HbAlc между пациентами, получавшими никотинамид, и контрольной группой. Аналогичные данные приводят Н. Ilkova и соавт. [26].
Аналогичные данные приводят Н. Ilkova и соавт. [26].
Отсутствие эффекта от применения никотинамида могло зависеть от нескольких факторов: возраста больных, остроты начала заболевания, поскольку известно, что в более молодом возрасте уменьшение массы функционирующих р-клеток происходит более быстро, достигая к концу первого года заболевания критических значений [41]. В этих случаях не приходится рассчитывать на успех [50, 58].
Эти данные были подтверждены в одной из последних работ группы исследователей под руководством Р. Pozzilli [45]. Авторами показано, что никотинамид может сохранить и улучшить функцию р-клеток у больных с началом заболевания в постпубертатном периоде (старше 15 лет). Несмотря на то что дозы никотинамида, применяемые для лечения больных с впервые выявленным ИЗСД, в 100—150 раз превышают суточную потребность в нем здорового человека, существенных побочных эффектов при его использовании не отмечено [42, 53].
С тех пор как никотинамид и никотиновая кислота были использованы для лечения шизофрении, литература по психиатрии является хорошим источником информации, касающейся побочного действия этих препаратов. Диапазон применяемых при этом доз был весьма широк и колебался от 3 до 12 г в сутки. Токсическое поражение печени встречалось крайне редко — описан только один случай из 6000 наблюдений [25]. Таким образом, по данным литературы, прием никотинамида в дозе 3 г в сутки относительно безопасен, хотя целесообразен регулярный контроль функции печени.
Диапазон применяемых при этом доз был весьма широк и колебался от 3 до 12 г в сутки. Токсическое поражение печени встречалось крайне редко — описан только один случай из 6000 наблюдений [25]. Таким образом, по данным литературы, прием никотинамида в дозе 3 г в сутки относительно безопасен, хотя целесообразен регулярный контроль функции печени.
Обсуждается вопрос о возможном канцерогенном действии никотинамида. Т. Yamagami и соавт. [60] показали, что никотинамид вместе с аллоксаном и стрептозотоцином оказывает канцерогенное действие у крыс. Однако впоследствии не сообщалось данных в отношении онкогенного действия никотинамида у животных [40]. Более того, исследования S. Le Doux [33], проведенные в культуре клеток инсулиномы крыс, показали, что прямые повреждения цепи ДНК в аллоксановой модели диабета уменьшались в присутствии никотинамида. Поэтому нет никаких веских аргументов, запрещающих применение никотинамида у больных ИЗСД [42, 53].
В настоящее время имеется два основных направления в исследовании свойств никотинамида. Первое — изучение эффективности никотинамида в доклинической стадии развития сахарного диабета у взрослых и детей [21, 22]. В стадии иммунологических нарушений, когда р-клетки еще не истощились и способны производить большое количество инсулина, никотинамид может быть особо эффективен [31, 34, 42]. Рекомендуется назначать никотинамид родственникам больных сахарным диабетом первой степени родства при выявлении у них высоких титров антител к р-клетке (ICA) — более 20 JDF units. Вместе с тем при уровне ICA 80 и более JDF препарат менее эффективен.
Первое — изучение эффективности никотинамида в доклинической стадии развития сахарного диабета у взрослых и детей [21, 22]. В стадии иммунологических нарушений, когда р-клетки еще не истощились и способны производить большое количество инсулина, никотинамид может быть особо эффективен [31, 34, 42]. Рекомендуется назначать никотинамид родственникам больных сахарным диабетом первой степени родства при выявлении у них высоких титров антител к р-клетке (ICA) — более 20 JDF units. Вместе с тем при уровне ICA 80 и более JDF препарат менее эффективен.
Второе направление — исследование эффективности никотинамида у больных с впервые выявленным ИЗСД в стадии клинической манифестации.
а) Необходимо определить достаточные и эффективные дозы, обеспечивающие наступление клинической ремиссии, сохранение остаточной инсулиновой секреции и улучшение метаболического контроля.
б) Следует изучить возможность сочетания с другими препаратами, в частности с иммуномодуляторами. В схемы лечения могут быть включены интенсифицированная инсулинотерапия [14, 48], низкие дозы циклоспорина А [56], глюкокортикоиды [57], ингибиторы свободных радикалов [44, 47], поскольку все эти препараты влияют на различные стадии инсулита.
Никотинамид и его сочетание с ос-токоферола ацетатом были нами применены в комплексной терапии больных с впервые выявленным ИЗСД [5, 6, 11, 12, 19, 49]. В группу обследованных был включен 61 пациент (33 женщины и 28 мужчин) в возрасте от 17 до 30 лет (21,4 ± 6,3 года). Длительность заболевания колебалась от 1 до 10 мес. Все больные исходно были в состоянии декомпенсации (HbAlc 10,9 ± 1,72%). Интеркуррент- ные заболевания и сосудистые осложнения отсутствовали. Все пациенты получали лечение диетой и инсулином (инсулин средней продолжительности действия дважды в день и короткого действия перед каждым приемом пищи).
Все больные были разделены на 4 группы методом случайной выборки.
В 1-й группе (п = 12), помимо традиционной инсулинотерапии, больным назначали ос-токоферола ацетат в дозе 10 мг на 1 кг массы тела в сутки (600—800 мг/сут) в течение 6 мес.
Во 2-й группе (и = И) больные получали никотинамид в дозе 20 мг на 1 кг массы тела в сутки (1600—1800 мг/сут) в течение того же периода.
В 3-й группе (п = 12) проведено лечение сочетанием вышеуказанных препаратов в тех же дозах.
В четвертой группе (п ■= 26) больные получали только инсулинотерапию. (В дальнейшем 8 человек были исключены в связи с отказом от обследования).
Об эффективности проводимого лечения судили по степени компенсации углеводного обмена (HbAlc), уровням базального и стимулированного пищевой нагрузкой С-пептида, суточной потребности в инсулине (доза инсулина на 1 кг массы тела), частоте развития клинической ремиссии.
Проведена оценка функциональной активности мононуклеарных клеток по способности секретировать интерлейкин-1 и содержанию этого цитокина в сыворотке крови.
При применении различных схем лечения нами были получены следующие результаты: отмечено достоверное повышение уровня стимулированного С-пептида в группах больных, получавших никотинамид и его сочетания с ос-токоферола ацетатом. После отмены антиоксидантов к концу первого года наблюдения достаточные уровни стимулированного С-пептида сохранялись в этих же группах. В группе больных, получавших монотерапию инсулином, отмечено неуклонное снижение уровня С-пептида.
В группе больных, получавших монотерапию инсулином, отмечено неуклонное снижение уровня С-пептида.
Лучшие показатели компенсации по уровню гликированного гемоглобина наблюдались в группах больных, получавших никотинамид и его сочетание с ос-токоферола ацетатом, но только в группе пациентов, получавших сочетание антиоксидантов, этот показатель приблизился к норме. После отмены антиоксидантов во всех группах отмечено ухудшение показателей компенсации.
Содержание интерлейкина-1 в сыворотке крови снизилось во всех группах обследованных, но максимально приблизилось к норме только в группе пациентов, которым был назначен никотинамид. Функциональная активность мононук- леарных клеток по способности секретировать интерлейкин-1 неуклонно нарастала у больных, получавших лечение только инсулином. Значительно меньшее нарастание этого показателя отмечено в группах пациентов, получавших антиоксиданты. Это увеличение было минимальным у больных, получавших, помимо инсулинотерапии, сочетание никотинамида и ос-токоферола ацетата. Полученные результаты позволили предположить, что применение никотинамида и его сочетание с ос-токоферола ацетатом может препятствовать развитию новой аутоиммунной атаки против оставшихся р-клеток.
Полученные результаты позволили предположить, что применение никотинамида и его сочетание с ос-токоферола ацетатом может препятствовать развитию новой аутоиммунной атаки против оставшихся р-клеток.
При применении антиоксидантов нами отмечено достоверное повышение активности защитных ферментов клетки (СОД и ГЛП), оно было наибольшим в группе пациентов, получавших сочетание антиоксидантов.
Критерием клинической ремиссии считали потребность в инсулине не более 0,4 ЕД на 1 кг массы тела при условии поддержания нормогликемии и агглюкозурии и уровня HbAlc < 6%. В группе пациентов, получавших монотерапию инсулином, ремиссия наступила в 17% наблюдений, при использовании ос-токоферола ацетата — в 33%, никотинамида — в 45%, и сочетания ос-токоферола ацетата и никотинамида — в 89% наблюдений.
В ходе нашего обследования мы не выявили побочных эффектов при применении достаточно больших доз указанных препаратов.
На основании полученных нами данных был сделан вывод о том, что применение в комплексной терапии впервые выявленного ИЗСД достаточных доз никотинамида и ос-токоферола ацетата вызывает увеличение секреции С-пептида, улучшение компенсации углеводного обмена, снижение потребности в инсулине, способствует развитию клинической ремиссии заболевания. Сдерживающий эффект сочетания никотинамида и ос-токоферола ацетата на функциональную активность мононуклеарных клеток может предотвратить развитие новой аутоиммунной атаки и защитить оставшиеся р-клетки от токсичных продуктов свободнорадикального окисления. Это позволяет предположить, что применение указанных препаратов необходимо на самых ранних этапах заболевания.
Сдерживающий эффект сочетания никотинамида и ос-токоферола ацетата на функциональную активность мононуклеарных клеток может предотвратить развитие новой аутоиммунной атаки и защитить оставшиеся р-клетки от токсичных продуктов свободнорадикального окисления. Это позволяет предположить, что применение указанных препаратов необходимо на самых ранних этапах заболевания.
Тем не менее на сегодняшний день остаются нерешенными многие вопросы как теоретического, так и практического плана. Необходимо разработать алгоритм применения никотинамида и ос- токоферола ацетата, уточнить длительность курсов и целесообразность их повторения, вопросы ежедневной и курсовой доз, необходимого и достаточного набора иммунологических, метаболических и функциональных маркеров для формирования групп высокого риска и дальнейшего слежения за эффективностью терапии.
Другой стороной проблемы является необходимость ранней профилактики сосудистых осложнений диабета. В этом смысле, учитывая их патогенез, антиоксидантные препараты незаменимы. Согласно нашим данным [11], уже в дебюте ИЗСД у ряда больных с поликлональной активацией иммунной системы, усилением процессов пероксидации липидов и ослаблением антиоксидантной защиты появляются условия для развития первых признаков сосудистых осложнений заболевания. Это делает необходимым назначение комплексной терапии никотинамидом и антиоксидантными препаратами уже в дебюте заболевания, что позволит улучшить течение заболевания и отсрочить развитие поздних сосудистых осложнений [45].
Согласно нашим данным [11], уже в дебюте ИЗСД у ряда больных с поликлональной активацией иммунной системы, усилением процессов пероксидации липидов и ослаблением антиоксидантной защиты появляются условия для развития первых признаков сосудистых осложнений заболевания. Это делает необходимым назначение комплексной терапии никотинамидом и антиоксидантными препаратами уже в дебюте заболевания, что позволит улучшить течение заболевания и отсрочить развитие поздних сосудистых осложнений [45].
1. Абакумов Г. 3., Бушма М. И., Лукиенко П. И. // Вопр. мед. химии. — 1988. — № 1. — С. 39—41.
2. Арчаков А. И. Микросомальное окисление. — М., 1975.
3. Великий Н. Н., Обросова И. Г., Ефимов А. С. // Вопр. мед. химии. — 1992. — № 4. — С. 45—52.
4. Владимиров Ю. А. Перекисное окисление липидов в биологических мембранах. — М., 1972.
5. Горелышева В. А. Перекисное окисление липидов и состояние антиокислительных ферментов у больных с впервые выявленным инсулинзависимым сахарным диабетом: Дис. … канд. мед. наук. — М., 1994. — С. 39—42.
… канд. мед. наук. — М., 1994. — С. 39—42.
6. Горелышева В. А., Смирнова О. М., Романовская Г. А., Филиппов И. К. // Клин, фармакол. и тер. — 1993. — №3. — С. 51-53.
7. Ефимов А. С. Диабетические ангиопатии. — М., 1989.
8. Меерсон Ф. З. Патогенез и предупреждение стрессорных и ишемических повреждений сердца. — М., 1984.
9. Обросова И. Г. Изучение действия никотинамида на сорбитоловый путь обмена глюкозы при экспериментальном диабете: Автореф. дис. … канд. мед. наук. — Киев, 1985.
10. Обросова И. Г., Великий Н. Н., Ефимов А. С. // Пробл. эндокринол. — 1988. — № 1. — С. 74—80.
11. Смирнова О. М. Клинические, иммуногенетические гормонально-метаболические аспекты впервые выявленного инсулинзависимого сахарного диабета (клиника, диагностика, лечение, профилактика): Дис. … д-ра мед. наук. — М., 1995.
12. Смирнова О. М., Горелышева В. А., Арбузова М. И. и др. // Симпозиум. Сахарный диабет сегодня: Материалы. — М., 1995. — С. 33.
13. Andersen Н. U., Jorgensen К. H., Egeberg J. // European Association for the Study of Diabetes. 29-th Annual Meeting Abstracts-Istanbul, 1993. — N 231. — P. A62.
U., Jorgensen К. H., Egeberg J. // European Association for the Study of Diabetes. 29-th Annual Meeting Abstracts-Istanbul, 1993. — N 231. — P. A62.
14. Brunetti P., Bolli G. B. // Immunotherapy of Type I Diabetes / Eds D. Andreani, H. Kolb, P. Pozzilli. — Chichester, 1989.
15. Burkard V., Fengler E. M., Kolb H. // Diabetologia. — 1992. — Vol. 35, Suppl. 1. — P. A215.
16. Buscema M., Vinci C, Gatta C. et al. // Metabolism. — 1992. — Vol. 41. — P. 296-300.
17. Cetkovic-Cvrlje M., Sandler S., Eizirik D. L. // European Association for the Study of Diabetes. 29-th Annual Meeting. Abstracts — Istanbul, 1993. — N 229. — P. A61.
18. Chase H. P., Batter-Simon N., Garg S. // Diabetologia. — 1990. — Vol. 33. — P. 444-446.
19. Dedov I. I., Gorelysheva V. A., Smirnova О. M. et al. // International Diabetes Congress: 15-th Abstracts. Kobe. — 1994. — P. 314.
20. Elliott R. B., Bibby N. J., Reddy S. // Immunology of Diabetes. (Proceedings. 19-th International Workshop) / Eds E.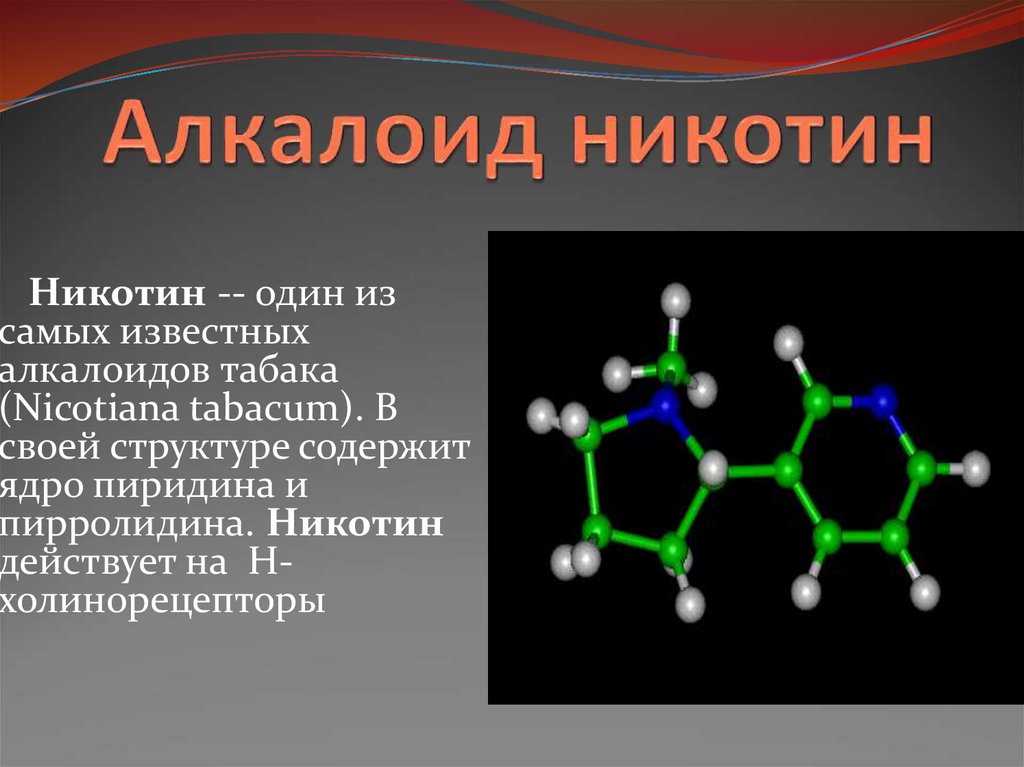 Shafir, P. Vardy. — Jerusalem, 1990. — P. 34.
Shafir, P. Vardy. — Jerusalem, 1990. — P. 34.
21. Elliott R. B., Chase H. P., Pilcher С. C. // The Immunology of Diabetes (9-th International Workshop) — Melbourne, 1988. — P. 18.
22. Elliott R. B., Chase H. P. // Diabetologia. — 1991. — Vol. 34. — P. 362-365.
23. Gorelysheva V. A., Smirnova О. M., Dedov I. I. // Horm. Metab. Res. — 1995. — Suppl. 1. — P. 14.
24. Grankvist K, Marklund S. L., Taljedal J.-B. // Biochem. J. — 1981. — Vol. 182. — P. 17-23.
25. Hoffer A. // Schizophrenia. — 1969. — Vol. 1. — P. 78—87.
26. Ilkova H, Gorpe U., Kadioglu P. et al. // International Congress of Endocrinology, 9-th: Abstracts. — Nice, 1992. — P. 376.
27. Jnone Y., Tanigawa K, Tamura K. et al. // Diabetologia. — 1992. — Vol. 35, Suppl. 1. — P. A115.
28. Kaliman B., Burkard U., Krancke K. D. et al. // Life Sci. — 1992. — Vol. 51. — P. 671-678.
29. Kolb H., Burkard V., Appels M. // J. Autoimmun. — 1990. — Vol. 3. — P. 1-4.
30. Kroncke K.-D., Funda J.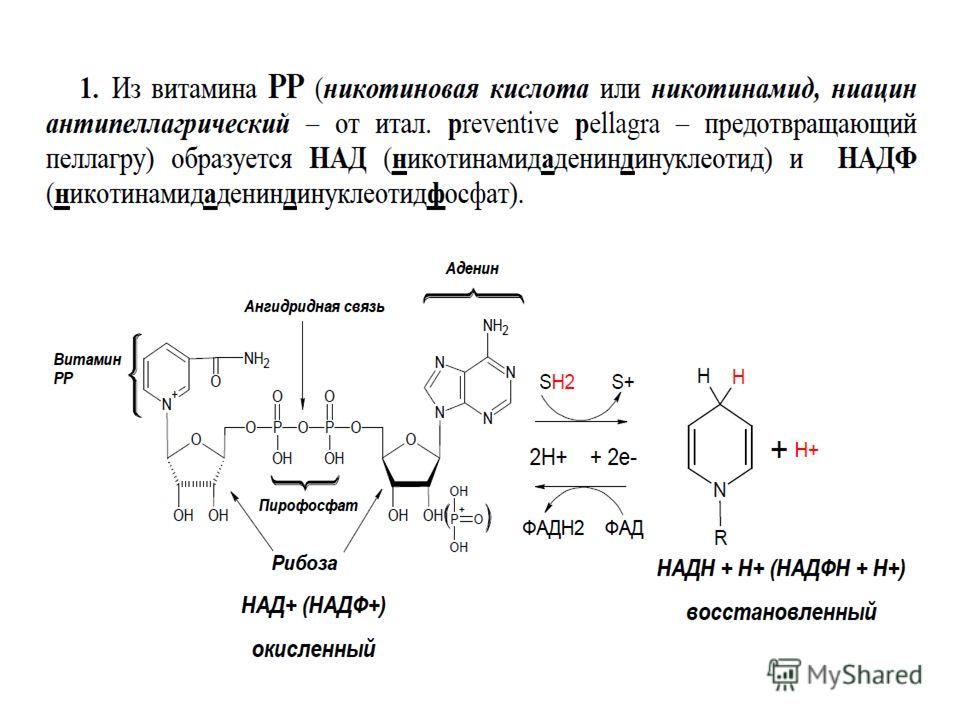 , Berschick B. // Diabetologia. — 1991. — Vol. 34. — P. 232-238.
, Berschick B. // Diabetologia. — 1991. — Vol. 34. — P. 232-238.
31. Lampeter E. F. // Diabet. Metab. — 1993. — Vol. 19, N 1—2. — P. 105-109.
32. Lazarow A. // Anat. Rec. — 1947. — Vol. 97. — P. 353-358.
33. Le Doux S. P., Hall C. R., Forbes P. M. // Diabetes. — 1988. — Vol. 37. — P. 1015-1019.
34. Manna R., Migliore A., Martin L. S. // Brit. J. clin. Pract. — 1992. — Vol. 46, N 3. — P. 177-179.
35. Mendpla G., Casamitjana R., Gomis R. // Diabetologia. — 1989. — Vol. 32. — P. 160-162.
36. Mendola J., Wright J. R., Lacy P. E. // Diabetes. — 1989. — Vol. 3.5. — P. 379-385.
37. Nakajama H, Fujino-Kurihara H, Hanafusa T. et al. // Biomed. Res. — 1985. — Vol. 6. — P. 185-189.
38. Nerup J. // Diabetologia. — 1994. — Vol. 37, Suppl. 2. — P. S82-S89.
39. Nomicos I. N., Prowse S. J., Carotenuto P. // Diabetes. — 1986. — Vol. 35. — P. 1302-1304.
40. Okamoto H. // Bio Essays. — 1985. — Vol. 2. — P. 15-21.
41. Pipeleers D., Ling Zh. et al. // Diabet. Metab. Rev. — 1992. — Vol. 8, N 3. — P. 209-227.
// Diabet. Metab. Rev. — 1992. — Vol. 8, N 3. — P. 209-227.
42. Pociot E, Reimers J. I., Andersen H. U. // Diabetologia. — 1993. — Vol. 36, N 6. — P. 574-576.
43. Pozzilli P., Lampeter E., Di Mario U., Andreani D. // Immunotherapy of Type I Diabetes. — London, 1989. — P. 35—54.
44. Pozzilli P. The IMDIAB Study Group // Diabetologia. — 1994. — Vol. 37. — P. 314.
45. Pozzilli P., Visalli N., Signore A. et al. // Diabetologia. — 1995. — Vol. 38. — P. 848-852.
46. Pozzilli P., Visalli N., Ghirlanda G. // Diabet. Med. — 1989. — Vol. 6. — P. 568-572.
47. Pozzilli P., Andreani D. // Diabet. Metab. Rev. — 1993. — Vol. 9. — P. 219-239.
48. Shah S. C., Malone J. I., Simpson M. E. // N. Engl. J. Med. — 1989. — Vol. 320. — P. 550-554.
49. Smirnova O., Tchugunova L., Gorelysheva V et al. // Horm. Metab. Res. — 1995. — Suppl. 1. — P. 14.
50. The DCCT Research Group. Effects of age, duration and treatment of insulin-dependent diabetes mellitus on residual beta-cell function: Observation during eligibility teasting for the diabetes control and complications trial (DCCT) // J. clin. Endocrin. Metab. — 1987. — Vol. 65. — P. 30—36.
clin. Endocrin. Metab. — 1987. — Vol. 65. — P. 30—36.
51. Uchigata Y., Yamamoto H., Nagai H. et al. // Diabetes. — 1983. — Vol. 32. — P. 316-318.
52. Vague P., Vialettes B., Lassmann-Vague V. // Lancet. — 1987. — Vol. 1. — P. 619-620.
53. Vague P., Picq R., Bernal M. // Diabetologia. — 1989. — Vol. 32. — P. 316-321.
54. Vague P., Vialettes B., Lassman V. // Acta diabetol. lat. — 1985. — Vol. 21. — P. 293-304.
55. Varsanyi-Nagy M., Datufalsa V., Buckingham B. // Diabetologia. — 1992. — Vol. 35, Suppl. 1. — P. 496.
56. Vialettes B., Picq R., du Rostu M. // Diabet. Med. — 1990. — Vol. 7, N 8. — P. 731-735.
57. Visalli N., Lucentini L., Crino A. // Diabetologia. — 1992. — Vol. 35, Suppl. 1. — P. A218.
58. Wallensteen M., Dahlquist G., Persson B. // Ibid. — 1988. — Vol. 31. — P. 664-669.
59. Wilson G. L., Patton N J., McCord J. M. // Ibid. — 1984. — Vol. 27. — P. 587-591.
60. Yamagami T, Miwa A., Takas aw a S. et al. // Cancer Res. — 1985. — Vol. 45. — P. 1845-1849.
— 1985. — Vol. 45. — P. 1845-1849.
61. Yonemura Y., Takashima T, Miwa K. et al. // Diabetes. — 1984. — Vol. 33. — P. 401-404.
Механизм действия ниацина
Обзор
. 2008 г., 17 апреля; 101(8A):20B-26B.
doi: 10.1016/j.amjcard.2008.02.029.
Вайджинат С Каманна 1 , Моти Л. Кашьяп
принадлежность
- 1 Центр исследования атеросклероза, Департамент системы здравоохранения по делам ветеранов, Лонг-Бич, Калифорния 90822, США.
- PMID: 18375237
- DOI:
10.
 1016/j.amjcard.2008.02.029
1016/j.amjcard.2008.02.029
Обзор
Vaijinath S Kamanna et al. Ам Джей Кардиол. .
. 2008 г., 17 апреля; 101(8A):20B-26B.
doi: 10.1016/j.amjcard.2008.02.029.
Авторы
Вайджинат С Каманна 1 , Моти Л Кашьяп
принадлежность
- 1 Центр исследования атеросклероза, Департамент системы здравоохранения по делам ветеранов, Лонг-Бич, Калифорния 90822, США.
- PMID: 18375237
- DOI:
10.
 1016/j.amjcard.2008.02.029
1016/j.amjcard.2008.02.029
Абстрактный
Никотиновая кислота (ниацин) уже давно используется для лечения нарушений липидного обмена и сердечно-сосудистых заболеваний. Ниацин благоприятно влияет на липопротеины, содержащие аполипопротеин (апо) В (например, липопротеины очень низкой плотности [ЛПОНП], липопротеины низкой плотности [ЛПНП], липопротеин [а]), и увеличивает содержание апо А-I-содержащих липопротеинов (липопротеинов высокой плотности [а]). ЛПВП]). Недавно новые открытия расширили наше понимание механизма действия ниацина и поставили под сомнение старые концепции. Имеются новые данные о (1) влиянии ниацина на метаболизм триглицеридов (ТГ) и апоВ-содержащих липопротеинов в печени, (2) влиянии на метаболизм апоА-I и ЛПВП, (3) влиянии на противовоспалительные явления в сосудах, (4) специфический рецептор ниацина в адипоцитах и иммунных клетках, (5) то, как ниацин вызывает гиперемию, и (6) характеристика транспортной системы ниацина в клетках печени и кишечника. Новые результаты показывают, что ниацин напрямую и неконкурентно ингибирует диацилглицерол-ацилтрансферазу-2 гепатоцитов, ключевой фермент синтеза ТГ. Ингибирование синтеза ТГ никотиновой кислотой приводит к ускоренной внутриклеточной печеночной деградации апо В и снижению секреции ЛПОНП и частиц ЛПНП. Предыдущие кинетические исследования на людях и недавние результаты клеточных культур in vitro показывают, что ниацин в основном замедляет печеночный катаболизм апо А-I (по сравнению с апо А-II), но не нейтрализует сложные эфиры холестерина, опосредованные рецептором BI. Снижение катаболизма апопротеинов ЛПВП A-I никотиновой кислотой объясняет увеличение периода полувыведения ЛПВП и концентрации субфракций липопротеинов A-I ЛПВП, которые усиливают обратный транспорт холестерина. Первоначальные данные свидетельствуют о том, что ниацин, ингибируя экспрессию бета-цепи аденозинтрифосфатсинтазы на поверхности гепатоцитов (недавно обнаруженный рецептор голочастиц HDL-apo A-I), ингибирует удаление HDL-apo A-I.
Новые результаты показывают, что ниацин напрямую и неконкурентно ингибирует диацилглицерол-ацилтрансферазу-2 гепатоцитов, ключевой фермент синтеза ТГ. Ингибирование синтеза ТГ никотиновой кислотой приводит к ускоренной внутриклеточной печеночной деградации апо В и снижению секреции ЛПОНП и частиц ЛПНП. Предыдущие кинетические исследования на людях и недавние результаты клеточных культур in vitro показывают, что ниацин в основном замедляет печеночный катаболизм апо А-I (по сравнению с апо А-II), но не нейтрализует сложные эфиры холестерина, опосредованные рецептором BI. Снижение катаболизма апопротеинов ЛПВП A-I никотиновой кислотой объясняет увеличение периода полувыведения ЛПВП и концентрации субфракций липопротеинов A-I ЛПВП, которые усиливают обратный транспорт холестерина. Первоначальные данные свидетельствуют о том, что ниацин, ингибируя экспрессию бета-цепи аденозинтрифосфатсинтазы на поверхности гепатоцитов (недавно обнаруженный рецептор голочастиц HDL-apo A-I), ингибирует удаление HDL-apo A-I.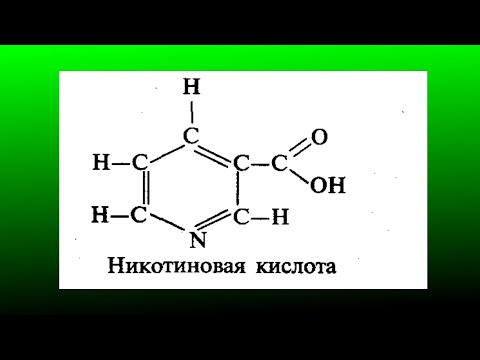 Недавние исследования показывают, что ниацин увеличивает окислительно-восстановительное состояние эндотелиальных клеток сосудов, что приводит к ингибированию окислительного стресса и генов воспаления сосудов, ключевых цитокинов, участвующих в развитии атеросклероза. Ниациновый прилив возникает в результате стимуляции простагландинов D(2) и E(2) подкожными клетками Лангерганса через рецептор, связанный с G-белком 109Ниациновый рецептор. Хотя снижение мобилизации свободных жирных кислот из жировой ткани через рецептор ниацина 109A, связанный с G-белком, было широко предполагаемым механизмом ниацина для снижения ТГ, физиологически и клинически, этот путь может быть лишь второстепенным фактором в объяснении эффектов ниацина на липиды. .
Недавние исследования показывают, что ниацин увеличивает окислительно-восстановительное состояние эндотелиальных клеток сосудов, что приводит к ингибированию окислительного стресса и генов воспаления сосудов, ключевых цитокинов, участвующих в развитии атеросклероза. Ниациновый прилив возникает в результате стимуляции простагландинов D(2) и E(2) подкожными клетками Лангерганса через рецептор, связанный с G-белком 109Ниациновый рецептор. Хотя снижение мобилизации свободных жирных кислот из жировой ткани через рецептор ниацина 109A, связанный с G-белком, было широко предполагаемым механизмом ниацина для снижения ТГ, физиологически и клинически, этот путь может быть лишь второстепенным фактором в объяснении эффектов ниацина на липиды. .
Похожие статьи
Агонисты рецепторов никотиновой кислоты (ниацина): будут ли они полезными терапевтическими агентами?
Каманна В.
 С., Кашьяп М.Л.
Каманна В.С. и соавт.
Ам Джей Кардиол. 2007 г., 3 декабря; 100 (11 А): S53-61. doi: 10.1016/j.amjcard.2007.09.080.
Ам Джей Кардиол. 2007.
PMID: 18047854
Обзор.
С., Кашьяп М.Л.
Каманна В.С. и соавт.
Ам Джей Кардиол. 2007 г., 3 декабря; 100 (11 А): S53-61. doi: 10.1016/j.amjcard.2007.09.080.
Ам Джей Кардиол. 2007.
PMID: 18047854
Обзор.Хомяк с высоким содержанием жира и фруктозы как животная модель биологической активности ниацина у людей.
Коннолли Б.А., О’Коннелл Д.П., Ламон-Фава С., Леблан Д.Ф., Куанг Ю.Л., Шефер Э.Дж., Коппаж А.Л., Бенедикт Ч.Р., Кирицы С.П., Бачовчин В.В. Коннолли Б.А. и соавт. Метаболизм. 2013 Декабрь; 62 (12): 1840-9. doi: 10.1016/j.metabol.2013.08.001. Epub 2013 13 сентября. Метаболизм. 2013. PMID: 24035454
Никотиновая кислота: последние разработки.
Каманна В.С., Во А., Кашьяп М.Л. Каманна В.С. и соавт. Карр Опин Кардиол.
 2008 июль; 23 (4): 393-8. doi: 10.1097/HCO.0b013e3283021c82.
Карр Опин Кардиол. 2008.
PMID: 18520725
Обзор.
2008 июль; 23 (4): 393-8. doi: 10.1097/HCO.0b013e3283021c82.
Карр Опин Кардиол. 2008.
PMID: 18520725
Обзор.Аполипопротеин A-I в комплексе с фосфолипидом способствует печеночному липопротеину и секреции аполипопротеина в перфузируемой печени хомяка.
Сонг В., Чен Дж., Редингер Р.Н. Сонг В. и др. J Исследовательская Мед. 1998 декабрь; 46 (9): 460-9. J Исследовательская Мед. 1998. PMID: 9861782
Ниацин и липопротеин (а): факты, неопределенности и клинические соображения.
Скану А.М., Бамба Р. Скану А.М. и др. Ам Джей Кардиол. 2008 г., 17 апреля; 101(8A):44B-47B. doi: 10.1016/j.amjcard.2008.02.031. Ам Джей Кардиол. 2008. PMID: 18375241 Обзор.
Посмотреть все похожие статьи
Цитируется
NAD + и его возможная роль в микробиоте кишечника: понимание механизмов, с помощью которых кишечные микробы влияют на метаболизм хозяина.

Жэнь З., Сюй И., Ли Т., Сунь В., Тан З., Ван Ю., Чжоу К., Ли Дж., Дин К., Лян К., Ву Л., Инь И., Сунь З. Рен З. и др. Аним Нутр. 2022 22 июня; 10: 360-371. doi: 10.1016/j.aninu.2022.06.009. электронная коллекция 2022 сент. Аним Нутр. 2022. PMID: 35949199 Бесплатная статья ЧВК. Обзор.
Что, если не все метаболиты путей образования уремического токсина токсичны? Гипотеза.
Ванхолдер Р., Нигам С.К., Берти С., Глорьё Г. Ванхолдер Р. и соавт. Токсины (Базель). 2022 17 марта; 14 (3): 221. дои: 10.3390/токсины14030221. Токсины (Базель). 2022. PMID: 35324718 Бесплатная статья ЧВК. Обзор.
Причины, клинические проявления и терапевтические возможности при синдроме хиломикронемии, особой форме гипертриглицеридемии.

Параг Г., Немет А., Харанги М., Банах М., Фюлоп П. Параг Г. и соавт. Здоровье липидов Дис. 2022 10 февраля; 21 (1): 21. doi: 10.1186/s12944-022-01631-z. Здоровье липидов Дис. 2022. PMID: 35144640 Бесплатная статья ЧВК. Обзор.
Руководство PoLA/CFPiP/PCS/PSLD/PSD/PSH по диагностике и терапии нарушений липидного обмена в Польше, 2021 г.
Банах М., Бурхардт П., Хлебус К., Добровольский П., Дудек Д., Дырбусь К., Гонсиор М., Янковский П., Юзвяк Й., Клосевич-Латошек Л., Ковальская И., Малецкий М., Прейбиш А., Раковский М., Рыш Й., Солница Б., Ситкевич Д., Сыгитович Г., Сыпневская Г., Томасик Т., Виндак А., Зозулинская-Зилкевич Д., Цыбульская Б. Банах М. и др. Arch Med Sci. 2021 8 ноября; 17 (6): 1447-1547. дои: 10.5114/аомс/141941. Электронная коллекция 2021. Arch Med Sci. 2021. PMID: 34
2 Бесплатная статья ЧВК. Аннотация недоступна.
Аннотация недоступна.Влияние гиполипидемических препаратов на характеристики бляшек в коронарных артериях.
Пулипати В.П., Аленгат Ф.Дж. Пулипати В.П. и соавт. Am J Prev Cardiol. 2021 9 ноября; 8:100294. doi: 10.1016/j.ajpc.2021.100294. электронная коллекция 2021 дек. Am J Prev Cardiol. 2021. PMID: 34877559Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Ниацин — StatPearls — Книжная полка NCBI
Непрерывное обучение, задание
Использование ниацина еще предстоит полностью понять и принять. Эта деятельность помогает расширить знания о преимуществах ниацина не только для лечения, но и для снижения заболеваемости некоторыми заболеваниями. В этом упражнении рассматриваются фармакокинетика, введение, показания, противопоказания, побочные эффекты, мониторинг, токсичность и, что наиболее важно, как улучшить результаты межпрофессиональной команды путем эффективного мониторинга использования этого лекарства.
Эта деятельность помогает расширить знания о преимуществах ниацина не только для лечения, но и для снижения заболеваемости некоторыми заболеваниями. В этом упражнении рассматриваются фармакокинетика, введение, показания, противопоказания, побочные эффекты, мониторинг, токсичность и, что наиболее важно, как улучшить результаты межпрофессиональной команды путем эффективного мониторинга использования этого лекарства.
Цели:
Опишите показания для начала терапии никотиновой кислотой.
Объясните фармакокинетику и введение никотиновой кислоты.
Опишите побочные эффекты, противопоказания и токсичность ниацина.
Узнайте, почему для обучения пациентов, принимающих никотиновую кислоту, необходима межпрофессиональная командная работа представителей сферы здравоохранения.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Ниацин (комбинация никотиновой кислоты и никотинамида), витамин B (витамин B3), представляет собой фармакотерапевтическое средство, которое используется с 1955 года, что делает его старейшим плейотропным гиполипидемическим средством. [1] Витамин играет роль как в нейропротекции, так и в гибели нейронов, что придает ему первостепенное значение для правильного функционирования центральной нервной системы (ЦНС), развития и функционирования нейронов.[2]
[1] Витамин играет роль как в нейропротекции, так и в гибели нейронов, что придает ему первостепенное значение для правильного функционирования центральной нервной системы (ЦНС), развития и функционирования нейронов.[2]
Ниацин широко используется отдельно или в комбинации со статинами (ингибиторами гидроксиметилглутарилкофермента А редуктазы) для снижения общего холестерина, триглицеридов, холестерина липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности (ЛПОНП). ) и уровень липопротеинов. Более того, ниацин является наиболее сильнодействующим средством, используемым для повышения уровня холестерина липопротеинов высокой плотности (ЛПВП) в плазме.[3] У пациентов с сахарным диабетом или смешанной дислипидемией ниацин продемонстрировал в клинических испытаниях, что он может уравновешивать риск сердечно-сосудистых заболеваний в этой популяции пациентов, снижая сердечно-сосудистые заболевания и смертность, особенно в сочетании со статинами.
Ниацин, будучи таким плейотропным агентом, все еще обладает свойствами, которые остаются нераскрытыми. Некоторые другие изученные применения ниацина, кроме указанных выше, включают следующее. It decreases the incidence of cardiovascular events, premature aging, age-associated neurological disorders such as[6]
Некоторые другие изученные применения ниацина, кроме указанных выше, включают следующее. It decreases the incidence of cardiovascular events, premature aging, age-associated neurological disorders such as[6]
Arthritis[6]
Alzheimer disease
Huntington disease
Schizophrenia[7]
Amyotrophic lateral sclerosis
Muscular atrophy
hyperphosphatemia in chronic kidney disease[8]
Parkinson disease
Squamous cell carcinoma[9]
It also has therapeutic use in treating diabetic энцефалопатия, злокачественная глиома, нейродегенеративные заболевания[10]
Циркадный ритм и регуляция метаболизма посредством сиртуинов
Внутриклеточная регуляция кальция
Механизм действия
После биохимических реакций в митохондриях с никотинамидом и триптофаном ниацин образует никотинамидадениндинуклеотид (НАД) и НАД фосфат (НАДФ). НАД и НАДФ являются активными формами ниацина, которые при восстановлении до НАД(Н) и НАДФ(Н) соответственно участвуют в катаболических окислительно-восстановительных реакциях и являются кофакторами анаболических окислительно-восстановительных реакций.
НАД и НАДФ являются активными формами ниацина, которые при восстановлении до НАД(Н) и НАДФ(Н) соответственно участвуют в катаболических окислительно-восстановительных реакциях и являются кофакторами анаболических окислительно-восстановительных реакций.
Хотя ниацин используется уже много лет, его полезные плейотропные эффекты затрудняют полное понимание механизма его действия. Однако целенаправленный механизм действия, основанный на определенных эффектах, которые ниацин оказывает на организм человека:
Метаболизм липидов. Липидоснижающая способность ниацина очень разнообразна и все еще находится на стадии изучения. Одним из предполагаемых механизмов является антилиполитический эффект ниацина, который, как считается, опосредуется через рецепторы никотиновой кислоты. Недавно обнаруженный альтернативный механизм заключается в способности ниацина ускорять внутриклеточную деградацию аполипопротеина B (ApoB), содержащего липопротеины, такие как VLDL и LDL, путем ингибирования синтеза триглицеридов.
 Кроме того, ниацин ингибирует диацилглицерол-ацилтрансферазу 2 (DGAT2), тем самым снижая синтез триглицеридов в печени. Предполагаемый механизм повышения уровня холестерина ЛПВП заключается в том, что никотиновая кислота снижает деградацию липопротеинов, содержащих ApoA-I, и увеличивает экспрессию γ-рецептора, активируемого пролифератором пероксисом (PPARγ), и усиливает транскрипционную активность PPARγ в макрофагах.[11] Уровни свободных жирных кислот снижаются за счет подавляющего действия ниацина циклического аденозинмонофосфата. Поступая таким образом, он уменьшает наиболее важный внутриклеточный медиатор пролиполитических стимулов.[12]
Кроме того, ниацин ингибирует диацилглицерол-ацилтрансферазу 2 (DGAT2), тем самым снижая синтез триглицеридов в печени. Предполагаемый механизм повышения уровня холестерина ЛПВП заключается в том, что никотиновая кислота снижает деградацию липопротеинов, содержащих ApoA-I, и увеличивает экспрессию γ-рецептора, активируемого пролифератором пероксисом (PPARγ), и усиливает транскрипционную активность PPARγ в макрофагах.[11] Уровни свободных жирных кислот снижаются за счет подавляющего действия ниацина циклического аденозинмонофосфата. Поступая таким образом, он уменьшает наиболее важный внутриклеточный медиатор пролиполитических стимулов.[12]Повышение гликемии натощак: считается, что это связано с ролью ниацин-чувствительного рецептора, связанного с G-белком (GPR109a), и жирных кислот, свободных от плазмы (FFA). Хотя детали механизма еще предстоит полностью раскрыть, исследования выявили прямую связь между резистентностью к инсулину в мышцах и высокой концентрацией свободных жирных кислот (в форме перегрузки липидами) в нежировых тканях.
 Кроме того, показано, что кишечные клетки in vivo увеличивают свое локальное поглощение глюкозы, когда GPR109a стимулируется ниацином, что может способствовать потере гликемического контроля.[13]
Кроме того, показано, что кишечные клетки in vivo увеличивают свое локальное поглощение глюкозы, когда GPR109a стимулируется ниацином, что может способствовать потере гликемического контроля.[13]Процессы и патологии, связанные со старением. Хотя механизм действия в ходе текущих исследований еще полностью не изучен, возможно, существует обратная связь между концентрацией никотинамидадениндинуклеотида (НАД) и потреблением ниацина с пищей. Исследователи продемонстрировали, что снижение внутриклеточной концентрации НАД приводит к потере способности клеток подвергаться делению и росту, что приводит к старению и гибели клеток. NAD-зависимые ферменты, такие как сиртуиновые белки и поли(АДФ-рибозо)полимераза (PARP), обеспечивают непрерывную защиту генома, а также необходимы для восстановления поврежденной ДНК. Исследователи наблюдали повышенную заболеваемость раком и активные формы кислорода при снижении PARP. Кроме того, продлевающие жизнь эффекты ограничения калорийности, опосредованные сиртуинами, были связаны с преждевременным старением и расстройствами типа Хантингтона и другими возрастными неврологическими расстройствами в клетках с дефектными сиртуинами.
 [14]
[14]Злокачественная глиома: ниацин может ингибировать инвазию клеток глиомы in vivo и in vitro. Эпителиально-мезенхимальный переход (ЭМП) участвует в процессах миграции, адгезии и полярности клеток; он также участвует в подавлении E-cadherin, эпителиального маркера, и повышении уровня Snail1, мезенхимального маркера, оба процесса важны для нормального развития мезодермы и миграции нервного гребня. Исследования показали, что опухолевые клетки имеют EMT-подобные процессы, которые дают им возможность рецидивировать и вызывать иммуносупрессию и клеточную инвазию. Было обнаружено, что деградация Snail1, фактора транскрипции, стимулирующего EMT, который приводит к инвазии клеток мультиформной глиобластомы U251, облегчается в клетках, обработанных ниацином, что приводит к снижению инвазии опухоли.
Администрация
Ниацин доступен в двух химических формах. Только как никотиновая кислота, используемая при гиперлипопротеинемии или заболеваниях периферических сосудов. Другой формой является как никотиновая кислота, так и никотинамид (ниацинамид), используемые в качестве пищевых добавок при пеллагре.
Другой формой является как никотиновая кислота, так и никотинамид (ниацинамид), используемые в качестве пищевых добавок при пеллагре.
Пероральные таблетки пролонгированного действия выпускаются в дозировках 250 мг, 500 мг, 750 мг, 1000 мг и 3000 мг. Было обнаружено, что дозировка от 1 до 3 граммов в день снижает уровень холестерина ЛПНП в сыворотке крови и повышает уровень холестерина ЛПВП в сыворотке [17]. Исследования показали, что состав ниацина с модифицированным высвобождением и кристаллический ниацин с немедленным высвобождением дают аналогичные результаты.
Таблетки с немедленным высвобождением доступны в дозировках от 50 до 500 мг. Начальная доза должна быть как можно более низкой для уменьшения нежелательных реакций и медленно титроваться, предпочтительно не более 500 мг в течение четырех недель до реакции пациента и переносимости.
При однократном введении никотиновой кислоты наблюдались реверсивные изменения резистентности к инсулину, вызванные липидной перегрузкой, и быстрое снижение уровня свободных жирных кислот в плазме [13].

Во время приема ниацина пациентам следует избегать употребления алкоголя, так как это может увеличить риск зуда и гиперемии. Кроме того, терапия ниацином не рекомендуется пациентам, хронически злоупотребляющим алкоголем, из-за повышенного риска гепатотоксичности.
Рекомендуемая дозировка для Пеллагра
Взрослые
Пероральная доза (никотиновая кислота или никотинамид/ниацинамид): до 500 мг/день перорально, в зависимости от тяжести дефицита ниацина.
Внутривенно или внутримышечно Дозировка: от 50 до 100 мг внутримышечно пять раз в день или от 25 до 100 мг в виде медленной внутривенной инфузии два раза в день, в зависимости от тяжести дефицита ниацина. Максимум: 500 мг/день.
Дети
Дозировка составляет до 300 мг/день путем медленного внутривенного вливания, в зависимости от тяжести дефицита ниацина.
Рекомендуемая дозировка при гиперхолестеринемии, смешанной дислипидемии или H гипертриглицеридемия, тип IV или V
Обычная доза составляет от 1500 до 3000 мг/день перорально, разделенная на два или три раза в день.

Начальная доза: 250 мг внутрь перед сном с постепенным увеличением на 250 мг/сут каждые 4–7 дней до 2000 мг/сут.
Через два месяца доза может быть увеличена до 250–500 мг/сутки каждые 2–4 недели, но не более 6000 мг/сутки.
Примечание: 325 мг аспирина за 30 минут до приема дозы может уменьшить покраснение; Лекарство следует давать без еды.
Рекомендации по беременности
Ниацин отнесен FDA к категории С при беременности. При использовании в высоких дозах для лечения таких состояний, как дислипидемия, ниацин может нанести вред нерожденному плоду.
Рекомендации по грудному вскармливанию
Вред может нанести кормящемуся ребенку, так как ниацин может проникать в грудное молоко; поэтому кормящим матерям следует избегать применения препарата.
Побочные эффекты
Общие реакции
Приливы: Ниацин часто вызывает генерализованный зуд, а ощущение жжения обычно ограничивается лицом и грудью и длится от 20 до 30 минут. Эта побочная реакция, однако, со временем уменьшается по частоте и степени тяжести.[4] Предварительное лечение аспирином (до 325 мг) в течение 30 минут может помочь справиться с этим побочным эффектом. Ларопипрант, мощный селективный антагонист рецептора простагландина D2 (PGD2) подтипа 1, не только помогает уменьшить этот побочный эффект ниацина, но и позволяет при необходимости подобрать оптимальную фармакологическую дозировку.[18]
Эта побочная реакция, однако, со временем уменьшается по частоте и степени тяжести.[4] Предварительное лечение аспирином (до 325 мг) в течение 30 минут может помочь справиться с этим побочным эффектом. Ларопипрант, мощный селективный антагонист рецептора простагландина D2 (PGD2) подтипа 1, не только помогает уменьшить этот побочный эффект ниацина, но и позволяет при необходимости подобрать оптимальную фармакологическую дозировку.[18]
Одной из реакций, которую следует учитывать, является влияние ниацина (используемого отдельно или в сочетании со статинами) на гликемический контроль у пациентов с дислипидемией, независимо от их статуса сахарного диабета. У недиабетических пациентов с дислипидемией в среднем пятилетняя терапия ниацином, независимо от того, применялась ли она отдельно или в составе комбинированной терапии с ларопипрантом, была связана с повышением риска развития диабета на 34% [19]. Кроме того, было продемонстрировано, что введение ниацина повышает гликемический уровень натощак у пациентов с диабетом. Пациентам с метаболическим синдромом или диабетом рекомендуется избегать терапии никотиновой кислотой.[13][5]
Пациентам с метаболическим синдромом или диабетом рекомендуется избегать терапии никотиновой кислотой.[13][5]
Другие побочные эффекты включают гиперурикемию, желудочно-кишечные расстройства, сыпь, повышение уровня гомоцистеина, гипотензию, диспепсию, повышение уровня АСТ и АЛТ, тошноту, рвоту и парестезии.[5][1]
Серьезные побочные реакции
Язвенная болезнь, аритмии, анафилаксия, гепатотоксичность, некроз печени, молниеносный отек желтого пятна [1]
Противопоказания
Противопоказания к ниацину включают следующие состояния:
Пациенты с активной язвенной болезнью
Пациенты с активным заболеванием печени или с необъяснимым и стойким повышением активности печеночных трансаминаз
Пациенты с гиперчувствительностью к никотиновой кислоте или любому компоненту этого препарата
- 0 9 артериальное кровотечение
Мониторинг
Пациентам, получающим никотиновую терапию, рекомендуется лабораторный мониторинг из-за его разнообразных побочных эффектов.

У пациентов с преддиабетом или диабетом необходим частый контроль уровня глюкозы в крови, поскольку ниацин может повышать уровень глюкозы в крови натощак. Пациенты, принимающие противодиабетические препараты, такие как акарбоза, альбиглутид, алоглиптин, глипизид или инсулин, также должны часто контролировать уровень глюкозы в крови.[19]
Ниацин может вызывать повышение уровня мочевой кислоты, оказывая тем самым антагонистическое действие на лекарства от подагры, такие как пеглотиказа и аллопуринол.
Ниацин вызывает аддитивную реакцию с лекарствами от артериального давления (амлодипин, клозапин, бисопролол, дилтиазем), опиоидами (морфин, оксикодон, трамадол, метадон), нейролептиками (кветиапин, рисперидон), ингибитором фосфодиэстеразы 5 типа (тадалафилом), что приводит к гипотензии. Рекомендуется частая проверка артериального давления. Кроме того, ниацин в сочетании с некоторыми бета-блокаторами может снижать его антигиперлипидемическую эффективность.

Ниацин может увеличить риск кровотечения, оказывая аддитивный эффект. Было показано, что ниацин не только вызывает снижение количества тромбоцитов (в среднем -11% при приеме 2000 мг), но и увеличивает протромбиновое время (в среднем примерно на +4%), что приводит к кровотечению, особенно в сочетании с антикоагулянтами, такими как апиксабан, каплацизумаб. или варфарин. Таким образом, панель свертывания крови должна быть рутинным тестом.
Ниацин также оказывает аддитивный эффект в сочетании с церитинибом, диазоксидом, что приводит к гипергликемии.
Уровни фосфора также требуют мониторинга у пациентов с риском гипофосфатемии, поскольку ниацин может вызывать снижение уровня фосфора (в среднем -13% при дозе 2000 мг).
Токсичность
В фармакологических дозах (например, от 1000 до 3000 мг/день) реакция покраснения, связанная с его кристаллическим компонентом никотиновой кислоты (не никотинамидом), является наиболее распространенной и изученной токсичностью никотиновой кислоты, которая одновременно является человеку и зависит от дозы.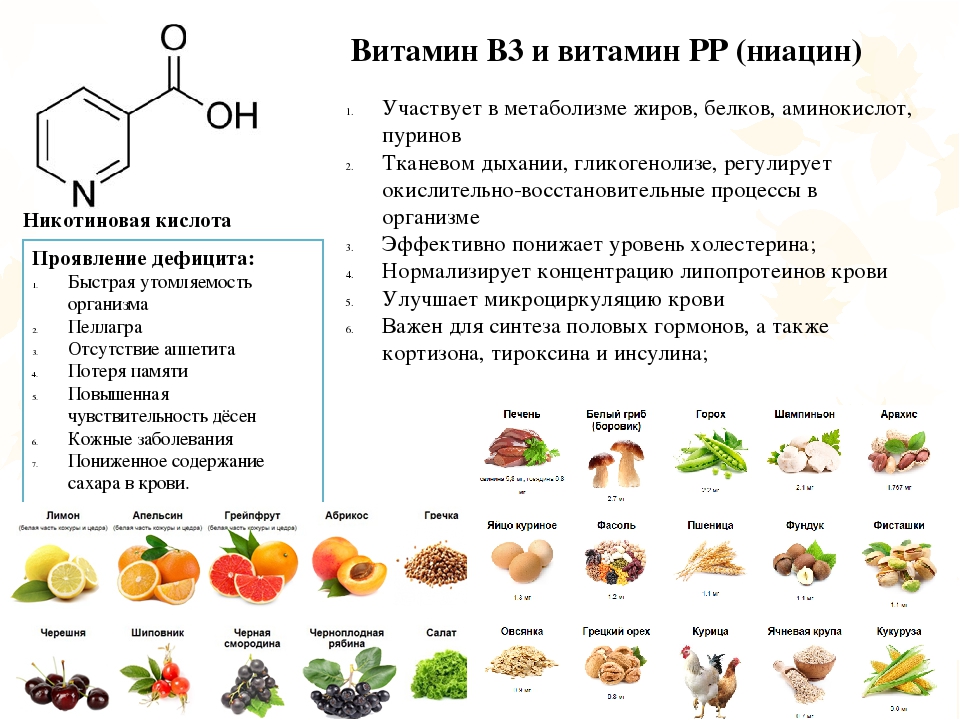 [4] Другие симптомы интоксикации могут включать головокружение, расстройство желудка, покраснение, зуд, тошноту и рвоту.
[4] Другие симптомы интоксикации могут включать головокружение, расстройство желудка, покраснение, зуд, тошноту и рвоту.
Улучшение результатов медицинского персонала
Ниацин является фармакотерапевтическим плейотропным средством, свойства которого еще предстоит полностью изучить. Рекомендуется, чтобы межпрофессиональные медицинские работники (врачи, фармацевты, практикующие медсестры, фельдшеры, поставщики первичной медико-санитарной помощи, медсестры) были в курсе свойств и побочных эффектов ниацина, выявленных в ходе текущих исследований. Ниацин может вызывать гиперемию, значительное неблагоприятное воздействие, которое существенно влияет на его соблюдение пациентами. Знание того, как титровать с минимальной дозы, поможет свести к минимуму такие нежелательные эффекты и улучшить результаты для здоровья пациентов. Необходим тщательный мониторинг и периодический анализ крови при начале или увеличении дозы ниацина, поскольку известно, что он увеличивает риск кровотечения, гипотонии, гиперурикемии и вызывает изменения в гликемическом контроле. Его неблагоприятное влияние на гликемический контроль у пациентов с дислипидемией, как с диабетом, так и без него, является одним из его наиболее тревожных эффектов, поскольку он может вызвать диабет у предрасположенных пациентов или затруднить лечение диабета. Использование межпрофессионального подхода, когда каждая дисциплина вносит свой вклад в свою область знаний, приведет к лучшим результатам для пациентов и меньшему количеству побочных эффектов от ниацина. [Уровень 5]
Его неблагоприятное влияние на гликемический контроль у пациентов с дислипидемией, как с диабетом, так и без него, является одним из его наиболее тревожных эффектов, поскольку он может вызвать диабет у предрасположенных пациентов или затруднить лечение диабета. Использование межпрофессионального подхода, когда каждая дисциплина вносит свой вклад в свою область знаний, приведет к лучшим результатам для пациентов и меньшему количеству побочных эффектов от ниацина. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Кей А., Либеропулос Э.Н., Элисаф М.С. Что ограничивает клиническое применение никотиновой кислоты? Курр Васк Фармакол. 2011 01 июля; 9 (4): 521-30. [PubMed: 21314634]
- 2.
Фрикер Р.А., Грин Э.Л., Дженкинс С.И., Гриффин С.М. Влияние никотинамида на здоровье и заболевания центральной нервной системы.
 Int J Триптофан Res. 2018;11:1178646918776658. [Бесплатная статья PMC: PMC5966847] [PubMed: 29844677]
Int J Триптофан Res. 2018;11:1178646918776658. [Бесплатная статья PMC: PMC5966847] [PubMed: 29844677]- 3.
Голдберг Р.Б., Якобсон Т.А. Влияние ниацина на контроль уровня глюкозы у пациентов с дислипидемией. Мэйо Клин Proc. 2008 г., апрель; 83 (4): 470-8. [PubMed: 18380993]
- 4.
Вежбицкий А.С. Ниацин: единственный витамин, уменьшающий сердечно-сосудистые события. Int J Clin Pract. 2011 Апрель; 65 (4): 379-85. [PubMed: 21401825]
- 5.
Флорентин М., Либеропулос Э.Н., Кей А., Михайлидис Д.П., Элисаф М.С. Плейотропные эффекты никотиновой кислоты: помимо повышения уровня холестерина липопротеинов высокой плотности. Курр Васк Фармакол. 2011 июль 01;9(4):385-400. [PubMed: 21314635]
- 6.
HOFFER A. Лечение артрита никотиновой кислотой и никотинамидом. Can Med Assoc J. 15 августа 1959 г .; 81: 235-8. [Бесплатная статья PMC: PMC1831040] [PubMed: 14402370]
- 7.
Xu XJ, Jiang GS.
 Подгруппа шизофрении, реагирующая на ниацин, — терапевтический обзор. Eur Rev Med Pharmacol Sci. 2015;19(6):988-97. [PubMed: 25855923]
Подгруппа шизофрении, реагирующая на ниацин, — терапевтический обзор. Eur Rev Med Pharmacol Sci. 2015;19(6):988-97. [PubMed: 25855923]- 8.
Такэтани Ю., Масуда М., Яманака-Окумура Х., Тацуми С., Сегава Х., Миямото К., Такеда Э., Ямамото Х. Ниацин и хроническая болезнь почек. J Nutr Sci Vitaminol (Токио). 2015;61 Приложение:S173-5. [В паблике: 26598845]
- 9.
Park SM, Li T, Wu S, Li WQ, Weinstock M, Qureshi AA, Cho E. Потребление ниацина и риск рака кожи у женщин и мужчин в США. Инт Джей Рак. 2017 01 мая; 140 (9): 2023-2031. [Бесплатная статья PMC: PMC5937269] [PubMed: 28152570]
- 10.
Мотави Т.К., Дарвиш Х.А., Хамед М.А., Эль-Ригал Н.С., Абул Насер А.Ф. Коэнзим Q10 и ниацин смягчают стрептозотоцин-индуцированную диабетическую энцефалопатию в модели на крысах. Метаб Мозг Дис. 2017 Окт;32(5):1519-1527. [PubMed: 28560538]
- 11.
Gille A, Bodor ET, Ahmed K, Offermanns S. Никотиновая кислота: фармакологические эффекты и механизмы действия.
 Annu Rev Pharmacol Toxicol. 2008;48:79-106. [PubMed: 17705685]
Annu Rev Pharmacol Toxicol. 2008;48:79-106. [PubMed: 17705685]- 12.
Montecucco F, Quercioli A, Dallegri F, Viviani GL, Mach F. Новые данные о лечении никотиновой кислотой для уменьшения атеросклероза. Эксперт Rev Cardiovasc Ther. 2010 окт;8(10):1457-67. [PubMed: 20936932]
- 13.
Мейер-Фикка М., Киркланд Дж.Б. Ниацин. Ад Нутр. 2016 май; 7(3):556-8. [Статья PMC бесплатно: PMC4863271] [PubMed: 27184282]
- 14.
Imai S, Guarente L. NAD+ и сиртуины при старении и болезнях. Тенденции клеточной биологии. 2014 авг; 24 (8): 464-71. [Бесплатная статья PMC: PMC4112140] [PubMed: 24786309]
- 15.
Li J, Qu J, Shi Y, Perfetto M, Ping Z, Christian L, Niu H, Mei S, Zhang Q, Yang X, Wei S. Никотиновая кислота ингибирует инвазию глиомы, способствуя деградации Snail1. Научный представитель 3 марта 2017 г .; 7: 43173. [Бесплатная статья PMC: PMC5335718] [PubMed: 28256591]
- 16.
Yang X, Mei S, Niu H, Li J.
 Никотиновая кислота нарушает сборку переднего края в клетках глиомы. Oncol Rep. 2017 Aug;38(2):829-836. [Бесплатная статья PMC: PMC5562096] [PubMed: 28656206]
Никотиновая кислота нарушает сборку переднего края в клетках глиомы. Oncol Rep. 2017 Aug;38(2):829-836. [Бесплатная статья PMC: PMC5562096] [PubMed: 28656206]- 17.
Farnier M, Chen E, Johnson-Levonas AO, McCrary Sisk C, Mitchel YB. Влияние пролонгированного высвобождения ниацина/ларопипранта, симвастатина и их комбинации на корреляции между аполипопротеином В, холестерином ЛПНП и холестерином не-ЛПВП у пациентов с дислипидемией. Управление рисками для здоровья Vasc. 2014;10:279-90. [Бесплатная статья PMC: PMC4019613] [PubMed: 24855368]
- 18.
Parhofer KG. Обзор фиксированной комбинации пролонгированного действия ниацин/ларопипрант при лечении смешанной дислипидемии и первичной гиперхолестеринемии. Управление рисками для здоровья Vasc. 2009;5:901-8. [Статья бесплатно PMC: PMC2788595] [PubMed: 20016845]
- 19.
Goldie C, Taylor AJ, Nguyen P, McCoy C, Zhao XQ, Preiss D. Ниациновая терапия и риск развития диабета: a метаанализ рандомизированных контролируемых исследований.

 1016/j.amjcard.2008.02.029
1016/j.amjcard.2008.02.029 1016/j.amjcard.2008.02.029
1016/j.amjcard.2008.02.029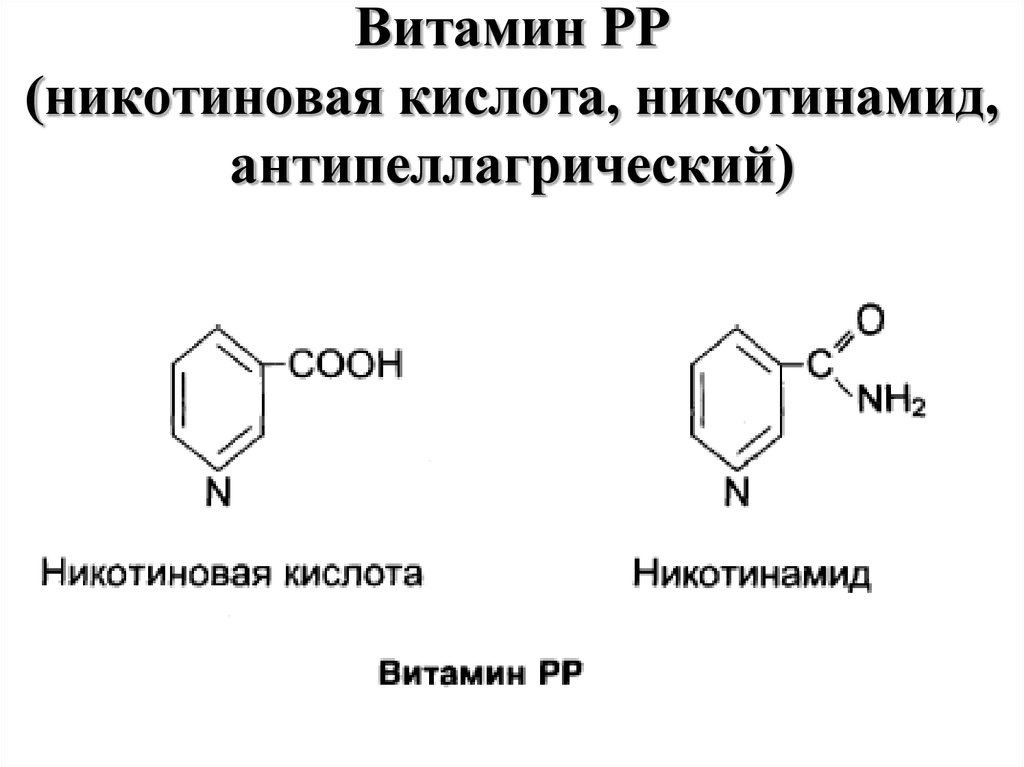 С., Кашьяп М.Л.
Каманна В.С. и соавт.
Ам Джей Кардиол. 2007 г., 3 декабря; 100 (11 А): S53-61. doi: 10.1016/j.amjcard.2007.09.080.
Ам Джей Кардиол. 2007.
PMID: 18047854
Обзор.
С., Кашьяп М.Л.
Каманна В.С. и соавт.
Ам Джей Кардиол. 2007 г., 3 декабря; 100 (11 А): S53-61. doi: 10.1016/j.amjcard.2007.09.080.
Ам Джей Кардиол. 2007.
PMID: 18047854
Обзор. 2008 июль; 23 (4): 393-8. doi: 10.1097/HCO.0b013e3283021c82.
Карр Опин Кардиол. 2008.
PMID: 18520725
Обзор.
2008 июль; 23 (4): 393-8. doi: 10.1097/HCO.0b013e3283021c82.
Карр Опин Кардиол. 2008.
PMID: 18520725
Обзор.
 Аннотация недоступна.
Аннотация недоступна. Кроме того, ниацин ингибирует диацилглицерол-ацилтрансферазу 2 (DGAT2), тем самым снижая синтез триглицеридов в печени. Предполагаемый механизм повышения уровня холестерина ЛПВП заключается в том, что никотиновая кислота снижает деградацию липопротеинов, содержащих ApoA-I, и увеличивает экспрессию γ-рецептора, активируемого пролифератором пероксисом (PPARγ), и усиливает транскрипционную активность PPARγ в макрофагах.[11] Уровни свободных жирных кислот снижаются за счет подавляющего действия ниацина циклического аденозинмонофосфата. Поступая таким образом, он уменьшает наиболее важный внутриклеточный медиатор пролиполитических стимулов.[12]
Кроме того, ниацин ингибирует диацилглицерол-ацилтрансферазу 2 (DGAT2), тем самым снижая синтез триглицеридов в печени. Предполагаемый механизм повышения уровня холестерина ЛПВП заключается в том, что никотиновая кислота снижает деградацию липопротеинов, содержащих ApoA-I, и увеличивает экспрессию γ-рецептора, активируемого пролифератором пероксисом (PPARγ), и усиливает транскрипционную активность PPARγ в макрофагах.[11] Уровни свободных жирных кислот снижаются за счет подавляющего действия ниацина циклического аденозинмонофосфата. Поступая таким образом, он уменьшает наиболее важный внутриклеточный медиатор пролиполитических стимулов.[12]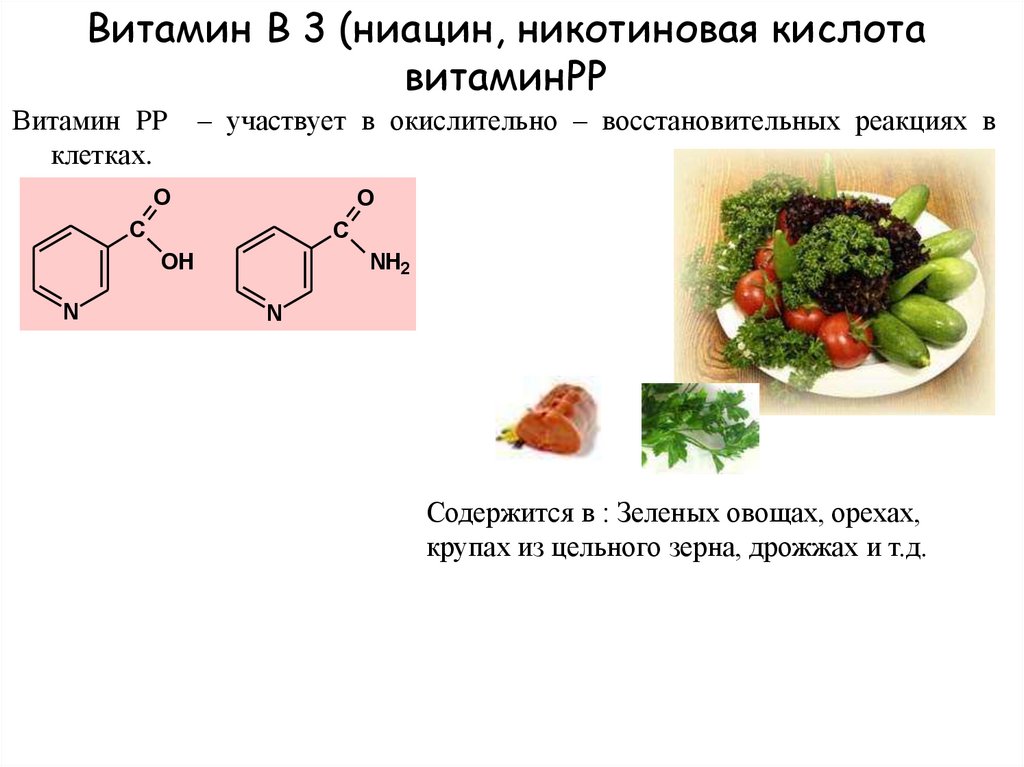 Кроме того, показано, что кишечные клетки in vivo увеличивают свое локальное поглощение глюкозы, когда GPR109a стимулируется ниацином, что может способствовать потере гликемического контроля.[13]
Кроме того, показано, что кишечные клетки in vivo увеличивают свое локальное поглощение глюкозы, когда GPR109a стимулируется ниацином, что может способствовать потере гликемического контроля.[13] [14]
[14]


 Int J Триптофан Res. 2018;11:1178646918776658. [Бесплатная статья PMC: PMC5966847] [PubMed: 29844677]
Int J Триптофан Res. 2018;11:1178646918776658. [Бесплатная статья PMC: PMC5966847] [PubMed: 29844677] Подгруппа шизофрении, реагирующая на ниацин, — терапевтический обзор. Eur Rev Med Pharmacol Sci. 2015;19(6):988-97. [PubMed: 25855923]
Подгруппа шизофрении, реагирующая на ниацин, — терапевтический обзор. Eur Rev Med Pharmacol Sci. 2015;19(6):988-97. [PubMed: 25855923]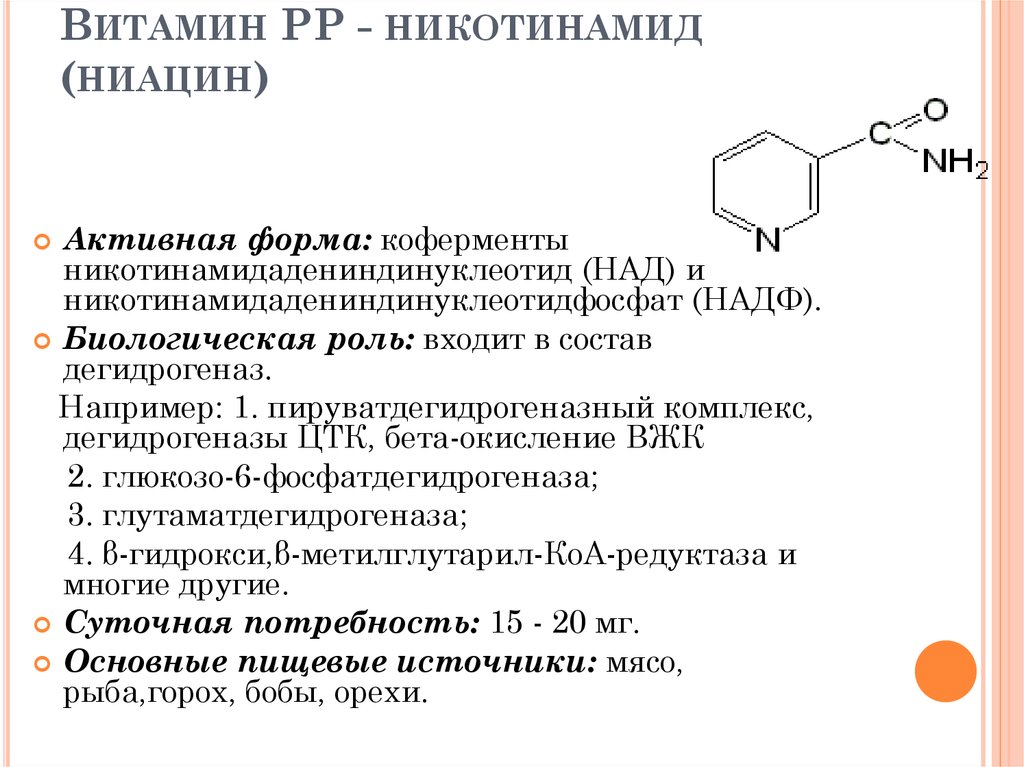 Annu Rev Pharmacol Toxicol. 2008;48:79-106. [PubMed: 17705685]
Annu Rev Pharmacol Toxicol. 2008;48:79-106. [PubMed: 17705685] Никотиновая кислота нарушает сборку переднего края в клетках глиомы. Oncol Rep. 2017 Aug;38(2):829-836. [Бесплатная статья PMC: PMC5562096] [PubMed: 28656206]
Никотиновая кислота нарушает сборку переднего края в клетках глиомы. Oncol Rep. 2017 Aug;38(2):829-836. [Бесплатная статья PMC: PMC5562096] [PubMed: 28656206]