Фармацевтический рынок | Remedium.ru
Фармацевтический рынок | Remedium.ruПопулярное
- Субвариант коронавируса кракен не стал более тяжёлым или смертельным
- В 2023 году около 200 научных организаций России получат гранты на обновление приборной базы
- Минздрав России продолжает разрабатывать дополнительные механизмы раннего выявления употребления наркотиков
- По итогам ноября натуральный объём поставок фармсубстанций в Россию сократился
- В 2023 году в России планируется запустить новый федеральный проект «Борьба с сахарным диабетом»
Карта портала
- СМИ — Новости
- Пресс-Релизы
- Фармацевтам
- Врачам
- Акушерство и гинекология
- Аллергология
- Гастроэнтерология
- Гепатология
- Дерматология
- Диетология
- Инфекционные заболевания
- Исследования и разработки
- Кардиология
- Неврология
- Онкология
- Оториноларингология
- Педиатрия
- Психиатрия
- Психология
- Пульмонология
- Ревматология
- Стоматология
- Терапия
- Травматология
- Урология
- Хирургия
- Эндокринология
- Специалистам здравоохранения
- Фармацевтический рынок
- Промышленность
- Фармацевтическая промышленность
- Медтехника +
- Правовая хроника
- Аналитика
- Законодательство
- Документы для аптечных учреждений
- Документы о здравоохранении
- Разные документы
- Медицинские издания
- Журналы
- Книги
- Мероприятия
- О компании
- О проекте
- Реклама
- Контакты
- Поиск
- Еnglish
| Логин: | |
| Пароль: | |
| Запомнить меня | |
| Регистрация | |
| Забыли свой пароль? | |
Подписка Онлайн
Книги Журналы
Новости
13 января 2023
Новая программа для онкодиспансеров в три раза сократит время ожидания консилиумов
Подмосковные онкологи подключились к новой программе, которая позволяет проводить врачебные консилиумы в цифровом формате.
Подробнее
Все наборы «ТестГен» для определения коронавируса определяют новый штамм кракен
13 января 2023
ГК «Эксперт» внедряет iRIS — обновлённую радиологическую информационную систему
/state/detail.php%3fid%3d69927
Врачам
12 января 2023
Первые результаты применения дурвалумаба после химиолучевой терапии в лечении местнораспространенного немелкоклеточного рака легкого в России
Д.И. Юдин1*, К. К. Лактионов1,2, Ф.В. Моисеенко3,6,7, Д.М. Пономаренко4, Е.А. Чех5, В.А….
К. Лактионов1,2, Ф.В. Моисеенко3,6,7, Д.М. Пономаренко4, Е.А. Чех5, В.А….
Подробнее
11 января 2023
Что делать после удаления зуба? Памятка чтобы не было осложнений
10 января 2023
Криптогенный инсульт. Часть 3: предсердная кардиопатия и скрытая фибрилляция предсердий
Фармацевтам
19 декабря 2022
Лекция: Современная аптека. Всесторонняя забота о ЖКТ
Представляем вашему вниманию лекцию для фармацевтов и провизоров «Современная аптека. Всес…
Всес…
Подробнее
12 декабря 2022
Лекция: Современная аптека. Тонкая настройка ЖКТ
12 декабря 2022
Лекция: Современная аптека
Искать
Раздел не найден.
Раздел не найден.
Ноотропные препараты: список средств
Какие ноотропные препараты считаются самыми известными и широко используемыми в медицинской практике? Какие ноотропы принято использовать для детей, у пожилых людей, при психоневрологических расстройствах и у здоровых лиц для стимуляции умственной деятельности? С этими вопросами мы обратились к Главному врачу медицинского многопрофильного центра «Гармония здоровья», психиатру, психиатру-наркологу и психотерапевту Владиславу Сиповичу.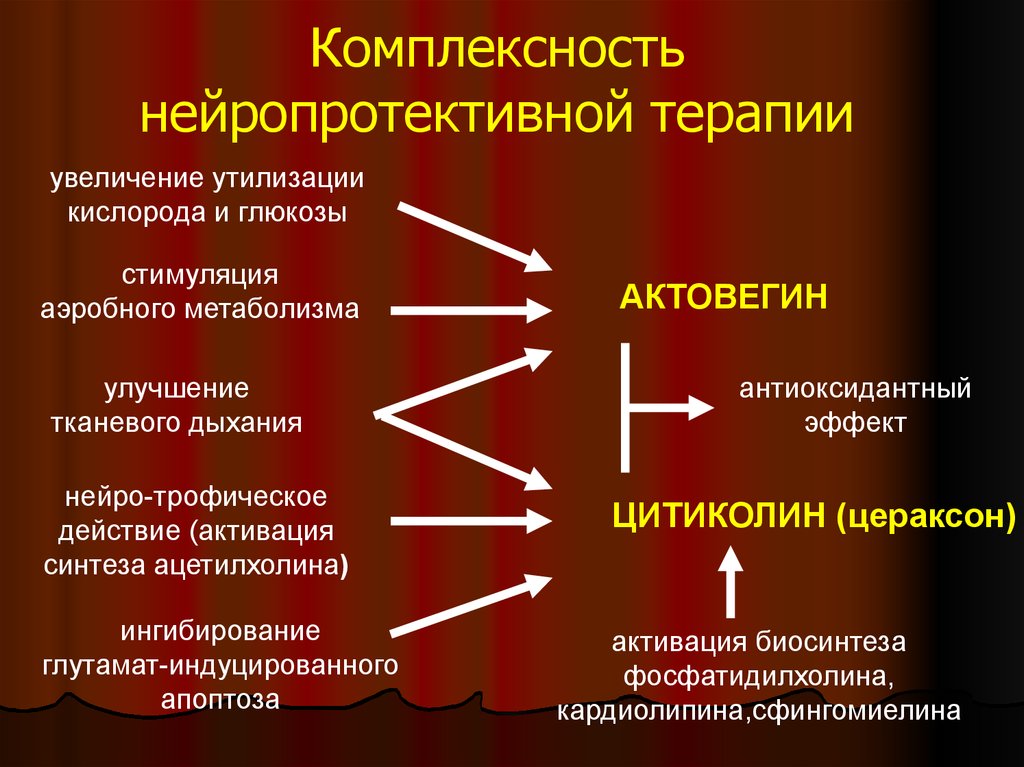
Какие ноотропы чаще всего назначаются в терапевтических целях и для стимуляции когнитивных функций у здоровых людей?
Прежде всего хочу напомнить, что ноотропы – это вещества, которые свой активирующий эффект на центральную нервную систему (ЦНС) реализуют, воздействуя на основные нейромедиаторные системы мозга:
• Моноаминергическую.
• Холинергическую.
• Глутаматергическую.
При этом ноотропы влияют на такие процессы в нейронах:
• Синтез РНК, белков, а также фосфолипидов мембран нейронов, чем способствует лучшему и сбалансированному обмену нейромедиаторов в синапсах нервных клеток.
• Снижение потребности в кислороде и сохранение нормальной функции нервной ткани в условиях гипоксии.
• Ингибирование образования свободных R, их ускоренную элиминацию их нейронов, а также блокирование перекисного окисления липидов, что предупреждает преждевременное разрушение нервных клеток.
• Усиление устойчивости нейронов к неблагоприятным факторам (интоксикации, нейроинфекциям, нервным перегрузкам и стрессам).
Чтобы понять особенности подбора нооторопных препаратов нужно знать, с какой нейромедиаторной системе они имеют сродство и за что она отвечает.
Представители моноаминовых нейромедиаторов (гистамин, дофамин, серотонин, адреналин и норадреналин, мелатонин) отвечают за такие процессы, как:
• Эмоции.
• Внимание.
• Когнитивные (познавательные) функции.
• Возбуждение.
• Запоминание.
Холинергические нейромедиаторы (НМ) регулируют следующие процессы в ЦНС:
• Баланс возбуждения и торможения.
• Передача импульсов, обеспечивающих двигательную активность.
• Автономное функционирование внутренних органов и жизненно важные процессы, связанные с их деятельностью.
Дефицит холинергетических НМ может вызывать неврологические нарушения и патологию эмоционально-волевой сферы.
Глутаматергические НМ участвуют в процессах, обеспечивающих когнитивные функции мозга и память, а именно прием, обработку и хранение информации. С ними также связаны реакция на боль, координация моторики, иммунный ответ организма и передача нервных сигналов на всех уровнях нервной системы.
В последние годы на постсоветском пространстве, в Европе и США проводятся серьезные клинические исследования ноотропных препаратов для выявления и доказательства их терапевтической эффективности в разных отраслях медицины. Пока не существуют достоверные доказательства их общего позитивного влияния на нервную систему, если не считать доказанного лечебного эффекта при лечении некоторых видов эпилепсии.
Положительные результаты действия ноотропов в качестве нейропротекторов и при когнитивных расстройствах различной этиологии отражены в публикациях на страницах научных журналов и информационных порталах в интернете. Единственное, чего не хватает для убедительности и доказательности статистики – это довольно небольшой охват статистических групп. Обычно он не превышает 10-20 человек и в основном касается случаев из клинической практики.
Тем не менее, ноотропы широко представлены на фармакологическом рынке и активно используются в медицинской практике. Кроме того, они даже самостоятельно назначаются себе отдельными лицами, заинтересованными в «разгонке мозга» при экстремальных и/или требующих усиленного умственного напряжения обстоятельствах.
В международной терапевтическо-химической классификации лекарственных средств можно найти ноотропы в списке N06BX (психостимуляторы и средства при синдроме дефицита внимания с гиперактивностью.
Какие ноотропы (список препаратов и их характеристика) широко используются в педиатрии?
Прежде всего, хочу напомнить, что ноотропы в педиатрии имеют довольно четкие показания для назначения. Это прежде всего, такие состояния:
• Профилактика и лечение отставания ребенка в психическом, моторном и речевом (после 3-х лет) развитии.
• Стимуляция функций ЦНС, связанных с процессами обучения, концентрации внимания, запоминания и воспроизведения информации.
• Органические поражения ЦНС в результате нейроинфекций, черепно-мозговых травм, генетических заболеваний.
• ДЦП.
• Расстройства мочеиспускания нейрогенной природы.
• Заикание.
• Комплексная терапия эпилепсии.
• Невротические состояния и астения (синдром навязчивых состояний)
• СДВГ – синдром дефицита внимания и гиперактивности.
Чаще всего детям назначаются ноотропы из списка так называемых истинных ноотропов, влияющих в первую очередь на мнестические (память) и когнитивные (познавательные) способности человека любого возраста. Это такие ноотропные препараты, как:
• Рацетамы.
• Нейропептиды.
• Холинергические ноотропы.
• Нейропротекторы.
• Активаторы аминокислот и ГАМК (гамма-аминомасляной кислоты).
• Антиоксиданты.
Из Рацетамов наиболее значимым и распространенным является Пирацетам – препарат, используемый врачами уже почти 50 лет и являющийся родоначальником ноотропных препаратов, список которых постоянно расширяется и обновляется. Известен под коммерческим названием ноотропил. У детей особенно эффективен, как стимулятор развития речи, а также хорошо помогает при ДЦП и олигофрении, при реабилитации после ЧМТ и интоксикаций ГМ, способствует повышению способности к обучению. Выпускается в самых разнообразных фармакологических формах – таблетки, гранулы, капсулы, сиропы, растворы для парентерального введения. Особенность применения – не рекомендуется для приема во второй половине дня.
Особенность применения – не рекомендуется для приема во второй половине дня.
В детском возрасте также часто назначаются такие препараты как:
• Кортексин, который считается лучшим для детей 1-го года жизни. Его можно применять начиная с первого дня рождения. Позитивно влияет на нервную систему, в том числе и периферическую, противодействует токсическим воздействиям, улучшает кровообращение, используется в комплексном лечении эпилепсии. Кроме того, кортексин улучшает память, увеличивает устойчивость к стрессам и эффективен при приеме детьми с задержкой развития (психомоторного и речевого). Довольно популярен у студентов, особенно во время сессий, для улучшения памяти и усвоения больших объемов информации. Кортексин также имеет положительные отзывы у родителей и педиатров, достаточно безопасен, но довольно дорогой. Выпускается в виде лиофилизата (высушенного при минусовой температуре порошка).
• Семакс 0,1% раствор – самый безопасный и выпускаемый в удобной для применения у детей форме назальных капель. Практически не имеет побочных эффектов, кроме редкого и незначительного раздражения слизистой. Относится к ноотропам пептидного ряда, позитивно влияет на внимание, обучаемость и восприятие. Кроме того, он помогает восстановлению и адаптации нервной системы после наркоза. В педиатрии хорошо зарекомендовал себя при терапии мозговых дисфункции у детей старше 5 лет. К плюсам семакса относится высокая безопасность и комфортная для использования форма выпуска. Относительным минусом является необходимость хранения препарата в холодильнике при температуре не выше 8 градусов.
Практически не имеет побочных эффектов, кроме редкого и незначительного раздражения слизистой. Относится к ноотропам пептидного ряда, позитивно влияет на внимание, обучаемость и восприятие. Кроме того, он помогает восстановлению и адаптации нервной системы после наркоза. В педиатрии хорошо зарекомендовал себя при терапии мозговых дисфункции у детей старше 5 лет. К плюсам семакса относится высокая безопасность и комфортная для использования форма выпуска. Относительным минусом является необходимость хранения препарата в холодильнике при температуре не выше 8 градусов.
• Церебролизин, представляющий собой нейропептид животного происхождения (концентрат пептидов из головного мозга свиньи или крупного рогатого скота. Активно используется, как активатор нейронного метаболизма, способствует увеличению концентрации внимания и снижению гиперактивности. Недостатком его является то, что это относительно дорогой препарат и выпускается только в виде инъекционных растворов, а плюсом то, что это один из самых эффективных ноотропов при задержке развития у детей. Побочные действия редкие и сводятся к индивидуальным аллергическим реакциям на компоненты препарата, бессоннице и крайне редко к аритмиям.
Побочные действия редкие и сводятся к индивидуальным аллергическим реакциям на компоненты препарата, бессоннице и крайне редко к аритмиям.
При задержке речевого развития (ЗРР) также эффективны такие ноотропы:
• Аналоги и производные ГАМК (Пикамилон, Пантогам), нормализующие проведение нервных импульсов и улучшающих утилизацию глюкозы и потребление кислорода в нейронах. Являясь тормозными медиаторами они эффективны при гиперактивности и повышенной возбудимости ЦНС.
• Препараты пиритинолового ряда (Энцефабол, Церебол), оказывающие нейропротекторное (стабилизация мембран и ингибирование продукции разрушающих структуру клеток свободных радикалов) и антигипоксическое действие.
• Цераксон – стимулятор деятельности ЦНС, содержащий цитиколин, отвечающий за восстановление мембран нейронов и их энергообеспечение, а также уменьшающий количество межклеточной жидкости в ГМ и оказывая таким образом противоотечное действие. Рекомендуется не только при ЗРР с явлениями заторможенности, но и при аутизме.
Подытоживая ответ на данный вопрос, хочу сказать, что выбор ноотропных препаратов, список которых с учетом препаратов нового поколения, включает более сотни наименований, остается за педиатром. Самостоятельно назначать ноотропы ни в коем случае нельзя, даже ориентируясь на показания, указанные в инструкции. Конечно, ноотропы являются довольно безопасными и положительно влияющими на нервную систему препаратами, но каждый из них имеет свое преимущественное действие и направлено на различные процессы в нервной ткани. Назначив самостоятельно активаторы ЦНС маленькому пациенту с гиперактивностью, родители могут получить усиление активности и повышение возбудимости у своего ребенка, доведя его до нервного срыва и лечения уже у детского психиатра. Предотвращением таких эксцессов является отпуск в аптеках подавляющего большинства ноотропов только по рецепту врача. Некоторые из них можно приобрести и без рецепта, но их список довольно ограничен. На них я остановлюсь более подробно в конце интервью.
Какие ноотропные препараты назначаются людям пожилого возраста и с какой целью?
Показаниями для назначения ноотропов пожилым людям являются такие состояния:
• Болезнь Альцгеймера.
• Синдромы спутанного сознания и фрагментарности мышления.
• Болезнь Пика.
• Дезориентация в пространстве и времени.
• Растерянность и неустойчивость внимания.
• Эмоциональная неуравновешенность.
• Тревожное расстройство.
• Иллюзорность восприятия.
• Проблемы с памятью.
• Нарушения сна.
• Двигательные перевозбуждение или заторможенность.
Кроме того, ноотропы могут назначаться и с профилактической целью, чтобы замедлить возрастные изменения в нервно-психической сфере, связанные с нарушениями мозгового кровообращения, ослаблением памяти и когнитивных возможностей.
Среди ноотропных средств, используемых для пожилых людей, наиболее распространены и популярны такие:
• Кавинтон, действующее вещество которого представлено винпоцетином. Его основное терапевтическое действие направлено на улучшение мозгового кровообращения за счет снижения вязкости крови и соответственно улучшения снабжения мозга кислородом. Для него характерно точечное избирательное действие на пораженную область мозга, поэтому этот ноотропный препарат особенно эффективен при лечении и реабилитации после инсульта, сосудистой деменции и нарушениях мозгового кровообращения. Также применяется при лечении поражений сосудов и сетчатки глаза и болезни Меньера. Среди побочных эффектов могут наблюдаться тошнота, изжога, слабость, головная боль и тахикардия, что является минусом препарата и противопоказанием для его приема при сбоях сердечного ритма (аритмиях).
Его основное терапевтическое действие направлено на улучшение мозгового кровообращения за счет снижения вязкости крови и соответственно улучшения снабжения мозга кислородом. Для него характерно точечное избирательное действие на пораженную область мозга, поэтому этот ноотропный препарат особенно эффективен при лечении и реабилитации после инсульта, сосудистой деменции и нарушениях мозгового кровообращения. Также применяется при лечении поражений сосудов и сетчатки глаза и болезни Меньера. Среди побочных эффектов могут наблюдаться тошнота, изжога, слабость, головная боль и тахикардия, что является минусом препарата и противопоказанием для его приема при сбоях сердечного ритма (аритмиях).
• Энцефабол – стимулирует метаболические процессы в ГМ за счет ускорения утилизацию глюкозы, нормализует кровообращение в пораженных ишемией участках, способствует восстановлению функций нервной системы. Среди других терапевтических эффектов можно отметить улучшение памяти, повышение умственной активности и общего тонуса ЦНС. Хорошо помогает в преодолении негативных последствий перенесенного энцефалита, а также при лечении цереброастенического синдрома и задержке психического развития у детей. Минусом является способность вызывать аллергические реакции у лиц, чувствительных к пиритинолу, а также высокая цена.
Хорошо помогает в преодолении негативных последствий перенесенного энцефалита, а также при лечении цереброастенического синдрома и задержке психического развития у детей. Минусом является способность вызывать аллергические реакции у лиц, чувствительных к пиритинолу, а также высокая цена.
• Фенибут – препарат, сочетающий ноотропное и транквилизирующее действие. Что проявляется в снижении возбудимости нервной системы, уменьшении тревожности и страха. Препарат удлиняет время действия и усиливает эффект снотворных средств. При длительном приеме увеличивает физические и интеллектуальные возможности, нормализует сон, улучшает память. Эффективен в комплексной терапии абстинентного синдрома при алкоголизме. Минусом является возможность проявления синдрома отмены после окончания курса препарата.
• Пикамилон – популярный у врачей и пациентов ноотропный препарат, имеющий несколько эффектов: психостимулятора, транквилизатора и антиоксиданта. Улучшает метаболические процессы и кровоснабжение в мозговой ткани, уменьшает интенсивность головных болей, снимает тревогу и нервное напряжение, а также повышает физические и интеллектуальные возможности человека. Положительно влияет на восстановление двигательных и речевых функций после инсульта и токсических поражений ГМ. У пожилых людей дает хороший эффект при комплексном лечении мигреней, нарушений мозгового кровообращения, а также заболеваний сетчатки глаза. Среди побочных эффектов можно отметить возможность развития аллергического ответа на данный препарат.
Положительно влияет на восстановление двигательных и речевых функций после инсульта и токсических поражений ГМ. У пожилых людей дает хороший эффект при комплексном лечении мигреней, нарушений мозгового кровообращения, а также заболеваний сетчатки глаза. Среди побочных эффектов можно отметить возможность развития аллергического ответа на данный препарат.
К применению ноотропов у пожилых людей следует относиться весьма осторожно с учетом глубины возрастных изменений, возможных побочных действий, преобладающей симптоматики, наличия сопутствующих заболеваний и общего состояния организма. Объективно оценить все эти аспекты и грамотно назначить лечение с применением ноотропов может лишь специалист. Самим назначать эти препараты своим пожилым родственникам крайне нежелательно и небезопасно для их здоровья.
Какие ноотропы наиболее часто используются при психических расстройствах и для стимуляции мозговой деятельности у молодых и среднего возраста людей?
Комбинированная терапия пограничных, легких и тяжелых психических расстройств включает и применение ноотропов, особенно в случае нарушения когнитивных функций, ухудшения настроения и нарушения сна. Они позволяют ускорить получение позитивного результата, улучшить общее психоэмоциональное состояние и повысить эффективность лечения. Чаще всего их назначают при таких состояниях:
Они позволяют ускорить получение позитивного результата, улучшить общее психоэмоциональное состояние и повысить эффективность лечения. Чаще всего их назначают при таких состояниях:
• Сосудистых заболеваниях ГМ, в том числе и сосудистой деменции.
• Психоорганических расстройствах различной этиологии.
• Психических расстройствах как преходящих, так и стойких.
Среди наиболее распространенных и известных ноотропов, используемых в терапии этих состояний можно выделить:
• Ноотропил (пирацетам) и иные производные пирролидона.
• Аналоги ГАМК (Фенибут, Аминалон, Пантогам).
• Производные витамина В6 (пиридоксина), например, Деанол.
• Производные девинкана, такие как Винпоцетин и Винкамин.
• Нейропептидный ряд ноотропов, включая окситоцин, вазопрессин и др.
• Антиоксиданты, например, Мексидол и Токоферол.
Что касается использования ноотропных препаратов у здоровых взрослых людей, то их чаще всего принимают для стимуляции интеллектуальных способностей, памяти и концентрации внимания при усвоении большого массива информации, напряженной умственной работе, экстремальных нервно-психических нагрузках и хронической усталости.
Среди препаратов этой группы наиболее действенны и популярны такие:
• Когитум – препарат французского производства, работающий, как психический стимулятор. Его действующее вещество ацетиламиноянтарная кислота стимулирует обменные процессы в нервной ткани, усиливает иммунитет и физическую выносливость. Кроме того, Когитум ускоряет выведение аммиака из организма и уменьшает негативное воздействие радиации. Применяется, как один из компонентов терапии при астеническом, неврастеническом и абстинентном синдроме, депрессивном состоянии. Оказывает влияние на устойчивость нервной системы в стрессовых ситуациях. Может использоваться для лечения детей с задержкой развития. Минусы – высокая стоимость и возможность появления аллергии на компоненты препарата.
• Пирацетам – все тот же хорошо знакомый родоначальник ноотропов, который одни специалисты не признают, а другие считают из одним из лучших представителей ноотропных средств. Фактически – это универсальный ноотропный препарат, который позитивно влияет на нервную систему у людей различного возраста – детей, взрослых и пожилых. Имеет оптимальное соотношение цены и качества, считается одним из самых эффективных ноотропов, активизирующим обменные нейромедиаторные процессы и ускоряющим передачу нервных сигналов в коре ГМ. Его отличает комплексность действия, а именно – стимулирующее влияние на интеллект и память, антитоксическое действие и активация усвоения глюкозы. Кроме того, пирацетам способствует взаимодействию полушарий ГМ, улучшает мозговое кровообращение без сосудорасширяющего действия. Прием препарата показан для улучшения памяти, концентрации внимания, повышения способности к обучению и усвоению большого количества информации, но имеет ряд «побочек» и противопоказаний.
Имеет оптимальное соотношение цены и качества, считается одним из самых эффективных ноотропов, активизирующим обменные нейромедиаторные процессы и ускоряющим передачу нервных сигналов в коре ГМ. Его отличает комплексность действия, а именно – стимулирующее влияние на интеллект и память, антитоксическое действие и активация усвоения глюкозы. Кроме того, пирацетам способствует взаимодействию полушарий ГМ, улучшает мозговое кровообращение без сосудорасширяющего действия. Прием препарата показан для улучшения памяти, концентрации внимания, повышения способности к обучению и усвоению большого количества информации, но имеет ряд «побочек» и противопоказаний.
• Пантогам считается лучшим ноотропом при синдроме хронической усталости как стимулятор физической и умственной выносливости и работоспособности. К его основным эффектам относят антигипоксическое и антитоксическое действие, активацию пластических процессов в нервных клетках.
Кроме того, он понижает возбудимость нервной системы и благоприятно влияет на поведение человека в социуме, а также усиливает интеллектуальные способности человека. В медицинской практике его активно используют при антистрессовой терапии, при чрезмерных нервных нагрузках, невротических состояниях после перенесенных ЧМТ, а также при снижении способности к концентрации внимания. Его преимуществом является высокая безопасность и минимум побочных эффектов. Относительные недостатки – горький вкус и необходимость длительного приема на протяжении не менее 1 месяца.
В медицинской практике его активно используют при антистрессовой терапии, при чрезмерных нервных нагрузках, невротических состояниях после перенесенных ЧМТ, а также при снижении способности к концентрации внимания. Его преимуществом является высокая безопасность и минимум побочных эффектов. Относительные недостатки – горький вкус и необходимость длительного приема на протяжении не менее 1 месяца.
• Интеллан – препарат растительного происхождения, представляющий собой экстракт растений и плодов, улучшающий мозговой кровоток и активизирующий память и внимание. В его состав входят биологически активные аминокислоты, витамины и микроэлементы. Все эти компоненты благотворно влияют на умственные способности, память, снижают уровень тревожности и депрессии. При этом Интеллан не влияет на способность человека осуществлять любую деятельность, поэтому он считается лучшим ноотропом для водителей. Имеет адекватную цену, но для 4-хнедельного курса препарата необходимо несколько упаковок.
Вы обещали рассказать, какие ноотропные препараты в списке средств, которые можно приобрести без рецепта?
Большинство ноотропов отпускаются в аптеке лишь при наличии рецепта и по назначению врача. Но существует ряд препаратов, которые находятся в свободном доступе и которые может приобрести любой желающий без рецепта от врача. Это такие ноотропные препараты:
Но существует ряд препаратов, которые находятся в свободном доступе и которые может приобрести любой желающий без рецепта от врача. Это такие ноотропные препараты:
• Биотредин, содержащий пиридоксин и треонин (витамин и аминокислота). Средство эффективно помогает при абстинентном синдроме и снижает влечение к алкоголю. Кроме того, снимает психоэмоциональное напряжение, позитивно влияет на интеллектуальные способности у детей и взрослых. Эффективность препарата увеличивается при сочетании с Глицином. Цена Биотредина вполне адекватная, немного кисловатые таблетки кладут под язык и рассасывают. Среди редких побочных эффектов наблюдаются усиленное потоотделение, аллергия и головокружение.
• Ноопепт – лучший безрецептурный ноотроп, реально помогающий при восстановлении после ЧМТ, нарушениях мозгового кровообращения, улучшающий память и внимание. Устраняя нарушения кровотока в ГМ, способствует лучшему усвоению, запоминанию информации и обучению. Принимается курсами минимальной длительностью 1,5 месяца с заметным улучшением уже спустя неделю после начала приема.
• Глицин – самый популярный, недорогой и безопасный ноотроп. Представляет собой аминокислоту, синтезируемую в организме и улучшающую память, умственные способности, снижающую уровень конфликтности, эмоциональной нестабильности и способствующую лучшей адаптации человека в обществе. Кроме того, Глицин нормализует сон, обладает антитоксическим действием, особенно при алкогольном отравлении, повышает устойчивость нервной системы к стрессам. Еще один плюс – возможность применения в педиатрии.
В заключение хочу сказать, что перечисленные препараты представляют собой лишь незначительную часть ноотропных препаратов, список которых постоянно расширяется, как и сфера их применения. К сожалению, эффективность ноотропов недостаточно изучена и достоверными клиническими испытаниями практически не доказана. Положительное влияние ноотропов на нервную систему в общем-то не вызывает сомнений. Все эти укрепляет, усиливает, повышает, стимулирует, активирует, нормализует, стабилизирует и т. п. действительно имеют место, но лишь по отзывам пациентов и мнениям специалистов на основании их врачебной практики. Но как говорится дыма без огня не бывает, популярность ноотропов все-таки свидетельствует об их полезности для нервной системы. Именно спрос рождает предложение, поэтому и существует фармакологическое производство ноотропов как на территории России, так и за рубежом, например, во Франции и Австрии. Мой вам совет, при решении форсировать свою умственную деятельность и память с помощью ноотропов, проконсультируйтесь со специалистом. Возможно, он предложит вам иное решение проблемы, в крайнем случае подберет оптимальный именно для вас ноотропный препарат.
п. действительно имеют место, но лишь по отзывам пациентов и мнениям специалистов на основании их врачебной практики. Но как говорится дыма без огня не бывает, популярность ноотропов все-таки свидетельствует об их полезности для нервной системы. Именно спрос рождает предложение, поэтому и существует фармакологическое производство ноотропов как на территории России, так и за рубежом, например, во Франции и Австрии. Мой вам совет, при решении форсировать свою умственную деятельность и память с помощью ноотропов, проконсультируйтесь со специалистом. Возможно, он предложит вам иное решение проблемы, в крайнем случае подберет оптимальный именно для вас ноотропный препарат.
Нейропротекция при болезни Паркинсона | Клиническая фармация и фармакология | JAMA Внутренняя медицина
Абстрактный
Лечение болезни Паркинсона значительно улучшилось за последнюю четверть века, и появляются многообещающие методы лечения. Хотя лечение леводопой приводит к заметному улучшению симптомов, уровень смертности от этого заболевания остается относительно неизменным. Недавние открытия аномального фолдинга белков в сочетании с окислительным стрессом обеспечивают научное обоснование новых терапевтических стратегий, направленных на замедление прогрессирования заболевания. Чтобы быть эффективными, эти модифицирующие заболевание и нейропротекторные методы лечения должны быть начаты на ранних стадиях заболевания, и поэтому ранняя диагностика имеет решающее значение. Следовательно, врачи первичной медико-санитарной помощи будут играть все более важную роль в раннем внедрении таких нейропротекторных стратегий. Этот обзор предназначен для освещения некоторых недавних достижений в нашем понимании механизмов нейродегенерации и привлечения внимания к важности раннего распознавания и внедрения новых терапевтических вмешательств.
Недавние открытия аномального фолдинга белков в сочетании с окислительным стрессом обеспечивают научное обоснование новых терапевтических стратегий, направленных на замедление прогрессирования заболевания. Чтобы быть эффективными, эти модифицирующие заболевание и нейропротекторные методы лечения должны быть начаты на ранних стадиях заболевания, и поэтому ранняя диагностика имеет решающее значение. Следовательно, врачи первичной медико-санитарной помощи будут играть все более важную роль в раннем внедрении таких нейропротекторных стратегий. Этот обзор предназначен для освещения некоторых недавних достижений в нашем понимании механизмов нейродегенерации и привлечения внимания к важности раннего распознавания и внедрения новых терапевтических вмешательств.
Случайное открытие того, что 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP), «самодельный» аналог меперидина, может вызывать дегенерацию нейронов, продуцирующих дофамин, и вызывать симптомы болезни Паркинсона ( БП), породил новые гипотезы об этиологии и патогенезе заболевания. Современные теории предполагают сложное взаимодействие между генетической предрасположенностью и факторами окружающей среды в сочетании с повышенным окислительным стрессом, митохондриальной дисфункцией, эксайтотоксичностью, образованием аномальных воспалительных цитокинов и аномальной переработкой клеточных белков. Эти и, возможно, другие механизмы приводят к потере дофаминергических нейронов в компактной части черной субстанции, что в конечном итоге вызывает симптомы БП. Дисфункция убиквитин-протеасомной системы, которая в норме служит механизмом выведения аномальных белков, становится ведущим механизмом гибели клеток не только при БП, но и при других нейродегенеративных заболеваниях.
Современные теории предполагают сложное взаимодействие между генетической предрасположенностью и факторами окружающей среды в сочетании с повышенным окислительным стрессом, митохондриальной дисфункцией, эксайтотоксичностью, образованием аномальных воспалительных цитокинов и аномальной переработкой клеточных белков. Эти и, возможно, другие механизмы приводят к потере дофаминергических нейронов в компактной части черной субстанции, что в конечном итоге вызывает симптомы БП. Дисфункция убиквитин-протеасомной системы, которая в норме служит механизмом выведения аномальных белков, становится ведущим механизмом гибели клеток не только при БП, но и при других нейродегенеративных заболеваниях.
Растущее понимание процессов, ведущих к гибели клеток, привело к выводу, что нейропротекция может быть достижимой целью при лечении БП. В отличие от симптоматической терапии, которая предназначена только для облегчения клинических признаков болезни, цель нейропротекторной терапии состоит в том, чтобы защитить или спасти нейроны, уязвимые для нейродегенеративного процесса. Ожидается, что в случае эффективности нейропротекторная терапия замедлит или даже остановит основное прогрессирование дегенерации.
Ожидается, что в случае эффективности нейропротекторная терапия замедлит или даже остановит основное прогрессирование дегенерации.
Нейропротекция должна быть начата на ранней стадии, чтобы быть эффективной, и поэтому очень важно, чтобы диагноз был поставлен как можно раньше после появления симптомов. Поскольку врачи первичного звена являются «привратниками» медицины, на них ложится бремя ранней диагностики. К моменту постановки диагноза обычно уже происходит потеря от 50 до 80% нигральных клеток.  Однако для целей данного обзора мы включим эти стратегии под общим термином « нейропротективные» 9.0016 .
Однако для целей данного обзора мы включим эти стратегии под общим термином « нейропротективные» 9.0016 .
Ранняя диагностика
Болезнь Паркинсона имеет постепенное, коварное начало, что делает раннюю диагностику сложной задачей. Заболевание имеет доклиническую фазу, начинающуюся за 2–6 лет до появления типичных узнаваемых симптомов. 2 ,3 Именно на этом этапе нейропротекция считается наиболее эффективной. Эти ранние доклинические симптомы и признаки БП часто малозаметны и неспецифичны:
В одном ретроспективном исследовании пациентов с БП сообщалось о неспецифических симптомах, включая генерализованную скованность, боль или парестезии в конечностях, запор, бессонницу и уменьшение объема голос. 4 Подробный анамнез показал, что по мере прогрессирования заболевания более специфическими жалобами были проблемы с мелкой моторикой, снижение обоняния, потеря аппетита, тремор, возникающий при тревоге.
Также важно расспросить членов семьи при подозрении на раннюю болезнь Паркинсона. Члены семьи часто ретроспективно сообщают об уменьшении размахивания руками на пораженной стороне пациента, а также о снижении эмоционального выражения и изменениях личности, включая большую интроверсию и негибкость. При физикальном осмотре врач может заметить потерю выражения лица, снижение частоты моргания, нарушение конвергенции взгляда, положительный признак межбровья, замедленность движений, тремор в покое, часто усиливающийся при ходьбе, и потерю способности размахивать руками. Кроме того, при осмотре можно выявить медленную и монотонную речь, зубчатую ригидность в ответ на пассивные движения конечностей, микрографию, медленную и шаркающую походку. Потеря равновесия и постуральных рефлексов обычно является более поздним признаком.
Потеря равновесия и постуральных рефлексов обычно является более поздним признаком.
При подозрении на болезнь Паркинсона врач может провести различные тесты во время посещения офиса, чтобы объективно оценить психические и двигательные нарушения. Унифицированная шкала оценки болезни Паркинсона является золотым стандартом для объективного измерения прогрессирования болезни Паркинсона. Эта шкала оценивает следующие 6 компонентов, связанных с инвалидностью при БП: поведение, повседневная деятельность, исследование двигательных навыков, дополнительные осложнения заболевания или лечения, определение стадии Хена и Яра, а также оценка по шкале активности повседневной жизни Шваба и Англии. . Монтгомери и др. 6 разработал ряд оценок PD, которые включают обоняние пациента, двигательные функции и настроение. Используя данные о том, что обонятельная дисфункция и расстройства настроения, такие как депрессия, часто предшествуют диагностике БП, в этом исследовании была предпринята попытка использовать эти симптомы, чтобы отличить здоровых людей от людей с ранней БП. Хотя индивидуальные оценки моторной функции, обоняния и настроения недостаточно чувствительны для диагностики БП, оценка всех трех компонентов показала относительно высокую чувствительность (69).%) и специфичность (89%). В будущем ранняя диагностика будет зависеть не только от клинического подозрения, но и от функциональной визуализации. Текущие рассматриваемые подходы включают методы визуализации, такие как позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография. И ПЭТ, и однофотонная эмиссионная компьютерная томография вызвали большой интерес, поскольку они показали свою полезность в доклиническом выявлении заболеваний. 7 -9
Хотя индивидуальные оценки моторной функции, обоняния и настроения недостаточно чувствительны для диагностики БП, оценка всех трех компонентов показала относительно высокую чувствительность (69).%) и специфичность (89%). В будущем ранняя диагностика будет зависеть не только от клинического подозрения, но и от функциональной визуализации. Текущие рассматриваемые подходы включают методы визуализации, такие как позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография. И ПЭТ, и однофотонная эмиссионная компьютерная томография вызвали большой интерес, поскольку они показали свою полезность в доклиническом выявлении заболеваний. 7 -9
нейропротекция
Хотя леводопа считается золотым стандартом лечения БП, при длительной терапии возникают многочисленные осложнения, такие как двигательные флуктуации, галлюцинации и психоз (табл. 1). 10 ,11 Считается, что эти симптомы связаны как с длительной терапией леводопой, так и с прогрессированием заболевания. Кроме того, при деградации леводопы образуется много токсичных метаболитов, которые могут вызывать окислительный стресс в нейронах. Культивируемые дофаминергические нейроны подвергались некрозу или апоптозу при воздействии леводопы, 12 , что позволяет предположить, что леводопа становится токсичной при определенном пороге. Другая гипотеза состоит в том, что леводопа преимущественно оказывает токсическое действие на ранее поврежденные нейроны. 13 Доказательств in vivo того, что леводопа вызывает нейротоксичность, в настоящее время не существует. 11 Тем не менее, существует теоретическая возможность усиления окислительного стресса, связанного с леводопой, и было отмечено, что терапия леводопой связана с развитием двигательных осложнений у большинства пациентов в течение 5 лет после начала терапии. Это привело к убеждению, что лечение леводопой следует отложить как можно дольше, и послужило стимулом для оценки новых препаратов для лечения БП. Исследования были сосредоточены на препаратах, щадящих леводопу, таких как ингибиторы моноаминоксидазы (МАО) и агонисты дофамина, которые не только оказывают симптоматическое действие, но также могут оказывать нейропротекторное действие, позволяя снизить дозировку леводопы и другие механизмы.
Кроме того, при деградации леводопы образуется много токсичных метаболитов, которые могут вызывать окислительный стресс в нейронах. Культивируемые дофаминергические нейроны подвергались некрозу или апоптозу при воздействии леводопы, 12 , что позволяет предположить, что леводопа становится токсичной при определенном пороге. Другая гипотеза состоит в том, что леводопа преимущественно оказывает токсическое действие на ранее поврежденные нейроны. 13 Доказательств in vivo того, что леводопа вызывает нейротоксичность, в настоящее время не существует. 11 Тем не менее, существует теоретическая возможность усиления окислительного стресса, связанного с леводопой, и было отмечено, что терапия леводопой связана с развитием двигательных осложнений у большинства пациентов в течение 5 лет после начала терапии. Это привело к убеждению, что лечение леводопой следует отложить как можно дольше, и послужило стимулом для оценки новых препаратов для лечения БП. Исследования были сосредоточены на препаратах, щадящих леводопу, таких как ингибиторы моноаминоксидазы (МАО) и агонисты дофамина, которые не только оказывают симптоматическое действие, но также могут оказывать нейропротекторное действие, позволяя снизить дозировку леводопы и другие механизмы.
Ингибиторы Мао
N -метил-4-фенилпиридиний (MPP+), продукт окисления MPTP, обычно поглощается дофаминергическими окончаниями и нарушает функцию митохондрий клетки, что в конечном итоге приводит к гибели нейрона. Селегилина гидрохлорид (также известный как L-депренил), селективный необратимый ингибитор МАО-В, предотвращает токсичность МРТР, блокируя окисление МРТР до МРР+. Кроме того, селегилин потенцирует действие леводопы, уменьшая количество препарата, необходимое для контроля симптомов. Было обнаружено, что селегилин оказывает умеренное положительное влияние на симптомы БП и помогает сгладить вызванные леводопой двигательные колебания. 14
Многие лабораторные и клинические исследования показали, что селегилин оказывает нейропротекторное действие не только благодаря своим антиоксидантным и леводопо-сберегающим свойствам, но и благодаря своему антиапоптотическому действию. 10 В клиническом исследовании DATATOP (антиоксидантная терапия депренилом и токоферолом паркинсонизма) изучалось нейропротекторное действие селегилина и α-токоферола (витамина Е). 15 Хотя исследование ясно показало, что селегилин отсрочивает необходимость терапии леводопой примерно на 9месяцев интерпретация этого вывода была затруднена симптоматическими эффектами селегилина, и было невозможно сделать вывод о том, что селегилин оказывает какое-либо нейропротекторное действие. Тем не менее, у пациентов, получавших селегилин, ухудшение состояния было значительно меньше, чем у пациентов, получавших плацебо, с более длительной выживаемостью. 16 Хотя точный нейропротекторный механизм селегилина неясен, все больше и больше данных свидетельствуют о том, что он не зависит от его способности блокировать МАО-В. Было показано, что селегилин не только предотвращает возникновение окислительного повреждения, но также спасает культивируемые нейроны от окислительного повреждения, вызванного MPP+. 17 Эти и другие исследования предполагают, что нейропротекторный эффект селегилина может быть связан с некоторым трофическим эффектом. Это относится к его аналогу TCH 346, который, связываясь с глицеральдегид-3-фосфатдегидрогеназой, предотвращает ее транслокацию в ядро клетки и, таким образом, предотвращает апоптоз.
15 Хотя исследование ясно показало, что селегилин отсрочивает необходимость терапии леводопой примерно на 9месяцев интерпретация этого вывода была затруднена симптоматическими эффектами селегилина, и было невозможно сделать вывод о том, что селегилин оказывает какое-либо нейропротекторное действие. Тем не менее, у пациентов, получавших селегилин, ухудшение состояния было значительно меньше, чем у пациентов, получавших плацебо, с более длительной выживаемостью. 16 Хотя точный нейропротекторный механизм селегилина неясен, все больше и больше данных свидетельствуют о том, что он не зависит от его способности блокировать МАО-В. Было показано, что селегилин не только предотвращает возникновение окислительного повреждения, но также спасает культивируемые нейроны от окислительного повреждения, вызванного MPP+. 17 Эти и другие исследования предполагают, что нейропротекторный эффект селегилина может быть связан с некоторым трофическим эффектом. Это относится к его аналогу TCH 346, который, связываясь с глицеральдегид-3-фосфатдегидрогеназой, предотвращает ее транслокацию в ядро клетки и, таким образом, предотвращает апоптоз. 18
18
Агонисты дофамина
Агонисты дофамина напрямую стимулируют дофаминовые рецепторы, уменьшая пресинаптический синтез дофамина и количество леводопы, необходимое для контроля заболевания. Хотя агонисты дофамина использовались для облегчения симптомов при БП в течение 30 лет, в настоящее время внимание сосредоточено на предполагаемых нейропротекторных эффектах этих препаратов. Доклинические исследования показали, что агонисты дофамина могут оказывать нейропротекторное действие посредством различных механизмов. 19 ,20 Агонисты дофамина снижают метаболизм дофамина, оказывают леводопо-сберегающий эффект и отсрочивают начало терапии леводопой. В дополнение к подавлению оборота дофамина путем стимуляции дофаминовых ауторецепторов агонисты дофамина могут также оказывать прямое антиоксидантное действие из-за их способности улавливать свободные радикалы. 19 Предварительная обработка культивируемых и in vivo черных клеток спорыньей (например, бромокриптин и перголид) и неэрготными (например, прамипексол и ропинирол) агонистами дофамина защищала клетки от гибели в результате окислительного повреждения. 20 ,21 Предварительная инкубация также защищала клетки от индуцированной глутаматом токсичности. 20 Исследования ропинирола показали, что его нейропротекторные эффекты могут включать активацию глутатиона, каталазы и супероксиддисмутазы. 21
20 ,21 Предварительная инкубация также защищала клетки от индуцированной глутаматом токсичности. 20 Исследования ропинирола показали, что его нейропротекторные эффекты могут включать активацию глутатиона, каталазы и супероксиддисмутазы. 21
Дальнейшее подтверждение нейропротекторных эффектов агонистов дофамина было получено в двух недавних исследованиях, оценивающих прогрессирование заболевания с помощью функциональной визуализации. Исследовательская группа Паркинсона использовала однофотонную эмиссионную компьютерную томографию для сравнения влияния прамипексола и леводопы на прогрессирование болезни Паркинсона. Результаты 46-месячного исследования показали, что у пациентов, принимавших прамипексол, была снижена потеря дофаминергических нейронов по сравнению с пациентами, принимавшими леводопу. 22 В исследовании Requip as Early Therapy по сравнению с L-допой–ПЭТ (REAL-PET) использовалось сканирование ПЭТ для оценки прогрессирования болезни Паркинсона у пациентов, принимавших ропинирол гидрохлорид (Requip; SmithKline Beecham Pharmaceuticals, Аксбридж, Англия) по сравнению с леводопой. Это двухлетнее двойное слепое исследование показало, что лечение ропиниролом по сравнению с леводопой приводит к значительно более медленному снижению поглощения флуродопа. 23 Хотя эти исследования не являются окончательными, они предоставляют важные доказательства, подтверждающие роль агонистов дофамина в качестве модифицирующих заболевание и, возможно, нейропротекторных средств.
Это двухлетнее двойное слепое исследование показало, что лечение ропиниролом по сравнению с леводопой приводит к значительно более медленному снижению поглощения флуродопа. 23 Хотя эти исследования не являются окончательными, они предоставляют важные доказательства, подтверждающие роль агонистов дофамина в качестве модифицирующих заболевание и, возможно, нейропротекторных средств.
Антагонисты Нмда
Поскольку повреждение нейронов в результате глутаматергической токсичности является одной из ведущих гипотез нейродегенерации, антагонисты рецепторов глутамата N -метил-D-аспартат (NMDA) становятся все более важными кандидатами для нейропротекторных клинических испытаний. Хотя амантадин, частичный антагонист NMDA, используется при БП более 30 лет, его роль в нейропротекции в настоящее время изучается. Мало того, что амантадин является леводопо-сберегающим препаратом, у пациентов, получавших амантадин, было повышено время выживания, что свидетельствует о нейропротекторном эффекте. 24 Кроме того, было показано, что амантадин и другие антагонисты NMDA полезны при лечении леводопа-индуцированных дискинезий. 25
24 Кроме того, было показано, что амантадин и другие антагонисты NMDA полезны при лечении леводопа-индуцированных дискинезий. 25
Антиапоптотическая терапия
Хотя механизмы гибели клеток при БП до конца не изучены, в черных нейронах пациентов с БП были обнаружены повышенные уровни проапоптотических сигнальных белков. Ожидается, что агенты, предназначенные для модификации этих белков и изменения путей, ведущих к апоптозу, будут оказывать нейропротекторное действие при БП и других заболеваниях, связанных с апоптозом. Препараты, действующие как ингибиторы каспаз или иммуномодуляторы, а также другие антиапоптотические агенты в настоящее время исследуются в центрах БП по всему миру. 26 -28
Текущие терапевтические рекомендации
Наиболее важной терапевтической стратегией при БП является адаптация лечения к потребностям каждого пациента. 18 Хотя время начала терапии и порядок приема препаратов остаются спорными, большинство паркинсонологов поддерживают идею отсрочки применения леводопы до тех пор, пока другие препараты (например, селегилин, антихолинергические средства, амантадин и агонисты дофамина) не подействуют для адекватного контроля симптомов. В нашей практике пациентам с диагнозом БП, никогда ранее не получавшим лечения, обычно сначала назначают селегилин из-за его способности отсрочивать потребность в леводопе. Назначение селегилина и других препаратов прелеводопы состоит не в том, чтобы полностью контролировать все симптомы, а в том, чтобы уменьшить их, чтобы пациент мог функционировать дома и на работе. Когда селегилин терапевтически исчерпан, выбор следующего лекарства зависит от возраста пациента. Пациенты моложе 65 лет и с когнитивными способностями могут начинать лечение либо амантадином, либо антихолинергическими средствами (рис. 1). 18 Амантадин может уменьшать все основные признаки паркинсонизма, и у него одно из лучших соотношений риска и пользы среди всех противопаркинсонических препаратов. Кроме того, было показано, что он уменьшает дискинезии, вызванные леводопой. Антихолинергические средства (например, тригексифенидил) особенно полезны у пациентов с беспокоящим тремором, но побочные эффекты, такие как сухость во рту, задержка мочи, запор и когнитивные нарушения, обычно ограничивают их применение.
В нашей практике пациентам с диагнозом БП, никогда ранее не получавшим лечения, обычно сначала назначают селегилин из-за его способности отсрочивать потребность в леводопе. Назначение селегилина и других препаратов прелеводопы состоит не в том, чтобы полностью контролировать все симптомы, а в том, чтобы уменьшить их, чтобы пациент мог функционировать дома и на работе. Когда селегилин терапевтически исчерпан, выбор следующего лекарства зависит от возраста пациента. Пациенты моложе 65 лет и с когнитивными способностями могут начинать лечение либо амантадином, либо антихолинергическими средствами (рис. 1). 18 Амантадин может уменьшать все основные признаки паркинсонизма, и у него одно из лучших соотношений риска и пользы среди всех противопаркинсонических препаратов. Кроме того, было показано, что он уменьшает дискинезии, вызванные леводопой. Антихолинергические средства (например, тригексифенидил) особенно полезны у пациентов с беспокоящим тремором, но побочные эффекты, такие как сухость во рту, задержка мочи, запор и когнитивные нарушения, обычно ограничивают их применение. После добавления амантадина или антихолинергических средств к селегилину рекомендуется попробовать агонисты дофамина. Многие исследования в настоящее время подтверждают мнение о том, что монотерапия агонистами дофамина, особенно прамипексолом, ропиниролом и перголидом мезилатом, может отсрочить применение леводопы на несколько лет. Леводопа должна использоваться после того, как лечение всеми другими лекарствами перестанет быть эффективным. Пациентам старше 65 лет или тем, у кого наблюдаются даже легкие когнитивные нарушения, не следует назначать антихолинергические препараты, так как любой симптоматический эффект обычно сводится на нет побочными эффектами. Общепризнанно, что пожилые пациенты могут начинать терапию леводопой раньше, чем более молодые пациенты. За исключением случаев крайней необходимости из-за неприятных симптомов, которые мешают социальной или профессиональной деятельности, молодым пациентам почти никогда не следует назначать леводопу, поскольку у них особенно высок риск раннего развития двигательных осложнений.
После добавления амантадина или антихолинергических средств к селегилину рекомендуется попробовать агонисты дофамина. Многие исследования в настоящее время подтверждают мнение о том, что монотерапия агонистами дофамина, особенно прамипексолом, ропиниролом и перголидом мезилатом, может отсрочить применение леводопы на несколько лет. Леводопа должна использоваться после того, как лечение всеми другими лекарствами перестанет быть эффективным. Пациентам старше 65 лет или тем, у кого наблюдаются даже легкие когнитивные нарушения, не следует назначать антихолинергические препараты, так как любой симптоматический эффект обычно сводится на нет побочными эффектами. Общепризнанно, что пожилые пациенты могут начинать терапию леводопой раньше, чем более молодые пациенты. За исключением случаев крайней необходимости из-за неприятных симптомов, которые мешают социальной или профессиональной деятельности, молодым пациентам почти никогда не следует назначать леводопу, поскольку у них особенно высок риск раннего развития двигательных осложнений. После добавления леводопы дозировка должна быть минимальной и дополняться агонистами дофамина и катехолом 9.0015 O -ингибиторы метилтрансферазы (например, энтакапон), особенно когда его действие ослабевает и возникают другие двигательные осложнения. Хирургическое вмешательство (например, паллидотомия или глубокая стимуляция мозга) может быть вариантом лечения пациентов с функциональными нарушениями, несмотря на оптимальную медикаментозную терапию. 29
После добавления леводопы дозировка должна быть минимальной и дополняться агонистами дофамина и катехолом 9.0015 O -ингибиторы метилтрансферазы (например, энтакапон), особенно когда его действие ослабевает и возникают другие двигательные осложнения. Хирургическое вмешательство (например, паллидотомия или глубокая стимуляция мозга) может быть вариантом лечения пациентов с функциональными нарушениями, несмотря на оптимальную медикаментозную терапию. 29
Несмотря на отсутствие убедительных доказательств фармакологической нейропротекции при БП, роль врачей первичного звена в лечении БП становится все более четкой. Если нейропротекторная терапия благоприятно влияет на течение заболевания, то необходимо раннее назначение препаратов, модифицирующих течение болезни. В этом обзоре мы попытались обобщить современные представления об обосновании терапевтических стратегий, но важно подчеркнуть, что по мере изменения нашего понимания механизмов нейродегенерации будут меняться и терапевтические рекомендации. Ранняя диагностика имеет решающее значение не только для максимизации потенциальных преимуществ быстрого нейропротекторного вмешательства, но и для информирования пациента о новых и появляющихся методах лечения. Врачи первичной медико-санитарной помощи должны ознакомиться с региональными центрами, обладающими опытом экспериментальной терапии БП, чтобы они могли направлять пациентов для оценки в качестве потенциальных субъектов клинических испытаний. В настоящее время по меньшей мере дюжина новых и многообещающих терапевтических стратегий исследуется в различных академических центрах, большинство из которых являются членами консорциума клинических исследователей — Исследовательской группы Паркинсона (http://www.Parkinson-study-group.org). . Будущий успех в лечении БП будет зависеть от тесного сотрудничества между клиническими исследователями и врачами первичного звена.
Ранняя диагностика имеет решающее значение не только для максимизации потенциальных преимуществ быстрого нейропротекторного вмешательства, но и для информирования пациента о новых и появляющихся методах лечения. Врачи первичной медико-санитарной помощи должны ознакомиться с региональными центрами, обладающими опытом экспериментальной терапии БП, чтобы они могли направлять пациентов для оценки в качестве потенциальных субъектов клинических испытаний. В настоящее время по меньшей мере дюжина новых и многообещающих терапевтических стратегий исследуется в различных академических центрах, большинство из которых являются членами консорциума клинических исследователей — Исследовательской группы Паркинсона (http://www.Parkinson-study-group.org). . Будущий успех в лечении БП будет зависеть от тесного сотрудничества между клиническими исследователями и врачами первичного звена.
Автор, ответственный за переписку, и оттиски: Джозеф Янкович, доктор медицинских наук, Центр болезни Паркинсона и клиника двигательных расстройств, отделение неврологии, Медицинский колледж Бейлора, 6550 Fannin St, Suite 1801, Houston, TX 77030.
Принято к публикации 7 октября 2002 г.
Эта работа была частично поддержана грантом Национального фонда Паркинсона, Майами, Флорида
использованная литература
1.
Фернли Джей Лис Старение и болезнь Паркинсона: региональная избирательность черной субстанции. Мозг. 1991;1142283- 2301PubMedGoogle ScholarCrossref
2.
Kraus P Ранняя диагностика болезни Паркинсона: ограничение биохимических маркеров и инструментальных методов. Приложение J Neural Transm. 1996;4823- 28PubMedGoogle Scholar
3.
Брукс D Ранняя диагностика болезни Паркинсона. Энн Нейрол. 1998;44(приложение 1)S10- S18PubMedGoogle ScholarCrossref
4.
Przuntek H Ранняя диагностика болезни Паркинсона. Приложение J Neural Transm. 1992;38105- 114PubMedGoogle Scholar
5.
Гонера ЭГван’т Хоф Бергер HJC и другие. Симптомы и продолжительность продромальной фазы болезни Паркинсона. Мов расстройство. 1997;12871- 876PubMedGoogle ScholarCrossref
6.
Монтгомери Эколлер WЛаМантия Т и другие. Раннее выявление вероятной идиопатической болезни Паркинсона: разработка набора диагностических тестов. Мов Расстройство. 2000;15467- 473PubMedGoogle ScholarCrossref
7.
Брукс
Конечные точки DJ Imaging для мониторинга нейропротекции при болезни Паркинсона. Энн Нейрол. 2003;53(приложение 3)S110- S119PubMedGoogle ScholarCrossref
2003;53(приложение 3)S110- S119PubMedGoogle ScholarCrossref
8.
Tissingh Бергманс PBooij Дж и другие. Пациенты с болезнью Паркинсона на стадиях I и II, ранее не получавшие лекарственные препараты, демонстрируют двустороннее снижение транспортеров дофамина в полосатом теле, что было выявлено с помощью [123I]β-CIT SPECT. J Нейрол. 1998;24514- 20PubMedGoogle ScholarCrossref
9.
Тедрофф Йэкесбо АРыдин ЭЛангстрем Бхагберг G Регуляция дофаминергической активности на ранней стадии болезни Паркинсона. Энн Нейрол. 1999;46359- 365PubMedGoogle ScholarCrossref
10.
Оланов
CWTatton
У.Г. Дженнер
P Механизмы гибели клеток при болезни Паркинсона. Янкович
Джей Толоса
Идс. Болезнь Паркинсона и двигательные расстройства 4-е изд. Philadephia, Pa Lippincott Williams & Wilkins 2002; Google Scholar
Болезнь Паркинсона и двигательные расстройства 4-е изд. Philadephia, Pa Lippincott Williams & Wilkins 2002; Google Scholar
11.
Jankovic J Сильные и слабые стороны леводопы. Неврология. 2002;58(приложение 1)S19- S32PubMedGoogle ScholarCrossref
12.
Цзоу ЛЯнкович Джей Роу DBXie WAppel ШЛе W Нейропротекция прамипексола против цитотоксичности, вызванной дофамином и леводопой. Науки о жизни. 1999;641275- 1285PubMedGoogle ScholarCrossref
13.
Дженнер P Окислительный стресс при болезни Паркинсона. Энн Нейрол. 2003;53(приложение 3)S26- S38PubMedGoogle ScholarCrossref
14.
Гилади Н.МакДермотт MPFahn С.Пшедборски СЯнкович Джей Стерн Таннер Кандидат исследовательской группы Паркинсона, Замирание походки при болезни Паркинсона: прогрессивная оценка когорты DATATOP. Неврология. 2001;561712- 1721PubMedGoogle ScholarCrossref
15.
Shoulson IOakes ДФан С и другие. Влияние длительного приема депренила (селегилина) на леводопа-леченную болезнь Паркинсона: рандомизированное плацебо-контролируемое расширение антиокислительной терапии депренилом и токоферолом при лечении паркинсонизма. Энн Нейрол. 2002;51604- 612PubMedGoogle ScholarCrossref
16.
Оланов
CMyllyla
В.Сотаниеми
К
и другие. Влияние селегилина на смертность у пациентов с болезнью Паркинсона. Неврология. 1998;51825- 830PubMedGoogle ScholarCrossref
Неврология. 1998;51825- 830PubMedGoogle ScholarCrossref
17.
Grunblatt Э.Мендель Юдим M Нейропротекторные стратегии при БП с использованием моделей 6-гидроксидофамина и MPTP. Ann N Y Acad Sci. 2000;899262- 273PubMedGoogle ScholarCrossref
18.
Вальдмайер ПКБултон AACools дополненная реальность и другие. Нейроспасательные эффекты лиганда GAPDH CGP 3466B. Приложение J Neural Transm. 2000;60197- 214PubMedGoogle Scholar
19.
Le Янкович JXie WAppel S Антиоксидантное свойство прамипексола не зависит от активации дофаминовых рецепторов при нейропротекции. J Нейронная передача. 2000;1071165- 1173PubMedGoogle ScholarCrossref
20.
Альског JE Замедление прогрессирования болезни Паркинсона: недавние испытания агонистов дофамина. Неврология. 2003;60381- 389PubMedGoogle ScholarCrossref
21.
Iida М.Миядзаки ITanaka ККабуто Хивата-Итикава Эогава Антиоксидантное и нейропротекторное действие ропинирола, агониста дофамина, опосредованное рецептором N допамина D2. Мозг Res. 1999;83851- 59PubMedGoogle ScholarCrossref
22.
Parkinson Study Group, Визуализация транспортеров дофамина в головном мозге для оценки влияния прамипексола по сравнению с леводопой на прогрессирование болезни Паркинсона. ЯМА. 2002;2871653- 1661PubMedGoogle ScholarCrossref
23.
Кто
АЛРеми
PDavis
МИСТЕР
и другие. Исследование REAL-PET: более медленное прогрессирование ранней болезни Паркинсона при лечении ропиниролом по сравнению с леводопой. Неврология. 2002;58(дополнение 3)A82- A83Google Scholar
Исследование REAL-PET: более медленное прогрессирование ранней болезни Паркинсона при лечении ропиниролом по сравнению с леводопой. Неврология. 2002;58(дополнение 3)A82- A83Google Scholar
24.
Uitti RJRajput Альског Дж и другие. Лечение амантадином является независимым предиктором улучшения выживаемости при болезни Паркинсона. Неврология. 1996;461551- 1556PubMedGoogle ScholarCrossref
25.
Verhagen Metman LDotto PDLePoole К и другие. Амантадин при леводопа-индуцированных дискинезиях: последующее исследование в течение 1 года. Арка Нейрол. 1999;561383- 1386PubMedGoogle ScholarCrossref
26.
Янкович
J Новые и появляющиеся методы лечения болезни Паркинсона. Арка Нейрол. 1999;56785- 790PubMedGoogle ScholarCrossref
Арка Нейрол. 1999;56785- 790PubMedGoogle ScholarCrossref
27.
Китамура Ю.Какимура JTaniguchi T Противопаркинсонические препараты и их нейропротекторное действие. Бык Биол Фарм. 2002;25284- 290PubMedGoogle ScholarCrossref
28.
Tintner РЯнкович J Варианты лечения болезни Паркинсона. Curr Opin Neurol. 2002;15467- 476PubMedGoogle ScholarCrossref
29.
Янкович
J Терапевтические стратегии при болезни Паркинсона. Янкович
Джей Толоса
Идс. Болезнь Паркинсона и двигательные расстройства 4-е изд. Филадельфия, штат Пенсильвания.
J Хирургия болезни Паркинсона и других двигательных расстройств: преимущества и ограничения абляции, стимуляции, восстановления и облучения. Арка Нейрол. 2001;581970- 1972PubMedGoogle ScholarCrossref
Арка Нейрол. 2001;581970- 1972PubMedGoogle ScholarCrossref
Решение для неврологических заболеваний?
Нейропротекция относится к механизмам и стратегиям, направленным на защиту нервной системы от травм и повреждений, особенно у людей, перенесших травму или у которых развилось заболевание, имеющее неврологические последствия.
Исследователи ищут способы защитить организм после острых событий, таких как инсульт или повреждение нервной системы, а также помочь людям с состояниями, поражающими нервную систему, такими как болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз (РС). .
Современные нейропротекторы не могут обратить вспять существующее повреждение, но они могут защитить нервы от дальнейшего повреждения и замедлить дегенерацию центральной нервной системы (ЦНС).
В настоящее время ученые изучают широкий спектр методов лечения, и некоторые из них уже используются сегодня. Некоторые подходы могут помочь при более чем одном состоянии, поскольку разные неврологические состояния часто имеют одни и те же характеристики.
Различные состояния, связанные с ЦНС, могут иметь разные симптомы, но процессы, при которых нейроны или нервные клетки умирают, часто схожи.
В настоящее время ученые считают, что к этим процессам относятся:
Окислительный стресс
Поделиться на Pinterest Неврологические повреждения лежат в основе целого ряда проблем со здоровьем.Некоторые химические реакции в организме производят отходы, называемые свободными радикалами. Эти электрически заряженные частицы возникают в среде, богатой кислородом. Они могут взаимодействовать, воздействовать на другие вещества и вызывать повреждение клеток.
Организм может удалить нежелательные свободные радикалы, но если он не может удалить их все, может возникнуть окислительный стресс.
В нервной системе окислительный стресс может увеличить риск болезни Альцгеймера.
Митохондриальная дисфункция
Митохондрии представляют собой специализированные структуры внутри клеток, которые генерируют энергию.
Ученые связывают проблемы с митохондриями в нейронах с депрессией, рассеянным склерозом, боковым амиотрофическим склерозом (БАС), болезнью Альцгеймера, Паркинсона и другими.
Эксайтотоксичность
Нервные клетки головного мозга могут погибнуть, если они станут сверхактивными.
Глутамат, химическое вещество мозга, стимулирует взаимодействие между нервными клетками. Это важный этап нейротрансмиссии, то есть процесса передачи информации от одной нервной клетки к другой.
Однако избыток глутамата может привести к разрушению клеток. Чрезмерная стимуляция нервов нервными импульсами может привести к повреждению или потере функции.
Эксайтотоксичность является ключевым фактором повреждения нервов после инсульта.
Воспалительные изменения
Воспаление является неотъемлемой частью иммунного ответа организма. Это может произойти в любом месте тела, когда иммунная система реагирует на чужеродный организм или инфекцию. Это также может произойти после повреждения клеток или травмы, когда организм пытается восстановить себя.
Когда воспаление возникает в головном мозге или ЦНС, оно может привести к гибели нейронов
Может способствовать гибели клеток при болезни Альцгеймера, Паркинсона и инфекциях головного мозга и ЦНС.
Накопление железа
Накопление железа в головном мозге может играть роль в развитии дегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и БАС, возможно, как часть цикла эксайтотоксичности и гибели клеток.
Исследователи ищут вещества, которые могут помочь удалить избыток железа из ЦНС. Использование этих веществ для удаления железа потенциально может восстановить баланс мозга и ЦНС.
Белки мозга
При деменции в мозгу накапливаются определенные белки.
Исследователи обнаружили высокий уровень белка, называемого фактором некроза опухоли (ФНО), у людей с различными дегенеративными состояниями, включая, среди прочего, болезнь Альцгеймера, болезнь Паркинсона и БАС.
По-видимому, существует связь между высокими уровнями ФНО, эксайтотоксичностью и высокими уровнями глутамата.
Нейропротекция направлена на:
- ограничение гибели нервов после повреждения ЦНС
- защиту ЦНС от преждевременной дегенерации и других причин гибели нервных клеток
Нейропротекторы противодействуют последствиям нейродегенерации или нервного расстройства.
Несколько типов веществ обладают нейропротекторным действием:
Агенты, улавливающие свободные радикалы
Они превращают поврежденные и вызывающие болезни нестабильные свободные радикалы в молекулы, которые более стабильны и легче поддаются управлению организмом.
Антиоксиданты могут взаимодействовать со свободными радикалами и уменьшать их воздействие. Они присутствуют в продуктах питания, особенно в продуктах растительного происхождения, и в пищевых добавках.
Ученые точно не знают, как они работают. Их механизм действия, по-видимому, зависит как от состояния, на которое они нацелены, так и от факторов, уникальных для каждого человека.
Витамин Е, например, проявляет антиоксидантные свойства при болезни Альцгеймера и, в меньшей степени, при БАС.
Тем не менее, исследования также показали, что добавки с витамином Е могут ухудшать работу мозга и деменцию у некоторых людей.
Важно проконсультироваться с врачом, прежде чем использовать какие-либо растительные продукты, лекарства, отпускаемые без рецепта, или добавки.
Многие продукты могут взаимодействовать с другими лекарствами, вызывая нежелательные побочные эффекты.
Антиэкзитотоксические средства
Поделиться на PinterestАнтиэксайтотоксические средства могут помочь справиться с непроизвольными движениями.
Глутамат является возбуждающим нейротрансмиттером. Это необходимо для нормальной функции нервных клеток, но слишком много может быть вредным.
Предотвращение проникновения глутамата в некоторые клетки путем, например, блокировки глутаматных рецепторов может предотвратить чрезмерную стимуляцию и дегенерацию.
Амантадин, который является одним из вариантов лечения болезни Паркинсона, может помочь уменьшить связанную с болезнью Паркинсона дискинезию или непроизвольные движения.
Кажется, он работает, изменяя взаимодействие между глутаматом и другим химическим веществом мозга.
Однако могут возникать побочные эффекты, включая галлюцинации, нечеткость зрения, спутанность сознания и отек ног.
Ингибиторы апоптоза
Апоптоз, или запрограммированная гибель клеток, относится к естественной гибели клеток по мере старения и роста организма.
Ученые предположили, что антиапоптотические агенты могут замедлять этот процесс в нейронах. Исследователи изучают эти виды терапии в исследованиях лечения рака.
Противовоспалительные средства
Они могут облегчить боль, а также уменьшить воспалительные процессы, которые могут усугубить болезни Паркинсона и Альцгеймера.
Одно исследование показало, что прием 40 миллиграммов аспирина в день может снизить риск болезни Альцгеймера у людей с диабетом 2 типа.
Нейротрофические факторы
Одна группа биомолекул, называемых нейротрофическими факторами, может способствовать росту нейронов.
Ученые ищут способы доставки этих белковых молекул для лечебных целей.
Хелаторы железа
У некоторых людей с болезнью Альцгеймера, Паркинсона или БАС уровень железа выше нормы.
По этой причине некоторые ученые считают, что снижение уровня железа может помочь при таких состояниях. Могут помочь вещества, выводящие из организма лишнее железо, или хелаторы железа.
В ходе одного исследования ученые обнаружили, что препараты, связывающие железо, улучшают состояние грызунов с болезнью Альцгеймера. Однако для подтверждения этих результатов необходимы дополнительные исследования.
Стимуляторы
Неясно, какую роль могут играть стимуляторы в развитии нарушений функционирования мозга, таких как деменция.
В прошлом исследования на животных показали, что кофеин может обладать нейропротекторными свойствами.
Однако обзор исследований по употреблению кофеина и деменции, проведенный в 2015 году, пришел к выводу, что он не является ни профилактическим, ни вредным для функции мозга.
Генная терапия
Поделиться на PinterestУченые изучают генную терапию и терапию стволовыми клетками для лечения неврологических заболеваний.
Гематоэнцефалический барьер предотвращает проникновение инфекций и вирусов в мозг, но он также может препятствовать проникновению в мозг лекарств. Это затрудняет доставку лечения непосредственно в мозг.
Генная терапия, которая включает в себя идентификацию и замену гена, вызывающего заболевание, может решить эту проблему.
Однако, как и в случае многих нейропротекторных средств, исследования еще не подтвердили неизменной эффективности генной терапии.
Терапия стволовыми клетками
Продолжаются исследования того, как ученые могут использовать технологию стволовых клеток для регенерации клеток организма, включая нервные клетки.
Некоторые исследования показали, что трансплантация стволовых клеток из костного мозга может помочь регенерировать клетки, которые подверглись повреждению, связанному с рассеянным склерозом.