Прямое и непрямое нейропротекторное действие некоторых гипотензивных препаратов | Ставицкая Т.В.
T.V. Stavitskaya
Department of Eye Diseases
Russian State Medical University.
Literature review, given in the article, reflects peculiarities of hypotensive and neuroprotective effect of adrenoblocker– betaxolol and carboanhydrase inhibitor brinzolamide.
В последние годы все больше и больше внимания уделяется изучению и поиску новых способов нейропротекторной терапии. Нейропротекция подразумевает защиту сетчатки и волокон зрительного нерва от повреждающего действия различных факторов риска. Общепринято делить нейропротекцию на прямую и непрямую. Препараты, оказывающие прямое нейропротекторное действие, непосредственно защищают нейроны сетчатки и волокна зрительного нерва и препятствуют их гибели. В свою очередь, непрямые нейропротекторы влияют на различные факторы риска повреждения нервных клеток. К этим факторам относят повышение ВГД, ухудшение кровообращения в этой зоне и другие состояния, которые усугубляют явления ишемии в зоне головки зрительного нерва.
Бетаксолол является одним из первых препаратов, применяемых для лечения глаукомы, у которого было выявлено нейропротекторное действие.
Проведенные в нашей клинике исследования особенностей распространения бетаксолола в различных тканях глаза выявили, что препарат в достаточной степени накапливается не только в переднем отделе глаза, но и достигает сетчатки.
При анализе пенетрации бетаксолола в роговицу было выявлено, что максимальная концентрация бетаксолола наблюдалась через 30 и 60 минут, и в среднем она была равна 29,43±13,11 мкг/мл и 27,29±12,24 мкг/мл соответственно. Ко второму часу исследования концентрация снизилась практически вдвое и была равна 15,14±7,17 мкг/мл. Через 240 минут количество бетаксолола уменьшилось в 3 раза по сравнению с началом исследования, в среднем концентрация составила 9,0±4,08 мкг/мл. У всех испытуемых распределение бетаксолола было однородным.
Максимальная концентрация бетаксолола во влаге передней камеры наблюдалась через 30 минут и была равна 23,5±1,76 мкг/мл.
 Через 60 минут концентрация снизилась практически вдвое и была равна 11,7±6,37 мкг/мл. Через 120 и 240 минут количество бетаксолола во влаге передней в среднем составило 8,72±3,9 мкг/мл и 9,8±0,75 мкг/мл. У всех испытуемых распределение бетаксолола было однородным.
Через 60 минут концентрация снизилась практически вдвое и была равна 11,7±6,37 мкг/мл. Через 120 и 240 минут количество бетаксолола во влаге передней в среднем составило 8,72±3,9 мкг/мл и 9,8±0,75 мкг/мл. У всех испытуемых распределение бетаксолола было однородным.Максимально длительное накопление бетаксолола было в сосудистой оболочке. Через 30 минут концентрация составила 14,11±7,21 мкг/мл. Максимальная концентрация бетаксолола наблюдалась через 60 и 120 минут и была равна 20,6±13,4 мкг/мл и 27,67±15,16 мкг/мл соответственно. Через 240 минут концентрация бетаксолола в сосудистой оболочке была равна исходной и составила 13,29±5,99 мкг/мл. У всех испытуемых распределение бетаксолола было однородным.
В веществе хрусталика максимальная концентрация бетаксолола наблюдалась через 30 и 60 минут, и в среднем она была равна 20,84±11,21 мкг/мл и 22,43±30,86 мкг/мл соответственно. Ко второму часу исследования концентрация снизилась до 14,84±7,88 мкг/мл. Через 240 минут количество бетаксолола, определяемое в веществе хрусталика, было незначительным, в среднем концентрация составила 3,14±1,77 мкг/мл.

В стекловидном теле бетаксолол накапливался в незначительном количестве. Через 30 минут концентрация составила 0,9±0,49 мкг/мл. Через час концентрация достигла максимума и составила 7,38±3,39 мкг/мл. Через 120 минут концентрация снизилась вдвое по сравнению с максимальным значением и была равна 3,0±1,38 мкг/мл. Через 240 минут концентрация была практически равна исходной и составила 0,6±0,28 мкг/мл. У всех испытуемых распределение бетаксолола было однородным.
В сетчатке бетаксолол накапливался в значительном количестве. Временные параметры распределения бетаксолола были следующими. Через 30 минут концентрация была равна 18,2±5,89 мкг/мл. Через 60 минут она несколько увеличилась и составила 22,33±14,81 мкг/мл. Затем она начала снижаться и через 120 и 240 минут была равна 6,57±4,79 мкг/мл и 5,7±2,69 мкг/мл соответственно.
 Распределение бетаксолола у испытуемых было недостаточно однородным.
Распределение бетаксолола у испытуемых было недостаточно однородным.Более наглядно распределение бетаксолола в тканях глазного яблока представлено на рисунке 1.
По своим фармакологическим свойствам бетаксолол является селективным блокатором b1–адренорецепторов, обладающим внутренней симпатомиметической активностью и мембраностабилизирующим (местноанестезирующим) действием.
Бетаксолол снижает ВГД в среднем на 20% от исходного уровня. Достаточный гипотензивный эффект бетаксолола развивается более чем у 70% пациентов.
Следует отметить, что эффективность 0,5% водного раствора бетаксолола (препарат «Бетоптик») и 0,25% суспензии (препарат «БетоптикС») одинакова и эти два препарата являются взаимозаменяемыми.
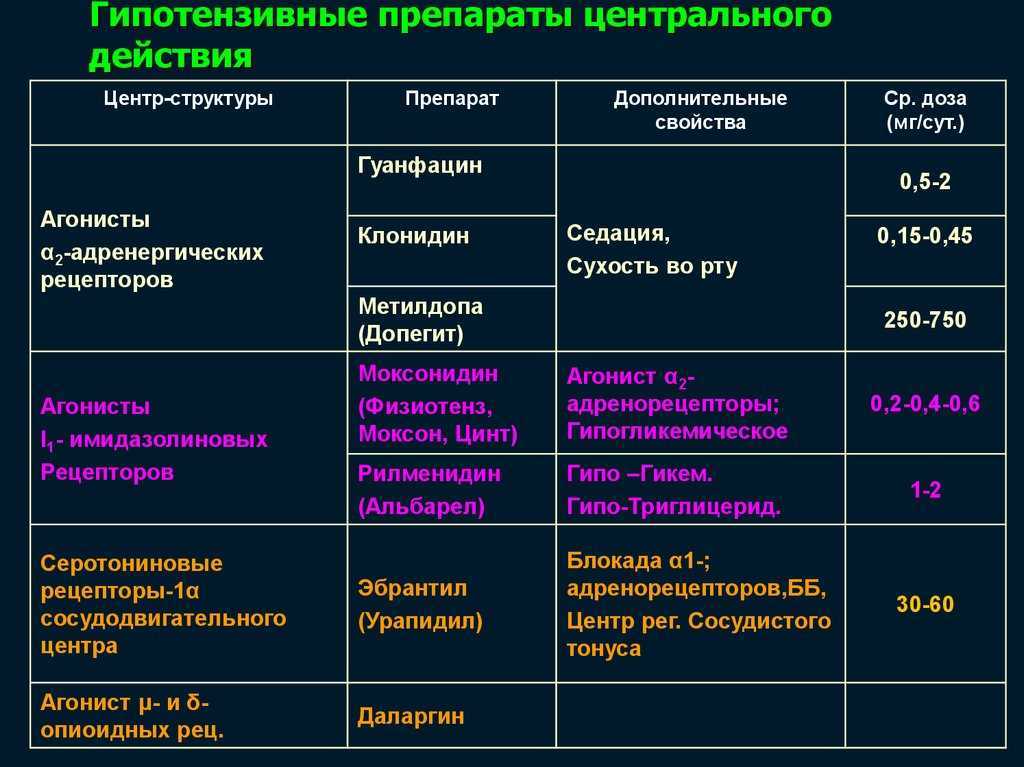 Одинаковая эффективность «Бетоптика» и «Бетоптика С», несмотря на разную концентрацию содержащегося в них бетаксолола, обусловлена применением в «Бетоптике С» специальных дополнительных веществ, повышающих биодоступность бетаксолола.
Одинаковая эффективность «Бетоптика» и «Бетоптика С», несмотря на разную концентрацию содержащегося в них бетаксолола, обусловлена применением в «Бетоптике С» специальных дополнительных веществ, повышающих биодоступность бетаксолола. В литературе имеются разноречивые данные о сравнительной эффективности бетаксолола и тимолола. По данным некоторых авторов, их эффективность одинакова, по данным других, тимолол оказывает несколько более выраженное влияние на офтальмотонус.
Однако практически все исследователи отмечают положительное влияние бетаксолола на сохранение зрительных функций у больных глаукомой.
Длительные исследования показали, что при применении бетаксолола происходит сохранение, а также и повышение средней чувствительности сетчатки по данным компьютерной периметрии с использованием статического периметра «Октопус». Кроме того, на фоне применения бетаксолола наблюдается улучшение кровотока в области зрительного нерва на 24,15%. При этом тимолол ухудшает кровоток в этой зоне в среднем на 13,35%.

Проведенные в нашей клинике исследования показали, что при применении бетаксолола наблюдается увеличение реологического коэффициента.
С чем же связано положительное влияние бетаксолола на поле зрения и кровоток в сосудах заднего отрезка глаза. Сосудорасширяющее и нейропротекторное действие бетаксолола обусловлено наличием у бетаксолола свойств блокатора кальциевых каналов.
Так как кальций необходим для мышечного сокращения, в том числе и гладкой мускулатуры сосудистой стенки, поэтому, блокируя его поступление из межклеточного пространства в клетку, бетаксолол оказывает сосудорасширяющее действие на сосуды сетчатки и зрительного нерва, а также увеличивает скорость линейного кровотока в них.
Чтобы понять механизм предотвращения гибели нервных клеток на фоне применения бетаксолола, следует рассмотреть основные факторы патогенеза гипоксии.
Патогенез гипоксии сложен. Одним из основных и начальных его звеньев является усиленный выброс катехоламинов, в результате чего в тканях увеличивается содержание цАМФ.
 Под влиянием цАМФ происходит активация фосфолипазы А2 и фосфорилазы, а также снижается активность гликогенсинтетазы. Вследствие активации фосфолипазы А2 развивается деградация фосфолипидов клеточных мембран и увеличивается содержание ненасыщенных жирных кислот (НЖК) в тканях. К классу НЖК относится арахидоновая кислота, которая является предшественником простагландина Е и простациклина, оказывающих вазоконстрикторное действие и увеличивающих проницаемость сосудистой стенки. Кроме того, НЖК – это исходный субстрат для синтеза тромбоксанов, способствующих агрегации тромбоцитов и повышенному тромбообразованию. Вазоконстрикция, нарушение реологических свойств крови и отек тканей, обусловленный увеличением проницаемости сосудистой стенки, могут усугублять явления гипоксии. Следствием активации фосфорилаз и ингибирования гликогенсинтетазы является активация гликолиза, что приводит к накоплению лактата и развитию метаболического ацидоза, вследствие которого возникает набухание клеток и их органелл и дальнейшее усиление процессов разрушения биологических мембран, отека тканей, а также усугубление явлений ишемии.
Под влиянием цАМФ происходит активация фосфолипазы А2 и фосфорилазы, а также снижается активность гликогенсинтетазы. Вследствие активации фосфолипазы А2 развивается деградация фосфолипидов клеточных мембран и увеличивается содержание ненасыщенных жирных кислот (НЖК) в тканях. К классу НЖК относится арахидоновая кислота, которая является предшественником простагландина Е и простациклина, оказывающих вазоконстрикторное действие и увеличивающих проницаемость сосудистой стенки. Кроме того, НЖК – это исходный субстрат для синтеза тромбоксанов, способствующих агрегации тромбоцитов и повышенному тромбообразованию. Вазоконстрикция, нарушение реологических свойств крови и отек тканей, обусловленный увеличением проницаемости сосудистой стенки, могут усугублять явления гипоксии. Следствием активации фосфорилаз и ингибирования гликогенсинтетазы является активация гликолиза, что приводит к накоплению лактата и развитию метаболического ацидоза, вследствие которого возникает набухание клеток и их органелл и дальнейшее усиление процессов разрушения биологических мембран, отека тканей, а также усугубление явлений ишемии.
Вторым важным компонентом в патогенезе повреждения тканей при недостатке поступления кислорода является повышение концентрации ионов кальция в цитозоле. В норме концентрация свободных ионов кальция в цитозоле колеблется от 10–9 до 10–6 моль/л, в то время как во внеклеточной жидкости их концентрация составляет 10–3 моль/л. Данный градиент концентрации является энергозависимым процессом и обусловлен ограниченной проницаемости клеточных мембран для ионов кальция, активному выделению их из клетки и накоплению ионов кальция в митохондриях и эндоплазматическом ретикулуме. При дефиците кислорода и макроэргов (прежде всего АТФ) происходит нарушение работы Са–транспортирующих АТФ–аз, следствием чего является накопления ионов кальция в цитозоле. Свободные ионы кальция приводят к активации липолиза и разрушению мембран. Деградация мембран митохондрий сопровождается нарушением их проницаемости для катионов, угнетением процессов тканевого дыхания. Митохондрии набухают, что приводит к разрыву их наружной мембраны и выходу цитохрома С в цитозоль.
 Свободный цитохром С может активировать перекисное окисление липидов, в результате чего появляются свободные радикалы и наблюдается еще большее повреждение клеток в условиях ишемии.
Свободный цитохром С может активировать перекисное окисление липидов, в результате чего появляются свободные радикалы и наблюдается еще большее повреждение клеток в условиях ишемии.Блокируя проникновение кальция в нервную клетку, бетаксолол препятствует ее разрушению в условиях гипоксии, что подтверждено иммуно–гистологическими экспериментами.
Таким образом, бетаксолол оказывает прямое и непрямое (сосудорасширяющее) нейропротекторное действие.
Гипотензивный эффект бринзоламида связан со снижением продукции водянистой влаги, что обусловлено угнетением активности карбоангидразы. В процессе образования водянистой влаги глаза бикарбонат–ионы активно транспортируются в заднюю камеру из цитоплазмы беспигментных клеток. Данный поток отрицательно заряженных ионов необходим для компенсации градиента положительных ионов, обусловленного активным транспортом ионов натрия.
 Бринзоламид блокирует образование угольной кислоты и снижает продукцию бикарбонат–ионов. Увеличение градиента положительно заряженных ионов приводит к снижению секреции водянистой влаги.
Бринзоламид блокирует образование угольной кислоты и снижает продукцию бикарбонат–ионов. Увеличение градиента положительно заряженных ионов приводит к снижению секреции водянистой влаги.Выраженность снижения офтальмотонуса на фоне применения 1% суспензии бринзоламида (препарат «Азопт») в среднем составляет 17,4–18,9% от исходного уровня. Исследования показали, что при применении этого препарата 2 или 3 раза в день степень снижения ВГД была статистически эквивалентной. Достаточный гипотензивный эффект бринзоламида развивается более чем у 65% пациентов.
При сравнении эффективности и переносимости двух ингибиторов карбоангидразы для местного применения – 1% суспензии бринзоламида и 2% раствора дорзоламида – было выявлено, что эффективность этих двух препаратов равнозначна, однако суспензия бринзоламида значительно лучше переносится больными и в меньшем проценте случаев применение бринзоламида сопровождается появлением нежелательных явлений. При проведении анкетного исследования средний бал оценки переносимости дорзоламида составлял 5,5, в то время как лечение бринзоламидом больные оценили в 0,95 балла (в данном исследовании чем выше балл, тем больше жалоб предъявляли пациенты).

Данные экспериментальных исследований показали, что при применении бринзоламида у кроликов по данным лазерной допплерометрии наблюдается увеличение скорости линейного кровотока в сосудах головки зрительного нерва на 11%, парциального давления кислорода более чем на 8%, в то время как парциальное давление углекислого газа снижается более чем на 6% от исходного уровня. Данные, полученные в ходе этих исследований, позволяют предположить, что бринзоламид будет оказывать непрямое нейропротекторное действие у больных глаукомой.
Механизмы нейротрофического и нейропротекторного действия препарата церебролизин при ишемии головного мозга
Высокая распространенность неврологических заболеваний (прежде всего ишемического инсульта и деменций) обусловливает необходимость рационального выбора наиболее эффективных препаратов. Если ранее считалось, что вазоактивные препараты имеют наибольшее значение для восстановления функций головного мозга, то в настоящее время происходит смещение акцента в сторону нейропротективных и нейротрофических препаратов.
Одним из таких препаратов является церебролизин (EVER Neuro Pharma, Австрия) — результат экстрагирования пептидной фракции головного мозга молодых свиней. Данный препарат отвечает требованиям международных стандартов нейропротекции в терапевтической и педиатрической практике [1]. Церебролизин производится и клинически тестируется в соответствии с существующими стандартами [2]. Многочисленные исследования указывают на несомненный положительный эффект применения препарата при инсульте, черепно-мозговой травме (ЧМТ), деменциях и перинатальной энцефалопатии. Хотя высокая терапевтическая эффективность и мультимодальное действие церебролизина давно доказаны, данные о точных молекулярно-фармакологических механизмах его действия изучены мало. Между тем, информация о механизмах действия препарата важна для рациональной терапии, планирования исследований по доказательной медицине препарата, для обучения неврологов фундаментальным основам нейротрофической терапии.
В течение ряда лет нами исследовался состав церебролизина, включая олигопептидную и мембранную фракции [3, 10], витаминную активность [4], аминокислотный [5] и микроэлементный состав [6, 7], его воздействие на гомеостаз микроэлементов мозга [8, 9].
Исследование проводилось с использованием универсального метода для решения задач молекулярной фармакологии пептидных препаратов, состоящего из 5 основных стадий. Результаты исследования пептидного состава препарата представлены в таблице. За исключением фрагмента ser-ser-phe-gly-ile (соответствующего ABC-транспортным белкам) все идентифицированные пептиды в исследованных образцах церебролизина являются фрагментами нейропептидов протеома человека. Комплексный анализ состава церебролизина позволил установить наличие в нем биоактивных пептидных фрагментов нейропептидов фактора роста нервов (ФРН), энкефалинов, орексина, галанина [10-12].
Фактор роста нервов необходим для развития и восстановления сетей нейронов. Связывается специфическими рецепторами TrkA (тирозинкиназа А) и LNGFR (от англ. «low affinity nerve growth factor receptor», т.е. «низкоафинный рецептор NGF»), которые и стимулируют процессы деления и дифференциации. В составе церебролизина были найдены два пептида, образовавшихся при протеолизе секретируемой молекулы ФРН: GEFSV, соответствующий остаткам 119-123 полипептида и NSYCTTT, соответствующий остаткам 186-192. Эти пептиды образуются при неспецифическом протеолизе в процессе производства препарата. Анализ взаимодействия ФРН с рецептором позволяет предположить, что пептид GEFSV (119-123) непосредственно может контактировать с молекулой рецептора, тем самым проявляя нейротрофическую активность [13]. Известны модельные пептиды, включающие GEFSV, обладающие ФРН-подобной активностью [14, 15]. Обнаружение пептидов ФРН практически во всех фракциях исследованных образцов имеет значение для понимания нейротрофической активности церебролизина.
Эти пептиды образуются при неспецифическом протеолизе в процессе производства препарата. Анализ взаимодействия ФРН с рецептором позволяет предположить, что пептид GEFSV (119-123) непосредственно может контактировать с молекулой рецептора, тем самым проявляя нейротрофическую активность [13]. Известны модельные пептиды, включающие GEFSV, обладающие ФРН-подобной активностью [14, 15]. Обнаружение пептидов ФРН практически во всех фракциях исследованных образцов имеет значение для понимания нейротрофической активности церебролизина.
Энкефалины. В составе исследованных фракций церебролизина были обнаружены несколько эндорфин/энкефалинподобных пептидов: tyr-gly-gly-phe-leu (YGGFL), gly-gly-phe-leu-arg (GGFLR) и tyr-gly-gly-phe-met (YGGFM). Leu-энкефалины и динорфины синтезируются в организме в результате протеолиза полипептида, кодируемого геном PDYN (динорфин). Энкефалины — эндогенные опиоидные пептидные нейротрансмиттеры, которые поддерживают множество физиологических и психологических функций, включая реакцию на стресс, восприятие боли, эмоции, контроль приема пищи и др.
Нейропептид VF. В составе исследованных фракций церебролизина был найден пептид PQRF, соответствующий фрагменту нейропептида VF. К настоящему времени имеется мало данных о его роли, хотя и известно, что нейропептид VF может активировать мю-опиоидные и каппа-опиоидные рецепторы и регулировать работу гипоталамуса [16].
Орексин. Пептид cys-cys-arg-gln-lys (CCRQK), найденный в образцах церебролизина, идентифицируется как фрагмент полипептида орексина (ген ORX). Пептид CCRQK локализуется в районе 39-43 полипептида орексина и, по данным интегрального биоинформационного анализа, может иметь важное значение для взаимодействия орексина-А с рецепторами. Орексины (гипокретины) играют роль в регуляции приема пищи, цикла сон-бодрствование [17] и воздействуют на разнообразные аспекты физиологии человека, включая энергетический метаболизм, баланс гормонов, регуляцию уровня жидкости в организме. Орексин-А увеличивает экспрессию нейротрофина-3 [18], который в свою очередь поддерживает выживание и дифференциацию нейронов, стимулируя нейроно- и синаптогенез.
Галанин. В составе церебролизина имеется галанинподобный пептид WWLNSAGY (в галанинах соответствующий пептид имеет последовательность WTLNSAGY). Анализ интегрированной функциональной карты галанина указывает на фрагмент 33-42, имеющий важное значение для взаимодействия галанина с рецепторами. Галанин (ген GALN) участвует в таких разнообразных процессах как регуляция приема пищи, энергетический метаболизм, регулирование секреции других нейротрансмиттеров, модуляция ноцицепции, перистальтика, восстановление нервной системы после повреждений. Галанин выступает как нейропептид, модулирующий секрецию нейротрансмиттеров ацетилхолина, серотонина и норадреналина [19, 20]. Активация рецепторов галанина оказывает антиконвульсантное, антидепрессантное действие [21]. Галанин необходим для развития нейронов [22], стимулируя спраутинг аксонов [23].
Идентифицированные пептиды функционально значимы и могут проявлять специфическую биологическую активность, взаимодействуя с соответствующими рецепторами [10].
В работе проведено сопоставление результатов молекулярно-биологического исследования состава церебролизина и результатов его клинических и экспериментальных исследований.
В многочисленных исследованиях была продемонстрирована эффективность церебролизина в терапии ишемических повреждений мозга в составе комплексной терапии. Применение церебролизина при инсульте и ЧМТ достоверно снижает неврологический дефицит [24], улучшает когнитивные способности [25, 26], восстанавливает биоэлектрическую активность мозга [27], снижает объем зоны инфаркта [28]. Экспериментальные исследования подтвердили результаты клинических наблюдений и позволили уточнить физиологические механизмы действия препарата. Церебролизин оказывает нейрорегенеративное воздействие [29], ослабляя нарушения структуры нейронов [30, 31], улучшает когнитивные функции на моделях диабета, снижает уровни провоспалительного фактора ФНО-альфа, повышает уровни инсулиноподобного гормона роста IGF-1, серотонина и оказывает антиоксидантное действие [32].
Экспериментальные исследования показали, что нейропротекторные свойства церебролизина связаны с активацией сигнального каскада Shh, сигнального пути PI3K/Akt, стимулирования ангиогенеза и модуляции синтеза и секреции оксида азота.
Улучшение неврологических функций после инсульта при лечении церебролизином связывают с активацией сигнального каскада Shh. Терапия церебролизином значительно увеличивала деление клеток-предшественников нейронов и их дифференциацию в нейроны и в миелинизирующие олигодендроциты. Эти изменения сопровождались параллельным увеличением активности каскада Shh [33]. Shh осуществляет масштабную координацию клеточного роста и не обладает нейротрофическим эффектом как таковым. Активность каскада Shh имеет огромное значение для процессов развития эмбриона, осуществляя формирование общей структуры конечностей, структур головного мозга [34], спинного мозга [35], таламуса [36]. Одной из наиболее изученных ролей каскада Shh является формирование нервной трубки плода из базальной пластины и формирование вентральных типов клеток в нервной трубке [37]. Исследования ФРН указали на существование взаимодействий между сигнальным каскадом Shh, ростом нейритов и активностью ретиноидных рецепторов. Рецептор ретиноидов RARβ2 экспрессируется в нейронах с маркерами NF200, CGRP и IB4. Нейроны этого типа стимулируют рост нейритов в ответ на воздействие ретиноидов. Сигналы от их рецепторов регулируют рост аксонов и ФРН-зависимый рост аксонов тормозится при делеции генов рецепторов ретиноидов. Каскад Shh является всего лишь одной из мишеней воздействия сигнального пути рецепторов ретиноидов и при делеции гена рецептора RARβ2 не активируется. Shh не может вызвать сам по себе рост аксонов, но может усиливать сигнал от ретиноидных рецепторов [38], повышая выживание клеток [39]. Дотации витамина А индуцируют синтез ФРН и нейротрофического фактора мозга [40].
Исследования ФРН указали на существование взаимодействий между сигнальным каскадом Shh, ростом нейритов и активностью ретиноидных рецепторов. Рецептор ретиноидов RARβ2 экспрессируется в нейронах с маркерами NF200, CGRP и IB4. Нейроны этого типа стимулируют рост нейритов в ответ на воздействие ретиноидов. Сигналы от их рецепторов регулируют рост аксонов и ФРН-зависимый рост аксонов тормозится при делеции генов рецепторов ретиноидов. Каскад Shh является всего лишь одной из мишеней воздействия сигнального пути рецепторов ретиноидов и при делеции гена рецептора RARβ2 не активируется. Shh не может вызвать сам по себе рост аксонов, но может усиливать сигнал от ретиноидных рецепторов [38], повышая выживание клеток [39]. Дотации витамина А индуцируют синтез ФРН и нейротрофического фактора мозга [40].
Учитывая данные о функционировании ФРН и наличие активных пептидных фрагментов ФРН в составе церебролизина, причина повышения активности каскада Shh под воздействием препарата становится очевидной [33]. ФРН инициирует рост нейритов и потенциирует активность рецепторов ретиноидов (RARβ2 и др.). Активированный ретиноидами рецептор RARβ2 дополнительно стимулирует рост нейритов и активирует каскад Shh. Активация каскада Shh способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов, что и является нейротрофическим эффектом.
ФРН инициирует рост нейритов и потенциирует активность рецепторов ретиноидов (RARβ2 и др.). Активированный ретиноидами рецептор RARβ2 дополнительно стимулирует рост нейритов и активирует каскад Shh. Активация каскада Shh способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов, что и является нейротрофическим эффектом.
Церебролизин (2,5 мл/кг) стимулирует рост клеток-предшественников нейронов за счет активации сигнального пути PI3K/Akt и повышает результат оценки неврологического тестирования [41]. Сигнальный путь PI3K/Akt активируется ФРН и орексином, которые были найдены в составе церебролизина. ФРН стимулирует цикл клеточного деления с участием циклинов и циклинзависимых киназ [42], а орексин стимулирует поглощение нервной тканью глюкозы за счет транслокации транспортера глюкозы GLUT4 из цитоплазмы нейронов на внешнюю поверхность мембраны [43].
ФРН и орексин стимулируют синтез/секрецию нейротрофического фактора мозга (BDNF), который также активирует сигнальный путь PI3K/Akt [44] под действием церебролизина. ФРН активирует циклинзависимую киназу 5 (cdk5) с участием цАМФ, что активирует процессы клеточного роста [45], нейропротекцию [46] и регулирует экспрессию BDNF [47] через сигнальный каскад внеклеточной регулируемой киназы 1/2 (ERK1/2) [48]. Орексин подавляет толерантность к глюкозе и предупреждает повреждение нейронов посредством повышения активности BDNF [49, 50].
ФРН активирует циклинзависимую киназу 5 (cdk5) с участием цАМФ, что активирует процессы клеточного роста [45], нейропротекцию [46] и регулирует экспрессию BDNF [47] через сигнальный каскад внеклеточной регулируемой киназы 1/2 (ERK1/2) [48]. Орексин подавляет толерантность к глюкозе и предупреждает повреждение нейронов посредством повышения активности BDNF [49, 50].
Церебролизин улучшает восстановление когнитивных способностей после ЧМТ, в частности за счет стимулирования ангиогенеза [25]. Улучшение неврологических показателей связано с повышением уровня фактора роста эндотелия (VEGF), стимулирующего восстановление сосудистого русла и повышающего кровоток в зоне ишемии [51]. Данный эффект также объясняется наличием в церебролизине ФРН. Известно, что ФРН стимулирует повышение экспрессии VEGF и ангиогенез при репаративной регенерации нейрональной ткани [52].
Церебролизин также модулирует активность синтеза/секреции оксида азота. В эксперименте хроническая алкогольная интоксикация в течение 30 дней приводила к увеличению уровня оксида азота с одновременным снижением уровней L-аргинина, каталазы и супероксиддисмутазы. Применение церебролизина в течение последующих 14 дней привело к нормализации функции системы оксида азота [53]. Данный эффект основан на том, что в состав церебролизина входят энкефалины и ФРН, которые оказывают влияние на метаболизм оксида азота. Цитопротекция энкефалином опосредована активацией синтазы окиси азота (СОА) и функции аденозинтрифосфат-регулируемых калиевых каналов [54]. В частности, мет-энкефалин модулирует синтез/секрецию оксида азота [55]. ФРН стимулирует экспрессию индуцируемой формы СОА и вещества Р [56]. Сигнальный путь Akt — оксид азота — цГМФ способствует воздействию ФРН на рост нейритов в модели деменции [57].
Применение церебролизина в течение последующих 14 дней привело к нормализации функции системы оксида азота [53]. Данный эффект основан на том, что в состав церебролизина входят энкефалины и ФРН, которые оказывают влияние на метаболизм оксида азота. Цитопротекция энкефалином опосредована активацией синтазы окиси азота (СОА) и функции аденозинтрифосфат-регулируемых калиевых каналов [54]. В частности, мет-энкефалин модулирует синтез/секрецию оксида азота [55]. ФРН стимулирует экспрессию индуцируемой формы СОА и вещества Р [56]. Сигнальный путь Akt — оксид азота — цГМФ способствует воздействию ФРН на рост нейритов в модели деменции [57].
Успешное применение церебролизина для поддержания состояния пациентов при нейродегенеративных заболеваниях было многократно продемонстрировано. Метаанализ 6 рандомизированных исследований по применению церебролизина для терапии сосудистой деменции (597 участников) подтвердил наличие его положительного эффект в отношении когнитивных функций пациентов по шкалам MMSE (на 1,10 балла в среднем, 95% ДИ 0,37-1,82) и ADAS-cog+ (в среднем на 4,01 балла, 95% ДИ 2,66-5,36) и по шкале CGI (ОШ 2,71; 95% ДИ 1,83-4,00) [58, 59]. Лечение церебролизином снижает уровень атрофии таламуса у молодых пациентов (20±0,5 года) с активным рассеянным склерозом [60] и способствует профилактике атрофии зрительного нерва у детей [61].
Лечение церебролизином снижает уровень атрофии таламуса у молодых пациентов (20±0,5 года) с активным рассеянным склерозом [60] и способствует профилактике атрофии зрительного нерва у детей [61].
Вызываемое церебролизином уменьшение дефицита памяти и других проявлений нейродегенеративного процесса сохраняется по крайней мере в течение 3 мес после окончания лечения. Посредством иммуногистохимического анализа было показано, что снижение амилоидных бляшек в новой коре и гиппокампе также сохраняется в течение 3 мес [62]. Эффект церебролизина при деменции связывают с преодолением холинергического дефицита, воздействием на отложение амилоидного тау-белка, модуляцией активности киназы 3 гликогенсинтазы (GSK3), ингибированием каскада калпаина.
Показано, что церебролизин увеличивает число холинергических нейронов [63] и общую длину дендритных пирамидальных нейронов [64]. Известно, что ФРН-рецептор TrkA повышает экспрессию генов, вовлеченных в холинергическую передачу сигнала [65]. Входящий в состав церебролизина активный фрагмент ФРН активирует TrkA, восполняя дефицит ацетилхолина. На амилоидной модели деменции церебролизин уменьшал уровни бета-амилоида и фосфорилирование ассоциированного с микротрубочками тау-белка путем регулирования киназы 3 гликогенсинтазы и циклинзависимой киназы 5, увеличивая плотность синапсов и восстанавливая цитоархитектонику нейрональной ткани [66, 67]. Этот эффект может быть связан с воздействием активного фрагмента пептидов галанина и ФРН. Показано, что галанин тормозит ухудшение пространственной памяти и уменьшает уровень бета-амилоида в модели болезни Альцгеймера [68], способствует дифференцировке нейронов в культуре клеток субвентрикулярной зоны [69].
Входящий в состав церебролизина активный фрагмент ФРН активирует TrkA, восполняя дефицит ацетилхолина. На амилоидной модели деменции церебролизин уменьшал уровни бета-амилоида и фосфорилирование ассоциированного с микротрубочками тау-белка путем регулирования киназы 3 гликогенсинтазы и циклинзависимой киназы 5, увеличивая плотность синапсов и восстанавливая цитоархитектонику нейрональной ткани [66, 67]. Этот эффект может быть связан с воздействием активного фрагмента пептидов галанина и ФРН. Показано, что галанин тормозит ухудшение пространственной памяти и уменьшает уровень бета-амилоида в модели болезни Альцгеймера [68], способствует дифференцировке нейронов в культуре клеток субвентрикулярной зоны [69].
Антиамилоидное действие церебролизина может быть связано с наличием в его составе активных пептидов ФРН. Интраназальное введение ФРН снижает отложения амилоида [70] и его токсическое воздействие на нейроны [71]. ФРН воздействует на активность киназы 3 гликогенсинтазы (GSK3) посредством активации сигнального пути Akt [72], что приводит к подавлению ее активности [73]. ФРН активирует циклинзависимую киназу 5 (cdk5) с участием сигнальной молекулы цАМФ, что активирует процессы клеточного роста и дифференциации [45], причем взаимодействие между cdk5 и GSK3 опосредовано белком нейрегулином [46].
ФРН активирует циклинзависимую киназу 5 (cdk5) с участием сигнальной молекулы цАМФ, что активирует процессы клеточного роста и дифференциации [45], причем взаимодействие между cdk5 и GSK3 опосредовано белком нейрегулином [46].
Церебролизин стабилизирует целостность нейронов и уменьшает число апоптотических клеток после ишемического поражения путем ингибирования каскада калпаина за счет активности ФРН и галанина. Активация рецептора ФРН тормозит активность бета- и гамма-секретаз, что предотвращает стимулируемое GSK3 фосфорилирование тау-белка и активацию каспаз и калпаина, которые приводят к распаду цитоскелета и ухудшению аксонального транспорта [74]. Делеция гена галанина приводит к увеличению экспрессии калпаина, увеличивая гибель нейронов, в том числе холинергических [75].
Терапевтический эффект церебролизина при атрофии зрительного нерва у 646 детей отмечался при внутримышечном (0,1 мл/кг массы тела) и ретробульбарном (0,3-0,5 мл) введении [61]. Этот эффект связан с наличием ФРН в составе препарата. Этим наблюдениям соответствуют экспериментальные данные о снижении экспрессии генов ФРН и рецептора TrkA в зрительном нерве крыс с глаукомой [76]. При дегенерации ганглиозных клеток сетчатки установлено влияние ФРН на регенерацию сетчатки [77]. ФРН и его рецепторы TrkA и p75 экспрессируются в переднем и заднем сегментах глаза человека; при нанесении на склеру ФРН достигает сетчатки и зрительного нерва [78].
Этим наблюдениям соответствуют экспериментальные данные о снижении экспрессии генов ФРН и рецептора TrkA в зрительном нерве крыс с глаукомой [76]. При дегенерации ганглиозных клеток сетчатки установлено влияние ФРН на регенерацию сетчатки [77]. ФРН и его рецепторы TrkA и p75 экспрессируются в переднем и заднем сегментах глаза человека; при нанесении на склеру ФРН достигает сетчатки и зрительного нерва [78].
Церебролизин улучшает состояние нейронных структур на моделях синдрома Ретта — врожденной прогрессирующей аномалией развития ЦНС, которая характеризуется умственной отсталостью, стереотипиями и апраксией. Исследования пациентов с синдромом Ретта показали снижение ветвления дендритов нейронов и аномальное формирование нейронных структур. Делеция гена метил-CpG-связывающего белка (MECP2) приводит к экспериментальной модели синдрома Ретта. Применение церебролизина на моделях синдрома Ретта улучшало рост нейронов и структурирование нервной ткани [79]. Положительное воздействие церебролизина на структуру нервной ткани при синдроме Ретта объясняется входящим в состав препарата активных пептидов ФРН. При синдроме Ретта отмечаются снижение уровня ФРН, продолжающееся с возрастом, в то время как в контрольной группе здоровых лиц уровень ФРН возрастает [80].
При синдроме Ретта отмечаются снижение уровня ФРН, продолжающееся с возрастом, в то время как в контрольной группе здоровых лиц уровень ФРН возрастает [80].
Церебролизин уменьшает апоптоз лимфоцитов человека [81, 82]. Этот эффект может осуществляться за счет ФРН и энкефалиновых пептидов в его составе. ФРН имеет выраженный антиапоптотический эффект на лимфоциты, защищая их от апоптоза путем активации белка PKCzeta [83]. В В-лимфоцитах памяти ФРН ингибирует апоптоз с помощью инактивации белка р38МАРК и предотвращения фосфорилирования регулирующего апоптоз белка Bcl-2 [84]. Энкефалины также защищают лимфоциты от апоптоза [85]. Антиапоптотическое действие метионинэнкефалина связано с эффектами каспазы-3 [86].
Церебролизин снижает уровень перинатальных расстройств ЦНС посредством иммуномодуляции, антиоксидантной защиты и нейротрофического эффекта. Изучалось влияние церебролизина на аутоиммунные параметры (FasL, Fas и металлотионеин-1) у новорожденных с перинатальными ишемическими повреждениями ЦНС и в группе 20 здоровых новорожденных. Лечение церебролизином (0,1 мл/кг, 10 инъекций через день) привело к нормализации апоптоза Т-лимфоцитов (увеличение Fas и снижение FasL) и активация антиоксидантной защиты путем увеличения экспрессии белка-антиоксиданта металлотионеина-1. Нормализация аутоиммунных реакций приводила к уменьшению отека мозга и улучшению кровотока в участках мозга пострадавших от ишемии [87].
Лечение церебролизином (0,1 мл/кг, 10 инъекций через день) привело к нормализации апоптоза Т-лимфоцитов (увеличение Fas и снижение FasL) и активация антиоксидантной защиты путем увеличения экспрессии белка-антиоксиданта металлотионеина-1. Нормализация аутоиммунных реакций приводила к уменьшению отека мозга и улучшению кровотока в участках мозга пострадавших от ишемии [87].
Структура рецептора ФРН р75 сходна со структурой Fas-рецептора, связывающего лиганд FasL, который играет важную роль в регуляции клеточного апоптоза [83]. Нельзя исключить, что ФРН может непосредственно взаимодействовать с Fas-рецептором, проявляя иммуномодуляторные эффекты. Модуляции системы Fas-рецептор/FasL могут осуществляться метионинэнкефалином [88].
Церебролизин стимулирует секрецию гамма-интерферона лимфоцитами [89]. Показано, что метионинэнкефалин стимулирует субпопуляции лимфоцитов в периферической крови [90], а энкефалин-подобные агонисты дельта-опиоидных рецепторов существенно улучшают выживаемость в моделях сепсиса [91]. Мет-энкефалин и его пептидный фрагмент YGG оказывают непосредственное влияние на синтез гамма-интерферона: стимулируя синтез при низких дозах и тормозя синтез при высоких. Пептидный фрагмент YG является минимальным молекулярным фрагментом энкефалина, оказывающим иммуномодулирующее воздействие [92]. Известно, что процессы дифференцировки нейронов сопровождаются вызываемым рецептором ФРН повышением уровня гамма-интерферона [93].
Мет-энкефалин и его пептидный фрагмент YGG оказывают непосредственное влияние на синтез гамма-интерферона: стимулируя синтез при низких дозах и тормозя синтез при высоких. Пептидный фрагмент YG является минимальным молекулярным фрагментом энкефалина, оказывающим иммуномодулирующее воздействие [92]. Известно, что процессы дифференцировки нейронов сопровождаются вызываемым рецептором ФРН повышением уровня гамма-интерферона [93].
Основополагающая роль энкефалинов и ФРН в осуществляемой церебролизином иммуномодуляции подтверждается профилем иммунологических изменений при внутримышечном применении препарата у детей с синдромом дефицита внимания и гиперактивностью. В этих случаях была отмечена нормализация как неврологических, так и иммунных показателей. Церебролизин повышал экспрессию маркеров активации (HLA-DR, CD25) и нормализацию количества клеток лимфоцитов типа CD45+, CD14-, CD4+, CD19+, CD16+, CD11b+ и CD56+, а также уровней IgG и IgA в сыворотке, активность NK-клеток и активацию Т-хелперов [94, 95]. Данный эффект также реализуется через действие энкефалинов и ФРН. Метионинэнкефалин воздействует на лимфоциты человека, нормализуя количество и активность Т-клеток CD4+, CD8+, регуляторных Т-клеток, дендритных клеток, NK-клеток и маркер активации CD25 [90]. Бета-эндорфин и мет-энкефалин оказывают иммуномодулирующее действие, влияя на экспрессию маркеров CD11b+, CD18+ и CD16+ [96]. ФРН влияет на экспрессию маркера активации Т-клеток HLA-DR [97], а рецептор ФРН (NGFR) присутствует на поверхности лимфоцитов человека и модулирует деление В-клеток и секрецию иммуноглобулинов [98].
Данный эффект также реализуется через действие энкефалинов и ФРН. Метионинэнкефалин воздействует на лимфоциты человека, нормализуя количество и активность Т-клеток CD4+, CD8+, регуляторных Т-клеток, дендритных клеток, NK-клеток и маркер активации CD25 [90]. Бета-эндорфин и мет-энкефалин оказывают иммуномодулирующее действие, влияя на экспрессию маркеров CD11b+, CD18+ и CD16+ [96]. ФРН влияет на экспрессию маркера активации Т-клеток HLA-DR [97], а рецептор ФРН (NGFR) присутствует на поверхности лимфоцитов человека и модулирует деление В-клеток и секрецию иммуноглобулинов [98].
Заключение
Несмотря на существование доказательной базы по использованию церебролизина в клинической медицине, точные механизмы фармакологического действия препарата изучены недостаточно. В настоящей работе представлен анализ связи состава церебролизина и результатов исследований препарата in vitro, in vivo. Показано что установленные ранее специфические особенности воздействия церебролизина в рамках нейротрофического, нейропротективного, иммуномодулирующего эффектов, могут быть объяснены через специфическую активность пептидных компонентов препарата (активные фрагменты ФРН, энкефалинов, орексина, галанина).
Проведенный анализ позволил сделать ряд выводов, важных для повышения эффективности использования церебролизина в клинической практике. Наиболее интересным, на наш взгляд, является возможный синергизм церебролизина с витамином А (ретиноидами). Результаты фундаментальных исследований показали, что установленное в эксперименте повышение активности сигнального каскада Shh под воздействием церебролизина связано скорее всего с наличие активных пептидных фрагментов ФРН в составе препарата. ФРН потенцирует активность рецепторов ретиноидов, которые стимулируют долговременный рост нейритов и параллельно активируют каскад Shh. Активация каскада Shh дополнительно способствует росту нейритов посредством усиления сигнала от ретиноидных рецепторов. Результаты позволяют сделать вывод о том, что долговременное воздействие церебролизина может существенно зависеть от обеспеченности организма витамином А. Поэтому у пациентов с дефицитом витамина А (и/или с неблагоприятными вариантами полиморфизмов генов метаболизма витамина А) можно ожидать более низкую нейротрофическую активность церебролизина. И наоборот, у пациентов, обеспеченных витамином А, церебролизин будет проявлять большую нейтротрофическую активность.
И наоборот, у пациентов, обеспеченных витамином А, церебролизин будет проявлять большую нейтротрофическую активность.
Представляется весьма перспективным исследование возможного синергичного эффекта церебролизина и ряда других микронутриентов. Первым этапом такого исследования является системно-биологический и биоинформационный анализ возможных молекулярно-фармакологических механизмов такого рода синергизма. Данный анализ позволит отобрать микронутриенты, восполнение дефицита который максимизирует эффективность церебролизина в экспериментальных и клинических исследованиях.
Нейропротекторное действие флавоноидов — PubMed
Обзор
. 2011;18(8):1195-212.
дои: 10.2174/092986711795029735.
C Гутьеррес-Мерино 1 , К. Лопес-Санчес, Р. Лагоа, А. К. Самхан-Ариас, К. Буэно, В. Гарсия-Мартинес
Гарсия-Мартинес
принадлежность
- 1 Кафедра биохимии и молекулярной биологии, Факультет естественных наук, Университет Эстремадура, Avenida de Elvas s/n, 06006 — Бадахос, Испания. [email protected]
- PMID: 21291366
- DOI: 10.2174/092986711795029735
Обзор
C Gutierrez-Merino et al. Курр Мед Хим. 2011.
. 2011;18(8):1195-212.
дои: 10.2174/092986711795029735.
Авторы
C Гутьеррес-Мерино 1 , К. Лопес-Санчес, Р. Лагоа, А. К. Самхан-Ариас, К. Буэно, В. Гарсия-Мартинес
Лопес-Санчес, Р. Лагоа, А. К. Самхан-Ариас, К. Буэно, В. Гарсия-Мартинес
принадлежность
- 1 Кафедра биохимии и молекулярной биологии, Факультет естественных наук, Университет Эстремадура, Avenida de Elvas s/n, 06006 — Бадахос, Испания. [email protected]
- PMID: 21291366
- DOI: 10.2174/092986711795029735
Абстрактный
Накопленные за последние годы экспериментальные данные указывают на существенную роль оксидативного стресса в нейродегенерации. В качестве антиклеточных агентов окислительного стресса флавоноиды могут действовать либо как прямые химические антиоксиданты, классическое представление о флавоноидах как антиоксидантах, либо как модуляторы ферментов и метаболических и сигнальных путей, приводящих к чрезмерному образованию активных форм кислорода (АФК). возникающее понятие. Флавоноиды, большое семейство природных антиоксидантов, подвергаются значительному метаболизму в печени, что приводит к метаболитам, производным флавоноидов, которые также биоактивны в качестве антиоксидантов. При разработке более эффективных методов лечения антиоксидантного стресса на основе флавоноидов следует также учитывать их биодоступность в головном мозге с использованием альтернативных протоколов введения, а также тот факт, что основные АФК, вызывающие клеточный окислительный стресс, не одинаковы для всех нейродегенеративных инсультов и заболеваний. Исходя из этого, мы рассмотрели сообщения о нейропротекции различными классами флавоноидов на клеточных культурах и модельных животных. Кроме того, поскольку в настоящее время они становятся ценными фармакологическими препаратами из-за их низкой токсичности, кратко обсуждаются сообщения о побочных эффектах флавоноидов на модельных экспериментальных животных и людях.
возникающее понятие. Флавоноиды, большое семейство природных антиоксидантов, подвергаются значительному метаболизму в печени, что приводит к метаболитам, производным флавоноидов, которые также биоактивны в качестве антиоксидантов. При разработке более эффективных методов лечения антиоксидантного стресса на основе флавоноидов следует также учитывать их биодоступность в головном мозге с использованием альтернативных протоколов введения, а также тот факт, что основные АФК, вызывающие клеточный окислительный стресс, не одинаковы для всех нейродегенеративных инсультов и заболеваний. Исходя из этого, мы рассмотрели сообщения о нейропротекции различными классами флавоноидов на клеточных культурах и модельных животных. Кроме того, поскольку в настоящее время они становятся ценными фармакологическими препаратами из-за их низкой токсичности, кратко обсуждаются сообщения о побочных эффектах флавоноидов на модельных экспериментальных животных и людях.
Похожие статьи
Природные антиоксиданты антоцианы — скрытый терапевтический кандидат при метаболических нарушениях с основным фокусом на нейродегенерации.

Улла Р., Хан М., Шах С.А., Саид К., Ким М.О. Улла Р. и др. Питательные вещества. 2019 28 мая; 11 (6): 1195. дои: 10.3390/nu11061195. Питательные вещества. 2019. PMID: 31141884 Бесплатная статья ЧВК. Обзор.
Флавоноиды: антиоксиданты или сигнальные молекулы?
Уильямс Р.Дж., Спенсер Дж.П., Райс-Эванс С. Уильямс Р.Дж. и др. Свободный Радик Биол Мед. 2004 1 апреля; 36 (7): 838-49. doi: 10.1016/j.freeradbiomed.2004.01.001. Свободный Радик Биол Мед. 2004. PMID: 15019969 Обзор.
Двойное действие антиоксидантов при нейродегенерации: прямая нейропротекция против окислительного стресса и непрямая защита посредством подавления воспаления, опосредованного глией.
Ван ДЖИ, Вэнь ЛЛ, Хуан ЮН, Чен ЮТ, Ку МЦ.
 Ван Цзи и др.
Курр Фарм Дез. 2006;12(27):3521-33. дои: 10.2174/138161206778343109.
Курр Фарм Дез. 2006.
PMID: 17017945
Обзор.
Ван Цзи и др.
Курр Фарм Дез. 2006;12(27):3521-33. дои: 10.2174/138161206778343109.
Курр Фарм Дез. 2006.
PMID: 17017945
Обзор.Защитные эффекты диетических флавоноидов при нейродегенерации сетчатки, вызванной диабетом.
Аль-Досари Д.И., Алхомида А.С., Ола М.С. Аль-Досари Д.И. и соавт. Curr Цели наркотиков. 2017;18(13):1468-1476. дои: 10.2174/1389450117666161003121304. Curr Цели наркотиков. 2017. PMID: 27697035 Обзор.
Антиоксидантная активность, клеточная биодоступность и управление железом и кальцием нейропротекторных и ненейропротекторных флавонов.
Эчеверри С., Арредондо Ф., Мартинес М., Абин-Каррикири Дж. А., Мидиво Дж., Дахас Ф. Эчеверри С. и др. Нейротокс Рез. 2015 янв; 27(1):31-42.
 дои: 10.1007/s12640-014-9483-й. Epub 2014 28 июня.
Нейротокс Рез. 2015.
PMID: 24972590
дои: 10.1007/s12640-014-9483-й. Epub 2014 28 июня.
Нейротокс Рез. 2015.
PMID: 24972590
Посмотреть все похожие статьи
Цитируется
Использование солей флавилия в качестве групп динамического ингибитора человеческого C b 5 R.
Мартинес-Коста О.Х., Родригес-Миранда Л., Клементе С.М., Парола А.Дж., Базилио Н., Самхан-Ариас А.К. Мартинес-Коста О.Г. и др. Молекулы. 2022 23 декабря; 28 (1): 123. дои: 10.3390/молекул 28010123. Молекулы. 2022. PMID: 36615312 Бесплатная статья ЧВК.
Возможное терапевтическое использование растительных флавоноидов при БА и БП.
Мэн-Чжэнь С., Юй Л., Лан-Чун З., Цай-Фэн Д., Шу-да Ю., Хао-Фей Ю., Вэй-Ян Х.
 Мэн-Чжэнь С. и соавт.
Гелион. 2022 7 ноября; 8 (11): e11440. doi: 10.1016/j.heliyon.2022.e11440. электронная коллекция 2022 нояб.
Гелион. 2022.
PMID: 36387565
Бесплатная статья ЧВК.
Обзор.
Мэн-Чжэнь С. и соавт.
Гелион. 2022 7 ноября; 8 (11): e11440. doi: 10.1016/j.heliyon.2022.e11440. электронная коллекция 2022 нояб.
Гелион. 2022.
PMID: 36387565
Бесплатная статья ЧВК.
Обзор.Апигенин модулирует опосредованную AnxA6 и TNAP минерализацию остеобластов.
Мрочек Ю., Пикула С., Суски С., Веремейчик Л., Бисага М., Стшелецка-Килишек А. Мрочек Дж. и соавт. Int J Mol Sci. 2022 29 октября; 23 (21): 13179. дои: 10.3390/ijms232113179. Int J Mol Sci. 2022. PMID: 36361965 Бесплатная статья ЧВК.
Участие серотонинергической системы и нейротрофического фактора головного мозга в антидепрессантоподобном эффекте флавоноидов.
German-Ponciano LJ, Rosas-Sánchez GU, Cueto-Escobedo J, Fernández-Demeneghi R, Guillen-Ruiz G, Soria-Fregozo C, Herrera-Huerta EV, Rodríguez-Landa JF.
 German-Ponciano LJ, et al.
Int J Mol Sci. 2022 17 сентября; 23 (18): 10896. дои: 10.3390/ijms231810896.
Int J Mol Sci. 2022.
PMID: 36142808
Бесплатная статья ЧВК.
Обзор.
German-Ponciano LJ, et al.
Int J Mol Sci. 2022 17 сентября; 23 (18): 10896. дои: 10.3390/ijms231810896.
Int J Mol Sci. 2022.
PMID: 36142808
Бесплатная статья ЧВК.
Обзор.Лютеолин облегчил повреждение, вызванное синим светом у дрозофилы.
Чжун Л., Тан Х., Сюй Ю., Лю Х., Шань Дж., Шэнь Дж. Чжун Л. и др. Фотохимия Photobiol Sci. 2022 декабря; 21 (12): 2085-2094. doi: 10.1007/s43630-022-00280-6. Epub 2022 5 августа. Фотохимия Photobiol Sci. 2022. PMID: 35930192
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Нейропротекторное действие глюкокортикоидных и неглюкокортикоидных стероидов при остром повреждении нейронов
Anderson, D.
 K., Means, E.D., Waters, T.R., and Green, E.S. (1982). Микроваскулярная перфузия и метаболизм в поврежденном спинном мозге после лечения метилпреднизолоном. Ж. Нейрохирург. 56 106–113.
K., Means, E.D., Waters, T.R., and Green, E.S. (1982). Микроваскулярная перфузия и метаболизм в поврежденном спинном мозге после лечения метилпреднизолоном. Ж. Нейрохирург. 56 106–113.Google Scholar (1985). Гидролиз липидов и перекисное окисление в поврежденном спинном мозге: Частичная защита метилпреднизолоном или витамином Е и селеном. Травма ЦНС 2 257–267.
Google Scholar (19)88). Влияние лечения U-74006F на неврологическое восстановление после экспериментальной травмы спинного мозга. Ж. Нейрохирург. 69 562–567.
Google Scholar
Андерсон Д.К., Холл Э.Д., Брауглер Дж.М., Макколл Дж.М. и Минс Э.Д. (1991). Влияние отсроченного введения U-74006F (тирилазада мезилат) на восстановление двигательной функции после экспериментальной травмы спинного мозга. Дж. Нейротравма 8 187–192.

Google Scholar
Аудус, К.Л., Гийо, Ф.Л., и Бролер, Дж.М. (1991). Доказательства связи 21-аминостероида с гидрофобными доменами эндотелиальных клеток микрососудов головного мозга. Свободный рад. биол. Мед. 11 361–371.
Google Scholar
Берманн, Д. Л., Бреснахан, Дж. К., и Битти, М. С. (1992). Эффект метилпреднизолона после ушиба спинного мозга у крыс. Дж. Нейротравма 9 56.
Google Scholar
Бракен, М. Б., Шепард, М. Дж., Коллинз, В. Ф., Холфорд, Т. Р., Янг, В., Баскин, Д. С., Айзенберг, Х. М., Фламм, Э. С., Лео-Саммерс, Л., Марун, Дж., Маршалл , L.F., Perot, P.L., Piepmeier, J., Sonntag, VKH, Wagner, F.C., Wilberger, J.E., and Winn, H.R. (1990). Рандомизированное контролируемое исследование метилпреднизолона или наксолона при лечении острого повреждения спинного мозга.
 Н. англ. Дж. Мед. 322 1405–1411.
Н. англ. Дж. Мед. 322 1405–1411.Google Scholar Тел. ., Sonntag, VKH, Wagner, F.C., Wilberger, J.E., Winn, H.R., and Young, W. (1992). Лечение метилпреднизолоном или налоксоном после острой травмы спинного мозга: данные наблюдения в течение 1 года: результаты второго Национального исследования острой травмы спинного мозга. Ж. Нейрохирург. 76 23–31.
Google Scholar
Брауглер, Дж. М. (1985). Вызванное перекисным окислением липидов ингибирование поглощения γ -аминомасляной кислоты в синаптосомах головного мозга крысы: защита глюкокортикоидами. Дж. Нейрохим. 44 1282–1288.
Google Scholar
Брауглер, Дж. М., и Холл, Э. Д. (1983a). Метаболизм лактата и пирувата в поврежденном спинном мозге кошки до и после однократного введения большой внутривенной дозы метилпреднизолона.
 Ж. Нейрохирург. 59 256–261.
Ж. Нейрохирург. 59 256–261.Google Scholar
Брауглер, Дж. М., и Холл, Э. Д. (1983b). Поглощение и выведение метилпреднизолона из ушибленного спинного мозга после внутривенной инъекции эфира сукцината натрия. Ж. Нейрохирург. 58 538–542.
Google Scholar
Бролер, Дж. М., и Холл, Э. Д. (1984). Влияние многократных доз метилпреднизолона сукцината натрия на деградацию нейрофиламента спинного мозга поврежденной кошки и энергетический обмен. Ж. Нейрохирург. 61 290–295.
Google Scholar
Брауглер, Дж. М., и Холл, Э. Д. (1989). Травма центральной нервной системы и инсульт. I. Биохимические аспекты образования кислородных радикалов и перекисного окисления липидов. Свободный рад. биол. Мед. 6 289–301.
Google Scholar
Брауглер, Дж.
 М., и Прегенцер, Дж. Ф. (1989). 21-аминостероидные ингибиторы перекисного окисления липидов: реакции с липидными пероксильными и феноксильными радикалами. Свободный рад. биол. Мед. 7 125–130.
М., и Прегенцер, Дж. Ф. (1989). 21-аминостероидные ингибиторы перекисного окисления липидов: реакции с липидными пероксильными и феноксильными радикалами. Свободный рад. биол. Мед. 7 125–130.Google Scholar
Брауглер Дж. М., Холл Э. Д., Минс Э. Д. и Андерсон Д. К. (1987a). Оценка интенсивного режима дозирования сукцината натрия метилпреднизолона при экспериментальном повреждении спинного мозга. Ж. Нейрохирург. 67 102–105.
Google Scholar
Брауглер, Дж. М., Прегензер, Дж. Ф., Чейз, Р. Л., Якобсен, Э. Дж., и МакКолл, Дж. М. (1987b). Новые 21-аминостероиды как мощные ингибиторы железозависимого перекисного окисления липидов. J. Biol. хим. 262 10438–10440.
Google Scholar (1989). 21-аминостероиды: мощные ингибиторы перекисного окисления липидов для лечения травм и ишемии центральной нервной системы.
 Наркотики будущего 14 143–152.
Наркотики будущего 14 143–152.Google Scholar
Демопулос, Х.Б., Фламм, Э.С., Пьетронигро, Д.Д., и Селигман, М.Л. (1980). Свободнорадикальная патология и микроциркуляция при основных нарушениях центральной нервной системы. Acta Physiol. Сканд. ( Приложение ) 492 91–119.
Google Scholar
Демопулос, Х. Б., Фламм, Э. С., Селигман, М. Л., Пьетронигро, Д. Д., Томасула, Дж., и ДеКрешито, В. (1982). Дальнейшие исследования свободнорадикальной патологии при основных расстройствах центральной нервной системы: влияние очень высоких доз метилпреднизолона на функциональный результат, морфологию и химию экспериментального ударного повреждения спинного мозга. Кан. Дж. Физиол. Фармакол. 60 1415–1424.
Google Scholar (1990). Влияние 21-аминостероида (U-74006F) на церебральные метаболиты и отек после тяжелой экспериментальной травмы головы.
 В Достижения в неврологии, Vol. 52 (Д. Лонг, ред.), Raven Press, Нью-Йорк, стр. 365–375.
В Достижения в неврологии, Vol. 52 (Д. Лонг, ред.), Raven Press, Нью-Йорк, стр. 365–375.Google Scholar
Драконтидес, А.Б. (1978). Влияние лечения глюкокортикоидами на денервированную гемидифрагму крысы. Мозг Res. 239 175–189.
Google Scholar
Giannotta, S.L., Weiss, M.H., Apuzzo, M.L.J., and Martin, E. (1984). Высокие дозы глюкокортикоидов при лечении тяжелой черепно-мозговой травмы. Нейрохирургия 15 497–501.
Google Scholar
Грин Б.А., Кан Т. и Клозе К.Дж. (1980). Сравнительное исследование стероидной терапии при острой экспериментальной травме спинного мозга. Хирург. Нейрол. 13 91–97.
Google Scholar
Гринвуд, Дж. (1991). Механизмы нарушения гематоэнцефалического барьера.
 Нейрорадиология 33 95–100.
Нейрорадиология 33 95–100.Google Scholar
Hall, ED (1982). Глюкокортикоиды влияют на возбудимость центральной нервной системы и синаптическую передачу. Междунар. Преподобный Нейробиол. 23 165–195.
Google Scholar
Холл, Э. Д. (1985). Лечение высокими дозами глюкокортикоидов улучшает неврологическое восстановление у мышей с травмой головы. Ж. Нейрохирург. 62 882–887.
Google Scholar
Холл, Э. Д. (1987). Интенсивная антиоксидантная предварительная обработка замедляет дегенерацию двигательных нервов. Мозг Res. 413 175–178.
Google Scholar
Холл, Э. Д. (1988). Влияние 21-аминостероида U-74006F на посттравматическую ишемию спинного мозга. Ж. Нейрохирург. 68 462–465.

Google Scholar
Холл Э. Д. и Бролер Дж. М. (1981). Острые эффекты предварительного внутривенного введения глюкокортикоидов на перекисное окисление in vitro в ткани спинного мозга кошек. Экспл. Нейрол. 73 321–324.
Google Scholar
Холл, Э. Д., и Бролер, Дж. М. (1982). Влияние внутривенного метилпреднизолона на перекисное окисление липидов спинного мозга и активность (Na + , K + )-АТФазы. Анализ доза-реакция в течение 1-го часа после контузии у кошки. Ж. Нейрохирург. 49 563–568.
Google Scholar
Холл, Э. Д., и Трэвис, Массачусетс (1988). Ингибирование вызванного арахидоновой кислотой вазогенного отека мозга не глюкокортикоидным 21-аминостероидом U-74006F. Мозг Res. 451 350–352.
Google Scholar
Холл Э.
 Д. и Вольф Д.Л. (1984). Метилпреднизолон для сохранения функции двигательного нерва при ранней дегенерации. Экспл. Нейрол. 84 715–720.
Д. и Вольф Д.Л. (1984). Метилпреднизолон для сохранения функции двигательного нерва при ранней дегенерации. Экспл. Нейрол. 84 715–720.Google Scholar
Холл Э.Д. и Вольф Д.Л. (1986). Фармакологический анализ патофизиологических механизмов посттравматической ишемии спинного мозга. Ж. Нейрохирург. 64 951–961.
Google Scholar
Холл Э.Д. и Йонкерс П.А. (1990). Сохранение функции двигательного нерва при ранней дегенерации с помощью 21-аминостероидного антиоксиданта U-74006F. Мозг Res. 513 244–247.
Google Scholar
Холл Э.Д., Бейкер Т. и Райкер В.Ф. (1977). Глюкокортикоидное сохранение функции двигательного нерва при ранней дегенерации. Энн. Нейрол. 1 273–270.
Google Scholar
Холл Э.
 Д., Райкер В.П. и Бейкер Т. (1983). Благоприятное действие лечения глюкокортикоидами на нервно-мышечную передачу во время ранней дегенерации двигательных нервов. Экспл. Нейрол. 79 488–496.
Д., Райкер В.П. и Бейкер Т. (1983). Благоприятное действие лечения глюкокортикоидами на нервно-мышечную передачу во время ранней дегенерации двигательных нервов. Экспл. Нейрол. 79 488–496.Google Scholar
Hall, E.D., Wolf, D.L., и Braughler, JM (1984). Влияние однократной большой дозы сукцината натрия метилпреднизолона на экспериментальную посттравматическую ишемию спинного мозга. Ж. Нейрохирург. 61 124–130.
Google Scholar
Холл, Э. Д., МакКолл, Дж. М., Йонкерс, П. А., Чейз, Р. Л., и Бролер, Дж. М. (1987). Неглюкокортикоидный аналог метилпреднизолона дублирует его фармакологию высоких доз в моделях травмы ЦНС и повреждения мембраны нейронов. J. Pharmacol. Эксп. тер. 242 137–142.
Google Scholar
Hall, E.D., McCall, J.M., и Braughler, J.M. (1988a).
 Новые фармакологические методы лечения травм спинного мозга. Дж. Нейротравма 5 81–89.
Новые фармакологические методы лечения травм спинного мозга. Дж. Нейротравма 5 81–89.Google Scholar
Холл, Э.Д., Йонкерс, П.А., МакКолл, Дж.М., и Бролер, Дж.М. (1988b). Влияние 21-аминостероида U-74006F на экспериментальную травму головы у мышей. Ж. Нейрохирург. 68 456–461.
Google Scholar
Холл, Э.Д., Йонкерс, П.А., Хоран, К.Л., и Бролер, Дж.М. (1989). Корреляция между ослаблением посттравматической ишемии спинного мозга и сохранением витамина Е под действием 21-аминостероида U-74006F: доказательства in vivo антиоксидантное действие. Дж. Нейротравма 6 169–176.
Google Scholar (1991). U-78517F: мощный ингибитор перекисного окисления липидов с активностью при экспериментальных повреждениях головного мозга и ишемии. J. Pharmacol. Эксп. тер. 258 688–694.

Google Scholar
Холл Э.Д., Йонкерс П.А., Андрус П.К., Кокс Дж.В. и Андерсон Д.К. (1992). Биохимия и фармакология липидных антиоксидантов при остром поражении головного и спинного мозга. Дж. Нейротравма 9 (Дополнение 2): S425-S442.
Google Scholar
Холл Э. Д., Андрус П. К. и Йонкерс П. А. (1993). Генерация гидроксильных радикалов головного мозга при острой экспериментальной черепно-мозговой травме. Дж. Нейрохим. 60 588–594.
Google Scholar (1984). Оценка применения наксолона, кроцетина, тиреотропного гормона, метилпреднизолона, частичной миелотомии и гемиламинэктомии при лечении острой травмы спинного мозга. Дж. Ам. Аним. Хосп. доц. 21 67–77.
Google Scholar
Хольц А., Нистром Б. и Гердин Б. (1990).
 Влияние метилпреднизолона на двигательную функцию и спинномозговой кровоток после компрессии спинного мозга у крыс. Акта Нейрол. Сканд. 82 68–73.
Влияние метилпреднизолона на двигательную функцию и спинномозговой кровоток после компрессии спинного мозга у крыс. Акта Нейрол. Сканд. 82 68–73.Google Scholar
Юзука Х., Ивасаки Ю. и Ямамото Т. (1986). Морфометрическая оценка действия препаратов при экспериментальной травме спинного мозга. Ж. Нейрохирург. 65 92–98.
Google Scholar
Макинтош, Т.К., Томас, М., Смит, Д., и Банбери, М. (1992). Новый 21-аминостероид U-74006F ослабляет отек головного мозга и улучшает выживаемость после черепно-мозговой травмы у крыс. Дж. Нейротравма 9 33–46.
Google Scholar
Моньер Х., Хартли Д. М. и Чой Д. В. (1990). 21-Аминостероиды ослабляют эксайтотоксическое повреждение нейронов в культурах клеток коры головного мозга. Нейрон 5 121–126.
Google Scholar
Окамото, М.
 , и Райкер, В.Ф. (1969). Окончания двигательных нервов как исходный участок функциональных изменений после денервации. J. Общая физиол. 53 70–80.
, и Райкер, В.Ф. (1969). Окончания двигательных нервов как исходный участок функциональных изменений после денервации. J. Общая физиол. 53 70–80.Google Scholar
Сапольский Р. М. (1990). Глюкокортикоиды, повреждение гиппокампа и глутаматергический синапс. Прог. Мозг Res. 86 13–25.
Google Scholar
Сапольски Р.М. и Пульсинелли В.А. (1985). Глюкокортикоиды потенцируют ишемическое повреждение нейронов: терапевтические последствия. Наука 229 1397–1399.
Google Scholar
Сапольски Р. М., Крей Л. К. и Макьюэн Б. С. (1985). Длительное воздействие глюкокортикоидов снижает количество нейронов гиппокампа: последствия для старения. J. Neurosci. 5 1221–1227.
Google Scholar
Шапира Ю.
 , Артру А. А., Ядид Г. и Шохами Э. (1992). Метилпреднизолон не снижает концентрацию эйкозаноидов или отек в ткани головного мозга и не улучшает неврологический исход после тепловой травмы у крыс. Анест. аналг. 75 238–244.
, Артру А. А., Ядид Г. и Шохами Э. (1992). Метилпреднизолон не снижает концентрацию эйкозаноидов или отек в ткани головного мозга и не улучшает неврологический исход после тепловой травмы у крыс. Анест. аналг. 75 238–244.Google Scholar
Spiller, C.R., Glicini, R.L., Tortella, B.J., and Lazaro, E.J. (1990). Эффект стероидной терапии при экспериментальной травме головы. Черепно-мозговая травма 4 199–201.
Google Scholar
Янг В. и Фламм Э. С. (1982). Влияние терапии высокими дозами кортикостероидов на кровоток, вызванные потенциалы и внеклеточный кальций при экспериментальной травме позвоночника. Ж. Нейрохирург. 57 667–673.
Google Scholar
Янг В., ДеКрешито В., Фламм Э.С., Блайт А.Р. и Грюнер Дж.А. (1988). Фармакотерапия острого повреждения спинного мозга: исследования с высокими дозами метилпреднизолона и налоксона.


 Ван Цзи и др.
Курр Фарм Дез. 2006;12(27):3521-33. дои: 10.2174/138161206778343109.
Курр Фарм Дез. 2006.
PMID: 17017945
Обзор.
Ван Цзи и др.
Курр Фарм Дез. 2006;12(27):3521-33. дои: 10.2174/138161206778343109.
Курр Фарм Дез. 2006.
PMID: 17017945
Обзор. дои: 10.1007/s12640-014-9483-й. Epub 2014 28 июня.
Нейротокс Рез. 2015.
PMID: 24972590
дои: 10.1007/s12640-014-9483-й. Epub 2014 28 июня.
Нейротокс Рез. 2015.
PMID: 24972590 Мэн-Чжэнь С. и соавт.
Гелион. 2022 7 ноября; 8 (11): e11440. doi: 10.1016/j.heliyon.2022.e11440. электронная коллекция 2022 нояб.
Гелион. 2022.
PMID: 36387565
Бесплатная статья ЧВК.
Обзор.
Мэн-Чжэнь С. и соавт.
Гелион. 2022 7 ноября; 8 (11): e11440. doi: 10.1016/j.heliyon.2022.e11440. электронная коллекция 2022 нояб.
Гелион. 2022.
PMID: 36387565
Бесплатная статья ЧВК.
Обзор. German-Ponciano LJ, et al.
Int J Mol Sci. 2022 17 сентября; 23 (18): 10896. дои: 10.3390/ijms231810896.
Int J Mol Sci. 2022.
PMID: 36142808
Бесплатная статья ЧВК.
Обзор.
German-Ponciano LJ, et al.
Int J Mol Sci. 2022 17 сентября; 23 (18): 10896. дои: 10.3390/ijms231810896.
Int J Mol Sci. 2022.
PMID: 36142808
Бесплатная статья ЧВК.
Обзор. K., Means, E.D., Waters, T.R., and Green, E.S. (1982). Микроваскулярная перфузия и метаболизм в поврежденном спинном мозге после лечения метилпреднизолоном. Ж. Нейрохирург. 56 106–113.
K., Means, E.D., Waters, T.R., and Green, E.S. (1982). Микроваскулярная перфузия и метаболизм в поврежденном спинном мозге после лечения метилпреднизолоном. Ж. Нейрохирург. 56 106–113.
 Н. англ. Дж. Мед. 322 1405–1411.
Н. англ. Дж. Мед. 322 1405–1411. Ж. Нейрохирург. 59 256–261.
Ж. Нейрохирург. 59 256–261. М., и Прегенцер, Дж. Ф. (1989). 21-аминостероидные ингибиторы перекисного окисления липидов: реакции с липидными пероксильными и феноксильными радикалами. Свободный рад. биол. Мед. 7 125–130.
М., и Прегенцер, Дж. Ф. (1989). 21-аминостероидные ингибиторы перекисного окисления липидов: реакции с липидными пероксильными и феноксильными радикалами. Свободный рад. биол. Мед. 7 125–130. Наркотики будущего 14 143–152.
Наркотики будущего 14 143–152. В Достижения в неврологии, Vol. 52 (Д. Лонг, ред.), Raven Press, Нью-Йорк, стр. 365–375.
В Достижения в неврологии, Vol. 52 (Д. Лонг, ред.), Raven Press, Нью-Йорк, стр. 365–375. Нейрорадиология 33 95–100.
Нейрорадиология 33 95–100.
 Д. и Вольф Д.Л. (1984). Метилпреднизолон для сохранения функции двигательного нерва при ранней дегенерации. Экспл. Нейрол. 84 715–720.
Д. и Вольф Д.Л. (1984). Метилпреднизолон для сохранения функции двигательного нерва при ранней дегенерации. Экспл. Нейрол. 84 715–720. Д., Райкер В.П. и Бейкер Т. (1983). Благоприятное действие лечения глюкокортикоидами на нервно-мышечную передачу во время ранней дегенерации двигательных нервов. Экспл. Нейрол. 79 488–496.
Д., Райкер В.П. и Бейкер Т. (1983). Благоприятное действие лечения глюкокортикоидами на нервно-мышечную передачу во время ранней дегенерации двигательных нервов. Экспл. Нейрол. 79 488–496. Новые фармакологические методы лечения травм спинного мозга. Дж. Нейротравма 5 81–89.
Новые фармакологические методы лечения травм спинного мозга. Дж. Нейротравма 5 81–89.
 Влияние метилпреднизолона на двигательную функцию и спинномозговой кровоток после компрессии спинного мозга у крыс. Акта Нейрол. Сканд. 82 68–73.
Влияние метилпреднизолона на двигательную функцию и спинномозговой кровоток после компрессии спинного мозга у крыс. Акта Нейрол. Сканд. 82 68–73. , и Райкер, В.Ф. (1969). Окончания двигательных нервов как исходный участок функциональных изменений после денервации. J. Общая физиол. 53 70–80.
, и Райкер, В.Ф. (1969). Окончания двигательных нервов как исходный участок функциональных изменений после денервации. J. Общая физиол. 53 70–80. , Артру А. А., Ядид Г. и Шохами Э. (1992). Метилпреднизолон не снижает концентрацию эйкозаноидов или отек в ткани головного мозга и не улучшает неврологический исход после тепловой травмы у крыс. Анест. аналг. 75 238–244.
, Артру А. А., Ядид Г. и Шохами Э. (1992). Метилпреднизолон не снижает концентрацию эйкозаноидов или отек в ткани головного мозга и не улучшает неврологический исход после тепловой травмы у крыс. Анест. аналг. 75 238–244.