Страница не найдена
Размер:
AAA
Цвет: C C C
Изображения Вкл. Выкл.
Обычная версия сайта
RUENBY
Гомельский государственный
медицинский университет
- Университет
- Университет
- История
- Руководство
- Устав и Символика
- Воспитательная деятельность
- Организация образовательного процесса
- Международное сотрудничество
- Система менеджмента качества
- Советы
- Факультеты
- Кафедры
- Подразделения
- Первичная профсоюзная организация работников
- Издания университета
- Гордость университета
- Выпускник-2021
- Первичная организация «Белорусский союз женщин»
- ГомГМУ в международных рейтингах
- Структура университета
- Абитуриентам
- Приёмная комиссия
- Целевая подготовка
- Заключение, расторжение «целевого» договора
- Льготы для молодых специалистов
- Архив проходных баллов
- Карта и маршрут проезда
- Порядок приёма на 2022 год
- Специальности
- Контрольные цифры приёма в 2022 году
- Стоимость обучения
- Информация о ходе приёма документов
- Приём документов и время работы приёмной комиссии
- Порядок приёма граждан РФ, Кыргызстана, Таджикистана, Казахстана
- Pепетиционное тестирование
- Горячая линия по вопросам вступительной кампании
- Студентам
- Первокурснику
- Расписание занятий
- Расписание экзаменов
- Информация для студентов
- Студенческий клуб
- Спортивный клуб
- Общежитие
- Нормативные документы
- Практика
- Стоимость обучения
- Безопасность жизнедеятельности
- БРСМ
- Профком студентов
- Учебный центр практической подготовки и симуляционного обучения
- Многофункциональная карточка студента
- Анкетирование студентов
- Выпускникам
- Интернатура и клиническая ординатура
- Докторантура
- Аспирантура
- Магистратура
- Распределение
- Врачам и специалистам
- Профессорский консультативный центр
- Факультет повышения квалификации и переподготовки
- Иностранным гражданам
- Факультет иностранных студентов
- Стоимость обучения
- Регистрация и визы
- Полезная информация
- Правила приёма
- Информация о возможностях и условиях приема в 2022 году
- Официальные представители ГомГМУ по набору студентов
- Страхование иностранных граждан
- Приём на Подготовительное отделение иностранных граждан
- Прием иностранных граждан для обучения на английском языке / Training of foreign students in English
- Повышение квалификации и переподготовка для иностранных граждан
- Научная деятельность
- Направления научной деятельности
- Научно-педагогические школы
- Студенчеcкое научное общество
- Инновационные технологии в ГомГМУ
- Научно-исследовательская часть
- Научно-исследовательская лаборатория
- Конкурсы, гранты, стипендии
- Работа комитета по этике
- Научные мероприятия
- В помощь исследователю
- Диссертационный совет
- «Горизонт Европа»
- Патенты
- Инструкции на метод
- Совет молодых ученых
- Госпрограмма (ЧАЭС)
- Главная
404 Cтраница не найдена
Размер:
AAA
Изображения
Вкл. Выкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
ГИСТОХИМИЯ УГЛЕВОДОВ Биологическая роль углеводов многообразна. В организме они выполняют опорные и энергетические функции, некоторые углеводы являются составными частями биологически важных соединений (АТФ, циклической АМФ, нуклеиновых кислот, гепарина, витамина С и др.). Гликопротеиды как специфический компонент иммуноглобулинов играют важную роль в иммунных механизмах, определяя антигенную активность сывороточных и клеточных факторов. Кроме того, продукты расщепления углеводов используются для синтеза практически всех классов соединений в живой клетке.
Классификация углеводов В живой клетке углеводы существуют в форме моно-, олиго- и полисахаридов. В гистологических препаратах они сохраняются практически только в виде полисахаридов: во всяком случае только полисахариды могут быть с достоверностью выявлены гистохимически. Правда, возможно также гистохимическое выявление глюкозы и витамина С. Общепринятой классификации полисахаридов не существует. Для практических гистохимических целей достаточно разделить полисахариды на гомо- и гетерополисахариды. Гомополисахариды построены из остатков молекул моносахаридов, главным образом пентозы и гексозы, соединенных между собой кислотными мостиками. Гомополисахаридами являются крахмал, инулин, клетчатка, гликоген. К ним с определенными оговорками можно также отнести хитин и полигалактуроновую кислоту. Гетерополисахариды разделяют на гликозаминогликаны (ГАГ) и гликопротеины. К кислым гликозаминогликанам ГАГ относят гиалуроновую кислоту, молекула которой построена из остатков глюкуроновой и уксусной кислот и гексозамина; хондроинин-4-сульфат, хондроитин-6-сульфат, дерматан-сульфат, кератан-сульфат, гепаритин-сульфат, гепарин, молекулы которых содержат остатки гексозамина, глюкуроновой или уроновой кислот, серной и уксусной кислот в различных сочетаниях. В тканях кислые ГАГ, кроме гепарина, находятся в соединении с белками. Такие комплексы, в которых к белковому стержню присоединены полисахаридные цепи, носят название «протеогликаны». Все эти соединения входят в состав матрикса соединительной ткани, крови, синовиальной жидкости, слизи. Гликопротеины являются белками, к молекуле которых ковалентно присоединены олигосахариды: гексозы, гексозамины, сиаловые кислоты, фукозы и др. Такие соединения являются составной частью клеточных мембран, слизистых секретов желез, сывороточных белков, ферментов, гормонов, «неколлагеновых белков» соединительной ткани и т.д.
Гистохимическая идентификация углеводов Выявление углеводов основано, как правило, на методах общего анализа химических групп. Используются методы окисления, метахроматическое окрашивание основными красителями, реакции связывания коллоидных металлов, выявление базофилии, окрашивание кармином, реакции блокирования и превращения реакционноспособных групп, методы ферментативного гидролиза, радиоавтографию, иммуногистохимию. Методы окисления 1,2-гликолей до альдегидов
Реакция Шифф-йодной кислотой (ШИК-реакция)
Метайодная кислота селективно окисляет и расщепляет -С=С-связи не только в 1,2-окси-, но также в 1-окси-2-амино-1-окси-2-алкиламино- и 1-окси-2-кетогруппах. В результате этого образуется одна кетогруппа или две альдегидные группы, как, например, в глюкозе. Альдегидные группы реагируют с реактивом Шиффа (фуксин-сернистой кислотой) точно так же, как и в реакции Фельгена. С помощью этого метода выявляют все соединения, содержащие оксигруппы, которые в результате окисления метайодной кислоты могут превращаться в альдегидные группы. Однако в гистологических срезах практически лишь гликоген и гликопротеины, сохраняющиеся в достаточных количествах, могут быть выявлены с помощью ШИК-реакции. Гликоген можно дифференцировать от гликопротеинов путем переваривания в амилазе или диастазе. Для окисления -С-С-связей в полисахаридах предпринимались попытки использовать, помимо одной кислоты, другие окислители-хромовую кислоту, перманганат калия, тетраацетат натрия и т.д. Наиболее удачной является модификация ШИК-реакции, предложенная А.Л. Шабадашем (1949).
1. Материал фиксируют в 10 % формалине, жидкостях Карнуа, Ценкера, заливают в парафин. 2. Депарафинированные срезы доводят до дистиллированной воды. 3. При комнатной температуре срезы окисляют 0,5—1 % водным раствором орто- или метайодной кислоты в течение 2 —10 мин. Окисление можно также проводить по Шабадашу в 0,001—0,01 М метаперйодате калия или натрия в течение 7 — 25 мин. Раствор хранят в темноте. Рабочую концентрацию этого раствора и продолжительность инкубации в ней подбирают в зависимости от объекта. 4. Промывают в дистиллированной воде 10 мин. 5. Помещают срезы в реактив Шиффа на 10-30 мин при комнатной температуре в темноте. ——————————————————————————————
6. Срезы промывают сернистой водой (600 мл дистиллированной воды + 30 мл 10 % пиросульфита калия + 30 мл 1 н. соляной кислоты) три раза по 2 мин. Сернистую воду можно также готовить (непосредственно до проведения реакции) по рекомендации А.Л. Шабадаша следующим образом: к 200 мл дистиллированной воды добавить 10 мл 10 % раствора натрия гидросульфита и 10 мл 1 н. соляной кислоты. 7. Тщательно промывают в проточной и дистиллированной воде, ядра можно докрасить 0,5 % светлым зеленым или кислым гемалауном. 8. Обезвоживают в спиртах возрастающей концентрации, заключают в бальзам.
Результат: углеводы, содержащие гексозу, окрашиваются в красно-лиловый цвет, гликоген — в более интенсивный темно-красный.
Контроль: расщепление гликогена амилазой или диастазой, реакция ацетилирования для блокирования гидроксильных групп. Примечание: необходимо пользоваться химически чистой посудой, стеклянными палочками; нельзя работать с металлическими крючками или иголками; окрашивание срезов в реактиве Шиффа следует проводить в темноте.
Метахроматическое окрашивание кислых гликозаминогликанов
Метахромазия — это изменение спектров поглощения используемых красителей. Метахромазию можно получить при использовании очень широкого набора красителей (табл. 2).
Пригодность красителя для выявления метахромазии определяется тем, насколько ортохроматический и метахроматический максимумы поглощения отдалены друг от друга. В гистохимии под метахромазией подразумевают практически только явления, наблюдающиеся при использовании красителей тиазиновой группы, а именно те изменения окраски от синего через фиолетовый до красного, которые происходят при окрашивании тканей разбавленными водными растворами красителей названной группы. Типичным примером метахромазии служит окрашивание тиазиновыми красителями (тионин, толуидиновый синий и т.п.) лаброцитов (тучных клеток), при котором гранулы этих клеток окрашиваются в фиолетово-красный цвет, тогда как другие структуры воспринимают оригинальный синий цвет красителя. Метахроматическое окрашивание не связано ни с определенной химической структурой, ни с определенным химическим соединением, а обусловлено плотностью анионов на поверхности молекулы субстрата, а также степенью ионизации. Наличие метахромазии свидетельствует только о наличии некоторой минимальной плотности свободных отрицательных поверхностных зарядов на молекулах субстрата. В животной ткани метахроматически окрашиваются главным образом кислые ГАГ, характеризующиеся высокой молекулярной массой и большим количеством свободных анионных групп (R=0=SO-3, R-0=HPO-3, R=COO-). Все приемы подготовки срезов и следующей за окрашиванием обработки влияют на метахромазию, поэтому предпочтительнее использовать криостатные срезы с непродолжительной последующей фиксацией. Окрашенные срезы перед обезвоживанием и заключением в бальзам рекомендуется предварительно просматривать в дистиллированной воде под покровным стеклом. Существуют также методы сохранения метахромазии в постоянных препаратах [Кутах Г.Н., Шубич М.Г., 1965].
Реакции связывания коллоидных металлов Подобно основным (катионным) красителям, катионы некоторых металлов также образуют соединения с анионами кислых ГАГ. С этой целью используют коллоидные растворы золота, тория, платины, железа, а также ионы бария и висмута. Торий, платину, барий и висмут применяют главным образом для контрастирования кислых ГАГ в электронно-микроскопической гистохимии. В светооптической гистохимии применяется в первую очередь метод Хэйла, основанный на связывании в кислой среде (рН < 2) коллоидных мицелл гидроксида железа (III) с карбоксильными и сульфоновыми группами кислых ГАГ и последующем выявлении связанного железа с помощью гексацианоферрата (ферроцианида) калия в реакции берлинской лазури.
Выявление кислых гликозаминогликанов с помощью коллоидного железа (модификация реакции Хэйла по Грауманну—Клаусу)
1. Материал фиксируют в забуференном 10 % формалине, жидкостях Карнуа, Жандра, спирт-формоле (лучше пользоваться безводными фиксаторами) и заливают в парафин; возможна обработка срезов без фиксации или криостатных срезов. 2. Срезы депарафинируют и через ряд спиртов убывающей концентрации доводят до дистиллированной воды. Обработку свежих криостатных срезов начинают с п. 3. Фиксированные срезы хорошо промывают в дистиллированной воде. 3. Помещают срезы на 10 мин в раствор коллоидного железа, подкисленного уксусной кислотой (маточного раствора 10 частей, 96-99 % уксусной кислоты 4 части). Маточный раствор: 750 мл дистиллированной воды доводят до кипения и добавляют 12 мл 32 % раствора трихлорида железа. 4. Промывают в 2 сменах 5 % уксусной кислоты по 5 мин в каждой. 5. Срезы помещают в свежеприготовленный раствор, включающий 30 мл 2 % гексацианоферрата калия + 60 мл 1 % соляной кислоты на 10 мин. 6. Срезы проводят через 2 смены дистиллированной воды по 2 мин. 7. Обезвоживают в ряду спиртов возрастающей концентрации, проводят через ксилол, заключают в бальзам. Результат: структуры, в которых содержатся кислые ГАГ, окрашиваются в синий цвет.
Реакция Хэйла специфична для выявления свободных кислотных групп, например эфиров серной и фосфорной кислот, свободных гидроксильных групп уроновой и моноаминодикарбоновой кислот белков. Специфичность метода Хэйла для выявления кислых мукоидных веществ следует контролировать с помощью вспомогательных реакций. Ложную положительную реакцию, обусловленную присутствием железа в тканях, можно исключить путем обработки контрольных срезов в растворе гексацианоферрата калия и соляной кислоты (5-й этап данного метода).
Реакцию связывания железа можно комбинировать с ШИК-реакцией. В этом случае после п. 6 следует окисление метайодной кислотой. В результате этого кислые ГАГ окрашиваются в темно-синий цвет, белковые структуры — в светло-синий, а нейтральные гликопротеины — в красный цвет различных оттенков. Эта комбинация двух методов позволяет получить контрастную гистологическую картину при исследовании ткани почек и кожи.
Окраска альциановым синим В гистохимической практике используют несколько фталоцианиновых красителей: альциановые синие — 8 GX, 8 SX, 8 GS, 8 GN, 5 GX, 150, альциановые зеленые — 2 GX, 3 ВХ, люксоловый прочный синий, астрасиний и др. Альциановый синий обладает большими преимуществами по сравнению с другими красителями кислых мукоидных веществ, прежде всего быстротой окрашивания и простотой применения. Прослеживается параллель между окрашиванием альциановым синим и метахромазией при изменении рН и концентрации красителя.
Окраска альциановым синим при рН 2,5 1. Материал фиксируют в формалине, формалин-этаноле, смесях Ценкера, Буэна, Карнуа и заливают в парафин (можно использовать криостатные срезы). 2. Депарафинированные срезы окрашивают в свежеотфильтрованном 1 % растворе альцианового синего 8 GX в 3 % уксусной кислоте (рН 2,5) в течение 30 мин. 3. Промывают в проточной воде в течение 5 мин. 4. Обезвоживают в ряду спиртов возрастающей концентрации, проводят через ксилол, заключают в бальзам. Результат: слабокислые сульфатированные ГАГ (гиалуроновая кислота) и сиалогликопротеины приобретают темно-синюю окраску. Сильнокислые сульфатированные ГАГ окрашиваются слабо или совсем не окрашиваются.
Окраска альциановым синим при рН 1,0
1. Срезы помещают в дистиллированную воду. 2. Окрашивают в 1 % растворе альцианового синего 8 GX в 0,1 н. соляной кислоте (рН 1,0) в течение 30 мин. 3. Просушивают фильтровальной бумагой. 4. Обезвоживают в этаноле, проводят через ксилол, заключают в бальзам. Результат: окрашиваются только сульфатированные ГАГ. Примечание. Вместо альцианового синего 8 GX можно использовать альциановый синий 8 GN, альциановый зеленый 3 ВХ или альциановый зеленый 2 GX. Для окрашивания очень кислых мукоидных веществ рекомендуется модификация окраски альциановым синим по Гомори.
Окраска метиленовым синим Тиазиновый краситель метиленовый синий позволяет отделить кислые ГАГ от нейтральных гликопротеинов и дифференцировать сульфатные, фосфатные и карбоксильные группы путем выявления их базофилии при различных рН. Степень базофилии определяется наличием свободных анионов полисахаридов. По мере снижения рН интенсивность окрашивания отдельных структур снижается. Это явление носит название «экстинкция» (от лат.
В присутствии электролитов, таких как соляная кислота, хлорид натрия и калия, окрашивание альциановым синим усиливается. При концентрациях хлорида магния ниже 0,3 М альциановый синий связывается кислыми ГАГ, содержащими сульфатированные и карбоксильные группы, а при концентрациях хлорида магния 0,8 М и выше окрашиваются исключительно вещества, содержащие S04-группы.. Эти факты свидетельствуют о ведущей роли электростатических сил при связывании альцианового синего с субстратом. Для определения экстинкции метиленового синего можно использовать растворы 0,0005-0,005 М (приблизительно 0,1 — 0,01 %) метиленового синего в веронал ацетатном буфере или ацетатном буфере Михаэлиса при различных рН (от 2,6 до 8,0 с интервалами 0,5).
Наибольший интерес представляют значения рН ниже 4,0, так как анионные группы белков, прежде всего карбоксильные группы, значительно осложняющие интерпретацию результатов, теряют свой заряд. При рН 3,0 метиленовый синий связывается также нуклеиновыми кислотами, но для них характерна другая локализация, и их можно дифференцировать с помощью специфических реакций. К.С. Митин (1966) показал, что коллагеновые волокна не окрашиваются метиленовым синим при рН 5,0-6,0,а основное вещество средней оболочки аорты, построенное из хондроитин -сульфатов, обладает метахромазией при рН 2,5-3,0, интима обесцвечивается при рН 4,0, а лаброциты (тучные клетки) и нейроны окрашиваются в фиолетовый цвет при рН 1,5 — 2,0.
Окраска рутениевым красным
Рутениевый красный давно используют в световой микроскопии для окрашивания пектина, растительных муцинов, целлюлозы, крахмала, инулина и лигнина, гранул лаброцитов, основного вещества хряща и т.д. Специфичность этого окрашивания невысока, однако благодаря методу контрастирования рутениевым красным по Лафту значительно дополнены сведения о гликокаликсе-слое мукоидов, окружающих плазмалемму.
Контрастирование рутениевым красным по Лафту
1. Кусочки ткани фиксируют в растворе глутарового альдегида и рутениевого красного (0,5 мл 3,6 % глутарового альдегида+0,5 мл 0,5 М какодилатного буфера рН 7,3 + 0,5 мл 0,15-0,3 % водного раствора рутениевого красного) в течение 1 ч при 4 °С. 2. Промывают в 0,15 М какодилатном буфере 3 раза по 3 мин. 3. Дополнительно фиксируют в течение 3 ч при 20 °С в следующем растворе: 0,5 мл 5 % тетраоксида осмия + 0,5 мл 0,2 М какодилатного буфера рН 7,3+0,5 мл 0,15-0,3 % раствора рутениевого красного. 4. Быстро промывают в буферном растворе, обезвоживают в спиртах, заливают в эпоксидную смолу.
Результат: контрастируются полианионы с умеренной и высокой плотностью заряда, представленные в тканях главным образом внеклеточными кислыми ГАГ.
Для очистки рутениевого красного рекристаллизацией 1 г рутениевого красного помещают в 10 мл 0,5 н. раствора аммиака при 60 °С. Нерастворимый остаток отделяют от горячего раствора центрифугированием. Надосадочную жидкость остужают до 0 °С. Образующийся при этом осадок промывают водой, охлажденной до 0 °С, спиртом и диэтиловым эфиром, а затем высушивают на воздухе при комнатной температуре.
Окраска кармином по Бесту
Классическая ШИК-реакция и различные ее модификации, направленные на выявление гликогена, не могут быть рекомендованы для всех случаев, особенно если ткань содержит вещества, имеющие ту же локализацию, что и гликоген, дающие положительную ШИК-реакцию: мукопротеиды, гликопротеиды и ненасыщенные липиды. Действующим началом природного кармина является карминовая кислота. Ее способность окрашивать гликоген зависит от ряда не до конца понятых физических и стереохимических факторов. Для лучшей сохранности гликогена в первоначальных прописях рекомендовалась заливка в целлоидин, однако можно использовать и парафиновые срезы, если перед перенесением в раствор Беста покрыть их тонким слоем целлоидина. Целлоидирования срезов можно избежать, фиксируя ткань в жидкости Марчи в течение 12-20 ч при 4 °С, промывая затем при 4 °С в течение 10-12 мин в 30 % спирте, инкубируя также при 4 «С в красящем растворе кармина и после дифференцирования быстро обезвоживая в двух сменах абсолютного ацетона. При использовании этого метода необходимо проводить контрольные реакции с перевариванием гликогена амилазой, диастазой или слюной.
1. Материал фиксируют по Лилли, Жандру, Россману, Карнуа, Шабадашу, Буэну или в 100% спирте; заливают в парафин; можно также использовать целлоидиновые или замороженные срезы. 2. Депарафинированные срезы доводят до абсолютного спирта. 3. Целлоидируют срезы в 1 % растворе целлоидина (в смеси равных частей спирта и эфира) в течение 2 мин. 4. Просушивают срезы на воздухе, уплотняют в 70 % спирте и помещают в дистиллированную воду. 5. Проводят интенсивное окрашивание ядер в гемалауне по Майеру или в гематоксилине по Эрлиху. 6. Промывают в дистиллированной воде, в случае необходимости дифференцируют в солянокислом спирте и снова промывают в воде. 7. Окрашивают в растворе кармина в течение 10-30 мин. Маточный раствор кармина: 2 г кармина, 1 г карбоната калия и 5 г хлорида калия растворяют в 60 мл дистиллированной воды и кипятят несколько минут на слабом огне. Раствор после охлаждения фильтруют и добавляют в него 20 мл раствора аммиака (плотность 0,880). Красящий раствор кармина: 20 мл профильтрованного маточного раствора кармина + 30 мл раствора аммиака + 30 мл метанола (сохранность несколько дней). 8. Переносят срезы непосредственно в смесь для дифференцирования (40 мл метанола + 50 мл абсолютного этанола + 100 мл дистиллированной воды). Дифференцируют в двух порциях до тех пор, пока видимые глазом следы красителя перестанут выходить из среза в раствор-от нескольких секунд до нескольких минут. 9. Промывают в 80 % спирте, обезвоживают в абсолютном спирте, проводят через ксилол, заключают в бальзам.
Результат: гликоген окрашивается в интенсивный красный цвет, ядра — в темно-синий.
Контрольные реакции в гистохимии углеводов
Описанные методы выявления углеводов являются в основном лишь реакциями на химические группы. Кислые группы (карбоксильные, фосфатные и сульфатные) можно блокировать метилированием в растворах метанол-НС1, метанол-тионилхлорида и метанол-метилиодида. В результате этого ослабляются базофилия и метахромазии элементов ткани. Метилирование по Белло—Гайеру 1. Депарафинированные срезы промывают в двух сменах абсолютного спирта, а затем в двух сменах абсолютного метанола. 2. Помещают срезы при 24С на 4-6 ч в следующий раствор: 1 мл тионилхлорида медленно добавляют в 50 мл абсолютного метанола (перед использованием раствор можно хранить в течение ночи). Контрольные срезы-без обработки тионилхлоридом. 3. Промывают в 70 % спирте и дистиллированной воде. 4. Проводят соответствующее окрашивание.
Результат: 6-часовая обработка полностью устраняет базофилию ткани. Базофилия цитоплазмы, обусловленная СООН-группами и РНК, снимается через 30 мин, а базофилия, обусловленная присутствием сульфатированных ГАГ, — через 4 ч. Для дифференциации кислых ГАГ и нейтральных гликопротеинов обычно используют переваривание гиалуронидазой инейраминидазой. Гиалуронидаза В, выделенная из культур пневмококков, стрептококков, стафилококков и Clostridium welchii, расщепляет гиалуроновую кислоту, а гиалуронидаза А, полученная из семенников быка, гидролизует, помимо гиалуроновой кислоты, еще и хондроитинсульфаты А и С. Удаление кислых гликозаминогликанов путем ферментативного гидролиза с гиалуронидазой
1. Материал фиксируют в одной из смесей, рекомендованных для фиксации полисахаридов, заливают в парафин. 2. Депарафинированные срезы доводят до дистиллированной воды через ряд спиртов убывающей концентрации. 3. Обрабатывают срезы в течение 4 —6 ч при 37 °С следующим раствором: 0,3 — 0,6 мг/мл гиалуронидазы из семенников в 0,1 н. Контрольные срезы инкубируют в буфере в таких же условиях. 4. Окрашивают контрольные срезы и срезы, обработанные в растворе гиалуронидазы, 0,1 % раствором толуидинового синего в течение 1-2 ч. 5. Тщательно промывают в дистиллированной воде. 6. Заключают в глицерин-желатин или после обезвоживания и просветления в ксилоле в бальзам.
Результат: метахроматическое окрашивание в контрольных срезах и отсутствие его в срезах, обработанных гиалуронидазой, свидетельствуют о наличии гиалуроновой кислоты или хондроитинсульфатов А и С. Нейраминидаза (сиалидаза, выделенная из культуральных сред Clostridium perfringens и Vibrio cholerae, а также из противогриппозной вакцины) селективно удаляет из гистологических срезов сиаловую кислоту, уменьшая окраску ШИК-позитивных гликопротеинов, а также ослабляя метахромазию. Следует учитывать, что буферный раствор, не содержащий нейраминидазы, может переводить в раствор значительную часть связанной нейраминовой кислоты в составе сиаломукоидов. Ферментативное переваривание гликогена на гистологических срезах проводят с помощью диастазы, амилазы или слюны. Обычно используют диастазу солода по Лилли, которая катализирует гидролиз гликогена, главным образом до дисахарида мальтозы.
Ферментативный гидролиз диастазой для удаления гликогена по Лилли
1. Депарафинированные срезы доводят до дистиллированной воды. 2. Обрабатывают в 0,1-1 % растворе диастазы солода на изотоническом растворе хлорида натрия при комнатной температуре в течение 2 ч или при 37 «С 30-40 мин. 3. Промывают в дистиллированной воде и проводят окрашивание на гликоген (ШИК-реакция или окрашивание кармином по Бесту).
Результат: вещества, которые в прямом опыте окрашиваются при ШИК-реакции или кармином по Бесту, но исчезают из среза после обработки диастазой, следует считать гликогеном.
Примечание. Различия между молекулами гликогена с разветвленными и неразветвленными цепями могут быть выявлены в срезах путем их обработки 0,5 % (b-амилазой в 0,004 М ацетатном буфере (рН 5,0) вместо a-амилазы. | ||||||||||||||||||||||||||||||||||||||||||||||
Локализация углеводсодержащих молекул | SpringerLink
Ainsworth, S.K., Karnovsky, M.J., 1972, Метод ультраструктурного окрашивания для увеличения размера и электронной непрозрачности ферритина в тонких срезах, J. Histochem. Цитохим. 20 : 225–229.
ПабМед перекрестная ссылка КАС Google ученый
Avrameas, S., 1969, Связывание ферментов с белками с глутаровым альдегидом: Использование конъюгатов для обнаружения антигенов и антител, Иммунохимия 6 : 43–52.
ПабМед перекрестная ссылка КАС Google ученый
Avrameas, S., 1970, Emploi de la concanavaline-A pour l’isolement, laDetectionetleResumodesGlucidesextra ou endocellulaire, C.
 R. Acad. науч. 270 : 2205–2208.
R. Acad. науч. 270 : 2205–2208.КАС Google ученый
Bauer, H., Horisberger, M., Bush, D.D., and Sigarlakie, E., 1972, Маннан как основной компонент почечных рубцов Saccharomyces cerevisiae, Arch. микробиол. 85 : 202–208.
КАС Google ученый
Байер Э.А., Вильчек М., Скутельский Э., 1976, Аффинная цитохимия: локализация рецепторов лектина и антител на эритроцитах через авидин-биотиновый комплекс, ФЭБС Письмо . 68 : 240–244.
ПабМед перекрестная ссылка КАС Google ученый
Bayer, ME, Thurow, H., 1977, Полисахаридная капсула Escherichia coli: микроскопическое исследование ее размера, структуры и мест синтеза, J. Bacteriol. 130 : 911–936.
ПабМед КАС Google ученый
Behnke, O.
 , Zelander, T., 1970, Сохранение межклеточных веществ катионным красителем Alcian blue в подготовительных процедурах для электронной микроскопии, J. Ultrastruct. Рез. 31 : 424–438.
, Zelander, T., 1970, Сохранение межклеточных веществ катионным красителем Alcian blue в подготовительных процедурах для электронной микроскопии, J. Ultrastruct. Рез. 31 : 424–438.ПабМед перекрестная ссылка КАС Google ученый
Bendayan, M., 1981, Ультраструктурная локализация нуклеиновых кислот с помощью комплексов фермент-золото, J. Histochem. Цитохим. 29 : 531–541.
ПабМед перекрестная ссылка КАС Google ученый
Bendayan, M., 1984, Электронно-микроскопическая цитохимия с использованием золота: новый аффинный подход к ультраструктурной локализации макромолекул, J. Electron Microsc. Тех. 1 : 349–372.
Перекрёстная ссылка КАС Google ученый
Bennett, H.S., 1963, Морфологические аспекты внеклеточных полисахаридов, J.
 Histochem. Цитохим. 11 : 14–23.
Histochem. Цитохим. 11 : 14–23.Перекрёстная ссылка Google ученый
Bernhard, W., Avrameas, S., 1971, Ультраструктурная визуализация клеточных углеводных компонентов с помощью конканавалина A, Exp. Сотовое разрешение . 64 : 232–236.
Перекрёстная ссылка КАС Google ученый
Birdsell, D.C., Doyle, RJ, Morgenstern, M., 1975, Организация тейхоевой кислоты в клеточной стенке Bacillus subtilis, J. Bacteriol. 121 : 726–734.
ПабМед КАС Google ученый
Briggman, JV, Widnell, B.C., 1983, Сравнение прямых и непрямых методов с использованием лигандов, конъюгированных с ферритином, для локализации сайтов связывания конканавалина А на изолированных плазматических мембранах гепатоцитов, J. Histochem. Цитохим.
 31 : 579–590.
31 : 579–590.ПабМед перекрестная ссылка КАС Google ученый
Chamberland, H., Charest, P.M., Ouellette, G.B., Pauze, FJ, 1985, Хитиназный комплекс золота для ультраструктурной локализации хитина в клетках корней томатов, инфицированных Fusarium oxysporum f. сп. radicis-lycopersici по сравнению с хитин-специфическим лектином, конъюгированным с золотом, Histochem. Дж. 17: 313-322.
Google ученый
Courtoy, R., Simar, L.J., 1974, Важность контроля для демонстрации углеводов в электронной микроскопии с использованием метенамина серебра или методов тиокарбогидразид-протеината серебра, J. Microsc. (Оксфорд) 100 : 199–211.
Перекрёстная ссылка КАС Google ученый
Кортуа Р., Бонивер Дж., Симар Л. Дж., 19 лет74, Метод хлорида цетилпиридиния (CPC) и тиоцианата железа (FeTh) для демонстрации полианионов на тонких срезах для электронной микроскопии, Гистохимия 42 : 133–139.

ПабМед перекрестная ссылка КАС Google ученый
Craig, A.S., 1974, Боргидрид натрия как реагент, блокирующий альдегиды, для гистохимии с помощью электронного микроскопа, Гистохимия 42 : 141–144.
ПабМед перекрестная ссылка КАС Google ученый
Данон Д., Гольдштейн Л., Мариковский Ю., Скутельский Е., 1972, Использование катионизированного ферритина в качестве метки отрицательных зарядов на клеточных поверхностях, J. Ultrastruct. Рез. 38 : 500–510.
ПабМед перекрестная ссылка КАС Google ученый
Дайкстра М.Дж., Олдрич Х.К., 1978, Успешная демонстрация неуловимой клеточной оболочки у амеб, J. Protozool. 25 : 38–41.
ПабМед КАС Google ученый
François, D.
 , Mongiat, F., 1977, Ультраструктурное исследование сайтов связывания агглютинина зародышей пшеницы с использованием глюкозооксидазы в качестве маркера, J. Ultrastruct. Рез. 59 : 119–125.
, Mongiat, F., 1977, Ультраструктурное исследование сайтов связывания агглютинина зародышей пшеницы с использованием глюкозооксидазы в качестве маркера, J. Ultrastruct. Рез. 59 : 119–125.ПабМед перекрестная ссылка Google ученый
Гарланд, Дж. М., 1973, Получение и применение конканавалина А, меченого золотом, для обнаружения специфически реактивных участков в стенках S. faecalis 8191, в: Электронная микроскопия и цитохимия (Е. Виссе, В. Т. Даемс, И. Molenaar и P. van Duijn, eds.), стр. 303–307, Северная Голландия, Амстердам.
Google ученый
Геогеган, В. Д., Акерман, Г. А., 1977, Адсорбция пероксидазы хрена, овомукоида и антииммуноглобулина коллоидным золотом для непрямого обнаружения конканавалина А, агглютинина зародышей пшеницы и козьего античеловеческого иммуноглобулина G на поверхности клеток в уровень электронного микроскопа: новый метод, теория и применение, J.
 Histochem. Цитохим. 25 : 1187–1200.
Histochem. Цитохим. 25 : 1187–1200.ПабМед перекрестная ссылка КАС Google ученый
Geyer, G., 1971, Новые гистохимические методы для демонстрации карбоксильных групп в слизистых веществах, Histochem. Дж. 3 : 241–250.
ПабМед перекрестная ссылка КАС Google ученый
Гейер, Г., Хелмке, У., и Кристнер, А., 1971, Ультрагистохимическая демонстрация окрашенных альциановым синим слизистых веществ с помощью реакции сульфид-серебро, Acta Histochem . 46 : 244–249.
Google ученый
Ghinea, N., Simionescu, N., 1985, Анионизированные и катионизированные гемеундекапептиды в качестве зондов для изучения заряда клеточной поверхности и проницаемости: дифференцированное мечение эндотелиальных плазмалеммальных пузырьков, J.
 Cell Biol. 100 : 606–612.
Cell Biol. 100 : 606–612.ПабМед перекрестная ссылка КАС Google ученый
Гомори, Г., 1946, Новый гистохимический тест на гликоген и муцин, Am. Дж. Клин. Патол. Тех. Разд. 10 : 177–179.
КАС Google ученый
Гомори, Г., 1952, Микроскопическая гистохимия: принципы и практика, с. 57, University of Chicago Press, Чикаго.
Google ученый
Grote, M., Fromme, H.G., 1984, Электронно-микроскопическая локализация рецепторов конканавалина А в материале поверхности пыльцы после фиксации хлоридом глутарового альдегида-цетилпиридиния, J. Histochem. Цитохим. 32 : 869–871.
ПабМед перекрестная ссылка КАС Google ученый
Густафсон Г.
 Т., Пихл Э., 19 лет67, Окрашивание кислых гликозаминогликанов тучных клеток на ультратонких срезах рутениевым красным, Nature (Лондон) 216 : 697–698.
Т., Пихл Э., 19 лет67, Окрашивание кислых гликозаминогликанов тучных клеток на ультратонких срезах рутениевым красным, Nature (Лондон) 216 : 697–698.Перекрёстная ссылка КАС Google ученый
Ханкер, Дж. С., Симэн, А. Р., Вайс, Л. П., Уэно, Х., Бергманн, Р. А., Селигман, А. М., 1964, Осмиофильные реагенты: новые цитохимические принципы для световой и электронной микроскопии, Science 146 : 1039–1043.
ПабМед перекрестная ссылка КАС Google ученый
Хардин, Дж. Х., Спайсер, С. С., 1971, Ультраструктурная локализация диализируемого железореактивного слизистого вещества в гетерофилах, базофилах и эозинофилах кролика, J. Cell Biol. 48 : 368–386.
ПабМед перекрестная ссылка КАС Google ученый
Харрис Дж.
 Л., Санисло П. Дж., 19 лет83, Электронно-микроскопическая демонстрация хитина в клеточных стенках Wangiella dermatiditis с помощью хитиназы-коллоидного золота, Abstr. Анну. Встретиться. Являюсь. Соц . Микробиол . 1983 : 144.
Л., Санисло П. Дж., 19 лет83, Электронно-микроскопическая демонстрация хитина в клеточных стенках Wangiella dermatiditis с помощью хитиназы-коллоидного золота, Abstr. Анну. Встретиться. Являюсь. Соц . Микробиол . 1983 : 144.Google ученый
Hayat, MA (ed.), 1981, Принципы и методы электронной микроскопии: биологические приложения, Vol. 1, 2-е изд., University Park Press, Балтимор.
Google ученый
Hernandez, W., Rambourg, A., Leblond, C.P., 1968, Метод периодической кислоты, хромовой кислоты и метенамина серебра для обнаружения гликопротеинов в электронном микроскопе, J. Histochem. Цитохим. 16 : 507.
Google ученый
Horisberger, M., 1979, Оценка коллоидного золота как цитохимического маркера для просвечивающей и сканирующей электронной микроскопии, Biol.
 Клетка. 36 : 253–258.
Клетка. 36 : 253–258.КАС Google ученый
Horisberger, M., 1984a, Электронно-непрозрачные маркеры: обзор, в: Иммунологическая маркировка для электронной микроскопии (JM Polak and 1. M. Varndell, eds.), pp. 17–26, Elsevier, Amsterdam.
Google ученый
Horisberger, M., 1984b, Цитохимия лектина, в: Иммунологическая маркировка для электронной микроскопии (J.M. Polak and IM Varndell, eds.), стр. 249–258, Эльзевир, Амстердам.
Google ученый
Horisberger, M., Rosset, J., 1977, Коллоидное золото, полезный маркер для просвечивающей и сканирующей электронной микроскопии, J. Histochem. Цитохим. 25 : 295–305.
ПабМед перекрестная ссылка КАС Google ученый
Horisberger, M.
 , Tacchini-Vonlanthen, M., 1983, Стабильность и стерические затруднения меченых лектином золотых маркеров в просвечивающей и сканирующей электронной микроскопии, в: Lectins, Vol. 3 (Т. К. Бог-Хансен и Г. А. Шпенглер), стр. 189.–197, де Грюйтер, Берлин.
, Tacchini-Vonlanthen, M., 1983, Стабильность и стерические затруднения меченых лектином золотых маркеров в просвечивающей и сканирующей электронной микроскопии, в: Lectins, Vol. 3 (Т. К. Бог-Хансен и Г. А. Шпенглер), стр. 189.–197, де Грюйтер, Берлин.Google ученый
Horisberger, M., Vonlanthen, M., 1979, Множественная маркировка рецепторов клеточной поверхности гранулами золота: одновременная локализация трех лектиновых рецепторов на эритроцитах человека, J. Microsc. (Оксфорд) 115 : 97–102.
Перекрёстная ссылка КАС Google ученый
Хорисбергер М., Бауэр Х., Буш Д. А., 19 лет71, Конканавалин А, помеченный ртутью, как маркер в электронной микроскопии — Локализация маннана в стенках дрожжевых клеток, FEBS Lett . 18 : 311–314.
ПабМед перекрестная ссылка КАС Google ученый
Horisberger, M.
 , Vonlanthen, M., and Rosset, J., 1978, Локализация галактоманнановых и агглютининовых рецепторов зародышей пшеницы в Schizosaccharomyces pombe, Arch. микробиол. 119: 107–111.
, Vonlanthen, M., and Rosset, J., 1978, Локализация галактоманнановых и агглютининовых рецепторов зародышей пшеницы в Schizosaccharomyces pombe, Arch. микробиол. 119: 107–111.ПабМед перекрестная ссылка КАС Google ученый
Джонс, Р., Рейд, Л., 1973, Влияние рН на окрашивание альциановым синим эпителиальных кислых гликопротеинов. I. Сиаломуцины и сульфомуцины (по отдельности или в простых комбинациях), Histochem. Дж. 5 : 9–18.
ПабМед перекрестная ссылка КАС Google ученый
Kataoka, M., Tavassoli, M., 1984, Синтетические неогликопротеины: класс реагентов для обнаружения веществ, распознающих сахар, J. Histochem. Цитохим. 32 : 1091–1098.
ПабМед перекрестная ссылка КАС Google ученый
Киеда С.
 , Дельмотт Ф. и Монсиньи М., 1977, Получение и свойства гликозилированных цитохимических маркеров, FEBS Lett . 76 : 257–261.
, Дельмотт Ф. и Монсиньи М., 1977, Получение и свойства гликозилированных цитохимических маркеров, FEBS Lett . 76 : 257–261.ПабМед перекрестная ссылка КАС Google ученый
Льюис, П. Р., Найт, Д. П., 1977, Методы окрашивания срезов, в: Практические методы электронной микроскопии (А. М. Глоерт, изд.), стр. 77–136, Эльзевир/Северная Голландия, Амстердам.
Google ученый
Линссен, В. Х., Хьюис ин’т Вельд, Дж. Х. Дж., Поорт, К., Слот, Дж. В., Гёз, Дж. Дж., 1973 г., Исследование двух типов стрептококковых углеводных антигенов с помощью иммуноэлектронного микроскопа: сравнение двух различных методов инкубации, в: Электронная микроскопия и цитохимия (E. Wisse, WT Daems, I. Molenaar и P. van Duijn, ред.), стр. 19.3–196, Северная Голландия, Амстердам.
Google ученый
Luft, J.H., 1964, Электронная микроскопия посторонних клеточных оболочек, выявленная окрашиванием рутениевым красным, J.
 Cell Biol. 23 : 54а.
Cell Biol. 23 : 54а.Google ученый
Люфт, Дж. Х., 1971а, Рутений красный и фиолетовый. I. Химия, очистка, методы использования для электронной микроскопии и механизм действия, Анат. Рек. 171 : 347–368.
ПабМед перекрестная ссылка КАС Google ученый
Люфт, Дж. Х., 1971b, Рутений красный и фиолетовый. II. Тонкая структурная локализация в тканях животных // Анат. Рек. 171: 369-416.
Google ученый
Мартин, Б. Дж., Спайсер, С. С., 1974, Конканавалин А-железо-декстрановый метод для окрашивания слизистых веществ клеточной поверхности, J. Histochem. Цитохим. 22 : 206–209.
ПабМед перекрестная ссылка КАС Google ученый
Molday, R.
 , Moher, P., 1980. Обзор маркеров клеточной поверхности и методов мечения для сканирующей электронной микроскопии, Histochem. Дж. 12 : 273–315.
, Moher, P., 1980. Обзор маркеров клеточной поверхности и методов мечения для сканирующей электронной микроскопии, Histochem. Дж. 12 : 273–315.ПабМед перекрестная ссылка КАС Google ученый
Monneron, A., Bernhard, W., 1966, Действие определенных ферментов на ткани, включая Epon, J. Microsc. (Париж) 5 : 697–714.
КАС Google ученый
Нахмиас, В. Т., Маршалл, Дж. М., младший, 1961, Поглощение белка пиноцитозом у амеб: Исследования ферритина и метилированного ферритина, в: Биологическая структура и функция, Том. 2 (Т. Гудвин и О. Линдберг, ред.), стр. 605–619., Академик Пресс, Нью-Йорк.
Google ученый
Nicolson, G.L., Singer, S.J., 1971, Ферритин-конъюгированные растительные агглютинины как специфические сахаридные красители для электронной микроскопии, Proc.
 Натл. акад. науч. США 68 : 942–945.
Натл. акад. науч. США 68 : 942–945.ПабМед перекрестная ссылка КАС Google ученый
Пейт, Дж. Л., Ордал, Э. Дж., 1967, Тонкая структура Chondrococcus columnaris. III. Поверхностные слои Chondrococcus columnaris, J. Cell Biol. 35 : 37–50.
ПабМед перекрестная ссылка КАС Google ученый
Пирс, А.Г.Е., 1968, Гистохимия, теоретическая и прикладная, Vol. 1, 3-е изд., Черчилль, Лондон.
Google ученый
Pease, D.C., 1970, Фосфорно-вольфрамовая кислота как специфический электронный краситель для сложных углеводов, J. Histochem. Цитохим. 18 : 455–458.
ПабМед перекрестная ссылка КАС Google ученый
Pickett-Heaps, J.D.
 , 1967, Предварительные попытки локализации ультраструктурных полисахаридов в клетках кончика корня, J. Histochem. Цитохим. 15 : 442–455.
, 1967, Предварительные попытки локализации ультраструктурных полисахаридов в клетках кончика корня, J. Histochem. Цитохим. 15 : 442–455.ПабМед перекрестная ссылка КАС Google ученый
Пистолет, Т.Г., 1981, Взаимодействие бактерий и грибов с лектинами и лектиноподобными веществами, Annu. Преподобный Микробиолог. 35 : 85–112.
ПабМед перекрестная ссылка КАС Google ученый
Progulske, A., Holt, S.C., 1980, Электронно-микроскопические наблюдения выбранных штаммов Eikenella corodens, J. Bacteriol. 143 : 1003–1018.
ПабМед КАС Google ученый
Rambourg, A., 1971, Морфологические и гистохимические аспекты гликопротеинов на поверхности клеток животных, Int. Преподобный Цитол.
 31: 57–114.
31: 57–114.ПабМед перекрестная ссылка КАС Google ученый
Rambourg, A., Leblond, C.P., 1967, Электронно-микроскопические наблюдения богатой углеводами клеточной оболочки, присутствующей на поверхности клеток у крыс, J. Cell Biol. 32 : 27–53.
ПабМед перекрестная ссылка КАС Google ученый
Rambourg, A., Hernandez, W., Leblond, C.P., 1969, Обнаружение сложных углеводов в аппарате Гольджи клеток крыс, J. Cell Biol. 40 : 395–414.
ПабМед перекрестная ссылка КАС Google ученый
Ренау-Пикерас, Дж., Кнехт, Э., Эрнандес-Яго, Дж., 19 лет81, Влияние различных фиксирующих растворов на мечение участков рецептора конканавалина-А в Т-лимфоцитах человека, Гистохимия 71 : 559–565.

ПабМед перекрестная ссылка КАС Google ученый
Ревель, Ж.-П., 1964, Краситель для ультраструктурной локализации кислых мукополисахаридов, J. Microsc. (Париж) 3 : 535–544.
КАС Google ученый
Rinehart, J.F., Abul-Haj, S.K., 1951, Усовершенствованный метод гистохимического выявления кислых мукополисахаридов в тканях, Arch. Патол. 52 : 189–194.
КАС Google ученый
Roberts, R.L., Bowers, B., Slater, M.L., Cabib, E., 1983, Синтез и локализация хитина в мутантах цикла клеточного деления Saccaromyces cerevisiae, Mol. Клетка. биол. 3 : 922–930.
ПабМед КАС Google ученый
Рот, Дж., 1978, Лектины: молекулярные зонды в клеточной биологии и исследованиях мембран, Exp.
 Патол. Доп. 3 : 5–186.
Патол. Доп. 3 : 5–186.Google ученый
Roth, J., 1983, Применение комплексов лектин-золото для электронно-микроскопической локализации гликоконъюгатов на тонких срезах, J. Histochem. Цитохим. 31 : 987–999.
ПабМед перекрестная ссылка КАС Google ученый
Roth, J., Binder, M., 1978, Коллоидное золото, ферритин и пероксидаза в качестве маркеров для электронно-микроскопических методов двойной маркировки лектинов, J. Histochem. Цитохим. 26 : 163–169.
ПабМед перекрестная ссылка КАС Google ученый
Roth, J., Franz, H., 1975, Ультраструктурное обнаружение лектиновых рецепторов с помощью цитохимической аффинной реакции с использованием комплекса маннан-железо, Гистохимия 41 : 365–368.

ПабМед перекрестная ссылка КАС Google ученый
Саннес, П.Л., Кацуяма, Т., Спайсер, С.С., 1978, Последовательности солей дубильной кислоты и металлов для световой и электронной микроскопии локализации сложных углеводов, J. Histochem. Цитохим. 26 : 55–61.
ПабМед перекрестная ссылка КАС Google ученый
Шревел Дж., Киеда К., Кенье Э., Грос Д., Дельмотт Ф. и Монсиньи М., 1979, Визуализация углеводов клеточной поверхности с помощью общего двухэтапного лектинового метода. : лектины и гликозилированные цитохимические маркеры, Biol. Клетка. 36 : 259–266.
КАС Google ученый
Скотт, Дж. Э., 1972, Гистохимия альцианового синего. III. Молекулярно-биологические основы окрашивания альциановым синим 8GX и аналогичными фталоцианинами, Histochemie 32 : 191–212.

ПабМед перекрестная ссылка КАС Google ученый
Скотт, Дж. Э., 1980, Молекулярная биология гистохимического окрашивания катионными фталоцианиновыми красителями: Дизайн замен альцианового синего, J. Microsc. (Оксфорд) 119 : 373–381.
Перекрёстная ссылка КАС Google ученый
Селигман, А. М., Ханкер, Дж. С., Вассеркруг, Х., ДиМоховски, Х., Кацофф, Л., 1965, Гистохимическая демонстрация некоторых окисленных макромолекул с тиокарбогидразидом (TCH) или тиосемикарбазидом (TSC) и четырехокисью осмия, Дж. Гистохим. Цитохим. 13 : 629–639.
ПабМед перекрестная ссылка КАС Google ученый
Seno, S., Tsujii, T., Ono, T., Ukita, S., 1983, Катионный какодилатный коллоид железа для обнаружения анионных участков на поверхности клеток и гистохимического окрашивания кислых мукополисахаридов, Гистохимия 78 : 27–31.

ПабМед перекрестная ссылка КАС Google ученый
Shea, S.M., 1971, Окрашивание лантаном поверхностного слоя клеток. Его усиление за счет использования фиксаторов, содержащих альциановый синий или хлорид цетилпиридиния, J. Cell Biol. 51 : 611–620.
ПабМед перекрестная ссылка КАС Google ученый
Simson, J.A.V., 1977, Влияние фиксации на углеводную цитохимию секреторных гранул слюнных желез крыс, Histochem . Дж . 9 : 645–657.
Перекрёстная ссылка КАС Google ученый
Smith, S.B., Revel, J.-P., 1972, Картирование сайтов связывания конканавалина А на поверхности нескольких типов клеток, Dev. биол. 27 : 434–441.
ПабМед перекрестная ссылка КАС Google ученый
Спайсер С.
 , Шульте Б., 1982, Ультраструктурные методы локализации сложных углеводов, Hum. Патол. 13 : 343–354.
, Шульте Б., 1982, Ультраструктурные методы локализации сложных углеводов, Hum. Патол. 13 : 343–354.ПабМед перекрестная ссылка КАС Google ученый
Спайсер, С.С., Хардин, Дж.Х., Сетсер, М.Е., 1978, Ультраструктурная визуализация сульфатированных сложных углеводов в крови и эпителиальных клетках с помощью процедуры диамина с высоким содержанием железа, Histochem. Дж. 10 : 435–452.
ПабМед перекрестная ссылка КАС Google ученый
Spurr, A.R., 1969, Среда для заливки смолы с низкой вязкостью для электронной микроскопии, J. Ultrastruct. Рез. 26 : 31–43.
ПабМед перекрестная ссылка КАС Google ученый
Thiéry, J.P., 1967, Mise en proof of polysaccharides sur coup fine en microscopie electronic, J.
 Microsc. (Париж) 6 : 987–1018.
Microsc. (Париж) 6 : 987–1018.Google ученый
Thiéry, J.P., Ovtracht, L., 1979, Дифференциальная характеристика карбоксильных и сульфатных групп в тонких срезах для электронной микроскопии, Biol. Клетка. 36 : 281–288.
Google ученый
Томопулос Г. Н., Шульте Б. А., Спайсер С. С., 1983а, Влияние среды для заливки и фиксации на ультраструктурную демонстрацию сложных углеводов после заливки. II. Окрашивание диализированным железом, Гистохимия 79 : 417–431.
ПабМед перекрестная ссылка КАС Google ученый
Томопулос, Г. Н., Шульте, Б. А., Спайсер, С. С., 1983b, Влияние среды для заливки и фиксации на ультраструктурную демонстрацию сложных углеводов после заливки. I. Морфология и окрашивание вицинальных диолов периодической кислотой-тиокарбогидразидом-протеинатом серебра, Гистохим.
 Дж. , 15 : 763–784.
Дж. , 15 : 763–784.ПабМед перекрестная ссылка КАС Google ученый
Vian, B., Brillouet, J.-M., and Satiat-Jeunemaitre, B., 1983, Ультраструктурная визуализация ксиланов в клеточных стенках твердой древесины с помощью комплекса ксиланаза-золото, Biol. Клетка. 49 : 179–182.
Google ученый
Vidic, B., 1973, Структура и цитохимия ацинарных клеток в верхнечелюстной железе крысы, Am. Дж. Анат. 137 : 103–117.
ПабМед перекрестная ссылка КАС Google ученый
West, B.M., Erdos, G.W., 1986, Гликоконъюгаты из нескольких серологически определенных семейств секретируются и накапливаются в матрице Dictyostelium discoideum, Дифференцировка (представлена).
Google ученый
Wetzel, M.
 G., Wetzel, B.K., Spicer, S.S., 1966, Ультраструктурная локализация кислых слизистых веществ в толстой кишке мыши с железосодержащими красителями, J. Cell Biol. 30 : 299–315.
G., Wetzel, B.K., Spicer, S.S., 1966, Ультраструктурная локализация кислых слизистых веществ в толстой кишке мыши с железосодержащими красителями, J. Cell Biol. 30 : 299–315.ПабМед перекрестная ссылка КАС Google ученый
Whitfield, C., Vimr, E.R., Costerton, J.W., Troy, F.A., 1984, Синтез белка необходим для активации in vivo синтеза капсулы полисиаловой кислоты в Escherichia coli Kl, J. Бактериол. 159 : 321–328.
ПабМед КАС Google ученый
Ву, Д. Д. Л., Холт, С. К., и Лидбеттер, Э. Р., 1979, Ультраструктура видов Bacteroides: Bacteroides asaccharlyticus, Bacteroides fragilis, Bacteroides melaninogenicus subspecies melaninogenicus и B. melaninogenicus subspecies intermedins, J Infect. Дис. 139 : 534–546.
ПабМед перекрестная ссылка КАС Google ученый
Скачать ссылки
Локализация углеводсодержащих молекул | SpringerLink
Ainsworth, S.
 K., Karnovsky, M.J., 1972, Метод ультраструктурного окрашивания для увеличения размера и электронной непрозрачности ферритина в тонких срезах, J. Histochem. Цитохим. 20 : 225–229.
K., Karnovsky, M.J., 1972, Метод ультраструктурного окрашивания для увеличения размера и электронной непрозрачности ферритина в тонких срезах, J. Histochem. Цитохим. 20 : 225–229.ПабМед перекрестная ссылка КАС Google ученый
Avrameas, S., 1969, Связывание ферментов с белками с глутаровым альдегидом: Использование конъюгатов для обнаружения антигенов и антител, Иммунохимия 6 : 43–52.
ПабМед перекрестная ссылка КАС Google ученый
Avrameas, S., 1970, Emploi de la concanavaline-A pour l’isolement, la discovery et le резюме гликопротеинов в глюкицидах extra ou endocellulaire, CR Acad. науч. 270 : 2205–2208.
КАС Google ученый
Bauer, H., Horisberger, M., Bush, D.D., and Sigarlakie, E.
 , 1972, Маннан как основной компонент почечных рубцов Saccharomyces cerevisiae, Arch. микробиол. 85 : 202–208.
, 1972, Маннан как основной компонент почечных рубцов Saccharomyces cerevisiae, Arch. микробиол. 85 : 202–208.КАС Google ученый
Байер Э.А., Вильчек М., Скутельский Э., 1976, Аффинная цитохимия: локализация рецепторов лектина и антител на эритроцитах через авидин-биотиновый комплекс, FEBS Lett . 68 : 240–244.
ПабМед перекрестная ссылка КАС Google ученый
Bayer, ME, Thurow, H., 1977, Полисахаридная капсула Escherichia coli: микроскопическое исследование ее размера, структуры и мест синтеза, J. Bacteriol. 130 : 911–936.
ПабМед КАС Google ученый
Behnke, O., Zelander, T., 1970, Сохранение межклеточных веществ катионным красителем Alcian blue в подготовительных процедурах для электронной микроскопии, J.
 Ultrastruct. Рез. 31 : 424–438.
Ultrastruct. Рез. 31 : 424–438.ПабМед перекрестная ссылка КАС Google ученый
Бендаяна М., 1981, Ультраструктурная локализация нуклеиновых кислот с использованием комплексов фермент-золото, J. Histochem. Цитохим. 29 : 531–541.
ПабМед перекрестная ссылка КАС Google ученый
Bendayan, M., 1984, Электронно-микроскопическая цитохимия с использованием золота: новый аффинный подход к ультраструктурной локализации макромолекул, J. Electron Microsc. Тех. 1 : 349–372.
Перекрёстная ссылка КАС Google ученый
Bennett, H.S., 1963, Морфологические аспекты внеклеточных полисахаридов, J. Histochem. Цитохим. 11 : 14–23.
Перекрёстная ссылка Google ученый
Bernhard, W.
 , Avrameas, S., 1971, Ультраструктурная визуализация клеточных углеводных компонентов с помощью конканавалина А, эксп. Сотовое разрешение . 64 : 232–236.
, Avrameas, S., 1971, Ультраструктурная визуализация клеточных углеводных компонентов с помощью конканавалина А, эксп. Сотовое разрешение . 64 : 232–236.Перекрёстная ссылка КАС Google ученый
Birdsell, D.C., Doyle, RJ, Morgenstern, M., 1975, Организация тейхоевой кислоты в клеточной стенке Bacillus subtilis, J. Bacteriol. 121 : 726–734.
ПабМед КАС Google ученый
Бриггман, Дж. В., Виднелл, Британская Колумбия, 1983, Сравнение прямых и непрямых методов с использованием лигандов, конъюгированных с ферритином, для локализации сайтов связывания конканавалина А на изолированных плазматических мембранах гепатоцитов, J. Histochem. Цитохим. 31 : 579–590.
ПабМед перекрестная ссылка КАС Google ученый
Chamberland, H.
 , Charest, P.M., Ouellette, G.B., Pauze, FJ, 1985, Хитиназный комплекс золота для ультраструктурной локализации хитина в клетках корней томатов, инфицированных Fusarium oxysporum f. сп. radicis-lycopersici по сравнению с хитин-специфическим лектином, конъюгированным с золотом, Histochem. Дж. 17: 313-322.
, Charest, P.M., Ouellette, G.B., Pauze, FJ, 1985, Хитиназный комплекс золота для ультраструктурной локализации хитина в клетках корней томатов, инфицированных Fusarium oxysporum f. сп. radicis-lycopersici по сравнению с хитин-специфическим лектином, конъюгированным с золотом, Histochem. Дж. 17: 313-322.Google ученый
Courtoy, R., Simar, L.J., 1974, Важность контроля для демонстрации углеводов в электронной микроскопии с использованием метенамина серебра или методов тиокарбогидразид-протеината серебра, J. Microsc. (Оксфорд) 100 : 199–211.
Перекрёстная ссылка КАС Google ученый
Кортуа Р., Бонивер Дж., Симар Л. Дж., 19 лет74, Метод хлорида цетилпиридиния (CPC) и тиоцианата железа (FeTh) для демонстрации полианионов на тонких срезах для электронной микроскопии, Гистохимия 42 : 133–139.
ПабМед перекрестная ссылка КАС Google ученый
Craig, A.
 S., 1974, Боргидрид натрия как реагент, блокирующий альдегиды, для гистохимии с помощью электронного микроскопа, Гистохимия 42 : 141–144.
S., 1974, Боргидрид натрия как реагент, блокирующий альдегиды, для гистохимии с помощью электронного микроскопа, Гистохимия 42 : 141–144.ПабМед перекрестная ссылка КАС Google ученый
Данон Д., Гольдштейн Л., Мариковский Ю., Скутельский Е., 1972, Использование катионизированного ферритина в качестве метки отрицательных зарядов на клеточных поверхностях, J. Ultrastruct. Рез. 38 : 500–510.
ПабМед перекрестная ссылка КАС Google ученый
Дайкстра М.Дж., Олдрич Х.К., 1978, Успешная демонстрация неуловимой клеточной оболочки у амеб, J. Protozool. 25 : 38–41.
ПабМед КАС Google ученый
François, D., Mongiat, F., 1977, Ультраструктурное исследование сайтов связывания агглютинина зародышей пшеницы с использованием глюкозооксидазы в качестве маркера, J.
 Ultrastruct. Рез. 59 : 119–125.
Ultrastruct. Рез. 59 : 119–125.ПабМед перекрестная ссылка Google ученый
Гарланд, Дж. М., 1973, Получение и применение конканавалина А, меченого золотом, для обнаружения специфически реактивных участков в стенках S. faecalis 8191, в: Электронная микроскопия и цитохимия (Е. Виссе, В. Т. Даемс, И. Molenaar и P. van Duijn, eds.), стр. 303–307, Северная Голландия, Амстердам.
Google ученый
Геогеган, В. Д., Акерман, Г. А., 1977, Адсорбция пероксидазы хрена, овомукоида и антииммуноглобулина коллоидным золотом для непрямого обнаружения конканавалина А, агглютинина зародышей пшеницы и козьего античеловеческого иммуноглобулина G на поверхности клеток в уровень электронного микроскопа: новый метод, теория и применение, J. Histochem. Цитохим. 25 : 1187–1200.
ПабМед перекрестная ссылка КАС Google ученый
Geyer, G.
 , 1971, Новые гистохимические методы для демонстрации карбоксильных групп в слизистых веществах, Histochem. Дж. 3 : 241–250.
, 1971, Новые гистохимические методы для демонстрации карбоксильных групп в слизистых веществах, Histochem. Дж. 3 : 241–250.ПабМед перекрестная ссылка КАС Google ученый
Гейер, Г., Хелмке, У., и Кристнер, А., 1971, Ультрагистохимическая демонстрация окрашенных альциановым синим слизистых веществ с помощью реакции сульфид-серебро, Acta Histochem . 46 : 244–249.
Google ученый
Ghinea, N., Simionescu, N., 1985, Анионизированные и катионизированные гемеундекапептиды в качестве зондов для изучения заряда клеточной поверхности и проницаемости: дифференцированное мечение эндотелиальных плазмалеммальных пузырьков, J. Cell Biol. 100 : 606–612.
ПабМед перекрестная ссылка КАС Google ученый
Гомори, Г.
 , 1946, Новый гистохимический тест на гликоген и муцин, Am. Дж. Клин. Патол. Тех. Разд. 10 : 177–179.
, 1946, Новый гистохимический тест на гликоген и муцин, Am. Дж. Клин. Патол. Тех. Разд. 10 : 177–179.КАС Google ученый
Гомори, Г., 1952, Микроскопическая гистохимия: принципы и практика, с. 57, University of Chicago Press, Чикаго.
Google ученый
Grote, M., Fromme, H.G., 1984, Электронно-микроскопическая локализация рецепторов конканавалина А в материале поверхности пыльцы после фиксации хлоридом глутарового альдегида-цетилпиридиния, J. Histochem. Цитохим. 32 : 869–871.
ПабМед перекрестная ссылка КАС Google ученый
Густафсон Г.Т., Пихл Э., 19 лет67, Окрашивание кислых гликозаминогликанов тучных клеток на ультратонких срезах рутениевым красным, Nature (Лондон) 216 : 697–698.
Перекрёстная ссылка КАС Google ученый
Ханкер, Дж.
 С., Симэн, А. Р., Вайс, Л. П., Уэно, Х., Бергманн, Р. А., Селигман, А. М., 1964, Осмиофильные реагенты: новые цитохимические принципы для световой и электронной микроскопии, Science 146 : 1039–1043.
С., Симэн, А. Р., Вайс, Л. П., Уэно, Х., Бергманн, Р. А., Селигман, А. М., 1964, Осмиофильные реагенты: новые цитохимические принципы для световой и электронной микроскопии, Science 146 : 1039–1043.ПабМед перекрестная ссылка КАС Google ученый
Хардин, Дж. Х., Спайсер, С. С., 1971, Ультраструктурная локализация диализируемого железореактивного слизистого вещества в гетерофилах, базофилах и эозинофилах кролика, J. Cell Biol. 48 : 368–386.
ПабМед перекрестная ссылка КАС Google ученый
Харрис Дж. Л., Санисло П. Дж., 19 лет83, Электронно-микроскопическая демонстрация хитина в клеточных стенках Wangiella dermatiditis с помощью хитиназы-коллоидного золота, Abstr. Анну. Встретиться. Являюсь. Соц . Микробиол . 1983 : 144.
Google ученый
Hayat, MA (ed.
 ), 1981, Принципы и методы электронной микроскопии: биологические приложения, Vol. 1, 2-е изд., University Park Press, Балтимор.
), 1981, Принципы и методы электронной микроскопии: биологические приложения, Vol. 1, 2-е изд., University Park Press, Балтимор.Google ученый
Hernandez, W., Rambourg, A., Leblond, C.P., 1968, Метод периодической кислоты, хромовой кислоты и метенамина серебра для обнаружения гликопротеинов в электронном микроскопе, J. Histochem. Цитохим. 16 : 507.
Google ученый
Horisberger, M., 1979, Оценка коллоидного золота как цитохимического маркера для просвечивающей и сканирующей электронной микроскопии, Biol. Клетка. 36 : 253–258.
КАС Google ученый
Horisberger, M., 1984a, Электронно-непрозрачные маркеры: обзор, в: Иммунологическая маркировка для электронной микроскопии (JM Polak and 1. M. Varndell, eds.), pp. 17–26, Elsevier, Amsterdam.

Google ученый
Horisberger, M., 1984b, Цитохимия лектина, в: Иммунологическая маркировка для электронной микроскопии (J.M. Polak and IM Varndell, eds.), стр. 249–258, Эльзевир, Амстердам.
Google ученый
Horisberger, M., Rosset, J., 1977, Коллоидное золото, полезный маркер для просвечивающей и сканирующей электронной микроскопии, J. Histochem. Цитохим. 25 : 295–305.
ПабМед перекрестная ссылка КАС Google ученый
Horisberger, M., Tacchini-Vonlanthen, M., 1983, Стабильность и стерические затруднения меченых лектином золотых маркеров в просвечивающей и сканирующей электронной микроскопии, в: Lectins, Vol. 3 (Т. К. Бог-Хансен и Г. А. Шпенглер), стр. 189.–197, де Грюйтер, Берлин.
Google ученый
Horisberger, M.
 , Vonlanthen, M., 1979, Множественная маркировка рецепторов клеточной поверхности гранулами золота: одновременная локализация трех лектиновых рецепторов на эритроцитах человека, J. Microsc. (Оксфорд) 115 : 97–102.
, Vonlanthen, M., 1979, Множественная маркировка рецепторов клеточной поверхности гранулами золота: одновременная локализация трех лектиновых рецепторов на эритроцитах человека, J. Microsc. (Оксфорд) 115 : 97–102.Перекрёстная ссылка КАС Google ученый
Хорисбергер М., Бауэр Х., Буш Д. А., 19 лет71, Конканавалин А, помеченный ртутью, как маркер в электронной микроскопии — Локализация маннана в стенках дрожжевых клеток, FEBS Lett . 18 : 311–314.
ПабМед перекрестная ссылка КАС Google ученый
Horisberger, M., Vonlanthen, M., and Rosset, J., 1978, Локализация галактоманнановых и агглютининовых рецепторов зародышей пшеницы в Schizosaccharomyces pombe, Arch. микробиол. 119: 107–111.
ПабМед перекрестная ссылка КАС Google ученый
Джонс, Р.
 , Рейд, Л., 1973, Влияние рН на окрашивание альциановым синим эпителиальных кислых гликопротеинов. I. Сиаломуцины и сульфомуцины (по отдельности или в простых комбинациях), Histochem. Дж. 5 : 9–18.
, Рейд, Л., 1973, Влияние рН на окрашивание альциановым синим эпителиальных кислых гликопротеинов. I. Сиаломуцины и сульфомуцины (по отдельности или в простых комбинациях), Histochem. Дж. 5 : 9–18.ПабМед перекрестная ссылка КАС Google ученый
Kataoka, M., Tavassoli, M., 1984, Синтетические неогликопротеины: класс реагентов для обнаружения веществ, распознающих сахар, J. Histochem. Цитохим. 32 : 1091–1098.
ПабМед перекрестная ссылка КАС Google ученый
Киеда С., Дельмотт Ф. и Монсиньи М., 1977, Получение и свойства гликозилированных цитохимических маркеров, FEBS Lett . 76 : 257–261.
ПабМед перекрестная ссылка КАС Google ученый
Льюис, П. Р., Найт, Д. П., 1977, Методы окрашивания срезов, в: Практические методы электронной микроскопии (А.
 М. Глоерт, изд.), стр. 77–136, Эльзевир/Северная Голландия, Амстердам.
М. Глоерт, изд.), стр. 77–136, Эльзевир/Северная Голландия, Амстердам.Google ученый
Линссен, В. Х., Хьюис ин’т Вельд, Дж. Х. Дж., Поорт, К., Слот, Дж. В., Гёз, Дж. Дж., 1973 г., Исследование двух типов стрептококковых углеводных антигенов с помощью иммуноэлектронного микроскопа: сравнение двух различных методов инкубации, в: Электронная микроскопия и цитохимия (E. Wisse, WT Daems, I. Molenaar и P. van Duijn, ред.), стр. 19.3–196, Северная Голландия, Амстердам.
Google ученый
Luft, J.H., 1964, Электронная микроскопия посторонних клеточных оболочек, выявленная окрашиванием рутениевым красным, J. Cell Biol. 23 : 54а.
Google ученый
Люфт, Дж. Х., 1971а, Рутений красный и фиолетовый. I. Химия, очистка, методы использования для электронной микроскопии и механизм действия, Анат.
 Рек. 171 : 347–368.
Рек. 171 : 347–368.ПабМед перекрестная ссылка КАС Google ученый
Люфт, Дж. Х., 1971b, Рутений красный и фиолетовый. II. Тонкая структурная локализация в тканях животных // Анат. Рек. 171: 369-416.
Google ученый
Мартин, Б. Дж., Спайсер, С. С., 1974, Конканавалин А-железо-декстрановый метод для окрашивания слизистых веществ клеточной поверхности, J. Histochem. Цитохим. 22 : 206–209.
ПабМед перекрестная ссылка КАС Google ученый
Molday, R., Moher, P., 1980. Обзор маркеров клеточной поверхности и методов мечения для сканирующей электронной микроскопии, Histochem. Дж. 12 : 273–315.
ПабМед перекрестная ссылка КАС Google ученый
Monneron, A.
 , Bernhard, W., 1966, Действие определенных ферментов на ткани, включая Epon, J. Microsc. (Париж) 5 : 697–714.
, Bernhard, W., 1966, Действие определенных ферментов на ткани, включая Epon, J. Microsc. (Париж) 5 : 697–714.КАС Google ученый
Нахмиас, В. Т., Маршалл, Дж. М., младший, 1961, Поглощение белка пиноцитозом у амеб: Исследования ферритина и метилированного ферритина, в: Биологическая структура и функция, Том. 2 (Т. Гудвин и О. Линдберг, ред.), стр. 605–619., Академик Пресс, Нью-Йорк.
Google ученый
Nicolson, G.L., Singer, S.J., 1971, Ферритин-конъюгированные растительные агглютинины как специфические сахаридные красители для электронной микроскопии, Proc. Натл. акад. науч. США 68 : 942–945.
ПабМед перекрестная ссылка КАС Google ученый
Пейт, Дж. Л., Ордал, Э. Дж., 1967, Тонкая структура Chondrococcus columnaris. III.
 Поверхностные слои Chondrococcus columnaris, J. Cell Biol. 35 : 37–50.
Поверхностные слои Chondrococcus columnaris, J. Cell Biol. 35 : 37–50.ПабМед перекрестная ссылка КАС Google ученый
Пирс, А.Г.Е., 1968, Гистохимия, теоретическая и прикладная, Vol. 1, 3-е изд., Черчилль, Лондон.
Google ученый
Pease, D.C., 1970, Фосфорно-вольфрамовая кислота как специфический электронный краситель для сложных углеводов, J. Histochem. Цитохим. 18 : 455–458.
ПабМед перекрестная ссылка КАС Google ученый
Pickett-Heaps, J.D., 1967, Предварительные попытки локализации ультраструктурных полисахаридов в клетках кончика корня, J. Histochem. Цитохим. 15 : 442–455.
ПабМед перекрестная ссылка КАС Google ученый
Пистолет, Т.
 Г., 1981, Взаимодействие бактерий и грибов с лектинами и лектиноподобными веществами, Annu. Преподобный Микробиолог. 35 : 85–112.
Г., 1981, Взаимодействие бактерий и грибов с лектинами и лектиноподобными веществами, Annu. Преподобный Микробиолог. 35 : 85–112.ПабМед перекрестная ссылка КАС Google ученый
Progulske, A., Holt, S.C., 1980, Электронно-микроскопические наблюдения выбранных штаммов Eikenella corodens, J. Bacteriol. 143 : 1003–1018.
ПабМед КАС Google ученый
Rambourg, A., 1971, Морфологические и гистохимические аспекты гликопротеинов на поверхности клеток животных, Int. Преподобный Цитол. 31: 57–114.
ПабМед перекрестная ссылка КАС Google ученый
Rambourg, A., Leblond, C.P., 1967, Электронно-микроскопические наблюдения богатой углеводами клеточной оболочки, присутствующей на поверхности клеток у крыс, J.
 Cell Biol. 32 : 27–53.
Cell Biol. 32 : 27–53.ПабМед перекрестная ссылка КАС Google ученый
Rambourg, A., Hernandez, W., Leblond, C.P., 1969, Обнаружение сложных углеводов в аппарате Гольджи клеток крыс, J. Cell Biol. 40 : 395–414.
ПабМед перекрестная ссылка КАС Google ученый
Ренау-Пикерас, Дж., Кнехт, Э., Эрнандес-Яго, Дж., 19 лет81, Влияние различных фиксирующих растворов на мечение участков рецептора конканавалина-А в Т-лимфоцитах человека, Гистохимия 71 : 559–565.
ПабМед перекрестная ссылка КАС Google ученый
Ревель, Ж.-П., 1964, Краситель для ультраструктурной локализации кислых мукополисахаридов, J. Microsc. (Париж) 3 : 535–544.
КАС Google ученый
Rinehart, J.
 F., Abul-Haj, S.K., 1951, Усовершенствованный метод гистохимического выявления кислых мукополисахаридов в тканях, Arch. Патол. 52 : 189–194.
F., Abul-Haj, S.K., 1951, Усовершенствованный метод гистохимического выявления кислых мукополисахаридов в тканях, Arch. Патол. 52 : 189–194.КАС Google ученый
Roberts, R.L., Bowers, B., Slater, M.L., Cabib, E., 1983, Синтез и локализация хитина в мутантах цикла клеточного деления Saccaromyces cerevisiae, Mol. Клетка. биол. 3 : 922–930.
ПабМед КАС Google ученый
Рот, Дж., 1978, Лектины: молекулярные зонды в клеточной биологии и исследованиях мембран, Exp. Патол. Доп. 3 : 5–186.
Google ученый
Roth, J., 1983, Применение комплексов лектин-золото для электронно-микроскопической локализации гликоконъюгатов на тонких срезах, J. Histochem. Цитохим. 31 : 987–999.

ПабМед перекрестная ссылка КАС Google ученый
Roth, J., Binder, M., 1978, Коллоидное золото, ферритин и пероксидаза в качестве маркеров для электронно-микроскопических методов двойной маркировки лектинов, J. Histochem. Цитохим. 26 : 163–169.
ПабМед перекрестная ссылка КАС Google ученый
Roth, J., Franz, H., 1975, Ультраструктурное обнаружение лектиновых рецепторов с помощью цитохимической аффинной реакции с использованием комплекса маннан-железо, Гистохимия 41 : 365–368.
ПабМед перекрестная ссылка КАС Google ученый
Саннес, П.Л., Кацуяма, Т., Спайсер, С.С., 1978, Последовательности солей дубильной кислоты и металлов для световой и электронной микроскопии локализации сложных углеводов, J.
 Histochem. Цитохим. 26 : 55–61.
Histochem. Цитохим. 26 : 55–61.ПабМед перекрестная ссылка КАС Google ученый
Шревел Дж., Киеда К., Кенье Э., Грос Д., Дельмотт Ф. и Монсиньи М., 1979, Визуализация углеводов клеточной поверхности с помощью общего двухэтапного лектинового метода. : лектины и гликозилированные цитохимические маркеры, Biol. Клетка. 36 : 259–266.
КАС Google ученый
Скотт, Дж. Э., 1972, Гистохимия альцианового синего. III. Молекулярно-биологические основы окрашивания альциановым синим 8GX и аналогичными фталоцианинами, Histochemie 32 : 191–212.
ПабМед перекрестная ссылка КАС Google ученый
Скотт, Дж. Э., 1980, Молекулярная биология гистохимического окрашивания катионными фталоцианиновыми красителями: Дизайн замен альцианового синего, J.
 Microsc. (Оксфорд) 119 : 373–381.
Microsc. (Оксфорд) 119 : 373–381.Перекрёстная ссылка КАС Google ученый
Селигман, А. М., Ханкер, Дж. С., Вассеркруг, Х., ДиМоховски, Х., Кацофф, Л., 1965, Гистохимическая демонстрация некоторых окисленных макромолекул с тиокарбогидразидом (TCH) или тиосемикарбазидом (TSC) и четырехокисью осмия, Дж. Гистохим. Цитохим. 13 : 629–639.
ПабМед перекрестная ссылка КАС Google ученый
Seno, S., Tsujii, T., Ono, T., Ukita, S., 1983, Катионный какодилатный коллоид железа для обнаружения анионных участков на поверхности клеток и гистохимического окрашивания кислых мукополисахаридов, Гистохимия 78 : 27–31.
ПабМед перекрестная ссылка КАС Google ученый
Shea, S.M., 1971, Окрашивание лантаном поверхностного слоя клеток.
 Его усиление за счет использования фиксаторов, содержащих альциановый синий или хлорид цетилпиридиния, J. Cell Biol. 51 : 611–620.
Его усиление за счет использования фиксаторов, содержащих альциановый синий или хлорид цетилпиридиния, J. Cell Biol. 51 : 611–620.ПабМед перекрестная ссылка КАС Google ученый
Simson, J.A.V., 1977, Влияние фиксации на углеводную цитохимию секреторных гранул слюнных желез крыс, Histochem . Дж . 9 : 645–657.
Перекрёстная ссылка КАС Google ученый
Smith, S.B., Revel, J.-P., 1972, Картирование сайтов связывания конканавалина А на поверхности нескольких типов клеток, Dev. биол. 27 : 434–441.
ПабМед перекрестная ссылка КАС Google ученый
Спайсер С., Шульте Б., 1982, Ультраструктурные методы локализации сложных углеводов, Hum. Патол. 13 : 343–354.

ПабМед перекрестная ссылка КАС Google ученый
Спайсер, С.С., Хардин, Дж.Х., Сетсер, М.Е., 1978, Ультраструктурная визуализация сульфатированных сложных углеводов в крови и эпителиальных клетках с помощью процедуры диамина с высоким содержанием железа, Histochem. Дж. 10 : 435–452.
ПабМед перекрестная ссылка КАС Google ученый
Spurr, A.R., 1969, Среда для заливки смолы с низкой вязкостью для электронной микроскопии, J. Ultrastruct. Рез. 26 : 31–43.
ПабМед перекрестная ссылка КАС Google ученый
Thiéry, J.P., 1967, Mise en proof of polysaccharides sur coup fine en microscopie electronic, J. Microsc. (Париж) 6 : 987–1018.
Google ученый
Thiéry, J.
 P., Ovtracht, L., 1979, Дифференциальная характеристика карбоксильных и сульфатных групп в тонких срезах для электронной микроскопии, Biol. Клетка. 36 : 281–288.
P., Ovtracht, L., 1979, Дифференциальная характеристика карбоксильных и сульфатных групп в тонких срезах для электронной микроскопии, Biol. Клетка. 36 : 281–288.Google ученый
Томопулос Г. Н., Шульте Б. А., Спайсер С. С., 1983а, Влияние среды для заливки и фиксации на ультраструктурную демонстрацию сложных углеводов после заливки. II. Окрашивание диализированным железом, Гистохимия 79 : 417–431.
ПабМед перекрестная ссылка КАС Google ученый
Томопулос, Г. Н., Шульте, Б. А., Спайсер, С. С., 1983b, Влияние среды для заливки и фиксации на ультраструктурную демонстрацию сложных углеводов после заливки. I. Морфология и окрашивание вицинальных диолов периодической кислотой-тиокарбогидразидом-протеинатом серебра, Гистохим. Дж. , 15 : 763–784.
ПабМед перекрестная ссылка КАС Google ученый
Vian, B.
 , Brillouet, J.-M., and Satiat-Jeunemaitre, B., 1983, Ультраструктурная визуализация ксиланов в клеточных стенках твердой древесины с помощью комплекса ксиланаза-золото, Biol. Клетка. 49 : 179–182.
, Brillouet, J.-M., and Satiat-Jeunemaitre, B., 1983, Ультраструктурная визуализация ксиланов в клеточных стенках твердой древесины с помощью комплекса ксиланаза-золото, Biol. Клетка. 49 : 179–182.Google ученый
Vidic, B., 1973, Структура и цитохимия ацинарных клеток в верхнечелюстной железе крысы, Am. Дж. Анат. 137 : 103–117.
ПабМед перекрестная ссылка КАС Google ученый
West, B.M., Erdos, G.W., 1986, Гликоконъюгаты из нескольких серологически определенных семейств секретируются и накапливаются в матрице Dictyostelium discoideum, Дифференцировка (представлена).
Google ученый
Wetzel, M.G., Wetzel, B.K., Spicer, S.S., 1966, Ультраструктурная локализация кислых слизистых веществ в толстой кишке мыши с железосодержащими красителями, J.
 Cell Biol. 30 : 299–315.
Cell Biol. 30 : 299–315.ПабМед перекрестная ссылка КАС Google ученый
Whitfield, C., Vimr, E.R., Costerton, J.W., Troy, F.A., 1984, Синтез белка необходим для активации in vivo синтеза капсулы полисиаловой кислоты в Escherichia coli Kl, J. Бактериол. 159 : 321–328.
ПабМед КАС Google ученый
Ву, Д. Д. Л., Холт, С. К., и Лидбеттер, Э. Р., 1979, Ультраструктура видов Bacteroides: Bacteroides asaccharlyticus, Bacteroides fragilis, Bacteroides melaninogenicus subspecies melaninogenicus и B. melaninogenicus subspecies intermedins, J Infect. Дис. 139 : 534–546.
ПабМед перекрестная ссылка КАС Google ученый
Скачать ссылки
1.4: Гликолипиды — Физика LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1979
Гликолипиды представляют собой компоненты клеточных мембран, состоящие из гидрофобного липидного хвоста и одной или нескольких гидрофильных сахарных групп, связанных гликозидной связью. Как правило, гликолипиды находятся на внешнем листке клеточных мембран, где они играют не только структурную роль в поддержании стабильности мембраны, но и облегчают межклеточную связь, выступая в качестве рецепторов, якорей для белков и регуляторов передачи сигнала [1]. Гликолипиды широко распространены во всех клетках и преимущественно локализованы, но не исключительно, в плазматической мембране.
Как правило, гликолипиды находятся на внешнем листке клеточных мембран, где они играют не только структурную роль в поддержании стабильности мембраны, но и облегчают межклеточную связь, выступая в качестве рецепторов, якорей для белков и регуляторов передачи сигнала [1]. Гликолипиды широко распространены во всех клетках и преимущественно локализованы, но не исключительно, в плазматической мембране.
Структура и синтез
Основная структура гликолипида состоит из моно- или олигосахаридной группы, присоединенной к сфинголипиду или глицериновой группе (может быть ацетилирована или алкилирована) одной или двумя жирными кислотами. Они составляют классы гликосфинголипидов и гликоглицеролипидов соответственно. Гликолипиды взаимодействуют и связываются с липидным бислоем благодаря гидрофобной природе липидного хвоста, который прикрепляет его к поверхности плазматической мембраны.
Рисунок \(\PageIndex{1}\). Структура гликолипидов Синтез гликолипидов протекает с помощью ряда ферментов, которые последовательно добавляют сахара к липидам. Гликосфинголипиды получают из лактозилцерамида (LacCer; β-D-галактозил(1→4)-β-D-глюкозилцерамид), где первой стадией является ацилирование и десатурация D-эритро-сфинганина. Церамид глюкозилируется, а затем β-галактозилируется внеклеточно с образованием лактозилцерамида. Дальнейшее удлинение может происходить с помощью гликозилтрансфераз и сульфотрансфераз. Например, биосинтез основного гликоглицеролипида в растениях включает перенос галактозила из UDP-Gal на диацилглицерин с образованием β-галактозилдиацилглицерина посредством галактозилтрансфераз. Дополнительный перенос галактозила от UDP-Gal образует α-D-галактозил-(1,6)- O -β-D-галактозилдиацилглицерин [2].
Гликосфинголипиды получают из лактозилцерамида (LacCer; β-D-галактозил(1→4)-β-D-глюкозилцерамид), где первой стадией является ацилирование и десатурация D-эритро-сфинганина. Церамид глюкозилируется, а затем β-галактозилируется внеклеточно с образованием лактозилцерамида. Дальнейшее удлинение может происходить с помощью гликозилтрансфераз и сульфотрансфераз. Например, биосинтез основного гликоглицеролипида в растениях включает перенос галактозила из UDP-Gal на диацилглицерин с образованием β-галактозилдиацилглицерина посредством галактозилтрансфераз. Дополнительный перенос галактозила от UDP-Gal образует α-D-галактозил-(1,6)- O -β-D-галактозилдиацилглицерин [2].
Метаболизм
Деградация гликосфинголипидов опосредована интернализацией путем эндоцитоза. Они транспортируются в лизосомы, где ферменты расщепляют гликосфинголипиды путем гидролитического и необратимого расщепления связей. Сфинголипидозы, присутствующие в мембране, также опосредуют деградацию гликолипидов этого класса [4].
Нарушение метаболизма гликолипидов связано с несколькими различными заболеваниями, начиная с нарушения деградации гликолипидов, приводящего к накоплению гликолипидов. На рисунке \(\PageIndex{2}\) показаны заболевания, связанные с различными нарушениями метаболизма гликолипидов. Например, болезнь Тея-Сакса является аутосомно-рецессивным заболеванием, относящимся к группе G9.1830 М2 ганглиозидотическая болезнь. Заболевание проявляется симптомами тяжелого психомоторного нарушения развития, которое вызвано неспособностью должным образом расщеплять ассоциированные с мембраной ганглиозиды. Это происходит из-за того, что фермент, необходимый для расщепления ганглиозидов, β-гексозаминдаза А, дисфункционален из-за мутаций в гене HEXA. Накопление этих ганглиозидов в нейронах приводит к гибели нервных клеток.
Рисунок \(\PageIndex{2}\). Заболевания, связанные с нарушением обмена гликолипидовРаспространение
Большинство гликолипидов расположены в мембранных структурах клетки.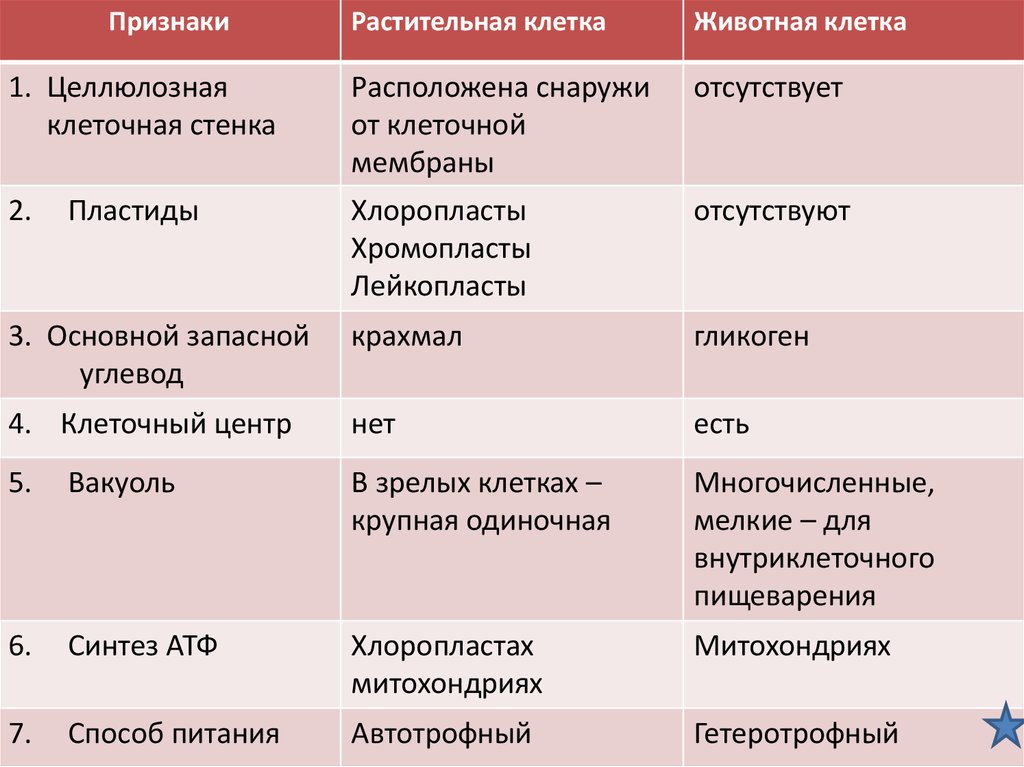 Две трети всех гликолипидов распределены во внутриклеточных мембранах, таких как аппарат Гольджи, эндосомы, лизосомы, ядерная мембрана и митохондрии [4]. Гликолипиды синтезируются в аппарате Гольджи, где большая их часть транспортируется к мембранам для поддержания бислоя. В цистоле можно найти немного гликолипидов; примерно 5% от общего количества гликолипидов в головном мозге приходится на растворимую фракцию.
Две трети всех гликолипидов распределены во внутриклеточных мембранах, таких как аппарат Гольджи, эндосомы, лизосомы, ядерная мембрана и митохондрии [4]. Гликолипиды синтезируются в аппарате Гольджи, где большая их часть транспортируется к мембранам для поддержания бислоя. В цистоле можно найти немного гликолипидов; примерно 5% от общего количества гликолипидов в головном мозге приходится на растворимую фракцию.
Гликосфинголипиды в плазматической мембране могут объединяться с холестерином для образования рафтов, содержащих меньше фосфолипидов по сравнению с другими частями мембраны; примерно 70% всех гликолипидов находится в этих рафтах, образующих гидрофобные взаимодействия [5]. Кроме того, сфинголипиды и гликосфинголипиды образуют слабые взаимодействия между углеводными головными группами и гидрофобными насыщенными липидами боковой цепи с заполнением пустот холестерином [6]. Сильные взаимодействия между гликолипидами и холестерином являются движущей силой, отделяющей их от жидких фосфолипидов в мембране [7].
Функция
Углеводы на гликолипидах представляют собой наиболее открытые структуры на внеклеточной поверхности клеток, они гибкие и имеют многочисленные сайты связывания, что делает их оптимальными для передачи клеточных сигналов. Поскольку липидный фрагмент обычно скрыт внутри мембраны, углевод-углеводные взаимодействия являются преобладающими взаимодействиями, которые могут происходить между гликолипидами. Они могут взаимодействовать бок о бок внутри одной и той же мембраны или осуществлять транс-взаимодействия между двумя мембранами. Сообщалось, что транс-взаимодействия между гликолипидами являются основой зависимой от гликосфинголипидов межклеточной адгезии, в которой участвуют ионы кальция [8]. Дальнейшие исследования показали, что углеводы клеточной поверхности играют важную роль в распознавании клеточного субстрата при онкогенезе, регуляции миелиновой оболочки и клеточной адгезии при метастазировании [9].-11]. Гликолипиды играют важную роль в нескольких биологических функциях, таких как распознавание и передача клеточных сигналов; ниже приведены несколько биологических функций, в которых играют роль гликолипиды.
Передача сигнала
Гликосфинголипиды и сфингомиелин сгруппированы в микродомены, где они могут связываться с несколькими различными белками, такими как cSrc, G-белки и киназа фокальной адгезии, для опосредования клеточных событий [ 12]. В плазматической мембране гликосфинголипиды образуют рафты с холестерином, где в этих областях относительно меньше фосфолипидов. Как показано на рисунке \(\PageIndex{3}\), гликосфинголипиды образуют рафты с холесторолом, чтобы заякорить белки GPI на внеклеточном листке, а киназы семейства src — на цистолитическом листке. Таким образом, гликосфинголипиды. Эти микродомены могут вызывать клеточные ответы, связываясь с GPI-заякоренными белками, которые могут индуцировать активацию специфических киназ для передачи фосфорилирования различных субстратов [13]. Гликосфинголипидные микродомены также связаны с опосредованными иммунорецепторами и рецепторами факторов роста [14].
Рисунок \(\PageIndex{3}\). Взаимодействие гликолипидов и мембраносвязанных белков.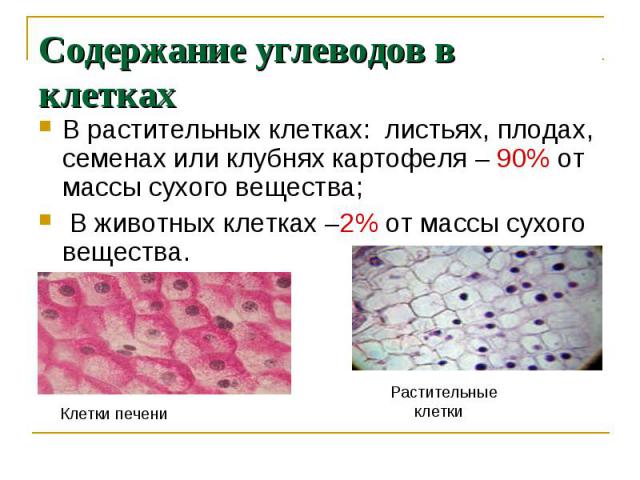
Пролиферация клеток
Было обнаружено, что гликолипиды играют роль в регуляции роста клеток посредством взаимодействия с рецепторами факторов роста. Внутриклеточный церамид стимулировал синтез ДНК в гладкомышечных клетках эндотелия, а также индуцировал митогенез тромбоцитарным фактором роста [15]. Лактозилцерамид активирует НАДФН-оксидазу, чтобы модулировать экспрессию межклеточной молекулы адгезии-1 на эндотелиальных клетках пупочной вены человека и индуцировать пролиферацию гладкомышечных клеток аорты человека. При снижении церамида повышалась активность церамидазы, сфингомиелинсинтазы, которая связана с пролиферацией гладкомышечных клеток. Кроме того, известно, что ганглиозиды участвуют в индукции апоптоза. Сигнал апоптоза, запускаемый CD95 в лимфоидных и миелоидных опухолевых клетках повышают уровень церамидов, что приводит к увеличению синтеза ганглиозидов GD3; Известно, что GD3 является мощным медиатором клеточной гибели. Обильные количества гликосфинголипидов обнаруживаются в плазматической мембране раковых клеток, где антитела, нацеленные на эти ганглиозиды, приводят к апоптозу [16].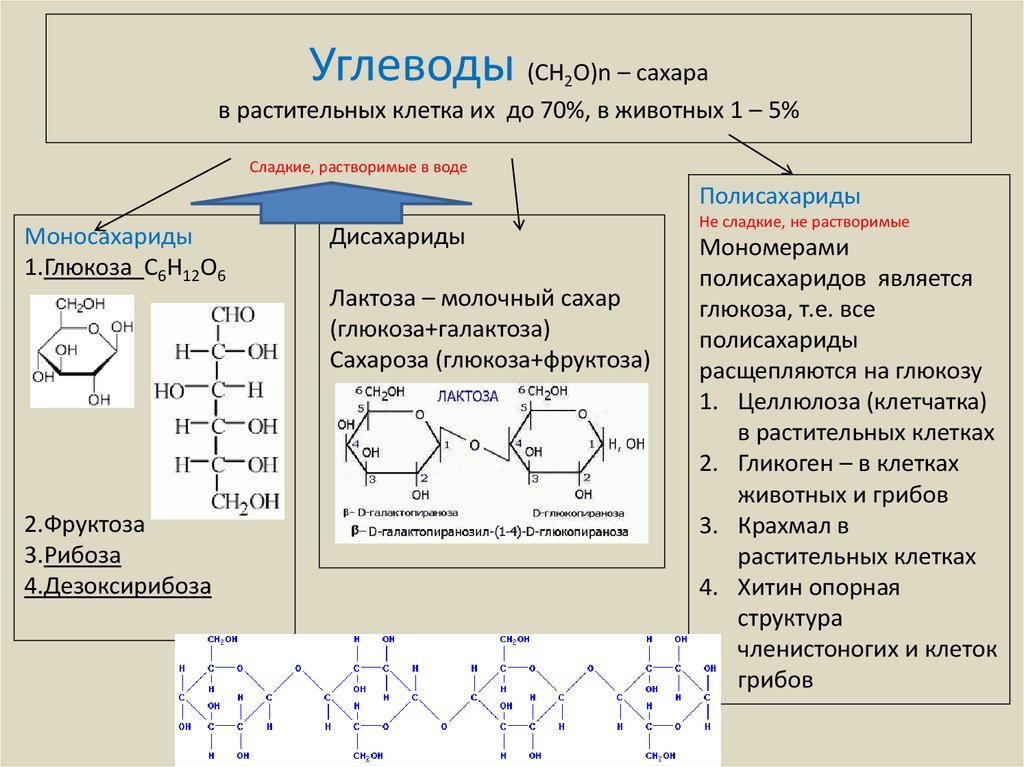 Лечение моноклональными антителами против ганглиозида GD2 индуцирует апоптоз в экспрессирующих GD2 клетках рака легких человека.
Лечение моноклональными антителами против ганглиозида GD2 индуцирует апоптоз в экспрессирующих GD2 клетках рака легких человека.
Передача сигналов кальция
Ганглиозиды связаны с ионами кальция, которые, как считается, играют роль в функционировании нейронов. Мицеллы ганглиоскольжения связываются с ионами кальция с высоким сродством и могут играть значительную роль в синаптической передаче. Сообщалось, что сфингозин и церамид опосредуют высвобождение кальция из внутриклеточных запасов. Ганглиозиды также могут играть роль в гомеостазе кальция и передаче сигналов. Эти гликолипиды вызывают изменения в клеточном кальции за счет модуляции каналов притока кальция, белков обмена кальция и зависимых от кальция ферментов, которые были изменены за счет ассоциации ганглиозидов. [17]. Кроме того, повышение уровня внутриклеточного глюкозилцерамида приводило к увеличению запасов кальция в нейронах [18]. Гликолипиды галактоцереброзиды наблюдались при открытии кальциевых каналов в клетках олигодендроцитов.
Типы гликолипидов
Гликосфинголипиды
Гликосфинголипиды представляют собой класс гликолипидов, которые содержат церамид в качестве липидного комплекса. Церамиды представляют собой амиды жирных кислот с длинноцепочечными ди- или тригидрокси-основаниями. Ацильная группа церамидов представляет собой длинноцепочечные насыщенные или мононенасыщенные жирные кислоты. Эти липиды в основном обнаруживаются в нервной ткани нервной ткани и опосредуют клеточную передачу сигналов. Гликофинголипиды можно разделить на следующие группы:
- Нейтральные гликосфинголипиды : Цереброзиды, также известные как моногликозилцерамиды, представляют собой гликолипиды, в основном обнаруживаемые в головном мозге и периферической нервной ткани. Наиболее распространенный цереброзид содержит молекулу галактозы, обнаруженную в миелине. Их функция заключается в создании защитного покрытия для каждого нерва, действующего как изолятор с высокой концентрацией в миелиновой оболочке.

- Кислые гликосфинголипиды : Эти липиды имеют отрицательный заряд при физиологическом pH, который обеспечивается N-ацетилнейраминовой кислотой (NANA) или сульфатными группами в сульфатидах. Ганглиозиды содержат сиаловую кислоту (НАНА), что делает их отрицательно заряженными. Они находятся в ганглиозных клетках ЦНС и преимущественно в нервных окончаниях. Сульфатиды представляют собой сульфатированные галактоцереброзиды, которые обнаруживаются в головном мозге и почках. Они в основном обнаруживаются в медулированных нервных волокнах и связаны с иммунными реакциями на передачу сигналов нервной системы.
- Основные гликосфинголипиды
- Амфотерные гликосфинголипиды
Гликоглицеролипиды
- Нейтральные гликоглицеролипиды : обычно содержат один или два сахара, связанных с глицерином или диацилглицерином. Эти липиды играют важную роль в высших растениях, водорослях и бактериях, у которых они локализованы в фотосинтетических мембранах.
 Фотосинтетические мембраны состоят примерно на 85% из нейтральных гликоглицеролипидов [6]. нейтральные гликоглицериновые липиды можно разделить на неацилированные или ацилированные гликозидные фрагменты.
Фотосинтетические мембраны состоят примерно на 85% из нейтральных гликоглицеролипидов [6]. нейтральные гликоглицериновые липиды можно разделить на неацилированные или ацилированные гликозидные фрагменты. - Гликофосфолипиды : Эти соединения представляют собой гликоглицеролипиды, содержащие по крайней мере одну фосфатную группу, присоединенную либо к сахару, либо к глицерину. Самые простые из этих соединений находятся в красных кровяных тельцах и называются глюкозилированной фосфатидной кислотой.
- Сульфогликоглицеролипиды : Эти соединения содержат атом серы и предполагаются локализованными на кислых мембранах (поверхность мембраны сильнокислая). Показано, что сульфолипиды присутствуют в тилакоидных мембранах растений в составе фотосинтетических мембран.
Литература
- «Гликолипиды». Природа. Издательская группа «Природа». Проверено в мае 2016 г.
- Ю и др., Р.К. Ю, Ю. Судзуки, М.
 Янагисава. Мембранные гликолипиды стволовых клеток. Письма ФЭБС, 584 (2010), с. 1694
Янагисава. Мембранные гликолипиды стволовых клеток. Письма ФЭБС, 584 (2010), с. 1694 - К. Нил Хантер, Февзи Далдал, Марион К. Турнаунер, Дж. Томас Бити. Достижения в области фотосинтеза и дыхания, Vol. 28. Пурпурные фототрофные бактерии. Спрингер. 2009.
- Гиллард Б.К., Турмон, Л.Т., Маркус Д.М. (1993) Вариабельная субклеточная локализация гликосфинголипидов. Гликобиология 3: 57-67. 5. Эдидин М (2003)
- Саймонс К., Тоомре Д. (2000) Липидные плоты и передача сигнала. Nat Rev Mol Cell Biol 1: 31-41.
- Браун Д.А., Лондон Э. (2000)Структура и функции мембранных рафтов, богатых сфинголипидами и холестерином. J Biol Chem 275: 17221-17224.
- Шауль П.В., Андерсон Р.Г. (1998) Роль кавеол плазмалеммы в передаче сигнала. Am J Physiol 275: 843-851.
- Marrow MR, Singh D, Lu D, Grant CW (1995) Расположение жирных кислот гликосфинголипидов в фосфолипидном бислое: эффекты холестерина. Биофиз J 68: 179-186
- Kojima N, Hakomori S (1991) Клеточная адгезия, распространение и подвижность клеток, экспрессирующих GM3, на основе взаимодействия гликолипидов и гликолипидов.
 J Biol Chem 266: 17552-17558.
J Biol Chem 266: 17552-17558. - Boggs JM, Menikh A, Rangaraj G (2000)Транс-взаимодействие между галактозилцерамидом и сульфатом цереброзида через противоположные бислои. Биофиз J 78: 874-885.
- Schnaar RL (2004)Опосредованное гликолипидами межклеточное распознавание при воспалении и регенерации нервов. Arch Biochem Biophys 426: 163-172.
- Malhotra R (2012) Мембранные гликолипиды: функциональная гетерогенность: обзор. Биохим Анал Биохим 1:108. дои: 10.4172/2161- 1009.1000108
- Hakamori SI (2000) Клеточная адгезия, распознавание и передача сигнала через гликосфинголипидный микродомен. Glycoconj J 17: 143-151.
- Jordan S, Rodgers W (2003) Мембранные домены, обогащенные гликолипидами Т-клеток, конститутивно собираются в виде мембранных фаз, которые перемещаются в иммунные синапсы. Дж. Иммунол 171: 78-87.
- Auge N, Andrieu N, Negre-Salvayre A, Thiers JC, Levade T, et al. (1996)Сфингомиелин-церамидный сигнальный путь участвует в пролиферации клеток, индуцированной окисленными липопротеинами низкой плотности.
 J Biol Chem 271: 19251–19255.
J Biol Chem 271: 19251–19255. - Де Мария Р., Ленти Л., Малисан Ф., д’Агостино Ф., Томассини Б. и др. (1997)Потребность в ганглиозиде GD3 при апоптозе, индуцированном CD95 и церамидом. Наука 277: 1652-1655.
- Nagatsuka Y et al., FEBS Lett 2001, 497, 141
- Benson AA et al., Proc Natl Acad Sci USA 1959, 45, 1582
1.4: Гликолипиды распространяются под лицензией CC BY и были созданы, изменены и/или курированы LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия 9Раздел 1799 или страница
- Лицензия
- СС BY
- Показать оглавление
- нет
- Теги
- гликолипиды
- source@https://ocw.


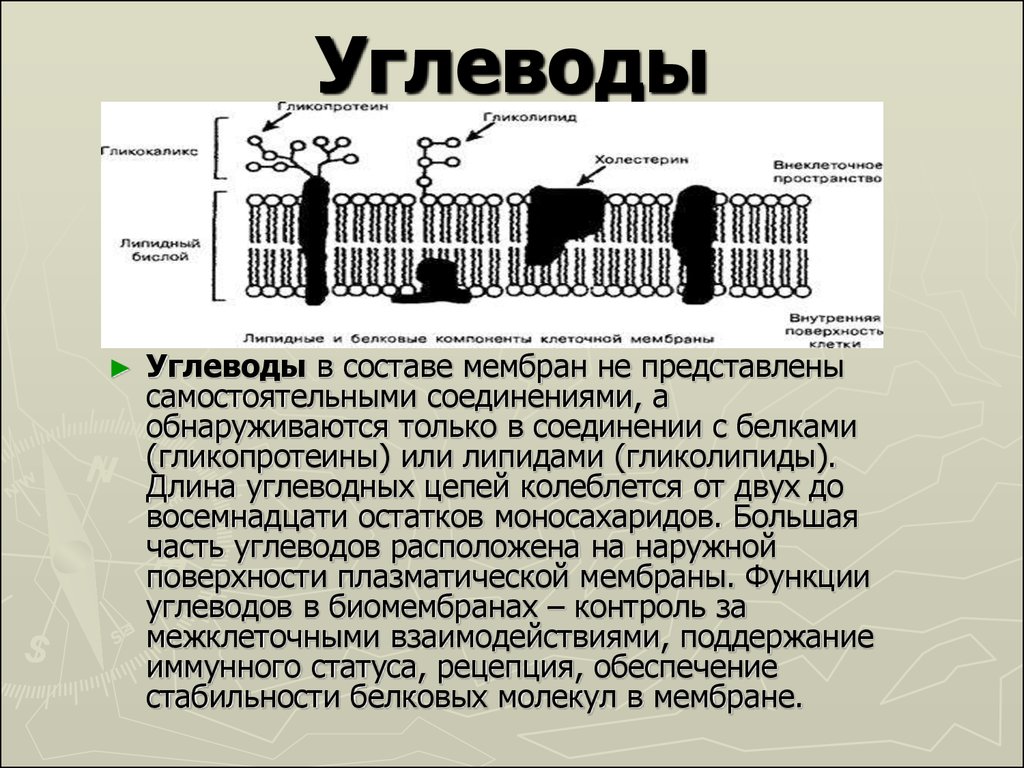
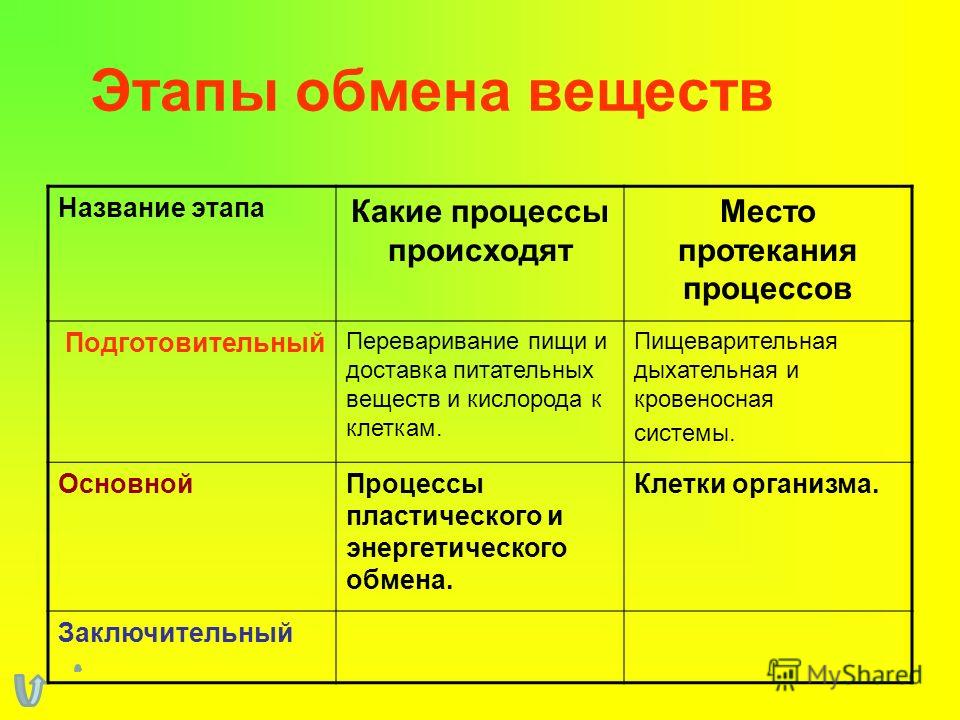


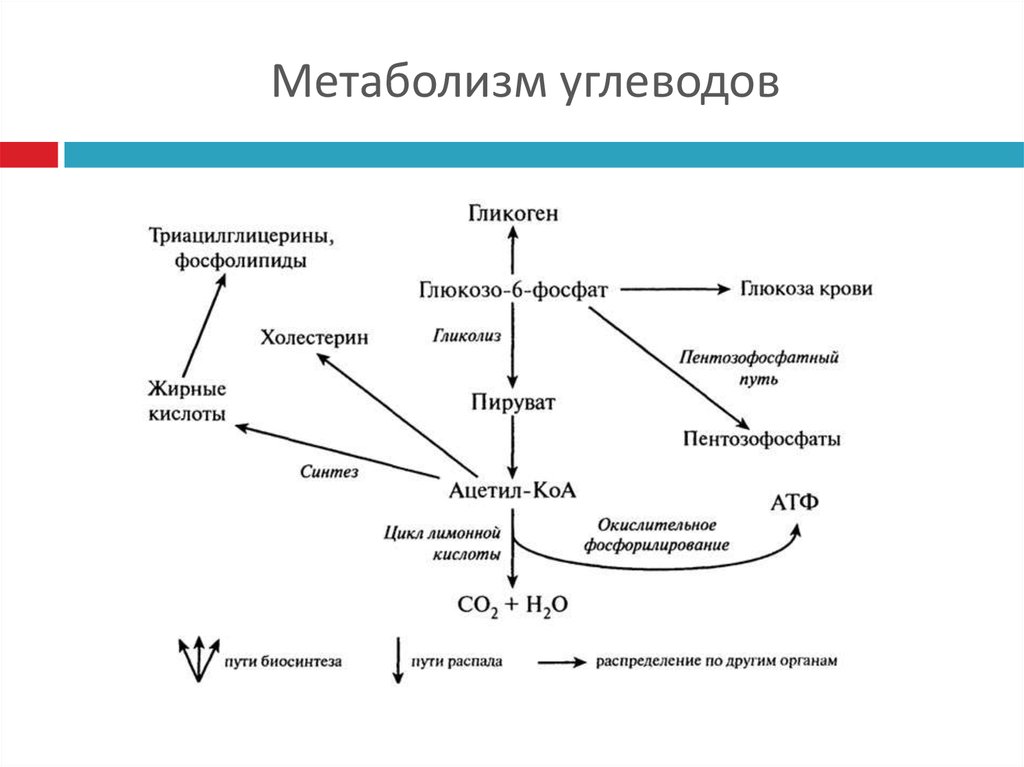




 Нуклеиновые кислоты и белки также могут связывать коллоидный гидроксид железа, но при более высоких значениях рН.
Нуклеиновые кислоты и белки также могут связывать коллоидный гидроксид железа, но при более высоких значениях рН.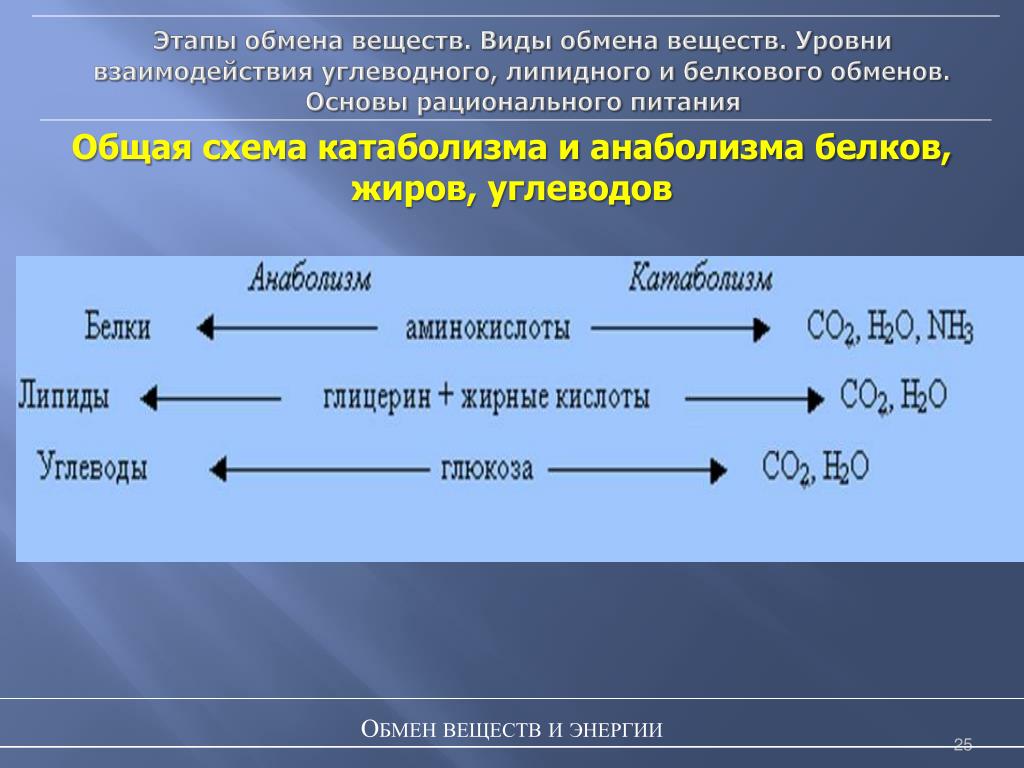 Образовавшийся гидроксид железа можно хранить в течение 1 мес.
Образовавшийся гидроксид железа можно хранить в течение 1 мес.
 На соответствующих объектах могут быть получены хорошие результаты в случае прижизненного окрашивания альциановым синим.
На соответствующих объектах могут быть получены хорошие результаты в случае прижизненного окрашивания альциановым синим.
 extinctio — гашение).
extinctio — гашение).
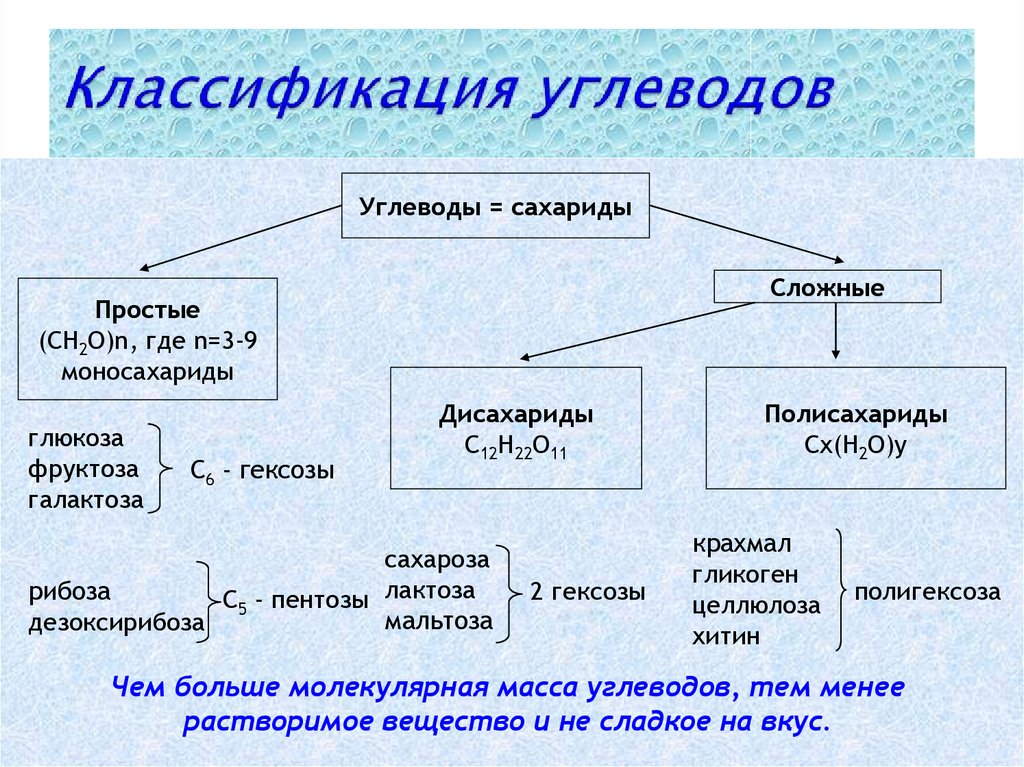 Кроме того, их окрашивание можно ослабить путем добавления хлорида магния к раствору красителя. Вместо метиленового синего можно использовать растворы (0,02 %) азура А в HCl-фосфатном или фосфат-цитратном буфере.
Кроме того, их окрашивание можно ослабить путем добавления хлорида магния к раствору красителя. Вместо метиленового синего можно использовать растворы (0,02 %) азура А в HCl-фосфатном или фосфат-цитратном буфере.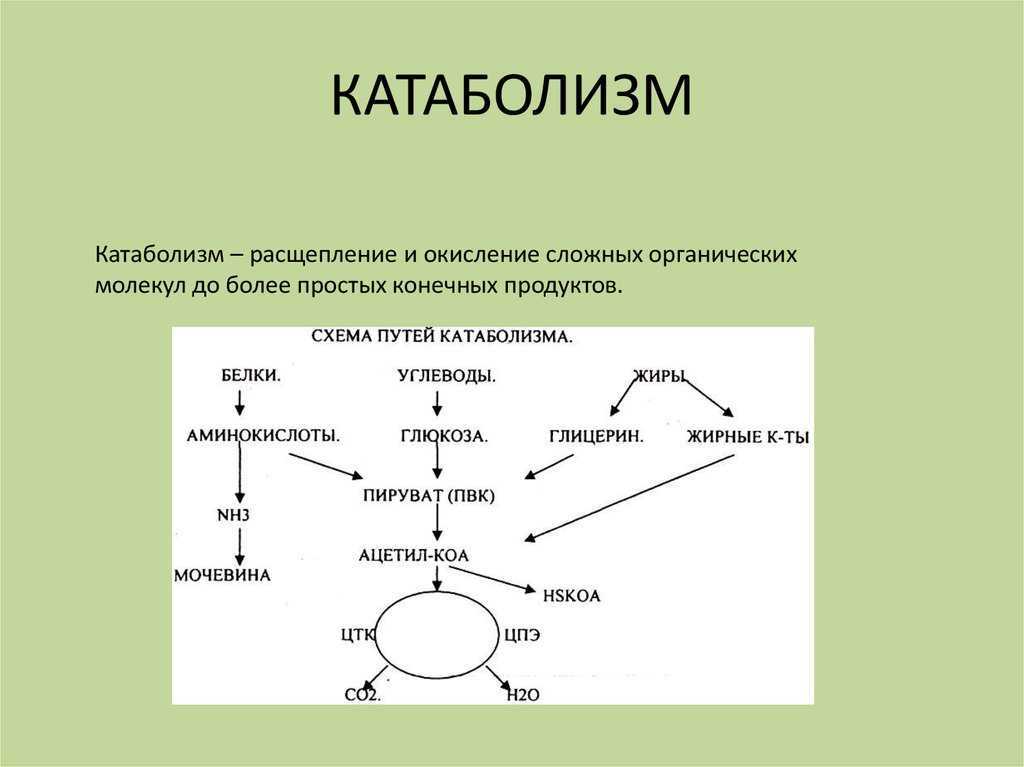 При использовании этого метода на первом этапе образуется связь между катионом рутениевого красного и анионными группами кислых ГАГ, при этом субстрат окрашивается в красный цвет. Электронно-микроскопическое контрастирование происходит при последующей обработке тетраоксидом осмия в окислительно-восстановительной реакции, катализируемой рутениевым красным, при которой низшие окислы осмия осаждаются на окисленном субстрате. Поскольку рутениевый красный плохо проникает в ткани, его рекомендуется добавлять прямо в фиксирующую смесь.
При использовании этого метода на первом этапе образуется связь между катионом рутениевого красного и анионными группами кислых ГАГ, при этом субстрат окрашивается в красный цвет. Электронно-микроскопическое контрастирование происходит при последующей обработке тетраоксидом осмия в окислительно-восстановительной реакции, катализируемой рутениевым красным, при которой низшие окислы осмия осаждаются на окисленном субстрате. Поскольку рутениевый красный плохо проникает в ткани, его рекомендуется добавлять прямо в фиксирующую смесь.
 В таких случаях лучшие результаты может дать карминовый метод Беста, хотя применение этого чисто эмпирического метода трудно «примирить» со строгими гистохимическими требованиями.
В таких случаях лучшие результаты может дать карминовый метод Беста, хотя применение этого чисто эмпирического метода трудно «примирить» со строгими гистохимическими требованиями.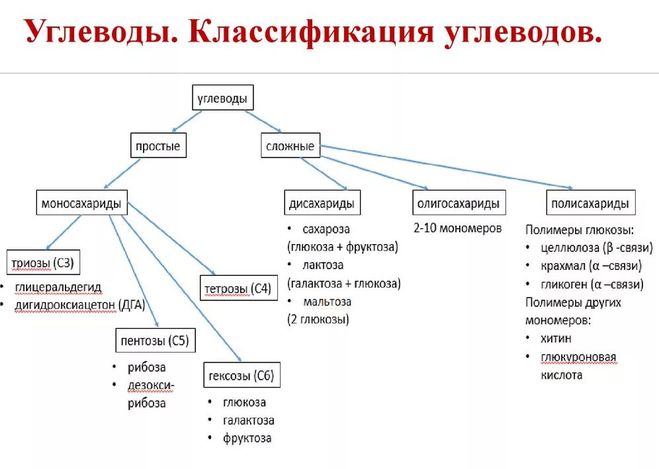
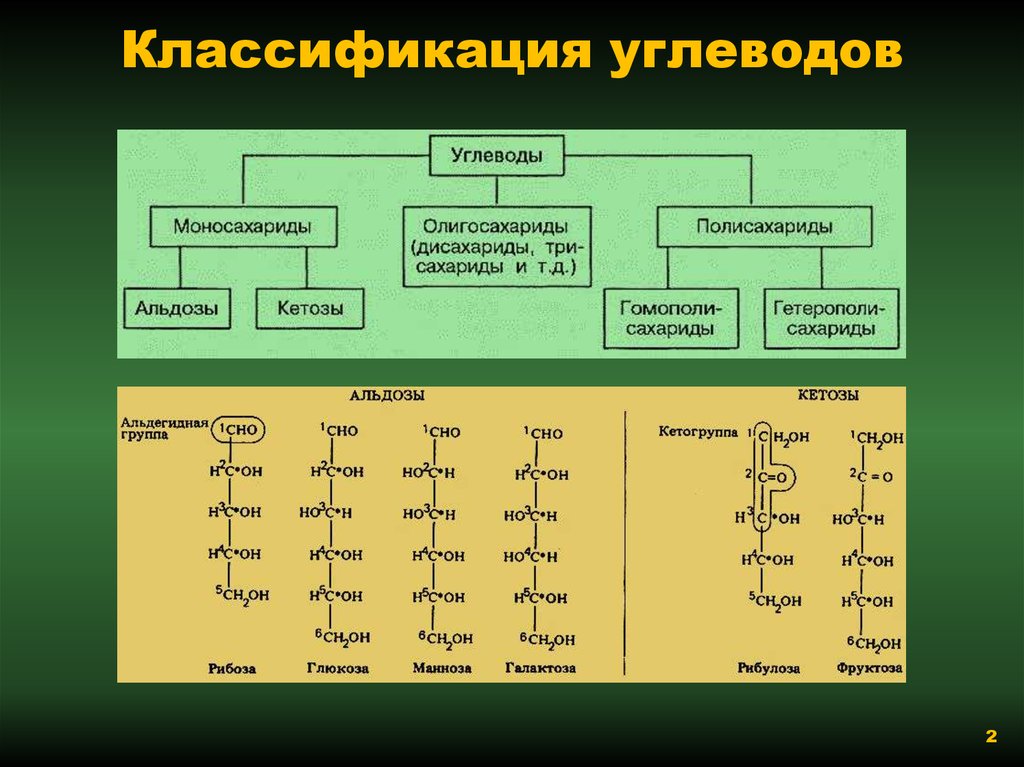 Раствор готов к непосредственному применению, его можно хранить в темной колбе в течение нескольких недель, в холодильнике — до 3 мес.
Раствор готов к непосредственному применению, его можно хранить в темной колбе в течение нескольких недель, в холодильнике — до 3 мес.  Для установления специфичности проведенной реакции и для дифференциальной локализации полисахаридов используют методы блокирования реакционноспособных групп и ферментативного гидролиза.
Для установления специфичности проведенной реакции и для дифференциальной локализации полисахаридов используют методы блокирования реакционноспособных групп и ферментативного гидролиза.
 фосфатном или ацетатном буфере (рН 6,0).
фосфатном или ацетатном буфере (рН 6,0). 
 (b-Амилаза расщепляет только молекулы с разветвленными цепями.
(b-Амилаза расщепляет только молекулы с разветвленными цепями.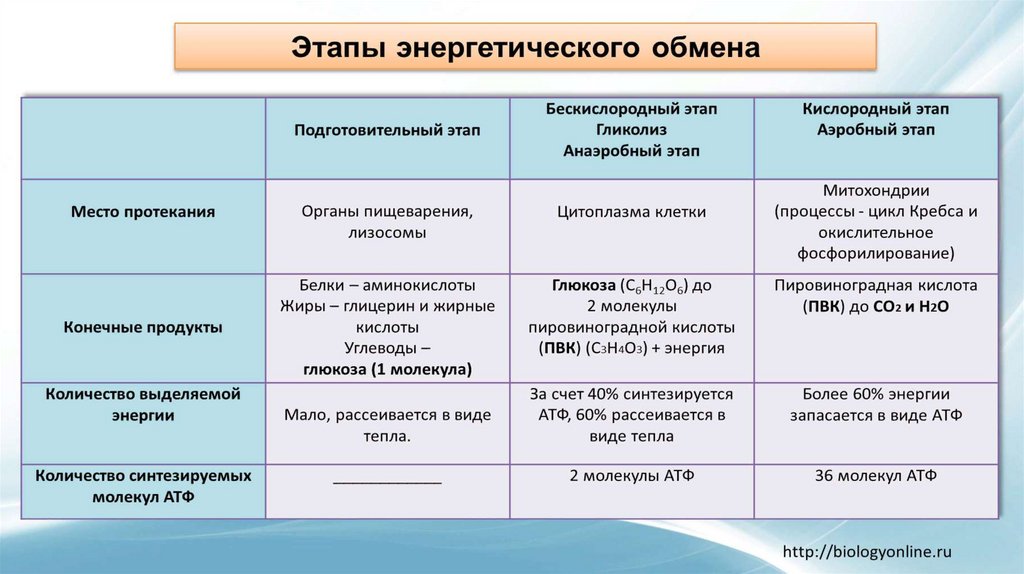 R. Acad. науч. 270 : 2205–2208.
R. Acad. науч. 270 : 2205–2208. , Zelander, T., 1970, Сохранение межклеточных веществ катионным красителем Alcian blue в подготовительных процедурах для электронной микроскопии, J. Ultrastruct. Рез. 31 : 424–438.
, Zelander, T., 1970, Сохранение межклеточных веществ катионным красителем Alcian blue в подготовительных процедурах для электронной микроскопии, J. Ultrastruct. Рез. 31 : 424–438. Histochem. Цитохим. 11 : 14–23.
Histochem. Цитохим. 11 : 14–23. 31 : 579–590.
31 : 579–590.
 , Mongiat, F., 1977, Ультраструктурное исследование сайтов связывания агглютинина зародышей пшеницы с использованием глюкозооксидазы в качестве маркера, J. Ultrastruct. Рез. 59 : 119–125.
, Mongiat, F., 1977, Ультраструктурное исследование сайтов связывания агглютинина зародышей пшеницы с использованием глюкозооксидазы в качестве маркера, J. Ultrastruct. Рез. 59 : 119–125. Histochem. Цитохим. 25 : 1187–1200.
Histochem. Цитохим. 25 : 1187–1200. Cell Biol. 100 : 606–612.
Cell Biol. 100 : 606–612. Т., Пихл Э., 19 лет67, Окрашивание кислых гликозаминогликанов тучных клеток на ультратонких срезах рутениевым красным, Nature (Лондон) 216 : 697–698.
Т., Пихл Э., 19 лет67, Окрашивание кислых гликозаминогликанов тучных клеток на ультратонких срезах рутениевым красным, Nature (Лондон) 216 : 697–698. Л., Санисло П. Дж., 19 лет83, Электронно-микроскопическая демонстрация хитина в клеточных стенках Wangiella dermatiditis с помощью хитиназы-коллоидного золота, Abstr. Анну. Встретиться. Являюсь. Соц . Микробиол . 1983 : 144.
Л., Санисло П. Дж., 19 лет83, Электронно-микроскопическая демонстрация хитина в клеточных стенках Wangiella dermatiditis с помощью хитиназы-коллоидного золота, Abstr. Анну. Встретиться. Являюсь. Соц . Микробиол . 1983 : 144. Клетка. 36 : 253–258.
Клетка. 36 : 253–258. , Tacchini-Vonlanthen, M., 1983, Стабильность и стерические затруднения меченых лектином золотых маркеров в просвечивающей и сканирующей электронной микроскопии, в: Lectins, Vol. 3 (Т. К. Бог-Хансен и Г. А. Шпенглер), стр. 189.–197, де Грюйтер, Берлин.
, Tacchini-Vonlanthen, M., 1983, Стабильность и стерические затруднения меченых лектином золотых маркеров в просвечивающей и сканирующей электронной микроскопии, в: Lectins, Vol. 3 (Т. К. Бог-Хансен и Г. А. Шпенглер), стр. 189.–197, де Грюйтер, Берлин. , Vonlanthen, M., and Rosset, J., 1978, Локализация галактоманнановых и агглютининовых рецепторов зародышей пшеницы в Schizosaccharomyces pombe, Arch. микробиол. 119: 107–111.
, Vonlanthen, M., and Rosset, J., 1978, Локализация галактоманнановых и агглютининовых рецепторов зародышей пшеницы в Schizosaccharomyces pombe, Arch. микробиол. 119: 107–111. , Дельмотт Ф. и Монсиньи М., 1977, Получение и свойства гликозилированных цитохимических маркеров, FEBS Lett . 76 : 257–261.
, Дельмотт Ф. и Монсиньи М., 1977, Получение и свойства гликозилированных цитохимических маркеров, FEBS Lett . 76 : 257–261. Cell Biol. 23 : 54а.
Cell Biol. 23 : 54а. , Moher, P., 1980. Обзор маркеров клеточной поверхности и методов мечения для сканирующей электронной микроскопии, Histochem. Дж. 12 : 273–315.
, Moher, P., 1980. Обзор маркеров клеточной поверхности и методов мечения для сканирующей электронной микроскопии, Histochem. Дж. 12 : 273–315. Натл. акад. науч. США 68 : 942–945.
Натл. акад. науч. США 68 : 942–945.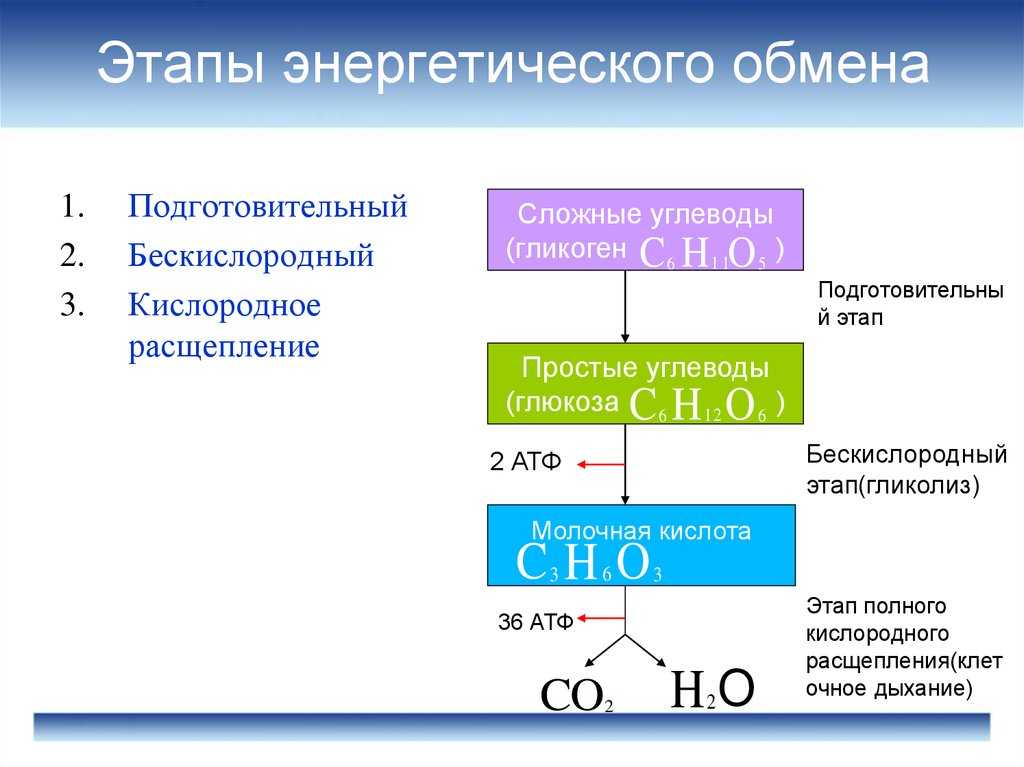 , 1967, Предварительные попытки локализации ультраструктурных полисахаридов в клетках кончика корня, J. Histochem. Цитохим. 15 : 442–455.
, 1967, Предварительные попытки локализации ультраструктурных полисахаридов в клетках кончика корня, J. Histochem. Цитохим. 15 : 442–455.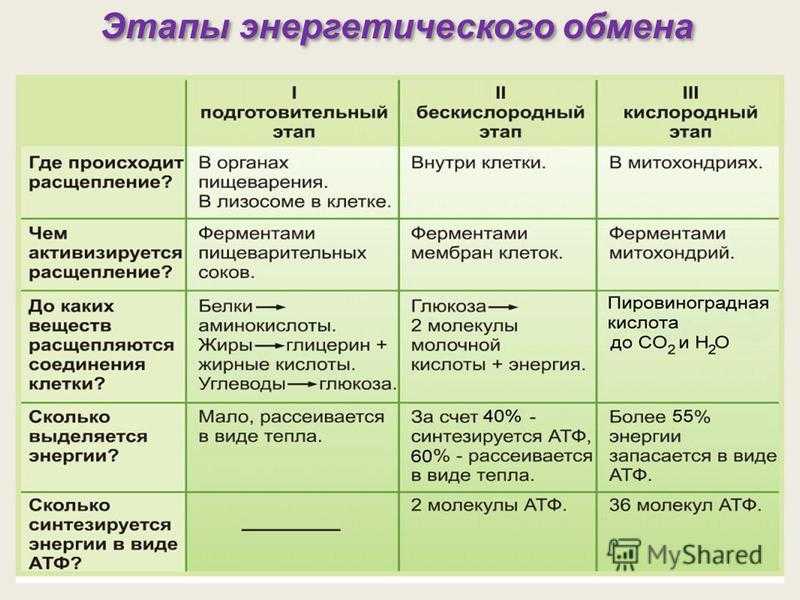 31: 57–114.
31: 57–114.
 Патол. Доп. 3 : 5–186.
Патол. Доп. 3 : 5–186.


 , Шульте Б., 1982, Ультраструктурные методы локализации сложных углеводов, Hum. Патол. 13 : 343–354.
, Шульте Б., 1982, Ультраструктурные методы локализации сложных углеводов, Hum. Патол. 13 : 343–354.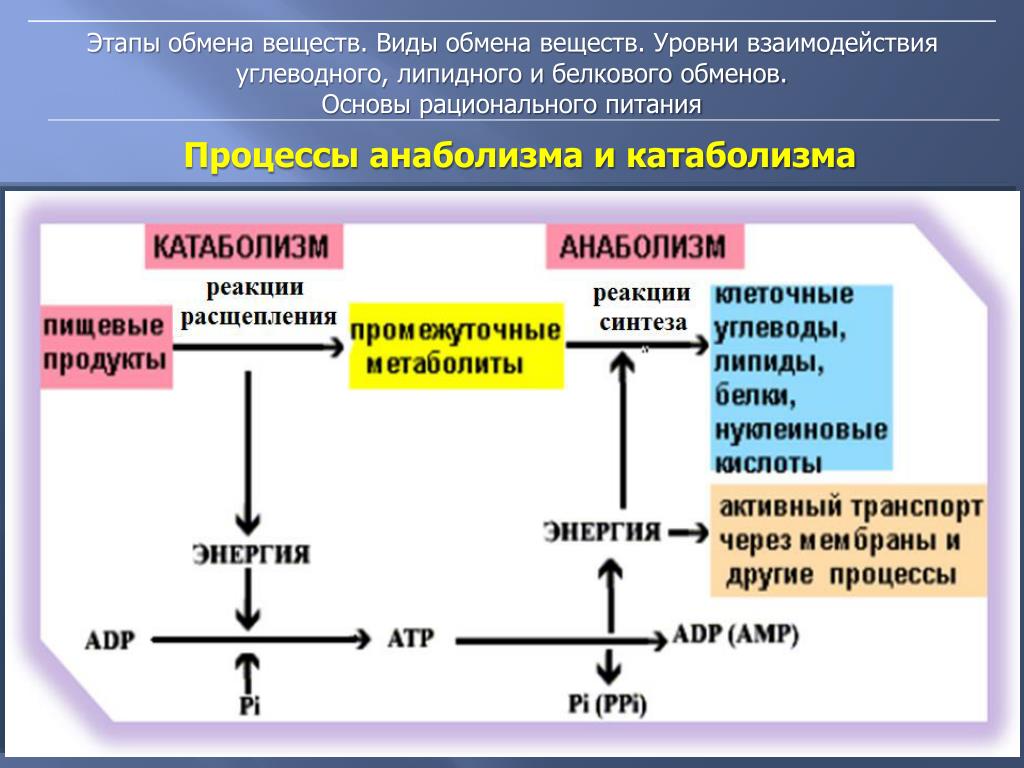 Microsc. (Париж) 6 : 987–1018.
Microsc. (Париж) 6 : 987–1018. Дж. , 15 : 763–784.
Дж. , 15 : 763–784.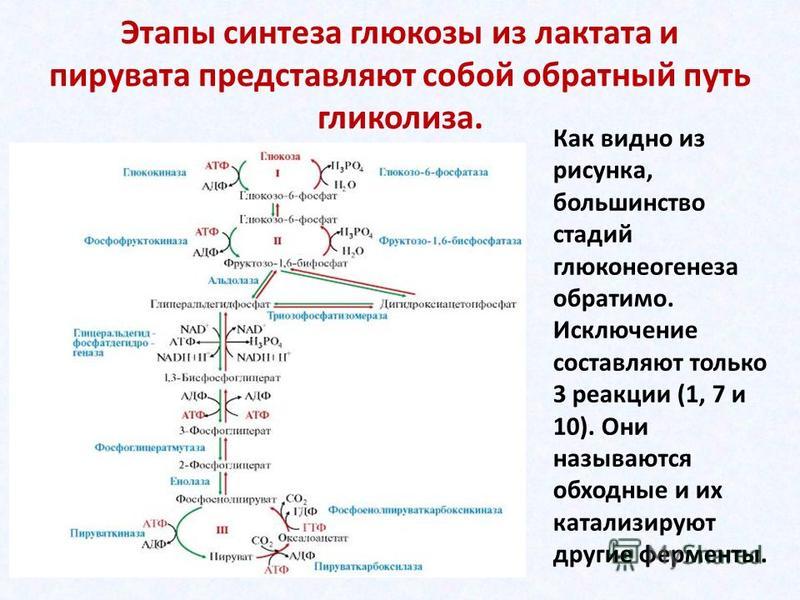 G., Wetzel, B.K., Spicer, S.S., 1966, Ультраструктурная локализация кислых слизистых веществ в толстой кишке мыши с железосодержащими красителями, J. Cell Biol. 30 : 299–315.
G., Wetzel, B.K., Spicer, S.S., 1966, Ультраструктурная локализация кислых слизистых веществ в толстой кишке мыши с железосодержащими красителями, J. Cell Biol. 30 : 299–315. K., Karnovsky, M.J., 1972, Метод ультраструктурного окрашивания для увеличения размера и электронной непрозрачности ферритина в тонких срезах, J. Histochem. Цитохим. 20 : 225–229.
K., Karnovsky, M.J., 1972, Метод ультраструктурного окрашивания для увеличения размера и электронной непрозрачности ферритина в тонких срезах, J. Histochem. Цитохим. 20 : 225–229. , 1972, Маннан как основной компонент почечных рубцов Saccharomyces cerevisiae, Arch. микробиол. 85 : 202–208.
, 1972, Маннан как основной компонент почечных рубцов Saccharomyces cerevisiae, Arch. микробиол. 85 : 202–208. Ultrastruct. Рез. 31 : 424–438.
Ultrastruct. Рез. 31 : 424–438. , Avrameas, S., 1971, Ультраструктурная визуализация клеточных углеводных компонентов с помощью конканавалина А, эксп. Сотовое разрешение . 64 : 232–236.
, Avrameas, S., 1971, Ультраструктурная визуализация клеточных углеводных компонентов с помощью конканавалина А, эксп. Сотовое разрешение . 64 : 232–236.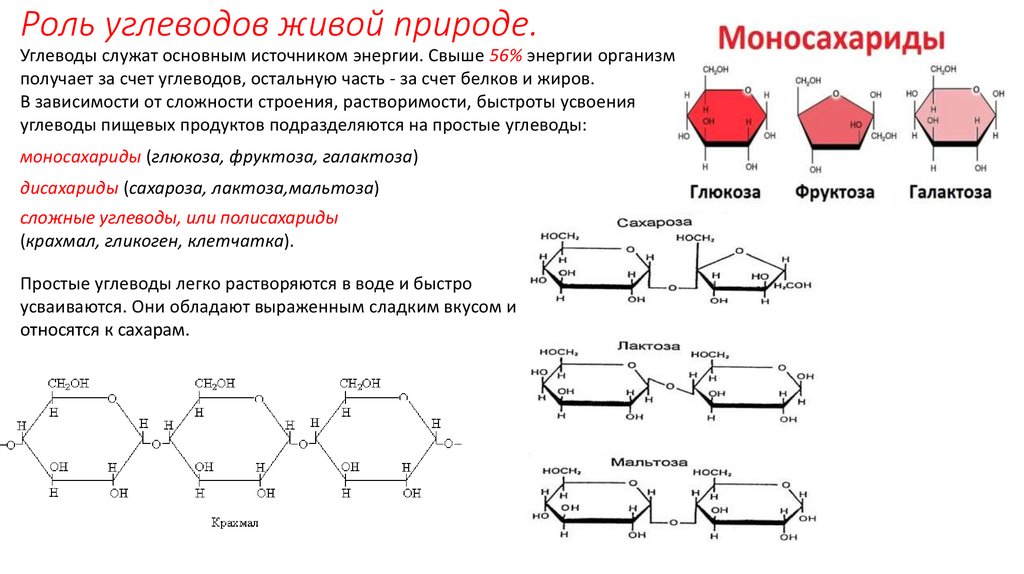 , Charest, P.M., Ouellette, G.B., Pauze, FJ, 1985, Хитиназный комплекс золота для ультраструктурной локализации хитина в клетках корней томатов, инфицированных Fusarium oxysporum f. сп. radicis-lycopersici по сравнению с хитин-специфическим лектином, конъюгированным с золотом, Histochem. Дж. 17: 313-322.
, Charest, P.M., Ouellette, G.B., Pauze, FJ, 1985, Хитиназный комплекс золота для ультраструктурной локализации хитина в клетках корней томатов, инфицированных Fusarium oxysporum f. сп. radicis-lycopersici по сравнению с хитин-специфическим лектином, конъюгированным с золотом, Histochem. Дж. 17: 313-322. S., 1974, Боргидрид натрия как реагент, блокирующий альдегиды, для гистохимии с помощью электронного микроскопа, Гистохимия 42 : 141–144.
S., 1974, Боргидрид натрия как реагент, блокирующий альдегиды, для гистохимии с помощью электронного микроскопа, Гистохимия 42 : 141–144.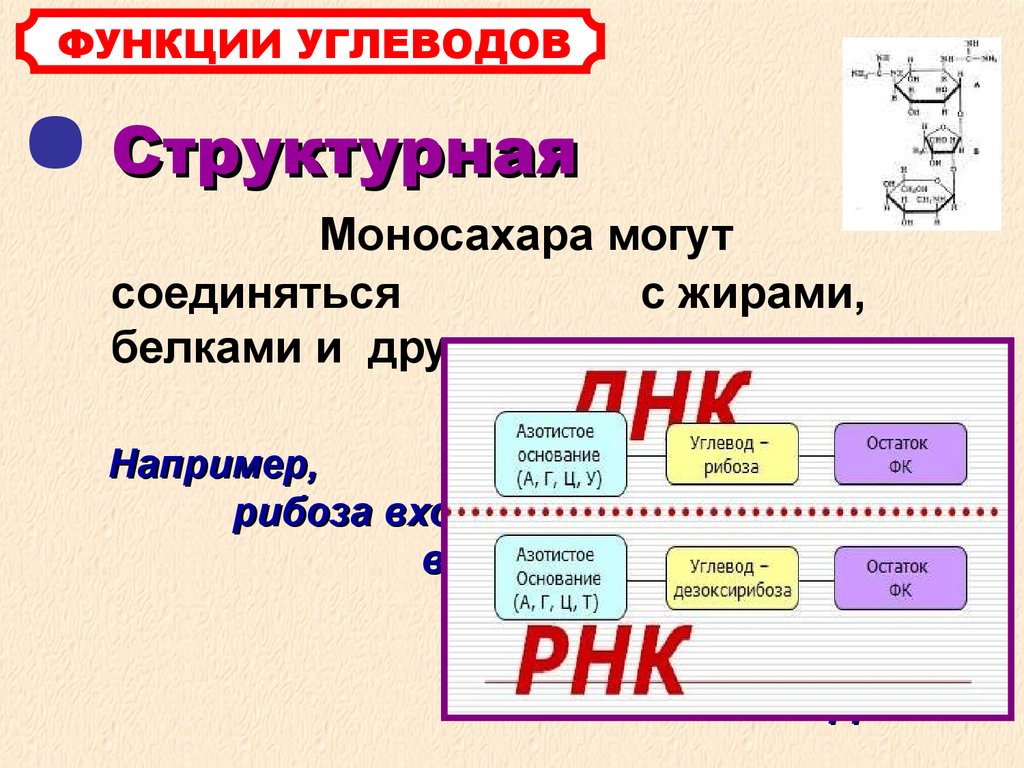 Ultrastruct. Рез. 59 : 119–125.
Ultrastruct. Рез. 59 : 119–125.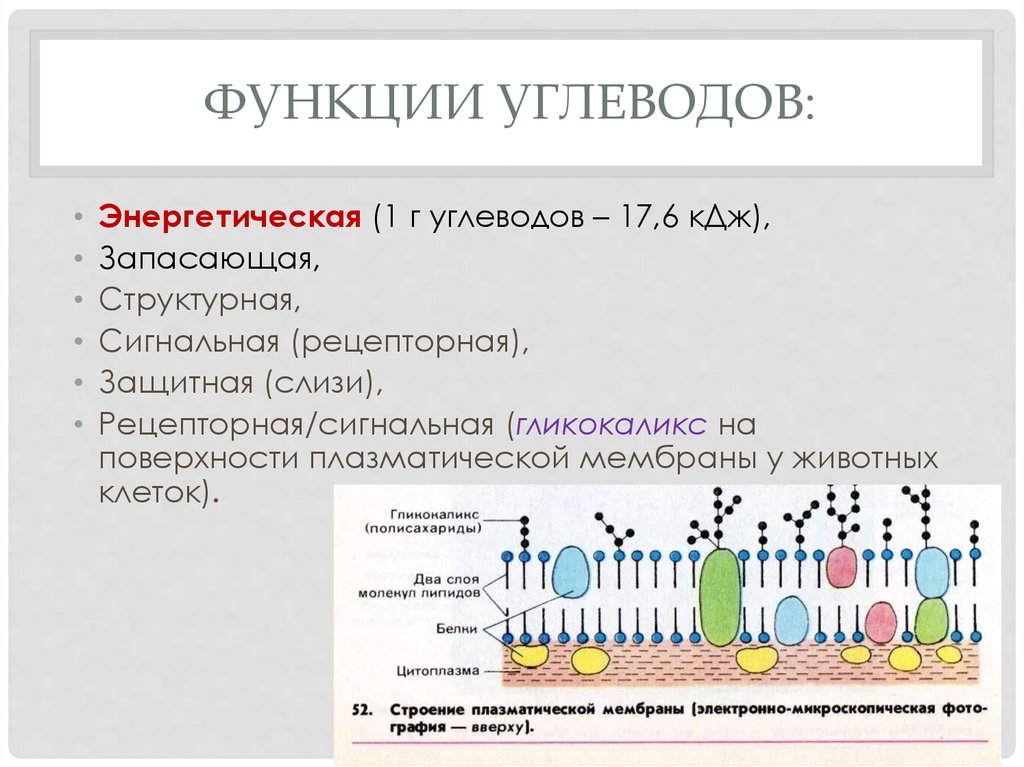 , 1971, Новые гистохимические методы для демонстрации карбоксильных групп в слизистых веществах, Histochem. Дж. 3 : 241–250.
, 1971, Новые гистохимические методы для демонстрации карбоксильных групп в слизистых веществах, Histochem. Дж. 3 : 241–250. , 1946, Новый гистохимический тест на гликоген и муцин, Am. Дж. Клин. Патол. Тех. Разд. 10 : 177–179.
, 1946, Новый гистохимический тест на гликоген и муцин, Am. Дж. Клин. Патол. Тех. Разд. 10 : 177–179. С., Симэн, А. Р., Вайс, Л. П., Уэно, Х., Бергманн, Р. А., Селигман, А. М., 1964, Осмиофильные реагенты: новые цитохимические принципы для световой и электронной микроскопии, Science 146 : 1039–1043.
С., Симэн, А. Р., Вайс, Л. П., Уэно, Х., Бергманн, Р. А., Селигман, А. М., 1964, Осмиофильные реагенты: новые цитохимические принципы для световой и электронной микроскопии, Science 146 : 1039–1043. ), 1981, Принципы и методы электронной микроскопии: биологические приложения, Vol. 1, 2-е изд., University Park Press, Балтимор.
), 1981, Принципы и методы электронной микроскопии: биологические приложения, Vol. 1, 2-е изд., University Park Press, Балтимор.
 , Vonlanthen, M., 1979, Множественная маркировка рецепторов клеточной поверхности гранулами золота: одновременная локализация трех лектиновых рецепторов на эритроцитах человека, J. Microsc. (Оксфорд) 115 : 97–102.
, Vonlanthen, M., 1979, Множественная маркировка рецепторов клеточной поверхности гранулами золота: одновременная локализация трех лектиновых рецепторов на эритроцитах человека, J. Microsc. (Оксфорд) 115 : 97–102. , Рейд, Л., 1973, Влияние рН на окрашивание альциановым синим эпителиальных кислых гликопротеинов. I. Сиаломуцины и сульфомуцины (по отдельности или в простых комбинациях), Histochem. Дж. 5 : 9–18.
, Рейд, Л., 1973, Влияние рН на окрашивание альциановым синим эпителиальных кислых гликопротеинов. I. Сиаломуцины и сульфомуцины (по отдельности или в простых комбинациях), Histochem. Дж. 5 : 9–18. М. Глоерт, изд.), стр. 77–136, Эльзевир/Северная Голландия, Амстердам.
М. Глоерт, изд.), стр. 77–136, Эльзевир/Северная Голландия, Амстердам.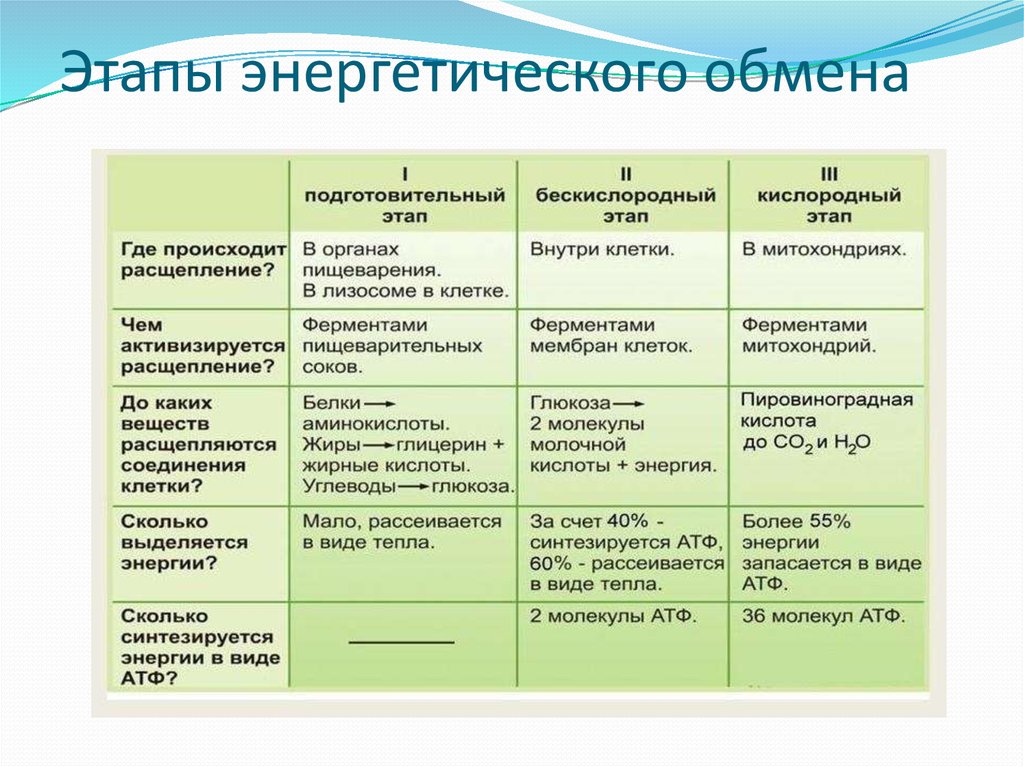 Рек. 171 : 347–368.
Рек. 171 : 347–368. , Bernhard, W., 1966, Действие определенных ферментов на ткани, включая Epon, J. Microsc. (Париж) 5 : 697–714.
, Bernhard, W., 1966, Действие определенных ферментов на ткани, включая Epon, J. Microsc. (Париж) 5 : 697–714.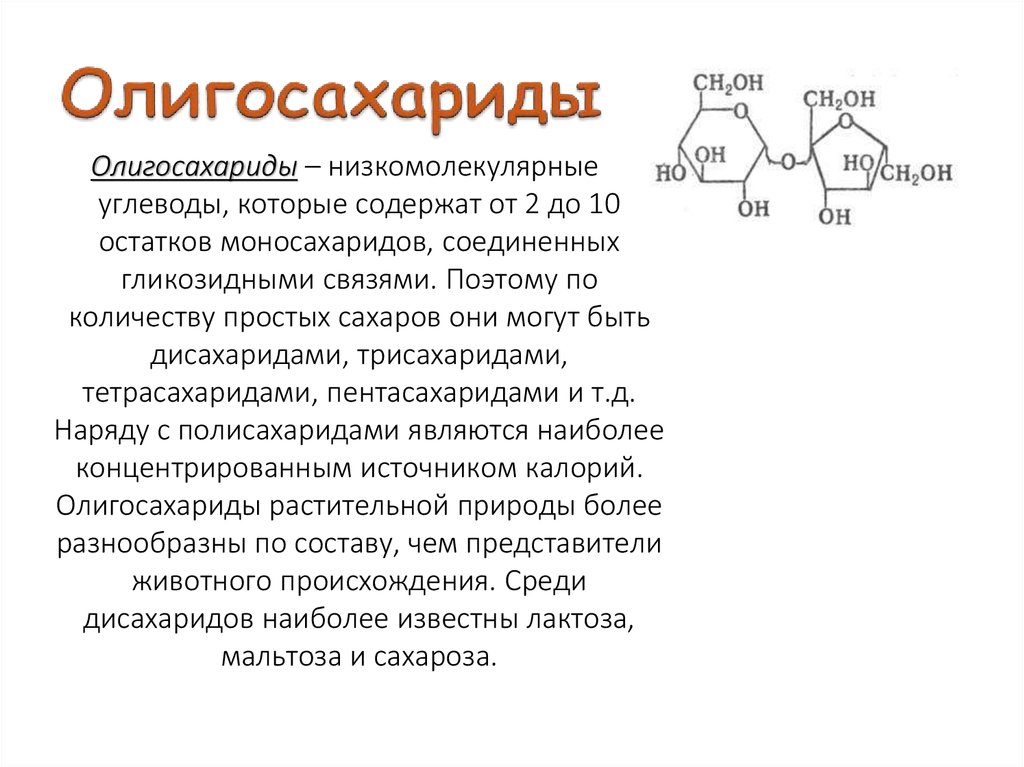 Поверхностные слои Chondrococcus columnaris, J. Cell Biol. 35 : 37–50.
Поверхностные слои Chondrococcus columnaris, J. Cell Biol. 35 : 37–50. Г., 1981, Взаимодействие бактерий и грибов с лектинами и лектиноподобными веществами, Annu. Преподобный Микробиолог. 35 : 85–112.
Г., 1981, Взаимодействие бактерий и грибов с лектинами и лектиноподобными веществами, Annu. Преподобный Микробиолог. 35 : 85–112. Cell Biol. 32 : 27–53.
Cell Biol. 32 : 27–53. F., Abul-Haj, S.K., 1951, Усовершенствованный метод гистохимического выявления кислых мукополисахаридов в тканях, Arch. Патол. 52 : 189–194.
F., Abul-Haj, S.K., 1951, Усовершенствованный метод гистохимического выявления кислых мукополисахаридов в тканях, Arch. Патол. 52 : 189–194.
 Histochem. Цитохим. 26 : 55–61.
Histochem. Цитохим. 26 : 55–61.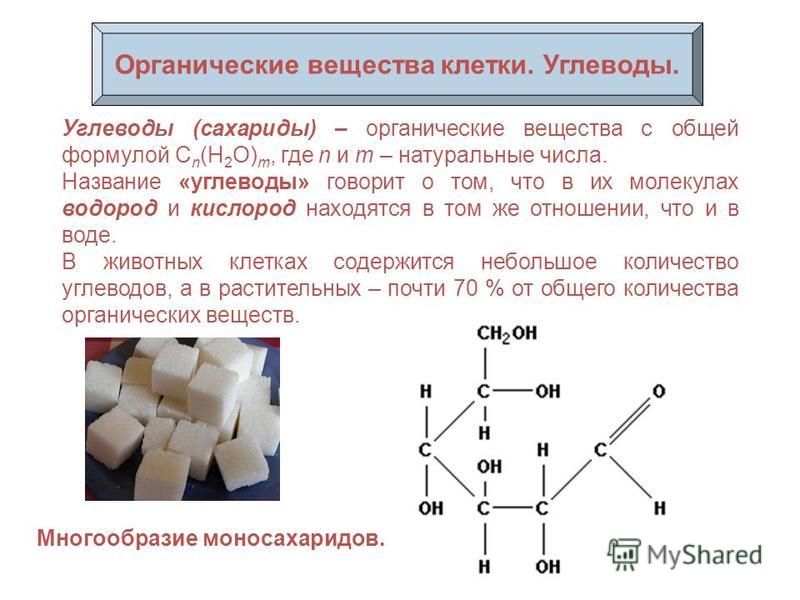 Microsc. (Оксфорд) 119 : 373–381.
Microsc. (Оксфорд) 119 : 373–381. Его усиление за счет использования фиксаторов, содержащих альциановый синий или хлорид цетилпиридиния, J. Cell Biol. 51 : 611–620.
Его усиление за счет использования фиксаторов, содержащих альциановый синий или хлорид цетилпиридиния, J. Cell Biol. 51 : 611–620.
 P., Ovtracht, L., 1979, Дифференциальная характеристика карбоксильных и сульфатных групп в тонких срезах для электронной микроскопии, Biol. Клетка. 36 : 281–288.
P., Ovtracht, L., 1979, Дифференциальная характеристика карбоксильных и сульфатных групп в тонких срезах для электронной микроскопии, Biol. Клетка. 36 : 281–288. , Brillouet, J.-M., and Satiat-Jeunemaitre, B., 1983, Ультраструктурная визуализация ксиланов в клеточных стенках твердой древесины с помощью комплекса ксиланаза-золото, Biol. Клетка. 49 : 179–182.
, Brillouet, J.-M., and Satiat-Jeunemaitre, B., 1983, Ультраструктурная визуализация ксиланов в клеточных стенках твердой древесины с помощью комплекса ксиланаза-золото, Biol. Клетка. 49 : 179–182. Cell Biol. 30 : 299–315.
Cell Biol. 30 : 299–315.
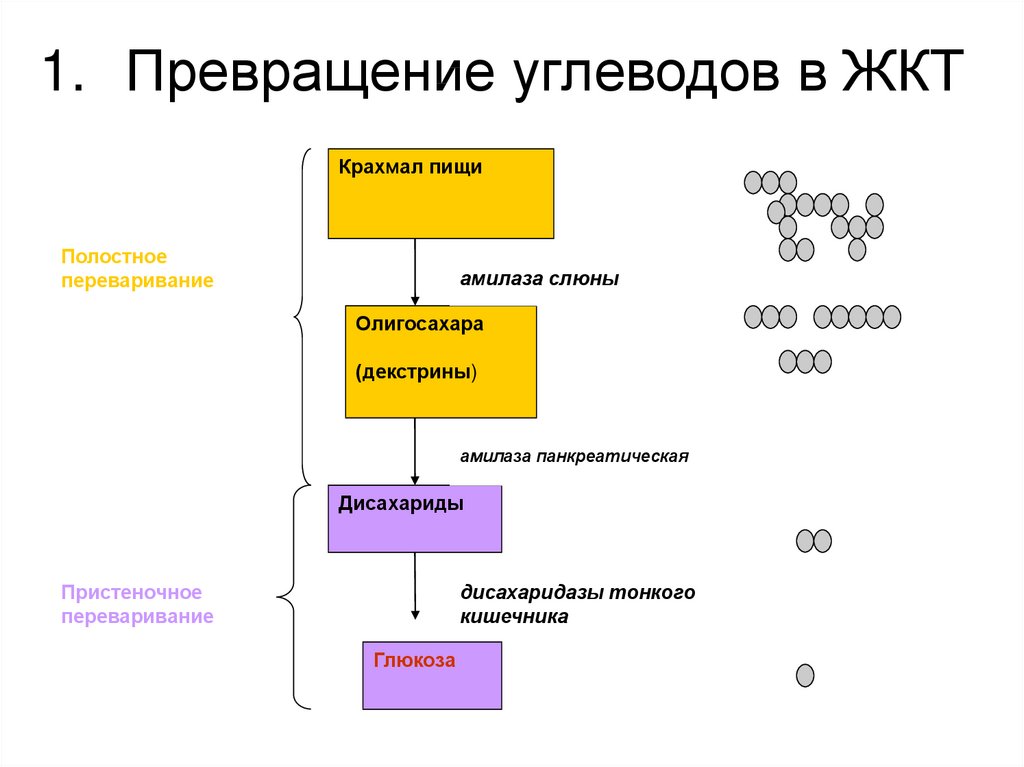 Фотосинтетические мембраны состоят примерно на 85% из нейтральных гликоглицеролипидов [6]. нейтральные гликоглицериновые липиды можно разделить на неацилированные или ацилированные гликозидные фрагменты.
Фотосинтетические мембраны состоят примерно на 85% из нейтральных гликоглицеролипидов [6]. нейтральные гликоглицериновые липиды можно разделить на неацилированные или ацилированные гликозидные фрагменты. Янагисава. Мембранные гликолипиды стволовых клеток. Письма ФЭБС, 584 (2010), с. 1694
Янагисава. Мембранные гликолипиды стволовых клеток. Письма ФЭБС, 584 (2010), с. 1694 J Biol Chem 266: 17552-17558.
J Biol Chem 266: 17552-17558. J Biol Chem 271: 19251–19255.
J Biol Chem 271: 19251–19255.