Синдром лизиса опухоли — вместе
Что такое синдром лизиса опухоли?
Синдром лизиса опухоли (СЛО) — это серьезное осложнение, которое может развиваться на ранних этапах лечения рака. Когда раковые клетки погибают и разрушаются, они выделяют в кровь различные вещества, в том числе калий, фосфор и нуклеиновые кислоты. Высокие концентрации этих веществ провоцируют метаболические нарушения, которые могут нанести вред сердцу, почкам, печени и другим органам. Синдром лизиса опухоли может угрожать жизни и считается неотложным состоянием.
Чаще всего синдром лизиса опухоли развивается у пациентов с неходжкинскими лимфомами или лейкозами. Однако он может встречаться при лечении любой быстрорастущей злокачественной опухоли. Если после начала лечения рака развивается синдром лизиса опухоли, это происходит, как правило, в течение 1–3 дней. У некоторых пациентов подобные метаболические нарушения могут наблюдаться даже до начала лечения ввиду быстрого обновления раковых клеток. Состояние может быстро прогрессировать и требует немедленного медицинского вмешательства. Для отслеживания и лечения метаболических нарушений прежде, чем они станут проблемой или спровоцируют физические симптомы, проводят частые анализы крови.
Для отслеживания и лечения метаболических нарушений прежде, чем они станут проблемой или спровоцируют физические симптомы, проводят частые анализы крови.
Пациенты с определенными онкологическими заболеваниями, такими как лимфома Беркитта, острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), или с другими факторами риска находятся под пристальным наблюдением в течение первой фазы лечения. Профилактическое лечение может включать инфузионную терапию для поддержания баланса жидкостей и назначение таких лекарственных препаратов, как расбуриказа или аллопуринол, позволяющих устранить избыток мочевой кислоты и лантана, а также гидроксид алюминия (Амфожель®) для нормализации уровня фосфора.
Диагностика синдрома лизиса опухоли
Синдром лизиса опухоли может привести к необратимому повреждению органов или даже внезапной смерти, поэтому врачи будут тщательно следить за состоянием детей из группы высокого риска.
Диагностика синдрома лизиса опухоли проводится на основании анализов крови. Врачи оценивают ряд отклонений, в том числе:
Врачи оценивают ряд отклонений, в том числе:
- Повышенный уровень калия
- Повышенный уровень мочевой кислоты
- Повышенный уровень фосфора
- Низкий уровень кальция
Симптомы синдрома лизиса опухоли
Симптомы синдрома лизиса опухоли обусловлены метаболическими нарушениями в организме. Дети с высоким риском развития синдрома лизиса опухоли должны находиться под тщательным наблюдением. В большинстве случаев метаболические нарушения корректируют еще до развития симптомов. Тем не менее, синдром лизиса опухоли может характеризоваться следующими симптомами:
- Тошнота
- Рвота
- Диарея
- Потеря аппетита
- Судороги
- Нарушения сердечного ритма
- Мышечные судороги или спазмы
- Обморок
- Слабость
- Повышенная утомляемость или вялость
- Боль в животе или спине
- Задержка жидкости в организме, отечность
Многие из этих симптомов могут быть также побочными эффектами химиотерапии или иметь другие причины.
Синдром лизиса опухоли возникает вследствие внезапного выброса клеточного содержимого в кровь, что приводит к нарушению метаболического равновесия в организме. В норме вещества, которые не могут быть использованы организмом, фильтруются из крови почками. Затем они выводятся из организма с мочой. Это позволяет организму поддерживать химический баланс. Если много раковых клеток погибает одновременно, организм не успевает вывести все вещества и они начинают накапливаться. Эти метаболические нарушения могут спровоцировать ряд проблем.
| Метаболическое нарушение | Влияние на организм |
|---|---|
| Высокий уровень калия (гиперкалиемия) | Нарушения в работе сердца, проблемы с мышцами, повышенная утомляемость, остановка сердца, внезапная смерть |
| Высокий уровень мочевой кислоты (гиперурикемия) | Повреждение почек, почечная недостаточность |
| Высокий уровень фосфатов (гиперфосфатемия) | Повреждение почек, мышечные судороги, проблемы с сердцем |
| Низкий уровень кальция (гипокальцемия) | Тошнота, рвота, мышечные судороги, проблемы с сердцем, спутанное сознание |
Факторы риска развития синдрома лизиса опухоли
Чаще всего синдром лизиса опухоли у детей встречается при таких онкологических заболеваниях, как лейкоз или лимфома Беркитта, острый лимфобластный лейкоз (ОЛЛ) и хронический миелоидный лейкоз (ХМЛ).
Выделяют следующие факторы риска развития синдрома лизиса опухоли:
- Быстрорастущая злокачественная опухоль
- Рак, быстро отвечающий на химиотерапию
- Большой размер опухоли
- Поздняя стадия онкологического заболевания
- Высокая опухолевая нагрузка
Врачи оценивают опухолевую нагрузку с учетом размера опухоли, количества лейкоцитов, уровня лактатдегидрогеназы (ЛДГ) и вовлечения костного мозга.
Кроме того, риск повышается при наличии определенных особенностей организма пациента. К ним относятся:
- Высокий уровень мочевой кислоты или фосфатов до начала лечения
- Нарушения в работе почек
- Выделение малого количества мочи
- Моча кислой реакции
- Низкое артериальное давление
- Обезвоживание
- Опухоль средостения
- Увеличение селезенки
Синдром лизиса опухоли чаще всего развивается в ответ на интенсивную терапию рака. Виды лечения, которые ассоциируются с развитием синдрома:
- Комбинированная химиотерапия
- Кортикостероиды
- Лучевая терапия
Профилактика и лечение синдрома лизиса опухоли
Врачи могут проводить мероприятия, направленные на профилактику синдрома лизиса опухоли и лечение развивающихся метаболических нарушений. С целью профилактики у детей с высоким риском применяются инфузионная терапия для поддержания баланса жидкостей и различные лекарственные препараты. Некоторым пациентам перед началом агрессивной терапии на короткое время может быть назначена менее интенсивная химиотерапия, чтобы лизис опухоли происходил медленнее. Это позволяет упростить его лечение, помочь организму поддерживать химический баланс и предотвратить повреждение почек. Ведение синдрома лизиса опухоли включает контроль результатов анализов крови, лечение конкретных метаболических нарушений и поддержку работы почек.
С целью профилактики у детей с высоким риском применяются инфузионная терапия для поддержания баланса жидкостей и различные лекарственные препараты. Некоторым пациентам перед началом агрессивной терапии на короткое время может быть назначена менее интенсивная химиотерапия, чтобы лизис опухоли происходил медленнее. Это позволяет упростить его лечение, помочь организму поддерживать химический баланс и предотвратить повреждение почек. Ведение синдрома лизиса опухоли включает контроль результатов анализов крови, лечение конкретных метаболических нарушений и поддержку работы почек.
Контроль результатов лабораторных анализов и симптомов
Необходимо тщательно отслеживать состояние пациентов с высоким риском развития синдрома лизиса опухоли, особенно на первой неделе лечения. Своевременная медицинская помощь может снизить токсическое воздействие на организм.
Мониторинг синдрома лизиса опухоли должен включать следующее:
- Оценка симптомов
- Измерение объема мочи при мочеиспускании
- Проведение лабораторных анализов для определения уровней калия, фосфатов, кальция, мочевой кислоты, азота мочевины крови (АМК), креатинина и лактатдегидрогеназы
План наблюдения зависит от того, относится ли пациент к группе высокого, промежуточного или низкого риска.
Инфузионная терапия для поддержания баланса жидкостей
Как правило, инфузионная терапия с введением жидкости начинается с момента постановки диагноза и продолжается в течение всего курса химиотерапии. Адекватное восполнение потери жидкости имеет большое значение для профилактики дисбаланса химических веществ в крови и поддержания работы почек. Пациенты со сниженным суточным объемом мочи подлежат тщательному наблюдению. Некоторым пациентам может потребоваться назначение мочегонных лекарственных препаратов (диуретиков) или даже диализ, чтобы фильтровать кровь до восстановления надлежащей работы почек.
Лекарственные препараты для снижения уровня мочевой кислоты
К лекарственным препаратам для лечения повышенного уровня мочевой кислоты (гиперурикемии) при синдроме лизиса опухоли у детей относятся аллопуринол и расбуриказа.
Аллопуринол предотвращает образование мочевой кислоты. Как правило, пациенты принимают аллопуринол за 2–3 дня до начала химиотерапии и продолжают прием в течение 10–14 дней. Этот лекарственный препарат в основном используется для профилактики.
Этот лекарственный препарат в основном используется для профилактики.
Расбуриказа разрушает мочевую кислоту и снижает ее концентрацию в крови. Препарат действует быстро, как правило, в течение 4 часов. Расбуриказа может использоваться для профилактики и лечения высоких концентраций мочевой кислоты. Однако этот препарат противопоказан пациентам с дефицитом Г6ФДГ. Кроме того, расбуриказа дороже аллопуринола и доступна не везде.
Лекарственные препараты для снижения концентрации фосфатов
Для снижения концентрации фосфатов в крови могут назначаться определенные лекарственные препараты. Эти т. н. фосфат-связывающие препараты соединяются с фосфатной группой и препятствуют ее всасыванию из пищеварительного тракта. Примерами таких лекарственных препаратов служат лантан и гидроксид алюминия (Амфожель®).
Лечение электролитного дисбаланса
Электролитный дисбаланс (повышение уровней калия и фосфатов и снижение уровня кальция) зачастую может устраняться путем поддержания работы почек. Однако эти нарушения могут представлять непосредственную угрозу для пациента и требовать специфического лечения. Важнейшее значение имеет адекватное восполнение потери жидкости. Во время лечения синдрома лизиса опухоли следует исключить некоторые электролиты из растворов для инфузионной терапии.
Однако эти нарушения могут представлять непосредственную угрозу для пациента и требовать специфического лечения. Важнейшее значение имеет адекватное восполнение потери жидкости. Во время лечения синдрома лизиса опухоли следует исключить некоторые электролиты из растворов для инфузионной терапии.
Диализ
Наиболее частым осложнением синдрома лизиса опухоли является повреждение почек. Повышенная концентрация мочевой кислоты приводит к образованию кристаллов в почечных канальцах — небольших структурах почек, которые фильтруют кровь. Каждый этап лечения — восполнение потери жидкости, назначение диуретиков, профилактический прием аллопуринола или расбуриказы — направлен на защиту почек. Однако даже при оказании надлежащей медицинской помощи работа почек может быть нарушена. Пациентам может потребоваться диализ, чтобы фильтровать кровь до тех пор, пока почки не восстановятся. У большинства пациентов функция почек со временем медленно восстанавливается. Однако у некоторых синдром лизиса опухоли может привести к необратимому повреждению почек, даже несмотря на профилактические мероприятия.
—
Онлайн-ресурс Together не является рекламой каких-либо из фирменных продуктов, упомянутых в этой статье.
—
Дата изменения: декабрь 2018 г.
Злокачественные опухоли костей и доброкачественные, их симптомы и классификации в статье травматолога Николенко В. А.
Над статьей доктора Николенко Виталия Александровича работали литературный редактор Маргарита Тихонова, научный редактор Сергей Федосов
Дата публикации 28 марта 2019Обновлено 26 апреля 2021
Определение болезни.
 Причины заболевания
Причины заболеванияНовообразование кости — это очаг изменённых клеток, не характерных для здорового организма, возникающий в любой части скелета.
Несмотря на своё аномальное строение, изменённые клетки сохраняют способность к делению, как и в обычных тканях. По своему строению они значительно отличаются от здоровых клеток костной ткани, что приводит к изменению свойств самой кости и характерной для неё функции. Данная группа клеток склонна к неконтролируемому, зачастую быстрому размножению, в результате чего размеры новообразования увеличиваются.[6]
Новообразование кости принято называть опухолью. Так, ранее здоровая костная ткань при росте новообразования может вымещаться опухолевыми клетками. Более того, отдельные опухолевые клетки могут метастазировать — покидать место первичного нахождения через кровь или лифу и давать начало новообразованиям в других, зачастую отдалённых анатомических областях.[13] Метастазы приводят только к злокачественным опухолям — образованиям, склонным к быстрому росту, которые нарушают общее состояние организма и становятся причиной плохого прогноза для жизни пациента. [7]
[7]
Известно, что источником злокачественной опухоли костей может стать любая опухоль, расположенная в другой части организма (например, опухоль внутренних органов).[14] Происходит это путём метастазирования.[8] Однако большая часть новообразований костей (как доброкачественных, так и злокачественных) появляется как первичная опухоль, то есть возникает и развивается в одном и том же месте.
В целом новообразование кости — многопричинное заболевание. Достоверных фактов, объясняющих его возникновение, в настоящее время нет. Условия для его развития складываются из многих компонентов:
- иммунодефицит;
- врождённые нарушения тканей;
- мутагенные окружающие факторы;
- гормональные нарушения;
- сопутствующие заболевания.
Так или иначе, в организме происходит сбой, и его защитная система перестаёт отличать чужеродные, аномально возникшие клетки от собственных неизменённых и «полезных» клеток. Это даёт возможность опухолевым клеткам размножаться, нарушая естественную структуру и анатомию кости.[6][14]
Это даёт возможность опухолевым клеткам размножаться, нарушая естественную структуру и анатомию кости.[6][14]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы новообразования кости
Симптомы новообразования кости разделяются на местные и общие. Они должны быть подтверждены инструментальными и лабораторными методами.
Местные симптомы вызваны непосредственно появлением новообразования. Они, как правило, носят механический характер, т. е. визуально заметны. Например, под кожей новообразование контурируется.[13] Сама кожа над очагом может быть изменена — отличаться богатым сосудистым рисунком, становиться ограниченно отёчной или уплотнённой.
Новообразование определяется на ощупь как дополнительная ткань, зачастую безболезненная, но структурированная. Её границы либо их отсутствие можно также установить при ощупывании. Злокачественные новообразования отличаются бугристой поверхностью и неправильной формой.[6]
Злокачественные новообразования отличаются бугристой поверхностью и неправильной формой.[6]
Если опухоль расположена околосуставно, то она ограничивает движения, вызывает стойкую боль, нарушение чувствительности и непроходящие отёки, сдавливая нервные и сосудистые стволы.[9] А из-за реакции лимфатической системы увеличиваются регионарные лимфатические узлы.
Часто местные симптомы симулируют другие заболевания опорно-двигательного аппарата, заводя в тупик клиницистов, которые рассматривают симптомы в отрыве от общей картины заболевания.[9]
В зависимости от вида новообразования местная симптоматика может быть очень скудной, вплоть до её отсутствия.[7]
Общие симптомы характерны преимущественно для злокачественных новообразований костей. К ним относятся все проявления, возникающие в организме от пагубного влияния опухоли — интоксикации (отравления организма продуктами деятельности опухоли). Они разнообразны и неспецифичны.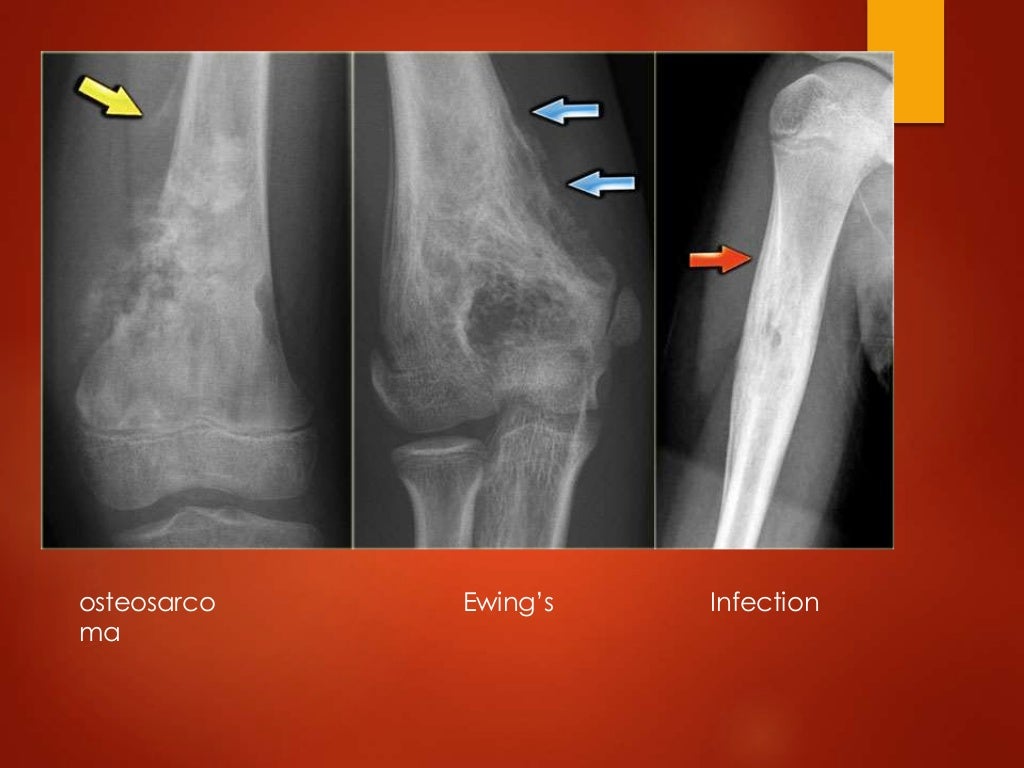 К ним относятся:
К ним относятся:
- лихорадка;
- потеря веса;
- общая слабость;
- нарушение сна и аппетита;
- ночная потливость;
- снижение работоспособности;
- астения (бессилие).[8]
Часто даже небольшое новообразование может вызвать общие симптомы ещё до того, как опухоль проявит себя местно. Однако есть небольшой процент опухолей костей, которые являются случайной находкой при рентгенографии или томографии по другому поводу.[4]
Патогенез новообразования кости
Патогенез новообразований костей изучен не в полной мере в силу своей сложности.
Причина новообразования — нарушение дифференцировки (развития) клеток. Это означает, что иммунная система организма по какой-то причине не уничтожила случайно возникшие атипичные клетки, отличающиеся от нормальной костной ткани. Это дало начало формированию новообразования, состоящего из недифференцированных (не имеющих специфичного строения) клеток, по структуре напоминающих несозревшую клетку.
Устройство таких клеток определяет свойства опухоли. Так, если строение клетки новообразования близко к нормальному, то опухоль носит доброкачественный характер.[9] В обратном случае новообразование является злокачественным.[15]
Опухоли свойственно изменение антигенного состава клеток, их бесконтрольный рост и деление. Вместе с утратой специфичной структуры клетки, теряется и её функция, новообразование кости агрессивно увеличивается в размерах, разрушая окружающие ткани.
Отличия злокачественного и доброкачественного новообразований — в инвазии (проникновении) опухоли в окружающую здоровую ткань.[6] Доброкачественная опухоль сохраняет отграниченность, не прорастая в здоровые структуры. Оно не обладает тенденцией к быстрому росту и распространению в другие области организма, а также не склонно к распаду (произвольному саморазрушению) с характерной интоксикацией (отравлением) организма продуктами распада. [7][9]
[7][9]
Вне зависимости от доброкачественности костного новообразования нарушается структура кости, в результате чего она теряет свою прочность. Это чревато патологическим переломом кости — перелом в зоне новообразования от минимальной нагрузки.
Стоит отметить, что доброкачественность образования может быть условна, так как известно явление малигнизации — перерождения доброкачественной опухоли в злокачественную.[9]
Классификация и стадии развития новообразования кости
Классификация костных новообразований обширна из-за массы вариантов клеточного строения. Основное значение имеет классификация по морфологии опухоли, т. е. её клеточному составу. Она одинаково актуальна для практикующих онкологов, патологоанатомов и рентгенологов.
Данная классификация разграничивает два вида новообразований:
- остеогенные опухоли — новообразования, возникшие из костных клеток;
- неостеогенные (некостные) опухоли — новообразования в кости, возникающие под влиянием клеток других видов, например, сосудистой или соединительной ткани.
 [9]
[9]
Также выделяют доброкачественные и злокачественные опухоли костей. Доброкачественные опухоли, как правило, растут медленно и не распространяются в организме. Злокачественные опухоли костей быстро развиваются, разрушают близлежащие ткани и поражают всё тело.
Доброкачественные опухоли:
- Остеобластокластома (доброкачественная гигантоклеточная опухоль кости) часто встречается во взрослом возрасте. Поражает преимущественно кости ног. Несмотря на доброкачественность, опухоль агрессивно растёт, разрушает и истончает костную ткань, что вынуждает проводить хирургическое лечение.
- Хондробластома встречается редко, поражает метаэпифизы трубчатых костей. Опухоль может долго развиваться без симптомов, но затем появляется боль и нарушаются функции поражённого сустава.
- Хондромиксофиброма — редкая опухоль, её выявляют в основном у пациентов 20–30 лет. Локализуется в длинных трубчатых костях, хотя содержит и хрящевую ткань.
 Новообразование растёт медленно, но способно разрушать кости, приводя к их переломам.
Новообразование растёт медленно, но способно разрушать кости, приводя к их переломам. - Энхондрома — опухоль, которая растёт внутрь костномозгового канала. Она появляется в молодом возрасте, протекает без симптомов и редко становится злокачественной, но требует наблюдения. Боль в области энхондромы может говорить об её озлокачествлении.
- Неоссифицирующая фиброма (фиброзный кортикальный дефект, фиброксантома) — опухоль из соединительной ткани, замещающей костную ткань. При малом размере её называют фиброзным кортикальным дефектом. Опухоль малоагрессивна, но требует наблюдения.
- Остеобластома — редкая опухоль, которая встречается преимущественно в губчатых костях, медленно, но обширно замещая нормальную костную ткань. Рост опухоли сопровождается значительным разрушением здоровой кости и требует хирургического лечения с установкой трансплантата.
- Остеохондрома — наиболее распространённая доброкачественная опухоль костной ткани.
 Её часто случайно обнаруживают при рентгенографии. Опухоль рекомендуется удалять только при сдавлении окружающих структур либо при подозрении на озлокачествление.
Её часто случайно обнаруживают при рентгенографии. Опухоль рекомендуется удалять только при сдавлении окружающих структур либо при подозрении на озлокачествление. - Остеоидная остеома — локализуется в различных участках скелета. Может вызывать боль, которая легко снимается противовоспалительными средствами.
- Аневризматическая костная киста — образуется и растёт в основном в метафизах костей. Она схожа со злокачественными опухолями, поэтому требует настороженности при диагностике.
- Однокамерная костная киста — кистозная полость в кости, встречаемая у детей. Характерный для неё рост и истончение костной ткани часто приводят к переломам. Однако отдельные небольшие кисты не вызывают симптомов и не угрожают здоровью.
- Фиброзная дисплазия — очаги повреждения соединительной ткани, которые возникают в костях в виде кистозных образований. Часто встречаются множественные поражения костей и иные сопутствующие аномалии фиброзной ткани вне скелета.

К злокачественным опухолям костей относятся:
- Остеогенная саркома — для неё характерно бессимптомное начало, бурный рост и раннее метастазирование. Опухоль выявляют в основном у пациентов 12–35 лет. Она интенсивно поражает трубчатые кости, что создаёт трудности при хирургическом лечении.
- Хондросаркома — менее злокачественная опухоль, чем остеогенная саркома. Развивается из хрящевой ткани, может переродиться из доброкачественной опухоли. Поражает как трубчатые, так и плоские кости. Метастазирует, но растёт медленно, что позволяет своевременно выявить её и приступить к лечению.
- Саркома Юинга — злокачественная опухоль, которая поражает нижнюю часть длинных трубчатых костей, рёбра, таз, лопатку, позвоночник и ключицу. Является одной из самых агрессивных злокачественных опухолей.
Прогностически важна классификация по степени дифференцировки клеток опухоли. Она показывает, насколько сохранились специфичные черты клеток, характерные для здоровой кости. Исходя из этой классификации, формируется деление опухолей по степени злокачественности: чем меньше дифференцированность клеток, тем больше их злокачественность.[3]
Она показывает, насколько сохранились специфичные черты клеток, характерные для здоровой кости. Исходя из этой классификации, формируется деление опухолей по степени злокачественности: чем меньше дифференцированность клеток, тем больше их злокачественность.[3]
Клиническая классификация стадий развития новообразования костей даёт представление о прогнозе заболевания и предпочтительном алгоритме лечения. Она соответствует общепринятой международной системе TNM, где:
- T — размер опухоли;
- N — поражение прилежащих лимфоузлов;
- M — наличие метастазов.
Каждый из предложенных критериев имеет стадийность, например:
- опухоль T1 размером от 3 до 5 см остаётся в пределах кости и одного мышечно-фасциального сегмента;
- опухоль T2 прорастает не более чем на 10 см вдоль кости, но в пределах одного фасциального футляра;
- опухоль T3 выходит за пределы одного мышечно-фасциального футляра, прорастая в прилежащий;
- опухоль T4 представляется как новообразование, проросшее через кожу или сосудисто-нервные стволы.
 [15]
[15]
Аналогичным способом классифицируются критерии поражённости лимфоузлов и признак метастазирования.
Также применяется система стадирования, предложенная W. Enneking. Для злокачественных и доброкачественных опухолей она разная.
Стадирование доброкачественных опухолей костей по Enneking
| Стадия | G | T | M |
|---|---|---|---|
| 1. Латентная | G0 | T0 | 0 |
| 2. Активная | G0 | T1 | 0 |
| 3. Агрессивная | G0 | T2 | 0-1 |
Стадирование злокачественных опухолей костей по Enneking
| Стадия | G | T | M |
|---|---|---|---|
| IA IB | G1 G1 | T1 T2 | М0 М0 |
| IIA IIB | G2 G2 | T1 T2 | M0 M0 |
| III A-B | G1-2 | T1-2 | M1 |
G0 — доброкачественная опухоль; G1 — средняя степень злокачественности; G2 — высокая степень злокачественности.
T0 — доброкачественная опухоль, ограниченная капсулой; Т1 — доброкачественная или злокачественная опухоль без капсулы в пределах одного анатомического участка; Т2 — доброкачественная или злокачественная опухоль без капсулы, которая вышла за пределы одного анатомического участка.
М0 — отсутствие метастазов; M1 — наличие метастазов.
Осложнения новообразования кости
К осложнениям новообразований кости относят любую чрезмерную активность опухоли, особенно после длительного периода спокойствия. В случае ранее установленной доброкачественного новообразования это могут быть признаки злокачественного перерождения опухоли.
К другим осложнениям относят быстрый рост опухоли, в том числе с прорастанием в уязвимые анатомические структуры:
- Прорастание в нервный ствол вызывает неприятное осложнение в виде нейропатической боли, связанной с воздействием на крупный нерв. Она крайне затруднительно снимается медикаментами, истощая пациента.[13]
- Прорастание в стенку сосуда может вызвать внезапное массивное кровотечение и формирование гематомы.

Вероятны и осложнения, связанные с дисфункцией сегмента, которой раньше не возникало. Рост опухоли в таком случае препятствует функционированию опорно-двигательного аппарата, ограничивая объём движений и вызывая их болезненность.[3]
К частым осложнениям также относят патологические переломы на фоне новообразования. При этом на пациента не действуют значительные травмирующие силы, но перелом наступает по причине несостоятельной и хрупкой костной ткани. Происходит это в зоне длительно текущего разрушения кости новообразованием.[4]
Также существуют специфические общие и местные осложнения, характерные для злокачественных новообразований:
- возникновение отдалённых и регионарных метастазов;
- появление интоксикации.
Обнаружение метастазов спустя время после первичного обследования говорит о малой эффективности лечения и прогрессировании опухолевого роста.
Интоксикация относится к тягостному для пациента, но предсказуемому осложнению опухолевого процесса. [14]
[14]
Как отдельный вид осложнений расценивают возникновение нового опухолевого или общего заболевания при химио- или лучевой терапии костного новообразования.
Диагностика новообразования кости
Диагностический алгоритм включает опрос пациента, детализацию жалоб и уточнение анамнеза. Особое внимание стоит обращать на лихорадку, потерю массы тела, нарушение аппетита и другие общие проявления. Также уточняется время, прошедшее с момента обнаружения костного новообразования, наличие и интенсивность его роста.[8]
При осмотре оценивается размер образования, его структура, локализация и изменения кожи. Прощупываются области регионарных лимфоузлов для оценки возможных изменений — увеличение лимфоузлов, их спаянность с окружающей тканью и друг с другом.
Лабораторный поиск начинается с общего и биохимического анализа крови: определения щелочной фосфатазы, фосфатов и кальция.[1] Эти анализы дают оценочную информацию.
Существуют лабораторные маркеры резорбции (растворения) кости, которые подтверждают преобладание процесса распада кости (возможно, в очаге опухоли). [9]
[9]
Но их диагностическое значение, к сожалению, ограничено, так как резорбция кости может происходить и при других состояниях, не связанных с опухолью кости.
Инструментальная диагностикаСамый доступный, быстрый и показательный инструментальный метод диагностики — рентгенография. Выполненный в двух проекциях рентген-снимок даёт представление не только о размерах и локализации костного новообразования, но и о его разновидности.[3]
Более детальная и чувствительная визуализация новообразований костей — компьютерная томография.[16] Она особо актуальна при опухолях суставов и костных опухолях малых размеров, плохо различимых на обыкновенных рентген-снимках.[8]
В качестве скрининга (поискового оценочного метода) используют сцинтиграфию — сканирование костей после внутривенного введения радиоактивного изотопа. Изотоп накапливается в костном новообразовании, заставляя последний «светиться» на экране сканера. Этот метод даёт информацию о наличии опухолей скелета и их количестве. Он также эффективен и для раннего выявления метастазов в костях у онкобольных.[6] Однако отличить доброкачественную опухоль от злокачественной и тем более определить вид опухоли на сцинтиограмме невозможно.[16]
Этот метод даёт информацию о наличии опухолей скелета и их количестве. Он также эффективен и для раннего выявления метастазов в костях у онкобольных.[6] Однако отличить доброкачественную опухоль от злокачественной и тем более определить вид опухоли на сцинтиограмме невозможно.[16]
Примечательно, что лучевые методы диагностики новообразований не дают право достоверно диагностировать конкретный вид костной опухоли. Даже при всех рентген-признаках, говорящих в пользу определённой опухоли, решающее значение вносит только исследование опухоли под микроскопом.
Для микроскопии клетки получают при помощи биопсии — забора части опухоли. Для этого используется пункционная биопсия, когда кость получают широкой иглой, или инцизионная биопсия — забор опухоли хирургическим путём, т.е отсечением её части.[16]
Часто биопсия выполняется во время операции сразу же с получением предварительного результата. Это даёт возможность определиться с объёмами операции. [2]
[2]
Лечение новообразования кости
Лечение новообразований костей может быть хирургическим и консервативным. С учётом возможного роста любой обнаруженной опухоли, риска её озлокачествления и отсутствия тенденций к самопроизвольному излечению предпочтение отдаётся хирургии.[1][7]
Однако существует ряд опухолей, не склонных к увеличению в размерах и нарушению функции поражённого сегмента. К тому же риск ракового перерождения может быть минимальным. В таком случае применима консервативная тактика лечения.[10] В большинстве случаев она состоит в наблюдении и регулярном обследовании, чтобы убедиться в отсутствии активности новообразования.
Хирургическое лечение заключается в удалении опухоли. Если речь идёт о злокачественном новообразовании, то основная задача хирурга — проведение радикальной операции.[16] Опухоль должна быть удалена полностью и бережно, чтобы не допустить распространения клеток новообразования во время операции.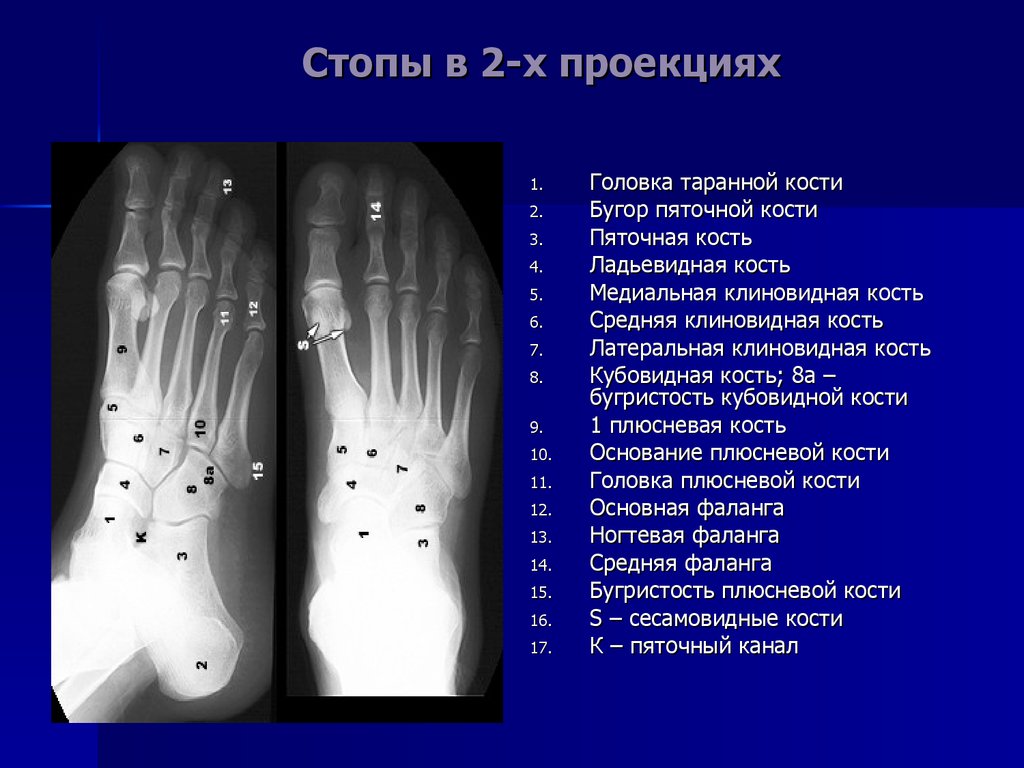 При попытке спасти жизнь оправдывают себя «калечащие» манипуляции — ампутации и экзартикуляции (вычленение по суставам).[11]
При попытке спасти жизнь оправдывают себя «калечащие» манипуляции — ампутации и экзартикуляции (вычленение по суставам).[11]
Если злокачественная опухоль дала метастазы в лимфатические узлы, то показано их иссечение.
Полное удаление новообразования кости в случае запущенного опухолевого процесса технически невозможно.[4] В этой ситуации выполняется операция, призванная облегчить состояние пациента.
Злокачественные костные новообразования лечатся комбинированно — с применением не только хирургии, но и химио- и лучевой терапии. Последние призваны подавить деление злокачественных опухолевых клеток и могут быть как дополнительными, так и самостоятельными методами лечения.
Решение о целях и методах лечения — в компетенции онколога. Лечебная тактика зависит от вида костного новообразования и его классификации по системе TNM.[12][15]
Хирургическое лечение доброкачественных новообразований костей отличается иными подходами. В подобных случаях практикуются «экономные» операции, сберегающие органы. Например, предпочтительно не удалять кость на протяжении, а выскабливать опухоль в пределах здоровых тканей либо удалять её компактным блоком.[1][10] После образовавшийся костный дефект замещается трансплантатом из стороннего материала или собственной кости, взятой из другой области.[2][5]
В подобных случаях практикуются «экономные» операции, сберегающие органы. Например, предпочтительно не удалять кость на протяжении, а выскабливать опухоль в пределах здоровых тканей либо удалять её компактным блоком.[1][10] После образовавшийся костный дефект замещается трансплантатом из стороннего материала или собственной кости, взятой из другой области.[2][5]
При снижении операционных рисков хирургическое лечение доброкачественных новообразований весьма эффективно.
Прогноз. Профилактика
Прогноз при новообразовании кости связан с клеточным составом опухоли. Очевидно, что угрозу для жизни несут злокачественные новообразования. Даже при адекватной лечебной тактике выживаемость пациентов в значительной мере зависит от вида опухоли и распространённости процесса.
Благоприятный прогноз при злокачественном новообразовании возможен в случае ранней диагностики, удобной локализации для хирургического пособия, чувствительности опухоли к препаратам и облучению.
Доброкачественные опухоли при определённых обстоятельствах могут иметь неблагоприятный прогноз.[16] К таким новообразованиям относятся доброкачественные опухоли с активным ростом и лизисом (разрушением) костной ткани.[10] За короткий период времени такие опухоли могут разрушить значительную площадь здоровой костной ткани. Это не только сопровождается интенсивной болью и снижением функции органа, но и грозит патологическим переломом. Хирургическое замещение костного дефекта в этом случае становится непростой задачей, а отсутствие консолидации (заживления) перелома — предсказуемым осложнением.[11]
Первичная профилактика новообразований костей сложна, так как опухоли, как правило, выявляются уже после появления жалоб. Обычно к этому моменту размер новообразования становится внушительным. При обнаружении доброкачественной опухоли действенной профилактикой является агрессивная хирургическая тактика, которая позволяет предотвратить её перерождение в злокачественное новообразование. [5]
[5]
Настороженность в отношении возникновения вторичных опухолей костей у онкобольных — шанс своевременной локализации метастазов. Вовремя выявленный метастаз может быть излечен малым вмешательством.[12]
Эффективного, безопасного и рационального метода профилактической оценки скелета на предмет опухолей в настоящее время нет.[17]
Миеломная болезнь костей | Лечение поражений костей
Миеломная болезнь костей может привести к тому, что кости станут тоньше и слабее (остеопороз), а также к появлению отверстий в костях (литические поражения). Ослабленная кость с большей вероятностью сломается при незначительном давлении или травме (патологический перелом). Наиболее часто поражаются кости позвоночника, таза, ребер, черепа и длинных костей рук и ног.
Миеломная болезнь костей может привести не только к переломам, но и к давлению на спинной мозг (сдавление спинного мозга), необходимости хирургического вмешательства для предотвращения или восстановления сломанных костей и/или необходимости лучевой терапии костей для контроля миелому и облегчить боль. Все вместе они известны как «события, связанные со скелетом».
Все вместе они известны как «события, связанные со скелетом».
Более чем у 80% пациентов с множественной миеломой во время болезни развиваются проблемы с костями; У 70% этих пациентов наблюдается потеря костной массы в позвоночнике.
Согласно официальному определению Международной рабочей группы по миеломе (IMWG) минимального объема повреждения костей, требующего терапии, является:
- более одного очагового поражения размером не менее 5 мм на МРТ или
- одно или несколько литических поражений костей, обнаруженных при КТ, включая низкодозную КТ всего тела или ПЭТ/КТ.
Что такое очаговые поражения?
Очаговые поражения — это ранние патологические участки в костном мозге, которые сигнализируют о развитии литического поражения в течение следующих 18–24 месяцев. В противном случае бессимптомный пациент, у которого МРТ показывает более 1 очагового поражения размером не менее 5 мм, имеет то, что называется «событием, определяющим миелому», и его следует лечить по поводу активного заболевания.
Что такое литические поражения?
Литические поражения — это области, где кость была разрушена, оставив в кости отверстие. Эти поражения позвоночника распространены и в тяжелых случаях могут привести к компрессионным переломам одного или нескольких позвонков, которые могут быть болезненными и даже привести к инвалидности. Литические поражения длинных костей голени или бедра могут потребовать хирургического вмешательства для укрепления и стабилизации кости.
Что вызывает литические поражения?
В здоровом скелете существует динамическое равновесие между разрушением старой костной ткани (выполняемым клетками, называемыми остеокластами), и строительством новой костной ткани (выполняемым клетками, называемыми остеобластами). Эти два действия — разрушение и наращивание костей — в тонком взаимодействии обеспечивают здоровье скелета.
Множественная миелома нарушает баланс остеокластов и остеобластов, разобщая их функции. Клетки миеломы продуцируют факторы, активирующие остеокласты, сигнализируя остеокластам о неконтролируемом разрушении костей.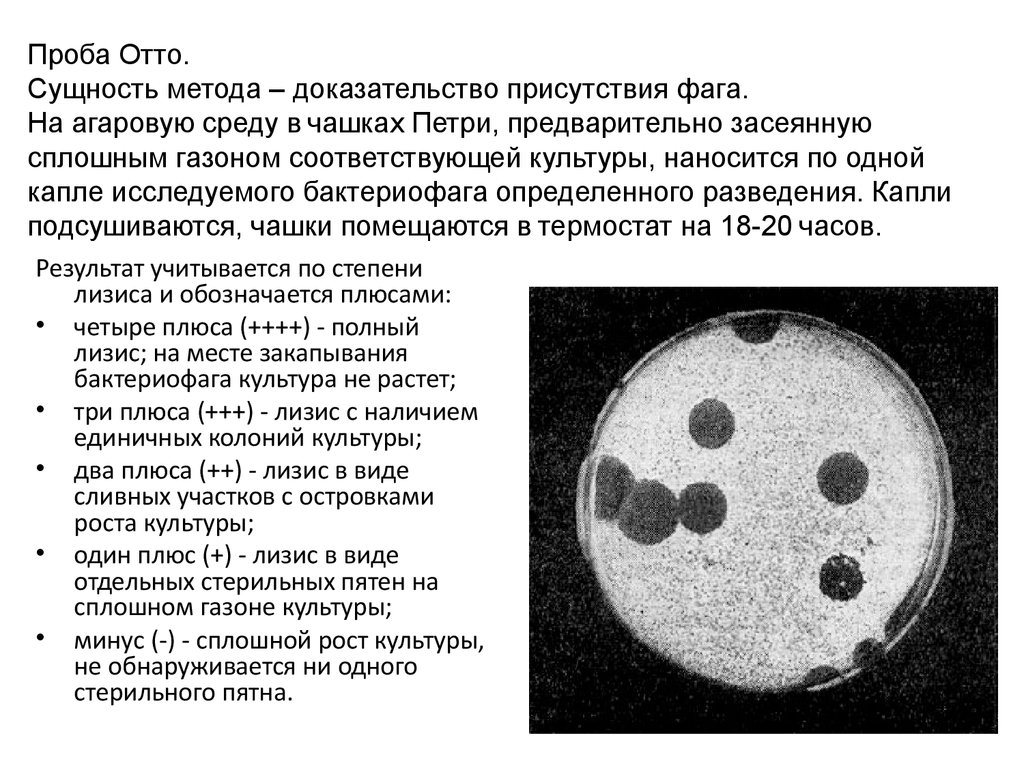 В то же время они предотвращают восстановление кости, подавляя образование остеобластов.
В то же время они предотвращают восстановление кости, подавляя образование остеобластов.
Результатом является слишком сильное разрушение костей и слишком малое их наращивание: кости ослабевают, что приводит к литическим поражениям, что, в свою очередь, может привести к патологическим переломам. Когда кости разрушаются, кальций высвобождается из костей в кровоток. Если это высвобождение происходит слишком быстро, может возникнуть состояние, называемое гиперкальциемией. Гиперкальциемия увеличивает разрушение костей и часто нарушает функцию почек.
Оценка заболевания костей
Для диагностики и мониторинга заболеваний костей при множественной миеломе используются различные типы визуализирующих исследований:
- Рентген: Несмотря на многочисленные ограничения, традиционное рентгенологическое исследование скелета остается стандартом медицинской помощи для диагностики заболеваний костей у пациентов с подозрением на миелому.
- КТ (компьютерная томография): В текущих рекомендациях NCCN (Национальной комплексной онкологической сети) обследование скелета или низкодозная компьютерная томография всего тела указаны в качестве предпочтительных исследований для диагностики миеломной болезни костей, что дает врачам выбор для проведения более чувствительных (и более дорого) исследование КТ, если доступно страховое возмещение.

- МРТ (магнитно-резонансная томография) является чувствительным исследованием для выявления ранних очаговых поражений в костном мозге.
- ПЭТ (позитронно-эмиссионная томография) используется для диагностики, прогнозирования и оценки ответа на лечение, часто в сочетании с КТ областей, которые обнаруживаются при ПЭТ. ПЭТ используется для оценки заболевания как в костях, так и в мягких тканях (экстрамедуллярное заболевание).
- Узнайте больше из этой публикации IMWG: Роль ПЭТ/КТ с 18F-ФДГ в диагностике и лечении множественной миеломы и других заболеваний плазматических клеток: консенсусное заявление Международной рабочей группы по миеломе
Наилучший подход к лечению заболеваний костей требует
1) эффективного лечения миеломы
2) использования поддерживающего «костемодифицирующего» лечения для предотвращения дальнейшей потери костной массы.
В настоящее время для лечения множественной миеломы доступны три таких средства, модифицирующих кость (BMA). Это не химиотерапия, и они не лечат множественную миелому. Они предотвращают дальнейшее повреждение костей и корректируют и/или предотвращают гиперкальциемию. Эти препараты также несут в себе риск развития остеонекроза челюсти (ОНЧ), поэтому перед началом лечения препаратами, модифицирующими кость, пациенты должны пройти стоматологическое обследование, а затем проходить стоматологические осмотры не реже одного раза в год. И Американское общество клинической онкологии (ASCO), и Национальная комплексная онкологическая сеть (NCCN) включают все три препарата в качестве вариантов лечения пациентов с множественной миеломой с заболеванием костей.
Это не химиотерапия, и они не лечат множественную миелому. Они предотвращают дальнейшее повреждение костей и корректируют и/или предотвращают гиперкальциемию. Эти препараты также несут в себе риск развития остеонекроза челюсти (ОНЧ), поэтому перед началом лечения препаратами, модифицирующими кость, пациенты должны пройти стоматологическое обследование, а затем проходить стоматологические осмотры не реже одного раза в год. И Американское общество клинической онкологии (ASCO), и Национальная комплексная онкологическая сеть (NCCN) включают все три препарата в качестве вариантов лечения пациентов с множественной миеломой с заболеванием костей.
- Aredia® (памидронат) и Zometa® (золедроновая кислота или золедронат) относятся к классу препаратов, называемых бисфосфонатами. Бисфосфонаты представляют собой небольшие неорганические молекулы, которые связываются с поверхностью поврежденных костей. В месте повреждения кости бисфосфонаты ингибируют и разрушают остеокласты. Их вводят внутривенно (в вену).
 У всех пациентов, принимающих бисфосфонаты, следует тщательно контролировать функцию почек, особенно у пациентов с известной почечной недостаточностью.
У всех пациентов, принимающих бисфосфонаты, следует тщательно контролировать функцию почек, особенно у пациентов с известной почечной недостаточностью. - Xgeva® (деносумаб) представляет собой моноклональное антитело, нацеленное на белок, контролирующий регенерацию и ремоделирование кости (RANK-лиганд или RANK-L). Его вводят в виде ежемесячной подкожной инъекции (укол под кожу). Xgeva не вызывает побочных эффектов, связанных с почками, и является более безопасным выбором для пациентов с почечной недостаточностью, чем бисфосфонаты.
См. также следующее:
Роль агентов, модифицирующих костную ткань, при множественной миеломе: Американское общество клинической онкологии, руководство по клинической практике, обновление
Рекомендации IMWG по лечению заболеваний костей, связанных с множественной миеломой
Здоровье костей, боль и подвижность: научно обоснованные рекомендации для пациентов с множественной миеломой, Руководящий совет медсестер IMF
Что такое компрессионный перелом позвонка?
Внезапная сильная боль в спине может сигнализировать о компрессионном переломе позвонка — коллапсе тела позвонка из-за того, что оно слишком слабое, чтобы выдерживать давление или нагрузку, воздействующую на него. Нагрузка на позвонок может быть такой же незначительной, как сила тяжести на вертикальном скелете, или может быть результатом падения, поворота, удара, кашля или чихания.
Нагрузка на позвонок может быть такой же незначительной, как сила тяжести на вертикальном скелете, или может быть результатом падения, поворота, удара, кашля или чихания.
При компрессионном переломе позвонка центр тяжести тела смещается вперед, оказывая большее давление на позвонки, прилегающие к компрессионному перелому. Может возникнуть эффект домино, в результате которого эти позвонки также разрушатся. Затем позвоночник укорачивается и изгибается вперед. Это искривление позвоночника вперед называется «кифозом».
Узнайте больше в публикации IMF: Понимание Лечение компрессионных переломов позвонков, вызванных миеломой .
Лечение компрессионных переломов позвонков (VCF)
Анальгетики
Анальгетики — это препараты, облегчающие боль. К ним относятся нестероидные противовоспалительные препараты (НПВП), такие как аспирин и ибупрофен, а также контролируемые вещества, отпускаемые только по рецепту врача. Лечение анальгетиками не предотвратит дальнейшие VCF и не восстановит переломы.
Лучевая терапия
Лучевая терапия обеспечивает облегчение боли у пациентов с угрожающими или фактическими компрессионными переломами позвонков. Облучение может использоваться отдельно или как часть программы лечения. Облегчение боли обычно начинается через несколько дней после лучевой терапии. Обезболивающие могут использоваться с лучевой терапией до тех пор, пока лучевая терапия не даст эффекта. Радиация не восстанавливает переломы и может повредить костный мозг, что приведет к снижению показателей крови и может серьезно ухудшить сбор стволовых клеток для трансплантации аутологичных стволовых клеток. Облучение используется в тех случаях, когда боль сильная и неконтролируемая, или когда есть опасения по поводу компрессии спинного мозга.
Фиксация
Для некоторых пациентов с ВКФ фиксация спины может быть всем, что необходимо для облегчения боли при компрессионном переломе. Корсет может обеспечить стабильность во время начала системной терапии миеломы и контроля заболевания.
Вертебропластика
Вертебропластика (специальный костный цемент, вводимый в сломанный позвонок) и кифопластика (процедура, освобождающая место для специального костного цемента) – это минимально инвазивные хирургические процедуры для облегчения боли при VCF и стабилизации спины. Эти процедуры могут выполняться хирургом-ортопедом, специализирующимся на хирургии позвоночника, нейрохирургом или интервенционным рентгенологом. Наиболее важными факторами при выборе врача для проведения процедуры являются его квалификация и опыт работы с множественной миеломной болезнью костей.
Показания к вертебропластике и кифопластике:
- Стойкая сильная боль от перелома тела позвонка, подтвержденная МРТ.
- Стойкие значительные симптомы, влияющие на повседневную деятельность, которые не исчезли с помощью более консервативных мер после 4 недель лечения.
Пациенты, которым не следует проводить вертебропластику и кифопластику:
- Пациенты со сдавлением спинного мозга.

- Боль в спине, не связанная с коллапсом позвоночника.
- Лица с инфекцией на участке VCF.
- Беременные женщины.
- Лица с тяжелой сердечной и легочной недостаточностью.
При вертебропластике костный цемент вводится шприцем непосредственно в разрушенный позвонок (или позвонки). Пациенты могут получать либо общую, либо местную анестезию и должны оставаться в постели не менее одного часа после процедуры, чтобы цемент затвердел. Вытекание цемента за пределы позвонка было зарегистрировано у 19,7% пациентов с вертебропластикой, в большинстве случаев без заметного эффекта. Тем не менее, были зарегистрированы случаи сдавливания цементом соседних нервов или попадания кусков цемента в легкие, что может привести к летальному исходу.
Хотя вертебропластика никогда не изучалась в клинических испытаниях у пациентов с множественной миеломой, она широко выполнялась в этих условиях на протяжении десятилетий.
Баллонная кифопластика
Баллонная кифопластика во многом похожа на вертебропластику: это минимально инвазивная хирургическая процедура, при которой используется костный цемент для стабилизации перелома позвоночника и уменьшения боли при VCF. В отличие от вертебропластики, кифопластика предполагает использование ортопедического баллона, который вставляется в пространство между позвонками и надувается для создания открытого пространства. Поврежденные фрагменты кости оттесняют к периферии открытого пространства, чтобы создать перемычку для цемента. Баллон сдувают и осторожно удаляют, а пустоту заполняют цементом. Контролируемое заполнение тела позвонка снижает риск утечки цемента.
В отличие от вертебропластики, кифопластика предполагает использование ортопедического баллона, который вставляется в пространство между позвонками и надувается для создания открытого пространства. Поврежденные фрагменты кости оттесняют к периферии открытого пространства, чтобы создать перемычку для цемента. Баллон сдувают и осторожно удаляют, а пустоту заполняют цементом. Контролируемое заполнение тела позвонка снижает риск утечки цемента.
Физическая активность
Чтобы максимизировать вашу повседневную активность и здоровье костей, поговорите со своим лечащим врачом о плане ежедневных физических нагрузок, включая занятия, которые помогают поддерживать баланс, силу и физическую форму. Упражнения, конечно же, должны быть адаптированы к состоянию ваших костей и общей физической форме.
Литические поражения костей — StatPearls
Непрерывное обучение
Опухоли костей в основном доброкачественные. Наиболее важными факторами, определяющими визуализацию опухолей костей, являются морфология на обзорной рентгенограмме (четкие литические, нечеткие литические и склеротические поражения) и возраст пациента на момент поступления. Четко очерченные остеолитические опухоли костей и опухолевидные поражения имеют множество дифференциалов в разных возрастных группах. В этом мероприятии рассматриваются этиология, проявления, оценка и лечение литических поражений костей, а также рассматривается роль межпрофессиональной команды в оценке, диагностике и лечении состояния.
Четко очерченные остеолитические опухоли костей и опухолевидные поражения имеют множество дифференциалов в разных возрастных группах. В этом мероприятии рассматриваются этиология, проявления, оценка и лечение литических поражений костей, а также рассматривается роль межпрофессиональной команды в оценке, диагностике и лечении состояния.
Цели:
Обобщите этиологию различных типов литических поражений костей.
Опишите результаты рентгенологического исследования, сопровождающие литические поражения костей, в зависимости от типа.
Обзор лечения и ведения литических поражений костей в зависимости от конкретной этиологии.
Объясните важность улучшения координации между межпрофессиональной бригадой для улучшения ухода за пациентами с литическими поражениями костей.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Опухоли костей в основном доброкачественные. Наиболее важными факторами, определяющими визуализацию опухолей костей, являются морфология на обзорной рентгенограмме (четкие литические, нечеткие литические и склеротические поражения) и возраст пациента на момент поступления.
Наиболее важными факторами, определяющими визуализацию опухолей костей, являются морфология на обзорной рентгенограмме (четкие литические, нечеткие литические и склеротические поражения) и возраст пациента на момент поступления.
Четко очерченные остеолитические опухоли костей и опухолеподобные поражения имеют множество дифференциалов в разных возрастных группах. Для простоты чрезвычайно полезна широко используемая мнемоника для литических поражений костей: FEGNOMASHIC. Мы попытались описать наиболее характерные черты каждой из этих опухолей.
Обсуждаются следующие различные опухоли и поражения костей: фиброзная дисплазия (ФД), [1] эозинофильная гранулема (ЭГ), энхондрома, гигантоклеточная опухоль (ГКО), неоссифицирующая фиброма, остеобластома, [2] аневризматическая костная киста. (ABC), солитарная костная киста (SBC), гиперпаратиреоз (Коричневая опухоль), инфекция (всегда держится в дифференциальной диагностике при лечении поражений костей), хондробластома, CMF, метастазы, миелома (любое поражение костей, обнаруженное в возрасте старше 40 лет, обязательно исключить метастазы и миелому).
Вариантом нормы, который может имитировать литическое поражение кости, является псевдокиста. Это область фокального трабекулярного разрежения в области низкого напряжения.[3] Псевдокисты чаще всего возникают в большом бугорке плечевой кости, пяточной кости и лучевом бугорке.
Остеолитическое поражение с плохо очерченной переходной зоной обычно характерно для злокачественных опухолей кости (саркома Юинга, остеосаркома, метастазы, лейкемия) и агрессивных доброкачественных поражений (гигантоклеточная опухоль, инфекция, эозинофильная гранулема).
Этиология
Этиология опухолей костей сильно различается. Они могут быть врожденными, развивающимися, вторичными по отношению к метаболическим нарушениям и другим первичным опухолям костей или метастазам первичных в других местах. Например, фиброзная дисплазия возникает из-за спорадической мутации стимулирующего белка альфа-субъединицы Gs, что приводит к неадекватной гиперпродукции циклического аденозинмонофосфата (ц-АМФ) [4]. Это вызывает замещение нормального костеобразования фиброзной стромой и островками незрелой костной ткани.
Это вызывает замещение нормального костеобразования фиброзной стромой и островками незрелой костной ткани.
Эпидемиология
Доброкачественные опухоли и опухолеподобные поражения составляют около 79,3% случаев всех поражений опорно-двигательного аппарата и демонстрируют незначительное преобладание женщин. Однако злокачественные опухоли составляют только 20,7% поражений и преобладают у мужчин.[5] Наиболее распространенными доброкачественными поражениями костей являются остеохондрома, энхондрома и простые кисты костей. Доброкачественные опухоли костей более распространены, чем злокачественные опухоли костей в младшей возрастной группе.[6] Злокачественные опухоли костей преимущественно метастазирующие и миеломные чаще встречаются в старшей возрастной группе, особенно после 40 лет.
Патофизиология
Характеристики визуализации для уточнения дифференциальной диагностики поражений:
Периостальная реакция: Периостальная реакция или периостит — неспецифический рентгенологический признак, возникающий из-за раздражения, вызванного доброкачественной или злокачественной опухолью подлежащей кости. Периостальная реакция подразделяется на непрерывную и прерывистую, однослойную и многослойную, доброкачественную и агрессивную формы.
Периостальная реакция подразделяется на непрерывную и прерывистую, однослойную и многослойную, доброкачественную и агрессивную формы.
Доброкачественная периостальная реакция: Хроническое незначительное раздражение позволяет надкостнице образовывать толстую, волнистую и однородную мозоль, что приводит к твердой периостальной реакции. Заживление переломов, остеоид-остеома и хронический остеомиелит могут привести к солидной периостальной реакции.
Агрессивная периостальная реакция: Возникает, когда надкостнице не хватает времени для отложения и консолидации костной ткани. Кора выглядит многослойной, пластинчатой, аморфной или спикулярной (солнечные лучи), иногда наблюдается периостальная реакция Кодмана. Злокачественное поражение, такое как остеосаркома, вызывает прерывистую периостальную реакцию и треугольник Кодмана. Саркома Юинга вызывает пластинчатую и прерывистую периостальную реакцию. Агрессивная периостальная реакция может присутствовать при доброкачественных поражениях, таких как инфекция, эозинофильная гранулема, ABC, остеоид-остеома, травма и гемофилия.
Переходная зона: Переходная зона может помочь дифференцировать доброкачественные и злокачественные образования. Узкая зона перехода приводит к резкой четко очерченной границе и является признаком плохой биологической активности. Однако у пациентов старше 40 лет, несмотря на доброкачественные рентгенологические проявления, при дифференциальной диагностике следует учитывать метастазы и миелому. Широкая зона перехода приводит к нечеткой или незаметной границе, что является признаком высокой биологической активности или агрессивного роста и является признаком злокачественной опухоли кости. Однако двумя доброкачественными поражениями костей, которые могут проявлять сходные агрессивные черты, являются инфекция и эозинофильная гранулема. Пермеативная или изъеденная молью кость выглядит как множественные эндостальные прозрачные поражения с плохой переходной зоной. Это связано с поражением костного мозга. Они могут проявляться множественной миеломой, лимфомой, инфекциями и эозинофильной гранулемой.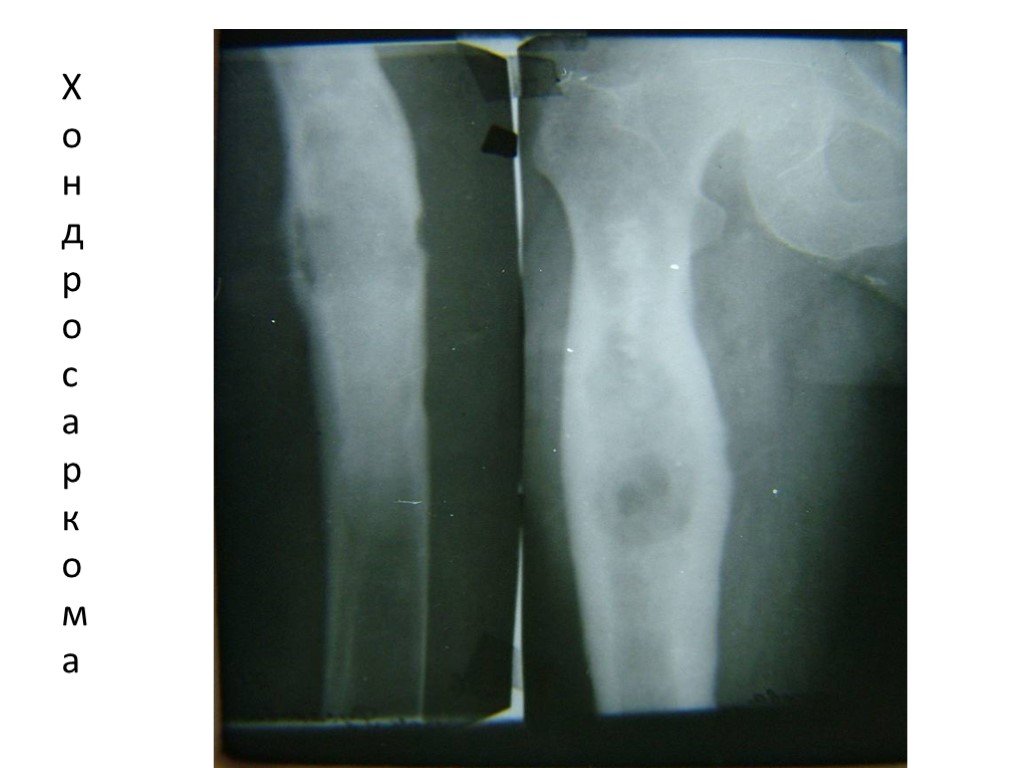
Разрушение коры: Разрушение коры часто встречается при поражениях костей. Тем не менее, это не очень полезно для дифференциации доброкачественных и злокачественных образований. Полная деструкция коры может наблюдаться при злокачественных поражениях высокой степени злокачественности, таких как остеосаркома, саркома Юинга, а также при локально агрессивных доброкачественных поражениях. Раздувание — это особый тип разрушения коры, который включает одновременное разрушение внутренней коры и образование новой кости вне коры. Наблюдается при гигантоклеточной опухоли (локально агрессивное экспансивное поражение с деструкцией коры, широкая переходная зона, прерванное новообразование кости на периферии) и в случае хондромиксоидной фибромы (четко очерченное экспансивное поражение с регулярным разрушением коры и непрерывным новообразованием кости) . Группа мелкоклеточных опухолей с вовлечением костного мозга, таких как лимфома Юинга, мелкоклеточная остеосаркома, может распространяться по всему гаверсову каналу без разрушения коры.
Матрикс: кальцификация или минерализация матрикса являются важными признаками для дифференциации опухолей костей. Различают два типа матричной минерализации. Хондроидный матрикс представлен в случаях хрящевых опухолей, таких как энхондрома, хондрообластома, хондросаркома, и представлен в виде кольца и дуги, хлопьевидного, пунктирного или похожего на попкорн. Остеоидные опухоли демонстрируют остеоидный матрикс. Характер трабекулярного окостенения при остеоидном матриксе и облачкообразных костных образований при остеосаркоме.
Локализация: Опухоли костей описываются в зависимости от их локализации в скелете (осевые, аппендикулярные и плоские кости), части кости (эпифиз, метафиз и диафиз) и локализации кости (центральная, эксцентрическая или юкстакортикальная) .
Возраст: Возраст является одним из наиболее важных критериев для возможных различий. В возрасте старше 40 лет множественную миелому и метастазы всегда необходимо держать в дифференциальной диагностике.
Анамнез и физикальное исследование
Соответствующий анамнез и физикальное обследование являются начальными и наиболее важными этапами оценки опухоли кости. У пациента может быть боль, новообразование или случайная рентгенологическая находка на рентгенограмме, сделанной для какой-либо другой цели. Доброкачественные поражения костей в большинстве случаев протекают бессимптомно. Они часто диагностируются случайно при визуализации. Они могут проявляться болью. Боль может быть первоначально связана с физической активностью или из-за периостита. Периостит — реакция кости, прилегающей к очагу поражения; они присутствуют в большинстве опухолей костей. Отдельного упоминания требуют доброкачественные литические поражения костей, не проявляющиеся периоститом или болью: фиброзная дисплазия, энхондрома, неоссифицирующая фиброма и солитарная костная киста. В случае злокачественных опухолей костей, как первичных, так и метастазирующих, боль может быть постоянной, не связанной с активностью из-за вовлечения сосудисто-нервных структур. Опухоли мягких тканей часто представляют собой массу, за исключением опухолей оболочек нервов, которые проявляются болью.
У пациента может быть боль, новообразование или случайная рентгенологическая находка на рентгенограмме, сделанной для какой-либо другой цели. Доброкачественные поражения костей в большинстве случаев протекают бессимптомно. Они часто диагностируются случайно при визуализации. Они могут проявляться болью. Боль может быть первоначально связана с физической активностью или из-за периостита. Периостит — реакция кости, прилегающей к очагу поражения; они присутствуют в большинстве опухолей костей. Отдельного упоминания требуют доброкачественные литические поражения костей, не проявляющиеся периоститом или болью: фиброзная дисплазия, энхондрома, неоссифицирующая фиброма и солитарная костная киста. В случае злокачественных опухолей костей, как первичных, так и метастазирующих, боль может быть постоянной, не связанной с активностью из-за вовлечения сосудисто-нервных структур. Опухоли мягких тканей часто представляют собой массу, за исключением опухолей оболочек нервов, которые проявляются болью.
Хотя некоторые опухоли костей имеют половую принадлежность, например ABC и GCT, чаще встречаются у женщин, это редко имеет какое-либо значение в диагностике и лечении опухолей.[7] Семейный анамнез иногда может быть полезен, например, при множественных энхондромах (аутосомно-доминантный) и костной дисплазии при нейрофиброматозе (аутосомно-доминантный).[8] Известно, что большинство доброкачественных и злокачественных опухолей костей возникают в определенных возрастных группах, что делает возраст одной из наиболее важных данных при проведении дифференциальной диагностики. Некоторые поражения костей могут быть множественными, например, фиброзная дисплазия, эозинофильная гранулема, энхондрома, метастазы и миелома, гиперпаратиреоз, гемангиомы и инфекции. Определенные синдромы могут вызывать поражения костей, такие как фиброзная дисплазия при синдроме МакКьюна-Олбрайта и синдроме Мазабро.
Физикальное обследование должно включать общее обследование, включающее общее состояние здоровья пациента, любые другие аномалии или признаки, кроме интересующей области, такие как пятна цвета кофе с молоком на коже, должны быть отмечены.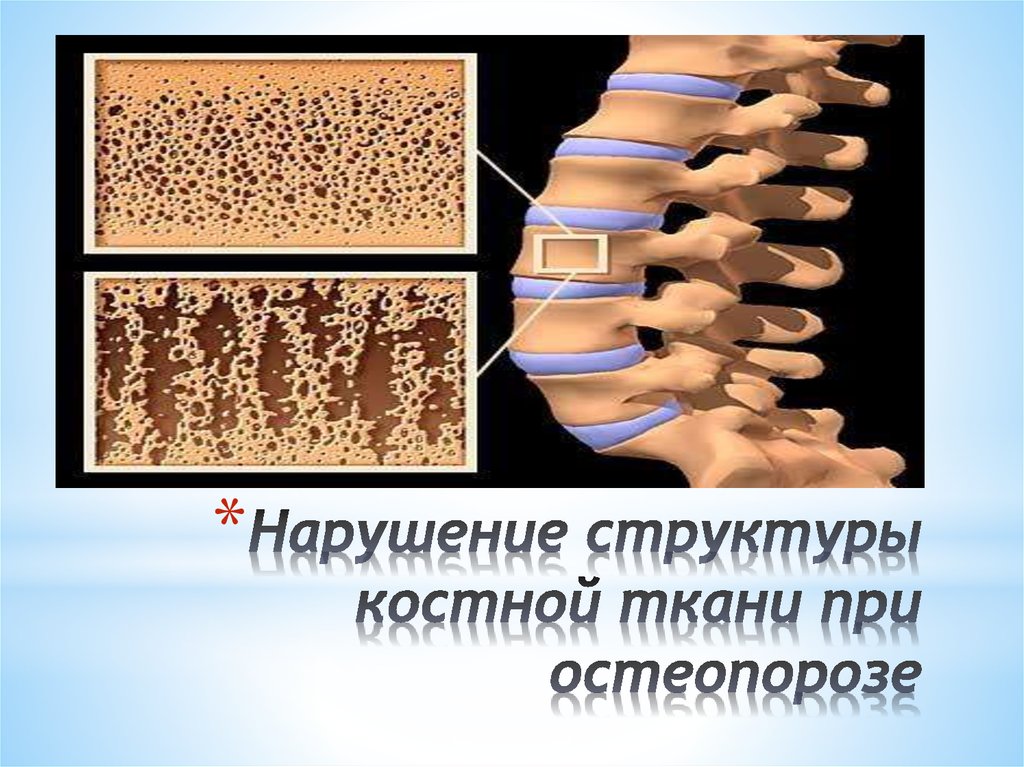 Специфическое обследование интересующей области, которое включает осмотр, пальпацию, изменение при подвижности, осмотр смежных структур и другие соответствующие обследования.
Специфическое обследование интересующей области, которое включает осмотр, пальпацию, изменение при подвижности, осмотр смежных структур и другие соответствующие обследования.
Оценка
Различные методы визуализации играют ключевую роль в диагностике опухолей костей. Рентгенограмма включает в себя начальный и один из наиболее важных методов диагностики. Часто для постановки диагноза достаточно рентгенологических данных и возраста пациента. Рентгенологическое исследование начинается с локализации очага поражения (эпифизарного, метафизарного или диафизарного). Эпифизарное поражение несросшегося органа, вероятно, является хондробластомой, тогда как поражение сросшегося органа, вероятно, является гигантоклеточной опухолью.[9]] Дифференциальный диагноз диафизарных поражений включает фиброзную дисплазию, остеобластому, гистиоцитоз, остеомиелит и др. У более молодых пациентов с поражением тел позвонков наиболее вероятным диагнозом является гистиоцитоз, в то время как поражения, затрагивающие задние элементы позвоночника, могут быть дифференцированы с ABC, остеобластомой и туберкулезом. Однако у пациентов старше 40 лет при поражении заднего элемента следует всегда помнить о метастазах. Точно так же агрессивность поражения и то, является ли оно доброкачественным или злокачественным, можно определить с помощью рентгенографии. Менее агрессивные поражения часто имеют четкую границу с окружающим склеротическим ободком. Более агрессивные поражения обычно имеют плохо очерченные края без четкого склеротического края, потому что реакция кости хозяина медленнее, чем рост опухоли. Расширение коры может быть видно при агрессивных доброкачественных поражениях, таких как ABC, но разрыв коры является признаком злокачественных поражений, таких как остеосаркома. Часто поражение кости замещает нормальный трабекулярный рисунок костного матрикса хондроидным или остеоидным матриксом. Типичный хрящевой матрикс показывает пунктирную кальцификацию, как при энхондроме или хондросаркоме. Остеоидный матрикс с деструкцией кости присутствует при остеосаркоме, в то время как неорганизованное образование остеоидов в коллагеновой строме придает вид матового стекла, наблюдаемый при фиброзной дисплазии.
Однако у пациентов старше 40 лет при поражении заднего элемента следует всегда помнить о метастазах. Точно так же агрессивность поражения и то, является ли оно доброкачественным или злокачественным, можно определить с помощью рентгенографии. Менее агрессивные поражения часто имеют четкую границу с окружающим склеротическим ободком. Более агрессивные поражения обычно имеют плохо очерченные края без четкого склеротического края, потому что реакция кости хозяина медленнее, чем рост опухоли. Расширение коры может быть видно при агрессивных доброкачественных поражениях, таких как ABC, но разрыв коры является признаком злокачественных поражений, таких как остеосаркома. Часто поражение кости замещает нормальный трабекулярный рисунок костного матрикса хондроидным или остеоидным матриксом. Типичный хрящевой матрикс показывает пунктирную кальцификацию, как при энхондроме или хондросаркоме. Остеоидный матрикс с деструкцией кости присутствует при остеосаркоме, в то время как неорганизованное образование остеоидов в коллагеновой строме придает вид матового стекла, наблюдаемый при фиброзной дисплазии.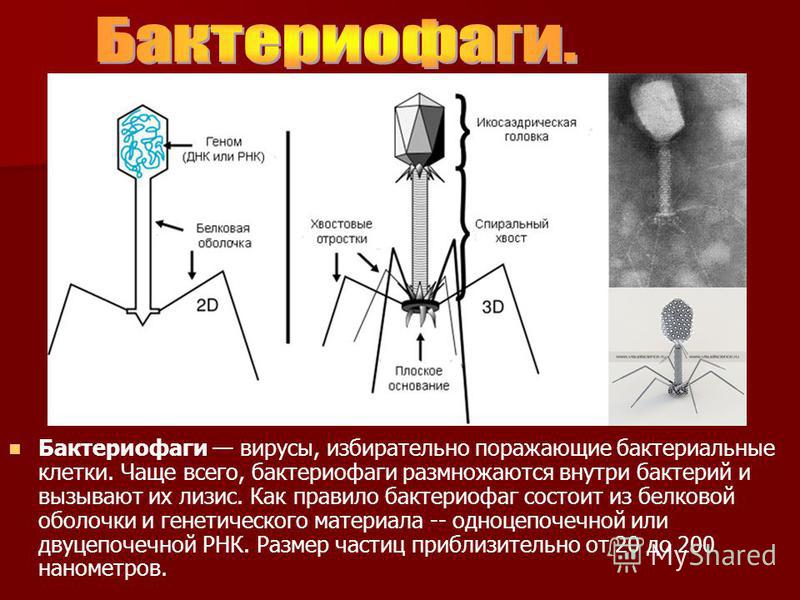 Периостит или реактивное новообразование кости возникает, когда опухоль раздражает кору. Периостальная реакция может быть доброкачественной или агрессивной, как треугольник Кодмана или снятие луковой шелухи при злокачественных опухолях. Обычная рентгенограмма менее информативна при опухолях мягких тканей; тем не менее, это может дать некоторую полезную информацию, например, флеболиты в гемангиоме.
Периостит или реактивное новообразование кости возникает, когда опухоль раздражает кору. Периостальная реакция может быть доброкачественной или агрессивной, как треугольник Кодмана или снятие луковой шелухи при злокачественных опухолях. Обычная рентгенограмма менее информативна при опухолях мягких тканей; тем не менее, это может дать некоторую полезную информацию, например, флеболиты в гемангиоме.
Компьютерная томография менее информативна в диагностике доброкачественных опухолей костей по сравнению со злокачественными опухолями костей [10]. Однако КТ помогает оценить кальцификацию, оссификацию и целостность коры. Он помогает локализовать очаг при остеоид-остеоме, тонком крае реактивного склероза при АВС и злокачественных опухолях, помогает оценить нарушение кортикального слоя, вовлечение мягких тканей и степень вовлечения опухоли для планирования хирургического вмешательства. Саггитальные и коронарные реконструктивные изображения помогают определить размеры опухоли в трех плоскостях и помогают в хирургическом планировании.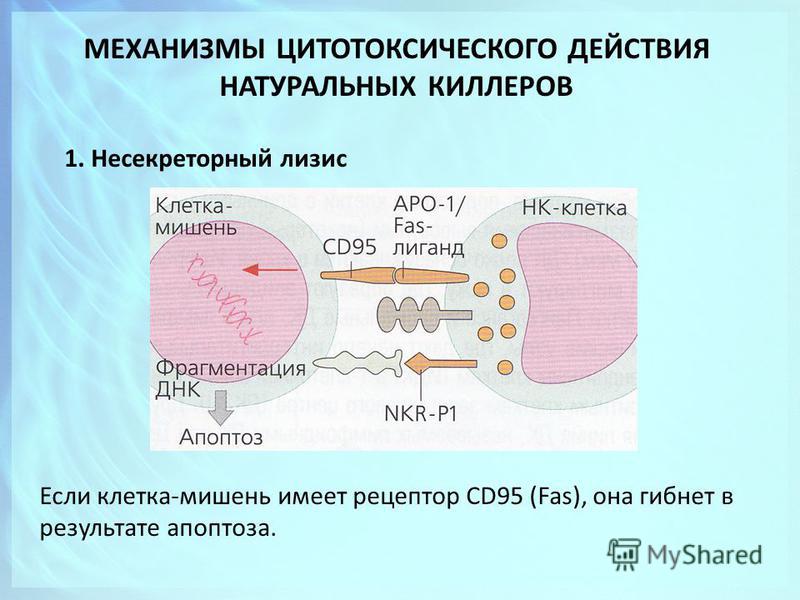 КТ легких помогает исключить метастазы в легкие при злокачественных опухолях.
КТ легких помогает исключить метастазы в легкие при злокачественных опухолях.
МРТ помогает лучше визуализировать мягкие ткани, дифференцируя некоторые доброкачественные костные кисты, такие как однокамерные и аневризматические костные кисты. При злокачественных опухолях костей они помогают оценить степень поражения костного мозга и исключить поражения для планирования хирургического вмешательства.
Сканирование костей с технецием используется для выявления активных поражений костей и исключения метастазов в кости. Однако сканирование костей может быть положительным при определенных активных доброкачественных образованиях и может быть ложноотрицательным при множественной миеломе [11]. Тем не менее, в большинстве случаев нормальное сканирование костей обнадеживает.
Позитронно-эмиссионная томография (ПЭТ) регистрирует распределение позитронно-излучающих радиоизотопов по всему телу. При опухолях опорно-двигательного аппарата ПЭТ полезна для определения стадии, планирования биопсии, ответа на химиотерапию, выявления рецидива и последующей визуализации.
Ультразвуковое исследование полезно для дифференциации солидных и кистозных поражений кости и лучшей визуализации поражений мягких тканей.
Анализы крови и мочи могут быть полезны в отдельных клинических ситуациях. Общий анализ крови может помочь предсказать заживление ран после операции и исключить любую инфекцию или лейкемию. Скорость оседания эритроцитов (СОЭ) может проявляться как повышенная при инфекции, метастатической карциноме, лейкемии и т. д. Повышенный уровень простатспецифического антигена (ПСА) часто присутствует при метастазах рака предстательной железы. Гиперкальциемия характерна для некоторых злокачественных новообразований и гиперпаратиреоза.
Биопсия должна быть последним шагом после полной оценки скелетно-мышечных опухолей на предмет места поражения, поведения опухоли и степени резектабельности. Тип биопсии, место разреза для биопсии и гистопатологическое исследование ткани биопсии требуют планирования. На МРТ и сканирование костей могут негативно повлиять биопсия и послеоперационные изменения тканей; поэтому их обычно получают до операции.
Следует упомянуть важные особенности визуализации некоторых различных литических поражений костей:
Фиброзная дисплазия: ФД — распространенное доброкачественное поражение, не зависящее от возраста. Классически он представляет собой хорошо выраженное литическое поражение, матрикс «матовое стекло», отсутствие периостальной реакции. Обычными локализациями являются ребра (моностотическая болезнь), таз и конечности.[12] Клинически известны четыре типа ФД: монооссальный, полиоссальный, черепно-лицевой и херувизм (верхнечелюстной и нижнечелюстной у детей). Это заболевание кости, характеризующееся заменой кости структурно дезорганизованной фиброзной тканью. Поражения фиброзной дисплазии могут быть покоящимися, неагрессивными или агрессивными типами
Эозинофильная гранулема: Это форма гистиоцитоза X. Она может быть литической или бластной, со склеротическими краями или без них, с периоститом или без него. Четких рентгенологических признаков у этого объекта нет. Однако, исходя из предыдущего опыта, ЭГ редко встречается в возрасте старше 30 лет. Он может быть моно- или полиоссальным. Также известно наличие секвестра.
Он может быть моно- или полиоссальным. Также известно наличие секвестра.
Энхондрома: это наиболее распространенное доброкачественное поражение фаланг пальцев. Обызвествленный хондроидный матрикс неизменен, за исключением фаланг пальцев. Отсутствие периостита. Наиболее важным дифференциальным диагнозом является инфаркт кости. Синдром, связанный с множественными энхондромами, представляет собой болезнь Олье, а при наличии множественных гемангиом — синдром Маффуччи.
Гигантоклеточная опухоль: они обычно возникают в закрытом эпифизе, эксцентричном поражении, субартикулярном примыкании к эпифизу с возможным распространением в метафиз и с резко очерченной несклеротической границей; они считаются умеренно агрессивной опухолью.
Неоссифицирующая фиброма: это одна из наиболее частых случайных опухолей костей. Это доброкачественные бессимптомные опухоли с четко выраженными склеротическими краями. Они обычно локализуются юкстакортикально и, как правило, возникают в метафизах длинных костей и чаще всего встречаются в возрастной группе до 30 лет.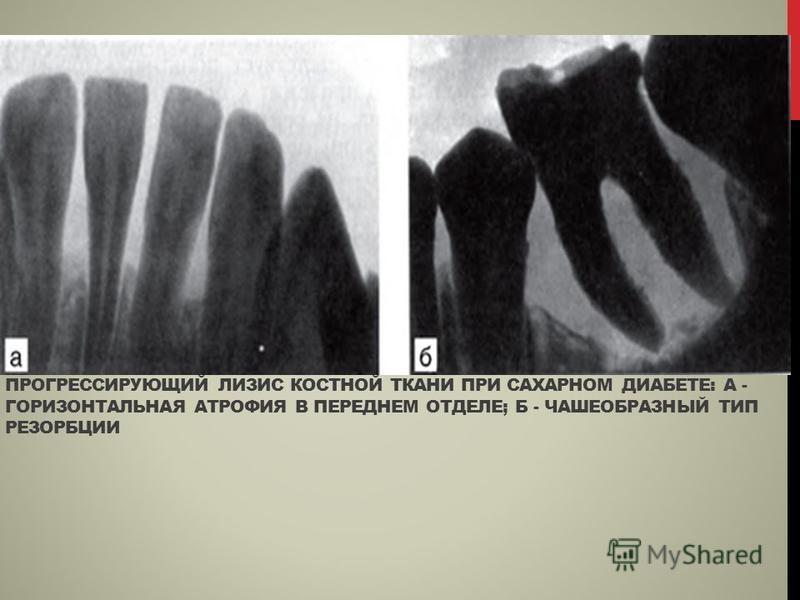 Когда поражение меньше 2 см, его называют фиброзным кортикальным дефектом (ФКД).
Когда поражение меньше 2 см, его называют фиброзным кортикальным дефектом (ФКД).
Аневризматическая костная киста [13]: это экспансивное литическое поражение, обычно наблюдаемое в возрастной группе до 30 лет. МРТ показывает множественные уровни жидкость-жидкость. Они могут быть двух типов: первичные и вторичные с другими основными поражениями, такими как остеосаркома и хондросаркома, и часто сопровождаются болью.
Остеобластома: редкая одиночная доброкачественная опухоль. Это один из дифференциалов опухолей, поражающих задний элемент позвоночника. Обычно это более 2 см, чтобы отличить от остеоид-остеомы.
Солитарная костная киста: это четко очерченное литическое поражение, расположенное в центре в проксимальном отделе плечевой и бедренной костей. Это происходит в возрастной группе до 30 лет. Чаще всего проявляется болью из-за перелома стенки кисты.
Хондробластома, хондромиксоидная фиброма (CMF): это хрящевые опухоли. Обычно они возникают в эпифизе и не имеют кальцифицированного матрикса.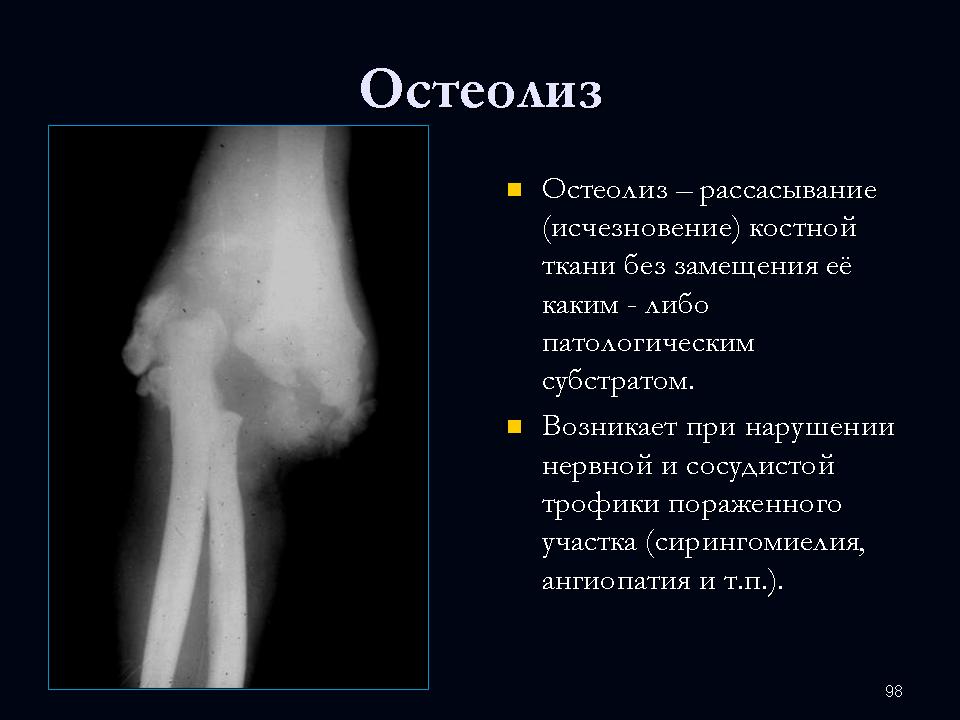
Метастазы: должны быть включены в дифференциал по возрасту старше 40 лет, будь то литические или склеротические, четко определенные или плохо определенные. Костные метастазы имеют склонность к гемопоэтическому костному мозгу, такому как позвоночник, таз, ребра, череп и проксимальные части длинных костей.
Миелома: Это должно учитываться при дифференциальной диагностике у лиц старше 40 лет. Наиболее частая локализация – осевой скелет. Он демонстрирует множественные перфорированные поражения на КТ. Он не показывает никакого поглощения при сканировании костей.
Инфекция: Инфекция костей или остеомиелит — отличный аналог опухоли. Он может присутствовать в любом месте кости.
Гиперпаратиреоз или коричневая опухоль: коричневая опухоль может возникать в любой кости и проявляется в виде множественных остеолитических поражений. Важные дифференциалы — это метастазы, ABC и GCT в зависимости от места поражения.
Лечение/управление
Диагноз большинства поражений костей ставится на основании их клинических, радиологических и биопсийных характеристик.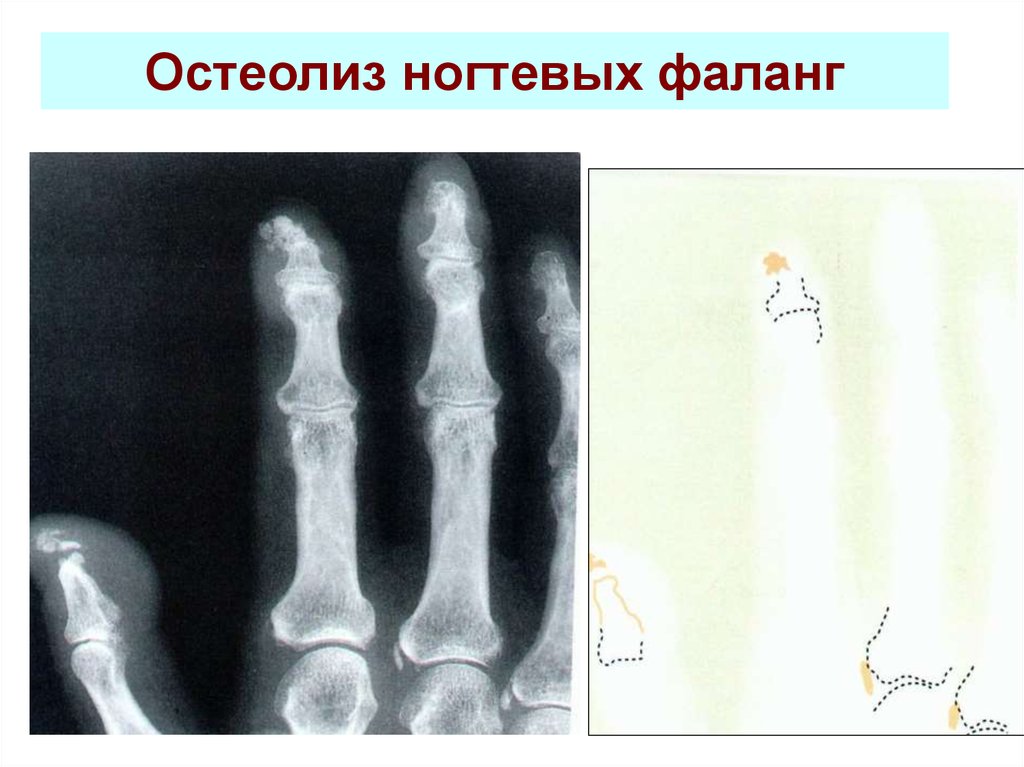 Эннекинг и другие предложили систему стадирования доброкачественных и злокачественных опухолей опорно-двигательного аппарата.[14] Стадирование помогает в планировании лечения, прогнозировании опухолей и сравнении различных вариантов лечения.
Эннекинг и другие предложили систему стадирования доброкачественных и злокачественных опухолей опорно-двигательного аппарата.[14] Стадирование помогает в планировании лечения, прогнозировании опухолей и сравнении различных вариантов лечения.
Стадия доброкачественных опухолей следующая:
Стадия 1: Скрытые (внутрикапсулярные, бессимптомные и случайные) поражения. Рентгенограмма показывает четко очерченное поражение с толстым склеротическим ободком без деструкции или расширения коры. Эти поражения не требуют лечения, поскольку они не нарушают прочность пораженной кости. Например, небольшие бессимптомные неоссифицирующие фибромы диагностируются случайно.
Стадия 2: Активные (внутрикапсулярные, активно растущие, проявляющиеся симптоматической болью или патологическим переломом) поражения. Они имеют четко очерченные края, но могут расширяться и истончать кору. Обычно они имеют тонкий ободок реактивного края. Лечение включает расширенное выскабливание.
Стадия 3: Агрессивные (экстракапсулярные) поражения.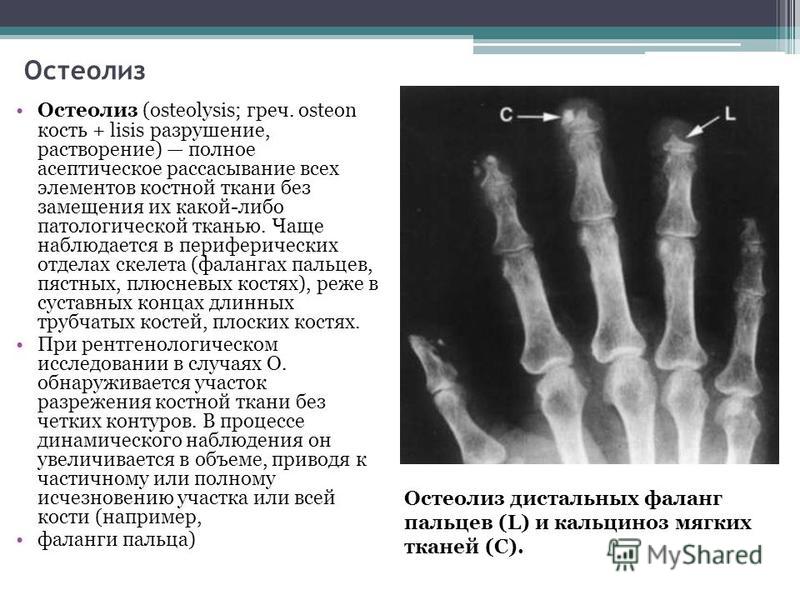 Известно, что они нарушают естественные анатомические барьеры, обычно пробивают кору. Расширенный кюретаж, краевая резекция или широкая резекция, если это необходимо.
Известно, что они нарушают естественные анатомические барьеры, обычно пробивают кору. Расширенный кюретаж, краевая резекция или широкая резекция, если это необходимо.
Скелетно-мышечные саркомы также классифицируются в соответствии с гистологической степенью, местным распространением, наличием или отсутствием метастазов по Эннекингу следующим образом: IIA/B: высокая степень, интракомпартментальная/экстракомпартментальная, без метастазов
Стадия IIIA/B: любая опухоль с метастазами, независимо от степени или размера опухоли
В качестве альтернативы, многие онкологи-ортопеды определяют стадию опухолей опорно-двигательного аппарата в соответствии с данными Американского объединенного комитета по онкологической системе (AJCC), которые периодически обновляются.
Лечение поражений костей должно проводиться опытными хирургами, хорошо знакомыми с основными принципами лечения различных опухолей костей. Выбор лечения зависит от множества факторов. При принятии решения о лечении необходимо учитывать хирургическое вмешательство по сравнению с консервативным лечением, лечение одним лекарством или комбинацию выскабливания, костной пластики и инъекций кисты, лечение сложных областей, таких как опухоль, затрагивающая позвоночник, и влияние терапии на продолжающийся рост скелета. Например, ABC лечится кюретажем и костной пластикой или инъекцией и эмболизацией, в то время как инфекция требует соответствующего лечения антибиотиками и хирургической обработки, если это необходимо.[15] Первичная цель лечения при первичном злокачественном новообразовании костей – излечение больных. В то время как в случае метастатического поражения костей основной целью лечения является обезболивание. Комбинированная терапия с лучевой терапией, химиотерапией и хирургическим вмешательством является распространенным выбором
При принятии решения о лечении необходимо учитывать хирургическое вмешательство по сравнению с консервативным лечением, лечение одним лекарством или комбинацию выскабливания, костной пластики и инъекций кисты, лечение сложных областей, таких как опухоль, затрагивающая позвоночник, и влияние терапии на продолжающийся рост скелета. Например, ABC лечится кюретажем и костной пластикой или инъекцией и эмболизацией, в то время как инфекция требует соответствующего лечения антибиотиками и хирургической обработки, если это необходимо.[15] Первичная цель лечения при первичном злокачественном новообразовании костей – излечение больных. В то время как в случае метастатического поражения костей основной целью лечения является обезболивание. Комбинированная терапия с лучевой терапией, химиотерапией и хирургическим вмешательством является распространенным выбором
Существуют специфические доброкачественные поражения костей, не требующие вмешательства; их лучше оставить в покое. Это доброкачественные образования и нормальные варианты. Хороший пример явно доброкачественных поражений, таких как неоссифицирующая фиброма. Это литическое поражение, расположенное в коре метафиза длинных костей с четко выраженной склеротической границей. Их инволютивный характер может показывать повышенную активность при сканировании костей. При постановке диагноза рентгенологом биопсия не требуется. Другим подобным откровенно доброкачественным образованием является однокамерная костная киста пяточной кости. Они бессимптомны и редко подвергаются переломам, как и другие поражения конечностей. Инфаркт кости также никогда не вызывает диагностической дилеммы у рентгенолога, поэтому биопсия не требуется.
Хороший пример явно доброкачественных поражений, таких как неоссифицирующая фиброма. Это литическое поражение, расположенное в коре метафиза длинных костей с четко выраженной склеротической границей. Их инволютивный характер может показывать повышенную активность при сканировании костей. При постановке диагноза рентгенологом биопсия не требуется. Другим подобным откровенно доброкачественным образованием является однокамерная костная киста пяточной кости. Они бессимптомны и редко подвергаются переломам, как и другие поражения конечностей. Инфаркт кости также никогда не вызывает диагностической дилеммы у рентгенолога, поэтому биопсия не требуется.
Дифференциальная диагностика
Эпифизарные поражения
Хондробластома (от 10 до 25 лет)
Гигантоклеточная опухоль (от 20 до 40 лет)
Хондросаркома (редко)
Саркома Юинга (от 5 до 25 лет)
Лимфома
Фиброзная дисплазия (от 5 до 30 лет)
003
Гистиоцитоз (от 5 до 30 лет)
Множественные поражения
Histiocytosis
Enchondroma
Osteochondroma
Fibrous dysplasia
Metastasis
Multiple myelomas
Infection
Hyperparathyroidism
Hemangioma
Осложнения
Осложнения, связанные с доброкачественными опухолями костей, могут быть связаны с самой опухолью, например, боль, патологический перелом, образование аневризматической костной кисты или злокачественная трансформация. Осложнения, связанные с лечением, включают рецидивы, нарушение подвижности и другие побочные эффекты. Известно, что злокачественные поражения костей вызывают боль, патологические переломы, потерю функции и низкое качество жизни, связанные с побочными эффектами лечения и в крайних случаях приводящие к смерти. Лечение заболеваний опорно-двигательного аппарата включает в себя решение всех этих вопросов.
Осложнения, связанные с лечением, включают рецидивы, нарушение подвижности и другие побочные эффекты. Известно, что злокачественные поражения костей вызывают боль, патологические переломы, потерю функции и низкое качество жизни, связанные с побочными эффектами лечения и в крайних случаях приводящие к смерти. Лечение заболеваний опорно-двигательного аппарата включает в себя решение всех этих вопросов.
Сдерживание и просвещение пациентов
Пациенты должны получать информацию о своем заболевании и доступных вариантах лечения. Поражения опорно-двигательного аппарата включают широкий спектр патологий, каждая из которых требует индивидуального подхода к лечению. Например, доброкачественные поражения костей, которые протекают бессимптомно и неактивны, обычно не трогают; в то время как те опухоли, которые являются активными и сопровождаются болью/патологическими переломами, требуют активного вмешательства. Более агрессивные опухоли кости могут потребовать расширенного выскабливания или широкой резекции. Основной целью при метастатическом поражении костей обычно является обезболивание и паллиативная помощь; в то время как первичные злокачественные опухоли костей получают агрессивное лечение, когда это возможно. Понимание заключается в том, что ведение пациентов с поражениями опорно-двигательного аппарата зависит от множества факторов, и пациенты должны быть осведомлены о своем состоянии для достижения лучших результатов лечения.
Основной целью при метастатическом поражении костей обычно является обезболивание и паллиативная помощь; в то время как первичные злокачественные опухоли костей получают агрессивное лечение, когда это возможно. Понимание заключается в том, что ведение пациентов с поражениями опорно-двигательного аппарата зависит от множества факторов, и пациенты должны быть осведомлены о своем состоянии для достижения лучших результатов лечения.
Улучшение результатов медицинских бригад
Для надлежащего лечения этих поражений необходим межпрофессиональный/межпрофессиональный подход.[17] Пациентам должна быть предоставлена вся необходимая информация об их заболевании, различных методах лечения и раннем начале паллиативной помощи, если это необходимо. Врачи, практикующие медсестры, хирурги-ортопеды и рентгенологи играют очень важную роль в правильной диагностике и лечении скелетно-мышечных поражений. Злокачественные поражения костей должны контролироваться опытными онкологами, чтобы снизить вероятность неудачного лечения. Медсестры, прошедшие специальную подготовку по проведению онкологического лечения, мониторингу и обучению пациентов, также играют жизненно важную роль в общем повышении выживаемости и качества жизни.[18] Межпрофессиональный командный подход даст наилучшие результаты. [Уровень 5] Большая часть доступной литературы о литических поражениях костей основана на доказательствах уровня 4/5.
Медсестры, прошедшие специальную подготовку по проведению онкологического лечения, мониторингу и обучению пациентов, также играют жизненно важную роль в общем повышении выживаемости и качества жизни.[18] Межпрофессиональный командный подход даст наилучшие результаты. [Уровень 5] Большая часть доступной литературы о литических поражениях костей основана на доказательствах уровня 4/5.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Lee JS, FitzGibbon EJ, Chen YR, Kim HJ, Lustig LR, Akintoye SO, Collins MT, Kaban LB. Клинические рекомендации по лечению черепно-лицевой фиброзной дисплазии. Orphanet J Rare Dis. 2012 г., 24 мая; 7 Приложение 1 (Приложение 1): S2. [Бесплатная статья PMC: PMC3359960] [PubMed: 22640797]
- 2.
Хани Р., Бен-Айси М., Беррада М.С. [Остеобластома голеностопного сустава: необычная локализация].
 Pan Afr Med J. 2018; 29:164. [Бесплатная статья PMC: PMC6057594] [PubMed: 30050628]
Pan Afr Med J. 2018; 29:164. [Бесплатная статья PMC: PMC6057594] [PubMed: 30050628]- 3.
Resnick D, Cone RO. Природа плечевых псевдокист. Радиология. 1984 г., январь; 150 (1): 27–8. [PubMed: 6689775]
- 4.
Вайнштейн Л.С., Шенкер А., Гейман П.В., Мерино М.Дж., Фридман Э., Шпигель А.М. Активирующие мутации стимулирующего G-белка при синдроме МакКьюна-Олбрайта. N Engl J Med. 1991 Декабрь 12; 325 (24): 1688-95. [PubMed: 1944469]
- 5.
Берговец М., Кубат О., Смердель М., Сейверт С., Боневски А., Орлик Д. Эпидемиология скелетно-мышечных опухолей в национальном специализированном ортопедическом отделении. Исследование 3482 случаев. Эпидемиол рака. 2015 июнь;39(3):298-302. [PubMed: 25703268]
- 6.
Traoré O, Chban K, Hode AF, Diarra Y, Salam S, Ouzidane L. [Интересность визуализации доброкачественных опухолей костей у детей]. Pan Afr Med J. 2016; 24:179. [Бесплатная статья PMC: PMC5072874] [PubMed: 27795776]
- 7.

Cottalorda J, Bourelle S. Современное лечение первичных аневризматических костных кист. J Pediatr Orthop B. 2006 May; 15 (3): 155-67. [PubMed: 16601582]
- 8.
Антонио М.Р., Голони-Бертолло Э.М., Тридико Л.А. Нейрофиброматоз: хронологическая история и современные проблемы. Бюстгальтеры Дерматол. 2013 г., май-июнь; 88(3):329-43. [Бесплатная статья PMC: PMC3754363] [PubMed: 23793209]
- 9.
Xu H, Nugent D, Monforte HL, Binitie OT, Ding Y, Letson GD, Cheong D, Niu X. Хондробластома костей конечностей: многоцентровое ретроспективное исследование. J Bone Joint Surg Am. 03 июня 2015 г.; 97 (11): 925-31. [PubMed: 26041854]
- 10.
Torricelli P, Reggiani G, Martinelli C, Boriani S, Folchi Vici F. [Значение и ограничения компьютерной томографии в исследовании доброкачественных опухолей кости]. Радиол Мед. 1987 ноябрь; 74(5):388-95. [В паблике: 3685463]
- 11.
Barwick T, Bretsztajn L, Wallitt K, Amiras D, Rockall A, Messiou C.
 Визуализация при миеломе с упором на передовые методы визуализации. Бр Дж Радиол. 2019 март; 92 (1095): 20180768. [PMC free article: PMC6540859] [PubMed: 30604631]
Визуализация при миеломе с упором на передовые методы визуализации. Бр Дж Радиол. 2019 март; 92 (1095): 20180768. [PMC free article: PMC6540859] [PubMed: 30604631]- 12.
Кущаева Ю.С., Кущаев С.В., Глушко Т.Ю., Телла С.Х., Тейтельбойм О.М., Коллинз М.Т., Бойс А.М. Фиброзная дисплазия для рентгенологов: костный матрикс за пределами матового стекла. Инсайты. 2018 дек;9(6):1035-1056. [Бесплатная статья PMC: PMC6269335] [PubMed: 30484079]
- 13.
Mascard E, Gomez-Brouchet A, Lambot K. Костные кисты: однокамерные и аневризматические костные кисты. Orthop Traumatol Surg Res. 2015 Февраль; 101 (1 Дополнение): S119-27. [PubMed: 25579825]
- 14.
Стеффнер Р.Дж., Джанг Э.С. Стадирование сарком костей и мягких тканей. J Am Acad Orthop Surg. 01 июля 2018 г .; 26 (13): e269-e278. [PubMed: 29781819]
- 15.
Кларксон П., Фергюсон П.С. Первичное мультидисциплинарное лечение сарком мягких тканей конечностей.

 [9]
[9] Новообразование растёт медленно, но способно разрушать кости, приводя к их переломам.
Новообразование растёт медленно, но способно разрушать кости, приводя к их переломам. Её часто случайно обнаруживают при рентгенографии. Опухоль рекомендуется удалять только при сдавлении окружающих структур либо при подозрении на озлокачествление.
Её часто случайно обнаруживают при рентгенографии. Опухоль рекомендуется удалять только при сдавлении окружающих структур либо при подозрении на озлокачествление.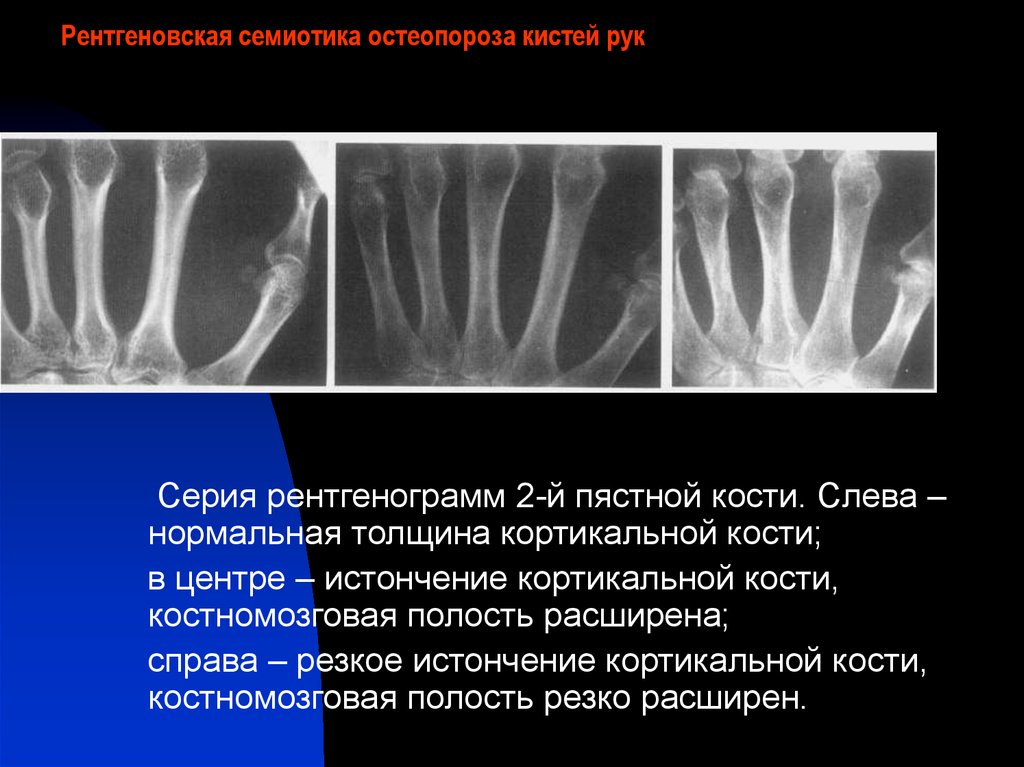
 [15]
[15]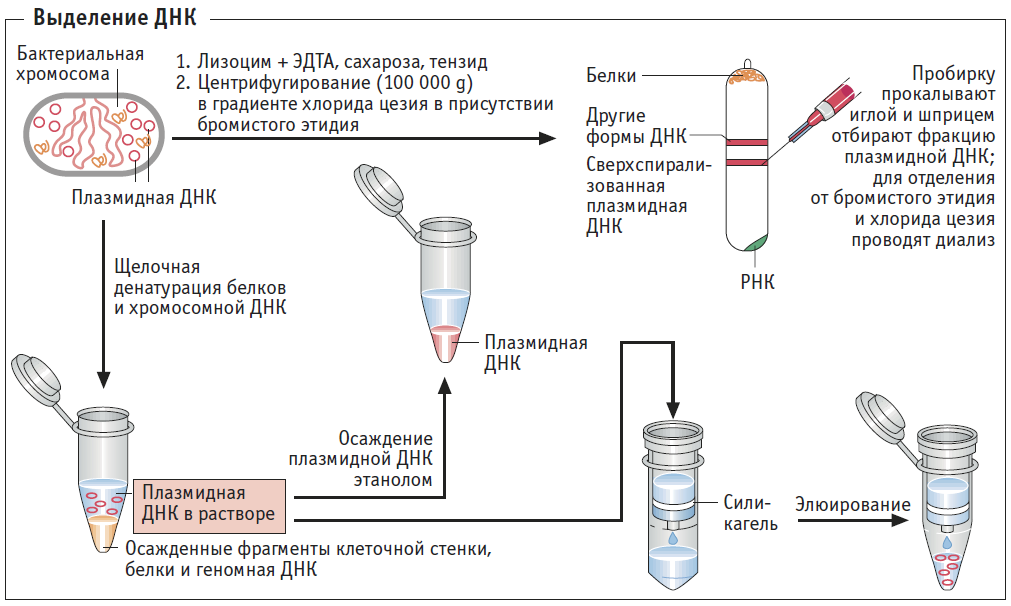
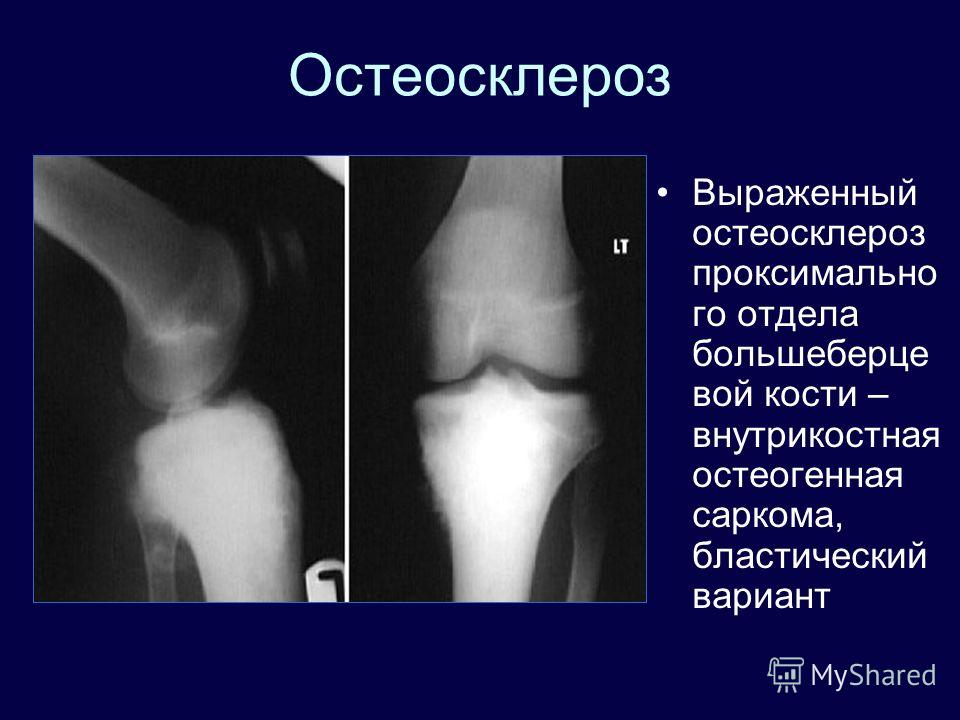
 У всех пациентов, принимающих бисфосфонаты, следует тщательно контролировать функцию почек, особенно у пациентов с известной почечной недостаточностью.
У всех пациентов, принимающих бисфосфонаты, следует тщательно контролировать функцию почек, особенно у пациентов с известной почечной недостаточностью.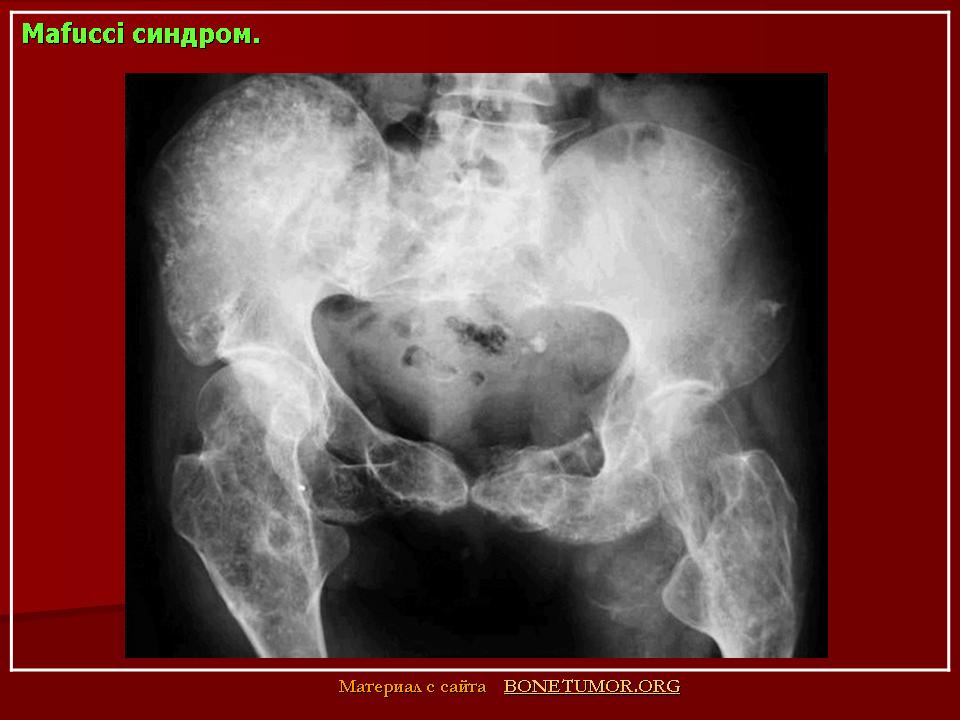
 Pan Afr Med J. 2018; 29:164. [Бесплатная статья PMC: PMC6057594] [PubMed: 30050628]
Pan Afr Med J. 2018; 29:164. [Бесплатная статья PMC: PMC6057594] [PubMed: 30050628]
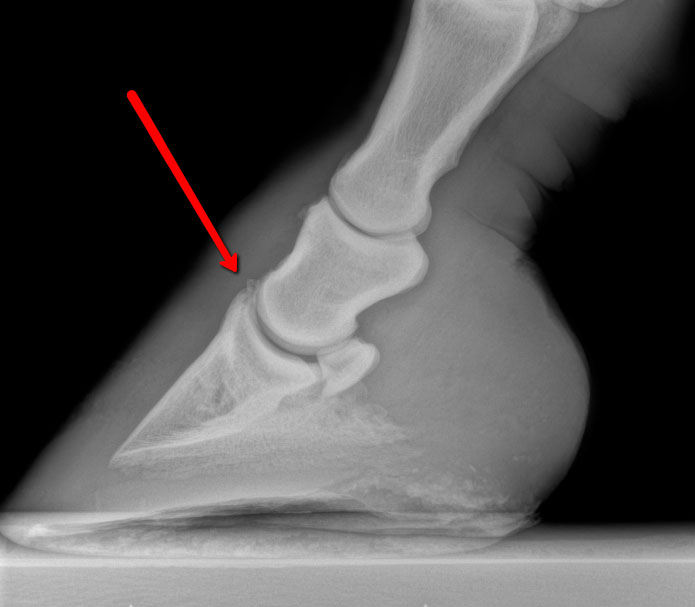 Визуализация при миеломе с упором на передовые методы визуализации. Бр Дж Радиол. 2019 март; 92 (1095): 20180768. [PMC free article: PMC6540859] [PubMed: 30604631]
Визуализация при миеломе с упором на передовые методы визуализации. Бр Дж Радиол. 2019 март; 92 (1095): 20180768. [PMC free article: PMC6540859] [PubMed: 30604631]