Как образуется кислотный дождь: характеристика и последствия
Одно из самых серьезных последствий загрязнения воздуха — кислотные дожди. Это серьезная экологическая проблема, вызванная промышленной деятельностью человека. Хотя во многих фильмах можно увидеть катастрофы, вызванные этим явлением, потому что люди не знают Как образуется кислотный дождь.
Поэтому мы собираемся посвятить эту статью тому, чтобы рассказать вам, как происходит кислотный дождь и каковы его последствия.
Индекс
- 1 Características principales
- 2 Как образуется кислотный дождь
- 3 Последствия для человека и окружающей среды
- 4 Решения от кислотного дождя
Características principales
Этот тип осадков связан с загрязнением атмосферы, поскольку образуется при взаимодействии влажности воздуха с диоксидом серы, триоксидом серы и другими оксидами азота, присутствующими в атмосфере.
Эти газы поступают из таких продуктов, как нефть, некоторые отходы, заводской дым и движение транспортных средств. Это явление стало проблемой на Земле из-за его все возрастающей частоты. Он наносит ущерб природным элементам и искусственной инфраструктуре человека.
Как образуется кислотный дождь
Чтобы узнать, почему он оказывает негативное влияние на эти природные и искусственные элементы, мы должны понять, как образуются кислотные дожди. Что касается кислотных дождей, можно сказать, что прямой причиной загрязнения окружающей среды является деятельность человека, например: работы заводов, общественных мест и отопления домов, электростанций, транспортных средств и другие виды деятельности.
Принято считать, что когда мы говорим о последствиях кислотного дождя, мы считаем, что не являемся причиной этого явления.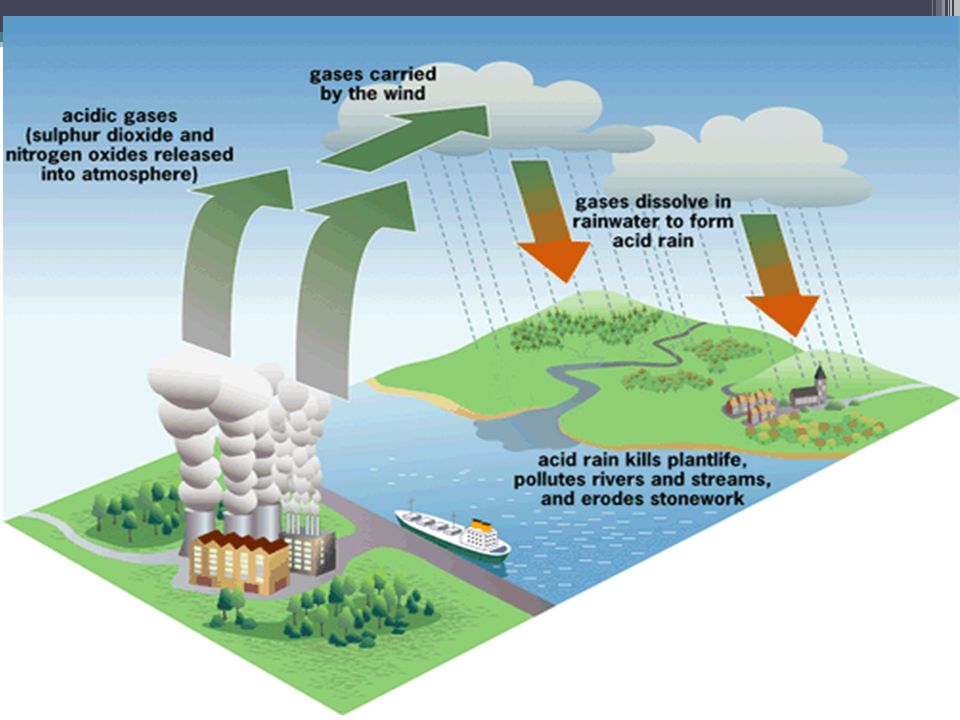
Это заставляет нас переосмыслить, действительно ли эти эффекты вызваны действием всего в целом. Помните, это явление содержит углекислый газ, который может быть снегом, льдом или туманом. В случае тумана это называется кислотным туманом, и он также может причинить вред здоровью, если вы дышите.
Все это делает воду немного кислой. PH дождевой воды обычно составляет 5,6, но pH кислотного дождя обычно составляет 5 или даже 3, если вода очень кислая.. Для его образования вода, содержащаяся в воздухе, контактирует со смесью газов, о которой мы упоминали ранее. Именно эти газы вместе с водой выделяют серную кислоту, которая делает дождевую воду более кислой. Также образуются две другие кислоты, такие как сернистая кислота и азотная кислота. Когда эта более кислая вода падает, она начинает разрушать окружающую среду, в которой находится.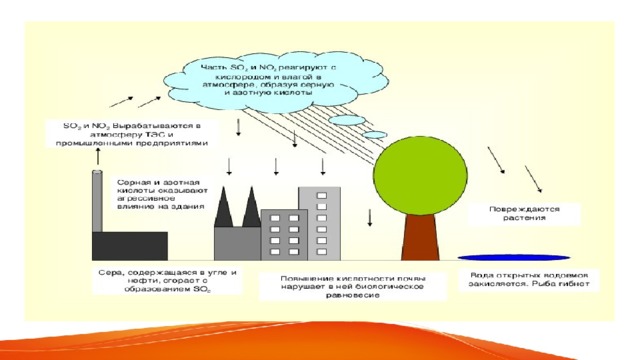
Последствия для человека и окружающей среды
Теперь мы более подробно рассмотрим, что происходит, когда начинается кислотный дождь. Он падает на землю, воду, леса, здания, транспортные средства, людей и т. Д. При этом уже можно сказать, что экология в целом ухудшилась.
Загрязняющие вещества, выделяемые при сжигании нефтепродуктов, не только загрязняют территорию, где они производятся, но также могут перемещаться с ветром на большие расстояния. до тысяч километров. Перед соединением с влагой он становится кислым и выпадает в виде осадков. Хотя это и называется кислотным дождем, эти осадки могут выпадать в виде снега, града или тумана. Все это говорит нам о том, что образование кислотных дождей может происходить в одной части мира и выпадать в другом месте.
Тот факт, что страна, которая не загрязняет окружающую среду, должна страдать от последствий того, что это делает другая страна, — это то, чего эта страна не должна допускать. Больше всего на свете, потому что это последствия кислотных дождей и то, какие страны, которые не виноваты в выбросах других, пострадают:
- Подкисление воды: Это воздействие на окружающую среду, которое наносит серьезный ущерб всему биоразнообразию как в квантовом, так и в земном поле.
 Затронуто и флора, и фауна, и вода больше не пригодна для питья. Все это приводит к увеличению количества последующих обработок и удорожанию питьевой воды.
Затронуто и флора, и фауна, и вода больше не пригодна для питья. Все это приводит к увеличению количества последующих обработок и удорожанию питьевой воды. - Наносит серьезный урон растительности: все лесные массивы и джунгли повреждены на уровне флоры и фауны.
- Имейте в виду, что во время процесс кислотных дождей смешивает одни химические компоненты с другими, уже присутствующими в почве. Это приводит к обеднению почвы питательными веществами. Основная последовательность этого заключается в том, что многие растения умирают, а животные, которые питаются этими растениями, в конечном итоге умирают из-за воздействия трофической цепи.
- Уничтожить жизнь всех микроорганизмов которые отвечают за фиксацию азота. Это приводит к увеличению содержания азота в окружающей среде.
- Он повреждает все искусственные поверхности, созданные человеком, в конечном итоге вызывая коррозию таких материалов, как дерево, пластик и камень.
 Вы просто должны увидеть, что многие статуи и памятники серьезно пострадали из-за частых выпадений кислотных дождей в загрязненных местах.
Вы просто должны увидеть, что многие статуи и памятники серьезно пострадали из-за частых выпадений кислотных дождей в загрязненных местах. - Кислоты, присутствующие в дожде, также вызывают усиление парникового эффекта.
Решения от кислотного дождя
Учитывая эти последствия, есть несколько возможных решений, например:
- Снижает уровень выбросов серного азота на заводах, в транспортных средствах, отоплении., И т.д.
- Увеличение использования возобновляемых источников энергии и повышение эффективности технологий по сокращению выбросов в атмосферу.
- Увеличьте потребление общественного транспорта сократить использование личного автомобиля.
- Снижение потребления электроэнергии в домах
- Снижение использования химических веществ для сельскохозяйственных культур и сельского хозяйства.
- Посадите больше деревьев
- Обучайте все население, чтобы они усваивали лучшие жизненные привычки, которые меньше загрязняют окружающую среду.

Я надеюсь, что с этой информацией вы сможете больше узнать о том, как происходит кислотный дождь и каковы его последствия.
Кислотные дожди | Экология природных ресурсов
Термин «кислотные дожди» был введен английским химиком Р.Э.Смитом более 100 лет назад.
В 1911 г. в Норвегии зафиксировали случаи гибели рыб в результате подкисления природной воды. Однако только в конце 60-х гг., когда аналогичные случаи в Швеции, Канаде, США привлекли внимание общественности, возникло подозрение, что причина — дождь с высоким содержанием серной кислоты.
Кислотные дожди — это атмосферные осадки (дождь, снег) с рН менее 5,6 (повышенной кислотностью).
Образуются кислотные дожди при промышленных выбросах в атмосферу диоксида серы и оксидов азота, которые, соединяясь с атмосферной влагой, образуют серную и азотную кислоты. В результате дождь и снег оказываются подкисленными (число рН ниже 5,6). В Баварии (ФРГ) в августе 1981 г. выпадали дожди с кислотностью рН = 3,5.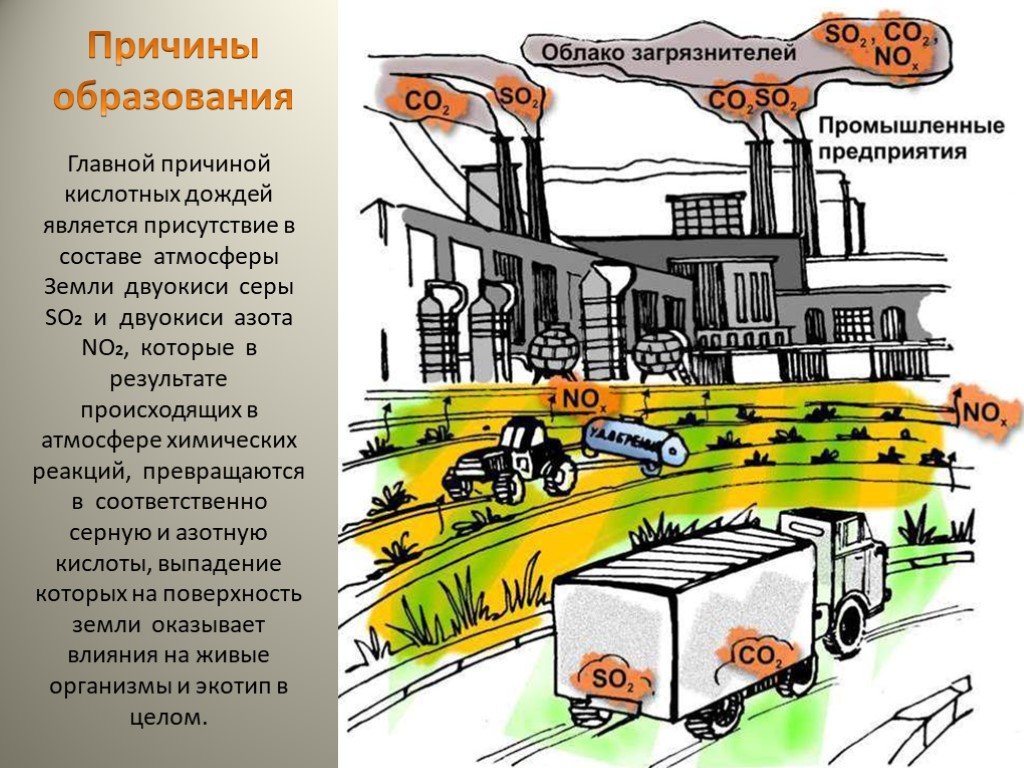 Максимальная зарегистрированная кислотность осадков в Западной Европе — рН =2,3.
Максимальная зарегистрированная кислотность осадков в Западной Европе — рН =2,3.
Суммарные мировые антропогенные выбросы оксидов серы и азота составляют ежегодно более 255 млн т (1994). Кислотообразующие газы надолго остаются в атмосфере и могут передвигаться на расстояния в сотни и даже тысячи километров. Так, значительная часть выбросов Великобритании попадает в северные страны (Швецию, Норвегию и др.), т.е. с трансграничным переносом, и наносит ущерб их экономике.
На огромной территории природная среда закисляется, что весьма негативно отражается на состоянии всех экосистем. Выяснилось, что природные экосистемы подвергаются разрушению даже при меньшем уровне загрязнения воздуха, чем тот, который опасен для человека.
Опасность представляют, как правило, не сами кислотные осадки, а протекающие под их влиянием процессы.
Кислотные дожди вымывают биогены из почвы. Частицы гумуса и глины обычно заряжены отрицательно и удерживают такие положительные ионы, как Са2+, К+, NH+. Просачивающаяся кислота уносит биогенные ионы, т. к. их вытесняет ионы водорода.
Просачивающаяся кислота уносит биогенные ионы, т. к. их вытесняет ионы водорода.
Под действием кислотных осадков из почвы выщелачиваются не только жизненно необходимые растениям питательные вещества, но и токсичные тяжелые и легкие металлы — свинец, кадмий, алюминий и др. Впоследствии они сами или образующиеся токсичные соединения усваиваются растениями и другими почвенными организмами, что ведет к весьма негативным последствиям. Например, возрастание в подкисленной воде содержания алюминия всего лишь до 0,2 мг на один литр летально для рыб, а токсичность тяжелых металлов (кадмия, свинца и др.) проявляется в еще большей степени.
Рефераты
Доклады
Презентации
Пятьдесят миллионов гектаров леса в 25 европейских странах страдает от действия кислотных дождей. Так, например, гибнут хвойные горные леса в Баварии. Отмечены случаи поражения хвойных и лиственных лесов в Карелии, Сибири и в других районах нашей страны.
Воздействие кислотных дождей и других загрязнителей снижает устойчивость лесов к засухам, болезням, природным загрязнениям, что приводит к еще более выраженной их деградации как природных экосистем.
Ярким примером негативного воздействия кислотных осадков на природные экосистемы является закисление озер. Особенно интенсивно оно происходит в Канаде, Швеции, Норвегии и на юге Финляндии. Объясняется это тем, что:
- значительная часть выбросов серы в таких промышленно развитых странах, как США, ФРГ и Великобритания, выпадает именно на их территории;
- коренные породы, слагающие ложе озер, обычно представлены гранитогнейсами и гранитами, не способными нейтрализовать кислотные осадки, в отличие, например, от известняков, которые создают щелочную среду и препятствуют закислению.
Закисление озер опасно не только для популяций различных видов рыб (в т. ч. лососевых, сиговых и др.), но часто влечет за собой постепенную гибель планктона, многочисленных видов водорослей и других обитателей водоемов. Озера становятся практически безжизненными. Так, в Канаде более 4 тыс. озер объявлены мертвыми, а еще 12 тыс. — на грани гибели. В южной части Норвегии в половине озер исчезла рыба.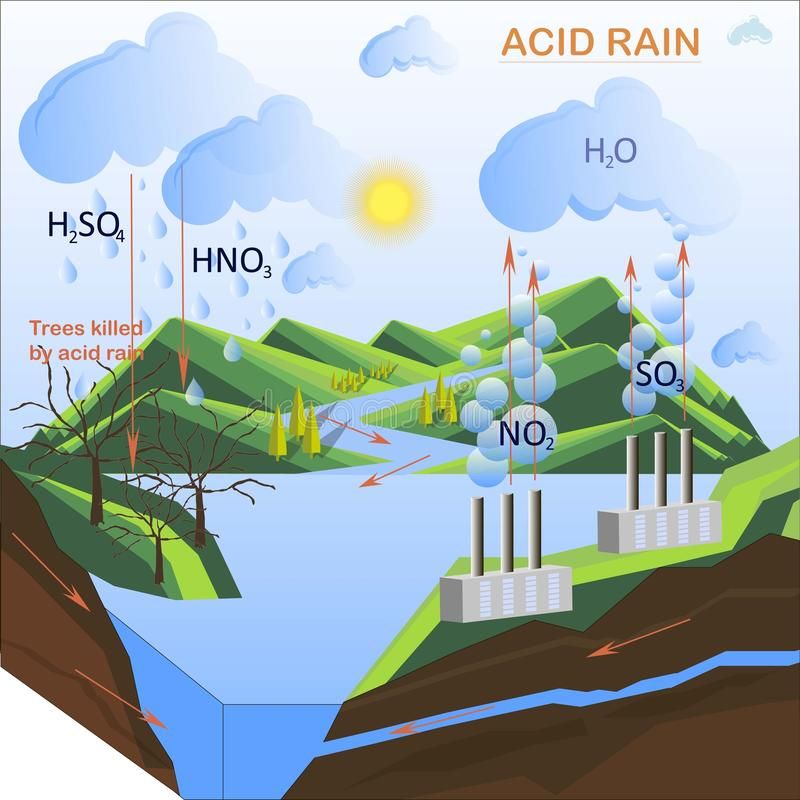 Кстати, если рН водной среды равно или меньше 4, то все живое в ней погибает.
Кстати, если рН водной среды равно или меньше 4, то все живое в ней погибает.
В нашей стране площадь значительного закисления от выпадения кислотных осадков достигает нескольких десятков миллионов гектаров. Отмечены и частные случаи закисления озер (Карелия и др.). Повышенная кислотность осадков наблюдается вдоль западной границы (трансграничный перенос серы и других загрязняющих веществ) и на территории ряда крупных промышленных районов, а также фрагментарно на побережье Таймыра и Якутии.
Парниковый эффект >
Загрязнение гидросферы >
Что такое кислотный дождь? | Поговорим о науке
AB 11 Биология 20 (2007 г., обновлено в 2014 г.) Блок А: Обмен энергией и веществом в биосфере
AB 10 Наука о знаниях и трудоустройстве 10-4 (2006) Блок D: Исследование вещества и энергии в экологических системах
AB 10 Наука 14 (2003 г., обновлено в 2014 г.) Блок D: Исследование вещества и энергии в экологических системах
AB
11
Наука 20 (2007 г. , обновлено в 2014 г.)
Блок D: Изменения в живых системах
, обновлено в 2014 г.)
Блок D: Изменения в живых системах
до н.э. 9 Наука 9 класс(июнь 2016 г.) Большая идея: Биосфера, геосфера, гидросфера и атмосфера взаимосвязаны, поскольку через них проходит круговорот материи и течет энергия.
МБ 10 Старший 2 науки (2001) Кластер 1: Динамика экосистем
NB 9 Наука 9: Динамика экосистем (2020) Экосистемы: энергия, материя и взаимодействия
NL 10 Наука 1206 (2018) Блок 4: Устойчивость экосистем
NL 11 Наука 2200 (2004) Блок 1: Экосистемы
NS 10 Наука 10 (2012, 2019) Науки о жизни: устойчивость экосистем
НУ 10 Экспериментальная наука 10 — Земные системы Блок 3: Экология земли
NU 11 Биология 20 (Альберта, 2007 г., обновлено в 2014 г.) Блок А: Обмен энергией и веществом в биосфере
NU 10 Наука о знаниях и трудоустройстве 10-4 (2006) Модуль D: Исследование вещества и энергии в экологических системах
NU 10 Наука 14 (2003 г., обновлено в 2014 г.) Модуль D: Исследование вещества и энергии в экологических системах
NU
11
Science 20 (Альберта, 2007 г. , обновлено в 2014 г.)
Раздел D: Изменения в живых системах
, обновлено в 2014 г.)
Раздел D: Изменения в живых системах
ВКЛ. 11 Экология, 11 класс, рабочее место (SVN3E) Направление B: Воздействие человека на окружающую среду
PE 9 Естествознание, 9 класс (пересмотрено в 2018 г.) Знание содержания: CK 1
PE 10 Наука 431A (без даты) Блок 1: Экосистемы
PE 12 Наука об окружающей среде 621A (2011) Экологические принципы
КК Раздел IV Экологические науки и технологии Земля и космос
YT 9 Science Grade 9 (Британская Колумбия, июнь 2016 г.) Большая идея: Биосфера, геосфера, гидросфера и атмосфера взаимосвязаны, поскольку через них проходит круговорот материи и течет энергия.
СК 7 Наука 7 класс (2009) Науки о жизни – взаимодействие внутри экосистем (IE)
SK 10 Наука 10 (2016) Динамика климата и экосистем
SK 11 Наука об окружающей среде 20 (2016) Наземные экосистемы
NT 11 Биология 20 (Альберта, 2007 г., обновлено в 2014 г.) Блок А: Обмен энергией и веществом в биосфере
NT
10
Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г. )
Модуль D: Исследование материи и энергии в экологических системах
)
Модуль D: Исследование материи и энергии в экологических системах
NT 10 Наука 14 (Альберта, 2003 г., обновлено в 2014 г.) Модуль D: Исследование вещества и энергии в экологических системах
НТ 11 Science 20 (Альберта, 2007 г., обновлено в 2014 г.) Модуль D: Изменения в живых системах
NT 10 Экспериментальная наука 10 — Земные системы Блок 3: Экология земли
ON 9 9 класс естественных наук (SNC1W) (2022) Направление B: Устойчивые экосистемы и изменение климата
AB 12 Наука 30 (2007 г., обновлено в 2014 г.) Блок B: Химия и окружающая среда
NL 12 Науки об окружающей среде 3205 (пересмотрено в 2010 г.) Блок 5: Атмосфера и окружающая среда
NU 12 Science 30 (Альберта, 2007 г., обновлено в 2014 г.) Раздел B: Химия и окружающая среда
НТ 12 Science 30 (Альберта, 2007 г., обновлено в 2014 г.) Модуль B: Химия и окружающая среда
МБ 10 Старший 2 науки (2001) Кластер 4: Динамика погоды
NB
3
Наука 3: Наша местная среда, октябрь (2019 г.
NL 10 Наука 1206 (2018) Блок 1: Weather Dynamics
NL 11 Наука 2200 (2004) Блок 2: Weather Dynamics
NS 10 Наука 10 (2012, 2019) Науки о Земле и космосе: динамика погоды
NU 10 Экспериментальная наука 10 — Земные системы Блок 2: Климатология и метеорология
ВКЛ. 12 Химия, 12 класс, Колледж (СЧ5С) Strand F: Химия в окружающей среде
PE 10 Наука 431A (без даты) Блок 4: Погодные системы
AB 11 Наука о знаниях и трудоустройстве 20–4 (2006 г.) Модуль A: Применение вещества и химических изменений
AB 11 Наука 24 (2003 г., обновлено в 2014 г.) Модуль A: Применение вещества и химических изменений
AB 10 Наука о знаниях и трудоустройстве 10-4 (2006) Модуль A: Исследование свойств материи
AB 9Наука о знаниях и трудоустройстве 8, 9 (пересмотрено в 2009 г.) Модуль C: Химия окружающей среды
AB 10 Наука 10 (2005 г., обновлено в 2015 г.) Модуль A: Энергия и материя в химическом изменении
AB
10
Наука 14 (2003 г.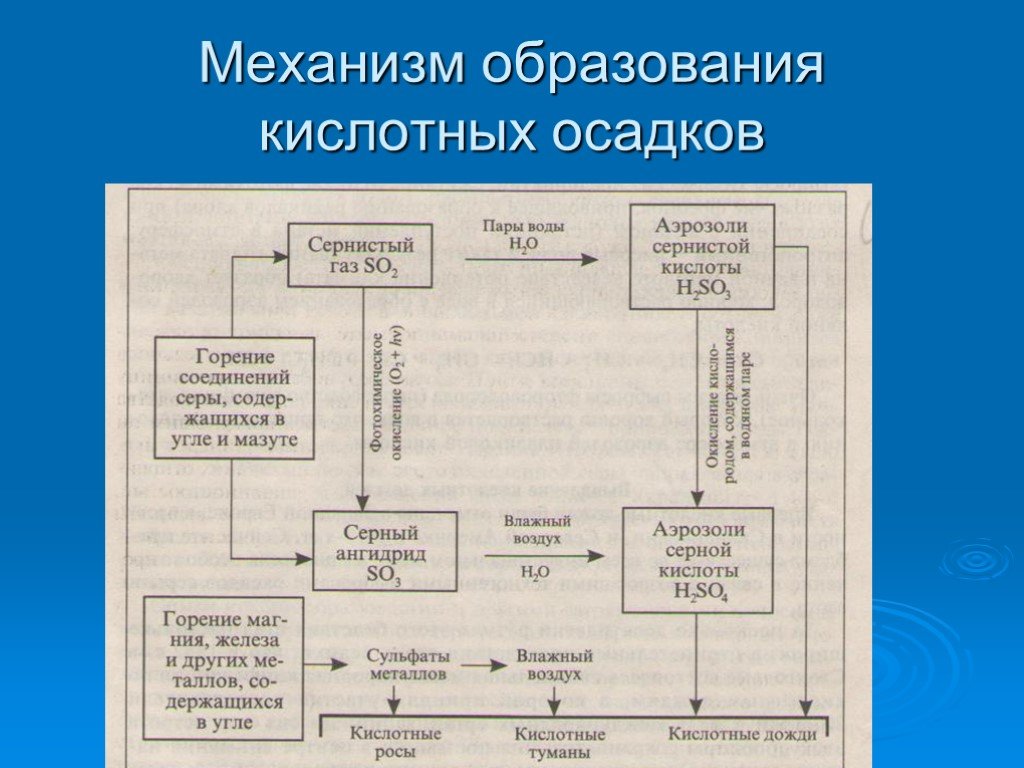 , обновлено в 2014 г.)
Модуль A: Исследование свойств материи
, обновлено в 2014 г.)
Модуль A: Исследование свойств материи
AB 11 Химия 20 (2007 г., обновление 2014 г.) Модуль C: Вещество в виде растворов, кислот и оснований
AB 12 Химия 30 (2007 г., обновление 2014 г.) Раздел D: Химическое равновесие с акцентом на кислотно-основные системы
AB 9Наука 7-8-9 (2003 г., обновлено в 2014 г.) Модуль C: Химия окружающей среды
BC 10 Естествознание 10 класс (март 2018 г.) Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
до н.э. 11 Химия 11 (июнь 2018 г.) Большая идея: материя и энергия сохраняются в химических реакциях.
до н.э. 12 Химия 12 (июнь 2018 г.) Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
МБ 10 Старший 2 науки (2001) Кластер 2: Химия в действии
МБ 12 Химия 12 класс (2013) Тема 1: Реакции в водных растворах
MB 12 Химия 12 класс (2013) Тема 5: Кислоты и щелочи
NB 12 Химия 121/122 (2009) Раздел 3: Кислоты и основания
NL 10 Наука 1206 (2018) Блок 2: Химические реакции
NL 12 Химия 3202 (2005) Раздел 2: Кислоты и основания
NL 12 Наука 3200 (2005) Модуль 1: Химические реакции
NS 10 Наука 10 (2012, 2019) Физические науки: химические реакции
NS 12 Химия 12 (2009), 2019) Кислоты и основания
NU
11
Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г. )
Модуль A: Применение вещества и химических изменений
)
Модуль A: Применение вещества и химических изменений
NU 11 Science 24 (Альберта, 2003 г., обновлено в 2014 г.). Модуль A: Применение вещества и химических изменений
NU 10 Наука о знаниях и трудоустройстве 10-4 (2006) Модуль A: Исследование свойств материи
NU 10 Наука 10 (2005 г., обновлено в 2015 г.) Модуль A: Энергия и материя в химическом изменении
NU 10 Наука 14 (2003 г., обновлено в 2014 г.) Модуль A: Исследование свойств материи
НУ 11 Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) Модуль C: Материя в виде растворов, кислот и оснований
NU 12 Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) Модуль D: Химическое равновесие с акцентом на кислотно-основные системы
NU 10 Наука, 10 класс (Британская Колумбия, июнь 2016 г.) Большая идея: требуется изменение энергии, поскольку атомы перестраиваются в химических процессах.
ВКЛ. 10 Прикладные науки 10 класса (SNC2P) Strand C: Химические реакции и их практическое применение
ON 10 Естествознание, 10 класс, академический (SNC2D) Нить C: Химические реакции
ВКЛ.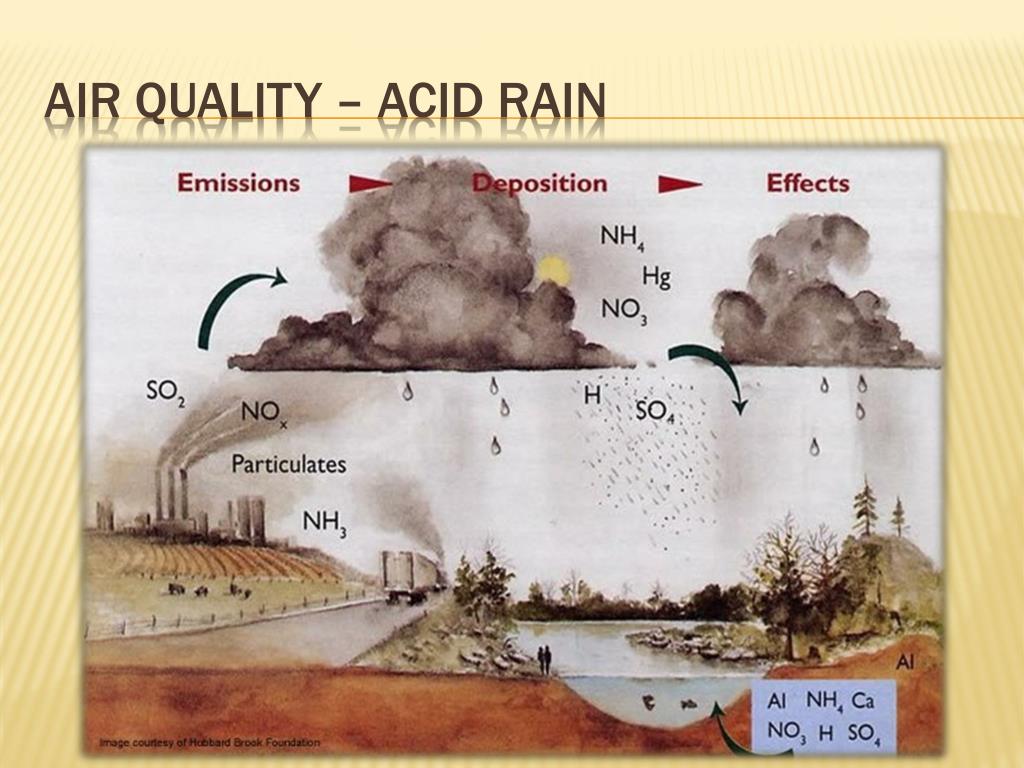 11
Химия, 11 класс, университет (СЧ4У)
Цепь C: Химические реакции
11
Химия, 11 класс, университет (СЧ4У)
Цепь C: Химические реакции
ON 11 Химия, 11 класс, университет (СЧ4У) Цепь E: растворы и растворимость
ON 12 Наука, 12 класс, рабочее место (SNC4E) Цепь C: Химические вещества в потребительских товарах
PE 10 Наука 421А (2019) Знание содержания: CK 2.2
PE 10 Наука 431A (без даты) Модуль 2: Химические реакции
PE 12 Химия 621А (проект 2021 г.) Знание содержания: CK 3.1, 3.2, 3.3
QC Раздел IV Экологические науки и технологии Материальный мир
Контроль качества Раздел IV Наука и технология Материальный мир
КК Раздел V Химия Химическое равновесие
Контроль качества Раздел I Наука и технология Материальный мир: Организация
QC Раздел II Наука и технология Материальный мир: Организация
YT 11 Химия 11 (Британская Колумбия, июнь 2018 г.) Большая идея: материя и энергия сохраняются в химических реакциях.
ЮТ
12
Химия 12 (Британская Колумбия, июнь 2018 г.)
Большая идея: Сила кислоты или основания зависит от степени диссоциации ионов.
СК 11 Физические науки 20 (2016) Основы химии
SK 12 Химия 30 (2016) Химические равновесия
NT 9 Наука о знаниях и трудоустройстве 9 (Альберта, редакция 2009 г.) Модуль C: Химия окружающей среды
NT 11 Наука о знаниях и трудоустройстве 20–4 (Альберта, 2006 г.) Модуль A: Применение материи и химических изменений
NT 11 Science 24 (Альберта, 2003 г., обновлено в 2014 г.). Модуль A: Применение материи и химических изменений
NT 10 Наука о знаниях и трудоустройстве 10-4 (Альберта, 2006 г.) Модуль A: Исследование свойств материи
НТ 10 Science 10 (Альберта, 2005 г., обновлено в 2015 г.) Модуль A: Энергия и материя в химическом изменении
NT 10 Наука 14 (Альберта, 2003 г., обновлено в 2014 г.) Модуль A: Исследование свойств материи
NT 11 Химия 20 (Альберта, 2007 г., обновлено в 2014 г.) Модуль C: Вещество в виде растворов, кислот и оснований
NT 12 Химия 30 (Альберта, 2007 г., обновлено в 2014 г.) Раздел D: Химическое равновесие с акцентом на кислотно-щелочные системы
Кислотный дождь | Воздух
Воздух
- Кислотный дождь
- Смог
- Озоновый слой
- Курсы
- Правила
- Принятие мер
- Научный форум 2006 г.

- Повестка дня
- Презентации
- Глоссарий
- Ссылки
Сопутствующие
- Данные о качестве окружающего воздуха
- Индекс качества воздуха
Загрязняющие вещества в атмосфере смешиваются с водой в воздухе, образуя кислотные дожди. Двуокись серы (SO 2 ) и оксиды азота (NO x ) являются двумя основными загрязнителями, образующими кислотные дожди. SO 2 реагирует с водой на воздухе с образованием сернистой кислоты (H 2 SO 3 ), а затем с кислородом с образованием серной кислоты (H 2 SO 4 ). NO x реагирует с водой с образованием азотной кислоты (HNO 3 ).
Кислотные дожди наносят ущерб наземным и водным экосистемам, а также искусственным материалам и конструкциям, таким как здания и статуи. Воздействие на здоровье человека, по-видимому, в основном связано с SO 2 и с образованием мелких частиц и озона (основных компонентов смога) из SO 2 и NO x .
Повреждение наземных и водных экосистем происходит, когда земля, вода или растения, такие как деревья и сельскохозяйственные культуры, не могут нейтрализовать кислоту, выделяемую дождем. Высокий уровень кислотности может уничтожить жизнь в наших озерах и реках и замедлить рост лесов. Новая Шотландия имеет низкую устойчивость к кислотным осадкам из-за низкой буферной способности и нейтрализующей способности водных и наземных экосистем на большей части территории провинции, особенно на юго-западе Новой Шотландии.
На этой карте красным цветом отмечены районы, где озера чрезвычайно чувствительны к подкислению, а оранжевым — районы, где озера очень чувствительны. (Источник: Состояние окружающей среды Новой Шотландии, июль 1998 г.)
Критическая нагрузка – это количество кислотных осадков, которое может выдержать экосистема до того, как возникнут долгосрочные вредные последствия. Порог критической нагрузки для озер Новой Шотландии составляет 8 кг сульфата на гектар в год (кг/га/год).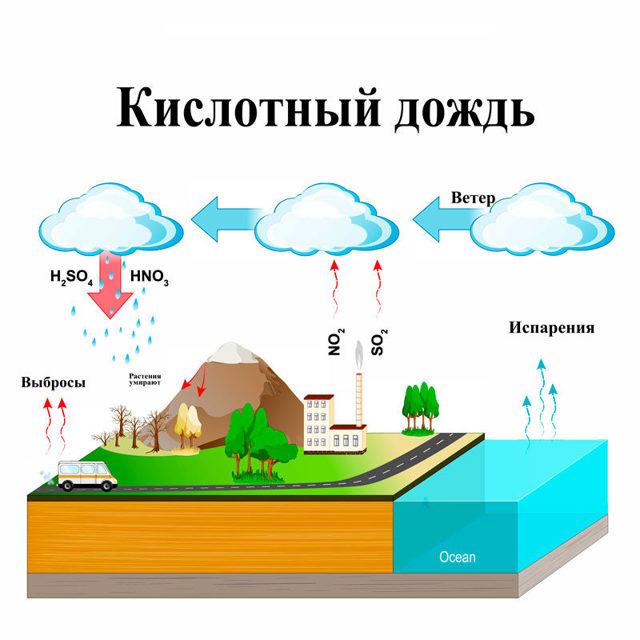
Существующие критические нагрузки (кг/га/год) были разработаны только для водных экосистем и были определены как уровень влажных отложений сульфатов, который поддерживал бы рН 6 в 95% озер (Канадская оценка кислотных дождей 1997 г.). (pH 6 является эталонным порогом для поддержания систем пресной воды).
Совсем недавно наука о критических нагрузках и измерениях для их поддержания продвинулась вперед, и были разработаны критические нагрузки для наземных экосистем. Впервые это позволило разработать карты «комбинированной экосистемы (водной и земельной) критической нагрузки». Эти комбинированные карты экосистем выражаются в других единицах (экв/га/год), чем только водные экосистемы (кг/га/год), потому что в расчетах необходимо комбинировать различные химические вещества и влажные и сухие отложения.
На приведенной выше карте показаны критические нагрузки для лесных почв восточной Канады (Онтарио, Квебек, Нью-Брансуик и Новая Шотландия). В Новой Шотландии одни из самых низких пороговых значений критических нагрузок в восточной Канаде.
 Затронуто и флора, и фауна, и вода больше не пригодна для питья. Все это приводит к увеличению количества последующих обработок и удорожанию питьевой воды.
Затронуто и флора, и фауна, и вода больше не пригодна для питья. Все это приводит к увеличению количества последующих обработок и удорожанию питьевой воды. Вы просто должны увидеть, что многие статуи и памятники серьезно пострадали из-за частых выпадений кислотных дождей в загрязненных местах.
Вы просто должны увидеть, что многие статуи и памятники серьезно пострадали из-за частых выпадений кислотных дождей в загрязненных местах.
