минеральный комплекс для восстановления костной ткани – инструкция на ProPharma
- Про-Фарма
- Продукты
- Диетические добавки
- Остеопро 14 шт
Диетические добавки
Osteopro
Минеральный комплекс ОСТЕОПРО рекомендован для восполнения кальция в организме, при остеопорозе и для ускорения сращения костей при переломах. Минеральная часть средства представлена кальцием, фосфором и другими элементами, которые способствуют полному усвоению кальцию из ЖКТ и улучшению его фиксации в костях. В органическую составляющую входят протеины, которые усиливают остеогенный эффект.
Скачать инструкциюИнформация
Показания к применению (инструкция): Остеопро 14 шт
ОСТЕОПРО® (OSTEOPRO®) является дополнительным источником кальция, фосфора и белков (коллагена, факторов роста, остеокальцина). Рекомендуется с целью регуляции кальциево-фосфорного обмена при дефиците кальция в организме, остеопорозе и для улучшения роста костей при переломах.
Рекомендуется с целью регуляции кальциево-фосфорного обмена при дефиците кальция в организме, остеопорозе и для улучшения роста костей при переломах.
Способ применения
При переломах: с первого дня перелома и в течение 14 дней рекомендуется принимать по 1 таблетке в сутки, запивая небольшим количеством питьевой воды, желательно во время приема пищи. С 15-го дня рекомендуется перейти на прием по 2 таблетки в сутки (в 2 приема), запивая небольшим количеством питьевой воды, желательно во время приема пищи. Для облегчения глотания таблетки можно разжевать. По рекомендации врача рекомендуемая суточная доза может быть увеличена. Курс применения определяется индивидуально. Минимально рекомендованный курс применения составляет 1 месяц. Перед применением рекомендуется консультация врача.
При других состояниях с целью регуляции кальциево-фосфорного обмена, при дефиците кальция в организме, остеопорозе: принимать взрослым по 2-4 таблетки в сутки (в 2 приема), запивая небольшим количеством питьевой воды, желательно во время приема пищи. Для облегчения глотания таблетки можно разжевать. По рекомендации врача рекомендуемая суточная доза может быть увеличена. Курс применения определяется индивидуально. Минимально рекомендованный курс применения составляет 1 месяц. Перед применением рекомендуется консультация врача.
Для облегчения глотания таблетки можно разжевать. По рекомендации врача рекомендуемая суточная доза может быть увеличена. Курс применения определяется индивидуально. Минимально рекомендованный курс применения составляет 1 месяц. Перед применением рекомендуется консультация врача.
Противопоказания
Индивидуальная непереносимость компонентов, гиперкальциемия, гиперкальциурия, мочекаменная болезнь, кальциноз тканей, тяжелые нарушения функции почек, гиперпролиферативные процессы.
Состав
1 таблетка содержит: активный ингредиент: микрокристаллический гидроксиапатитный комплекс МСНАтм (МСН-Саlтм) — 1000 мг (mg) Вспомогательные вещества: наполнители: целлюлоза микрокристаллическая, натрия карбоксиметилцеллюлоза, гидроксипропилцеллюлоза; антиспекающие агенты: магния стеарат, двуокись кремния аморфный.
МСНАтм (МСН-Саlтм) — включает 250 мг (mg) протеинов (коллагена I типа и неколлагеновых пептидов, в том числе инсулиноподобный фактор роста I и II типа (IGF1 — 0,285 мкг (μg), IGF2 — 0,17 мкг (μg) ), трансформирующий ростовой фактор бета (TGF-β — 0,0275 мкг (μg)), остеокальцин — 604 мкг (μg)) и 670 мг (mg) гидроксиапатита кальция (в том числе 250 мг (mg) кальция, 125 мг (mg) фосфора, 4 мг (mg) магния, 64 мкг (μg) цинка, 3,9 мкг (μg) железа и 1,4 мкг (μg) бора).
** типичное усредненное содержание компонентов.
Без ГМО.
Форма выпуска
Упаковка, 14 таблеток в банке.
Производитель
Др. Густав Кляйн ГмбХ & Ко. КГ, Германия.
Санитарно-гигиеническое заключение
№43 от 31.07.2020
Данный продукт не является лекарственным средством.
Официальный сайт
Остеопро 14 штРеклама диетической добавки. Не является лекарственным средством.
Линейка продуктов
Гормоны и остеопороз | Ширалиев
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев [12, 37]. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом [2, 35]. Возникновение остеопороза в пожилом возрасте у женщин обусловлено’ ■уменьшением ‘ выработки эстрогенов [6]. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
В связи с изложенным целью настоящей работы явилось обобщение данных литературы о влиянии гормонов на возникновение и развитие остеопороза.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм [42].
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты [40].
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются [49].
Процесс ремоделирования кости делится на пять фаз [42]. В здоровом взрослом организме в состоянии покоя находится до 80 % трабекулярной и 95 % кортикальной костной ткани. Фаза активации, возникающая в каждом участке кости с интервалом 2—3 года, включает в себя пролиферацию и активацию предшественников остеокластов в гемопоэтической ткани, поступление и прикрепление мультиядерных остеокластов к поверхности резорбируемого участка. Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
На основании физиологических процессов костного ремоделирования было предложено несколько возможных вариантов возникновения остеопороза [13]. Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
В патогенезе развития остеопороза оба этих механизма имеют место. Так, при остеопорозе, возникающем сначала в метаболически более активной трабекулярной ткани, уменьшаются количество и толщина пластинок, полости, находящиеся между пластинами, увеличиваются за счет перфораций последних. Эти изменения обусловлены нарушением баланса между глубиной резорбированных полостей и толщиной вновь возникающих пластинок [43].
Одним из наиболее активных гормонов, влияющих на процессы обновления кости, является паратиреоидный гормон (ПТГ). Основная его функция заключается в поддержании в организме гомеостаза кальция. Уменьшение концентрации кальция в плазме приводит к выбросу паращитовидными железами гормона, который, воздействуя на почки, увеличивает реабсорбцию кальция в канальцах и экскрецию фосфатов, а на уровне костной ткани вызывает ее резорбцию и выход кальция во внеклеточную жидкость [10].
Уже через 30 мин после введения ПТГ количество и активность остеокластов увеличиваются. Однако эта реакция не наблюдается при воздействии ПТГ на изолированные остеокласты, а происходит лишь при добавлении к ним остеобластов. Дальнейшие исследования показали, что остеобласты и их предшественники имеют на своей поверхностной мембране рецепторы к ПТГ [53], в то время как на остеокластах таких рецепторов не обнаружено. На основании полученных результатов было предположено [47] существование связи между ПТГ-активными остеобластами и ПТГ-нечувствитель- ными остеокластами. Оказалось, что остеобласты являются основным звеном, запускающим и контролирующим резорбцию кости. Под воздействием ПТГ наблюдается пролиферация остеобластов, морфологически они из округлой формы приобретают звездообразную, происходит деполяризация мембраны и изменяется ферментативная активность, ингибируется синтез коллагена, остеокальцина и щелочной фосфатазы, увеличивается синтез коллагеназы. С целью стимуляции остеокластов к резорбции остеобласты выделяют водорастворимый фактор размером 0,5—2,0 кД, который блокируется ингибиторами липоксигеназы [31]. Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Указанные изменения возникают при повышении концентрации ПТГ в плазме. В то же время практически невозможно объяснить стимулирующее действие малых доз ПТГ на костеобразование [21].
У женщин в период постменопаузы отмечается отрицательный баланс кальция, хотя его концентрация в плазме повышается и снижается до нормального уровня при заместительной гормональной терапии [41]. Противоречивые результаты получены при исследовании ПТГ в постменопаузе. В раннем периоде концентрация ПТГ несколько снижается, через 3 года после наступления не меняется или незначительно повышается, а при проведении эстрогенотерапии уровень ПТГ возвращается к исходным показателям [34]. У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
Антагонистом ПТГ является кальцитонин (КТ). Уже через несколько минут после добавления КТ к культуре остеокластов отмечается уменьшение количества ядер в них, а затем и общего количества, значительно снижается подвижность и их резорбционная способность, они покидают поверхность кости. Такая быстрая реакция остеокластов обусловлена тем, что они имеют на своей мембране рецепторы к КТ [38]. Молекулярные механизмы воздействия КТ на остеокласты связаны с увеличением образования циклического аденозинмонофосфата в них [39]. Кроме этого, остеокласты под воздействием КТ начинают вырабатывать пептид, называемый кальцитонин- генсвязанный пептид, который, действуя на остеобласты, заставляет их синтезировать циклический аденозинмонофосфат [32].
У здоровых людей имеется разница в концентрации КТ в плазме в зависимости от пола и возраста: у женщин эти значения ниже, чем у мужчин [54], с возрастом наблюдается уменьшение концентрации КТ в плазме. Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Наиболее часто остеопороз поражает женщин со сниженной гормональной функцией яичников, вне зависимости от причин, вызывающих это состояние. Позднее менархе, менопауза, аменорея у спортсменок и балетных танцоров, оперативное удаление яичников, пролактинсекретирующие опухоли, синдром Тернера приводят к деминерализации кости [28].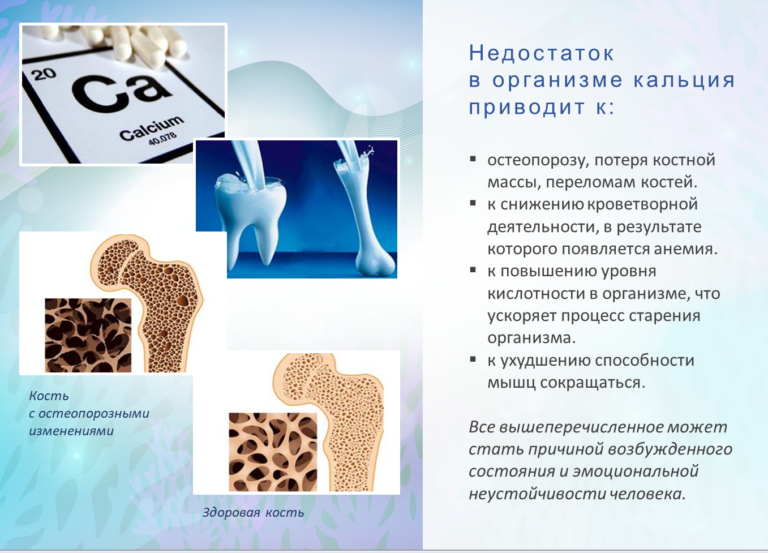 Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Механизм действия эстрогенов на процессы обновления кости остается спорной проблемой. В условиях дефицита эстрогенов наблюдаются как замедление формирования новой кости, так и ускоренная костная резорбция. В последнее время
опубликованы работы, в которых показано наличие рецепторов к эстрогенам на мембране остеобластов [9, 26]. Однако до этих исследований считалось, что эстрогены дают защитный эффект от воздействия ПТГ на костную ткань, а также увеличивают продукцию эндогенного КТ [34, 51].
Уменьшение выработки андрогенов как первичного генеза, так и вторичного (вследствие гипогонадотропного гипогонадизма) приводит к остеопорозу [24]. Отмечается положительная корреляционная зависимость между уровнем тестостерона в плазме и массой кости при различных формах гипогонадизма [II]. У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
Роль других половых гормонов в процессах ремоделирования кости остается неизвестной, хотя имеются отдельные клинические наблюдения. Гиперпролактинемия сопровождается значительным снижением минеральной плотности кости, а терапия этого состояния способствует увеличению показателя |25]. У мужчин с гиперпролактинемией также отмечается уменьшение массы кости, а нормализация уровня тестостерона и пролактина вызывает ее увеличение (16].
Глюкокортикоиды (ГК) оказывают значительное влияние на процессы обновления кости. Считается, что 50 % больных с болезнью Иценко — Кушинга и 30—50 % больных, хронически принимающих ГК, страдают остеопорозом. Оперативное лечение детей с болезнью Иценко — Кушинга повышает минеральную плотность кости [45].
Воздействие ГК на кости обусловлено множеством факторов, среди которых основное значение имеет нарушение обмена кальция, связанное с уменьшением его абсорбции в кишечнике и увеличением экскреции с мочой, снижение выработки половых гормонов на всех уровнях и непосредственное влияние на клетки костной ткани (50].
Наиболее противоречивые данный получены при изучении прямого действия ГК на костную ткань. В физиологических дозах в первые сутки ГК усиливают функцию остеобластов и их способность синтезировать коллаген, а в последующем эта активность резко снижается [5]. ГК ингибируют превращения предшественников остеобластов, уменьшают время их активности, т. е. угнетают костеобразование. Воздействие ГК на остеокласты осуществляется, по-видимому, опосредованно через остеобласты. Несмотря на то что ГК увеличивают мобилизацию минералов кости усилением резорбции, они ингибируют созревание предшественников остеокластов и количество их снижается [52].
Одним из множества эффектов тиреоидных гормонов является их способность оказывать влияние на процессы обновления кости. В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипотиреоза наблюдается уменьшение количества обновляющихся участков, резко увеличивается продолжительность всех фаз цикла ремоделирования, снижается резорбционная активность остеокластов, уменьшается способность остеобластов к формированию кости и ее минерализации [55].
Интересная особенность выявлена при лечении гипотиреоза тиреоидными препаратами. Все они вызывают остеопороз, хотя сроки его возникновения, по данным разных авторов, колеблются от 6 мес до 10 лет [12, 44]. По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
Сахарный диабет (СД) наряду с метаболическими нарушениями различных органов и систем организма сопровождается изменениями в костной системе. У больных СД I типа длительностью более 5 лет отмечается уменьшение минеральной плотности кости по сравнению со здоровыми людьми того же возраста и пола [30, 57]. Особенно значительные изменения отмечаются у больных, заболевших в детском и юношеском возрасте, с большими дозами инсулина и плохим контролем. Отмечается изменение обмена кальция, проявляющееся увеличением экскреции кальция и фосфора, что приводит к уменьшению их концентраций в плазме. На этом фоне наблюдается парадоксальное уменьшение концентрации ПТГ в плазме у больных как без нарушения функции почек, так и со снижением их функционального состояния (19]. При этом уровень КТ не изменяется [48]. В патогенезе развития остеопороза у больных СД основное значение придается метаболическим и гормональным изменениям, диабетической ангиопатии [20]. Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Гормон роста — один из важнейших гормонов при росте костей, особенно их эпифизов. Он оказывает активирующее влияние на остеобласты локальным выделением соматомеди- на С, известного как инсулиноподобный фактор роста I. Этот пептид вызывает пролиферацию остеобластов, стимулирует синтез ДНК и протеинов. С возрастом продукция гормона роста снижается, однако это уменьшение не коррелирует с возрастными изменениями костной ткани. Использование гормона роста при остеопорозе оказалось неэффективным [1].
Анализ литературных публикаций показывает, что в течение жизни происходит постоянное обновление костной ткани. Наиболее активно на этот процесс оказывают влияние ПТГ и КТ через активацию или ингибирование клеточных элементов кости. Дефицит эстрогенов одна из самых широко распространенных причин остеопороза приводит к снижению костеобразования и ускорению резорбции кости. Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
1. Aloia J. F., Vaswani A., Kapoor A. et al. // Metabolism.—1985—Vol. 34,—P. 124—129.
2. Auwera J., Bouillon R. // Quart. J. Med.— 1986.— Vol. 60,— P. 737—752.
3. Baron R. 11 Anat. Rec.— 1989,—Vol. 224,— P. 317—324.
4. Burckhardt P. // Hormone Res.— 1984.— Vol. 20.— P. 59— 64.
5. Canalis E. M. // Endocrinology.— 1983.— Vol. 112.— P. 931—939.
6. Compston J. E. // Clin. Endocr.— 1990.— Vol. 3.— P. 653—682.
7. Eastell R., Riggs B. L. // Clin. Obstet. Gynec.—1987— Vol. 30,— P. 860—870.
8. Eisman J. E. // Aust. Prescriber.— 1984. — Vol. 7.—
— Vol. 7.—
9. P. 34—36.
10. Eriksen E. F., Colvard D. S., Berg N. J. 11 Science.—1987—Vol. 241,— P. 84—86.
11. Evans R. A., Hills E. // Aust. N. Z. J. Ophthal.—1987— Vol. 17.— P. 121 — 124.
12. Foresta C., Ruzza G., Mioni R. et al. // Hormone Res.— 1984,-Vol. 19,—P. 18—22.
13. Franklyn J. A., Sheppard M. C. // Brit. med. J.—1987— Vol. 300,— P. 693—694.
14. Frost H. M. // Clin. Orthopaed. Relat. Res.— 1985.— Vol. 200,— P. 198-225.
15. Gennari C., Motagnani M., Nardi P., Civitelli R. // International Conference on Osteoporosis: Social and Clinical Aspects, 2-d.— Milan, 1986.— P. 240—254.
16. Greenberg С. P., Kukreja S. C., Bowser E. N. et al. // Endocrinology.— 1986,—Vol. 118,— P. 2594—2598.
17. Greenspan S. L., Neer R. M., Ridgway E. C., Klibanski A. 11 Ann. intern. Med.— 1986.— Vol. 104.— P. 777—782.
18. Greenspan S. L., Oppenheim D. S., Klibanski A. // Ibid.— 1989,—Vol. ПО,— P. 526—531.
19. Guimond J., Picard D., Chartrand R. et al. // Un. med. Can.—1986,—Vol. 115,—P. 529—532.
et al. // Un. med. Can.—1986,—Vol. 115,—P. 529—532.
20. Heidbreder E., Gotz R., Schafferhans K-, Heidland A. 11 Nephron.— 1986.— Vol. 42.— P. 285—289.
21. Hough F. S. 11 S. Afr. med. J.— 1987,— Vol. 72 — P. 116—119.
22. Howard G. A., Bottemiller B. L., Turner R. I. 11 Proc. nat. Acad. Sci. USA.— 1981.— Vol. 78.— P. 3204— 3208.
23. Huffer W. F. // Lab. Invest.— 1988,—Vol. 59.—P. 418— 442.
24. Hurley D. L, Tiegs R. D„ Wahner H. W., Heath H. Ill // New Engl. J. Med.— 1987.— Vol. 317— P. 537—541.
25. Jackson J. A., Kleerekoper M. // Medicine (Baltimore).— 1990,— Vol. 69.- P. 137-152.
26. Klibanski A., Greenspan S. L. // New Engl. J. Med.—1985— Vol. 315.— P. 542—546.
27. Komm B. S., Terpening C. A., Benz D. J. // Science.—1988— Vol. 241. P. 8 1-—.
28. Lefy J. R., Murry E., Manolagas S. // Endocrinology.— 1986.— Vol. 119. — P. 1786—1702.
29. Lindsay R. // Clin. Obstet. Gynec.— 1987.— Vol. 30.— P. 847—850.
30. Lindsay R. // Schweiz, med. Wschr.— 1980.— Bd 1D.— S..L806—1810.
Wschr.— 1980.— Bd 1D.— S..L806—1810.
31. McNair P. // Dan. med. Bull.— 1988.— Vol. 35,— P. 100— 121.
32. McSheehy P. M. J., Chambers T. J. // Endocrinology.— 1986.— Vol. 119.—P. 1654—1650.
33. Martin T. J., Kong Wah Ng, Suda T. // Endocr. Metab.—1989— Wo 1 8,— — . 838—W8.
34. Mazzuoli G. F., Passeri M., Gennari C. et al. Il Calcif. Tiss. int.— 1986,— Vol. 38,— P. 3—8.
35. Mazzuoli G. F., D’erasmo D, Minisola S. et al. // Clin. Rheum.— 1988.— Vol. 8.— Suppl. 2.— P. 22—20.
36. Milhaud G. // J. med. nucl. Biophys.— 1988.— Vol. 12.— P. 71—72.
37. Mosekilde L., Eriksen E. F., Chartes P. Il Endocr. Metab. Clin. N. Amer.— 1990.— Vol. 19,— P. 35.
38. National Institutes of Health: Consensus Conference. Osteoporosis // J. A. M. A.— 1984.— Vol. 252,— P. 700—802.
39. Nicholson G. C., Moseley J. Al., Sexton P. M, et al. // J. clin. Invest.— 1986,— Vol. 78. — P. 355—360.
40. Nicholson G. C., Livesey S. A., Moseley J. Л4., Martim T. J. // J. Cell Biochem.— 1986,— Vol. 31,— P. 220—236.
Cell Biochem.— 1986,— Vol. 31,— P. 220—236.
41. Nijweide P. J., Burger E. H, Feyen J. H. M. // Physiol. Rev.— 1986.— Vol. 66,— P. 855—886.
42. Nordin B. Е. Ch., Morris H. A. Il Nutr. Rev.— 1989.— Vol. 47.— P. 65—72.
43. Parfitt A. M. // Clin. Obstet. Gynec.— 1987.— Vol. 30.— P. 780—811.
44. Parfitt A. M. // Amer. J. Med.— 1987.— Vol. 82, Suppl. IB.— P. 68—72.
45. Paul T. L., Kerrigan J., Kelly A. A4 et al. Il J. A. M. A.— 1988,— Vol. 250,— P. 3137—3141.
46. Pocock N. A., Eisman J. A., Dunstan C. R. et al. // Ann. intern. Med.— 1987,— Vol. 107.— P. 3D—323.
47. Reginsier I. J., Deroisy R., Denis D. et al. Il Acta belg. med. phys.— 1989.— Vol. 12.— P. 41—46.
48. Rodan G. A., Martin T. J. Il Calcif. Tiss. int.— 1981.— Vol. 33,— P. 340—351.
49. Schmitz 0., Christensen C. K-, Christensen S. Е, Emmertsen K. Il Horm. Metab. Res.— 1984.— Vol. 16.— P. 100—101.
50. Silverberg S. J., Lindsay R. // Med. Clin. N. Amer.— 1987— Wo 7 1,—. 41-7.
51. Smith R. // Thorax.— 1990,— Vol. 45.— P. 573—578.
52. Stevenson J. C. // Bailliere’s Clin. Endocr. Metab.—1988—. 87—101.
53. Suda T, Testa. N. G., Allen T. D. // Calcif. Tiss. int.— 1983.- Vol. 35.— P. 82—86.
54. Teitelbaum A. P, Silve C. M., Nyiredy K. O., Arnaud C. D. Il Endocrinology.— 1986,—Vol. 118,— P. 505—602.
55. Tiegs R. D., Body J. J., Barta J. M., Heath H. Ill II J. Bone Mineral Res.— 1986,— Vol. 1,— P. 330—340.
56. Tremollieres F, Pouilles J. A4, Louvet J. P., Ribot C. // Clin. Rheum.— 1989,— Vol. 8,—Suppl. 2,—P. 116—118.
57. Vaananen H. K., Hentunen T, Lakkakorpi P. et al. // Ann. Chir. Gynaec.— 1988,— Vol. 77,—P. 193—196.
58. Weber G, Beccaria L., de’Angelis M, et al. Il Bone and Mineral Res.— 1990,— Vol. 8,— P. 20—23.
Продукты, богатые кальцием, улучшающие состояние костей
Многие питательные вещества участвуют в поддержании здоровья костей. Кальций и витамин D являются двумя из наиболее важных.
Кальций — это минерал, который необходим для правильного функционирования вашего тела и хранится в ваших костях. Ваше тело нуждается в витамине D, чтобы усваивать кальций. Недостаток кальция в вашем рационе может привести к хрупкости и ломкости костей, которые более склонны к переломам и заболеваниям.
Витамин К, витамин С, магний и фосфор являются другими важными питательными веществами для здоровья костей.
Темная листовая зелень, такая как капуста, руккола, кресс-салат и листовая капуста, возможно, является лучшим немолочным источником кальция. Эта зелень также богата магнием, который полезен для поддержания целостности костей, и витамином К, который необходим для метаболизма костей.
Хотя шпинат обычно входит в эту группу, он содержит щавелевую кислоту, из-за которой человеческий организм не может усваивать кальций.
Солнце — наш основной источник витамина D. Однако употребление в пищу жирной рыбы, такой как лосось, — еще один отличный способ получить витамин D.
По данным Национального института здоровья (NIH), одна порция лосося весом 3 унции обеспечит вас 447 международными единицами (МЕ) витамина D. Рекомендуемое минимальное потребление витамина D составляет 400 МЕ в день.
Консервированный лосось содержит более мягкие (съедобные) кости рыбы, что означает, что он насыщен кальцием.
Поделиться на Pinterest
Тунец — еще одна жирная рыба, богатая полезным витамином D. Он также содержит большое количество других полезных питательных веществ, таких как калий, магний и омега-3 жирные кислоты. А поскольку он продается в консервах, его легко найти, он не требует кошелька и его легко добавить в свой рацион.
Поделиться на Pinterest
Пока мы занимаемся рыбой, вы не ошибетесь с сомом. Это, пожалуй, самый дешевый сорт рыбы, а также один из самых богатых витамином D, содержащий 425 МЕ в одном филе весом 3 унции.
Поделиться на Pinterest
Из всех орехов, которые вы можете найти в продуктовом магазине, миндаль содержит наибольшее количество кальция на порцию. Вы можете получить те же преимущества кальция в форме масла. В качестве бонуса миндальное масло не содержит холестерина, содержит меньше жира и больше белка, чем арахисовое масло.
Вы можете получить те же преимущества кальция в форме масла. В качестве бонуса миндальное масло не содержит холестерина, содержит меньше жира и больше белка, чем арахисовое масло.
Поделиться на Pinterest
Все довольно просто: сыр делается из молока. В молоке много кальция. Следовательно, в сыре много кальция.
Благодаря широкому ассортименту моцарелла особенно богата кальцием. Для более здорового варианта попробуйте сыр из обезжиренного молока.
Поделиться на Pinterest
Йогурт — древний кулинарный продукт, история которого насчитывает 2000 лет до н. э. Из-за процесса приготовления йогурта этот основной продукт питания на самом деле содержит значительно больше кальция, чем молоко, из которого он сделан. По данным NIH, одна порция обезжиренного йогурта на 8 унций обеспечивает полные 42 процента ваших ежедневных потребностей в кальции.
Поделиться на Pinterest
Хорошие новости для любителей завтрака: яйца содержат большое количество витамина D и могут улучшить здоровье костей. Витамин D содержится только в желтках, поэтому, если вы склонны есть омлеты из яичных белков, вам придется получать витамин D из других источников.
Витамин D содержится только в желтках, поэтому, если вы склонны есть омлеты из яичных белков, вам придется получать витамин D из других источников.
Другой продукт для завтрака, апельсиновый сок, часто обогащают витамином D и
Поделиться на Pinterest
Из всех немолочных источников кальция брокколи уступает темной листовой зелени. И брокколи не только полезна для костей — это отличный источник витамина С, клетчатки и питательных веществ, обладающих противораковыми свойствами.
Поделиться на Pinterest
А как насчет молока?
По данным Национального института здоровья США, в одной чашке молока содержится около 30% суточной нормы кальция. Кроме того, молоко, которое продается в магазинах, обычно обогащено витамином D, что делает его двойным ударом, когда речь идет о здоровье костей.
Однако есть предположения, что молоко может истощать кости жизненно важными питательными веществами. Исследование 2014 года показало, что нет никакой связи между потреблением молока в подростковом возрасте и снижением риска переломов бедра у пожилых людей.