Влияние табакокурения на метаболизм и эффективность противоопухолевой лекарственной терапии | partners
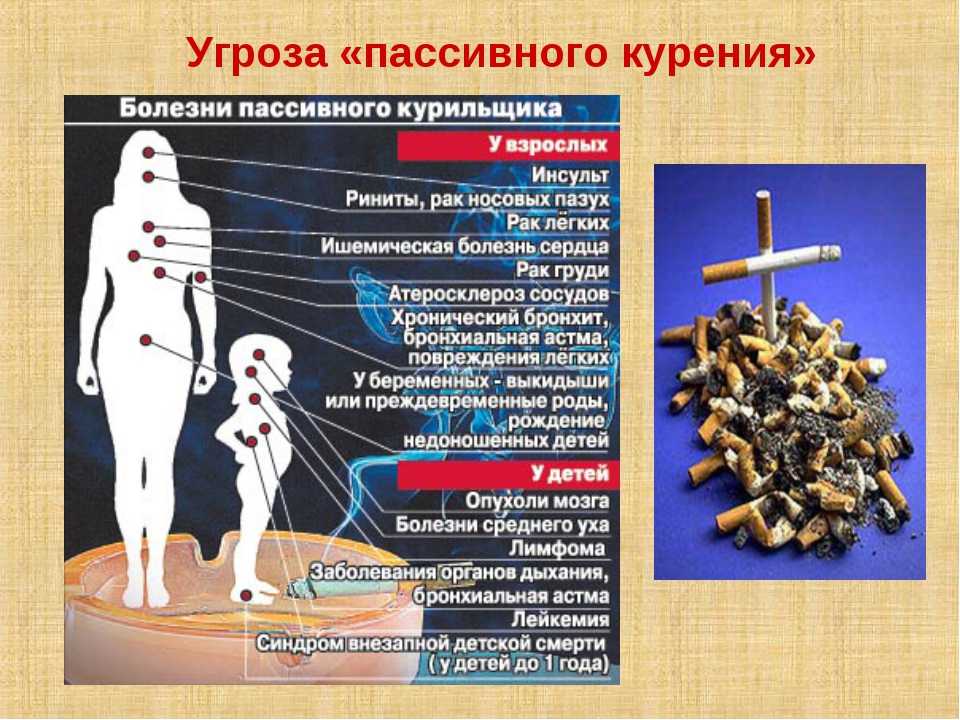
Табачная эпидемия признана одной из наиболее серьезных угроз для здоровья населения. По данным ВОЗ, более 1,1 миллиардов людей имеют такую вредную привычку, как курение, от которого ежегодно во всем мире умирает более 8 миллионов людей [1]. Помимо роли табака в возникновении сердечно-сосудистых заболеваний, заболеваний дыхательной и других систем, доказана канцерогенность табачного дыма [2]. Причем показатель относительного риска отличается для каждого вида опухоли и зависит от продолжительности и интенсивности курения. Например, относительный риск развития рака легких у курящих до 20 сигарет в день составляет 2,5, у тех, кто выкуривает от 20 до 39 сигарет в день – 10,4, а у выкуривающих 40 и более сигарет в день – 32,8 [3]. Неутешительны и результаты лечения онкологических пациентов с курением в анамнезе. Так, по данным исследования G.M. Videtic с соавт., 5-летняя общая выживаемость у больных мелкоклеточным раком легкого, продолжающих курить, составляет всего 4%, но в то же время среди бывших курильщиков этот показатель достигает уже 8,9% [4].
Потенциальное влияние табака на фармакокинетические процессы, многогранно. Продукты неполного сгорания табака индуцируют активность ферментов метаболизма лекарственных средств. Так, например, еще во второй половине прошлого века R. Kushinsky и C. J. Louis заметили, что введение такого компонента табачного дыма, как бензо(a)пирена, вызывает значительное увеличение веса печени и содержания цитохрома Р450 (CYP) у крыс [7]. В настоящее время известно, что другие канцерогенные соединения сигаретного дыма, полициклические ароматические углеводороды, ответственны за индукцию нескольких изоформ ферментов семейства цитохрома Р450 (CYP1A1, 1A2, 1B1, 2D6 и 3A4), а также уридиндифосфат-глюкуронозилтрансферазы (UGT) – фермента глюкуронирования, при котором образуются водорастворимые, экскретируемые метаболиты [5].
Таксаны. Химиотерапия на основе цитостатиков таксанового ряда является стандартной терапией для многих злокачественных новообразований. Ее эффективность главным образом зависит от степени связывания с белками плазмы крови, в т.ч. с альфа-1-кислым гликопротеином – одним из самых распространенных белков сыворотки крови, концентрация которого заметно повышена у курильщиков [7]. Ретроспективные данные, свидетельствуют о том, что уровень альфа-1-кислого гликопротеина в плазме крови напрямую связан с исходом лечения доцетакселом [7].
Иринотекан. Исследования in vitro показали, что у курильщиков понижена плазменная концентрация иринотекана [9]. Вероятно, это связано с тем, что такие компоненты табачного дыма, как ариламин, непосредственно препятствуют взаимодействию эритроцитов с цитостатиком. Поскольку эритроциты играют ключевую роль в переносе лекарственных средств, то более низкие концентрации иринотекана и любых других препаратов у курильщиков по сравнению с некурящими пациентами могут приводить к негативным клиническим последствиям.
В другом исследовании было показано, что у курильщиков клиренс иринотекана ускорен на 18%, а системная экспозиция его активного метаболита SN-38 снижена на 40% [10]. Кроме того, частота глубокой нейтропении была значительно ниже: 6% против 38% соответственно (р<0,001), что также указывает на потенциальный риск низкой эффективности лечения. И хотя точный основной механизм еще предстоит выяснить, влияние курения на действие иринотекана может быть приписано индукции и модуляции некоторых изоферментов семейства Р450 и UGT1A1, которые участвуют в его метаболизме.
Гемцитабин. Этот противоопухолевый препарат из группы аналогов пиримидина метаболизируется в клетке под действием цитидиндеаминазы до неактивного метаболита – 2′-дезокси-2′,2′-дифторуридина. Сверхэкспрессия цитидиндеаминазы, вызванная курением, может привести к ускоренному метаболизму и снижению эффективности гемцитабина у нынешних и бывших курильщиков. Как следствие, это также приводит к более низкой гематологической токсичности.
Препараты платины. Общепризнано, что повреждение ДНК и последующая индукция апоптоза являются основными цитотоксическими механизмами платиновых соединений. В свою очередь, никотин и никотинопроизводные нитрозамины, содержащиеся в сигаретном дыме, могут подавлять терапевтический эффект препаратов платины за счет прямого блокирования апоптоза и стимуляции клеточной пролиферации [12]. Это наглядно продемонстрировали китайские коллеги [12]. При совместной обработке клеток Tca8113 цисплатином и никотином наблюдалась незначительная ядерная фрагментация и малое количество апоптотических тел. Также было замечено, что истощение сурвивина, одного из белков семейства ингибиторов апоптоза, снижало ингибирующий эффект никотина на апоптоз, вызванный действием цисплатина.
Иматиниб. Данный противоопухолевый препарат является ингибитором рецепторов тирозинкиназы для фактора роста тромбоцитов и фактора стволовых клеток. Лишь в одном исследовании было показано, что у курящих пациентов, получающих иматиниб по поводу гастроинтестинальной стромальной опухоли, общая выживаемость ниже, а частота анемии и астении выше по сравнению с контрольной группой [13]. Возможно это связано с индукцией изоферментов цитохрома Р450 (преимущественно CYP3A4, в меньшей степени – CYP1A2, 2D6, 2C9 и 2C19) или с высокой степенью связывания иматиниба с альфа-1-кислым гликопротеином вследствие курения [14].
Эрлонитиб. Известно, что данный селективный ингибитор тирозинкиназы рецептора эпидермального фактора роста метаболизируется в основном при участии CYP3A4 и в меньшей степени CYP1A2 и CYP1A1. В связи с этим было выдвинуто предположение, что курение может влиять на фармокинетику эрлотиниба посредством индукции изоформ цитохрома Р450. И действительно, несколько исследований показали, что у курильщиков значительно снижена плазменная концентрация и ускорен метаболический клиренс эрлотиниба. Так, в исследовании, проведенном группой американских ученых, после однократного приема эрлотиниба в дозе 150 мг или 300 мг отмечена меньшая экспозиция препарата у больных, продолжающих курить во время лечения [15]. После приема 150 мг эрлотиниба средняя геометрическая величина AUC0-infinity у курильщиков была в 2,8 раза ниже, чем у некурящих, и сопоставима с таковой у некурящих при приеме 300 мг эрлотиниба. Максимальная концентрация эрлотиниба (Сmах) у курильщиков составила 2/3 от таковой у некурящих, а средняя концентрация препарата через 24 часа (C24h) была в 8,3 раза ниже, чем у некурящих. В другом исследовании было выявлено, что у курильщиков при увеличении дозы эрлотиниба со 150 мг до 300 мг (максимально переносимой дозы) наблюдается аналогичная концентрация препарата и вместе с тем частота возникновения сыпи и диареи, как у больных, которые никогда не курили либо бросили курить, получающих эрлотиниб в суточной дозе 150 мг [16].
В связи с этим было выдвинуто предположение, что курение может влиять на фармокинетику эрлотиниба посредством индукции изоформ цитохрома Р450. И действительно, несколько исследований показали, что у курильщиков значительно снижена плазменная концентрация и ускорен метаболический клиренс эрлотиниба. Так, в исследовании, проведенном группой американских ученых, после однократного приема эрлотиниба в дозе 150 мг или 300 мг отмечена меньшая экспозиция препарата у больных, продолжающих курить во время лечения [15]. После приема 150 мг эрлотиниба средняя геометрическая величина AUC0-infinity у курильщиков была в 2,8 раза ниже, чем у некурящих, и сопоставима с таковой у некурящих при приеме 300 мг эрлотиниба. Максимальная концентрация эрлотиниба (Сmах) у курильщиков составила 2/3 от таковой у некурящих, а средняя концентрация препарата через 24 часа (C24h) была в 8,3 раза ниже, чем у некурящих. В другом исследовании было выявлено, что у курильщиков при увеличении дозы эрлотиниба со 150 мг до 300 мг (максимально переносимой дозы) наблюдается аналогичная концентрация препарата и вместе с тем частота возникновения сыпи и диареи, как у больных, которые никогда не курили либо бросили курить, получающих эрлотиниб в суточной дозе 150 мг [16].
Концепция снижения вреда
Отказ от курения, безусловно, является оптимальным решением для пациента, проходящего противоопухолевую терапию. Однако в силу человеческой природы и недостаточного доступа к эффективным услугам по прекращению потребления табака большинство пациентов с онкологическими заболеваниями продолжает курить. Недавний опрос показал, что среди 26365 больных, наблюдавшихся в онкологических центрах, назначенных NCI (Национальным институтом рака США), в течение первых 18 месяцев реализации программы по отказу от курения, лишь 17,22% пациентов, употребляющих табак, согласились пойти к специалисту по лечению табачной зависимости [17]. Среди тех, кто отказался обращаться за медицинской помощью, 65,84% не были готовы бросать курить, хотя 27,01% пытались сделать это самостоятельно. Поскольку процент успешных отказов от курения по-прежнему остается невысоким, предприняты попытки по снижению негативных последствий, связанных с курением, что укладывается в концепцию снижения вреда – комплекса методов и программ, направленных на максимальное уменьшение вреда здоровью для людей, не имеющих возможности, либо не желающих прекратить опасные действия или поведение.

Заключение
Во всем мире табакокурение остается актуальной медико-социальной проблемой, особенно для онкобольных в связи повышенным риском развития рецидива, первично-множественных опухолей и снижением общей выживаемости в целом. Доклинические данные свидетельствуют о том, что никотин сам по себе обладает пролиферативным и антиапоптотическим действием в клеточных культурах. В связи с этим борьба с курением среди онкологических больных все больше признается как неотъемлемая часть лечения. Статус курения, его анамнез, включая способы потребления табака, должны быть тщательно изучены, а отказ от курения должен быть принят во внимание при разработке планов лечения. Рассмотренные в статье примеры и механизмы фармакокинетического взаимодействия могут позволить врачам проводить соответствующий мониторинг для индивидуализации дозирования. Учитывая, что курение приводит к ускоренному клиренсу противоопухолевых препаратов, можно предположить, что у курильщиков (включая тех, кто недавно бросил курить) увеличение суточной дозы лекарства позволит достичь желаемого терапевтического эффекта. Однако для подтверждения этой гипотезы необходимы проспективные исследования, сравнивающие результаты лечения онкологических больных в зависимости от статуса курения и применяемой дозы препарата.
Однако для подтверждения этой гипотезы необходимы проспективные исследования, сравнивающие результаты лечения онкологических больных в зависимости от статуса курения и применяемой дозы препарата.
Больному же на каждой консультации или госпитализации необходимо разъяснять потенциальные риски и прогнозы лечения при продолжении потребления табака. При составлении плана терапии также рекомендовано проводить тест на определение степени никотиновой зависимости, так называемый тест Фагерстрема, и тест для оценки готовности бросить курить. В зависимости от их результатов выстраивается тактика лечащего врача по практическим способам прекращения табакокурения на основе краткого индивидуального консультирования по общепринятой схеме 5 «С», «стратегического» консультирования для готовых бросить курить либо мотивационного консультирования по схеме 5 «П» для не совсем готовых бросить курить).
Для пациентов с низкой мотивацией к отказу от курения на первом этапе возможен переход на СНТ – альтернативные продукты доставки никотина, но с меньшим содержанием токсичных веществ в выделяемом аэрозоле за счет отсутствия процесса горения, характерного для традиционных сигарет. Такой подход особенно актуален для курильщиков, отягощенных наличием онкологической и другой патологией.
Такой подход особенно актуален для курильщиков, отягощенных наличием онкологической и другой патологией.
КОНФЛИКТ ИНТЕРЕСОВ. Автор статьи подтвердил отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
- WHO report on the global tobacco epidemic 2021: addressing new and emerging products. URL: https://www.who.int/publications/i/item/9789240032095
- Pfeifer G. P., Denissenko M. F., Olivier M., Tretyakova N., Hecht S. S., Hainaut P. Tobacco smoke carcinogens, DNA damage and p53 mutations in smoking-associated cancers // Oncogene. 2002. 21(48):7435-51.
- Khuder S. A., Dayal H. H., Mutgi A. B., Willey J. C., Dayal G. Effect of cigarette smoking on major histological types of lung cancer in men // Lung Cancer. 1998;22(1):15-21.
- Videtic G. M., Stitt L. W., Dar A. R., Kocha W. I., Tomiak A. T., Truong P. T.
 , Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9.
, Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9. - Zevin S., Benowitz N. L. Drug interactions with tobacco smoking. An update // Clin Pharmacokinet 1999;36:425-38.
- Kushinsky R., Louis C. J. The effect of cigarette smoke on aryl hydrocarbon hydroxylase activity and cytochrome P450 content in rat liver and lung microsomes // Oncology. 1976; 33:197–200.
- Veyrat-Follet C., Bruno R., Olivares R., Rhodes G. R., Chaikin P. Clinical trial simulation of docetaxel in patients with cancer as a tool for dosage optimization // Clin. Pharmacol. Ther. 2000;68:677–687.
- de Graan A. J., Loos W. J., Friberg L. E., Baker S. D., van der Bol J. M., van Doorn L., Wiemer E. A., van der Holt B., Verweij J., Mathijssen R. H. Influence of smoking on the pharmacokinetics and toxicity profiles of taxane therapy // Clin Cancer Res.
 2012;18(16):4425-32.
2012;18(16):4425-32. - Dumez H., Guetens G., De Boeck G., Highley M. S., de Bruijn E. A., van Oosterom A. T., Maes R. A. In vitro partition of irinotecan (CPT-11) in human volunteer blood: the influence of concentration, gender and smoking // Anticancer Drugs 2005;16:893–895.
- van der Bol J. M., Mathijssen R. H., Loos W. J., Friberg L. E., van Schaik R. H., de Jonge M. J., Planting A. S., Verweij J., Sparreboom A., de Jong F. A. Cigarette smoking and irinotecan treatment: pharmacokinetic interaction and effects on neutropenia // J Clin Oncol. 2007;25(19):2719-26.
- Kanai M., Morita S., Matsumoto S., Nishimura T., Hatano E., Yazumi S., Sasaki T., Yasuda H., Kitano T., Misawa A., Ishiguro H., Yanagihara K., Ikai I., Doi R., Fukushima M. A. A history of smoking is inversely correlated with the incidence of gemcitabine-induced neutropenia // Ann Oncol. 2009;20(8):1397-401.
- Xu J., Huang H., Pan C., Zhang B., Liu X., Zhang L. Nicotine inhibits apoptosis induced by cisplatin in human oral cancer cells // Int J Oral Maxillofac Surg.
 2007 Aug;36(8):739-44.
2007 Aug;36(8):739-44. - van Erp N., Gelderblom H., van Glabbeke M., Van Oosterom A., Verweij J., Guchelaar H. J., Debiec-Rychter M., Peng B., Blay J. Y., Judson I. Effect of cigarette smoking on imatinib in patients in the soft tissue and bone sarcoma group of the EORTC // Clin Cancer Res. 2008;14:8308–8313.
- Delbaldo C., Chatelut E., Ré M., Deroussent A., Séronie-Vivien S., Jambu A., Berthaud P., Le Cesne A., Blay J. Y., Vassal G. Pharmacokinetic-pharmacodynamic relationships of imatinib and its main metabolite in patients with advanced gastrointestinal stromal tumors // Clin Cancer Res. 2006; 12:6073–6078.
- Hamilton M., Wolf J. L., Rusk J., Beard S. E., Clark G. M., Witt K., Cagnoni P. J. Effects of smoking on the pharmacokinetics of erlotinib // Clin Cancer Res. 2006 Apr 1;12(7 Pt 1):2166-71.
- Hughes A. N., O’Brien M. E., Petty W. J., Chick J. B., Rankin E., Woll P. J., Dunlop D., Nicolson M., Boinpally R., Wolf J., Price A.
 Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6.
Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6. - Burris J. L., Borger T. N., Shelton B. J., Darville A. K., Studts J. L., Valentino J., Blair C., Davis D. B., Scales J. Tobacco Use and Tobacco Treatment Referral Response of Patients With Cancer: Implementation Outcomes at a National Cancer Institute-Designated Cancer Center // JCO Oncol Pract. 2021 Jun 29:OP2001095.
- Drope J., Cahn Z., Kennedy R., Liber A. C., Stoklosa M., Henson R., Douglas C. E., Drope J. Key issues surrounding the health impacts of electronic nicotine delivery systems (ENDS) and other sources of nicotine // CA Cancer J Clin. 2017 Nov;67(6):449-471.
- Bentley M.C., Almstetter M., Arndt D., Knorr A., Martin E., Pospisil P., Maeder S. Comprehensive chemical characterization of the aerosol generated by a heated tobacco product by untargeted screening // Anal Bioanal Chem. 2020;412(11):2675-2685.

- Haziza C., de La Bourdonnaye G., Merlet S., Benzimra M., Ancerewicz J., Donelli A., Baker G., Picavet P., Lüdicke F. Assessment of the reduction in levels of exposure to harmful and potentially harmful constituents in Japanese subjects using a novel tobacco heating system compared with conventional cigarettes and smoking abstinence: A randomized controlled study in confinement // Regul Toxicol Pharmacol. 2016;81:489-499.
- Lüdicke F., Picavet P., Baker G., Haziza C., Poux V., Lama N., Weitkunat R. Effects of Switching to the Tobacco Heating System 2.2 Menthol, Smoking Abstinence, or Continued Cigarette Smoking on Biomarkers of Exposure: A Randomized, Controlled, Open-Label, Multicenter Study in Sequential Confinement and Ambulatory Settings (Part 1) // Nicotine Tob Res. 2018;20(2):161-172.
- Yuan J. M., Butler L. M., Stepanov I., Hecht S. S. Urinary tobacco smoke-constituent biomarkers for assessing risk of lung cancer // Cancer Res. 2014;74(2):401-11.

Е. А. Дегтярёва, аспирант
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Контактная информация: [email protected]
Курение и метаболизм. Как ускорить метаболизм после отказа от курения На сколько замедляет обмен веществ курение
Все мы знаем о том, что курение вредно для здоровья, а повышают уровень зависимости от никотина и заставляют человека курить больше. Однако курильщиками являются более 20% взрослых людей в мире (более 1 млрд. человек) и порядка 30% россиян. Статистика говорит о том, что в России курят порядка 45% мужчин и 15% женщин (1) . Многие из них не могут побороть вредную привычку, но активно занимаются физическими тренировками.
Таких людей всегда интересует вопрос, совместимы ли спорт и курение, и действительно ли сигареты негативно влияют на рост мышц и набор массы. К сожалению, ответ неутешителен — курение действительно мешает силовым тренировкам и даже несколько затяжек сигаретой после физических нагрузок существенно усугубляют вред, наносимый организму.
Строго говоря, никотин можно считать жиросжигателем — он притупляет аппетит и определенно влияет на процессы использования организмом свободных жирных кислот. Однако вышеназванные эффекты проявляют себя лишь на начальном этапе привыкания к курению — ежедневное выкуривание пачки сигарет не смогут превратить толстяка в Аполлона.
При этом отказ от никотина провоцирует классический «синдром отмены» — человек буквально не знает, куда себя деть и чем занять руки. Именно в этом случае на помощь и придет спорт. С помощью регулярного кардио бросивший курить уже за несколько недель сможет привести свою сердечно-сосудистую и гормональную систему в норму.
Связь курения с нарушением метаболизмаНаучные исследования говорят о том, регулярное курение меняет метаболизм человека на клеточном уровне, ухудшает процессы синтеза мышечного белка и повышает активность генов, вызывающих саркопению — возрастную потерю мышечной массы (3) . Говоря простыми словами, тело курильщика в буквальном смысле стареет быстрее.
Говоря простыми словами, тело курильщика в буквальном смысле стареет быстрее.
Кроме этого, никотин вносит дисбаланс в гормональную систему спортсменов. Сперва он дает некоторый прилив сил, быстро сменяющийся утомлением. Повышается уровень стрессовых гормонов (в первую очередь, кортизола), постепенно снижается уровень тестостерона (3) и ряда других важных для набора и поддержания мышечной массы гормонов.
Влияние курение на рост мышц
Хроническое курение нарушает кислородный обмен в организме, а недостаток кислорода напрямую вредит работе сердечно-сосудистой системы и росту мышц. Негативно сказывается как то, что курильщики имеют меньший объем легких, так и то, что никотин и прочие химические вещества сигарет существенно уменьшают активность кровотока.
При этом для спортсменов наиболее вредным элементом сигаретного (или кальянного) дыма является монооксид углерода, известный как угарный газ. Попадая в кровь, он связывается с гемоглобином, нарушая способность эритроцитов переносить кислород. В итоге мышцы (ровно как и все тело) начинают испытывать острое кислородное голодание. При этом еще сильнее.
В итоге мышцы (ровно как и все тело) начинают испытывать острое кислородное голодание. При этом еще сильнее.
Вред никотина для сердца
Научные исследования говорят о том, что сердце курильщика бьется на 30% быстрее — это повышает артериальное давление и создает дополнительную нагрузку на сердечнососудистую систему при выполнении силовых и кардио упражнений. Суммарно это выражается в снижении силовых показателей и повышении утомляемости.
Поскольку легкие и дыхательная система работают менее эффективно, появляется хроническая отдышка, в результате чего нагрузка на сердце усиливается еще больше. Пусть спортивный курильщик даже и сможет пробежать марафон, регулярно поставляемые в организм дозы никотина заставят его сердце работать буквально на пределе возможностей. Опасная частота сердцебиения при спорте для него также ниже.
Влияние никотина на уровень стрессаНа смену кратковременному расслаблению, вызванного выкуренной сигаретой, спустя уже пять-семь минут приходит стресс, провоцируемый отсутствием «бодрящего» никотина — в конечном итоге курение выматывает нервную систему. Кроме этого, появляется общая утомляемость, и курящему человеку начинает казаться, что он просто не хочет двигаться.
Кроме этого, появляется общая утомляемость, и курящему человеку начинает казаться, что он просто не хочет двигаться.
Употребление никотина (как в виде курения обычных сигарет, так и в виде электронных девайсов или кальяна) ведет к выбросу в кровь серотонина и прочих «гормонов радости» — что является одним из главных элементов формирования зависимости. Также никотин затормаживает действие гормона сна мелатонина и курильщикам требуется больше времени, чтобы выспаться.
Вред курения для спортсмена-новичкаВред курения для здоровья спортсмена сложно игнорировать. Элементы табачного дыма более чем в 20 раз повышают риск развития рака легких, сужают сосуды и делают кровь более густой, приводя к закупорке кровеносных путей и повышая риск развития варикозного расширения вен (4) . Очень часто инсульт в раннем возрасте напрямую связан с курением.
При этом курильщик с многолетним стажем, начавший заниматься спортом, подвергает себя повышенной опасности — особенно это актуально для тех, кто пытается похудеть с помощью активных жиросжигающих кардиотренировок. Утомленная и вымотанная регулярным употреблением никотина сердечно-сосудистая система принимает на себя весь удар.
Утомленная и вымотанная регулярным употреблением никотина сердечно-сосудистая система принимает на себя весь удар.
***
Несмотря на то, что с формальной точки зрения никотин может считаться жиросжигателем, регулярное курение сигарет крайне негативно влияет на сердечно-сосудистую и дыхательную системы, снижает выносливость и способность заниматься спортом в полную силу. В итоге, курение ухудшает доступность кислорода, нарушает процессы синтез белка и активизирует потерю мышц.
Научные источники:
- Минздрав: Количество курящих в России продолжает сокращаться,
- Nicotine – Scientific Review on Usage, Dosage, Side Effects,
- Smoking impairs muscle protein synthesis and increases the expression of myostatin and MAFbx in muscle,
- Effect of cigarette smoking on levels of bioavailable testosterone in healthy men,
- Health Effects of Cigarette Smoking,
Многие зависимы от вредных привычек. Главная серди них — курение. Никотин влияет на человеческий организм и вызывает серьезные патологии. Не каждый готов расстаться с сигаретой. Кто-то не хочет ничего менять, а кто-то боится набрать вес. Влияет ли курение на вес или это отговорка, чтобы не расставаться с привычкой?
Никотин влияет на человеческий организм и вызывает серьезные патологии. Не каждый готов расстаться с сигаретой. Кто-то не хочет ничего менять, а кто-то боится набрать вес. Влияет ли курение на вес или это отговорка, чтобы не расставаться с привычкой?
Изменения в работе организма
Тема взаимосвязи веса и курения давно изучается. Курильщики обычно стройные люди. Но есть среди них представители с лишним весом. У тех, кто давно курит, жиры накапливаются по типу фигуры «яблоко» — по кругу в области талии и на верхней части туловища.
Подобный эффект может испортить женское тело, которое постепенно приобретет форму груши — узкая талия и широкие бедра.
У худых курильщиков активизируется ген AZGP1, который отвечает за работу дыхательной системы — от нее зависит расщепление жиров и углеводов. Когда человек начинает курить, этот ген оберегает систему дыхания, а усиление метаболизма — это побочное действие.
Влияние табачного яда на фигуру человека можно объяснить не только генами. Во время курения в организме происходят психологические и физиологические изменения, которые способствуют похудению или набору лишних килограммов:
Во время курения в организме происходят психологические и физиологические изменения, которые способствуют похудению или набору лишних килограммов:
- Курение вызывает активную выработку слюны. Еда в организм не поступает, а соляная кислота вырабатывается. В результате в желудке образуются маленькие язвы. Постепенно сократительная функция ЖКТ снижает ся: аппетит пропадает, кишечник плохо работает, развивается гастрит и т. д.
- Человек, который курит, заставляет свой организм постоянно бороться с никотином. На это уходят не только калории, которые поступают с едой, но и энергетические запасы организма. В результате сигарета помогает похудеть.
- Человек начинает курить, чтобы справиться с переживаниями. Одна выкуренная сигарета заменяет ему бутерброд или пирожное, поэтому организм начинает получать в 2 раза меньше калорий.
- Когда никотин проникает в кровь человека, нарушается выработка гликогена. Он используется организм ом как дополнительный источник энергии в экстренных случаях.
 При курении организм принимает его как должное и запускает в работу. Из-за этого ощущение голода полностью исчезает.
При курении организм принимает его как должное и запускает в работу. Из-за этого ощущение голода полностью исчезает. - Сигаретный дым негативно влияет ли работу эндокринных желез. Возникают гормональные нарушения. Это способствует замедлению метаболизма — развивается ожирение. Жир накапливается в области талии, а объем бедер остается прежним. По худеть при помощи сигарет не всегда получается.
- Никотин ухудшает работу сосудов. В результате возникает кислородная недостаточность, нарушается кровообращение и отток лимфы. Кожа лица и тела темнеет, а лишний вес появляется даже у тех людей, которые всегда были стройными.
- Обмен веществ ускоряет ся из-за влияния никотина. Он действует на выработку адреналина, который помогает сжигать жир. Многие считают, что сигарета успокаивает, но это заблуждение. Сигарета возбуждает нервную систему, поэтому, когда человек бросает курить, обмен веществ замедляется и бывший курильщик поправляется.
Изменение образа жизни
Вес и курение взаимосвязаны. Когда человек бросает курить, его организм начинает работать нормально — это способствует набор у лишних килограммов и мешает похудеть. У людей, которые курили всю жизнь, произойдет резкий набор веса.
Когда человек бросает курить, его организм начинает работать нормально — это способствует набор у лишних килограммов и мешает похудеть. У людей, которые курили всю жизнь, произойдет резкий набор веса.
Влияет психологический фактор. Человеку непросто отказаться от сигареты, поэтому он испытывает стресс. Чтобы его побороть, он начинает много есть. Он хочет снизить влияние никотиновой ломки и изменяет свой рацион. Начинается набор веса.
Отказ от сигарет влияет на аппетит. Количество гликогена постепенно приходит в норму, а организму требуется глюкоза: в рационе появляется много калорийной еды. Похудение после отказа от курения реально. Помогут несколько правил:
- Сбалансированное питание. Как только человек бросил курить, наиболее вероятно увеличение массы тела. Это актуально в первый месяц после отказа от сигарет. Здоровая пища поможет восстановить обмен веществ.
- Ежедневные физические упражнения. Сначала это могут быть прогулки по парку или плавание. Затем нагрузки постепенно увеличивают, добавляют фитнес, бег и т.
 д. Спорт поможет избавиться от лишнего веса. Во время физических нагрузок вырабатывается эндорфин — гормон счастья, который не позволит сорваться и начать курить.
д. Спорт поможет избавиться от лишнего веса. Во время физических нагрузок вырабатывается эндорфин — гормон счастья, который не позволит сорваться и начать курить. - Планирование. Плотный график поможет справиться с зависимостью: работа, спорт, прогулки и т. д.
Изменение рациона
Вес и курение имеют тесную связь. Организм человека постепенно привыкает как к наличию никотина, так и к его отсутствию . Это означает, что вскоре человек прекратит набирать вес и сможет навсегда избавиться от вредной привычки. Чтобы бросить курить и не навредить здоровью, важно делать это поэтапно:
- изменить рацион;
- когда курильщик похудеет при помощи сбалансированного питания и привыкнет к диете, можно бросать курить;
- риск набрать вес после отказа от сигарет существует, но в этом случае поможет опробованная диета.
Курить вредно любому человеку. Никотин способствует развитию серьезных заболеваний: чем раньше отказаться от сигарет, тем лучше. Отказ от курения влияет на увеличение веса, поэтому многие боятся бросать эту привычку. Курение замедляет процессы накапливания жира. Бросить курить и не поправиться возможно. Главное делать это поэтапно и придерживаться диеты.
Отказ от курения влияет на увеличение веса, поэтому многие боятся бросать эту привычку. Курение замедляет процессы накапливания жира. Бросить курить и не поправиться возможно. Главное делать это поэтапно и придерживаться диеты.
Широко известно, что курение ускоряет метаболизм, поэтому некоторые боятся отказываться от вредной привычки из-за опасности набрать лишние килограммы. Никотин является одним из наиболее мощных веществ, подавляющих аппетит, так что при снижении этого вещества в организме чувство голода нарастает. Все продукты и напитки кажутся вкуснее, потому что восстанавливается нормальная работа рецепторов. Все это может привести к перееданию сладостями и жирными продуктами, которые будут казаться невероятно аппетитными. К тому же без возможности покурить многие люди переходят к частым перекусам. Как избежать проблем с лишним весом в период отказа от сигарет? Помогут эти рекомендации!
Ешьте чаще
Не бойтесь есть чаще, чем вы привыкли, — это то, что необходимо вашему организму в данный момент! Употребляя пищу пять раз в день, вы подстегнете свой метаболизм, будете менее раздражительны и более внимательны в течение дня. Обязательно начинайте день с сытного завтрака, потому что исследования показали, что это помогает употреблять меньше калорий. Главное правило — чем чаще вы едите, тем меньшими по количеству должны быть приемы пищи.
Обязательно начинайте день с сытного завтрака, потому что исследования показали, что это помогает употреблять меньше калорий. Главное правило — чем чаще вы едите, тем меньшими по количеству должны быть приемы пищи.
Контролируйте количество еды
Когда ваши вкусовые рецепторы возвращаются в норму, потому что сигаретная смола на них уже не действует, еда естественным образом кажется более вкусной. Легко начать переедать и набирать вес, так что постарайтесь внимательно оценивать, сколько вы едите. Контролируйте порции и создайте для себя сбалансированный рацион, который обеспечит вас витаминами и минералами. Не стоит подвергать организм стрессу со строгой диетой, это может подорвать ваше здоровье.
Приправляйте пищу
Известно, что острые продукты улучшают метаболизм, так что хорошей идеей будет использование разнообразных пряностей. В перце содержится капсаицин, который ускоряет метаболизм, оказывая эффект, похожий на эффект никотина. Кроме того, он стимулирует нервы в полости рта и на губах, что помогает быстрее отвыкать от курения.
Пейте больше
Достаточный уровень увлажнения — это важное условие для поддержания хорошей физической формы и стабильного здоровья. Употребление жидкости помогает вам чувствовать сытость, в результате вы меньше едите. Эксперименты рекомендуют пить около восьми стаканов воды в день, это среднее количество для любого здорового человека. Держитесь подальше от газированных напитков с сахаром — они вызывают только набор веса.
Займите руки
Порой тяга к сигарете может быть крайне интенсивной, именно поэтому вам так важно занять чем-то руки. Носите с собой бутылку воды, в таком случае вы сможете еще и заботиться об уровне жидкости в организме. Можете также попробовать вязание или другие хобби, к примеру, можно играть на музыкальном инструменте — это прекрасный способ отвлечься от мыслей о сигаретах и заняться чем-то интересным.
Употребляйте больше белка
Богатые белком продукты могут значительно улучшать ваш метаболизм. Выбирайте пищу, в которой много белка и мало жира. К примеру, вам подойдут яйца, нежирная говядина, овсянка, тунец, миндаль, греческий йогурт, брокколи. Они богаты питательными веществами и качественным белком. Постарайтесь внимательно планировать свой рацион, чтобы избежать проблем с метаболизмом.
К примеру, вам подойдут яйца, нежирная говядина, овсянка, тунец, миндаль, греческий йогурт, брокколи. Они богаты питательными веществами и качественным белком. Постарайтесь внимательно планировать свой рацион, чтобы избежать проблем с метаболизмом.
Двигайтесь как можно больше
Это кажется довольно простым, но это факт — движение является ключом к сохранению здоровья и хорошей формы. Это простейший способ улучшить метаболизм и сжечь калории, к тому же ваши мышцы будут становиться сильнее с каждым днем. Необязательно как можно скорее отправляться в тренажерный зал, вы можете просто начать регулярно прогуливаться или ходить на пробежки с друзьями, а также заниматься йогой.
Инструкция
Ученые давно подтвердили, что курение в большинстве случаев помогает человеку сбросить вес. Это связано с тем, что ежедневная порция не только немного притупляет чувство голода, но и ускоряет обмен веществ в организме.
Данное вещество оказывает псевдорасслабляющий эффект, схожий с наркотическим. Поэтому удовольствие от курения часто заменяет удовольствие от принятия пищи. Кроме того, из-за никотина в крови повышается уровень глюкозы – это вводит в заблуждение организм, так как он воспринимает ее как результат потребления сладких и углеводных продуктов. Вот утренняя сигарета с кофе часто заменяет полноценный завтрак.
Поэтому удовольствие от курения часто заменяет удовольствие от принятия пищи. Кроме того, из-за никотина в крови повышается уровень глюкозы – это вводит в заблуждение организм, так как он воспринимает ее как результат потребления сладких и углеводных продуктов. Вот утренняя сигарета с кофе часто заменяет полноценный завтрак.
Попадающий в кровь никотин воспринимается организмом как токсин, для защиты от которого он мобилизует все свои силы. В результате калории, которые могли быть потрачены на энергию или оказаться вовсе невостребованными, тратятся на выведение из организма никотина. Отсюда и более быстрый метаболизм.
При ежедневном организм не успевает вывести никотин, поэтому данное вещество накапливается в органах и тканях, вызывая . В результате этого перестают усваиваться должным образом и полезные вещества, что также оказывает влияние на снижение веса. А если к выкуриванию сигарет добавить еще и потребление небольшого количества вредной пищи, вместо нормального питания, последствия могут привести не только к дистрофии, но и к нарушению жизненно важных функций.
Неудивительно, что при отказе от этой вредной привычки в работе организма происходят изменения и замедляется обмен веществ. Все это приводит к тому, что человек начинает резко набирать в весе. Помимо этого бывшие заядлые курильщики в первое время сами способствуют своему ожирению, стараясь заглушить потребность в сигарете частыми перекусами и более обильными трапезами.
Тем не менее, набранные килограммы не так страшны, как негативные последствия курения. Кроме того, при правильном питании и активном образе жизни от лишнего веса довольно быстро можно избавиться, а то и вовсе застраховать себя от его появления. Для этого нужно в первые месяцы после отказа от сигарет соблюдать режим питания, стараться употреблять только полезные продукты и есть небольшими порциями. Со временем организм привыкнет к новому образу жизни, а желудок – к количеству и качеству потребляемой ежедневно пищи. Тогда проблемы с весом уйдут навсегда, а самочувствие значительно улучшится.
Метаболические эффекты отказа от курения
1. Всемирная организация здравоохранения. Табак. Информационный бюллетень № 339. [онлайн] 2015 [Google Scholar]
Всемирная организация здравоохранения. Табак. Информационный бюллетень № 339. [онлайн] 2015 [Google Scholar]
2. Yuen BG, et al. Связь между курением и увеитом: результаты Тихоокеанского исследования воспаления глаз. Офтальмология. 2015; 122:1257–1261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Roura E, et al. Курение как основной фактор риска рака шейки матки и предраковых состояний: результаты когорты EPIC. Междунар. Дж. Рак. 2014; 135:453–466. [PubMed] [Академия Google]
4. Джарамилло Дж. Д. и соавт. Снижение плотности костей и переломы позвонков у курильщиков. Мужчины и больные ХОБЛ в группе повышенного риска. Анна. Являюсь. Торак. соц. 2015;12:648–656. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Министерство здравоохранения и социальных служб США. Последствия курения для здоровья — 50 лет прогресса: отчет главного хирурга, 2014 г. 2014 г. [онлайн], http://www.surgeongeneral.gov/library/reports/50-years-of-progress/
6 Практический комитет Американского общества репродуктивной медицины. Курение и бесплодие: мнение комитета. Плодородный. Стерильно. 2012;98:1400–1406. [PubMed] [Google Scholar]
Курение и бесплодие: мнение комитета. Плодородный. Стерильно. 2012;98:1400–1406. [PubMed] [Google Scholar]
7. Ruan X, Mueck AO. Влияние курения на эстрогенную эффективность. Климактерический. 2015;18:38–46. [PubMed] [Google Scholar]
8. Pedone C, Incalzi RA. Курение и смертность — вне установленных причин. Н. англ. Дж. Мед. 2015;372:2169. [PubMed] [Google Scholar]
9. Grando SA. Связь никотина с раком. Нац. Преподобный Рак. 2014; 14:419–429. [PubMed] [Google Scholar]
10. Kowall B, et al. Ассоциация пассивного и активного курения с возникновением сахарного диабета 2 типа у пожилых людей: когортное исследование KORA S4/F4. Евро. Дж. Эпидемиол. 2010;25:393–402. [PubMed] [Google Scholar]
11. Кермах Д., Шахин М., Пан Д., Фридман Т.С. Многомерный анализ данных Национального обследования состояния здоровья и питания (NHANES) за 2001–2006 годы показывает, что пассивное курение связано как с ожирением, так и с сахарным диабетом. Эндокринное общество. 2012 [онлайн], http://press. endocrine.org/doi/abs/10.1210/endo-meetings.2012.DGM.5.SUN-192. [Google Scholar]
endocrine.org/doi/abs/10.1210/endo-meetings.2012.DGM.5.SUN-192. [Google Scholar]
12. Facchini FS, Hollenbeck CB, Jeppesen J, Chen YD, Reaven GM. Инсулинорезистентность и курение сигарет. Ланцет. 1992;339:1128–1130. [PubMed] [Google Scholar]
13. Assali AR, Beigel Y, Schreibman R, Shafer Z, Fainaru M. Увеличение веса и резистентность к инсулину во время никотинзаместительной терапии. клин. Кардиол. 1999; 22: 357–360. [Статья бесплатно PMC] [PubMed] [Google Scholar]
14. Attvall S, Fowelin J, Lager I, Von Schenck H, Smith U. Курение вызывает резистентность к инсулину — потенциальная связь с синдромом резистентности к инсулину. Дж. Стажер. Мед. 1993; 233:327–332. [PubMed] [Google Scholar]
15. Hautanen A, Adlercreutz H. Гиперинсулинемия, дислипидемия и преувеличенная реакция надпочечников на андрогены на адренокортикотропин у курящих мужчин. Диабетология. 1993;36:1275–1281. [PubMed] [Google Scholar]
16. Janzon L, Berntorp K, Hanson M, Lindell SE, Trell E. Толерантность к глюкозе и курение: популяционное исследование пероральных и внутривенных тестов на толерантность к глюкозе у мужчин среднего возраста. Диабетология. 1983; 25: 86–88. [PubMed] [Google Scholar]
Толерантность к глюкозе и курение: популяционное исследование пероральных и внутривенных тестов на толерантность к глюкозе у мужчин среднего возраста. Диабетология. 1983; 25: 86–88. [PubMed] [Google Scholar]
17. Kong C, et al. Курение связано с повышенной активностью печеночной липазы, резистентностью к инсулину, дислипидемией и ранним развитием атеросклероза при диабете 2 типа. Атеросклероз. 2001; 156: 373–378. [PubMed] [Академия Google]
18. Ronnemaa T, Ronnemaa EM, Puukka P, Pyorala K, Laakso M. Курение независимо связано с высоким уровнем инсулина в плазме у мужчин, не страдающих диабетом. Уход за диабетом. 1996;19:1229–1232. [PubMed] [Google Scholar]
19. Targher G, et al. Курение сигарет и инсулинорезистентность у больных инсулинзависимым сахарным диабетом. Дж. Клин. Эндокринол. Метаб. 1997; 82: 3619–3624. [PubMed] [Google Scholar]
20. Законы А, Reaven GM. Доказательства независимой связи между резистентностью к инсулину и концентрацией холестерина ЛПВП, триглицеридов и инсулина в плазме натощак. Дж. Стажер. Мед. 1992;231:25–30. [PubMed] [Google Scholar]
Дж. Стажер. Мед. 1992;231:25–30. [PubMed] [Google Scholar]
21. Steinberg HO, et al. Ожирение/инсулинорезистентность связаны с эндотелиальной дисфункцией. Последствия для синдрома резистентности к инсулину. Дж. Клин. Вкладывать деньги. 1996; 97: 2601–2610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Sinha-Hikim I, et al. Никотин в сочетании с диетой с высоким содержанием жиров вызывает внутримиоцеллюлярные митохондриальные аномалии у самцов мышей. Эндокринология. 2014; 155:865–872. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Farrell GC, Teoh NC, McCuskey RS. Печеночная микроциркуляция при жировой болезни печени. Анат. Рек. (Хобокен) 2008; 291: 684–692. [PubMed] [Google Scholar]
24. Postic C, Girard J. Вклад синтеза de novo жирных кислот в стеатоз печени и резистентность к инсулину: уроки генетически модифицированных мышей. Дж. Клин. Вкладывать деньги. 2008; 118: 829–838. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Траунер М., Арресе М., Вагнер М. Жирная печень и липотоксичность. Биохим. Биофиз. Акта. 2010;1801:299–310. [PubMed] [Google Scholar]
Траунер М., Арресе М., Вагнер М. Жирная печень и липотоксичность. Биохим. Биофиз. Акта. 2010;1801:299–310. [PubMed] [Google Scholar]
26. Liu RH, Mizuta M, Matsukura S. Длительное пероральное введение никотина снижает резистентность к инсулину у крыс с ожирением. Евро. Дж. Фармакол. 2003; 458: 227–234. [PubMed] [Google Scholar]
27. Нахате К.Т., Дандекар М.П., Кокаре Д.М., Субхедар Н.К. Участие рецепторов нейропептида YY 1 в остром, хроническом и абстинентном эффектах никотина на кормление и массу тела у крыс. Евро. Дж. Фармакол. 2009; 609: 78–87. [PubMed] [Академия Google]
28. Сили Р.Дж., Сандовал Д.А. Неврология: потеря веса через курение. Природа. 2011; 475:176–177. [PubMed] [Google Scholar]
29. Chen H, et al. Длительное воздействие сигаретного дыма увеличивает экспрессию разобщающего белка, но снижает потребление энергии. Мозг Res. 2008;1228:81–88. [PubMed] [Google Scholar]
30. Ypsilantis P, et al. Влияние воздействия сигаретного дыма и его прекращения на массу тела, потребление пищи и циркулирующий лептин, а также уровни грелина у крыс. Никотин Тоб. Рез. 2013;15:206–212. [PubMed] [Академия Google]
Никотин Тоб. Рез. 2013;15:206–212. [PubMed] [Академия Google]
31. Одрен-Макговерн Дж., Беновиц Н.Л. Курение сигарет, никотин и масса тела. клин. Фармакол. тер. 2011;90:164–168. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Баджадж М. Никотин и резистентность к инсулину: когда рассеется дым. Диабет. 2012;61:3078–3080. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Hankey C, Leslie W. Ожирение: является ли увеличение веса после отказа от курения серьезной проблемой? Нац. Преподобный Эндокринол. 2012; 8: 630–632. [PubMed] [Академия Google]
34. Clair C, et al. Дозозависимая положительная связь между курением сигарет, абдоминальным ожирением и жировыми отложениями: перекрестные данные опроса населения. Общественное здравоохранение BMC. 2011;11:23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Tsuji T, et al. Эластаза макрофагов подавляет разрастание белой жировой ткани при курении сигарет. Являюсь. Дж. Дыхание. Ячейка Мол. биол. 2014; 51:822–829. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014; 51:822–829. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. McGrath-Morrow SA, et al. Влияние выбросов электронных сигарет на системные уровни котинина, вес и постнатальный рост легких у новорожденных мышей. ПЛОС ОДИН. 2015;10:e0118344. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Martinez de Morentin PB, et al. Никотин индуцирует отрицательный энергетический баланс через гипоталамическую АМФ-активируемую протеинкиназу. Диабет. 2012;61:807–817. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Schoenberg NE, Huang B, Seshadri S, Tucker TC. Тенденции курения сигарет и ожирения в Аппалачах, штат Кентукки. Юг. Мед. Дж. 2015; 108:170–177. [PubMed] [Google Scholar]
39. Jamal A, et al. Текущее курение сигарет среди взрослых — США, 2005–2013 гг. MMWR Морб. Смертный. Wkly Rep. 2014; 63:1108–1112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Центры по контролю и профилактике заболеваний. Отказ от курения. 2015 [онлайн], http://www. cdc.gov/tobacco/data_statistics/fact_sheets/cessation/quitting/index.htm.
cdc.gov/tobacco/data_statistics/fact_sheets/cessation/quitting/index.htm.
41. Билано В. и др. Глобальные тенденции и прогнозы в отношении употребления табака, 1990–2025 гг.: анализ показателей курения из Комплексных информационных систем ВОЗ по борьбе против табака. Ланцет. 2015; 385:966–976. [PubMed] [Google Scholar]
42. Министерство здравоохранения и социальных служб США. Лечение употребления табака и зависимости: обновление 2008 г. Национальный центр биотехнологической информации. 2008 г. [онлайн], http://www.ncbi.nlm.nih.gov/books/NBK639.52/
43. Фиоре М.С., Флеминг М.Ф., Бернс М.Э. Злоупотребление табаком и алкоголем: клинические возможности для эффективного вмешательства. проц. доц. Являюсь. Врачи. 1999; 111: 131–140. [PubMed] [Google Scholar]
44. Casella G, Caponnetto P, Polosa R. Терапевтические достижения в лечении никотиновой зависимости: настоящее и будущее. тер. Доп. Хронический дис. 2010;1:95–106. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Siahpush M, et al. Лучше быть толстым бывшим курильщиком, чем худым: выводы из 1997–2004 Национальный опрос о состоянии здоровья и исследование взаимосвязи Национального индекса смертности. Тоб. Контроль. 2014; 23:395–402. [PubMed] [Google Scholar]
Siahpush M, et al. Лучше быть толстым бывшим курильщиком, чем худым: выводы из 1997–2004 Национальный опрос о состоянии здоровья и исследование взаимосвязи Национального индекса смертности. Тоб. Контроль. 2014; 23:395–402. [PubMed] [Google Scholar]
46. Тиан Дж., Венн А., Отахал П., Галл С. Связь между отказом от курения и увеличением веса: системный обзор и метаанализ проспективных когортных исследований. Обес. 2015; 16:883–901. [PubMed] [Google Scholar]
47. Klesges RC, Meyers AW, Klesges LM, La Vasque ME. Курение, масса тела и их влияние на курение: всесторонний обзор литературы. Психол. Бык. 1989;106:204–230. [PubMed] [Google Scholar]
48. Williamson DF, et al. Отказ от курения и увеличение веса в национальной когорте. Н. англ. Дж. Мед. 1991; 324: 739–745. [PubMed] [Google Scholar]
49. Aubin HJ, Farley A, Lycett D, Lahmek P, Aveyard P. Увеличение веса у курильщиков после отказа от сигарет: метаанализ. БМЖ. 2012;345:e4439. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Lichtenstein E, Zhu SH, Tedeschi GJ. Телефонные линии для отказа от курения: малоизвестная история успеха вмешательств. Являюсь. Психол. 2010;65:252–261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Lichtenstein E, Zhu SH, Tedeschi GJ. Телефонные линии для отказа от курения: малоизвестная история успеха вмешательств. Являюсь. Психол. 2010;65:252–261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Levine MD, Bush T, Magnusson B, Cheng Y, Chen X. Проблемы с весом и ожирением, связанные с курением: различия между курильщиками с нормальным весом, избыточным весом и ожирением, использующими телефонную линию для отказа от табака. Никотин Тоб. Рез. 2013;15:1136–1140. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Bush TM, et al. Влияние исходного веса на прекращение курения и увеличение веса в очередях отказа от курения. Анна. Поведение Мед. 2014;47:208–217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Lycett D, Munafo M, Johnstone E, Murphy M, Aveyard P. Связь между изменением веса за 8 лет и исходным индексом массы тела в когорте продолжающих и бросающих курить курильщики. Зависимость. 2011; 106: 188–196. [PubMed] [Google Scholar]
54. Locatelli I, Collet TH, Clair C, Rodondi N, Cornuz J. Совместное влияние пола и количества курящих на увеличение веса через год после отказа от курения. Междунар. Дж. Окружающая среда. Рез. Здравоохранение. 2014; 11:8443–8455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Locatelli I, Collet TH, Clair C, Rodondi N, Cornuz J. Совместное влияние пола и количества курящих на увеличение веса через год после отказа от курения. Междунар. Дж. Окружающая среда. Рез. Здравоохранение. 2014; 11:8443–8455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Komiyama M, et al. Анализ факторов, определяющих увеличение массы тела при терапии отказа от курения. ПЛОС ОДИН. 2013;8:e72010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Prod’hom S, et al. Предикторы изменения веса у малоподвижных курильщиков, получающих стандартное вмешательство по прекращению курения. Никотин Тоб. Рез. 2013;15:910–916. [PubMed] [Google Scholar]
57. Hur YN, Hong GH, Choi SH, Shin KH, Chun BG. Диета с высоким содержанием жиров изменила механизм энергетического гомеостаза, вызванного никотином и синдромом отмены у мышей C57BL/6. Мол. Клетки. 2010;30:219–226. [PubMed] [Google Scholar]
58. Lerman C, et al. Изменения в пищевой награде после отказа от курения: фармакогенетическое исследование. Психофармакология (Берл.) 2004; 174: 571–577. [PubMed] [Google Scholar]
Психофармакология (Берл.) 2004; 174: 571–577. [PubMed] [Google Scholar]
59. Волков Н.Д., Ван Г.Дж., Фаулер Дж.С., Теланг Ф. Перекрывающиеся нейронные цепи при зависимости и ожирении: свидетельство системной патологии. Фил. Транс. Р. Соц. Б. 2008; 363:3191–3200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Johnson PM, Hollander JA, Kenny PJ. Снижение функции вознаграждения мозга во время отмены никотина у мышей C57BL6: данные исследований внутричерепной самостимуляции (ICSS). Фармакол. Биохим. Поведение 2008;90:409–415. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Уайт М.А., Машеб Р.М., Грило К.М. Самооценка прибавки в весе после отказа от курения: функция переедания. Междунар. Дж. Ешьте. Беспорядок. 2010; 43: 572–575. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Брук Дж.С., Чжан С., Брук Д.В., Финч С.Дж. Добровольный запрет на курение дома и в машине и отказ от курения, ожирение и самоконтроль. Психол. Отчет 2014; 114: 20–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Stadler M, et al. Влияние отказа от курения на функцию β-клеток, чувствительность к инсулину, массу тела и аппетит. Евро. Дж. Эндокринол. 2014;170:219–227. [PubMed] [Google Scholar]
64. Центры по контролю и профилактике заболеваний. Жизненно важные показатели: воздействие пассивного курения на некурящих — США, 19 лет99–2008. MMWR Морб. Смертный. еженедельно. Отчет 2010; 59: 1141–1146. [PubMed] [Google Scholar]
65. Biedermann L, et al. Отказ от курения вызывает глубокие изменения в составе микробиоты кишечника человека. ПЛОС ОДИН. 2013;8:e59260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Biedermann L, et al. Отказ от курения изменяет кишечную микробиоту: результаты количественных исследований образцов фекалий человека с использованием FISH. Воспаление. Кишечник Дис. 2014;20:1496–1501. [PubMed] [Академия Google]
67. Farley AC, Hajek P, Lycett D, Aveyard P. Вмешательства для предотвращения увеличения веса после отказа от курения. Кокрановская система баз данных. Ред. 2012; 1:CD006219. [PubMed] [Google Scholar]
Кокрановская система баз данных. Ред. 2012; 1:CD006219. [PubMed] [Google Scholar]
68. Love SJ, et al. Предложение программы контроля веса курильщикам с избыточным весом и ожирением, обеспокоенным своим весом, улучшает результаты лечения табачной зависимости. Являюсь. Дж. Наркоман. 2011; 20:1–8. [PubMed] [Google Scholar]
69. Perkins KA, et al. Когнитивно-поведенческая терапия для уменьшения проблем с весом улучшает результаты отказа от курения у женщин, обеспокоенных весом. Дж. Консалт. клин. Психол. 2001;69: 604–613. [PubMed] [Google Scholar]
70. Meyers AW, et al. Являются ли проблемы с весом предвестником отказа от курения? Перспективный анализ. Дж. Консалт. клин. Психол. 1997; 65: 448–452. [PubMed] [Google Scholar]
71. Parsons AC, Shraim M, Inglis J, Aveyard P, Hajek P. Вмешательства для предотвращения увеличения веса после отказа от курения. Кокрановская система баз данных. Ред. 2012; 1:CD006219. [PubMed] [Google Scholar]
72. Levine MD, et al. Бупропион и когнитивно-поведенческая терапия для курящих женщин, обеспокоенных лишним весом. Арка Стажер Мед. 2010;170:543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Бупропион и когнитивно-поведенческая терапия для курящих женщин, обеспокоенных лишним весом. Арка Стажер Мед. 2010;170:543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Schnoll RA, Wileyto EP, Lerman C. Длительная терапия трансдермальным никотином может уменьшить увеличение веса после отказа от курения. Наркоман. Поведение 2012; 37: 565–568. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Taniguchi C, et al. Варениклин более эффективен в снижении прибавки в весе, чем никотиновый пластырь через 12 месяцев после окончания терапии по отказу от курения: обсервационное исследование в Японии. Никотин Тоб. Рез. 2014;16:1026–1029. [PubMed] [Академия Google]
75. Heffner JL, Lewis DF, Winhusen TM. Метилфенидат в ротовой полости с осмотическим высвобождением предотвращает увеличение веса при попытке бросить курить у взрослых с СДВГ. Никотин Тоб. Рез. 2013; 15: 583–587. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Vergnaud AC, et al. Потребление фруктов и овощей и предполагаемое изменение веса у участников Европейского проспективного исследования рака и питания – физическая активность, питание, алкоголь, отказ от курения, питание вне дома и ожирение. Являюсь. Дж. Клин. Нутр. 2012;95:184–193. [PubMed] [Google Scholar]
Являюсь. Дж. Клин. Нутр. 2012;95:184–193. [PubMed] [Google Scholar]
77. Leslie WS, et al. Изменения массы тела и выбора продуктов питания у тех, кто пытается бросить курить: кластерное рандомизированное контролируемое исследование. Общественное здравоохранение BMC. 2012;12:389. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Заместитель NP, Sharma AJ, Kim SY, Hinkle SN. Распространенность и характеристики, связанные с адекватностью гестационного набора веса. Обст. Гинекол. 2015; 125:773–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Suzuki K, et al. Влияние отказа матери от курения до и во время ранней беременности на развитие плода и детства. Дж. Эпидемиол. 2014;24:60–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Wang L, Mamudu HM, Wu T. Влияние пренатального курения матери на развитие избыточного веса у детей школьного возраста. Педиатр. Обес. 2013; 8: 178–188. [PubMed] [Google Scholar]
81. Хокинс С.С., Баум С. Ф., Окен Э., Гиллман М.В. Связь политики борьбы против табака с результатами родов. JAMA Педиатр. 2014;168:e142365. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ф., Окен Э., Гиллман М.В. Связь политики борьбы против табака с результатами родов. JAMA Педиатр. 2014;168:e142365. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Lee K, et al. Ассоциации курения и отказа от курения с висцеральным ожирением, измеренным с помощью КТ, у 4656 корейских мужчин. Пред. Мед. 2012;55:183–187. [PubMed] [Академия Google]
83. Matsushita Y, et al. Связь отказа от курения с площадью висцерального жира и распространенностью метаболического синдрома у мужчин: исследование здоровья Hitachi. Ожирение (Серебряная весна) 2011; 19: 647–651. [PubMed] [Google Scholar]
84. Huang PL. Полное определение метаболического синдрома. Дис. Модель. мех. 2009; 2: 231–237. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Lihn AS, Pedersen SB, Richelsen B. Адипонектин: действие, регуляция и связь с чувствительностью к инсулину. Обес. 2005; 6:13–21. [PubMed] [Академия Google]
86. Maeda K, et al. Клонирование кДНК и экспрессия нового коллагеноподобного фактора, специфичного для жировой ткани, apM1 (транскрипт 1 наиболее распространенного гена жировой ткани).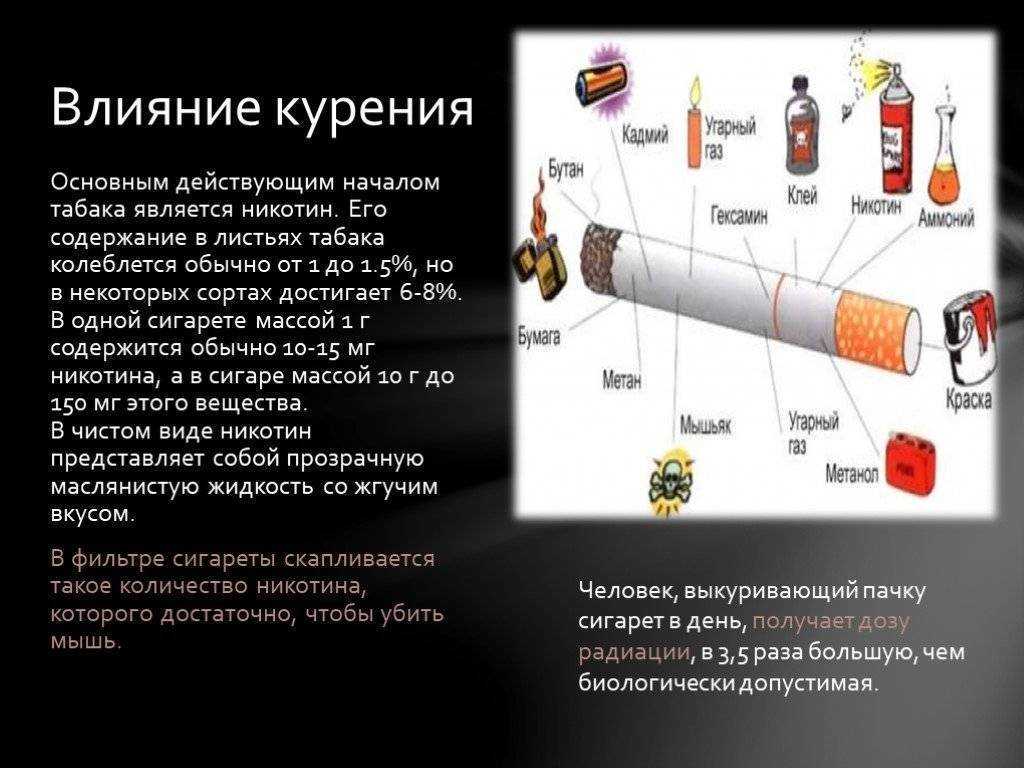 1996. Биохим. Биофиз. Рез. коммун. 2012; 425: 556–559. [PubMed] [Google Scholar]
1996. Биохим. Биофиз. Рез. коммун. 2012; 425: 556–559. [PubMed] [Google Scholar]
87. Shapiro L, Scherer PE. Кристаллическая структура белка семейства комплемента-1q предполагает эволюционную связь с фактором некроза опухоли. Курс. биол. 1998; 8: 335–338. [PubMed] [Google Scholar]
88. Díez JJ, Iglesias P. Роль нового гормона адипонектина, полученного из адипоцитов, в заболевании человека. Евро. Дж. Эндокринол. 2003;148:293–300. [PubMed] [Google Scholar]
89. Chen J, et al. Секреция адипонектина плацентой человека: дифференциальная модуляция адипонектина и его рецепторов цитокинами. Диабетология. 2006; 49: 1292–1302. [PubMed] [Google Scholar]
90. Каур Дж. Всесторонний обзор метаболического синдрома. Кардиол. Рез. Практика. 2014;2014:943162. [Статья PMC бесплатно] [PubMed] [Google Scholar]Retracted
91. Inoue K, et al. Ранние эффекты прекращения курения и увеличения веса на уровни адипонектина в плазме и резистентность к инсулину. Стажер Мед. 2011;50:707–712. [PubMed] [Академия Google]
[PubMed] [Академия Google]
92. Matthews DR, et al. Оценка модели гомеостаза: резистентность к инсулину и функция β-клеток по концентрации глюкозы в плазме натощак и концентрации инсулина у человека. Диабетология. 1985; 28: 412–419. [PubMed] [Google Scholar]
93. Беновиц Н.Л. Курение сигарет и сердечно-сосудистые заболевания: патофизиология и последствия для лечения. прог. Кардиовас. Дис. 2003; 46: 91–111. [PubMed] [Google Scholar]
94. Наканиши К., Нисида М., Охама Т., Морияма Т., Ямаути-Такихара К. Курение связано с накоплением висцерального жира, особенно у женщин. Цирк. Дж. 2014; 78:1259–1263. [PubMed] [Google Scholar]
95. Yun JE, Kimm H, Choi YJ, Jee SH, Huh KB. Курение связано с абдоминальным ожирением, а не с общим ожирением у мужчин с диабетом 2 типа. Дж. Прев. Мед. Здравоохранение. 2012;45:316–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Kirilly E, Gonda X, Bagdy G. CB 1 Антагонисты рецепторов: новые открытия, ведущие к новым перспективам. Акта Физиол. (Оксф.) 2012; 205:41–60. [PubMed] [Google Scholar]
Акта Физиол. (Оксф.) 2012; 205:41–60. [PubMed] [Google Scholar]
97. Gamaleddin IH, et al. Роль эндогенной каннабиноидной системы в никотиновой зависимости: новые идеи. Передний. Психиатрия. 2015;6:41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Silvestri C, Di Marzo V. Второе поколение CB 1 Блокаторы рецепторов и другие ингибиторы гиперактивности периферических эндоканнабиноидов и обоснование их использования при нарушениях обмена веществ. Мнение эксперта. расследование Наркотики. 2012;21:1309–1322. [PubMed] [Google Scholar]
99. Garwood CL, Potts LA. Новые фармакотерапевтические средства для прекращения курения. Являюсь. J. Система здравоохранения. фарм. 2007; 64: 1693–1698. [PubMed] [Google Scholar]
100. Bruin JE, Gerstein HC, Morrison KM, Holloway AC. Повышенный апоптоз β-клеток поджелудочной железы после воздействия никотина на плод и новорожденного опосредуется через митохондрии. Токсикол. науч. 2008; 103: 362–370. [PubMed] [Академия Google]
101. Yoshikawa H, Hellstrom-Lindahl E, Grill V. Доказательства функциональных никотиновых рецепторов на β-клетках поджелудочной железы. Метаболизм. 2005; 54: 247–254. [PubMed] [Google Scholar]
Yoshikawa H, Hellstrom-Lindahl E, Grill V. Доказательства функциональных никотиновых рецепторов на β-клетках поджелудочной железы. Метаболизм. 2005; 54: 247–254. [PubMed] [Google Scholar]
102. Войнилович А.К., Раха С., Николсон С.Дж., Холлоуэй А.С. Влияние фармакотерапии по прекращению курения на функцию β-клеток поджелудочной железы. Токсикол. заявл. Фармакол. 2012; 265:122–127. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Tjalve H, Popov D. Влияние никотина и метаболитов никотина на секрецию инсулина из кусочков поджелудочной железы кролика. Эндокринология. 1973;92:1343–1348. [PubMed] [Google Scholar]
104. Wu Y, et al. Активация AMPKα2 в адипоцитах необходима для индуцированной никотином резистентности к инсулину in vivo . Нац. Мед. 2015;21:373–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Hsia S, DesNoyers M, Lee ML, Goldstein C, Friedman TC. Метаболические эффекты курильщиков, бросивших курить. Эндокринное общество. 2015 [онлайн], https://endo.confex.com/endo/2015endo/webprogram/Paper21451.html. [Академия Google]
2015 [онлайн], https://endo.confex.com/endo/2015endo/webprogram/Paper21451.html. [Академия Google]
106. Bergman BC, et al. Новые и обратимые механизмы индуцированной курением резистентности к инсулину у людей. Диабет. 2012;61:3156–3166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Вулгари С., Кациламброс Н., Тентолурис Н. Отказ от курения предсказывает улучшение микроальбуминурии при недавно диагностированном сахарном диабете 2 типа: 1-летнее проспективное исследование. Метаболизм. 2011;60:1456–1464. [PubMed] [Google Scholar]
108. Атирос В.Г., Кацики Н., Думас М., Карагианнис А., Михайлидис Д.П. Влияние курения табака и прекращения курения на липопротеины плазмы и связанные с ними основные сердечно-сосудистые факторы риска: описательный обзор. Курс. Мед. Рез. мнение 2013;29: 1263–1274. [PubMed] [Google Scholar]
109. Офис законодательного аналитика. 2011 Калифорнийские факты. Экономика и бюджет Калифорнии в перспективе. 2011 [онлайн], http://www. lao.ca.gov/reports/2011/calfacts/calfacts_010511.aspx.
lao.ca.gov/reports/2011/calfacts/calfacts_010511.aspx.
110. Твид Дж.О., Ся С.Х., Лутфи К., Фридман Т.С. Эндокринные эффекты никотина и сигаретного дыма. Тенденции Эндокринол. Метаб. 2012; 23:334–342. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Метаболические эффекты курения сигарет
Обзор
. 1992 г., февраль; 72(2):401-9.
doi: 10.1152/jappl.1992.72.2.401.
К А Перкинс 1
принадлежность
- 1 Западный психиатрический институт и клиника Медицинской школы Университета Питтсбурга, Пенсильвания 15213.
- PMID: 1559911
- DOI:
10.
 1152/яппл.1992.72.2.401
1152/яппл.1992.72.2.401
Обзор
К. А. Перкинс. J Appl Physiol (1985). 1992 Февраль
. 1992 г., февраль; 72(2):401-9.
doi: 10.1152/jappl.1992.72.2.401.
Автор
К А Перкинс 1
принадлежность
- 1 Западный психиатрический институт и клиника Медицинской школы Университета Питтсбурга, Пенсильвания 15213.
- PMID: 1559911
- DOI:
10.
 1152/яппл.1992.72.2.401
1152/яппл.1992.72.2.401
Абстрактный
Обратная зависимость между курением сигарет и массой тела, являющаяся серьезным препятствием для отказа от курения, может быть частично связана с влиянием курения на ускорение обмена веществ в организме. Дан обзор исследований, изучающих хронические и острые метаболические эффекты курения, а также входящего в его состав никотина. Данные свидетельствуют об отсутствии хронического эффекта; большинство исследований показывают, что курильщики и некурящие имеют одинаковую скорость метаболизма в покое (RMR) и что RMR очень мало снижается после прекращения курения. Хотя острый эффект, вызванный курением, очевиден, его величина непостоянна в разных исследованиях, возможно, из-за вариабельности воздействия дыма или потребления никотина. У курильщиков в состоянии покоя острый эффект курения (и потребления никотина) оказывается значительным, но небольшим (менее 10% от RMR) и преходящим (менее или равным 30 мин). Однако конкретные ситуации, в которых курильщики склонны курить, могут опосредовать величину этого эффекта, поскольку курение во время случайной физической активности может усилить его, а курение после еды может уменьшить его. Симпатоадреналовая активация никотином, по-видимому, в первую очередь ответственна за метаболический эффект курения, но возможное влияние неникотиновых компонентов табачного дыма и поведенческих эффектов вдыхания также может быть важным. Улучшение понимания этих метаболических эффектов может привести к лучшему прогнозированию и контролю увеличения веса после отказа от курения, что повысит вероятность сохранения воздержания.
Однако конкретные ситуации, в которых курильщики склонны курить, могут опосредовать величину этого эффекта, поскольку курение во время случайной физической активности может усилить его, а курение после еды может уменьшить его. Симпатоадреналовая активация никотином, по-видимому, в первую очередь ответственна за метаболический эффект курения, но возможное влияние неникотиновых компонентов табачного дыма и поведенческих эффектов вдыхания также может быть важным. Улучшение понимания этих метаболических эффектов может привести к лучшему прогнозированию и контролю увеличения веса после отказа от курения, что повысит вероятность сохранения воздержания.
Похожие статьи
Острые эффекты никотина на скорость метаболизма в покое у курильщиков сигарет.
Перкинс К.А., Эпштейн Л.Х., Стиллер Р.Л., Маркс Б.Л., Джейкоб Р.Г. Перкинс К.А. и соавт. Am J Clin Nutr.
 1989 г., сен; 50 (3): 545–50. doi: 10.1093/ajcn/50.3.545.
Am J Clin Nutr. 1989.
PMID: 2773833
Клиническое испытание.
1989 г., сен; 50 (3): 545–50. doi: 10.1093/ajcn/50.3.545.
Am J Clin Nutr. 1989.
PMID: 2773833
Клиническое испытание.Метаболические эффекты никотина после приема пищи у курильщиков и некурящих.
Перкинс К.А., Эпштейн Л.Х., Стиллер Р.Л., Секстон Дж.Е., Фернстром М.Х., Джейкоб Р.Г., Сольберг Р. Перкинс К.А. и соавт. Am J Clin Nutr. 1990 авг.; 52(2):228-33. doi: 10.1093/ajcn/52.2.228. Am J Clin Nutr. 1990. PMID: 2375287 Клиническое испытание.
Дивергентная толерантность к метаболическим и сердечно-сосудистым эффектам никотина у курильщиков с низким и высоким уровнем потребления сигарет.
Аркави Л., Джейкоб П. 3-й, Хеллерштейн М., Беновиц Н.Л. Аркави Л. и др. Клин Фармакол Тер. 1994 г.
 , июль; 56 (1): 55–64. doi: 10.1038/clpt.1994.101.
Клин Фармакол Тер. 1994.
PMID: 8033495
, июль; 56 (1): 55–64. doi: 10.1038/clpt.1994.101.
Клин Фармакол Тер. 1994.
PMID: 8033495[Сокращение курения и временное воздержание: новые подходы к прекращению курения].
Le Houezec J, Säwe U. Le Houezec J, et al. Джей Мэл Васк. 2003 Декабрь; 28 (5): 293-300. Джей Мэл Васк. 2003. PMID: 14978435 Обзор. Французский.
Прибавка в весе после отказа от курения.
Перкинс К.А. Перкинс К.А. J Consult Clin Psychol. 1993 г., октябрь; 61 (5): 768–777. doi: 10.1037//0022-006x.61.5.768. J Consult Clin Psychol. 1993. PMID: 8245274 Обзор.
Посмотреть все похожие статьи
Цитируется
Влияние отказа от курения на массу тела и другие метаболические параметры с акцентом на людей с сахарным диабетом 2 типа.

Дрива С., Корконцелу А., Тонстад С., Тентолурис Н., Катсауну П. Дрива С. и др. Общественное здравоохранение Int J Environ Res. 2022 14 октября; 19 (20): 13222. doi: 10.3390/ijerph292013222. Общественное здравоохранение Int J Environ Res. 2022. PMID: 36293800 Бесплатная статья ЧВК. Обзор.
Различные роли субъединиц никотиновых рецепторов α5 и β4 в пищевом вознаграждении и никотин-индуцированной потере веса у самцов мышей.
Бреум А.В., Фальк С., Свендсен CSA, Николайсен Т.С., Матисен К.В., Маскос У., Клемменсен К. Бреум А.В. и др. Эндокринология. 1 июля 2022 г .; 163 (7): bqac079. doi: 10.1210/endocr/bqac079. Эндокринология. 2022. PMID: 35595472 Бесплатная статья ЧВК.
Анатабин, норникотин и анабазин снижают прибавку в весе и жировые отложения за счет снижения потребления пищи и увеличения физической активности.

Гребенштейн П.Е., Эриксон П., Грейс М., Коц К.М. Grebenstein PE, et al. Дж. Клин Мед. 2022 18 января; 11 (3): 481. doi: 10.3390/jcm11030481. Дж. Клин Мед. 2022. PMID: 35159932 Бесплатная статья ЧВК.
Комментарий: Пищевая глутаминовая кислота, ожирение и симптомы депрессии у пациентов с шизофренией.
Хан Т.А., Сивенпайпер Д.Л., Фернстром Д.Д. Хан Т.А. и соавт. Фронтовая психиатрия. 2021 14 окт;12:725786. дои: 10.3389/fpsyt.2021.725786. Электронная коллекция 2021. Фронтовая психиатрия. 2021. PMID: 34721103 Бесплатная статья ЧВК. Аннотация недоступна.
Ангедония при отказе от табака среди афроамериканских курильщиков.
Liautaud MM, Kechter A, Bello MS, Guillot CR, Oliver JA, Banks DE, D’Orazio LM, Leventhal AM.

 , Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9.
, Vincent M. D., Yu E. W. Continued cigarette smoking by patients receiving concurrent chemoradiotherapy for limited-stage small-cell lung cancer is associated with decreased survival // J Clin Oncol 2003;21:1544-9. 2012;18(16):4425-32.
2012;18(16):4425-32. 2007 Aug;36(8):739-44.
2007 Aug;36(8):739-44. Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6.
Overcoming CYP1A1/1A2 mediated induction of metabolism by escalating erlotinib dose in current smokers // J Clin Oncol. 2009 Mar 10;27(8):1220-6.
 При курении организм принимает его как должное и запускает в работу. Из-за этого ощущение голода полностью исчезает.
При курении организм принимает его как должное и запускает в работу. Из-за этого ощущение голода полностью исчезает. д. Спорт поможет избавиться от лишнего веса. Во время физических нагрузок вырабатывается эндорфин — гормон счастья, который не позволит сорваться и начать курить.
д. Спорт поможет избавиться от лишнего веса. Во время физических нагрузок вырабатывается эндорфин — гормон счастья, который не позволит сорваться и начать курить. 1152/яппл.1992.72.2.401
1152/яппл.1992.72.2.401 1152/яппл.1992.72.2.401
1152/яппл.1992.72.2.401 1989 г., сен; 50 (3): 545–50. doi: 10.1093/ajcn/50.3.545.
Am J Clin Nutr. 1989.
PMID: 2773833
Клиническое испытание.
1989 г., сен; 50 (3): 545–50. doi: 10.1093/ajcn/50.3.545.
Am J Clin Nutr. 1989.
PMID: 2773833
Клиническое испытание. , июль; 56 (1): 55–64. doi: 10.1038/clpt.1994.101.
Клин Фармакол Тер. 1994.
PMID: 8033495
, июль; 56 (1): 55–64. doi: 10.1038/clpt.1994.101.
Клин Фармакол Тер. 1994.
PMID: 8033495

