2 антисептик Дорогова (фракция 2) (id 58981348)
Форма выпуска, состав и упаковка
Раствор для наружного, перорального, интравагинального и внутриматочного применения в виде жидкости от желтого до красновато-коричневого цвета, со специфическим запахом, хорошо смешивающейся с водой, с наличием хлопьевидного осадка от серого до черного цвета.
Препарат АСД фракция 2 содержит: низкомолекулярные органические соединения, включая низшие карбоновые кислоты, их амиды и аммонийные соли, холиновые эфиры карбоновых кислот, холин, первичные и вторичные амины, пептиды, а также неорганические азотистые соединения (соли аммония углекислого, аммония уксуснокислого) и воду.
Расфасован по 5, 7, 10 мл в полимерные или стеклянные флаконы вместимостью 10 мл; по 20, 50, 100, 200 мл в полимерные или стеклянные флаконы соответствующей вместимости; по 1000 мл в пластиковые или стеклянные бутылки.
Флаконы, стеклянные бутылки укупорены резиновыми пробками и обкатаны алюминиевыми колпачками, полимерные бутылки закрыты навинчиваемыми пластмассовыми крышками с контролем первого вскрытия.
Флаконы вместимостью 10 мл по 4, 6, 8, 10 шт. или поштучно помещены в картонную пачку, допускается выпуск флаконов с препаратом по 100 мл без пачки. Каждая единица фасовки снабжена инструкцией по применению.
Регистрационное удостоверение 02-3-31.12-2370 № ПВР-3-1.2/00910 от 22.10.14
Фармакологические (биологические) свойства и эффекты
Иммуностимулирующий препарат, полученный путем сухой перегонки мясокостной муки.
Препарат обладает широким спектром биологической активности, повышает активность тканевых и пищеварительных ферментов, обладает антисептическим действием, стимулирует активность ретикулоэндотелиальной и эндокринной систем, нормализует трофику, ускоряет регенерацию поврежденных тканей, участвует в процессах фосфорилирования и синтеза белков, не обладает кумулятивным действием.
АСД фракция 2 по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности согласно ГОСТ 12.1.007). Хорошо переносится животными разных видов и возрастов.
Показания к применению препарата АСД фракция 2
Назначают сельскохозяйственным животным (в т.ч. птице) и собакам с лечебной и профилактической целью:
— при болезнях ЖКТ;
— при болезнях органов дыхания;
— при болезнях мочеполовой системы;
— при поражениях кожных покровов;
— при нарушениях обмена веществ;
— для стимуляции деятельности центральной и вегетативной нервной системы;
— для повышения естественной резистентности у ослабленных и переболевших инфекционными и инвазионными болезнями животных;
— для стимуляции роста и развития поросят, цыплят;
— для повышения яйценоскости кур.
Порядок применения
Внутрь препарат АСД фракция 2 назначают с питьевой водой перед кормлением или в смеси с комбикормом в утреннее кормление в дозах, указанных в таблице.
| Вид животных, возраст | Количество препарата на голову (мл) | Количество воды (мл) или корма (г) |
| Лошади | ||
| От 3 лет и старше | 10-20 | 200-600 |
| От 1 года до 3 лет | 10-15 | 200-400 |
| До 1 года | 5 | 100 |
| Коровы | ||
| От 3 лет и старше | 20-30 | 200-400 |
| От 1 года до 3 лет | 10-15 | 100-400 |
| До 1 года | 5-7 | 40-100 |
| Овцы | ||
| Старше 1 года | 2-5 | 40-100 |
| Старше 6 мес | 1-3 | 20-80 |
| До 6 мес | 0. | 10-40 |
| Свиньи | ||
| Старше 1 года | 5-10 | 100-200 |
| Старше 6 мес | 2-5 | 40-100 |
| 2-3 месяца | 1-3 | 20-80 |
| Собаки | ||
| от 10 мес | 2 | 40 |
| Куры, индюки, утки, гуси | ||
| Взрослое поголовье | 35 | 100 л |
| Молодняк | 0.1 мл/кг | — |
Наружно, внутриматочно и интравагинально препарат применяют в виде 2-20% растворов, приготовленных на стерильном физиологическом растворе. Для орального применения возможно приготовление на кипяченой воде.
При диспепсии, гастроэнтероколите, гастроэнтерите, а также дистрофических состояниях, вызванных расстройствами пищеварения и нарушениями обмена веществ, препарат назначают курсами по 5 дней с интервалами 2-3 дня внутрь 1 раз/сут в течение 1 мес.
При тимпании крупного рогатого скота, при метеоризме кишечника у лошадейпрепарат выпаивают или вводят через зонд 1-2 раза/сут в течение 3-5 дней.
При катаральной пневмонии поросят наряду с этиотропным лечением препарат применяют 1 раз/сут за 30-40 мин до кормления с питьевой водой или в смеси с комбикормом. Препарат применяют курсами по 5 дней с интервалом 3 дня в течение 1 мес.
При вагинитах применяют 2 л 3-5% раствора препарата, подогретого до 37-40°С, которым промывают влагалище 1 раз/сут в течение 4-5 дней.
При задержании последа у коров (после его удаления) применяют 200-300 мл 3-5% раствора препарата, подогретого до 37-40°С, который вводят в полость матки 1 раз/сут в течение 4-5 дней.
При острых и хронических эндометритах, миометрите и пиометре у коров в полость матки вводят 200-300 мл 15% раствора препарата, подогретого до 37-40°С, и сразу удаляют, используя для этих целей катетер с обратным током жидкости, 1 раз/сут в течение 10-14 дней.
В комплексной терапии трихомоноза коровам вводят во влагалище 200-300 мл 20% раствора препарата при помощи шприца Жане 1 раз/сут в течение 10-14 дней.
При лечении быков, больных острой формой трихомоноза, препуциальный мешок промывают 1 л 2-3% раствора препарата, используя для этого кружку Эсмарха. После этого наружное отверстие препуциального мешка зажимают на 3-5 мин рукой и проводят легкий массаж. Процедуру повторяют 1 раз/сут в течение 5-7 дней.
После этого наружное отверстие препуциального мешка зажимают на 3-5 мин рукой и проводят легкий массаж. Процедуру повторяют 1 раз/сут в течение 5-7 дней.
В целях стимуляции центральной и вегетативной нервной системы, повышения резистентности у переболевших инфекционными и инвазионными болезнями животных, ускорения заживления кожных покровов, при некробактериозе, экземах, дерматитах, трофических язвах препарат применяют с питьевой водой или индивидуально в смеси с кормом 1 раз/сут курсами по 5 дней с интервалом 3 дня в течение 1 мес.
Инфицированные вялозаживающие раны промывают 15-20% раствором препарата, накладывают повязки, смоченные этим раствором. При наличии свищей, вскрытых полостей абсцессов, флегмон в их полость вводят марлевый дренаж из этого раствора. Лечение проводят 1 раз/сут до образования грануляционного вала, но не более 10-14 дней.
При мыте лошадей и наличии абсцессов в подчелюстном пространстве и на других частях тела после предварительного туалета полости промывают 15-20% раствором препарата и при необходимости вводят тампоны, пропитанные лекарственным средством 1 раз/сут до очищения раны от гноя и появления грануляции, но не более 10-14 дней.
В целях стимуляции роста и развития телят, поросят и цыплят препарат применяют индивидуально в смеси с комбикормом из расчета 0.1 мл препарата АСД фракция 2 на 1 кг массы тела через день в течение 1-2 мес.
Особенностей действия при первом применении препарата и при его отмене не выявлено.
Следует избегать пропуска очередной дозы препарата, т.к. это может привести к снижению терапевтической эффективности. При пропуске одной или нескольких обработок курс применения необходимо возобновить в предусмотренных дозах и по той же схеме применения.
Побочные эффекты
При применении препарата в соответствии с инструкцией побочных явлений и осложнений, как правило, не наблюдается.
Симптомы передозировки при применении лекарственного препарата не выявлены.
Противопоказания к применению препарата АСД фракция 2
Запрещается применение препарата при:
— повышенной индивидуальной чувствительности животного к компонентам препарата (в т.ч. в анамнезе).
Особые указания и меры личной профилактики
В случае появления аллергических реакций использование препарата прекращают и назначают животному антигистаминные препараты и средства симптоматической терапии.
Применение препарата АСД фракция 2 не исключает использование других лекарственных препаратов.
Продукты убоя, молоко дойных животных, яйцо птицы в период применения препарата используются без ограничений.
Меры личной профилактики
При работе с препаратом АСД фракция 2 следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами ветеринарного назначения. Во время работы запрещается пить, курить и принимать пищу. По окончании работы руки следует вымыть теплой водой с мылом.
Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с препаратом АСД фракция 2. При случайном контакте лекарственного препарата с кожей или слизистыми оболочками глаз их необходимо промыть большим количеством воды. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (при себе иметь инструкцию по применению препарата или этикетку).
Пустые упаковки из-под лекарственного препарата запрещается использовать для бытовых целей, они подлежат утилизации с бытовыми отходами.
Условия хранения Асд Фракция 2
Препарат следует хранить в закрытой упаковке производителя, в недоступном для детей, сухом, защищенном от прямых солнечных лучей месте, отдельно от пищевых продуктов и кормов, при температуре от 10°С до 30°С.
Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
Срок годности Асд Фракция 2
Срок годности препарата при соблюдении условий хранения — 4 года с даты производства, после вскрытия флакона — не более 14 суток. Запрещается применение препарата по истечении срока годности.
АСД -2 100мл (Армавир)
Производитель:
Api-San, Россия
АВЗ, Агроветзащита Россия
Экопром, Россия
КРКА, Словения
Россия
Новартис
Другое
LIVISTO (INVESA), ИСПАНИЯ
Цена
от до ₸
- Подробное описание
СОСТАВ И ФОРМА ВЫПУСКА
Препарат АСД-З является продуктом сухой перегонки сырья животного происхождения. Содержит в своем составе карбоновые кислоты, алифатические и циклические углеводороды, алкилбензолы и замещенные фенолы, алифатические амины и амиды, соединения с активной сульфгидрильной группой и воду. По внешнему виду препарат представляет собой густую жидкость от темно-коричневого до черного цвета, растворимую в спирте, растительных и животных маслах и практически не растворимую в воде.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
АСД фракция 3 относится к тканевым препаратам. Получают путем сухой перегонки тканей животного происхождения. Препарат повышает иммунитет организма, обладает выраженным антисептическим действием, стимулирует активность ретикулоэндотелиальной и эндокринной систем, нормализует трофику, ускоряет регенерацию поврежденных тканей, не обладает кумулятивным действием. АСД фракция 3 по степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007).
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Препарат АСД-З назначают животным наружно в нативном виде или в форме 20-50% масляных растворов. Применяется для лечения инфицированных вяло заживающих ран, дерматитов, хронических воспалительных повреждений кожи и копыт, трофических язв, свищей, копытной гнили овец и некробактериоза у животных, а также гинекологических заболеваний различной этиологии.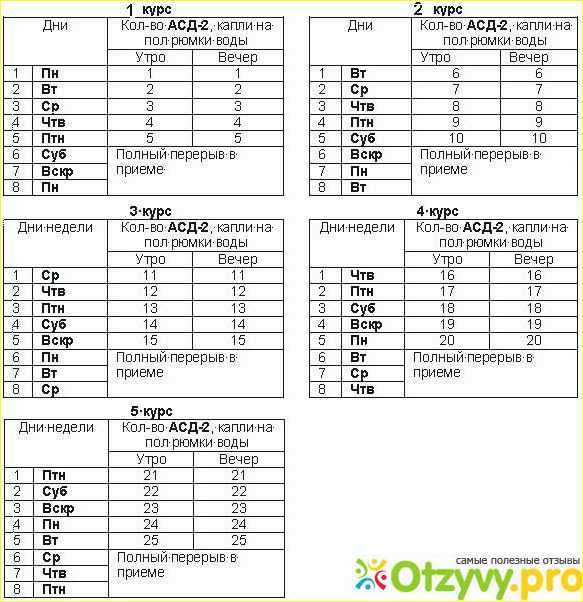
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Масляные растворы готовят в асептических условиях с использованием стерильного касторового, льняного, подсолнечного масел или рыбьего жира при тщательном перемешивании с добавлением препарата АСД-З в соотношении 1:4 или 1:1.
При гинекологических заболеваниях АСД-3 применяют: при вагинитах интравагинально, а эндометритах — внутриматочно в виде 20-50% масляных растворов, при заболеваниях кожи и копыт — наружно в нативном виде или в форме масляных растворов и мазей.
Для лечения инфицированных вялозаживающих ран и свищей пораженный участок промывают 15-20% раствором другого препарата АСД-2 до прекращения гнойных выделений, а после этого накладывают марлевую салфетку с 20% масляным раствором препарата АСД-З, которую фиксируют бинтом. Лечение проводят до выздоровления, ежедневно заменяя салфетки с препаратом.
 Лечение проводят до выздоровления. При обширных поражениях препарат наносят попеременно на разные участки, покрывая за одну обработку не боле 1/10 поверхности тела животного.
Лечение проводят до выздоровления. При обширных поражениях препарат наносят попеременно на разные участки, покрывая за одну обработку не боле 1/10 поверхности тела животного.При некробактериозе животных и копытной гнили овец после санитарной обработки пораженные участки смазывают нативным препаратом один раз в день до полного выздоровления животных. Лечение проводят в комплексе с местными хирургическими обработками и лекарственными средствами специфической и симптоматической терапии.
ОСОБЫЕ УКАЗАНИЯ
Применение АСД фракция 3 не исключает использование других лекарственных препаратов специфической и симптоматической терапии.
Продукция животноводства, полученная в период применения АСД фракция 3, может быть использована на общих основаниях. В случае вынужденного убоя животного, обработанные препаратом участки туши зачищают и утилизируют.
При работе с АСД фракция 3 следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами. По окончании работы руки следует вымыть теплой водой с мылом. При случайном контакте лекарственного препарата с кожей или слизистыми оболочками глаз, их необходимо промыть большим количеством воды. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (иметь при себе инструкцию по применению препарата и этикетку).
По окончании работы руки следует вымыть теплой водой с мылом. При случайном контакте лекарственного препарата с кожей или слизистыми оболочками глаз, их необходимо промыть большим количеством воды. В случае появления аллергических реакций или при случайном попадании препарата в организм человека следует немедленно обратиться в медицинское учреждение (иметь при себе инструкцию по применению препарата и этикетку).
ПОБОЧНЫЕ ДЕЙСТВИЯ
Побочных явлений и осложнений при применении лекарственного препарата в соответствии с настоящей инструкцией, как правило, не наблюдается.
ПРОТИВОПОКАЗАНИЯ
Повышенная индивидуальная чувствительность животного к компонентам препарата (в том числе в анамнезе).
УСЛОВИЯ ХРАНЕНИЯ
Хранят АСД-3 в местах недоступных для детей, в упаковке предприятия-изготовителя отдельно от пищевых продуктов и кормов, в сухом, защищенном от света месте при температуре от 10 до 30°С. Препарат пригоден для применения в течение 4 лет с даты изготовления при соблюдении указанных условий хранения. После первого вскрытия флакона препарат пригоден к применению в течение 14 суток.
Препарат пригоден для применения в течение 4 лет с даты изготовления при соблюдении указанных условий хранения. После первого вскрытия флакона препарат пригоден к применению в течение 14 суток.
Copyright MAXXmarketing GmbH
JoomShopping Download & Support
Катетерное лечение дефекта межпредсердной перегородки — StatPearls
Кристен Н. Браун; Арун Канмантаредди.
Информация об авторе и организациях
Последнее обновление: 13 февраля 2023 г.
Непрерывное обучение
Транскатетерное закрытие ДМПП в настоящее время доступно для вторичного типа ДМПП, и в настоящее время в Соединенных Штатах есть два одобренных FDA устройства. Государства для закрытия ASD. В этом упражнении рассматривается техника закрытия ДМПП, показания, противопоказания и подчеркивается роль межпрофессиональной команды в лечении пациентов с врожденными пороками сердца.
Цели:
Определить технику катетерного лечения ДМПП.

Опишите показания к катетерному лечению ДМПП.
Вспомните осложнения катетерного лечения ДМПП.
Чтобы улучшить результаты, обсудите важность помощи межпрофессиональной бригады при лечении пациентов, перенесших закрытие ДМПП с помощью катетера.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Дефект межпредсердной перегородки (ДМПП) является одним из наиболее распространенных врожденных пороков сердца с расчетной частотой от 6 до 10 на 10 000 живорождений [1]. Дефекты межпредсердной перегородки классифицируются как первичные, вторичные, дефекты венозного синуса и дефекты коронарного синуса. Начало симптомов варьирует у разных пациентов, и многие пациенты остаются бессимптомными. Дефекты большего размера, как правило, вызывают симптомы на раннем этапе, а дефекты меньшего размера вызывают симптомы в более позднем возрасте. Симптомы включают задержку развития, одышку, учащенное сердцебиение, увеличение правых отделов сердца, периферические отеки, цианоз, ортодеоксию-платипноэ и парадоксальную эмболию. Транскатетерное закрытие ДМПП в настоящее время доступно для вторичного типа ДМПП, и в настоящее время в США есть два одобренных FDA устройства для закрытия ДМПП.
Транскатетерное закрытие ДМПП в настоящее время доступно для вторичного типа ДМПП, и в настоящее время в США есть два одобренных FDA устройства для закрытия ДМПП.
Анатомия и физиология
Сердце состоит из четырех камер; две верхние камеры называются предсердиями, а две нижние камеры называются желудочками. Межпредсердная перегородка делит предсердие на правое и левое предсердия. Точно так же перегородка разделяет желудочки на правый и левый и называется межжелудочковой перегородкой. Эмбриологически межпредсердная перегородка происходит от первичной и вторичной перегородки. Первичная перегородка начинается от крыши предсердия и развивается по направлению к эндокардиальным подушкам, покрывающим первичное отверстие. За этим следует дегенерация первичной перегородки по направлению к крыше предсердий с образованием вторичного отверстия. Затем вторичная перегородка начинается от крыши предсердия на стороне правого предсердия и растет каудально, покрывая вторичное отверстие [2]. В зависимости от локализации дефекта ДМПП подразделяют на первичный, вторичный, дефекты венозного синуса и дефекты коронарного синуса. Дефекты межпредсердной перегородки в области вторичного отверстия (овальной ямки) относятся к вторичному типу ДМПП, который является наиболее распространенным типом ДМПП. Дефекты primum включают в себя ostium primum и эндокардиальные подушки и связаны с атриовентрикулярными клапанными аномалиями. Дефекты венозного синуса располагаются в месте впадения верхней или нижней полой вены в правое предсердие и называются дефектами верхнего или нижнего венозного синуса по отношению к верхней или нижней полой вене. Дефекты верхнего венозного синуса связаны с аномальными соединениями легочных вен. При дефекте коронарного синуса происходит потеря крыши коронарного синуса, что обеспечивает прямое сообщение между левым предсердием и коронарным синусом [3]. В зависимости от размера, ASD классифицируются на[4]:
В зависимости от локализации дефекта ДМПП подразделяют на первичный, вторичный, дефекты венозного синуса и дефекты коронарного синуса. Дефекты межпредсердной перегородки в области вторичного отверстия (овальной ямки) относятся к вторичному типу ДМПП, который является наиболее распространенным типом ДМПП. Дефекты primum включают в себя ostium primum и эндокардиальные подушки и связаны с атриовентрикулярными клапанными аномалиями. Дефекты венозного синуса располагаются в месте впадения верхней или нижней полой вены в правое предсердие и называются дефектами верхнего или нижнего венозного синуса по отношению к верхней или нижней полой вене. Дефекты верхнего венозного синуса связаны с аномальными соединениями легочных вен. При дефекте коронарного синуса происходит потеря крыши коронарного синуса, что обеспечивает прямое сообщение между левым предсердием и коронарным синусом [3]. В зависимости от размера, ASD классифицируются на[4]:
Простая: диаметр менее 3 мм
Мелкая: диаметр от 3 до менее 6 мм
Средняя: диаметр от 6 до 8 мм
9 0017
Большой: более 8 мм в диаметре [4]
Показания
Транскатетерное закрытие ДМПП может быть выполнено только при вторичном типе ДМПП. Другие типы ДМПП восстанавливаются хирургическим путем из-за их локализации и связанных с ними аномалий дефектов атриовентрикулярного клапана (тип primum) и аномальных соединений легочных вен (тип венозного синуса).
Другие типы ДМПП восстанавливаются хирургическим путем из-за их локализации и связанных с ними аномалий дефектов атриовентрикулярного клапана (тип primum) и аномальных соединений легочных вен (тип венозного синуса).
Текущие показания для закрытия ДМПП транскатетерным доступом включают:
Симптоматический ДМПП, вызывающий функциональные нарушения (Класс I)
Симптоматическое (Класс I) или бессимптомное увеличение правого предсердия и/или правого желудочка (Класс II)
900 20Симптоматический (класс I) бессимптомный гемодинамически значимый дефект без симптомов (отношение легочного и системного кровотока более 1,5) (класс II)
Парадоксальная эмболия[5][6][7]
Противопоказания
Противопоказания для закрытия ДМПП транскатетерным доступом включают: тип венозного синуса, и дефекты коронарного синуса
Тяжелая легочная гипертензия (легочное систолическое давление или легочное сосудистое сопротивление, превышающее две трети системного давления или системного сосудистого сопротивления)
Синдром Эйзенменгера или сетка справа налево
Дефекты диаметром более 38 мм
Отсутствие или недостаточный ободок ткани вокруг дефекта[5][7]
9 0020Оборудование
Лаборатория катетеризации сердца
Чреспищеводная эхокардиография (ЧПЭ) или внутрисердечная эхокардиография (ВСЭ)
Замыкающее устройство ДМПП
Катетерная система доставки
Рентгеноскопия
Анестезия
Антибиотики[8]
Персонал
Интервенционный кардиолог, обученный и имеющий опыт работы со структурными заболеваниями сердца, медсестра сердечно-сосудистой катетерологической лаборатории, первый ассистент и лаборант сердечной катетеризации.
Подготовка
Оценка перед процедурой
Пациент должен быть обследован клинически и в анамнезе, включая любые аллергии, особенно на такие металлы, как никель. Пациенту следует пройти чреспищеводную эхокардиограмму, чтобы оценить тип ДМПП и его пригодность для восстановления, например, оценить края ткани вокруг ДМПП. Размер дефекта должен быть измерен для определения размера устройства. Пациенту также следует провести катетеризацию правых отделов сердца для оценки легочного давления и фракции шунта. Магнитно-резонансная томография сердца или КТ-ангиография сердца рекомендуются для оценки дефекта и аномальных соединений легочных вен, если это невозможно оценить во время чреспищеводной эхокардиограммы.
После определения приемлемости пациента следует проконсультировать о рисках и преимуществах процедуры и получить согласие. В день процедуры пациента следует обследовать на любые активные текущие инфекции и определить пригодность для анестезии.
Техника
Транскатетерное закрытие ДМПП проводится под умеренной седацией или под общей анестезией в зависимости от сложности дефекта и необходимости ЧПЭхоКГ. Но подавляющее большинство дефектов ДМПП можно закрыть при умеренной седации. Перед операцией вводят предоперационный антибиотик. После седации пациента получают сосудистый доступ в бедренной вене. В зависимости от предпочтений оператора венозный доступ может быть получен через правую бедренную вену или могут быть использованы двусторонние бедренные вены. Для выполнения процедуры требуется два доступа, если для визуализации используется ICE. Если используется ЧПЭ, то достаточно одного венозного доступа. Доступ для катетера ICE требует размещения интродьюсера 8-10 French, и предпочтительно используются интродьюсеры длиной 25-35 см, поскольку это обеспечивает стабильность катетера ICE и помогает избежать извитости бедренных вен. Второй доступ, в зависимости от предпочтений оператора, может начинаться с 6 французских и может быть увеличен до соответствующего размера интродьюсера в диапазоне от 6 до 12 французских в зависимости от размера используемого закрывающего устройства. Оболочки большего размера необходимы для доставки устройств большего размера.
Но подавляющее большинство дефектов ДМПП можно закрыть при умеренной седации. Перед операцией вводят предоперационный антибиотик. После седации пациента получают сосудистый доступ в бедренной вене. В зависимости от предпочтений оператора венозный доступ может быть получен через правую бедренную вену или могут быть использованы двусторонние бедренные вены. Для выполнения процедуры требуется два доступа, если для визуализации используется ICE. Если используется ЧПЭ, то достаточно одного венозного доступа. Доступ для катетера ICE требует размещения интродьюсера 8-10 French, и предпочтительно используются интродьюсеры длиной 25-35 см, поскольку это обеспечивает стабильность катетера ICE и помогает избежать извитости бедренных вен. Второй доступ, в зависимости от предпочтений оператора, может начинаться с 6 французских и может быть увеличен до соответствующего размера интродьюсера в диапазоне от 6 до 12 французских в зависимости от размера используемого закрывающего устройства. Оболочки большего размера необходимы для доставки устройств большего размера. В зависимости от оператора может быть получен дополнительный артериальный доступ для мониторинга давления. После получения обоих доступов пациенту назначают антикоагулянтную терапию, предпочтительно нефракционированным гепарином, но для пациентов с аллергией на гепарин можно использовать и другие препараты, такие как бивалирудин. ACT > 250 поддерживается на протяжении всей процедуры.
В зависимости от оператора может быть получен дополнительный артериальный доступ для мониторинга давления. После получения обоих доступов пациенту назначают антикоагулянтную терапию, предпочтительно нефракционированным гепарином, но для пациентов с аллергией на гепарин можно использовать и другие препараты, такие как бивалирудин. ACT > 250 поддерживается на протяжении всей процедуры.
Затем катетер ICE продвигают под рентгеноскопическим контролем в правое предсердие и располагают для визуализации межпредсердной перегородки. После этого визуализируют перегородку и опрашивают межпредсердную перегородку на наличие обода соответствующего размера. Размер ДМПП измеряется в нескольких плоскостях, регистрируется цветовой поток и направление шунта. После этого катетер с изогнутым кончиком продвигают по J-образному проводнику в правое предсердие. Дефект пересекают J-образным проводником из правого предсердия в левое под контролем рентгеноскопии и ICE. После этого проводник с J-образным наконечником продвигают в левую верхнюю легочную вену, а катетер продвигают в левую верхнюю легочную вену. Затем проводник с J-образным наконечником заменяют сверхжестким проводником, а катетер с изогнутым кончиком удаляют. После этого венозный футляр в бедренной вене удаляют и калибровочный баллон ДМПП продвигают по проволоке в ДМПП. Под флюороскопическим контролем калибровочный баллон медленно надувают контрастом до тех пор, пока поток через ДМПП не прекратится, что визуализируется с помощью ICE. При этом следует соблюдать осторожность, чтобы не допустить перераздувания баллона, так как это приведет к завышению размеров дефекта. Предпочтительный подход состоит в том, чтобы сдувать баллон до тех пор, пока не возобновится поток через ASD, а затем надувать баллон до тех пор, пока поток через ASD снова не прекратится; это называется техникой «остановки потока». Затем размер дефекта будет измерен как с помощью рентгеноскопии, так и с помощью ICE с использованием отпечатков на калибровочном баллоне ASD. После этого баллон сдувают и удаляют через проволоку, соблюдая осторожность, чтобы не допустить выпадения проволоки из легочной вены.
Затем проводник с J-образным наконечником заменяют сверхжестким проводником, а катетер с изогнутым кончиком удаляют. После этого венозный футляр в бедренной вене удаляют и калибровочный баллон ДМПП продвигают по проволоке в ДМПП. Под флюороскопическим контролем калибровочный баллон медленно надувают контрастом до тех пор, пока поток через ДМПП не прекратится, что визуализируется с помощью ICE. При этом следует соблюдать осторожность, чтобы не допустить перераздувания баллона, так как это приведет к завышению размеров дефекта. Предпочтительный подход состоит в том, чтобы сдувать баллон до тех пор, пока не возобновится поток через ASD, а затем надувать баллон до тех пор, пока поток через ASD снова не прекратится; это называется техникой «остановки потока». Затем размер дефекта будет измерен как с помощью рентгеноскопии, так и с помощью ICE с использованием отпечатков на калибровочном баллоне ASD. После этого баллон сдувают и удаляют через проволоку, соблюдая осторожность, чтобы не допустить выпадения проволоки из легочной вены. После этого интродьюсер соответствующего размера, который может доставить устройство ДМПП, продвигается по проводу в левое предсердие, а расширитель интродьюсера и провод удаляются. К интродьюсеру следует прикрепить запорный кран или шприц, чтобы предотвратить случайное попадание воздуха в интродьюсер.
После этого интродьюсер соответствующего размера, который может доставить устройство ДМПП, продвигается по проводу в левое предсердие, а расширитель интродьюсера и провод удаляются. К интродьюсеру следует прикрепить запорный кран или шприц, чтобы предотвратить случайное попадание воздуха в интродьюсер.
Затем подготавливается устройство ASD соответствующего размера. Устройство сначала проверяется на целостность, и устройство погружается в ванну с солевым раствором. После этого устройство прикрепляется к кабелю доставки, и устройство медленно втягивается обратно в кожух загрузчика, в то время как боковая часть кожуха загрузчика постоянно промывается, чтобы предотвратить попадание воздуха в устройство или кожух загрузчика. Далее лоадер прикрепляют к доставочной оболочке осторожно, без введения воздуха. Кабель доставки продвигают в оболочку, тем самым продвигая устройство в оболочку доставки. После этого устройство медленно продвигают к кончику интродьюсера под рентгеноскопическим контролем. На этом этапе следует позаботиться о перемещении катетера ICE, чтобы оптимизировать визуализацию ДМПП, поскольку иногда катетер ICE перемещается во время выполнения вышеуказанных шагов. Как только устройство достигает кончика интродьюсера, интродьюсер вытягивается по кабелю доставки, чтобы обнажить диск левого предсердия. Это можно визуализировать как на ICE, так и на рентгеноскопии. Как только диск левого предсердия полностью сформирован, и интродьюсер доставки, и кабель доставки извлекаются до тех пор, пока диск левого предсердия не будет хорошо прилегать к межпредсердной перегородке на стороне левого предсердия. Следует поддерживать небольшое натяжение, чтобы вызвать натяжение межпредсердной перегородки. Чрезмерное натяжение интродьюсера или кабеля доставки на этом этапе может привести к выпадению диска левого предсердия в правое предсердие, и в этом случае диск левого предсердия следует убрать в интродьюсер. Устройство должно быть удалено, и все шаги от пересечения перегородки до продвижения интродьюсера должны быть повторены.
На этом этапе следует позаботиться о перемещении катетера ICE, чтобы оптимизировать визуализацию ДМПП, поскольку иногда катетер ICE перемещается во время выполнения вышеуказанных шагов. Как только устройство достигает кончика интродьюсера, интродьюсер вытягивается по кабелю доставки, чтобы обнажить диск левого предсердия. Это можно визуализировать как на ICE, так и на рентгеноскопии. Как только диск левого предсердия полностью сформирован, и интродьюсер доставки, и кабель доставки извлекаются до тех пор, пока диск левого предсердия не будет хорошо прилегать к межпредсердной перегородке на стороне левого предсердия. Следует поддерживать небольшое натяжение, чтобы вызвать натяжение межпредсердной перегородки. Чрезмерное натяжение интродьюсера или кабеля доставки на этом этапе может привести к выпадению диска левого предсердия в правое предсердие, и в этом случае диск левого предсердия следует убрать в интродьюсер. Устройство должно быть удалено, и все шаги от пересечения перегородки до продвижения интродьюсера должны быть повторены.
После того, как диск левого предсердия надежно закрепится на левой стороне перегородки и будет достигнуто достаточное натяжение межпредсердной перегородки диском левого предсердия, следующим шагом будет осторожное обнажение диска правого предсердия. После этого интродьюсер немного отводят от диска правого предсердия, чтобы уменьшить натяжение устройства. После этого ICE используется для проверки стабильности устройства и выполняется цветная допплеровская визуализация, чтобы убедиться, что ДМПП хорошо герметизирован. Цветовой поток может быть отмечен на талии и в центре устройства, но цветовой поток на краях дисков или вдали от диска предполагает, что устройство может быть меньше по размеру или могут быть дополнительные ASD вдали от текущего ASD. расположение. В любом случае устройство следует поместить обратно в оболочку, а перегородку снова осмотреть на наличие поблизости других ДМПП. В этой ситуации устройство может быть модернизировано до устройства ASD большего размера или крибриформного окклюдера, если другие ASD находятся рядом с основным ASD. Если другие ДМПП > 7 мм от основного ДМПП, то другие дефекты необходимо закрыть с помощью дополнительных окклюдеров ДМПП. Если через устройство не проходит цветовой поток, то кабель доставки раскачивается с сильным толчком и натяжением (Minnesota Wiggle) для проверки стабильности устройства как с помощью рентгеноскопии, так и с помощью ICE. Если устройство выглядит стабильно и поток через устройство отсутствует, устройство освобождается. После освобождения устройства снова проверяют стабильность и цветовой поток, и, если они удовлетворительные, интродьюсер вводят в нижнюю полую вену. После этого выполняется визуализация ICE для визуализации устройства и поиска перикардиального выпота. Если все выглядит удовлетворительно, катетер ICE извлекают из тела. Затем и бедренный венозный интродьюсер, и родильный интродьюсер извлекаются из тела и либо накладывается шов в виде восьмерки, либо удерживается ручное давление для достижения гемостаза. В это время может быть введен протамин для отмены антикоагуляции, в зависимости от предпочтений врача.
Если другие ДМПП > 7 мм от основного ДМПП, то другие дефекты необходимо закрыть с помощью дополнительных окклюдеров ДМПП. Если через устройство не проходит цветовой поток, то кабель доставки раскачивается с сильным толчком и натяжением (Minnesota Wiggle) для проверки стабильности устройства как с помощью рентгеноскопии, так и с помощью ICE. Если устройство выглядит стабильно и поток через устройство отсутствует, устройство освобождается. После освобождения устройства снова проверяют стабильность и цветовой поток, и, если они удовлетворительные, интродьюсер вводят в нижнюю полую вену. После этого выполняется визуализация ICE для визуализации устройства и поиска перикардиального выпота. Если все выглядит удовлетворительно, катетер ICE извлекают из тела. Затем и бедренный венозный интродьюсер, и родильный интродьюсер извлекаются из тела и либо накладывается шов в виде восьмерки, либо удерживается ручное давление для достижения гемостаза. В это время может быть введен протамин для отмены антикоагуляции, в зависимости от предпочтений врача.
Пациенту назначают клопидогрел 300-600 мг перорально в дополнение к аспирину и продолжают двойную антитромбоцитарную терапию в течение 6 месяцев после процедуры. После процедуры пациент находится под наблюдением в течение ночи. Последующая эхокардиограмма выполняется на следующий день, чтобы проверить стабильность устройства и исключить любую эрозию устройства и исключить перикардиальный выпот. Если все удовлетворительно, то больного выписывают, а через 6 месяцев проводят повторную эхокардиографию. Рекомендуется профилактика инфекционного эндокардита в течение 6 месяцев при стоматологических процедурах [9].][10]
Осложнения
Основные осложнения, связанные с транскатетерным закрытием ДМПП, включают:
Эмболизация устройством
Эрозия сердечных структур от устройства
Предсердные аритмии
Атриовентрикулярная блокада ( АВ блокада)
Персистирующая аневризма предсердий
Тромбоэмболия
Перикардиальный выпот и тампонада [11][12][13]
Клиническое значение
Текущие руководства рекомендуют хирургическое или транскатетерное закрытие вторичного ДМПП. Тем не менее, транскатетерное закрытие ДМПП является относительно безопасной и эффективной процедурой закрытия ДМПП у правильно отобранных пациентов и связано с низкой заболеваемостью. Таким образом, транскатетерное закрытие стало методом выбора для закрытия вторичных дефектов ДМПП.
Тем не менее, транскатетерное закрытие ДМПП является относительно безопасной и эффективной процедурой закрытия ДМПП у правильно отобранных пациентов и связано с низкой заболеваемостью. Таким образом, транскатетерное закрытие стало методом выбора для закрытия вторичных дефектов ДМПП.
Улучшение результатов работы команды здравоохранения
Транскатетерное закрытие ДМПП является относительно безопасной процедурой с низким уровнем осложнений и более быстрым восстановлением. Для тщательной оценки пациента кардиологом и интервенционным кардиологом, имеющим опыт лечения структурных заболеваний сердца, рекомендуется подход межпрофессиональной кардиологической бригады для оценки подходящей стратегии лечения для каждого пациента. Как правило, эти процедуры должны выполняться в центрах с большим объемом операций для получения оптимальных результатов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Рисунок
Крышка ASD. Изображение предоставлено S Bhimji MD
Ссылки
- 1.
Hoffman JI, Kaplan S. Заболеваемость врожденными пороками сердца. J Am Coll Кардиол. 2002 19 июня; 39 (12): 1890-900. [PubMed: 12084585]
- 2.
Накви Н., Маккарти К.П., Хо С.И. Анатомия межпредсердной перегородки и межпредсердных сообщений. Дж. Торак Дис. 2018 сен; 10 (приложение 24): S2837-S2847. [Бесплатная статья PMC: PMC6174145] [PubMed: 30305943]
- 3.
Уэбб Г., Гатзулис М.А. Дефекты межпредсердной перегородки у взрослых: недавний прогресс и обзор. Тираж. 2006 10 октября; 114 (15): 1645-53. [PubMed: 17030704]
- 4.
Yang MC, Wu JR. Недавний обзор транскатетерного закрытия дефекта межпредсердной перегородки. Гаосюн J Med Sci. 2018 июль; 34 (7): 363-369. [PubMed: 30063008]
- 5.
Fraisse A, Latchman M, Sharma SR, Bayburt S, Amedro P, di Salvo G, Baruteau AE.
 Закрытие дефекта межпредсердной перегородки: показания и противопоказания. Дж. Торак Дис. 10 сентября 2018 г. (приложение 24): S2874-S2881. [Бесплатная статья PMC: PMC6174144] [PubMed: 30305947]
Закрытие дефекта межпредсердной перегородки: показания и противопоказания. Дж. Торак Дис. 10 сентября 2018 г. (приложение 24): S2874-S2881. [Бесплатная статья PMC: PMC6174144] [PubMed: 30305947]- 6.
Васкес А.Ф., Ласала Дж.М. Закрытие дефекта межпредсердной перегородки. Кардиол клин. 2013 г., 31 августа (3): 385–400. [PubMed: 23931101]
- 7.
Стаут К.К., Дэниелс С.Дж., Абулхосн Дж.А., Бозкурт Б., Броберг С.С., Колман Дж.М., Крамб С.Р., Деарани Дж.А., Фуллер С., Гурвиц М., Хайри П., Ландзберг М.Дж., Са иди А., Валенте А.М., Ван Харе Г.Ф. Руководство AHA/ACC 2018 г. по ведению взрослых с врожденными пороками сердца: Краткое резюме: отчет Целевой группы Американского колледжа кардиологов/Американской кардиологической ассоциации по рекомендациям по клинической практике. J Am Coll Кардиол. 201902 апреля; 73(12):1494-1563. [PubMed: 30121240]
- 8.
Xu WZ, Shou XY, Li JH, Yu JG, Zhang ZW, Yu J, Ye JJ. Нерентгеноскопическое чрескожное чрескатетерное закрытие дефектов межпредсердной перегородки у детей под чреспищеводным эхокардиографическим контролем.
 Мир J Педиатр. 2018 авг; 14 (4): 378-382. [Бесплатная статья PMC: PMC6154211] [PubMed: 30141110]
Мир J Педиатр. 2018 авг; 14 (4): 378-382. [Бесплатная статья PMC: PMC6154211] [PubMed: 30141110]- 9.
Сарик М., Перк Г., Пурджесс Дж. Р., Кронзон И. Визуализация дефектов межпредсердной перегородки с помощью трехмерной чреспищеводной эхокардиографии в реальном времени: шаг за шагом ступенчатый подход. J Am Soc Эхокардиогр. 2010 ноябрь;23(11):1128-35. [В паблике: 20833505]
- 10.
Юнг С.Ю., Чой Д.Ю. Транскатетерное закрытие дефекта межпредсердной перегородки: принципы и доступные устройства. Дж. Торак Дис. 10 сентября 2018 г. (приложение 24): S2909-S2922. [Бесплатная статья PMC: PMC6174149] [PubMed: 30305951]
- 11.
Werner RS, Prêtre R, Maisano F, Wilhelm MJ. Перелом транскатетерного окклюдера дефекта межпредсердной перегородки, вызывающий перфорацию митрального клапана. Энн Торак Серг. 2019 июль;108(1):e29-e30. [PubMed: 30550803]
- 12.
О’Бирн М.Л., Леви Д.С. Современные устройства для закрытия дефекта межпредсердной перегородки при врожденном сердце.
 Интерв Кардиол Клин. 2019 янв;8(1):11-21. [Бесплатная статья PMC: PMC6298220] [PubMed: 30449418]
Интерв Кардиол Клин. 2019 янв;8(1):11-21. [Бесплатная статья PMC: PMC6298220] [PubMed: 30449418]- 13.
Faccini A, Butera G. Дефект межпредсердной перегородки (ДМПП) транскатетерное закрытие устройства: ограничения. Дж. Торак Дис. 2018 сен; 10 (прил. 24): S2923-S2930. [Бесплатная статья PMC: PMC6174146] [PubMed: 30305952]
Антитромботическая/антитромбоцитарная терапия при чрескатетерных структурных вмешательствах на сердце — Окклюдер PFO/ASD/LAA и межпредсердные шунтирующие устройства
1. Baumgartner H, Bonhoeffer P, De Groot NM, de Haan F, Deanfield JE, Galie N и др.. Руководство ESC по лечению врожденных пороков сердца у взрослых (новая версия 2010 г.). Европейское сердце Дж. (2010) 31: 2915–57. 10.1093/eurheartj/ehq249 [PubMed] [CrossRef] [Google Scholar]
2. Pristipino C, Sievert H, D’Ascenzo F, Mas JL, Meier B, Scacciatella P, et al.
Европейская позиция по ведению пациентов с открытым овальным окном. Общий подход и тромбоэмболия левого кровотока. Евроинтервенция. (2018) 25:EIJ-D-18-00622. [PubMed] [Академия Google]
Евроинтервенция. (2018) 25:EIJ-D-18-00622. [PubMed] [Академия Google]
3. Sherman JM, Hagler DJ, Cetta F. Тромбоз после установки устройства для закрытия перегородки: обзор современной литературы. Катетер Cardiovasc Interv. (2004) 63:486–9. 10.1002/ccd.20220 [PubMed] [CrossRef] [Google Scholar]
4. Yorgun H, Canpolat U, Kaya EB, Aytemir K, Oto A. Образование тромба во время чрескожного закрытия дефекта межпредсердной перегородки окклюдером Amplatzer. Tex Heart Inst J. (2011) 38: 427–30. [PMC free article] [PubMed] [Google Scholar]
5. Рагху А., Кавальски Д., Фельдман М. Эмболический инсульт из-за тромба левого предсердия через два года после установки устройства для закрытия дефекта межпредсердной перегородки. Ам Джей Кардиол. (2017) 98:1294–6. 10.1016/j.amjcard.2006.05.067 [PubMed] [CrossRef] [Google Scholar]
6. Ковачевич П., Срданович И., Иванович В., Раич Дж., Петрович Н., Велицкий Л. Поздние осложнения транскатетерного закрытия дефекта межпредсердной перегородки, требующие закрытия срочная операция. Постеpы Кардиол Interwencyjnej. (2017) 13:335–8. 10.5114/aic.2017.71617 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Постеpы Кардиол Interwencyjnej. (2017) 13:335–8. 10.5114/aic.2017.71617 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Brandt RR, Neumann T, Neuzner J, Rau M, Faude I, Hamm CW. Транскатетерное закрытие дефекта межпредсердной перегородки и открытого овального окна у взрослых пациентов с помощью окклюзионного устройства Amplatzer: нет доказательств отложения тромба антиагрегантами. J Am Soc Эхокардиогр. (2002) 15 (10, часть 1): 1094–8. 10.1067/mje.2002.121666 [PubMed] [CrossRef] [Google Scholar]
8. Anzai H, Child J, Natterson B, Krivokapich J, Fishbein MC, Chan VK, et al. Частота образования тромбов на CardioSEAL и Межпредсердные окклюдеры Amplatzer. Ам Джей Кардиол. (2004) 93:426–31. 10.1016/j.amjcard.2003.10.036 [PubMed] [CrossRef] [Google Scholar]
9. Rodes-Cabau J, Palacios A, Palacio C, Girona J, Galve E, Evangelista A, et al.. Оценка маркеры активации тромбоцитов и коагуляции после транскатетерного закрытия дефектов межпредсердной перегородки. Int J Кардиол. (2005) 98:107–12. 10.1016/j.ijcard.2004.03.022 [PubMed] [CrossRef] [Google Scholar]
Int J Кардиол. (2005) 98:107–12. 10.1016/j.ijcard.2004.03.022 [PubMed] [CrossRef] [Google Scholar]
10. Bedard E, Rodes-Cabau J, Houde C, Mackey A, Rivest D, Cloutier S, et al. Усиленный тромбогенез, но не активация тромбоцитов, связан с транскатетерным закрытием открытого овального окна у пациентов с криптогенным инсультом. Гладить. (2007) 38:100–4. 10.1161/01.STR.0000251712.55322.69 [PubMed] [CrossRef] [Google Scholar]
11. Mas JL, Derumeaux G, Guillon B, Massardier E, Hosseini H, Mechtouff L, et al. Закрытие открытого овального окна или антикоагулянтная терапия по сравнению с антитромбоцитарной терапией после инсульта. N Engl J Med. (2017) 377:1011–21. 10.1056/NEJMoa1705915 [PubMed] [CrossRef] [Google Scholar]
12. Furlan AJ, Reisman M, Massaro J, Mauri L, Adams H, Albers GW, et al. ЗАВЕРШЕНИЕ I Следователи. Закрытие или медикаментозная терапия криптогенного инсульта с открытым овальным окном. N Engl J Med. (2012) 366:991–9. 10.1056/NEJMoa1009639 [PubMed] [CrossRef] [Google Scholar]
13. Lee PH, Song JK, Kim JS, Heo R, Lee S, Kim DH и др. Криптогенный инсульт и открытое овальное окно высокого риска: ЗАЩИТА-ПФО. Пробный. J Am Coll Кардиол. (2018) 71:2335–42. 10.1016/j.jacc.2018.02.046 [PubMed] [CrossRef] [Google Scholar]
Lee PH, Song JK, Kim JS, Heo R, Lee S, Kim DH и др. Криптогенный инсульт и открытое овальное окно высокого риска: ЗАЩИТА-ПФО. Пробный. J Am Coll Кардиол. (2018) 71:2335–42. 10.1016/j.jacc.2018.02.046 [PubMed] [CrossRef] [Google Scholar]
14. Saver JL, Carroll JD, Thaler DE, Smalling RW, MacDonald LA, Marks DS, et al. УВАЖАЙТЕ следователей. отдаленные результаты закрытия открытого овального окна или медикаментозной терапии после инсульта. N Engl J Med. (2017) 377:1022–32. 10.1056/NEJMoa1610057 [PubMed] [CrossRef] [Google Scholar]
15. Нкомо В.Т., Теума П., Маниу К.В., Чандрасекаран К., Миллер Ф.А., Шафф Х.В. и др. Патентный тромбоз устройства для закрытия овального окна. Мэйо Клин Proc. (2001) 76:1057–61. 10.4065/76.10.1057 [PubMed] [CrossRef] [Google Scholar]
16. Krumsdorf U, Ostermayer S, Billinger K, Trepels T, Zadan E, Horvath K, et al. Частота и клиническое течение тромбообразования на дефекте межпредсердной перегородки и устройствах для закрытия овального окна у 1000 последовательных пациентов. J Am Coll Кардиол. (2004) 43:302–9. 10.1016/j.jacc.2003.10.030 [PubMed] [CrossRef] [Google Scholar]
J Am Coll Кардиол. (2004) 43:302–9. 10.1016/j.jacc.2003.10.030 [PubMed] [CrossRef] [Google Scholar]
17. Willcoxson FE, Thomson JD, Gibbs JL. Успешное лечение тромба диска левого предсердия на окклюдере дефекта межпредсердной перегородки Amplatzer с помощью абциксимаба и гепарина. Сердце. (2004) 90:e30. 10.1136/hrt.2003.027946 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Acar P, Aggoun Y, Abdel-Massih T. Изображения в кардиологии: тромб после транскатетерного закрытия ДМПП септальным окклюдером Amplatzer оценивается с помощью трехмерной эхокардиографической реконструкции. Сердце. (2002) 88:52. 10.1136/heart.88.1.52-a [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Чесса М., Карминати М., Бутера Г., Бини Р.М., Драго М., Рости Л. и др.. Ранние и поздние осложнения, связанные с транскатетерной окклюзией вторичного дефекта межпредсердной перегородки. J Am Coll Кардиол. (2002) 39: 1061–5. 10.1016/S0735-1097(02)01711-4 [PubMed] [CrossRef] [Google Scholar]
20. Vanderheyden M, Willaert W, Claessens P, Branders I, Ex P, Vermeersch P. Тромбоз закрытия открытого овального окна устройство: тромболитическая терапия. Катетер Cardiovasc Interv. (2002) 56:522–6. 10.1002/ccd.10253 [PubMed] [CrossRef] [Google Scholar]
Vanderheyden M, Willaert W, Claessens P, Branders I, Ex P, Vermeersch P. Тромбоз закрытия открытого овального окна устройство: тромболитическая терапия. Катетер Cardiovasc Interv. (2002) 56:522–6. 10.1002/ccd.10253 [PubMed] [CrossRef] [Google Scholar]
21. Uysal F, Bostan ÖM, Senkaya Signak I, Güneş M, Çil E. Образование огромного тромба через 1 год после чрескожного закрытия дефекта межпредсердной перегородки с помощью Амплацер септальный окклюдер. Анатолий Дж. Кардиол. (2016) 16:63–4. 10.14744/AnatolJCardiol.2015.6538 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Дивчев Д., Шефер А., Фукс М., Брейманн Т., Дрекслер Х., Мейер Г.П. Образование тромба на устройстве для закрытия дефекта межпредсердной перегородки: отчет о клиническом случае и обзор литературы. Eur J Эхокардиогр. (2007) 8:53–6. 10.1016/j.euje.2005.10.011 [PubMed] [CrossRef] [Google Scholar]
23. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, et al.
Группа научных документов ESC. Руководство ESC 2016 г. по лечению мерцательной аритмии, разработанное в сотрудничестве с EACTS. Европейское сердце Дж. (2016) 37:2893–962. 10.15829/1560-4071-2017-7-7-86 [PubMed] [CrossRef] [Google Scholar]
Руководство ESC 2016 г. по лечению мерцательной аритмии, разработанное в сотрудничестве с EACTS. Европейское сердце Дж. (2016) 37:2893–962. 10.15829/1560-4071-2017-7-7-86 [PubMed] [CrossRef] [Google Scholar]
24. Main ML, Fan D, Reddy VY, Holmes DR, Gordon NT, Coggins TR, et al.. Оценка тромбоза, связанного с устройством, и связанных с ним клинических исходов с помощью устройства для закрытия ушка левого предсердия WATCHMAN для защиты от эмболии у пациентов с мерцательной аритмией (из исследования PROTECT-AF). Ам Джей Кардиол. (2016) 117:1127–34. 10.1016/j.amjcard.2016.01.039 [PubMed] [CrossRef] [Google Scholar]
25. Reddy VY, Doshi SK, Sievert H, Buchbinder M, Neuzil P, Huber K, et al. Чрескожное закрытие ушка левого предсердия для профилактики инсульта у пациентов с фибрилляцией предсердий: 2,3-летнее наблюдение за исследованием PROTECT AF. Тираж. (2013) 127: 720–9. 10.1161/CIRCULATIONAHA.112.114389 [PubMed] [CrossRef] [Google Scholar]
26. Holmes DR, Jr, Kar S, Price MJ, Whisenant B, Sievert H, Doshi SK, et al. . Проспективная рандомизированная оценка Устройство Watchman для закрытия ушка левого предсердия у пациентов с фибрилляцией предсердий по сравнению с длительной терапией варфарином: исследование PREVAIL. J Am Coll Кардиол. (2014) 64:1–12. 10.1016/j.jacc.2014.04.029 [PubMed] [CrossRef] [Google Scholar]
. Проспективная рандомизированная оценка Устройство Watchman для закрытия ушка левого предсердия у пациентов с фибрилляцией предсердий по сравнению с длительной терапией варфарином: исследование PREVAIL. J Am Coll Кардиол. (2014) 64:1–12. 10.1016/j.jacc.2014.04.029 [PubMed] [CrossRef] [Google Scholar]
27. Reddy VY, Holmes D, Doshi SK, Neuzil P, Kar S. Безопасность чрескожного закрытия ушка левого предсердия: результаты Watchman Клинические испытания системы ушка левого предсердия для защиты от эмболии у пациентов с ФП (PROTECT AF) и Реестр постоянного доступа. Тираж. (2011) 123:417–24. 10.1161/ЦИРКУЛЯЦИЯHA.110.976449 [PubMed] [CrossRef] [Google Scholar]
28. Reddy VY, Möbius-Winkler S, Miller MA, Neuzil P, Schuler G, Wiebe J, et al.. Закрытие ушка левого предсердия с помощью устройства Watchman у пациентов с противопоказанием к приему пероральных антикоагулянтов: исследование ASAP. J Am Coll Кардиол. (2013) 61:2551–6. 10.1016/j.jacc.2013.03.035 [PubMed] [CrossRef] [Google Scholar]
29. Boersma LVA, Schmidt B, Betts T, Sievert H, Tamburino C, Teiger E, et al. Успех имплантации и безопасность закрытие ушка левого предсердия с помощью устройства WATCHMAN: перипроцедурные результаты из регистра EWOLUTION. Европейское сердце Дж. (2016) 37: 2465–74. 10.1093/eurheartj/ehv730 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Boersma LVA, Schmidt B, Betts T, Sievert H, Tamburino C, Teiger E, et al. Успех имплантации и безопасность закрытие ушка левого предсердия с помощью устройства WATCHMAN: перипроцедурные результаты из регистра EWOLUTION. Европейское сердце Дж. (2016) 37: 2465–74. 10.1093/eurheartj/ehv730 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Цикас А. Окклюзия ушка левого предсердия сердечной пробкой и амулетом Amplatzer: обновление клинических испытаний. J Atr Фибрилляция. (2017) 10:1651. 10.4022/jafib.1651 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Tarantini G, D’Amico G, Latib A, Montorfano M, Mazzone P, Fassini G, et al.. Чрескожная левая Окклюзия ушка предсердия у пациентов с мерцательной аритмией и тромбом левого ушка: осуществимость, безопасность и клиническая эффективность. Евроинтервенция. (2018) 13:1595–602. 10.4244/EIJ-D-17-00777 [PubMed] [CrossRef] [Google Scholar]
32. Meincke F, Spangenberg T, Kreidel F, Frerker C, Virmani R, Ladich E, et al. . Обоснование устройств защиты головного мозга при окклюзии ушка левого предсердия. Катетер Cardiovasc Interv. (2017) 89: 154–8. 10.1002/ccd.26677 [PubMed] [CrossRef] [Google Scholar]
. Обоснование устройств защиты головного мозга при окклюзии ушка левого предсердия. Катетер Cardiovasc Interv. (2017) 89: 154–8. 10.1002/ccd.26677 [PubMed] [CrossRef] [Google Scholar]
33. Pracon R, Bangalore S, Dzielinska Z, Konka M, Kepka C, Kruk M, et al. Тромбоз устройства после чрескожной окклюзии ушка левого предсердия связан с характеристиками пациента и процедуры, но не с продолжительностью постимплантационной двойной антитромбоцитарной терапии. Circ Cardiovasc Interv. (2018) 11:e005997 10.1161/CIRCINTERVENTIONS.117.005997 [PubMed] [CrossRef] [Google Scholar]
34. Chun KRJ, Bordignon S, Urban V, Perrotta L, Dugo D, Fürnkranz A и др.. Закрытие ушка левого предсердия с последующим 6-недельным лечением. антитромботическая терапия: проспективный одноцентровый опыт. Ритм сердца. (2013) 10:1792–9. 10.1016/j.hrthm.2013.08.025 [PubMed] [CrossRef] [Google Scholar]
35. Plicht B, Konorza TF, Kahlert P, Al-Rashid F, Kaelsch H, Jánosi RA, et al.. Факторы риска для образование тромба на сердечной пробке Amplatzer после окклюзии ушка левого предсердия. JACC Cardiovasc Interv. (2013) 6:606–13. 10.1016/j.jcin.2013.02.014 [PubMed] [CrossRef] [Google Scholar]
JACC Cardiovasc Interv. (2013) 6:606–13. 10.1016/j.jcin.2013.02.014 [PubMed] [CrossRef] [Google Scholar]
36. Бёше Л.И., Афшари Ф., Шёне Д., Эверс А., Мюгге А., Гоцманн М. Начальный опыт применения новых пероральных антикоагулянтов в течение первых 45 дней после закрытия ушка левого предсердия с помощью сторожевого устройства. Клин Кардиол. (2015) 38:720–4. 10.1002/clc.22478 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Enomoto Y, Gadiyaram VK, Gianni C, Horton RP, Trivedi C, Mohanty S. Использование вместо варфариновых пероральных антикоагулянтов варфарина во время закрытия ушка левого предсердия с помощью устройства Watchman. Ритм сердца. (2017) 14:19–24. 10.1016/j.hrthm.2016.10.020 [PubMed] [CrossRef] [Google Scholar]
38. Grygier M, Wojakowski W, Smolka G, Demkow M, Wasek W, Sorysz D и др. Окклюзия ушка левого предсердия: консенсусный документ Ассоциации сердечно-сосудистых вмешательств и секции сердечного ритма Польского кардиологического общества. Кардиол Пол. (2018) 76: 677–97. 10.5603/KP.a2018.0057 [PubMed] [CrossRef] [Google Scholar]
Кардиол Пол. (2018) 76: 677–97. 10.5603/KP.a2018.0057 [PubMed] [CrossRef] [Google Scholar]
39. Urena M, Rodés-Cabau J, Freixa X, Saw J, Webb JG, Freeman M, et al. Чрескожное закрытие ушка левого предсердия с кардиостимулятором AMPLATZER у пациентов с неклапанной фибрилляцией предсердий и противопоказаниями к антикоагулянтной терапии. J Am Coll Кардиол. (2013) 62:96–102. 10.1016/j.jacc.2013.02.089 [PubMed] [CrossRef] [Google Scholar]
40. Bergmann MW, Betts TR, Sievert H, Schmidt B, Pokushalov E, Kische S, et al. Безопасность и эффективность раннего схемы антикоагулянтной терапии после закрытия ушка левого предсердия WATCHMAN: трехмесячные данные из проспективного, многоцентрового, контролируемого международного регистра EWOLUTION закрытия ушка левого предсердия EWOLUTION. Евроинтервенция. (2017) 13:877–84. 10.4244/EIJ-D-17-00042 [PubMed] [CrossRef] [Google Scholar]
41. Fauchier L, Cinaud A, Brigadeau F, Lepillier A, Pierre B, Abbey S, et al. Тромбоз, связанный с устройством после чрескожная окклюзия ушка левого предсердия при мерцательной аритмии. J Am Coll Кардиол. (2018) 71:1528–36. 10.1016/j.jacc.2018.01.076 [PubMed] [CrossRef] [Google Scholar]
J Am Coll Кардиол. (2018) 71:1528–36. 10.1016/j.jacc.2018.01.076 [PubMed] [CrossRef] [Google Scholar]
42. Lempereur M, Aminian A, Freixa X, Gafoor S, Kefer J, Tzikas A, et al.. Тромбообразование, связанное с устройством, после окклюзии ушка левого предсердия: систематический обзор событий, зарегистрированных Watchman, Amplatzer Cardiac Вилка и Амулет. Катетер Cardiovasc Interv. (2017) 90:E111–21. 10.1002/ccd.26903 [PubMed] [CrossRef] [Google Scholar]
43. Maksym J, Mazurek T, Kochman J, Grygier M, Kaplon-Cieślicka A, Marchel M, et al. Двойная антитромбоцитарная терапия безопасна и эффективна после закрытия ушка левого предсердия. Кардиол Пол. (2018)76:459–63. 10.5603/KP.a2017.0245 [PubMed] [CrossRef] [Google Scholar]
44. Dukkipati SR, Kar S, Holmes DR, Doshi SK, Swarup V, Gibson DN, et al. Тромб, связанный с устройством, после левого предсердия закрытие придатка. Тираж. (2018) 138:874–85. 10.1161/CIRCULATIONAHA.118.035090 [PubMed] [CrossRef] [Google Scholar]
45. Ketterer U, D’Ancona G, Siegel I, Ortak J, Ince H, Kische S. Чрескожная окклюзия ушка левого предсердия: тромбоз устройства в клопидогреле не — ответчики. Int J Кардиол. (2016) 204:196–7. 10.1016/j.ijcard.2015.11.160 [PubMed] [CrossRef] [Google Scholar]
Ketterer U, D’Ancona G, Siegel I, Ortak J, Ince H, Kische S. Чрескожная окклюзия ушка левого предсердия: тромбоз устройства в клопидогреле не — ответчики. Int J Кардиол. (2016) 204:196–7. 10.1016/j.ijcard.2015.11.160 [PubMed] [CrossRef] [Google Scholar]
46. Sedaghat A, Schrickel JW, Andrié R, Schueler R, Nickenig G, Hammerstingl C. Образование тромба после окклюзии ушка левого предсердия с помощью Амплатцер амулет устройство. JACC Clin Электрофизиол. (2017) 3:71–5. 10.1016/j.jacep.2016.05.006 [PubMed] [CrossRef] [Google Scholar]
47. Kaneko H, Neuss M, Weissenborn J, Butter C. Предикторы образования тромбов после чрескожного закрытия ушка левого предсердия с использованием WATCHMAN устройство. Сердечные сосуды. (2017) 32:1137–43. 10.1007/с00380-017-0971-x [PubMed] [CrossRef] [Google Scholar]
48. Grygier M, Olasinska-Wiśniewska A, Araszkiewicz A, Trojnarska O, Babicz-Sadowska A и др.. Watchman FLX — новое устройство для левого предсердия Окклюзия придатка — дизайн, потенциальные преимущества и первый клинический опыт. Постеpы Кардиол Interwencyjnej. (2017) 13:62–66. 10.5114/aic.2017.66188 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Постеpы Кардиол Interwencyjnej. (2017) 13:62–66. 10.5114/aic.2017.66188 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Bartuś K, Myć J, Bartuś M, Lee RJ, Litwinowicz R, Dziewierz A, et al.. Быстрое левое предсердие образование тромба перед перевязкой швов с помощью LARIAT. Постеpы Кардиол Interwencyjnej. (2018) 14:435–7. 10.5114/aic.2018.79876 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
50. Lam SC, Bertog S, Sievert H. Неполная окклюзия ушка левого предсердия и образование тромба после имплантации Watchman, леченной антикоагулянтами, с последующим транскатетерным закрытием с помощью Amplatzer Cardiac Plug второго поколения (устройство Amulet). Катетер Cardiovasc Interv. (2015) 85:321–7. 10.1002/ccd.25456 [PubMed] [CrossRef] [Google Scholar]
51. Viles-Gonzalez JF, Kar S, Douglas P, Dukkipati S, Feldman T, Horton R, et al. Клинические последствия неполного левого предсердия закрытие придатка с помощью устройства Watchman у пациентов с фибрилляцией предсердий: подисследование PROTECT AF (Чрескожное закрытие ушка левого предсердия по сравнению с терапией варфарином для предотвращения инсульта у пациентов с фибрилляцией предсердий). J Am Coll Кардиол. (2012) 59: 923–9. 10.1016/j.jacc.2011.11.028 [PubMed] [CrossRef] [Google Scholar]
J Am Coll Кардиол. (2012) 59: 923–9. 10.1016/j.jacc.2011.11.028 [PubMed] [CrossRef] [Google Scholar]
52. Qazi AH, Wimmer AP, Huber KC, Latus GG, Main ML. Разрешение (и поздний рецидив) тромба, связанного с устройством WATCHMAN, после лечения дабигатраном. Эхокардиография. (2016) 33:792–5. 10.1111/echo.13174 [PubMed] [CrossRef] [Google Scholar]
53. Rodés-Cabau J, Bernier M, Amat-Santos IJ, Ben Gal T, Nombela-Franco L, García Del Blanco B, et al.. Межпредсердное шунтирование при сердечной недостаточности: ранние и поздние результаты первого человеческого опыта с системой V-волны. JACC Cardiovasc Interv. (2018) 11:2300–10. 10.1016/j.jcin.2018.07.001 [PubMed] [CrossRef] [Google Scholar]
54. Søndergaard L, Reddy V, Kaye D, Malek F, Walton A, Mates M, Franzen O, et al. Транскатетерное лечение сердечной недостаточности с сохраненной или слегка сниженной фракцией выброса с использованием нового межпредсердного имплантата для нижней части левого предсердия. давление. Сердечная недостаточность Eur J. (2014) 16:796–801. 10.1002/ejhf.111 [PubMed] [CrossRef] [Google Scholar]
(2014) 16:796–801. 10.1002/ejhf.111 [PubMed] [CrossRef] [Google Scholar]
55. Feldman T, Mauri L, Kahwash R, Litwin S, Ricciardi MJ, van der Harst P, REDUCE LAP-HF I Исследователи и координаторы исследования. транскатетерное межпредсердное шунтирующее устройство для лечения сердечной недостаточности с сохраненной фракцией выброса (REDUCE LAP-HF I [снижение повышенного давления в левом предсердии у пациентов с сердечной недостаточностью]): рандомизированное плацебо-контролируемое исследование фазы 2. Тираж. (2018) 137:364–75. 10.1161/ТИРАЖАГА.117.032094 [PubMed] [CrossRef] [Google Scholar]
56. Амат-Сантос И.Дж., Бержерон С., Бернье М., Альенде Р., Барбоза Рибейро Х., Урена М. и др.. Декомпрессия левого предсердия посредством однонаправленной слева направо межпредсердный шунт для лечения левожелудочковой сердечной недостаточности: первый опыт использования устройства V-Wave у человека. Евроинтервенция. (2015) 10:1127–31. 10.4244/EIJY14M05_07 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57.


 Закрытие дефекта межпредсердной перегородки: показания и противопоказания. Дж. Торак Дис. 10 сентября 2018 г. (приложение 24): S2874-S2881. [Бесплатная статья PMC: PMC6174144] [PubMed: 30305947]
Закрытие дефекта межпредсердной перегородки: показания и противопоказания. Дж. Торак Дис. 10 сентября 2018 г. (приложение 24): S2874-S2881. [Бесплатная статья PMC: PMC6174144] [PubMed: 30305947] Мир J Педиатр. 2018 авг; 14 (4): 378-382. [Бесплатная статья PMC: PMC6154211] [PubMed: 30141110]
Мир J Педиатр. 2018 авг; 14 (4): 378-382. [Бесплатная статья PMC: PMC6154211] [PubMed: 30141110] Интерв Кардиол Клин. 2019 янв;8(1):11-21. [Бесплатная статья PMC: PMC6298220] [PubMed: 30449418]
Интерв Кардиол Клин. 2019 янв;8(1):11-21. [Бесплатная статья PMC: PMC6298220] [PubMed: 30449418]