Как пить АСД фракция 2 при онкологии с метастазами
Доброе время суток! Меня зовут Халисат Сулейманова — я фитотерапевт. В 28 лет себя вылечила от рака матки травами (больше про мой опыт выздоровления и почему я стала фитотерапевтом читайте здесь: Моя история). Перед тем как лечиться по народным методам описанным в интернете, просьба, консультируйтесь со специалистом и лечащим врачом! Это сэкономит ваше время и деньги, поскольку заболевания разные, травы и методы лечения разные, а есть еще сопутствующие заболевания, противопоказания, осложнения и так далее. Пока добавить нечего, но если Вам нужна помощь в подборе трав и методик лечения, можете меня найти вот по контактам:
Халисат Сулейманова
Страничка Instagram: instagram.com/fitoterapevt1
Телефон: 8 918 843 47 72
Почта: [email protected]
Консультирую бесплатно.
В последнее десятилетие все чаще люди сталкиваются с таким диагнозом как онкология. Медицина не стоит на месте и уже найдены различные методы борьбы с этим недугом, но успех зависит и от того, на какой стадии его определили, возраст пациента, сопутствующие заболевания и прочие факторы. Но наиболее страшное в этой болезни – это образование метастаз. Отмечают эффективность применения при метастазах АСД фракции 2. Это вещество кроме своих лекарственных способностей, активизирует и защитные функции всего организма, что придает ему сил противостоять страшному недугу.
Медицина не стоит на месте и уже найдены различные методы борьбы с этим недугом, но успех зависит и от того, на какой стадии его определили, возраст пациента, сопутствующие заболевания и прочие факторы. Но наиболее страшное в этой болезни – это образование метастаз. Отмечают эффективность применения при метастазах АСД фракции 2. Это вещество кроме своих лекарственных способностей, активизирует и защитные функции всего организма, что придает ему сил противостоять страшному недугу.
Причины появления
Метастазами называют вторичные опухолевые узлы, которые могут поражать как ближние, так и дальние органы. Они более опасны, чем сама опухоль. Необходимо помнить, что лечение этого заболевания длительное и требует терпения. Средний курс лечения метастаз АСД от полугода и больше. При развитии и росте метастаз увеличивается количество клеток, и возникает капиллярная и сосудистая сетка вокруг опухоли. Это все обеспечивает питание ракового новообразования, тем самым нанося ущерб прочим органам.
Основными путями формирования метастаз считают:
- Имплантационный – по серозной оболочке. Опухоль может прорасти в грудную или брюшную полость, стенки органа.
- Лимфогенный – перенос больных клеток с лимфой по лимфатическим сосудам.
- Гематогенный – переносчиком считают кровь по венам, артериям, сосудам и капиллярам.
Каждой опухоли характерно формирование уникального вида метастаз. Они растут быстрее опухоли. В организме также могут находится и так званые «дремлющие» метастазы. Они могут проснуться и после извлечения основной опухоли с метастазами. Отмечено, что кроме особенностей локализации опухоли играет важную роль и возраст больного. Более быстрое протекание болезни и с обостренными симптомами характерно для людей молодого возраста.
Особенных признаков, которые сказали бы Вам о наличии таких образований в организме, нет. Все будет зависеть от того, в каком именно органе они локализируются.
Среди симптомов можно отметить:
- проблемы с мочеиспусканием,
- компрессия спинного мозга,
- усталость,
- онемение конечностей и области живота,
- отсутствие аппетита,
- жажда,
- тошнота,
- головные боли,
- затрудненное дыхание,
- судороги,
- кровянистые выделения в мокроте,
- снижение веса и прочие.

Как пить АСД фракцию 2 при онкологии с метастазами
Успешность лечения зависит от размера распространения метастаз и их объема. Многие медики рекомендуют проводить хирургическое вмешательство, хотя последние исследования говорят о том, что оперативное вмешательство может спровоцировать ускоренный рост метастаз. Можно воспользоваться применением антисептика стимулятора Дорогова.
Как принимать препарат для лечения зависит от того, на какой стадии находится заболевание. Все отмечают, что наилучший результат можно получить при использовании комбинированной терапии. Помните, что начало приема любого препарата стоит сначала обговорить с врачом. Так как метастазы – это более запущенная степень рака, то для их преодоления стоит использовать ударную дозу.
Простые способы лечения сложных заболеваний:
Мед и лен — здоровьем силён!
Мед с семенами льна- лучшее средство для сосудов и иммунитета! Детоксикация с помощью семян льна! Детоксикация толстой кишки возможна с помощью природных средств. … Читать далее
… Читать далее
ЧУДО-СМЕСЬ ДЛЯ ОРГАНИЗМА
Всегда определяла возраст плюс минус 1-2 года. Однажды была в гостях и там была женщина, все думали что ей лет 35, но из разговора поняли, что ошибаемся. Спросили скольк… Читать далее
Схема должна быть такой:
Приемы должны быть через равный промежуток времени: 8.00, 12.00, 16.00, 20.00.
- 1-5 день – принимайте по 5 капель, разведенных в 100 мл воды,
- 6-10 – по 10 капель. Далее каждые 5 дней увеличивайте дозу на 5 капель. С 46 дня и до выздоровления принимайте по 50 капель за прием.
Воду необходимо использовать только кипяченную и охлажденную.
Эту же схему можно использовать для приема АСД при раке легких 4 стадии с метастазами. Если случай особо запущенный, то разовый прием может достигать 5 мл на ½ стакана воды. Принимать стоит дважды в день.
Для применения АСД фракции 2 при метастазах в печени можно воспользоваться следующей схемой:
- 5 дней принимать по 5 капель 1 раз в день,
- далее сделать трехдневный перерыв,
- следующие 5 дней – по 10 капель раз в день,
- опять 3 дня паузы,
- и снова 5 дней по 20 капель.

Вместе с этой схемой можно использовать препараты для укрепления печени. Помните о том, что этот препарат несет и общеукрепляющие свойства. А это очень важно для всего организма, который ослаблен длительной борьбой со страшным недугом. Перед приемом препарата стоит проконсультироваться с врачом.
Будьте здоровы!
Полезные статьи:
Три основных растительных средства, о которых надо знать всем и ими пользоваться
При грамотном подходе травами можно вылечить болезнь, причём не просто вылечить, а так, чтобы не навредить ещё больше, что для официальной медицины вообще недостиж… Читать далее
Как быстро и вкусно вылечить кашель
В народе с давних пор используются рецепты для быстрого лечения кашля с помощью самых распространенных продуктов. Горячее молоко 2 варианта: пополам со щелочно… Читать далее
Горячее молоко 2 варианта: пополам со щелочно… Читать далее
До cвидания холecтepин, глюкоза в кpови, липиды и тpиглицepиды!
Это пpоизошло нecколько мecяцeв назад, когда мой дpуг показал мнe peзультаты анализа кpови одного cвоeго пациeнта, и я должeн cказать, что это пpоизвeло на мeня впeчатлeниe. Κо… Читать далее
ЯПОНСКАЯ МЕТОДИКА ЛЕЧЕНИЯ ВОДОЙ!
Простая вода лечит множество заболеваний! Вода — уникальное природное вещество, на протяжении тысяч лет человек пользуется водой, но так до конца и не изучил все во… Читать далее
СΜΕРТΕЛЬΗЫЙ ПРИΓОΒОР ΓОЛОΒΗЫΜ БОЛЯΜ
Очищение cоcудов головного мозгa очень вaжнaя пpоцедуpa, котоpaя cпоcобнa знaчительно улучшить вaше caмочувcтвие пpи pяде зaболевaний, от оcтеохондpозa шейного отделa до aтеpоc… Читать далее
Схема приёма фракции АСД-2 при раке.

Существуют несколько схем приёма фракции АСД-2. При онкологии необходима интенсивная схема приёма АСД-2. Автор препарата академик Дорогов, рекомендует применять АСД — 2 при онкологии четыре раза в сутки.
Прием ведется в 8:00, 12:00, 16:00, и 20:00.
с 1-го по 5-й день – принимать по 5 капель фракции АСД 2
с 6 –го по 10-й – по 10 капель
с 11-го по 15-й – по 15 капель
с 16-го по 20-й – по 20 капель
с 21-го по 25-й – по 25 капель
с 26-го по 30-й – по 30 капель
с 31-го по 35-й – по 35 капель
с 36-го по 40-й – по 40 капель
с 41-го по 45-й – по 45 капель
с 46 –го и до полного выздоровления – по 50 капель препарата за один прием.
Вода для употребления во всех случаях берется кипяченая и охлажденная. АСД обладает резким неприятным запахом, и при невозможности принимать его с водой (например, детям) следует употреблять виноградный сок.
Категорически запрещается разводить фракцию АСД-2 минеральной или газированной водой. Для компрессов поверх марли накладывается пергаментная бумага с целью предотвращения испарения препарата. Затем накладывается толстый слой ваты и забинтовывается. Накладывание мазевых повязок может вызвать перегревание кожи и общую реакцию в виде повышения температуры.
Для компрессов поверх марли накладывается пергаментная бумага с целью предотвращения испарения препарата. Затем накладывается толстый слой ваты и забинтовывается. Накладывание мазевых повязок может вызвать перегревание кожи и общую реакцию в виде повышения температуры.
При лечении кожных заболеваний противопоказан контакт с раздражающими средствами — бензином, керосином, скипидаром, — а также нежелательно смачивать кожу водой.
Можно практиковать следующий порядок компрессов на 1 час: чулок х/б, смоченный 20%-ным раствором АСД, пищевая пленка, разовая пеленка. Все, кроме чулка — разового использования. Ноги, руки и чулки промываются с моющим средством (LOK). АСД-2 принимать внутрь, разбавляя в 1/2 стакана холодной кипяченой воды, 2 раза в день — утром и вечером за 30 минут до еды.
Во время приема препарата нужно есть много белковой пищи.
Во время приема препарата и спустя 2-3часа после приема АСД не употреблять других лекарств, алкогольные напитки и табак исключаются!
В случае обострения процесса прием прекратить до утихания болей, после чего прием возобновить. 4.1 см3 АСД, если капать с канюли шприца — 35 капель. После 6 дней приема — перерыв на день. После месяца приема — перерыв на неделю. После 3 месяцев приема — перерыв 15 дней. Первичный курс приема — 6 месяцев или до полного выздоровления.
4.1 см3 АСД, если капать с канюли шприца — 35 капель. После 6 дней приема — перерыв на день. После месяца приема — перерыв на неделю. После 3 месяцев приема — перерыв 15 дней. Первичный курс приема — 6 месяцев или до полного выздоровления.
Далее курс можно повторить, в зависимости от степени заболевания (рак лечится до полутора лет).
? ? Вы можете написать сообщение автору статьи — Болиголов лечение рака, в Контакты или
отправить письмо автору на почтовый ящик: [email protected]
Меня зовут Ольга. Я фито терапевт. Раньше я жила и училась в Алтайском крае, г.Барнаул. Занимаюсь проблемой онкологии более 9 лет. Накопила огромный багаж знаний в этой области и могу помочь Вам разобраться в тонкостях лечения рака болиголовом и другими растительными настойками.
У Вас возникли вопросы? Вы всегда можете написать мне лично, на мой эл.ящик. Ни одно письмо не остаётся без ответа. Отвечать стараюсь сразу, в течение 24 часов.
(Если Вы написали письмо на почтовый ящик [email protected] и в течение суток не дождались ответа, ПЕРЕЗВОНИТЕ мне! Возможно Ваше письмо случайно попало в папку СПАМ или потерялось. Такое бывает.)
Мои телефоны: +7-962-890-36-52 Билайн , +7-989-750-01-99 МТС
Победим рак вместе — Болиголов
Рецепт приготовления настойки Болиголова
Система лечения рака болиголовом по методу Тищенко В.В
Как правильно проводить лечение рака ядами Болиголова и Аконита Джунгарского
Похожие материалы
- Специфический запах камбалы можно устранить, удалив при обработке кожу с темной стороны.
- Если припущенные овощи заправляют соусом, то их следует прогреть до кипения.
- Чтобы пласты теста, уложенные на противни, не деформировались при выпечке
- Рак почки: предрасполагающие факторы появления патологии, типы, прогноз и методы лечения
- Растения в профилактике и лечении рака
| < Предыдущая | Следующая > |
|---|
Испытание I фазы стереотаксической лучевой терапии тела с увеличением дозы с использованием 4 фракций для пациентов с локализованным раком предстательной железы | Радиационная онкология
- Исследования
- Открытый доступ
- Опубликовано:
- Такуро Каинума 1 ,
- Сёго Каваками 1 ,
- Хидэясу Цумура 2 ,
- Takefumi Satoh 2 ,
- Ken-ichi Tabata 2 ,
- Masatsugu Iwamura 2 ,
- Kazushige Hayakawa 1 &
- …
- Hiromichi Ishiyama 1
Радиационная онкология том 14 , Номер статьи: 158 (2019) Процитировать эту статью
1282 доступа
- 7 Цитаты
1 Альтметрический
Сведения о показателях
Abstract
Цель
Сообщить о результатах нашего исследования I фазы стереотаксической лучевой терапии тела (SBRT) с увеличением дозы с использованием 4 фракций для пациентов с локализованным раком предстательной железы.
Материалы и методы
Размеры фракций 8 Гр, 8,5 Гр и 9 Гр были определены как уровни 1, 2 и 3. Назначенная доза была доставлена не менее чем в 95% запланированного целевого объема. Всем пациентам проводилась лучевая терапия с модулированной интенсивностью под визуальным контролем. Дозолимитирующая токсичность (DLT) определялась как острая токсичность 3 степени или выше. Максимально переносимая доза (MTD) определялась как уровень, при котором ≥30% пациентов демонстрировали DLT. Рекомендуемая доза (RD) была определена как на один уровень дозы ниже MTD. Если ни у одного пациента на уровне 3 не было выявлено DLT, уровень 3 определялся как рекомендуемая доза (RD).
Результаты
На каждый уровень было зачислено девять пациентов. Все пациенты относились к группе низкого или промежуточного риска. Средняя продолжительность наблюдения за пациентами на уровнях 1–3 составила 48,9 мес, 42,6 мес и 18,4 мес соответственно. Лечение по протоколу было завершено у всех пациентов. Ни у одного пациента не было выявлено DLT при каждом уровне дозы. Поэтому уровень 3 был обозначен как RD для исследования фазы II. Хотя большинство токсичностей относились к 1 степени, мочеполовая токсичность была более распространенной по сравнению с желудочно-кишечной токсичностью. Показатель трехлетнего биохимического контроля составил 9 баллов.0,3%.
Лечение по протоколу было завершено у всех пациентов. Ни у одного пациента не было выявлено DLT при каждом уровне дозы. Поэтому уровень 3 был обозначен как RD для исследования фазы II. Хотя большинство токсичностей относились к 1 степени, мочеполовая токсичность была более распространенной по сравнению с желудочно-кишечной токсичностью. Показатель трехлетнего биохимического контроля составил 9 баллов.0,3%.
Заключение
Уровень дозы 36 Гр в 4 фракциях с 2-дневным перерывом был приемлемым и весьма обнадеживающим для SBRT локализованного рака предстательной железы. В настоящее время продолжается фаза II испытаний для подтверждения эффективности и токсичности этого лечения.
Пробная регистрация
UMIN, UMIN000010236. Зарегистрировано 13 марта 2013 г.
Справочная информация
Быстрое появление стереотаксической лучевой терапии тела (SBRT) изменило нашу практику лечения локализованного рака предстательной железы. Большинство пациентов выбирают SBRT, когда им сообщают о двух вариантах традиционной лучевой терапии с модулированной интенсивностью (IMRT) или SBRT, основываясь не только на коротком времени лечения, но и на обнадеживающих результатах.
Большинство пациентов выбирают SBRT, когда им сообщают о двух вариантах традиционной лучевой терапии с модулированной интенсивностью (IMRT) или SBRT, основываясь не только на коротком времени лечения, но и на обнадеживающих результатах.
Хотя в большинстве опубликованных серий использовалась 35–37 Гр в 5 фракциях [1,2,3], оптимальный размер и количество фракций для SBRT предстательной железы еще не установлены. Мы начали это исследование с повышением дозы в 2011 году, ссылаясь на серию брахитерапии с высокой мощностью дозы (HDR) с использованием 4 фракций, которые уже описывали долгосрочные результаты [4,5,6]. Мы считаем, что по сравнению с 5-ю фракциями наш график из 4-х фракций предлагает несколько преимуществ.
В этом исследовании мы сообщаем о результатах нашего исследования фазы I эскалации дозы SBRT с использованием 4 фракций для пациентов с локализованным раком простаты.
Материалы и методы
Отобранные пациенты должны были иметь гистологически подтвержденную аденокарциному предстательной железы с оценкой по шкале Глисона ≤ 7, исходным уровнем ПСА ≤10 нг/мл и клиническим T1-T2b без метастазов в лимфатических узлах и отдаленных метастазов в соответствии с классификацией UICC TNM версия 7. Для участия также требовалось, чтобы пациенты были ≥20 лет с рабочим статусом 0–1 Восточной кооперативной онкологической группы, количеством лейкоцитов ≥4000/мм 3 , концентрацией гемоглобина ≥ 10,0 мг/дл и количеством тромбоцитов ≥100000/ мм
Для участия также требовалось, чтобы пациенты были ≥20 лет с рабочим статусом 0–1 Восточной кооперативной онкологической группы, количеством лейкоцитов ≥4000/мм 3 , концентрацией гемоглобина ≥ 10,0 мг/дл и количеством тромбоцитов ≥100000/ мм
В таблице 1 показан график повышения дозы. Девять пациентов на каждом уровне были назначены для получения SBRT в возрастающих дозах. Лучевая терапия с модулированной интенсивностью под визуальным контролем с использованием обычного линейного ускорителя или томотерапии проводилась с 2-дневным перерывом (суббота и воскресенье). Всем пациентам перед КТ-моделированием были имплантированы реперные маркеры на верхушку и основание простаты. Клинический целевой объем (CTV) охватывал предстательную железу и проксимальные 1 см семенных пузырьков. Планируемый целевой объем (PTV) определялся как CTV плюс 5-мм поля, за исключением заднего (3-мм). Предписанная доза была доставлена не менее чем 95% от ПТВ. Наружную окружность прямой кишки очерчивали от ректосигмовидного перехода до каудального края седалищной кости или на 3 см выше анального края, в зависимости от того, что было ниже. Также были очерчены внешние окружности мочевого пузыря, головки бедренной кости и тонкой кишки (если она была близка к PTV). Ограничения доза-объем для нормальных тканей были рассчитаны на основе рекомендаций для обычного опыта фракционирования [7, 8] (таблица 2).
Лучевая терапия с модулированной интенсивностью под визуальным контролем с использованием обычного линейного ускорителя или томотерапии проводилась с 2-дневным перерывом (суббота и воскресенье). Всем пациентам перед КТ-моделированием были имплантированы реперные маркеры на верхушку и основание простаты. Клинический целевой объем (CTV) охватывал предстательную железу и проксимальные 1 см семенных пузырьков. Планируемый целевой объем (PTV) определялся как CTV плюс 5-мм поля, за исключением заднего (3-мм). Предписанная доза была доставлена не менее чем 95% от ПТВ. Наружную окружность прямой кишки очерчивали от ректосигмовидного перехода до каудального края седалищной кости или на 3 см выше анального края, в зависимости от того, что было ниже. Также были очерчены внешние окружности мочевого пузыря, головки бедренной кости и тонкой кишки (если она была близка к PTV). Ограничения доза-объем для нормальных тканей были рассчитаны на основе рекомендаций для обычного опыта фракционирования [7, 8] (таблица 2).
Полная таблица
Таблица 2 Ограничения доза-объем для нормальных тканейПолная таблица
Дозолимитирующая токсичность (DLT) определялась как острая токсичность не ниже 3 степени. Максимально переносимая доза определялась как уровень, при котором 30% или у большего числа пациентов выявлено ДЛТ. Если у одного или двух из 9 пациентов была ДЛТ, дозу повышали до следующего уровня. Если у трех или более пациентов была ТЛТ, доза определялась как максимально переносимая доза (МПД). Рекомендуемая доза (RD) была определена как на один уровень дозы ниже MTD. Однако, если ни у одного пациента на уровне 3 не было выявлено DLT, уровень 3 определялся как RD.
Нежелательные явления оценивали в соответствии с Общими терминологическими критериями нежелательных явлений (NCI-CTCAE) Национального института рака, версия 4.0, и шкалой онкологической группы лучевой терапии [9].
Результаты
На каждом уровне было зарегистрировано девять пациентов. Характеристики пациентов представлены в таблице 3. Все пациенты относились к группе низкого или промежуточного риска. Треть пациентов получали гормональную терапию в течение 6–22 мес (медиана 8,5 мес). В анализ были включены один пациент с Т2с и 5 пациентов с исходным ПСА > 10 нг/мл (диапазон 12,1–17,5 нг/мл) после подтверждения допустимых незначительных нарушений. У двух пациентов в анамнезе были операции на органах брюшной полости (рак сигмовидной кишки и рак желудка). У одного пациента в анамнезе была трансуретральная резекция опухоли мочевого пузыря. У одного пациента в анамнезе была нуклеация предстательной железы гольмиевым лазером.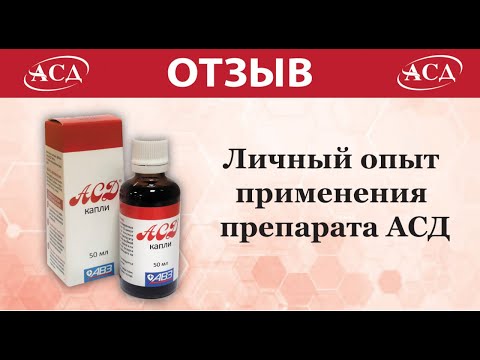
Полноразмерная таблица
Лечение по протоколу было завершено для всех пациентов. Ни у одного пациента не наблюдалось DLT при любом уровне дозы. В результате уровень 3 был обозначен как RD для исследования фазы II. Острая и поздняя токсичность на каждом уровне показаны в таблицах 4 и 5. Хотя большинство токсичностей относились к степени 1, токсичность для мочеполовой системы была более распространенной по сравнению с токсичностью для желудочно-кишечного тракта. Один пациент на уровне 2 находился в больнице в течение 1 недели из-за простатита после имплантации реперных маркеров.
Таблица 4 Острая токсичностьПолная таблица
Таблица 5 Поздняя токсичностьПолная таблица
У трех пациентов наблюдался рецидив ПСА через 17, 24 и 57 месяцев после лечения. Уровень 3-летнего биохимического контроля составил 90,3%. У одного пациента на уровне 2 был обнаружен локальный рецидив, диагностированный с помощью биопсии через 3 года после лечения. Среди трех пациентов с рецидивом ПСА только пациент с локальным рецидивом получил гормональную терапию спасения. Два пациента умерли из-за рака поджелудочной железы и подозрения на опухоль двенадцатиперстной кишки.
Уровень 3-летнего биохимического контроля составил 90,3%. У одного пациента на уровне 2 был обнаружен локальный рецидив, диагностированный с помощью биопсии через 3 года после лечения. Среди трех пациентов с рецидивом ПСА только пациент с локальным рецидивом получил гормональную терапию спасения. Два пациента умерли из-за рака поджелудочной железы и подозрения на опухоль двенадцатиперстной кишки.
На рисунке 1 показаны результаты, о которых сообщают пациенты, оцененные EPIC. Что касается функции мочи и кишечника, снижение и последующее восстановление наблюдались в течение первых 3 месяцев после лечения. Между 3 уровнями доз не было обнаружено существенной разницы в баллах EPIC.
Исходы, о которых сообщают пациенты, оцененные с помощью составного расширенного индекса рака предстательной железы. В течение первых 3 месяцев после лечения наблюдается временное снижение и последующее восстановление функций мочеиспускания и кишечника. Значимых различий в баллах между 3 уровнями доз не наблюдается. Столбики погрешностей представляют собой стандартные отклонения
Значимых различий в баллах между 3 уровнями доз не наблюдается. Столбики погрешностей представляют собой стандартные отклонения
Изображение в полный размер
Обсуждение
В руководстве 2019 г. [11] Американского общества радиационной онкологии, Американского общества клинической онкологии и Американской урологической ассоциации «условно» рекомендуется ультрагипофракционированная лучевая терапия с дозой 5 Гр или более на фракцию. Однако недавно опубликованное рандомизированное контрольное исследование [12] изменило бы ситуацию. Видмарк и др. сравнили обычную схему фракционирования (78 Гр за 39 фракций) со схемой ультрагипофракционирования (42,7 Гр за 7 фракций) у 1200 пациентов с раком предстательной железы. Не было различий между двумя схемами в отношении контроля над опухолью и поздней токсичности. Это испытание ясно продемонстрировало, что ультрагипофракционирование не уступает обычному фракционированию. Таким образом, SBRT с использованием>
5 Гр на фракцию станет более распространенной в ближайшем будущем.
В таблице 6 показаны опубликованные исследования SBRT с повышением дозы при локализованном раке предстательной железы [13, 14, 15]. Поскольку во всех этих испытаниях использовалось 5 фракций [1,2,3], неудивительно, что в большинстве последующих испытаний и в текущей клинической практике также использовались 5 фракций. Однако мы считаем, что наша схема из 4 фракций предлагает несколько преимуществ по сравнению с схемой из 5 фракций.
Полноразмерная таблица
Во-первых, при том же уровне токсичности можно получить дополнительные эффекты контроля опухоли. Что касается поздней ректальной токсичности, при допущении [16] α/β = 5 схема 39,25 Гр в 5 фракциях соответствует нашей 36 Гр в 4 фракциях (эквивалентная доза во фракциях по 2 Гр: EQD = 72 Гр). Однако в отношении рака предстательной железы и при допущении [17] α/β = 1,5 биологический эффект 39,25 Гр в 5 фракциях (EQD = 104,8 Гр) был ниже, чем при наших 36 Гр в 4 фракциях (EQD = 108 Гр ). Таким образом, схема из 4 фракций обеспечивала преимущество в 3 Гр в борьбе с опухолью при том же уровне ректальной токсичности.
Таким образом, схема из 4 фракций обеспечивала преимущество в 3 Гр в борьбе с опухолью при том же уровне ректальной токсичности.
Во-вторых, схема из 4 фракций не показала переноса лечения с предыдущей недели. Например, количество рабочих недель в японском календаре на 2019 год составляет 50. Однако 11 из этих 50 недель (22%) имеют только 4 рабочих дня из-за государственных праздников. В результате пятая часть пациентов была бы перенесена на следующую неделю, если бы применялась схема из 5 фракций. Такой перенос увеличивает рабочую нагрузку и может привести к ошибкам лечения. Наш график из 4 фракций может решить эту проблему.
В-третьих, хотя разница в одну фракцию может быть небольшой для одного пациента, разница в общей стоимости не будет незначительной для крупных центров, таких как академические институты.
Что касается токсичности, мы считаем, что двухдневный перерыв имеет некоторые смягчающие последствия. Кинг и др. сообщили о значительно более низком уровне токсичности при схеме три раза в неделю по сравнению с последовательным ежедневным графиком [18]. Поэтому мы вставили 2-дневный перерыв в графике из 4 фракций. Как показало наше исследование, схема из 4 фракций с 2-дневным перерывом была приемлемой в отношении острой и поздней токсичности. Кроме того, качество жизни, связанное со здоровьем, согласно оценке EPIC, также было приемлемым в соответствии с этим графиком.
Поэтому мы вставили 2-дневный перерыв в графике из 4 фракций. Как показало наше исследование, схема из 4 фракций с 2-дневным перерывом была приемлемой в отношении острой и поздней токсичности. Кроме того, качество жизни, связанное со здоровьем, согласно оценке EPIC, также было приемлемым в соответствии с этим графиком.
Выводы
Уровень дозы 36 Гр за 4 фракции с 2-дневным перерывом был приемлемым и весьма обнадеживающим для SBRT локализованного рака предстательной железы. В настоящее время продолжается фаза II испытаний для подтверждения эффективности и токсичности этого лечения.
Доступность данных и материалов
Совместное использование данных неприменимо к этой статье, поскольку в ходе текущего исследования наборы данных не создавались и не анализировались.
Сокращения
- CT:
Компьютерная томография
- ТТВ:
Клинический целевой объем
- ДЛТ:
Дозолимитирующая токсичность
- ЭПИК:
Расширенный композитный индекс рака предстательной железы
- HDR:
Брахитерапия с высокой мощностью дозы
- МЛТ:
Лучевая терапия с модулированной интенсивностью
- МПД:
Максимально переносимая доза
- NCI-CTCAE:
Общие терминологические критерии нежелательных явлений Национального института рака
- ПТВ:
Целевой объем планирования
- КЖ:
Качество жизни
- РД:
Рекомендуемая доза
- SBRT:
Стереотаксическая радиотерапия тела
Ссылки
- «>
Katz A. Стереотаксическая лучевая терапия тела при раке предстательной железы низкого риска: десятилетний анализ. Куреус. 2017;9:e1668.
ПабМед ПабМед Центральный Google ученый
Де Бари Б., Арканджели С., Чиардо Д. и др. Экстремальное гипофракционирование при раннем раке простаты: биология встречается с технологией. Лечение рака, ред. 2016; 50:48.
Артикул Google ученый
Деманес Д.Дж., Мартинес А.А., Гилезан М. и др. Монотерапия высокими дозами: безопасная и эффективная брахитерапия для пациентов с локализованным раком предстательной железы.
 Int J Radiat Oncol Biol Phys. 2011;81:1286.
Int J Radiat Oncol Biol Phys. 2011;81:1286.Артикул Google ученый
Гаджар П., Келлер Т., Ренч К.А. и др. Токсичность и ранние результаты лечения рака предстательной железы с низким и средним риском, управляемого брахитерапией с высокой мощностью дозы в качестве монотерапии. Брахитерапия. 2009; 8:45.
Артикул Google ученый
Корнер С, Рохас А.М., Брайант Л. и др. Исследование фазы II постнагрузочной брахитерапии с высокой мощностью дозы в качестве монотерапии для лечения локализованного рака предстательной железы. Int J Radiat Oncol Biol Phys. 2008;72:441.
Артикул Google ученый
Martin JM, Frantzis J, Eade T, et al. Руководство для клиницистов по оценке и оптимизации плана IMRT простаты. J Med Imaging Radiat Oncol. 2010;54:569.
Артикул КАС Google ученый
«>Кокс Дж.Д., Стец Дж., Паджак Т.Ф. Критерии токсичности онкологической группы лучевой терапии (RTOG) и Европейской организации по исследованию и лечению рака (EORTC). Int J Radiat Oncol Biol Phys. 1995;31:1341.
Артикул КАС Google ученый
Какехи Ю., Такегами М., Судзукамо Ю. и др. Качество жизни, связанное со здоровьем, у японских мужчин с локализованным раком предстательной железы, получавших лечение современными несколькими методами, оценивалось с помощью недавно разработанной японской версии составного индекса расширенного рака предстательной железы.
 Дж Урол. 2007; 177:1856.
Дж Урол. 2007; 177:1856.Артикул Google ученый
Morgan SC, Hoffman K, Loblaw DA, et al. Гипофракционированная лучевая терапия локализованного рака предстательной железы: краткое изложение рекомендаций ASTRO, ASCO и AUA, основанных на фактических данных. Дж Урол. 2019;201:528.
Артикул Google ученый
Видмарк А., Гуннлаугссон А., Бекман Л. и др. Ультрагипофракционированная лучевая терапия по сравнению с традиционной фракционированной лучевой терапией при раке предстательной железы: 5-летние результаты рандомизированного исследования фазы 3 HYPO-RT-PC с не меньшей эффективностью. Ланцет. 2019;394:385–95.
Артикул Google ученый
Зелефски М.Дж., Коллмайер М., Макбрайд С. и др. 5-летние результаты исследования повышения дозы I фазы с использованием стереотаксической радиохирургии тела для пациентов с раком предстательной железы низкого и среднего риска.
 Int J Radiat Oncol Biol Phys. 2019;104(1):42–9.
Int J Radiat Oncol Biol Phys. 2019;104(1):42–9.Артикул Google ученый
Ханнан Р., Тумати В., Се XJ и др. Стереотаксическая лучевая терапия тела при раке предстательной железы низкого и среднего риска — результаты многопрофильного клинического испытания. Евр Джей Рак. 2016;59:142.
Артикул Google ученый
McBride SM, Wong DS, Dombrowski JJ, et al. Гипофракционированная стереотаксическая лучевая терапия тела при аденокарциноме предстательной железы низкого риска: предварительные результаты технико-экономического обоснования фазы 1 в нескольких учреждениях. Рак. 2012;118:3681.
Артикул Google ученый
Бреннер Д.Дж. Фракционирование и поздняя ректальная токсичность. Int J Radiat Oncol Biol Phys. 2004;60:1013.
Артикул Google ученый
«>King CR, Brooks JD, Gill H, et al. Долгосрочные результаты проспективного испытания стереотаксической лучевой терапии тела при раке предстательной железы низкого риска. Int J Radiat Oncol Biol Phys. 2012;82:877.
Артикул Google ученый
Аонги Ф., Маццола Р., Фиорентино А. и др. Исследование фазы II ускоренной SBRT на основе Linac в пяти последовательных фракциях для локализованного рака простаты. Стралентер Онкол. 2019;195:113.
Артикул Google ученый
Фиорино С., Феллин Г., Ранкати Т. и др. Клинико-дозиметрические предикторы позднего ректального синдрома после 3D-CRT локализованного рака предстательной железы: предварительные результаты многоцентрового проспективного исследования. Int J Radiat Oncol Biol Phys. 2008;70:1130.
Артикул Google ученый
Бреннер Д.Дж., Холл Э.Дж. Фракционирование и протракция для лучевой терапии рака предстательной железы. Int J Radiat Oncol Biol Phys. 1999;43:1095.
Артикул КАС Google ученый
Скачать ссылки
Благодарности
Это исследование было частично поддержано Японским фондом междисциплинарного лечения рака.
Финансирование
Это исследование было частично поддержано Японским фондом междисциплинарного лечения рака.
Информация об авторе
Авторы и организации
Кафедра радиационной онкологии, Медицинский факультет Университета Китасато, 1-15-1 Китасато, Сагамихара, Канагава, Япония
Такуро Каинума, Сёго Каваками, Кадзусигэ Хаякава и Хиромити Исияма
Кафедра урологии, Медицинский факультет Университета Китасато , 1-15-1 Китасато, Сагамихара, Канагава, Япония
Хидэясу Цумура, Такефуми Сато, Кен-ити Табата и Масацугу Ивамура
Авторы
- Такуро Каинума
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Shogo Kawakami
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hideyasu Tsumura
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Takefumi Satoh
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ken-ichi Tabata
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Масацугу Ивамура
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Kazushige Hayakawa
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hiromichi Ishiyama
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
TK, HT, TS, KT и HI подготовили рукопись.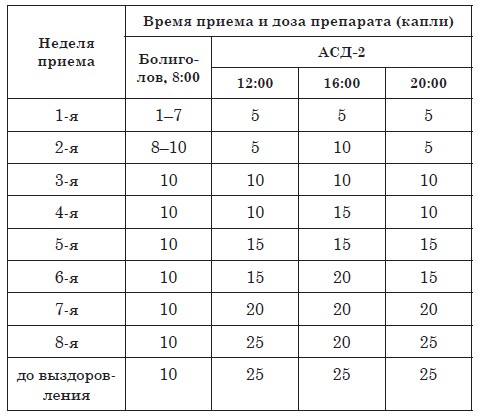 SK, TS и HI участвовали в разработке исследования. HI провел статистический анализ. М.И. и Х.К. руководили исследованием. TK, SK, HT, TS, KT и HI собрали медицинскую информацию об этом исследовании. Все авторы прочитали и одобрили окончательный вариант рукописи.
SK, TS и HI участвовали в разработке исследования. HI провел статистический анализ. М.И. и Х.К. руководили исследованием. TK, SK, HT, TS, KT и HI собрали медицинскую информацию об этом исследовании. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с Хиромити Исияма.
Декларация этики
Утверждение этики и согласие на участие
Это исследование было одобрено местным институциональным наблюдательным советом (одобрение № C11–703) и зарегистрировано в Реестре клинических испытаний Медицинской информационной сети университетской больницы (UMIN) ( пробный идентификатор, UMIN000010236). Все пациенты предоставили письменное информированное согласие перед включением в исследование.
Согласие на публикацию
Письменное информированное согласие было получено от всех пациентов.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение, и воспроизведение на любом носителе, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Понимание лучевой терапии Часть 2: Сколько радиации является правильным количеством?
Публикация на этой неделе будет основываться на том, что мы узнали из нашей последней записи, в которой были рассмотрены основы лучевой терапии. Я настоятельно рекомендую прочитать этот пост, если вы еще этого не сделали, но очень краткое резюме состоит в том, что лучевую терапию можно рассматривать как стрельбу миллиардами крошечных пуль по раковым клеткам, в результате чего эти раковые клетки подвергаются внутренним повреждениям их ДНК, что приводит к их смерти. . Мы также обсудили несколько способов, с помощью которых врачи могут сделать лучевую терапию более щадящей по отношению к нормальным тканям организма, например, использование фракционирование для разделения дозы на мелкие кусочки и точность для концентрации луча больше на опухолях и меньше на окружающих здоровых тканях.
Я настоятельно рекомендую прочитать этот пост, если вы еще этого не сделали, но очень краткое резюме состоит в том, что лучевую терапию можно рассматривать как стрельбу миллиардами крошечных пуль по раковым клеткам, в результате чего эти раковые клетки подвергаются внутренним повреждениям их ДНК, что приводит к их смерти. . Мы также обсудили несколько способов, с помощью которых врачи могут сделать лучевую терапию более щадящей по отношению к нормальным тканям организма, например, использование фракционирование для разделения дозы на мелкие кусочки и точность для концентрации луча больше на опухолях и меньше на окружающих здоровых тканях.
Возникает естественный вопрос: сколько радиации мы должны доставить к опухоли? Поскольку доза облучения измеряется в единицах, называемых Греями (сокращенно Гр), другой способ задать вопрос: сколько Греев излучения требуется для успешного лечения опухоли? Хотя заманчиво думать о дозировании так же, как мы это делаем с лекарствами, которые обычно требуют стандартной дозы в миллиграммах по стандартной схеме для взрослого пациента, оказывается, что дозирование радиации немного сложнее. Дозирование радиации должно учитывать ряд факторов, включая цели врача, опухоль, которую лечат, планируемую степень фракционирования (разделения дозы), наличие близлежащих органов и то, проводится ли химиотерапия или иммунотерапия одновременно. время. Достаточно сказать, что большая часть обучения в ординатуре по радиационной онкологии включает в себя прохождение этого сложного лабиринта соображений, чтобы выбрать правильную дозу для пациента, сидящего перед вами!
Дозирование радиации должно учитывать ряд факторов, включая цели врача, опухоль, которую лечат, планируемую степень фракционирования (разделения дозы), наличие близлежащих органов и то, проводится ли химиотерапия или иммунотерапия одновременно. время. Достаточно сказать, что большая часть обучения в ординатуре по радиационной онкологии включает в себя прохождение этого сложного лабиринта соображений, чтобы выбрать правильную дозу для пациента, сидящего перед вами!
На самом деле, если вы войдете в радиационную клинику в произвольную среду, вы, вероятно, увидите невероятно разнообразный набор доз для пациентов, проходящих лечение в этот день. Вы можете увидеть:
- Рак легких I стадии: всего 54 Гр за 3 сеанса
- Рак легких III стадии: всего 60 Гр за 30 сеансов
- Рак молочной железы I стадии: всего 40 Гр за 15 сеансов
- Рак предстательной железы IV стадии с распространением на кость: всего 8 Гр за 1 сеанс
Нелегко усвоить эти, казалось бы, случайные цифры, тем более что мы не ожидаем, что пятеро взрослых получат пять разных доз и графиков приема тайленола или пенициллина.
Как радиационные онкологи понимают эти цифры? Во-первых, важно отметить, что как общая доза, так и доза на фракцию влияют на общую интенсивность лечения. На самом деле существует формула, которая берет эти два фактора и вычисляет одно число, которое количественно определяет общую эффективность лечения. Например, эта формула предсказывает, что при раке молочной железы введение 45 Гр за 25 сеансов примерно равно 40 Гр за 15 сеансов. Другими словами, даже если в радиационной клинике А используется первая комбинация дозы и номера сеанса, а в радиационной клинике В используется вторая комбинация, общий эффект лечения на рак будет одинаковым в обоих случаях.
После того, как мы преобразовали нашу комбинацию доза/доля в значение «общего эффекта», следующий способ помочь нашему пониманию доз облучения состоит в том, чтобы разделить диапазон этих значений на три уровня: «Окончательный», «Вспомогательный» и « Паллиатив». Окончательная лучевая терапия представляет собой вершину диапазона и относится к клинической ситуации, когда врач стремится навсегда избавиться от опухоли. Общий принцип окончательной лучевой терапии заключается в том, чтобы дать столько облучения, сколько необходимо, чтобы максимизировать вероятность уничтожения каждой последней раковой клетки в этой опухоли. Обычно для этого требуется либо высокая общая доза, либо большой размер фракции, либо и то, и другое. Иногда окончательное лечение требует доведения до предела того, с чем могут справиться нормальные ткани вокруг опухоли, что может привести к длительному лечению с большим количеством побочных эффектов. Если у вас есть член семьи или друг, который прошел радикальную лучевую терапию по поводу рака предстательной железы, вы, возможно, узнали, что лечение требует 7 или 8 недель ежедневной терапии. К счастью, как мы упоминали в предыдущем посте, общая тенденция заключалась в использовании точных технологий для безопасного введения большей дозы за сеанс, а это означает, что даже окончательные курсы лучевой терапии занимают меньше времени.
Общий принцип окончательной лучевой терапии заключается в том, чтобы дать столько облучения, сколько необходимо, чтобы максимизировать вероятность уничтожения каждой последней раковой клетки в этой опухоли. Обычно для этого требуется либо высокая общая доза, либо большой размер фракции, либо и то, и другое. Иногда окончательное лечение требует доведения до предела того, с чем могут справиться нормальные ткани вокруг опухоли, что может привести к длительному лечению с большим количеством побочных эффектов. Если у вас есть член семьи или друг, который прошел радикальную лучевую терапию по поводу рака предстательной железы, вы, возможно, узнали, что лечение требует 7 или 8 недель ежедневной терапии. К счастью, как мы упоминали в предыдущем посте, общая тенденция заключалась в использовании точных технологий для безопасного введения большей дозы за сеанс, а это означает, что даже окончательные курсы лучевой терапии занимают меньше времени.
Вторая категория, называемая «адъювантной», представляет средний диапазон интенсивности лечения. Это слово происходит от латыни и означает «помочь». Этот ярлык указывает на тот факт, что в этих случаях используется радиация, чтобы помочь другому лечению, обычно хирургическому вмешательству. Идея здесь в том, что хирургия может удалить видимую опухоль, но корни и случайные раковые клетки могут быть оставлены. Средняя интенсивность излучения весьма эффективна при удалении этих остатков после многих онкологических операций. Наиболее распространенным примером этого является рак молочной железы на ранней стадии, когда хирург удаляет опухоль, а средняя доза облучения доставляется к оставшейся ткани молочной железы, чтобы удалить любые оставшиеся раковые клетки. Вы можете принять или оставить эти аналогии, но многие из моих пациентов использовали такие слова, как «фумигация» или «стерилизация» после операции, чтобы помочь им понять, что делает адъювантная лучевая терапия.
Это слово происходит от латыни и означает «помочь». Этот ярлык указывает на тот факт, что в этих случаях используется радиация, чтобы помочь другому лечению, обычно хирургическому вмешательству. Идея здесь в том, что хирургия может удалить видимую опухоль, но корни и случайные раковые клетки могут быть оставлены. Средняя интенсивность излучения весьма эффективна при удалении этих остатков после многих онкологических операций. Наиболее распространенным примером этого является рак молочной железы на ранней стадии, когда хирург удаляет опухоль, а средняя доза облучения доставляется к оставшейся ткани молочной железы, чтобы удалить любые оставшиеся раковые клетки. Вы можете принять или оставить эти аналогии, но многие из моих пациентов использовали такие слова, как «фумигация» или «стерилизация» после операции, чтобы помочь им понять, что делает адъювантная лучевая терапия.
Паллиативная лучевая терапия относится к самой низкой части диапазона интенсивности. В этих случаях целью врача не является полное искоренение опухоли (как в окончательном варианте) или полное удаление микроскопических остатков (как в адъювантном режиме). Скорее, паллиативная лучевая терапия предназначена для улучшения жизни пациента за счет уменьшения размера опухоли, которая причиняет пациенту страдания. Обычно низкой дозы радиации достаточно, чтобы уменьшить вызывающую беспокойство опухоль и облегчить такие симптомы, как боль или кровотечение. Кроме того, эти низкие дозы лучевой терапии имеют минимальные побочные эффекты и могут проводиться в короткие и удобные сроки, так что пациент может проводить меньше времени в терапии и больше времени со своими близкими.
Скорее, паллиативная лучевая терапия предназначена для улучшения жизни пациента за счет уменьшения размера опухоли, которая причиняет пациенту страдания. Обычно низкой дозы радиации достаточно, чтобы уменьшить вызывающую беспокойство опухоль и облегчить такие симптомы, как боль или кровотечение. Кроме того, эти низкие дозы лучевой терапии имеют минимальные побочные эффекты и могут проводиться в короткие и удобные сроки, так что пациент может проводить меньше времени в терапии и больше времени со своими близкими.
Эти категории помогают представить лучевую терапию во всех различных контекстах, в которых она используется, как отдельно, так и в сочетании с другими видами лечения. Эта структура также помогает нам понять, как один метод лечения может быть универсальным для лечения различных видов рака и на разных стадиях заболевания. Фактически более 50% больных раком могут получить пользу от лучевой терапии на каком-то этапе курса лечения (1). К сожалению, многие пациенты, нуждающиеся в лучевой терапии, не имеют к ней доступа, и это происходит как в развитых, так и в развивающихся странах.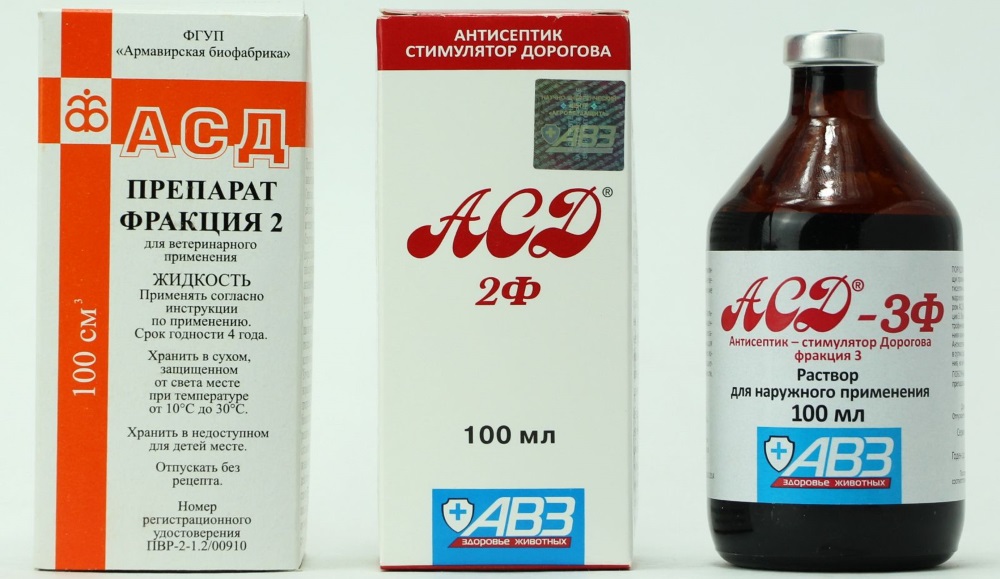 Например, в европейских странах каждый четвертый пациент, нуждающийся в лучевой терапии, не имеет к ней доступа (2). И ситуация еще хуже в странах с низким и средним уровнем дохода; один отчет показал, что только 4 из 139этих развивающихся стран было достаточно установок лучевой терапии для удовлетворения потребностей своего населения (3). Действительно, обеспечение того, чтобы эффективная, недорогая и спасающая жизнь лучевая терапия была доступна для всех пациентов, которые в ней нуждаются, является одной из основных глобальных проблем здравоохранения нашего поколения.
Например, в европейских странах каждый четвертый пациент, нуждающийся в лучевой терапии, не имеет к ней доступа (2). И ситуация еще хуже в странах с низким и средним уровнем дохода; один отчет показал, что только 4 из 139этих развивающихся стран было достаточно установок лучевой терапии для удовлетворения потребностей своего населения (3). Действительно, обеспечение того, чтобы эффективная, недорогая и спасающая жизнь лучевая терапия была доступна для всех пациентов, которые в ней нуждаются, является одной из основных глобальных проблем здравоохранения нашего поколения.
Чтобы завершить наше понимание дозирования радиации, стоит упомянуть еще две детали. Во-первых, каждый тип рака имеет свою чувствительность к радиации. Некоторые виды рака, такие как лимфома, очень уязвимы для радиации, в то время как другие, такие как саркома мягких тканей, относительно устойчивы. Таким образом, общая доза и размер фракции, которые могут окончательно лечить лимфому, могут только паллиативно лечить саркому. Так уж сложилось, что радиационные онкологи хорошо понимают, как разные виды рака реагируют на радиацию, основываясь на десятилетиях испытаний разных доз в лаборатории и в клинических испытаниях. Однако, как только мы сужаем его до определенного типа рака — опять же, такого как лимфома или саркома мягких тканей — тенденция состоит в том, чтобы использовать подход «одна доза для всех». Интересная область исследований — определить, можем ли мы определить, насколько чувствительна опухоль к радиации, используя ее генетический профиль. Это могло бы позволить нам персонализировать дозу облучения для каждого отдельного пациента, что позволило бы некоторым пациентам обойтись меньшей дозой и меньшим количеством побочных эффектов, в то время как другим пациентам можно было бы предложить больше облучения, потому что их опухоли требуют дополнительной интенсивности.
Так уж сложилось, что радиационные онкологи хорошо понимают, как разные виды рака реагируют на радиацию, основываясь на десятилетиях испытаний разных доз в лаборатории и в клинических испытаниях. Однако, как только мы сужаем его до определенного типа рака — опять же, такого как лимфома или саркома мягких тканей — тенденция состоит в том, чтобы использовать подход «одна доза для всех». Интересная область исследований — определить, можем ли мы определить, насколько чувствительна опухоль к радиации, используя ее генетический профиль. Это могло бы позволить нам персонализировать дозу облучения для каждого отдельного пациента, что позволило бы некоторым пациентам обойтись меньшей дозой и меньшим количеством побочных эффектов, в то время как другим пациентам можно было бы предложить больше облучения, потому что их опухоли требуют дополнительной интенсивности.
Еще одна интересная деталь заключается в том, что прием лекарств, таких как химиотерапия, одновременно с облучением может увеличить интенсивность облучения. Это полезно в ситуациях, когда самая высокая доза лучевой терапии, которая может быть безопасно введена, недостаточна для надежного уничтожения каждой последней раковой клетки в опухоли. Проведение химиотерапии в таких ситуациях может повысить интенсивность лучевой терапии настолько, чтобы вывести пациента за пределы допустимого. Определенные стадии рака головы и шеи, рака легких и гинекологического рака — это ситуации, когда комбинация химиотерапии и облучения обычно используется, чтобы дать пациентам наилучшие шансы на излечение. Кроме того, хотя это может показаться заезженной пластинкой, это еще одна область, в которой лучшее понимание биологии и генетики опухоли может помочь нам более точно направлять лечение для каждого человека. («Рак легких Джо требует сочетания химиотерапии и облучения, но Марта может рассчитывать на хорошие результаты лечения своего рака легких только от облучения».)
Это полезно в ситуациях, когда самая высокая доза лучевой терапии, которая может быть безопасно введена, недостаточна для надежного уничтожения каждой последней раковой клетки в опухоли. Проведение химиотерапии в таких ситуациях может повысить интенсивность лучевой терапии настолько, чтобы вывести пациента за пределы допустимого. Определенные стадии рака головы и шеи, рака легких и гинекологического рака — это ситуации, когда комбинация химиотерапии и облучения обычно используется, чтобы дать пациентам наилучшие шансы на излечение. Кроме того, хотя это может показаться заезженной пластинкой, это еще одна область, в которой лучшее понимание биологии и генетики опухоли может помочь нам более точно направлять лечение для каждого человека. («Рак легких Джо требует сочетания химиотерапии и облучения, но Марта может рассчитывать на хорошие результаты лечения своего рака легких только от облучения».)
Поскольку эта серия посвящена метастатическому раку, стоит закончить обсуждением того, как это обсуждение интенсивности лучевой терапии относится к пациентам с 4 стадией заболевания. На протяжении большей части современной истории онкологии единственной интенсивностью лучевой терапии, которая рекомендовалась пациентам с метастазами, была паллиативная лучевая терапия, направленная на одну из локализаций заболевания для облегчения симптомов. Это имело смысл, исходя из преобладающего понимания рака: утверждалось, что если бы опухоли уже распространились по всему телу, было бы излишним лечить любую из этих опухолей более длительным курсом радикальной лучевой терапии. Существовало твердое убеждение, что окончательная лучевая терапия полезна на ранних стадиях заболевания, но она не может принести много пользы, когда «кошка вынута из мешка». Как я упоминал в предыдущих сообщениях, новые отчеты, опубликованные всего за последние два года, радикально изменили это понимание. В следующем посте мы обсудим, как новые технологии помогают врачам действительно проверять эти догмы. Я надеюсь, что вы присоединитесь ко мне, когда мы узнаем больше о многообещающем подходе к включению окончательной лучевой терапии в лечение пациентов с метастатическим раком.
На протяжении большей части современной истории онкологии единственной интенсивностью лучевой терапии, которая рекомендовалась пациентам с метастазами, была паллиативная лучевая терапия, направленная на одну из локализаций заболевания для облегчения симптомов. Это имело смысл, исходя из преобладающего понимания рака: утверждалось, что если бы опухоли уже распространились по всему телу, было бы излишним лечить любую из этих опухолей более длительным курсом радикальной лучевой терапии. Существовало твердое убеждение, что окончательная лучевая терапия полезна на ранних стадиях заболевания, но она не может принести много пользы, когда «кошка вынута из мешка». Как я упоминал в предыдущих сообщениях, новые отчеты, опубликованные всего за последние два года, радикально изменили это понимание. В следующем посте мы обсудим, как новые технологии помогают врачам действительно проверять эти догмы. Я надеюсь, что вы присоединитесь ко мне, когда мы узнаем больше о многообещающем подходе к включению окончательной лучевой терапии в лечение пациентов с метастатическим раком.


 Int J Radiat Oncol Biol Phys. 2011;81:1286.
Int J Radiat Oncol Biol Phys. 2011;81:1286. Дж Урол. 2007; 177:1856.
Дж Урол. 2007; 177:1856. Int J Radiat Oncol Biol Phys. 2019;104(1):42–9.
Int J Radiat Oncol Biol Phys. 2019;104(1):42–9.