Чем животные белки отличаются от растительных?
И почему они не могут полностью заменить друг друга
Редакция сайта
Специалисты всего мира продолжают активно вести споры о том, возможно ли получить все необходимое для организма из растительной пищи. В частности, речь идет о белках. В нашем материале мы собрали все, что вам необходимо знать о растительных и животных белках: чем они отличаются и почему одни на 100% не могут заменить другие.
Почему белок необходим?
Белок — это макроэлемент, который является неотъемлемой частью каждой клетки человеческого организма. Наряду с жирами и углеводами, белок необходим для нормальной работы всех систем организма от опорно-двигательной до нервной и сердечно-сосудистой. Белки, а точнее аминокислоты, из которых они состоят, формируют своего рода «строительные блоки», из которых состоит весь организм. Они отвечают за прочность костей, регенерацию тканей (как кожи, так и внутренних органов) и многие другие процессы.
Вернемся к строению белков. Они состоят из особых соединений — аминокислот, которые, в свою очередь, бывают заменимые и незаменимые. Незаменимых аминокислот девять видов, и они не могут вырабатываться организмом самостоятельно, поэтому должны поступать с пищей. Когда белок содержит все девять незаменимых аминокислот, он считается полноценным, если в нем недостает хоть одной — неполноценным.
Так вот, все белки животного происхождения — полноценные, а это значит, что включая их в свой рацион в должном количестве, вы заметно облегчаете работу всем системам своего организма и обеспечиваете профилактику многих хронических заболеваний.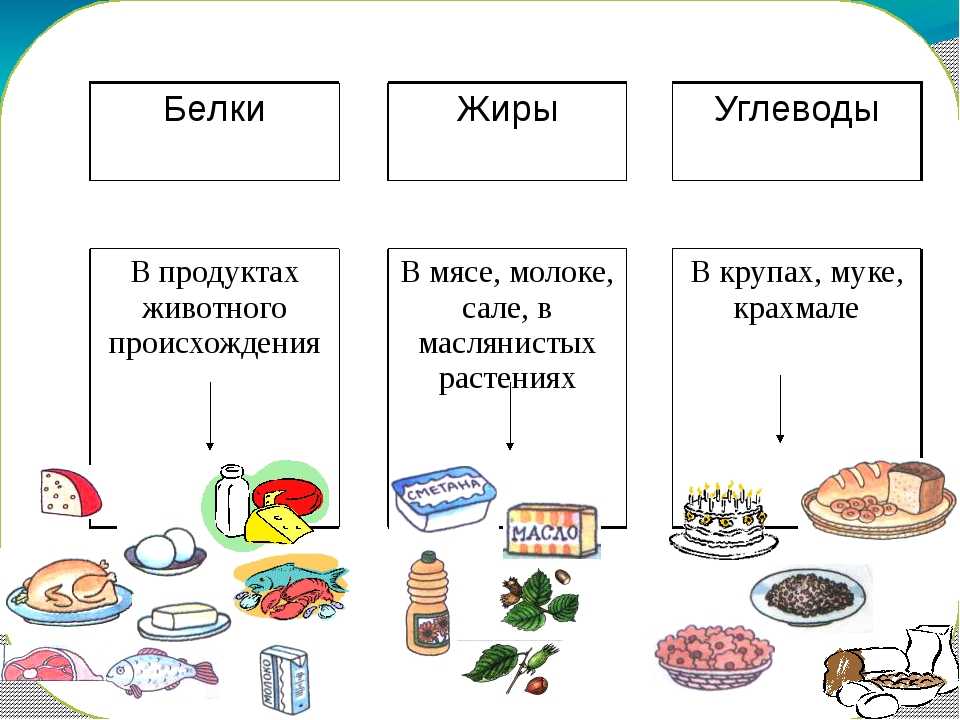 С растительными белками дело обстоит немного сложнее: во-первых, ни один растительный продукт (кроме сои) не содержит полноценных белков, всегда не хватает одной или двух незаменимых аминокислот; во-вторых, концентрация белка в животных и растительных продуктах отличается. Например, 100г. миндаля и 100г. куриной грудки содержат примерно одинаковое количество белка, но продукты имеют разную пищевую ценность, и съедать столько же орехов, сколько курицы — вредно для организма.
С растительными белками дело обстоит немного сложнее: во-первых, ни один растительный продукт (кроме сои) не содержит полноценных белков, всегда не хватает одной или двух незаменимых аминокислот; во-вторых, концентрация белка в животных и растительных продуктах отличается. Например, 100г. миндаля и 100г. куриной грудки содержат примерно одинаковое количество белка, но продукты имеют разную пищевую ценность, и съедать столько же орехов, сколько курицы — вредно для организма.
Однако, даже придерживаясь растительной диеты, можно получить все незаменимые аминокислоты, просто к вопросу придется подойти тщательнее. В большинстве случаев растительным белкам не хватает только одной незаменимой аминокислоты, а различные группы растительных белков совместимы друг с другом — это означает, что их комбинации составляют полный аминокислотный профиль. Например, идеальным сочетанием считается рис или киноа с бобами. Эти продукты не только станут отличным ужином, но и обеспечат организм всеми необходимыми аминокислотами.
Умный белок: где содержится и как организму его правильно усваивать?
Белок или протеин — основной строительный материал организма. Он способствует формированию мышц, сухожилий, внутренних органов, кожи, а также необходим для производства ферментов, гормонов и других молекул, выполняющих в организме множество важных функций. Именно поэтому так важно, чтобы баланс содержания белка в организме не нарушался. Однако нехватка протеина — одна из характерных проблем современного человека. Белковый дисбаланс негативно сказывается как на общем состоянии организма, так и на внешности, ведь от него напрямую зависит состояние кожи, волос и ногтей. О том, как поддерживать достаточный уровень белка в организме и отлично себя чувствовать, рассказывает Джемма Владимировна Подрезова, физиолог, клинический психолог, нутрициолог, эксперт компании
SOLGAR.
Белки — это органические вещества животного и растительного происхождения. Они крайне многочисленны, а их функции в организме многообразны и сложны.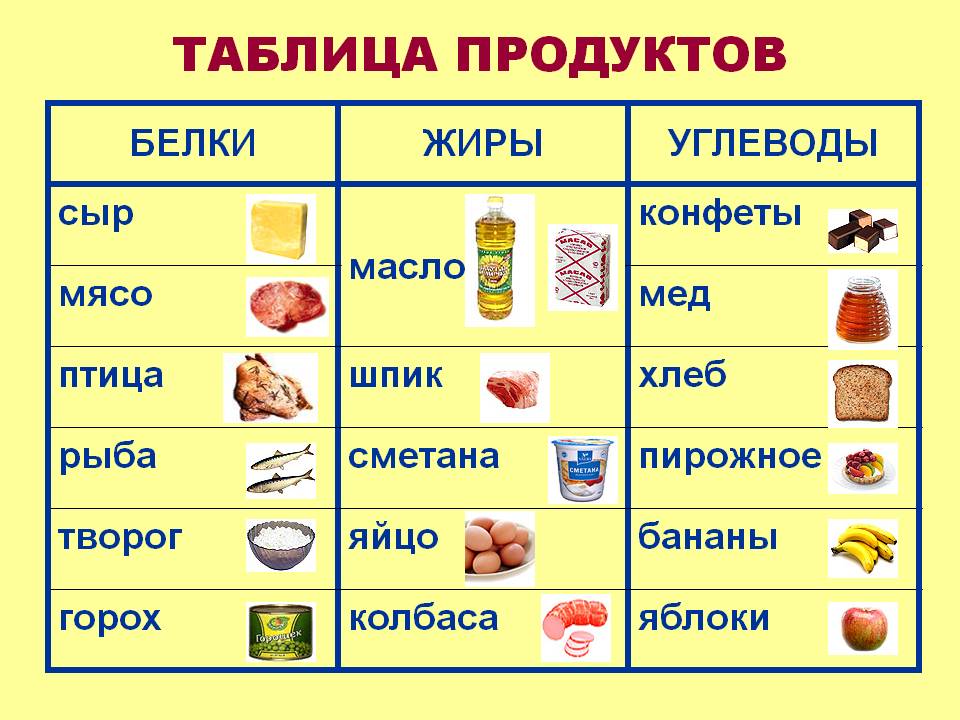
«Белки или протеины представляют собой основной строительный материал для нашего организма. Их функции трудно переоценить и также непросто полностью перечислить. Белки отвечают за рост мышц и повышение выносливости, регулируют биохимические процессы и гормональный фон, влияют на состояние иммунитета и уровень кислотности, контролируют баланс жидкости и вес, а также определяют качество структуры тканей. В отличие, например, от жиров или глюкозы, белки не накапливаются в организме, а находятся в постоянном динамическом состоянии распада или синтеза»,
Основной источник животных белков — красное мясо, в котором содержатся незаменимые аминокислоты, микроэлементы, а также ряд противовоспалительных веществ. Помимо этого, источниками животного белка являются рыба, молочные и морепродукты. Растительным белком богаты бобовые растения, семена и орехи. Однако недостаточно просто употреблять в пищу источники белка. Его питательная ценность зависит как от аминокислотного состава, так и от способности усваиваться организмом.
Его питательная ценность зависит как от аминокислотного состава, так и от способности усваиваться организмом.
Джемма Владимировна: «Белки преимущественно расщепляются ферментами поджелудочной железы и так называемыми протеолитическими ферментами. Обычное расщепление белка возможно только в условиях нормального уровня кислотности желудочного сока, при этом сегодня мы наблюдаем достаточное число людей с пониженной кислотностью. Если в общем анализе крови фигурирует низкий уровень белка, при этом человек употребляет его в достаточном количестве, то, возможно, проблема кроется в пониженной кислотности желудочного сока, недостаточном обеспечении организма ферментами и сбоем работы поджелудочной железы».
Что же делать для того, чтобы организм мог получать необходимое количество белка и полноценно его усваивать? Эксперты и нутрициологи советуют использовать в рационе так называемые белковые сыворотки, которые являются отличным источником самых разных аминокислот.
Джемма Владимировна Подрезова: «Белковая сыворотка Вэй то Гоу — источник незаменимых аминокислот в L-форме — форме, доступной для комфортного усвоения. Сывороточный протеин имеет высокую биологическую ценность для организма. Являясь источником аминокислот, он способствует ускорению периода восстановления после перенесенных заболеваний, сохранению чувства сытости и обогащению рациона, что может быть особенно важно для старшего поколения. Лейцин, валин и изолейцин необходимы организму для восполнения потерь энергии — они помогают расщеплять запасы подкожного жира. Триптофан и тирозин способствуют подавлению чувства голода, регулируя уровень инсулина в крови. Также триптофан обладает некоторым успокаивающим действием, что способствует снижению уровня стресса.
Помимо этого, аминокислоты очень важны для поддержки упругости кожи и продления молодости и красоты».
В одной мерной ложке сыворотки Вэй ту Гоу содержится 20 г. белка, полученного из молока новозеландских коров, выращенных в природных условиях неограниченного доступа к пастбищу, что позволяет обеспечить высокое качество молока. Для получения белковой сыворотки используется процесс ультрафильтрации с технологией сохранения пептидов для более быстрой доставки и усвоения аминокислот. Продукт не содержит глютена, пшеницы, сои, подходит для лакто-вегетарианцев и имеет несколько вкусов: шоколад, ваниль и без вкуса. Белковую сыворотку можно использовать для приготовления белкового коктейля или любимой выпечки, при этом питательная ценность возрастет, а содержание углеводов не увеличится.
Сегодня сывороточный протеин незаменим для нашего организма, он составляет базу всего белкового обмена. Дополнительное его включение в рацион важно для каждого современного человека, а благодаря Вэй ту Гоу его прием стал удобнее и приятнее. Эксперт отмечает, что для ощутимого эффекта потребление белковой сыворотки должно носить регулярный характер, тогда результат не заставит себя ждать, и организм будет благодарен за такую поддержку.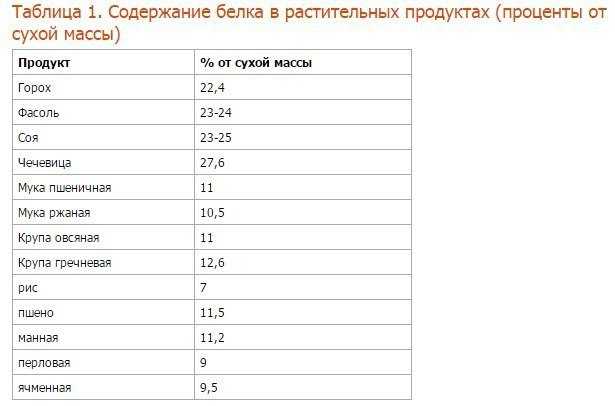
О компании SOLGAR
Компания SOLGAR основана в 1947 году и уже 75 лет SOLGAR производит уникальные биологически активные добавки премиум-класса. Миссия SOLGAR — обеспечить потребителей высококачественной, инновационной, научно-обоснованной продукцией, которая несет здоровье и отличное самочувствие людям по всему миру.
Основное внимание компания уделяет качеству, вся продукция производится из компонентов натурального происхождения с использованием инновационных технологий. Все поступившее для производства сырье проходит тщательное изучение в собственном научно-исследовательском центре компании. Производственный цикл одной серии продукта может занимать порядка 12 недель, что является самым длительным по продолжительности в индустрии биологически активных добавок. Продукция SOLGAR реализуется в упаковке из темного стекла, что защищает биологически-активные компоненты от воздействия света, тепла и влажности.
На сегодняшний день продукция представлена более, чем в 65 странах мира, а ассортимент насчитывает более 600 наименований витаминов, минералов, лекарственных растений, аминокислот, пробиотиков, комплексов и специальных продуктов. Продукция SOLGAR реализуется исключительно через аптеки, что дает возможность получения квалифицированной консультации специалистов аптек.
Продукция SOLGAR реализуется исключительно через аптеки, что дает возможность получения квалифицированной консультации специалистов аптек.
Официальный сайт компании http://www.solgarvitamin.ru
Новость предоставлена на безвозмездной основе.
белков | Биология для специальностей I
Описать строение и функции белков
Белки представляют собой полимеры аминокислот. Каждая аминокислота содержит центральный углерод, водород, карбоксильную группу, аминогруппу и вариабельную группу R. Группа R указывает, к какому классу аминокислот она принадлежит: электрически заряженные гидрофильные боковые цепи, полярные, но незаряженные боковые цепи, неполярные гидрофобные боковые цепи и особые случаи.
Белки имеют разные «слои» строения: первичный, вторичный, третичный, четвертичный.
Белки выполняют различные функции в клетках. Основные функции включают в себя действие в качестве ферментов, рецепторов, транспортных молекул, регуляторных белков для экспрессии генов и так далее. Ферменты — это биологические катализаторы, которые ускоряют химическую реакцию, не изменяясь навсегда. У них есть «активные центры», где связывается субстрат/реагент, и они могут либо активироваться, либо ингибироваться (конкурентные и/или неконкурентные ингибиторы).
Ферменты — это биологические катализаторы, которые ускоряют химическую реакцию, не изменяясь навсегда. У них есть «активные центры», где связывается субстрат/реагент, и они могут либо активироваться, либо ингибироваться (конкурентные и/или неконкурентные ингибиторы).
Цели обучения
- Продемонстрировать знакомство с мономерными единицами белков: аминокислотами
- Определение различных слоев структуры белка
- Определите несколько основных функций белков
Аминокислоты
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию.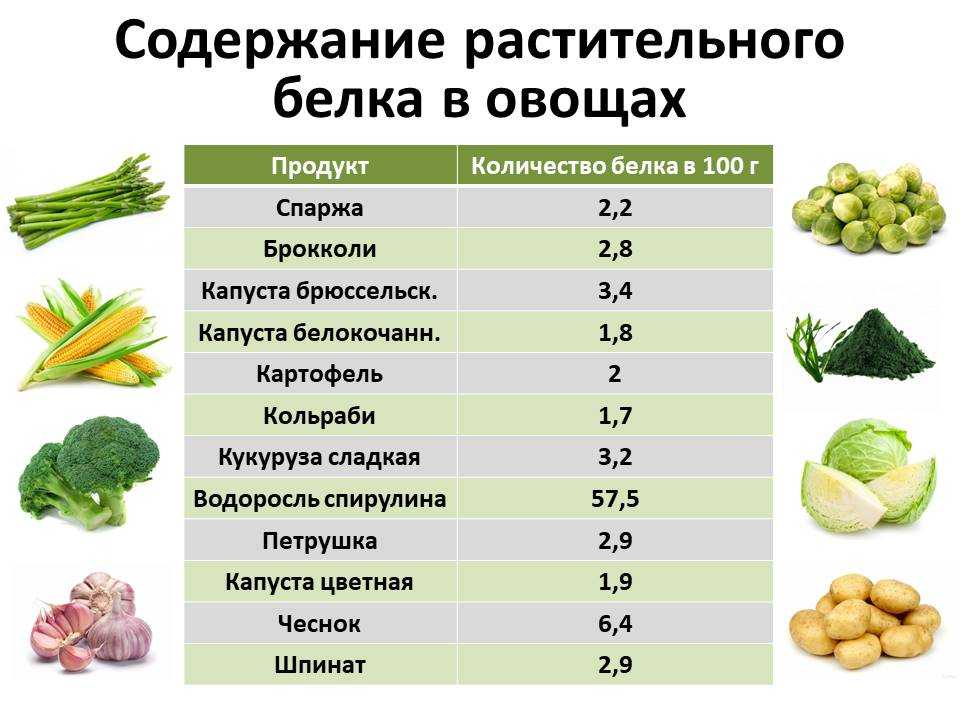 Их структура, как и их функции, сильно различаются. Однако все они являются полимерами аминокислоты , расположенные в линейной последовательности.
Их структура, как и их функции, сильно различаются. Однако все они являются полимерами аминокислоты , расположенные в линейной последовательности.
Рисунок 1. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. . Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
Название «аминокислота» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 аминокислот.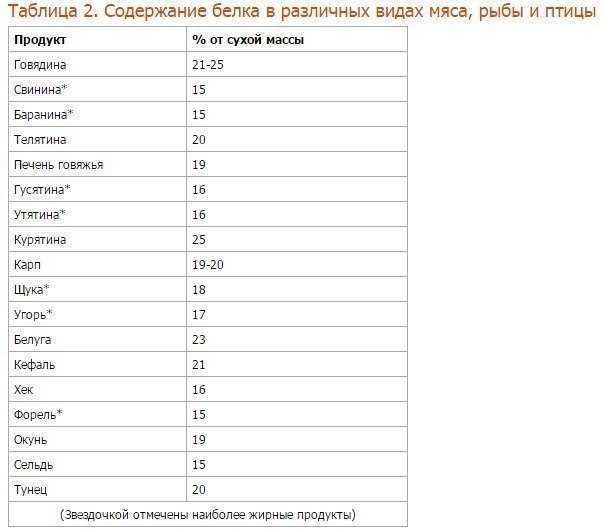 Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их вырабатывать и они поступают с пищей.
Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их вырабатывать и они поступают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практический вопрос
Рисунок 2. В белках обычно встречаются 20 аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу.
Какие категории аминокислот вы ожидаете обнаружить на поверхности растворимого белка и какие внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
Показать ответ
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенной аббревиатурой. Например, валин известен под буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, и у человека они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к аминокислотам, необходимым для построения белков в организме, хотя и не вырабатываемым организмом; какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Рисунок 3. Образование пептидной связи представляет собой реакцию синтеза дегидратации.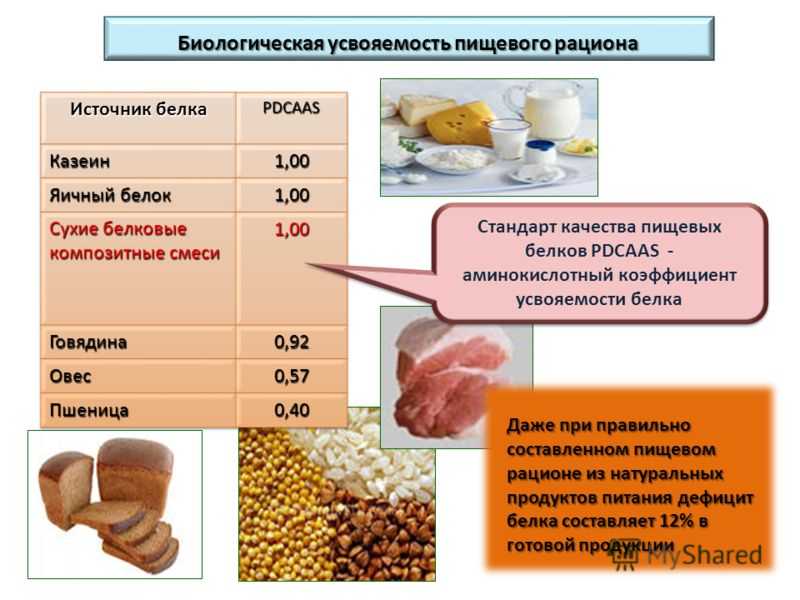 Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом высвобождается молекула воды.
Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом высвобождается молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты соединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 3).
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется все больше аминокислот, получающаяся в результате цепь известна как полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму.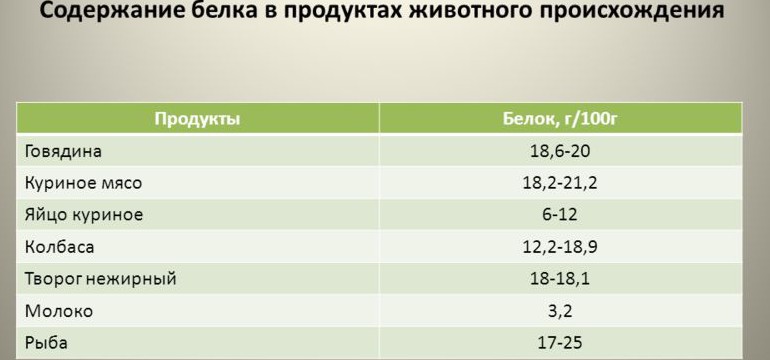 , и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
, и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания и обычно находится в клеточных органеллах, митохондриях. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется при переносе электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с; другими словами, эволюционное родство можно оценить, измерив сходство или различие последовательностей ДНК или белков разных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот находятся в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться со специфическим субстратом в месте, известном как активный центр. Если этот активный центр изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть не в состоянии связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи является ее первичной структурой. Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны друг с другом дисульфидными связями. N-концевая аминокислота цепи A представляет собой глицин, тогда как C-концевая аминокислота представляет собой аспарагин (рис. 4). Последовательности аминокислот в цепях А и В уникальны для инсулина.
Рисунок 4. Инсулин сыворотки крупного рогатого скота представляет собой белковый гормон, состоящий из двух пептидных цепей: А (длиной 21 аминокислота) и В (длиной 30 аминокислот). В каждой цепи первичная структура обозначается трехбуквенными аббревиатурами, представляющими названия аминокислот в том порядке, в котором они присутствуют. Аминокислота цистеин (цис) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности нарисованы разными размерами.
Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности нарисованы разными размерами.
Уникальная последовательность каждого белка в конечном счете определяется геном, кодирующим белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке 5) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка.
Рис. 5. Длина бета-цепи гемоглобина составляет 147 остатков, но одна аминокислотная замена приводит к серповидноклеточной анемии. В нормальном гемоглобине аминокислотой в седьмом положении является глутамат.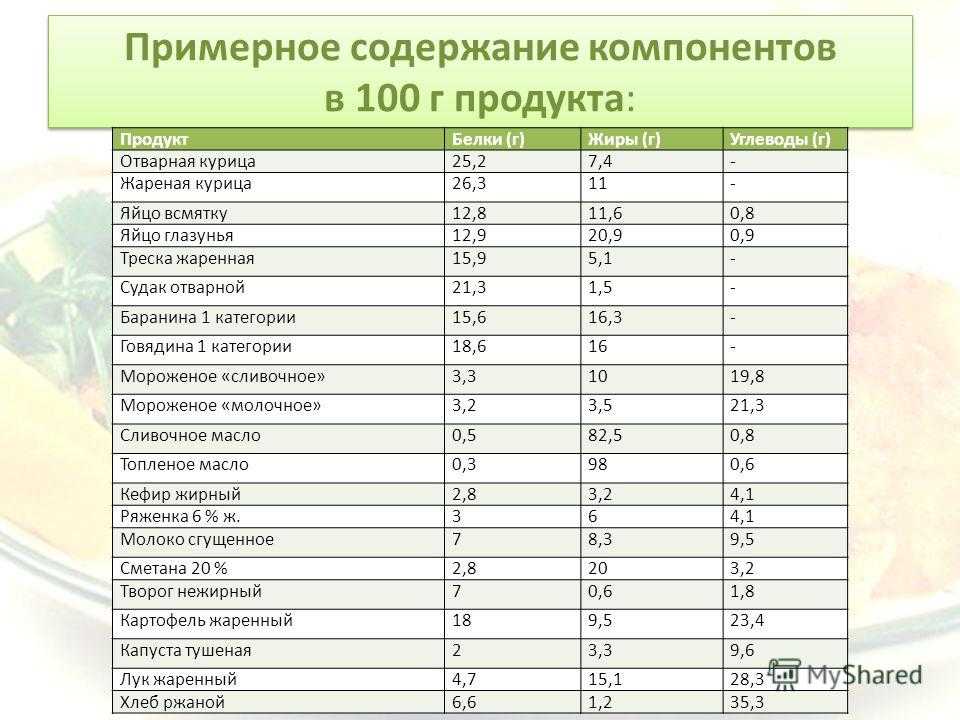 В серповидноклеточном гемоглобине этот глутамат заменен валином.
В серповидноклеточном гемоглобине этот глутамат заменен валином.
В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидноклеточной клетки, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Еще более примечательно то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызывается изменением одного основания (точечная мутация), 1 на 1800 оснований.
Рисунок 6. В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска. (кредит: модификация работы Эда Утмана; данные масштабной линейки Мэтта Рассела)
Из-за этой замены одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные эритроциты.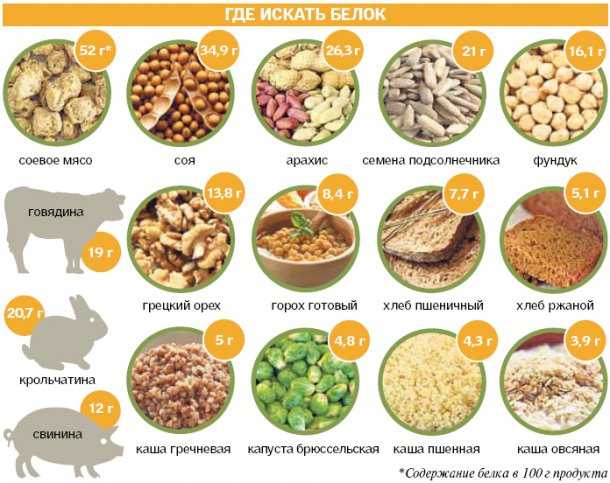 и принимают форму полумесяца или «серпа», который закупоривает артерии (рис. 6). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.
и принимают форму полумесяца или «серпа», который закупоривает артерии (рис. 6). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.
Вторичная структура
Локальная укладка полипептида в некоторых областях приводит к возникновению вторичной структуры белка. Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. 7). Обе структуры представляют собой спиральную структуру α — спираль, удерживаемая в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рисунок 7. α-спираль и β-складчатый лист являются вторичными структурами белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в пептидном остове. Некоторые аминокислоты имеют склонность к образованию α-спирали, в то время как другие имеют склонность к образованию β-складчатого листа.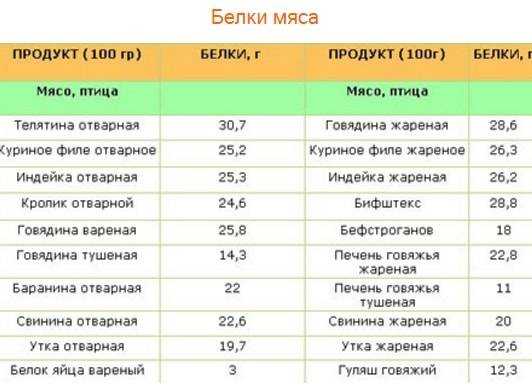
Каждый спиральный виток в альфа-спирали состоит из 3,6 аминокислотных остатков. Группы R (вариантные группы) полипептида выступают из α -спиральной цепи. В β — складчатый лист, «складки» образованы водородными связями между атомами на основной цепи полипептидной цепи. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. Структуры α -спирали и β -складчатые листы обнаруживаются в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальной трехмерной структурой полипептида является его третичная структура (рис. 8). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи.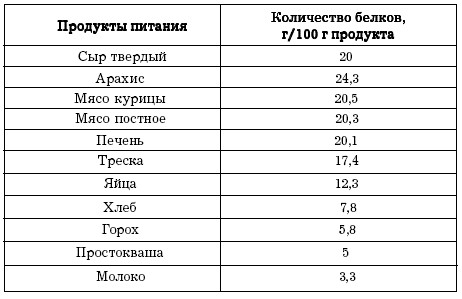 Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Рис. 8. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Однако шелк (волокнистый белок) имеет β — гофрированная листовая структура, являющаяся результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на Рисунке 9.
Рисунок 9. На этих иллюстрациях можно увидеть четыре уровня структуры белка. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белков
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе химическими взаимодействиями. Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате так называемой денатурации. Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как шапероны (или шаперонины), которые связываются с белком-мишенью во время процесса фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Чтобы получить дополнительную информацию о белках, просмотрите эту анимацию под названием «Биомолекулы: белки».
Функция белков
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин | Переносят вещества с кровью или лимфой по всему телу |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация деятельности различных систем организма |
| Оборона | Иммуноглобулины | Защита организма от чужеродных патогенов |
| Сократительный | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечение питания на раннем этапе развития зародыша и проростка |
Двумя особыми и распространенными типами белков являются ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят из своих субстратов более сложные молекулы, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят из своих субстратов более сложные молекулы, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация. Все белки состоят из разного расположения одних и тех же 20 типов аминокислот.
Резюме: Белки
Белки представляют собой класс макромолекул, которые выполняют разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки организованы на четырех уровнях: первичном, вторичном, третичном и (необязательно) четвертичном. Первичная структура представляет собой уникальную последовательность аминокислот. Локальная укладка полипептида с образованием таких структур, как спираль α и складчатый лист β , составляет вторичную структуру. Общая трехмерная структура является третичной структурой. Когда два или более полипептида объединяются, образуя полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Ответьте на вопросы ниже, чтобы узнать, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе. В этом коротком тесте , а не учитываются при подсчете вашей оценки в классе, и вы можете пересдавать его неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
Белковые основы | Исследовательский центр протеомики
Что такое белок?
Белок представляет собой большую органическую молекулу, состоящую из более мелких молекул аминокислот. Хотя небольшие белки могут содержать всего 50 аминокислот, обычно они намного крупнее и состоят из сотен или даже тысяч аминокислот.
Белки иногда намеренно разрезают на более мелкие сегменты. Эти сегменты называются пептидами. Пептид может состоять от двух до 50 аминокислот.
В белке аминокислоты соединены одна за другой, образуя длинную цепь. Они удерживаются вместе пептидными связями, которые представляют собой химические связи между атомами углерода и азота аминокислот. Помимо углерода и азота, аминокислоты содержат водород, кислород и иногда серу.
Они удерживаются вместе пептидными связями, которые представляют собой химические связи между атомами углерода и азота аминокислот. Помимо углерода и азота, аминокислоты содержат водород, кислород и иногда серу.
Белки содержат 20 типов аминокислот. За исключением лейцина и изолейцина, которые имеют одинаковую атомную массу в 113 дальтон, каждая аминокислота имеет уникальную массу. (Дальтон — единица измерения атомной массы. Один Дальтон равен 1/12 массы одного атома углерода 12.)
Что делают белки?
Белки, составляющие от 12 до 18 процентов худощавого взрослого тела, играют важную роль в физиологии человека. Вот некоторые из них:
- Белки образуют структурный каркас тканей и других структур в организме. Например, коллаген участвует в формировании сухожилий, связок, хрящей и других соединительных тканей.
- Белки переносят вещества по всему телу. Например, гемоглобин является переносчиком кислорода и углекислого газа.
- Белки работают как ферменты, облегчая химические реакции.
 В организме человека существует более 1000 известных типов ферментов.
В организме человека существует более 1000 известных типов ферментов. - Белки миозин и актин позволяют мышцам сокращаться.
- Белки регулируют физиологические процессы и контролируют рост.
- Белки являются неотъемлемой частью иммунной системы. Антитела, например, состоят из белка, используемого иммунной системой.
Как гены кодируют белки?
Геном человека можно представить как одну длинную цепочку ДНК, разделенную на 46 частей, называемых хромосомами. В каждой хромосоме тысячи генов. Последовательность ДНК, из которой состоит ген, похожа на программный код, который указывает клетке, как производить белки.
Четыре типа оснований составляют цепь ДНК: аденин (А), цитозин (С), гуанин (G) и тимин (Т). Каждая основа имеет дополнение — другую основу, с которой она обычно сочетается. A соединяется с T, а C с G. В целом геном человека имеет длину 3 миллиарда пар оснований.
Три последовательных основания в цепи ДНК, называемые кодоном, могут действовать как инструкция для клетки по выбору определенного типа аминокислоты.
 В организме человека существует более 1000 известных типов ферментов.
В организме человека существует более 1000 известных типов ферментов.