АСД-2Ф, 100мл (Армавирская БФ)
АСД-2Ф — относится к препаратам, регулирующим метаболические процессы.
Антисептик-стимулятор Дорогова фракции 2 обладает широким спектром биологической активности, стимулирует моторную деятельность желудочно-кишечного тракта, секрецию пищеварительных желез, повышает активность пищеварительных ферментов, способствует улучшению процессов пищеварения и усвоения питательных веществ, повышает активность тканевых ферментов, включая транспортную Na+ и К+-АТФазы, рибонуклеазу, щелочную фосфатазу, участвующих в активном транспорте ионов и питательных веществ через клеточные мембраны, в процессах фосфорилирования, а также синтеза белковых веществ. В результате этого улучшается трофика тканей, повышается уровень обменных процессов и факторов естественной резистентности организма.
При наружном применении АСД-2Ф оказывает антисептическое и противовоспалительное действие, стимулирует активность ретикулоэндотелиальной системы, нормализует трофику и ускоряет регенерацию поврежденных тканей.
При диспепсии, гастроэнтероколитах, гастроэнтеритах, а также дистрофических состояниях, вызванных расстройствами пищеварения и нарушениями обмена веществ, АСД-2Ф назначают животным пероралыю один раз в сутки, но не более 15 дней.
При тимпании крупного рогатого скота АСД-2Ф выпаивают из бутылки или вводят в рубец через желудочный зонд один-два раза в сутки, но не более 3 дней.
Лошадям при метеоризме кишечника АСД-2Ф выпаивают или вводят через желудочный зонд однократно. При необходимости лечение повторяют.
В комплексной терапии катаральной пневмонии, диспепсии, гастроэнтероколитов, гастроэнтеритов поросятам препарат применяют один раз в день до кормления.
Для стимуляции центральной и вегетативной нервной системы, повышения резистентности у переболевших инфекционными и инвазионными болезнями животных, ускорения процессов заживления кожных покровов при некробактериозе, экземах, дерматитах, трофических язвах препарат АСД-2Ф применяют один раз в сутки в течение 21 дня.
В целях повышения устойчивости организма к неблагоприятным факторам окружающей среды, увеличения привесов и снижения смертности АСД-2Ф назначают поросятам индивидуально в смеси с комбикормом из расчета 0,1 мл препарата на 1 кг массы животного с 7-дневного до 2-месячного возраста; телятам — выпаивают с молоком или водой для поения из расчета 0,1 мл препарата на 1 кг массы животного через день в течение 1-2 месяцев.
Наружно, внутриматочно, интравагинально АСД-2Ф применяют в виде 2-20% растворов, приготовленных в асептических условиях с использованием стерильного физиологического раствора. При приготовлении лечебного раствора требуемой концентрации, исходный стерильный раствор антисептика-стимулятора Дорогова фракции 2 принимают за 100%.
Инфицированные вялозаживающие раны промывают 15-20% раствором АСД-2Ф, после этого накладывают смоченную этим раствором повязку.
При наличии свищей, вскрытых полостей абсцессов, флегмон в их полость вводят марлевый дренаж, смоченный раствором препарата, и сверху, накладывают стерильную повязку.
 Дренаж меняют ежедневно до образования грануляционного вала.
Дренаж меняют ежедневно до образования грануляционного вала.При мыте лошадей при наличии абсцессов в подчелюстном пространстве и на других частях тела после предварительного туалета, полости абсцессов промывают 15-20% раствором АСД-2Ф или вводят в них пропитанные раствором тампоны, один раз в день в течение 7-9 дней до очищения раны от экссудата и появления грануляции.
Коровам при вагинитах и задержании последа (после его удаления) применяют 3-5% водный раствор АСД-2Ф, подогретый до 40°С, которым промывают влагалище один раз в сутки и течение 4-5 дней, с нормой расхода 1,5-2 л на каждую процедуру. Если шейка матки открыта, внутриматочно вводят 200-300 мл раствора и сразу же его удаляют, используя катетер с обратным током жидкости.
При острых и хронических эндометритах, миометрите и пиометрите, если шейка матки открыта, в полость матки вводят 200-300 мл 15% водного раствора АСД-2Ф, подогретого до 40°С и сразу же его удаляют, используя катетер с обратным током жидкости. Обработку проводят один раз в сутки в течение 4-5 дней.
В комплексной терапии трихомонозов коровам вводят во влагалище 200-300 мл 20% водного раствора АСД-2Ф с помощью шприца Жанэ с резиновой трубкой и специального катетера, имеющего на конечной части большое количество отверстий. Обработки проводят один раз в сутки в течение 5-7 дней.
Быкам при острой форме трихомоноза препуциальный мешок промывают 0,5-1,0 л 2-3% водного раствора АСД-2Ф, который вводят с помощью катетера, соединенного резиновой трубкой с кружкой Эсмарха. После этого наружное отверстие препуциального мешка зажимают рукой на 3-5 минут и проводят легкий массаж. Обработки проводят один раз в сутки в течение 5-7 дней.
АСД-2Ф — лекарственный препарат, предназначенный для применения сельскохозяйственным животным, включая птиц, и собакам с лечебной и профилактической целью при болезнях желудочно-кишечного тракта, органов дыхания, мочеполовой системы, поражениях кожных покровов, нарушениях обмена веществ различной этиологии, для стимуляции деятельности центральной и вегетативной нервной системы, повышения естественной резистентности у ослабленных и переболевших инфекционными и инвазионными болезнями животных, для стимуляции роста и развития молодняка поросят и цыплят, а также повышения яйценоскости кур.
| Действующие вещества | антисептик-стимулятор |
| Для кого | козы, крупный рогатый скот, птица, свиньи |
| Лекарственная форма | раствор |
| Страна производства | РОССИЯ |
Ваше имя
Ваш отзыв
Примечание: HTML разметка не поддерживается! Используйте обычный текст.
Рейтинг Плохо Хорошо
АСД-2Ф антисептик-стимулятор Дорогова, 20 мл АВЗ
- Производитель:
- Агроветзащита, Россия
- Единица:
- флакон
Цена розн:
0. 00 ₽
00 ₽
АСД-2Ф антисептик-стимулятор Дорогова, 20 мл АВЗ, инструкция
Состав
Содержит в своем составе карбоновые кислоты, алифатические углеводороды, амины и амиды, алкилбензолы и замещенные фенолы, соединения с активной сульфгидрильной группой и др., а также воду.
Свойства
При пероральном применении оказывает активизирующее действие на центральную и вегетативную нервную системы, стимулирует моторную деятельность желудочно-кишечного тракта, секрецию пищеварительных желез, повышает активность пищеварительных и тканевых ферментов, улучшает проникновение ионов Nа+ и К+ через клеточные мембраны, способствует нормализации процессов пищеварения, усвоения питательных веществ и повышению естественной резистентности организма.
При наружном применении препарат стимулирует активность ретикулоэндотелиальной системы, нормализует трофику, и ускоряет регенерацию поврежденных тканей, обладает выраженным антисептическим и противовоспалительным действием.
Показания
«Антисептик-стимулятор Дорогова фракция 2» («АСД-2Ф») назначают сельскохозяйственным животным, птице и плотоядным животным для профилактики и лечения болезней желудочно-кишечного тракта, органов дыхания, мочеполовой системы, при поражениях кожных покровов, нарушениях обмена веществ, для стимуляции деятельности центральной и вегетативной нервной системы, повышения естественной резистентности у ослабленных и переболевших инфекционными и инвазионными болезнями, а также для стимуляции роста и развития молодняка сельскохозяйственных животных и птицы.
Дозировка и способ применения
Внутрь «АСД-2Ф» назначают животным с питьевой водой перед кормлением.
Наружно «АСД-2Ф» применяют в виде 15–20% растворов, приготовленных на стерильном физиологическом растворе или кипяченой воде. При приготовлении лечебного раствора требуемой концентрации исходный стерильный раствор «АСД-2Ф» принимают за 100%.
Коровам. При вагинитах и задержании последа (после его удаления) применяют 3-5% раствор «АСД-2Ф», подогретый до 40°С, которым промывают влагалище один раз в сутки в течение 4-5 дней, расходуя по 1,5-2 л раствора на каждую обработку.
 Лечение проводят один раз в сутки в течение 5-7 дней.
При тимпании крупного рогатого скота препарат «АСД-2Ф» выпаивают животному или вводят в рубец через желудочный зонд один-два раза в сутки в разовой дозе, указанной в таблице 1, но не более 3 дней. В процессе лечения назначают теплые клизмы, массаж рубца и другие процедуры, предусмотренные при указанной патологии.
В целях повышения устойчивости организма к неблагоприятным факторам окружающей среды, увеличения привесов и снижения смертности, «АСД-2Ф» телятам – выпаивают с молоком или водой для поения из расчета 0,1 мл «АСД-2Ф» на 1 кг массы животного через день в течение 1–2 месяцев.
Поросятам назначают препарат индивидуально в смеси с комбикормом из расчета 0,1 мл «АСД-2Ф» на 1 кг массы животного с 7-дневного до 2-месячного возраста;
При катаральной пневмонии, диспепсии, гастроэнтероколитах, гастроэнтеритах наряду с этиотропным лечением «АСД-2Ф» назначают поросятам один раз в день с питьевой водой за 30-40 минут до кормления, в дозах, указанных в таблице 1.
Лечение проводят один раз в сутки в течение 5-7 дней.
При тимпании крупного рогатого скота препарат «АСД-2Ф» выпаивают животному или вводят в рубец через желудочный зонд один-два раза в сутки в разовой дозе, указанной в таблице 1, но не более 3 дней. В процессе лечения назначают теплые клизмы, массаж рубца и другие процедуры, предусмотренные при указанной патологии.
В целях повышения устойчивости организма к неблагоприятным факторам окружающей среды, увеличения привесов и снижения смертности, «АСД-2Ф» телятам – выпаивают с молоком или водой для поения из расчета 0,1 мл «АСД-2Ф» на 1 кг массы животного через день в течение 1–2 месяцев.
Поросятам назначают препарат индивидуально в смеси с комбикормом из расчета 0,1 мл «АСД-2Ф» на 1 кг массы животного с 7-дневного до 2-месячного возраста;
При катаральной пневмонии, диспепсии, гастроэнтероколитах, гастроэнтеритах наряду с этиотропным лечением «АСД-2Ф» назначают поросятам один раз в день с питьевой водой за 30-40 минут до кормления, в дозах, указанных в таблице 1.
 Лечение проводят курсами по 5 дней с интервалом З дня до выздоровления.
Лечение проводят курсами по 5 дней с интервалом З дня до выздоровления.Форма выпуска
Стеклянный флакон 20 мл, стеклянный флакон 100 мл. Внешняя упаковка – картонная коробка. Флакон 1 л.
АСД-2Ф антисептик-стимулятор Дорогова, 20 мл АВЗ отзывы
Пока нет отзывов…
АСД-2Ф антисептик-стимулятор Дорогова, 20 мл АВЗВнешний вид товара может отличаться от изображенного на фотографии
Наши партнеры
ООО «ТД «Гама-Маркет»
г.Москва, ул. Гамалеи д.18, тел. 8(800) 700-12-10
г.Краснодар, ул. Сормовская, д.4, тел. 8(861) 205-43-90
Получить коммерческое предложение:
Мы осуществляем поддержку наших клиентов в области применения лекарственных средств для ветеринарного применения.
Как нас найти в Москве
Как нас найти в Краснодаре
Часы работы:
Мы работаем с понедельника по пятницу с 8 до 18 часов (МСК)
Вся представленная на сайте информация, касающаяся стоимости товаров, наличия на складе, характеристик товаров, носит информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437(2) Гражданского кодекса Российской Федерации.
Для улучшения работы сайта и его взаимодействия с пользователями мы используем файлы cookie.
Астроциты, полученные от людей с РАС, изменяют поведение и дестабилизируют активность нейронов посредством аберрантной передачи сигналов Ca2+
1. de la Torre-Ubieta L, Won H, Stein JL, Geschwind DH. Продвижение понимания механизмов болезни аутизма с помощью генетики. Нат Мед. 2016;22:345–61. doi: 10.1038/nm.4071. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Chaste P, Leboyer M. Факторы риска аутизма: гены, окружающая среда и взаимодействие генов и окружающей среды. Диалоги Clin Neurosci. 2012; 14: 281–9.2. doi: 10.31887/DCNS.2012.14.3/пчасть. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Константино Дж. Н., Тодд Р. Д. Аутичные черты среди населения в целом: исследование близнецов. Арх генерал психиатрия. 2003; 60: 524–30. doi: 10.1001/archpsyc. 60.5.524. [PubMed] [CrossRef] [Google Scholar]
60.5.524. [PubMed] [CrossRef] [Google Scholar]
4. Рональд А., Хаппе Ф., Прайс Т.С., Барон-Коэн С., Пломин Р. Фенотипическое и генетическое совпадение между аутистическими чертами у крайних групп населения. J Am Acad Детская подростковая психиатрия. 2006; 45:1206–14. дои: 10.1097/01.чи.0000230165.54117.41. [PubMed] [CrossRef] [Google Scholar]
5. Betancur C, Sakurai T, Buxbaum JD. Новая роль путей синаптической клеточной адгезии в патогенезе расстройств аутистического спектра. Тренды Нейроси. 2009; 32: 402–12. doi: 10.1016/j.tins.2009.04.003. [PubMed] [CrossRef] [Google Scholar]
6. Satterstrom FK, Kosmicki JA, Wang JB, Breen MS, De Rubeis S, An JY, et al. Крупномасштабное исследование секвенирования экзома выявило как изменения в развитии, так и функциональные изменения в нейробиологии аутизма. Клетка. 2020;180:568. doi: 10.1016/j.cell.2019.12.036. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Berger JM, Rohn TT, Oxford JT. Аутизм как раннее закрытие нейропластического критического периода обычно наблюдается в подростковом возрасте. Биол Сист Открытый доступ. 2013;1. 10.4172/2329-6577.1000118. [Бесплатная статья PMC] [PubMed]
Биол Сист Открытый доступ. 2013;1. 10.4172/2329-6577.1000118. [Бесплатная статья PMC] [PubMed]
8. Сигаард Р.К., Кьяер М., Паккенберг Б. Развитие клеточной популяции в белом веществе головного мозга детей раннего возраста. Кора головного мозга. 2016;26:89–95. doi: 10.1093/cercor/bhu178. [PubMed] [CrossRef] [Академия Google]
9. Bushong EA, Martone ME, Jones YZ, Ellisman MH. Протоплазматические астроциты в лучистом слое СА1 занимают отдельные анатомические домены. Дж. Нейроски. 2002; 22:183–92. doi: 10.1523/JNEUROSCI.22-01-00183.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Halassa MM, Fellin T, Takano H, Dong JH, Haydon PG. Синаптические островки определяются территорией одного астроцита. Дж. Нейроски. 2007; 27:6473–7. doi: 10.1523/JNEUROSCI.1419-07.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Oberheim NA, Takano T, Han X, He W, Lin JH, Wang F, et al. Уникальные гоминидные черты астроцитов взрослого человека. Дж. Нейроски. 2009;29:3276–87. doi: 10.1523/JNEUROSCI.4707-08.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Нейроски. 2009;29:3276–87. doi: 10.1523/JNEUROSCI.4707-08.2009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Молофский А.В., Кренчик Р., Уллиан Э.М., Цай Х.Х., Денин Б., Ричардсон В.Д. и соавт. Астроциты и болезни: перспектива развития нервной системы. Гены Дев. 2012;26:891–907. doi: 10.1101/gad.188326.112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Пфригер Ф.В., Баррес Б.А. Синаптическая эффективность усиливается глиальными клетками in vitro. Наука. 1997; 277:1684–7. doi: 10.1126/science.277.5332.1684. [PubMed] [CrossRef] [Google Scholar]
14. Уллиан Э.М., Сапперштейн С.К., Кристоферсон К.С., Баррес Б.А. Контроль количества синапсов с помощью глии. Наука. 2001; 291: 657–61. doi: 10.1126/science.291.5504.657. [PubMed] [CrossRef] [Google Scholar]
15. Allen M, Ghosh S, Ahern GP, Villapol S, Maguire-Zeiss KA, Conant K. Пластичность, индуцированная протеазами: матриксная металлопротеиназа-1 способствует нейроструктурным изменениям за счет активации активированной протеазы. рецептор 1. Научный доклад 2016; 6: 35497. doi: 10.1038/srep35497. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
рецептор 1. Научный доклад 2016; 6: 35497. doi: 10.1038/srep35497. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Allen NJ, Bennett ML, Foo LC, Wang GX, Chakraborty C, Smith SJ, et al. Астроциты glypicans 4 и 6 способствуют образованию возбуждающих синапсов через GluA1 AMPA-рецепторы. Природа. 2012; 486:410–4. doi: 10.1038/nature11059. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Christopherson KS, Ullian EM, Stokes CC, Mullowney CE, Hell JW, Agah A, et al. Тромбоспондины представляют собой секретируемые астроцитами белки, которые способствуют синаптогенезу в ЦНС. Клетка. 2005; 120:421–33. doi: 10.1016/j.cell.2004.12.020. [PubMed] [CrossRef] [Академия Google]
18. Hamilton NB, Attwell D. Действительно ли астроциты экзоцитируют нейротрансмиттеры? Нат Рев Нейроски. 2010; 11: 227–38. doi: 10.1038/nrn2803. [PubMed] [CrossRef] [Google Scholar]
19. Chung WS, Allen NJ, Eroglu C. Астроциты контролируют образование, функцию и устранение синапсов. Колд Спринг Харб Перспект Биол. 2015;7:a020370. doi: 10.1101/cshperspect.a020370. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Колд Спринг Харб Перспект Биол. 2015;7:a020370. doi: 10.1101/cshperspect.a020370. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Rothstein JD, Dykes-Hoberg M, Pardo CA, Bristol LA, Jin L, Kuncl RW, et al. Нокаут транспортеров глутамата показывает основную роль астроглиального транспорта в эксайтотоксичности и клиренсе глутамата. Нейрон. 1996;16:675–86. doi: 10.1016/S0896-6273(00)80086-0. [PubMed] [CrossRef] [Google Scholar]
21. Haydon PG, Nedergaard M. Как астроциты участвуют в пластичности нейронов? Колд Спринг Харб Перспект Биол. 2015;7:a020438. [Бесплатная статья PMC] [PubMed]
22. Luscher C, Malenka RC. NMDA-рецептор-зависимая долговременная потенциация и длительная депрессия (LTP/LTD). Колд Спринг Харб Перспект Биол. 2012;4:a005710. [Бесплатная статья PMC] [PubMed]
23. Ballas N, Lioy DT, Grunseich C, Mandel G. Неклеточное автономное влияние MeCP2-дефицитной глии на морфологию дендритов нейронов. Нат Нейроски. 2009 г.;12:311–7. doi: 10.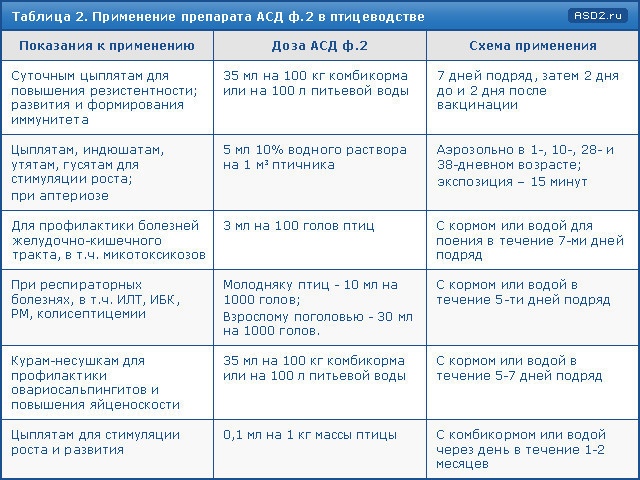 1038/nn.2275. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1038/nn.2275. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Jacobs S, Doering LC. Астроциты предотвращают аномальное развитие нейронов у хрупких мышей x. Дж. Нейроски. 2010;30:4508–14. doi: 10.1523/JNEUROSCI.5027-09.2010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Gupta S, Ellis SE, Ashar FN, Moes A, Bader JS, Zhan J, et al. Анализ транскриптома выявляет нарушение регуляции генов врожденного иммунного ответа и генов, зависящих от активности нейронов, при аутизме. Нац коммун. 2014;5:5748. doi: 10.1038/ncomms6748. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Эдмонсон С., Зиац М.Н., Реннерт О.М. Изменена экспрессия глиальных маркеров в посмертной аутистической префронтальной коре и мозжечке. Мол Аутизм. 2014;5:3. doi: 10.1186/2040-2392-5-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Vargas DL, Nascimbene C, Krishnan C, Zimmerman AW, Pardo CA. Нейроглиальная активация и нейровоспаление в головном мозге пациентов с аутизмом. Энн Нейрол. 2005; 57: 67–81. doi: 10.1002/ana.20315. [PubMed] [CrossRef] [Академия Google]
Энн Нейрол. 2005; 57: 67–81. doi: 10.1002/ana.20315. [PubMed] [CrossRef] [Академия Google]
28. Russo FB, Freitas BC, Pignatari GC, Fernandes IR, Sebat J, Muotri AR, et al. Моделирование взаимодействия между нейронами и астроцитами при аутизме с использованием индуцированных человеком плюрипотентных стволовых клеток. Биол психиат. 2018; 83: 569–78. doi: 10.1016/j.biopsych.2017.09.021. [PubMed] [CrossRef] [Google Scholar]
29. Lancaster MA, Knoblich JA. Генерация церебральных органоидов из плюрипотентных стволовых клеток человека. Нат Проток. 2014;9:2329–40. doi: 10.1038/nprot.2014.158. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, et al. Церебральные органоиды моделируют развитие человеческого мозга и микроцефалию. Природа. 2013;501:373–9. doi: 10.1038/nature12517. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Renner M, Lancaster MA, Bian S, Choi H, Ku T, Peer A, et al. Самоорганизованное формирование паттернов развития и дифференцировка церебральных органоидов. EMBO J. 2017; 36:1316–29. doi: 10.15252/embj.201694700. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Самоорганизованное формирование паттернов развития и дифференцировка церебральных органоидов. EMBO J. 2017; 36:1316–29. doi: 10.15252/embj.201694700. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Hasel P, Dando O, Jiwaji Z, Baxter P, Todd AC, Heron S, et al. Исправление автора: Нейроны и активность нейронов контролируют экспрессию генов в астроцитах, чтобы регулировать их развитие и метаболизм. Нац коммун. 2018;9:16176. doi: 10.1038/ncomms16176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Tcw J, Wang M, Pimenova AA, Bowles KR, Hartley BJ, Lacin E, et al. Эффективная платформа для дифференцировки астроцитов из индуцированных человеком плюрипотентных стволовых клеток. Представитель стволовых клеток, 2017; 9: 600–14. doi: 10.1016/j.stemcr.2017.06.018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Cheng Z, Teo G, Krueger S, Rock TM, Koh HW, Choi H, et al. Дифференциальная динамика экспрессии мРНК и белка млекопитающих в ответ на стресс неправильной укладки. Мол Сист Биол. 2016;12:855. doi: 10.15252/msb.20156423. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мол Сист Биол. 2016;12:855. doi: 10.15252/msb.20156423. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Dezonne RS, Sartore RC, Nascimento JM, Saia-Cereda VM, Romao LF, Alves-Leon SV, et al. Получение функциональных астроцитов человека из церебральных органоидов. Научный представитель 2017; 7: 45091. doi: 10.1038/srep45091. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Li QY, Cheng ZL, Zhou L, Darmanis S, Neff NF, Okamoto J, et al. Гетерогенность развития микроглии и миелоидных клеток головного мозга, выявленная с помощью глубокого секвенирования одноклеточной РНК. Нейрон. 2019;101:207. doi: 10.1016/j.neuron.2018.12.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Moda-Sava RN, Murdock MH, Parekh PK, Fetcho RN, Huang BS, Huynh TN, et al. Устойчивое восстановление дисфункции префронтальной цепи за счет образования позвоночника, вызванного антидепрессантами. Наука. 2019;364:eaat8078. [Бесплатная статья PMC] [PubMed]
38. Windrem MS, Schanz SJ, Guo M, Tian GF, Washco V, Stanwood N, et al. Неонатальная химеризация с человеческими глиальными клетками-предшественниками может как ремиелинизировать, так и спасать в противном случае летально гипомиелинизированную дрожащую мышь. Клеточная стволовая клетка. 2008; 2: 553–65. doi: 10.1016/j.stem.2008.03.020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Windrem MS, Schanz SJ, Guo M, Tian GF, Washco V, Stanwood N, et al. Неонатальная химеризация с человеческими глиальными клетками-предшественниками может как ремиелинизировать, так и спасать в противном случае летально гипомиелинизированную дрожащую мышь. Клеточная стволовая клетка. 2008; 2: 553–65. doi: 10.1016/j.stem.2008.03.020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Kenney LL, Shultz LD, Greiner DL, Brehm MA. Гуманизированные мышиные модели для трансплантационной иммунологии. Am J Транспл. 2016;16:389–97. doi: 10.1111/ajt.13520. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Martin A, Valentine M, Unger P, Yeung SW, Shultz LD, Davies TF. Приживление человеческих лимфоцитов и ткани щитовидной железы мышам с дефицитом scid и rag2: отсутствие прогрессирования лимфоцитарной инфильтрации. J Clin Endocrinol Metab. 1994; 79: 716–23. [PubMed] [Google Scholar]
41. Han X, Chen M, Wang F, Windrem M, Wang S, Shanz S, et al. Приживление переднего мозга глиальными клетками-предшественниками человека повышает синаптическую пластичность и способность к обучению у взрослых мышей. Клеточная стволовая клетка. 2013;12:342–53. doi: 10.1016/j.stem.2012.12.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Клеточная стволовая клетка. 2013;12:342–53. doi: 10.1016/j.stem.2012.12.015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Ю ХЗ, Нагай Ж, Хах БС. Усовершенствованные инструменты для изучения астроцитов. Нат Рев Нейроски. 2020; 21: 121–38. doi: 10.1038/s41583-020-0264-8. [PubMed] [CrossRef] [Google Scholar]
43. Шринивасан Р., Хуанг Б.С., Венугопал С., Джонстон А.Д., Чай Х., Цзэн Х.К. и др. Передача сигналов Ca2+ в астроцитах мышей Ip3r2(-/-) в срезах головного мозга и во время реакции испуга in vivo. Нат Нейроски. 2015;18:708. doi: 10.1038/nn.4001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Dawson G, Webb S, Schellenberg GD, Dager S, Friedman S, Aylward E, et al. Определение более широкого фенотипа аутизма: генетические, мозговые и поведенческие аспекты. Дев психопат. 2002; 14: 581–611. дои: 10.1017/S0954579402003103. [PubMed] [CrossRef] [Google Scholar]
45. Geurts HM, Verte S, Oosterlaan J, Roeyers H, Sergeant JA. Насколько специфичен дефицит управляющих функций при синдроме дефицита внимания с гиперактивностью и аутизме? J Детская психологическая психиатрия. 2004; 45: 836–54. doi: 10.1111/j.1469-7610.2004.00276.x. [PubMed] [CrossRef] [Google Scholar]
Насколько специфичен дефицит управляющих функций при синдроме дефицита внимания с гиперактивностью и аутизме? J Детская психологическая психиатрия. 2004; 45: 836–54. doi: 10.1111/j.1469-7610.2004.00276.x. [PubMed] [CrossRef] [Google Scholar]
46. Hill EL. Исполнительная дисфункция при аутизме. Тенденции Cogn Sci. 2004; 8: 26–32. doi: 10.1016/j.tics.2003.11.003. [PubMed] [CrossRef] [Академия Google]
47. О’Хирн К., Асато М., Ордаз С., Луна Б. Нейроразвитие и исполнительная функция при аутизме. Дев психопат. 2008; 20:1103–32. doi: 10.1017/S0954579408000527. [PubMed] [CrossRef] [Google Scholar]
48. Озонофф С., Пеннингтон Б.Ф., Роджерс С.Дж. Дефицит исполнительной функции у высокофункциональных аутистов: связь с теорией разума. J Детская психологическая психиатрия. 1991; 32: 1081–105. doi: 10.1111/j.1469-7610.1991.tb00351.x. [PubMed] [CrossRef] [Академия Google]
49. Quaak I, Brouns MR, Van de Bor M. Динамика расстройств аутистического спектра: как взаимодействуют нейротоксичные соединения и нейротрансмиттеры. Общественное здравоохранение Int J Environ Res. 2013;10:3384–408. doi: 10.3390/ijerph20083384. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Общественное здравоохранение Int J Environ Res. 2013;10:3384–408. doi: 10.3390/ijerph20083384. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Робинсон С., Годдард Л., Дритшель Б., Уисли М., Хоулин П. Исполнительные функции у детей с расстройствами аутистического спектра. Познание мозга 2009; 71: 362–8. doi: 10.1016/j.bandc.2009.06.007. [PubMed] [CrossRef] [Академия Google]
51. Барон-Коэн С., Ринг Х.А., Буллмор Э.Т., Уилрайт С., Эшвин С., Уильямс С.Р. Миндалевидная теория аутизма. Neurosci Biobehav R. 2000;24:355–64. doi: 10.1016/S0149-7634(00)00011-7. [PubMed] [CrossRef] [Google Scholar]
52. Саут М., Ларсон М.Дж., Уайт С.Е., Дана Дж., Кроули М.Дж. Лучшее обусловливание страха связано с уменьшением тяжести симптомов при расстройствах аутистического спектра. Аутизм рез. 2011;4:412–21. doi: 10.1002/aur.221. [PubMed] [CrossRef] [Google Scholar]
53. Верлинг Д.М., Гешвинд Д.Х. Половые различия в расстройствах аутистического спектра. Карр Опин Нейрол. 2013;26:146–53. дои: 10.1097/WCO.0b013e32835ee548. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2013;26:146–53. дои: 10.1097/WCO.0b013e32835ee548. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Poo MM, Pignatelli M, Ryan TJ, Tonegawa S, Bonhoeffer T, Martin KC, et al. Что такое память? Текущее состояние инграммы. БМС Биол. 2016;14:40. [Бесплатная статья PMC] [PubMed]
55. Чанг Л.И., Бей А.Л., Цзян Ю.Х. Синаптическая пластичность в мышиных моделях расстройств аутистического спектра. Корейский J Physiol Pha. 2012;16:369–78. doi: 10.4196/kjpp.2012.16.6.369. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Парпура В., Басарский Т.А., Лю Ф., Джефтиния К., Джефтиния С., Хейдон П.Г. Глутамат-опосредованная передача сигналов астроцитов-нейронов. Природа. 1994; 369: 744–7. doi: 10.1038/369744a0. [PubMed] [CrossRef] [Google Scholar]
57. Navarrete M, Perea G, Fernandez de Sevilla D, Gomez-Gonzalo M, Nunez A, Martin ED, et al. Астроциты опосредуют in vivo холинергически-индуцированную синаптическую пластичность. PLoS биол. 2012;10:e1001259. doi: 10.1371/journal.pbio.1001259. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1371/journal.pbio.1001259. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Nedergaard M. Прямая передача сигналов от астроцитов к нейронам в культурах клеток головного мозга млекопитающих. Наука. 1994; 263:1768–71. doi: 10.1126/science.8134839. [PubMed] [CrossRef] [Google Scholar]
59. Хеннебергер С., Папуин Т., Олиет С.Х., Русаков Д.А. Длительное потенцирование зависит от высвобождения D-серина из астроцитов. Природа. 2010; 463: 232–6. doi: 10.1038/nature08673. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Адамский А., Кол А., Крайзель Т., Дорон А., Озери-Энгельхард Н., Мельцер Т. и соавт. Активация астроцитов вызывает потенциацию нейронов de novo и улучшение памяти. Клетка. 2018;174:59–71.e14. doi: 10.1016/j.cell.2018.05.002. [PubMed] [CrossRef] [Google Scholar]
61. Frey U, Huang YY, Kandel ER. Эффекты цАМФ имитируют позднюю стадию LTP в нейронах CA1 гиппокампа. Наука. 1993; 260:1661–4. doi: 10.1126/science. 8389057. [PubMed] [CrossRef] [Google Scholar]
8389057. [PubMed] [CrossRef] [Google Scholar]
62. Boland RJ. Руководство DSM-5 (R): незаменимый помощник в руководстве по диагностике и статистике психических расстройств. Амерский психиатрический паб; 5-е изд. Вашингтон, округ Колумбия, Лондон, Англия, 2015 г.
63. Dhamne SC, Silverman JL, Super CE, Lammers SHT, Hameed MQ, Modi ME, et al. Воспроизводимые in vivo физиологические и поведенческие фенотипы мышиной модели аутизма с нулевой мутацией Shank3B. Мол Аутизм. 2017;8:26. doi: 10.1186/s13229-017-0142-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Santini E, Huynh TN, MacAskill AF, Carter AG, Pierre P, Ruggero D, et al. Преувеличенный перевод вызывает синаптические и поведенческие аберрации, связанные с аутизмом. Природа. 2013;493: 411–5. doi: 10.1038/nature11782. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Moy SS, Nadler JJ, Perez A, Barbaro RP, Johns JM, Magnuson TR, et al. Общительность и предпочтение социальной новизне у пяти инбредных штаммов: подход к оценке аутистического поведения у мышей. Гены Мозг Поведение. 2004; 3: 287–302. doi: 10.1111/j.1601-1848.2004.00076.x. [PubMed] [CrossRef] [Google Scholar]
Гены Мозг Поведение. 2004; 3: 287–302. doi: 10.1111/j.1601-1848.2004.00076.x. [PubMed] [CrossRef] [Google Scholar]
66. Wang IT, Allen M, Goffin D, Zhu X, Fairless AH, Brodkin ES, et al. Потеря CDKL5 нарушает профиль кинома и потенциалы, связанные с событиями, что приводит к аутоподобному фенотипу у мышей. Proc Natl Acad Sci USA. 2012;109: 21516–21. doi: 10.1073/pnas.1216988110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Winship IR, Plaa N, Murphy TH. Быстрые кальциевые сигналы астроцитов коррелируют с активностью нейронов и началом гемодинамического ответа in vivo. Дж. Нейроски. 2007; 27: 6268–72. doi: 10.1523/JNEUROSCI.4801-06.2007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Гм JW. Роль глиальных клеток в формировании тормозных синапсов и нервных цепей. Фронт Мол Невроски. 2017;10:381. дои: 10.3389/фнмол.2017.00381. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Bazargani N, Attwell D. Передача сигналов кальция астроцитами: третья волна. Нат Нейроски. 2016;19:182–9. doi: 10.1038/nn.4201. [PubMed] [CrossRef] [Google Scholar]
Нат Нейроски. 2016;19:182–9. doi: 10.1038/nn.4201. [PubMed] [CrossRef] [Google Scholar]
70. Glaum SR, Holzwarth JA, Miller RJ. Глутаматные рецепторы активируют мобилизацию Са2+ и приток Са2+ в астроциты. Proc Natl Acad Sci USA. 1990; 87: 3454–8. doi: 10.1073/pnas.87.9.3454. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Биллапс Д., Биллапс Б., Чаллисс Р.А., Нахорски С.Р. Модуляция инозитолтрифосфата, связанного с белком Gq, и передача сигналов Ca2+ мембранным потенциалом. Дж. Нейроски. 2006; 26:9983–95. doi: 10.1523/JNEUROSCI.2773-06.2006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Петравич Дж., Фиакко Т.А., Маккарти К.Д. Потеря зависимого от рецептора IP3 увеличения количества Ca2+ в астроцитах гиппокампа не влияет на исходную синаптическую активность пирамидных нейронов CA1. Дж. Нейроски. 2008;28:4967–73. doi: 10.1523/JNEUROSCI.5572-07.2008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Pascual O, Casper KB, Kubera C, Zhang J, Revilla-Sanchez R, Sul JY, et al. Астроцитарная пуринергическая передача сигналов координирует синаптические сети. Наука. 2005; 310:113–6. doi: 10.1126/science.1116916. [PubMed] [CrossRef] [Google Scholar]
Астроцитарная пуринергическая передача сигналов координирует синаптические сети. Наука. 2005; 310:113–6. doi: 10.1126/science.1116916. [PubMed] [CrossRef] [Google Scholar]
74. Auerbach BD, Osterweil EK, Bear MF. Мутации, вызывающие синдромальный аутизм, определяют ось синаптической патофизиологии. Природа. 2011; 480:63–68. doi: 10.1038/nature10658. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Буржерон Т. От генетической архитектуры к синаптической пластичности при расстройствах аутистического спектра. Нат Рев Нейроски. 2015; 16: 551–63. doi: 10.1038/nrn3992. [PubMed] [CrossRef] [Google Scholar]
76. Gladysz D, Krzywdzinska A, Hozyasz KK. Иммунные аномалии при расстройствах аутистического спектра — могут ли они быть перспективными для этиотропного лечения? Мол Нейробиол. 2018;55:6387–435. doi: 10.1007/s12035-017-0822-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. DiStasio MM, Nagakura I, Nadler MJ, Anderson MP. Т-лимфоциты и пузырьки цитотоксических астроцитов коррелируют в мозге при аутизме. Энн Нейрол. 2019;86:885–98. doi: 10.1002/ana.25610. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Энн Нейрол. 2019;86:885–98. doi: 10.1002/ana.25610. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Мельцер А., Ван де Уотер Дж. Роль иммунной системы в расстройствах аутистического спектра. Нейропсихофармакология. 2017;42:284–98. doi: 10.1038/npp.2016.158. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Davis G, Plaisted-Grant K. Низкий эндогенный нейронный шум при аутизме. Аутизм. 2015;19:351–62. doi: 10.1177/1362361314552198. [PubMed] [CrossRef] [Академия Google]
80. Хахами А., Берманн М., Малах Р. Идиосинкразический мозг: искажение спонтанных паттернов связи при расстройствах аутистического спектра. Нат Нейроски. 2015;18:302–9. doi: 10.1038/nn.3919. [PubMed] [CrossRef] [Google Scholar]
81. Clarke LE, Barres BA. Новые роли астроцитов в развитии нервной цепи. Нат Рев Нейроски. 2013;14:311–21. doi: 10.1038/nrn3484. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Hutsler JJ, Zhang H. Увеличение плотности дендритных шипов на проекционных нейронах коры при расстройствах аутистического спектра. Мозг Res. 2010;1309: 83–94. doi: 10.1016/j.brainres.2009.09.120. [PubMed] [CrossRef] [Google Scholar]
Мозг Res. 2010;1309: 83–94. doi: 10.1016/j.brainres.2009.09.120. [PubMed] [CrossRef] [Google Scholar]
83. Penzes P, Cahill ME, Jones KA, VanLeeuwen JE, Woolfrey KM. Дендритная патология позвоночника при нервно-психических расстройствах. Нат Нейроски. 2011;14:285–93. doi: 10.1038/nn.2741. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Tang G, Gudsnuk K, Kuo SH, Cotrina ML, Rosoklija G, Sosunov A, et al. Потеря mTOR-зависимой макроаутофагии вызывает аутоподобный дефицит сокращения синапсов. Нейрон. 2014;83:1131–43. doi: 10.1016/j.neuron.2014.07.040. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Келлехер Р.Дж., 3-й, Медведь М.Ф. Аутичный нейрон: затрудненный перевод? Клетка. 2008; 135:401–6. doi: 10.1016/j.cell.2008.10.017. [PubMed] [CrossRef] [Google Scholar]
86. Levy D, Ronemus M, Yamrom B, Lee YH, Leotta A, Kendall J, et al. Редкие de novo и передаваемые вариации числа копий при расстройствах аутистического спектра. Нейрон. 2011;70:886–97. doi: 10.1016/j.neuron.2011.05.015. [PubMed] [CrossRef] [Google Scholar]
Нейрон. 2011;70:886–97. doi: 10.1016/j.neuron.2011.05.015. [PubMed] [CrossRef] [Google Scholar]
87. Pinto D, Pagnamenta AT, Klei L, Anney R, Merico D, Regan R, et al. Функциональное влияние глобального изменения числа редких копий на расстройства аутистического спектра. Природа. 2010; 466: 368–72. дои: 10.1038/nature09146. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. De Rubeis S, He X, Goldberg AP, Poultney CS, Samocha K, Cicek AE, et al. Синаптические, транскрипционные и хроматиновые гены нарушены при аутизме. Природа. 2014;515:209–15. doi: 10.1038/nature13772. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Orefice LL, Mosko JR, Morency DT, Wells MF, Tasnim A, Mozeika SM, et al. Ориентация на периферические соматосенсорные нейроны для улучшения тактильных фенотипов в моделях РАС. Клетка. 2019;178:867–86 e824. doi: 10.1016/j.cell.2019.07.024. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Петравич Дж. , Фиакко Т.А., Маккарти К.Д. Потеря IP(3) рецептор-зависимого увеличения Ca(2+) в астроцитах гиппокампа не влияет на исходную синаптическую активность пирамидных нейронов CA1. Дж. Нейроски. 2008; 28:4967–73. doi: 10.1523/JNEUROSCI.5572-07.2008. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Фиакко Т.А., Маккарти К.Д. Потеря IP(3) рецептор-зависимого увеличения Ca(2+) в астроцитах гиппокампа не влияет на исходную синаптическую активность пирамидных нейронов CA1. Дж. Нейроски. 2008; 28:4967–73. doi: 10.1523/JNEUROSCI.5572-07.2008. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Хах Б.С., Софронев М.В. Разнообразие функций и фенотипов астроцитов в нейронных цепях. Нат Нейроски. 2015;18:942–52. doi: 10.1038/nn.4043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
92. Араке А., Карминьото Г., Хейдон П.Г., Олиет С.Х., Робитайл Р., Вольтерра А. Глиотрансмиттеры путешествуют во времени и пространстве. Нейрон. 2014; 81: 728–39. doi: 10.1016/j.neuron.2014.02.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Yang JH, Yang HB, Liu YL, Li X, Qin LM, Lou HF, et al. Астроциты способствуют элиминации синапсов посредством зависимого от инозитол-1,4,5-трифосфатного рецептора 2 типа высвобождения АТФ. Элиф. 2016;5:15043. 001–15043.023. [Бесплатная статья PMC] [PubMed]
001–15043.023. [Бесплатная статья PMC] [PubMed]
94. Chung WS, Clarke LE, Wang GX, Stafford BK, Sher A, Chakraborty C, et al. Астроциты опосредуют элиминацию синапсов посредством путей MEGF10 и MERTK. Природа. 2013; 504: 394–400. doi: 10.1038/nature12776. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Kuijlaars J, Oyelami T, Diels A, Rohrbacher J, Versweyveld S, Meneghello G, et al. Устойчивая синхронизированная активность нейронной сети в системе совместного культивирования астроцитов человека. Научный доклад 2016; 6: 1745–53. [Бесплатная статья PMC] [PubMed]
96. Lischka FW, Efthymiou A, Zhou Q, Nieves MD, McCormack NM, Wilkerson MD, et al. Неонатальные мышиные кортикальные, но не изогенные питающие слои астроцитов человека усиливают функциональное созревание индуцированных плюрипотентных нейронов, происходящих из стволовых клеток, в культуре. Глия. 2018;66:725–48. doi: 10.1002/glia.23278. [PubMed] [CrossRef] [Google Scholar]
РАС/АСС Расстройство аутистического спектра/состояние
Прокрутите до содержимого
Интерактивная панель
Учиться. Расти. Достигать. Процветать.
Расти. Достигать. Процветать.
Быстрый доступ
ДомСвязаться с нами
Найди нас
Начальная школа англиканской церкви Святой Марии, Yew Tree Road, Slough, England, SL1 2AR
Карты Гугл
Доска объявлений
- Информационный бюллетень 22 от 10 марта 2023 г. 13 марта 2023 г.
- Информационный бюллетень 21 3 марта 2023 г. 8 марта 2023 г.
- Информационный бюллетень 20 24 февраля 2023 г. 8 марта 2023 г.
Еще новости
Календарь
- В ближайшие 10 недель событий не будет.

Еще события
Награды
Награды
Твиттер
Больше твитов
Переводить
Посещаемость
- Питомник: 84%
- Прием: 93%
- 1 год: 93%
- 2 год: 91%
- 3 год: 94%
- 4 год: 93%
- 5 год: 92%
- 6 год: 96%
Что такое аутизм (часть 1)? | Написано аутичным человеком
Что такое аутизм (часть 1)?
Что с Ником?
Чтобы создать более инклюзивную среду в классе, посмотрите этот короткий анимационный видеоролик об аутизме.
