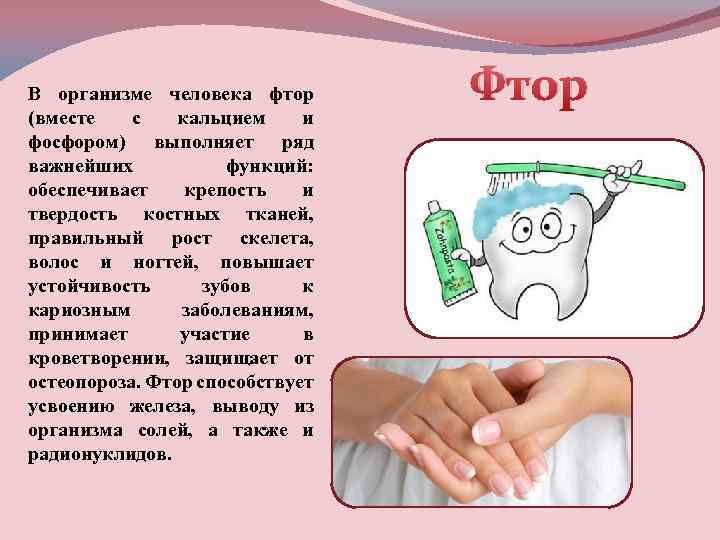
Вред и польза фтора для зубов
Красивая, белая улыбка, ровный ряд зубов лучше располагают к себе собеседника, привлекают взгляды. Всего этого невозможно добиться, если не следить за здоровьем зубов и полости рта. Современная медицина предлагает пациентам целый ряд услуг, позволяющих вернуть красоту зубов, в числе которых находится и фторирование.
Фтор – природное вещество, которое также содержится во многих компонентах, в том числе и в воде. Это средство активно добавляют в зубные пасты и различные средства для чистки полости рта и профилактики заболеваний.
В этой статье мы рассмотрим, что такое фторирование, а также влияние фтора на зубы.
Что такое фторирование?
Фторирование – способ укрепления зубной эмали, придания ей более привлекательного вида и защиты от кариеса. Процедура предполагает использование специальных средств, например, лаков, пен или гелей, в которых количество фтора гораздо выше, чем в обычных зубных пастах.
Как фтор влияет на зубы?
Пользу или вред приносит фтор для зубов – однозначного ответа нет. Это вещество необходимо организму человека только в разумном количестве, иначе это может стать причиной для образования различных заболеваний.
Это вещество необходимо организму человека только в разумном количестве, иначе это может стать причиной для образования различных заболеваний.
Фтор выполняет следующие функции в организме:
- Является профилактическим средством от заболеваний полости рта, например, кариеса, пародонтоза.
- Принимает участие в процессе формирования зубной эмали.
- Активно очищает твердые ткани зубов.
- Оказывает антибактериальные свойства.
- Положительно воздействует на мягкие ткани полости рта.
Полезен ли фтор для зубов?
Безусловно, фтор оказывает положительное влияние на полость рта человека. Основные преимущества вещества:
- защита от появления кариеса;
- укрепление эмали;
- профилактика образования зубного камня;
- фторирование предотвращает воспаление и кровотечение десен;
- предотвращает развитие мелких трещин.

Перед тем, как применять вещества с содержанием фтора, лучше всего посоветоваться со стоматологом, который подберет комплекс препаратов или назначит дополнительное лечение.
Вреден ли фтор для зубов?
Фтор вреден для зубов и для организма человека в целом только в очень больших количествах, но такое случается крайне редко. Обычная процедура в стоматологии абсолютно безопасна для человека, так как проводится под контролем опытного врача, внимательно следящего за дозой препарата.
В случае самостоятельного применения средств, содержащих фтор, необходимо проконсультироваться со стоматологом.
Пользу или вред фтора именно для ваших зубов может определить только стоматолог. Поэтому, если вы хотите сделать фторирование или использовать средства с содержанием фторида, то лучше обратиться к специалисту, например, в «Клинике Пасман». Наши стоматологи оценят состояние зубов пациента, при необходимости назначат лечение и дадут рекомендации по уходу за ними.
Роль соединений фтора в профилактике стоматологических заболеваний / Липецкая городская стоматологическая поликлиника №1
В отечественной литературе наиболее часто встречается понятие «фтор», но следует помнить, что препараты, применяемые для профилактики кариеса зубов — это не химически чистый фтор, а его соединения- фториды, где элемент содержится в виде фторид-иона, связанного с каким-либо катионом.
Вероятно, самое раннее упоминание об эффекте фторидов найдено у поэта Маркеса Валериуса Мартиалиса (40-104 г.). Описывая зубы Таис, подруги Александра Македонского, он писал: «У Таис черные зубы, у Лакении — белые, как снег. Почему? У второй зубы куплены, у первой — ее собственные». По-видимому, черные зубы были широко распространены в вулканической области Италии, где жил Мартиалис, и являлись проявлением влияния избытка фторидов на развивающуюся эмаль зуба.
Еще одно упоминание о влиянии фторидов встречается в исландской литературе тысячелетней давности. После вулканического извержения овцы ели траву, загрязненную упавшей золой, заболевали, и у них возникали симптомы, которые теперь можно интерпретировать как острое или хроническое отравление фторидами.
В конце XIX века были описаны два события. В 1886 г. Moisson выделил элементарный фтор. Многие ученые описали нарушение вегетации в окрестностях медеплавильных заводов, производящих плавиковую кислоту, суперфосфаты, стекло.
В 1931 г. три различные группы исследователей открыли, что причиной дефекта зубов, известного как крапчатость, является избыток фторида в питьевой воде. В это же время T.Dean исследовал распространенность пятнистого поражения зубов в некоторых штатах Америки и отметил, что при увеличении крапчатости, кариес был выражен в меньшей степени. На основании этих данных было сделано предположение о возможности искусственного повышения содержания фторида в питьевой воде там, где его концентрация низка, для снижения интенсивности кариеса.
Т. Dean в 1931г. обнаружил, что у людей, употреблявших воду из источников с содержанием фторида 1мг/л или выше, отмечалось на 50% меньше кариозных поражений, чем при концентрации 0,1 — 0,3 мг/л. Поскольку концентрация фторида, равная 1 мг/л, не сопровождалась появлением флюороза зубов, этот уровень был признан оптимальным.
Впервые искусственное фторирование питьевой воды было осуществлено в 2-х городах Америки. Эти исследования показали, что при минимальных усилиях и без значительных изменений характера питания интенсивность кариеса зубов может быть снижена на 60—70%. Результаты оказались настолько впечатляющими, что фторирование питьевой воды стало активно внедряться в Америке и других странах. В 1966 г. фторирование воды стало одной из самых важных современных общественных мер охраны здоровья.
Фтор составляет 0,065% элементов земной коры и является важным компонентом общего биогеохимического цикла, в котором протекает жизнь.
Фториды поступают в организм человека с водой, однако существуют и другие источники: продукты, лекарства, пестициды. Некоторые люди вдыхают соединения фтора, находящиеся в воздухе, на ряде производств. Сегодня значительная часть фторидов, поступающая в организм человека, является результатом человеческой деятельности. Потенциальными источниками эмиссии фтора являются производства фосфорной кислоты и суперфосфата, алюминия, стекла, серной кислоты, пластмасс и углеводородов. В окружающую среду промышленными предприятиями выбрасывается большое количество твердых продуктов, содержащих соединения фтора.
В окружающую среду промышленными предприятиями выбрасывается большое количество твердых продуктов, содержащих соединения фтора.
При изучении метаболизма фторида в организме человека оказалось, что эти соединения имеют сродство к минералам, из которых построены кости и зубы. Накопление подобных соединений происходит в тех участках скелетных тканей, которые контактируют с циркулирующими жидкостями (например, дентине, прилежащем к пульпе, поверхностной эмали).
Количество фторида, содержащегося в плазме крови и откладывающегося в тканях, напрямую зависит от его поступления в организм из различных источников, в первую очередь, из питьевой воды.
Процесс накопления фторида в тканях зуба наиболее интенсивно происходит во время формирования эмали и в первые годы после прорезывания зуба, когда осуществляется её минерализация.
Для временных зубов характерна более низкая концентрация фторида, чем для постоянных.
С возрастом концентрация фторида в постоянных зубах снижается, что, вероятно, связано с постепенной потерей эмали в результате стирания.
Если рассмотреть распределение фторида в эмали зуба, то представится следующая картина.
Содержание фторида выше в поверхностных слоях эмали и понижается к глубоким слоям, причем в органической матрице эмали и дентина фторид не выявлен.
В области режущего края, жевательной поверхности зуба концентрация фторида значительно больше, чем в области шейки. Вероятно, данный феномен обусловлен тем, что режущий край формируется первым, более длительно развивается и минерализуется, вследствие чего адсорбирует больше фторида.
Однако это утверждение справедливо лишь для недавно прорезавшихся зубов, так как с возрастом именно в области шейки концентрация фторида становится выше, что можно объяснить стиранием эмали в области режущего края.
В слюне концентрация фторида составляет 1 моль/л, или 0,019 ppni, что соответствует примерно 1/50 оптимального значения фторида в питьевой воде (I ppm).
Концентрация фторида в налете колеблется от 4 до 50-60 ppm. При этом большая его часть связана, и лишь небольшое количество находится в ионной форме. В жидкой фазе налета может содержаться в 10 раз больше фторида, чем в слюне.
В жидкой фазе налета может содержаться в 10 раз больше фторида, чем в слюне.
Наши представления о механизме действия фторидов изменяются в зависимости от получения новых научных данных.
В течение долгого времени профилактическое действие фторидсодержащих препаратов объясняли только образованием в эмали фторапатита.
При этом образование фторида кальция представлялось неблагоприятным, поскольку он растворим в слюне и быстро теряется из поверхностных слоев эмали.
Согласно современной концепции кариесстатическое действие фторида обеспечивается его накоплением в тканях и жидкостях полости рта. При снижении величины рН зубного налета из них выделяется свободный фторид, замедляющий процесс деминерализации эмали.
При регулярном введении фторида происходит пополнение таких запасов, в виде глобул микрокристаллов фторида кальция, образующихся на поверхности эмали. Постоянное поступление даже небольших концентраций фторида, подобных тем, что присутствуют в зубных пастах, достаточно для поддержания резистентности эмали. В настоящее время признано, что после образования микрокристаллов фторида кальция они покрываются фосфатом кальция и белками, содержащимися в слюне. Фосфат-ионы адсорбируются на активных центрах кристаллов фторида кальция, что приводит к формированию поверхностного слоя фторидгидроксиапатита. Этот процесс значительно замедляет скорость растворения фторида кальция.
В настоящее время признано, что после образования микрокристаллов фторида кальция они покрываются фосфатом кальция и белками, содержащимися в слюне. Фосфат-ионы адсорбируются на активных центрах кристаллов фторида кальция, что приводит к формированию поверхностного слоя фторидгидроксиапатита. Этот процесс значительно замедляет скорость растворения фторида кальция.
При уменьшении величины рН фторид кальция становится нестабильным, и фторид-ионы реагируют с ионами кальция и фосфатов, освобождающимися из эмали при формировании кариозного повреждения. При этом наблюдается репреципитация ионов в форме фторидапатита, который, таким образом, является результатом ингибирования кариеса. В процессе кислотной атаки фторид кальция действует как идеальный фторидвыделяющий агент.
Результаты исследований показывают, что прочно связанный фторид, включенный в кристаллическую решетку, можно считать потенциальным фактором защиты от кариеса. Однако в непосредственной реакции развития и ингибирования кариеса участвует фторид, находящийся на границе взаимодействия эмали и ротовой жидкости.
Для проникновения в жидкую фазу налета или эмаль фторид должен быть растворен в слюне. Движущая сила транспорта фторида в налет и жидкость эмали — концентрационный градиент, обусловленный разницей концентраций этого иона в разных средах. Поэтому, в настоящее время разрабатывается новое направление исследований: кинетика и концентрация фторида в различных слоях ротовой жидкости.
Исследования показали, что фторид эффективен и для профилактики кариеса корня зуба, поэтому его следует использовать во всех возрастных группах.
Фторид оказывает свое влияние двумя путями, воздействуя на эмаль зуба и на бактерии зубного налета.
Влияние поступающего извне фторида на эмаль зубов зависит от того, когда происходит это воздействие. Если оптимальные дозы фторида поступают до прорезывания зубов, то:
— увеличивается размер кристаллов гидроксиапатита;
— в гидроксиапатите происходит замещение гидроксильных групп (ОН) на ионы фтора с образованием кристаллов фторапатита;
— снижается содержание карбонатов; ^ — эмаль становится более прочной; — фиссуры менее глубокие и более широкие.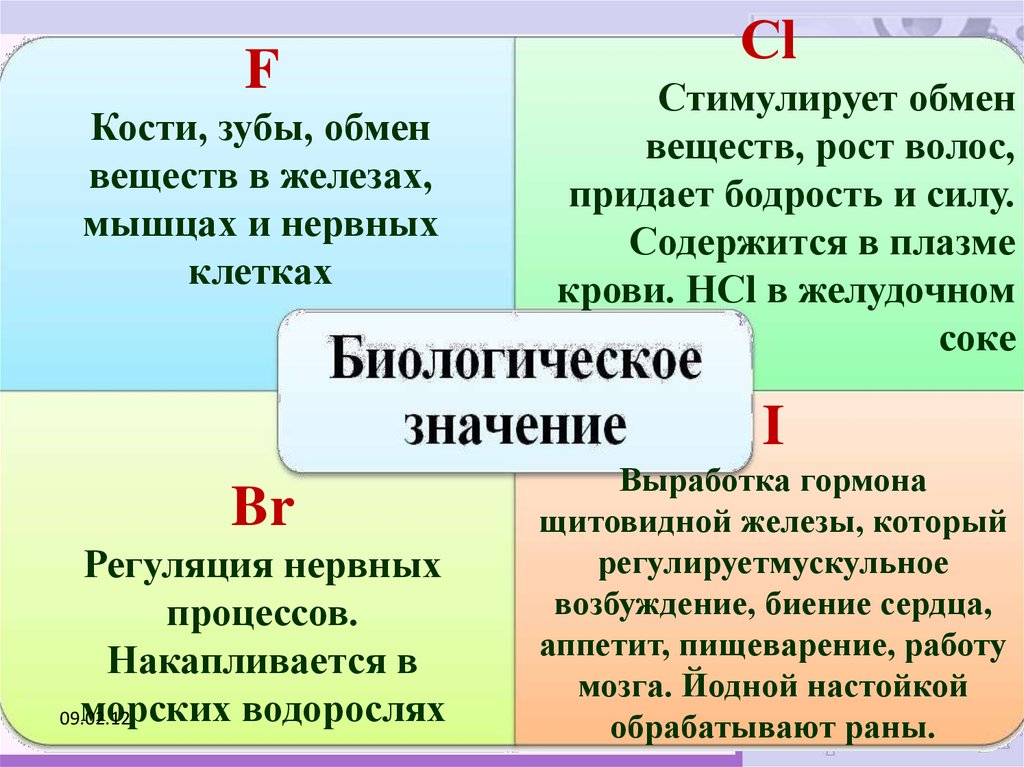 Если фторид поступает после прорезывания зубов, то он снижает растворимость эмали, способствует реминерализации частично деминерализованной эмали.
Если фторид поступает после прорезывания зубов, то он снижает растворимость эмали, способствует реминерализации частично деминерализованной эмали.
Эти особенности определяют значительно большую эффективность использования системных по сравнению с местными методами введения фторида.
При воздействии фторида на бактерии зубного налета нарушается метаболизм патогенных бактерий без влияния на нормальную микрофлору полости рта, в результате чего снижается его кариесогенность.
Соединения фтора в слюне и налете ингибируют транспорт глюкозы в клетки патогенных бактерий и образование внеклеточных полисахаридов, которые формируют матрицу зубного налета. Низкие концентрации фторида способны подавлять активность ферментов, участвующих в образовании органических кислот, снижая их концентрацию.
Уровень фторидов в зубном налете и слюне, хотя и низкий, однако является достаточным для того, чтобы значительно влиять на скорость развития кариеса. Следует подчеркнуть, что фторид не столько препятствует возникновению начального кариозного повреждения, сколько тормозит скорость его прогрессирования. Достичь включения фторида в интактную эмаль очень трудно, поэтому важно создать его низкие концентрации в жидкой фазе раннего кариозного повреждения.
Достичь включения фторида в интактную эмаль очень трудно, поэтому важно создать его низкие концентрации в жидкой фазе раннего кариозного повреждения.
Фтор может оказывать как полезное, так и вредное воздействие на людей, что зависит от принятой дозы. Еще Парацельс (1493-1541) говорил, что все вещества являются ядами, но правильная доза разделяет их на яды и лекарства.
Избыточный прием фторидов в течение многих лет может вести к флюорозу.
В избыточных концентрациях фториды токсичны: они могут ингибировать активность ферментов, убивать живые клетки, но эти действия оказывает активный фтор.
Применение фторидов для профилактики стоматологических заболеваний до настоящего времени вызывает оживленные дискуссии, несмотря на то, что использование для этой цели искусственно фторированной питьевой воды с концентрацией фторидов 1 мг/л не связано с негативными последствиями для человека.
Исследователи предполагают, что «оптимальный» прием фторида в день колеблется между 0,05 и 0,07 мг на кг веса. Общий прием фторида в день не должен превышать 0,1 мг/кг веса, чтобы избежать появления флюороза зубов и костей.
Общий прием фторида в день не должен превышать 0,1 мг/кг веса, чтобы избежать появления флюороза зубов и костей.
Национальная Академия Наук США предложила считать, что безопасен прием в день от 1,5 до 4 мг фторида.
Смертельной дозой для взрослых является прием 5-Юг фторида натрия (32-64 мг/кг веса). Для детей срочная помощь нужна при приеме фторида, начиная с 5 мг/кг веса.
Первыми проявлениями отравления фторидом являются тошнота, рвота, боль в животе. В качестве противоядия рекомендуется прием per os молока или известковой воды.
Симптомы, проявляющиеся при всасывании избытка препаратов фтора, многочисленны: флюороз, изменения слизистой желудка, снижение концентрационной способности почек.
У лиц, проживающих в области с оптимальным содержанием фторида в воде (около 1 ррм), распространенность очень слабых форм флюороза зубов составляет 15—20%, но это не является клинической или косметической проблемой. Возрастание флюороза обусловлено увеличенным приемом общего количества фторида во время развития зуба, и это поражение становится клинически выраженным при концентрации фторида в воде свыше 2 мг/л. При этом необходимо учитывать ежедневный прием фторидов из всех источников, включая продукты питания. Например, в областях, где содержание фторида в воде оптимально, дети получают в день 0,5 мг. Если это количество в воде составляет 1,6- 1,8 мг/л, то в день в организм поступает 0,75—1 мг, и тогда суммарное количество фторидов может вызвать флюороз.
При этом необходимо учитывать ежедневный прием фторидов из всех источников, включая продукты питания. Например, в областях, где содержание фторида в воде оптимально, дети получают в день 0,5 мг. Если это количество в воде составляет 1,6- 1,8 мг/л, то в день в организм поступает 0,75—1 мг, и тогда суммарное количество фторидов может вызвать флюороз.
Всасывание фторида может происходить и при использовании препаратов для местной обработки зубов.
В пастах концентрация фторида составляет около 1000 ррм, при этом пациенты заглатывают примерно 25% этого количества, а маленькие дети — еще больше, поэтому у детей фторидсодержащие пасты можно использовать только под наблюдением родителей, начиная с 3-4 лет. В то же время 20-летний опыт применения фторидсодержащих зубных паст в скандинавских странах не дал случаев флюороза.
Растворы для полосканий содержат 0,05% NaF (0,023% F, что эквивалентно 230 ррм), или 0,2% (900 ррм F). Так же, как и при применении зубных паст, детьми заглатывается примерно 25% фторида, и результатом может быть развитие флюороза. Детям моложе 6 лет полоскания не рекомендуются, а у младших школьников объем раствора для полосканий не должен превышать 5 мл.
Детям моложе 6 лет полоскания не рекомендуются, а у младших школьников объем раствора для полосканий не должен превышать 5 мл.
Чистка зубов фторидсодержащей пастой 2 раза в день. Дает количество фторида, аналогичное проглоченному с водой и пищей — 0,5 мг. Примерно одинаковое количество Фторида поступает в результате 1 чистки зубов в сочетании с 1 полосканием или от 2 полосканий в день. Любой из этих источников фторида +0,5 мг из воды и пищи дают 1 мг в день, т.е. то количество, которое может вызвать флюороз у некоторых детей.
При аппликациях гелем с подкисленным фторид-фосфатом (APF) пациентами проглатывается от 15 до 100% (в среднем 30%), поэтому гели надо использовать с осторожностью, особенно у детей. При выполнении аппликации следует применять слюноогсос, а после окончания процедуры — тщательно полоскать полость рта в течение 30 секунд —1 минуты.
Избыточное поступление фторида в организм во время формирования эмали может приводить к флюорозу, влиять на морфологию коронки, в результате чего образуются менее кариесвосприимчивые щели и фиссуры.
Точный механизм развития флюороза пока неизвестен, но высокий уровень фторидов в плазме может ингибировать удаление матрицы эмали во время фазы созревания. Флюорозная эмаль содержит больше фторида во внутренних слоях по сравнению с нормальной эмалью, является более чувствительной к переломам и истиранию.
Поступление фторида в концентрациях 0.7-1.2 ppm обуславливает снижение интенсивности кариеса зубов. При увеличении концентрации фторида до 1.5-3.0 ppm возможно возникновение флюороза зубов умеренной формы и низкой распространенности; 4.0-8.0 ppm — тяжелой формы флюороза зубов и умеренной формы флюороза костей скелета; 8.0 и более ppm — тяжелой формы флюороза зубов и костей скелета.
Химия фтора (Z=9) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 578
Фтор (F) является первым элементом в группе галогенов (группа 17) в периодической таблице.
Краткая справочная таблица
Краткая история
В конце 1600-х годов минералы, которые, как мы теперь знаем, содержат фтор, использовались для травления стекла. Открытие элемента было вызвано поисками химического вещества, способного разъедать стекло (это HF, слабая кислота). Ранняя история выделения и работы с фтором и фтористым водородом полна несчастных случаев, поскольку оба они чрезвычайно опасны. В конце концов, электролиз смеси KF и HF (тщательно следя за тем, чтобы образовавшийся водород и фтор не соприкасались) в платиновом аппарате дал элемент.
Ранняя история выделения и работы с фтором и фтористым водородом полна несчастных случаев, поскольку оба они чрезвычайно опасны. В конце концов, электролиз смеси KF и HF (тщательно следя за тем, чтобы образовавшийся водород и фтор не соприкасались) в платиновом аппарате дал элемент.
Фтор был открыт в 1530 году Георгиусом Агриколой. Первоначально он нашел его в составе плавикового шпата, который использовался для ускорения плавления металлов. Он находился под этим приложением до 1670 года, когда Шванхард обнаружил его полезность в травлении стекла. Чистый фтор (от латинского fluere, что означает «поток») не был выделен до 1886 года Анри Муассаном, который по пути сжег и даже убил многих ученых. Сегодня у него много применений, в частности, в Манхэттенском проекте по созданию первой ядерной бомбы.
Электроотрицательность фтора
Фтор является самым электроотрицательным элементом в периодической таблице, что означает, что он является очень сильным окислителем и принимает электроны других элементов. Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 . (см. рис. 2)
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 . (см. рис. 2)
Фтор является наиболее электроотрицательным элементом, поскольку он имеет 5 электронов в своей 2P-оболочке. Оптимальная электронная конфигурация 2P-орбитали содержит 6 электронов, поэтому, поскольку фтор настолько близок к идеальной электронной конфигурации, электроны очень плотно прилегают к ядру. Высокая электроотрицательность фтора объясняет его малый радиус, потому что положительные протоны имеют очень сильное притяжение к отрицательным электронам, удерживая их ближе к ядру, чем более крупные и менее электроотрицательные элементы.
Реакции фтора
Из-за своей реакционной способности элементарный фтор никогда не встречается в природе, и никакой другой химический элемент не может вытеснить фтор из его соединений. Фтор связывается практически со всеми элементами, как с металлами, так и с неметаллами, поскольку является очень сильным окислителем. -\). 9- \tag{2}\]
-\). 9- \tag{2}\]
Существуют также некоторые органические соединения, сделанные из фтора, от нетоксичных до высокотоксичных. Фтор образует ковалентные связи с углеродом, которые иногда образуют стабильные ароматические кольца. Когда углерод реагирует с фтором, реакция носит сложный характер и образует смесь \(CF_4\), \(C_2F_6\), \(C_5F_{12}\).
\[C_{(s)} + F_{2(g)} \rightarrow CF_{4(g)} + C_2F_6 + C_5F_{12} \tag{3}\]
Фтор реагирует с кислородом с образованием \ (OF_2\), потому что фтор более электроотрицателен, чем кислород. Реакция идет:
\[2F_2 + O_2 \rightarrow 2OF_2 \tag{4}\]
Фтор настолько электроотрицателен, что иногда он даже образует молекулы с благородными газами, такими как ксенон, такие как молекула дифторида ксенона, \(XeF_2\).
\[Xe + F_2 \rightarrow XeF_2 \tag{5}\]
Фтор также образует сильные ионные соединения с металлами. Некоторые распространенные ионные реакции фтора:
\[F_2 + 2NaOH \rightarrow O_2 + 2NaF +H_2 \tag{6}\]
\[4F_2 + HCl + H_2O \rightarrow 3HF + OF_2 + ClF_3 \tag{7} \]
\[F_2 + 2HNO_3 \rightarrow 2NO_3F + H_2 \tag{8}\]
Применение фтора
Соединения фтора присутствуют во фторированной зубной пасте и во многих муниципальных системах водоснабжения, где они помогают предотвратить кариес.
- Ракетное топливо
- Производство полимеров и пластмасс
- производство тефлона и тефзеля
- В сочетании с кислородом используется в качестве охладителя холодильника
- Плавиковая кислота, используемая для травления стекла
- Очистка коммунальных источников воды
- Производство урана
- Кондиционер
Источники
Фтор можно найти в природе или получить в лаборатории. Чтобы сделать это в лаборатории, такие соединения, как фторид калия, подвергают электролизу с плавиковой кислотой для создания чистого фтора и других соединений. Его можно проводить с различными соединениями, обычно ионными, включающими фтор и металл. Фтор также можно найти в природе в виде различных минералов и соединений. Двумя основными соединениями, в которых он содержится, являются плавиковый шпат (\(CaF_2\)) и криолит (\(Na_3AlF_6\)).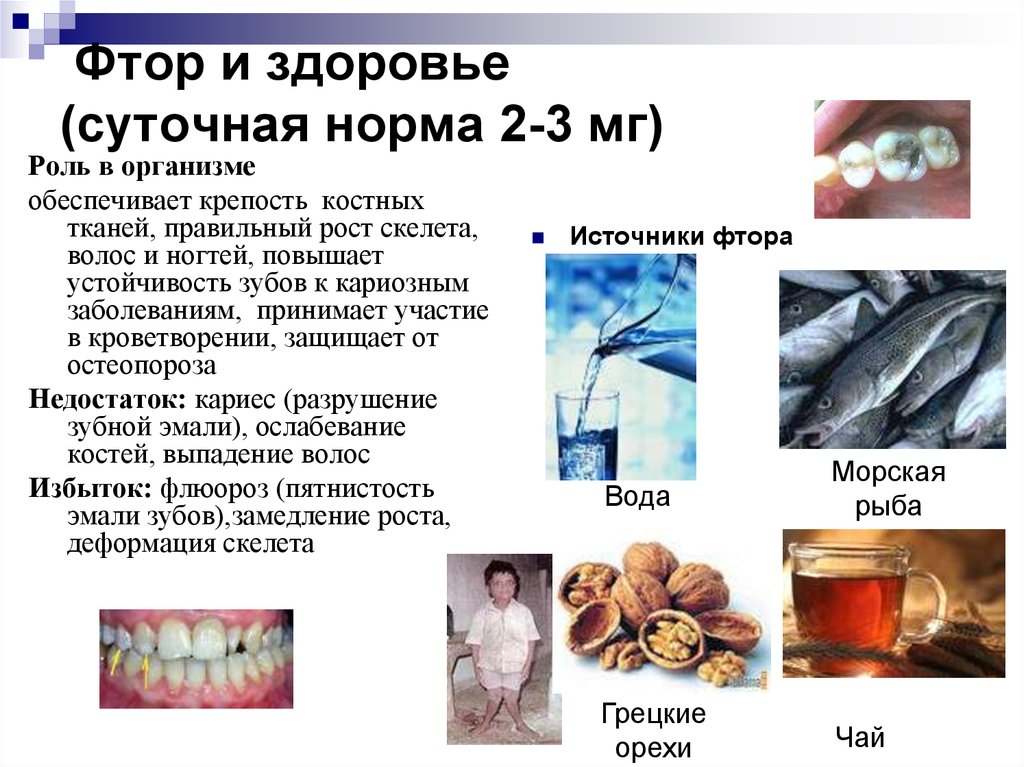
Ссылки
- Newth, GS Неорганическая химия . Лонгманс, Грин и Ко.: Нью-Йорк, 1903 г. .
- Латимер, Венделл М., Хильдебранд, Джоэл Х. Справочник по неорганической химии . Компания Macmillan: Нью-Йорк, 1938. .
Проблемы
(Выделите для просмотра ответов)
1. В. Какова электронная конфигурация фтора? F — ?
А. 1с 2 2с 2 2п 5
1s 2 2s 2 2p 6
2. В. Фтор обычно окисляется или восстанавливается? объяснять.
A. Фтор обычно восстанавливается, потому что он принимает электрон от других элементов, поскольку он такой электроотрицательный.
3. В. Каковы некоторые распространенные области применения фтора?
A. Зубная паста, пластмассы, ракетное топливо, травление стекла и т. д.
4. Q. Образует ли фтор соединения с неметаллами? если да, приведите два примера, один из которых относится к оксиду.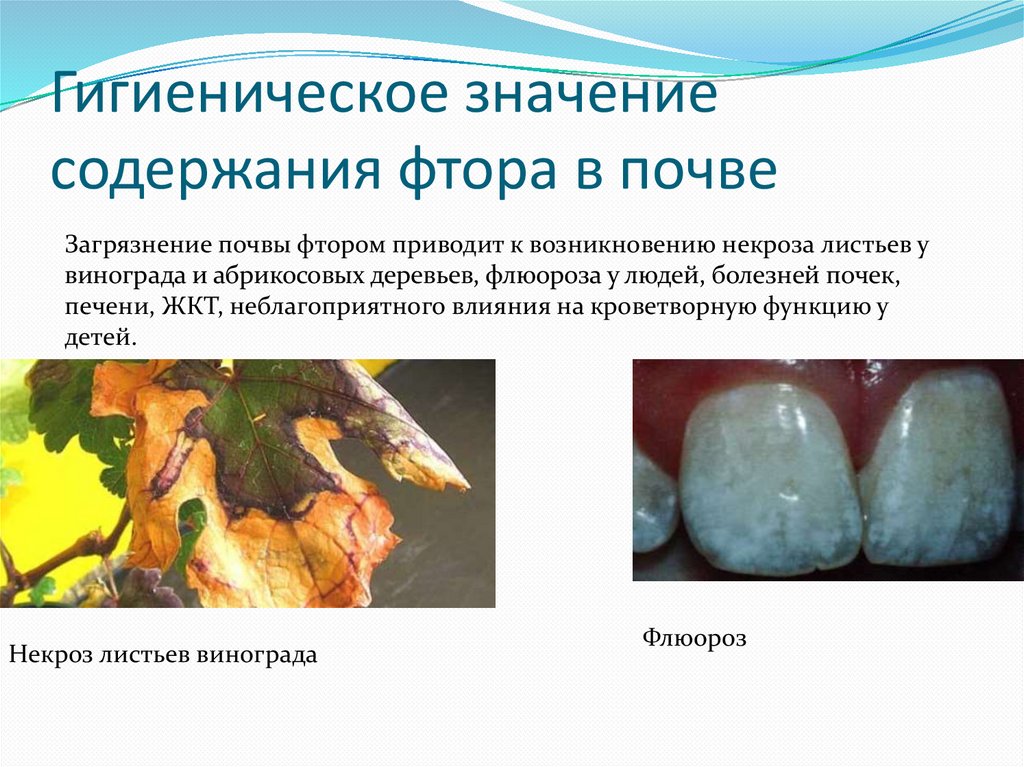
A. OF 2 , ClF
5. В. К какой группе относится фтор? (укажите название группы и номер)
A. 17, Halogens
Участники и авторство
- Рэйчел Фельдман (Калифорнийский университет, Дэвис)
Стивен Р. Марсден
Chemistry of Fluorine (Z=9) распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- атомный номер
- точка кипения
- двухатомных молекул
- электроотрицательный
- электроотрицательность
- Георгиус Агрикола
- Группа 17
- галоген
- Группа галогенов
- Кислота Льюиса
- температура плавления
- неметалл
- периодическая таблица
- комнатная температура
Части периодической таблицы
Части периодической таблицыПериодические тенденции — электроотрицательность
| 1А | 2А | 3А | 4А | 5А | 6А | 7А | 8А | ||||||||||||
| (1) | (2) | (13) | (14) | (15) | (16) | (17) | (18) | ||||||||||||
| 3Б | | 5Б | 6Б | 7Б | — | 8Б | — | 1Б | 2Б | ||||||||||
| (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | ||||||||||
| 1 | Х 2,20 | Он н. | |||||||||||||||||
| 2 | Ли 0,98 | Быть 1,57 | Б 2,04 | С 2,55 | Н 3,04 | О 3,44 | Ф 3,98 | Не н. | |||||||||||
| 3 | Нет 0,93 | мг 1,31 | Ал 1,61 | Си 1,90 | Р 2,19 | С 2,58 | Кл 3,16 | Ар н. | |||||||||||
| 4 | К 0,82 | Са 1,00 | Sc 1,36 | Ти 1,54 | В 1,63 | Кр 1,66 | Мн 1,55 | Фе 1,83 | Со 1,88 | Ni 1,91 | Медь 1,90 | Цинк 1,65 | Га 1,81 | Гэ 2. | Как 2,18 | Се 2,55 | Бр 2,96 | Кр 3,00 | |
| 5 | руб. 0,82 | Старший 0,95 | Д 1,22 | Зр 1,33 | № 1,60 | Пн 2,16 | ТК 1,90 | Ру 2,20 | Рх 2,28 | Пд 2,20 | Аг 1,93 | CD 1,69 | В 1,78 | Сн 1,96 | Сб 2,05 | Те 2. | я 2,66 | Хе 2,60 | |
| 6 | цезий 0,79 | Ба 0,89 | Ла 1,10 | Хф 1,30 | Та 1,50 | Вт 2,36 | Ре 1,90 | ОС 2,20 | Ир 2,20 | Пт 2,28 | Золото 2,54 | рт. 2,00 | Тл 1,62 | Пб 2,33 | Би 2,02 | ПО 2,00 | В 2,20 | Р-н н.д. | |
| 7 | Пт 0,70 | Ра 0,89 | Ас 1,10 | РФ н.д. | Дб н. | Сг н.д. | Бх н.д. | Гс н.д. | Мт н.д. | Дс н.д. | № н.д. | Ууб н.д. | — | Уук н.д. | — | — | — | — | |
| 6 | Се 1,12 | Пр 1,13 | Нд 1,14 | вечера 1,13 | См 1,17 | ЕС 1,20 | гд 1,20 | Тб 1,10 | Дай 1,22 | Хо 1,23 | Er 1,24 | Тм 1,25 | Ыб 1,10 | Лу 1,27 | |||||
| 7 | 1,30 | Па 1,50 | У 1,38 | Нп 1,36 | Пу 1,28 | Ам 1,30 | См 1,30 | Бк 1,30 | См. 1,30 | Эс 1,30 | фм 1,30 | Мд 1,30 | № 1,30 | Лр 1,30 |
Электроотрицательность в единицах Полинга
Данные взяты из John Emsley, The Elements , 3-е издание. Оксфорд: Clarendon Press, 1998.
.
Электроотрицательность относится к способности атома притягивать общие электронов в ковалентной связи. Чем выше значение электроотрицательность, тем сильнее этот элемент притягивает общие электроны.
Концепция электроотрицательности была введена Лайнусом Полингом. в 1932 году; по шкале Полинга фтору присваивается электроотрицательность 3,98, а остальные элементы масштабируются относительно этого значения. Другие шкалы электроотрицательности включают шкалу Малликена, предложенную Робертом С. Малликеном в 1934 г., в которой первая энергия ионизации и сродство к электрону усредняются вместе, и шкала Оллреда-Рохова, которая измеряет электростатическую притяжение между ядром атома и его валентными электронами.
Электроотрицательность изменяется предсказуемым образом в периодическом стол. Электроотрицательность возрастает снизу вверх в группы и увеличиваются слева направо по периодам . Таким образом, фтор — самый электроотрицательный элемент, а франций — один из из наименее электроотрицательных. (Гелий, неон и аргон не перечислены в шкале электроотрицательности Полинга, хотя в По шкале Allred-Rochow гелий имеет самую высокую электроотрицательность.
) Тенденции не очень гладкие среди переходных металлов и внутренних переходных металлов, но достаточно регулярны для основных элементов группы, и их можно увидеть в диаграммы ниже.
Разница в электроотрицательности между двумя связанными элементами определяет, какой тип связи они образуют. Когда атомы с разницей электроотрицательностей больше чем две единицы соединены вместе, связь, которая образуется, ионная связь , в которой более электроотрицательный элемент имеет отрицательный заряд, а менее электроотрицательный элемент имеет положительный заряд. (В качестве аналогии вы можете думать об этом как игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы тянуть веревку от другой команды.
) Например, натрий имеет электроотрицательность 0,93, а хлор имеет электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное связь, при которой хлор отбирает электрон у натрия, образуя катион натрия, Na + и хлорид-анион, Кл —. Отдельные ионы натрия и хлора не «связаны» вместе, но очень сильно притягивают друг друга из-за противоположные заряды и образуют прочную кристаллическую решетку.
Когда атомы с разницей электроотрицательностей менее двух звенья соединяются вместе, образующаяся связь представляет собой ковалентную связь связь , в которой электроны являются общими для обоих атомов. Когда два одинаковых атома делят электроны в ковалентной связи, между ними нет разницы в электроотрицательности, и электроны в ковалентной связи являются общими равно — тот то есть существует симметричное распределение электронов между связанными атомами.
Эти связи неполярны. ковалентные связи . (В качестве аналогии вы можете думать об этом как игра в перетягивание каната между двумя одинаково сильными командами, в которой веревка не двигается.) Например, когда два хлора атомы соединены ковалентной связью, электроны проводят так же, как много времени близко к одним атомам хлора, как и к другим, и полученная молекула неполярна:
Когда разница электроотрицательностей находится в диапазоне от 0 до 2, более электроотрицательный элемент больше притягивает общий сильно, но недостаточно сильно, чтобы полностью удалить электроны. образуют ионное соединение. Электроны общие неравномерно — то есть есть несимметричный распределение электронов между связанными атомами. Эти связи называются полярными ковалентными связями.
Чем больше электроотрицательный атом имеет частичный отрицательный заряд , д — , т.к. электроны проводят больше времени ближе к этому атому, в то время как меньше электроотрицательный атом имеет частичный положительный заряд , d + , потому что электроны частично (но не полностью) отрываются от этого атом. Например, в молекуле хлороводорода хлор электроотрицательнее водорода на 0,96 единицы электроотрицательности. Общие электроны проводят больше времени близко к атому хлора, что делает хлорный конец молекулы очень слабо отрицательное (обозначено на рисунке ниже синим цветом). заштрихованная область), в то время как водородный конец молекулы очень слегка положительный (обозначен красной заштрихованной областью), а полученная молекула полярна:
Для молекул с более чем одной ковалентной связью трехмерная форма молекулы и как устроены полярные связи ориентированы друг относительно друга, определяет, молекула полярна.


 д.
д. д.
д. д.
д. 01
01 10
10 ст.
ст. д.
д.

 ) Тенденции не очень гладкие
среди переходных металлов и внутренних переходных металлов, но
достаточно регулярны для основных элементов группы, и их можно увидеть в
диаграммы ниже.
) Тенденции не очень гладкие
среди переходных металлов и внутренних переходных металлов, но
достаточно регулярны для основных элементов группы, и их можно увидеть в
диаграммы ниже. ) Например, натрий
имеет электроотрицательность 0,93, а хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия, Na + и хлорид-анион,
Кл —. Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.
) Например, натрий
имеет электроотрицательность 0,93, а хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия, Na + и хлорид-анион,
Кл —. Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.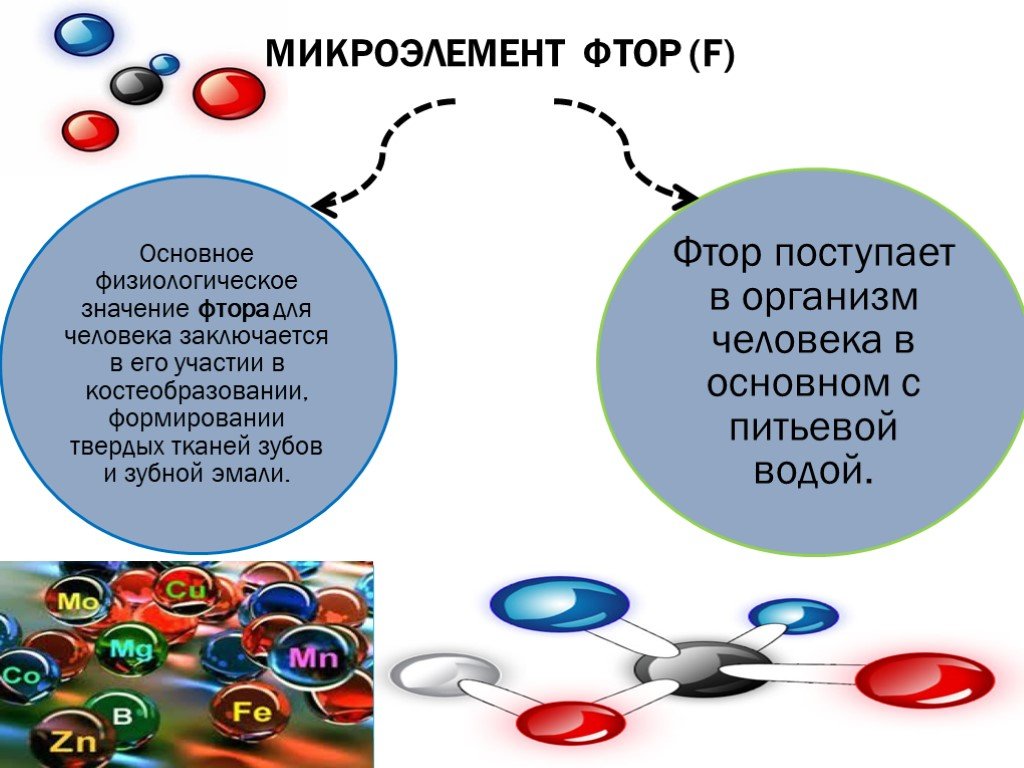 Эти связи неполярны.
ковалентные связи . (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната между двумя одинаково сильными командами, в которой
веревка не двигается.) Например, когда два хлора
атомы соединены ковалентной связью, электроны проводят так же, как
много времени близко к одним атомам хлора, как и к другим, и
полученная молекула неполярна:
Эти связи неполярны.
ковалентные связи . (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната между двумя одинаково сильными командами, в которой
веревка не двигается.) Например, когда два хлора
атомы соединены ковалентной связью, электроны проводят так же, как
много времени близко к одним атомам хлора, как и к другим, и
полученная молекула неполярна: Чем больше
электроотрицательный атом имеет частичный отрицательный заряд , д — , т.к.
электроны проводят больше времени ближе к этому атому, в то время как меньше
электроотрицательный атом имеет частичный положительный заряд , d + , потому что
электроны частично (но не полностью) отрываются от этого
атом. Например, в молекуле хлороводорода
хлор электроотрицательнее водорода на 0,96
единицы электроотрицательности. Общие электроны проводят больше времени
близко к атому хлора, что делает хлорный конец молекулы
очень слабо отрицательное (обозначено на рисунке ниже синим цветом).
заштрихованная область), в то время как водородный конец молекулы очень
слегка положительный (обозначен красной заштрихованной областью), а
полученная молекула полярна:
Чем больше
электроотрицательный атом имеет частичный отрицательный заряд , д — , т.к.
электроны проводят больше времени ближе к этому атому, в то время как меньше
электроотрицательный атом имеет частичный положительный заряд , d + , потому что
электроны частично (но не полностью) отрываются от этого
атом. Например, в молекуле хлороводорода
хлор электроотрицательнее водорода на 0,96
единицы электроотрицательности. Общие электроны проводят больше времени
близко к атому хлора, что делает хлорный конец молекулы
очень слабо отрицательное (обозначено на рисунке ниже синим цветом).
заштрихованная область), в то время как водородный конец молекулы очень
слегка положительный (обозначен красной заштрихованной областью), а
полученная молекула полярна: