Жирные кислоты | это… Что такое Жирные кислоты?
Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными[1].
Содержание
|
Общие сведения
Жирные кислоты могут быть насыщенными (только с одинарными связями между атомами углерода), мононенасыщенными (с одной двойной связью между атомами углерода) и полиненасыщенными (с двумя и более двойными связями, находящимися, как правило, через CH2-группу). Они различаются по количеству углеродных атомов в цепи, а также, в случае ненасыщенных кислот, по положению, конфигурации (как правило цис-) и количеству двойных связей. Жирные кислоты можно условно поделить на низшие (до семи атомов углерода), средние (восемь — двенадцать атомов углерода) и высшие (более двенадцати атомов углерода). Исходя из исторического названия данные вещества должны быть компонентами жиров. На сегодня это не так; термин «жирные кислоты» подразумевает под собой более широкую группу веществ.
Карбоновые кислоты начиная с масляной кислоты (С4) считаются жирными, в то время как жирные кислоты, полученные непосредственно из животных жиров, имеют в основном восемь и больше атомов углерода (каприловая кислота). Число атомов углерода в натуральных жирных кислотах в основном чётное, что обусловлено их биосинтезом с участием ацетил-кофермента А.
Число атомов углерода в натуральных жирных кислотах в основном чётное, что обусловлено их биосинтезом с участием ацетил-кофермента А.
Большая группа жирных кислот (более 400 различных структур, хотя только 10—12 распространены) находятся в растительных маслах семян. Наблюдается высокое процентное содержание редких жирных кислот в семенах определённых семейств растений.
Под незаменимыми понимаются те жирные кислоты, которые не могут быть синтезированы в организме. Для человека незаменимыми являются кислоты, содержащие по крайней мере одну двойную связь на расстоянии более девяти атомов углерода от карбоксильной группы.
Биохимия
Расщепление
Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При потребности под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза. Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом А (КоА).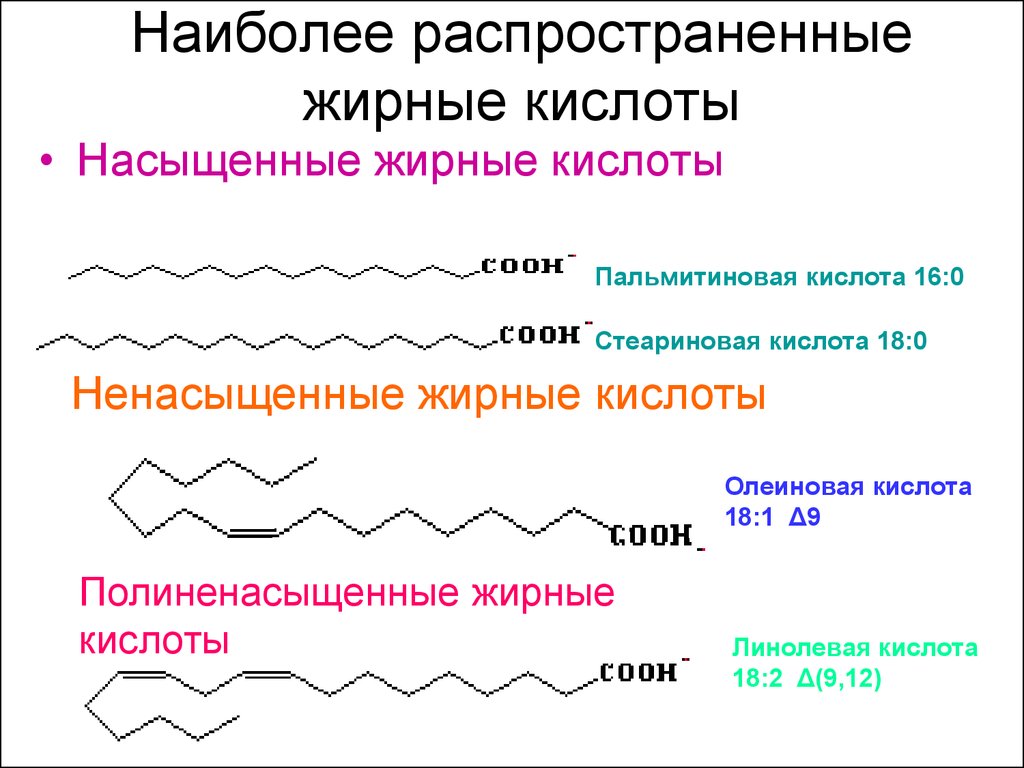 При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi).
При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi).
- R-COOH + КоА-SH + АТФ → R-CO-S-КоА + 2Pi + H+ + АМФ
Синтез
В растительном и животном организме жирные кислоты образуются, как продукты углеводного и жирового обмена. Синтез жирных кислот осуществляется в противоположность расщеплению в цитозоле.
Циркуляция
Пищеварение и всасывание
Коротко- и среднецепочечные жирные кислоты всасываются напрямую в кровь через капилляры кишечного тракта и проходят через воротную вену, как и другие питательные вещества. Более длинноцепочечные слишком велики, чтобы проникнуть напрямую через маленькие капилляры кишечника. Вместо этого они поглощаются жирными стенками ворсинок кишечника и заново синтезируются в триглицериды. Триглицериды покрываются холестерином и белками с образованием хиломикрона. Внутри ворсинки хиломикрон попадает в лимфатические сосуды, так называемый млечный капилляр, где поглощается большими лимфатическими сосудами.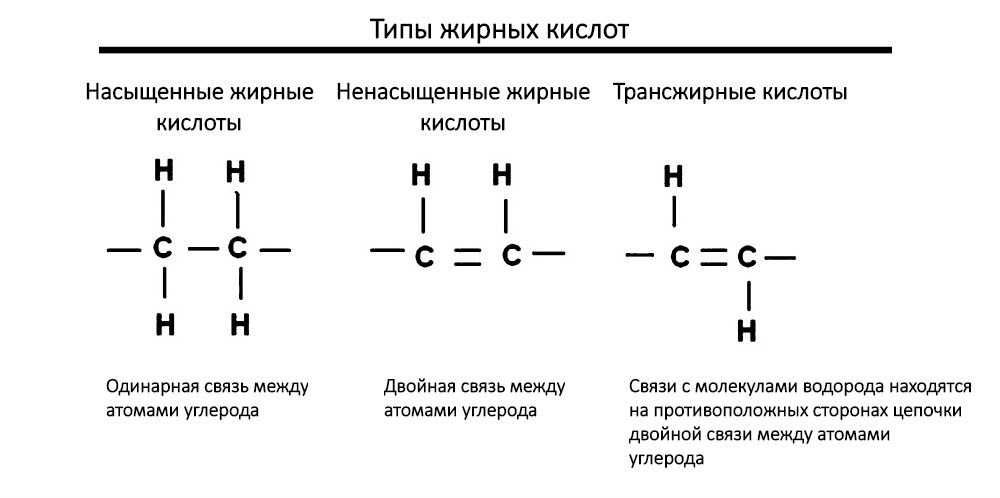 Он транспортируется по лимфатической системе вплоть до места, близкого к сердцу, где кровеносные артерии и вены наибольшие. Грудной канал освобождает хиломикрон в кровоток посредством подключичной вены. Таким образом триглицериды транспортируются в места, где в них нуждаются. [2]
Он транспортируется по лимфатической системе вплоть до места, близкого к сердцу, где кровеносные артерии и вены наибольшие. Грудной канал освобождает хиломикрон в кровоток посредством подключичной вены. Таким образом триглицериды транспортируются в места, где в них нуждаются. [2]
Виды существования в организме
Жирные кислоты существуют в различных формах на различных стадиях циркуляции в крови. Они поглощаются в кишечнике, образуя хиломикроны, но в то же время они существуют в виде липопротеинов очень низкой плотности или липопротеинов низкой плотности после превращений в печени. При выделении из адипоцитов жирные кислоты поступают в свободном виде в кровь.
Кислотность
Кислоты с коротким углеводородным хвостом, такие как муравьиная и уксусная кислоты, полностью смешиваются с водой и диссоциируют с образованием достаточно кислых растворов (pKa 3.77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом незначительно отличаются по кислотности.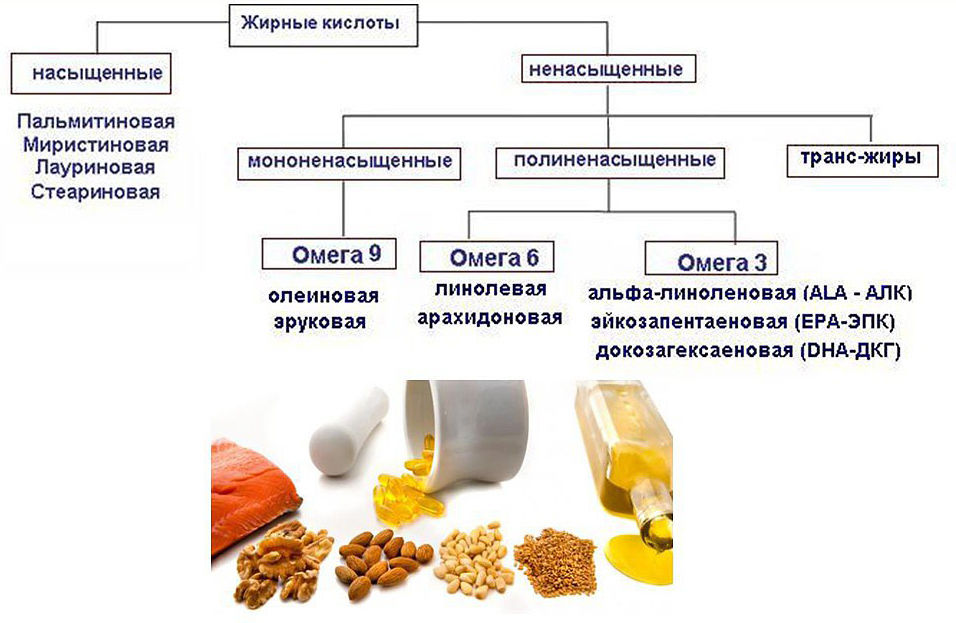 Например, нонановая кислота имеет pKa 4.96. Однако с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате чего эти кислоты мало изменяют pH раствора. Значение величин pKa для данных кислот приобретает значение лишь в реакциях, в которые эти кислоты способны вступить. Кислоты, нерастворимые в воде, могут быть растворены в тёплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледнорозового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
Например, нонановая кислота имеет pKa 4.96. Однако с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате чего эти кислоты мало изменяют pH раствора. Значение величин pKa для данных кислот приобретает значение лишь в реакциях, в которые эти кислоты способны вступить. Кислоты, нерастворимые в воде, могут быть растворены в тёплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледнорозового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
Реакции жирных кислот
Жирные кислоты реагируют так же, как и другие карбоновые кислоты, что подразумевает этерификацию и кислотные реакции. Восстановление жирных кислот приводит к жирным спиртам. Ненасыщенные жирные кислоты также могут вступать в реакции присоединения; наиболее характерно гидрирование, которое используется для превращения растительных жиров в маргарин.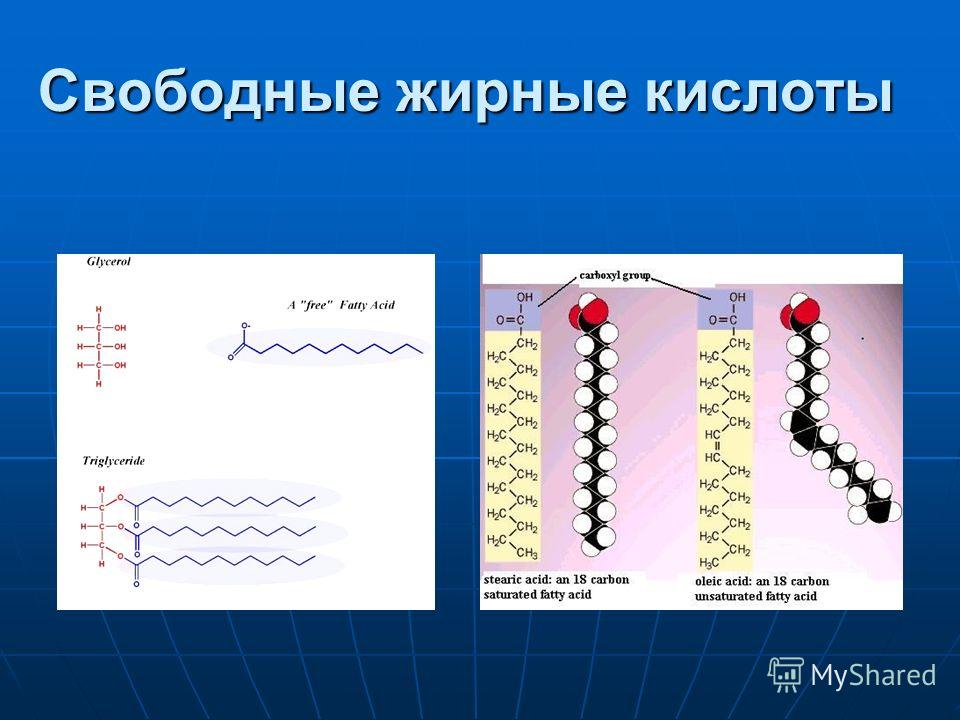 В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природных жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут быть расщеплены в расплавленной щёлочи. Эта реакция имеет значение для определения структуры ненасыщенных жирных кислот.
В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природных жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут быть расщеплены в расплавленной щёлочи. Эта реакция имеет значение для определения структуры ненасыщенных жирных кислот.
Автоокисление и прогоркание
Жирные кислоты при комнатной температуре подвергаются автоокислению и прогорканию. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжёлые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокисление. Чтобы избежать этого, жиры и масла часто обрабатываются хелатирующими агентами, такими как лимонная кислота.
Применение
Натриевые и калиевые соли высших жирных кислот являются эффективными ПАВ и используются в качестве мыл. В пищевой промышленности жирные кислоты зарегистрированы в качестве пищевой добавки E570, как стабилизатор пены, глазирователь и пеногаситель.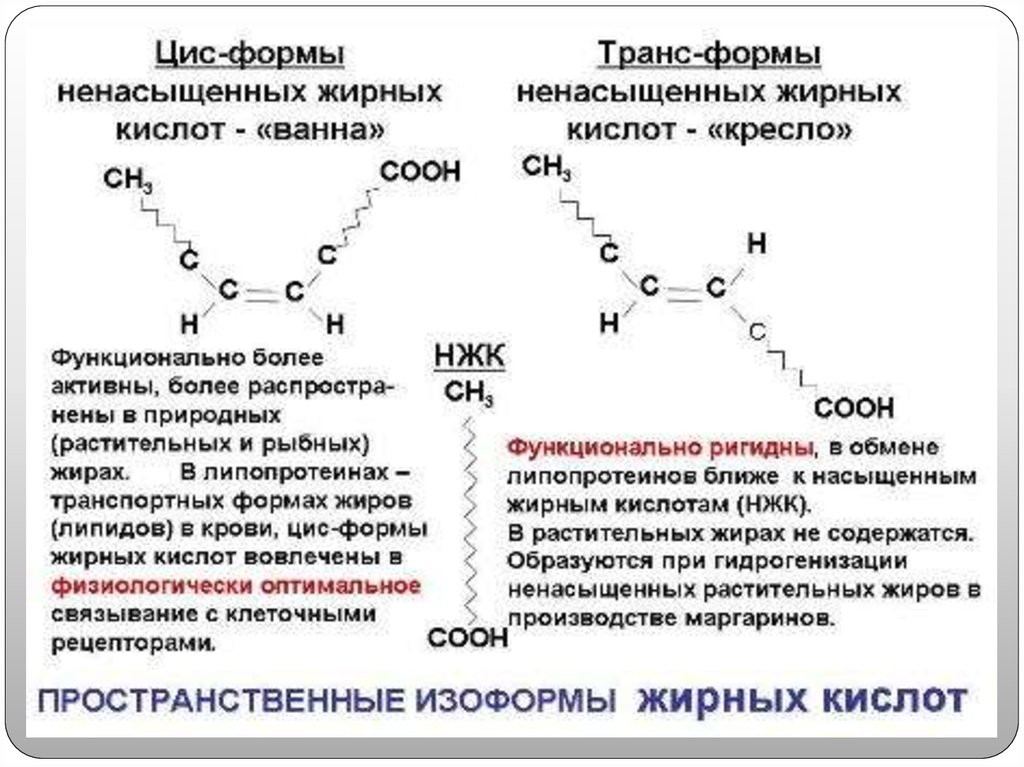 [1]
[1]
Разветвлённые жирные кислоты
Разветвлённые карбоновые кислоты липидов обычно не относятся к собственно жирным кислотам, но рассматриваются как их метилированные производные. Метилированные по предпоследнему атому углерода ( изо-жирные кислоты) и по третьему от конца цепи (антеизо-жирные кислоты) входят в качестве минорных компонент в состав липидов бактерий и животных.
Разветвленные карбоновые кислоты также входят в состав эфирных масел некоторых растений: так, например, в эфирном масле валерианы содержится изовалериановая кислота:
Основные жирные кислоты
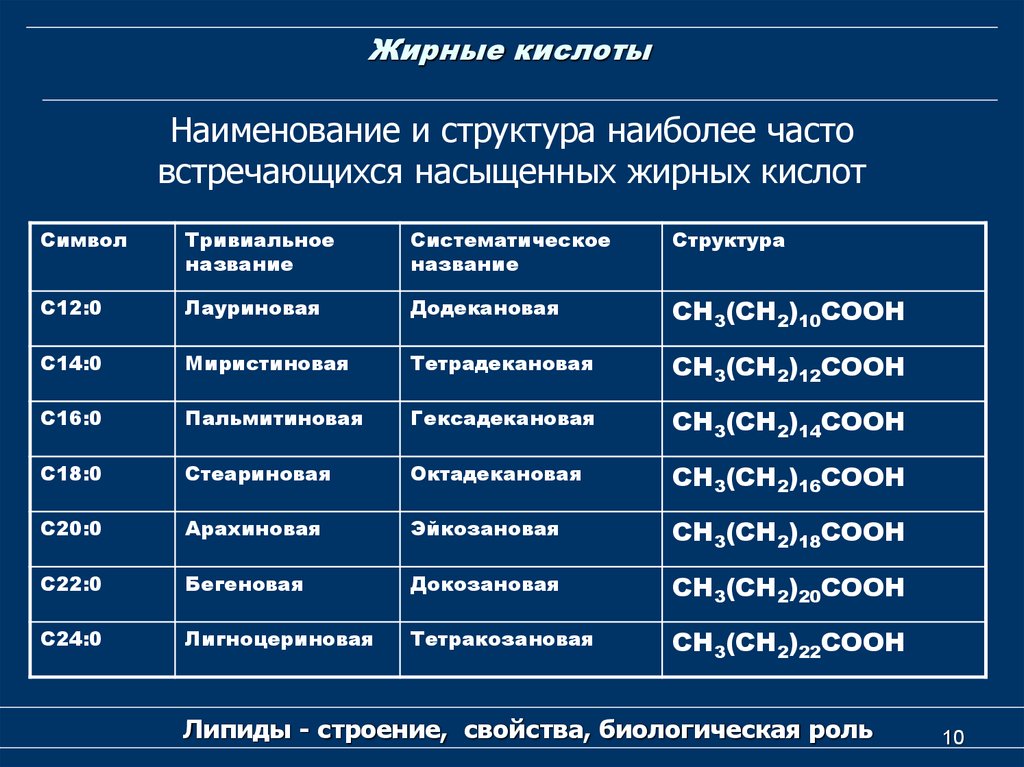
Насыщенные жирные кислоты
Общая формула: CnH2n+1COOH или CH3-(CH2)n-COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | Рациональная полуразвернутая формула | Нахождение | Т.пл. | pKa |
|---|---|---|---|---|---|---|
| Масляная кислота | Бутановая кислота | C3H7COOH | CH3(CH2)2COOH | Сливочное масло, древесный уксус | −8 °C | 4,82 |
| Капроновая кислота | Гексановая кислота | C5H11COOH | CH3(CH2)4COOH | Нефть | −4 °C | 4,85 |
| Каприловая кислота | Октановая кислота | C7H15COOH | CH3(CH2)6COOH | 17 °C | 4,89 | |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | CH3(CH2)7COOH | 12,5 °C | 4. 96 96 | |
| Каприновая кислота | Декановая кислота | C9H19COOH | CH3(CH2)8COOH | Кокосовое масло | 31 °C | |
| Лауриновая кислота | Додекановая кислота | С11Н23СООН | CH3(CH2)10COOH | 43,2 °C | ||
| Миристиновая кислота | Тетрадекановая кислота | С13Н27СООН | CH3(CH2)12COOH | 53,9 °C | ||
| Пальмитиновая кислота | Гексадекановая кислота | С15Н31СООН | CH3(CH2)14COOH | 62,8 °C | ||
| Маргариновая кислота | Гептадекановая кислота | С16Н33СООН | CH3(CH2)15COOH | 61,3 °C | ||
| Стеариновая кислота | Октадекановая кислота | С17Н35СООН | CH3(CH2)16COOH | 69,6 °C | ||
| Арахиновая кислота | Эйкозановая кислота | С19Н39СООН | CH3(CH2)18COOH | 75,4 °C | ||
| Бегеновая кислота | Докозановая кислота | С21Н43СООН | CH3(CH2)20COOH | |||
| Лигноцериновая кислота | Тетракозановая кислота | С23Н47СООН | CH3(CH2)22COOH | |||
| Церотиновая кислота | Гексакозановая кислота | С25Н51СООН | CH3(CH2)24COOH | |||
| Монтановая кислота | Октакозановая кислота | С27Н55СООН | CH3(CH2)26COOH |
Мононенасыщенные жирные кислоты
Общая формула: СН3-(СН2)m-CH=CH-(CH2)n-COOH ( m=ω-2; n=Δ-2)
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | IUPAC формула (с метил.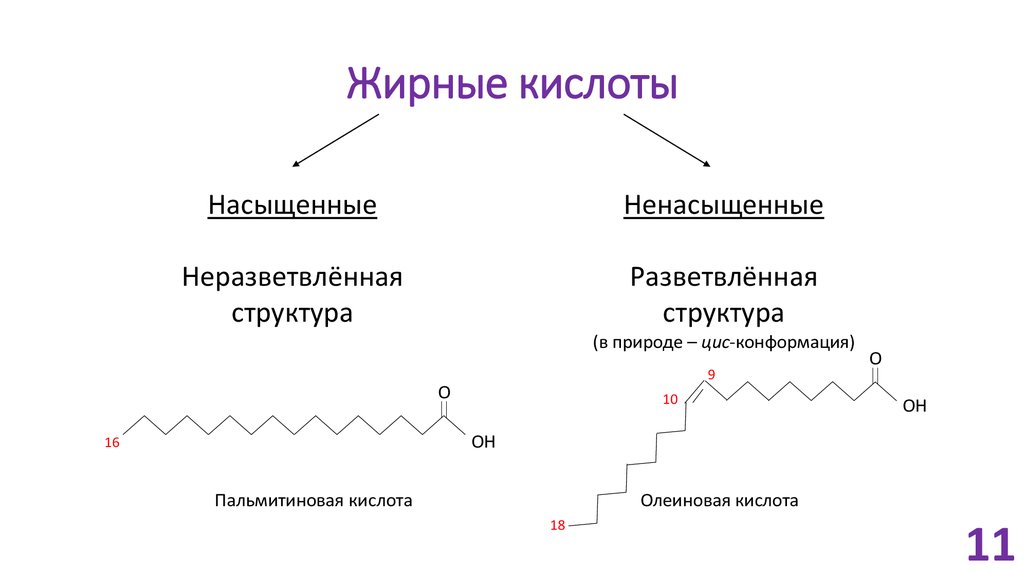 конца) конца) | IUPAC формула (с карб.конца) | Рациональная полуразвернутая формула | |
|---|---|---|---|---|---|---|
| Акриловая кислота | 2-пропеновая кислота | С2Н3COOH | 3:1ω1 | 3:1Δ2 | СН2=СН-СООН | |
| Метакриловая кислота | 2-метил-2-пропеновая кислота | С3Н5OOH | 4:1ω1 | 3:1Δ2 | СН2=С(СН3)-СООН | |
| Кротоновая кислота | 2-бутеновая кислота | С3Н5СOOH | 4:1ω2 | 4:1Δ2 | СН2-СН=СН-СООН | |
| Винилуксусная кислота | 3-бутеновая кислота | С3Н6СOOH | 4:1ω1 | 4:1Δ3 | СН2=СН-СН2-СООН | |
| Лауроолеиновая кислота | цис-9-додеценовая кислота | С11Н21СOOH | 12:1ω3 | 12:1Δ9 | СН3-СН2-СН=СН-(СН2)7-СООН | |
| Миристоолеиновая кислота | цис-9-тетрадеценовая кислота | С13Н25СOOH | 14:1ω5 | 14:1Δ9 | СН3-(СН2)3-СН=СН-(СН2)7-СООН | |
| Пальмитолеиновая кислота | цис-9-гексадеценовая кислота | С15Н29СOOH | 16:1ω7 | 16:1Δ9 | СН3-(СН2)5-СН=СН-(СН2)7-СООН | |
| Петроселиновая кислота | цис-6-октадеценовая кислота | С17Н33СOOH | 18:1ω12 | 18:1Δ6 | СН3-(СН2)16-СН=СН-(СН2)4-СООН | |
| Олеиновая кислота | цис-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3-(СН2)7-СН=СН-(СН2)7-СООН | |
| Элаидиновая кислота | транс-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3-(СН2)7-СН=СН-(СН2)7-СООН | |
| Цис-вакценовая кислота | цис-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | 18:1Δ11 | СН3-(СН2)5-СН=СН-(СН2)9-СООН | |
| Транс-вакценовая кислота | транс-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | СН3-(СН2)5-СН=СН-(СН2)9-СООН | ||
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | С19Н37СOOH | 20:1ω11 | 19:1Δ9 | СН3-(СН2)9-СН=СН-(СН2)7-СООН | |
| Гондоиновая кислота | цис-11-эйкозеновая кислота | С19Н37СOOH | 20:1ω9 | 20:1Δ11 | СН3-(СН2)7-СН=СН-(СН2)9-СООН | |
| Эруковая кислота | цис-9-доказеновая кислота | С21Н41СOOH | 22:1ω13 | 22:1Δ9 | СН3-(СН2)11-СН=СН-(СН2)7-СООН | |
| Нервоновая кислота | цис-15-тетракозеновая кислота | С23Н45СOOH | 24:1ω9 | 23:1Δ15 | СН3 -(СН2)7-СН=СН-(СН2)13-СООН |
Полиненасыщенные жирные кислоты
Общая формула: СН3-(СН2)m-(CH=CH-(CH2)х(СН2)n-COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | IUPAC формула (с метил. конца) конца) | IUPAC формула (с карб.конца) | Рациональная полуразвернутая формула | |
|---|---|---|---|---|---|---|
| Сорбиновая кислота | транс,транс-2,4-гексадиеновая кислота | С5Н7COOH | 6:2ω3 | 6:2Δ2,4 | СН3-СН=СН-СН=СН-СООН | |
| Линолевая кислота | цис,цис-9,12-октадекадиеновая кислота | С17Н31COOH | 18:2ω6 | 18:2Δ9,12 | СН3(СН2)3-(СН2 | |
| Линоленовая кислота | цис,цис,цис-6,9,12-октадекатриеновая кислота | С17Н28COOH | 18:3ω6 | 18:3Δ6,9,12 | СН3-(СН2)-(СН2-СН=СН)3-(СН2)6-СООН | |
| Линоленовая кислота | цис,цис,цис-9,12,15-октадекатриеновая кислота | С17Н29COOH | 18:3ω3 | 18:3Δ9,12,15 | СН3-(СН2-СН=СН)3-(СН2)7-СООН | |
| Арахидоновая кислота | цис-5,8,11,14-эйкозотетраеновая кислота | С19Н31COOH | 20:4ω6 | 20:4Δ5,8,11,14 | СН3-(СН2)4-(СН=СН-СН2)4-(СН2)2-СООН | |
| Дигомо-γ-линоленовая кислота | 8,11,14-эйкозатриеновая кислота | С19Н33COOH | 20:3ω6 | 20:3Δ8,11,14 | СН3-(СН2)4-(СН=СН-СН2)3-(СН2)5-СООН | |
| — | 4,7,10,13,16-докозапентаеновая кислота | С19Н29COOH | 20:5ω4 | 20:5Δ4,7,10,13,16 | СН3-(СН2)2-(СН=СН-СН2)5-(СН2)-СООН | |
| Тимнодоновая кислота | 5,8,11,14,17-эйкозапентаеновая кислота | С19Н29COOH | 20:5ω3 | 20:5Δ5,8,11,14,17 | СН3-(СН2)-(СН=СН-СН2)5-(СН2)2-СООН | |
| Цервоновая кислота | 4,7,10,13,16,19-докозагексаеновая кислота | С21Н31COOH | 22:6ω3 | 22:3Δ4,7,10,13,16,19 | СН3-(СН2)-(СН=СН-СН2)6-(СН2)-СООН | |
| — | 5,8,11-эйкозатриеновая кислота | С19Н33COOH | 20:3ω9 | 20:3Δ5,8,11 | СН3-(СН2)7-(СН=СН-СН2)3-(СН2)2-СООН |
Примечания
- ↑ fatty acids // IUPAC Gold Book
- ↑ Обмен липидов
См.
 также
также- Синтаза жирных кислот
- Пищевые добавки
- Полиненасыщенные жирные кислоты
Жирные кислоты | это… Что такое Жирные кислоты?
Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными[1].
Содержание
|
Общие сведения
Жирные кислоты могут быть насыщенными (только с одинарными связями между атомами углерода), мононенасыщенными (с одной двойной связью между атомами углерода) и полиненасыщенными (с двумя и более двойными связями, находящимися, как правило, через CH2-группу). Они различаются по количеству углеродных атомов в цепи, а также, в случае ненасыщенных кислот, по положению, конфигурации (как правило цис-) и количеству двойных связей. Жирные кислоты можно условно поделить на низшие (до семи атомов углерода), средние (восемь — двенадцать атомов углерода) и высшие (более двенадцати атомов углерода). Исходя из исторического названия данные вещества должны быть компонентами жиров. На сегодня это не так; термин «жирные кислоты» подразумевает под собой более широкую группу веществ.
Карбоновые кислоты начиная с масляной кислоты (С4) считаются жирными, в то время как жирные кислоты, полученные непосредственно из животных жиров, имеют в основном восемь и больше атомов углерода (каприловая кислота). Число атомов углерода в натуральных жирных кислотах в основном чётное, что обусловлено их биосинтезом с участием ацетил-кофермента А.
Большая группа жирных кислот (более 400 различных структур, хотя только 10—12 распространены) находятся в растительных маслах семян. Наблюдается высокое процентное содержание редких жирных кислот в семенах определённых семейств растений.
Под незаменимыми понимаются те жирные кислоты, которые не могут быть синтезированы в организме. Для человека незаменимыми являются кислоты, содержащие по крайней мере одну двойную связь на расстоянии более девяти атомов углерода от карбоксильной группы.
Биохимия
Расщепление
Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При потребности под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза.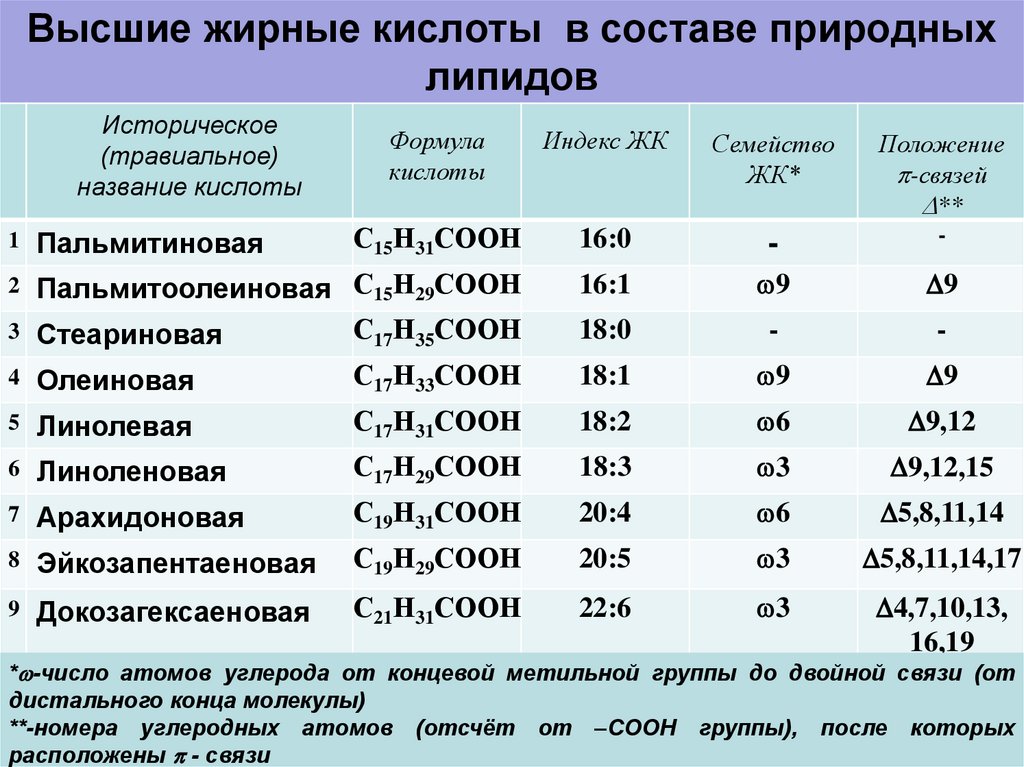 Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi).
Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi).
- R-COOH + КоА-SH + АТФ → R-CO-S-КоА + 2Pi + H+ + АМФ
Синтез
В растительном и животном организме жирные кислоты образуются, как продукты углеводного и жирового обмена. Синтез жирных кислот осуществляется в противоположность расщеплению в цитозоле.
Циркуляция
Пищеварение и всасывание
Коротко- и среднецепочечные жирные кислоты всасываются напрямую в кровь через капилляры кишечного тракта и проходят через воротную вену, как и другие питательные вещества. Более длинноцепочечные слишком велики, чтобы проникнуть напрямую через маленькие капилляры кишечника. Вместо этого они поглощаются жирными стенками ворсинок кишечника и заново синтезируются в триглицериды. Триглицериды покрываются холестерином и белками с образованием хиломикрона. Внутри ворсинки хиломикрон попадает в лимфатические сосуды, так называемый млечный капилляр, где поглощается большими лимфатическими сосудами. Он транспортируется по лимфатической системе вплоть до места, близкого к сердцу, где кровеносные артерии и вены наибольшие. Грудной канал освобождает хиломикрон в кровоток посредством подключичной вены. Таким образом триглицериды транспортируются в места, где в них нуждаются. [2]
Триглицериды покрываются холестерином и белками с образованием хиломикрона. Внутри ворсинки хиломикрон попадает в лимфатические сосуды, так называемый млечный капилляр, где поглощается большими лимфатическими сосудами. Он транспортируется по лимфатической системе вплоть до места, близкого к сердцу, где кровеносные артерии и вены наибольшие. Грудной канал освобождает хиломикрон в кровоток посредством подключичной вены. Таким образом триглицериды транспортируются в места, где в них нуждаются. [2]
Виды существования в организме
Жирные кислоты существуют в различных формах на различных стадиях циркуляции в крови. Они поглощаются в кишечнике, образуя хиломикроны, но в то же время они существуют в виде липопротеинов очень низкой плотности или липопротеинов низкой плотности после превращений в печени. При выделении из адипоцитов жирные кислоты поступают в свободном виде в кровь.
Кислотность
Кислоты с коротким углеводородным хвостом, такие как муравьиная и уксусная кислоты, полностью смешиваются с водой и диссоциируют с образованием достаточно кислых растворов (pKa 3. 77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом незначительно отличаются по кислотности. Например, нонановая кислота имеет pKa 4.96. Однако с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате чего эти кислоты мало изменяют pH раствора. Значение величин pKa для данных кислот приобретает значение лишь в реакциях, в которые эти кислоты способны вступить. Кислоты, нерастворимые в воде, могут быть растворены в тёплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледнорозового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
77 и 4.76, соответственно). Жирные кислоты с более длинным хвостом незначительно отличаются по кислотности. Например, нонановая кислота имеет pKa 4.96. Однако с увеличением длины хвоста растворимость жирных кислот в воде уменьшается очень быстро, в результате чего эти кислоты мало изменяют pH раствора. Значение величин pKa для данных кислот приобретает значение лишь в реакциях, в которые эти кислоты способны вступить. Кислоты, нерастворимые в воде, могут быть растворены в тёплом этаноле, и оттитрованы раствором гидроксида натрия, используя фенолфталеин, в качестве индикатора до бледнорозового цвета. Такой анализ позволяет определить содержание жирных кислот в порции триглицеридов после гидролиза.
Реакции жирных кислот
Жирные кислоты реагируют так же, как и другие карбоновые кислоты, что подразумевает этерификацию и кислотные реакции. Восстановление жирных кислот приводит к жирным спиртам. Ненасыщенные жирные кислоты также могут вступать в реакции присоединения; наиболее характерно гидрирование, которое используется для превращения растительных жиров в маргарин. В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природных жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут быть расщеплены в расплавленной щёлочи. Эта реакция имеет значение для определения структуры ненасыщенных жирных кислот.
В результате частичного гидрирования ненасыщенных жирных кислот цис-изомеры, характерные для природных жиров, могут перейти в транс-форму. В реакции Варрентраппа ненасыщенные жиры могут быть расщеплены в расплавленной щёлочи. Эта реакция имеет значение для определения структуры ненасыщенных жирных кислот.
Автоокисление и прогоркание
Жирные кислоты при комнатной температуре подвергаются автоокислению и прогорканию. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжёлые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокисление. Чтобы избежать этого, жиры и масла часто обрабатываются хелатирующими агентами, такими как лимонная кислота.
Применение
Натриевые и калиевые соли высших жирных кислот являются эффективными ПАВ и используются в качестве мыл. В пищевой промышленности жирные кислоты зарегистрированы в качестве пищевой добавки E570, как стабилизатор пены, глазирователь и пеногаситель. [1]
[1]
Разветвлённые жирные кислоты
Разветвлённые карбоновые кислоты липидов обычно не относятся к собственно жирным кислотам, но рассматриваются как их метилированные производные. Метилированные по предпоследнему атому углерода (изо-жирные кислоты) и по третьему от конца цепи (антеизо-жирные кислоты) входят в качестве минорных компонент в состав липидов бактерий и животных.
Разветвленные карбоновые кислоты также входят в состав эфирных масел некоторых растений: так, например, в эфирном масле валерианы содержится изовалериановая кислота:
Основные жирные кислоты
Насыщенные жирные кислоты
Общая формула: CnH2n+1COOH или CH3-(CH2)n-COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | Рациональная полуразвернутая формула | Нахождение | Т.пл. | pKa |
|---|---|---|---|---|---|---|
| Масляная кислота | Бутановая кислота | C3H7COOH | CH3(CH2)2COOH | Сливочное масло, древесный уксус | −8 °C | 4,82 |
| Капроновая кислота | Гексановая кислота | C5H11COOH | CH3(CH2)4COOH | Нефть | −4 °C | 4,85 |
| Каприловая кислота | Октановая кислота | C7H15COOH | CH3(CH2)6COOH | 17 °C | 4,89 | |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH | CH3(CH2)7COOH | 12,5 °C | 4. 96 96 | |
| Каприновая кислота | Декановая кислота | C9H19COOH | CH3(CH2)8COOH | Кокосовое масло | 31 °C | |
| Лауриновая кислота | Додекановая кислота | С11Н23СООН | CH3(CH2)10COOH | 43,2 °C | ||
| Миристиновая кислота | Тетрадекановая кислота | С13Н27СООН | CH3(CH2)12COOH | 53,9 °C | ||
| Пальмитиновая кислота | Гексадекановая кислота | С15Н31СООН | CH3(CH2)14COOH | 62,8 °C | ||
| Маргариновая кислота | Гептадекановая кислота | С16Н33СООН | CH3(CH2)15COOH | 61,3 °C | ||
| Стеариновая кислота | Октадекановая кислота | С17Н35СООН | CH3(CH2)16COOH | 69,6 °C | ||
| Арахиновая кислота | Эйкозановая кислота | С19Н39СООН | CH3(CH2)18COOH | 75,4 °C | ||
| Бегеновая кислота | Докозановая кислота | С21Н43СООН | CH3(CH2)20COOH | |||
| Лигноцериновая кислота | Тетракозановая кислота | С23Н47СООН | CH3(CH2)22COOH | |||
| Церотиновая кислота | Гексакозановая кислота | С25Н51СООН | CH3(CH2)24COOH | |||
| Монтановая кислота | Октакозановая кислота | С27Н55СООН | CH3(CH2)26COOH |
Мононенасыщенные жирные кислоты
Общая формула: СН3-(СН2)m-CH=CH-(CH2)n-COOH (m=ω-2; n=Δ-2)
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | IUPAC формула (с метил. конца) конца) | IUPAC формула (с карб.конца) | Рациональная полуразвернутая формула | |
|---|---|---|---|---|---|---|
| Акриловая кислота | 2-пропеновая кислота | С2Н3COOH | 3:1ω1 | 3:1Δ2 | СН2=СН-СООН | |
| Метакриловая кислота | 2-метил-2-пропеновая кислота | С3Н5OOH | 4:1ω1 | 3:1Δ2 | СН2=С(СН3)-СООН | |
| Кротоновая кислота | 2-бутеновая кислота | С3Н5СOOH | 4:1ω2 | 4:1Δ2 | СН2-СН=СН-СООН | |
| Винилуксусная кислота | 3-бутеновая кислота | С3Н6СOOH | 4:1ω1 | 4:1Δ3 | СН2=СН-СН2-СООН | |
| Лауроолеиновая кислота | цис-9-додеценовая кислота | С11Н21СOOH | 12:1ω3 | 12:1Δ9 | СН3-СН2-СН=СН-(СН2)7-СООН | |
| Миристоолеиновая кислота | цис-9-тетрадеценовая кислота | С13Н25СOOH | 14:1ω5 | 14:1Δ9 | СН3-(СН2)3-СН=СН-(СН2)7-СООН | |
| Пальмитолеиновая кислота | цис-9-гексадеценовая кислота | С15Н29СOOH | 16:1ω7 | 16:1Δ9 | СН3-(СН2)5-СН=СН-(СН2)7-СООН | |
| Петроселиновая кислота | цис-6-октадеценовая кислота | С17Н33СOOH | 18:1ω12 | 18:1Δ6 | СН3-(СН2)16-СН=СН-(СН2)4-СООН | |
| Олеиновая кислота | цис-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3-(СН2)7-СН=СН-(СН2)7-СООН | |
| Элаидиновая кислота | транс-9-октадеценовая кислота | С17Н33СOOH | 18:1ω9 | 18:1Δ9 | СН3-(СН2)7-СН=СН-(СН2)7-СООН | |
| Цис-вакценовая кислота | цис-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | 18:1Δ11 | СН3-(СН2)5-СН=СН-(СН2)9-СООН | |
| Транс-вакценовая кислота | транс-11-октадеценовая кислота | С17Н33СOOH | 18:1ω7 | 18:1Δ11 | СН3-(СН2)5-СН=СН-(СН2)9-СООН | |
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | С19Н37СOOH | 20:1ω11 | 19:1Δ9 | СН3-(СН2)9-СН=СН-(СН2)7-СООН | |
| Гондоиновая кислота | цис-11-эйкозеновая кислота | С19Н37СOOH | 20:1ω9 | 20:1Δ11 | СН3-(СН2)7-СН=СН-(СН2)9-СООН | |
| Эруковая кислота | цис-9-доказеновая кислота | С21Н41СOOH | 22:1ω13 | 22:1Δ9 | СН3-(СН2)11-СН=СН-(СН2)7-СООН | |
| Нервоновая кислота | цис-15-тетракозеновая кислота | С23Н45СOOH | 24:1ω9 | 23:1Δ15 | СН3-(СН2)7-СН=СН-(СН2)13-СООН |
Полиненасыщенные жирные кислоты
Общая формула: СН3-(СН2)m-(CH=CH-(CH2)х(СН2)n-COOH
| Тривиальное название | Систематическое название (IUPAC) | Брутто формула | IUPAC формула (с метил. конца) конца) | IUPAC формула (с карб.конца) | Рациональная полуразвернутая формула | |
|---|---|---|---|---|---|---|
| Сорбиновая кислота | транс,транс-2,4-гексадиеновая кислота | С5Н7COOH | 6:2ω3 | 6:2Δ2,4 | СН3-СН=СН-СН=СН-СООН | |
| Линолевая кислота | цис,цис-9,12-октадекадиеновая кислота | С17Н31COOH | 18:2ω6 | 18:2Δ9,12 | СН3(СН2)3-(СН2-СН=СН)2-(СН2)7-СООН | |
| Линоленовая кислота | цис,цис,цис-6,9,12-октадекатриеновая кислота | С17Н28COOH | 18:3ω6 | 18:3Δ6,9,12 | СН3-(СН2)-(СН2-СН=СН)3-(СН2)6-СООН | |
| Линоленовая кислота | цис,цис,цис-9,12,15-октадекатриеновая кислота | С17Н29COOH | 18:3ω3 | 18:3Δ9,12,15 | СН3-(СН2-СН=СН)3-(СН2)7-СООН | |
| Арахидоновая кислота | цис-5,8,11,14-эйкозотетраеновая кислота | С19Н31COOH | 20:4ω6 | 20:4Δ5,8,11,14 | СН3-(СН2)4-(СН=СН-СН2)4-(СН2)2-СООН | |
| Дигомо-γ-линоленовая кислота | 8,11,14-эйкозатриеновая кислота | С19Н33COOH | 20:3ω6 | 20:3Δ8,11,14 | СН3-(СН2)4-(СН=СН-СН2)3-(СН2)5-СООН | |
| — | 4,7,10,13,16-докозапентаеновая кислота | С19Н29COOH | 20:5ω4 | 20:5Δ4,7,10,13,16 | СН3-(СН2)2-(СН=СН-СН2)5-(СН2)-СООН | |
| Тимнодоновая кислота | 5,8,11,14,17-эйкозапентаеновая кислота | С19Н29COOH | 20:5ω3 | 20:5Δ5,8,11,14,17 | СН3-(СН2)-(СН=СН-СН2)5-(СН2)2-СООН | |
| Цервоновая кислота | 4,7,10,13,16,19-докозагексаеновая кислота | С21Н31COOH | 22:6ω3 | 22:3Δ4,7,10,13,16,19 | СН3-(СН2)-(СН=СН-СН2)6-(СН2)-СООН | |
| — | 5,8,11-эйкозатриеновая кислота | С19Н33COOH | 20:3ω9 | 20:3Δ5,8,11 | СН3-(СН2)7-(СН=СН-СН2)3-(СН2)2-СООН |
Примечания
- ↑ fatty acids // IUPAC Gold Book
- ↑ Обмен липидов
См.
 также
также- Синтаза жирных кислот
- Пищевые добавки
- Полиненасыщенные жирные кислоты
Жирные кислоты | Определение, структура, функции, свойства и примеры
липидная структура
Посмотреть все СМИ
- Ключевые люди:
- Мишель-Эжен Шеврёль Омура Сатоши Конрад Э. Блох Федор Линен
- Похожие темы:
- простагландин ненасыщенные жиры олеиновая кислота стеариновая кислота пальмитиновая кислота
См. все связанные материалы →
жирная кислота , важный компонент липидов (жирорастворимых компонентов живых клеток) растений, животных и микроорганизмов. Как правило, жирная кислота состоит из прямой цепи с четным числом атомов углерода, с атомами водорода по всей длине цепи и на одном конце цепи и карбоксильной группой (—COOH) на другом конце. Именно эта карбоксильная группа делает его кислотой (карбоновой кислотой). Если все углерод-углеродные связи одинарные, кислота насыщена; если какая-либо из связей двойная или тройная, кислота ненасыщенная и более реакционноспособная. Несколько жирных кислот имеют разветвленные цепи; другие содержат кольцевые структуры (например, простагландины). Жирные кислоты не встречаются в природе в свободном состоянии; обычно они существуют в сочетании с глицерином (спиртом) в форме триглицеридов.
Именно эта карбоксильная группа делает его кислотой (карбоновой кислотой). Если все углерод-углеродные связи одинарные, кислота насыщена; если какая-либо из связей двойная или тройная, кислота ненасыщенная и более реакционноспособная. Несколько жирных кислот имеют разветвленные цепи; другие содержат кольцевые структуры (например, простагландины). Жирные кислоты не встречаются в природе в свободном состоянии; обычно они существуют в сочетании с глицерином (спиртом) в форме триглицеридов.
Среди наиболее широко распространенных жирных кислот 16- и 18-углеродные жирные кислоты, также известные как пальмитиновая кислота и стеариновая кислота, соответственно. И пальмитиновая, и стеариновая кислоты встречаются в липидах большинства организмов. У животных пальмитиновая кислота составляет до 30 процентов жира в организме. На его долю приходится от 5 до 50 процентов липидов в растительных жирах, особенно в пальмовом масле. Стеариновая кислота содержится в большом количестве в некоторых растительных маслах (например, в масле какао и масле ши) и составляет относительно большую часть липидов, содержащихся в жире жвачных животных.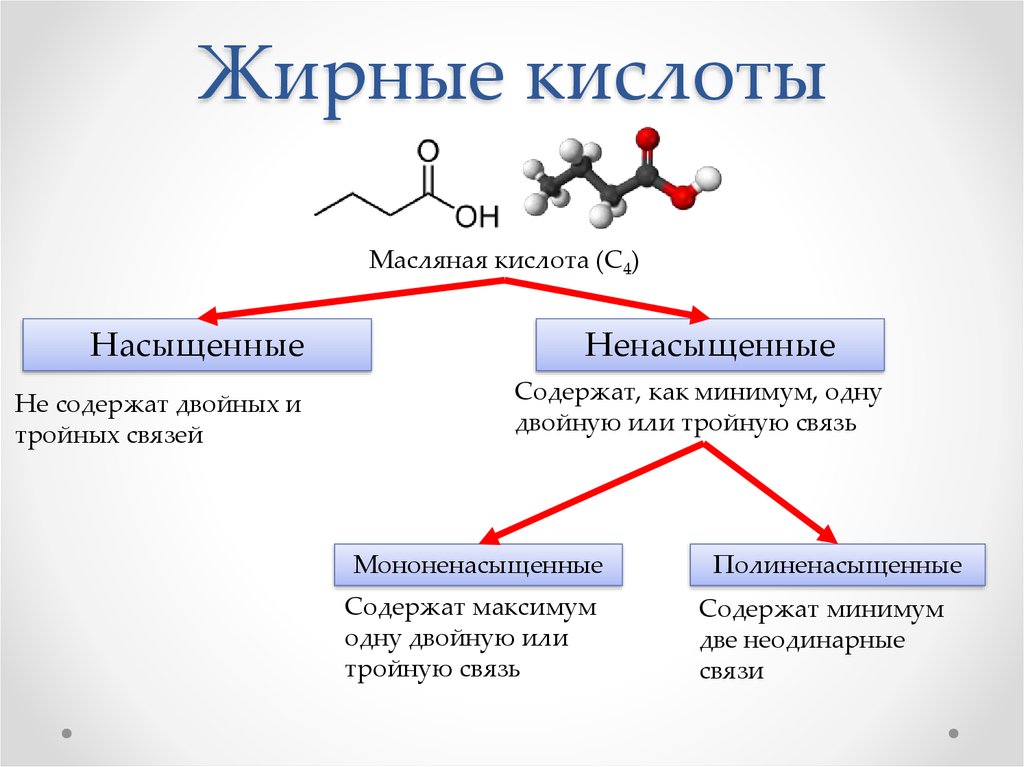
More From Britannica
липиды: жирные кислоты
Многие животные не могут синтезировать линолевую кислоту (жирную кислоту омега-6) и альфа-линоленовую кислоту (жирную кислоту омега-3). Однако эти жирные кислоты необходимы для клеточных процессов и производства других необходимых жирных кислот омега-3 и омега-6. Таким образом, поскольку они должны поступать с пищей, их называют незаменимыми жирными кислотами. Жирные кислоты омега-6 и омега-3, полученные из линолевой кислоты и альфа-линоленовой кислоты, соответственно, условно необходимы многим млекопитающим — они образуются в организме из исходных жирных кислот, но не всегда в количествах, необходимых для поддержания оптимального здоровья или разработка. Например, считается, что младенцы человека имеют условно необходимую потребность в докозагексаеновой кислоте (ДГК), производной альфа-линоленовой кислоты, и, возможно, также в арахидоновой кислоте, производной линолевой кислоты.
Жирные кислоты имеют широкий спектр коммерческого применения. Например, они используются не только в производстве многочисленных продуктов питания, но и в мыле, моющих и косметических средствах. Мыла представляют собой натриевые и калиевые соли жирных кислот. Некоторые средства по уходу за кожей содержат жирные кислоты, которые помогают поддерживать здоровый вид и функции кожи. Жирные кислоты, особенно жирные кислоты омега-3, также обычно продаются в качестве пищевых добавок.
Например, они используются не только в производстве многочисленных продуктов питания, но и в мыле, моющих и косметических средствах. Мыла представляют собой натриевые и калиевые соли жирных кислот. Некоторые средства по уходу за кожей содержат жирные кислоты, которые помогают поддерживать здоровый вид и функции кожи. Жирные кислоты, особенно жирные кислоты омега-3, также обычно продаются в качестве пищевых добавок.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Карой Роджерс.
Омура Сатоши | Японский микробиолог
Омура Сатоши
Смотреть все медиа
- Дата рождения:
- 12 июля 1935 г. (87 лет) Яманаси Япония
- Награды и награды:
- Нобелевская премия (2015)
- Предметы изучения:
- глистогонный жирная кислота паразитизм
Посмотреть весь связанный контент →
Омура Сатоши (родился 12 июля 1935 года, префектура Яманаси, Япония), японский микробиолог, известный своими открытиями натуральных продуктов, в частности, из почвенных бактерий. Особое значение имело открытие Омурой бактерии Streptomyces avermitilis , из которой было выделено антигельминтное соединение авермектин. Производное авермектина, известное как ивермектин, стало ключевым лекарством, используемым для борьбы с некоторыми паразитарными заболеваниями у людей и других животных. За свой вклад в открытие авермектина и ивермектина Омура получил Нобелевскую премию по физиологии и медицине 2015 года (совместно с американским паразитологом ирландского происхождения Уильямом Кэмпбеллом и китайским ученым Ту Юю).
Особое значение имело открытие Омурой бактерии Streptomyces avermitilis , из которой было выделено антигельминтное соединение авермектин. Производное авермектина, известное как ивермектин, стало ключевым лекарством, используемым для борьбы с некоторыми паразитарными заболеваниями у людей и других животных. За свой вклад в открытие авермектина и ивермектина Омура получил Нобелевскую премию по физиологии и медицине 2015 года (совместно с американским паразитологом ирландского происхождения Уильямом Кэмпбеллом и китайским ученым Ту Юю).
Омура получил степень бакалавра в 1958 году в Университете Яманаси и степень магистра в 1963 году в Токийском научном университете. В 1968 году он защитил кандидатскую диссертацию. получил степень доктора фармацевтических наук в Токийском университете, а два года спустя, вернувшись в Токийский научный университет, он также получил степень доктора философии. в химии. С 1963 по 1965 год Омура работал научным сотрудником в Университете Яманаси, а затем служил под тем же званием в Институте Китасато, который в то время был одним из ведущих мировых центров микробиологических исследований. Заканчивая докторскую диссертацию. учась и проводя исследования в институте, он занял должность адъюнкт-профессора в близлежащем университете Китасато. Между 1968 и 2007 г., когда Омура был назначен почетным профессором Университета Китасато, он занимал различные должности директора и президента Института Китасато, а также профессора и директора университета (университет стал частью института в 2008 г.). В 2013 году ему было присвоено звание заслуженного профессора Китасато.
Заканчивая докторскую диссертацию. учась и проводя исследования в институте, он занял должность адъюнкт-профессора в близлежащем университете Китасато. Между 1968 и 2007 г., когда Омура был назначен почетным профессором Университета Китасато, он занимал различные должности директора и президента Института Китасато, а также профессора и директора университета (университет стал частью института в 2008 г.). В 2013 году ему было присвоено звание заслуженного профессора Китасато.
Викторина «Британника»
Наука: правда или вымысел?
С середины 1960-х годов исследования Омуры были сосредоточены на открытии и выделении встречающихся в природе биоактивных химических соединений из микроорганизмов, особенно из бактерий, живущих в почве. Омура разработал новые методы, которые облегчили рост почвенных бактерий в лабораторных культурах и позволили охарактеризовать вещества, которые они производят. Среди его первых крупных открытий была идентификация в середине 1970-х годов церуленина, антибиотика, вырабатываемого одним из видов грибков.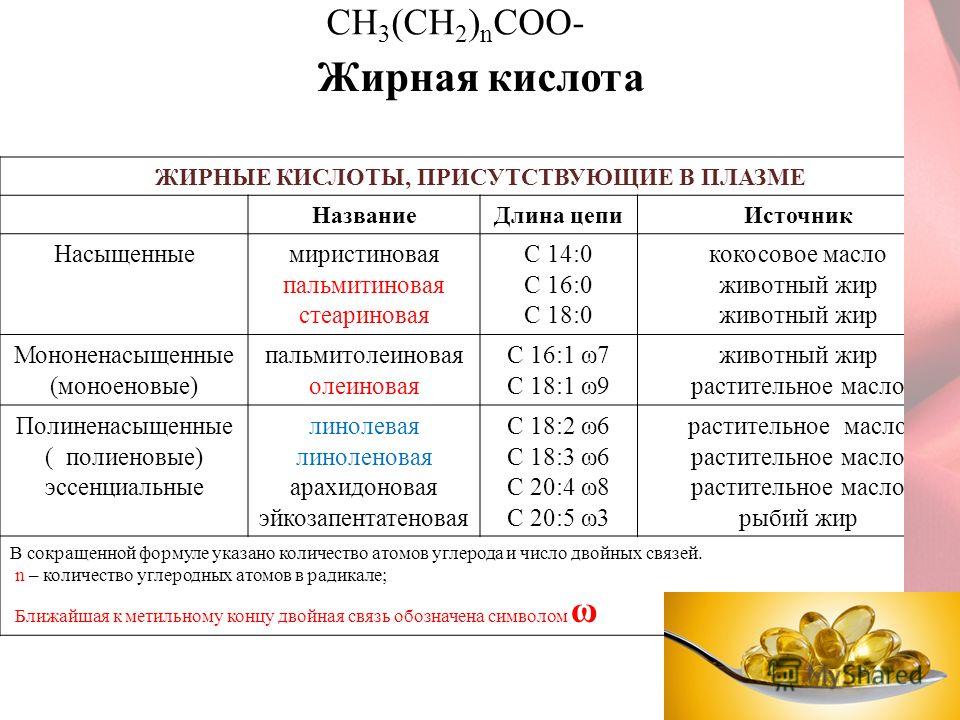 Омура обнаружил, что церуленин ингибирует биосинтез жирных кислот. Соединение впоследствии стало важным исследовательским инструментом.
Омура обнаружил, что церуленин ингибирует биосинтез жирных кислот. Соединение впоследствии стало важным исследовательским инструментом.
Также в середине 1970-х Омура обнаружил и успешно культивировал новые штаммы почвенных бактерий Streptomyces , в том числе S. avermitilis . Омура отправил культуру S. avermitilis исследователям в исследовательские лаборатории Merck в США. Там из бульона, собранного из культур организма, паразитолог Уильям Кэмпбелл и его коллеги выделили новое семейство соединений, известных как авермектины. Исследователи Merck впоследствии модифицировали структуру авермектина, тем самым производя ивермектин, который, как было обнаружено, активен против микрофилярий (личинок) некоторых нитевидных нематод. Ивермектин стал одним из самых важных антигельминтных средств в мире, его используют для лечения различных паразитарных заболеваний, связанных с микрофиляриями, у людей и других животных. У людей препарат оказался особенно ценным для предотвращения речной слепоты и лимфатического филяриатоза (слоновости), которые были основными причинами изнурительных болезней в тропиках.
 также
также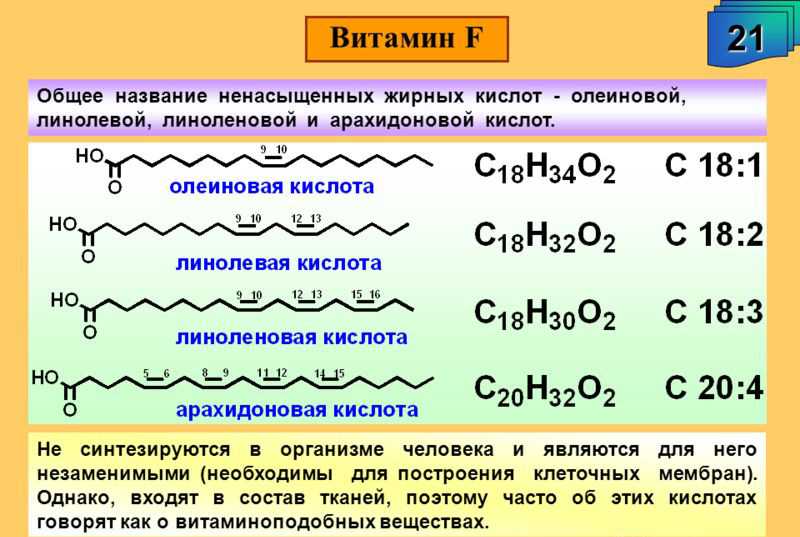 1 Насыщенные жирные кислоты
1 Насыщенные жирные кислоты