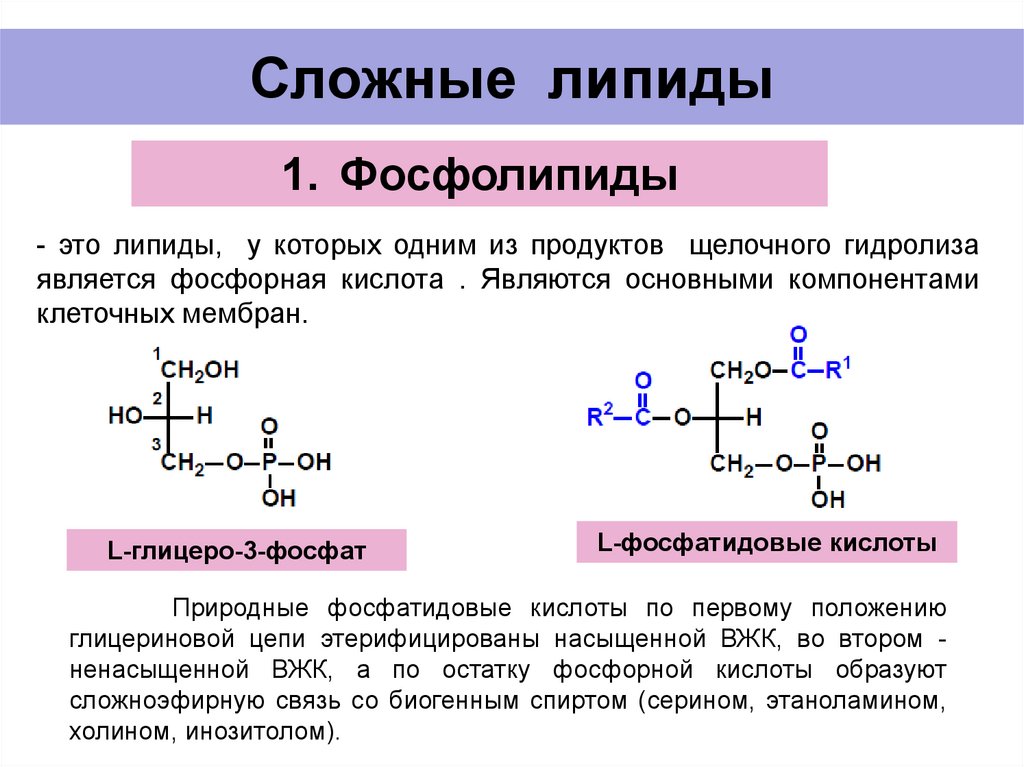
Карбоновые кислоты – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Если внимательно посмотреть на представленные химические формулы, во всех можно заметить общую часть , при записи химических формул используется буквенное обозначение СООН .
Эта часть называется карбоксильной группой, именно она определяет общие свойства, характерные для всей группы карбоновых кислот.
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Определение
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Классификация
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
-
одноосновные (муравьиная)
-
-
многоосновные (лимонная)
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
-
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.

-
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
-
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
В группу карбоновых кислот входят вещества с различными углеводородными радикалами. Если количество атомов углерода в составе радикала больше шести — карбоновую кислоту называют жирной.
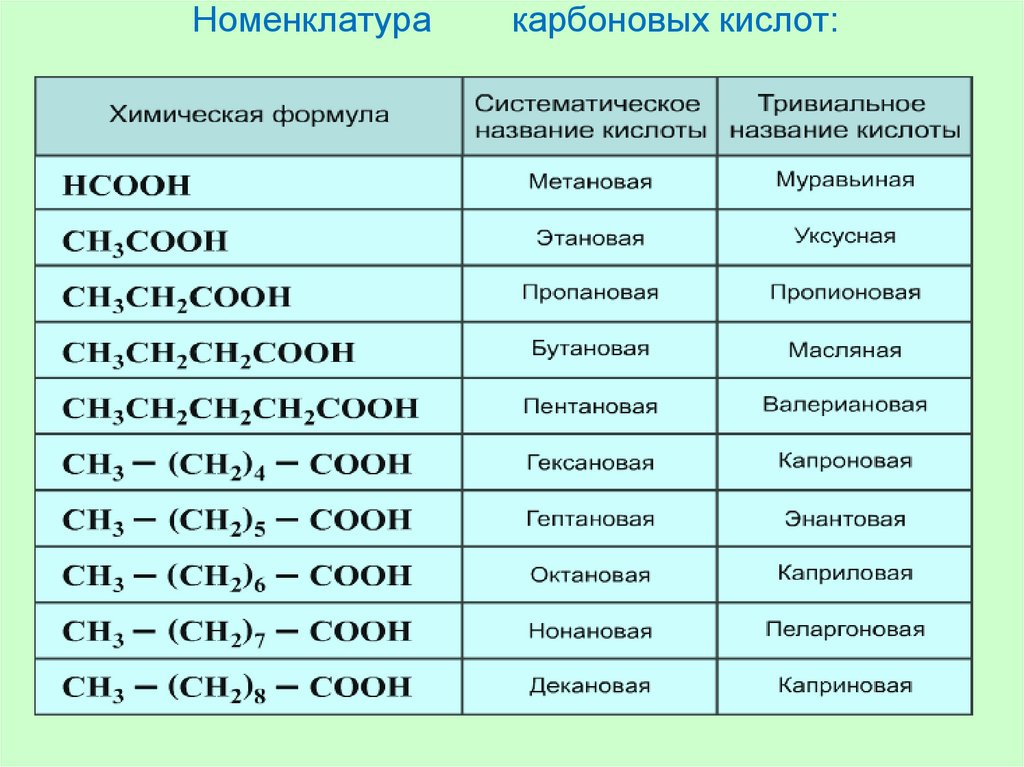
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
3. Добавить -овая кислота.
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
C2H5OH + O2 —> CH3COOH + H2O
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) CO2 + H2O + 2Ag
Больше интересных материалов:
- Массовая доля вещества
- Технология критического мышления на уроке химии
- Почему лимон кислый?
- Ведение нормативной документации в кабинете химии
- Методическая помощь учителю химии
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O22 RCOOH
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 RCOOH + H2O
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 4 CH3COOH + 2 H2O
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
-
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
-
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом.
 маслянистые на ощупь.
маслянистые на ощупь.
-
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.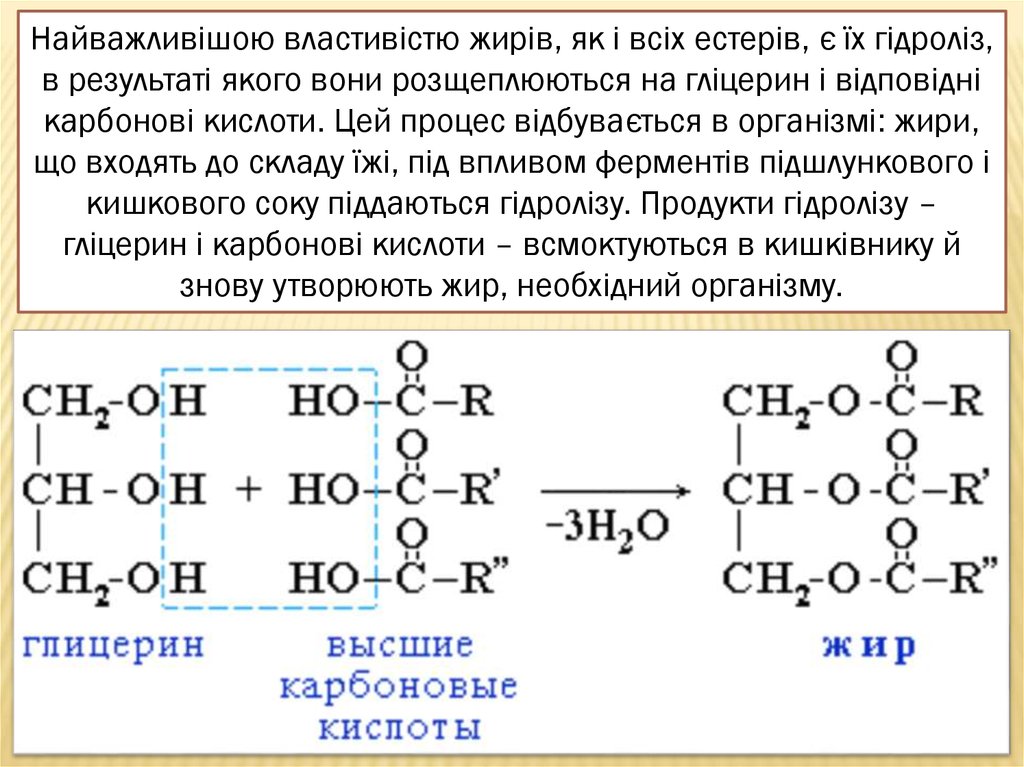
Mg + 2 CH3COOH —> (CH3COO)2Mg + H2
CaO + 2 CH3COOH —> (CH3COO)2Mg + H2
NaOH + CH3COOH —> CH3COONa + H2O
K2CO3 + 2 CH3COOH —> 2 CH3COOK + H2O + CO2
3. Сложные эфиры образуются в реакциях карбоновых кислот со спиртами.
#ADVERTISING_INSERT#
Роль жирных кислот в организме человека
Омега-3, омега-6, омега-9: что такое жирные кислоты и зачем они нужны
Что такое омега жирные кислоты? Жиры — природные органические соединения, представляющие собой полные сложные эфиры трехатомного спирта глицерина ижирных кислот. Все жирные кислоты имеют четное число атомов углерода, которые присоединены друг к другу по цепи. Некоторые из них имеют простые связи между атомами углерода и называются насыщенными жирами, другие же имеют двойные связи и считаются ненасыщенными. Омега-3, омега-6 и омега-9 — все эти типы естественных ненасыщенных жиров, которые большинство экспертов в области здорового питания считают значительно полезнее, чем насыщенные жиры.
Некоторые из них имеют простые связи между атомами углерода и называются насыщенными жирами, другие же имеют двойные связи и считаются ненасыщенными. Омега-3, омега-6 и омега-9 — все эти типы естественных ненасыщенных жиров, которые большинство экспертов в области здорового питания считают значительно полезнее, чем насыщенные жиры.
Если обратиться к химической структуре — начало углеродной цепи называется «альфа», а ее конец — «омега». Омега-3 кислоты имеют тройку в названии, потому что первая молекула с двойной связью находится на три атома углерода от омега-конца (то же самое — с омега-6 и омега-9 жирными кислотами). Условно все жирные кислоты делят на две группы:
- мононенасыщенные — соседние атомы углерода имеют не более одной двойной связи (омега-9). Эти кислоты не относятся к группе незаменимых кислот.
- полиненасыщенные – здесь связей больше (омега-3 и омега-6).Полиненасыщенные жирные кислоты являются одним из очень важных базовых элементов здоровья человека и относятся к незаменимым факторам питания.
 Они не образуются в организме и должны поступать с пищей.
Они не образуются в организме и должны поступать с пищей.
Наиболее изученными жирными кислотами являются:
из Омега -9:
- олеиновая кислота
- эруковая кислота
- эйкозеновая кислота
- мидовая кислота
- элаидиновая кислота
- нервоновая или селахолевая кислота
Источниками Омега- 9 являются: оливковое масло, арахис, авокадо, орехи и семечки, семена горчицы, льна, кунжута, а также лососевые рыбы.Некоторые из входящих в комплекс Омега -9 жирных кислот при чрезмерном и несбалансированном поступлении имеют свойство накапливаться в организме, что, разумеется, не очень хорошо для здоровья человека. Полезным в Омега -9 является то, что они повышают усвоение глюкозы и этим предупреждают развитие диабета и метаболического синдрома, предотвращают развитие рака молочной железы у женщин, а также участвуют в укреплении иммунитета. Кроме того, Омега -9 снижают уровень холестерина в крови и препятствуют оседанию холестериновых бляшек на стенках сосудов, снижая таким образом риск развития атеросклероза. Омега- 9 снижают риск развития хронических воспалений в организме за счет улучшения тканевого метаболизма. Суточная норма потребности организма человека в мононенасыщенных жирах Омега-9 колеблется в пределах 15-20% от общей калорийности пищевого рациона. В зависимости от общих показателей здоровья, возрастных особенностей и условий проживания, показатель суточной потребности может изменяться.
Кроме того, Омега -9 снижают уровень холестерина в крови и препятствуют оседанию холестериновых бляшек на стенках сосудов, снижая таким образом риск развития атеросклероза. Омега- 9 снижают риск развития хронических воспалений в организме за счет улучшения тканевого метаболизма. Суточная норма потребности организма человека в мононенасыщенных жирах Омега-9 колеблется в пределах 15-20% от общей калорийности пищевого рациона. В зависимости от общих показателей здоровья, возрастных особенностей и условий проживания, показатель суточной потребности может изменяться.
из Омега- 6:
- линолевая (ЛК, или, в англоязычном варианте, LA)
- арахидоновая (АРК или ARA)
Источники Омега-6 весьма обширны: в первую очередь это растительные масла — пальмовое, соевое, рапсовое, подсолнечное, энотеры, бораго, чёрной смородины, соевое, конопляное, кукурузное, хлопковое и сафлоровое. Кроме растительных масел, Омега- 6 много в мясе птицы, яйцах, подсолнечных и тыквенных семечках, авокадо, злаках и хлебе, орехах кешью, пекан и кокосовых.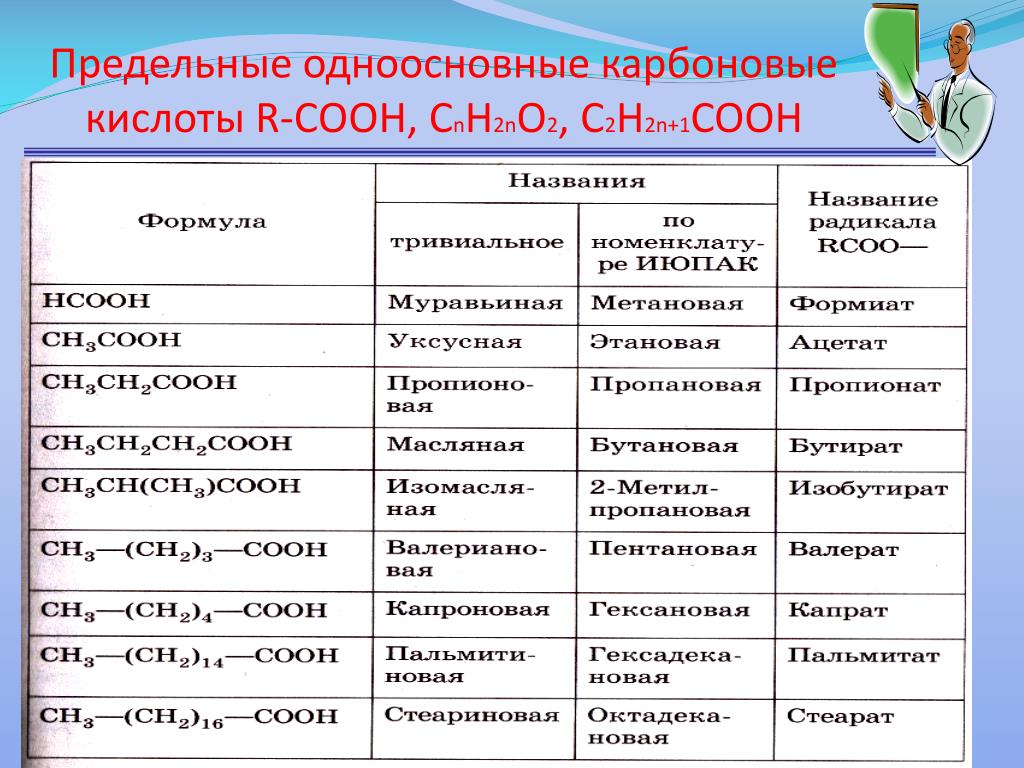 Омега-6 обеспечивает здоровье нашей коже и снижает уровень холестерина, улучшает свёртываемость крови, снимает воспаления, ослабляет боль. Потребность организма в Омега-6 индивидуальна для каждого человека и находится в пределах 4,5 – 8 граммов в день (5 – 8% от общей калорийности пищевого рациона).
Омега-6 обеспечивает здоровье нашей коже и снижает уровень холестерина, улучшает свёртываемость крови, снимает воспаления, ослабляет боль. Потребность организма в Омега-6 индивидуальна для каждого человека и находится в пределах 4,5 – 8 граммов в день (5 – 8% от общей калорийности пищевого рациона).
При этом важно соблюдать соотношение Омега-3 и Омега-6 в рационе. Оптимальным соотношением Омега-3 и Омега- 6 является 1:4, но к сожалению в современном питании это соотношение иногда перекошено в пользу Омега-6 подчас в десятки раз.
из Омега- 3:
- эйкозапентаеновая (ЭПК или EPA)
- докозагексаеновая (ДГК, или DHA)
- альфа-линоленовая (АЛК или ALA)
Источником Омега -3 является, прежде всего, морская рыба. Больше всего Омега-3 содержит жирная и полужирная рыба (скумбрия, сардина, лосось, тунец и др.). Наибольшая польза от свежей рыбы, но есть жирные кислоты и в рыбных консервах в масле.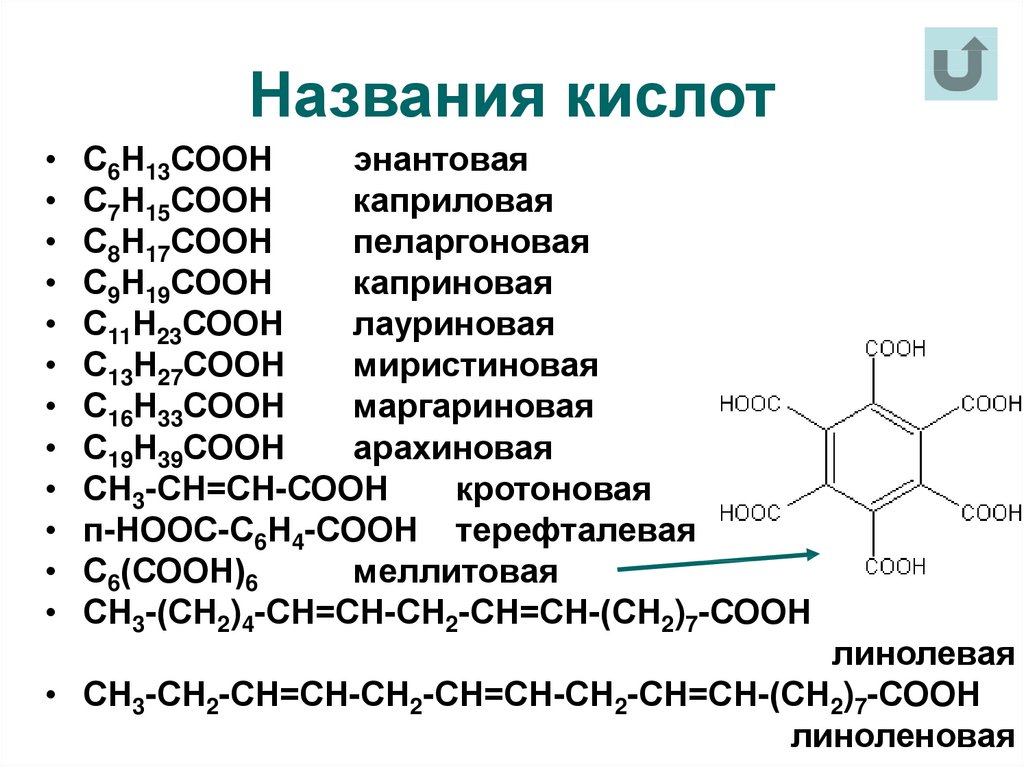
Из растений наибольшим содержанием Омега-3 могут похвастаться льняное семя и кунжут. Поэтому льняным и кунжутным маслом рекомендуется заправлять овощные салаты. Можно употреблять и порошок из семени льна, он хорош тем, что в нем еще и содержится клетчатка. Много Омега-3 в грецких орехах. Есть Омега-3 (хотя и в меньших количествах) в фасоли, цветной капусте, шпинате, брокколи.
Основная польза омега — 3 жирных кислот заключена в их способности укреплять структуру клеточных мембран. Попадая внутрь организма, кислоты улучшают клеточную деятельность, что естественным образом влияет на нормальное функционирование всех органов и систем организма.
Достаточное количество в организме омега- 3 жирных кислот позволяет достичь следующих результатов:
- улучшается работа мозга, сердечно — сосудистой системы и ЖКТ;
- нормализуется эмоциональное и психологическое состояние человека, после чего пропадает хроническая усталость, раздражение, депрессия;
- пропадают болевые ощущения и воспаление при артрозе и ревматизме;
- улучшается половая функция у мужчин;
- понижается уровень холестерина;
- улучшается работа нервной системы;
- стимулируются репродуктивная система;
- укрепляется иммунная система и выравнивается гормональный фон;
- повышается способность организма к регенерации, быстрому заживлению ран и повреждений внутренних органов;
- организм омолаживается естественным образом, повышается тонус и эластичность кожи, укрепляются ногти и волосяные луковицы;
- существенно снижается вероятность развития онкологических заболеваний.

Современные исследования установили, что на сегодняшний день среднестатистический человек потребляет этих полезных жиров непозволительно мало. Было установлено, что в рационе взрослого человека количество Омега-3 жиров составляет лишь 50-70% от жизненно необходимой нормы. Поэтому особое внимание следует уделять формированию своего пищевого рациона. Для этого необходимо знать, в каких продуктах можно найти эти необходимые Омега-3 жирные кислоты.
Оптимальное ежедневное потребление Омега-3 1 грамм в сутки. Именно такое количество необходимо для нормального функционирования клеток организма. Если перевести на пищевые продукты, то это (на выбор): 1 ст. ложка рапсового масла, 1 чайная ложка льняного семени, 5-10 штук не жареных орехов, 70 граммов лосося, 90 граммов консервированных сардин, 120 граммов тунца.
Противопоказаниями к употреблению омега- 3 являются:
- склонность к аллергии на любой вид морепродуктов;
- тяжёлые травмы, кровопотери;
- послеоперационный период;
- геморрой, болезни желчевыводящих путей, почек и печени;
- активная форма туберкулёза и некоторых заболеваниях щитовидной железы;
Но обычными последствиями, с которыми могут столкнуться здоровые люди при переизбытке омега- 3 в организме – это тошнота, диарея и другие проблемы с ЖКТ.
Для того чтобы Вы были здоровыми, бодрыми, энергичными, следует создавать свой пищевой рацион, сохраняя при этом оптимальный баланс жирных кислот.
Врач – диетолог
Л.В. Иванович
2. Сильные и слабые кислоты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3852
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице объясняются термины «сильный» и «слабый» применительно к кислотам. Как часть этого, он определяет и объясняет, что подразумевается под pH, K 9-_{(aq)} \tag{3}\]
Это показывает, что хлористый водород, растворенный в воде, расщепляется с образованием ионов водорода в растворе и ионов хлора в растворе.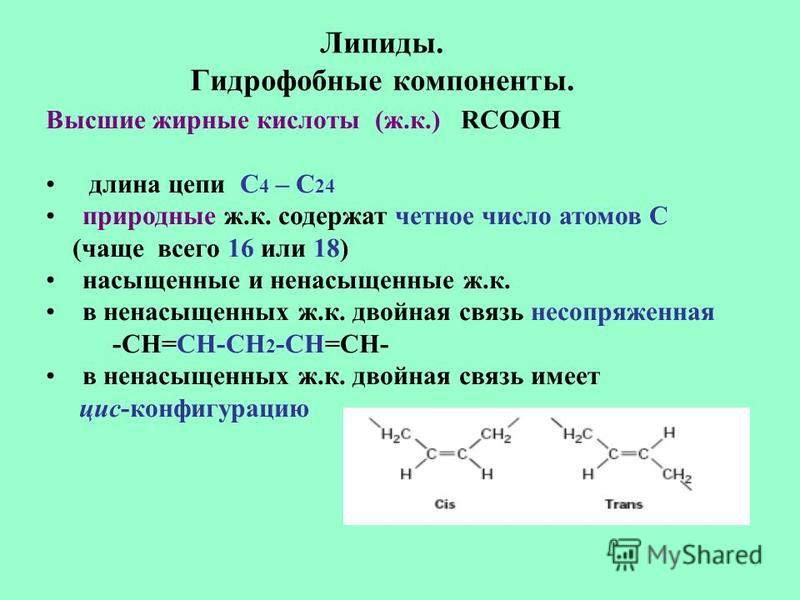
Эта версия часто используется в этой работе, чтобы все выглядело проще. Если вы используете его, помните, что на самом деле участвует вода, и что когда вы пишете H + (водн.) , вы на самом деле имеете в виду ион гидроксония, H 3 O + .
Сильные кислоты и pH
pH является мерой концентрации ионов водорода в растворе. Сильные кислоты, такие как соляная кислота, в концентрациях, которые вы обычно используете в лаборатории, имеют pH от 0 до 1. Чем ниже pH, тем выше концентрация ионов водорода в растворе.
Определение рН
Пример: Расчет рН сильной кислоты
Предположим, вам нужно определить рН 0,1 моль дм -3 соляной кислоты. Все, что вам нужно сделать, это определить концентрацию ионов водорода в растворе, а затем использовать калькулятор, чтобы преобразовать ее в pH.
С сильными кислотами это сделать легко.
Соляная кислота является сильной кислотой, практически на 100% ионизированной.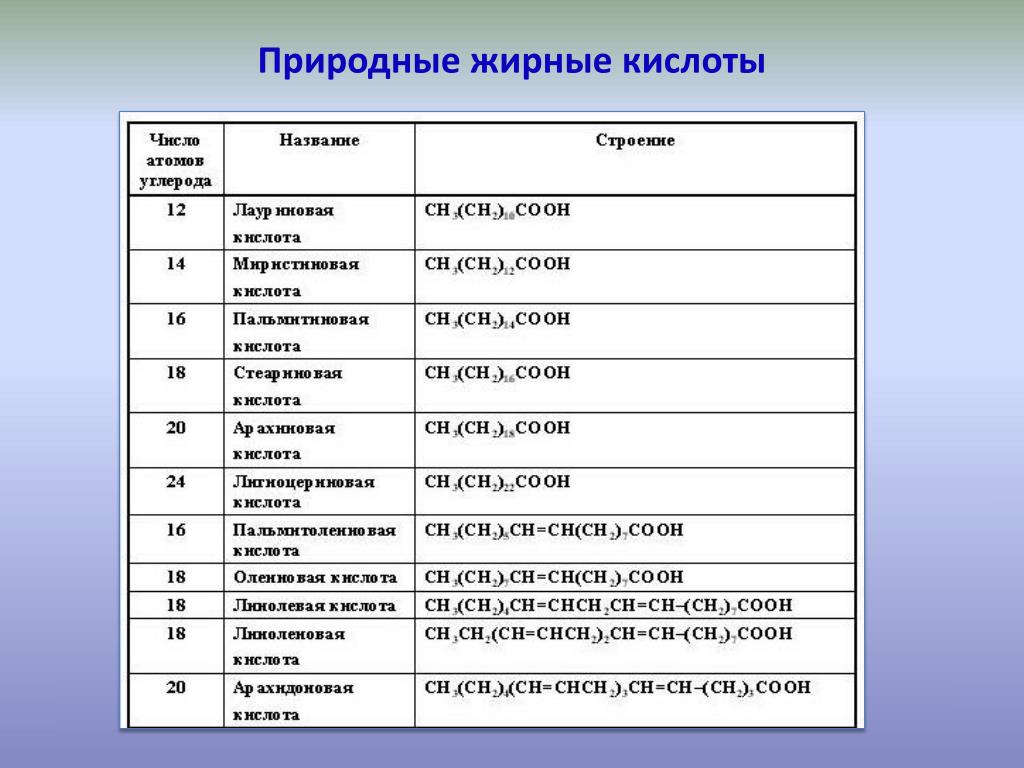 Каждый моль HCl реагирует с водой, образуя 1 моль ионов водорода и 1 моль ионов хлора
Каждый моль HCl реагирует с водой, образуя 1 моль ионов водорода и 1 моль ионов хлора
Значит, если концентрация кислоты 0,1 моль дм -3 , то концентрация ионов водорода также 0,1 моль дм -3 .
Используйте калькулятор, чтобы преобразовать это значение в pH. Мой калькулятор хочет, чтобы я ввел 0,1, а затем нажал кнопку «журнал». Ваш может захотеть, чтобы вы сделали это в другом порядке. Вы должны узнать!
log 10 [0,1] = -1
Но pH = — log 10 [0,1]
— (-1) = 1
pH этой кислоты равен 1,9+ \tag{4}\]
В любой момент только около 1% молекул этановой кислоты превратились в ионы. Остальные остаются в виде простых молекул этановой кислоты. Большинство органических кислот являются слабыми. Фторид водорода (растворяющийся в воде с образованием плавиковой кислоты) — это слабая неорганическая кислота, которую вы можете встретить где угодно.
Сравнение сил слабых кислот
Положение равновесия реакции между кислотой и водой варьируется от одной слабой кислоты к другой. Чем левее она лежит, тем слабее кислота. 9- \tag{5}\]
Чем левее она лежит, тем слабее кислота. 9- \tag{5}\]
Константа диссоциации кислоты, K
aВы можете получить меру положения равновесия, написав константу равновесия для реакции. Чем ниже значение константы, тем больше положение равновесия смещено влево. Примером гомогенной реакции является диссоциация (ионизация) кислоты. Все присутствует в одной фазе — в данном случае в растворе в воде. Таким образом, вы можете написать простое выражение для константы равновесия K 9-]}{[HA][H_2O]} \]
Однако, если хорошенько подумать, в этом есть что-то странное.
Внизу выражения у вас есть термин для концентрации воды в растворе. Это не проблема, за исключением того, что число будет очень большим по сравнению со всеми остальными числами.
В 1 дм 3 раствора будет около 55 молей воды.
При наличии слабой кислоты с концентрацией около 1 моль дм -3 , и только около 1% его прореагировало с водой, количество молей воды уменьшится только примерно на 0,01. Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывается. Эта новая константа равновесия называется K a .
Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывается. Эта новая константа равновесия называется K a .
Вы можете найти K a 9Выражение 0033 записывается иначе, если вы работаете с упрощенной версией равновесной реакции:
Это может быть записано с символами состояния или без них.
На самом деле это то же самое, что и предыдущее выражение для K a ! Помните, что хотя мы часто пишем H + для ионов водорода в растворе, на самом деле мы говорим о ионах гидроксония. Эта вторая версия выражения K a не так точна, как первая. 9+ \тег{8}\]
. . . выражение K a :
В таблице приведены некоторые значения K a для некоторых простых кислот:
| кислота | К а (моль дм -3 ) |
|---|---|
| фтористоводородная кислота | 5,6 x 10 -4 |
| метановая кислота | 1,6 x 10 -4 |
| этановая кислота | 1,7 x 10 -5 |
| сероводород | 8,9 x 10 -8 |
Все это слабые кислоты, потому что значения K a очень малы. Они перечислены в порядке убывания силы кислоты — значения K и становятся меньше по мере продвижения вниз по таблице. Однако, если вы не очень довольны цифрами, это не сразу очевидно. Поскольку числа состоят из двух частей, слишком многое нужно быстро обдумать! Чтобы избежать этого, числа часто переводятся в новую, более простую форму, называемую pK 9.0032 и .
Они перечислены в порядке убывания силы кислоты — значения K и становятся меньше по мере продвижения вниз по таблице. Однако, если вы не очень довольны цифрами, это не сразу очевидно. Поскольку числа состоят из двух частей, слишком многое нужно быстро обдумать! Чтобы избежать этого, числа часто переводятся в новую, более простую форму, называемую pK 9.0032 и .
Знакомство с pKa
pK a имеет такое же отношение к K a , как pH относится к концентрации ионов водорода:
\[pK_a = -\log_{10} K_a \tag{9}\ ]
Если вы используете свой калькулятор для всех значений K a в таблице выше и преобразуете их в значения pK a , вы получите:
| кислота | К а (моль дм -3 ) | ПК и |
|---|---|---|
| фтористоводородная кислота | 5,6 x 10 -4 | 3,3 |
| метановая кислота | 1,6 x 10 -4 | 3,8 |
| этановая кислота | 1,7 x 10 -5 | 4,8 |
| сероводород | 8,9х 10 -8 | 7,1 |
Обратите внимание, что чем слабее кислота, тем больше значение pK a . Теперь легко увидеть тенденцию к более слабым кислотам по мере продвижения вниз по таблице.
Теперь легко увидеть тенденцию к более слабым кислотам по мере продвижения вниз по таблице.
Примечание
- Чем ниже значение pK a , тем сильнее кислота.
- Чем выше значение pK a , тем слабее кислота.
Эта страница под названием 2. Strong and Weak Acids распространяется под лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- сильные кислоты
- слабые кислоты
Сила кислот и щелочей — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1314
Все кислоты и основания не ионизируются и не диссоциируют в одинаковой степени. Это приводит к утверждению, что не все кислоты и основания одинаково сильны в образовании ионов H + и OH — в растворе. Термины «сильный» и «слабый» указывают на силу кислоты или основания.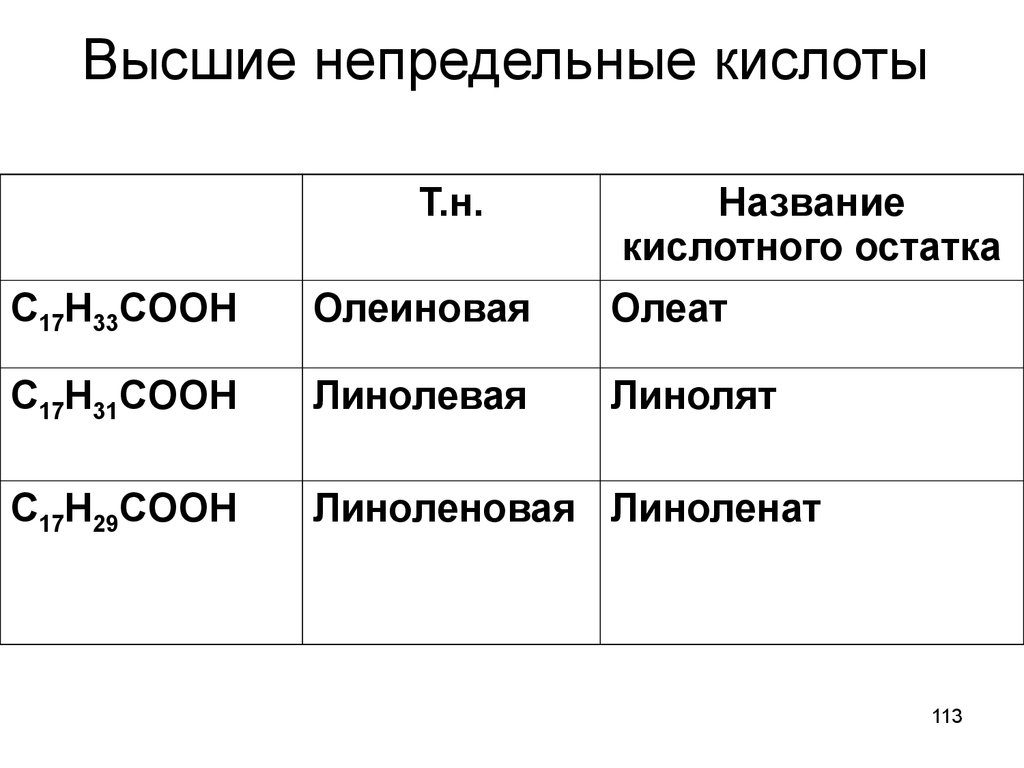 Термины сильный и слабый описывают способность растворов кислот и оснований проводить электричество. Если кислота или основание сильно проводят электричество, это сильная кислота или основание. Если кислота или основание слабо проводят электричество, то это слабая кислота или основание.
Термины сильный и слабый описывают способность растворов кислот и оснований проводить электричество. Если кислота или основание сильно проводят электричество, это сильная кислота или основание. Если кислота или основание слабо проводят электричество, то это слабая кислота или основание.
Демонстрация кислотной и щелочной проводимости
Инструктор проверит проводимость различных растворов с помощью прибора с лампочкой. Цепь лампочки неполная. Если цепь замыкается раствором, содержащим большое количество ионов, лампочка будет ярко светиться, указывая на сильную способность проводить электричество, как это показано для HCl. Если цепь замыкается раствором, содержащим большое количество молекул и либо отсутствием ионов, либо небольшим количеством ионов, раствор не проводит или проводит очень слабо, как это показано для уксусной кислоты.
Кислота или основание, которые хорошо проводят электричество, содержат большое количество ионов и называются сильной кислотой или основанием , а кислота или основание, которые слабо проводят электричество, содержат только несколько ионов и называются слабой кислотой или база .
| Соединения | Внешний вид лампочки | Классификация Слабый или сильный | Вывод ионов или молекул |
|---|---|---|---|
| Н 2 О | нет света | слабый | молекул |
| HCl | яркий | сильный | ионов |
| HC 2 H 3 O 2 | тусклый | слабый | молекул |
| Н 2 SO 4 | яркий | Ответ сильный | ответов |
| H 2 CO 3 | тусклый | Ответ слабый | Молекулы ответов |
| NaOH | яркий | Ответ сильный | ответов |
| КОН | яркий | Ответ сильный | ответов |
| НХ 4 ОХ | тусклый | Ответ слабый | Молекулы ответов |
Сила связи
Сила связи кислот и оснований определяется относительным количеством молекул и ионов, присутствующих в растворе. Облигации представлены как:
Облигации представлены как:
| кислота | база |
| Х-А | М-ОН |
где А — отрицательный ион, а М — положительный ион
- Сильные кислоты содержат в растворе в основном ионы, поэтому связи, удерживающие Н и А вместе, должны быть слабыми. Сильные кислоты легко распадаются на ионы.
- Слабые кислоты существуют в основном в виде молекул с небольшим количеством ионов в растворе, поэтому связи, связывающие Н и А вместе, должны быть прочными. Слабые кислоты не распадаются на ионы, но остаются связанными вместе в виде молекул.
Принцип прочности связи
Кислоты или основания с сильными связями существуют преимущественно в виде молекул в растворах и называются «слабыми» кислотами или основаниями. Кислоты или основания со слабыми связями легко диссоциируют на ионы и называются «сильными» кислотами или основаниями.
| Характеристика | Сильная кислота или основание | Слабая кислота или основание |
|---|---|---|
| Молекулы | несколько | большое число |
| Ионы | большое число | маленький номер |
| Проводимость | сильный | слабый |
| Сила связи | слабый | сильный |
Кислоты и основания ведут себя в растворе по-разному в зависимости от их силы. Кислотная или щелочная «сила» является мерой того, насколько легко молекула ионизируется в воде.
Кислотная или щелочная «сила» является мерой того, насколько легко молекула ионизируется в воде.
Введение Снова
Некоторые кислоты и основания быстро и почти полностью ионизируются в растворе; они называются сильными кислотами и сильными основаниями. Например, соляная кислота (HCl) является сильной кислотой. При помещении в воду практически каждая молекула HCl расщепляется на H 9{-}(aq)} \nonumber\]
Для сильной кислоты, такой как HCl, если вы поместите 1 моль HCl в литр воды, вы получите примерно 1 моль H 3 0 + ионов и 1 моль ионов Cl — . В слабой кислоте, такой как плавиковая кислота (HF), не все молекулы HF расщепляются, и хотя будут высвобождаться некоторые ионы H + и F — , в растворе все еще будут молекулы HF 1 . Аналогичная концепция применима к основаниям, за исключением того, что реакция отличается. Сильное основание, такое как гидроксид натрия (NaOH), также полностью диссоциирует в воду; если в воду добавить 1 моль NaOH, то получится 1 моль гидроксид-ионов.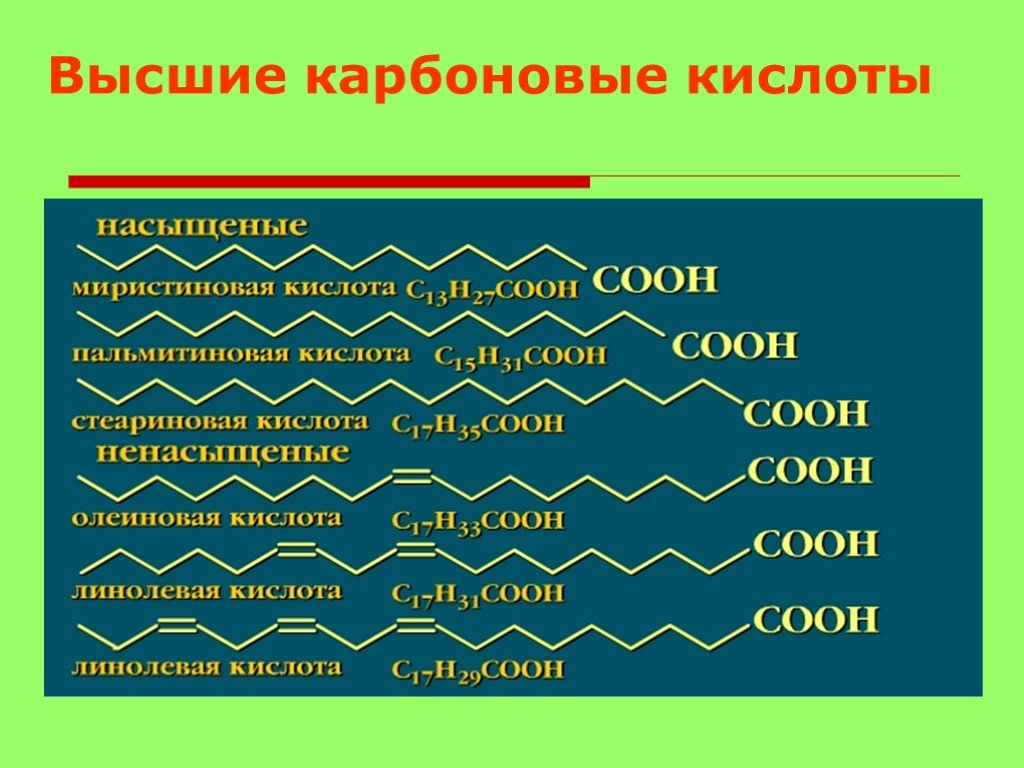 9{-}(aq) + h3O(l)} \nonumber\]
9{-}(aq) + h3O(l)} \nonumber\]
Термины «сильный» и «слабый» в данном контексте не относятся к тому, насколько коррозионным или едким является вещество, а относятся только к его способности ионизироваться в воде . Способность вещества проедать другие материалы или повреждать кожу больше зависит от свойств этой кислоты, а также от ее концентрации. Хотя сильные кислоты более опасны при более низких концентрациях, сильная кислота не обязательно более опасна, чем слабая. Например, плавиковая кислота является слабой кислотой 1 , но он чрезвычайно опасен, и с ним следует обращаться с большой осторожностью. Плавиковая кислота особенно опасна тем, что способна проедать стекло, как видно на видео в разделе ссылок V1 . Процент диссоциации кислоты или основания математически определяется константой ионизации кислоты (K a ) или константой ионизации основания (K b ) 1 . Эти термины относятся к соотношению реагентов к продуктам, находящимся в равновесии, когда кислота или основание реагируют с водой.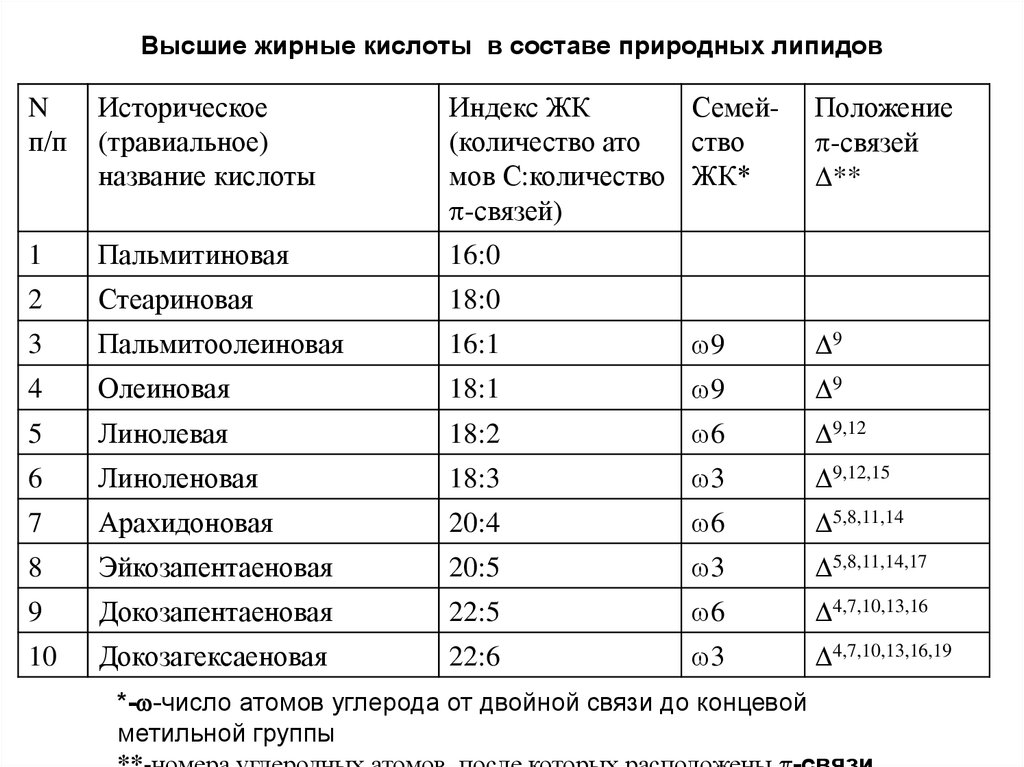 Для кислот выражение будет 9{+}}]}{\ce{B}}\]
Для кислот выражение будет 9{+}}]}{\ce{B}}\]
где B — концентрация основания в равновесии, а HB + — концентрация его сопряженной кислоты в равновесии
Чем сильнее кислота, тем снизить pH, который он будет производить в растворе. pH рассчитывается путем отрицательного логарифма концентрации ионов гидроксония. Для сильных кислот вы можете рассчитать pH, просто взяв отрицательный логарифм его молярности, поскольку он полностью диссоциирует на сопряженное основание и гидроксоний. То же самое относится и к сильным основаниям, за исключением того, что отрицательный логарифм дает вам pOH, а не pH. Для слабых кислот и оснований чем выше K a или K b , тем более кислым или основным является раствор. Чтобы найти pH для слабой кислоты или основания, вы должны использовать уравнение K и таблицу RICE для определения pH.
Все кислоты имеют сопряженное основание, которое образуется, когда они реагируют с водой, и аналогичным образом все основания имеют сопряженную кислоту, которая реагирует, когда они реагируют с водой.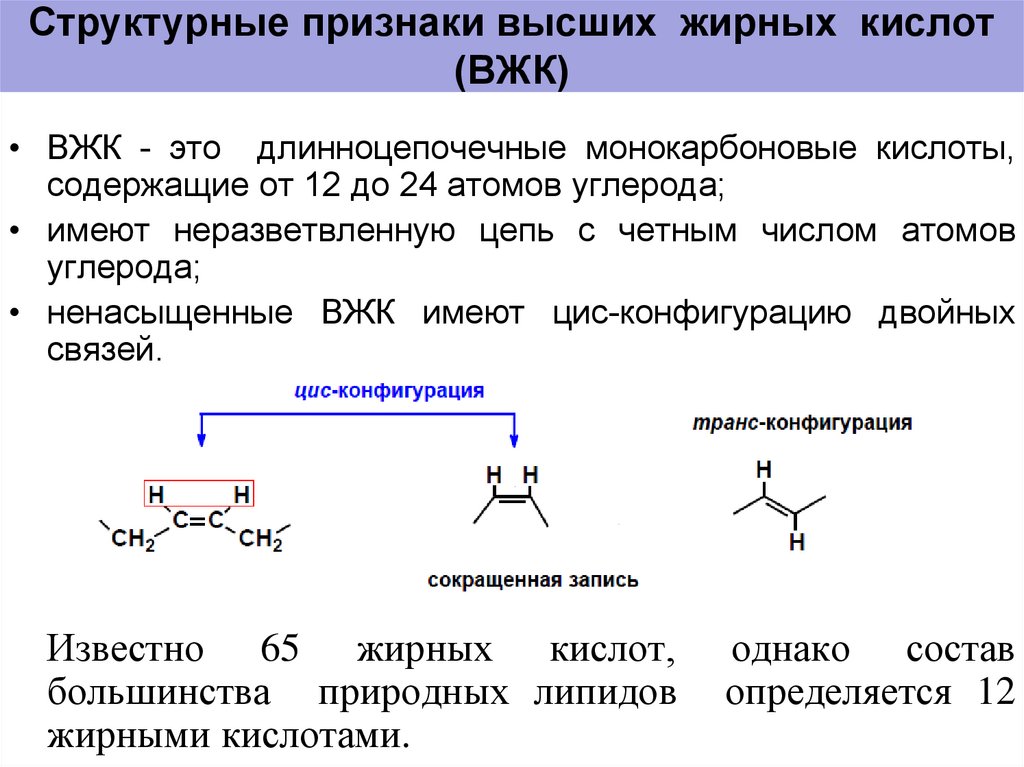 1 Об относительной силе конъюгата можно судить по величине \(K_a\) или \(K_b\) вещества, поскольку \(K_a \times K_b\) равно константе ионизации воды, K 9-]}{[HA]}\]
1 Об относительной силе конъюгата можно судить по величине \(K_a\) или \(K_b\) вещества, поскольку \(K_a \times K_b\) равно константе ионизации воды, K 9-]}{[HA]}\]
, где каждый член в квадратных скобках представляет концентрацию этого вещества в растворе.
Соотношение K w , K b , K a
\[K_w = K_a \times K_b \номер\]
Частичный список сильных кислот: соляная кислота (HCl), азотная кислота 3 ), хлорная кислота (HClO 4 ), серная кислота (H 2 SO 4 )
Частичный список сильных оснований: гидроксид натрия (NaOH), гидроксид бария (Ba(OH) 2 ), гидроксид кальция (Ca(OH) 2 ), гидроксид лития (LiOH) (гидроксиды элементов группы I и II обычно являются сильными основаниями)
Частичный список слабых кислот: уксусная кислота (CH 3 COOH), угольная кислота (H 2 CO 3 ), фосфорная кислота (H 3 PO 4 )
Неполный список слабых оснований: аммиак (NH 3), карбонат кальция
), ацетат натрия (NaCH 3 COO)
Пример \(\PageIndex{1}\)
Найдите pH 0,5 г HCl, растворенной в 100 мл воды:
Раствор
Первое определение молей кислоты:
грамм/молярная масса = моль
0,5 грамм/(36,5 г/моль) = 0,014 моль HCl
Тогда находим молярность:
моль/объем = молярность
0,014 моль/0,100 л = 0,14 М
HCl является сильной кислотой и полностью диссоциирует в воде, поэтому рН будет равен отрицательному логарифму концентрации HCl
pH = -log(H 3 O + )
pH = -log(0,14) = 0,85 равно 1,76*10 -5 , а значение K a для бензойной кислоты равно 6,46*10 -5 , если приготовить два раствора, по одному от каждой кислоты, с одинаковыми концентрациями, какой из них будет иметь более низкий рН ?
Раствор
Значение K a является мерой соотношения между реагентами и продуктами при равновесии.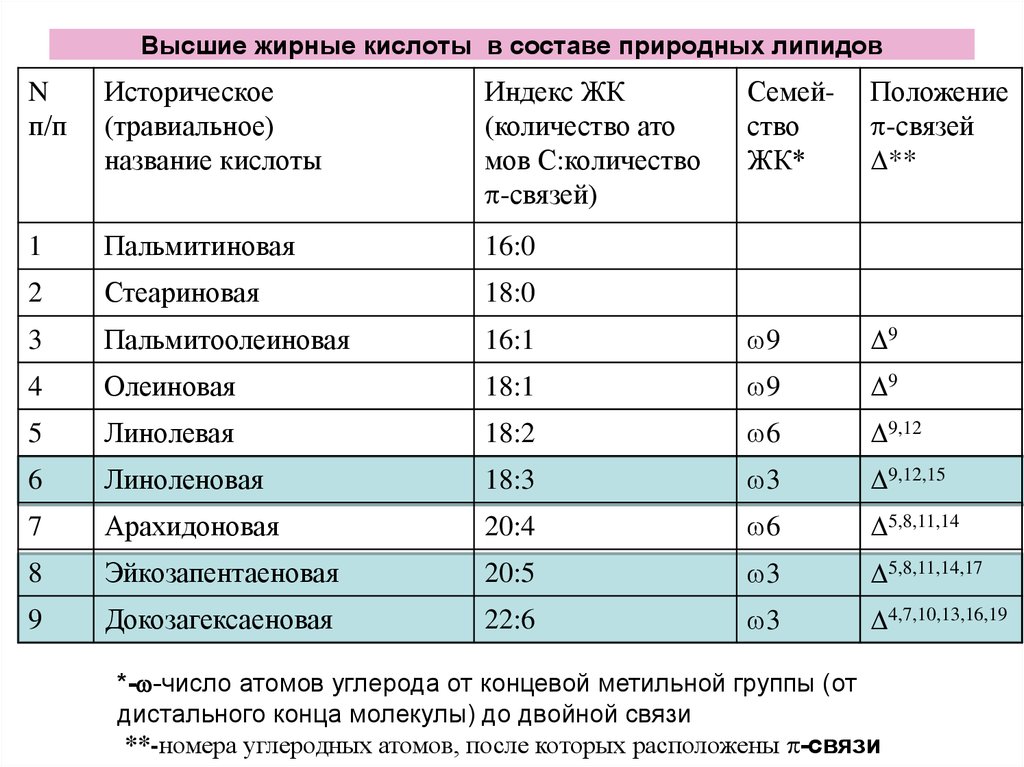 Для кислоты реакция будет HA + H 2 О —> А — + Н 3 О + . PH основан на концентрации иона гидроксония (H 3 O + ), который является продуктом реакции кислоты и воды. Более высокое значение K a означает более высокое отношение реагентов к продуктам, поэтому кислота с более высоким значением K a будет производить больше гидроксония и, следовательно, будет иметь более низкий pH. Поэтому раствор бензойной кислоты будет иметь более низкий рН.
Для кислоты реакция будет HA + H 2 О —> А — + Н 3 О + . PH основан на концентрации иона гидроксония (H 3 O + ), который является продуктом реакции кислоты и воды. Более высокое значение K a означает более высокое отношение реагентов к продуктам, поэтому кислота с более высоким значением K a будет производить больше гидроксония и, следовательно, будет иметь более низкий pH. Поэтому раствор бензойной кислоты будет иметь более низкий рН.
Пример \(\PageIndex{3}\)
Значение K a для аммония (NH 4 + ) составляет 5,6*10 -10 , значение K b для аммиака (NH — 3) 5 06 06 9,9040 9,9040 9,8*10 9,8*10 -10 . Является ли аммоний более сильнокислотным, чем аммиак щелочным?
Раствор
Относительная сила кислоты или основания зависит от того, насколько велико значение K a или K b , в этом случае значение K a намного ниже, чем значение K b поэтому аммиак является более сильным основанием, чем аммоний кислым.

 маслянистые на ощупь.
маслянистые на ощупь.
 Они не образуются в организме и должны поступать с пищей.
Они не образуются в организме и должны поступать с пищей.
