Рак костного мозга
Костный мозг считается особым органом в организме человека, отвечающий за создание новых кровяных клеток, которые замещают уже погибшие клетки. Факторы внутренней среды могут оказывать влияние на эти клетки, в результате чего они могут развиваться в разных направлениях.
Специалисты считают, что рак костного мозга является некорректным названием для заболевания. Однако именно этот термин описывает все заболевания, которые характеризуются ростом злокачественной опухоли в клетках костного мозга.
Среди этих заболеваний выделяют:
- меланому. Меланомой называют злокачественную опухоль, которая начинает свой рост в плазматических клетках;
- лейкозы. Данное заболевание, а именно новообразования, появляющиеся в кроветворной системе, являются наиболее распространенными злокачественными проблемами костного мозга;
- лимфомы. Лимфомы возникают в лимфатической ткани и представляют собой злокачественные новообразования. Лимфомы сначала поражают лимфоузлы, но в редких случаях они могут начать проявлять себя сразу в тканях костного мозга.

Причины возникновения
Наиболее частой причиной онкологии костного мозга является мутация в стволовых клетках. На самом деле, мутации в человеческом организме происходят регулярно, но есть специальные механизмы, которые могут исправить ошибки или же убить мутировавшие клетки.
Когда у человека начинает развиваться онкология, в частности рак костного мозга, эти механизмы перестают работать, так как клетки мутируют в большом количестве, в результате чего организм перестает воспринимать их как чужеродные. В конечном итоге раковые клетки вытесняют здоровые, не тронутые мутацией клетки. Для развития рака необходимы мутации в уже мутировавших ранее клетках или же сбои в иммунной системе организма человека, так как из-за этого могут возникнуть различные патологии.
Кто может заболеть раком костного мозга?
Групп риска тех, кто может заболеть онкологией костного мозга, довольно немало. Это лица, чьи ближайшие родственники страдали от одной из форм рака костного мозга. Также люди, у которых обнаружен иммунодефицит.
Это лица, чьи ближайшие родственники страдали от одной из форм рака костного мозга. Также люди, у которых обнаружен иммунодефицит.
У некоторых людей обнаруживают заболевания, которые называют располагающими к онкологии костного мозга, среди них моноклональная гаммапатия, а также мононуклеоз. Пациенты, которые принимают лекарственную терапию, направленную на борьбу с опухолью, тоже рискуют заболеть раком костного мозга.
Симптомы и признаки рака костного мозга
Если у человека миелома, то он будет ощущать боль в костях. Чаще всего такие боли проявляются не в одном месте. Они мигрируют. Также боль обычно ощущается во время передвижения. С течением времени боль будет становиться все сильнее, в конечном итоге она может стать невыносимый. Есть вероятность, что больной останется обездвиженным.
Также одним из признаков миеломы считается расплавление костной ткани, то есть в организме человека будет сильно превышен уровень кальция, человек будет постоянно чувствовать тошноту, сознание будет нарушаться.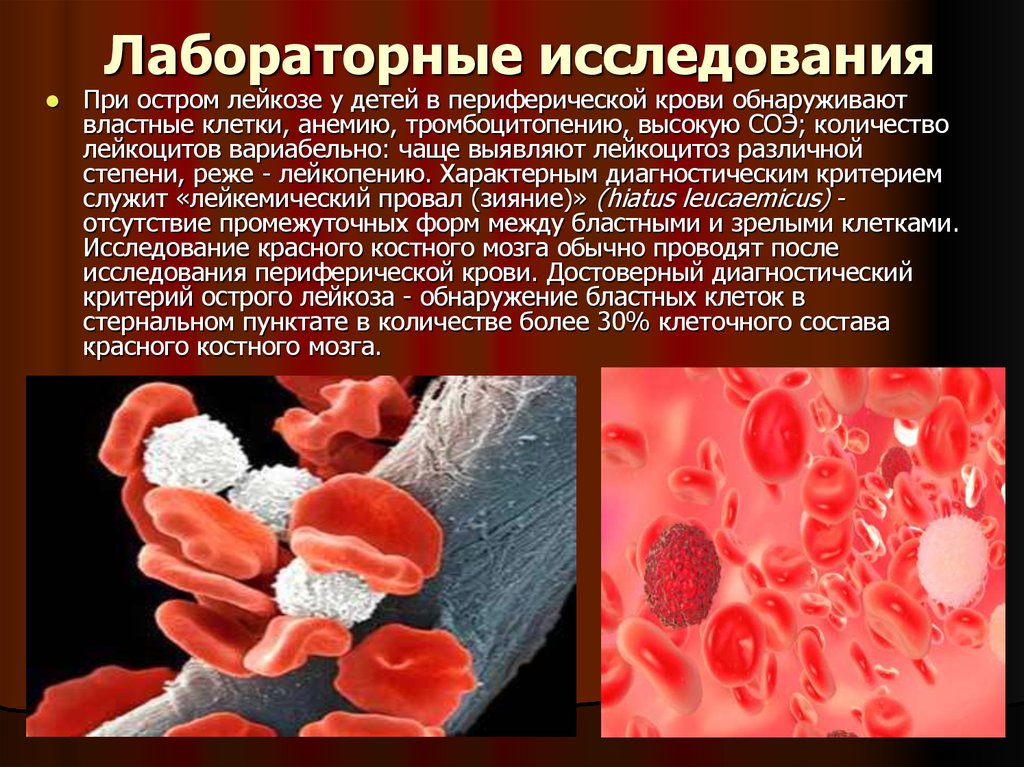 В самых тяжелых случаях больной может впасть в кому.
В самых тяжелых случаях больной может впасть в кому.
Поражение почек, нарушение зрения и частые кровотечения тоже являются признаками появления в организме человека онкологии костного мозга, а именно, миеломы.
При миеломе повреждаются корешки спинномозговых нервов, в результате чего у человека могут неметь конечности и происходить параличи.
Симптомы лейкоза проявляются не так выражено. При лейкозе опухолевые клетки начинают вытеснять здоровые ростки кровотечения, в результате человек начинает страдать от анемии, постоянных кровотечений и иммунодефицита. Если у человека развивается нейролейкемия, то он ощущает постоянные головные боли, тошноту, рвоту.
Диагностика рака костного мозга в онкоцентре
Для того чтобы выявить рак костного мозга, требуется комплексный подход к обследованию. У человека производится сбор анамнеза и проводится физикальный осмотр. При этом специалист должен узнать обо всех жалобах и симптомах, которые ощущает сам пациент. Далее пациента направляют на обследование. Подозрения в наличие миеломы могут появиться после рентгенограммы костей. Лейкозы можно выявить, сделав общий анализ крови.
Подозрения в наличие миеломы могут появиться после рентгенограммы костей. Лейкозы можно выявить, сделав общий анализ крови.
Подтверждение диагноза
Для того чтобы точно сказать о том, есть ли у человека онкология костного мозга, нужно провести морфологической исследование субстрата опухоли. Для этого пациент должен пройти пункцию или биопсию костного мозга.
Также специалисты онкоцентра проводят тесты, которые уточнят молекулярно-генетический профиль рака.
Все эти исследования необходимы для того, чтобы выбрать наиболее точную и наиболее действенную тактику лечения больного. Кроме того, данные анализов и тестов помогут выбрать оптимальный метод химиотерапии.
Где можно пройти обследование?
Пройти обследование можно в онкоцентре София: 2-й Тверской-Ямской переулок, 10. Наши специалисты готовы обследовать всех пациентов с профессионализмом и точностью, а также приняться за лечение в случае обнаружения болезни.
Лечение рака костного мозга
В большинстве случаев вылечить рак костного мозга полностью невозможно. Можно лишь замедлить его развитие и продлить пациенту жизнь, так как эта болезнь является системной, а опухолевая масса с кровью распространяется по всему телу.
Можно лишь замедлить его развитие и продлить пациенту жизнь, так как эта болезнь является системной, а опухолевая масса с кровью распространяется по всему телу.
Стоит отметить, что при онкологии костного мозга наблюдается огромное количество опухолевой массы в организме человека. Если речь идет о радикальном лечении заболевания, то придется воздействовать на организм системно, что невозможно без иммунотерапии, химиотерапии и таргетной терапии.
Схема лечения определяется врачами в зависимости от разновидности рака.
Система лечения при лейкозе
При диагностировании лейкоза сначала проводится индукция ремиссии, то есть человек лечится при помощи химиотерапии, так как преследуется цель в уничтожении как можно большего количества раковых клеток. Организм человека переживает серьезные негативные воздействия продуктов распада опухоли и компонентов химиотерапии. При этом проявляется немало побочных эффектов.
Консолидационная терапия является вторым этапом лечения.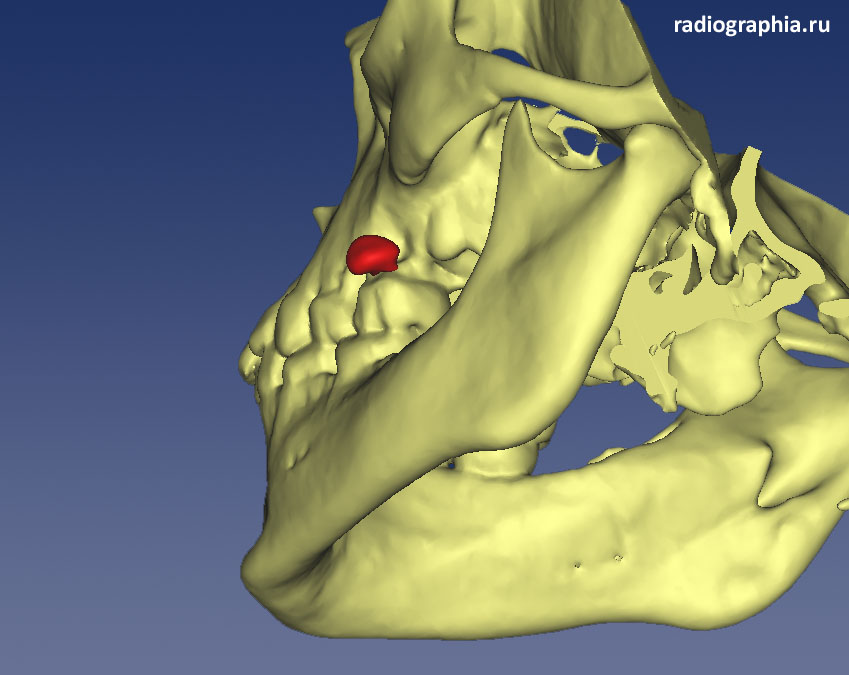 С помощью химиотерапии невозможно избавиться от всех раковых клеток мозга, так как часть из них на ранних этапах находится в спящем состоянии, то есть эти клетки просыпаются позже и начинают активизировать повторный рост опухоли, поэтому такая терапия просто необходима.
С помощью химиотерапии невозможно избавиться от всех раковых клеток мозга, так как часть из них на ранних этапах находится в спящем состоянии, то есть эти клетки просыпаются позже и начинают активизировать повторный рост опухоли, поэтому такая терапия просто необходима.
Реиндукция ремиссии является точной копией индукционной терапии, на данном этапе продолжается уничтожение клеток. Последним этапом является поддерживающая терапия, которая призвана уничтожить оставшиеся злокачественные клетки.
Химиотерапия
Чаще всего химиотерапию используют в комбинации с лучевым воздействием. Одновременно с этим пациент должен принимать гормональные препараты для улучшения состояния крови и всего организма, так как во время химиотерапии на организм оказывается сильнейшее воздействие.
У человека могут выпасть волосы, и резко ухудшиться состояние здоровья. Также врачи назначают применение препаратов, которые призваны бороться с разрушением костной ткани в организме. Мембранный плазмаферез – процедура, которую назначаю с целью продления срока жизни больного.
Хирургический способ лечения
При хирургическом вмешательстве, которое является наиболее эффективным способом лечения онкологии костного мозга, специалисты проводят пересадку костного мозга. Такая процедура осложняется тем, что найти донора для пересадки крайне сложно, так как организм может отторгнуть новый костный мозг.
Также эта процедура довольно дорогостоящая. Чаще всего в качестве доноров подходят ближайшие родственники. От хирургического вмешательства отказываются в том случае, когда пациент находится в тяжелом состоянии или органы поражены отдалёнными метастазами.
Прогнозы
От вида опухоли зависит прогноз выживаемости человека при онкологии костного мозга. При остром лейкозе человек может прожить без рецидива в течение пяти лет в 80% случаев. Чем дольше длится ремиссия, тем больше вероятность полного отступления болезни, однако при раке костного мозга в большинстве случаев происходит рецидив, то есть пациенту требуется повторное лечение.
Некоторые пациенты сталкиваются с несколькими рецидивами. В каждом случае вернуться к состоянию ремиссии становится всё сложнее. Однако были случаи, когда люди выздоравливали даже после нескольких рецидивов.
В каждом случае вернуться к состоянию ремиссии становится всё сложнее. Однако были случаи, когда люди выздоравливали даже после нескольких рецидивов.
Миелома является неизлечимым заболеванием. Даже после пересадки костного мозга в течение 3-5 лет рак костного мозга может вернуться. Хронические лейкозы практически не поддаются лечению, они протекают с обострениями и затуханиями. Чаще всего такое заболевание возникает у людей, чей возраст приближается к пожилому. В таком случае интенсивное лечение противопоказано, остается только проводить поддерживающую терапию.
Осложнения
При стремительном развитии онкологии костного мозга здоровые клетки с невероятно быстрой скоростью замещаются раковыми клетками. Кроветворение сильно замедляется, человек страдает от анемии, кровотечений и иммунодефицита. Для миеломы и лейкозов характерны сильнейшие боли, которые можно снять только с использованием наркотических анальгетиков.
Рецидив
Вид онкологии костного мозга определяет вероятность появления рецидива. Некоторые формы лейкоза поддаются лечению, то есть у человека есть возможность на полное выздоровление. Хронические формы рака практически неизлечимы, миеломы тоже считаются неизлечимыми. Если применяется стандартная терапия, то рецидив должен наступить примерно через 29 месяцев. Если же произошла тандемная трансплантация, то пациент может продержаться в состоянии ремиссии на протяжении более 40 месяцев.
Некоторые формы лейкоза поддаются лечению, то есть у человека есть возможность на полное выздоровление. Хронические формы рака практически неизлечимы, миеломы тоже считаются неизлечимыми. Если применяется стандартная терапия, то рецидив должен наступить примерно через 29 месяцев. Если же произошла тандемная трансплантация, то пациент может продержаться в состоянии ремиссии на протяжении более 40 месяцев.
Как записаться к специалисту в онкоцентре София?
На прием к специалистам онкоцентра София можно записаться по телефону +7(495)995-00-33 или с помощью формы на сайте. Адрес: 2-й Тверской-Ямской пер., д. 10.
Вы можете прийти как на консультативный прием или сразу же осуществить запись на диагностику. После получения результатов врачи определят степень распространения рака и назначат оптимальный вариант лечения. Заметим, что наши специалисты учитывают не только тип заболевания, но и индивидуальные особенности организма человека.
Остеомиелит на МРТ
Остеомиелит – опасное, сложное заболевание, которое с латинского переводится как воспаление костного мозга. Чаще всего воспаление затрагивает крупные трубчатые кости скелета: бедренную, большеберцовую, плечевую, хотя поражаться может любая другая кость, например, позвонки, а также суставы челюсти. В область воспаления включаются все элементы кости: губчатое вещество, компактное вещество и надкостница.
Чаще всего воспаление затрагивает крупные трубчатые кости скелета: бедренную, большеберцовую, плечевую, хотя поражаться может любая другая кость, например, позвонки, а также суставы челюсти. В область воспаления включаются все элементы кости: губчатое вещество, компактное вещество и надкостница.
Причиной воспаления является проникновение в кость патогенных организмов, в подавляющем большинстве случаев бактерий (в особенности золотистый стафилококк), реже инфекция имеет грибковую природу. Специфический остеомиелит может развиваться при наличии таких системных заболеваний как туберкулез костей и суставов, сифилис и т.п. Инфекция может проникнуть в полость кости как прямым путем (например, в результате травмы или операции), а также инфицирование может произойти в результате занесения возбудителя из любых очагов в организме с системным кровотоком.
Остеомиелит имеет как общую, интоксикационную, так и местную симптоматику, на поздних стадиях заболевания в мягких тканях, окружающих пораженную кость происходят патологические изменения, которые напрямую указывают на остеомиелит — образуются свищи, через которые гнойное содержимое из кости выходит наружу.
Остеомиелит имеет несколько форм, среди которых есть формы с молниеносным течением и высоким риском летального исхода. Болезнь может иметь серьезные осложнения. В лечении остеомиелита чрезвычайна важна своевременная и точная диагностика.
Клинические проявления заболевания в некоторых случаях позволяют заподозрить остеомиелит на ранних стадиях еще на стадии первоначального осмотра и сбора анамнеза, однако, для выбора тактики лечения необходимо подтверждение предварительного диагноза. Логично, что увидеть следы воспаления внутренних структур кости позволяют рентгенографические методы исследования(МРТ или КТ), однако ситуация осложняется тем, что выраженные признаки воспаления костного мозга и часто сопровождающего его воспаления сустава (артрит) появляются только спустя не менее 2 недель с момента начала заболевания. Времени ждать эти признаки при молниеносных и гнойно-септических формах остеомиелита просто не остается.
МРТ позволяет производить дифференцированную диагностику остеомиелита, то есть отделять воспаление мягких тканей, примыкающих к кости, от воспаления ее внутреннего содержания, то есть костного мозга и других внутренних структур (надкостницы, губчатого и компактного вещества).
Признаками остеомиелита на снимках мрт являются: утолщение и деформация мягких тканей в области пораженной кости, а также утолщение надкостницы, остеосклероз и остеопороз, очаги разрушения костной ткани, секвестры (участки мертвой костной ткани).
МРТ покажет изменения во всех типах тканей, как костных структур, так и нервных волокон, мышечной ткани, сосудов, а также позволит оценить степень и область распространения некроза. При выборе методов хирургического лечения остеомиелита снимки магнитно-резонансной томографии имеют высочайшую важность, так как позволяют определить границы вмешательства.
ВАЖНО знать ,что выбор метода диагностики при остеомелите определяет Ваш лечащий врач.Вам может быть назначена как магнитно -резонансная томография (МРТ), так и компьютерная томография(КТ).
-
-
Возможность проводить исследование в динамике для отслеживания изменений в ответ на медикаментозную и иную терапию.

-
Возможность уже по истечению 30-60 минут после выполнения сканирования оценить результат, сохранить снимки на цифровой носитель с возможностью доступа к ним в любое время.
Остеомиелит: что вызывает воспаление костного мозга?
- Что такое остеомиелит?
- Признаки и симптомы остеомиелита
- Что вызывает остеомиелит?
- Как диагностируется остеомиелит?
- Лечение остеомиелита
- Факторы риска и профилактика
Если у вас есть какие-либо медицинские вопросы или опасения, обратитесь к своему лечащему врачу. Статьи в Health Guide основаны на рецензируемых исследованиях и информации, полученной от медицинских обществ и государственных учреждений. Однако они не заменяют профессиональные медицинские консультации, диагностику или лечение.
Все мы в течение жизни перенесли то или иное инфекционное заболевание. Простуда, инфекции мочевыводящих путей, целлюлит, грипп, инфекции, передающиеся половым путем, пневмония… список можно продолжать и продолжать.
Гораздо реже встречается инфекция, поражающая кость, также называемая остеомиелитом. Давайте углубимся в инфекцию, которая повлияла на карьеру Яо Мина, Микки Мэнтла и Эла Калина.
Слово остеомиелит происходит от набора греческих корней. Остеомиелит можно разделить на три части: остео от остеона, что означает кость, миело, что означает костный мозг, и итис, что означает воспаление.
В совокупности остеомиелит означает воспаление кости и ее костного мозга, возникающее в результате инфекции кости. Это редкое заболевание, затрагивающее только около 2 из 10 000 человек (Parvizi, 2010).
Получите скидку 15 долларов на первый заказ поливитаминов
Наша команда штатных врачей создала Roman Daily для восполнения общих пробелов в питании мужчин с помощью научно обоснованных ингредиентов и дозировок.
Узнать больше
Его редкость обусловлена устойчивостью здоровой кости к инфекции — кость может быть инфицирована только в суровых условиях, когда происходит повреждение кости или большое количество бактерий проникает в результате травмы, хирургического вмешательства или сильная инфекция тканей рядом с ним.
Остеомиелит отнюдь не новое явление. Термин был впервые использован в 1844 году французским хирургом Огюстом Нелатоном. Но не думайте, что это был самый ранний случай остеомиелита. Имеются ископаемые свидетельства остеомиелита, поражавшего диметродона, массивного древнего животного длиной 15 футов с парусом на спине, которое жило в пермскую эпоху (Moodie, 1921).
Медицинский работник обычно подозревает остеомиелит из-за симптомов, которые вы проявляете.
У детей остеомиелит может вызывать лихорадку в течение нескольких недель, раздражительность, а также покраснение, отек и болезненность пораженной кости. У взрослых общие симптомы включают болезненность, жар, покраснение, отек, боль в костях и боль в зараженной области, а также лихорадку и озноб.
У детей чаще всего поражаются длинные кости рук и ног. У взрослых кости позвоночника, также называемые позвонками, часто поражаются вместе с костями стоп, особенно у диабетиков (Крадин, 2010).
Остеомиелит можно разделить на острый остеомиелит и хронический остеомиелит. Люди с острым остеомиелитом испытывают симптомы только от нескольких дней до пары недель, в то время как люди с хроническим остеомиелитом имеют длительную инфекцию в течение месяцев или лет.
Люди с острым остеомиелитом испытывают симптомы только от нескольких дней до пары недель, в то время как люди с хроническим остеомиелитом имеют длительную инфекцию в течение месяцев или лет.
Остеопения: менее выраженная, но более распространенная, чем остеопороз
Как правило, инфекции костей возникают в результате операции или травмы самой кости, инфекции области вокруг кости или при наличии системной инфекции и наличии возбудителя в крови.
Чаще всего остеомиелит возникает в результате бактериальной инфекции. Остеомиелит чаще всего вызывается бактерией Staphylococcus aureus. В редких случаях бывают случаи, когда остеомиелит вызывается грибковыми инфекциями или аутоиммунными реакциями (Castellazzi, 2016).
Если ваш лечащий врач подозревает, что у вас может быть остеомиелит, он может провести ряд полезных тестов для вашей оценки. Сначала они изучат историю ваших симптомов, а затем проведут медицинский осмотр.
Сначала они изучат историю ваших симптомов, а затем проведут медицинский осмотр.
Медицинский работник может провести один физический тест, который называется «прощупывание кости». Если у вас тревожная рана, подозрительная на инфекцию кости, врач возьмет зонд из нержавеющей стали и попытается дотронуться до дна раны.
Если они доходят до кости, высока вероятность наличия остеомиелита. Этот тест важен, особенно при оценке остеомиелита в контексте диабетических язв. Рентгенологическое сканирование важно для выяснения того, есть ли у вас инфекция кости и где она может находиться. Медицинским работникам доступно несколько различных видов сканирования.
Наиболее быстрым является рентген, который иногда позволяет выявить участки воспалительной реакции на поверхности кости, а также участки разрушения кости. Рентген также полезен для выявления других возможных причин подобных симптомов, включая рак и переломы. Тем не менее, рентген может с трудом обнаружить небольшие очаги инфекции или ранние признаки инфекции.
Цитрат кальция: как он поддерживает здоровье и силу костей
Здоровье костей 5 минут чтения
Другое широко используемое сканирование называется МРТ (магнитно-резонансная томография). Изображения МРТ могут определить, инфицирована ли кость намного раньше, чем другие виды сканирования, примерно через 3–5 дней после начала инфекции. Как правило, это один из лучших тестов на инфекции костей, выявляющий более 90 % случаев с низким уровнем ложноположительных результатов (Hatzenbuehler, 2011).
Однако это дороже, чем другие типы тестов, и его нельзя использовать у людей с металлом в организме (хотя большинство металлических изделий, которые сейчас используются в хирургии, безопасны для МРТ).
Последние типы тестов визуализации называются тестами ядерной медицины. В этих тестах вам вводят очень небольшое количество радиоактивного вещества (не волнуйтесь, это не опасно, и количество радиации, которому вы подвергаетесь, минимально), которое затем обнаруживается с помощью визуализации. машина.
машина.
Одним из тестов в этой категории является сцинтиграфия костей с технецием-99, также называемая сканированием костей. В этом тесте загорятся области метаболической активности костей. Это означает, что области инфекции загорятся, а также любое воспаление или перелом.
Другой тест в этой категории называется сцинтиграфия лейкоцитов, при котором лейкоциты маркируются и вводятся в ваше тело. Также называемое сканированием лейкоцитов, лейкоциты, используемые в тесте, направляются в области инфекции, что может быть полезно, если ваши медицинские работники не уверены, откуда взялась инфекция.
Оба эти теста неспецифичны, а это означает, что радиологам сложно определить, являются ли проблемные области, показанные на этих снимках, инфекцией или другим воспалительным процессом.
Анализы крови также могут быть чрезвычайно полезными. Медицинский работник может проверить вас на маркеры воспаления, такие как скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ), которые часто повышены при остеомиелите. Они также могут оценить уровень лейкоцитов в крови, который обычно также высок. Другой часто проводимый тест называется посевом крови, когда образец вашей крови проверяется на наличие микроорганизмов в лаборатории.
Они также могут оценить уровень лейкоцитов в крови, который обычно также высок. Другой часто проводимый тест называется посевом крови, когда образец вашей крови проверяется на наличие микроорганизмов в лаборатории.
Окончательный диагноз остеомиелита ставится с помощью так называемой биопсии кости, при которой берется небольшой образец костной ткани и исследуется под микроскопом. Обычно это делается с помощью хирургической процедуры. Медицинские работники также могут использовать образец кости, чтобы определить, какие организмы в нем растут. Это может помочь адаптировать лечение антибиотиками к вашему конкретному случаю.
Большинство случаев остеомиелита связано с бактериальной инфекцией. Из-за этого остеомиелит обычно лечат антибиотиками.
Большинству антибиотиков трудно проникнуть в кость, что затрудняет лечение костных инфекций. Вот почему медицинские работники могут попросить вас продолжать внутривенную терапию антибиотиками в течение длительного периода времени — от нескольких недель до месяцев — чтобы бактерии могли быть полностью уничтожены.
Другой важной частью лечения является удаление фрагментов мертвой или умирающей кости. Эти участки кости также называются некротическими и, к сожалению, не имеют шансов на заживление или регенерацию. Эта хирургическая процедура называется дебридментом. Хирургическая обработка помогает устранить области, где бактерии могут прятаться и вызывать больше проблем в будущем.
Если остеомиелит поражает области, где ранее были имплантированы аппаратные средства, такие как спондилодез позвоночника или искусственный тазобедренный сустав, эти аппаратные средства необходимо удалить и заменить.
Кроме того, если инфекция возникла из-за внутривенного катетера, такого как те, которые используются при гемодиализе для людей с почечной недостаточностью, катетер необходимо удалить. В тяжелых случаях ампутация пораженной конечности может быть единственным способом полноценного лечения остеомиелита.
Существует несколько основных факторов риска развития остеомиелита. Эти медицинские условия могут повысить риск развития остеомиелита от чего-то редкого до того, о чем стоит беспокоиться.
Первым из них является диабет. При диабете повреждение кровеносных сосудов и нервов из-за высокого уровня сахара в крови может вызвать диабетические язвы стопы. Риск развития язвы стопы при диабете составляет около 15% (Alexiadou, 2012).
Диабетические язвы стопы являются частыми предвестниками остеомиелита. Инфекция в месте язвы может распространиться на близлежащие кости, которым может быть трудно бороться с инфекцией из-за плохого притока крови к пораженному участку.
Лучший способ профилактики остеомиелита при диабете — это профилактика диабетических язв стопы. Это включает в себя максимально возможный контроль уровня сахара в крови, соблюдение диеты и регулярный прием лекарств от диабета. Точно так же заболевание артерий является еще одним фактором риска развития остеомиелита, поскольку плохое кровоснабжение может вызвать язвы, которые затем приведут к остеомиелиту.
Проблемы с иммунной системой, например, вызванные вирусом иммунодефицита человека (ВИЧ) или химиотерапией, могут снизить способность организма бороться с инфекцией и предрасполагать к развитию остеомиелита. В частности, люди с серповидноклеточной анемией подвержены риску остеомиелита и инфекций суставов. Это связано с тем, что селезенка, выполняющая важную иммунную функцию, повреждается серповидно-клеточной анемией.
В частности, люди с серповидноклеточной анемией подвержены риску остеомиелита и инфекций суставов. Это связано с тем, что селезенка, выполняющая важную иммунную функцию, повреждается серповидно-клеточной анемией.
Травма или хирургическое вмешательство, особенно те, которые приводят к открытым ранам, открытым переломам или имплантатам, могут быть еще одной причиной инфекций костей. И, наконец, основным фактором риска является употребление инъекционных наркотиков. Грязные иглы могут напрямую занести бактерии в кровоток, которые затем засеют кости, вызывая инфекции.
Если вы беспокоитесь об инфекции в любом месте вашего тела, лучше всего поговорить с вашим лечащим врачом. Они смогут провести необходимые анализы и лечение, чтобы вернуть вас в прекрасную форму.
- Алексиаду, К., и Дупис, Дж. (2012). Лечение диабетических язв стопы. Diabetes Therapy , 3 (1), 4. doi: 10.1007/s13300-012-0004-9Reference, https://www.ncbi.nlm.nih.gov/pubmed/22529027
- Кастеллацци, Л.
 , Мантеро, М., и Эспозито, С. (2016). Обновленная информация о лечении острого остеомиелита и септического артрита у детей. International Journal of Molecular Sciences , 17 (6), 855. doi: 10.3390/ijms17060855, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4926389/
, Мантеро, М., и Эспозито, С. (2016). Обновленная информация о лечении острого остеомиелита и септического артрита у детей. International Journal of Molecular Sciences , 17 (6), 855. doi: 10.3390/ijms17060855, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4926389/ - Хатценбюлер, Дж., и Пуллинг, Т.Дж. (2011). Диагностика и лечение остеомиелита. Американский семейный врач , 84 (9), 1027–1033. Получено с https://www.aafp.org/pubs/afp/issues/2011/1101/p1027.html .
- Крадин Р.Л. (2010). Диагностическая патология инфекционных болезней . Получено с https://www.sciencedirect.com/book/9781416034292/diagnostic-pathology-of-infectious-disease#book-info .
- Муди, Р.Л. (1921). Остеомиелит в Перми. Science , 53 (1371), 333. doi: 10.1126/science.53.1371.333, https://www.ncbi.nlm.nih.gov/pubmed/17783693
Воспалительное микроокружение костного мозга — PMC
1. Kramann R, Schneider RK. Идентификация предшественников миофибробластов, вызывающих фиброз, открывает новые терапевтические возможности при миелофиброзе. Кровь. 2018;131(19):2111-2119. [PubMed] [Google Scholar]
Идентификация предшественников миофибробластов, вызывающих фиброз, открывает новые терапевтические возможности при миелофиброзе. Кровь. 2018;131(19):2111-2119. [PubMed] [Google Scholar]
2. Gleitz HF, Kramann R, Schneider RK. Понимание нарушенной клеточной и молекулярной динамики в нише гемопоэтических стволовых клеток для разработки новых терапевтических средств для лечения фиброза костного мозга. Джей Патол. 2018;245(2):138-146. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Warr MR, Pietras EM, Passegué E. Механизмы, контролирующие функции гемопоэтических стволовых клеток при нормальном кроветворении и гемобластозах. Wiley Interdiscip Rev Syst Biol Med. 2011;3(6):681-701. [PubMed] [Академия Google]
4. Френетт П.С., Пиньо С., Лукас Д., Шайерманн К. Мезенхимальные стволовые клетки: краеугольный камень ниши гемопоэтических стволовых клеток и ступенька для регенеративной медицины. Анну Рев Иммунол. 2013;31:285-316. [PubMed] [Google Scholar]
5. Энтони Б. А., Link DC.
Регуляция гемопоэтических стволовых клеток стромальными клетками костного мозга. Тренды Иммунол. 2014;35(1):32-37. [Бесплатная статья PMC] [PubMed] [Google Scholar]
А., Link DC.
Регуляция гемопоэтических стволовых клеток стромальными клетками костного мозга. Тренды Иммунол. 2014;35(1):32-37. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. El Aha E, Kramann R, Schneider RK, et al.. Мезенхимальные стволовые клетки при фиброзной болезни. Клеточная стволовая клетка. 2017;21(2):166-177. [PubMed] [Академия Google]
7. Винклер И.Г., Барбье В., Уодли Р., Заннеттино А.С., Уильямс С., Левеск Дж.П. Позиционирование гемопоэтических и стромальных клеток костного мозга относительно кровотока in vivo: последовательно восстанавливающиеся гемопоэтические стволовые клетки располагаются в отдельных неперфузируемых нишах. Кровь. 2010;116(3):375-385. [PubMed] [Google Scholar]
8. Schepers K, Pietras EM, Reynaud D, et al.. Миелопролиферативная неоплазия ремоделирует эндостальную нишу костного мозга в самоусиливающуюся лейкемическую нишу. Клеточная стволовая клетка. 2013;13(3):285-299. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Morrison SJ, Scadden DT.
Ниша костного мозга для гемопоэтических стволовых клеток. Природа. 2014;505(7483):327-334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Morrison SJ, Scadden DT.
Ниша костного мозга для гемопоэтических стволовых клеток. Природа. 2014;505(7483):327-334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Сугияма Т., Кохара Х., Нода М., Нагасава Т. Поддержание пула гемопоэтических стволовых клеток посредством передачи сигналов хемокинов CXCL12-CXCR4 в нишах стромальных клеток костного мозга. Иммунитет. 2006;25(6):977-988. [PubMed] [Google Scholar]
11. Ара Т., Токойода К., Сугияма Т., Эгава Т., Кавабата К., Нагасава Т. Долгоживущие гемопоэтические стволовые клетки нуждаются в факторе-1, полученном из стромальных клеток, для колонизации костного мозга во время онтогенеза. Иммунитет. 2003;19(2): 257-267. [PubMed] [Google Scholar]
12. Огава М., Мацудзаки Ю., Нишикава С. и др.. Экспрессия и функция c-kit в гемопоэтических клетках-предшественниках. J Эксперт Мед. 1991;174(1):63-71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Perlin JR, Sporrij A, Zon LI.
Кровь на дорожках: взаимодействие гемопоэтических стволовых клеток и эндотелиальных клеток при самонаведении и приживлении. J Mol Med (Берл). 2017;95(8):809-819. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Mol Med (Берл). 2017;95(8):809-819. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Chasis JA, Mohandas N. Эритробластные островки: ниши для эритропоэза. Кровь. 2008;112(3):470-478. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Агарвала С., Тамплин О.Дж. Нейронные перекрестки в нише гемопоэтических стволовых клеток. Тенденции клеточной биологии. 2018;28(12):987-998. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Ковтонюк Л.В., Фрич К., Фэн X, Манц М.Г., Такидзава Х. Воспалительное старение органов кроветворения, гемопоэтических стволовых клеток и микроокружения костного мозга. Фронт Иммунол. 2016;7:502. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Passegué E, Ernst P. ИФН-альфа пробуждает спящие гемопоэтические стволовые клетки. Нат Мед. 2009 г.;15(6):612-613. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Essers MA, Offner S, Blanco-Bose WE, et al..
IFN-альфа активирует спящие гемопоэтические стволовые клетки in vivo. Природа. 2009;458(7240):904-908. [PubMed] [Google Scholar]
Природа. 2009;458(7240):904-908. [PubMed] [Google Scholar]
19. Трамп А., Эссерс М., Уилсон А. Пробуждение дремлющих гемопоэтических стволовых клеток. Нат Рев Иммунол. 2010;10(3):201-209. [PubMed] [Google Scholar]
20. Baldridge MT, King KY, Boles NC, Weksberg DC, Goodell MA. Покоящиеся гемопоэтические стволовые клетки активируются гамма-интерфероном в ответ на хроническую инфекцию. Природа. 2010;465(7299):793-797. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. de Bruin AM, Voermans C, Nolte MA. Влияние интерферона-γ на гемопоэз. Кровь. 2014;124(16):2479-2486. [PubMed] [Google Scholar]
22. Selleri C, Maciejewski JP, Sato T, Young NS. Гамма-интерферон, конститутивно экспрессируемый в стромальном микроокружении культур костного мозга человека, опосредует сильное гематопоэтическое ингибирование. Кровь. 1996;87(10):4149-4157. [PubMed] [Google Scholar]
23. Исихара Дж., Умемото Т., Ямато М. и др..
Nov/CCN3 регулирует долговременную репопуляционную активность мышиных гемопоэтических стволовых клеток через интегрин αvβ3. Int J Гематол. 2014;99(4):393-406. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Int J Гематол. 2014;99(4):393-406. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. de Bruin AM, Libregts SF, Valkhof M, Boon L, Touw IP, Nolte MA. IFNγ индуцирует монопоэз и ингибирует развитие нейтрофилов во время воспаления. Кровь. 2012;119(6):1543-1554. [PubMed] [Google Scholar]
25. Пьетрас Э.М. Воспаление: ключевой регулятор судьбы гемопоэтических стволовых клеток в норме и при патологии. Кровь. 2017;130(15):1693-1698. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Мохандас Н., Пренант М. Трехмерная модель костного мозга. Кровь. 1978;51(4):633-643. [PubMed] [Google Scholar]
27. Macciò A, Madeddu C, Massa D и др.. Уровни гемоглобина коррелируют с уровнями интерлейкина-6 у пациентов с распространенным нелеченым эпителиальным раком яичников: роль воспаления в анемии, связанной с раком. Кровь. 2005;106(1):362-367. [PubMed] [Google Scholar]
28. Arinobu Y, Mizuno S, Chong Y и др..
Реципрокная активация GATA-1 и PU.1 отмечает начальную спецификацию гемопоэтических стволовых клеток на миелоэритроидные и миелолимфоидные линии. Клеточная стволовая клетка. 2007;1(4):416-427. [PubMed] [Академия Google]
Клеточная стволовая клетка. 2007;1(4):416-427. [PubMed] [Академия Google]
29. Бэк Дж., Дирих А., Бронн С., Кастнер П., Чан С. PU.1 определяет способность к самообновлению эритроидных клеток-предшественников. Кровь. 2004;103(10):3615-3623. [PubMed] [Google Scholar]
30. Felli N, Pedini F, Zeuner A, et al.. Многие члены суперсемейства TNF способствуют ингибированию эритропоэза, опосредованному IFN-γ. Дж Иммунол. 2005;175(3):1464-1472. [PubMed] [Google Scholar]
31. Koury MJ, Haase VH. Анемия при заболевании почек: использование реакции гипоксии для терапии. Нат Рев Нефрол. 2015;11(7):394-410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Lamble AJ, Lind EF. Ориентация на иммунную микросреду при остром миелоидном лейкозе: в центре внимания Т-клеточный иммунитет. Фронт Онкол. 2018;8:213. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Wang Y, Chen X, Cao W, Shi Y.
Пластичность мезенхимальных стволовых клеток в иммуномодуляции: патологические и терапевтические последствия. Нат Иммунол. 2014;15(11):1009-1016. [PubMed] [Google Scholar]
Нат Иммунол. 2014;15(11):1009-1016. [PubMed] [Google Scholar]
34. Китинг А. Мезенхимальные стромальные клетки: новые направления. Клеточная стволовая клетка. 2012;10(6):709-716. [PubMed] [Google Scholar]
35. Bunnell BA, Flaat M, Gagliardi C, Patel B, Ripoll C. Стволовые клетки жирового происхождения: выделение, размножение и дифференцировка. Методы. 2008;45(2):115-120. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Bunnell BA, Betancourt AM, Sullivan DE. Новые представления об иммуномодуляции, опосредованной мезенхимальными стволовыми клетками. Стволовые клетки Res Ther. 2010;1(5):34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Martino MM, Maruyama K, Kuhn GA, et al.. Ингибирование передачи сигналов IL-1R1/MyD88 способствует регенерации тканей, управляемой мезенхимальными стволовыми клетками. Нац коммун. 2016;7:11051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Манц М.Г., Бетчер С.
Экстренный гранулопоэз. Нат Рев Иммунол. 2014;14(5):302-314. [PubMed] [Google Scholar]
2014;14(5):302-314. [PubMed] [Google Scholar]
39. Boettcher S, Gerosa RC, Radpour R, et al.. Эндотелиальные клетки переводят сигналы патогенов в экстренный гранулопоэз, управляемый Г-КСФ. Кровь. 2014;124(9):1393-1403. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Broudy VC, Kaushansky K, Segal GM, Harlan JM, Adamson JW. Фактор некроза опухоли типа альфа стимулирует эндотелиальные клетки человека к выработке гранулоцитарно-макрофагального колониестимулирующего фактора. Proc Natl Acad Sci USA. 1986;83(19):7467-7471. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Sieff CA, Tsai S, Faller DV. Интерлейкин 1 индуцирует выработку культивируемыми эндотелиальными клетками человека гранулоцитарно-макрофагального колониестимулирующего фактора. Джей Клин Инвест. 1987;79(1):48-51. [PMC free article] [PubMed] [Google Scholar]
42. Тихонова А.Н., Долгалев И., Ху Х и др..
Микроокружение костного мозга при одноклеточном разрешении
[опубликованное исправление появляется в Nature . 2019;572(7767):E6]. Природа. 2019;569(7755):222-228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2019;572(7767):E6]. Природа. 2019;569(7755):222-228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Morales-Mantilla DE, King KY. Роль гамма-интерферона в развитии гемопоэтических стволовых клеток, гомеостазе и заболевании. Curr Stem Cell Rep. 2018;4(3):264-271. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Lambert C, Wu Y, Aanei C. Иммунитет костного мозга и миелодисплазия. Фронт Онкол. 2016;6:172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Coppé J-P, Desprez P-Y, Krtolica A, Campisi J. Секреторный фенотип, связанный со старением: темная сторона подавления опухоли. Анну Рев Патол. 2010;5:99-118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Orjalo AV, Bhaumik D, Gengler BK, Scott GK, Campisi J. Связанный с клеточной поверхностью IL-1alpha является вышестоящим регулятором сети цитокинов IL-6/IL-8, ассоциированной со старением. Proc Natl Acad Sci USA. 2009;106(40):17031-17036. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Веровская Е и др..
Воспалительные изменения в микроокружении костного мозга приводят к ремоделированию как ниши, так и системы крови при старении. эксп Гематол. 2018;64:S43-S44. [Академия Google]
Веровская Е и др..
Воспалительные изменения в микроокружении костного мозга приводят к ремоделированию как ниши, так и системы крови при старении. эксп Гематол. 2018;64:S43-S44. [Академия Google]
48. Биаско Л., Пеллин Д., Скала С. и др.. In vivo отслеживание кроветворения человека выявляет закономерности клональной динамики во время ранней и стационарной фаз восстановления. Клеточная стволовая клетка. 2016;19(1):107-119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Ergen AV, Boles NC, Goodell MA. Rantes/Ccl5 влияет на подтипы гемопоэтических стволовых клеток и вызывает перекос миелоидных клеток. Кровь. 2012;119(11):2500-2509. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Tuljapurkar SR, McGuire TR, Brusnahan SK, et al.. Изменения содержания жира в костном мозге человека связаны с изменениями количества гемопоэтических стволовых клеток и уровней цитокинов с возрастом. Дж Анат. 2011;219(5):574-581. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Naveiras O, Nardi V, Wenzel PL, Hauschka PV, Fahey F, Daley GQ.
Адипоциты костного мозга как негативные регуляторы гемопоэтического микроокружения. Природа. 2009;460(7252):259-263. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Naveiras O, Nardi V, Wenzel PL, Hauschka PV, Fahey F, Daley GQ.
Адипоциты костного мозга как негативные регуляторы гемопоэтического микроокружения. Природа. 2009;460(7252):259-263. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Reynaud D, Pietras E, Barry-Holson K, et al.. IL-6 контролирует судьбу лейкемических мультипотентных клеток-предшественников и способствует развитию хронического миелогенного лейкоза. Раковая клетка. 2011;20(5):661-673. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Gañán-Gómez I, Wei Y, Starczynowski DT, et al.. Нарушение регуляции врожденной иммунной и воспалительной сигнализации при миелодиспластических синдромах. Лейкемия. 2015;29(7):1458-1469. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Rambaldi A, Torcia M, Bettoni S, et al..
Модуляция клеточной пролиферации и продукции цитокинов при остром миелобластном лейкозе антагонистом рецептора интерлейкина-1 и отсутствием его экспрессии лейкозными клетками. Кровь. 1991;78(12):3248-3253. [PubMed] [Академия Google]
[PubMed] [Академия Google]
55. Зумбос, Северная Каролина, Гаскон П., Джеу Ю.Ю., Янг Н.С. Интерферон является медиатором подавления кроветворения при апластической анемии in vitro и, возможно, in vivo. Proc Natl Acad Sci USA. 1985;82(1):188-192. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Chen J, Feng X, Desierto MJ, Keyvanfar K, Young NS. IFN-γ-опосредованная деструкция гемопоэтических клеток в мышиных моделях иммуноопосредованной недостаточности костного мозга. Кровь. 2015;126(24):2621-2631. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Чен Ю.Ф., Ву З.М., Се С., Бай С., Чжао Л.Д. Уровень экспрессии ИЛ-6, секретируемого стромальными клетками костного мозга у мышей с апластической анемией. ИСРН Гематол. 2013;2013:986219. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Michelozzi IM, Pievani A, Pagni F, et al..
Мезенхимальные стромальные клетки человека, полученные при апластической анемии, образуют функциональную нишу гемопоэтических стволовых клеток in vivo. Бр Дж Гематол. 2017;179(4):669-673. [PubMed] [Google Scholar]
Бр Дж Гематол. 2017;179(4):669-673. [PubMed] [Google Scholar]
59. Spyridonidis A, Küttler T, Wäsch R, et al.. Кондиционирование с пониженной интенсивностью по сравнению со стандартным кондиционированием сохраняет способность роста стромы костного мозга in vitro, которая остается исходной. Стволовые клетки Dev. 2005;14(2):213-222. [PubMed] [Академия Google]
60. Solomou EE, Rezvani K, Mielke S, et al.. Дефицит CD4+ CD25+ FOXP3+ Т-регуляторных клеток при приобретенной апластической анемии. Кровь. 2007;110(5):1603-1606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Gargiulo L, Lastraioli S, Cerruti G, et al.. Высоко гомологичные бета-последовательности Т-клеточных рецепторов поддерживают общую мишень для аутореактивных Т-клеток у большинства пациентов с пароксизмальной ночной гемоглобинурией. Кровь. 2007;109(11):5036-5042. [PubMed] [Google Scholar]
62. Giudice V, Feng X, Lin Z и др..
Глубокое секвенирование и проточная цитометрия расширенной эффекторной памяти CD8+CD57+ Т-клеток часто выявляют олигоклональность Т-клеточного рецептора Vβ и гомологию CDR3 при приобретенной апластической анемии. Гематология. 2018;103(5):759-769. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гематология. 2018;103(5):759-769. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Gargiulo L, Papaioannou M, Sica M, et al.. Гликозилфосфатидилинозитол-специфические CD1d-рестриктированные Т-клетки при пароксизмальной ночной гемоглобинурии. Кровь. 2013;121(14):2753-2761. [PubMed] [Google Scholar]
64. Риситано А.М. Иммунный взгляд на АА. Кровь. 2017;129(21):2824-2826. [PubMed] [Google Scholar]
65. Barrett J, Saunthararajah Y, Molldrem J. Миелодиспластический синдром и апластическая анемия: разные состояния или заболевания, связанные общей патофизиологией? Семин Гематол. 2000;37(1):15-29. [PubMed] [Google Scholar]
66. Schneider RK, Schenone M, Ferreira MV, et al.. Гаплонедостаточность Rps14 вызывает блокирование эритроидной дифференцировки, опосредованное S100A8 и S100A9. Нат Мед. 2016;22(3):288-297. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Basiorka AA, McGraw KL, Eksioglu EA, et al..
Инфламмасома NLRP3 функционирует как драйвер фенотипа миелодиспластического синдрома. Кровь. 2016;128(25):2960-2975. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кровь. 2016;128(25):2960-2975. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Zambetti NA, Ping Z, Chen S, et al.. Воспаление мезенхимы вызывает генотоксический стресс в гемопоэтических стволовых клетках и предсказывает эволюцию заболевания у человека до лейкемии. Клеточная стволовая клетка. 2016;19(5):613-627. [PubMed] [Google Scholar]
69. Huang J, Xie Y, Sun X и др.. DAMP, старение и рак: «гипотеза DAMP». Aging Res Rev. 2015; 24 (pt A): 3–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Ribezzo F, Snoeren IAM, Ziegler S, et al.. Дефицит Rps14, Csnk1a1 и miRNA145/miRNA146a взаимодействует в клиническом фенотипе и активации врожденной иммунной системы при 5q-синдроме. Лейкемия. 2019;33(7):1759-1772. [PubMed] [Google Scholar]
71. Chen S, Zambetti NA, Bindels EM, et al..
Массивное параллельное секвенирование РНК высокоочищенных мезенхимальных элементов при МДС с низким риском выявляет активацию воспалительных программ, зависящую от контекста ткани. Лейкемия. 2016;30(9):1938-1942. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лейкемия. 2016;30(9):1938-1942. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Sica A, Massarotti M. Миелоидные супрессорные клетки при раке и аутоиммунитете. J Аутоиммун. 2017;85:117-125. [PubMed] [Google Scholar]
73. Велья Ф., Перего М., Габрилович Д. Взросление супрессорных клеток миелоидного происхождения. Нат Иммунол. 2018;19(2):108-119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Strauss L, Sangaletti S, Consonni FM и др.. RORC1 регулирует «аварийный» грануломоноцитопоэз, способствующий развитию опухоли. Раковая клетка. 2015;28(2):253-269. [PubMed] [Google Scholar]
75. Салман Д.А., Список А. Центральная роль воспалительной сигнализации в патогенезе миелодиспластических синдромов. Кровь. 2019;133(10):1039-1048. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Chen X, Eksioglu EA, Zhou J и др.. Индукция миелодисплазии супрессорными клетками миелоидного происхождения. Джей Клин Инвест. 2013;123(11):4595-4611. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Эксиоглу Э.А., Чен X, Хайдер К.Х. и др..
Новый терапевтический подход к улучшению кроветворения при МДС с низким риском путем нацеливания на MDSC с помощью Fc-инженерного антитела к CD33 BI 836858. Лейкемия. 2017;31(10):2172-2180. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эксиоглу Э.А., Чен X, Хайдер К.Х. и др..
Новый терапевтический подход к улучшению кроветворения при МДС с низким риском путем нацеливания на MDSC с помощью Fc-инженерного антитела к CD33 BI 836858. Лейкемия. 2017;31(10):2172-2180. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Raaijmakers MHGP, Mukherjee S, Guo S, et al.. Дисфункция костных предшественников вызывает миелодисплазию и вторичный лейкоз. Природа. 2010;464(7290):852-857. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Schneider RK, Mullally A, Dugourd A, et al.. Мезенхимальные стромальные клетки Gli1+ являются ключевым фактором фиброза костного мозга и важной клеточной терапевтической мишенью [опубликованное исправление появляется в Cell Stem Cell. 2018;23(2):308-309]. Клеточная стволовая клетка. 2017;20(6):785-800.e8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Арранс Л., Санчес-Агилера А., Мартин-Перес Д. и др..
Нейропатия ниши гемопоэтических стволовых клеток имеет важное значение для миелопролиферативных новообразований. Природа. 2014;512(7512):78-81. [PubMed] [Академия Google]
Природа. 2014;512(7512):78-81. [PubMed] [Академия Google]
81. Ханун М., Чжан Д., Мидзогучи Т. и др.. Симпатическая невропатия, индуцированная острым миелогенным лейкозом, способствует развитию злокачественных новообразований в измененной нише гемопоэтических стволовых клеток. Клеточная стволовая клетка. 2014;15(3):365-375. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Winkler IG, Sims NA, Pettit AR, et al.. Макрофаги костного мозга поддерживают ниши гемопоэтических стволовых клеток (ГСК), и их истощение мобилизует ГСК. Кровь. 2010;116(23):4815-4828. [PubMed] [Google Scholar]
83. Джайсвал С., Натараджан П., Сильвер А.Дж. и др.. Клональное кроветворение и риск атеросклеротических сердечно-сосудистых заболеваний. N Engl J Med. 2017;377(2):111-121. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Джайсвал С., Фонтанильяс П., Фланник Дж. и др..
Возрастной клональный гемопоэз ассоциирован с неблагоприятными исходами. N Engl J Med. 2014;371(26):2488-2498. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Zhang Q, Zhao K, Shen Q и др.. Tet2 необходим для устранения воспаления путем привлечения Hdac2 для специфической репрессии IL-6. Природа. 2015;525(7569):389-393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Costello RT, Mallet F, Sainty D, Maraninchi D, Gastaut JA, Olive D. Регуляция экспрессии молекул CD80/B7-1 и CD86/B7-2 при первичном остром миелоидном лейкозе человека и их роль в аллогенном иммунном распознавании. Евр Дж Иммунол. 1998;28(1):90-103. [PubMed] [Google Scholar]
87. Prestipino A, Emhardt AJ, Aumann K, et al.. Онкогенный JAK2V617F вызывает экспрессию PD-L1, опосредуя ускользание от иммунного ответа при миелопролиферативных новообразованиях. Sci Transl Med. 2018;10(429). [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Chen X, Liu S, Wang L, Zhang W, Ji Y, Ma X. Клиническое значение экспрессии B7-h2 (PD-L1) при остром лейкозе человека. Рак Биол Тер. 2008;7(5):622-627. [PubMed] [Google Scholar]
89. Killick SB, Bown N, Cavenagh J, et al.; Британское общество стандартов в гематологии. Руководство по диагностике и лечению апластической анемии у взрослых. Бр Дж Гематол. 2016;172(2):187-207. [PubMed] [Академия Google]
Killick SB, Bown N, Cavenagh J, et al.; Британское общество стандартов в гематологии. Руководство по диагностике и лечению апластической анемии у взрослых. Бр Дж Гематол. 2016;172(2):187-207. [PubMed] [Академия Google]
90. Лю Ю, Ю Ю, Ян С и др.. Регуляция активности и экспрессии аргиназы I с помощью PD-1 и CTLA-4 на супрессорных клетках миелоидного происхождения. Рак Иммунол Иммунотер. 2009;58(5):687-697. [PubMed] [Google Scholar]
91. Metz R, Rust S, Duhadaway JB и др.. IDO ингибирует сигнал достаточности триптофана, который стимулирует mTOR: новый эффекторный путь IDO, на который нацелен d-1-метил-триптофан. Онкоиммунология. 2012;1(9):1460-1468. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Мезрич Дж. Д., Фехнер Дж. Х., Чжан С., Джонсон Б. П., Берлингем В. Дж., Брэдфилд, Калифорния. Взаимодействие между кинуренином и рецептором арилуглеводорода может генерировать регуляторные Т-клетки. Дж Иммунол. 2010;185(6):3190-3198. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Niedbala W, Cai B, Liew FY.
Роль оксида азота в регуляции функций Т-клеток. Энн Реум Дис. 2006;65(дополнение 3):iii37-iii40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Niedbala W, Cai B, Liew FY.
Роль оксида азота в регуляции функций Т-клеток. Энн Реум Дис. 2006;65(дополнение 3):iii37-iii40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Mittal SK, Roche PA. Подавление презентации антигена IL-10. Курр Опин Иммунол. 2015;34:22-27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Йошимура А., Вакабаяси Ю., Мори Т. Клеточная и молекулярная основа регуляции воспаления TGF-бета. Дж Биохим. 2010;147(6):781-792. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Sinha P, Okoro C, Foell D, Freeze HH, Ostrand-Rosenberg S, Srikrishna G. Провоспалительные белки S100 регулируют накопление супрессорных клеток миелоидного происхождения. Дж Иммунол. 2008;181(7):4666-4675. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Schürch CM, Riether C, Ochsenbein AF.
Цитотоксические CD8+ Т-клетки стимулируют гемопоэтические клетки-предшественники, способствуя высвобождению цитокинов из мезенхимальных стромальных клеток костного мозга.