Углеводы: химические свойства, способы получения и строение
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
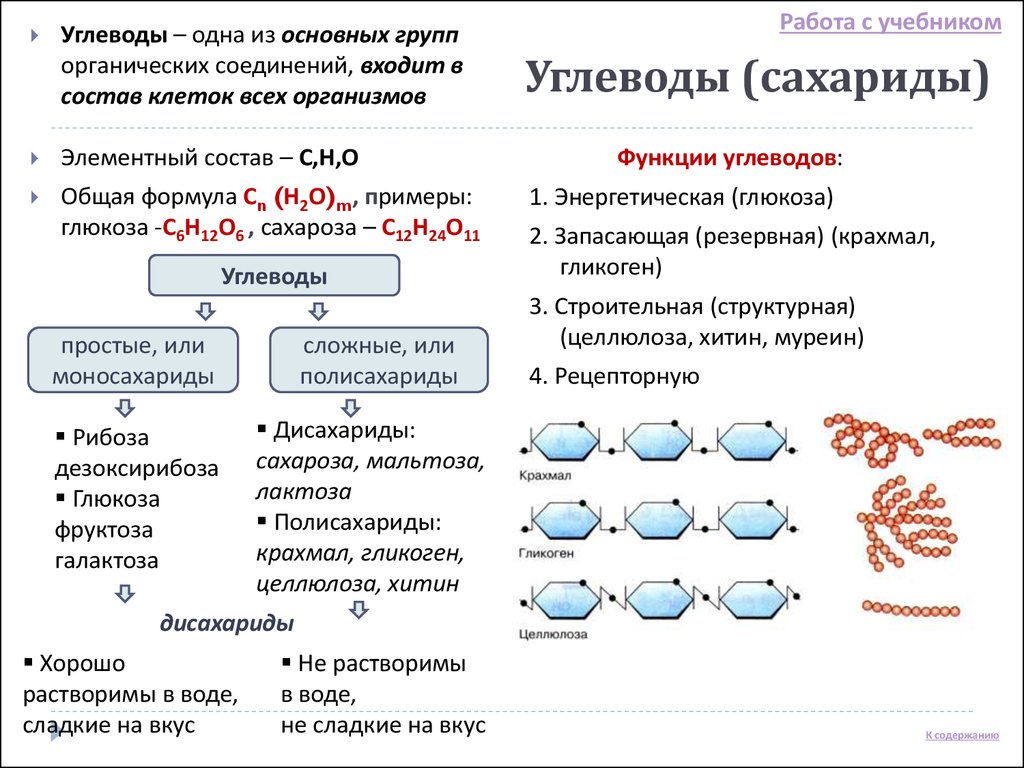
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.

Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.

- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
C6H12O6
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула | |||
| Классификация |
|
|
|
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы.
 Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
Простые эфиры глюкозы получили название гликозидов.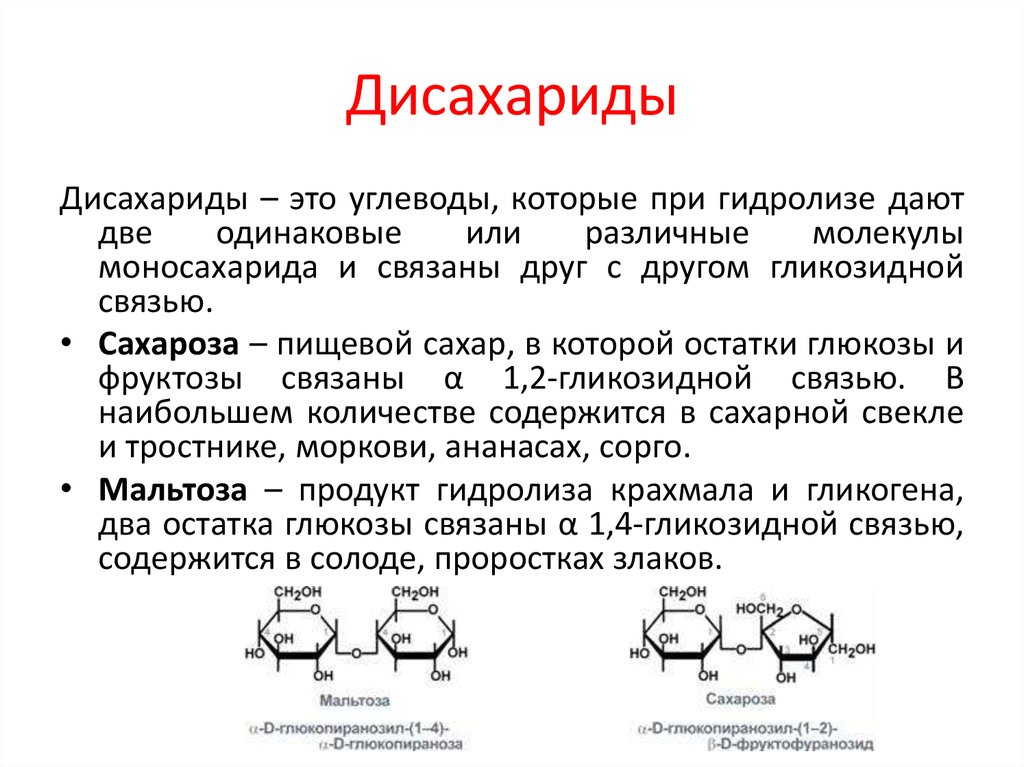 |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.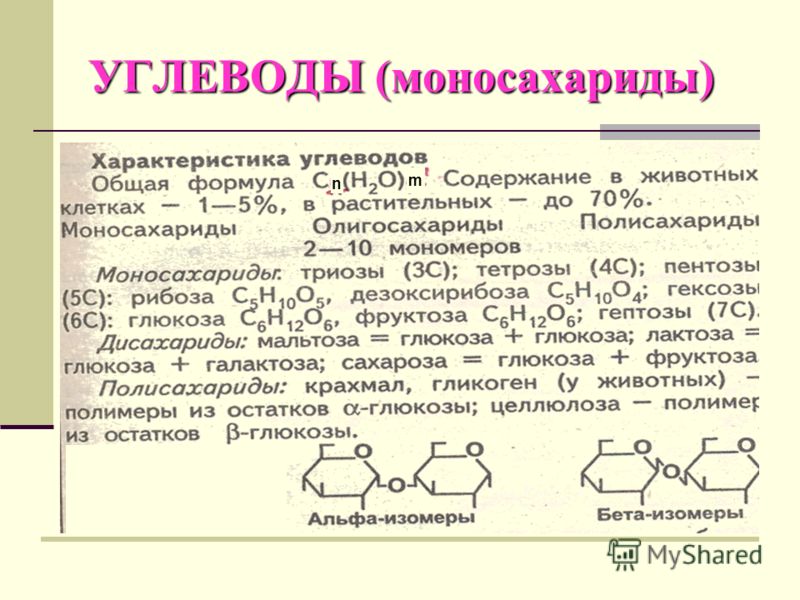
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).

- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Понравилось это:
Нравится Загрузка…
Углеводы, классификация, номенклатура, строение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Анализ на содержание углеводов в кале сдать в Щербинке
Метод определения Метод Бенедикта.
Исследуемый материал Кал
Доступен выезд на дом
Синонимы: Анализ кала на углеводы; Содержание сахаров в кале; Анализ на содержание углеводов в кале.
Fecal sugar; Reducing Substance, Feces; Stool sugar; Reducing substances faeces; Stool (or faecal) reducing substances; Fecal reducing substances (carbohydrates).
Краткое описание исследования «Содержание углеводов в кале»
Молочный сахар, или лактоза − единственный углевод молока. Это дисахарид, состоящий из глюкозы и галактозы. В тонкой кишке он расщепляется на эти моносахариды с помощью единственного фермента − лактазы. Нерасщепленная лактоза остается в просвете кишечника, удерживает жидкость, способствует поносу, появлению большого количества газов, спастических болей в животе.
Лактазная недостаточность (ЛН) – врожденное или приобретенное состояние, характеризующееся снижением активности фермента лактазы. Непереносимость лактозы – это клинически проявляющаяся врожденная или приобретенная неспособность ее расщеплять. Эквивалентом термина «непереносимость лактозы» является «интолерантность к лактозе». Такая ферментная недостаточность является широко распространенным состоянием. У взрослых она различается в зависимости от региона: Швеция, Дания – 3%, Финляндия, Швейцария – 16%, Англия – 20-30%, Франция – 42%, страны Юго-Восточной Азии, афроамериканцы США – 80-100%, европейская часть России – 16-18%.
Непереносимость лактозы – это клинически проявляющаяся врожденная или приобретенная неспособность ее расщеплять. Эквивалентом термина «непереносимость лактозы» является «интолерантность к лактозе». Такая ферментная недостаточность является широко распространенным состоянием. У взрослых она различается в зависимости от региона: Швеция, Дания – 3%, Финляндия, Швейцария – 16%, Англия – 20-30%, Франция – 42%, страны Юго-Восточной Азии, афроамериканцы США – 80-100%, европейская часть России – 16-18%.
Наибольшую значимость эта проблема имеет для детей раннего возраста, т. к. в этот возрастной период молочные продукты составляют значительную долю в рационе, а на первом году жизни являются основным продуктом питания. Лактоза составляет примерно 80-85% углеводов грудного молока и содержится в нем в количестве 6-7 г/100 мл. В коровьем молоке ее содержание несколько ниже − 4,5-5,0 г/100 мл. Другие молочные продукты также содержат лактозу, но в еще меньших количествах. Лактаза впервые обнаруживается на 10-12-й неделе гестации; с 24-й недели начинается рост ее активности, который достигает максимума к моменту рождения.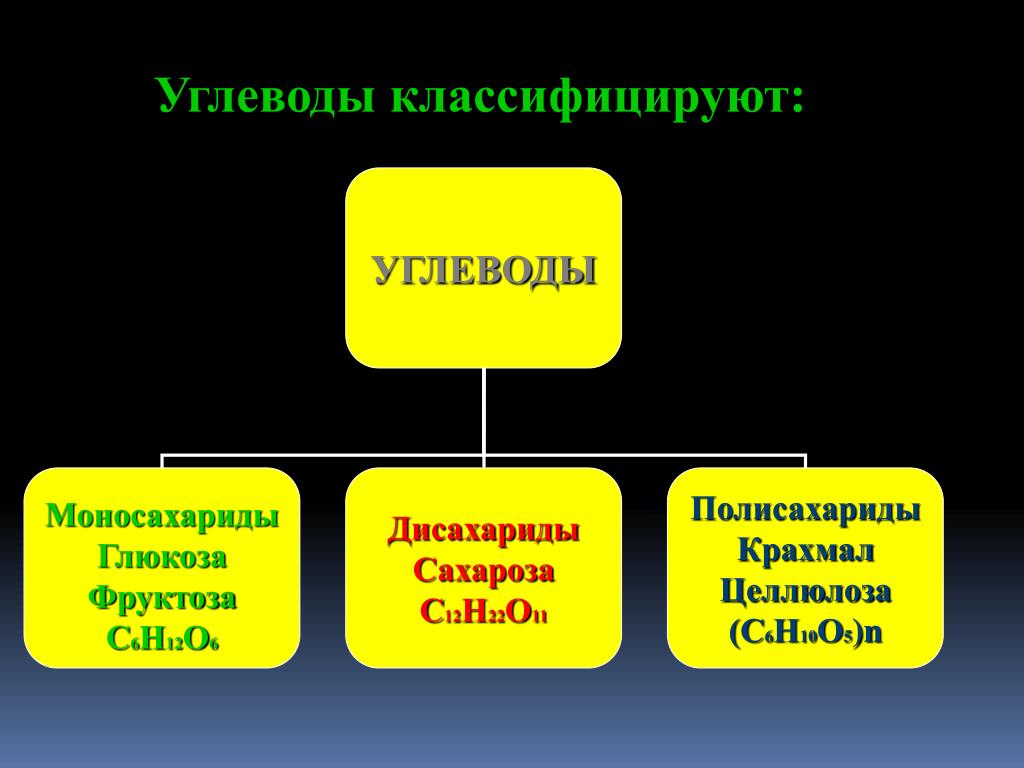 С 17 по 24-ую неделю она наиболее активна в тощей кишке, затем активность в проксимальном и дистальном отделах кишечника выравнивается. C 28 по 34-ую неделю активность лактазы составляет 30% от ее уровня на 39-40-й неделях. В последние недели гестации происходит быстрое нарастание активности лактазы до уровня, превышающего данный показатель у взрослого человека.
С 17 по 24-ую неделю она наиболее активна в тощей кишке, затем активность в проксимальном и дистальном отделах кишечника выравнивается. C 28 по 34-ую неделю активность лактазы составляет 30% от ее уровня на 39-40-й неделях. В последние недели гестации происходит быстрое нарастание активности лактазы до уровня, превышающего данный показатель у взрослого человека.
Перечисленные факторы обуславливают лактазную недостаточность у недоношенных и незрелых к моменту рождения детей. У доношенных новорожденных активность фермента в 2-4 раза выше, чем у детей в возрасте 10-12 месяцев. В последующие годы жизни активность лактазы в норме снижается, составляя у взрослых лишь 5-10% от исходного уровня.
Типы лактазной недостаточности
По степени выраженности различают частичную (гиполактазия) или полную (алактазия) лактазную недостаточность. По происхождению: первичную ЛН (врожденное снижение активности лактазы при морфологически сохранном энтероците) и вторичную ЛН (снижение активности лактазы, связанное с повреждением энтероцита).
Первичная лактазная недостаточность (ЛН):
- врожденная (генетически обусловленная, семейная) ЛН;
- транзиторная ЛН недоношенных и незрелых к моменту рождения детей;
- ЛН взрослого типа (конституциональная ЛН).
Вторичная лактазная недостаточность особенно распространена среди детей первого года жизни и часто является следствием дисбактериоза кишечника или незрелости поджелудочной железы. Причинами ее могут быть: инфекции (ротавирус, условно-патогенная микрофлора), пищевая аллергия, целиакия, лямблиоз, энтериты.
В раннем детском возрасте лактазная недостаточность носит чаще транзиторный или вторичный характер. Она нередко является причиной колик, беспокойства, диспепсических расстройств. Поскольку симптоматика вторичной лактазной недостаточности наслаивается на симптомы основного заболевания, диагностика ее может быть весьма затруднительной. Вторичная лактазная недостаточность проходит после коррекции кишечного дисбиоза или со временем (транзиторная), и тогда в старшем возрасте молочный сахар нормально усваивается.
Особенности исследования Содержания углеводов в кале
Подтвердить или опровергнуть лактазную недостаточность можно, определив содержание углеводов в кале методом Бенедикта. Это исследование отражает общую способность усваивать углеводы. В его основе лежит реакция, позволяющая выявлять присутствие сахаров, обладающих редуцирующей активностью (способностью восстанавливать медь из состояния Cu2+ в Cu1+). К ним относятся глюкоза, галактоза, лактоза, фруктоза, мальтоза. Сахароза такой способностью не обладает.
В норме содержание сахаров, обладающих редуцирующей активностью, в кале незначительно. Превышение референсных значений характеризует нарушения расщепления и всасывания сахаров. При обследовании детей первого года жизни результат отражает, преимущественно, остаточное содержание в кале молочного сахара – лактозы, и продуктов расщепления остаточной лактозы (глюкозы и галактозы) микрофлорой толстого кишечника.
С какой целью определяют Содержание углеводов в кале
Тест используется для диагностики лактазной недостаточности (нарушение всасывания лактозы и плохой переносимости продуктов питания, содержащих молочный сахар) у детей первого года жизни.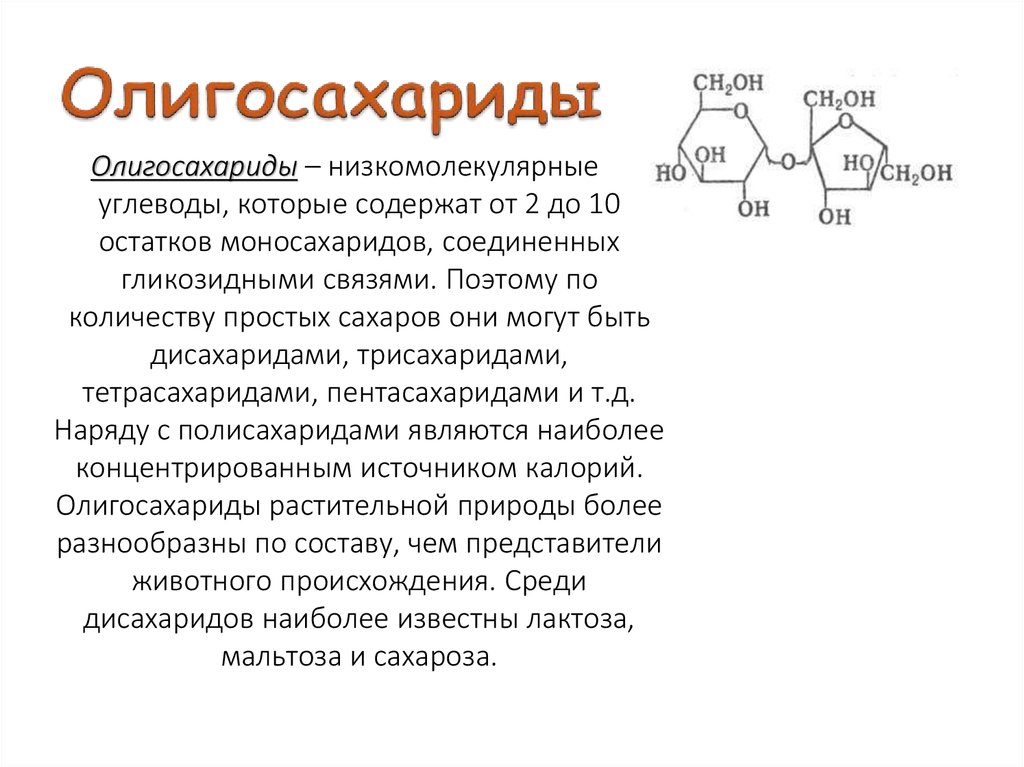
Возможности метода исследования Содержание углеводов в кале
Метод не позволяет дифференцировать различные виды дисахаридазной недостаточности между собой, однако совместно с клиническими данными вполне достаточен для скрининга и контроля правильности подбора диеты.
углеводов | Определение, классификация и примеры
пути утилизации углеводов
Просмотреть все средства массовой информации
- Ключевые люди:
- Эмиль Фишер Дж. Фрейзер Стоддарт сэр Норман Хаворт Густав Георг Эмбден Луис Федерико Лелуар
- Похожие темы:
- полисахарид моносахарид дисахарид олигосахарид декстрин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводы?
Углевод представляет собой встречающееся в природе соединение или производное такого соединения с общей химической формулой C x (H 2 O) y , состоящее из молекул углерода (C), водорода (Н) и кислород (О). Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Что означает слово углевод означает?
Химическая формула углевода C x (H 2 O) y , что означает некоторое количество атомов углерода (C) с присоединенными молекулами воды (H 2 O) — отсюда и слово углевод , что означает «гидратированный углерод».
Как классифицируются углеводы?
Углеводы делятся на четыре типа: моносахариды, дисахариды, олигосахариды и полисахариды. Моносахариды состоят из простого сахара; то есть они имеют химическую формулу C 6 Н 12 О 6 . Дисахариды — это два простых сахара. Олигосахариды состоят из трех-шести моносахаридных звеньев, а полисахариды — из более чем шести.
Являются ли углеводы полимерами?
Углеводы, не являющиеся моносахаридами, то есть дисахариды, олигосахариды и полисахариды, представляют собой полимеры, состоящие из более чем одного более простого звена или мономера. В этом случае мономер представляет собой простой сахар или моносахарид.
В этом случае мономер представляет собой простой сахар или моносахарид.
Резюме
Прочтите краткий обзор этой темы
углевод , класс встречающихся в природе соединений и образованных из них производных. В начале XIX века было обнаружено, что такие вещества, как древесина, крахмал и лен, состоят в основном из молекул, содержащих атомы углерода (С), водорода (Н) и кислорода (О), и имеют общую формулу C 6 H 1 2 O 6 ; Было обнаружено, что другие органические молекулы с аналогичными формулами имеют такое же соотношение водорода и кислорода. Общая формула С x (H 2 O) y обычно используется для обозначения многих углеводов, что означает «разбавленный водой углерод».
Углеводы, вероятно, являются наиболее распространенными и распространенными органическими веществами в природе и являются важными компонентами всех живых существ. Углеводы образуются зелеными растениями из углекислого газа и воды в процессе фотосинтеза. Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Общие характеристики
Классификация и номенклатура
Узнайте о структуре и использовании простых сахаров глюкозы, фруктозы и галактозы
Просмотреть все видео к этой статье четыре основные группы — моносахариды, дисахариды, олигосахариды и полисахариды — используемые здесь, являются одними из наиболее распространенных. Большинство моносахаридов или простых сахаров содержится в винограде, других фруктах и меде. Хотя они могут содержать от трех до девяти атомов углерода, наиболее распространенные представители состоят из пяти или шести, соединенных вместе в цепочечную молекулу. Три наиболее важных простых сахара — глюкоза (также известная как декстроза, виноградный сахар и кукурузный сахар), фруктоза (фруктовый сахар) и галактоза — имеют одинаковую молекулярную формулу (C 6 H 1 2 O 6 ), но поскольку их атомы имеют различное структурное расположение, сахара имеют разные характеристики; то есть они являются изомерами.
Незначительные изменения в структурном устройстве обнаруживаются живыми существами и влияют на биологическую значимость изомерных соединений. Известно, например, что степень сладости различных сахаров различается в зависимости от расположения гидроксильных групп (—ОН), составляющих часть молекулярной структуры. Однако прямая корреляция, которая может существовать между вкусом и каким-либо конкретным структурным устройством, еще не установлена; то есть пока невозможно предсказать вкус сахара, зная его конкретное структурное устройство. Энергия химических связей глюкозы косвенно снабжает большинство живых существ большей частью энергии, необходимой им для осуществления своей деятельности. Галактоза, которая редко встречается в виде простого сахара, обычно комбинируется с другими простыми сахарами для образования более крупных молекул.
Две молекулы простого сахара, связанные друг с другом, образуют дисахарид или двойной сахар. Дисахарид сахароза, или столовый сахар, состоит из одной молекулы глюкозы и одной молекулы фруктозы; наиболее известными источниками сахарозы являются сахарная свекла и тростниковый сахар. Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Полисахариды (этот термин означает множество сахаров) представляют собой большую часть структурных и энергозапасающих углеводов, встречающихся в природе. Крупные молекулы, которые могут состоять из 10 000 связанных друг с другом моносахаридных звеньев, полисахариды значительно различаются по размеру, сложности структуры и содержанию сахара; к настоящему времени идентифицировано несколько сотен различных типов. Целлюлоза, основной структурный компонент растений, представляет собой сложный полисахарид, состоящий из множества связанных друг с другом звеньев глюкозы; это самый распространенный полисахарид. Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Родовая номенклатура моносахаридов оканчивается на -ose ; таким образом, термин пентоза ( пентоза = пять) используется для моносахаридов, содержащих пять атомов углерода, а термин гексоза ( гекс = шесть) используется для моносахаридов, содержащих шесть. Кроме того, поскольку моносахариды содержат химически активную группу, которая является либо альдегидной, либо кетогруппой, их часто называют альдопентозами, кетопентозами, альдогексозами или кетогексозами. Альдегидная группа может находиться в положении 1 альдопентозы, а кетогруппа может находиться в другом положении (например, 2) внутри кетогексозы. Глюкоза представляет собой альдогексозу, т. е. содержит шесть атомов углерода, а химически активная группа представляет собой альдегидную группу.
Альдегидная группа может находиться в положении 1 альдопентозы, а кетогруппа может находиться в другом положении (например, 2) внутри кетогексозы. Глюкоза представляет собой альдогексозу, т. е. содержит шесть атомов углерода, а химически активная группа представляет собой альдегидную группу.
углеводы | Определение, классификация и примеры
пути утилизации углеводов
Просмотреть все средства массовой информации
- Ключевые люди:
- Эмиль Фишер Дж. Фрейзер Стоддарт сэр Норман Хаворт Густав Георг Эмбден Луис Федерико Лелуар
- Похожие темы:
- полисахарид моносахарид дисахарид олигосахарид декстрин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводы?
Углевод представляет собой встречающееся в природе соединение или производное такого соединения с общей химической формулой C x (H 2 O) y , состоящее из молекул углерода (C), водорода (Н) и кислород (О). Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Что означает слово углевод означает?
Химическая формула углевода C x (H 2 O) y , что означает некоторое количество атомов углерода (C) с присоединенными молекулами воды (H 2 O) — отсюда и слово углевод , что означает «гидратированный углерод».
Как классифицируются углеводы?
Углеводы делятся на четыре типа: моносахариды, дисахариды, олигосахариды и полисахариды. Моносахариды состоят из простого сахара; то есть они имеют химическую формулу C 6 Н 12 О 6 . Дисахариды — это два простых сахара. Олигосахариды состоят из трех-шести моносахаридных звеньев, а полисахариды — из более чем шести.
Являются ли углеводы полимерами?
Углеводы, не являющиеся моносахаридами, то есть дисахариды, олигосахариды и полисахариды, представляют собой полимеры, состоящие из более чем одного более простого звена или мономера. В этом случае мономер представляет собой простой сахар или моносахарид.
В этом случае мономер представляет собой простой сахар или моносахарид.
Резюме
Прочтите краткий обзор этой темы
углевод , класс встречающихся в природе соединений и образованных из них производных. В начале XIX века было обнаружено, что такие вещества, как древесина, крахмал и лен, состоят в основном из молекул, содержащих атомы углерода (С), водорода (Н) и кислорода (О), и имеют общую формулу C 6 H 1 2 O 6 ; Было обнаружено, что другие органические молекулы с аналогичными формулами имеют такое же соотношение водорода и кислорода. Общая формула С x (H 2 O) y обычно используется для обозначения многих углеводов, что означает «разбавленный водой углерод».
Углеводы, вероятно, являются наиболее распространенными и распространенными органическими веществами в природе и являются важными компонентами всех живых существ. Углеводы образуются зелеными растениями из углекислого газа и воды в процессе фотосинтеза. Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Общие характеристики
Классификация и номенклатура
Узнайте о структуре и использовании простых сахаров глюкозы, фруктозы и галактозы
Просмотреть все видео к этой статье четыре основные группы — моносахариды, дисахариды, олигосахариды и полисахариды — используемые здесь, являются одними из наиболее распространенных. Большинство моносахаридов или простых сахаров содержится в винограде, других фруктах и меде. Хотя они могут содержать от трех до девяти атомов углерода, наиболее распространенные представители состоят из пяти или шести, соединенных вместе в цепочечную молекулу. Три наиболее важных простых сахара — глюкоза (также известная как декстроза, виноградный сахар и кукурузный сахар), фруктоза (фруктовый сахар) и галактоза — имеют одинаковую молекулярную формулу (C 6 H 1 2 O 6 ), но поскольку их атомы имеют различное структурное расположение, сахара имеют разные характеристики; то есть они являются изомерами.
Незначительные изменения в структурном устройстве обнаруживаются живыми существами и влияют на биологическую значимость изомерных соединений. Известно, например, что степень сладости различных сахаров различается в зависимости от расположения гидроксильных групп (—ОН), составляющих часть молекулярной структуры. Однако прямая корреляция, которая может существовать между вкусом и каким-либо конкретным структурным устройством, еще не установлена; то есть пока невозможно предсказать вкус сахара, зная его конкретное структурное устройство. Энергия химических связей глюкозы косвенно снабжает большинство живых существ большей частью энергии, необходимой им для осуществления своей деятельности. Галактоза, которая редко встречается в виде простого сахара, обычно комбинируется с другими простыми сахарами для образования более крупных молекул.
Две молекулы простого сахара, связанные друг с другом, образуют дисахарид или двойной сахар. Дисахарид сахароза, или столовый сахар, состоит из одной молекулы глюкозы и одной молекулы фруктозы; наиболее известными источниками сахарозы являются сахарная свекла и тростниковый сахар. Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Полисахариды (этот термин означает множество сахаров) представляют собой большую часть структурных и энергозапасающих углеводов, встречающихся в природе. Крупные молекулы, которые могут состоять из 10 000 связанных друг с другом моносахаридных звеньев, полисахариды значительно различаются по размеру, сложности структуры и содержанию сахара; к настоящему времени идентифицировано несколько сотен различных типов. Целлюлоза, основной структурный компонент растений, представляет собой сложный полисахарид, состоящий из множества связанных друг с другом звеньев глюкозы; это самый распространенный полисахарид. Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Родовая номенклатура моносахаридов оканчивается на -ose ; таким образом, термин пентоза ( пентоза = пять) используется для моносахаридов, содержащих пять атомов углерода, а термин гексоза ( гекс = шесть) используется для моносахаридов, содержащих шесть. Кроме того, поскольку моносахариды содержат химически активную группу, которая является либо альдегидной, либо кетогруппой, их часто называют альдопентозами, кетопентозами, альдогексозами или кетогексозами. Альдегидная группа может находиться в положении 1 альдопентозы, а кетогруппа может находиться в другом положении (например, 2) внутри кетогексозы. Глюкоза представляет собой альдогексозу, т. е. содержит шесть атомов углерода, а химически активная группа представляет собой альдегидную группу.
Альдегидная группа может находиться в положении 1 альдопентозы, а кетогруппа может находиться в другом положении (например, 2) внутри кетогексозы. Глюкоза представляет собой альдогексозу, т. е. содержит шесть атомов углерода, а химически активная группа представляет собой альдегидную группу.
углеводы | Определение, классификация и примеры
пути утилизации углеводов
Просмотреть все средства массовой информации
- Ключевые люди:
- Эмиль Фишер Дж. Фрейзер Стоддарт сэр Норман Хаворт Густав Георг Эмбден Луис Федерико Лелуар
- Похожие темы:
- полисахарид моносахарид дисахарид олигосахарид декстрин
Просмотреть весь связанный контент →
Популярные вопросы
Что такое углеводы?
Углевод представляет собой встречающееся в природе соединение или производное такого соединения с общей химической формулой C x (H 2 O) y , состоящее из молекул углерода (C), водорода (Н) и кислород (О).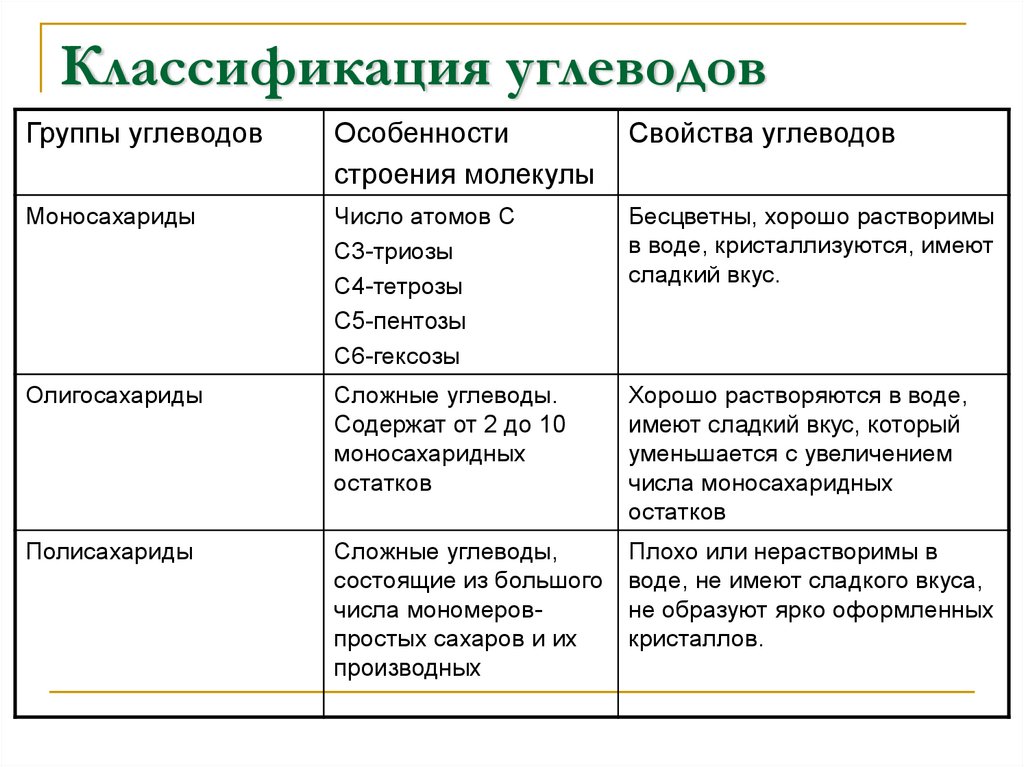 Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Углеводы являются наиболее распространенными органическими веществами и играют жизненно важную роль во всей жизни.
Что означает слово углевод означает?
Химическая формула углевода C x (H 2 O) y , что означает некоторое количество атомов углерода (C) с присоединенными молекулами воды (H 2 O) — отсюда и слово углевод , что означает «гидратированный углерод».
Как классифицируются углеводы?
Углеводы делятся на четыре типа: моносахариды, дисахариды, олигосахариды и полисахариды. Моносахариды состоят из простого сахара; то есть они имеют химическую формулу C 6 Н 12 О 6 . Дисахариды — это два простых сахара. Олигосахариды состоят из трех-шести моносахаридных звеньев, а полисахариды — из более чем шести.
Являются ли углеводы полимерами?
Углеводы, не являющиеся моносахаридами, то есть дисахариды, олигосахариды и полисахариды, представляют собой полимеры, состоящие из более чем одного более простого звена или мономера.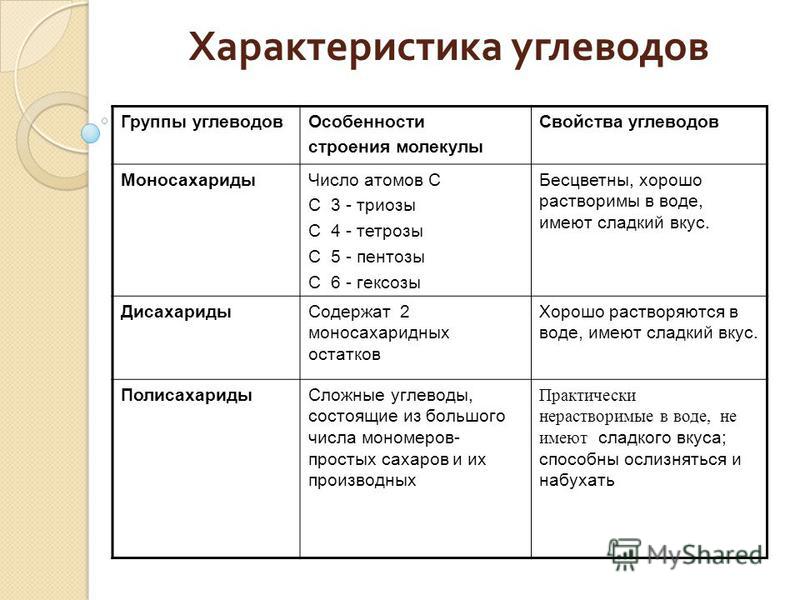 В этом случае мономер представляет собой простой сахар или моносахарид.
В этом случае мономер представляет собой простой сахар или моносахарид.
Резюме
Прочтите краткий обзор этой темы
углевод , класс встречающихся в природе соединений и образованных из них производных. В начале XIX века было обнаружено, что такие вещества, как древесина, крахмал и лен, состоят в основном из молекул, содержащих атомы углерода (С), водорода (Н) и кислорода (О), и имеют общую формулу C 6 H 1 2 O 6 ; Было обнаружено, что другие органические молекулы с аналогичными формулами имеют такое же соотношение водорода и кислорода. Общая формула С x (H 2 O) y обычно используется для обозначения многих углеводов, что означает «разбавленный водой углерод».
Углеводы, вероятно, являются наиболее распространенными и распространенными органическими веществами в природе и являются важными компонентами всех живых существ. Углеводы образуются зелеными растениями из углекислого газа и воды в процессе фотосинтеза. Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Углеводы служат источниками энергии и важными структурными компонентами организмов; кроме того, часть структуры нуклеиновых кислот, содержащих генетическую информацию, состоит из углеводов.
Общие характеристики
Классификация и номенклатура
Узнайте о структуре и использовании простых сахаров глюкозы, фруктозы и галактозы
Просмотреть все видео к этой статье четыре основные группы — моносахариды, дисахариды, олигосахариды и полисахариды — используемые здесь, являются одними из наиболее распространенных. Большинство моносахаридов или простых сахаров содержится в винограде, других фруктах и меде. Хотя они могут содержать от трех до девяти атомов углерода, наиболее распространенные представители состоят из пяти или шести, соединенных вместе в цепочечную молекулу. Три наиболее важных простых сахара — глюкоза (также известная как декстроза, виноградный сахар и кукурузный сахар), фруктоза (фруктовый сахар) и галактоза — имеют одинаковую молекулярную формулу (C 6 H 1 2 O 6 ), но поскольку их атомы имеют различное структурное расположение, сахара имеют разные характеристики; то есть они являются изомерами.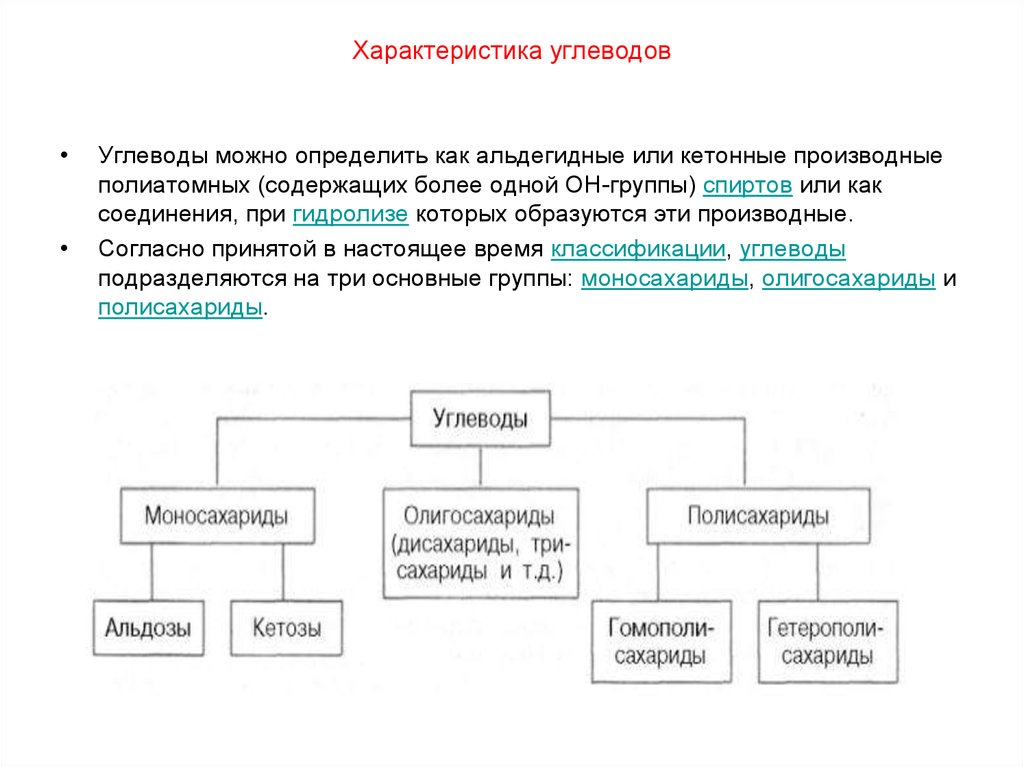
Незначительные изменения в структурном устройстве обнаруживаются живыми существами и влияют на биологическую значимость изомерных соединений. Известно, например, что степень сладости различных сахаров различается в зависимости от расположения гидроксильных групп (—ОН), составляющих часть молекулярной структуры. Однако прямая корреляция, которая может существовать между вкусом и каким-либо конкретным структурным устройством, еще не установлена; то есть пока невозможно предсказать вкус сахара, зная его конкретное структурное устройство. Энергия химических связей глюкозы косвенно снабжает большинство живых существ большей частью энергии, необходимой им для осуществления своей деятельности. Галактоза, которая редко встречается в виде простого сахара, обычно комбинируется с другими простыми сахарами для образования более крупных молекул.
Две молекулы простого сахара, связанные друг с другом, образуют дисахарид или двойной сахар. Дисахарид сахароза, или столовый сахар, состоит из одной молекулы глюкозы и одной молекулы фруктозы; наиболее известными источниками сахарозы являются сахарная свекла и тростниковый сахар.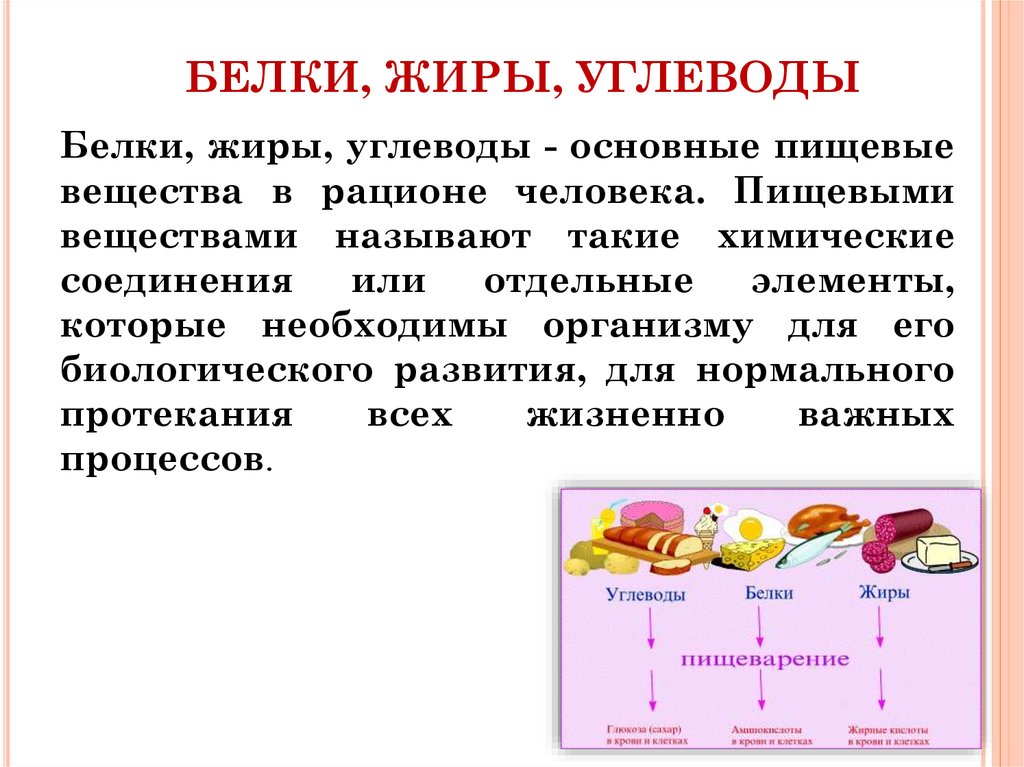 Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Молочный сахар, или лактоза, и мальтоза также являются дисахаридами. Прежде чем энергия дисахаридов сможет быть использована живыми существами, молекулы должны быть расщеплены на соответствующие им моносахариды. Олигосахариды, состоящие из трех-шести моносахаридных звеньев, довольно редко встречаются в природных источниках, хотя было идентифицировано несколько растительных производных.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Полисахариды (этот термин означает множество сахаров) представляют собой большую часть структурных и энергозапасающих углеводов, встречающихся в природе. Крупные молекулы, которые могут состоять из 10 000 связанных друг с другом моносахаридных звеньев, полисахариды значительно различаются по размеру, сложности структуры и содержанию сахара; к настоящему времени идентифицировано несколько сотен различных типов. Целлюлоза, основной структурный компонент растений, представляет собой сложный полисахарид, состоящий из множества связанных друг с другом звеньев глюкозы; это самый распространенный полисахарид. Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Крахмал, обнаруженный в растениях, и гликоген, обнаруженный в животных, также являются сложными полисахаридами глюкозы. Крахмал (от староанглийского слова stercan , что означает «затвердевать») содержится в основном в семенах, корнях и стеблях, где он хранится в качестве доступного источника энергии для растений. Растительный крахмал можно перерабатывать в такие продукты, как хлеб, или его можно потреблять напрямую, например, в картофеле. Гликоген, состоящий из разветвленных цепочек молекул глюкозы, образуется в печени и мышцах высших животных и запасается как источник энергии.
Родовая номенклатура моносахаридов оканчивается на -ose ; таким образом, термин пентоза ( пентоза = пять) используется для моносахаридов, содержащих пять атомов углерода, а термин гексоза ( гекс = шесть) используется для моносахаридов, содержащих шесть. Кроме того, поскольку моносахариды содержат химически активную группу, которая является либо альдегидной, либо кетогруппой, их часто называют альдопентозами, кетопентозами, альдогексозами или кетогексозами.


 Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.