Смекта при ротавирусе у детей и взрослых
Ротавирусная инфекция
– довольно распространенная проблема как у детей, так и у взрослых, и вероятность заражения при контакте с больным почти стопроцентная. Весной и осенью ротавирусы особенно часто встречаются, и диарея, тошнота, температура становятся массовым явлением, а лечение – неприятной необходимостью. Смекта при ротавирусе – одно из самых эффективных средств, не приводящих к ослаблению иммунитета.
Вы узнаете:
- 1 Кишечный грипп: основные угрозы
- 2 Что обязательно нужно делать?
- 3 Смекта или Энтеросгель?
- 4 Как принимать Смекту при ротавирусе?
- 5 Натуральность и безопасность? Еще и приятный вкус!
Кишечный грипп: основные угрозы
При ротавирусной инфекции главной проблемой становится
обезвоживание организма
, поскольку рвота и диарея выводят слишком много жидкости. Даже для взрослого человека понос в течение 2-3 днем может угрожать жизни, а при инфекции у детей достаточно суток, чтобы начались необратимые изменения в организме.
Именно поэтому в лечении ротавируса важно решать одновременно несколько задач: бороться с вирусом, восстанавливать водно-солевой баланс, сохранять кишечную микрофлору и выводить токсины и продукты метаболизма. И выбор сорбента в данном случае производится по целому списку критериев, начиная от размеров пор, чтобы не выводить электролиты, и заканчивая быстродействием, чтобы как можно скорее восстановить нормальную работу кишечника.
Ребенок также может страдать от высокой температуры и интоксикации, выраженной в болевых ощущениях, так что еще одно обязательное требование к сорбенту – быстрое выведение продуктов распада, которые усиливают боль.
Что обязательно нужно делать?
При ротавирусе обязательно нужно пить воду.
Очень много теплой воды, можно с регидроном или любыми растворами для восстановления водно-электролитного баланса. Это поможет предотвратить обезвоживание. В случае тошноты и рвоты можно добавлять в воду несколько капель лимонного сока – кислое уменьшит тошноту.
Еще при ротавирусе нужно лежать. Не ходить на работу, учебу, в детский сад, на кружки, даже в магазин – чтобы не заражать всех окружающих людей и не истощать и без того малые запасы энергии. Постельный режим и обильное теплое питье – вообще наилучшая стратегия при любых вирусных инфекциях, и у взрослых, и у детей. Экономить энергию необходимо еще и потому, что питаться в период острой фазы болезни крайне затруднительно, и, более того, нежелательно.
При первых симптомах ротавируса у взрослых следует организовать для пациента изолированное помещение, и выбрать одного члена семьи для ухода, ограничив контакты с остальными. Детям в данном случае так же желательно не контактировать с родными, но реализовать данную рекомендацию будет сложнее.
После выздоровления крайне важно укреплять иммунитет закаливанием, витаминами, регулярными прогулками на свежем воздухе. В течении двух-трех недель нежелательно заниматься спортом, отправляться в путешествия и выполнять тяжелую физическую работу.
Ротавирус под микроскопом
Смекта или Энтеросгель?
Многие советы из сети рекомендуют сначала принимать Энтеросгель, а уже в качестве завершения лечения – Смекту. Некоторые врачи так же советуют применять только Энтеросгель, однако есть один нюанс: Смекта значительно лучше борется именно с инфекционной диареей, а Энтеросгель снимает симптомы отравления. Именно поэтому начинать лечение лучше Смектой. Вот для профилактики поноса и рвоты Энтеросгель вполне подойдет.
Как принимать Смекту при ротавирусе?
Начиная лечение ротавируса важно помнить, что жаропонижающие препараты и иммуноукрепляющие средства нужно принимать после Смекты – иначе сорбент просто их удалит из организма.
Прием следует начинать по инструкции: развести порошок в воде комнатной температуры для получения суспензии и тут же выпить. Дозировка при этом определяется по специальной таблице в инструкции: по половине пакетика дважды в сутки детям и до трех пакетиков в сутки взрослым.
При острой диарее объемы препарата возрастают до 2 пакетов в день малышам до года, детям – до 4 пакетиков, взрослым – до 6. Естественно, что как только острая фаза болезни миновала, дозировки снижаются.
Дозировка при этом определяется по специальной таблице в инструкции: по половине пакетика дважды в сутки детям и до трех пакетиков в сутки взрослым.
При острой диарее объемы препарата возрастают до 2 пакетов в день малышам до года, детям – до 4 пакетиков, взрослым – до 6. Естественно, что как только острая фаза болезни миновала, дозировки снижаются.
Поскольку применение Смекты на фоне обезвоживания способно вызвать запоры, рекомендуется во время лечения пить больше жидкости. При использовании в терапевтических дозировках риск запоров минимален.
Натуральность и безопасность? Еще и приятный вкус!
Действующее вещество препарата — смектит диоктаэдрический(диосмектит), состоящий из смеси силикатов алюминия и магния, проходит через желудочно-кишечный тракт, не всасываясь. Пористая структура диосмектита позволяет впитывать и связывать жидкость вместе с токсинами, ядами, бактериями и вирусами, находящимися в кишечнике. Поскольку силикаты вообще слаборастворимы, а соединения в составе сорбента устойчивы даже к желудочному соку, отравиться или получить аллергическую реакцию при их применении невозможно.
Помимо действующего вещества в состав Смекты входят нейтральные ароматизаторы: ванильный и апельсиновый, а так же сахароза, которая обеспечивает суспензии приятный вкус. Добавки позволяют исключить капризы при применении сорбента у детей, однако их наличие ограничивает применение препарата у аллергиков и диабетиков. Данным категориям можно применять Смекту при ротавирусе только в отсутствие альтернативных вариантов.
К сожалению, суспензия при употреблении не слишком приятна на вкус, однако очень мелкие частицы не создают ощущение «песка» и легко проглатываются при запивании водой. Сладость и легкий аромат делают лечение более комфортным.
Поскольку с помощью Смекты можно одновременно связывать ротавирус в кишечнике и купировать диарею, сам процесс лечения инфекции ускоряется, а течение болезни становится менее острым. С применением сорбента снижается необходимость в приеме обезболивающих жаропонижающих, удается снизить нагрузку на печень и выделительную систему.
Ротавирус у ребенка
Ротавирус у детей: симптомы, лечение, профилактика.
Ротавирусная инфекция — острое инфекционное заболевание с фекально-оральным путем передачи, характеризующиеся поражением желудочно-кишечного тракта по типу гастроэнтерита с развитием синдрома дегидратации (обезвоживания).
Ротавирус является ведущей причиной гастроэнтеритов у детей в возрасте младше 5 лет. .В России наиболее часто регистрируется в зимне-весенний период.
Причины инфекции:
Возбудитель — ротавирус, относится к семейству
РНК-содержащих вирусов. Заразными для человека считаются 1 — 4, 8 и 9 типы вируса.
Источник инфекции ― человек (больной или вирусовыделитель). Число бессимптомных носителей вируса среди детей может достигать 5–7%. Вирус способен на протяжении нескольких месяцев сохранять жизнеспособность во внешней среде, устойчив при низких температурах, быстро погибает при нагревании.
В целом по РФ удельный вес заболевших детей до 1 года составляет 20,6%, в возрасте 1–2 лет — 44,7%. К 2-летнему возрасту почти каждый ребенок хотя бы 1 раз переносит ротавирусную инфекцию и более 2/3 заболевают повторно. Учитывая высокую контагиозность (заразность) является частой причины вспышек в организованных коллективах (детский сад, школа) и больницах.
К 2-летнему возрасту почти каждый ребенок хотя бы 1 раз переносит ротавирусную инфекцию и более 2/3 заболевают повторно. Учитывая высокую контагиозность (заразность) является частой причины вспышек в организованных коллективах (детский сад, школа) и больницах.
Механизм передачи ротавируса ― фекально-оральный: реализуется пищевым, водным и контактно-бытовым путем. Учитывая крайне высокую контагиозность ротавируса и устойчивость возбудителя к средствам бытовой химии, даже очень строгие меры гигиены (в т.ч. мытье рук после каждого контакта с больным) зачастую могут оказаться неэффективными. Инкубационный период составляет всего несколько суток ― в среднем от 1 до 3 дней.
Клиническая картина
Основные симптомы ротавирусного гастроэнтерита — общая интоксикация (лихорадка, вялость, рвота, головная боль) и изменения со стороны ЖКТ: боли в животе, частый жидкий водянистый стул. Ротавирусному гастроэнтериту свойственны два варианта начала болезни: острый (около 90% больных), когда все основные симптомы появляются в 1-е сутки болезни, и подострый, когда к 1-2 симптомам (чаще боли в животе и интоксикация) на 2-3 день болезни присоединяются диарея, рвота, лихорадка.
Ротавирусному гастроэнтериту свойственны два варианта начала болезни: острый (около 90% больных), когда все основные симптомы появляются в 1-е сутки болезни, и подострый, когда к 1-2 симптомам (чаще боли в животе и интоксикация) на 2-3 день болезни присоединяются диарея, рвота, лихорадка.
Общеинфекционный синдром.
Большинство случаев ротавирусной инфекции начинается остро с повышения температуры до фебрильных цифр (38,0 градусов) или даже гипертермии, однако длительность лихорадки, несмотря на её выраженность, редко превышает 2-4 дня. Лихорадка сопровождается симптомами интоксикации: слабостью, вялостью, снижением аппетита вплоть до развития анорексии и адинамии при тяжелых формах болезни. У детей старшего возраста при легких формах заболевание может протекать на фоне субфебрильной температуры с умеренно выраженными симптомами интоксикации или их отсутствием.
Синдром местных изменений (гастрит, гастроэнтерит и/или энтерит). Одним из первых, а нередко и ведущим проявлением ротавирусной инфекции, является рвота. Она может возникать одновременно с диареей или предшествовать ей, носить повторный или многократный характер на протяжении 1-2 дней. Поражение ЖКТ протекает по типу гастроэнтерита или (реже) энтерита. Диарейный синдром при ротавирусной инфекции является одним из наиболее важных и постоянных проявлений, в ряде случаев определяющих клиническую картину заболевания. Стул обильный, водянистый, пенистый, желтого цвета, без видимых патологических примесей, или с небольшим количеством прозрачной слизи, иногда отмечается характерный кислый запах испражнений. Частота стула в среднем не превышает 4–5 раз в сутки, но у детей младшего возраста может достигать 15–20 раз. Продолжительность диареи в среднем колеблется от 3 до 7 дней, но может сохраняться и более продолжительное время (до 10-14 дней, чаще у детей раннего возраста). Для ротавирусной инфекции характерно сочетание диареи с явлениями метеоризма, которые наиболее выражены у детей первого года жизни.
Одним из первых, а нередко и ведущим проявлением ротавирусной инфекции, является рвота. Она может возникать одновременно с диареей или предшествовать ей, носить повторный или многократный характер на протяжении 1-2 дней. Поражение ЖКТ протекает по типу гастроэнтерита или (реже) энтерита. Диарейный синдром при ротавирусной инфекции является одним из наиболее важных и постоянных проявлений, в ряде случаев определяющих клиническую картину заболевания. Стул обильный, водянистый, пенистый, желтого цвета, без видимых патологических примесей, или с небольшим количеством прозрачной слизи, иногда отмечается характерный кислый запах испражнений. Частота стула в среднем не превышает 4–5 раз в сутки, но у детей младшего возраста может достигать 15–20 раз. Продолжительность диареи в среднем колеблется от 3 до 7 дней, но может сохраняться и более продолжительное время (до 10-14 дней, чаще у детей раннего возраста). Для ротавирусной инфекции характерно сочетание диареи с явлениями метеоризма, которые наиболее выражены у детей первого года жизни.
Синдром дегидратации. Тяжесть течения ротавирусного гастроэнтерита определяется объемом патологических потерь жидкости с рвотой и диарей и развитием эксикоза (обезвоживания) I–II, реже II-III степени. Степень эксикоза у больных зависит не только от выраженности патологических потерь жидкости и электролитов, а также от адекватности проводимой регидратационной терапии (адекватного восполнения жидкости). О развитии дегидратации сигнализируют следующие признаки: постоянная жажда, западение глаз и большого родничка, сухость кожи, склер и слизистых оболочек. Кожные покровы приобретают землисто-серый оттенок, губы становятся яркими и сухими, снижает тургор кожи, уменьшается количество мочи.
Синдром катаральных изменений. У 60–70% больных при ротавирусной инфекции имеют место катаральные явления со стороны верхних дыхательных путей, которые могут предшествовать дисфункции кишечника. Он характеризуется умеренной гиперемией и зернистостью задней стенки глотки, мягкого неба и небных дужек, заложенностью носа, покашливанием. Однако наличие катаральных явлений в ряде случаев может быть обусловлено сопутствующей респираторной вирусной инфекцией, особенно в период сезонного подъема заболеваемости.
Внекишечные осложнения:
— дегидратация
— вторичная инфекция
— возможно развитие судорог
— неправильном водном режиме РВГЭ может стать причиной отека мозга, ДВС-синдрома, острой почечной недостаточности и других жизнеугрожающих состояний
Наиболее тревожный признаки! (Необходимо вызвать СМП)
-выраженная слабость и вялость, практически постоянный сон или наоборот непрекращающиеся беспокойство
— непрекращающаяся рвота
— невозможность напоить ребенка
— отсутствие мочеиспускания или очень редкое концентрированной мочой
— у детей до года — западение родничка
— примесь крови в стуле
Прогноз заболеваения:
Прогноз заболевания при адекватной гидратации, как правило, благоприятный, длительность болезни редко превышает 5−7 дней. После перенесенного ротавирусного гастроэнтерита ребенок может заразиться повторно из-за сезонной смены циркулирующих серотипов ротавируса, но перенесенная естественная инфекция может снижать тяжесть течения последующих инфекций.
После перенесенного ротавирусного гастроэнтерита ребенок может заразиться повторно из-за сезонной смены циркулирующих серотипов ротавируса, но перенесенная естественная инфекция может снижать тяжесть течения последующих инфекций.
Диагностика:
ИФА кала и ОКИ -тест (так же включает ПЦР исследование на другие типы вирусов, вызывающих острые кишечные инфекции, сальмонеллез и дизентерию)
Первая помощь:
-Обильное дробное питье. Для этого предпочтительнее использовать специализированные солевые растворы — Регидрон, Регидрон — Био. В первые часы, что бы не провоцировать рвоту, можно давать по 1 ч.л. или ст.л. каждые 5 — 10 минут.
ВАЖНО ПОМНИТЬ! За сутки в зависимости от возраста ребенок должен выпить минимум 1 — 1,5 литра воды. Поэтому особенно в первые стуки ребенка СЛЕДУЕТ продолжать поить и во сне, контролируя что бы ребенок не поперхнулся.
— Маленького ребенка положить на бок, чтобы в случае приступа рвоты он не захлебнулся рвотными массами.
-Жаропонижающие средства — только если температура выше 38,5.
— первые 3 часа после рвоты не кормить, далее небольшими порциями.
Грудное вскармливание обязательно продолжать!
— В остром периоде, для ускоренной нормализации стула и выведения вируса из организма, применяются вяжущие и адсорбирующие вещества (карболен, полифепан, смекта, энтеросгель и пр.)
Диета:
При лечении кишечных инфекций, провоцирующих развитие ферментопатии, особое внимание уделяется диете. Так как в ходе развития патологического процесса нарушается активность ряда пищеварительных ферментов, в частности, лактазы, в острый период заболевания из пищевого рациона ребенка следует исключить цельное молоко и молочные продукты и ограничить прием пищи, богатой углеводами (сладкие фрукты, фруктовые соки, выпечка, бобовые культуры). Также в острый период болезни не разрешается кормить детей мясом, бульонами, мясными продуктами, жирными и жареными блюдами. Пищу больному ребенку дают часто, небольшими порциями. В список разрешенных продуктов входят слизистые каши, овощные пюре и супы, белые сухарики и печеные яблоки.
Также в острый период болезни не разрешается кормить детей мясом, бульонами, мясными продуктами, жирными и жареными блюдами. Пищу больному ребенку дают часто, небольшими порциями. В список разрешенных продуктов входят слизистые каши, овощные пюре и супы, белые сухарики и печеные яблоки.
Грудное вскармливание при наличии кишечной инфекции не прекращают, так как в материнском молоке содержаться антитела, нейтрализующие ротавирус и иммуноглобулины, облегчающие течение заболевания.
Частые ошибки:
— Дача антибиотика. В данном случае виновник вирус и любой антибиотик совершенно бессилен против него. Он не принесет никакой пользы, тлько увеличит вероятность осложнений.
— при обильном поносе использование любых противодиарейных средств по типу лоперамида (без консультации врача). Их прием может усилить интоксикацию, удлинить период выздоровления.
Профилактика:
Против ротавируса существует специфическая профилактика- вакцинация
Вакцинация (Ротатек). Курс состоит из трех доз с интервалом введкения от 4 до 10 недель.. Первое введение вакцины в возрасте от 6 до 12 недель. Последнеее введение до 32 недели жизни. (Совместима с любыми вакцинами из национального календаря кроме БЦЖ)
Курс состоит из трех доз с интервалом введкения от 4 до 10 недель.. Первое введение вакцины в возрасте от 6 до 12 недель. Последнеее введение до 32 недели жизни. (Совместима с любыми вакцинами из национального календаря кроме БЦЖ)
Кроме того:
Производится изоляция пациентов в домашних условиях с легкими формами ротавирусной инфекции т в течение 7 дней, после чего переболевший может быть допущен в организованный коллектив (в том числе детский) на основании справки врача о выздоровлении без дополнительного вирусологического обследования.
• Использование для питья только кипяченой воды;
• Тщательное мытье рук перед едой;
• Предварительное мытье фруктов и овощей при помощи щетки;
• Достаточная термическая обработка пищи.
Ротавирус у детей — КГБУЗ Горбольница №12, г.
 Барнаул: статьи
Барнаул: статьиОдна из самых распространенных причин диареи у детей — ротавирусная инфекция 1,2 . Свое название ротавирус получил из-за внешнего сходства с колесом (ободом со спицами), которое на латинском языке звучит как «rota» 1 .
Как правило, ротавирусная инфекция протекает в форме острого гастроэнтерита 3,4 — воспаления слизистой оболочки желудка и тонкого кишечника. Заболевание сопровождается рвотой и диареей 3 . В 60–70% случаев эти симптомы появляются на фоне лихорадки, общего недомогания, ломоты в теле, насморка и дискомфорта в глотке — симптомов, напоминающих грипп 2,3 . Из-за этого ротавирусную инфекцию часто называют желудочным или кишечным гриппом 4 .
Где можно заразиться ротавирусом?
Ротавирусом может заразиться каждый вне зависимости от пола и возраста. Однако дети в возрасте от 6 месяцев до 2 лет болеют чаще взрослых 3 . Источником ротавируса являются люди — больные с симптомами инфекции или здоровые вирусоносители 2,3,4 , у которых обычно отсутствуют какие-либо жалобы 5 .
Больные люди и здоровые вирусоносители выделяют вирусы в окружающую среду вместе с калом 3,4 . Дальше возбудители попадают в воду, на предметы обихода, руки и одежду и через них передаются другим людям 4 . Это значит, что ротавирус передается детям при нарушении правил гигиены 4 , купании в водоемах 3 или употреблении загрязненной воды 4 и пищи 3 . Не исключен и воздушно-капельный механизм передачи ротавирусной инфекции 3,4 .
Не все дети одинаково восприимчивы к ротавирусной инфекции 3 . Чаще ротавирусом заражаются дети:
- в возрасте 6-18 месяцев 3 ;
- находящиеся на искусственном вскармливании 6 ;
- имеющие сопутствующие заболевания 6 ;
- с ослабленным иммунитетом 6 .
Симптомы ротавируса у детей
Инкубационный период — время от момента заражения до появление первых симптомов ротавирусной инфекции — у детей в среднем составляет 1–2 дня. В целом первые признаки могут проявиться чуть раньше или позже — через 12 часов или до 3-5 дней после попадания ротавируса в организм ребенка 7 .
Острое начало заболевания бывает в 9 из 10 случаев: основные симптомы появляются буквально сразу — в первый день 3,7 . При подостром течении вначале появляется 1-2 симптома, обычно боль в животе, а остальные только на 2-3 день 3,7 .
К признакам ротавирусной инфекции относятся 3,6,7 :
- Лихорадка. Температура тела часто может колебаться в пределах 38-39,8°С 2 , лихорадка обычно держится до 2–4 дней 6 . Ей сопутствуют слабость, вялость, головная боль, ухудшение аппетита 3 .
- Рвота. Зачастую многократная рвота возникает на фоне лихорадки и при нетяжелом течении длится 1-2 дня 7 .
- Диарея. Стул становится частым, 4–5 раз в сутки. Каловые массы жидкие, водянистые, с небольшой примесью прозрачной слизи 7 .
- Боль в животе. Разлитая боль в верхней части живота появляется практически в самом начале болезни. Зачастую она носит схваткообразный характер и предшествует отхождению газов и дефекации 3,7 .
- Гриппоподобные симптомы. У ребенка наблюдаются признаки поражения дыхательных путей — заложенность носа, насморк, покашливание 3,7 .
 Они могут возникать как на фоне кишечного расстройства, так и предшествовать рвоте и диарее 7 .
Они могут возникать как на фоне кишечного расстройства, так и предшествовать рвоте и диарее 7 .
С рвотными массами и жидким стулом организм теряет большое количество жидкости. Если потерянный объем не компенсируется, развивается обезвоживание 3,6,7 . Именно оно определяет тяжесть течения кишечной инфекции, вызванной ротавирусом 7 .
Как лечить ротавирусную инфекцию у ребенка
Любое подозрение на кишечную инфекцию у ребенка является поводом для обращения к врачу педиатру или инфекционисту. После осмотра доктор назначает необходимые анализы и терапию.
В легких случаях лечить ротавирусную инфекцию у ребенка можно дома 1 . Если соблюдать рекомендации, данные врачом, выздоровление наступает на 4-5 день заболевания 6 .
При среднетяжелом и тяжелом течении болезни (высокой температуре, вялости и ухудшении состояния малыша, многократной рвоте, водянистом стуле более 8 раз в день) 6 , а также появлении крови в кале 1 необходима госпитализация 1 .
Лечение ротавирусной инфекции включает 3 :
- Регидратацию.
 При вирусной кишечной инфекции организм ребенка теряет большое количество воды и солей 3 . Чтобы восстановить и поддержать водно-солевой баланс, педиатр назначает специальные растворы 3 . Все рекомендации, как и чем выпаивать малыша, родителям дает лечащий врач.
При вирусной кишечной инфекции организм ребенка теряет большое количество воды и солей 3 . Чтобы восстановить и поддержать водно-солевой баланс, педиатр назначает специальные растворы 3 . Все рекомендации, как и чем выпаивать малыша, родителям дает лечащий врач. - Диетотерапию. При легком течении заболевания голодать более 4 часов не рекомендуется 1 . Ребенок должен, как и прежде, получать пищу в соответствии со своим возрастом 1 . При выраженном обезвоживании, в первые 2-4 часа, пока проводится регидратация, питание временно прекращается, а затем возобновляется в щадящем режиме 1 .
- Медикаментозную терапию. Лекарства для лечения ротавирусной инфекции должен подбирать врач с учетом возраста малыша, симптомов и тяжести течения заболевания.
Специалист может назначить:
- энтеросорбенты 3 , связывающие и выводящие из организма вирусы и токсины, образующиеся в результате их жизнедеятельности и нарушения пищеварения 7 ;
- пробиотики 3 , содержащие живые микроорганизмы, полезные для организма 1 ;
- противовирусные препараты 3 , действующие на возбудителя заболевания;
- иммуномодулирующие препараты 3 , стимулирующие защитные силы организма в борьбе с инфекцией 3 .

В составе комплексной терапии ротавирусной инфекции у детей от 6 месяцев до 18 лет может быть использован Анаферон® детский в виде таблеток для рассасывания 8 . Анаферон® детский обладает противовирусной и иммуностимулирующей активностью 8,9 . Благодаря содержанию антител к гамма интерферону человека препарат снижает концентрацию вирусов в пораженных тканях, активизирует иммунные клетки, повышает выработку антител 8 .
Также в лечении ротавирусных гастроэнетритов врачами могут назначаться ферментные препараты, облегчающие пищеварение 7 .
Восстановление после ротавируса
Дети, столкнувшиеся с ротавирусной инфекцией, нуждаются в особом уходе и питании. Поврежденный вирусами кишечник не может в полной мере выполнять свои функции 3 . Поэтому питание должно быть щадящим 10 :
- младенцев продолжают кормить грудным молоком 1,10 не менее 6 раз в день, в первое время уменьшая объем пищи (время кормления) на 30–50% 1,10 .
- детей на искусственном вскармливании вначале переводят на низко- и безлактозные заменители грудного молока 3,10 , затем, когда состояние улучшится, в питание вводят лактозосодержащие продукты 1,10 .

- дети постарше получают привычные напитки и продукты 2 , за исключением тех, которые усиливают брожение, стимулируют двигательную активность желудочно-кишечного тракта и секрецию пищеварительных соков 10 .
В период выздоровления может быть оправдано применение мультивитаминно-микроэлементных комплексов, восстанавливающих баланс необходимых организму веществ, таких как фолаты, витамин А, медь, цинк, магний 1 .
Профилактика ротавируса у детей
При столкновении с ротавирусом максимальный уровень иммунной защиты развивается не сразу. Чтобы сформировался постинфекционный иммунитет нужны 3 последовательные «встречи» с ротавирусом, причем между эпизодами болезни не должно быть длительных интервалов 3 . Дело в том, что ротавирусы — неоднородная группа 2 и существуют разные штаммы (подвиды) возбудителя, которые и могут вызвать повторные заражения 3 .
В защите от последующих заражений ротавирусом особую роль играет иммунитет 3 . Поэтому у детей с ослабленным иммунитетом нужно принимать дополнительные меры профилактики 3,6 .
Ротавирус может сохраняться на предметах от 10 дней до месяца, в водопроводной воде — в течение 2 месяцев и не погибает даже при многократном замораживании 11 . Поэтому, чтобы уменьшить риск заражения, нужно строго соблюдать следующие санитарно-гигиенические правила:
- избегать контакта с больными с желудочно-кишечными симптомами 11 ;
- чаще и не менее минуты мыть руки с мылом и обрабатывать их спиртосодержащим кожным антисептиком 11 ;
- тщательно мыть и обдавать кипятком овощи и фрукты — на них ротавирус может сохраняться до 10 дней 11 ;
- детские соски, пустышки, бутылочки и другую посуду кипятить или дезинфицировать в горячей воде, игрушки обрабатывать паром (возбудитель погибает при температуре 70°С в течение 10 минут, а при 80°С — в течение 1 минуты) 11 .
Для специфической профилактики ротавирусной инфекции у детей разработаны и используются специальные вакцины. Вакцинация от ротавируса включена в Национальный календарь профилактических прививок РФ и Календарь профилактических прививок по показаниям 3 .
Ротавирусная инфекция у детей – острое инфекционное заболевание, вызываемое патогенными ротавирусами и протекающее с преимущественным поражением желудочно-кишечного тракта. При ротавирусной инфекции у детей развивается острый гастроэнтерит с лихорадкой, тошнотой, рвотой, диареей и абдоминальными болями, сопровождающийся интоксикацией и респираторным синдромом. Диагноз ротавирусной инфекции у детей ставится на основании комплекса клинических и эпидемиологических данных и результатов лабораторных исследований. Лечение ротавирусной инфекции у детей включает регидратационную, дезинтоксикационную терапию, лечебную диету, прием спазмолитиков, ферментов, энтеросорбентов, пробиотиков, противовирусных и иммунотропных препаратов.
Общие сведения
Ротавирусная инфекция относится к группе вирусных диарей, встречающихся в любом возрастном периоде, но наиболее часто регистрируется у детей. Это распространенное заболевание в практике педиатров, детских гастроэнтерологов, детских инфекционистов. Естественная восприимчивость детей к ротавирусной инфекции очень высока. Практически все дети переболевают ротавирусной инфекцией (иногда неоднократно) в первые 5 лет жизни, причем 70–80% случаев заболевания приходится на детей в возрасте от 6 месяцев до 2 лет, особенно находящихся на искусственном вскармливании. Дети первых 3-х месяцев жизни болеют ротавирусной инфекцией относительно редко из-за наличия пассивного иммунитета, полученного трапсплацентарно или с грудным молоком, однако при его отсутствии могут заболевать и новорожденные. Повторные случаи ротавирусной инфекции у детей возможны спустя 6-12 месяцев после перенесенного заболевания при заражении другим сероваром ротавируса. Дети, переболевшие ротавирусной инфекцией, обычно легче переносят последующие случаи заболевания.
Естественная восприимчивость детей к ротавирусной инфекции очень высока. Практически все дети переболевают ротавирусной инфекцией (иногда неоднократно) в первые 5 лет жизни, причем 70–80% случаев заболевания приходится на детей в возрасте от 6 месяцев до 2 лет, особенно находящихся на искусственном вскармливании. Дети первых 3-х месяцев жизни болеют ротавирусной инфекцией относительно редко из-за наличия пассивного иммунитета, полученного трапсплацентарно или с грудным молоком, однако при его отсутствии могут заболевать и новорожденные. Повторные случаи ротавирусной инфекции у детей возможны спустя 6-12 месяцев после перенесенного заболевания при заражении другим сероваром ротавируса. Дети, переболевшие ротавирусной инфекцией, обычно легче переносят последующие случаи заболевания.
Причины ротавирусной инфекции у детей
Источником ротавирусной инфекции у детей является больной человек с манифестной или бессимптомной формой заболевания. Механизм передачи ротавирусной инфекции у детей — фекально-оральный, может осуществляться через пищевые продукты (чаще молочные), водопроводную воду, а также через бытовые контакты (грязные руки, загрязненные предметы обихода, игрушки, белье).
Наибольшее выделение вирусных частиц больным наблюдается в первые 3-5 суток заболевания. Ротавирусная инфекция у детей активизируется сезонно; подъем заболеваемости отмечается в зимне-весенний период, иногда возникают спорадические случаи. Нередко отмечаются групповые заболевания и массовые вспышки в детских коллективах (дошкольных и школьных учреждениях, стационарах).
Возбудителями ротавирусной инфекции у детей являются энтеротропные РНК-содержащие вирусы рода Rotavirus, включающие 7 серогрупп (большинство ротавирусов человека относятся к группе A). Ротавирусы высокоустойчивы во внешней среде, сохраняют многомесячную жизнеспособность при замораживании, но быстро погибают при кипячении. Ротавирусная инфекция вызывает повреждение и разрушение микроворсинок тонкой кишки, приводящее к вторичной дисахаридазной недостаточности, накоплению негидролизованных дисахаридов (лактозы), нарушению реабсорбции воды и электролитов, развитию у ребенка диарейного синдрома и дегидратации.
Снижение интерфероногенеза в острую фазу и в период реконвалесценции при ротавирусной инфекции у детей является одной из причин затяжного и хронического течения заболевания.
Симптомы ротавирусной инфекции у детей
Инкубационный период ротавирусной инфекции у детей может продолжаться от 12 часов до 1-5 суток. В клинической картине на первый план выходит поражение ЖКТ в форме острого гастроэнтерита и интоксикация; респираторный синдром может сопровождать или предшествовать основным расстройствам. Симптомы ротавирусной инфекции у детей характеризуются острым началом и развиваются в течение суток, иногда может иметь место продромальный период с незначительным изменением состояния. По тяжести течения ротавирусная инфекция разделяется на легкую, среднетяжелую и тяжелую формы. Могут иметь место атипичные стертые формы (как правило, у недоношенных и новорожденных детей), а также носительство ротавируса. Ротавирусная инфекция у детей имеет циклическое течение, тяжесть заболевания зависит от продолжительности и степени дегидратации (эксикоза I, II, III степени) и интоксикации.
В стадию выраженных клинических проявлений отмечается лихорадка (38,5-39ºC), тошнота, рвота повторного или многократного характера, диарея, абдоминальные боли, метеоризм, урчание по ходу кишечника. Для ротавирусной инфекции у детей характерен обильный, водянисто-пенистый стул желто-зеленого цвета, с резким запахом, без видимых патологических примесей, иногда со слизью. В зависимости от тяжести заболевания частота стула колеблется от 3 до 20 раз в сутки; диарея сохраняется до 3-7 дней.
Для ротавирусной инфекции у детей характерен обильный, водянисто-пенистый стул желто-зеленого цвета, с резким запахом, без видимых патологических примесей, иногда со слизью. В зависимости от тяжести заболевания частота стула колеблется от 3 до 20 раз в сутки; диарея сохраняется до 3-7 дней.
Интоксикационный синдром у детей при легком и среднетяжелом течении ротавирусной инфекции характеризуется резкой слабостью, бледностью кожных покровов, головной болью, в тяжелых случаях – адинамией, головокружением, обморочным состоянием, судорогами мышц конечностей; у детей первого года жизни отмечается падение массы тела, снижение тургора тканей.
Респираторными проявлениями ротавирусной инфекции у детей служат умеренная гиперемия и боль в горле, насморк, небольшой суховатый кашель, конъюнктивит. Выздоровление при ротавирусной инфекции у детей наступает обычно через 5-12 дней, при тяжелом течении — позднее.
Осложнениями ротавирусной инфекции у детей могут выступать циркуляторные расстройства, острая сердечно-сосудистая и почечная недостаточность, присоединение бактериальной инфекции, обострение имеющейся гастроэнтерологической патологии — хронического гастрита, энтероколита, дисбактериоза кишечника.
Диагностика
Диагноз ротавирусного гастроэнтерита у детей ставится на основании комплекса клинических и эпидемиологических данных, результатов лабораторных исследований (вирусологических, бактериологических, серологических, молекулярно-генетических).
Учитываются ведущий клинический синдром, сочетание и последовательность появления симптомов, локализация патологического процесса (гастрит, энтерит, колит и т. д.), возраст ребенка, наличие острой кишечной инфекции в его окружении, предполагаемый источник заражения, сезонность. Диагностика ротавирусной инфекции у детей облегчается при наличии семейного очага или эпидемической вспышки заболевания.
Подтверждением ротавирусной инфекции у детей является обнаружение вирусных частиц и антигенов, вирусной РНК и специфических антител в фекалиях, рвотных массах, сыворотке крови. Генетический материал ротавируса в фекалиях позволяют выявить ПЦР, метод точечной гибридизации, электрофорез РНК в ПААГ. Морфологическая идентификация ротавирусной инфекции у детей проводится с помощью электронной микроскопии, ИФА, РПГА, реакции диффузной преципитации, латекс-агглютинации, РИФ, выделения ротавируса в культуре клеток, радиоиммунного анализа (РИА). Определение специфических антител к ротавирусу в крови больного (методами твердофазной реакции коагглютинации, РТГА, РСК, РНВ) проводят с 5-го дня от начала заболевания.
Определение специфических антител к ротавирусу в крови больного (методами твердофазной реакции коагглютинации, РТГА, РСК, РНВ) проводят с 5-го дня от начала заболевания.
При ротавирусной инфекции у детей результаты бактериологического исследования кала на основные кишечные инфекции – отрицательные. Вспомогательное значение в постановке диагноза имеет микроскопическое исследование кала – копрограмма, общий анализ мочи и крови.
Дифференциальная диагностика ротавирусной инфекции у детей проводится с дизентерией, сальмонеллезом, эшерихиозом, легкими формами холеры, пищевым отравлением, вирусными диареями другой этиологии (энтеровирусными и др.). В сложных, сомнительных случаях может быть проведена ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки.
Лечение ротавирусной инфекции у детей
При ротавирусной инфекции у детей очень важны ранняя диагностика и своевременно начатое лечение. Дети с тяжелой и среднетяжелой формой ротавирусной инфекции подлежат госпитализации. Терапия заболевания является патогенетической и направлена на борьбу с дегидратацией, функциональными нарушениями со стороны сердечно-сосудистой и мочевыделительной систем, расстройствами пищеварения.
Терапия заболевания является патогенетической и направлена на борьбу с дегидратацией, функциональными нарушениями со стороны сердечно-сосудистой и мочевыделительной систем, расстройствами пищеварения.
При развитии обезвоживания проводят регидратационную терапию: при I-II степени эксикоза ограничиваются пероральным приемом регидрона, глюкосолана; при III степени эксикоза – парентерально применяются растворы трисоль, ацесоль; с целью дезинтоксикации и улучшения гемодинамики — гемодез, полиглюкин. В случае необходимости назначаются жаропонижающие и спазмолитические препараты.
При ротавирусной инфекции применяются энтеросорбенты (активированный уголь, комбинированные препараты), ферменты (панкреатин), пробиотики (лактобактерии, бифидобактерии), пребиотики (лактулоза). Показана лечебная щадящая диета, соответствующая тяжести течения заболевания и возрасту ребенка. В острый период из пищевого рациона исключаются молоко и молочные продукты, ограничивается пища, богатая углеводами.
Этиотропное лечение ротавирусной инфекции у детей может включать противовирусные и иммунотропные средства (умифеновир, иммуноглобулин, рекомбинантный интерферон альфа), помогающие сокращению сроков клинических проявлений заболевания.
Прогноз и профилактика ротавирусной инфекции у детей
Прогноз ротавирусной инфекции зависит от тяжести клинических проявлений: при легкой и среднетяжелой форме – исход практически всегда благоприятный; при резком и длительном обезвоживании из-за развития сердечно-сосудистой и почечной недостаточности возможен летальный исход, особенно у детей из групп риска (новорожденных, недоношенных, детей с гипотрофией).
В целях профилактики ротавирусной инфекции у детей необходимо соблюдение правил личной гигиены и питания, грудное вскармливание, раннее выявление больных и их своевременная изоляция, соблюдение санитарно-гигиенического режима в очаге заболевания (семье и детском учреждении). В качестве специфической профилактики ротавирусной инфекции у детей используется вакцинация живыми оральными вакцинами.
Из всех групп вирусов, способных вызывать диарею, в России наиболее распространена ротавирусная инфекция. Она имеет выраженную зимне-осеннюю сезонность. Иногда заболевание начинается как ОРВИ, а затем присоединяются симптомы диареи с частотой стула 4-15 раз в сутки
Количество просмотров: 1 833 772
Дата последнего обновления: 25.05.2022
Среднее время прочтения: 15 минут
В соответствии со сведениями, основанными на данных современной медицинской вирусологии, в природе существует несколько групп вирусов, которые способны вызвать понос у детей и взрослых. Типичными возбудителями вирусной диареи являются астровирусы, аденовирусы, калицивирусы, вирус Норфолк, Бреда и другие.
Особенности развития ротавирусной инфекции у детей и взрослых
Ротавирус, попадая в просвет тонкого кишечника, приводит к развитию ротавирусного энтерита. Данное заболевание, характеризующееся выраженной зимне-осенней сезонностью, как правило, протекает в 2 этапа: вначале появляются симптомы и признаки, схожие с ОРВИ, а затем к ним присоединяется диарея. Болезнь сопровождается сильной рвотой и иногда повышением температуры тела до +38…+39 °С, частота поноса достигает 4–15 раз в сутки. При массивном инфицировании и тяжелом течении заболевания возможно развитие осложнений, приводящих к нарушению водно-солевого баланса и обезвоживанию организма.
Болезнь сопровождается сильной рвотой и иногда повышением температуры тела до +38…+39 °С, частота поноса достигает 4–15 раз в сутки. При массивном инфицировании и тяжелом течении заболевания возможно развитие осложнений, приводящих к нарушению водно-солевого баланса и обезвоживанию организма.
В среднем продолжительность ротавирусной инфекции составляет 4–5 дней, в редких случаях полное восстановление наступает через 10–12 дней. У некоторых взрослых ротавирус вызывает необычайно выраженные болевые симптомы, из-за которых пациенты попадают в стационарное отделение с обобщенным диагнозом «синдром острого живота». В то же время в 30 % случаев заражения кишечная инфекция может протекать бессимптомно.
Так же как и любая диарея, вызванный вирусом понос требует проведения специализированного лечения, ключевым звеном которого является регидратационная терапия. Взрослым и детям старше 6 лет быстро устранить негативные кишечные симптомы может помочь современное средство от поноса ИМОДИУМ ® Экспресс. Этот препарат, оказывая избирательное действие на рецепторы мышечной оболочки кишечника, способствует нормализации перистальтических сокращений, замедлению передвижения кала, улучшению процессов всасывания жидкости и электролитов, а также увеличению тонуса анального сфинктера. Как следствие, за счет этого признаки кишечного расстройства могут стихнуть или полностью пройти в течение часа.
Этот препарат, оказывая избирательное действие на рецепторы мышечной оболочки кишечника, способствует нормализации перистальтических сокращений, замедлению передвижения кала, улучшению процессов всасывания жидкости и электролитов, а также увеличению тонуса анального сфинктера. Как следствие, за счет этого признаки кишечного расстройства могут стихнуть или полностью пройти в течение часа.
Инфекция имеет несколько других наименований:
- кишечный грипп,
- желудочный грипп,
- ротавирусный энтерит.
Вирус, который вызывает это заболевание, получил название «ротавирус» благодаря своему внешнему виду (в переводе с латинского rota означает «колесо»).
Инкубационный период
Длительность инкубационного периода (временного промежутка от заражения до появления первых признаков ротавируса) зависит от состояния иммунитета и количества проникших в кишечник вирусных частиц. В среднем он составляет 3–5 дней.
Заболевание длится неделю, у некоторых взрослых симптомы ротавируса не прекращаются в течение 10–12 дней. После выздоровления в организме человека вырабатывается специфический пожизненный иммунитет к инфекции, благодаря чему повторно заразиться данным типом вируса практически невозможно. Исключение составляют люди с изначально ослабленной иммунной системой.
После выздоровления в организме человека вырабатывается специфический пожизненный иммунитет к инфекции, благодаря чему повторно заразиться данным типом вируса практически невозможно. Исключение составляют люди с изначально ослабленной иммунной системой.
Заразный период начинается от возникновения первых признаков заболевания и длится до выздоровления. Все это время больной человек продолжает выделять вирусные частицы.
Как передается вирус
Основной путь передачи ротавирусной инфекции – фекально-оральный. Чаще всего он проникает в организм вместе с зараженными продуктами питания или сырой водой. Вирус хорошо переносит низкие температуры, на протяжении длительного периода времени может сохранять свою жизнеспособность в холодильнике.
Также возможно заражение воздушно-капельным путем. Как и классический, кишечный грипп сопровождается воспалением респираторного тракта. Во время чихания и кашля вирусные частицы вместе с мельчайшими капельками слизи распространяются по воздуху и заражают восприимчивых к заболеванию окружающих людей.
Где можно заразиться ротавирусом
Как правило, заражение происходит в местах большого скопления народа: в детских садах, школах, офисах, общественном транспорте и пр. Заболевание может проявляться единичными случаями или эпидемическими вспышками, чаще всего случающимися в холодное время года.
Источником распространения инфекции является больной манифестной формой кишечного гриппа (клинически выраженной болезни) или вирусоноситель. Заболевание передается только от человека к человеку.
Симптомы
Симптомы ротавирусной инфекции отличаются неспецифичностью. У пациентов развивается слабость, головная боль, тошнота, рвота, возможно повышение температуры тела. К респираторным признакам заболевания относят насморк, кашель, воспаление и покраснение горла. Проникая в пищеварительный тракт, вирус начинает быстрыми темпами размножаться, поражая преимущественно слизистую оболочку тонкого кишечника и оказывая негативное влияние на пищеварительную функцию.
Нарушая физиологические процессы переваривания пищи и приводя к развитию энтерита (воспаления кишечной стенки), вирус кишечного гриппа становится причиной острой интоксикации организма, вызывающей тошноту, рвоту и диарею. При этом в кровь вирусные частицы не проникают.
При этом в кровь вирусные частицы не проникают.
Как отличить ротавирус от отравления
Отравление, в отличие от ротавирусной инфекции, развивается внезапно и очень быстро. При этом схожие симптомы одновременно обычно появляются у всех людей, употреблявших в пищу одинаковые продукты. Ротавирус, являющийся сезонным заболеванием, помимо пищеварительного расстройства, сопровождается лихорадочным состоянием и респираторными признаками. Характерными отличиями данного заболевания являются серовато-желтый кал характерной глинистой консистенции и очень темная моча, иногда с примесями крови.
Ротавирус у детей
Симптомы у детей
У детей сразу же после окончания инкубационного (латентного) периода наблюдается острая клиническая картина заболевания. С первого дня повышается температура тела, появляется тошнота, рвота, жидкий стул. Понос при ротавирусе имеет свою специфичность: по мере развития воспаления каловые массы приобретают характерный желтовато-серый цвет и глиноподобную консистенцию. Появляются катаральные симптомы: насморк, першение и воспаление в горле. Возможен кашель. Ребенок становится вялым и капризным, отказывается от еды.
Появляются катаральные симптомы: насморк, першение и воспаление в горле. Возможен кашель. Ребенок становится вялым и капризным, отказывается от еды.
Ротавирусная инфекция может вызывать у детей развитие тошноты и рвоты не только после еды, но и на голодный желудок. В первом случае в рвотных массах обнаруживаются непереваренные кусочки пищи, во втором – прожилки слизи. Температура тела, поднимаясь до высоких отметок, как правило, остается на одном уровне до окончания болезни. В том случае, если маленький ребенок не может объяснить, что и где болит, родители должны обращать внимание на такие признаки, как беспокойство, плач, болезненное вздутие, сильное урчание в животе, сонливость. Возможна потеря массы тела.
По окончании болезни кал у детей еще некоторое время может иметь жидковатую консистенцию. В связи с тем, что симптомы ротавирусной инфекции весьма схожи с пищевым отравлением, а также с проявлениями сальмонеллеза и холеры, определить причину расстройства практически невозможно. При возникновении первых признаков заболевания необходимо вызвать врача или бригаду скорой помощи. До приезда медиков ребенку, во избежание смазывания клинической картины и затруднения диагностики, не рекомендуется давать спазмолитические и обезболивающие средства.
При возникновении первых признаков заболевания необходимо вызвать врача или бригаду скорой помощи. До приезда медиков ребенку, во избежание смазывания клинической картины и затруднения диагностики, не рекомендуется давать спазмолитические и обезболивающие средства.
Диета
В период данной вирусной инфекции особое значение приобретает сбалансированная диета и дробный режим питания. О ее составе более подробно рекомендуется консультироваться с лечащим врачом, так как могут быть индивидуальные корректировки. Обычно еду и напитки ребенку дают малыми порциями, выдерживая интервалы между приемами пищи. Часто при таком состоянии у детей нет аппетита. Если при развитии симптомов вирусной диареи ребенок отказывается от еды, ни в коем случае не следует его заставлять. Однако для восполнения водно-солевого баланса малыша желательно уговорить выпить нежирный куриный бульон, некрепкий несладкий чай, отвар шиповника или кисель.
Категорически не рекомендуется давать молочные продукты, являющиеся отличной питательной средой для вируса, сладости, сырые фрукты и овощи, консервы, жирные супы, концентрированные соки, макароны, черный хлеб и сдобу.
После того как ребенок проявит интерес к пище, его необходимо перевести на лечебную диету. Она обычно включает в себя:
- каши из манной крупы или рисовых хлопьев, сваренные на воде или овощном бульоне;
- пюре из отварной/пропаренной моркови;
- паровые омлеты;
- перетертый свежий творог;
- печеные яблоки;
- приготовленные на пару котлеты из нежирного рыбного или мясного филе.
Диета при ротавирусе у детей предусматривает строгое ограничение жиров, жареной пищи и углеводов.
Ротавирусная инфекция у взрослых
В связи с тем, что симптомы ротавируса у взрослых протекают менее выраженно, чем у детей, большинство пациентов переносит заболевание на ногах. Отсутствие тошноты, рвоты и катаральных признаков приводит к тому, что кишечное расстройство списывается на потребление несвежих продуктов. Однако бессимптомное течение болезни не отменяет того факта, что люди являются переносчиками и распространителями вируса. Поэтому наличие в семье или коллективе заболевшего нередко приводит к массовому заражению, от которого можно уберечься только при наличии специфического пожизненного иммунитета.
Диагностика
При проведении диагностики заболевания учитываются не только клинические симптомы заболевания, но и эпидемические предпосылки (его сезонность и тенденция к массовому распространению). К информативным методам, применяющимся для подтверждения диагноза, относят анализ на ротавирус (обнаружение в кале возбудителя методом электронной микроскопии), реакцию латекс-агглютинации и радиоиммунные тесты.
В связи со схожестью симптоматики ротавирусной инфекции с сальмонеллезом, дизентерией, холерой, эшерихиозом и иерсиниозом требуется проведение дифференциальной диагностики.
Для диагностики заболевания в домашних условиях существует специальный тест на ротавирус, позволяющий за 10 минут обнаружить в кале возбудителя.
Одностадийный иммунохроматический экспресс-тест, представленный в виде традиционной полоски, содержит специфические антитела, реагирующие на присутствие антигена ротавируса. Перед проведением анализа кал помещают в идущий в комплекте флакон с растворителем. После полного растворения образца в окошко теста наносится ровно 5 капель полученной жидкости. Через 10 минут производится учет результатов. В случае наличия в кале ротавируса в тестовой зоне появляется окрашенная в розовый цвет полоска. Однако важно понимать, что проведение теста не отменяет консультацию с врачом, поэтому для подтверждения диагноза необходимо обратиться к специалисту.
После полного растворения образца в окошко теста наносится ровно 5 капель полученной жидкости. Через 10 минут производится учет результатов. В случае наличия в кале ротавируса в тестовой зоне появляется окрашенная в розовый цвет полоска. Однако важно понимать, что проведение теста не отменяет консультацию с врачом, поэтому для подтверждения диагноза необходимо обратиться к специалисту.
Лечение
Отвечая на вопрос, чем лечить ротавирусную инфекцию, следует подчеркнуть, что в настоящее время не существует специфических методов лечения кишечного гриппа. В данной ситуации обычно применяется симптоматическая терапия, направленная на коррекцию водно-электролитных нарушений, прекращение рвоты и диареи, предотвращение развития обезвоживания организма. Для назначения лечения рекомендуется обратиться к врачу.
Чтобы избежать дегидратации при лечении ротавируса у взрослых и детей, для восстановления водно-солевого баланса могут рекомендовать прием регидрантов (лекарственных средств, содержащих в своем составе хлорид натрия). В особо тяжелых случаях проводится внутривенная регидратация.
В особо тяжелых случаях проводится внутривенная регидратация.
Пациентам старше 6 лет для нормализации перистальтики и секреторной функции кишечника и устранения симптомов диареи могут назначить ИМОДИУМ ® Экспресс. Антибиотики не принимаются, так как данная группа препаратов предназначена для лечения заболеваний бактериального происхождения. Кроме того, бесконтрольный прием противомикробных средств может стать причиной развития дисбактериоза кишечника.
Следует ли сбивать высокую температуру
Ротавирус не переносит воздействия высоких температур и теряет свою активность уже при +38 °С. Поэтому в процессе лечения не рекомендуется принимать жаропонижающие средства, если температура тела ниже +38,5 °С. Если столбик термометра пересекает отметку +38,5 °С, для устранения негативных симптомов врач может назначить различные жаропонижающие препараты.
Осложнения ротавирусной инфекции
Чаще всего кишечный грипп протекает без осложнений. Однако при лечении заболевания очень важно не допускать обезвоживания организма, а также следить, чтобы у маленьких детей температура тела не поднялась выше +39 °С – подобное состояние может привести к повреждению клеток организма.
Однако стоит обратить внимание: если не обращаться к врачу и не заниматься лечением вирусной инфекции с поносом, есть риск достигнуть сильного обезвоживания организма. В таком случае обильное питье не поможет, необходимо вводить жидкость внутривенно под присмотром специалистов. Сильное обезвоживание может привести даже к летальному исходу.
Профилактика
Одним из средств профилактики является вакцинация. Прививка от ротавируса (специфическая вакцина) представлена в виде бесцветной жидкости для орального применения, содержащей в своем составе ослабленный штамм вируса кишечного гриппа. Прививка помогает организму выработать устойчивость к ротавирусной инфекции.
Неспецифическая профилактика включает в себя строгое соблюдение правил личной гигиены, среди них – частое мытье рук, применение для питья только кипяченой чистой воды и другие. Также важно полноценное сбалансированное питание, способное обеспечить организм всеми необходимыми нутриентами и биологически активными веществами, поддерживающими и укрепляющими иммунитет.
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
«Имодиум противопоказан для применения у детей младше 6 лет».
Вирусная инфекция может быть причиной поноса!
* Среди средств на основе Лоперамида. По продажам в деньгах за февраль 2018 г. — январь 2019 г., по данным IQVIA (с англ. АйКЬЮВИА).
На период с ноября по апрель приходится около 95% случаев заболевания детей и взрослых ротавирусной инфекцией. Тяжелее всего ее переносят дети в возрасте до 5 лет. Их организм отличается низкой кислотностью вырабатываемого желудочного сока и отсутствием способности активно сопротивляться вирусным инфекциям. Свое название ротавирус получил за характерную форму вибриона, внешне напоминающего колесо с хорошо очерченным ободом (в переводе с латыни rota означает «колесо»).
Как отличить ротавирус?
За ротавирусной инфекцией закрепилось название «кишечный грипп». Объясняется это сходством ее симптомов с гриппом: оба начинаются остро, с резкого повышения температуры до 39°. Но не имеющая отношения к вирусам гриппа инфекция характеризуется еще и дисфункцией пищеварительной системы. Поэтому типичными симптомами ротавируса являются:
- диарея;
- тошнота и рвота;
- боли в области пупка и выше;
- характерное «урчание» в животе.
Заболевший малыш становится вялым, раздражительным и теряет интерес даже к любимой еде. Рвотой, поносом и повышенной температурой сопровождаются и другие болезни. Родителям необходимо запомнить, что следствием ротавирусной инфекции является особенно тяжело протекающая диарея — с поносом до 20 раз за сутки на протяжении 3–5 дней. Поначалу стул имеет кашицеобразный вид и желтоватый оттенок, но постепенно становится все более водянистым и обесцвечивается.
Как заражаются ротавирусом?
Возможности заразиться подвержены абсолютно все дети. На вероятность заражения не влияют ни уровень гигиены и тип поведения малыша, ни качество пищи и воды. Ротавирус чрезвычайно заразен, относится к категории «грязных рук» и передается орально–фекальным путем. Дети, как правило, заражаются от взрослых, которые обычно переносят болезнь в легкой форме, в большинстве случаев даже не обращая внимания на легкое, быстро проходящее расстройство стула. Малышам после полугода, активно ползающим по полу и хватающим все окружающие предметы руками, ничего не стоит подхватить инфекцию.
На вероятность заражения не влияют ни уровень гигиены и тип поведения малыша, ни качество пищи и воды. Ротавирус чрезвычайно заразен, относится к категории «грязных рук» и передается орально–фекальным путем. Дети, как правило, заражаются от взрослых, которые обычно переносят болезнь в легкой форме, в большинстве случаев даже не обращая внимания на легкое, быстро проходящее расстройство стула. Малышам после полугода, активно ползающим по полу и хватающим все окружающие предметы руками, ничего не стоит подхватить инфекцию.
Попав в организм, вирус поселяется в клетках слизистой оболочки тонкого кишечника и желудка, вызывая воспаление — энтерит, гастроэнтерит. Типичная симптоматика заболевания объясняется разрушением ворсинок эпителия и нарушением процессов выработки необходимых для переваривания пищи ферментов.
После выздоровления неприятных последствий ротавирус у детей не оставляет. Тем не менее для ослабленных малышей он может стать весьма опасным. Поэтому при первых же подозрениях на «кишечный грипп» ребенка следует показать хорошему платному врачу педиатру.
Чем опасна ротавирусная инфекция для детей в возрасте до 5 лет?
Инкубационный период ротавируса короток, он составляет всего 1–4 дня. Поэтому вирусы очень быстро разрушают нормальную работу кишечника, заставляя его выкачивать из организма малыша воду и микроэлементы — в частности, калий и магний, необходимые для нормальной работы сердца. Это приводит к быстрому нарастанию слабости.
Для выздоровления и ослабления симптомов интоксикации ребенок должен употреблять много жидкости и восполнять утраченные минеральные вещества. Но при этом пить приходится буквально по 50 мл, так как прием того же регидрона в больших объемах может спровоцировать рвоту. Значительно ухудшает состояние крохи и высокая температура.
Родителям необходимо срочно обратиться за квалифицированной врачебной помощью, если:
- рвоту не удалось остановить в течение суток;
- ребенка не удается выпаивать и у него нарастают признаки обезвоживания;
- в стуле появились сгустки слизи или кровь;
- начали проявляться симптомы бактериальной инфекции, поразившей ослабленный организм.
 Она может проявляться спутанностью речи, двоением в глазах, сыпью, болезненность икроножных мышц и пр.
Она может проявляться спутанностью речи, двоением в глазах, сыпью, болезненность икроножных мышц и пр.
При отсутствии адекватного лечения заболевание может привести к появлению обменных и сердечно–сосудистых нарушений.
Лечение ротавируса у детей
Специализированных фармпрепаратов для терапии ротавирусной инфекции не существует. Лечение должно быть направлено на компенсацию утрачиваемых организмом минеральных солей и жидкости, чтобы не пострадали сердечно–сосудистая и мочевыделительная система. Чтобы не рисковать здоровьем ребенка (особенно если заболел малыш до 2 лет), лучше всего вызвать врача на дом. Хороший педиатр подтвердит или опровергнет диагноз, даст адекватные рекомендации и будет контролировать состояние малыша, чтобы заболевание не повлекло нежелательных последствий.
Чем лечить ротавирус?
Голоданием, выпаиванием и абсорбентами.
- Кишечник и желудок нуждаются в пищевой паузе, которая должна продолжаться не менее 4–6 часов, а при тяжелом течении — до суток.
 Примерно на 3–4 сутки, при позитивной динамике, питание можно постепенно восстанавливать, не злоупотребляя углеводами и растительной клетчаткой. Даже когда дело идет на поправку, в течение 8–10 дней не нужно давать молоко (из-за временной лактозной недостаточности), сырые фрукты и овощи, картофель, сладости.
Примерно на 3–4 сутки, при позитивной динамике, питание можно постепенно восстанавливать, не злоупотребляя углеводами и растительной клетчаткой. Даже когда дело идет на поправку, в течение 8–10 дней не нужно давать молоко (из-за временной лактозной недостаточности), сырые фрукты и овощи, картофель, сладости. - При лечении ротавируса у детей до года кормить их грудным молоком или смесью нужно в обычном режиме, но порцию следует уменьшить наполовину.
- Во время пищевой паузы малыша нужно постоянно выпаивать солевыми растворами, чтобы избежать обезвоживания. Готовый раствор приобретается в аптеке, но его можно приготовить и в домашних условиях: на литр кипяченой воды — пол чайной ложки соли и 2 столовые ложки сахара. Поить можно еще и слабым чаем, морсом, компотом из сухофруктов.
- Разрешенными для детей сорбентами являются активированный уголь (1 грамм угля на 1 кг веса), смекта, энтеросгель.
Категорически запрещен самостоятельный прием антибиотиков. Они не только не рассчитаны на лечение вирусных инфекций, но еще и серьезно изменяют состав кишечной микрофлоры.
Сколько дней длится ротавирус?
У большинства малышей, при правильной терапии, рвота уходит уже через сутки, а боли в животике и понос сохраняются в течение 3–7 дней. Иммунная система организма, получающего поддержку, начинает вырабатывать иммуноглобулин А, помогающий бороться с вирусной инфекцией. Но даже на 12–15 день с момента начала болезни кишечник еще не очищается от вирусов. Поэтому ребенок, уже относительно хорошо себя чувствующий, продолжает оставаться опасным для окружающих примерно в течение 4 недель.
Чтобы не заболели другие члены семьи, необходимо соблюдать элементарные гигиенические нормы: мыть руки, кипятить детскую посуду и столовые приборы, не забывать о влажной уборке квартиры. По окончании болезни в организме сформируется определенное количество антител, которые помогут в следующий раз перенести ротавирус гораздо легче.
Прививка от ротавируса — эффективное средство профилактики
До начала массовой вакцинации от ротавируса количество летальных исходов среди заболевших детей младше 5 лет в мире доходило до 600 тыс. в год. Ситуацию значительно улучшила американская вакцина от ротавируса РотаТек. Эффективная и безопасная, в России она применяется только по желанию родителей, платно, но с 2020 года должна стать обязательной.
в год. Ситуацию значительно улучшила американская вакцина от ротавируса РотаТек. Эффективная и безопасная, в России она применяется только по желанию родителей, платно, но с 2020 года должна стать обязательной.
Смекта или энтеросгель от диареи. Смекта
Смекта относится к клинико-фармакологической группе противодиарейных средств с адсорбирующим лечебным действием. Применяется при развитии диареи различного генеза.
Состав и форма выпуска
Смекта (Smecta) – природный энтеросорбент, способствует быстрому выводу токсинов из организма, «работает» против вирусов, возбудителей и вредных веществ.
фармакологический эффект
Диосмектит – это аббревиатура диоктаэдрического смектита (МНН – международное родовое наименование). Это алюмосиликат (разновидность пористой глины), который добывают в месторождениях смектита. Действует как энтеросорбент.
Обладает следующими свойствами:
- стабилизирующее действие на слизистую оболочку органов пищеварения;
- образует химическую связь с белковыми соединениями пристеночного слоя слизи;
- влияет на количество вырабатываемой слизи и улучшает ее иммунологические свойства;
- поглощает вредоносные бактерии и вирусы, заполняющие просвет пищеварительного тракта.

В терапевтических дозах не влияет на перистальтику кишечника. Диосмектит является рентгенопрозрачным и не окрашивает стул. Алюминий в составе смекты не всасывается из желудочно-кишечного тракта, в том числе при заболеваниях желудочно-кишечного тракта, сопровождающихся симптомами и колонопатиями.
Особенность препарата – это возможность применения препарата даже у новорожденных. Компоненты порошка хорошо переносятся как взрослыми пациентами, так и малышами. Суспензия имеет приятный аромат и вкус.
Действующее вещество Смекты обладает легким отечным действием, при приеме в рекомендуемых дозах не изменяет физиологического времени прохождения пищи по кишечнику, не метаболизируется, выводится в неизмененном виде и не окрашивает кал. Препарат рентгенопрозрачный.
От чего помогает Смекта: основные показания
Смекта стимулирует выработку естественной слизи кишечником. Он защитит себя от пагубного воздействия болезнетворных организмов. Это большое преимущество перед другими препаратами этой серии. В комплексном лечении заболеваний органов пищеварения его назначают только благодаря этой способности стимулировать работу кишечника.
Это большое преимущество перед другими препаратами этой серии. В комплексном лечении заболеваний органов пищеварения его назначают только благодаря этой способности стимулировать работу кишечника.
Смекта помогает при таких состояниях:
- Диарея при нарушении диеты;
- Диарея при приеме лекарств, например антибиотиков;
- Пищевое отравление, например, при употреблении непривычной пищи;
- Боли в желудке, кишечнике;
- Изжога;
- , кишечник;
- Вздутие живота
- В Комплексная терапия при инфекционных заболеваниях;
| Рвота | Препарат принимают, если рвота вызвана отравлением, а не другими заболеваниями. Перед тем, как пить лекарство, нужно промыть желудок, тогда порошок будет воздействовать непосредственно на слизистую оболочку, это быстро приведет к желаемому положительному результату – выздоровлению. Если рвота прекращается, прием лекарства следует прекратить. |
| Диарея | Для избавления от симптомов диареи необходимо принимать по 3 пакетика средства в день (9 грамм). Разведите порошок перед приемом в 125 мл кипяченой воды. В готовой смеси не должно быть комочков. При лечении острой диареи врачи рекомендуют увеличить дозу до 6 пакетиков лекарства (18 грамм). Передозировка может привести не только к запорам. У человека может возникнуть аллергическая реакция. |
| Отравление | Смекта при отравлениях является эффективным препаратом, так как способна абсорбировать многочисленные токсические вещества в просвете желудка и кишечника, вызывая клинические проявления отравления. В результате сорбции в кишечнике токсины перестают всасываться в кровь, и симптомы интоксикации уменьшаются. При отравлении каким-либо веществом Смекту следует принимать по правилам лечения диареи. |
Инструкция по применению: способы применения и дозы
Как принимать Смекту: до или после еды? При симптоматическом лечении следует принимать сразу после еды. Во всех остальных случаях препарат следует принимать либо за 1 ч до, либо через 2 ч после еды.
Во всех остальных случаях препарат следует принимать либо за 1 ч до, либо через 2 ч после еды.
Новорожденные дети принимают Смекту с едой или питьем или, если возможно, между кормлениями.
Как разводить и принимать Смекту взрослым
Продолжительность лечения и дозировка Смекты абсолютно не зависит от веса и возраста больного. Важно только учитывать интенсивность интоксикации, тяжесть кишечной инфекции, отравления.
Дозировка Смекты варьируется:
- 1-2 пакетика на 1 прием;
- 1-6 пакетиков в день;
- от разовой дозы до 7 дней регулярного применения.
При острой диарее суточная доза Смекты для взрослых составляет 6 пакетиков.
Примечание: препарат обладает мощными адсорбирующими свойствами, его нельзя принимать одновременно с какими-либо другими лекарственными средствами, чтобы не снижать всасывание лекарственных веществ.
Способ приготовления лекарства следующий:
- Пакет с порошком вскрывается после взбалтывания содержимого.

- Порошок засыпают стаканом кипяченой теплой воды. Разводить смекту необходимо в теплой воде. Слишком горячая жидкость снижает активность действующего вещества, порошок может не раствориться на холоде.
- Раствор тщательно перемешивают и оставляют на несколько минут до полного растворения.
- При диарее, а также рвоте взрослым рекомендуется пить теплую суспензию единовременно 3-4 раза в день.
Инструкция по приему Смекты для детей
Врачи назначают Смекту не только взрослым, но и детям с грудного возраста. Детям разводят содержимое одной упаковки в 50 мл. теплая вода. Если ребенок не может выпить такое количество суспензии за один раз, то ее можно давать в несколько приемов, наблюдая при этом за состоянием малыша.
Препарат необходимо разводить непосредственно перед применением, разведенную смесь нельзя хранить длительное время, максимум 16 часов в холодильнике в закрытой таре.
Смекта в виде готовой суспензии хорошо воспринимается младенцами и детьми 1-2 лет, так как небольшая доза препарата легко проглатывается и имеет приятный вкус.
При острой диарее дозировка Смекты будет следующей:
- новорожденным и до года — по 2 пакетика препарата в сутки в течение трех дней, затем по 1 пакетику в сутки до полного выздоровления/нормализации стул;
- детей старше одного года — по 4 пакетика в сутки в течение первых трех дней болезни, затем по 2 пакетика в день до полного выздоровления.
Другие показания см. в таблице ниже:
Чаще всего назначают прием Смекты с медом во время еды. Малышам, находящимся на искусственном вскармливании, Смекту дают в виде готовой суспензии или разводят порошок в 50 мл. теплая кипяченая вода или детская смесь.
Противопоказания
Прием суспензии порошка Смекты противопоказан в ряде ситуаций, к которым относятся:
- Индивидуальная непереносимость любого из компонентов (активных или вспомогательных) препарата.
- Нарушение переваривания и всасывания углеводов в кишечнике (дефицит лактазы, непереносимость лактозы, глюкозо-галактозы).

- Непереносимость фруктозы.
- Кишечная непроходимость любой локализации.
Перед началом применения препарата важно убедиться в отсутствии противопоказаний.
Применение во время беременности и кормления грудью
одобрен для применения беременными и кормящими женщинами. Коррекции дозы и режима введения не требуется.
Побочное действие на организм
Смекта детям и взрослым назначается в соответствии с инструкцией по применению. Переносится хорошо, но иногда могут возникать побочные эффекты:
- запор, диарея, тошнота, рвота;
- аллергические реакции: кожная сыпь, зуд, анафилактические реакции, отек Квинке, ангионевротический отек;
- головокружение, головные боли;
- метеоризм кишечника;
- частые испражнения;
- проблемы с пищеварением;
- потемнение эмали зубов;
- боли в животе, ощущение тяжести в желудке.
По инструкции побочные эффекты быстро проходят, не нужно отменять препарат или назначать симптоматическую терапию.
особые указания
При воспалении слизистой оболочки пищевода смекту натощак не принимают — всегда после еды. Во всех остальных случаях лекарство принимают между приемами пищи, то есть не менее чем за 1-2 часа до еды или через 1 час после еды. Конечно, после смекты есть можно, но не сразу.
Диарея (особенно у детей) повышает риск электролитного дисбаланса и обезвоживания. Во избежание этого ребенку обычно назначают Регидрон и Смекту вместе. Вместо Регидрона можно использовать:
- Цитраглюкозолан,
- Дисоль,
- Трисоль,
- Реосолан,
- Гидровит.
Солевой раствор для пероральной регидратации помогает восполнить потери электролитов во время рвоты и диареи, содержащаяся в нем глюкоза улучшает всасывание соли, а цитраты помогают скорректировать баланс при метаболическом ацидозе.
Взрослым при необходимости назначают регидратационные средства.
Передозировка
Взаимодействие с другими лекарственными средствами
Препарат может снижать скорость и степень всасывания одновременно принимаемых лекарственных средств. Не рекомендуется принимать Смекту одновременно с другими препаратами.
Не рекомендуется принимать Смекту одновременно с другими препаратами.
Срок годности
- Срок годности порошка для приготовления суспензии Смекты 3 года.
- Хранить в оригинальной неповрежденной заводской упаковке, в сухом, защищенном от света месте, недоступном для детей, при температуре воздуха не выше +25°С.
Условия отпуска из аптек
Отпускается из аптеки без рецепта.
Аналоги
Синонимами Смекты являются следующие препараты:
- Диосмектит порошок для приготовления суспензии для приема внутрь;
- Неосмектин суспензия и порошок для приготовления раствора для приема внутрь.
Аналогами Смекты являются:
- неосмектин,
- Диосмектит,
- Энтеросорбент СУМС-1,
- Активированный уголь, 9 шт.0016
- энтерумин,
- микроцель,
- Энтеросгель,
- Энтеросорб,
- Лактофильтрум,
- Энтенин,
- Лигносорб,
- Энтероды,
- Полифепан,
- Фильтрум-СТИ.

Цены в аптеках
В среднем цена Смекты со вкусом ванили колеблется от 127 до 155 рублей, со вкусом апельсина — от 139 до 156 рублей (за упаковку из 10 пакетиков).
Достаточно молодая инфекция, обнаруженная менее полувека назад.
Это определенная группа вирусов, поражающих структуры кишечника человека. Характерными проявлениями такой инфекции являются признаки интоксикации, расстройства пищеварения и .
Патология встречается у разных больных, но все же чаще диагностируется у новорожденных и детей раннего возраста. ранний возраст. Довольно часто при больных назначают .
Лекарственные свойства
Препарат выпускается в виде прозрачной гелеобразной субстанции с мельчайшими комковатыми включениями.
Перед применением вещество разбавляют водой до образования суспензии. Если препарат изготовлен в виде пасты, то его уже не нужно разбавлять, он полностью готов к применению.
Препарат имеет ряд преимуществ:
- Во-первых, он содержит соединения кремния, обладающие прекрасными абсорбирующими свойствами.
 Кремниевая кислота нейтрализует токсины и болезнетворные микроорганизмы.
Кремниевая кислота нейтрализует токсины и болезнетворные микроорганизмы. - Во-вторых, Энтеросгель поглощает вредные компоненты и вместе с ними мягко выводится вместе с калом.
- Кроме того, препарат отличается особой избирательностью, не влияет на полезные микроэлементы, витамины и питательные вещества.
- Энтеросорбент быстро очищает структуры организма от токсических соединений, в результате чего состояние больного значительно улучшается.
Препарат стимулирует перистальтику кишечника и активирует иммунную защиту, нормализует белковый и жировой обмен, выводит билирубин и холестерин. Энтеросгель предотвращает образование других повреждений слизистых оболочек желудочно-кишечного тракта.
Препарат действует только местно и вообще не всасывается в кровь, а выводится естественным путем. Средство практически не имеет противопоказаний, поэтому его без опасений назначают грудничкам, кормящим и беременным пациенткам.
Действие препарата
Энтеросорбентные свойства препарата определяются структурными особенностями его активного компонента. Кремниевая кислота представляет собой пористую матрицу, активно поглощающую токсины среднего молекулярного размера.
Кремниевая кислота представляет собой пористую матрицу, активно поглощающую токсины среднего молекулярного размера.
Энтеросгель не взаимодействует с жидкостями, что обеспечивает отсутствие контакта со слизистыми оболочками, не травмирует и исключает всасывание через стенки кишечных структур.
При проникновении сорбента в структуры кишечника ребенка, больного компоненты препарата соединяются с вредными веществами, такими как токсины, вирусы или метаболиты и материальные продукты, выводя их из организма.
Уже через 8-12 часов в организме больного от препарата не остается и следа. При этом препарат никак не влияет на всасывание. витаминные компоненты, микроэлементы и не влияет на моторику кишечника.
Как принимать сорбент взрослым и детям?
Препарат ничем не пахнет, представляет собой желеобразное вещество, содержащее мелкие комочки.
При приеме у малышей часто возникают проблемы, лекарство неприятное, поэтому они отказываются от приема препарата, также имеет значение отсутствие аппетита.
В такой ситуации в качестве растворителя можно использовать домашний кисель или сок, сироп и другие напитки. Также хорош для растворения и рисовый отвар или куриный бульон.
Дозировки для разных категорий пациентов могут незначительно отличаться.
- Взрослым пациентам препарат следует принимать по одной-полторы столовые ложки трижды в день;
- Детям 5-14 лет показан прием по большой ложке также 3 раза в день;
- Детям до 5 лет показано пить по пол-ложки 3 раза в день;
- Детям грудного возраста показано пить по половине чайной ложки препарата.
Детям можно давать препарат, растворив его в грудном молоке. Если малыш отказывается принимать средство из ложечки, то можно пить его из шприца перед каждым прикладыванием к груди, это поможет предотвратить рвоту.
При восстановлении аппетита допускается растворение препарата в рисовом отваре или манке, фруктовом пюре или компоте. Главное, уменьшать объем каждой порции, чтобы избежать рвоты.
Сколько длится курс лечения?
Продолжительность приема Энтеросгеля не менее 14-21 дня.
При необходимости курс лечения продлевают или повторяют. После прекращения пить препарат нужно еще неделю, чтобы закрепить терапию.
Если течение очень тяжелое, то взрослым пациентам можно увеличить дозировку в два раза. Если вам необходимо параллельно принимать другие лекарства, то совмещать их с Энтеросгелем бессмысленно, так как сорбент нейтрализует их лечебное действие. Поэтому принимать их нужно в разное время.
Что лучше, Смекта или Энтеросгель от ротавируса?
Основным компонентом Энтеросгеля является кремнийорганическая кислота, а Смекта – природный алюмосиликат. Оба средства обладают сорбирующим действием, но действуют по-разному.
Энтеросгель включается в работу сразу после приема, в то время как Смекте необходимо определенное время для полноценной терапевтической активности.
Компоненты Смекты, проникая в отделы кишечника, начинают устанавливать связи со слизью, постепенно растворяясь в ней, только после этого начинается действие сорбента. Энтеросгель уже имеет усвояемую желеобразную форму, поэтому его всасывающие качества значительно выше, а действие практически мгновенное.
Энтеросгель уже имеет усвояемую желеобразную форму, поэтому его всасывающие качества значительно выше, а действие практически мгновенное.
Один грамм диосмектита способен поглощать 100 м 2 /г, а кремнийорганическая кислота поглощает до 150 м 2 /г токсинов и других вредных веществ. Поэтому Энтеросгель действует более эффективно и избирательно.
Добавки, которых нет в Энтеросгеле, также важны. Но Смекта дополнительно содержит ароматизаторы, сахарины, моногидрат декстрозы, что направлено на улучшение вкуса, но ограничивает применение продукта.
Диспепсические расстройства желудочно-кишечного тракта наиболее распространенное заболевание среди взрослых и детей. Их причин много. Среди них всевозможные отравления и воспалительные заболевания.
Возбудителями могут быть бактерии, различные микроорганизмы, вирусы или грибковые инфекции. Появившийся понос, рвота, боль и температура сильно ослабляют больного, а в ряде случаев приводят к обезвоживанию и даже смерти.
Безусловно, тяжелые диареи у взрослых, а также их появление в детском возрасте, особенно в грудном возрасте, требуют обязательной консультации специалистов. Только врач может оценить состояние пациента и назначить соответствующее лечение.
Только врач может оценить состояние пациента и назначить соответствующее лечение.
Сегодня для лечения диареи различного происхождения используется очень большое количество лекарственных средств, дающих положительный результат. Задача врача – подобрать препарат, который наносит наименьший вред здоровью пациента. Одним из таких препаратов является Энтерол.
Форма выпуска
Препарат производится французской фармацевтической промышленностью. Лекарство выпускается в форме:
- капсул по 10, 20, 30 или 50 штук в одной упаковке дозировкой 250м;
- порошок для приготовления раствора по 10 пакетиков в упаковке дозировкой 250 мг;
- порошок для приготовления суспензии от 2 до 20 пакетиков в упаковке дозировкой 100 мг
Применение препарата
Препарат включает Saccharomyces boulardii. Это живые организмы, высушенные методом быстрой заморозки и восстанавливающие свои первоначальные свойства при разбавлении водой.
В связи с тем, что Saccharomycetes boulardii устойчивы к антибиотикам и благотворно влияют на микрофлору кишечника, препарат рекомендуется для совместного с ними применения.
Энтерол — капсулы, инструкция по применению
Применение капсул предназначено для взрослых и детей старшего возраста. Детям раннего возраста разрешается открывать капсулы и пить находящийся там порошок, растворив его в жидкости.
Больным старше трех лет следует принимать по 1-2 капсулы дважды в день энтерола 250, инструкция по его применению определяет курс лечения в количестве от семи до десяти дней. Препарат детям от года до трех лет следует принимать по 1 капсуле 2 раза в день в течение 5 дней.
Лекарство принимают за час до еды. При лечении тяжелой диареи лучше сочетать применение препарата с приемом углеводно-электролитных растворов, например, таких препаратов, как регидрон, гастролит и др.
Из противопоказаний следует выделить:
- формирование фунгиемии у больных с ЦВ катетер, хотя это случается достаточно редко;
- индивидуальная непереносимость препарата.
Препарат с осторожностью назначают женщинам в положении и кормящим матерям. При отсутствии положительного эффекта от назначенного лечения в течение двух дней, а также в случае высокой температуры и появления слизи и крови в кале следует немедленно направить больного к врачу. Появление симптомов жажды и сухости во рту может свидетельствовать о низкой регидратации больного.
При отсутствии положительного эффекта от назначенного лечения в течение двух дней, а также в случае высокой температуры и появления слизи и крови в кале следует немедленно направить больного к врачу. Появление симптомов жажды и сухости во рту может свидетельствовать о низкой регидратации больного.
Случаев передозировки препарата не выявлено.
Препарат не следует применять одновременно с противогрибковыми препаратами, так как его эффективность снижается.
Необходимо хранить при плюсовой температуре 15 — 25 градусов. Срок действия определяется трехлетним периодом.
Порошки детские
Для детей раннего возраста применяют порошкообразные лекарственные средства, из которых готовят лекарственные растворы или суспензии. Детям до года дают по полпакетика энтерола 250 или по целому пакетику энтерола 100 два раза в день.
Порошок можно разводить в молоке или детском питании. Для прекращения диареи достаточно принимать препарат до 5 дней. При дисбактериозе срок удлиняется до десяти дней.
Детям старше года можно давать энтерол 250 за целый пакетик и энтерол 100 за два пакетика. Прием осуществляется два раза в день. Сроки лечения такие же, как и в грудном возрасте.
Энтерол или Энтерофурил, что лучше?
Вопрос о выборе препарата для лечения диареи может решить только врач. это различные наркотики. Если основным действующим веществом энтерола являются живые микроорганизмы, воздействие которых подавляет патогенные микробы и восстанавливает микрофлору кишечника, то энтерофурил оказывает иное действие. Содержит Нифуроксазид, обладающий выраженным противомикробным действием.
Препарат энтерофурил, хотя и присутствует на рынке достаточно давно, но не имеет достоверных доказательств своей эффективности в отношении инфекционной диареи. В некоторых странах энтерол для детей до двух лет применять не рекомендуется. В России не назначают детям до месяца и недоношенным детям, могут вызывать аллергические реакции.
В то же время данный препарат не оказывает негативного влияния на микрофлору кишечника, восстанавливает эубиоз кишечника, является профилактическим средством при развитии у больного суперинфекции. Кроме того, препарат положительно влияет на иммунитет пациента.
Кроме того, препарат положительно влияет на иммунитет пациента.
Препараты-аналоги
Если больному противопоказано лечение данным средством, по причинам непереносимости или заболевания центральным венозным катетером, то необходимо его заменить. Для этого существуют аналоги энтерола, обладающие аналогичными лечебными свойствами, но содержащие другие штаммы микроорганизмов. К ним относятся:
- Лактобактерин;
- Атоксил;
- Бифилиз;
- Бактиспорин;
- Полисорб;
- Пробифор
- Энтеросгель и др.
Аналоги Энтерола дешевле и доступнее оригинала.
Но они могут различаться по своей эффективности, а также оказывать различное воздействие на организм, включая аллергические реакции и индивидуальную непереносимость. По этой причине людям с тяжелыми заболеваниями и склонным к аллергии следует принимать их с осторожностью.
Лекарства от диареи для детей и взрослых
Не принимайте Лоперамид, Имодиум или Лопедиум при подозрении на инфекционную диарею: Задержка богатых вредными бактериями каловых масс в организме будет только способствовать обострению заболевания. Если диарея у взрослых или детей сопровождается лихорадкой, от применения Имодиума и других подобных препаратов лучше воздержаться, так как это средство от диареи и не более того. Это не вылечит раздраженный кишечник.
Если диарея у взрослых или детей сопровождается лихорадкой, от применения Имодиума и других подобных препаратов лучше воздержаться, так как это средство от диареи и не более того. Это не вылечит раздраженный кишечник.
Противопоказан при беременности и в период лактации и принимается только в очень тяжелых случаях, когда никакие другие методы не оказывают положительного действия. Риск для плода слишком высок, поэтому если раньше мать справлялась с диареей только с помощью Лопаремида, то в период вынашивания и вскармливания ребенку придется привыкать к другим, более безопасным лекарствам. Также не рекомендуется применение Имодиума и Лопедиума при повышенном газообразовании, отечности, острых формах заболеваний, сопровождающихся болью и лихорадкой, колите.
Если препараты вызвали побочные эффекты, то необходимо срочно промыть желудок, а затем полностью прекратить их прием.
3. Энтерофурил.
В отличие от других средств, применяемых для восстановления работы желудочно-кишечного тракта и устранения нарушений его функционирования, оказывает не только противодиарейное, но и антимикробное действие. Препарат нормализует моторику кишечника и оказывает обеззараживающее действие, подавляя активность возбудителей и устраняя основную причину появления жидкого стула. Препарат не оказывает системного действия, не адсорбируется в органах пищеварения, а значит дает небольшое количество побочных эффектов. Препарат активен только в кишечнике, поэтому не вызывает привыкания.
Препарат нормализует моторику кишечника и оказывает обеззараживающее действие, подавляя активность возбудителей и устраняя основную причину появления жидкого стула. Препарат не оказывает системного действия, не адсорбируется в органах пищеварения, а значит дает небольшое количество побочных эффектов. Препарат активен только в кишечнике, поэтому не вызывает привыкания.
Терапию диареи препаратом Энтерофурил можно проводить у детей и взрослых. Ребенок легко выпьет ложку специального сиропа, доза которого рассчитана специально для детского возраста, а взрослый пациент легко проглотит капсулу. После употребления возникает лечебный эффект, а затем переработанные организмом вещества выводятся с калом. Лекарство не следует принимать более недели в дозировке, указанной в инструкции.
Детская композиция предназначена для малышей от года. Лучше всего принимать через час после еды, соблюдая дозировку, указанную в инструкции. Взрослым желательно принимать по 2 таблетки по 200 мг каждые 6 часов, дозы для детей определяются в зависимости от их возраста.
Если по каким-то причинам Энтерофурил не подходит, то можно выбрать его аналог Стопдиар, который содержит то же лекарственное вещество, но выпускается в несколько иных формах: банановый сироп для детей до 6 лет и таблетки для взрослых. Обладает не менее выраженным эффектом, применяется вне зависимости от времени приема пищи. Препарат хорошо переносится, редко вызывает побочные эффекты, но его нельзя применять для лечения беременных и кормящих женщин, так как клинических исследований по этому поводу проведено недостаточно.
Если эффект от этих препаратов не проявляется в течение 3 дней, то необходимо обратиться к специалисту для установления причины возникновения заболевания и назначения курса антибиотиков.
4. Линекс.
При диарее страдает не только водно-солевой баланс, но и баланс полезной микрофлоры внутри толстого кишечника. Жидкий стул выводит нормальные микроорганизмы, лишая организм естественных защитных сил и важных компонентов пищеварения и всасывания, поэтому для возвращения необходимого функционирования желудочно-кишечного тракта требуется применение лекарственных средств от диареи, содержащих полезные бифидо- и лактобактерии и питательная среда для них.
К таким препаратам относится Линекс, это противодиарейное и противовоспалительное средство с большим спектром действия. Его положительный эффект построен на том, что плотная оболочка капсулы не растворяется в желудке, доставляя необходимые бактерии в кишечник в целости и сохранности. Микроорганизмы успешно приживаются в естественной среде и возобновляют работу полезной микрофлоры, которая побеждает патогенные воздействия и дальнейшие процессы отравления за счет всасывания вредных веществ ослабленным кишечником. Линекс положительно влияет на пищеварение, высвобождая энзимы и энзимы, способствуя выработке кислот.
Применяется при диарее, вызванной пищевыми отравлениями, после длительного приема антибиотиков, диарее, вызванной лечебными физиотерапевтическими процедурами (рентгенологическими исследованиями) и различных формах диареи, являющейся реакцией на стресс и неврозы. Врачи-специалисты включают его в список лекарственных средств, включаемых в лечение всех видов инфекционной диареи.
Линекс практически не вызывает побочных эффектов, особых правил нет, кроме одного: его нельзя употреблять с алкогольными напитками, так как этиловый спирт и его соединения уничтожают полезные бактерии. Разрешено применять грудным детям, беременным женщинам в любом триместре и кормящим, так как его компоненты не проникают в грудное молоко и плаценту. Но он противопоказан больным, страдающим тяжелыми хроническими заболеваниями (сахарный диабет, СПИД), а также людям, перенесшим трансплантацию органов. Лекарство с осторожностью применяют у новорожденных, желательно предварительно выяснить у педиатра, что послужило причиной поноса.
Линекс выпускается в форме капсул для взрослых и детей старше 2 лет. Для детей младшего возраста применяют порошки, расфасованные в пакетики, которые перед употреблением необходимо растворить в воде комнатной температуры. Капсулы необходимо запивать большим количеством воды или молока. При лечении диареи доза для взрослого и ребенка от 2 лет составляет по 2 капсулы 3 раза в сутки. Детям грудного возраста дают по 1 пакетику в день или, если в аптеке нет препарата в такой форме, то можно просто давать по 1 капсуле в день, предварительно разломив ее и растворив ее содержимое в 1 чайной ложке воды.
Детям грудного возраста дают по 1 пакетику в день или, если в аптеке нет препарата в такой форме, то можно просто давать по 1 капсуле в день, предварительно разломив ее и растворив ее содержимое в 1 чайной ложке воды.
В каких случаях следует обращаться к специалисту?
Существует ряд случаев, когда самолечение противопоказано и необходима консультация врача-специалиста:
1. Эффект от приема препаратов и сиропов не проявляется через 3 дня после начала медикаментозной терапии.
2. Поносом страдает ребенок до 1 года или, наоборот, пожилой человек.
3. Понос сопровождается лихорадкой, резкими болями в животе в области желудка или кишечника.
4. Стул дегтярного цвета.
5. Рвота «кофейной гущей».
6. Слабость, сухость во рту, бледность кожи, запавшие глаза. Это первые признаки обезвоживания.
Часто жидкий стул является не просто следствием небольшого пищевого отравления или переедания, но и симптомом более серьезного и трудноизлечимого заболевания, поэтому не стоит легкомысленно относиться к самолечению и подавлению болезни капсулами и таблетками.
Смекта при болях в желудке
- 1 Краткое описание
- 2 Состав
- 3 Воздействие на организм
- 4 Показания
- 5 Дозировка и введение препарата
- 6 рекомендаций
- 7 Смекта от боли при заболеваниях желудка и дисбактериозе
- 8 Особенности назначения детям
- 9 Беременность и лактация
- 10 Взаимодействие с алкоголем и наркотиками
- 11 Побочные эффекты, передозировка, противопоказания
- 12 направлений
- 13 Аналоги
Хотя бы раз в жизни боль в животе беспокоила каждого человека. Аптечные сети предлагают широкий ассортимент лекарств от болей в желудочно-кишечном тракте, одним из таких препаратов является «Смекта». Этот лекарственный препарат обладает способностью устранять боли при заболеваниях желудочно-кишечного тракта и лечить диарею.
Смекта — популярное средство от болей в желудке и диареи. с болью в желудке.
краткое описание
«Смекта» имеет форму выпуска в виде порошка, может быть с ванильным или апельсиновым вкусом. Это универсальное средство, применяемое при диарее и обладающее способностью восстанавливать микрофлору кишечника и его слизистую оболочку. «Смекта» способна выводить токсины из организма и оказывать адсорбирующее действие. Таким образом, препарат способен оказывать на организм человека следующее воздействие:
Это универсальное средство, применяемое при диарее и обладающее способностью восстанавливать микрофлору кишечника и его слизистую оболочку. «Смекта» способна выводить токсины из организма и оказывать адсорбирующее действие. Таким образом, препарат способен оказывать на организм человека следующее воздействие:
- выводит шлаки и токсины;
- предотвращает потерю электролитов;
- удаляет болезнетворные микробы;
- устраняет начальные признаки гастрита и язвы;
- снижает газообразование;
- улучшает работу кишечника;
- нормализует водный баланс.
Современный образ жизни имеет ряд недостатков: неправильное питание, малоподвижный образ жизни, злоупотребление алкоголем и другими веществами, вызывающими интоксикацию и засорение организма различными токсическими микроэлементами. В результате обостряются хронические заболевания, человек долго не выздоравливает, снижается иммунитет. Здесь помогут сорбенты.
Сорбенты: почему сложно выбрать?
Сорбенты – вещества, поглощающие газы, пары и другие подобные элементы вокруг себя.
Сорбенты назначаются для связывания и выведения вредных веществ из организма человека с целью его опьянения и очищения. Медицинские сорбенты применяются при лечении отравлений различной степени тяжести.
Типы сорбентов:
- Образуют раствор с поглощенным веществом.
- Загуститель на собственной поверхности.
- Вступление в химическую связь с веществом.
Для определенных целей сорбенты назначают в виде монопрепаратов для лечения конкретного недуга. В других вариантах сорбенты применяют для комбинированной терапии желудочно-кишечного тракта.
Очень распространенная профилактика атеросклероза, инфаркта, инсульта, которые часто приводят к преждевременной смерти.
Наиболее известными сорбентами на сегодняшний день являются: «Полисорб», «Смекта», «Полифепан», «Лактофильтрум» и другие.
Сложность выбора заключается в назначении каждого из этих препаратов при лечении конкретного недуга, а также в применении их как отдельного препарата или в составе комплексной терапии.
Полисорб: обзор препаратов
Полисорб – самый сильный сорбент на сегодняшний день . Его уникальность заключается в строении и механизме действия. Он состоит из очищенного от всех примесей диоксида кремния и в этом его главное преимущество перед другими сорбентами. Без добавок, без красителей. Силикагель — уникальный в своем роде полупроводник, элемент передовых инженерных технологий.
Этот важнейший элемент жизни присутствует в организме человека, но его очень мало. Его недостаток приводит ко многим заболеваниям – дисбактериозу, полиомиелиту, колитам, гастритам, язвам, остеохондрозу, ишиасу и др.
Диоксид кремния, входящий в состав препарата, является мощным катализатором окислительно-восстановительных процессов. Полисорб благотворно влияет на жировой, углеводный, белковый обмен. Он также отвечает за эластичность и прочность соединительных тканей. Улучшает общее состояние костей, ногтей, волос, делая их крепкими и здоровыми.
Полисорб обладает очищающими и интоксикационными свойствами. Лекарство в виде порошка. белого цвета, обогащенного кислородом. Благодаря этому Полисорб обладает мощным сорбирующим действием.
Лекарство в виде порошка. белого цвета, обогащенного кислородом. Благодаря этому Полисорб обладает мощным сорбирующим действием.
Полисорб принимают внутрь в виде водной суспензии. Для этого необходимое количество лекарства смешивают с четвертью стакана воды. Приготовленную смесь пить за час до еды.
Взрослым пациентам препарат назначают в дозе 0,1-0,2 г/кг массы тела 3 раза в сутки .
Какие болезни лечит?
- Острые отравления сильнодействующими и ядовитыми веществами, наркотиками, спиртосодержащими напитками.
- Острые кишечные инфекции различного генеза.
- Дисбактериоз.
- Вирусный гепатит и хроническая почечная недостаточность.
Противопоказания:
- Кровотечения в желудочно-кишечном тракте.
- Язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения.
- Индивидуальная непереносимость препарата.
Смекта: описание
Смекта представляет собой порошок для приема внутрь от светло-белого до серовато-белого оттенка. Имеет легкий запах ванили. 1 пакетик смектита содержит 3 грамма смектита диактоэдрического строения.
Имеет легкий запах ванили. 1 пакетик смектита содержит 3 грамма смектита диактоэдрического строения.
Это средство природного происхождения , благодаря которому выводит из организма болезнетворные бактерии, вирусы, токсины, кишечные газы, усиливает защитную функцию слизистой оболочки пищеварительного тракта, предохраняя ее от негативного воздействия соляной кислоты и других раздражителей .
Какие болезни лечит?
- Острая и хроническая диарея.
- Диарея инфекционного происхождения.
- Изжога.
- Вздутие живота.
Противопоказания:
- Чувствительность к отдельным компонентам препарата.
- Кишечная непроходимость.
Смекту пьют недельным курсом по 1 пакетику 3 раза в день. побочный эффект — запор.
Сравнение двух вариантов
Смекта и Полисорб – самые популярные препараты для очищения организма и выведения вредных веществ. Но возникает вопрос: какой из двух лучше?
- Оба относятся к группе сорбентов.
 Разница лишь в том, что в полисорбе действующим веществом является диоксид кремния, а в смекте – диоктаэдрический смектит. Первый вкуснее второго. Смекта может вызвать тошноту.
Разница лишь в том, что в полисорбе действующим веществом является диоксид кремния, а в смекте – диоктаэдрический смектит. Первый вкуснее второго. Смекта может вызвать тошноту. - Полисорб назначают при различных видах пищевой аллергии, пищевых отравлениях, кишечных инфекциях, диарее, выведении после алкогольной интоксикации, при рвоте и тошноте. Смекта применяется при диарее, вздутии живота, изжоге и является скорее частью комплексного лечения кишечных инфекций, чем отдельным монопрепаратом от подобных недугов.
- Побочные эффекты. Полисорб вызывает максимальный запор. От смекты могут возникнуть длительные запоры, кишечная непроходимость, аллергия и тошнота.
- Лекарства различаются по цене. Смекта стоит около 150 рублей, полисорб – от 40 рублей.
- Продолжительность приема. Полисорб принимают пять дней, иногда курс продлевают до двух недель. Смекту пьют от трех до пяти дней.
Часто для максимально быстрого эффекта многие принимают Энтеросгель и Смекту вместе. Однако целесообразно ли это и не навредит ли это желудку? Чтобы ответить на этот вопрос, необходимо проанализировать принцип действия обоих препаратов.
Однако целесообразно ли это и не навредит ли это желудку? Чтобы ответить на этот вопрос, необходимо проанализировать принцип действия обоих препаратов.
Несмотря на то, что оба препарата относятся к группе сорбентов, принцип действия у них несколько разный, это заметно и по их форме выпуска. Если Смекта представляет собой порошок, который перед применением растворяют в воде, то Энтеросгель выпускается в форме геля. Последний всасывается и действует гораздо быстрее Смекты, именно за счет гелеобразного состояния он быстрее и успешнее достигает кишечника.
Кроме того, спектр применения Энетросгеля шире, чем у Смекты. Именно эти два фактора позволяют сделать вывод, что прием обоих препаратов одновременно нецелесообразен, но вполне безопасен. Проще говоря, при одновременном приеме Энетросгель нейтрализует действие Смекты.
Энтеросгель и Смекта: как принимать вместе
Энтеросгель принимают при токсическом поражении печени, для улучшения работы почек, при гастрите, диарее и кожных заболеваниях. Он хорошо связывает вредные вещества и в кратчайшие сроки выводит их из организма. Препарат практически не имеет противопоказаний кроме кишечной непроходимости.
Он хорошо связывает вредные вещества и в кратчайшие сроки выводит их из организма. Препарат практически не имеет противопоказаний кроме кишечной непроходимости.
Спектр применения Смекты уже есть. Его назначают при изжоге, диарее любого характера, вздутии живота и дискомфорте в животе. Что касается противопоказаний, то они такие же, как у Энтеросгеля. Иногда после приема Энтеросгеля целесообразно принять пакетик Смекты, чтобы устранить дискомфорт в животе, особенно если после отравления появилось чувство вздутия живота, метеоризма и диареи. С такими проблемами лучше справится Смекта, но изначально гель лучше очистит организм.
Что будет, если выпить Энетросгель и Смекту вместе?
Препараты данного вида обладают дезинтоксикационной активностью, она показывает, сколько может поглотить 1 грамм сорбента. Если для Смекты это 100 м2/г, то для Энтросгеля в полтора раза выше. Это значит, что второй препарат начинает действовать быстрее, активнее и эффективнее.
Именно поэтому считается бессмысленным совмещать прием препаратов, один из которых более активен и сильнее, он устранит причину раньше, чем начнет действовать второй. При желании их можно принимать в комплексе во время лечения заболевания, но не одновременно.
Ротавирусная инфекция у взрослых — ПМК
1. Parashar UD, Bresee JS, Gentsch JR, Glass RI. Ротавирус. Эмердж Инфекция Дис. 1998; 4: 561–570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Капикян А.З., Вятт Р.Г., Долин Р., Торнхилл Т.С., Калица А.Р., Чанок Р.М. Визуализация с помощью иммунной электронной микроскопии 27-нм частицы, связанной с острым инфекционным небактериальным гастроэнтеритом. Дж Вирол. 1972; 10: 1075–1081. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Вирусные частицы в эпителиальных клетках слизистой оболочки двенадцатиперстной кишки у детей с острым небактериальным гастроэнтеритом. Ланцет. 1973;2:1281–1283. [PubMed] [Google Scholar]
4. Капикян А.З. Вирусный гастроэнтерит. ДЖАМА. 1993; 269: 627–630. [PubMed] [Google Scholar]
Капикян А.З. Вирусный гастроэнтерит. ДЖАМА. 1993; 269: 627–630. [PubMed] [Google Scholar]
5. Fankhauser RL, Noel JS, Monroe SS, Ando T, Glass RI. Молекулярная эпидемиология «норуолк-подобных вирусов» при вспышках гастроэнтерита в США. J заразить дис. 1998; 178:1571–1578. [PubMed] [Google Scholar]
6. Адамс В.Р., Крафт Л.М. Эпизоотическая диарея мышей-младенцев: идентификация этиологического агента. Наука. 1963;141:359–360. [PubMed] [Google Scholar]
7. Flewett TH, Bryden AS, Davies H. Связь между вирусами острого гастроэнтерита у детей и новорожденных телят. Ланцет. 1974; 2: 61–63. [PubMed] [Google Scholar]
8. Дессельбергер У. Ротавирусные инфекции: рекомендации по лечению и профилактике. Наркотики. 1999; 58: 447–452. [PubMed] [Google Scholar]
9. Эстес М.К. Ротавирусы и их репликация. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. 4-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия: 2001. стр. 1747–1785. [Академия Google]
10. Капикян А. З., Хосино Ю., Чанок Р.М. Ротавирусы. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. 4-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия: 2001. стр. 1787–1833. [Google Scholar]
З., Хосино Ю., Чанок Р.М. Ротавирусы. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. 4-е изд. Липпинкотт Уильямс и Уилкинс; Филадельфия: 2001. стр. 1787–1833. [Google Scholar]
11. Vollet JJ, 3rd, DuPont HL, Pickering LK. Некишечные источники ротавируса при острой диарее. J заразить дис. 1981; 144:495. [PubMed] [Google Scholar]
12. Zheng BJ, Chang RX, Ma GZ. Ротавирусная инфекция ротоглотки и дыхательных путей у детей раннего возраста. J Med Virol. 1991;34:29–37. [PubMed] [Google Scholar]
13. Холмс И.Х., Рак Б.Дж., Бишоп РФ, Дэвидсон Г.П. Вирусы детского энтерита: морфогенез и морфология. J Вирусология. 1975; 16: 937–943. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Лундгрен О., Свенссон Л. Патогенез ротавирусной диареи. микробы заражают. 2001;3:1145–1156. [ЧВК бесплатная статья] [PubMed] [Google Scholar]
15. Anon Ротавирусы человека и животных. Ланцет. 1975; 1: 257–259. [PubMed] [Академия Google]
16. Vollet JJ, Ericsson CD, Gibson G. Ротавирус человека у взрослого населения с диареей путешественников и его связь с местом потребления пищи. J Med Virol. 1979; 4: 81–87. [PubMed] [Google Scholar]
Ротавирус человека у взрослого населения с диареей путешественников и его связь с местом потребления пищи. J Med Virol. 1979; 4: 81–87. [PubMed] [Google Scholar]
17. Barnes GL, Callaghan SL, Kirkwood CD, Bogdanovic-Sakran N, Johnston LJ, Bishop RF. Выделение штаммов ротавируса серотипа Gl бессимптомным персоналом: возможный источник внутрибольничной инфекции. J Педиатр. 2003; 142: 722–725. [PubMed] [Google Scholar]
18. Барнс Г.Л., Таунли Р.Р. Поражение слизистой оболочки двенадцатиперстной кишки у 31 ребенка с гастроэнтеритом. Арч Дис Чайлд. 1973;48:343–349. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Davidson GP, Barnes GL. Структурно-функциональные нарушения тонкой кишки у детей грудного и раннего возраста при ротавирусном энтерите. Acta Pediatr Scand. 1979; 68: 181–186. [PubMed] [Google Scholar]
20. Лундгрен О., Перегрин А.Т., Перссон К., Кордасти С., Уноо И., Свенссон Л. Роль кишечной нервной системы в секреции жидкости и электролитов при ротавирусной диарее. Наука. 2000; 287:491–495. [PubMed] [Академия Google]
Наука. 2000; 287:491–495. [PubMed] [Академия Google]
21. Болл Дж.М., Тиан П., Цзэн К.К., Моррис А.П., Эстес М.К. Возрастная диарея, вызванная ротавирусным неструктурным гликопротеином. Наука. 1996; 272:101–104. [PubMed] [Google Scholar]
22. Horie Y, Nakagomi O, Koshimura Y. Индукция диареи ротавирусом NSP4 в гомологичной модельной системе мыши. Вирусология. 1999; 262: 398–407. [PubMed] [Google Scholar]
23. Halaihel N, Lievin V, Alvarado F, Vasseur M. Ротавирусная инфекция нарушает активность котранспорта Na(+)-растворенных веществ в кишечной мембране у молодых кроликов. Am J Physiol Gastrointest Liver Physiol. 2000;279:G587–G596. [PubMed] [Google Scholar]
24. Keljo DJ, MacLeod RJ, Perdue MH, Butler DG, Hamilton JR. Транспорт D-глюкозы в мембранах щеточной каемки тощей кишки поросят: выводы из модели заболевания. Am J Physiol. 1985; 249:G751–G760. [PubMed] [Google Scholar]
25. MacLeod RJ, Hamilton JR. Отсутствие цАМФ-опосредованного антиабсорбционного эффекта в недифференцированном эпителии тощей кишки. Am J Physiol. 1987; 252:G776–G782. [PubMed] [Google Scholar]
Am J Physiol. 1987; 252:G776–G782. [PubMed] [Google Scholar]
26. Дикман К.Г., Хемпсон С.Дж., Андерсон Дж. Ротавирус изменяет парацеллюлярную проницаемость и энергетический метаболизм в клетках Caco-2. Am J Physiol Gastrointest Liver Physiol. 2000;279:G757–G766. [PubMed] [Google Scholar]
27. Йохансен К., Стинцинг Г., Магнуссон К.Е. Проницаемость кишечника, оцененная с помощью полиэтиленгликолей у детей с диареей, вызванной ротавирусом и распространенными бактериальными патогенами в развивающемся сообществе. J Pediatr Gastroenterol Nutr. 1989; 9: 307–313. [PubMed] [Google Scholar]
28. Оберт Г., Пайффер И., Сервин А.Л. Вызванные ротавирусом структурные и функциональные изменения в плотных контактах монослоев поляризованных клеток Caco-2 кишечника. Дж Вирол. 2000;74:4645–4651. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Офф. Пенсильвания. Факторы хозяина, связанные с защитой от ротавирусной инфекции: небо проясняется. J заразить дис. 1996; 174:S59–S64. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
30. Бернштейн Д.И., МакНил М.М., Шифф Г.М., Уорд Р.Л. Индукция и персистенция местных антител к ротавирусу по отношению к сывороточным антителам. J Med Вирусология. 1989; 28: 90–95. [PubMed] [Google Scholar]
31. De Boissieu D, Lebon P, Badoual J, Bompard Y, Dupont C. Ротавирус вызывает выброс альфа-интерферона у детей с гастроэнтеритом. J Pediatr Gastroenterol Nutr. 1993;16:29–32. [PubMed] [Google Scholar]
32. Епископ РФ, Барнс Г.Л., Сиприани Э., Лунд Дж.С. Клинический иммунитет после неонатальной ротавирусной инфекции: проспективное продольное исследование у детей раннего возраста. N Engl J Med. 1983; 309: 72–76. [PubMed] [Google Scholar]
33. Velazquez FR, Matson DO, Calva JJ. Ротавирусные инфекции у детей раннего возраста как защита от последующих инфекций. N Engl J Med. 1996; 335:1022–1028. [PubMed] [Google Scholar]
34. Йолкен Р.Х., Вятт Р.Г., Зиссис Г. Эпидемиология ротавируса человека типов 1 и 2 по данным твердофазного иммуноферментного анализа. N Engl J Med. 1978;299:1156–1161. [PubMed] [Google Scholar]
N Engl J Med. 1978;299:1156–1161. [PubMed] [Google Scholar]
35. Капикян А.З., Вятт Р.Г., Левин М.М. Пероральное введение ротавируса человека добровольцам: индукция заболевания и корреляты резистентности. J заразить дис. 1983; 147: 95–106. [PubMed] [Google Scholar]
36. Jiang B, Gentsch JR, Glass RI. Роль сывороточных антител в защите от ротавирусной инфекции: обзор. Клин Инфекция Дис. 2002; 34: 1351–1361. [PubMed] [Google Scholar]
37. Коулсон Б.С., Гримвуд К., Хадсон И.Л., Барнс Г.Л., Бишоп РФ. Роль копроантител в клинической защите детей при реинфекции ротавирусом. Дж. Клин Микробиол. 1992;30:1678–1684. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Элиас М.М. Распределение и титры ротавирусных антител в разных возрастных группах. Дж Хиг. 1977; 79: 365–372. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Ward RL. Механизмы защиты от ротавируса у человека и мыши. J заразить дис. 1996; 174 (дополнение 1): S51–S58. [PubMed] [Google Scholar]
40. Chiba S, Yokoyama T, Nakata S. Защитный эффект естественно приобретенных гомотипических и гетеротипических антител против ротавируса. Ланцет. 1986;2:417–421. [PubMed] [Google Scholar]
Chiba S, Yokoyama T, Nakata S. Защитный эффект естественно приобретенных гомотипических и гетеротипических антител против ротавируса. Ланцет. 1986;2:417–421. [PubMed] [Google Scholar]
41. O’Ryan ML, Matson DO, Estes MK, Pickering LK. Типоспецифические и изотипоспецифические антитела к ротавирусу G у детей с природной ротавирусной инфекцией. J заразить дис. 1994; 169: 504–511. [PubMed] [Google Scholar]
42. Ward RL, Bernstein DI. Защита от ротавирусной инфекции после естественной ротавирусной инфекции: Группа эффективности ротавирусной вакцины США. J заразить дис. 1994; 169:900–904. [PubMed] [Google Scholar]
43. Мэтсон Д.О., О’Райан М.Л., Эррера И., Пикеринг Л.К., Эстес М.К. Реакция фекальных антител на симптоматическую и бессимптомную ротавирусную инфекцию. J заразить дис. 1993;167:577–583. [PubMed] [Google Scholar]
44. Веласкес Ф.Р., Мэтсон Д.О., Герреро М.Л. Сывороточные антитела как маркер защиты от природной ротавирусной инфекции и заболевания. J заразить дис. 2000; 182:1602–1609. [PubMed] [Google Scholar]
2000; 182:1602–1609. [PubMed] [Google Scholar]
45. Капикян А.З., Вятт Р.Г., Левин М.М. Исследования на добровольцах с ротавирусами человека. Стенд Дев Биол. 1983; 53: 209–218. [PubMed] [Google Scholar]
46. Уорд Р.Л., Бернштейн Д.И., Шукла Р. Влияние антител к ротавирусу на защиту взрослых, инфицированных ротавирусом человека. J заразить дис. 1989;159:79–88. [PubMed] [Google Scholar]
47. Уорд Р.Л., Бернштейн Д.И., Шукла Р. Защита взрослых, повторно инфицированных ротавирусом человека. J заразить дис. 1990; 161:440–445. [PubMed] [Google Scholar]
48. Ward RL, Bernstein DI, Young EC, Sherwood JR, Knowlton DR, Schiff GM. Исследования ротавируса человека на добровольцах: определение инфекционной дозы и серологического ответа на инфекцию. J заразить дис. 1986; 154: 871–880. [PubMed] [Google Scholar]
49. Грин К.Ю., Капикян А.З. Идентификация эпитопов VP7, связанных с защитой от ротавирусной болезни человека или выделения у добровольцев. Дж Вирол. 1992;66:548–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Грин К.Ю., Танигучи К., Маков Э.Р., Капикян А.З. Гомотипические и гетеротипические эпитоп-специфические антитела у взрослых и младенцев, вакцинированных против ротавируса: последствия для разработки вакцин. J заразить дис. 1990; 161: 667–679. [PubMed] [Google Scholar]
51. Шарма Р., Худак М.Л., Премачандра Б.Р. Клинические проявления ротавирусной инфекции в отделении реанимации новорожденных. Pediatr Infect Dis J. 2002; 21:1099–1105. [PubMed] [Академия Google]
52. Кроули Дж.М., Бишоп РФ, Барнс Г.Л. Ротавирусный гастроэнтерит у детей в возрасте 0–6 месяцев в Мельбурне, Австралия: последствия для вакцинации. J Педиатр Здоровье ребенка. 1993; 29: 219–221. [PubMed] [Google Scholar]
53. Grimwood K, Lund JC, Coulson BS, Hudson IL, Bishop RF, Barnes GL. Сравнение ответов антител сыворотки и слизистых оболочек после тяжелого острого ротавирусного гастроэнтерита у маленьких детей. Дж. Клин Микробиол. 1988; 26: 732–738.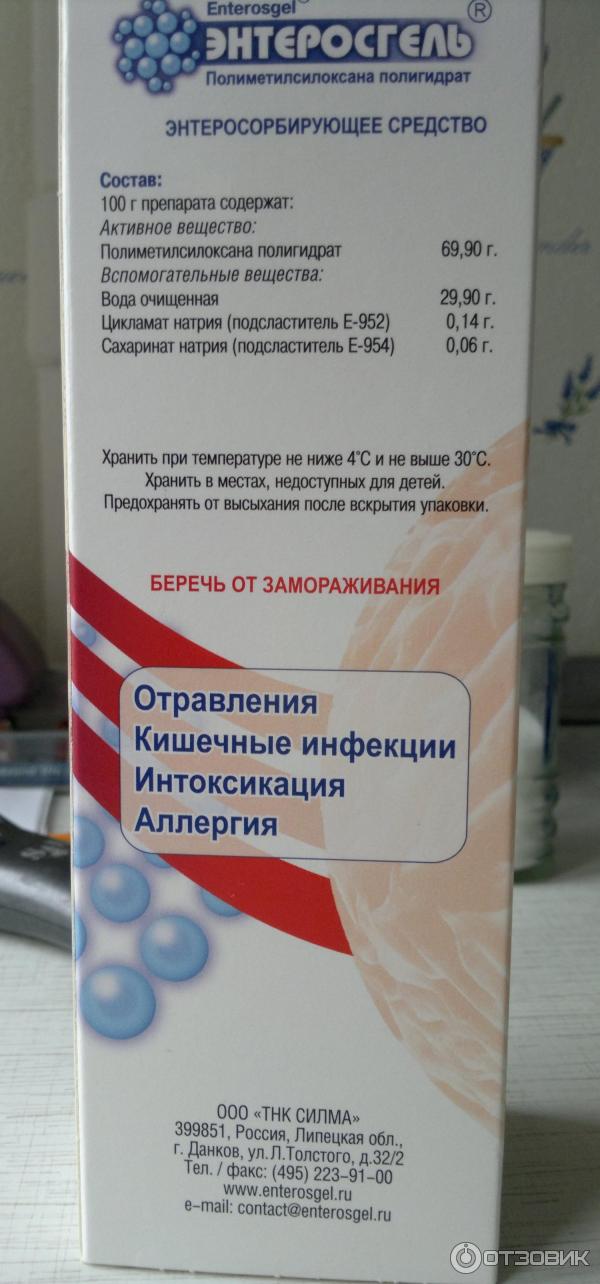 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Миддлтон П.Дж., Шимански М.Т., Эбботт Г.Д., Бортолусси Р. Орбивирусный острый гастроэнтерит младенчества. Ланцет. 1974; 1: 1241–1244. [Google Scholar]
55. Wenman WM, Hinde D, Feltham S, Gurwith M. Ротавирусная инфекция у взрослых. Результаты проспективного семейного исследования. N Engl J Med. 1979; 301: 303–306. [PubMed] [Google Scholar]
56. Капикян А.З., Ким Х.В., Вятт Р.Г. Реовирусоподобный агент человека как основной возбудитель, ассоциированный с «зимним» гастроэнтеритом у госпитализированных детей грудного и раннего возраста. N Engl J Med. 1976;294:965–972. [PubMed] [Google Scholar]
57. Grimwood K, Abbott GD, Fergusson DM, Jennings LC, Allan JM. Распространение ротавируса в семьях: исследование на базе сообщества. БМЖ. 1983; 287: 575–577. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Вспышка ротавирусного гастроэнтерита группы А пищевого происхождения среди студентов колледжей: округ Колумбия, март-апрель 2000 г. MMWR Morb Mortal Wkly Rep. 2000;49:1131–1133. [PubMed] [Google Scholar]
MMWR Morb Mortal Wkly Rep. 2000;49:1131–1133. [PubMed] [Google Scholar]
59. Saulsbury FT, Winkelstein JA, Yolken RH. Хроническая ротавирусная инфекция при иммунодефиците. J Педиатр. 1980;97:61–65. [PubMed] [Google Scholar]
60. Мори И., Мацумото К., Сугимото К. Длительное выделение ротавируса у гериатрического стационара. J Med Virol. 2002; 67: 613–615. [PubMed] [Google Scholar]
61. Gilger MA, Matson DO, Conner ME, Rosenblatt HM, Finegold MJ, Estes MK. Внекишечные ротавирусные инфекции у детей с иммунодефицитом. J Педиатр. 1992; 120:912–917. [PubMed] [Google Scholar]
62. Боливар Р. Ротавирусный скрининг у взрослых онкологических больных. Саут Мед Дж. 1983;76:418. [PubMed] [Google Scholar]
63. Yolken RH, Bishop CA, Townsend TR. Инфекционный гастроэнтерит у реципиентов костного мозга. N Engl J Med. 1982; 306:1010–1012. [PubMed] [Google Scholar]
64. Troussard X, Bauduer F, Gallet E. Восстановление вируса из стула пациентов, перенесших трансплантацию костного мозга. Пересадка костного мозга. 1993; 12: 573–576. [PubMed] [Google Scholar]
Пересадка костного мозга. 1993; 12: 573–576. [PubMed] [Google Scholar]
65. van Kraaij MG, Dekker AW, Verdonck LF. Инфекционный гастроэнтерит: редкая причина диареи у взрослых реципиентов аллогенной и аутологичной трансплантации стволовых клеток. Пересадка костного мозга. 2000;26:299–303. [Статья бесплатно PMC] [PubMed] [Google Scholar]
66. Albrecht H, Stellbrink HJ, Fenske S, Ermer M, Raedler A, Greten H. Обнаружение антигена ротавируса у пациентов с ВИЧ-инфекцией и диареей. Scand J Гастроэнтерол. 1993; 28: 307–310. [PubMed] [Google Scholar]
67. Thomas PD, Pollok RC, Gazzard BG. Кишечные вирусные инфекции как причина диареи при синдроме приобретенного иммунодефицита. ВИЧ мед. 1999; 1:19–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Hrdy DB. Эпидемиология ротавирусной инфекции у взрослых. Преподобный Заражает Дис. 1987;9:461–469. [PubMed] [Google Scholar]
69. Итурриза-Гомара М., Грин Дж., Браун Д.В., Рамзи М., Дессельбергер У., Грей Дж. Дж. Молекулярная эпидемиология ротавирусных инфекций группы А человека в Соединенном Королевстве в период с 1995 по 1998 год. J Clin Microbiol. 2000; 38: 4394–4401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Молекулярная эпидемиология ротавирусных инфекций группы А человека в Соединенном Королевстве в период с 1995 по 1998 год. J Clin Microbiol. 2000; 38: 4394–4401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Cox MJ, Medley GF. Серологическое исследование IgM против ротавируса группы А у взрослых в Великобритании. Эпидемиол инфекции. 2003; 131: 719–726. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Nakajima H, Nakagomi T, Kamisawa T. Зимняя сезонность и ротавирусная диарея у взрослых. Ланцет. 2001; 357:1950. [PubMed] [Google Scholar]
72. Джукс Дж., Ларсон Х.Е., Прайс А.Б., Сандерсон П.Дж., Дэвис Х.А. Этиология острой диареи у взрослых. Кишка. 1981; 22: 388–392. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Loosli J, Gyr K, Stalder H, Stalder GA. Этиология острой инфекционной диареи в высокоиндустриальном районе Швейцарии. Гастроэнтерология. 1985; 88: 75–79. [PubMed] [Google Scholar]
74. Свенунгссон Б., Лагергрен А., Эквалл Э. Энтеропатогены у взрослых пациентов с диареей и у здоровых контрольных субъектов: годичное проспективное исследование в шведской клинике инфекционных заболеваний. Клин Инфекция Дис. 2000; 30: 770–778. [PubMed] [Google Scholar]
Энтеропатогены у взрослых пациентов с диареей и у здоровых контрольных субъектов: годичное проспективное исследование в шведской клинике инфекционных заболеваний. Клин Инфекция Дис. 2000; 30: 770–778. [PubMed] [Google Scholar]
75. Echeverria P, Blacklow NR, Cukor GG, Vibulbandhitkit S, Changchawalit S, Boonthai P. Ротавирус как причина тяжелого гастроэнтерита у взрослых. Дж. Клин Микробиол. 1983; 18: 663–667. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. де Вит М.А., Купманс М.П., Кортбик Л.М., ван Леувен Н.Дж., Винье Дж., ван Дуйнховен Ю.Т. Этиология гастроэнтерита в дозорной общей практике в Нидерландах. Клин Инфекция Дис. 2001; 33: 280–288. [PubMed] [Google Scholar]
77. Купман Дж. С., Монто А. С. Исследование Текумсе. XV: Ротавирусная инфекция и патогенность. Am J Эпидемиол. 1989; 130: 750–759. [PubMed] [Google Scholar]
78. Pryor WM, Bye WA, Curran DH, Grohmann GS. Острая диарея у взрослых: проспективное исследование. Мед J Aust. 1987;147:490–493. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
79. Ойофо Б.А., Субекти Д., Тджаниади П. Энтеропатогены, связанные с острой диареей у пациентов в общинах и больницах в Джакарте, Индонезия. FEMS Immunol Med Microbiol. 2002; 34: 139–146. [PubMed] [Google Scholar]
80. дель Рефухио Гонсалес-Лоса М., Поланко-Марин Г.Г., Мансано-Кабрера Л., Пуэрто-Солис М. Острый гастроэнтерит, связанный с ротавирусом у взрослых. Арх Мед Рез. 2001; 32: 164–167. [PubMed] [Google Scholar]
81. Джеймс В.Л., Лэмбден П.Р., Кол Э.О., Кук С.Дж., Кларк И.Н. Сероэпидемиология ротавируса группы С человека в Великобритании. J Med Virol. 1997;52:86–91. [PubMed] [Google Scholar]
82. von Bonsdorff CH, Hovi T, Makela P, Morttinen A. Ротавирусные инфекции у взрослых в сочетании с острым гастроэнтеритом. J Med Virol. 1978; 2: 21–28. [PubMed] [Google Scholar]
83. Фостер С.О., Палмер Э.Л., Гэри Г.В., мл. Гастроэнтерит, вызванный ротавирусом, в изолированной группе тихоокеанских островов: эпидемия 3439 случаев. J заразить дис. 1980; 141:32–39. [PubMed] [Google Scholar]
J заразить дис. 1980; 141:32–39. [PubMed] [Google Scholar]
84. Meurman OH, Laine MJ. Эпидемия ротавирусной инфекции у взрослых. N Engl J Med. 1977;296:1298–1299. [PubMed] [Google Scholar]
85. Фридман М.Г., Галил А., Саров Б. Две последовательные вспышки ротавирусного гастроэнтерита: свидетельство симптоматической и бессимптомной реинфекции. J заразить дис. 1988; 158: 814–822. [PubMed] [Google Scholar]
86. Linhares AC, Pinheiro FP, Freitas RB, Gabbay YB, Shirley JA, Beards GM. Вспышка ротавирусной диареи среди неиммунных изолированных общин южноамериканских индейцев. Am J Эпидемиол. 1981; 113: 703–710. [PubMed] [Академия Google]
87. Marrie TJ, Lee SH, Faulkner RS, Ethier J, Young CH. Ротавирусная инфекция в гериатрической популяции. Arch Intern Med. 1982; 142: 313–316. [PubMed] [Google Scholar]
88. Cubitt WD, Holzel H. Вспышка ротавирусной инфекции в отделении длительного пребывания гериатрической больницы. Джей Клин Патол. 1980; 33: 306–308. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Dupuis P, Beby A, Bourgoin A, Lussier-Bonneau MD, Agius G. Эпидемия вирусного гастроэнтерита в пожилом сообществе. Пресс Мед. 1995;24:356–358. [PubMed] [Google Scholar]
90. Abbas AM, Denton MD. Вспышка ротавирусной инфекции в гериатрической больнице. Джей Хосп заражает. 1987; 9: 76–80. [PubMed] [Google Scholar]
91. Льюис Д.С., Лайтфут Н.Ф., Кубитт В.Д., Уилсон С.А. Вспышки астровируса типа 1 и ротавирусного гастроэнтерита в гериатрической стационарной популяции. Джей Хосп заражает. 1989; 14:9–14. [PubMed] [Google Scholar]
92. Halvorsrud J, Orstavik I. Эпидемия ротавирус-ассоциированного гастроэнтерита в доме престарелых. Scand J Infect Dis. 1980;12:161–164. [PubMed] [Google Scholar]
93. Ryan MJ, Wall PG, Adak GK, Evans HS, Cowden JM. Вспышки инфекционных кишечных заболеваний в интернатных учреждениях Англии и Уэльса в 1992–1994 гг. J заразить. 1997; 34:49–54. [PubMed] [Google Scholar]
94. Hopkins RS, Gaspard GB, Williams FP, Jr, Karlin RJ, Cukor G, Blacklow NR. Вспышка гастроэнтерита, передающегося через воду: свидетельство ротавируса как возбудителя. Am J Общественное здравоохранение. 1984; 74: 263–265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hopkins RS, Gaspard GB, Williams FP, Jr, Karlin RJ, Cukor G, Blacklow NR. Вспышка гастроэнтерита, передающегося через воду: свидетельство ротавируса как возбудителя. Am J Общественное здравоохранение. 1984; 74: 263–265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Гриффин Д.Д., Флетчер М., Леви М.Е. Вспышки гастроэнтерита взрослых связаны с одним генотипом ротавируса. J заразить дис. 2002; 185:1502–1505. [PubMed] [Google Scholar]
96. Fang ZY, Ye Q, Ho MS. Расследование вспышки ротавирусной диареи взрослых в Китае. J заразить дис. 1989; 160:948–953. [PubMed] [Google Scholar]
97. Кришнан Т., Сен А., Чоудхури Дж. С., Дас С., Найк Т. Н., Бхаттачарья С. К. Появление ротавируса диареи взрослых в Калькутте, Индия. Ланцет. 1999;353:380–381. [PubMed] [Google Scholar]
98. Steffen R, Collard F, Tornieporth N. Эпидемиология, этиология и последствия диареи путешественников на Ямайке. ДЖАМА. 1999; 281:811–817. [PubMed] [Google Scholar]
99. Боливар Р. , Конклин Р.Х., Воллет Дж.Дж. Ротавирус в диарее путешественников: исследование взрослой студенческой популяции в Мексике. J заразить дис. 1978; 137: 324–327. [PubMed] [Google Scholar]
, Конклин Р.Х., Воллет Дж.Дж. Ротавирус в диарее путешественников: исследование взрослой студенческой популяции в Мексике. J заразить дис. 1978; 137: 324–327. [PubMed] [Google Scholar]
100. Vollet JJ, Ericsson CD, Gibson G. Ротавирус человека у взрослого населения с диареей путешественников и его связь с местом потребления пищи. J Med Virol. 1979;4:81–87. [PubMed] [Google Scholar]
101. Keswick BH, Blacklow NR, Cukor GC, DuPont HL, Vollet JL. Норуолкский вирус и ротавирус при диарее путешественников в Мексике. Ланцет. 1982; 1: 109–110. [PubMed] [Google Scholar]
102. Ryder RW, Oquist CA, Greenberg H. Диарея путешественников у панамских туристов в Мексике. J заразить дис. 1981; 144: 442–448. [PubMed] [Google Scholar]
103. Шеридан Дж. Ф., Аврелиан Л., Барбур Г., Сантошам М., Сак Р. Б., Райдер Р. В. Диарея путешественников, ассоциированная с ротавирусной инфекцией: анализ классов вирусспецифических иммуноглобулинов. Заразить иммун. 1981;31:419–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Kim HW, Brandt CD, Kapikian AZ. Заражение человека реовирусоподобным агентом: встречаемость у взрослых, контактировавших с педиатрическими больными гастроэнтеритом. ДЖАМА. 1977; 238: 404–407. [PubMed] [Google Scholar]
Kim HW, Brandt CD, Kapikian AZ. Заражение человека реовирусоподобным агентом: встречаемость у взрослых, контактировавших с педиатрическими больными гастроэнтеритом. ДЖАМА. 1977; 238: 404–407. [PubMed] [Google Scholar]
105. Rodriguez WJ, Kim HW, Brandt CD. Распространенная вспышка гастроэнтерита, вызванного ротавирусом типа 2, с высокой частотой вторичных поражений в семьях. J заразить дис. 1979; 140: 353–357. [PubMed] [Академия Google]
106. von Bonsdorff CH, Hovi T, Makela P, Hovi T, Tevalvoto-Aarnio M. Ротавирус, связанный с острым гастроэнтеритом у взрослых. Ланцет. 1976; 2:423. [PubMed] [Google Scholar]
107. Орставик И., Хауг К.В., Совде А. Ротавирус-ассоциированный гастроэнтерит у двух взрослых, вероятно, вызванный реинфекцией вируса. Scand J Infect Dis. 1976; 8: 277–278. [PubMed] [Google Scholar]
108. Yolken RH, Wilde J. Анализы для обнаружения ротавируса человека. В: Капикян А.З., редактор. Вирусные инфекции желудочно-кишечного тракта, 2-е изд. М Деккер; Нью-Йорк: 1994. стр. 251–278. [Google Scholar]
М Деккер; Нью-Йорк: 1994. стр. 251–278. [Google Scholar]
109. Wilde J, Yolken R, Willoughby R, Eiden J. Улучшенное обнаружение выделения ротавируса с помощью полимеразной цепной реакции. Ланцет. 1991; 337: 323–326. [PubMed] [Google Scholar]
110. Рао Г.Г. Борьба со вспышками вирусной диареи в больницах: практический подход. Джей Хосп заражает. 1995; 30:1–6. [PubMed] [Google Scholar]
111. Ричардсон С., Гримвуд К., Горрелл Р., Паломбо Э., Барнс Г., Бишоп Р. Расширенное выделение ротавируса после тяжелой диареи у маленьких детей. Ланцет. 1998;351:1844–1848. [PubMed] [Google Scholar]
112. Guarino A, Canani RB, Spagnuolo MI, Albano F, Di Benedetto L. Пероральная бактериальная терапия сокращает продолжительность симптомов и выделение вируса у детей с легкой диареей. J Pediatr Gastroenterol Nutr. 1997; 25: 516–519. [PubMed] [Google Scholar]
113. Шорникова А.В., Касас И.А., Микканен Х., Сало Э., Весикари Т. Бактериотерапия Lactobacillus reuteri при ротавирусном гастроэнтерите. Pediatr Infect Dis J. 1997; 16:1103–1107. [PubMed] [Академия Google]
Pediatr Infect Dis J. 1997; 16:1103–1107. [PubMed] [Академия Google]
114. Desselberger U. Ротавирусные инфекции: рекомендации по лечению и профилактике. Наркотики. 1999; 58: 447–452. [PubMed] [Google Scholar]
115. Soriano-Brucher H, Avendano P, O’Ryan M. Субсалицилат висмута при лечении острой диареи у детей: клиническое исследование. Педиатрия. 1991; 87: 18–27. [PubMed] [Google Scholar]
116. Гуарино А., Канани Р.Б., Руссо С. Пероральные иммуноглобулины для лечения острого ротавирусного гастроэнтерита. Педиатрия. 1994; 93:12–16. [PubMed] [Академия Google]
117. Лосонский Г.А., Джонсон Дж.П., Винкельштейн Дж.А., Йолкен Р.Х. Пероральное введение иммуноглобулина сыворотки человека иммунодефицитным пациентам с вирусным гастроэнтеритом: фармакокинетический и функциональный анализ. Джей Клин Инвест. 1985; 76: 2362–2367. [Бесплатная статья PMC] [PubMed] [Google Scholar]
118. Kanfer EJ, Abrahamson G, Taylor J, Coleman JC, Samson DM. Тяжелая диарея, связанная с ротавирусом, после трансплантации костного мозга: лечение пероральным иммуноглобулином. Пересадка костного мозга. 1994;14:651–652. [PubMed] [Google Scholar]
Пересадка костного мозга. 1994;14:651–652. [PubMed] [Google Scholar]
119. Ансари С.А., Саттар С.А., Спрингторп В.С., Уэллс Г.А., Тостоварик В. Выживание ротавируса на руках человека и перенос инфекционного вируса на живые и непористые неживые поверхности. Дж. Клин Микробиол. 1988; 26: 1513–1518. [Бесплатная статья PMC] [PubMed] [Google Scholar]
120. Американская академия педиатрии. Ротавирусные инфекции. В: Пикеринг Л.К., редактор. 26-е изд. Том. 536. Американская академия педиатрии; Элк-Гроув-Виллидж, Иллинойс: 2003 г. (Красная книга: отчет Комитета по инфекционным заболеваниям за 2003 г.). [Академия Google]
121. Американская академия педиатрии. Инфекционный контроль госпитализированных детей. В: Пикеринг Л.К., редактор. 26-е изд. Том. 150. Американская академия педиатрии; Элк-Гроув-Виллидж, Иллинойс: 2003 г. (Красная книга: отчет Комитета по инфекционным заболеваниям за 2003 г.). [Google Scholar]
122. Sattar SA, Lloyd-Evans N, Springthorpe VS, Nair RC. Институциональные вспышки ротавирусной диареи: потенциальная роль фомитов и поверхностей окружающей среды как средств передачи вируса. Дж Хиг. 1986;96:277–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Институциональные вспышки ротавирусной диареи: потенциальная роль фомитов и поверхностей окружающей среды как средств передачи вируса. Дж Хиг. 1986;96:277–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
123. Ward RL, Bernstein DI, Knowlton DR. Профилактика передачи ротавирусов от поверхности к человеку путем обработки дезинфицирующим спреем. Дж. Клин Микробиол. 1991; 29:1991–1996. [Статья бесплатно PMC] [PubMed] [Google Scholar]
124. Joensuu J, Koskenniemi E, Pang XL, Vesikari T. Рандомизированное плацебо-контролируемое исследование резус-человеческой реассортантной ротавирусной вакцины для профилактики тяжелого ротавирусного гастроэнтерита. Ланцет. 1997;350:1205–1209. [PubMed] [Google Scholar]
125. Perez-Schael I, Guntinas MJ, Perez M. Эффективность четырехвалентной вакцины на основе ротавируса резуса у младенцев и детей младшего возраста в Венесуэле. N Engl J Med. 1997; 337:1181–1187. [PubMed] [Google Scholar]
126. Мерфи Б.Р., Моренс Д.М., Симонсен Л. , Чанок Р.М., Ла Монтань Дж.Р., Капикян А.З. Переоценка связи инвагинации кишечника с лицензированной живой ротавирусной вакциной ставит под сомнение первоначальные выводы. J заразить дис. 2003; 187:1301–1308. [PubMed] [Академия Google]
, Чанок Р.М., Ла Монтань Дж.Р., Капикян А.З. Переоценка связи инвагинации кишечника с лицензированной живой ротавирусной вакциной ставит под сомнение первоначальные выводы. J заразить дис. 2003; 187:1301–1308. [PubMed] [Академия Google]
127. Мерфи Т.В., Смит П.Дж., Гарджулло П.М., Шварц Б. Первая ротавирусная вакцина и инвагинация: эпидемиологические исследования и политические решения. J заразить дис. 2003; 187:1309–1313. [PubMed] [Google Scholar]
Лечение антибиотиками подавляет ротавирусную инфекцию и повышает специфический гуморальный иммунитет
- Список журналов
- J заразить Dis
- PMC4399425
J Заразить Dis. 2014 15 июля; 210(2): 171–182.
Опубликовано онлайн 2014 январь 16. DOI: 10.1093/infdis/jiu037
DOI: 10.1093/infdis/jiu037
, 1, 2 , 1 , 1 и 1, 2 и 1, 2 и 1, 2 и 1, 2 и 1, 2 и 1, 2 информация Отказ от ответственности
- Дополнительные материалы
Фон. Ротавирус вызывает 500 000 смертей и миллионы посещений врачей и госпитализаций в год с худшими исходами и снижением эффективности вакцин в развивающихся странах. Мы предположили, что микробиота кишечника может модулировать ротавирусную инфекцию и/или реакцию антител и, таким образом, потенциально играть роль в таких региональных различиях.
Методы. Микробиота была удалена с помощью безмикробных методов или подходов с применением антибиотиков. Повышенное воздействие на микробиоту было достигнуто за счет обработки низкими дозами декстрансульфата натрия (DSS). Ротавирусную инфекцию и репликацию оценивали с помощью твердофазного иммуноферментного анализа (ELISA) и количественной полимеразной цепной реакции с обратной транскрипцией. Диарею оценивали визуально. Гуморальный ответ на ротавирус измеряли с помощью ИФА и иммуноферментного анализа.
Ротавирусную инфекцию и репликацию оценивали с помощью твердофазного иммуноферментного анализа (ELISA) и количественной полимеразной цепной реакции с обратной транскрипцией. Диарею оценивали визуально. Гуморальный ответ на ротавирус измеряли с помощью ИФА и иммуноферментного анализа.
Результаты. Элиминация микробиоты задержала инфекцию и снизила инфекционность на 42%. Антибиотики не изменили соотношения положительно-смысловых и отрицательно-смысловых цепей, предполагая, что это повлияло на вход, а не на репликацию. Антибиотики снижали заболеваемость и продолжительность диареи, указывая на то, что снижение уровня ротавирусного антигена было биологически значимым. Несмотря на сниженный уровень антигена, антибиотики приводили к более стойкому слизисто-гуморальному ответу на ротавирус. Повышенная устойчивость ответа антител против ротавируса коррелирует с повышенной концентрацией клеток, секретирующих антитела, продуцирующие иммуноглобулин А, ротавируса тонкого кишечника, у мышей, получавших антибиотики. И наоборот, лечение DSS нарушало выработку специфических антител к ротавирусу.
И наоборот, лечение DSS нарушало выработку специфических антител к ротавирусу.
Выводы. Абляция микробиоты привела к уменьшению ротавирусной инфекции/диареи и более стойкому ответу антител против ротавируса, что свидетельствует о том, что введение антибиотиков перед вакцинацией против ротавируса может привести к низким показателям сероконверсии, которые коррелируют с неэффективностью вакцины в развивающихся регионах.
Ключевые слова: вакцина , микробиота, антибиотики, стерильность, иммунитет слизистых оболочек.0999
Ротавирус (РВ), двухцепочечный безоболочечный РНК-вирус, преимущественно поражающий эпителиальные клетки кишечника, является ведущей причиной острого гастроэнтерита у детей раннего возраста в мире [1]. До недавнего внедрения вакцин против RV, RV повсеместно заражал детей в возрасте до 5 лет. Большинство случаев разрешаются в течение 8 дней, хотя некоторые приводят к более тяжелым осложнениям, приводящим к 2–4 миллионам госпитализаций в год во всем мире [2, 3]. Однако бремя РВ наиболее велико в развивающихся странах, где РВ ежегодно вызывает 500 000 смертей [4, 5]. Обычно считается, что такое неравенство в бремени болезни РВ отражает общее состояние здоровья и состояние питания, доступ к поддерживающей терапии и/или потенциальные коинфекции [6].
Однако бремя РВ наиболее велико в развивающихся странах, где РВ ежегодно вызывает 500 000 смертей [4, 5]. Обычно считается, что такое неравенство в бремени болезни РВ отражает общее состояние здоровья и состояние питания, доступ к поддерживающей терапии и/или потенциальные коинфекции [6].
Широкое внедрение вакцин против RV значительно снизило бремя болезни RV в развивающихся странах. Например, в Малави, одной из наименее развитых стран мира, введение Rotarix снизило смертность, связанную с RV, на 43%. Тем не менее, эффективность вакцины в развивающихся странах заметно ниже, чем в Европе и Америке (49% в Малави против >95% в Европе и Америке) [2]. Большая часть этой разницы, по-видимому, связана с тем, что вакцины вызывали меньший иммунный ответ, поскольку в Малави после вакцинации Rotarix наблюдалось только 57% серопозитивности к анти-RV иммуноглобулину A (IgA), тогда как RotaTeq индуцировал 95% серопозитивных анти-RV IgA в Америке и Европе [7, 8].
Различные гипотезы могут объяснить, почему вакцины против RV менее иммуногенны в некоторых регионах. Недостаток правильного питания, который влияет на иммунный ответ, может быть причиной снижения эффективности вакцины. Кроме того, высокие титры материнских трансплацентарных антител и IgA грудного молока обладают потенциалом нейтрализации вакцинного штамма RV и могут снизить экспозицию антигена RV, предотвращая инфекционно-подобное состояние, связанное с вакциной RV. Чтобы преодолеть присутствие нейтрализующих антител, которые блокируют инфекционноподобное состояние и последующие защитные иммунные реакции, были предложены более высокие дозы РВ [9].]. Другая возможность заключается в том, что хроническая инфекция, например гельминтозы, подавляет иммунный ответ на вакцину против РВ [5, 10]. Более общая форма последней гипотезы заключается в том, что заражение или иммунный ответ на вакцины против RV находится под влиянием микробиоты кишечника, которая, как считается, значительно различается у людей в развитых и развивающихся странах. Действительно, микробиота оказывает широкое и разнообразное влияние на развитие и функционирование иммунной системы [11].
Недостаток правильного питания, который влияет на иммунный ответ, может быть причиной снижения эффективности вакцины. Кроме того, высокие титры материнских трансплацентарных антител и IgA грудного молока обладают потенциалом нейтрализации вакцинного штамма RV и могут снизить экспозицию антигена RV, предотвращая инфекционно-подобное состояние, связанное с вакциной RV. Чтобы преодолеть присутствие нейтрализующих антител, которые блокируют инфекционноподобное состояние и последующие защитные иммунные реакции, были предложены более высокие дозы РВ [9].]. Другая возможность заключается в том, что хроническая инфекция, например гельминтозы, подавляет иммунный ответ на вакцину против РВ [5, 10]. Более общая форма последней гипотезы заключается в том, что заражение или иммунный ответ на вакцины против RV находится под влиянием микробиоты кишечника, которая, как считается, значительно различается у людей в развитых и развивающихся странах. Действительно, микробиота оказывает широкое и разнообразное влияние на развитие и функционирование иммунной системы [11]. Например, в моделях гриппа и лимфоцитарного хориоменингита вирусспецифические адаптивные ответы, включая ответы как Т-клеток, так и В-клеток, уменьшались при лечении антибиотиками из-за снижения функции дендритных клеток и макрофагов [12, 13]. . В случае энтеровирусов, а именно полиовируса и реовируса, удаление микробиоты привело к относительной устойчивости к инфекции, что могло уменьшить выработку защитных иммунных ответов [14]. Такая способность микробиоты влиять как на вирусную инфекцию, что необходимо для иммунного ответа, так и на иммунный ответ позволяет предположить, что микробиота может опосредовать различия в тяжести заболевания РВ и/или эффективности вакцины.
Например, в моделях гриппа и лимфоцитарного хориоменингита вирусспецифические адаптивные ответы, включая ответы как Т-клеток, так и В-клеток, уменьшались при лечении антибиотиками из-за снижения функции дендритных клеток и макрофагов [12, 13]. . В случае энтеровирусов, а именно полиовируса и реовируса, удаление микробиоты привело к относительной устойчивости к инфекции, что могло уменьшить выработку защитных иммунных ответов [14]. Такая способность микробиоты влиять как на вирусную инфекцию, что необходимо для иммунного ответа, так и на иммунный ответ позволяет предположить, что микробиота может опосредовать различия в тяжести заболевания РВ и/или эффективности вакцины.
Наша цель состояла в том, чтобы исследовать возможность того, что микробиота может влиять на инфекцию и/или иммунный ответ на RV. Неонатальные мыши служили моделью РВ-заболевания, а взрослая модель РВ-инфекции считалась аналогом вакцинации против РВ, при этом защита от инфекции лучше всего коррелирует с уровнями анти-РВ IgA в кишечнике [1]. Наши результаты показывают, что комменсальная микробиота способствует заражению RV и влияет на иммунные реакции, вызванные RV.
Наши результаты показывают, что комменсальная микробиота способствует заражению RV и влияет на иммунные реакции, вызванные RV.
Животные
Во всех экспериментах, за исключением экспериментов с неонатальными или безмикробными мышами, использовались 6-8-недельные самцы мышей C57BL/6, приобретенные в Jackson Laboratories (Бар-Харбор, Мэн). В экспериментах с новорожденными мышами использовали 6-дневных потомков (самцов и самок) мышей C57BL/6J. В экспериментах с участием стерильных мышей использовали мышей C57BL/6, полученных путем переноса эмбрионов, как описано ранее [15]. Мышей содержали в стерильных изоляторах в Университете штата Джорджия, где были одобрены все процедуры.
Вирусы и прививки
Штамм EC мышей RV был предоставлен Mary Estes (Медицинский колледж Бейлора). Взрослые мыши получали 10 5 50% выделенных доз (SD 50 ) RV, которым предшествовал 1,33% (масса/объем) бикарбонат натрия (Sigma-Aldrich) через пероральный желудочный зонд. Новорожденные получали 2 50% диарейных дозы RV через желудочный зонд.
Новорожденные получали 2 50% диарейных дозы RV через желудочный зонд.
Антибиотики и схемы антибиотикотерапии
Взрослым мышам вводили ампициллин (Sigma-Aldrich) в дозе 1 г/л и неомицин (Sigma-Aldrich) в концентрации 0,5 г/л в питьевой воде без ограничений за 1 неделю до инокуляции и через 1, 7 или 11 недель после прививки. Новорожденные получали 200 мкг ампициллина и 100 мкг неомицина в 100 мкл воды перорально через желудочный зонд за 1 день до и 1 день после прививки. Кроме того, матери получали 1 г/л ампициллина и 0,5 г/л неомицина в питьевой воде, начиная с 1 недели до родов и продолжая до отнятия от груди потомства.
Заражение безмикробных мышей RV
Самцов и самок стерильных мышей в возрасте 6–8 недель инокулировали и содержали в гнотобиотических изоляторах (Park Bioservices) во время и до 9 недель после инокуляции. Безмикробный статус контролировали количественной полимеразной цепной реакцией (ПЦР) на 16S рибосомную ДНК (рДНК) и культуру фекалий в инфузионном бульоне мозга и сердца (BD).
Количественная оценка бактериальной нагрузки
ДНК фекальных бактерий выделяли с использованием набора QiAamp DNA Stool Kit (Qiagen) и 16S рДНК амплифицировали с помощью количественной ПЦР (Bio-Rad).
Определение фекального ротавирусного антигена
Супернатанты фекальных гомогенатов (100 мг/мл) замораживали или сразу же анализировали с помощью твердофазного иммуноферментного анализа (ИФА), как описано в другом месте [16].
Количественная ПЦР с обратной транскрипцией генома RV двенадцатиперстной кишки (qRT-PCR)
Образцы двенадцатиперстной кишки собирали, промывали в фосфатно-солевом буфере и гомогенизировали в TRIzol (Ambion). Дуоденальную РНК исследовали на наличие генома RV, как описано ранее [17].
Одноцепочечная qRT-PCR для репликации RV 9[17].
ИФА на антитела
Относительную продукцию и титр анти-РВ-антител в фекалиях и сыворотке анализировали, как описано ранее [18]. Уровни общего IgA измеряли, как описано в другом месте [19].
Тонкий кишечник, RV-специфический, IgA-продуцирующий, антитело-секретирующий клеточный иммуноферментный точечный анализ
Целый тонкий кишечник, собственную пластинку и клетки пейеровой бляшки собирали, как описано ранее [20]. Клетки наносили на фильтровальные пластины (Millipore), покрытые очищенным резус-РВ. RV-специфический IgA зондировали вторичным антителом против IgA (SouthernBiotech).
Введение декстрансульфата натрия (DSS)
DSS (MP Biomedicals) разбавляли в питьевой воде до 1% (масса/объем) и вводили по желанию за 4 дня до и через 3 дня после инокуляции RV.
Липокалин-2 ИФА
Супернатанты фекалий готовили, как указано выше, а липокалин-2 оценивали, как описано в другом месте [21].
Статистический анализ
Если не указано иное, данные взяты из одного эксперимента (n = 5 мышей в каждом состоянии), который был проведен несколько раз и дал аналогичные результаты. Статистическую значимость оценивали с помощью теста Стьюдента t .
Исчезновение микробиоты задерживает инфицирование вирусом RV и облегчает заболевание, вызванное вирусом RV
Инфицирование взрослых мышей RV не приводит к тяжелым проявлениям заболевания, но служит четко определенной моделью инфекции [1]. Соответственно, пероральная инокуляция 6–8-недельных мышей C57BL/6 10 5 SD 50 мышиного штамма EC RV привела к тому, что антиген RV стал обнаруживаться в фекалиях через 1–2 дня после инокуляции. Такое выделение ВВ, которое достигает пика через 3-4 дня после инокуляции и продолжается 6-8 дней после инокуляции, пропорционально инфекционности (т.е. уровню вирусного генома в кишечных лизатах) [22]. Чтобы исследовать роль микробиоты, мы вводили RV мышам, которых лечили комбинацией ампициллина и неомицина за 1 неделю до инокуляции, которую они продолжали получать на протяжении всей инфекции. Количественный анализ на основе ПЦР показал, что такие антибиотики снижали бактериальную нагрузку кишечника на 9%.9% (дополнительный рисунок 1 A ). Такое снижение уровня микробиоты последовательно приводило к 1-дневной задержке появления фекального антигена RV и снижению общего выделения RV примерно на 40% (как определено по площади под кривой; рисунок A ). Учитывая, что у мышей, получавших антибиотики, все еще была значительная бактериальная нагрузка в кишечнике и что антибиотики могут изменять относительные пропорции бактерий, что может привести к увеличению численности некоторых видов, также использовались стерильные мыши. Свободным от микробов мышам C57BL/6, которые содержались в стерильных изоляторах на протяжении всего эксперимента, и контрольным мышам, содержащимся в обычных условиях, перорально вводили стерилизованный фильтрацией RV. Культура фекалий и количественная ПЦР подтвердили отсутствие бактерий у этих мышей. Подобно мышам, получавшим антибиотики, у стерильных мышей наблюдалась задержка первоначального появления инфекции на 1 день. У стерильных мышей также наблюдалась задержка клиренса ПВ, что, вероятно, отражало их незрелую адаптивную иммунную систему кишечника [11], что важно для клиренса ПВ (рис.
Такое снижение уровня микробиоты последовательно приводило к 1-дневной задержке появления фекального антигена RV и снижению общего выделения RV примерно на 40% (как определено по площади под кривой; рисунок A ). Учитывая, что у мышей, получавших антибиотики, все еще была значительная бактериальная нагрузка в кишечнике и что антибиотики могут изменять относительные пропорции бактерий, что может привести к увеличению численности некоторых видов, также использовались стерильные мыши. Свободным от микробов мышам C57BL/6, которые содержались в стерильных изоляторах на протяжении всего эксперимента, и контрольным мышам, содержащимся в обычных условиях, перорально вводили стерилизованный фильтрацией RV. Культура фекалий и количественная ПЦР подтвердили отсутствие бактерий у этих мышей. Подобно мышам, получавшим антибиотики, у стерильных мышей наблюдалась задержка первоначального появления инфекции на 1 день. У стерильных мышей также наблюдалась задержка клиренса ПВ, что, вероятно, отражало их незрелую адаптивную иммунную систему кишечника [11], что важно для клиренса ПВ (рис. 9).0930 В ) [18]. Таким образом, задержка РВ-инфекции может быть однозначным следствием абляции микробиоты. Чтобы убедиться, что снижение уровня фекального антигена RV отражает снижение инфекционности, мы количественно определили уровень генома RV в лизатах двенадцатиперстной кишки с помощью qRT-PCR. Обработка антибиотиками привела к 10-кратному снижению геномов RV через 2 и 3 дня после инокуляции (рис. C ), что подтверждает, что антибиотики снижали инфекционность RV. Затем мы измерили отношение положительных смысловых и отрицательных смысловых нитей RV, что отражает степень активной репликации RV [17]. Этот параметр существенно не отличался между контрольными мышами и мышами, получавшими антибиотики (рис. 9).0930 D ), предполагая, что удаление микробиоты снижает проникновение вируса, а не репликацию RV.
9).0930 В ) [18]. Таким образом, задержка РВ-инфекции может быть однозначным следствием абляции микробиоты. Чтобы убедиться, что снижение уровня фекального антигена RV отражает снижение инфекционности, мы количественно определили уровень генома RV в лизатах двенадцатиперстной кишки с помощью qRT-PCR. Обработка антибиотиками привела к 10-кратному снижению геномов RV через 2 и 3 дня после инокуляции (рис. C ), что подтверждает, что антибиотики снижали инфекционность RV. Затем мы измерили отношение положительных смысловых и отрицательных смысловых нитей RV, что отражает степень активной репликации RV [17]. Этот параметр существенно не отличался между контрольными мышами и мышами, получавшими антибиотики (рис. 9).0930 D ), предполагая, что удаление микробиоты снижает проникновение вируса, а не репликацию RV.
Открыть в отдельном окне
Абляция микробиоты замедляет инфекционность ротавируса (РВ). Самцов мышей C57BL6 в возрасте 6–8 недель лечили ампициллином и неомицином за 1 неделю до пероральной инокуляции 10 5 50%-ных доз выделения (SD 50 ) мышиного штамма RV EC. A , Образцы фекалий собирали ежедневно и анализировали на антигены RV с помощью твердофазного иммуноферментного анализа (ELISA). B , Самцов и самок стерильных мышей в возрасте 6–8 недель заражали стерилизованным фильтрованием RV. Образцы кала собирали ежедневно и анализировали на антиген RV с помощью ELISA. C , Тотальную РНК получали из двенадцатиперстной кишки, и лизат клеток мышей, получавших антибиотики, исследовали на наличие матричной РНК NSP3, репрезентативной для генома RV, с помощью количественной полимеразной цепной реакции с обратной транскрипцией (qRT-PCR). D , Был приготовлен лизат клеток двенадцатиперстной кишки, и каждый образец был проанализирован на соотношение положительных и отрицательных цепей с помощью одноцепочечной qRT-PCR. Значение отношения положительно коррелирует с репликацией ПЖ. * P < 0,05.
A , Образцы фекалий собирали ежедневно и анализировали на антигены RV с помощью твердофазного иммуноферментного анализа (ELISA). B , Самцов и самок стерильных мышей в возрасте 6–8 недель заражали стерилизованным фильтрованием RV. Образцы кала собирали ежедневно и анализировали на антиген RV с помощью ELISA. C , Тотальную РНК получали из двенадцатиперстной кишки, и лизат клеток мышей, получавших антибиотики, исследовали на наличие матричной РНК NSP3, репрезентативной для генома RV, с помощью количественной полимеразной цепной реакции с обратной транскрипцией (qRT-PCR). D , Был приготовлен лизат клеток двенадцатиперстной кишки, и каждый образец был проанализирован на соотношение положительных и отрицательных цепей с помощью одноцепочечной qRT-PCR. Значение отношения положительно коррелирует с репликацией ПЖ. * P < 0,05.
Как и у людей, инфицирование вирусом РВ у новорожденных мышей вызывает секреторную диарею, возникающую через 2–3 дня после прививки и продолжающуюся 3–8 дней. Чтобы определить, влияет ли снижение инфекционности РВ в результате лечения антибиотиками на заболевание РВ, новорожденным мышам вводили антибиотики через желудочный зонд за 1 день до и через 1 день после инокуляции, а затем инокулировали РВ в день 0. Затем мышей ежедневно контролировали на наличие диареи, как указано. наличием жидких, обильных каловых масс желтого цвета при легком надавливании на живот (рис. 9).0930 А ). Лечение антибиотиками привело к снижению частоты диареи на 4–8-й день после прививки (рис. B ) и снижению общей заболеваемости диареей на 34% (рис. C ). Среди мышей, у которых развилась диарея, у тех, кто получал антибиотики, диарея длилась примерно на 1 день меньше, чем у мышей, не получавших лечения (рис. D ). Таким образом, уменьшение инфекции РВ посредством удаления микробиоты привело к сокращению продолжительности диарейного заболевания.
Чтобы определить, влияет ли снижение инфекционности РВ в результате лечения антибиотиками на заболевание РВ, новорожденным мышам вводили антибиотики через желудочный зонд за 1 день до и через 1 день после инокуляции, а затем инокулировали РВ в день 0. Затем мышей ежедневно контролировали на наличие диареи, как указано. наличием жидких, обильных каловых масс желтого цвета при легком надавливании на живот (рис. 9).0930 А ). Лечение антибиотиками привело к снижению частоты диареи на 4–8-й день после прививки (рис. B ) и снижению общей заболеваемости диареей на 34% (рис. C ). Среди мышей, у которых развилась диарея, у тех, кто получал антибиотики, диарея длилась примерно на 1 день меньше, чем у мышей, не получавших лечения (рис. D ). Таким образом, уменьшение инфекции РВ посредством удаления микробиоты привело к сокращению продолжительности диарейного заболевания.
Открыть в отдельном окне
Лечение антибиотиками снижает диарею, вызванную ротавирусом (RV), у новорожденных мышей. Беременных самок C57BL6 обрабатывали ампициллином и неомицином в питьевой воде ad libitum за 1 неделю до родов, и лечение продолжали до отъема потомства. Потомство обрабатывали 100 мкг неомицина и 200 мкг ампициллина в 100 мкл воды через желудочный зонд за 1 день до и через 1 день после инокуляции. Шестидневным мышам инокулировали 2 50% диарейных дозы мышиного RV и ежедневно визуально наблюдали диарею. A , Типичная правожелудочковая диарея у новорожденных. B , Ежедневная частота наблюдаемой диареи в дни 0–9 после инокуляции. C , Заболеваемость диареей, представленная в виде доли и процента от общего числа инокулированных мышей. D , Для мышей, у которых были обнаружены признаки диареи, усредняли количество дней, в течение которых у каждой мыши была диарея. * P < 0,05.
Беременных самок C57BL6 обрабатывали ампициллином и неомицином в питьевой воде ad libitum за 1 неделю до родов, и лечение продолжали до отъема потомства. Потомство обрабатывали 100 мкг неомицина и 200 мкг ампициллина в 100 мкл воды через желудочный зонд за 1 день до и через 1 день после инокуляции. Шестидневным мышам инокулировали 2 50% диарейных дозы мышиного RV и ежедневно визуально наблюдали диарею. A , Типичная правожелудочковая диарея у новорожденных. B , Ежедневная частота наблюдаемой диареи в дни 0–9 после инокуляции. C , Заболеваемость диареей, представленная в виде доли и процента от общего числа инокулированных мышей. D , Для мышей, у которых были обнаружены признаки диареи, усредняли количество дней, в течение которых у каждой мыши была диарея. * P < 0,05.
Отсутствие микробиоты приводит к более стойкому ответу слизистых оболочек, специфичному для RV
Инфекция RV инициирует сильный адаптивный иммунитет, который устраняет первичную инфекцию и обеспечивает защиту от инфекции в будущем [1]. Такой инфекционно-индуцированный иммунитет лежит в основе применяемых в настоящее время вакцин против РВ, представляющих собой живые аттенуированные вирусы. Такой защитный иммунитет лучше всего коррелирует с RV-специфическим фекальным IgA, уровни которого часто совпадают с уровнями сывороточного иммуноглобулина G (IgG) и IgA, которые обычно измеряют в клинических исследованиях [1, 18]. Модель инфекции RV у взрослых мышей можно считать моделью вакцинации против RV, поскольку обе инфекции представляют собой бессимптомные инфекции, которые не приводят к диарее, но обеспечивают защитный иммунитет [1]. Принимая во внимание, что антибиотики могут снижать гуморальный ответ на системно вводимые антигены и что снижение инфекционности, вероятно, снижает воздействие антигена, мы предположили, что лечение антибиотиками может снижать уровень антител, специфичных к RV [12, 13]. Чтобы исследовать эту возможность, мы лечили мышей антибиотиками за 1 неделю до и до 11 недель после инокуляции, еженедельно собирали фекалии и сыворотку и анализировали образцы на наличие RV-специфических IgG и IgA.
Такой инфекционно-индуцированный иммунитет лежит в основе применяемых в настоящее время вакцин против РВ, представляющих собой живые аттенуированные вирусы. Такой защитный иммунитет лучше всего коррелирует с RV-специфическим фекальным IgA, уровни которого часто совпадают с уровнями сывороточного иммуноглобулина G (IgG) и IgA, которые обычно измеряют в клинических исследованиях [1, 18]. Модель инфекции RV у взрослых мышей можно считать моделью вакцинации против RV, поскольку обе инфекции представляют собой бессимптомные инфекции, которые не приводят к диарее, но обеспечивают защитный иммунитет [1]. Принимая во внимание, что антибиотики могут снижать гуморальный ответ на системно вводимые антигены и что снижение инфекционности, вероятно, снижает воздействие антигена, мы предположили, что лечение антибиотиками может снижать уровень антител, специфичных к RV [12, 13]. Чтобы исследовать эту возможность, мы лечили мышей антибиотиками за 1 неделю до и до 11 недель после инокуляции, еженедельно собирали фекалии и сыворотку и анализировали образцы на наличие RV-специфических IgG и IgA. Лечение антибиотиками не влияло на выработку антител в ранние сроки после инокуляции RV, но увеличивало уровни специфических антител против RV, особенно сывороточного и фекального IgA, 9недель после прививки и далее (рис. ). Такое усиление наблюдалось при измерении иммунореактивности RV при однократном разведении сыворотки или надосадочной жидкости фекалий или при количественном определении титра после ряда разведений. Это увеличение было специфичным для RV, поскольку, согласно другим исследованиям, лечение антибиотиками приводило к умеренному снижению общего уровня IgA (дополнительная фигура 2 A и 2 B ) [11].
Лечение антибиотиками не влияло на выработку антител в ранние сроки после инокуляции RV, но увеличивало уровни специфических антител против RV, особенно сывороточного и фекального IgA, 9недель после прививки и далее (рис. ). Такое усиление наблюдалось при измерении иммунореактивности RV при однократном разведении сыворотки или надосадочной жидкости фекалий или при количественном определении титра после ряда разведений. Это увеличение было специфичным для RV, поскольку, согласно другим исследованиям, лечение антибиотиками приводило к умеренному снижению общего уровня IgA (дополнительная фигура 2 A и 2 B ) [11].
Открыть в отдельном окне
Лечение антибиотиками повышает устойчивость гуморального ответа на ротавирус (РВ). Мышей C57BL6 лечили антибиотиками, как описано, и они оставались на антибиотиках до 11 недель после инокуляции. A , C и E , сывороточный RV иммуноглобулин G (IgG; A ), сывороточный RV иммуноглобулин A (IgA; C ) и фекальный RV IgA ( E ), измеренный по иммунореактивности RV при однократном разведении сыворотки или фекального супернатанта через 0, 9, 10 и 11 недель после инокуляции. Полученные данные отражают поздний системный и слизистый ответ антител к RV. B , D и F , сывороточный RV IgG ( B ), сывороточный RV IgA ( D ) и фекальные титры RV IgA ( F ), измеренные с помощью разведения образца, при котором OD 450 равнялась 0,2 по сравнению с контролем, через 11 недель после инокуляции. * P < 0,05.
Полученные данные отражают поздний системный и слизистый ответ антител к RV. B , D и F , сывороточный RV IgG ( B ), сывороточный RV IgA ( D ) и фекальные титры RV IgA ( F ), измеренные с помощью разведения образца, при котором OD 450 равнялась 0,2 по сравнению с контролем, через 11 недель после инокуляции. * P < 0,05.
Альтернативным подходом к использованию антибиотиков для изучения микробиоты является использование стерильных мышей, хотя с оговоркой, что у этих мышей отсутствует связанная с кишечником лимфоидная ткань, которая опосредует адаптивный иммунитет [11]. В соответствии с этими данными и замедленным клиренсом RV, наблюдаемым у этих мышей, у стерильных мышей наблюдалась заметная задержка выработки фекальных анти-RV IgA. Несмотря на отсутствие GALT, это нарушение продукции фекальных анти-RV IgA у стерильных мышей со временем было преодолено. Более того, по аналогии с мышами, получавшими антибиотики, у стерильных мышей наблюдался ответ антител против RV в сыворотке, который изначально был аналогичен таковому у обычных мышей, но усиливался через несколько недель после инокуляции (рис. 1). Затем мы исследовали влияние антибиотиков на приобретение RV-специфических антител после патогенной (т.е. вызывающей диарею) RV-инфекции у новорожденных мышей. Патогенная вирусная инфекция обычно является сильным индуктором адаптивного иммунитета. Тем не менее, несмотря на сокращение продолжительности диареи, вызванной RV, лечение антибиотиками увеличивало выработку анти-RV IgA в сыворотке, при этом самые высокие титры наблюдались преимущественно в более поздние сроки после заражения (рис. 1). Таким образом, в отличие от нашего первоначального прогноза, абляция микробиоты привела к усилению системных и слизистых антител, специфичных для RV.
1). Затем мы исследовали влияние антибиотиков на приобретение RV-специфических антител после патогенной (т.е. вызывающей диарею) RV-инфекции у новорожденных мышей. Патогенная вирусная инфекция обычно является сильным индуктором адаптивного иммунитета. Тем не менее, несмотря на сокращение продолжительности диареи, вызванной RV, лечение антибиотиками увеличивало выработку анти-RV IgA в сыворотке, при этом самые высокие титры наблюдались преимущественно в более поздние сроки после заражения (рис. 1). Таким образом, в отличие от нашего первоначального прогноза, абляция микробиоты привела к усилению системных и слизистых антител, специфичных для RV.
Открыто в отдельном окне
Безмикробные мыши проявляют повышенный ответ сывороточных антител на ротавирус (RV). Свободных от микробов самцов и самок мышей C57BL6 инокулировали стерилизованным фильтрованием RV, фекалии и сыворотку собирали еженедельно вплоть до 9-й недели после инокуляции, а образцы анализировали на наличие антител к RV с помощью твердофазного иммуноферментного анализа. Мышей еженедельно проверяли культурой фекалий на отсутствие микробов до конечной точки эксперимента. А , С и E , Сывороточный иммуноглобулин RV G (IgG; A ), сывороточный RV иммуноглобулин A (IgA; C ) и фекальный RV IgA ( E ), измеренный по иммунореактивности RV при однократном разведении супернатант сыворотки или фекалий через 0–9 недель после инокуляции, отражающий поздний системный и мукозальный гуморальный гуморальный ответ. B , D и F , сывороточные титры RV IgG ( B ), сывороточные титры RV IgA ( D ) и фекальные титры RV IgA ( F ), измеренные с помощью разведения образца. ОД 450 равнялись 0,2 по сравнению с контролем через 9 недель после инокуляции. * P < 0,05. Сокращение: Conv, условно.
Мышей еженедельно проверяли культурой фекалий на отсутствие микробов до конечной точки эксперимента. А , С и E , Сывороточный иммуноглобулин RV G (IgG; A ), сывороточный RV иммуноглобулин A (IgA; C ) и фекальный RV IgA ( E ), измеренный по иммунореактивности RV при однократном разведении супернатант сыворотки или фекалий через 0–9 недель после инокуляции, отражающий поздний системный и мукозальный гуморальный гуморальный ответ. B , D и F , сывороточные титры RV IgG ( B ), сывороточные титры RV IgA ( D ) и фекальные титры RV IgA ( F ), измеренные с помощью разведения образца. ОД 450 равнялись 0,2 по сравнению с контролем через 9 недель после инокуляции. * P < 0,05. Сокращение: Conv, условно.
Открыто в отдельном окне
У новорожденных мышей, получавших антибиотики, после прививки ротавирусом (РВ) наблюдается повышенная выработка сывороточного иммуноглобулина А (IgA). Новорожденных лечили антибиотиками, как описано в разделе «Материалы и методы», и прививали РВ. Образцы кала и сыворотки были собраны через несколько недель после инокуляции, и образцы были исследованы на антитела к RV. A и C , Сывороточный иммуноглобулин RV G (IgG; A ) и сывороточный иммуноглобулин RV A (IgA; C ), измеренный по иммунореактивности RV при однократном разведении сыворотки, 4, 6, и через 9 недель после прививки. B , Титр RV IgG в сыворотке, измеренный с помощью разведения образца, при котором OD 450 равнялась 0,2 по сравнению с контролем, через 9 недель после инокуляции. D , Титр RV IgA в сыворотке, измеренный по разведению сыворотки, при котором OD 450 равняется 0,2 над контролем через 9 недель после инокуляции. * P < 0,05.
Новорожденных лечили антибиотиками, как описано в разделе «Материалы и методы», и прививали РВ. Образцы кала и сыворотки были собраны через несколько недель после инокуляции, и образцы были исследованы на антитела к RV. A и C , Сывороточный иммуноглобулин RV G (IgG; A ) и сывороточный иммуноглобулин RV A (IgA; C ), измеренный по иммунореактивности RV при однократном разведении сыворотки, 4, 6, и через 9 недель после прививки. B , Титр RV IgG в сыворотке, измеренный с помощью разведения образца, при котором OD 450 равнялась 0,2 по сравнению с контролем, через 9 недель после инокуляции. D , Титр RV IgA в сыворотке, измеренный по разведению сыворотки, при котором OD 450 равняется 0,2 над контролем через 9 недель после инокуляции. * P < 0,05.
Увеличение продолжительности ответа антител на RV предполагает возможность включения лечения антибиотиками в кампании по вакцинации. Однако, учитывая потенциальные негативные последствия длительного введения антибиотиков, мы затем попытались определить, могут ли более короткие воздействия также усиливать выработку антител к RV. Таким образом, мы сравнили эффекты 2-недельного курса антибиотиков (от 1 недели до и до 1 недели после прививки) с контрольными условиями (т. е. без антибиотиков) и с антибиотикотерапией, продолжавшейся на протяжении всего эксперимента (от 1 недели до и до 7 недель). после прививки). У мышей, получавших антибиотики всего 2 недели, наблюдалось возвращение фекальной бактериальной нагрузки в течение 2 недель после прекращения приема антибиотиков, тогда как у мышей, получавших антибиотики на протяжении всего эксперимента, по-прежнему наблюдалось бактериальное подавление (дополнительная фигура 19).0930 Б и 1 С ). В то время как максимальное усиление ответа антител против RV наблюдалось при продолжении лечения антибиотиками, 2-недельного курса было достаточно для значительного повышения уровней и титров анти-RV IgG и IgA в сыворотке (рис. A – D ). Дальнейшее сокращение курса антибиотиков, продолжавшееся от 2 дней до и до 3 дней после инокуляции RV, привело к тенденции к увеличению титров анти-RV IgA в фекалиях и сыворотке, что не было статистически значимым (дополнительная фигура 3).
Таким образом, мы сравнили эффекты 2-недельного курса антибиотиков (от 1 недели до и до 1 недели после прививки) с контрольными условиями (т. е. без антибиотиков) и с антибиотикотерапией, продолжавшейся на протяжении всего эксперимента (от 1 недели до и до 7 недель). после прививки). У мышей, получавших антибиотики всего 2 недели, наблюдалось возвращение фекальной бактериальной нагрузки в течение 2 недель после прекращения приема антибиотиков, тогда как у мышей, получавших антибиотики на протяжении всего эксперимента, по-прежнему наблюдалось бактериальное подавление (дополнительная фигура 19).0930 Б и 1 С ). В то время как максимальное усиление ответа антител против RV наблюдалось при продолжении лечения антибиотиками, 2-недельного курса было достаточно для значительного повышения уровней и титров анти-RV IgG и IgA в сыворотке (рис. A – D ). Дальнейшее сокращение курса антибиотиков, продолжавшееся от 2 дней до и до 3 дней после инокуляции RV, привело к тенденции к увеличению титров анти-RV IgA в фекалиях и сыворотке, что не было статистически значимым (дополнительная фигура 3). Мы предположили, что опосредованное антибиотиками усиление стойкости иммунного ответа слизистых оболочек связано с более устойчивыми уровнями клеток, секретирующих антитела, специфичные к RV (ASC). Таким образом, затем мы провели анализ ELISPOT для количественного определения уровней RV-специфических IgA-продуцирующих ASC из собственной пластинки тонкой кишки и пейеровых бляшек. У контрольных мышей инокуляция RV привела к тому, что RV-специфические ASC снизились с неопределяемого уровня до уровня 4000 клеток на миллион клеток собственной пластинки пластинки и пейеровых бляшек, который затем снизился примерно в 40 раз через 7 недель после инокуляции. Лечение антибиотиками не оказывало существенного влияния на образование RV-специфических IgA-продуцирующих ASC через 2 недели после инокуляции. Однако через 7 недель после инокуляции лечение антибиотиками заметно повысило уровни этих клеток. Степень усиления (примерно в 20 раз) была наибольшей у мышей, получавших антибиотики на протяжении всего эксперимента, но, тем не менее, была устойчивой (увеличение в 10 раз) у мышей, получавших 2-недельный курс антибиотиков (рис.
Мы предположили, что опосредованное антибиотиками усиление стойкости иммунного ответа слизистых оболочек связано с более устойчивыми уровнями клеток, секретирующих антитела, специфичные к RV (ASC). Таким образом, затем мы провели анализ ELISPOT для количественного определения уровней RV-специфических IgA-продуцирующих ASC из собственной пластинки тонкой кишки и пейеровых бляшек. У контрольных мышей инокуляция RV привела к тому, что RV-специфические ASC снизились с неопределяемого уровня до уровня 4000 клеток на миллион клеток собственной пластинки пластинки и пейеровых бляшек, который затем снизился примерно в 40 раз через 7 недель после инокуляции. Лечение антибиотиками не оказывало существенного влияния на образование RV-специфических IgA-продуцирующих ASC через 2 недели после инокуляции. Однако через 7 недель после инокуляции лечение антибиотиками заметно повысило уровни этих клеток. Степень усиления (примерно в 20 раз) была наибольшей у мышей, получавших антибиотики на протяжении всего эксперимента, но, тем не менее, была устойчивой (увеличение в 10 раз) у мышей, получавших 2-недельный курс антибиотиков (рис. 9).0930 Е ).
9).0930 Е ).
Открыть в отдельном окне
Лечение антибиотиками приводит к большему поддержанию в кишечнике клеток, продуцирующих антитела, специфичные к ротавирусу (RV). Мышей C57BL6 лечили антибиотиками, как описано в разделе «Материалы и методы». Однако одна группа мышей продолжала терапию антибиотиками только в течение 1 недели после инокуляции (всего 2 недели), тогда как другая группа мышей продолжала терапию антибиотиками на протяжении всего эксперимента (всего 8 недель). А и C , Иммуноглобулин G сыворотки RV (IgG; A ) и иммуноглобулин A RV сыворотки (IgA; C ) вырабатываются еженедельно до 7 недель после инокуляции, что отражает поздний системный ответ антител против RV и слизистых оболочек. B и D , титр RV IgG в сыворотке ( B ) и титр RV IgA в сыворотке ( D ), измеренные путем разведения образца, при котором OD 450 равнялась 0,2 по сравнению с контролем, через 7 недель после инокуляции. E . Клетки собственной пластинки тонкого кишечника (LP) и пейеровой бляшки (PP) выделяли и наносили на чашки с покрытием через 2 недели и 7 недель после инокуляции. Концентрацию RV-специфических IgA-продуцирующих антитело-секретирующих клеток (ASC) рассчитывали в каждой группе. * P < 0,05. Сокращение: UnTx, необработанный.
E . Клетки собственной пластинки тонкого кишечника (LP) и пейеровой бляшки (PP) выделяли и наносили на чашки с покрытием через 2 недели и 7 недель после инокуляции. Концентрацию RV-специфических IgA-продуцирующих антитело-секретирующих клеток (ASC) рассчитывали в каждой группе. * P < 0,05. Сокращение: UnTx, необработанный.
Воздействие микробиоты на базальное состояние активации врожденного иммунитета может регулировать адаптивный иммунитет, специфичный для RV сигналы опасности для более быстрой активации GALT во время инфекции; это должно привести к более сильной активации вирусспецифических клеток и сохранению ASC в кишечнике. Обратной стороной этой гипотезы является то, что активация большей степени врожденного иммунитета перед введением вируса может ослабить ответ антител. Чтобы проверить эту возможность, мышей подвергали воздействию DSS через питьевую воду, что нарушает целостность эпителиального барьера кишечника и приводит к повышенному воздействию микробиоты и ее продуктов на иммунные клетки.
 Хотя лечение DSS может привести к тяжелому угрожающему жизни колиту, воздействие низких концентраций DSS, таких как 1,0%, приводит только к умеренным гистопатологическим изменениям в кишечнике, но все же вызывает легко обнаруживаемую активацию экспрессии провоспалительных генов, которую можно контролировать путем измерения уровни фекального липокалина-2 [21]. Соответственно, воздействие 1,0% DSS в течение 1 недели не приводило к явным симптомам колита, но, тем не менее, индуцировало устойчивую экспрессию фекального липокалина-2 (рис. 9).0930 А ). Лечение DSS не изменило течение инфекции RV (фигура B ). Более того, вызванное DSS слабовыраженное воспаление не влияло на начальную генерацию сывороточных RV-специфических IgG (фиг. C и D ). Тем не менее, лечение DSS привело к значительному снижению уровня RV-специфического IgA в фекалиях и сыворотке через 3–9 недель после инокуляции (рис. E – H ). Эти результаты позволяют предположить, что состояние базовой активации врожденного иммунитета во время инокуляции RV может модулировать уровни специфических антител против RV.
Хотя лечение DSS может привести к тяжелому угрожающему жизни колиту, воздействие низких концентраций DSS, таких как 1,0%, приводит только к умеренным гистопатологическим изменениям в кишечнике, но все же вызывает легко обнаруживаемую активацию экспрессии провоспалительных генов, которую можно контролировать путем измерения уровни фекального липокалина-2 [21]. Соответственно, воздействие 1,0% DSS в течение 1 недели не приводило к явным симптомам колита, но, тем не менее, индуцировало устойчивую экспрессию фекального липокалина-2 (рис. 9).0930 А ). Лечение DSS не изменило течение инфекции RV (фигура B ). Более того, вызванное DSS слабовыраженное воспаление не влияло на начальную генерацию сывороточных RV-специфических IgG (фиг. C и D ). Тем не менее, лечение DSS привело к значительному снижению уровня RV-специфического IgA в фекалиях и сыворотке через 3–9 недель после инокуляции (рис. E – H ). Эти результаты позволяют предположить, что состояние базовой активации врожденного иммунитета во время инокуляции RV может модулировать уровни специфических антител против RV. Соответственно, манипулирование этим параметром может быть способом модулирования генерации этих защитных реакций.
Соответственно, манипулирование этим параметром может быть способом модулирования генерации этих защитных реакций.Открыть в отдельном окне
Повышение базовой иммунной активации снижает выработку антител, индуцированную ротавирусом (РВ). Мышей C57BL6 лечили декстрансульфатом натрия (DSS), как описано в разделе «Материалы и методы», и инокулировали RV. A , Экспрессию фекального липокалина-2 анализировали с помощью твердофазного иммуноферментного анализа. B , Ежедневно собирали образцы кала и анализировали антиген RV. C , E и G , Были получены супернатанты сыворотки и фекалий, а также сывороточный иммуноглобулин RV G (IgG; C ), сывороточный иммуноглобулин А RV (IgA; E ) и фекальный RV IgA ( G ), определяемый по иммунореактивности RV при однократном разведении сыворотки или фекального супернатанта, исследовали до 9 недель. после прививки. D , F и H , сывороточные титры RV IgG ( D ), сывороточные титры RV IgA ( F ) и фекальные титры RV IgA ( H ). ОП 450 равнялась 0,2 по сравнению с контролем через 9 недель после инокуляции. * P < 0,05.
ОП 450 равнялась 0,2 по сравнению с контролем через 9 недель после инокуляции. * P < 0,05.
Микробиота кишечника все больше ценится как модулятор многочисленных инфекционных и иммунологических процессов. Во многих случаях микробиота кишечника служит для защиты хозяина от инфекционных заболеваний, так что использование антибиотиков приводит к повышенной восприимчивости к ряду бактериальных инфекций. Кроме того, у мышей, подвергшихся абляции микробиоты, нарушается формирование иммунных ответов на некоторые вирусы [12, 13]. Таким образом, мы первоначально предположили, что устранение микробиоты может повысить восприимчивость к инфекции RV. В соответствии с наблюдением, что микробиота необходима для развития GALT [11], который генерирует фекальный IgA, который способствует клиренсу RV [18], у стерильных мышей наблюдалась задержка выработки фекального анти-RV IgA и одновременно замедленный клиренс RV. Тем не менее, общие последствия абляции микробиоты, особенно когда она достигается с помощью более клинически значимого подхода лечения антибиотиками, по-видимому, приносят пользу хозяину. В частности, лечение антибиотиками привело к задержке инфицирования РВ и снижению общей инфекционности. Такое снижение инфекции было связано и, вероятно, привело к существенному снижению частоты и продолжительности диареи, вызванной вирусом риновируса.
В частности, лечение антибиотиками привело к задержке инфицирования РВ и снижению общей инфекционности. Такое снижение инфекции было связано и, вероятно, привело к существенному снижению частоты и продолжительности диареи, вызванной вирусом риновируса.
Механизм, с помощью которого удаление микробиоты замедляет инфекционность RV, не ясен, но может быть аналогичен случаю полиовируса, реовируса и вируса опухоли молочной железы мыши, которые, как недавно сообщалось, менее эффективно инфицируют в отсутствие микробиоты [14]. , 23]. В таких случаях было обнаружено, что ЛПС, полученные из бактерий, связывают вирус и облегчают его проникновение [14]. Хотя наши эксперименты на сегодняшний день не продемонстрировали прямой роли бактериальных лигандов в содействии проникновению RV, антибиотики оказывали явное влияние на вирусную нагрузку с небольшим влиянием на репликацию RV, что предполагает, что подобная парадигма может действовать. Другая возможность заключается в том, что отсутствие бактерий может снижать экспрессию рецепторов RV, необходимых для проникновения вируса. Действительно, известно, что микробиота способствует экспрессии некоторых Toll-подобных рецепторов [24, 25], которые, как постулируется, облегчают проникновение кишечных вирусов [14, 23].
Действительно, известно, что микробиота способствует экспрессии некоторых Toll-подобных рецепторов [24, 25], которые, как постулируется, облегчают проникновение кишечных вирусов [14, 23].
Уменьшение инфекционности RV при лечении антибиотиками, вероятно, привело к уменьшению воздействия антигенов RV на иммунную систему, что, по нашим прогнозам, уменьшит реакцию антител на вирус. Напротив, антибиотики усиливали гуморальный ответ, в частности, делая его более стойким. Такие более высокие титры в более поздние моменты времени, вероятно, обеспечивают более длительную и широкую защиту от последующего инфицирования гетерологичными штаммами RV. Механизм, опосредующий этот эффект, не совсем ясен, но может отражать то, что так называемые сигналы опасности RV обеспечивают больший стимулирующий эффект на взаимодействия антиген-представляющих клеток и лимфоцитов, когда такие сигналы возникают в контексте сниженной базальной/фоновой передачи сигналов. В подтверждение этой возможности удаление микробиоты приводит к снижению фекальных уровней маркеров иммунного воспаления, таких как липокалин-2 (данные не показаны) и relm-β [26], где использование DSS для повышения состояния иммунной активации до инфекции RV приводит к менее стойкому ответу антител. В этом контексте мы предполагаем, что неспособность вакцин против RV постоянно вызывать сильный ответ антител в развивающихся странах может отражать измененный состав микробиоты, возможно обогащенный патобионтами, что приводит к хронической иммунной активации при введении вакцины против RV. Другая возможность заключается в том, что удаление микробиоты снижает регуляторное функционирование Т-клеток, что приводит к усилению воспалительных Т-клеточных ответов [27]. Расшифровка таких сложных механизмов остается важной исследовательской задачей.
В этом контексте мы предполагаем, что неспособность вакцин против RV постоянно вызывать сильный ответ антител в развивающихся странах может отражать измененный состав микробиоты, возможно обогащенный патобионтами, что приводит к хронической иммунной активации при введении вакцины против RV. Другая возможность заключается в том, что удаление микробиоты снижает регуляторное функционирование Т-клеток, что приводит к усилению воспалительных Т-клеточных ответов [27]. Расшифровка таких сложных механизмов остается важной исследовательской задачей.
Предполагая, что мышиная модель RV применима к людям, наше исследование имеет несколько последствий для использования антибиотиков в контексте инфекции RV и вакцинации. Во-первых, учитывая, что многие клинические диагнозы инфекций основаны на симптомах, а не на лабораторном обнаружении конкретного патогена, наши результаты показывают, что при принятии решения о назначении антибиотиков не нужно опасаться, что это повысит восприимчивость к РВ. Более того, наши результаты свидетельствуют о том, что введение вакцины против RV не нужно откладывать, если человек в настоящее время принимает антибиотики. Скорее, наше исследование предполагает, что это может быть идеальное время для введения RV и, возможно, других пероральных вакцин. Кроме того, низкая стоимость антибиотиков может оправдывать их избирательное использование при лечении РВ. Возможно, активную вспышку инфекции RV можно было бы контролировать путем введения антибиотиков, за которыми следует быстрая вакцинация против RV. Это действие может уменьшить тяжесть возникающих инфекций и повысить эффективность вакцины. В качестве альтернативы, включение антибиотиков в более широкую кампанию вакцинации против RV может повысить уровень сероконверсии. Действительно, на основе предложенного нами механизма, с помощью которого антибиотики стимулируют антитела к RV, мы предполагаем, что эффект может быть наибольшим в районах с низким уровнем сероконверсии, таких как Малави, где может быть более высокий уровень базовой иммунной активации.
Более того, наши результаты свидетельствуют о том, что введение вакцины против RV не нужно откладывать, если человек в настоящее время принимает антибиотики. Скорее, наше исследование предполагает, что это может быть идеальное время для введения RV и, возможно, других пероральных вакцин. Кроме того, низкая стоимость антибиотиков может оправдывать их избирательное использование при лечении РВ. Возможно, активную вспышку инфекции RV можно было бы контролировать путем введения антибиотиков, за которыми следует быстрая вакцинация против RV. Это действие может уменьшить тяжесть возникающих инфекций и повысить эффективность вакцины. В качестве альтернативы, включение антибиотиков в более широкую кампанию вакцинации против RV может повысить уровень сероконверсии. Действительно, на основе предложенного нами механизма, с помощью которого антибиотики стимулируют антитела к RV, мы предполагаем, что эффект может быть наибольшим в районах с низким уровнем сероконверсии, таких как Малави, где может быть более высокий уровень базовой иммунной активации. Даже незначительное повышение эффективности вакцины может привести к резкому снижению общественного бремени болезней из-за коллективного иммунитета. В случае, если наши наблюдения на мышах окажутся актуальными для людей, следует тщательно рассмотреть пагубные последствия использования антибиотиков, включая повышенную восприимчивость к бактериальным инфекциям [28] и продвижение устойчивых к антибиотикам бактерий [29].], является оправданным перед широкомасштабным внедрением противомикробных препаратов для борьбы с бременем РВ. В свете этих опасений разработка подходов к выборочному манипулированию микробиотой может предоставить лучшие средства для безопасного усиления иммунного ответа на вакцины против RV. Такие избирательные манипуляции могут принимать форму более специфического действия антибиотиков и/или введения пробиотиков. Действительно, введение пробиотика повышало уровень сероконверсии в когорте финских детей, вакцинированных против вируса RV [30]. Таким образом, хотя механистическое понимание и оптимизация требуют дополнительных экспериментов, подход к манипулированию микробиотой может быть полезной стратегией борьбы с РВ.
Даже незначительное повышение эффективности вакцины может привести к резкому снижению общественного бремени болезней из-за коллективного иммунитета. В случае, если наши наблюдения на мышах окажутся актуальными для людей, следует тщательно рассмотреть пагубные последствия использования антибиотиков, включая повышенную восприимчивость к бактериальным инфекциям [28] и продвижение устойчивых к антибиотикам бактерий [29].], является оправданным перед широкомасштабным внедрением противомикробных препаратов для борьбы с бременем РВ. В свете этих опасений разработка подходов к выборочному манипулированию микробиотой может предоставить лучшие средства для безопасного усиления иммунного ответа на вакцины против RV. Такие избирательные манипуляции могут принимать форму более специфического действия антибиотиков и/или введения пробиотиков. Действительно, введение пробиотика повышало уровень сероконверсии в когорте финских детей, вакцинированных против вируса RV [30]. Таким образом, хотя механистическое понимание и оптимизация требуют дополнительных экспериментов, подход к манипулированию микробиотой может быть полезной стратегией борьбы с РВ.
Дополнительные материалы доступны по адресу The Journal of Infectious Diseases онлайн (http://jid.oxfordjournals.org/). Дополнительные материалы состоят из данных, предоставленных автором, которые публикуются в интересах читателя. Размещенные материалы не редактируются. Ответственность за содержание всех дополнительных данных несут исключительно авторы. Вопросы или сообщения об ошибках следует направлять автору.
Дополнительные данные:
Щелкните здесь для просмотра.
Благодарности. Мы благодарим Кейтлин Боханнон, Сару Блатт, Даниэля Риоса и Джейсона О за технические советы; и Рама Амара, Тимоти Деннинг и Ифор Уильямс за полезное обсуждение.
Финансовая поддержка. Эта работа была поддержана Национальным институтом здравоохранения (грант DK083890).
Возможные конфликты интересов. Все авторы: Нет сообщений о конфликтах.
Все авторы представили форму ICMJE для раскрытия потенциальных конфликтов интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
1. Гринберг Х.Б., Эстес М.К. Ротавирусы: от патогенеза к вакцинации. Гастроэнтерология. 2009; 136: 1939–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Patel MM, Glass R, Desai R, Tate JE, Parashar UD. Выполнение обещаний ротавирусных вакцин: как далеко мы продвинулись с момента лицензирования? Ланцет Infect Dis. 2012; 12: 561–70. [PubMed] [Академия Google]
3. Ротавирус. Доступно по адресу: http://www.cdc.gov/rotavirus/about/symptoms.html. По состоянию на 17 декабря 2013 г.
4. Надзор за ротавирусами — во всем мире, 2009 г. Morbid Mortal Wkly Rep. 2011; 60:514–6. [PubMed] [Google Scholar]
5. Бабджи С., Канг Г. Вакцинация против ротавируса в развивающихся странах. Карр Опин Вирол. 2012;2:443–8. [PubMed] [Google Scholar]
6. Holmgren J, Svennerholm AM. Вакцины против инфекций слизистых оболочек. Курр Опин Иммунол. 2012; 24:343–53. [PubMed] [Академия Google]
Курр Опин Иммунол. 2012; 24:343–53. [PubMed] [Академия Google]
7. Madhi SA, Cunliffe NA, Steele D, et al. Влияние ротавирусной вакцины человека на тяжелую диарею у африканских младенцев. N Engl J Med. 2010; 362: 289–98. [PubMed] [Google Scholar]
8. Vesikari T, Matson DO, Dennehy P, et al. Безопасность и эффективность пятивалентной реассортантной ротавирусной вакцины человека и крупного рогатого скота (WC3). N Engl J Med. 2006; 354: 23–33. [PubMed] [Google Scholar]
9. Патель М., Шейн А.Л., Парашар У.Д., Цзян Б., Генч Дж.Р., Гласс Р.И. Пероральные ротавирусные вакцины: насколько хорошо они будут работать там, где в них больше всего нуждаются? J заразить дис. 2009 г.;200(Приложение 1):S39–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Cooper PJ, Chico ME, Losonsky G, et al. Лечение альбендазолом детей с аскаридозом усиливает вибриоцидный ответ антител на живую аттенуированную оральную холерную вакцину CVD 103-HgR. J заразить дис. 2000; 182:1199–206. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
11. Соммер Ф., Бакхед Ф. Кишечная микробиота — мастера развития хозяина и физиологии. Nat Rev Microbiol. 2013; 11: 227–38. [PubMed] [Академия Google]
12. Ичинохе Т., Панг И.К., Кумамото Ю. и др. Микробиота регулирует иммунную защиту от инфекции вируса гриппа А дыхательных путей. Proc Natl Acad Sci U S A. 2011;108:5354–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Abt MC, Osborne LC, Monticelli LA, et al. Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета. Иммунитет. 2012; 37: 158–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Kuss SK, Best GT, Etheredge CA, et al. Кишечная микробиота способствует репликации кишечных вирусов и системному патогенезу. Наука. 2011;334:249–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Carvalho FA, Nalbantoglu I, Ortega-Fernandez S, et al. Интерлейкин-1бета (IL-1бета) повышает восприимчивость мышей с дефицитом Toll-подобного рецептора 5 (TLR5) к колиту. Кишка. 2012;61:373–84. [PubMed] [Google Scholar]
Кишка. 2012;61:373–84. [PubMed] [Google Scholar]
16. Blutt SE, Warfield KL, O’Neal CM, Estes MK, Conner ME. Факторы хозяина, вируса и вакцины, которые определяют защитную эффективность, индуцированную ротавирусом и вирусоподобными частицами (ВПЧ). Вакцина. 2006; 24:1170–9. [PubMed] [Академия Google]
17. Fenaux M, Cuadras MA, Feng N, Jaimes M, Greenberg HB. Внекишечное распространение и репликация гомологичного штамма ротавируса ЕС и гетерологичного ротавируса резуса у мышей BALB/c. Дж Вирол. 2006; 80: 5219–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Blutt SE, Miller AD, Salmon SL, Metzger DW, Conner ME. IgA важен для клиренса и критичен для защиты от ротавирусной инфекции. Иммунол слизистых оболочек. 2012;5:712–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Виджай-Кумар М., Эйткен Дж.Д., Кумар А. и соавт. У мышей с дефицитом Toll-подобного рецептора 5 нарушена регуляция экспрессии кишечных генов и неспецифическая устойчивость к тифоподобному заболеванию, индуцированному Salmonella. Заразить иммун. 2008;76:1276–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 2008;76:1276–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Denning TL, Wang YC, Patel SR, Williams IR, Pulendran B. Макрофаги собственной пластинки пластинки и дендритные клетки по-разному индуцируют регуляторные и интерлейкин-17-продуцирующие Т-клеточные ответы. Нат Иммунол. 2007; 8: 1086–9.4. [PubMed] [Google Scholar]
21. Chassaing B, Srinivasan G, Delgado MA, Young AN, Gewirtz AT, Vijay-Kumar M. Фекальный липокалин 2, чувствительный и широко динамический неинвазивный биомаркер воспаления кишечника. ПЛОС Один. 2012;7:e44328. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Feng N, Franco MA, Greenberg HB. Мышиная модель ротавирусной инфекции. Adv Exp Med Biol. 1997; 412: 233–40. [PubMed] [Google Scholar]
23. Kane M, Case LK, Kopaskie K, et al. Успешная передача ретровируса зависит от комменсальной микробиоты. Наука. 2011; 334: 245–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Lundin A, Bok CM, Aronsson L, et al. Кишечная флора, Толл-подобные рецепторы и ядерные рецепторы: трехсторонняя связь, которая настраивает врожденный иммунитет в толстой кишке. Клеточная микробиология. 2008; 10:1093–103. [PubMed] [Google Scholar]
Кишечная флора, Толл-подобные рецепторы и ядерные рецепторы: трехсторонняя связь, которая настраивает врожденный иммунитет в толстой кишке. Клеточная микробиология. 2008; 10:1093–103. [PubMed] [Google Scholar]
25. Wang Y, Devkota S, Musch MW, et al. Региональная микробиота, ассоциированная со слизистой оболочкой, определяет физиологическую экспрессию TLR2 и TLR4 в толстой кишке мышей. ПЛОС Один. 2010;5:e13607. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Wang ML, Shin ME, Knight PA, et al. Регуляция экспрессии изоформы RELM/FIZZ с помощью Cdx2 в ответ на стимуляцию врожденного и адаптивного иммунитета в кишечнике. Am J Physiol Gastrointest Liver Physiol. 2005; 288:G1074–83. [PubMed] [Google Scholar]
27. Боллрат Дж., Powrie FM. Контроль границы: Регуляторные Т-клетки и кишечный гомеостаз. Семин Иммунол. 2013;25:352–7. [PubMed] [Google Scholar]
28. Dupont HL. Диагностика и лечение инфекции Clostridium difficile. Клин Гастроэнтерол Гепатол. 2013;11:1216–23.
 Они могут возникать как на фоне кишечного расстройства, так и предшествовать рвоте и диарее 7 .
Они могут возникать как на фоне кишечного расстройства, так и предшествовать рвоте и диарее 7 . При вирусной кишечной инфекции организм ребенка теряет большое количество воды и солей 3 . Чтобы восстановить и поддержать водно-солевой баланс, педиатр назначает специальные растворы 3 . Все рекомендации, как и чем выпаивать малыша, родителям дает лечащий врач.
При вирусной кишечной инфекции организм ребенка теряет большое количество воды и солей 3 . Чтобы восстановить и поддержать водно-солевой баланс, педиатр назначает специальные растворы 3 . Все рекомендации, как и чем выпаивать малыша, родителям дает лечащий врач.

 Она может проявляться спутанностью речи, двоением в глазах, сыпью, болезненность икроножных мышц и пр.
Она может проявляться спутанностью речи, двоением в глазах, сыпью, болезненность икроножных мышц и пр. Примерно на 3–4 сутки, при позитивной динамике, питание можно постепенно восстанавливать, не злоупотребляя углеводами и растительной клетчаткой. Даже когда дело идет на поправку, в течение 8–10 дней не нужно давать молоко (из-за временной лактозной недостаточности), сырые фрукты и овощи, картофель, сладости.
Примерно на 3–4 сутки, при позитивной динамике, питание можно постепенно восстанавливать, не злоупотребляя углеводами и растительной клетчаткой. Даже когда дело идет на поправку, в течение 8–10 дней не нужно давать молоко (из-за временной лактозной недостаточности), сырые фрукты и овощи, картофель, сладости.



 Кремниевая кислота нейтрализует токсины и болезнетворные микроорганизмы.
Кремниевая кислота нейтрализует токсины и болезнетворные микроорганизмы.
 Разница лишь в том, что в полисорбе действующим веществом является диоксид кремния, а в смекте – диоктаэдрический смектит. Первый вкуснее второго. Смекта может вызвать тошноту.
Разница лишь в том, что в полисорбе действующим веществом является диоксид кремния, а в смекте – диоктаэдрический смектит. Первый вкуснее второго. Смекта может вызвать тошноту.