Фармакотерапия ожирения: что нового? | Трошина
Введение
Темпы распространения ожирения как в экономически развитых, так и в развивающихся странах, сопоставимы с масштабами эпидемии. Катастрофический рост распространенности ожирения, согласно опубликованным сведениям ВОЗ [1], привел к тому, что в 2014 г. более 1,9 млрд взрослых (18 лет и старше) лиц имели избыточный вес, из них 600 млн человек страдали ожирением. Если такие тенденции сохранятся, то к 2030 г. около 60% мирового населения, т.е. 3,3 млрд человек, могут иметь избыточный вес (2,2 млрд) или ожирение (1,1 млрд) [2]. Ассоциированные с ожирением заболевания, такие как сахарный диабет 2-го типа (СД 2), артериальная гипертония (АГ), ишемическая болезнь сердца и др., представляют собой глобальную медицинскую проблему, сопряженную со значительно возрастающим риском заболеваемости и смертности, существенным ростом расходов на здравоохранение и значительно ухудшающую качество жизни больных [1, 3]. ВОЗ относит ожирение к числу пяти основных факторов риска смерти. На лечение заболеваний, ассоциированных с ожирением, приходится около 70% затрат на здравоохранение. Риск смертности значимо увеличивается при индексе массы тела (ИМТ) >30 кг/м2. При ИМТ >40 кг/м2 смертность в возрастной группе 35—45 лет увеличивается в 6 раз; в возрастной группе 25—30 лет смертность в 12 раз выше, чем у лиц того же возраста без ожирения.
На лечение заболеваний, ассоциированных с ожирением, приходится около 70% затрат на здравоохранение. Риск смертности значимо увеличивается при индексе массы тела (ИМТ) >30 кг/м2. При ИМТ >40 кг/м2 смертность в возрастной группе 35—45 лет увеличивается в 6 раз; в возрастной группе 25—30 лет смертность в 12 раз выше, чем у лиц того же возраста без ожирения.
Поскольку снижение массы тела позволяет уменьшить риск развития сопутствующих ожирению заболеваний, существенно повлиять на сроки их манифестации или способствовать их более благоприятному течению [4—7], вопросы консервативного лечения ожирения становятся чрезвычайно актуальными.
Модификация образа жизни, основанная на коррекции питания и расширении объема физической нагрузки, является краеугольным камнем лечения пациентов с ожирением, в том числе морбидным. Однако далеко не всем пациентам удается изменить прочно укоренившиеся привычки в питании и образе жизни и достичь положительных результатов лечения.
Известно, что пациентам с ожирением, осложненным сопутствующими заболеваниями (СД 2, АГ, атеросклерозом, синдромом обструктивного апноэ сна, артрозом, подагрой и т. д.), труднее снизить массу тела, поскольку такие состояния затрудняют выполнение врачебных рекомендаций по питанию и физическим нагрузкам. Этими трудностями и продиктована необходимость включения фармакопрепаратов в комплексное лечение ожирения. Фармакотерапия позволяет добиться более эффективного снижения массы тела, облегчает выполнение рекомендаций по питанию, помогает в выработке новых пищевых привычек, способствует длительному удержанию сниженной массы тела.
д.), труднее снизить массу тела, поскольку такие состояния затрудняют выполнение врачебных рекомендаций по питанию и физическим нагрузкам. Этими трудностями и продиктована необходимость включения фармакопрепаратов в комплексное лечение ожирения. Фармакотерапия позволяет добиться более эффективного снижения массы тела, облегчает выполнение рекомендаций по питанию, помогает в выработке новых пищевых привычек, способствует длительному удержанию сниженной массы тела.
Поскольку ожирение представляет собой хроническое заболевание с частыми рецидивами, требующее долговременного пожизненного лечения и последующего наблюдения, краткосрочная терапия малоэффективна.
У больных с осложненным ожирением лечение должно быть продолжено, даже если незначительное снижение массы тела сопровождается улучшением состояния здоровья и метаболических показателей.
Поэтому к основным задачам фармакотерапии относятся достижение эффективного снижения массы тела (более 10% от исходной), компенсация имеющихся метаболических нарушений, улучшение переносимости лечения и повышение приверженности к нему, а также предотвращение рецидивов заболевания.
Препараты для лечения ожирения должны иметь известный механизм действия, значимо снижать массу тела, положительно влиять на метаболические нарушения, сопутствующие ожирению (дислипидемию, СД 2, АГ и т.д.), иметь приемлемый профиль переносимости, не вызывать зависимости, быть эффективными и безопасными при длительном применении.
Современная фармакотерапия ожирения
До недавнего времени на российском фармацевтическом рынке были представлены только два лекарственных препарата для лечения ожирения — орлистат и сибутрамин [5—8].
Орлистат
Препарат периферического действия, оказывает терапевтический эффект в пределах желудочно-кишечного тракта (ЖКТ) и не обладает системным действием. Являясь специфическим, длительно действующим ингибитором желудочно-кишечных липаз, орлистат препятствует расщеплению и последующему всасыванию жиров, поступающих с пищей (около 30%), создавая тем самым дефицит энергии, что приводит к снижению массы тела. Одновременно он уменьшает количество свободных жирных кислот и моноглицеридов в просвете кишечника, таким образом, снижая растворимость и последующее всасывание холестерина, способствуя снижению гиперхолестеринемии, причем независимо от степени снижения массы тела. К побочным эффектам препарата относятся жирный стул, маслянистые выделения из прямой кишки, императивные позывы на дефекацию, учащение дефекации и недержание кала, боли в животе, выделение газов с некоторым количеством кишечного отделяемого.
К побочным эффектам препарата относятся жирный стул, маслянистые выделения из прямой кишки, императивные позывы на дефекацию, учащение дефекации и недержание кала, боли в животе, выделение газов с некоторым количеством кишечного отделяемого.
Выраженность и продолжительность побочных эффектов напрямую зависят от приверженности пациентов лечению и соблюдения рекомендаций по ограничению жиров в пище. Побочные эффекты орлистата дополнительно побуждают пациентов следовать этим рекомендациям. Нежелательные явления учащаются при повышении содержания жира в рационе, возникают на ранних этапах лечения (первые 3 мес), а при условии ограничения жиров в пище слабо выражены и транзиторны.
Оптимальной дозой препарата является 120 мг 3 раза в сутки во время еды или не позже чем через час после нее. Увеличение дозы не повышает эффективности. Коррекции дозы у больных пожилого возраста и при нарушении функции печени или почек не требуется. Препарат противопоказан при обострении панкреатита и заболеваниях, сопровождающихся диареей, синдромом мальабсорбции, холестазом, при повышенной чувствительности к самому препарату или любым его компонентам.
Применение орлистата приводит к эффективному снижению массы тела и ИМТ более чем у 80% больных. На фоне приема препарата происходит уменьшение ассоциированных с ожирением факторов риска и заболеваний. Безопасность длительного применения (до 4 лет непрерывного приема), а также эффективность профилактики СД 2 были продемонстрированы в исследовании XENDOS (Xenical in the Prevention of Diabetes in Obese Subjects). Длительное применение препарата в сочетании с изменением образа жизни приводило к более выраженному снижению массы тела и статистически значимо уменьшало заболеваемость СД 2 по сравнению с одним лишь изменением образа жизни. Кроме того, лечение приводило к значимому и стойкому снижению таких сердечно-сосудистых факторов риска, как артериальное давление (АД) и уровень атерогенных фракций липидов, причем положительное влияние на липидный спектр обеспечивалось не только снижением массы тела, но и прямым, не зависящим от степени ее снижения влиянием препарата на всасывание холестерина [5]. Получены также данные о положительном влиянии орлистата на углеводный обмен: лечение препаратом приводит к уменьшению выраженности таких составляющих метаболического синдрома, как гипергликемия натощак, гиперинсулинемия и инсулинорезистентность. S. Heymsfield и соавт. [7] показали, что в группе пациентов, принимавших орлистат, нарушение толерантности к глюкозе с последующим развитием СД 2 регистрировалось вдвое реже, чем в группе получавших плацебо (3,0 и 7,6% соответственно). При этом число больных, у которых на фоне приема препарата углеводный обмен нормализовался, наоборот, оказалось значительно выше (71,6 и 49,1% соответственно).
Получены также данные о положительном влиянии орлистата на углеводный обмен: лечение препаратом приводит к уменьшению выраженности таких составляющих метаболического синдрома, как гипергликемия натощак, гиперинсулинемия и инсулинорезистентность. S. Heymsfield и соавт. [7] показали, что в группе пациентов, принимавших орлистат, нарушение толерантности к глюкозе с последующим развитием СД 2 регистрировалось вдвое реже, чем в группе получавших плацебо (3,0 и 7,6% соответственно). При этом число больных, у которых на фоне приема препарата углеводный обмен нормализовался, наоборот, оказалось значительно выше (71,6 и 49,1% соответственно).
Поскольку механизм действия орлистата заключается в ограничении всасывания жиров, его длительное применение потенциально может привести к дефициту жирорастворимых витаминов, в частности витамина 25(ОН)D, и, как следствие, к нарушению обмена кальция. В некоторых работах было показано, что у женщин в постменопаузе лечение ожирения орлистатом не меняет содержания 25(ОН)D, однако при более длительном применении препарата (12 мес) отмечалось значимое снижение содержания витамина [8, 9]. Таким образом, всем пациентам, которые получают лечение орлистатом, особенно женщинам в постменопаузе, рекомендуется дополнительный прием мультивитаминов, включая кальций и 25(ОН)D, причем орлистат и витамины не следует принимать одновременно.
Таким образом, всем пациентам, которые получают лечение орлистатом, особенно женщинам в постменопаузе, рекомендуется дополнительный прием мультивитаминов, включая кальций и 25(ОН)D, причем орлистат и витамины не следует принимать одновременно.
Орлистат повышает вероятность образования камней в желчном пузыре, поскольку торможение липолиза уменьшает высвобождение жирных кислот в просвет кишечника, что необходимо для стимуляции секреции холецистокинина и сокращения желчного пузыря. Поскольку орлистат ингибирует расщепление лишь 30% жиров, поступающих с пищей, рациональное потребление жиров не приводит к снижению моторики желчного пузыря.
Сибутрамин
Сибутрамин, препарат для лечения ожирения с двойным механизмом действия, является ингибитором обратного захвата серотонина, норадреналина и, в меньшей степени, дофамина в синапсах центральной нервной системы. Препарат усиливает и пролонгирует чувство насыщения, тем самым уменьшая количество потребляемой пищи. С другой стороны, сибутрамин увеличивает энергозатраты организма, что в совокупности приводит к отрицательному балансу энергии. Таким образом, препарат облегчает пациентам выполнение врачебных рекомендаций по питанию.
Таким образом, препарат облегчает пациентам выполнение врачебных рекомендаций по питанию.
На фоне приема сибутрамина 1/3 больных удается снизить вес более чем на 10% [6].
В качестве начальной дозы сибутрамин назначают по 10 мг утром, ежедневно, независимо от приема пищи. Если масса тела за первый месяц лечения снизилась менее чем на 2 кг, рекомендуется увеличить дозу до 15 мг при условии хорошей переносимости препарата. Если по прошествии следующего месяца масса тела уменьшилась менее чем на 2 кг, или за 3 мес приема менее чем на 5% от исходной, лечение считается неэффективным. Максимальный период терапии сибутрамином — 2 года. При наличии СД 2 лечение начинают сразу с 15 мг. Потеря менее 2 кг за первый месяц терапии не требует отмены препарата, поскольку больные с СД 2 медленнее снижают вес. При этом даже незначительное снижение массы тела сопровождается улучшением показателей углеводного обмена. Как показало исследование STORM, около 54% пациентов снизили массу тела более чем на 10% в течение 6 мес приема, и сниженная за указанный период масса тела сохранялась на протяжении 2 лет лечения. Положительно влияя на антропометрические параметры, сибутрамин оказывает благоприятный эффект в отношении метаболических нарушений. Его применение сопровождается уменьшением уровня триглицеридов на 20% и повышением уровня липопротеинов высокой плотности на 21%, что существенно снижает сердечно-сосудистый риск [10].
Положительно влияя на антропометрические параметры, сибутрамин оказывает благоприятный эффект в отношении метаболических нарушений. Его применение сопровождается уменьшением уровня триглицеридов на 20% и повышением уровня липопротеинов высокой плотности на 21%, что существенно снижает сердечно-сосудистый риск [10].
Учитывая, однако, такие возможные побочные эффекты препарата, как повышение АД на 1—3 мм рт.ст. и учащение пульса на 3—7 уд. в мин, назначать препарат пациентам с ожирением и часто сопутствующей ему АГ можно лишь после коррекции последней. Препарат нельзя назначать пациентам с неконтролируемой АГ, ишемической болезнью сердца, декомпенсированной сердечной недостаточностью, нарушением ритма сердца, цереброваскулярными заболеваниями (инсультом, транзиторными нарушениями мозгового кровообращения), тяжелыми поражениями печени и почек, а также при одновременном приеме или ранее, чем через 2 нед после отмены ингибиторов моноаминооксидазы или других препаратов, действующих на центральную нервную систему (в том числе антидепрессантов).
Такие побочные эффекты, как тошнота, потеря аппетита, запор, сухость во рту, изменение вкуса, бессонница, головная боль, возбуждение, потливость обычно слабо выражены, отмечаются лишь в начале лечения и, как правило, не требуют отмены терапии.
При лечении сибутрамином необходимо врачебное наблюдение. Контролировать АД и пульс следует у всех больных до начала лечения, далее с 1-го по 3-й мес лечения каждые 2 нед, с 4-го по 6-й мес — ежемесячно, с 6-го по 12-й мес — каждые 3 мес.
Препарат отменяют при учащении пульса более чем на 10 уд./мин, повышении АД более чем на 10 мм рт.ст., а также при АД >140/90 мм рт.ст. у лиц с ранее компенсированной АГ, при прогрессировании одышки, появлении болей в груди или отеков суставов.
Предиктором успешного снижения и долговременного удержания массы тела является потеря более 2 кг за первые месяцы лечения или более 5% от исходной массы за 3 мес. У женщин, особенно молодого возраста, успех лечения регистрируется чаще, чем у мужчин. Чем выше исходный ИМТ, тем более интенсивного снижения веса можно ожидать. Наличие же сопутствующих ожирению заболеваний предопределяет медленную потерю веса.
Чем выше исходный ИМТ, тем более интенсивного снижения веса можно ожидать. Наличие же сопутствующих ожирению заболеваний предопределяет медленную потерю веса.
Представляет интерес досрочно завершенное исследование SCOUT [11] — первое проспективное исследование связи между снижением массы тела при долгосрочной фармакотерапии ожирения (сибутрамином) и сердечно-сосудистыми исходами (сердечно-сосудистая смерть, стенокардия, инфаркт миокарда, инсульт). Результаты рандомизированного, двойного слепого плацебо-контролируемого исследования с включением 10 744 человек с избыточным весом или ожирением (средний возраст 63 года) в 300 центрах 17 стран мира показали, что пациенты с существующими сердечно-сосудистыми заболеваниями, длительно применявшие сибутрамин, имели повышенные риски нефатального инфаркта миокарда и нефатального инсульта, но не сердечно-сосудистых смертей или смертности от всех причин. Эти результаты привели к отзыву препарата сибутрамин на территории Европейского союза и США.
В России препарат в настоящее время не отозван; он остается одобренным средством терапии ожирения. С января 2008 г. сибутрамин входит в утвержденный правительством список сильнодействующих препаратов, что означает отпуск только по рецепту.
Лираглутид 3 мг
Доступность в нашей стране только двух препаратов для лечения ожирения с необходимостью строгого соблюдения показаний и противопоказаний к их назначению крайне ограничивала возможность терапии этого состояния. Весной 2016 г. в России был зарегистрирован первый аналог глюкагоноподобного пептида-1 (ГПП-1) для лечения ожирения — лираглутид в дозе 3 мг (Саксенда). До этого лираглутид в дозах 1,2 и 1,8 мг в день использовался под названием Виктоза для лечения СД 2. ГПП-1 представляет собой физиологический регулятор аппетита и потребления пищи. Лираглутид на уровне гипоталамуса активирует рецепторы ГПП-1, усиливая сигналы о насыщении и ослабляя сигналы о голоде, что способствует уменьшению массы тела. Кроме того, лираглутид стимулирует глюкозозависимую секрецию инсулина и уменьшает парадоксальную гиперглюкагонемию (характерную для пациентов с нарушениями углеводного обмена), а также способствует сохранению функционирующего пула ß-клеток.
Эффективность и безопасность лираглутида в дозе 3 мг в сутки при лечении пациентов с ожирением была исследована в серии рандомизированных двойных слепых, плацебо-контролируемых исследований, входивших в программу SCALE (the Satiety and Clinical Adiposity — Liraglutide Evidence in nondiabetic and diabetic individuals). Эта программа, охватившая более 5 000 пациентов, явилась той доказательной базой данных, которая позволила зарегистрировать препарат в США, Европе и России. Программа включала 4 исследования — «SCALE, ожирение и предиабет», «SCALE, диабет», «SCALE, поддержание массы тела» и «SCALE, апноэ во сне».
Исследование «SCALE, ожирение и предиабет» продолжительностью 56 нед проводилось на базе 191 клинического центра в 27 странах мира с участием 3731 пациента с ожирением или избыточной массой тела в сочетании с дислипидемией и/или АГ. В России участвовало 160 пациентов. Все пациенты были рандомизированы в соотношении 2:1 в группы, получавшие лираглутид 3 мг (n=2487) либо плацебо (n=1244) в качестве дополнения к диетотерапии и физическим нагрузкам. Равноправными конечными точками являлись изменение массы тела и доля пациентов, у которых масса тела снизилась на ≥5%. Через 56 нед среднее снижение массы тела в группе лираглутида составило 8,0±6,7% (8,4±7,3 кг) по сравнению с 2,6±5,7% (2,8±6,5 кг) в группе плацебо.
Равноправными конечными точками являлись изменение массы тела и доля пациентов, у которых масса тела снизилась на ≥5%. Через 56 нед среднее снижение массы тела в группе лираглутида составило 8,0±6,7% (8,4±7,3 кг) по сравнению с 2,6±5,7% (2,8±6,5 кг) в группе плацебо.
Снижение массы тела на 5% и более было достигнуто у 63,2% пациентов в группе лираглутида и у 27,1% пациентов в группе плацебо; снижение массы тела на 10% отмечалось, соответственно, у 33,1 и 10,6% больных (p<0,001). Распространенность предиабета среди пациентов с исходно установленным диагнозом через 56 нед в группе лираглутида снизилась в два раза (с 61,4 до 30,8%), тогда как в группе плацебо увеличилась (с 60,9 до 67,3%) [12]. Через 56 нед пациенты с исходным предиабетом продолжили участие в исследовании общей продолжительностью до 3 лет и были повторно рандомизированы в соотношении 2:1 для назначения лираглутида 3 мг (n=1505) или плацебо (n=749). За 3 года СД 2 был зарегистрирован у 26 (2%) человек, получавших лираглутид 3 мг, и у 46 (6%) — в группе плацебо. Кроме того, время до манифестации СД 2 у пациентов, получавших лираглутид, было в 2,7 раза больше, чем в группе плацебо, что свидетельствовало о существенном снижении риска развития СД 2 на фоне приема лираглутида — на 80% (ОШ=0,21; 95% ДИ 0,13—0,34). За 3 года снижение веса у пациентов, получавших лираглутид 3 мг и плацебо, составило соответственно 6,1 и 1,9% от исходного [13].
Кроме того, время до манифестации СД 2 у пациентов, получавших лираглутид, было в 2,7 раза больше, чем в группе плацебо, что свидетельствовало о существенном снижении риска развития СД 2 на фоне приема лираглутида — на 80% (ОШ=0,21; 95% ДИ 0,13—0,34). За 3 года снижение веса у пациентов, получавших лираглутид 3 мг и плацебо, составило соответственно 6,1 и 1,9% от исходного [13].
В исследовании «SCALE, ожирение и предиабет» оценивалась также динамика кардиометаболических факторов риска на фоне снижения веса. Через 56 нед терапии систолическое АД снизилось в группе лираглутида 3 мг на 4,2±12,2 мм рт.ст., что было значимо больше, чем в группе плацебо (1,5±12,4 мм рт.ст.). Кроме того, в группе лираглутида отмечалось более выраженное по сравнению с плацебо улучшение таких кардиометаболических параметров, как липидный спектр крови, уровень высокочувствительного С-реактивного протеина, ингибитора-1 активатора плазминогена и адипонектина.
В исследовании «SCALE, поддержание массы тела» длительностью 56 нед, проведенного на базе 36 исследовательских центров с участием 422 пациентов, оценивалась эффективность лираглутида 3 мг в поддержании массы тела после ее снижения с помощью низкокалорийной диеты у больных с ожирением или избыточной массой тела в сочетании с дислипидемией и/или АГ. В течение вводного периода длительностью от 4 до 12 нед проводили диетотерапию (суточный калораж 1200—1400 ккал) и рекомендовалось повышение физической активности (быстрая ходьба продолжительностью не менее 150 мин в нед). После вводного периода пациенты, добившиеся снижения массы тела на 5% и более, были рандомизированы в соотношении 1:1 для назначения лираглутида 3 мг или плацебо на срок 56 нед. На фоне применения лираглутида в дозе 3 мг дополнительное снижение массы тела составило в среднем 6,2% (0,2% на плацебо). Среди получавших лираглутид 3 мг доля участников, сохранивших достигнутое за вводный период снижение массы тела на 5% и более, была существенно выше (81,4%), чем в группе плацебо (48,9%). После завершения исследования на протяжении 12 нед в группе больных, получавших лираглутид 3 мг, сохранялось достигнутое снижение массы тела (на 4,1%), тогда как среди больных, получавших плацебо, наблюдалась прибавка веса (+0,3%) [14]. Таким образом была подтверждена эффективность лираглутида в дозе 3 мг 1 раз в сутки в комбинации с изменением образа жизни в отношении длительного поддержания клинически значимого снижения массы тела.
В течение вводного периода длительностью от 4 до 12 нед проводили диетотерапию (суточный калораж 1200—1400 ккал) и рекомендовалось повышение физической активности (быстрая ходьба продолжительностью не менее 150 мин в нед). После вводного периода пациенты, добившиеся снижения массы тела на 5% и более, были рандомизированы в соотношении 1:1 для назначения лираглутида 3 мг или плацебо на срок 56 нед. На фоне применения лираглутида в дозе 3 мг дополнительное снижение массы тела составило в среднем 6,2% (0,2% на плацебо). Среди получавших лираглутид 3 мг доля участников, сохранивших достигнутое за вводный период снижение массы тела на 5% и более, была существенно выше (81,4%), чем в группе плацебо (48,9%). После завершения исследования на протяжении 12 нед в группе больных, получавших лираглутид 3 мг, сохранялось достигнутое снижение массы тела (на 4,1%), тогда как среди больных, получавших плацебо, наблюдалась прибавка веса (+0,3%) [14]. Таким образом была подтверждена эффективность лираглутида в дозе 3 мг 1 раз в сутки в комбинации с изменением образа жизни в отношении длительного поддержания клинически значимого снижения массы тела. Кроме того, лираглутид 3 мг снижал некоторые факторы сердечно-сосудистого риска (окружность талии, уровень глюкозы плазмы натощак, АД и др.).
Кроме того, лираглутид 3 мг снижал некоторые факторы сердечно-сосудистого риска (окружность талии, уровень глюкозы плазмы натощак, АД и др.).
В исследовании «SCALE, диабет» длительностью 56 нед, проведенного на базе 126 клинических центров из 9 стран с участием 846 пациентов, оценивалась эффективность различных доз лираглутида (3 и 1,8 мг) в отношении снижения массы тела у больных СД 2. К моменту завершения исследования снижение массы тела составило 6,1% на дозе 3 мг, 4,7% — на дозе 1,8 мг, 1,9% — на плацебо. Число пациентов, достигших потери массы тела на 5% и более, также было существенно выше в группе пациентов, принимавших лираглутид в дозе 3 мг. Доля больных, достигших уровня HbA1c <7% на фоне терапии лираглутидом 3 мг, составила 69,2% (по сравнению с 27,2% — на плацебо) [15].
В исследование «SCALE, апноэ во сне» длительностью 32 нед, проведенного на базе 40 клинических центров с участием 359 пациентов с ожирением, страдавших обструктивным апноэ во сне умеренной или тяжелой степени, после рандомизации в соотношении 1:1 участникам назначали либо лираглутид 3 мг, либо плацебо. В основной группе наряду с более значительным снижением массы тела (на 5,7% от исходной в сравнении с 1,6% на плацебо), удалось добиться и более существенного снижения индекса апноэ/гипопноэ (–12,2 эпизодов/ч в сравнении с –6,1 эпизодов/ч на плацебо) [16].
В основной группе наряду с более значительным снижением массы тела (на 5,7% от исходной в сравнении с 1,6% на плацебо), удалось добиться и более существенного снижения индекса апноэ/гипопноэ (–12,2 эпизодов/ч в сравнении с –6,1 эпизодов/ч на плацебо) [16].
Таким образом, данные программы клинических исследований продемонстрировали высокую эффективность лираглутида в дозе 3 мг в отношении снижения массы тела и удержания достигнутых результатов у лиц с ожирением и избыточной массой тела, независимо от наличия у них СД 2 и других сопутствующих заболеваний. Это сопровождалось существенным снижением сердечно-сосудистого риска при хорошем профиле переносимости и безопасности.
Согласно инструкции, препарат вводится подкожно один раз в сутки в любое время, независимо от приема пищи, в область живота, бедра или плеча. Начальная доза составляет 0,6 мг в сутки. Доза увеличивается на 0,6 мг с интервалами не менее одной недели для улучшения желудочно-кишечной переносимости до достижения терапевтической дозы 3 мг в сутки. При отсутствии снижения массы тела за 12 нед на 5% от исходной лечение прекращают. Среди побочных эффектов отмечаются в первую очередь диспепсические явления (снижение аппетита, тошнота, рвота, запор, диарея), которые возникают, как правило, в первые недели лечения и в большинстве случаев имеют преходящий характер, не требуя отмены терапии.
При отсутствии снижения массы тела за 12 нед на 5% от исходной лечение прекращают. Среди побочных эффектов отмечаются в первую очередь диспепсические явления (снижение аппетита, тошнота, рвота, запор, диарея), которые возникают, как правило, в первые недели лечения и в большинстве случаев имеют преходящий характер, не требуя отмены терапии.
Поскольку лираглутид у грызунов может индуцировать медуллярный рак щитовидной железы, препарат противопоказан больным с медуллярным раком щитовидной железы в анамнезе, а также при синдроме множественной эндокринной неоплазии 2-го типа. При ожирении и в случаях выраженного снижения массы тела увеличивается концентрация холестерина в желчи и снижается сократительная функция желчного пузыря (что увеличивает риск образования камней в желчном пузыре), пациентам с желчнокаменной болезнью в анамнезе лираглутид необходимо назначать с осторожностью.
Препараты, не зарегистрированные на российском фармацевтическом рынке
В Европе и США используются и другие препараты для лечения ожирения, которые в настоящий момент в России не зарегистрированы.
Лоркасерин — агонист рецепторов 5HT2c серотонина, снижающий аппетит. Препарат разрешен к применению в США, отклонен в странах Евросоюза. Эффективность и безопасность препарата оценивалась в исследованиях BLOOM, BLOOM-DM и BLOSSOM, показавших снижение массы тела через год лечения в среднем на 3,6% и улучшение метаболических показателей. Статистически значимых различий в частоте сердечной валвулопатии между группами плацебо и лоркасерина выявлено не было. Наиболее частыми побочными эффектами лоркасерина были снижение зрения, головокружение, сонливость, головная боль, желудочно-кишечные расстройства. Результаты продолжающегося исследования сердечно-сосудистых исходов CAMELLIA TIMI 61 позволят определить роль лоркасерина в первичной профилактике СД 2 у лиц с избыточным весом или ожирением и возможность использования этого препарата при высоком сердечно-сосудистом риске [17].
Сочетание фентермина и топирамата применяют для достижения эффекта при меньшей токсичности препаратов. Фентермин, будучи атипичным аналогом амфетамина и симпатомиметиком, подавляет аппетит на уровне ЦНС. Топирамат — противосудорожный препарат, механизм влияния которого на аппетит может включать уменьшение активности карбангидразы или модификацию эффекта гаммааминомасляной кислоты. Эффективность и безопасность комбинированного препарата оценивали в исследованиях EQUIP, CONQUER, SEQUEL и EQUATE. Средняя потеря массы тела колебалась в пределах 6,6—8,6% за 1 год. Неблагоприятными эффекты включали сухость во рту, запор, бессонницу, сердцебиение, головокружение, парестезии, нарушения внимания, метаболический ацидоз и образование камней в почках, головную боль, искажение вкуса, алопецию и гипокалиемию. Лечение противопоказано во время беременности из-за возможного тератогенного эффекта [17].
Топирамат — противосудорожный препарат, механизм влияния которого на аппетит может включать уменьшение активности карбангидразы или модификацию эффекта гаммааминомасляной кислоты. Эффективность и безопасность комбинированного препарата оценивали в исследованиях EQUIP, CONQUER, SEQUEL и EQUATE. Средняя потеря массы тела колебалась в пределах 6,6—8,6% за 1 год. Неблагоприятными эффекты включали сухость во рту, запор, бессонницу, сердцебиение, головокружение, парестезии, нарушения внимания, метаболический ацидоз и образование камней в почках, головную боль, искажение вкуса, алопецию и гипокалиемию. Лечение противопоказано во время беременности из-за возможного тератогенного эффекта [17].
В комбинации бупропиона с налтрексоном первое средство является селективным ингибитором обратного захвата норадреналина и дофамина, применяемым в лечении депрессии и никотиновой зависимости. Налтрексон — антагонист опиоидных рецепторов — широко используется в лечении алкогольной и опиатной зависимости. Анорексигенный эффект комбинации бупропион/налтрексон может быть следствием активации нейронов в дугообразном ядре гипоталамуса и выделения α-меланоцитстимулирующего гормона. Эффективность и безопасность препарата оценивали в исследованиях COR-I, COR-II, COR-BMOD и COR-DM. Средняя потеря массы тела за 1 год терапии составила 4,8%. Самыми частыми побочными явлениями при приеме комбинированного препарата были тошнота, рвота, головная боль, головокружение, бессонница [17].
Анорексигенный эффект комбинации бупропион/налтрексон может быть следствием активации нейронов в дугообразном ядре гипоталамуса и выделения α-меланоцитстимулирующего гормона. Эффективность и безопасность препарата оценивали в исследованиях COR-I, COR-II, COR-BMOD и COR-DM. Средняя потеря массы тела за 1 год терапии составила 4,8%. Самыми частыми побочными явлениями при приеме комбинированного препарата были тошнота, рвота, головная боль, головокружение, бессонница [17].
Заключение
Гетерогенность ожирения и наличие ассоциированных с ним заболеваний требуют персонализации подхода к лечению. Важнейшими задачами, наряду со снижением массы тела, являются профилактика развития и прогрессирования заболеваний, ассоциированных с ожирением, коррекция уже имеющихся метаболических нарушений. Поэтому при определении тактики лечения должны учитываться не только степень ожирения, но и возраст пациента, его психологические особенности, спектр сопутствующих заболеваний, репродуктивная функция, семейный анамнез. Успешным может считаться лечение, приводящее к улучшению состояния здоровья пациента в целом. Поскольку ожирение является хроническим заболеванием с частыми рецидивами, лечение должно быть длительным, нередко пожизненным. Пополнение арсенала средств фармакотерапии ожирения новыми препаратами, например, лираглутидом в дозе 3 мг (Саксенда), принципиально отличающимися механизмом действия от двух используемых в Российской Федерации (орлистата и сибутрамина) и обладающими приемлемым профилем безопасности и переносимости, даже при длительном применении, существенно расширяет возможности лечения пациентов с ожирением, в том числе морбидным и осложненным, а накопление клинического опыта позволит всесторонне оценить сферы применения таких препаратов и их вероятные плейотропные эффекты.
Успешным может считаться лечение, приводящее к улучшению состояния здоровья пациента в целом. Поскольку ожирение является хроническим заболеванием с частыми рецидивами, лечение должно быть длительным, нередко пожизненным. Пополнение арсенала средств фармакотерапии ожирения новыми препаратами, например, лираглутидом в дозе 3 мг (Саксенда), принципиально отличающимися механизмом действия от двух используемых в Российской Федерации (орлистата и сибутрамина) и обладающими приемлемым профилем безопасности и переносимости, даже при длительном применении, существенно расширяет возможности лечения пациентов с ожирением, в том числе морбидным и осложненным, а накопление клинического опыта позволит всесторонне оценить сферы применения таких препаратов и их вероятные плейотропные эффекты.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Е. А. Трошина — разработка концепции рукописи, анализ зарубежной и российской литературы, редактирование рукописи; Е.В. Ершова — анализ зарубежной и российской литературы, написание черновика рукописи, подготовка окончательного варианта рукописи.
А. Трошина — разработка концепции рукописи, анализ зарубежной и российской литературы, редактирование рукописи; Е.В. Ершова — анализ зарубежной и российской литературы, написание черновика рукописи, подготовка окончательного варианта рукописи.
Сибутрамин в лечении ожирения (по материалам конгресса «Человек и лекарство». Москва, апрель 2001 г.) | Бутрова С.А.
За последние годы в подходах к терапии ожирения произошли значительные изменения. Пересмотрены сами принципы лечения этого распространенного хронического заболевания, которое по определению должно быть пожизненным. Показано, что нецелесообразно в погоне за идеальными формами тела стараться любыми способами и как можно скорее избавиться от излишнего веса.
Лечение ожирения в первую очередь необходимо направить на предупреждение заболеваемости и увеличение продолжительности жизни пациентов. То есть нужно стремиться к достижению так называемой здоровой массы тела, именно той массы, при которой происходит улучшение или нормализация метаболических нарушений, которую пациент может относительно легко достичь и удержать в течение длительного времени. На сегодняшний день считается клинически значимой и приносящей реальную пользу для здоровья снижение массы тела на 5–10% в течение 4–6 месяцев. При таком подходе, как правило, потеря веса составляет 0,5 –1,0 кг в неделю и преимущественно за счет жировой ткани, реже происходят рецидивы. Причем такое снижение массы тела не требует резкого изменения пищевых привычек и образа жизни пациента. Систематичность наблюдения – не менее важный принцип лечения, особенно на этапе поддержания массы тела.
На сегодняшний день считается клинически значимой и приносящей реальную пользу для здоровья снижение массы тела на 5–10% в течение 4–6 месяцев. При таком подходе, как правило, потеря веса составляет 0,5 –1,0 кг в неделю и преимущественно за счет жировой ткани, реже происходят рецидивы. Причем такое снижение массы тела не требует резкого изменения пищевых привычек и образа жизни пациента. Систематичность наблюдения – не менее важный принцип лечения, особенно на этапе поддержания массы тела.
 Следование пациентом тем рекомендациям по изменению образа жизни и характера питания, которые дал ему врач, обычно со временем ухудшается. В этой связи в терапии ожирения большая роль отводится специальному обучению пациентов, направленному на повышение мотивации и формирование их активной позиции в лечении. Ожирение характеризуется избыточным, патологическим накоплением жировой ткани в организме. На сегодняшний день многие рассматривают ожирение, как состояние дисфункции жировой ткани.
Следование пациентом тем рекомендациям по изменению образа жизни и характера питания, которые дал ему врач, обычно со временем ухудшается. В этой связи в терапии ожирения большая роль отводится специальному обучению пациентов, направленному на повышение мотивации и формирование их активной позиции в лечении. Ожирение характеризуется избыточным, патологическим накоплением жировой ткани в организме. На сегодняшний день многие рассматривают ожирение, как состояние дисфункции жировой ткани. В последние годы показано, что жировая ткань – не только “депо” энергии и место, где происходит метаболизм стероидных гормонов, но и активный эндокринный орган. Установлено, что жировая ткань выделяет более 20 биологически активных веществ, которые участвуют в регуляции потребления пищи, расхода энергии, нейроэндокринных функций, процессов метаболизма. Очевидным доказательством того, что жировая ткань имеет прямое отношение к развитию всех тех нарушений, которые имеют место при ожирении, является тот факт, что при снижении массы тела улучшаются показатели метаболизма и уменьшается вероятность развития тяжелых сопряженных заболеваний.
Ожирение – это результат длительно существующего положительного энергетического баланса, когда поступление энергии с пищей превышает энергетические траты организма. Поэтому все методы лечения ожирения, как немедикаментозные, так и медикаментозные, направлены на уменьшение поступления энергии с пищей и/или увеличение расхода энергии.
Основа лечения ожирения – сбалансированное рациональное питание: гипокалорийное в фазе снижения и эукалорийное на этапе поддержания массы тела. Это регулярный прием пищи с правильным распределением калорийности в течение суток, и, разумеется, ограничение поступления жиров. Жир является наиболее калорийной составляющей пищи, обладает низкой насыщающей способностью и плохо метаболизируется в организме. В последние годы также показано, что избыточное поступление жиров с пищей способствует развитию инсулинорезистентности. Доля жиров в рационе должна составлять не более 30%, углеводов – 55% суточной калорийности, ограничиваются продукты с высоким гликемическим индексом.
Целесообразность использования фармакотерапии в лечении ожирения в настоящее время не вызывает сомнений. При применении только немедикаментозных методов лечения нередко не удается достичь желаемых результатов. Медикаментозная терапия при ожирении нужна так же, как при любом другом хроническом заболевании. В принципе любой пациент с ожирением имеет право на медикаментозную поддержку, другое дело – пока такой поддержки мы ему предоставить не можем. Так, если для лечения артериальной гипертонии в распоряжении врача имеется очень широкий арсенал антигипертензивных средств, то для лечения ожирения в настоящее время сертифицировано только 2 препарата. Поэтому вопрос о назначении фармакологического лечения в каждом случае решается индивидуально.
Одним пациентам предпочтительнее назначать в период поддержания массы тела, другим – при нарастании массы тела, а некоторым пациентам медикаментозное лечение следует проводить в самом начале.
Фармакотерапия прежде всего необходима для повышения эффективности немедикаментозных методов лечения. Применение медикаментозной терапии облегчает соблюдение рекомендаций по питанию, способствует более быстрому и эффективному снижению массы тела, а также помогает удержать достигнутую массу тела и предотвратить развитие рецидива. Препараты для лечения ожирения обязательно должны иметь известный механизм действия, быть безопасными при длительном применении и иметь лишь слабые, преходящие побочные эффекты.
Медикаментозная терапия назначается больным с индексом массы тела (ИМТ) > 30 и с ИМТ > 27 кг/м2 – при наличии абдоминального ожирения, либо факторов риска или уже развившихся сопряженных заболеваний, а также при наследственной предрасположенности к ним.
Фармакотерапия не назначается детям до 16 лет, т. к. не проводились соответствующие исследования по безопасности применения препаратов для лечения ожирения у детей. Не применяются фармакопрепараты при беременности и лактации.
к. не проводились соответствующие исследования по безопасности применения препаратов для лечения ожирения у детей. Не применяются фармакопрепараты при беременности и лактации.
Современным препаратом центрального механизма действия нового поколения для лечения ожирения является сибутрамин (Меридиа, “Knoll AG”, Германия). Фармакологическое действие препарата состоит в селективном торможении обратного захвата нейромедиаторов – серотонина и норадреналина из синаптической щели. Вследствие такого двойного действия быстро достигается чувство насыщения и снижается количество потребляемой пищи, при этом вследствие усиления термогенеза увеличивается расход энергии. То есть сибутрамин действует на обе стороны энергетического баланса, способствуя снижению массы тела. Препарат выгодно отличается по механизму действия от препаратов группы амфетаминов и фенфлурамина: не влияет на допаминергическую систему и на высвобождение моноаминов из нервных окончаний.
В крупных многоцентровых плацебоконтролируемых исследованиях эффективности применения препарата, включавших 6000 пациентов, клинически значимое снижение массы тела (і5%) было достигнуто в течение года у 82% пациентов. Снижение массы тела сопровождалось положительными сдвигами со стороны липидного и углеводного обменов. Была отмечена безопасность и хорошая переносимость сибутрамина. Побочные реакции носили преходящий характер и были слабо выражены: сухость во рту, запоры, отсутствие аппетита, бессонница, повышение систолического и диастолического давления в среднем на 2–3 мм рт.ст., увеличение числа сердечных сокращений на 3–5 уд. в мин.
Снижение массы тела сопровождалось положительными сдвигами со стороны липидного и углеводного обменов. Была отмечена безопасность и хорошая переносимость сибутрамина. Побочные реакции носили преходящий характер и были слабо выражены: сухость во рту, запоры, отсутствие аппетита, бессонница, повышение систолического и диастолического давления в среднем на 2–3 мм рт.ст., увеличение числа сердечных сокращений на 3–5 уд. в мин.
Недавно были опубликованы результаты длительного мультицентрового (8 европейских медицинских центров) рандомизированного плацебоконтролированного исследования клинической эффективности применения сибутрамина с целью снижения и поддержания массы тела в течение в течение 2 лет (STORM – Sibutramine Trial in Obesity Reduction and Maintenance).
В исследование были включены пациенты (n=605) в возрасте 17–65 лет с ИМТ 30–45 кг/м2. Сибутрамин назначался в суточной дозе 10 мг с рекомендациями по соблюдению умеренно гипокалорийного питания и увеличению физической активности.
Во вторую фазу исследования (18 месяцев) – стадия поддержания массы тела – были включены пациенты, снизившие массу тела > 5% (n=467). Пациенты были рандомизированы в соотношении 3:1 для приема препарата сибутрамин или плацебо, соответственно. Рекомендации по соблюдению диеты и выполнению физических нагрузок сохранялись в обеих группах. Дозу препарата увеличивали до 15 мг. Если через 6 месяцев отмечалось увеличение массы тела более чем на 1 кг, при продолжающемся увеличении массы тела суточную дозу сибутрамина увеличивали до 20 мг. К окончанию исследования в группе сибутрамина 69% пациентов сохраняли снижение массы тела на 5% от исходной, 46% удерживали 10%-ное снижение массы тела и 27% удерживали достигнутую в фазе снижения массу тела. Снижение массы тела составило 10,2 кг.
У больных с ожирением и дислипидемией на фоне лечения сибутрамином отмечалось снижение уровня общего холестерина (в среднем на 13,5%), триглицеридов (на 14,7%), повышение уровня ХС ЛПВП (на 21%). Снижались также уровни инсулина и С–пептида (на 14,9 и 15,4%, соответственно). Из 51 пациента с артериальной гипертензией, участвовавших в исследовании, 31 принимали сибутрамин в течение 2 лет.
Открытое исследование эффективности и переносимости сибутрамина проведено в 8 российских клинических центрах. В течение 12 недель 160 пациентов с ожирением (ИМТ 27,7–50 кг/м2) получали препарат по 10–15 мг/сут на фоне умеренно гипокалорийного питания и увеличения физической активности. Среди этих пациентов 10 обследованных имели сахарный диабет 2 типа: 9 получали таблетированные сахароснижающие препараты, 1 – инсулинотерапию.
У 12 больных зарегистрирована артериальная гипертония, 9 из них получали антигипертензивную терапию. В результате лечения снижение массы тела > 5% от исходной было достигнуто у 88,1% больных, в том числе і10% – у 25%. В среднем масса тела снизилась на 10,91±2,12 кг. Не ответили на лечение 9 больных, у 10 снижение массы тела составило < 5%. Окружность талии (ОТ) уменьшилась в среднем на 6,42±0,17 см. Снижение массы тела и висцеральной жировой ткани (по показателю ОТ) сопровождалось улучшением показателей липидного обмена: снижением уровней общего холестерина на 5,4%, ХС ЛПНП на 4,5% (табл. 1). У 35 пациентов с гиперхолестеринемией уровень общего холестерина нормализовался (5,7±0,34 и 4,4±0,41 ммоль/л, соответственно). У больных ожирением и сахарным диабетом 2 типа масса тела уменьшилась в среднем на 6,78±3,42 кг (6,9%), ОТ – на 6,25±2,11 см. Нормализовались показатели углеводного обмена: содержание глюкозы плазмы натощак снизилось на 22,6%, уровень HbA1c – на 21,7%. Наблюдались положительные изменения показателей липидного обмена: нормализовались уровни триглицеридов и общего холестерина, уменьшилось содержание ХС ЛПНП (табл. 2). Существенных изменений АД и частоты сердечных сокращений отмечено не было.
В среднем масса тела снизилась на 10,91±2,12 кг. Не ответили на лечение 9 больных, у 10 снижение массы тела составило < 5%. Окружность талии (ОТ) уменьшилась в среднем на 6,42±0,17 см. Снижение массы тела и висцеральной жировой ткани (по показателю ОТ) сопровождалось улучшением показателей липидного обмена: снижением уровней общего холестерина на 5,4%, ХС ЛПНП на 4,5% (табл. 1). У 35 пациентов с гиперхолестеринемией уровень общего холестерина нормализовался (5,7±0,34 и 4,4±0,41 ммоль/л, соответственно). У больных ожирением и сахарным диабетом 2 типа масса тела уменьшилась в среднем на 6,78±3,42 кг (6,9%), ОТ – на 6,25±2,11 см. Нормализовались показатели углеводного обмена: содержание глюкозы плазмы натощак снизилось на 22,6%, уровень HbA1c – на 21,7%. Наблюдались положительные изменения показателей липидного обмена: нормализовались уровни триглицеридов и общего холестерина, уменьшилось содержание ХС ЛПНП (табл. 2). Существенных изменений АД и частоты сердечных сокращений отмечено не было. У 12 больных артериальной гипертонией исходное систолическое АД равнялось 135,22±3,48 мм рт.ст., диастолическое – 85,4±7,8 мм рт.ст. На фоне лечения значимых изменений систолического и диастолического АД отмечено не было (133,31±3,87 и 86,7±7,9 мм рт.ст., соответственно). Изменений антигипертензивной терапии не требовалось. Переносимость препарата была хорошей, лишь у 5,6% больных отмечались преходящие легко выраженные нежелательные явления (сухость во рту, запоры), исчезавшие в течение первых 2–3 недель лечения.
У 12 больных артериальной гипертонией исходное систолическое АД равнялось 135,22±3,48 мм рт.ст., диастолическое – 85,4±7,8 мм рт.ст. На фоне лечения значимых изменений систолического и диастолического АД отмечено не было (133,31±3,87 и 86,7±7,9 мм рт.ст., соответственно). Изменений антигипертензивной терапии не требовалось. Переносимость препарата была хорошей, лишь у 5,6% больных отмечались преходящие легко выраженные нежелательные явления (сухость во рту, запоры), исчезавшие в течение первых 2–3 недель лечения.
Просмотреть таблицу 2
Сибутрамин также способствовал выработке правильных привычек питания и облегчал пациентам соблюдение рекомендаций по питанию: отмечалось сокращение объема потребляемой пищи, снижалась частота незапланированных приемов пищи, исчезала потребность в вечерних приемах пищи.
Таким образом, включение сибутрамина (Меридиа) в комплексное лечение больных ожирением позволяет эффективно снижать и длительно поддерживать массу тела, осуществлять компенсацию метаболических нарушений и улучшить ближайший и отдаленный прогноз больных.
Сибутрамин –
Меридиа (торговое название)
(Knoll AG)
Сибутрамин – Медицинская информационная библиотека
Предостережение: производитель этого препарата удаляет этот продукт с рынка США. Если в настоящее время у вас есть рецепт на это лекарство, вы должны немедленно поговорить со своим врачом, прежде чем вносить изменения в план лечения.
Сибутрамин используется для лечения ожирения, включая снижение массы тела и поддержание потери массы тела, и его следует использовать в сочетании с диетой с пониженной калорийностью.
Распространенные торговые марки:
MeridiaКраткое описание взаимодействий с витаминами, травами и продуктами питания
Что такое питательные взаимодействия
Виды взаимодействий: Выгодный неблагоприятный Чек
Восполняет истощенные питательные вещества
нет
Снижение побочных эффектов
нет
Вспомогательная медицина
нет
Снижает эффективность
нет
Потенциальное негативное взаимодействие
- 5-ПВТ
Аминокислоты L-триптофан и 5-гидрокситриптофан (5-HTP) иногда используются для лечения психической депрессии.
 Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP.
Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP. Одним из побочных эффектов сибутрамина является высокое кровяное давление. Эфедра, трава, которая до 2004 года использовалась в средствах от простуды и продуктах для похудения, содержит эфедрин, который также может повышать кровяное давление. Хотя ни в одном исследовании не изучалось, может ли прием сибутрамина вместе с эфедрой вызвать неблагоприятное взаимодействие, имеющиеся в настоящее время данные свидетельствуют о том, что эту комбинацию следует использовать с осторожностью.
- L-триптофан
Аминокислоты L-триптофан и 5-гидрокситриптофан (5-HTP) иногда используются для лечения психической депрессии.
 Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP.
Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP.
Требуется объяснение
нет
Таблица взаимодействий между лекарственными средствами и питательными веществами может не включать все возможные взаимодействия. Прием лекарств во время еды, натощак или с алкоголем может повлиять на их действие. Для получения подробной информации обратитесь к информации об упаковке производителя, поскольку она не включена в эту таблицу. Если вы принимаете лекарства, всегда обсуждайте потенциальные риски и преимущества добавления новой добавки со своим врачом или фармацевтом.
- Начало страницы
Следующий раздел:
Сибутрамин как причина внезапной сердечной смерти
На этой странице Сибутрамин был отозван с рынка США из-за связи с неблагоприятными сердечно-сосудистыми исходами, особенно у пациентов с ранее существовавшими заболеваниями сердца. Тем не менее, постоянное присутствие сибутрамина в растительных препаратах является проблемой для общественной безопасности. Результаты. Мы сообщаем о случае пациента без признаков предыдущей ишемической болезни сердца, у которого развился острый коронарный синдром без подъема сегмента ST (NSTE-ACS). Срочная коронарная катетеризация показала необструктивные коронарные артерии. Однако пациент неожиданно скончался в течение 24 часов после госпитализации. Пациент отрицал токсические привычки, но принимал безрецептурные травяные добавки для похудения. Было проведено полное вскрытие, которое показало токсикологический анализ сибутрамина.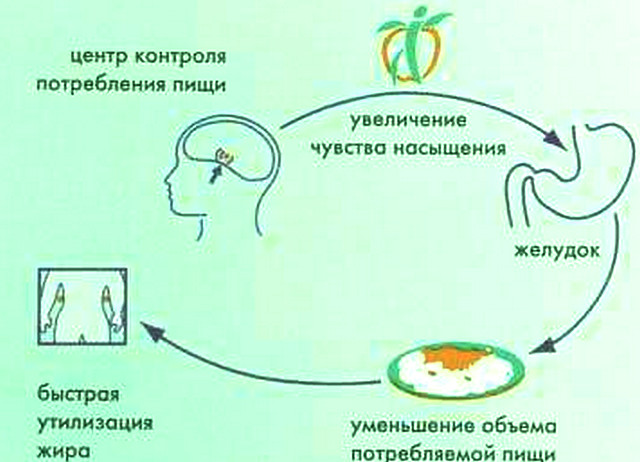 Больной умер в результате осложнений острой непреднамеренной интоксикации сибутрамином. Заключение и актуальность. Это первый случай в литературе, показывающий связь сибутрамина с внезапной сердечной смертью у пациентов без предшествующего сердечного анамнеза. Продолжающееся присутствие сибутрамина в некоторых безрецептурных препаратах для похудения является очень серьезной проблемой общественного здравоохранения.
Больной умер в результате осложнений острой непреднамеренной интоксикации сибутрамином. Заключение и актуальность. Это первый случай в литературе, показывающий связь сибутрамина с внезапной сердечной смертью у пациентов без предшествующего сердечного анамнеза. Продолжающееся присутствие сибутрамина в некоторых безрецептурных препаратах для похудения является очень серьезной проблемой общественного здравоохранения.
1. Введение
Ожирение является одним из поддающихся изменению факторов сердечно-сосудистого риска, и его заболеваемость с годами увеличилась в геометрической прогрессии. Сибутрамин представляет собой комбинированный ингибитор обратного захвата норадреналина и серотонина, используемый для снижения аппетита и снижения веса в сочетании с диетой и физическими упражнениями [1]. Первоначально считалось, что при суточной дозе 10–20 мг он обладает отличным профилем безопасности [1, 2]. Однако исследование сибутрамина для сердечно-сосудистых исходов (SCOUT) показало, что он имеет неблагоприятные сердечно-сосудистые исходы, особенно у пациентов с ранее существовавшим заболеванием сердца [3]. На основании этого отчета сибутрамин был отозван с рынка США после рекомендаций Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в октябре 2010 года. лекарства, у которых впоследствии развился острый коронарный синдром без подъема сегмента ST (NSTE-ACS) и внезапная сердечная смерть.
На основании этого отчета сибутрамин был отозван с рынка США после рекомендаций Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в октябре 2010 года. лекарства, у которых впоследствии развился острый коронарный синдром без подъема сегмента ST (NSTE-ACS) и внезапная сердечная смерть.
2. Случай
59-летняя латиноамериканка поступила в отделение неотложной помощи с жалобами на боли в животе, тошноту и рвоту, которые начались рано утром в день обращения. Она была сонная, но возбудимая. Она отрицала какую-либо боль в груди, одышку, лихорадку, кашель или головную боль. При дальнейшем допросе она отрицала какие-либо поездки или контакты с больными — отсутствие курения, наркотиков или чрезмерного употребления алкоголя. Лекарства пациента включали беназеприл, кальций, алендроновую кислоту и «травяную добавку с экстрактом томатов» для снижения веса. Накануне вечером она ела овощной суп перед сном и до дня презентации, по-видимому, чувствовала себя хорошо.
При осмотре у нее отсутствовала лихорадка с нерегулярной нерегулярной частотой пульса 60 в минуту, артериальным давлением 130/80 мм рт. ст., частотой дыхания 16 в минуту и насыщением кислородом 90% при 28% кислородная добавка. Общий анализ крови показал лейкоцитоз 23,4 кл/дл. Рентгенограмма грудной клетки была нормальной. Электрокардиограмма (ЭКГ) показала нормальный синусовый ритм с подъемом сегмента ST в отведении aVR и депрессией сегмента ST в нескольких отведениях с атриовентрикулярной (АВ) блокадой высокой степени (рис. 1). Эхокардиограмма показала нормальную функцию и размер левого желудочка, без нарушений движения стенки. Сердечные ферменты, тропонин Т и креатининкиназа были повышены, что привело к диагнозу ОКСбпST. Однако катетеризация сердца показала только 50% стеноз проксимального отдела левой передней нисходящей артерии, что не могло объяснить повышенный уровень сердечных ферментов и изменения на ЭКГ (рис. 2(а) и 2(б)). Впоследствии она была переведена в отделение кардиореанимации (CCU). В реанимации у больного тахипноэ с ЧСС 18-22 в мин, сатурация кислородом 9.2-94% на 2 литра кислорода, с колеблющимся психическим статусом. Учитывая повышенное количество лейкоцитов 34,9 клеток/дл при повторном общем анализе крови, было начато лечение антибиотиками широкого спектра действия (ванкомицин, пиперациллин-тазобактам и метронидазол). Компьютерная томография (КТ) головы была нормальной, а КТ брюшной полости, которая также включала основания легких, показала двустороннюю консолидацию нижних долей воздушного пространства, возможно, пневмонию и нормальные результаты при сканировании брюшной полости. Примерно через 14 часов после поступления в больницу у нее развился эпизод желудочковой тахикардии, который спонтанно вернулся к ее обычному ритму. Позже у нее развилась брадикардия и асистолия. Больную не удалось реанимировать, и она скончалась через 15 часов после поступления в больницу. Из-за необъяснимой смерти в течение 24 часов после госпитализации было проведено полное вскрытие.
В реанимации у больного тахипноэ с ЧСС 18-22 в мин, сатурация кислородом 9.2-94% на 2 литра кислорода, с колеблющимся психическим статусом. Учитывая повышенное количество лейкоцитов 34,9 клеток/дл при повторном общем анализе крови, было начато лечение антибиотиками широкого спектра действия (ванкомицин, пиперациллин-тазобактам и метронидазол). Компьютерная томография (КТ) головы была нормальной, а КТ брюшной полости, которая также включала основания легких, показала двустороннюю консолидацию нижних долей воздушного пространства, возможно, пневмонию и нормальные результаты при сканировании брюшной полости. Примерно через 14 часов после поступления в больницу у нее развился эпизод желудочковой тахикардии, который спонтанно вернулся к ее обычному ритму. Позже у нее развилась брадикардия и асистолия. Больную не удалось реанимировать, и она скончалась через 15 часов после поступления в больницу. Из-за необъяснимой смерти в течение 24 часов после госпитализации было проведено полное вскрытие. При вскрытии не было обнаружено признаков легочной эмболии или острого инфаркта миокарда. Однако ее судебно-медицинский токсикологический скрининг показал уровень сибутрамина 0,27 нг/мл, а его метаболизированных форм десметилсибутрамина и дидесметилсибутрамина — 0,59.нг/мл и 0,44 нг/мл соответственно. Причина смерти определена как «Осложнения острой интоксикации сибутрамином».
При вскрытии не было обнаружено признаков легочной эмболии или острого инфаркта миокарда. Однако ее судебно-медицинский токсикологический скрининг показал уровень сибутрамина 0,27 нг/мл, а его метаболизированных форм десметилсибутрамина и дидесметилсибутрамина — 0,59.нг/мл и 0,44 нг/мл соответственно. Причина смерти определена как «Осложнения острой интоксикации сибутрамином».
3. Обсуждение
Сибутрамин представляет собой комбинированный ингибитор обратного захвата норадреналина и серотонина, используемый в качестве средства против ожирения для снижения аппетита и снижения веса в сочетании с диетой и физическими упражнениями [1]. FDA одобрило его в 1997 году в США. Первоначально он показал хороший профиль безопасности [2]. Было показано, что он улучшает резистентность к инсулину, метаболизм глюкозы, дислипидемию и маркеры воспаления, что привело к гипотезе о том, что он может обладать антиатерогенными свойствами [1]. Однако он также оказывает периферическое симпатомиметическое действие, которое вызывает умеренное увеличение частоты сердечных сокращений и ослабляет снижение АД, связанное с потерей массы тела, или даже незначительно повышает АД [1, 4]. Было также показано, что он удлиняет интервал QT, что потенциально может увеличить риск сердечных аритмий [1].
Было также показано, что он удлиняет интервал QT, что потенциально может увеличить риск сердечных аритмий [1].
У нашего пациента был ОКСбпST, при коронарной ангиографии которого не было выявлено никакого поражения. О подобном представлении сообщалось в предыдущих отчетах о клинических случаях [5-7]. Во всех случаях, кроме одного случая [8], на коронарной ангиограмме не было обнаружено поражения коронарных артерий. Во всех описаниях случаев [5–8] пациенты имели избыточный вес, но не имели сопутствующих заболеваний, включая известное заболевание сердца. Однако в рандомизированных исследованиях сибутрамин был связан с высоким риском сердечно-сосудистых событий только у пациентов с известными заболеваниями сердца или с высоким риском из-за сопутствующих заболеваний [3]. Возможным объяснением вышеуказанного проявления может быть спазм коронарных артерий, что вполне вероятно, учитывая симпатомиметические эффекты сибутрамина.
Нам не удалось найти ни одного сообщения о случаях, прямо связывающих сибутрамин с внезапной сердечной смертью. Наш пациент умер в течение 15 часов после поступления и имел один эпизод желудочковой тахикардии, который вернулся к нормальному синусовому ритму. Позднее перед смертью у больного отмечалась брадикардия и гипоксия. Проведенное вскрытие не показало ничего, что могло бы объяснить причину смерти. Однако токсикологические исследования обнаружили значительные уровни сибутрамина и его метаболитов десметилсибутрамина и дидесметилсибутрамина. Согласно протоколу вскрытия, причина смерти определена как «Осложнения острой интоксикации сибутрамином».
Наш пациент умер в течение 15 часов после поступления и имел один эпизод желудочковой тахикардии, который вернулся к нормальному синусовому ритму. Позднее перед смертью у больного отмечалась брадикардия и гипоксия. Проведенное вскрытие не показало ничего, что могло бы объяснить причину смерти. Однако токсикологические исследования обнаружили значительные уровни сибутрамина и его метаболитов десметилсибутрамина и дидесметилсибутрамина. Согласно протоколу вскрытия, причина смерти определена как «Осложнения острой интоксикации сибутрамином».
С 2002 г. у пациентов, получавших сибутрамин, было зарегистрировано несколько нежелательных явлений со стороны сердечно-сосудистой системы (гипертензия, тахикардия, аритмии и инфаркт миокарда). Это привело к исследованию SCOUT, в котором оценивалось долгосрочное влияние лечения сибутрамином в сочетании с диетой и физическими упражнениями на частоту сердечно-сосудистых событий и смерти от сердечно-сосудистых заболеваний среди субъектов с высоким сердечно-сосудистым риском [3]. Он показал, что у пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями, получающих длительное лечение сибутрамином, был повышен риск нефатального инфаркта миокарда и нефатального инсульта, но не смерти от сердечно-сосудистых заболеваний или смерти от любой причины [3]. Поскольку польза сибутрамина как препарата для снижения веса, по-видимому, не перевешивает сердечно-сосудистые риски, он был отозван с рынков США и Европы. Тем не менее, постоянное присутствие сибутрамина в некоторых безрецептурных препаратах для похудения является очень серьезной проблемой общественного здравоохранения. В настоящее время FDA ввело более строгие правила контроля над пищевыми добавками, что является долгожданным шагом для обеспечения общественной безопасности [10]. Агрессивный интернет-маркетинг играет жизненно важную роль в привлечении клиентов для приобретения безрецептурных добавок; к сожалению, несмотря на его уход с рынка с 2010 года, сибутрамин продолжает присутствовать во многих пищевых добавках против ожирения, продаваемых в Интернете [11].
Он показал, что у пациентов с ранее существовавшими сердечно-сосудистыми заболеваниями, получающих длительное лечение сибутрамином, был повышен риск нефатального инфаркта миокарда и нефатального инсульта, но не смерти от сердечно-сосудистых заболеваний или смерти от любой причины [3]. Поскольку польза сибутрамина как препарата для снижения веса, по-видимому, не перевешивает сердечно-сосудистые риски, он был отозван с рынков США и Европы. Тем не менее, постоянное присутствие сибутрамина в некоторых безрецептурных препаратах для похудения является очень серьезной проблемой общественного здравоохранения. В настоящее время FDA ввело более строгие правила контроля над пищевыми добавками, что является долгожданным шагом для обеспечения общественной безопасности [10]. Агрессивный интернет-маркетинг играет жизненно важную роль в привлечении клиентов для приобретения безрецептурных добавок; к сожалению, несмотря на его уход с рынка с 2010 года, сибутрамин продолжает присутствовать во многих пищевых добавках против ожирения, продаваемых в Интернете [11]. Текущий поиск сибутрамина на веб-сайте FDA упоминает 250 результатов публичного уведомления о добавках, содержащих сибутрамин. Тем не менее, одно недавнее исследование показало, что 66,7% отозванных добавок, все еще доступных для покупки по крайней мере через шесть месяцев после отзыва FDA, оставались фальсифицированными запрещенными ингредиентами [12]. Необходимы дальнейшие исследования для определения эффективности политики в области общественной безопасности, учитывая продолжающееся присутствие некоторых запрещенных веществ в некоторых пищевых добавках.
Текущий поиск сибутрамина на веб-сайте FDA упоминает 250 результатов публичного уведомления о добавках, содержащих сибутрамин. Тем не менее, одно недавнее исследование показало, что 66,7% отозванных добавок, все еще доступных для покупки по крайней мере через шесть месяцев после отзыва FDA, оставались фальсифицированными запрещенными ингредиентами [12]. Необходимы дальнейшие исследования для определения эффективности политики в области общественной безопасности, учитывая продолжающееся присутствие некоторых запрещенных веществ в некоторых пищевых добавках.
4. Заключение
Этот случай, несмотря на неблагоприятный конечный результат, имеет несколько уникальных аспектов, о которых стоит сообщить и которыми стоит поделиться, чтобы полученные таким образом знания могли помочь спасти других пациентов. Во-первых, насколько нам известно, это первый клинический случай, показывающий связь сибутрамина с внезапной сердечной смертью. Во-вторых, это шестой случай в PubMed у пациента без сопутствующих заболеваний, принимавшего сибутрамин, у которого развился ОКСбпST [5–9]. В-третьих, беспокоит тот факт, что препарат по-прежнему доступен для пациента в составе некоторых травяных добавок для снижения веса, несмотря на то, что он снят с рынка [5, 6].
В-третьих, беспокоит тот факт, что препарат по-прежнему доступен для пациента в составе некоторых травяных добавок для снижения веса, несмотря на то, что он снят с рынка [5, 6].
Доступность данных
Совместное использование данных неприменимо к этой статье, так как наборы данных не были созданы. Актуальная информация доступна в МР-системе нашей больницы и у соответствующего автора по обоснованному запросу.
Конфликт интересов
Ни один из авторов не сообщает о каком-либо конфликте интересов.
Ссылки
A. J. Scheen, «Профиль риска и пользы для сердечно-сосудистой системы сибутрамина», Американский журнал сердечно-сосудистых препаратов , том. 10, нет. 5, стр. 321–334, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Wirth и J. Krause, «Долговременная потеря веса с помощью сибутрамина: рандомизированное контролируемое исследование», Journal of the American Medical Association , vol.
 286, нет. 11, стр. 1331–1339, 2001.
286, нет. 11, стр. 1331–1339, 2001.Посмотреть по адресу:
Сайт издателя | Google Scholar
В. П. Джеймс, И. Д. Катерсон, В. Коутиньо и др., «Влияние сибутрамина на сердечно-сосудистые исходы у пациентов с избыточным весом и ожирением», стр. 9.0004 Медицинский журнал Новой Англии , том. 363, нет. 10, стр. 905–917, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Siebenhofer, K. Jeitler, K. Horvath et al., «Долгосрочные эффекты препаратов для снижения веса у людей с гипертонией», Cochrane Database of Systematic Reviews , vol. 3, article Cd007654, 2016.
Посмотреть по адресу:
Google Scholar
Азарисман С.М., Магди Ю.А., Ноорфайзан С. и Отех М. Инфаркт миокарда, вызванный препаратами, подавляющими аппетит, в Малайзии, стр.
 9.0004 Медицинский журнал Новой Англии , том. 357, нет. 18, стр. 1873-1874, 2007.
9.0004 Медицинский журнал Новой Англии , том. 357, нет. 18, стр. 1873-1874, 2007.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. М. Йим, Х. В. Нг, С. К. Чан, Г. Ип и Ф. Л. Лау, «Сибутрамин-индуцированный острый инфаркт миокарда у молодой женщины», Clinical Toxicology , vol. 46, нет. 9, стр. 877–879, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Посс, М. Бом и А. Линк, «32-летний пациент с острым инфарктом миокарда, возможно, вызванным сибутрамином, подавляющим аппетит», Deutsche Medizinische Wochenschrift , vol. 135, нет. 19, стр. 965–968, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
E. Eroglu, G. Gemici, F. Bayrak, A.K. Kalkan и M.
 Degertekin, «Острый инфаркт миокарда у 24-летнего мужчины, возможно связанный с применением сибутрамина», International Journal of Cardiology , том. 137, нет. 2, стр. e43–e45, 2009 г.
Degertekin, «Острый инфаркт миокарда у 24-летнего мужчины, возможно связанный с применением сибутрамина», International Journal of Cardiology , том. 137, нет. 2, стр. e43–e45, 2009 г.Посмотреть по адресу:
Сайт издателя | Академия Google
П. А. Коэн, «Оценка безопасности пищевых добавок — спорное предложение FDA», The New England Journal of Medicine , vol. 366, нет. 5, стр. 389–391, 2012 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Бунья, К. Савамото, С. Уэмура и др., «Остановка сердца, вызванная сибутрамином, полученным через Интернет: случай молодой женщины без ранее существовавшего сердечно-сосудистого заболевания, успешно реанимированной с помощью экстракорпоральной мембранной оксигенации. », Неотложная медицина и хирургия , том. 4, pp. 334–337, 2017.

 Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP.
Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP. Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP.
Прием сибутрамина с L-триптофаном или 5-HTP может привести к редкой, но серьезной группе симптомов, известных как «синдром серотонина». Симптомы, связанные с серотониновым синдромом, могут включать спутанность сознания, тревогу, мышечную слабость, нарушение координации и рвоту. Поэтому лицам, принимающим сибутрамин, следует избегать добавок L-триптофана и 5-HTP. 286, нет. 11, стр. 1331–1339, 2001.
286, нет. 11, стр. 1331–1339, 2001. 9.0004 Медицинский журнал Новой Англии , том. 357, нет. 18, стр. 1873-1874, 2007.
9.0004 Медицинский журнал Новой Англии , том. 357, нет. 18, стр. 1873-1874, 2007. Degertekin, «Острый инфаркт миокарда у 24-летнего мужчины, возможно связанный с применением сибутрамина», International Journal of Cardiology , том. 137, нет. 2, стр. e43–e45, 2009 г.
Degertekin, «Острый инфаркт миокарда у 24-летнего мужчины, возможно связанный с применением сибутрамина», International Journal of Cardiology , том. 137, нет. 2, стр. e43–e45, 2009 г.