почему не стоит бояться УЗИ, рентгена и микроволновки
Елизавета Приставка Новостной редактор
УЗИ, вайфай, микроволновые печи, магнитно-резонансная томография: какое излучение вредное, что нужно делать, чтобы себе не навредить, а чего не стоит бояться.
Читайте «Хайтек» в
Какая радиация бывает
Радиация — это в узком значении ионизирующее излучение, то есть вид энергии, которая способна выбивать электроны из атомов и делать их ионами. Эти лучи прямо или косвенно могут повреждать ДНК и клеточные мембраны.
Часто радиацию и ионизирующее излучение не разделяют, однако именно ионизирующее излучение повреждает живые клетки, вызывает поломки ДНК. Поэтому в широком смысле радиация — это любое излучение.
Если излучение не ионизирующее, оно все равно может быть вредным: например солнечная радиация может вызвать ожоги.
Виды ионизирующего излучения:
- Альфа-излучение. Не может проникать через одежду или кожу. Но если радионуклиды с альфа-излучением попали внутрь через дыхательные пути, рот или открытые раны, они могут сильно навредить.
- Бета-излучение. Не может проникать через дерево или кирпич, а под кожу может, однако не повреждает основные органы.
- Гамма-излучение. Проникает в органы через многие препятствия. Его может остановить бетонная стена и несколько сантиметров тяжелого металла.
Кто излучает радиацию
Источники радиации:
- Процесс распада ядер атомов.

- Реакции слияния атомов.
Второй процесс идет в недрах звезд, включая Солнце. За пределами атмосферы Земли и ее магнитного поля солнечное излучение включает в себя не только свет и тепло, но также рентгеновские лучи, жесткий ультрафиолет и разогнанные до внушительной скорости протоны.
Протоны наиболее опасны для оказавшихся в дальнем космосе. В год повышенной солнечной активности попадание под пучок протонов даст смертельную дозу облучения за считаные минуты. Это примерно соответствует фону вблизи разрушенного реактора Чернобыльской АЭС.
Однако ближе нашему пониманию другие источники радиации, например горные породы, включая гранит и уголь, содержат уран, торий и испускают газ радон. Так что если дом построен на скальных породах и плохо проветривается, то из-за радона у жителей повышается риск заболеть раком легких. Также вредно в этом плане курение: полоний-210 в табачном дыме активный и опасный изотоп.
Все это составляющие естественного радиационного фона: человеческий организм приспособился жить в таких условиях.
Бытовые и медицинские приборы с радиацией
- Микроволновая печь
Энергии микроволн недостаточно для того, чтобы оторвать электроны от ядер атомов. Медики и биологи спорят о том, как СВЧ-излучение в малых дозах может влиять на человеческий организм, но пока результаты скорее обнадеживающие: сопоставление целого ряда разных масштабных исследований указывает на то, что связи между телефонами и злокачественными опухолями нет.
- УЗИ
Есть много методов, которые позволяет посмотреть буквально внутри человека и все они считаются опасными, хотя по суть своей очень разные. Например в УЗИ используют неионизирующее излучение — это волны с небольшой энергией, они не могут повреждать ДНК, но могут, например, нагревать ткани.
Ультразвук не относится к ионизирующему излучению, которое повреждает ДНК, также доказано, что никакого отрицательного влияния на женщину или плод он не оказывает.
Не смотря на это, УЗИ лучше делать только в тех случаях, когда вам его назначил врач.
- МРТ
МРТ действует по такому же принципу, что и УЗИ. И в МРТ, и в УЗИ используют неионизирующее излучение.
- КТ и рентгенография
Во время компьютерной томографии (КТ) и рентгенографии человека действительно облучают. Этот метод основан на ионизирующем излучении, то есть том, которое может отрывать электроны в атомах, создавая таким образом ионы, и провоцировать мутации в ДНК. Ионизирующее излучение в больших дозах может увеличивать риск развития онкологических заболеваний.
Для того, чтобы понять на сколько КТ действительно опасно или нет, вред ионизирующего излучения оценили преимущественно из последствий крупных катастроф, например, взрыва атомной бомбы в Хиросиме и чернобыльской аварии. Поэтому нельзя с уверенностью говорить о вреде КТ и рентгенографии: все-таки дозы облучения в этих случаях довольно маленькие. Возможно даже, такие методы никак не вредят здоровью — или вредят, но не так сильно, как принято думать.
Поэтому нельзя с уверенностью говорить о вреде КТ и рентгенографии: все-таки дозы облучения в этих случаях довольно маленькие. Возможно даже, такие методы никак не вредят здоровью — или вредят, но не так сильно, как принято думать.
Однако при беременности есть ряд отдельных показаний. Снизить количество облучения, если процедура необходима, можно, например, если делать снимок со спины. Рентгенография головы, шеи, груди и конечностей никак особенно не вредит плоду, особенно если использовать свинцовый фартук.
Компьютерная томография разных частей тела тоже относительно безобидна, если накрыть живот. Кроме того, компьютерную томографию можно делать чуть более низкого качества, чтобы уменьшить лучевую нагрузку.
Большинство исследований не выходит за дозу поглощенной радиации в 0,05 Гр (5 рад). Если же доза в 0,1 Гр (10 рад) то на скоре до 14 дней это никак не влияет на плод, но на большем сроке есть риск, что плод будет развиваться с задержкой. Облучение после 20–25 недели относительно безопасно.
Облучение после 20–25 недели относительно безопасно.
- Вайфай
Вред от вайфая также не доказан. Это радиочастотное излучение, и у роутера оно гораздо слабее, чем у мобильного телефона.
- Мобильный телефон
И он тоже не опасен: сопоставление целого ряда разных масштабных исследований указывает на то, что связи между телефонами и злокачественными опухолями нет.
От телефонов идет неионизирующее радиочастотное излучение, влияние которого на человека изучено не на 100 процентов. Но пока, как сообщают в Центрах по контролю и профилактике заболеваний США, нет причин отказываться от мобильных телефонов.
Радиация и другая техника
Радиация может оказывать разрушительный эффект при долгом и методичном воздействии. Микросхемы на аппаратах в межпланетном пространстве, где много космических лучей, приходится специально адаптировать для работы в условиях повышенного радиационного фона.
Микросхемы на аппаратах в межпланетном пространстве, где много космических лучей, приходится специально адаптировать для работы в условиях повышенного радиационного фона.
Именно из-за этого производительность процессора, скажем, на марсоходе или юпитерианском зонде Juno весьма скромна по земным меркам: за устойчивость к облучению конструкторы расплачиваются габаритами и скоростью работы.
Кто больше всего подвержен радиации
Дети в большей степени подвержены негативному влиянию радиации. Облучение эмбриона или плода может привести к разнообразным тяжелым последствиям: от гибели до ухудшения когнитивных способностей в дальнейшем. Но многое зависит от дозы, и в случае, когда доза поглощенной радиации меньше 0,1 Гр, ни о каких последствиях не известно.
Читать далее:
Замедление вращения Земли вызвало выброс кислорода на планете
На Большом адронном коллайдере открыли новую частицу
Ученые нашли самый древний пример прикладной геометрии
Радиация и здоровье
Радиация и здоровье- Популярные темы
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- Данные и статистика »
- Информационный бюллетень
- Факты наглядно
- Публикации
- Найти страну »
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- ВОЗ в странах »
- Репортажи
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- Центр СМИ
- Пресс-релизы
- Заявления
- Сообщения для медиа
- Комментарии
- Репортажи
- Онлайновые вопросы и ответы
- События
- Фоторепортажи
- Вопросы и ответы
- Последние сведения
- Чрезвычайные ситуации »
- Новости »
- Новости о вспышках болезней
- Данные ВОЗ »
- Приборные панели »
- Приборная панель мониторинга COVID-19
- Основные моменты »
- Информация о ВОЗ »
- Генеральный директор
- Информация о ВОЗ
- Деятельность ВОЗ
- Где работает ВОЗ
- Руководящие органы »
- Всемирная ассамблея здравоохранения
- Исполнительный комитет
- Главная страница/
- Центр СМИ/
- Вопросы и ответы/
- Вопросы и ответы/
- Радиация и здоровье
4 марта 2022 г. | Вопросы и ответы
| Вопросы и ответы
Что такое радиация и в каких ситуациях она может воздействовать на здоровье человека?
Радиация (ионизирующее излучение) – это перенос энергии в виде электромагнитных волн или субатомных частиц. К природным источникам радиации относятся разнообразные радиоактивные вещества, присутствующие в почве, воде, воздухе и в организме человека. Каждый день человек вдыхает или потребляет с воздухом, водой и продуктами питания некоторое количество радиоактивных веществ.
Сегодня наиболее распространенным искусственным источником воздействия ионизирующего излучения являются рентгеновские аппараты и радиофармацевтические препараты, применяемые для диагностики или лучевой терапии, а также другие медицинские изделия.
Воздействие радиации на организм может иметь природный, плановый (в медицине или на предприятии) или случайный характер; механизм облучения может быть внешним, внутренним (вдыхание, потребление внутрь или попадание радиоактивных веществ в организм через контаминированную рану) или комбинированным.
Как радиация влияет на здоровье человека?
Подверженность чрезмерному воздействию ионизирующего излучения может привести к повреждению живых тканей и органов, интенсивность которого зависит от полученной дозы облучения. Масштаб потенциального вреда зависит от множества факторов, таких как:
- тип излучения;
- восприимчивость облученных тканей и органов;
- характер и продолжительность облучения;
- тип радиоактивных изотопов – источников облучения;
- характеристики человека, получившего дозу облучения (например, возраст, пол и наличие сопутствующих заболеваний).
Риск развития неблагоприятных последствий для здоровья человека зависит от дозы облучения. Чем выше доза, тем выше риск неблагоприятных последствий. Если доза облучения низкая или если облучение имеет место в течение длительного периода времени, риск значительно ниже, поскольку организм человека восстанавливает поврежденные клетки и молекулы.
Каковы острые последствия облучения для здоровья человека?
Очень высокие дозы облучения могут приводить к нарушению функционирования тканей и органов и вызывать такие острые симптомы, как тошнота и рвота, покраснение кожи, выпадение волос, лучевые ожоги, острый лучевой синдром или даже смерть.
В случае радиологической чрезвычайной ситуации или аварии на ядерном объекте лица, участвующие в принятии неотложных мер по ликвидации последствий, и работники пострадавшего объекта (например, персонал атомной электростанции) подвергаются наибольшему риску получения высоких доз облучения, вызывающих острые эффекты. Однако, как представляется, население в целом не будет подвергаться воздействию доз облучения, способных вызвать вышеупомянутые эффекты.
В случае радиологической чрезвычайной ситуации населению следует опираться на информацию, распространяемую местными органами власти, и принимать неотложные защитные меры для снижения риска облучения.
Как я могу защитить свое здоровье, если я проживаю в районе радиологической опасности?
Необходимо придерживаться трех основных принципов: не выходить на улицу, быть в курсе актуальной информации и следовать инструкциям.
Всегда следуйте инструкциям по вопросам безопасности, распространяемым национальными и местными органами власти, и оставайтесь в курсе последних новостей. Если вам было рекомендовано оставаться в помещении, следуйте этой инструкции, поскольку стены и
потолки могут обеспечивать защиту от радиоактивных осадков. По возможности следует находиться в помещении без окон и ведущих на улицу дверей, закрыть все окна в доме и отключить вентиляционные системы и приборы (кондиционеры или обогреватели).
Если вам было рекомендовано оставаться в помещении, следуйте этой инструкции, поскольку стены и
потолки могут обеспечивать защиту от радиоактивных осадков. По возможности следует находиться в помещении без окон и ведущих на улицу дверей, закрыть все окна в доме и отключить вентиляционные системы и приборы (кондиционеры или обогреватели).
Подвергаются ли дети более высокому риску вреда в результате облучения?
Да, дети в наибольшей степени подвержены риску развития неблагоприятных последствий для здоровья в случае ионизирующего облучения. В организме детей и подростков больше быстро делящихся клеток и растущих тканей, и, поскольку им предстоит еще более долгая
жизнь, они подвержены более высокому риску развития онкологических заболеваний со временем. Крайне важно обеспечить соблюдение детьми инструкций и мер защиты от облучения и обратиться за педиатрической медицинской помощью сразу же после того, как
органы по управлению чрезвычайными ситуациями оповестят о ликвидации радиационной аварии.
Каковы долгосрочные последствия ионизирующего излучения для здоровья?
Превышение допустимой дозы радиационного облучения в долгосрочной перспективе может привести к повышению риска развития онкологических заболеваний. Во время ядерных аварий может происходить выброс радиоактивного йода, который при вдыхании или попадании внутрь организма накапливается в щитовидной железе, что повышает вероятность развития рака щитовидной железы. Для снижения этого риска применяется йодистый калий в таблетках, однако это средство следует принимать только в случае соответствующего указания со стороны местных органов власти.
Что такое йодистый калий (KI)?
Йодистый калий – соль, похожая по своим свойствам на поваренную. В случае своевременного приема в надлежащей дозировке йодистый калий препятствует накоплению радиоактивного йода в щитовидной железе. Это снижает риск рака щитовидной железы и развития других болезней.
Может ли прием йодистого калия защитить от облучения?
Нет. Йодистый калий защищает только щитовидную железу от воздействия радиоактивного йода. Самый эффективный способ защиты – следовать трем принципам: не выходить на улицу, быть в курсе актуальной информации и следовать инструкциям национальных органов
власти.
Йодистый калий защищает только щитовидную железу от воздействия радиоактивного йода. Самый эффективный способ защиты – следовать трем принципам: не выходить на улицу, быть в курсе актуальной информации и следовать инструкциям национальных органов
власти.
Какую роль в случае чрезвычайных ситуаций играет ВОЗ?
Задача ВОЗ – спасать жизни людей и помогать нуждающимся во время кризисных ситуаций, будь то вооруженный конфликт, вспышка болезни или стихийное бедствие. Программа ВОЗ по чрезвычайным ситуациям в области здравоохранения привержена делу сотрудничества с государствами-членами и другими заинтересованными сторонами в интересах сведения к минимуму страданий и смертности во время кризисных ситуаций и обеспечения защиты и восстановления систем здравоохранения.
Программа ВОЗ по чрезвычайным ситуациям в области здравоохранения:
- оказывает странам поддержку в проведении оценки готовности к чрезвычайным ситуациям в области здравоохранения и подготовке национальных планов по устранению критических пробелов;
- содействует разработке стратегий и созданию потенциала для предотвращения возникновения источников инфекционной опасности и их устранения;
- ведет мониторинг новых и текущих инцидентов в области общественного здравоохранения для их оценки, оповещения о них и формулирования рекомендаций относительно мер снижения рисков для здоровья населения.

В дополнение к этому ВОЗ ведет совместную работу со странами и партнерами, с тем чтобы:
- обеспечить готовность к принятию мер по снижению санитарно-эпидемиологического риска в странах с высокой степенью уязвимости;
- обеспечить оказание жизненно важных услуг здравоохранения пострадавшему населению в странах, затронутых чрезвычайными ситуациями.
Применение радиоактивных веществ в медицине — история и перспективы развития | Шеремета
ВВЕДЕНИЕ
Фундаментальные исследования, проведенные в ядерной физике в 1920–1940-х гг., положили начало радиационной и ЯМ. Период зарождения ЯМ располагается между открытием искусственной радиоактивности в 1934 г. и производством радионуклидов Oak Ridge National Laboratory, США, в 1940 г. для их использования в медицинских целях. Потребовалось немало усилий, прежде чем применение радиоактивности стало безопасным и эффективным.
Один из первых искусственно полученных радиоизотопов, используемых в медицине вот уже 80 лет, — изотоп 131I. Его выделяют в форме йодида натрия (NaI) из продуктов распада урана или нейтронной бомбардировки теллура-130 в ядерном реакторе. Изотоп 131I излучает β- и γ-лучи, период полураспада — 8,02 дня (рис. 1) [1].
Его выделяют в форме йодида натрия (NaI) из продуктов распада урана или нейтронной бомбардировки теллура-130 в ядерном реакторе. Изотоп 131I излучает β- и γ-лучи, период полураспада — 8,02 дня (рис. 1) [1].
Рисунок 1. Схема распада 131I. Изотоп 131I распадается в стабильный 131Xe (131-Ксенон) в два этапа, при этом γ-распад следует сразу после β-распада. Основная энергия γ-излучения равна 364 кэВ (89,9%), β-излучения — 606 кэВ (81,7%). С меньшим выходом наблюдается γ-излучение с энергией 637 кэВ (7,2%), β-излучение с энергией 338 кэВ (7,3%).
Новая медицинская парадигма, тераностика, использует один многофункциональный агент для терапии и диагностики, достигая максимального персонализированного терапевтического ответа, а также улучшая долгосрочный прогноз и снижая дозозависимую токсичность. Термин «тераностика» образован путем слияния слов «терапия» и «диагностика». Он был введен в 2002 г. американским консультантом John Funkhouser, главным исполнительным директором PharmaNetics [2]. Один из первых тераностических агентов, радиоактивный йод, использован при заболеваниях щитовидной железы (ЩЖ) в 1940-х гг., а в 1950 г. американским врачом Benedict Cassen проведена первая визуализация щитовидной железы (ЩЖ) с использованием прямолинейного сканера после введения в организм радиоактивного йода [3].
Один из первых тераностических агентов, радиоактивный йод, использован при заболеваниях щитовидной железы (ЩЖ) в 1940-х гг., а в 1950 г. американским врачом Benedict Cassen проведена первая визуализация щитовидной железы (ЩЖ) с использованием прямолинейного сканера после введения в организм радиоактивного йода [3].
ЙОД: РОЛЬ, МЕТАБОЛИЗМ
Основную роль в метаболизме йода в организме играет ЩЖ. Йод — важный микроэлемент, необходимый для синтеза гормонов ЩЖ, тироксина (Т4) и трийодтиронина (Т3). Йод составляет 65 и 59% массы Т4 и Т3 соответственно [4]. Выработка и секреция гормонов ЩЖ регулируются тиреотропным гормоном (ТТГ) передней доли гипофиза.
В организме здорового взрослого человека содержится 15–20 мг йода, из них 70–80% находится в ЩЖ. В основном йод поступает в организм с пищей, при этом наиболее богатые йодом продукты — это йодированная соль, молочные продукты, некоторые виды хлеба, морские водоросли и морепродукты. При хроническом дефиците йода его содержание в ЩЖ может снизиться до менее чем 20 мкг. В районах с достаточным потреблением йода ЩЖ взрослого человека захватывает около 60 мкг йода в день, чтобы сбалансировать потери и поддерживать синтез Т4 и Т3 [4].
В районах с достаточным потреблением йода ЩЖ взрослого человека захватывает около 60 мкг йода в день, чтобы сбалансировать потери и поддерживать синтез Т4 и Т3 [4].
После всасывания йод выводится из основного кровотока главным образом ЩЖ и почками. Поглощение йода ЩЖ обеспечивается Na+/I–-симпортером, описанным S. Kaminsky и соавт. в 1993 г. [5]. Na+/I–-симпортер располагается на базолатеральной мембране клеток ЩЖ. Перенос йодида из циркулирующей крови внутрь тиреоцита происходит по градиенту концентрации, который образуется Na+/K+-АТФазой и примерно в 30–50 раз превышает концентрацию в плазме, обеспечивая поступление достаточного количества йода для синтеза тиреоидных гормонов [4][6].
ТТГ регулирует транспорт йода в ЩЖ, стимулируя транскрипцию Na+/I–-симпортера и способствуя его правильному встраиванию в плазматическую мембрану. При диете с низким содержанием йода ТТГ стимулирует экспрессию Na+/I–-симпортера и отвечает за изменение его субклеточной локализации.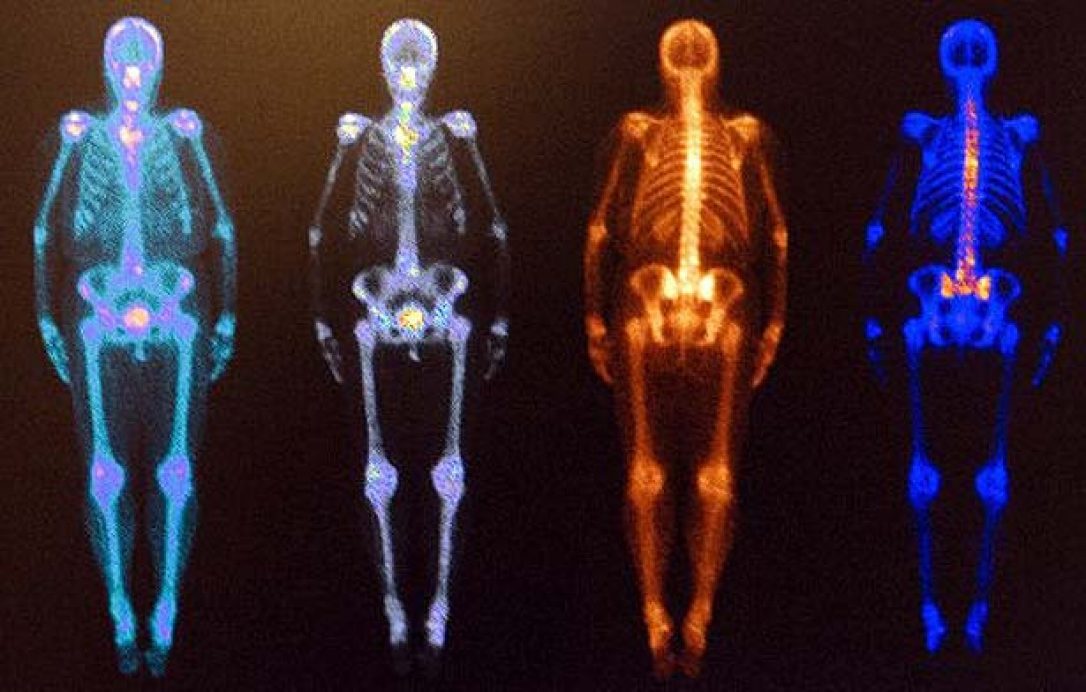
Существует механизм, обеспечивающий нормальное функционирование ЩЖ при избытке йода. Когда в организм человека с нормальной функцией ЩЖ поступает большое количество йода, происходит транзиторное снижение синтеза тиреоидных гормонов в течение примерно 48 ч. Избыток йода блокирует его органификацию и образование Т3, Т4 [7]. Этот процесс, описанный в 1948 г., называется эффектом Вольфа–Чайкова [8]. Предполагается, что эффект Вольфа–Чайкова связан с негативной посттрансляционной регуляцией Na+/I–-симпортера йодидами [9]. В ответ на введение больших количеств йода уменьшается высвобождение тиреоидных гормонов из ЩЖ с компенсаторным увеличением уровня ТТГ. Со временем синтез тиреоидных гормонов восстанавливается. Феномен «ускользания» от эффекта Вольфа–Чайкова является адаптационным процессом, он не зависит от ТТГ и связан со снижением содержания йода внутри ЩЖ. Наиболее вероятный механизм развития этого явления — снижение активности Na+/I–-симпортера, приводящее к уменьшению поступления микроэлемента в тиреоциты. Когда уровень йода в ЩЖ становится ниже значений, поддерживающих эффект Вольфа–Чайкова, процесс органификации восстанавливается, а вместе с ним нормализуется функция ЩЖ [7].
Когда уровень йода в ЩЖ становится ниже значений, поддерживающих эффект Вольфа–Чайкова, процесс органификации восстанавливается, а вместе с ним нормализуется функция ЩЖ [7].
Считалось, что йодид пересекает апикальную мембрану под действием электрохимического градиента, однако исследования показали, что ТТГ стимулирует перенос йодида через апикальную мембрану специфическим транспортером — пендрином. Пендрин принадлежит к семейству SLC26A и кодируется геном SLC26A4. Он присутствует в апикальной мембране фолликулярных клеток [4].
В просвете фолликулов йодид окисляется и включается в тиреоглобулин (ТГ) тиреоидной пероксидазой — ферментом, локализованным в микросомальной фракции фолликулярных клеток ЩЖ. Этот процесс называется органификацией и приводит к образованию 3-монойодтирозина и 3,5-дийодтирозина. После тирозольные остатки сближаются друг с другом и конденсируются, образуя йодтиронины — тиреоидные гормоны. Йодированный ТГ хранится в просвете фолликула в густой жидкости, которая называется коллоидом и выводится посредством эндоцитоза или микропиноцитоза с последующим протеолитическим расщеплением в лизосомах и высвобождением Т3 и Т4 в кровоток [10].
ТЕРАПИЯ РАДИОАКТИВНЫМ ЙОДОМ — ПРИМЕР УСПЕШНОЙ ИСТОРИИ ЯДЕРНОЙ МЕДИЦИНЫ
Современное представление о применении радиоактивности основано на знаниях физических и радиобиологических свойств изотопов, применении концепции тераностики с возможностью достижения максимально эффективного и безопасного лечения. Мультидисциплинарная работа команды врачей, физиков и радиохимиков началась более 80 лет назад. Потребовалось много усилий, прежде чем радиойодтерапия (РЙТ) стала стандартным радикальным методом лечения доброкачественных и злокачественных заболеваний ЩЖ.
Первые открытия
Эру применения ионизирующих излучений отсчитывают с 1895 г., когда немецкий физик Wilhelm Conrad Röntgen в экспериментах с трубкой Крукса открыл рентгеновское излучение. Шесть лет спустя — в 1901 г. — за это открытие Röntgen получит первую в истории Нобелевскую премия по физике.
В 1896 г. Jules Henri Poincare, французский ученый широкого профиля, на заседании Парижской Академии высказал предположение, что рентгеновское излучение связано с флуоресценцией и, возможно, всегда возникает в люминесцирующих веществах, поэтому катодной трубки для получения рентгеновских лучей не требуется.
В этом же году данную гипотезу проверил французский физик Antoine Henri Becquerel [1]. Он использовал фотографическое действие через черную бумагу активированных солнечным светом кристаллов соли урана. На первом этапе эксперимент подтвердил гипотезу H. Poincare, но вскоре A. Becquerel обнаружил, что урановая соль без воздействия солнечного света способна испускать излучение, проходящее через черную бумагу.
Незадолго до этого открытия, в 1895 г., признана роль йода как предшественника гормонов ЩЖ. Немецкий химик Eugen Baumann пролил концентрированную азотную кислоту на образец ЩЖ и увидел пурпурные испарения, поднимающиеся над ней. Так стало известно, что стабильный йод1 присутствует в тканях ЩЖ [4].
Прежде чем радиоактивные изотопы (РИ) йода заняли свое почетное место в истории ЯМ, были изучены свойства таких радиоэлементов, как уран, торий, радий, полоний, актиний. Большой вклад в изучение радиоактивности внесли польская и французская ученая-экспериментатор Marie Curie и ее муж — французский физик Pierre Curie. В 1903 г. Шведская королевская академия наук присудила Нобелевскую премию по физике A. Becquerel и супругам Curie «за выдающиеся заслуги в совместных исследованиях явлений радиации» [14].
В 1903 г. Шведская королевская академия наук присудила Нобелевскую премию по физике A. Becquerel и супругам Curie «за выдающиеся заслуги в совместных исследованиях явлений радиации» [14].
В 1923 г., в то время как будущий врач и отец тераностики Saul Hertz учился в Гарвардской медицинской школе, венгерский химик György de Hevesy создал принципы использования радиоактивных веществ для изучения биологических процессов. Позднее, в 1934 г., итальянский физик Enrico Fermi путем облучения альфа-частицами алюминиевой фольги синтезировал 22 новых радиоактивных изотопа, среди которых были изотопы йода [13][15].
В 1931 г. Saul Hertz был принят на работу в Клинику щитовидной железы и Лабораторию метаболизма Массачусетской больницы общего профиля (MGH). Ранее Saul Hertz являлся волонтером, а впоследствии стал заведующим Клиникой щитовидной железы [16].
Karl Compton: «Что физика может сделать для биологии и медицины»
Saul Hertz знал, что йод легко поглощается ЩЖ и некоторые химические элементы можно сделать радиоактивными, но о работах Enrico Fermi ему было неизвестно. В 1936 г. Karl Compton, американский физик и президент Массачусетского технологического института (MIT), выступил на обеде в Вандербиль холле с докладом «Что физика может сделать для биологии и медицины», что послужило исторической точкой в зарождении исследования РИ йода [17][18]. Karl Compton был старшим братом Arthur Compton, физика, который в 1923 г. открыл явление рассеяния электромагнитного излучения на свободных электронах (известное как «эффект Комптона»). Возможно, в своем докладе Karl Compton затронул открытие явления искусственной радиоактивности, сделанное французскими физиками Frederic и Irene Joliot-Curie в 1934 г. [17].
В 1936 г. Karl Compton, американский физик и президент Массачусетского технологического института (MIT), выступил на обеде в Вандербиль холле с докладом «Что физика может сделать для биологии и медицины», что послужило исторической точкой в зарождении исследования РИ йода [17][18]. Karl Compton был старшим братом Arthur Compton, физика, который в 1923 г. открыл явление рассеяния электромагнитного излучения на свободных электронах (известное как «эффект Комптона»). Возможно, в своем докладе Karl Compton затронул открытие явления искусственной радиоактивности, сделанное французскими физиками Frederic и Irene Joliot-Curie в 1934 г. [17].
Группа клиницистов и ученых, присутствовавших на обеде, вдохновилась выступлением Karl Compton и захотела больше узнать о радиоактивном йоде. Saul Hertz поинтересовался: «Можно ли искусственным путем сделать йод радиоактивным?» Несколько лет он изучал роль йода в физиологии ЩЖ в MGH в поисках нехирургического решения проблемы тиреотоксикоза. По другим рассказам, главный врач MGH, профессор James Howard Means, в конце доклада поинтересовался фактической биодоступностью радиоактивных изотопов йода. Он также хотел понять, может ли MIT производить РИ йода искусственным путем [17].
Он также хотел понять, может ли MIT производить РИ йода искусственным путем [17].
Karl Compton не имел однозначного ответа, возможно, потому, что его лекция об искусственных радиоизотопах была инициирована в последнюю минуту Robley Evans, американским физиком из MIT [19]. Он записал вопрос Hertz и ответил ему в письме спустя месяц, 15.12.1936: «К моему сожалению, я только сейчас наткнулся на заметку, сделанную по вашему вопросу о радиоактивном йоде. Йод можно сделать радиоактивным искусственно. Он имеет период полураспада в 25 минут и испускает γ- и αβ-лучи (электроны) с максимальной энергией 2,1 миллиона вольт» [20]. Период полураспада в 25 минут соответствует изотопу йода с атомной массой 128, т.е. 128I.
Hertz ответил на письмо через 8 дней — 23.12.1936. Выдвигая свою гипотезу, он писал: «…надеюсь, что йод, который, как вы указали, можно сделать радиоактивным, будет полезным методом терапии в случаях гиперфункции щитовидной железы». Предполагается, что эта гипотеза построена на более ранних работах Howard Means 1922 г. относительно возможного лечения заболеваний ЩЖ с помощью рентгеновского излучения. Обмен письмами между Compton и Hertz — бесспорное доказательство того, что идея применения РЙТ возникла именно у эндокринолога Saul Hertz.
относительно возможного лечения заболеваний ЩЖ с помощью рентгеновского излучения. Обмен письмами между Compton и Hertz — бесспорное доказательство того, что идея применения РЙТ возникла именно у эндокринолога Saul Hertz.
Перспективное сотрудничество
В 1937 г. Hertz стал сотрудничать с молодым физиком и преподавателем Arthur Roberts, с которым в ходе последующих экспериментов изучал возможность применения радиоактивного йода (РЙ) для диагностики и лечения заболеваний ЩЖ.
Основываясь на работе Fermi, будущего создателя ядерного реактора, группа построила самодельный источник нейтронов, который содержал бериллий и переработанный радий (Ra-Be). Спиртовой раствор йода (127I) облучался в течение 1 или 2 ч путем погружения его в источник нейтронов с целью создать преципитат радиоактивного иодида серебра (Ag128I) [17].
Первые эксперименты на животных моделях включали изучение 48 кроликов2, которым вводили Ag128I.
Все животные выжили. Поглощение радиоактивного йода (RAIU) изучили при различных состояниях функции ЩЖ. Затем радиоактивность тканей животных измеряли с помощью счетчика Гейгера–Мюллера. Roberts использовал счетчик Гейгера-Мюллера для определения количества РИ йода, присутствующего в биологических образцах. Результаты показали, что RAIU ЩЖ происходит быстро и зависит от степени гиперплазии3.
Hertz и Roberts смогли провести исследования фармакокинетики йода, а в мае 1938 г. ими опубликована первая статья под названием «Радиоактивный йод как индикатор в изучении физиологии щитовидной железы» [21]. Исследования показали, что РЙ может использоваться для оценки функции ЩЖ.
Циклотрон и изотопы радиоактивного йода
За несколько лет до этих экспериментов американский физик Ernest Orlando Lawrence и его команда из Беркли разработали циклотрон для исследований в области ядерной физики. После открытия Joliot–Curie стало очевидно, что циклотрон можно применять для создания искусственной радиоактивности [22].
В 1938 г. американские ученые Glenn Seaborg и John Livingood получили 131I путем облучения источников теллура [23]. Этот прорыв произошел после разговора Seaborg с Joseph Hamilton, профессором медицинской физики, экспериментальной медицины и радиологии. Hamilton объяснил, что короткий период полураспада 128I ограничивает клиническое применение данного изотопа. Преимущество же 131I в том, что он излучает как γ-, так и β-лучи: первые позволяют получать изображения для диагностики и дозиметрии, вторые применимы для таргетной радионуклидной терапии. Данная особенность 131I делает его первым естественным тераностическим радионуклидом в медицине.
Параллельно с Hertz и Roberts ученые Joseph Hamilton и Mayo Soley проводили свои эксперименты с использованием РЙ и других радиоактивных элементов [24]. К июню 1939 г. они исследовали RAIU ЩЖ человека и предположили, что можно получить динамическую картину метаболизма йода, оценив уровни поглощения и выделения йода ЩЖ4. Команда исследователей сообщила об отсутствии RAIU у больного со злокачественным образованием ЩЖ. В 1940 г. было подтверждено, что ЩЖ человека захватывает радиоактивный йод.
Команда исследователей сообщила об отсутствии RAIU у больного со злокачественным образованием ЩЖ. В 1940 г. было подтверждено, что ЩЖ человека захватывает радиоактивный йод.
Первая оценка опытов Hertz и Roberts привела к лучшему пониманию метаболизма йода при болезни Грейвса и была представлена на заседании Американского общества клинических исследований (ASCI) в Атлантик-Сити в мае 1942 г. Joseph Hamilton также присутствовал на встрече и сообщил о своем опыте лечения РЙ (130I) трех пациентов с тиреотоксикозом [26].
Первые результаты терапии радиоактивным йодом
Пациентка ED направляется в клинику доктора Hertz с тиреотоксикозом без офтальмопатии и с уровнем базального метаболизма5 (BMR) +30.
31 марта 1941 г. ей назначают активность 77,7 МБк смеси 130I/131I, а потом дополнительные 48,1 МБк. ED становится первой пациенткой с заболеванием ЩЖ, которую лечат РИ йода. По совету James H. Means, ED получает стабильный йод вслед за дозой РЙ. После терапии BMR пациентки снижается до -7. Об этом клиническом случае было сообщено в мае 1941 г. на ежегодном собрании ASCI [18].
После терапии BMR пациентки снижается до -7. Об этом клиническом случае было сообщено в мае 1941 г. на ежегодном собрании ASCI [18].
В течение последующих 2 лет (1941–1943 гг.) Hertz и Roberts пролечили 29 пациентов с тиреотоксикозом и после терапии вводили всем нерадиоактивный йод. Сообщалось, что 20 пациентов считались вылеченными, 9 без положительного ответа на лечение были направлены на хирургическое лечение, а при патологоанатомическом исследовании образцов ЩЖ у 6 из них выявлена инволюция. Однако эти результаты будут сообщены только через несколько лет — в 1946 г. Причина тому — война.
В 1943 г., в разгар Второй мировой войны, доктор Saul Hertz решил добровольно принять участие в военной службе и поступил на службу в Военно-морской флот США. Пока Hertz отсутствовал, Earl Chapman, врач частной практики из MGH, работал с Evans над лечением пациентов с заболеваниями ЩЖ. На этот раз за введением радиоактивного йода не последовало введения дозы стабильного йода.
Сенсация
Hertz вернулся домой в 1945 г. Он не смог продолжить свои исследования в MGH из-за разногласий, возникших с Chapman, и присоединился к докторам больницы Beth Israel.
Он не смог продолжить свои исследования в MGH из-за разногласий, возникших с Chapman, и присоединился к докторам больницы Beth Israel.
Chapman первым отправил публикацию в Журнал Американской Медицинской ассоциации (JAMA). Но она была слишком длинной, и ее вернули на доработку. В ноябре 1945-го главный редактор JAMA, американский врач Morris Fishbein, сообщил Hertz, что Клиника щитовидной железы представила рукопись по лечению РИ йода без упоминания Hertz и Roberts, что побудило Hertz быстрее закончить свою работу по РЙТ.
Необычное обстоятельство — две рукописи на одну тему из одного учреждения без перекрывающегося авторства были опубликованы в одном медицинском журнале 11 мая 1946 г. Это подтверждало, что РЙТ — перспективный метод лечения тиреотоксикоза [27][28].
Изотоп 131I появился в свободном доступе с 1946 г. в результате реализации манхэттенского проекта в Ок-Ридж в Теннесси [19].
Возможность исследовать метаболизм и функцию ЩЖ с помощью РИ йода использовалась для лечения доброкачественных и злокачественных заболеваний ЩЖ. В 1946 г. Hertz был принят в ASCI в качестве Young Turk за революционную работу по разработке первой тераностической методики в медицине: использование РИ йода при заболеваниях ЩЖ [19].
В 1946 г. Hertz был принят в ASCI в качестве Young Turk за революционную работу по разработке первой тераностической методики в медицине: использование РИ йода при заболеваниях ЩЖ [19].
Применение РЙТ при злокачественных образованиях ЩЖ
Первыми исследованиями применения РИ йода при карциноме ЩЖ стали клинические работы под руководством врача-ученого Hamilton. В исследовании 1942 г. команда Hamilton ввела РИ йода 2 пациентам с тиреотоксикозом, которым впоследствии была сделана ТЭ. Патологоанатомическое исследование образца ЩЖ показало диффузное накопление РЙ в злокачественных очагах железы [29].
В том же году доктора Reid и Albert S. Keston открыли 125I, а позже Keston и его коллеги из Колумбийского университета сообщили о поглощении РЙ (RAIU) метастазами карциномы ЩЖ [30]6. Результаты имели большое значение в понимании потенциальной роли абляции остаточной ткани ЩЖ с помощью РЙ.
Клиническое применение РЙ для диагностики и лечения дифференцированного рака щитовидной железы (РЩЖ), проведенное в 1942 г. , принадлежит американскому эндокринологу Samuel M. Seidlin, который отметил, что поглощение радиоактивного йода метастазами можно индуцировать инъекцией рекомбинантного человеческого тиреотропина или тиреоидэктомией (ТЭ) [32]. 7 декабря 1946 г. JAMA опубликовала обширный отчет Seidlin о первом успешном лечении метастатической карциномы ЩЖ с использованием РЙ [33].
, принадлежит американскому эндокринологу Samuel M. Seidlin, который отметил, что поглощение радиоактивного йода метастазами можно индуцировать инъекцией рекомбинантного человеческого тиреотропина или тиреоидэктомией (ТЭ) [32]. 7 декабря 1946 г. JAMA опубликовала обширный отчет Seidlin о первом успешном лечении метастатической карциномы ЩЖ с использованием РЙ [33].
В 1946 г. Hertz заявил, что его исследования будут сосредоточены на «раке щитовидной железы, который является ключом к более серьезной проблеме — онкологии в целом» [19].
У одной из первых пациенток, поступивших в Королевский онкологический центр (Лондон) в 1949 г., был неоперабельный дифференцированный РЩЖ и метастазы, требующие трахеостомии. Первая диагностическая активность в 2,59 МБк 131I получена. На фоне хорошего поглощения РЙ удалось назначить терапевтические активности. Спустя несколько сеансов (1850, 3256, 3700, 8510 МБк) РЙ, выполненных в течение 7 мес, отмечалось улучшение состояния пациентки7.
Клинический случай
Пациент BB, мужчина 51 года со злокачественным образованием ЩЖ. Из анамнеза известно: в возрасте 30 лет (командой врачей Seidlin; Montefiore Hospital, Нью-Йорк, США) пациенту выполнена тотальная ТЭ большого зоба, сопровождающегося компрессионным синдромом. Микроскопическое исследование образца ЩЖ не выявило нормальных структур, а патологоанатомический диагноз звучал как злокачественная аденома. После операции полного удаления ткани ЩЖ пациент находился в ремиссии на протяжении 15 лет, пока у него не появились классические симптомы тиреотоксикоза. Мужчина сильно похудел, жаловался на учащенное сердцебиение и тревожность. Симптомы нарастали, а в ноябре 1939 г. мужчина был направлен на хирургическое лечение из-за пульсирующей опухоли на уровне TXII. Уровень его BMR достиг +40. Выполнена ламинэктомия TXII и LI для эксцизионной биопсии, в результате которой выявлена метастатическая карцинома ЩЖ.
Послеоперационный период осложнился тиреотоксическим кризом. Состояние пациента ухудшалось. Команда Seidlin использовала ежедневные дозы 1–6 мл р-ра Люголя в течение почти 10 мес, блокируя органификацию йода, подавляя присоединение молекулярного йода к ТГ и образование тиреоидных гормонов Т3 и Т4. Сначала BB показал симптоматическое улучшение, но к январю 1943 г. его состояние ухудшилось. Seidlin незамедлительно проконсультировался с Hertz, чтобы обсудить возможность использования РЙ для лечения метастазов. Организовать поставку РЙ оказалось крайне трудно. Evans запросил огромную сумму — 1800 долларов за час — и поинтересовался, сколько миллиКюри нужно доктору. «Пришлите мне за час», — ответил Seidlin. Позднее Seidlin признал, что ни у него, ни у пациента не было 1800 долларов, кроме того, он не понял, что Evans имел в виду под «миллиКюри» [19].
Состояние пациента ухудшалось. Команда Seidlin использовала ежедневные дозы 1–6 мл р-ра Люголя в течение почти 10 мес, блокируя органификацию йода, подавляя присоединение молекулярного йода к ТГ и образование тиреоидных гормонов Т3 и Т4. Сначала BB показал симптоматическое улучшение, но к январю 1943 г. его состояние ухудшилось. Seidlin незамедлительно проконсультировался с Hertz, чтобы обсудить возможность использования РЙ для лечения метастазов. Организовать поставку РЙ оказалось крайне трудно. Evans запросил огромную сумму — 1800 долларов за час — и поинтересовался, сколько миллиКюри нужно доктору. «Пришлите мне за час», — ответил Seidlin. Позднее Seidlin признал, что ни у него, ни у пациента не было 1800 долларов, кроме того, он не понял, что Evans имел в виду под «миллиКюри» [19].
Первая терапевтическая активность РЙ, введенная 11 мая 1943 г., содержала 629 МБк 130I. В общей сложности пациент получил 16 терапевтических активностей 130I и 131I. Суммарная активность составила 9945 МБк. Доктора отслеживали выделение РЙ мочой. Из-за непомерной стоимости радионуклида, генерируемого циклотроном, они извлекли и переработали РЙ из мочи пациента для повторного использования. Команда Seidlin наблюдала клиническое улучшение больного в самом начале и при каждом последующем применении РЙТ. Пациент набрал вес, боль в костях почти прошла, беспокоящее сердцебиение прекратилось, а BMR упал до –27. Доктора были поражены результатами лечения. Клинический случай опубликован в октябрьском номере журнала LIFE в 1949 г. В статье несколько приукрасили результаты, сообщая о том, что мужчина полностью выздоровел. На самом деле спустя несколько лет пациент умер от установленной при вскрытии анапластической карциномы [19].
Суммарная активность составила 9945 МБк. Доктора отслеживали выделение РЙ мочой. Из-за непомерной стоимости радионуклида, генерируемого циклотроном, они извлекли и переработали РЙ из мочи пациента для повторного использования. Команда Seidlin наблюдала клиническое улучшение больного в самом начале и при каждом последующем применении РЙТ. Пациент набрал вес, боль в костях почти прошла, беспокоящее сердцебиение прекратилось, а BMR упал до –27. Доктора были поражены результатами лечения. Клинический случай опубликован в октябрьском номере журнала LIFE в 1949 г. В статье несколько приукрасили результаты, сообщая о том, что мужчина полностью выздоровел. На самом деле спустя несколько лет пациент умер от установленной при вскрытии анапластической карциномы [19].
В 1949 г. доктор Hertz создал первое отделение ЯМ, расширив исследования с использованием радионуклидов в области онкологии [17]. В январе 1950 г. опубликована исчерпывающая глава, в которой сообщалось о применении РЙТ при карциноме ЩЖ. «В целом результаты использования РЙТ при злокачественных образованиях щитовидной железы хотя и многообещающие, но не свидетельствуют о большом проценте излечений за короткое время, в течение которого используется метод», — писал Hertz [35]. Он понимал, что потребуется время для лучшего понимания возможностей РЙТ у пациентов с раком ЩЖ. В июле 1950 г. Hertz умер в результате внезапного сердечного приступа.
«В целом результаты использования РЙТ при злокачественных образованиях щитовидной железы хотя и многообещающие, но не свидетельствуют о большом проценте излечений за короткое время, в течение которого используется метод», — писал Hertz [35]. Он понимал, что потребуется время для лучшего понимания возможностей РЙТ у пациентов с раком ЩЖ. В июле 1950 г. Hertz умер в результате внезапного сердечного приступа.
В 1951 г. 131I стал первым радиофармацевтическим препаратом, получившим одобрение Food and Drug Administration (FDA), который использовался для лечения заболеваний ЩЖ. Показания для применения РЙТ при злокачественных образованиях ЩЖ сформулированы в 1957 г. американским врачом William Henry Beierwaltes, пионером в использовании ЯМ: «Желательно провести РЙТ для того, чтобы закончить работу, которую начал хирург». Определена цель применения РЙТ при РЩЖ — полная абляция ткани ЩЖ [19].
РЙТ — МЕХАНИЗМ ДЕЙСТВИЯ
131I И ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ ЩЖПоглощение и метаболизм радиоактивного йода 131I в ткани ЩЖ идентичны стабильному йоду. При пероральном приеме 131I (капсула или раствор) в виде йодид-иона всасывается из желудочно-кишечного тракта. Na+/I–-симпортер транспортирует йодид клетками ЩЖ через базолатеральную мембрану фолликулярных клеток. Некоторые экстратиреоидные ткани (слизистая оболочка желудка, слюнные, слезные и лактирующие молочные железы), также содержащие Na+/I–-симпортер, опосредованно поглощают 131I через базолатеральную мембрану фолликулярных клеток.
При пероральном приеме 131I (капсула или раствор) в виде йодид-иона всасывается из желудочно-кишечного тракта. Na+/I–-симпортер транспортирует йодид клетками ЩЖ через базолатеральную мембрану фолликулярных клеток. Некоторые экстратиреоидные ткани (слизистая оболочка желудка, слюнные, слезные и лактирующие молочные железы), также содержащие Na+/I–-симпортер, опосредованно поглощают 131I через базолатеральную мембрану фолликулярных клеток.
Экспрессия белка Na+/I–-симпортера усилена при болезни Грейвса, что подтверждается повышенным поглощением РИ йода. При многоузловом токсическом зобе экспрессия белка Na+/I–-симпортера выше, чем в норме, и ниже, чем при болезни Грейвса. При раке ЩЖ экспрессия NIS (SLC5A5), как правило, снижена [6][9].
Попадая в фолликулярные клетки ЩЖ, 131I включается в состав фенольного кольца тирозильных остатков тиреоглобулина. Когда β-частицы 131I высвобождаются внутри клеток ЩЖ, они проходят в среднем 0,8 мм, прежде чем их энергия полностью поглощается. β-частицы, испускаемые 131I, разрушают функционирующую ткань ЩЖ. Радиобиологическое воздействие 131I на ткани бывает прямым (влияние радиации на ДНК — разрыв молекулярных связей) или косвенным. При косвенном воздействии образуются свободные радикалы, которые вступают в реакцию с макромолекулами в среде микроокружения клеток. Свободные радикалы и оксиданты взаимодействуют с молекулами ДНК, вызывая большое количество разнообразных нарушений ее структуры, обеспечивая локальную деструкцию тиреоцитов. Воздействие ионизирующего излучения приводит к генетическим повреждениям, мутациям или гибели клеток. Таким образом, 131I вызывает обширное местное повреждение и некроз тканей ЩЖ. Основной эффект РЙТ — радиационный тиреоидит. Тяжесть этого эффекта прямо пропорциональна полученной дозе [36]. Целью терапии является подавление функционального состояния клеток и нарушение способности к пролиферации [37].
Когда β-частицы 131I высвобождаются внутри клеток ЩЖ, они проходят в среднем 0,8 мм, прежде чем их энергия полностью поглощается. β-частицы, испускаемые 131I, разрушают функционирующую ткань ЩЖ. Радиобиологическое воздействие 131I на ткани бывает прямым (влияние радиации на ДНК — разрыв молекулярных связей) или косвенным. При косвенном воздействии образуются свободные радикалы, которые вступают в реакцию с макромолекулами в среде микроокружения клеток. Свободные радикалы и оксиданты взаимодействуют с молекулами ДНК, вызывая большое количество разнообразных нарушений ее структуры, обеспечивая локальную деструкцию тиреоцитов. Воздействие ионизирующего излучения приводит к генетическим повреждениям, мутациям или гибели клеток. Таким образом, 131I вызывает обширное местное повреждение и некроз тканей ЩЖ. Основной эффект РЙТ — радиационный тиреоидит. Тяжесть этого эффекта прямо пропорциональна полученной дозе [36]. Целью терапии является подавление функционального состояния клеток и нарушение способности к пролиферации [37]. Эффективная абляция тиреоидной ткани происходит через 8–16 нед с отсутствием возможности выработки тиреоидных гормонов [9, 38].
Эффективная абляция тиреоидной ткани происходит через 8–16 нед с отсутствием возможности выработки тиреоидных гормонов [9, 38].
РОЛЬ NA
+/I–-СИМПОРТЕРА В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ ЩЖ С ИСПОЛЬЗОВАНИЕМ 131I. ЙОДРЕЗИСТЕНТНОСТЬРЙТ основана на способности клеток ЩЖ захватывать и накапливать 131I. Свойство накопления 131I может отсутствовать примерно в 10% случаев высокодифференцированного РЩЖ. В процессе дифференцировки клетки ЩЖ теряют способность накапливать 131I, что делает проведение РЙТ неэффективным лечением [39]. Есть данные, что 18–25% дифференцированных карцином ЩЖ исходно лишены способности к захвату 131I, а 35–50% пациентов перестают реагировать на лечение 131I во время РЙТ [40].
Дисбаланс работы Na+/I–-симпортера, а именно снижение его экспрессии, дефекты белка Na+/I–-симпортера и нарушение его встраивания в плазматическую мембрану — ключевые факторы развития резистентности к РЙТ, приводящие к неэффективности лечения. Мутации в гене NIS и в других генах, таких как RAS (KRAS, HRAS, NRAS), TERTp и BRAF, могут способствовать более низкой экспрессии мРНК и белка Na+/I–-симпортера, а также нарушениям его ориентации на мембране [41]. Описанные генетические альтерации ведут к снижению поглощения 131I и высокому риску рецидива РЩЖ после РЙТ. Как пример, при наличии мутации в гене BRAF представляется возможным использование таргетных препаратов, ингибиторов RAF-киназ (дабрафениб) и MEK (траметиниб), регулирующих MAP-киназный путь. К другим молекулярным маркерам, участвующим в канцерогенезе, относятся хромосомные перестройки RET/PTC, PAX8/PPARG и мутации в генах TP53, PIK3CA и AKT1.
Мутации в гене NIS и в других генах, таких как RAS (KRAS, HRAS, NRAS), TERTp и BRAF, могут способствовать более низкой экспрессии мРНК и белка Na+/I–-симпортера, а также нарушениям его ориентации на мембране [41]. Описанные генетические альтерации ведут к снижению поглощения 131I и высокому риску рецидива РЩЖ после РЙТ. Как пример, при наличии мутации в гене BRAF представляется возможным использование таргетных препаратов, ингибиторов RAF-киназ (дабрафениб) и MEK (траметиниб), регулирующих MAP-киназный путь. К другим молекулярным маркерам, участвующим в канцерогенезе, относятся хромосомные перестройки RET/PTC, PAX8/PPARG и мутации в генах TP53, PIK3CA и AKT1.
Есть как минимум два ключевых агента, контролирующих транспорт и количество Na+/I–-симпортера, — фактор рибозилирования АДФ 4 (ARF4) и валозин-содержащий белок (VCP). ARF4 усиливает везикулярную транспортировку Na+/I–-симпортера от аппарата Гольджи к плазматической мембране, а VCP, находящийся на эндоплазматическом ретикулуме и отвечающий за деградацию, регулирует протеолиз Na+/I–-симпортера. Известно, что экспрессия VCP повышена при агрессивных формах течения РЩЖ и у пациентов с неблагоприятным прогнозом после РЙТ, а продолжительность жизни пациентов радиойодрезистентным РЩЖ, особенно при метастатическом поражении, составляет 3–5 лет [41][42].
Известно, что экспрессия VCP повышена при агрессивных формах течения РЩЖ и у пациентов с неблагоприятным прогнозом после РЙТ, а продолжительность жизни пациентов радиойодрезистентным РЩЖ, особенно при метастатическом поражении, составляет 3–5 лет [41][42].
В экспериментах Fletcher и соавт. абляция ARF4 в NIS+ клетках TPC-1, а также в первичных тиреоцитах человека привела к снижению поглощения 125I от ∼60% до 80%, а сверхэкспрессия ARF4 — к значительному увеличению поглощения 125I. Индукция VCP в этих клетках путем транзиторной трансфекции способствовала подавлению поглощения 125I. Подтверждено, что и ARF4, и VCP регулируют ориентацию Na+/I–-симпортера. Экзогенная экспрессия ARF4 в NIS+-клетках демонстрирует удвоение количества белка Na+/I–-симпортера на плазматической мембране, при этом сверхэкспрессия VCP приводит к его значительному снижению.
Специфических агонистов ARF4 в настоящее время не существует, но можно повлиять на Na+/I–-симпортер путем ингибирования VCP. Два ингибитора VCP, одобренных FDA, а именно клотримазол и эбастин, подавляют VCP-опосредованное снижение активности Na+/I–-симпортера (специфическое ингибирование и аллостерическая регуляция) и способствуют увеличению количества Na+/I–-симпортера на поверхности клеток, а также повышают поглощение РЙ в моделях ЩЖ мыши и человека in vitro [41]. Таким образом, возможно повлиять на успех РЙТ у пациентов с радиойодрезистентным РЩЖ с помощью данной группы препаратов.
Два ингибитора VCP, одобренных FDA, а именно клотримазол и эбастин, подавляют VCP-опосредованное снижение активности Na+/I–-симпортера (специфическое ингибирование и аллостерическая регуляция) и способствуют увеличению количества Na+/I–-симпортера на поверхности клеток, а также повышают поглощение РЙ в моделях ЩЖ мыши и человека in vitro [41]. Таким образом, возможно повлиять на успех РЙТ у пациентов с радиойодрезистентным РЩЖ с помощью данной группы препаратов.
К более известным таргетным препаратам, одобренным FDA и применяемым при радиойодрезистентном РЩЖ, относятся мультикиназные ингибиторы сорафениб и ленватиниб [43]. Они блокируют ангиогенез в опухолевой ткани и ингибируют киназы, задействованные в онкогенных механизмах, тем самым замедляя рост опухоли.
ОБСУЖДЕНИЕ
Многолетний опыт применения радиоактивного йода, современные знания радиобиологии, тераностики и молекулярной генетики составляют основу эффективного и безопасного применения радиоактивности. Изучение фармакокинетики, сопоставление клинических предикторов течения болезни и выбранной модели расчета индивидуальной терапевтической активности позволяют персонализированно использовать радиоизотопы. Оценка фармакодинамики как элемента радиобиологии важна при сопоставлении поглощенной дозы функционирующей ткани ЩЖ с эффектом лечения. Фармакобезопасность радионуклидной терапии основана на совершенствовании методов профилактики вторичных осложнений, снижении лучевой нагрузки и рисков отдаленных эффектов. Технологическое дозиметрическое обеспечение в перспективе позволит более детально описывать поведение йода не только в ткани ЩЖ, но и в организме в целом с учетом накопления в тропных органах. Спектрометрическое оборудование способно определить низкое содержание 131I в образце крови, что позволяет проводить биодозиметрию крови с целью определения максимально допустимой терапевтической активности при проведении радиойодтерапии дифференцированного РЩЖ. Совершенствование оборудования ЯМ, способов ранней диагностики заболеваний ЩЖ и профилактики детерминированных и отсроченных клинических проявлений РЙТ — ключ к дальнейшему развитию технологии персонализированной медицины.
Изучение фармакокинетики, сопоставление клинических предикторов течения болезни и выбранной модели расчета индивидуальной терапевтической активности позволяют персонализированно использовать радиоизотопы. Оценка фармакодинамики как элемента радиобиологии важна при сопоставлении поглощенной дозы функционирующей ткани ЩЖ с эффектом лечения. Фармакобезопасность радионуклидной терапии основана на совершенствовании методов профилактики вторичных осложнений, снижении лучевой нагрузки и рисков отдаленных эффектов. Технологическое дозиметрическое обеспечение в перспективе позволит более детально описывать поведение йода не только в ткани ЩЖ, но и в организме в целом с учетом накопления в тропных органах. Спектрометрическое оборудование способно определить низкое содержание 131I в образце крови, что позволяет проводить биодозиметрию крови с целью определения максимально допустимой терапевтической активности при проведении радиойодтерапии дифференцированного РЩЖ. Совершенствование оборудования ЯМ, способов ранней диагностики заболеваний ЩЖ и профилактики детерминированных и отсроченных клинических проявлений РЙТ — ключ к дальнейшему развитию технологии персонализированной медицины.
Дозиметрическое планирование радиойодтерапии
В совместной работе американских ученых — медицинских физиков E. Quimby и L. Marinelli — представлен опыт оптимизации лечения с использованием радиоактивных веществ.
E. Quimby в 1951 г. представила сферические модели органов, необходимых для расчета поглощенных доз излучения. Наблюдения позволили сделать вывод, что захват исследуемой ткани в фиксированное время после введения сильно зависит от особенностей фармакокинетики человека.
L. Marinelli совместно с E. Quimby акцентировали внимание на важных для расчета терапевтической активности 131I характеристиках фармакокинетики и физико-математического моделирования распространения элементарных частиц. Они предложили максимально простую реализацию комбинации параметров в виде формулы, учитывающей объем ЩЖ, индекс захвата 131-йода, эффективный период выведения 131I и фактор накопления дозы [44]. Ученые стали основоположниками принципа ALARA (As Low As Reasonably Achievable), который был сформулирован в 1954 г. Международной Комиссией по радиологической защите. Данный принцип заключается в минимизации воздействия ионизирующего излучения при достижении эффективности радионуклидной терапии.
Международной Комиссией по радиологической защите. Данный принцип заключается в минимизации воздействия ионизирующего излучения при достижении эффективности радионуклидной терапии.
ЗАКЛЮЧЕНИЕ
Прошло более 80 лет с тех пор, как эндокринолог Saul Hertz впервые использовал радиоактивный йод, терапию которым на данный момент получили большое количество пациентов по всему миру.
Современные представления о радиобиологии и дозиметрии в ЯМ признают, что предложенная Hertz методика эффективна и успешно применяется.
Ученые, принимавшие участие в исследованиях в области теоретической физики и ядерного приборостроения, внесли большой вклад в развитие общих представлений о РЙТ.
William Beierwaltes создал базовые принципы использования РЙТ при РЩЖ, которые легли в основу современной молекулярной тераностической концепции. Сегодня основы молекулярной радиотераностики включены в алгоритм принятия клинических решений и выбора тактики ведения пациентов, а молекулярная тераностика становится перспективным направлением. Методы таргетной радионуклидной терапии являются основой для лечения ряда онкологических заболеваний. Будущее персонализированной ЯМ определит интеграция радиотераностики, мультимодальной визуализации, интраоперационной навигации и существующих/новых методов диагностики и лечения в сочетании с прикладными геномными и постгеномными технологиями.
Методы таргетной радионуклидной терапии являются основой для лечения ряда онкологических заболеваний. Будущее персонализированной ЯМ определит интеграция радиотераностики, мультимодальной визуализации, интраоперационной навигации и существующих/новых методов диагностики и лечения в сочетании с прикладными геномными и постгеномными технологиями.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования.
Госзадание № АААА-А20-120011790174-3 «Радиогеномные предикторы гибридной молекулярной визуализации и радионуклидной терапии эндокринных опухолей».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Бубнову А.А. — за создание графического изображения.
1. Йод был открыт в 1811 г. французским химиком Bernard Courtois. Ученый извлек йод из пепла морских водорослей. Joseph Gay-Lussac, французский химик и физик, признал, что в ходе эксперимента Courtois получил новый элемент, и назвал его iodes — в переводе с греческого значит фиолетовый. В 1914 г. американскому биохимику Edward Calvin Kendall удалось выделить в кристаллической форме «соединение, содержащее йод, которое присутствует в щитовидной железе». Впоследствии оно было названо тироксином [11]. Позже, в 1917 г., обнаружено, что ЩЖ захватывает йод из крови [12]. Несмотря на эти открытия, физиология ЩЖ оставалась тайной еще несколько десятилетий — до того момента, когда впервые с терапевтической целью были использованы изотопы йода [13].
2. В 1930-х годах не существовало комитетов, регулирующих проведение экспериментов на животных. Единственным этическим стандартом являлся личный моральный кодекс исследователей.
3. Исследования на кроликах имели решающее значение: они позволили определить количество йода, которое поглощает ЩЖ. Необходимо было установить терапевтическую активность РИ йода, но в ходе эксперимента стало ясно, что 128I и то количество, которое можно произвести с помощью Ra-Be, не подходит для терапевтического применения, так как полученный изотоп имел 25-минутный период полураспада и мог использоваться только для краткосрочных экспериментов [19].
4. Во время ранних экспериментов Hertz и Roberts, в 1938–1939 гг., допущен один просчет. Дело в том, что с радиоактивным йодом вводилось определенное количество стабильного йода. Ученые не предполагали, что стабильный йод будет конкурировать с РИ йода за поглощение ЩЖ и тем самым уменьшит проникновение РЙ в ткани. В результате расчеты эффективной дозы для будущих клинических исследований были непомерно высоки и оценены в 27 750 МБк для эффективного лечения тиреотоксикоза [25].
5. Уровень метаболизма определяется путем измерения количества кислорода, используемого организмом за определенный промежуток времени. Если измерение производится в состоянии покоя, полученные данные будут показывать уровень базального метаболизма (BMR). Ранее измерение BMR стало одним из первых тестов оценки функции ЩЖ. У пациентов с гипофункцией ЩЖ наблюдался низкий BMR, а у пациентов с гиперфункцией ЩЖ — высокий BMR. Позднее исследования продемонстрировали зависимость BMR от уровня гормонов ЩЖ и показали, что низкий уровень гормонов ЩЖ связан с низким BMR, а высокий уровень — с высоким. Сейчас определение BMR не используют из-за сложности в проведения теста, наличия более достоверных методов исследования, а также из-за того, что BMR подвержен влиянию других факторов кроме функции ЩЖ (например, BMR растет при заболеваниях, сопровождающихся повышением температуры). Нормальный BMR колеблется от -15% до +5%, у пациентов с тиреотоксикозом BMR обычно +20% и более, а при гипотиреозе — BMR -20% и ниже.
Если измерение производится в состоянии покоя, полученные данные будут показывать уровень базального метаболизма (BMR). Ранее измерение BMR стало одним из первых тестов оценки функции ЩЖ. У пациентов с гипофункцией ЩЖ наблюдался низкий BMR, а у пациентов с гиперфункцией ЩЖ — высокий BMR. Позднее исследования продемонстрировали зависимость BMR от уровня гормонов ЩЖ и показали, что низкий уровень гормонов ЩЖ связан с низким BMR, а высокий уровень — с высоким. Сейчас определение BMR не используют из-за сложности в проведения теста, наличия более достоверных методов исследования, а также из-за того, что BMR подвержен влиянию других факторов кроме функции ЩЖ (например, BMR растет при заболеваниях, сопровождающихся повышением температуры). Нормальный BMR колеблется от -15% до +5%, у пациентов с тиреотоксикозом BMR обычно +20% и более, а при гипотиреозе — BMR -20% и ниже.
6. Пациент Keston знал о костных метастазах. Доктора провели сканирование пациента утром 7.12.1941. Определив местонахождение одного метастаза, назначили терапевтическую активность РЙ в размере 370 МКб. Последующее 3-недельное наблюдение показало незначительное поглощение РЙ очагом поражения, демонстрируя положительный эффект от проведенной терапии. Когда в 1944 г. был опубликован отчет о вскрытии пациента, оказалось, что большая часть метастатической опухолевой ткани оказалась недифференцированной, а значит – неспособной накапливать РЙ [31].
Последующее 3-недельное наблюдение показало незначительное поглощение РЙ очагом поражения, демонстрируя положительный эффект от проведенной терапии. Когда в 1944 г. был опубликован отчет о вскрытии пациента, оказалось, что большая часть метастатической опухолевой ткани оказалась недифференцированной, а значит – неспособной накапливать РЙ [31].
7. Девушке было всего 20 лет. Хирургами предпринята попытка удалить опухоль ЩЖ. Кроме опухоли ЩЖ наблюдались увеличенные твердые лимфатические узлы с обеих сторон шеи, полная обструкция трахеи и многочисленные вторичные очаги в легких. Удален один лимфатический узел, выполнена трахеостомия. Диагноз подтвержден: карцинома щитовидной железы. После курса РЙТ опухолевая ткань не выявлена. Появилась возможность удалить трахеостомическую трубку. Легкие на рентгенограмме выглядели практически нормальными. Пациентка набрала вес и была здорова уже через 15 месяцев после первого приезда в больницу [34].
1. Al-jubeh W, Shaheen A, Zalloum O. Radioiodine I-131 for diagnosing and treatment of thyroid diseases.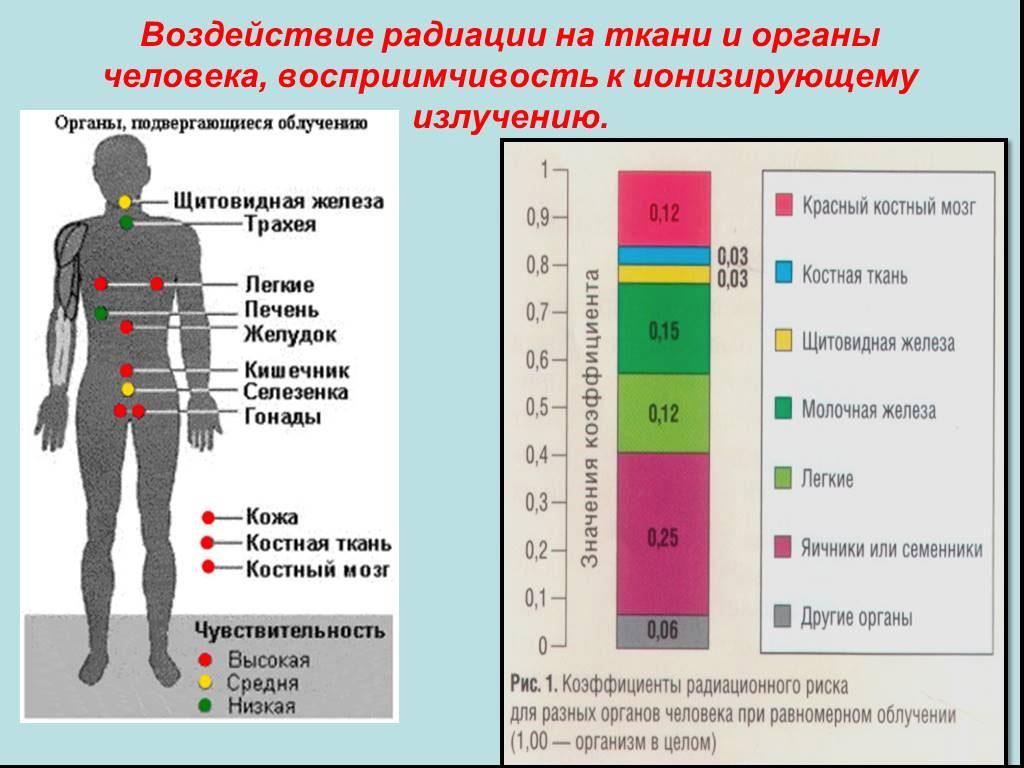 Conf. Paper. 2012;6.
Conf. Paper. 2012;6.
2. Jeelani S, Jagat Reddy R, Maheswaran T, et al. Theranostics: A treasured tailor for tomorrow. J Pharm Bioallied Sci. 2014;6(5):6. doi: https://doi.org/10.4103/0975-7406.137249
3. Blahd W. Ben cassen and the development of the rectilinear scanner. Semin Nucl Med. 1996;26(3):165-170. doi: https://doi.org/10.1016/s0001-2998(96)80021-3
4. Collins J. Molecular, Genetic, And Nutritional Aspects Of Major And Trace Minerals. Elsevier Science; 2016.
5. Kaminsky SM, Levy O, Salvador C, et al. The Na+/I- symporter of the thyroid gland. Soc Gen Physiol Ser. 1993;48:251-262.
6. Джикия Е.Л., Авилов О.Н., Киселева Я.Ю., и др. Na+/i- симпортер (Nis): структура, функции, экспрессия в норме и опухолях // Вестник РНЦРР. — 2018. — Т. 18. — №1. — С. 3.
7. Егоров А.В., Свириденко Н.Ю., Платонова Н.М. Особенности функционального состояния щитовидной железы после проведения диагностических исследований с применением йодсодержащих рентгеноконтрастных средств // Проблемы Эндокринологии. — 2005. — Т. 51. — №1. — С.50-52. doi: https://doi.org/10.14341/probl200551150-52
— 2005. — Т. 51. — №1. — С.50-52. doi: https://doi.org/10.14341/probl200551150-52
8. Wolff J, Chaikoff I. Plasma inorganic iodide as a homeostatic regulator of thyroid function. Journal of Biological Chemistry. 1948;174(2):555-564. doi: https://doi.org/10.1016/s0021-9258(18)57335-x
9. Akbulut A, Aydinbelge F, Koca G. Radioiodine Treatment for Benign Thyroid Diseases. Radionuclide Treatments. 2017. doi: https://doi.org/10.5772/intechopen.68575
10. Iakovou I, Giannoula E, Exadaktylou P, Papadopoulos N. RAI Therapy for Graves’ Hyperthyroidism. In: Graves’ Disease. IntechOpen; 2021. doi: https://doi.org/10.5772/intechopen.96083
11. Kendall EC. The isolation in crystalline form of the compound containing iodin, which occurs in the thyroid. J Am Med Assoc. 1915;LXIV(25):2042. doi: https://doi.org/10.1001/jama.1915.02570510018005
12. Marine D, Kimball OP. The Journal of Laboratory and Clinical Medicine. October, 1917. Volume III, No. 1, Pages 40-49. The prevention of simple goiter in man. A survey of the incidence and types of thyroid enlargements in the schoolgirls of Akron (Ohio), from the 5th to the 12th grades, inclusivethe plan of prevention proposed. Nutr Rev. 1975;33(9):272-275. doi: https://doi.org/10.1111/j.1753-4887.1975.tb05112.x
A survey of the incidence and types of thyroid enlargements in the schoolgirls of Akron (Ohio), from the 5th to the 12th grades, inclusivethe plan of prevention proposed. Nutr Rev. 1975;33(9):272-275. doi: https://doi.org/10.1111/j.1753-4887.1975.tb05112.x
13. van Isselt J.W.. Dosage assessment for radioiodine therapy in benign thyroid disorders. Thesis University Utrecht; 2001.
14. Radvanyi P, Villain J. The discovery of radioactivity. Comptes Rendus Physique. 2017;18(9-10):544-550. doi: https://doi.org/10.1016/j.crhy.2017.10.008
15. FERMI E. Radioactivity Induced by Neutron Bombardment. Nature. 1934;133(3368):757-757. doi:10.1038/133757a0
16. Hertz BE, Schuller KE. Saul Hertz, MD (1905-1950): A Pioneer in the Use of Radioactive Iodine. Endocr Pract. 2010;16(4):713-715. doi: https://doi.org/10.4158/EP10065.CO
17. Borges de Souza P, McCabe C. Radioiodine treatment: an historical and future perspective. Endocr Relat Cancer. 2021;28(10):121-124. doi: https://doi.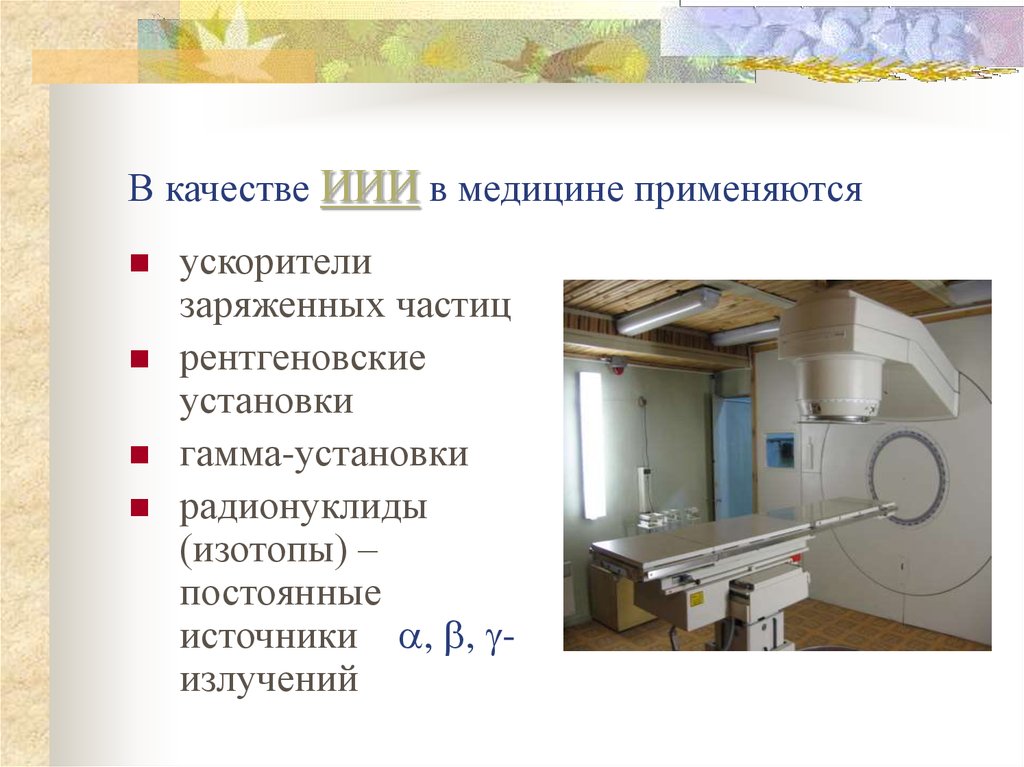 org/10.1530/erc-21-0037
org/10.1530/erc-21-0037
18. Fahey FH, Grant FD, Thrall JH. Saul Hertz, MD, and the birth of radionuclide therapy. EJNMMI Phys. 2017;4(1):15. doi: https://doi.org/10.1186/s40658-017-0182-7
19. Ehrhardt Jr J, Güleç S. A Review of the History of Radioactive Iodine Theranostics: The Origin of Nuclear Ontology. Mol Imaging Radionucl Ther. 2020;29(3):88-97. doi: https://doi.org/10.4274/mirt.galenos.2020.83703
20. Compton K. Letter to Saul Hertz: Hertz Family Archive December 15;1936.
21. Hertz S, Roberts A, Evans R. Radioactive Iodine as an Indicator in the Study of Thyroid Physiology. Experimental Biology and Medicine. 1938;38(4):510-513. doi: https://doi.org/10.3181/00379727-38-9915p
22. Joliot F, Curie I. Artificial Production of a New Kind of Radio-Element. Nature. 1934;133(3354):201-202. doi: https://doi.org/10.1038/133201a0
23. Livingood J, Seaborg G. Radioactive Iodine Isotopes. Physical Review. 1938;53(12):1015-1015. doi: https://doi.org/10.1103/physrev. 53.1015.2
53.1015.2
24. Hamilton J. The rates of absorption of the radioactive isotopes of sodium, potassium, chlorine, bromine, and iodine in normal human subjects. American Journal of Physiology-Legacy Content. 1938;124(3):667-678. doi: https://doi.org/10.1152/ajplegacy.1938.124.3.667
25. Sawin C, Becker D. Radioiodine and the Treatment of Hyperthyroidism: The Early History *. Thyroid. 1997;7(2):163-176. doi: https://doi.org/10.1089/thy.1997.7.163
26. Proceedings of the thirty-fourth annual meeting of the American society for clinical investigation held in Atlantic city, N. J., May 4, 1942. J Clin Invest. 1942;21(5):619-649. doi: https://doi.org/10.1172/JCI101340
27. Hertz S, Roberts A. Radioactive iodine in the study of thyroid physiology; the use of radioactive iodine therapy in hyperthyroidism. J Am Med Assoc. 1946;131:81-86. doi: https://doi.org/10.1001/jama.1946.02870190005002
28. Chapman EM, Evans RD. The treatment of hyperthyroidism with radioactive iodine. J Am Med Assoc. 1946;131:86-91. doi: https://doi.org/10.1001/jama.1946.02870190010003
1946;131:86-91. doi: https://doi.org/10.1001/jama.1946.02870190010003
29. Hamilton J. The Use of Radioactive Tracers in Biology and Medicine. Radiology. 1942;39(5):541-572. doi: https://doi.org/10.1148/39.5.541
30. Keston A, Ball R, Frantz V, Palmer W. Storage of radioactive iodine in a metastasis from thyroid carcinoma. Science (1979). 1942;95(2466):362-363. doi: https://doi.org/10.1126/science.95.2466.362
31. Frantz V, Ball R, Keston A, Palmer W. Thyroid carcinoma with metastases. Ann Surg. 1944;119(5):668-689. doi: https://doi.org/10.1097/00000658-194405000-00003
32. Seidlin S, Oshry E, Yalow A. Spontaneous and experimentally induced uptake of radioactive iodine in metastases from thyroid carcinoma: a preliminary report*†. The Journal of Clinical Endocrinology & Metabolism. 1948;8(6):423-432. doi: https://doi.org/10.1210/jcem-8-6-423
33. Seidlin SM, Marinelli LD, Oshry E. Radioactive iodine therapy; effect on functioning metastases of adenocarcinoma of the thyroid. J Am Med Assoc. 1946;132(14):838-847. doi: https://doi.org/10.1001/jama.1946.02870490016004
J Am Med Assoc. 1946;132(14):838-847. doi: https://doi.org/10.1001/jama.1946.02870490016004
34. Smithers D. Some Varied Applications of Radioactive Isotopes to the Localisation and Treatment of Tumours. Acta radiol. 1951;35(1):49-61. doi: https://doi.org/10.3109/00016925109136645
35. Hertz S. Use of radioactive iodine in the diagnosis, study and treatment of diseases of the thyroid. Progress in Clinical Endocrinology 1950;65-78
36. Dobyns B, Vickery A, Maloof F, Chapman E. Functional and histologic effects of therapeutic doses of radioactive iodine on the thyroid of man*. The Journal of Clinical Endocrinology & Metabolism. 1953;13(5):548-567. doi: https://doi.org/10.1210/jcem-13-5-548
37. Pouget J, Lozza C, Deshayes E, et al. Introduction to Radiobiology of Targeted Radionuclide Therapy. Front Med (Lausanne). 2015;2. doi: https://doi.org/10.3389/fmed.2015.00012
38. Bahn R. Graves’ Disease. New York: Springer; 2015. 344 p.
39. Семенов Д.Ю., Борискова М. Е., Фарафонова У.В., и др. Прогностическое значение экспрессии натрий-йодного симпортера для высокодифференцированного рака щитовидной железы // Клиническая и экспериментальная тиреоидология. — 2015. — Т. 11. — №1. — С. 50-58.
Е., Фарафонова У.В., и др. Прогностическое значение экспрессии натрий-йодного симпортера для высокодифференцированного рака щитовидной железы // Клиническая и экспериментальная тиреоидология. — 2015. — Т. 11. — №1. — С. 50-58.
40. Spitzweg C, Bible K, Hofbauer L, Morris J. Advanced radioiodine-refractory differentiated thyroid cancer: the sodium iodide symporter and other emerging therapeutic targets. The Lancet Diabetes & Endocrinology. 2014;2(10):830-842. doi: https://doi.org/10.1016/s2213-8587(14)70051-8
41. Fletcher A, Read M, Thornton C, et al. Targeting Novel Sodium Iodide Symporter Interactors ADP-Ribosylation Factor 4 and Valosin-Containing Protein Enhances Radioiodine Uptake. Cancer Res. 2019;80(1):102-115. doi: https://doi.org/10.1158/0008-5472.can-19-1957
42. Schlumberger M, Brose M, Elisei R et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer. The Lancet Diabetes & Endocrinology. 2014;2(5):356-358. doi: https://doi. org/10.1016/s2213-8587(13)70215-8
org/10.1016/s2213-8587(13)70215-8
43. Mufazalov F, Sharipova N. Current status of differetiated radioactive iodine-resistant thyroid cancer: case report of successful long-term treatment with sorafenib. Malignant tumours. 2015;(3):24. doi: https://doi.org/10.18027/2224-5057-2015-3-24-33
44. Marinelli L. Dosage determination in the use of radioactive isotopes. Journal of Clinical Investigation. 1949;28(6 Pt1):1271-1280. doi: https://doi.org/10.1172/jci102194
Радиация в здравоохранении: ядерная медицина | Радиация | NCH
Ядерная медицина использует радиоактивный материал внутри тела, чтобы увидеть, как функционируют органы или ткани (для диагностики), или для нацеливания и уничтожения поврежденных или больных органов или тканей (для лечения).
Ядерная медицина в сравнении с обычными процедурами визуализации с использованием рентгеновских лучей: как они работают
| Ядерная медицина | рентген |
| Радиоактивный материал (индикатор) при введении, проглатывании или вдыхании | Лучи излучения проходят через тело |
Изображения тела показывают, где и как впитывается индикатор. | Производятся изображения структуры тела |
| Показывает функцию | Показывает структуру |
| Используется для диагностики или лечения | Используется в диагностике |
Несмотря на то, что мы все ежедневно подвергаемся воздействию ионизирующего излучения из окружающей среды, дополнительное воздействие, например, в результате процедур ядерной медицины, может немного увеличить риск развития рака в более позднем возрасте.
Поговорите со своим лечащим врачом, чтобы выбрать наилучшую процедуру для вашего здоровья и обсудить любые проблемы, которые у вас есть.
Что вам следует знать
Ваш поставщик медицинских услуг может порекомендовать процедуру ядерной медицины для диагностики или лечения проблем со здоровьем.
Использование для диагностики
Ядерная медицина может показать, как функционируют органы или ткани. Для большинства диагностических процедур индикатор, содержащий радиоактивный материал, вводят, проглатывают или вдыхают. Затем поставщик медицинских услуг или радиолог (медицинский работник, прошедший специальную подготовку по использованию радиации в здравоохранении) использует детектор радиации, чтобы увидеть, сколько индикатора поглощается или как он реагирует в органе или ткани. Это даст провайдеру информацию о том, насколько хорошо он работает.
Затем поставщик медицинских услуг или радиолог (медицинский работник, прошедший специальную подготовку по использованию радиации в здравоохранении) использует детектор радиации, чтобы увидеть, сколько индикатора поглощается или как он реагирует в органе или ткани. Это даст провайдеру информацию о том, насколько хорошо он работает.
Обычно ядерная медицина используется для диагностики:
- Сканирование сердца, легких, почек, желчного пузыря и щитовидной железы
В методе ядерной медицины, называемом позитронно-эмиссионной томографией (ПЭТ), индикатор используется для отображения естественной активности клеток, предоставляя более подробную информацию о том, как работают органы и есть ли повреждения клеток. ПЭТ часто сочетают с компьютерной томографией (КТ) или магнитно-резонансной томографией (МРТ), которые обеспечивают трехмерное изображение органа.
Обычное использование ПЭТ-сканирования включает:
- Диагностику болезней сердца, болезни Альцгеймера и заболеваний головного мозга
- Получение подробной информации о раковых опухолях для выбора наилучшего варианта лечения
При использовании в лечебных целях
При использовании в лечебных целях индикатор нацеливается на вредный орган или ткань, а радиоактивность повреждает или останавливает рост их клеток.
Два распространенных применения ядерной медицины для лечения включают терапию радиоактивным йодом и брахитерапию (форма лучевой терапии, при которой закрытый источник излучения помещается внутрь или рядом с областью, требующей лечения).
Что ожидать
Найдите информацию об особых особенностях беременных женщин и детей.
Перед процедурой
- Вы получите индикатор либо в виде инъекции, ингаляции (вдыхания), либо в виде таблетки или вещества для проглатывания.
- Возможно, вам придется подождать некоторое время, пока индикатор пройдет через ваше тело к диагностируемой или лечащейся ткани или органу.
Во время процедуры
- Вас могут попросить лечь на стол или пройтись по беговой дорожке.
- Над вашим телом будет размещена камера, регистрирующая радиацию, для сбора информации о том, как индикатор действует на орган или ткань.
После процедуры
- Радиолог и ваш поставщик медицинских услуг используют эту информацию, чтобы увидеть, как функционирует орган или ткань.

- Радиоактивный материал из индикатора выводится из вашего тела в течение от нескольких часов до нескольких дней, в зависимости от типа индикатора и теста, который вы получаете.
Когда вы идете домой
Сразу после процедуры ваше тело очень слабо радиоактивно (выделяет радиацию), но это проходит со временем и не представляет прямого вреда для окружающих. Ваш лечащий врач может дать вам специальные инструкции, чтобы помочь уменьшить любое небольшое количество радиации, которое вы испускаете, подвергая других облучению, например частое мытье рук. Употребление большого количества воды может помочь радиоактивному материалу быстрее покинуть ваше тело.
- Перед отъездом спросите у своего поставщика медицинских услуг, есть ли шаги, которые вы должны предпринять, чтобы защитить других, или если у вас есть какие-либо опасения или вопросы относительно информации, которую вы получили.
- Поговорите со своим лечащим врачом, если вы в настоящее время кормите грудью.

Фотография аппарата, используемого для сканирования щитовидной железы
Узнайте больше о преимуществах и рисках визуализирующих исследований, включая ядерную медицину, и о том, как уменьшить воздействие радиации.
Доза ионизирующего излучения для этих процедур обычно выше, чем доза, полученная при обычной рентгенологической процедуре. Всегда существуют некоторые возможные риски от воздействия ионизирующего излучения в здравоохранении, но эти процедуры следует использовать, когда польза для здоровья перевешивает эти риски.
Преимущества и риски ядерной медицины
Преимущества
- Предоставляет информацию о том, как работают органы, ткани и клетки. (Другие распространенные процедуры визуализации показывают только структуры.)
- Может также использоваться в таргетных методах лечения для уничтожения или повреждения вредных или раковых клеток, уменьшения размера опухолей или уменьшения боли.
Риски
- Дозы облучения обычно выше, чем при обычной визуализации, такой как рентген.
 Это означает, что эти процедуры немного повышают вероятность того, что вы заболеете раком в более позднем возрасте.
Это означает, что эти процедуры немного повышают вероятность того, что вы заболеете раком в более позднем возрасте. - Некоторые процедуры ядерной медицины длятся дольше и требуют большего количества радиации, чем другие. Это может вызвать покраснение кожи и выпадение волос.
- Вы можете получить небольшое количество радиации сразу после процедуры, и вам необходимо принять меры для защиты других от облучения.
Связанные ресурсы
- Процедуры ядерной медицины и диагностикиexternal icon
- Изображение Аккуратно внешний значок
- Ядерная медицина: что это такое и чем она не является external icon
- Медицинская визуализация для пациентовexternal icon
Что такое процедуры ядерной медицины?
Процедуры ядерной медицины используются для диагностики и лечения некоторых заболеваний. В этих процедурах используются радиоактивные материалы, называемые радиофармпрепаратами. Примерами заболеваний, которые лечат методами ядерной медицины, являются гипертиреоз, рак щитовидной железы, лимфомы и боли в костях, вызванные некоторыми видами рака.
Количество радиоактивных материалов, используемых для диагностики заболеваний, зависит от потребностей человека и варьируется от небольшого до большого количества. Эти материалы проходят через различные органы тела и в некоторых случаях поглощаются определенными органами или тканями. Излучение, которое исходит от радиофармацевтического препарата, используется для лечения или регистрируется камерой для получения изображений соответствующего органа, области или ткани тела.
Что происходит во время процедуры визуализации ядерной медицины?
- Во время процедуры визуализации в ядерной медицине врачи дают пациентам радиофармпрепараты. В зависимости от вида медицинского обследования их можно вдыхать (вдыхать), вводить или проглатывать.
- После введения радиофармпрепарата пациента обычно просят лечь на стол. Специальная камера, регистрирующая радиацию, размещается над телом пациента и делает снимки. Компьютер используется, чтобы показать, где тело концентрирует радиоактивный материал.
 Это позволяет врачам проверять, правильно ли работают органы, и диагностировать заболевания.
Это позволяет врачам проверять, правильно ли работают органы, и диагностировать заболевания. - Радиоактивные материалы обычно покидают организм в течение от нескольких часов до нескольких месяцев.
image icon[JPG — 31 КБ]
Фотография аппарата, используемого для сканирования щитовидной железы (щелкните, чтобы увеличить)
Что такое радиоактивные материалы?
Радиоактивные материалы представляют собой химические вещества, выделяющие излучение (энергию). Радиоактивные материалы могут быть природными или искусственными. Они могут быть твердыми (например, некоторые горные породы на Земле) или жидкими, а также могут быть газами, которыми люди могут дышать (например, радон). Каждый радиоактивный материал имеет уникальный период полураспада, который показывает, как быстро он перестает быть радиоактивным.
Связаны ли какие-либо последствия для здоровья с процедурами ядерной медицины?
Комиссия по ядерному регулированию (NRC), Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и штаты регулируют использование радиоактивных материалов в ядерной медицине, чтобы обеспечить безопасность пациентов, медицинского персонала и населения. Прежде чем использовать любой тип процедуры ядерной медицины, необходимо обосновать, чтобы преимущества процедур перевешивали риски для пациента. Однако воздействие слишком большого количества радиации может быстро повредить органы или ткани, в то время как воздействие любого количества радиации может привести к увеличению риска развития рака спустя годы после воздействия. Image Gentlyexternal icon – это кампания, призывающая медицинские учреждения использовать количество радиоактивного материала «детского размера» при проведении ребенку процедуры ядерной медицины.
Прежде чем использовать любой тип процедуры ядерной медицины, необходимо обосновать, чтобы преимущества процедур перевешивали риски для пациента. Однако воздействие слишком большого количества радиации может быстро повредить органы или ткани, в то время как воздействие любого количества радиации может привести к увеличению риска развития рака спустя годы после воздействия. Image Gentlyexternal icon – это кампания, призывающая медицинские учреждения использовать количество радиоактивного материала «детского размера» при проведении ребенку процедуры ядерной медицины.
Какие существуют распространенные процедуры ядерной медицины?
Существует несколько методов ядерной медицины для диагностики и лечения болезней.
Ниже приведены некоторые распространенные процедуры:
Диагностические процедуры
- Болезнь сердца можно диагностировать с помощью стресс-теста с использованием Sestamibi, содержащего технеций-99m, или с помощью позитронно-эмиссионной томографии (ПЭТ).
 Дополнительную информацию о том, как ПЭТ-сканирование используется в ядерной медицине, см. в разделе ниже.
Дополнительную информацию о том, как ПЭТ-сканирование используется в ядерной медицине, см. в разделе ниже. - Проблемы с желчным пузырем можно диагностировать с помощью сканирования гепатобилиарной иминодиуксусной кислоты (HIDA), которое содержит индикатор радиоактивного материала, обычно технеций-99m.
- Заболевание щитовидной железы можно диагностировать с помощью сканирования щитовидной железы с радиоактивным йодом, в котором используется йод натрия, содержащий йод-131.
Терапевтические процедуры
- Радиоиммунотерапия, при которой радиоактивный элемент, такой как йод-133 90, связывается с антителом, нацеленным на конкретную раковую клетку.
- Абляция щитовидной железы с использованием йодида натрия, содержащего йодид-131.
- Брахитерапия, при которой радиоактивный источник, такой как иридий-192, вводится внутрь или рядом с опухолью, чтобы убить раковые клетки, не затрагивая соседние клетки.
Как используются ПЭТ-сканы?
Врачи используют ПЭТ для получения дополнительных данных о функционировании органов тела. ПЭТ-сканирование может выполняться вместе с компьютерной аксиальной томографией (CAT), которая обеспечивает изображение органа. ПЭТ-сканирование дает четкое представление о том, как органы работают на клеточном уровне и не повреждены ли они. Сканирование помогает врачам определить эффективные варианты лечения. ПЭТ обычно используется для диагностики сердечных заболеваний, помогает врачам определить подходящее лечение рака, помогает в диагностике болезни Альцгеймера и заболеваний головного мозга. Они также могут предоставить данные для медицинских исследований.
ПЭТ-сканирование может выполняться вместе с компьютерной аксиальной томографией (CAT), которая обеспечивает изображение органа. ПЭТ-сканирование дает четкое представление о том, как органы работают на клеточном уровне и не повреждены ли они. Сканирование помогает врачам определить эффективные варианты лечения. ПЭТ обычно используется для диагностики сердечных заболеваний, помогает врачам определить подходящее лечение рака, помогает в диагностике болезни Альцгеймера и заболеваний головного мозга. Они также могут предоставить данные для медицинских исследований.
Cdc-pdfзначок pdfвнешний значокВнешнийзначок pdfвнешний значок
- Процедуры ядерной медицины и диагностикиВнешнийвнешний значок
- Изображение мягко и внешний значок SNMExternal
- Что такое ядерная медицина?Внешний внешний значок
- Что такое молекулярная визуализация? Внешний внешний значок
- PET Professional Resources and Outreach SourceCdc-pdfExternalpdf iconexternal icon
- Ядерная медицина: что это такое и чем она не являетсяВнешнийвнешний значок
Радиация в медицине: палка о двух концах — Harvard Health Publications
Следует использовать рентген, компьютерную томографию и другие процедуры
рассудительно.
Диагностика болезни сердца без вскрытия грудной клетки и осмотра сердце похоже на попытку сказать, что не так с двигателем автомобиля не открывая капот. Лечение сердечных заболеваний без «открыть капот» еще более проблематично.
Тем не менее, врачи придумали множество способов исследовать
сердце снаружи. Они могут открыть закупоренные артерии без
открытие грудной клетки и когда-нибудь починит таким образом неисправные клапаны.
Радиация является ключом к этим достижениям. Но везде, где радиация
был использован, он оказался острым как бритва
обоюдоострый меч. Медицина не исключение. Радиационные предложения
исключительные преимущества для диагностики широкого спектра
болезней и недомоганий, от сломанных костей до сердечных заболеваний. это
является основой для лечения некоторых видов рака. Тем не менее воздействие
радиация может также повредить ДНК, руководство по эксплуатации клетки.
Это повреждение может привести к неконтролируемому делению клеток, что является отличительной чертой
рака. Чем больше доза, тем выше риск
развивающийся рак. Этот тонкий баланс между выгодой и риском
требует разумного и надлежащего использования радиации для
диагностики и лечения заболеваний.
Чем больше доза, тем выше риск
развивающийся рак. Этот тонкий баланс между выгодой и риском
требует разумного и надлежащего использования радиации для
диагностики и лечения заболеваний.
Стремительный рост
Каждый из нас подвергается воздействию небольшого количества космического излучения. лучи, природный газ радон и радиоактивные вещества в Земле. Средняя доза от этого так называемого фона радиация составляет 3 миллизиверта (мЗв) в год. Это крошечная сумма радиации, которая мало влияет на здоровье.
До конца 19 века радиационный фон был
единственный вид вокруг. Все изменилось с открытием рентгеновских лучей
и радиоактивные минералы и их использование в медицине, энергетике
генерация, война и множество других приложений. Посредством
рано 1980-е, радиация от медицинских процедур, атомная энергетика
заводы и радиоактивные осадки от ядерных испытаний, а также небольшие
суммы от детекторов дыма, телевизоров и компьютеров
были добавлены мониторы, сканеры безопасности аэропортов и другие виды использования. еще 0,5 мЗв в год. С тех пор использование радиации в
медицина выросла настолько, что теперь она конкурирует с фоном
радиации, добавляя в среднем 3 мЗв на человека каждый год, говорит
Национальный совет по радиационной защите и измерению.
Большая часть увеличения связана с быстрым ростом использования
компьютерная томография (КТ), которая дает гораздо больше радиации
чем обычные рентгеновские лучи ( Health Physics , ноябрь 2008 г.).
еще 0,5 мЗв в год. С тех пор использование радиации в
медицина выросла настолько, что теперь она конкурирует с фоном
радиации, добавляя в среднем 3 мЗв на человека каждый год, говорит
Национальный совет по радиационной защите и измерению.
Большая часть увеличения связана с быстрым ростом использования
компьютерная томография (КТ), которая дает гораздо больше радиации
чем обычные рентгеновские лучи ( Health Physics , ноябрь 2008 г.).
Облучение от тестов или процедур | |
Тест или процедура | Эффективная доза облучения в миллизивертах* (мЗв) |
Стоматологический рентген | 0,005 |
Рентгенограмма грудной клетки | 0,02 |
Маммография | 0,7 |
Сканирование коронарного кальция | 1–3 |
Радиационный фон за год | 3 |
КТ брюшной полости | 10 |
КТ сердца | |
64-срез | 7–23 |
320-срез | 10–18 |
Ангиопластика | 7–57 |
Стресс-тест с технецием | 6–15 |
Стресс-тест с таллием | 17 |
Двойной изотопный стресс-тест | 18–38 |
Ангиограмма | 2–23 |
эхокардиография | |
Магнитно-резонансная томография (МРТ) | |
* Зиверт отражает биологические эффекты радиации. | |
Источники: Американский колледж радиологии; Физика здоровья Общество; исследовательские и обзорные статьи |
Экспозиция варьируется
Количество радиации, которое вы можете получить при медицинском обследовании или процедура сильно различается. Рентгенограмма грудной клетки находится в нижней части шкала, при 0,02 мЗв. Оттуда она повышается: от 1 до 3 мЗв за сканирование кальция коронарной артерии, от 2 до 23 мЗв для ангиограммы, от 7 до 23 мЗв для КТ сердца, от 6 до 38 мЗв для ядерного стресса тест и от 7 до 57 мЗв для ангиопластики.
Почему такие большие диапазоны? Ангиограмма требует повторного
рентгеновские снимки, чтобы врач, выполняющий его, мог видеть катетер (проволоку) как
он или она мягко маневрирует им от кровеносного сосуда в запястье или
пахать в сердце. У некоторых людей артерии более извитые. чем другие, и требуется больше времени (и больше рентгеновских снимков), чтобы вести
катетер в сердце. Необходимость ангиопластики, открывающей артерии
еще больше рентгеновских снимков, чтобы врач мог направить баллон в
правильное место в заблокированной коронарной артерии, чтобы убедиться, что
баллон устранил закупорку, и чтобы убедиться, что стент
прочно стоит на месте. Ядерные стресс-тесты различаются в зависимости от
используется радиоактивный элемент и вводится ли он
во время упражнений, отдыха или того и другого.
чем другие, и требуется больше времени (и больше рентгеновских снимков), чтобы вести
катетер в сердце. Необходимость ангиопластики, открывающей артерии
еще больше рентгеновских снимков, чтобы врач мог направить баллон в
правильное место в заблокированной коронарной артерии, чтобы убедиться, что
баллон устранил закупорку, и чтобы убедиться, что стент
прочно стоит на месте. Ядерные стресс-тесты различаются в зависимости от
используется радиоактивный элемент и вводится ли он
во время упражнений, отдыха или того и другого.
КТ сердца (иногда называемая КТ-ангиографией сердца) новичок в этой сфере. Он используется для проверки на кальций в артерий и проходит испытания в качестве альтернативы ангиограммам для выявить закупорку коронарных артерий. Также проводится КТ сердца. продается как «сканирование сердца» для людей, обеспокоенных сердечными заболеваниями.
Количество излучения от КТ сердца варьируется в широких пределах. Ан
международное исследование процедуры в 50 медицинских центрах показало
что доза варьировалась от одной модели компьютерного томографа к другой, в зависимости от того, как
машина эксплуатировалась, и были ли радиационно-снижающие
методы были использованы ( Журнал американского медицинского
Ассоциация , 4 февраля 2009 г. ).
).
Уравновешивание
В целом, риск рака от одного медицинского теста или процедура низкая. Комитет Национальной академии наук по Биологические эффекты ионизирующего излучения оценивают, что для на каждую 1000 человек, подвергшихся облучению 10 мЗв (количество от КТ брюшной полости), облучение добавит один дополнительный случай рака до 420 «естественных» случаев, ожидаемых по мере того, как эти люди уходят через жизнь.
Но стремительный рост использования КТ — с восьми миллионов в 1990 году до 62 миллионов сегодня — предполагает, что медицинские визуализация может увеличить бремя рака. Отчет из Центр радиологических исследований Колумбийского медицинского университета По оценкам Центра, излучение от компьютерной томографии в настоящее время составляет 1,5% всех случаев рака в США.
Возраст — большой фактор. Обычно требуется от 10 до 20 лет, прежде чем ДНК
поврежденный малой дозой радиации приводит к раку. Чем ты старше
тем ниже вероятность того, что радиация представляет угрозу. С другой стороны, опасность радиации выше для
детей и молодых людей.
С другой стороны, опасность радиации выше для
детей и молодых людей.
Защита себя
Большинство тестов на сердечные заболевания важны, даже необходимы. А стресс-тест с использованием таллия или технеция может показать, как сердце работает, когда ему нужно больше работать. Ангиограмма может выявить сильно суженные или заблокированные артерии, которые необходимо открыть.
Однако некоторые тесты могут не стоить полученного излучения. значение сканирования коронарного кальция и КТ сердца еще не были установлены, особенно когда они используются для здоровых людям «просто посмотреть», в какой форме находятся артерии сердца.
Вы бы никогда не согласились на операцию, если бы она не была вам нужна. Похожий
Принцип должен применяться к медицинскому тестированию, связанному с радиацией.
— не соглашайтесь на это и не просите об этом, если это не даст вам и
ваш доктор важную информацию о вашем здоровье или вашем теле.
И даже тогда, посмотрите, возможно ли получить наименьшую дозу
Возможна радиация.
Как люди подвергаются воздействию рентгеновских и гамма-лучей?
Люди могут подвергаться воздействию этого типа излучения из 3 основных источников:
- Естественный радиационный фон возникает из-за космических лучей из нашей Солнечной системы и радиоактивных элементов, обычно присутствующих в почве. Это основной вклад в глобальное радиационное облучение.
- Медицинское излучение используется для рентгенографии, компьютерной томографии и других тестов, а также для лучевой терапии. Лучевая терапия используется для лечения некоторых видов рака и включает дозы, во много тысяч раз превышающие дозы, используемые при диагностическом рентгеновском излучении.
- Немедицинское техногенное излучение используется в небольших количествах для облучения пищевых продуктов, сканеров безопасности аэропортов и некоторых потребительских товаров. Воздействие искусственного излучения может произойти на определенных рабочих местах или в населенных пунктах в результате наземных испытаний ядерного оружия и ядерных аварий.

Естественный фон Радиация
Мы все подвергаемся воздействию радиации просто потому, что находимся на этой планете. Это известно как фоновое излучение . В Соединенных Штатах это в среднем около 3 мЗв в год. Для большинства людей фоновое излучение является основной причиной воздействия ионизирующего излучения в течение года. Он поступает из нескольких разных источников.
Космические лучи
Космические лучи — это радиоактивные частицы, попадающие на Землю из космоса. Они исходят от Солнца и от других звезд. Земная атмосфера блокирует часть этих лучей, но некоторые из них достигают земли.
Поскольку атмосфера блокирует некоторые космические лучи, воздействие выше на больших высотах. Например, люди, живущие в Денвере, штат Колорадо, расположенном на большой высоте, подвергаются немного большему воздействию космических лучей, чем люди, живущие на уровне моря. Люди также подвергаются более высокому уровню космических лучей во время полетов на самолетах. Пилоты авиакомпаний и бортпроводники, которые проводят много часов на большой высоте, подвергаются большему воздействию этих лучей, но неясно, подвержены ли они повышенному риску рака из-за этого.
Пилоты авиакомпаний и бортпроводники, которые проводят много часов на большой высоте, подвергаются большему воздействию этих лучей, но неясно, подвержены ли они повышенному риску рака из-за этого.
Радиация в земле
Люди также подвергаются воздействию небольшого количества радиации от радиоактивных элементов, которые естественным образом встречаются в горных породах и почве. Некоторые из них могут оказаться в строительных материалах, используемых в домах и других сооружениях. Небольшое количество радиации может быть обнаружено даже в питьевой воде и некоторых продуктах растительного происхождения в результате контакта с почвой. Для курящих людей табак может составлять значительную часть ежегодного облучения, которое они получают.
Радон
Крупнейшим источником естественного радиационного фона для большинства людей является радон. Это бесцветный газ без запаха, который образуется при распаде радиоактивных элементов в земле. Уровни радона обычно выше внутри зданий и домов, особенно на уровнях ближе к земле, таких как подвалы. Уровни радона могут сильно различаться в зависимости от того, где вы живете или работаете. Например, воздействие выше для людей, которые работают в шахтах. Для получения более подробной информации о радоне и его возможном воздействии на здоровье см. Радон .
Уровни радона могут сильно различаться в зависимости от того, где вы живете или работаете. Например, воздействие выше для людей, которые работают в шахтах. Для получения более подробной информации о радоне и его возможном воздействии на здоровье см. Радон .
Медицинское излучение
Рентгеновские лучи, гамма-лучи и другие формы ионизирующего излучения используются для диагностики и лечения некоторых заболеваний. Это может быть в виде излучения, проникающего извне в организм, или радиоактивных частиц, которые проглатываются или вводятся в организм.
Визуализирующие исследования
Определенные типы визуализирующих исследований, такие как рентген, компьютерная томография и тесты ядерной медицины (такие как ПЭТ-сканирование и сканирование костей), подвергают людей воздействию низких уровней радиации для создания внутренних изображений тела . (Некоторые тесты визуализации, такие как МРТ и УЗИ, не подвергают людей воздействию ионизирующего излучения. )
)
У взрослых: Уровень радиации варьируется в зависимости от теста. Например, облучение при рентгенографии грудной клетки в двух проекциях составляет около 0,1 мЗв, тогда как облучение при обычной КТ грудной клетки составляет около 7 или 8 мЗв. Воздействие при ПЭТ/КТ (сочетающем ПЭТ-сканирование тела с КТ-сканированием) может достигать 30 мЗв. Рентгеноскопия, которая использует рентгеновские лучи для создания движущихся изображений в реальном времени, похожа на получение множества рентгеновских снимков подряд. Он подвергает людей различному количеству радиации в зависимости от того, как долго он используется. Количество излучения, используемого во многих тестах визуализации, со временем уменьшилось по мере совершенствования технологий.
У детей: Радиационное воздействие также зависит от теста. Если параметры сканера не отрегулированы в соответствии с размером тела, уровни экспозиции могут быть выше, чем для взрослого человека. Например, одно исследование показало, что КТ брюшной полости может подвергнуть желудок взрослого примерно 10 мЗв, в то время как желудок новорожденного ребенка подвергнется воздействию 20 мЗв при проведении того же теста без настройки параметров.
Особое беспокойство у детей вызывает радиационное облучение при визуализирующих исследованиях, поскольку:
- Дети гораздо более чувствительны к радиации, чем взрослые
- Ожидается, что дети проживут дольше, чем взрослые, поэтому у них больше времени для развития проблем, связанных с радиационным облучением
- При проведении таких тестов, как компьютерная томография, дети могут получить более высокую дозу облучения, чем необходимо, если параметры компьютерной томографии не скорректированы с учетом их меньшего размера тела
Эти факторы означают, что для маленького ребенка риск развития радиационно-обусловленного рака может быть в несколько раз выше, чем для взрослого человека, прошедшего тот же визуализирующий тест. Риски, связанные с этими тестами, точно неизвестны, но в целях безопасности большинство врачей рекомендуют детям проходить эти тесты только тогда, когда они абсолютно необходимы. При проведении таких тестов важно использовать минимальное количество радиации, необходимое для получения изображения.
Лучевая терапия
Рентгеновские лучи, гамма-лучи и другие формы ионизирующего излучения предлагают эффективный способ лечения некоторых видов рака. Во время лучевой терапии высокие дозы ионизирующего излучения (гораздо более высокие, чем те, которые используются для визуализирующих тестов) направляются на рак, что приводит к гибели раковых клеток. Однако это может привести к мутациям ДНК в других клетках, переживших облучение, что в конечном итоге может привести к развитию второго рака. Лучевая терапия также иногда используется для лечения серьезных заболеваний, помимо рака.
Для получения дополнительной информации о рисках рака при лучевой терапии рака см. Второй рак у взрослых .
Немедицинские источники искусственного излучения
Люди также могут подвергаться воздействию ионизирующего излучения от немедицинских искусственных источников.
Ядерное оружие
Атомные бомбы, сброшенные на Нагасаки и Хиросиму в Японии, подвергли многих людей воздействию рентгеновского, гамма- и нейтронного излучения. Некоторые люди умерли довольно быстро в результате ожогов и лучевой болезни, но многие выжили. Выжившие подверглись воздействию разного количества радиации, в основном в зависимости от того, насколько далеко они находились от взрывов. Только около 2% выживших подверглись воздействию высоких доз радиации (1000 мЗв и более), в то время как почти треть получили относительно низкие дозы (менее 5 мЗв). Большая часть имеющейся у нас информации о рисках радиации и рака получена из исследований более 105 000 выживших.
Некоторые люди умерли довольно быстро в результате ожогов и лучевой болезни, но многие выжили. Выжившие подверглись воздействию разного количества радиации, в основном в зависимости от того, насколько далеко они находились от взрывов. Только около 2% выживших подверглись воздействию высоких доз радиации (1000 мЗв и более), в то время как почти треть получили относительно низкие дозы (менее 5 мЗв). Большая часть имеющейся у нас информации о рисках радиации и рака получена из исследований более 105 000 выживших.
Правительство США провело наземные ядерные испытания в южной части Тихого океана и в штате Невада в период с 1945 по 1962 год. Другие страны также проводили наземные испытания. Многие военнослужащие в то время участвовали в учениях в этом районе и подверглись воздействию ионизирующего излучения в ходе этих испытаний. Другие подверглись радиационному облучению во время работы на объектах, производящих бомбы, или на других ядерных объектах.
Невоенные люди, живущие вблизи ядерных полигонов или с подветренной стороны, также могли подвергаться воздействию побочных радиоактивных продуктов. Уровни радиации, вероятно, будут выше вблизи этих мест, но некоторые радиоактивные частицы в результате испытаний попали в атмосферу и переместились на большие расстояния, приземлившись за тысячи миль от исходного места. Хотя уровни облучения, вероятно, были выше во время испытаний, некоторая часть радиации в почве сегодня является результатом этих испытаний.
Уровни радиации, вероятно, будут выше вблизи этих мест, но некоторые радиоактивные частицы в результате испытаний попали в атмосферу и переместились на большие расстояния, приземлившись за тысячи миль от исходного места. Хотя уровни облучения, вероятно, были выше во время испытаний, некоторая часть радиации в почве сегодня является результатом этих испытаний.
Были созданы программы для оказания финансовой поддержки людям, подвергшимся испытаниям ядерного оружия и заболевшим раком.
Атомные электростанции
Выбросы радиации от атомных электростанций тщательно контролируются и контролируются. По данным Агентства по охране окружающей среды (EPA), на работу атомных электростанций приходится менее одной сотой (1/100) процента от общего радиационного облучения среднего американца.
Аварии на атомных электростанциях: Аварии на атомных электростанциях случаются редко, но они могут подвергнуть людей воздействию высоких уровней радиации.
В 1986 году авария на Чернобыльской атомной электростанции (Украина) обусловила облучение миллионов людей, проживающих в этом районе, либо непосредственно, либо в результате радиоактивных элементов, выброшенных в воздух и осевших на землю. Аварийные ликвидаторы подверглись самому высокому уровню радиации. Хотя средняя доза у ликвидаторов составила около 100 мЗв, некоторые получили очень высокие дозы – более 1000 мЗв. Средние дозы облучения людей, проживающих в этом районе (некоторые из которых были эвакуированы), составили от 10 до 50 мЗв.
Аварийные ликвидаторы подверглись самому высокому уровню радиации. Хотя средняя доза у ликвидаторов составила около 100 мЗв, некоторые получили очень высокие дозы – более 1000 мЗв. Средние дозы облучения людей, проживающих в этом районе (некоторые из которых были эвакуированы), составили от 10 до 50 мЗв.
В 2011 году землетрясение и цунами обрушились на побережье Японии, в результате чего была повреждена атомная электростанция Фукусима Дайити в префектуре Фукусима, Япония. Радиация попала в воздух, загрязнив почву, продукты питания и воду (как пресную, так и морскую). На заводе уровень радиации достигал 10 000 мЗв в час на раннем этапе. Было обнаружено, что территория площадью более 300 квадратных миль вокруг завода также была загрязнена радиацией, хотя и на более низком уровне, чем внутри завода. Из-за высокого уровня радиации многие районы были эвакуированы. Медицинские последствия этой катастрофы все еще изучаются.
Облучение на рабочем месте
Некоторые люди могут подвергаться радиационному облучению на работе. Например:
Например:
- Люди, работающие на атомных электростанциях, могут подвергаться более высокому уровню радиации, чем обычные люди, хотя уровни их облучения тщательно контролируются.
- Люди, работающие на урановых рудниках, находятся под наблюдением из-за их воздействия радиации в виде радона.
- Люди, работающие в сфере здравоохранения или стоматологии, особенно работающие с рентгеновским (или другим визуализирующим) оборудованием или работающие с радиоактивными изотопами, также могут подвергаться воздействию радиации на работе. Радиационное облучение может также произойти в некоторых исследовательских лабораториях.
В Соединенных Штатах люди, которые могут подвергнуться воздействию радиации на рабочем месте, тщательно контролируются. Воздействие ограничено эффективной дозой 100 мЗв в течение 5 лет, с максимальной дозой 50 мЗв в любой отдельный год.
Потребительские товары
Некоторые потребительские товары содержат небольшое количество ионизирующего излучения.
Например, табачные изделия содержат низкий уровень радиации, которая может исходить от почвы, в которой они выращиваются, или от удобрений, используемых для их роста. Табак может составлять значительную часть годовой радиации, которой подвергаются курящие люди.
Некоторые строительные материалы, используемые в доме или других сооружениях, могут содержать низкий уровень естественного излучения. По данным EPA, количество радиации может варьироваться в зависимости от того, из чего они сделаны, но уровни вряд ли сильно влияют на общее воздействие радиации на человека.
Многие детекторы дыма содержат небольшое количество очень низкоактивного радиоактивного материала, помогающего обнаруживать дым. Этот материал запечатан в контейнере и не представляет значительного риска радиационного облучения.
Облучение пищевых продуктов
Ионизирующее излучение можно использовать для уничтожения бактерий и других микробов на определенных продуктах питания, что может сделать их более безопасными для употребления в пищу и продлить срок их хранения. Некоторые люди могут быть обеспокоены тем, что облученная пища сама по себе может содержать радиацию.
Некоторые люди могут быть обеспокоены тем, что облученная пища сама по себе может содержать радиацию.
Важно понимать, что радиация не остается в пище. По данным Министерства сельского хозяйства США (USDA), облучение пищи , а не приводит к тому, что она становится радиоактивной, и не изменяет питательную ценность пищи больше, чем ее приготовление или замораживание.
Сканеры безопасности аэропортов
В последние годы некоторые аэропорты начали использовать сканеры всего тела для обнаружения объектов, скрытых под одеждой. Эти сканеры отличаются от металлодетекторов, с которыми знакомо большинство людей.
Используемый в настоящее время сканер тела основан на технологии миллиметровых волн. Ни сканеры миллиметрового диапазона, ни металлодетекторы не подвергают людей рентгеновскому или гамма-излучению.
Другой тип сканера тела, основанный на технологии обратного рассеяния, использует очень слабые рентгеновские лучи, направленные на поверхность тела, для получения изображения всего тела.


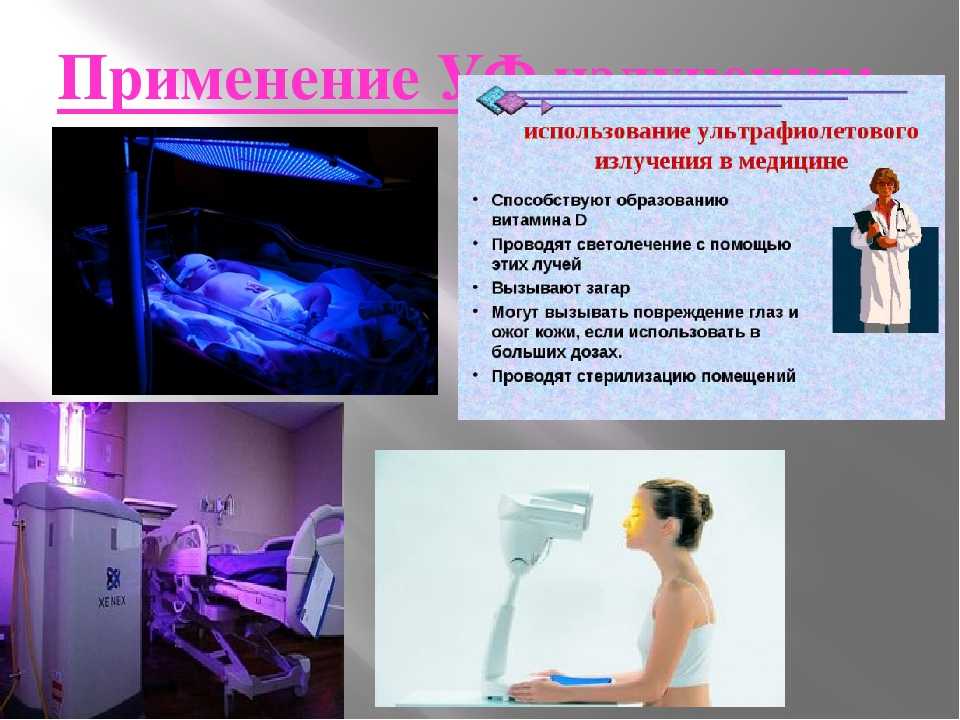 Это означает, что эти процедуры немного повышают вероятность того, что вы заболеете раком в более позднем возрасте.
Это означает, что эти процедуры немного повышают вероятность того, что вы заболеете раком в более позднем возрасте. Это позволяет врачам проверять, правильно ли работают органы, и диагностировать заболевания.
Это позволяет врачам проверять, правильно ли работают органы, и диагностировать заболевания. Дополнительную информацию о том, как ПЭТ-сканирование используется в ядерной медицине, см. в разделе ниже.
Дополнительную информацию о том, как ПЭТ-сканирование используется в ядерной медицине, см. в разделе ниже. на тканях.
на тканях.