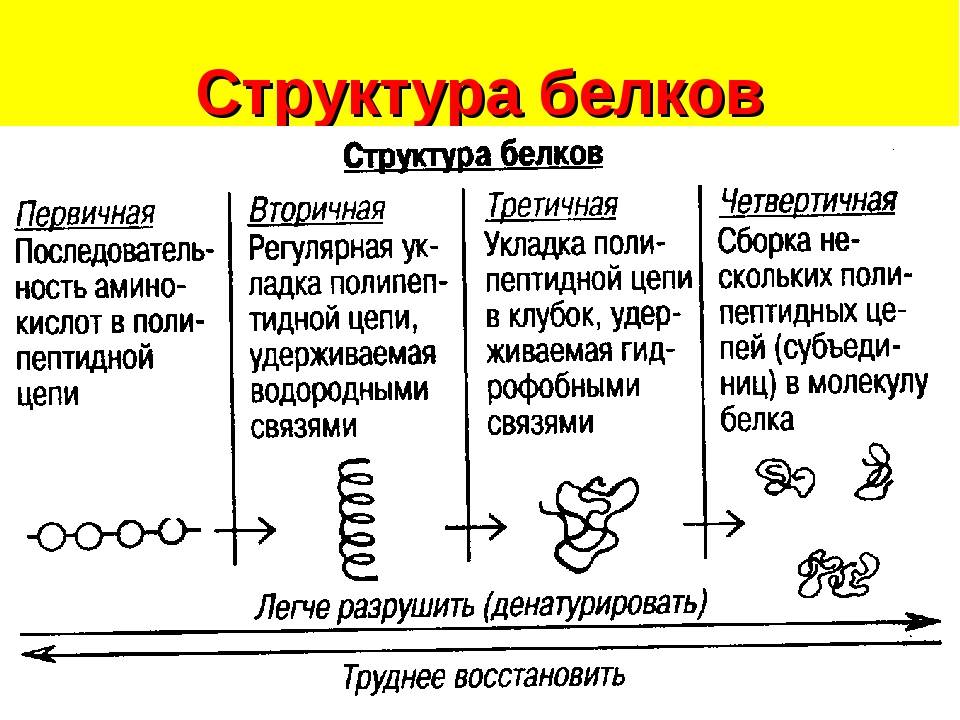
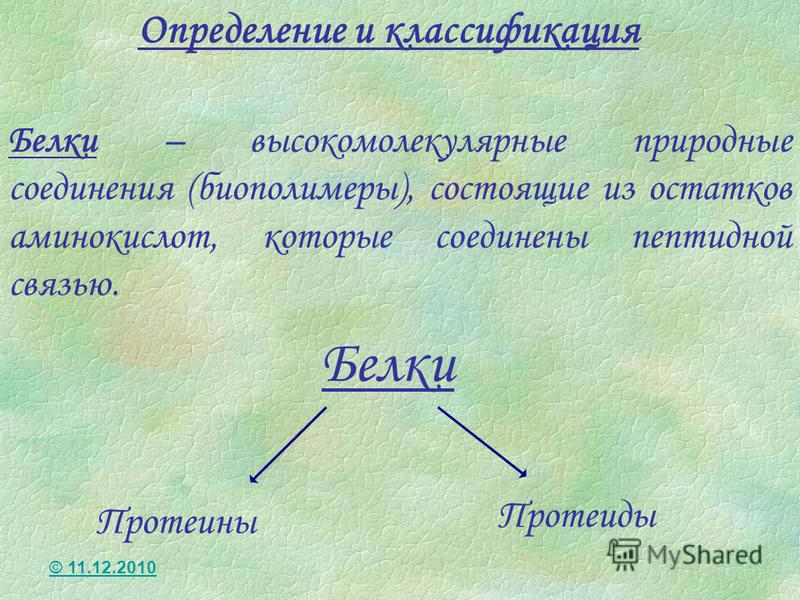
1.10.1. Простые белки (протеины)
К протеинам (простым белкам) относят белки, состоящие только из аминокислот.
Они, в свою очередь, делятся на группы в зависимости от физико-химических свойств и особенностей аминокислотного состава. Выделяют следующие группы простых белков:
альбумины;
глобулины;
протамины;
гистоны;
проламины;
глютелины;
протеиноиды
Альбумины
Альбумины – широко распространённая группа белков в тканях организма человека.
Они имеют сравнительно
невысокую молекулярную массу 50 –70 тыс. д. Альбумины в физиологическом
диапазоне рН имеют отрицательный заряд,
так как в силу высокого содержания
глютаминовой кислоты в их составе
находятся в изоэлектрическом состоянии
при рН 4,7.
Глобулины
Глобулины –
широко распространённая гетерогенная
группа белков, обычно сопутствующая
альбуминам. Они имеют более высокую,
чем альбумины молекулярную массу – до
200 и более тыс. д., поэтому медленнее
перемещаются при электрофорезе.
Изоэлектрическая точка глобулинов
находится при рН 6,3 – 7. Они отличаются
разнообразным набором аминокислот.
Гистоны
Гистоны имеют небольшую молекулярную массу (11-24 тыс. д.). Они богаты щелочными аминокислотами лизином и аргинином, поэтому находятся в изоэлектрическом состоянии в резко щелочной среде при рН 9,5 – 12. В физиологических условиях гистоны имеют положительный заряд. В различных видах гистонов содержание аргинина и лизина варьирует, в связи с чем они делятся на 5 классов. Гистоны Н1и Н2
 Гистоны в хроматине формируют
остов, на который накручивается молекула
ДНК. Основные функции гистонов –
структурная и регуляторная.
Гистоны в хроматине формируют
остов, на который накручивается молекула
ДНК. Основные функции гистонов –
структурная и регуляторная.Протамины
Протамины – низкомолекулярные щелочные белки. Молекулярная масса их составляет 4 – 12 тыс. д. Протамины в своём составе содержат до 80% аргинина и лизина. Они содержатся в составе таких нуклеопротеидов молоки рыб как клупеин (сельдь), скумбрин (скумбрия).
Проламины, глютелины
Проламины, глютелины – растительные белки, богатые
глютаминовой кислотой (до 43%) и гидрофобными
аминокислотами, в частности, пролином
(до 10 – 15%). В силу особенностей
аминокислотного состава проламины и
глютелины не растворимы в воде и солевых
растворах, но растворимы в 70% этиловом
спирте. Проламины и глютелины являются
пищевыми белками злаковых культур,
составляя так называемые глютеновые
белки. К глютеновым белкам относятся
секалин (рожь), глиадин (пшеница), гордеин
(ячмень), авенин (овёс).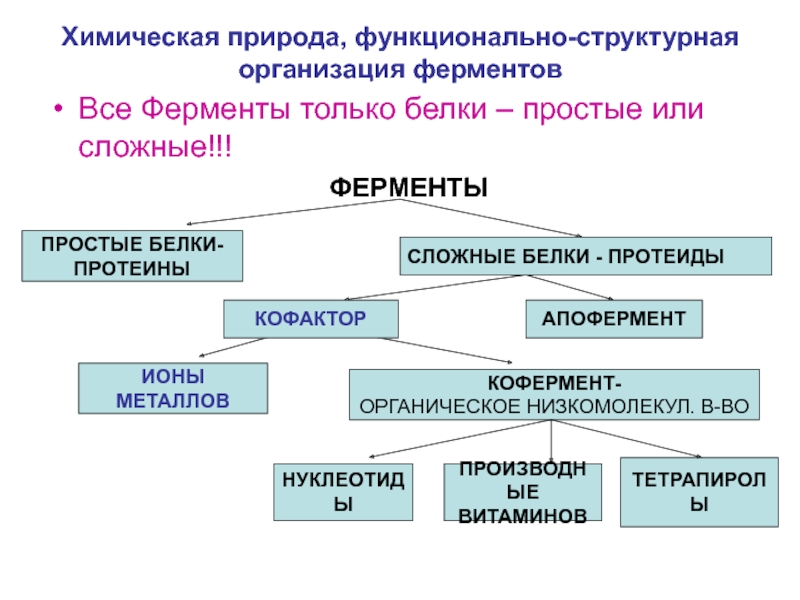
Протеиноиды
Протеиноиды
Коллаген (рождающий клей) – широко распространённый в организме белок, составляет около трети всех белков организма. Входит в состав костей, хрящей, зубов, сухожилий и других видов соединительной ткани.
К особенностям
аминокислотного состава коллагена
относится, прежде всего, высокое
содержание глицина (1/3 всех аминокислот),
пролина (1/4 всех аминокислот), лейцина. В составе коллагена присутствуют редкие
аминокислоты гидроксипролин и
гидроксилизин, но отсутствуют циклические
аминокислоты.
В составе коллагена присутствуют редкие
аминокислоты гидроксипролин и
гидроксилизин, но отсутствуют циклические
аминокислоты.
Полипептидные цепи коллагена содержит около 1000 аминокислот. Различают несколько видов коллагена в зависимости от сочетания в нём различных видов полипептидных цепей. К фибриллообразующим видам коллагена относятся коллаген первого типа (преобладает в коже), коллаген второго типа (преобладает в хрящах) и коллаген третьего типа (преобладает в сосудах). У новорожденных детей основная масса коллагена представлена IIIтипом, у взрослых людей-IIиIтипами.
Вторичная структура коллагена представляет особую «ломаную» альфа-спираль, в витке которой укладывается 3,3 аминокислоты. Шаг спирали равен 0,29 нм.
Три полипептидные
цепи коллагена уложены в виде тройного
закрученного каната, фиксированного
водородными связями, и образуют
структурную единицу коллагенового
волокна – тропоколлаген. Тропоколлагеновые
структуры размещаются параллельными,
смещёнными по длине рядами, фиксированными
ковалентными связями, и формируют
коллагеновое волокно. В промежутках
между тропоколлагеном в костной ткани
откладывается кальций. Коллагеновые
волокна содержат в своём составе
углеводы, которые стабилизируют
коллагеновые пучки.
В промежутках
между тропоколлагеном в костной ткани
откладывается кальций. Коллагеновые
волокна содержат в своём составе
углеводы, которые стабилизируют
коллагеновые пучки.
Кератины — белки волос, ногтей. Они не растворимы в растворах солей, кислот, щелочей. В составе кератинов имеется фракция, которая содержит большое количество серосодеоржащих аминокислот (до 7 – 12%), образующих дисульфидные мостики, придающие высокую прочность этим белкам. Молекулярная масса кератинов очень высока, достигает 2 000 000 д. Кератины могут иметь α– структуру и β- структуру. В α — кератинах три α — спирали объединяются в суперспираль, формирующую протофибриллы. Протофибриллы объединяются в профибриллы, затем в макрофибриллы. Примером β — кератинов является фиброин шёлка.
Эластин –белок эластических волокон, связок,
сухожилий. Эластин не растворим в воде,
не способен к набуханию. В эластине
высока доля глицина, валина, лейцина
(до 25 – 30%).
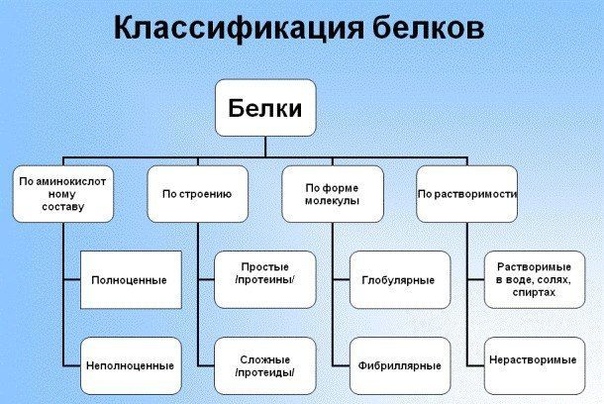
1. Простые белки (протеины).
Простыми белками являются:
1) Альбумины группа распространенных белков, встречается в тканях животных и растений, а также в различных жидкостях организма. Эти белки растворимы в воде и нерастворимы в насыщенных растворах сульфата аммония.
2) Глобулины подобно альбуминам, широко представлены в организмах. Они нерастворимы в воде, но растворимы в водных растворах различных солей. В отличие от альбуминов, глобулины или не содержат глицин, или же содержат его в незначительных количествах.
3) Гистоны
группа белков, в состав которых входит
от 20 до 30% диаминомонокарбоновых кислот
(лизин, аргинин), и значительное количества
гистидина. Гистоны встречаются в белках
эритроцитов и щитовидной железы.
Гистоны встречаются в белках
эритроцитов и щитовидной железы.
4) Протамины отличаются особо высоким содержанием (до 80%) диаминомонокарбоновых кислот. В большом количестве они содержатся в сперме и икре рыб. Протамины и гистоны представляют значительный биологический интерес, так как составляют белковую часть нуклеопротеидов.
5) Проламины группа белков растительного происхождения, встречается в семенах злаков, содержит большое количество пролина. Проламины хорошо растворимы в 60-80% этаноле, тогда как другие белки в этих условиях выпадают в осадок.
6) Кератины
имеют фибриллярное строение, находятся,
главным образом, в составе волос, копыт
и ногтей. Характеризуются полной
нерастворимостью в воде, кислотах,
щелочах, солевых раст-ворах и органических
растворителях. Распадаются при длительном
гидролизе с минеральными кислотами,
выделяя от 7 до 14 различных аминокислот,
в которых содержится до 12% цистеина, до
15% лейцина и до 17% глутаминовой кислоты.
7) Коллагены белки соединительной ткани (сухожилий, связок, подкожной клетчатки и хрящей) содержат до 25% глицина, 14% пролина. В их состав не входят цистин, цистеин и триптофан. Они нерастворимы в воде, но легко набухают с образованием студней.
Так как коллаген богат глицином и пролином, он не способен образовывать ни правую α-спираль, ни β-складчатый листок. Этот белок построен из трех левых спиралей, которые переплетаются, давая правую «сверхспираль». Две из трех переплетенных пептидных цепей имеют одинаковую первичную структуру. Строение этой «сверхспирали» представлено на следующем рисунке:
Каждая из трех
полипептидных цепей закручена в
левовращающую спираль, а все вместе они
переплетаются, образуя правовращающую
спираль. На каждый виток тройной спирали
приходится десять витков отдельных
цепей.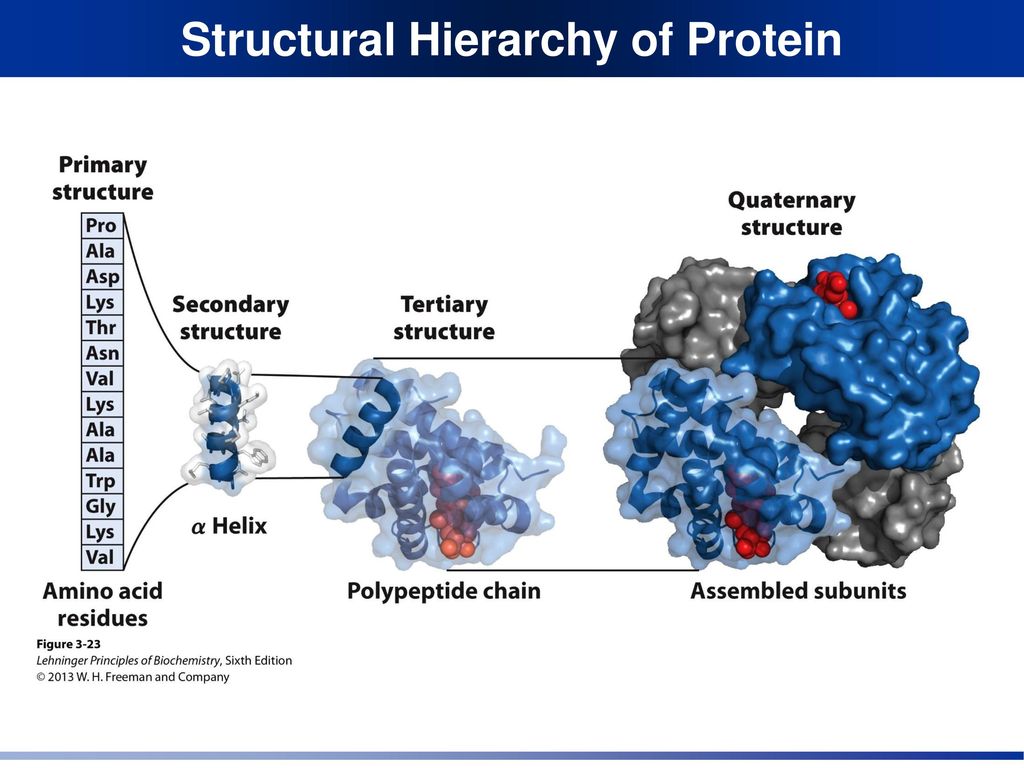
В биологических системах коллаген встречается в виде пучков линейных волокон, которые по прочности на растяжение почти не отличаются от стальной проволоки.
8) Элластины белки соединительной ткани, составляют основу связок и сухожилий. Они нерастворимы в воде, не способны к набуханию. В их составе преобладают глицин и лейцин (до 25-30%).
Эластины фибриллярные белки, более прочные, чем коллаген.
2. Сложные белки (протеиды).
Это системы,
состоящие из простого белка и небелкового
соединения, называемого простетической группой. Функцию этой группы могут
выполнять различные углеводы, липиды,
витамины, гормоны. В настоящее время
группу сложных белков принято разделять
на две большие подгруппы: стабильные
с прочными химическими связями между
белком и простетической группой и лабильные
имеющие непрочные связи белка с
простетической группой (водородные
связи, адсорбционные и др).
Первую группу сложных белков можно выделить из тканей обычными методами; для выделения второй группы белков требуются мягкие методы, щадящие лабильную структуру, иначе эти белки разлагаются.
Классификация сложных белков основана на химических особенностях их небелковых компонентов. Исходя из этого, сложные белки делят на фосфопротеиды, гликопротеиды, хромопротеиды, нуклеопротеиды и липопротеиды.
1) Фосфопротеиды характеризуются наличием фосфорно-эфирной связи, которая образуется в результате присоединения фосфатного остатка к гидроксогруппе серина и треонина. Интересно отметить, что из всех гидроксилсодержащих аминокислот только серин и треонин связывают фосфорную кислоту:
Применение более
совершенных методов исследования
позволило выявить наличие в фосфопротеидах
пирофосфорных и фосфодиэфирных остатков.
Это указывает на то, что пептидные цепи
в молекулах фосфопротеидов соединены
друг с другом не только дисульфидными
мостиками, но и с помощью остатков
фосфорной кислоты.
2) Гликопротеиды сложные белки, которые имеют в своем составе углеводы и производные углеводов: (глюкуроновую кислоту, гексозамины).
3) Хромопротеиды сложные белки, включающие окрашенные (греч chroма краска) простетические группы, которыми могут быть железо (гемоглобин), медь (гемоцианины).
4) Нуклеопротеиды сложные белки, в которых простетической группой являются нуклеиновые кислоты. Белковой частью нуклеопротеидов чаще всего бывают гистоны и протамины. Эти основные белки образуют с нуклеиновыми кислотами солеобразные соединения. Нуклеопротеиды содержатся в основном в ядрах клеток, но могут встречаться и вне их.
5) Липопротеиды
это комплексы, состоящие из белков и
липидов (фосфатидов жиров). В отличие
от липидов, липопротеиды растворимы в
воде и нерастворимы в органических
растворителях. Липопротеиды чрезвычайно
распространены. Они встречаются в
сос-таве различных тканей, являясь
важнейшим компонентом протоплаз-мы
клеток, обнаруживаются в форменных
элементах, плазме крови, яичном желтке,
молоке. Особенно богата липопротеидами
нервная ткань.
Они встречаются в
сос-таве различных тканей, являясь
важнейшим компонентом протоплаз-мы
клеток, обнаруживаются в форменных
элементах, плазме крови, яичном желтке,
молоке. Особенно богата липопротеидами
нервная ткань.
Приведенная классификация основана частично на химическом строении и частично на биологических свойствах белковых тел.
Структура и функция простых белков
Содержание
ВведениеПростые белки — это тип белков, представляющих собой биомакромолекулы. Биомакромолекулы имеют большие размеры, с более высокой молекулярной массой 10000 дальтон и выше. Существуют разные виды белка. И каждый белок имеет определенную структуру и определенную функциональность. Ниже приводится обсуждение структуры и функции простых белков.
Белок является наиболее важной и распространенной внутриклеточной органической биомолекулой. Это полипептиды с линейно расположенными цепочками аминокислот, соединенными пептидными связями.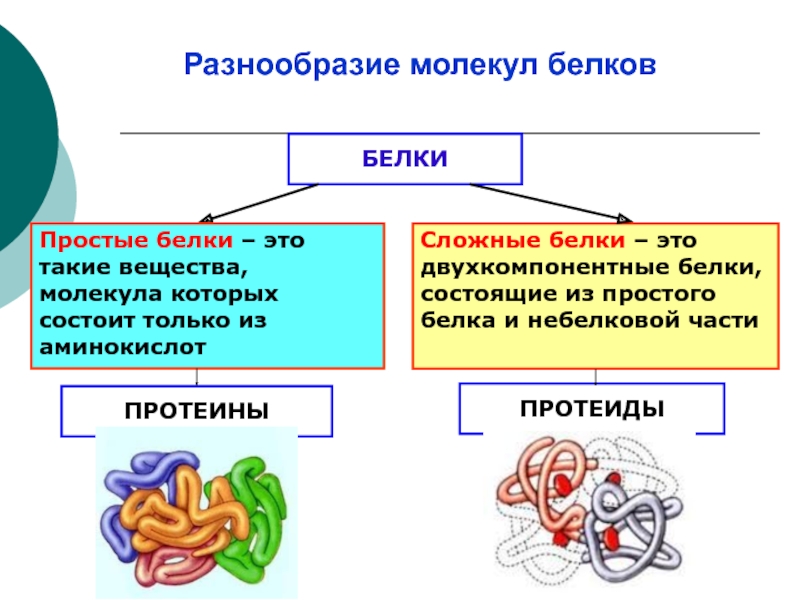 Таким образом, каждый белок представляет собой полимер аминокислот. Эти биомолекулы могут быть отделены друг от друга в основном их аминокислотными последовательностями.
Таким образом, каждый белок представляет собой полимер аминокислот. Эти биомолекулы могут быть отделены друг от друга в основном их аминокислотными последовательностями.
Большое количество функций внутри организма, таких как катализатор метаболических реакций, репликация ДНК, реакция на раздражители, транспорт различных молекул из одного места в другое и др., выполняют белки. Они классифицируются по форме, химическому составу и функциям. По строению выделяют три типа белков. Простой белок является одним из них.
Простой белокБелки, не связанные ни с какими другими элементами, называются простыми белками. Простые белки состоят только из аминокислотных субъединиц, соединенных между собой связью. Эта связь известна как пептидная связь. Когда простые белки расщепляются ферментами, образуются только аминокислоты. Белок, относящийся к категории простых белков, является самым простым из всех белков.
Структура Простые белки состоят только из аминокислот. Аминокислоты представляют собой небольшие органические молекулы. Он состоит из альфа-атома углерода, связанного с аминогруппой, карбоксильной группой, атомом водорода и боковой цепью. Эти аминокислоты являются строительными блоками простого белка. Они представляют собой пептидные цепи, содержащие аминокислоты, но не содержащие других небелковых компонентов. Простой белок имеет набор аминокислот в определенном порядке.
Аминокислоты представляют собой небольшие органические молекулы. Он состоит из альфа-атома углерода, связанного с аминогруппой, карбоксильной группой, атомом водорода и боковой цепью. Эти аминокислоты являются строительными блоками простого белка. Они представляют собой пептидные цепи, содержащие аминокислоты, но не содержащие других небелковых компонентов. Простой белок имеет набор аминокислот в определенном порядке.
Простые белки подразделяются на разные типы. Это такие белки, которые при гидролизе дают аминокислоты или их производные. Некоторые типы простых белков и их структура описаны ниже.
1. Глобулины- Глобулины в основном представляют собой белки крови. Нормальное количество глобулина в крови человека составляет от 2,5 до 3,5 г/дл.
- Нерастворим в чистой воде.
- Глобулин представляет собой тип глобулярного белка.
- Имеет более высокую молекулярную массу, чем альбумины.

- Они коагулируются под воздействием тепла и кислот.
- Они растворимы в разбавленных растворах солей сильных кислот и оснований.
- Глобулины осаждаются полунасыщенными растворами, такими как MgSO₄ И (NH₄)₂SO₄.
Структура
Глобулин образован аминокислотами. Существует три типа глобулинов, а именно альфа-1-глобулин, альфа-2-глобулин, бета-глобулин и гамма-глобулин. Гамма-глобулины известны как антитела. Его молекулярная масса составляет от 100 до 1000 кДа.
Эти типы белков имеют самую высокую белковую фракцию. Он содержит большое количество ароматических и сернистых аминокислот, глутаминовой и аспарагиновой кислот, треонина и гистидина. Каждая субъединица глобулина состоит из кислой субъединицы в 40 000 Да и основной субъединицы в 20 000 Да.
Пример
Включает сывороточный глобулин, овоглобулин (яичный желток), кристаллический (хрусталик), фибриноген (плазма), эдестин (хлопок), легумин (горох), миозин (мышечный).
- Глютелины растворимы в разбавленных кислотах и щелочах.
- Нерастворимы в нейтральных солях.
- Коагулируется под воздействием тепла.
- Большинство видов трав обычно имеют как высокомолекулярную, так и низкомолекулярную массу.
- Они также растворимы в детергентах, хаотропных агентах или восстановителях.
- Глютелины сшивают себя и другие белки во время выпечки за счет дисульфидных связей.
Структура
Глютелины сравнительно богаты аргинином, пролином и глутаминовой кислотой. Это класс пропаин-проламиновых белков. Эти белки составляли основной компонент белкового соединения, известного под общим названием глютен. Они содержатся в пшенице, ячмене и ржи. Глютелины богаты гидрофобными аминокислотами, содержащими аминокислоты фенилаланин, валин, тирозин, пролин и лейцин.
Пример
Встречается только в растениях. Примерами глютелинов являются глютенин пшеницы и оризенин риса.
Примерами глютелинов являются глютенин пшеницы и оризенин риса.
- Проламины растворимы в 70-90% этаноле.
- Это тип растительных запасных белков.
- Они обнаружены в растениях, главным образом в семенах злаков, таких как пшеница, ячмень, овес, кукуруза и т. д.
- Нерастворимы в воде и других нейтральных растворителях.
- В зависимости от молекулярной массы существует четыре типа проламинов кукурузы и сорго. Это альфа (α), бета (β), гамма (γ) и дельта (δ).
Структура
Проламины состоят в основном из аминокислот пролина и глутамина. Эти две аминокислоты присутствуют в больших количествах в белках проламинов. В дополнение к этим двум аминокислотам в этих типах белков также присутствуют некоторые аминокислоты, но их количество невелико. Это аргинин, лизин и гистидин.
Эти белки подразделяются на бедные серой, богатые серой и высокомолекулярные белки. Богатые серой и высокомолекулярные проламины содержат от шести до восьми аминокислот.
Богатые серой и высокомолекулярные проламины содержат от шести до восьми аминокислот.
Пример
Примерами проламинов являются зеин из кукурузы, глиадин из пшеницы и гордеин из ячменя.
4. Альбумины- Альбумины представляют собой тип глобулярных белков.
- Они растворимы в воде.
- Эти белки осаждаются насыщенными растворами солей, такими как сульфат аммония.
- Альбумины коагулируют при нагревании.
- В основном они обнаруживаются в плазме крови.
- Одним из белков, вырабатываемых в печени, является альбумин.
- Он не гликозилирован, поэтому отличается от других белков крови.
- Альбумины относятся к амфотерным типам, что означает, что они способны реагировать как в качестве основания, так и в качестве кислоты.
- Они встречаются в яичном белке, крови, молоке и растениях.
Структура
Альбумины — это простые белки, поэтому они состоят только из аминокислот. Они состоят из одной полипептидной цепи. Молекулярная масса альбумина составляет около 65 кДа. В этих белках имеется три гомологичных домена. Основная функция этих доменов заключается в формировании сердцевидных белков.
Они состоят из одной полипептидной цепи. Молекулярная масса альбумина составляет около 65 кДа. В этих белках имеется три гомологичных домена. Основная функция этих доменов заключается в формировании сердцевидных белков.
Аминоостатки, присутствующие в больших количествах в альбуминах, представляют собой глутаминовую кислоту, аспарагиновую кислоту, лизин и аргинин. А в альбуминах обычно мало или недостаточно аминокислотных остатков глицина.
- Пример
Яичный альбумин, сывороточный альбумин, лактальбумин (молоко), миоальбумин (мышцы) и лейкозин (пшеница).
5. Альбуминоиды или склеропротеины- Склеропротеины нерастворимы в воде, нейтральных растворителях, разбавленных кислотах и щелочах.
- Являются одной из трех основных классификаций структуры белков.
- Они образуют длинную белковую нить.
- Также известны как волокнистые белки.
- Животные имеют высокие уровни этого белка в костях, волосах, ногтях, коже и соединительной ткани.

- Склеропротеины атакуются ферментами.
- Иногда эти белки растворяются смесью кислот, таких как лимонная и уксусная кислота.
- Коллагены и кератины представляют собой два важных класса склеропротеинов.
Структура
Они состоят из многих суперсемейств, таких как коллаген, кератин, эластин и фибрин. В этих типах белков присутствуют аминокислоты глицин, пролин и гидроксипролин. Существует два вида склеропротеинов. Это альфа-кератин и коллаген. Кератин и коллаген образуют длинные волокна, которые выполняют структурную роль в организме.
Пример
Кератин (копыта, когти и рога), эластин (хрящи), коллаген (волокнистая ткань), оссеин (кости и зубы).
Основные белкиКлассифицируются на два типа.
1. Протамин- Протамины – это самые маленькие, богатые аргинином ядерные белки.
- Имеют аналогичную структуру относительно низкой молекулярной массы.

- Протамины растворимы в воде или аммиаке
- Эти белки не коагулируются при нагревании.
- Это положительно заряженная белковая молекула, которая связывает отрицательно заряженный гепарин.
- Они гидролизуются ферментами, такими как трипсин, папаин, а не пепсином.
- Протамины в основном содержатся в яйцеклетках.
Структура
Протамин содержит 28 аминокислотных остатков с 19 аргининовыми остатками. Они не содержат серы, но имеют высокое содержание азота из-за присутствия большого количества аргинина. Количество азота в протамине составляет от 25 до 30%. В этих белках отсутствуют тирозин и триптофан. Его молекулярная масса составляет от 5,5 до 13,0 кДа. Количество аргинина в протамине составляет 67%.
Пример
Обнаружено, что они связываются с ДНК в сперме рыб, таких как лосось, осетр и т. д. Лососевая рыба содержит белок, называемый физиологическим раствором.
2. Гистон
Гистон - Гистоны – водорастворимые белки.
- Они нерастворимы в разбавленном аммиаке.
- Не коагулируются при нагревании.
- Гистоны легко гидролизуются пепсином и трипсином.
- Является основным белком хроматина.
- Они чаще встречаются в ядре и с нуклеиновыми кислотами.
- Осаждаются (NH₄)₂SO4.
- Это семейство высокощелочных белков, присутствующих в ядре эукариотических клеток.
Структура
Гистон состоит в основном из положительно заряженных аминокислот, таких как лизин и аргинин. Они также богаты гистидином, но бедны триптофаном и содержат небольшое количество цистина или метионина. Существует 5 типов гистонов, таких как линкерный гистон h3A, h3B, h4, h5 и h2.
Пример
Гистоны можно экстрагировать в больших количествах из некоторых железистых тканей, таких как вилочковая железа и поджелудочная железа. Большинство гистонов соединяются с нуклеиновыми кислотами, гемоглобином и др. У эукариот ДНК хромосом связывается с гистонами с образованием нуклеопротеина.
У эукариот ДНК хромосом связывается с гистонами с образованием нуклеопротеина.
- Глобулины переносят липиды, гормоны и холестерин по кровотоку. Они также помогают бороться с инфекцией и играют важную роль в печени и свертывании крови.
- Глютелин является источником энергии для иммунных клеток и кишечника. Он играет жизненно важную роль в кишечнике. Эти белки помогают в росте кишечных клеток.
- Проламины играют роль в поддержании иммунной системы.
- Основная роль белка альбумина заключается в защите осмотического давления кровеносных сосудов, питании тканей и транспортировке витаминов, лекарств, кальция, гормонов и т. д. в организм.
- Склеропротеины защищают соединительную ткань, сухожилия, кости и мышечные волокна. Эти белки образуют защитный барьер. Барьер водонепроницаем.
- Протамин связывается с ДНК и играет жизненно важную роль в формировании хроматина.
- Гистон помогает в формировании структуры ДНК.
 Они играют роль в упаковке ДНК в нуклеосомы. Эти белки также помогают формировать хромосомы и регулировать активность генов.
Они играют роль в упаковке ДНК в нуклеосомы. Эти белки также помогают формировать хромосомы и регулировать активность генов.
Аминокислоты являются простыми единицами. Белки состоят из сотен или тысяч аминокислот. Существует двадцать различных типов аминокислот. Эти различные типы аминокислот объединяются вместе, образуя вещества. Это вещество известно как белок.
2. Что такое простые белки?Белки состоят только из аминокислот и не содержат небелковых веществ.
3. Почему для облегченной диффузии требуются мембранные транспортные белки, а для простой диффузии — нет? При облегченной диффузии молекулы распространяются через плазматическую мембрану с помощью мембранных транспортных белков, таких как канальный белок, белки-переносчики и т. д. Облегченные транспортные белки защищают эти молекулы от гидрофобного ядра мембраны, обеспечивая путь, через который они могут пройти.
Аминокислоты представляют собой простые единицы, из которых состоит белок. Двадцать типов аминокислот соединяются вместе, образуя белки.
5. Какие два простых белка образуют глютен?Глиадин и глютенин.
Ссылки1. Привет, Пол. Почести зоологии, том 1, Books & Allied (P) Ltd. Глава: Белки. Стр. с 771 по 782.
2. Б. Повар и Г. Р. Чатвал. Биохимия, B. SC (общий курс и курс с отличием) и M. Sc. Издательство Гималаи, Глава: Пептиды и белки. Номер страницы: с 192 по 206.
4. Чандрасекар Чакрабарти. Современный подход к учебнику по основной зоологии, общим и почестям. Библиотека Нирмала, издательство в рамках престижной международной системы стандартных номеров книг (ISBN). Калькутта (Индия). Часть II. Глава- Углеводы, белки и липиды. Страница: 2 nd – 25- 21 по 2 nd – 25 – 35.
Разница между простым белком и конъюгированным белком
ключевое различие между простым белком и конъюгированным белком состоит в том, что простых белков состоят из простых белков. связаны вместе, образуя большую молекулу, тогда как конъюгированные белки представляют собой сложные молекулы, содержащие простые белки и небелковые компоненты.
Белок представляет собой биополимерную молекулу. Это значит; молекула белка содержит ряд повторяющихся звеньев, связанных ковалентными связями. Эти повторяющиеся звенья представляют собой аминокислоты, которые использовались при образовании белка. По химическому составу белки бывают двух типов: простые белки и сопряженные белки.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое простой белок
3. Что такое конъюгированный белок
4. Сравнение бок о бок — простой белок и конъюгированный белок в табличной форме
5. Что такое резюме
3
3 простой белок?
Простые белки представляют собой пептидные цепи, содержащие аминокислоты, но не содержащие других небелковых компонентов. Поэтому при гидролизе этих белков простые белки дают в качестве продуктов только аминокислоты. Однако эти белки при гидролизе иногда дают и следовые количества углеводных компонентов. Некоторые распространенные примеры простых белков включают альбумин, глютелины, альбуминоиды, гистоновые белки и протамины. Что касается ферментов, то есть простые белки, которые могут действовать как ферменты в организме человека, включая пищеварительные ферменты, такие как трипсин, химотрипсин и эластаза.
Поэтому при гидролизе этих белков простые белки дают в качестве продуктов только аминокислоты. Однако эти белки при гидролизе иногда дают и следовые количества углеводных компонентов. Некоторые распространенные примеры простых белков включают альбумин, глютелины, альбуминоиды, гистоновые белки и протамины. Что касается ферментов, то есть простые белки, которые могут действовать как ферменты в организме человека, включая пищеварительные ферменты, такие как трипсин, химотрипсин и эластаза.
Рисунок 01: Переваривание простых белков
Что такое конъюгированный белок?
Конъюгированные белки представляют собой пептидные цепи, содержащие как аминокислоты, так и небелковые компоненты. Поэтому при гидролизе эти сопряженные белки дают как аминокислоты, так и неаминокислотные компоненты. Здесь небелковые компоненты также связаны с белком ковалентными связями. Неаминокомпоненты в белке называются простетическими группами. Большинство этих простетических групп образуются из витаминов. Мы можем классифицировать сопряженные белки на основе химической природы простетической группы. Некоторые распространенные примеры белков этого типа включают липопротеины (содержат остаток липида), гликопротеины (содержат остаток сахара), фосфопротеины (содержат остаток фосфата), гемопротеины (содержат остаток железа) и т. д.
Мы можем классифицировать сопряженные белки на основе химической природы простетической группы. Некоторые распространенные примеры белков этого типа включают липопротеины (содержат остаток липида), гликопротеины (содержат остаток сахара), фосфопротеины (содержат остаток фосфата), гемопротеины (содержат остаток железа) и т. д.
Рисунок 02: Гемоглобин
Гемоглобин представляет собой тип конъюгированных белков, в которых гемовая группа используется в качестве простетической группы. Эта гемовая группа содержит центр иона двухвалентного железа, который может транспортировать кислород в его димолекулярной форме за счет образования координационной связи между ионом двухвалентного железа и молекулой кислорода. Следовательно, этот конъюгированный белок очень важен для транспортировки молекулярного кислорода по всему телу через кровоток. Как правило, гликопротеины являются крупнейшими и наиболее распространенными членами группы конъюгированных белков.
В чем разница между простым белком и конъюгированным белком?
Белки бывают двух типов в зависимости от химического состава: простые белки и сопряженные белки.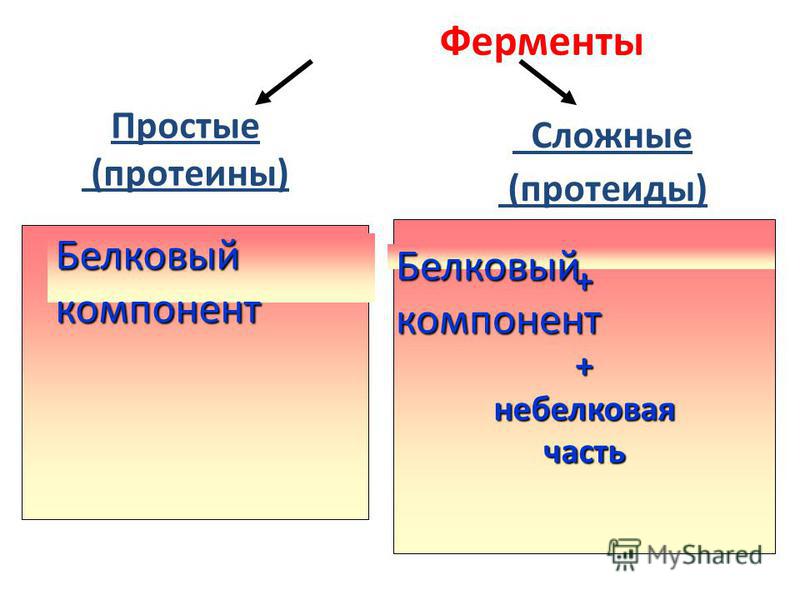 Ключевое различие между простым белком и сопряженным белком заключается в том, что простые белки состоят из аминокислот, связанных вместе, образуя большую молекулу, тогда как сопряженные белки представляют собой сложные молекулы, содержащие простые белки и небелковые компоненты. Альбумины, глютелины, альбуминоиды, гистоновые белки и протамины представляют собой простые белки, тогда как липопротеины, гликопротеины, фосфопротеины и гемопротеины представляют собой конъюгированные белки.
Ключевое различие между простым белком и сопряженным белком заключается в том, что простые белки состоят из аминокислот, связанных вместе, образуя большую молекулу, тогда как сопряженные белки представляют собой сложные молекулы, содержащие простые белки и небелковые компоненты. Альбумины, глютелины, альбуминоиды, гистоновые белки и протамины представляют собой простые белки, тогда как липопротеины, гликопротеины, фосфопротеины и гемопротеины представляют собой конъюгированные белки.
В следующей таблице приведены различия между простым белком и конъюгированным белком.
Резюме – простой белок и сопряженный белок
В зависимости от химического состава существует два типа белков: простые белки и сопряженные белки. Ключевое различие между простым белком и сопряженным белком заключается в том, что простые белки состоят из аминокислот, связанных вместе, образуя большую молекулу, тогда как сопряженные белки представляют собой сложные молекулы, содержащие простые белки и небелковые компоненты.


 Они играют роль в упаковке ДНК в нуклеосомы. Эти белки также помогают формировать хромосомы и регулировать активность генов.
Они играют роль в упаковке ДНК в нуклеосомы. Эти белки также помогают формировать хромосомы и регулировать активность генов.