Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа | Препараты | Дозы, путь введения |
Неопиоидные анальгетики, НПВП | Диклофенак Целекоксиб (Целебрекс®) | 75 мг (150 мг суточная), в/м 400 мг + 400 мг/сут |
Неопиоидные анальгетики, прочие | Парацетамол (Перфалган®) | 1 г (4 г), в/в инфузия в течение 15 минут |
Опиоидные анальгетики, сильные | Морфин | 5-10 мг (50 мг), в/в, в/м |
Опиоидные анальгетики, слабые | Трамадол (Трамал®) | 100 мг (400 мг), в/в, в/м |
Адъювантные препараты | Кетамин | 0, 15-0, 25 мг/кг в/в |
Местные анестетики | Лидокаин 2% | (800 мг суточная) * |
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— широкое применение высокотехнологичных методов обезболивания — продленной эпидуральной анальгезии посредством инфузии местных анестетиков, а также контролируемой пациентом внутривенной или эпидуральной анальгезии.
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство | Продолжительность обезболивания, часы |
Торакотомии | 72-96 |
Вмешательства на верхнем этаже брюшной полости и диафрагме | 72-96 |
Вмешательства на нижнем этаже брюшной полости | 48 |
Нефрэктомия | 48-72 |
Операции на тазобедренном суставе | 24-48 |
Операции на конечностях | 24-36 |
Лапароскопические операции среднего объема | 24-36 |
Грыжесечения | 24 |
Очевидно, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. С этим связано и само наличие в клинической практике целого перечня возможных методов купирования ПБС (табл. 3). Тем не менее, даже при наличии целого арсенала средств и методов послеоперационного обезболивания, с позиций здравого смысла логичным будет утверждать, что предотвращение ноцицептивной стимуляции, приводящей к развитию болевого синдрома, прежде всего — введением НПВП, гораздо проще и требует меньших медикаментозных затрат, нежели борьба с уже развившейся сильной болью. Так, ещё в 1996 году в Ванкувере метод предупреждающей (превентивной) анальгезии с периоперационным назначением НПВП был признан перспективным направлением в патогенетической терапии болевых синдромов и широко используется прогрессивными клиниками в настоящее время.
С этим связано и само наличие в клинической практике целого перечня возможных методов купирования ПБС (табл. 3). Тем не менее, даже при наличии целого арсенала средств и методов послеоперационного обезболивания, с позиций здравого смысла логичным будет утверждать, что предотвращение ноцицептивной стимуляции, приводящей к развитию болевого синдрома, прежде всего — введением НПВП, гораздо проще и требует меньших медикаментозных затрат, нежели борьба с уже развившейся сильной болью. Так, ещё в 1996 году в Ванкувере метод предупреждающей (превентивной) анальгезии с периоперационным назначением НПВП был признан перспективным направлением в патогенетической терапии болевых синдромов и широко используется прогрессивными клиниками в настоящее время.
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию. 2. Опиоидные препараты агонисты/антагонисты: а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия. б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное 3. Неопиоидные анальгетики с системным введением: а) нестероидные противоспалительные препараты б) ацетаминофен (парацетамол) 4. Методы регионарной анестезии: а) эпидуральное введение опиоидов; б) нестероидные противовоспалительные препараты; в) введение а2 -адренергических агонистов:
5. Нефармакологические методы:
6. Сочетанное использование представленных методов |
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
Основным побочным эффектом, ассоциируемым с применением природных опиоидов (морфин, промедол, омнопон), является депрессия дыхательного центра. При этом главная проблема заключается в том, что эффективная анальгетическая доза зачастую близка к той, которая вызывает депрессию дыхания. Помимо депрессии дыхания увеличение дозы лимитировано увеличением частоты других побочных эффектов, таких как угнетение сознания, кожный зуд, тошнота и рвота, нарушение моторики кишечника, затруднение самостоятельного мочеиспускания в послеоперационном периоде. Следует отметить, что именно в абдоминальной хирургии все отрицательные эффекты опиоидов проявляются в большей степени, чем в иных областях хирургии. В первую очередь это связано с их негативным влиянием на моторику желудочно-кишечного тракта, которое имеет место (хотя и в меньшей степени) и при эпидуральном введении малых доз морфина. Последнее обстоятельство явилось одной из причин наблюдаемого в последние годы снижения популярности послеоперационной эпидуральной анальгезии с использованием гидрофильных опиоидов.
Следует отметить, что именно в абдоминальной хирургии все отрицательные эффекты опиоидов проявляются в большей степени, чем в иных областях хирургии. В первую очередь это связано с их негативным влиянием на моторику желудочно-кишечного тракта, которое имеет место (хотя и в меньшей степени) и при эпидуральном введении малых доз морфина. Последнее обстоятельство явилось одной из причин наблюдаемого в последние годы снижения популярности послеоперационной эпидуральной анальгезии с использованием гидрофильных опиоидов.
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат | Дозировка и пути введения | Относительная анальгетическая активность | Побочные эффекты |
Морфин | До 20 мг/сут | 1 | Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал |
Промедол | До 60-80 мг/сут | 0, 3 – 0, 25 | Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал |
Омнопон | До 100 мг/сут | 0, 1 | Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала |
Значительно меньшее количество побочных эффектов вызывает применение полусинтетического опиоида трамадола. Трамадола гидрохлорид — анальгетик, опосредующий обезболивающий эффект как через опиоидные рецепторы, так и путем ингибирования норадренергического и серотонинергического механизма передачи болевой импульсации. Трамадол характеризуется сравнительно высокой биодоступностью и длительным болеутоляющим эффектом. Тем не менее анальгетический эффект трамадола ниже, чем у морфина и промедола. Существенное преимущество трамадола по сравнению с другими опиоидными анальгетиками крайне низкая степень привыкания и минимальный наркогенный потенциал этого препарата. В отличие от других опиоидов, в эквианальгетических дозах трамадол не вызывает запора, не угнетает кровообращения и дыхания. Тем не менее и для трамадола характерны развитие тошноты, головокружения, в редких случаях рвоты.
Трамадола гидрохлорид — анальгетик, опосредующий обезболивающий эффект как через опиоидные рецепторы, так и путем ингибирования норадренергического и серотонинергического механизма передачи болевой импульсации. Трамадол характеризуется сравнительно высокой биодоступностью и длительным болеутоляющим эффектом. Тем не менее анальгетический эффект трамадола ниже, чем у морфина и промедола. Существенное преимущество трамадола по сравнению с другими опиоидными анальгетиками крайне низкая степень привыкания и минимальный наркогенный потенциал этого препарата. В отличие от других опиоидов, в эквианальгетических дозах трамадол не вызывает запора, не угнетает кровообращения и дыхания. Тем не менее и для трамадола характерны развитие тошноты, головокружения, в редких случаях рвоты.
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов.
По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов.
По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс | Препараты | Особенности терапии | Побочные эффекты |
Антагонисты NMDA-рецепторов | Кетамин | Применяется как адъювант при введении опиоидов. Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания | При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов. |
Антиконвульсанты | Гарбапентин | Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. | Головокружение, сонливость, периферические отеки. |
Ингибиторы протеаз | Трансамин | Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС | Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения. |
Центральные α-адреномиметики | Клонидин | Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии. | Гипотензия, брадикардия, психические нарушения. |
Бензодиазепины | Диазепам и т. п. | Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей. | Сонливость, головокружение, психические расстройства |
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Возможность применения парацетамола в качестве средства для борьбы с ПБС появилась с внедрением в клиническую практику лекарственной формы данного препарата для внутривенной инфузии (Перфалган®). Внутривенное введение парацетамола используется, как правило, в качестве базисного компонента мультимодальной послеоперационной анальгезии в разных областях хирургии: травматологии, гинекологии, стоматологии. Обезболивающий эффект 1 г внутривенного парацетамола с 10 мг морфина, 30 мг кеторолака, 75 мг диклофенака и 2, 5 мг метамизола. В настоящее время в европейских клиниках парацетамол в послеоперационном периоде получают 90-95% пациентов. Обычно препарат вводят внутривенно во время операции, примерно за 30 минут до ее окончания, что обеспечивает спокойное, безболезненное пробуждение. Повторно парацетамол вводят через 4 часа, а затем каждые 6 часов, до 4 г в сутки. Необходимо подчеркнуть, что обезболивающий эффект парацетамола в полной мере проявляется лишь при использовании его как компонента мультимодальной анальгезии, то есть при сочетании его с другими анальгетиками, в том числе – в составе комбинированных препаратов — Залдиар® и Форсодол®, имеющих в своем составе парацетамол и трамадол (препарат выпускается только в таблетированной форме, что часто делает его применение в ближайшем послеоперационном периоде невозможным). По мнению отечественных специалистов и, исходя из собственных наблюдений, применение внутривенного парацетамола в моноварианте недостаточно эффективно купирует ПБС.
По мнению отечественных специалистов и, исходя из собственных наблюдений, применение внутривенного парацетамола в моноварианте недостаточно эффективно купирует ПБС.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
рис. ).
Мультимодальная анальгезия в настоящее время является методом выбора послеоперационного обезболивания. Ее базис — назначение неопиоидных анальгетиков (прежде всего — НПВП), которое у пациентов с болями средней и высокой интенсивности сочетается с использованием опиоидных анальгетиков, неопиоидных анальгетиков и методов регионарной анальгезии. Выбор той или иной схемы мультимодальной анальгезии определяется прежде всего травматичностью проведенного хирургического вмешательства (табл. 6).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.
Операции | До операции | Во время операции | После операции |
Низкой травматичности | НПВП в/в, в/м или per os за 30-40 минут до начала операции | Общая анестезия и/или регионарная (от инфильтрационной до спинальной) | НПВП + парацетамол в/в 2-3 р/сут |
Средней травматичности | То же | Общая анестезия и/или регионарная (от блокады периферических нервов и сплетений до комбинированной спинально-эпидуральной). | НПВП + парацетамол в/в 3-4 р/сут ± опиоидный анальгетик (трамадол в/м или в/в 2-3 р/сут или промедол 2 р/сут в/м) |
Высокой травматичности | То же | Общая анестезия с обязательным использованием регионарной (предпочтительна эпидуральная) в качестве компонента. В схему индукции анестезии целесообразно включить кетамин болюс 0, 25 мг/кг 4. За 30 минут до окончания операции парацетамол 1 г в/в, инфузия в течение 15 минут | Продленная эпидуральная анальгезия (ропивакаин ± фентанил) + НПВП 2 р/сут + парацетамол в/в 2-3 р/сут |
Протоколы
ПРОТОКОЛ ПЕРИОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ ПРИ ОПЕРАЦИЯХ НА ГОЛОВНОМ МОЗГЕ
Размер файлов:
44.68 kB
Дата:
08 февраля 2016
Загрузки:
2182 x
АНЕСТЕЗИЯ //ОПЕРАЦИЯ:
А. Метод выбора: Общая анестезия
Б.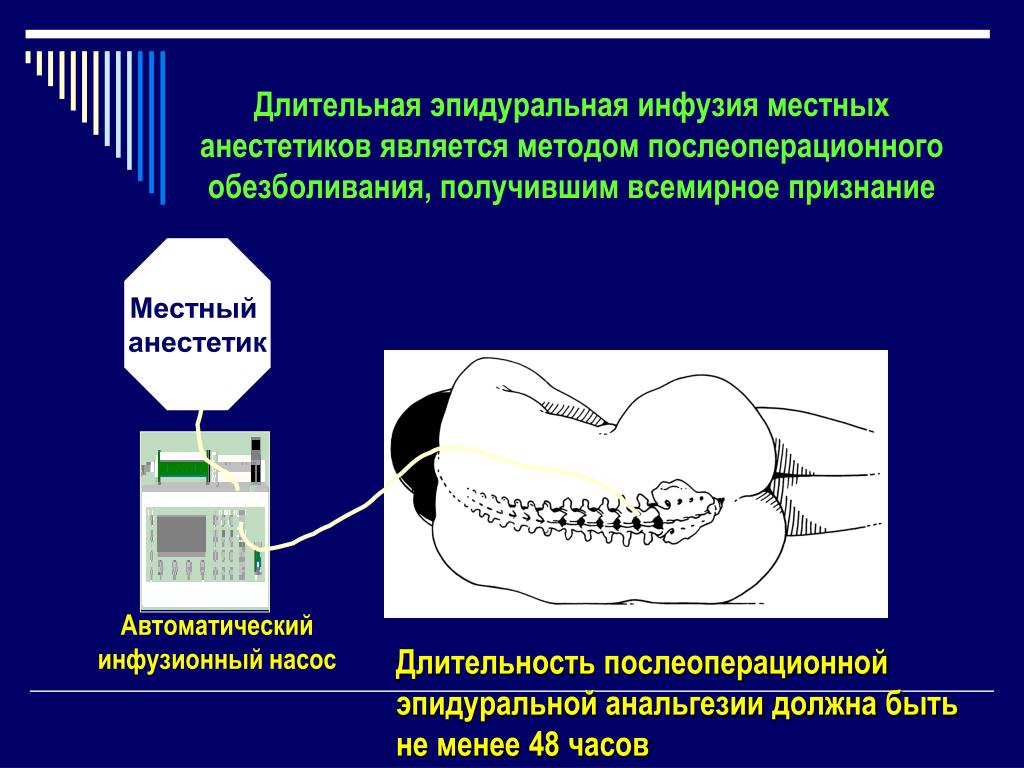 За 30 минут до конца операции (с момента ушивания раны): • Парацетамол1 совместно с • Традиционные НПВС2 или ингибиторы циклооксигеназы-23 при повышенном риске развития осложнений от традиционных НПВС В. Хирургическая техника •Для уменьшения интенсивности послеоперационного болевого синдрома рекомендуется выполнить инфильтрацию места кожного разреза4 ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ: А. Всем пациентам (при отсутствии противопоказаний): • Парацетамол5 совместно с • Традиционные НПВС3 или ингибиторы циклооксигеназы-23 при повышенном риске развития осложнений от традиционных НПВС Б. При сильном болевом синдроме (ВАШ7 > 30 мм) – добавить опиоиды7 регулярными инъекциями или аутоанальгезией. Примечания: 1 Внутривенно в дозе 1 грамм. В конце операции не рекомендуется использовать ректальную форму парацетамола в связи с непредсказуемыми фармакокинетическими и фармакодинамическими характеристиками. 2 В раннем послеоперационном периоде следует избегать внутримышечного введения НПВC вследствие неудовлетворительной фармакокинетики и фармакодинамики, болезненностью от введения.
За 30 минут до конца операции (с момента ушивания раны): • Парацетамол1 совместно с • Традиционные НПВС2 или ингибиторы циклооксигеназы-23 при повышенном риске развития осложнений от традиционных НПВС В. Хирургическая техника •Для уменьшения интенсивности послеоперационного болевого синдрома рекомендуется выполнить инфильтрацию места кожного разреза4 ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ: А. Всем пациентам (при отсутствии противопоказаний): • Парацетамол5 совместно с • Традиционные НПВС3 или ингибиторы циклооксигеназы-23 при повышенном риске развития осложнений от традиционных НПВС Б. При сильном болевом синдроме (ВАШ7 > 30 мм) – добавить опиоиды7 регулярными инъекциями или аутоанальгезией. Примечания: 1 Внутривенно в дозе 1 грамм. В конце операции не рекомендуется использовать ректальную форму парацетамола в связи с непредсказуемыми фармакокинетическими и фармакодинамическими характеристиками. 2 В раннем послеоперационном периоде следует избегать внутримышечного введения НПВC вследствие неудовлетворительной фармакокинетики и фармакодинамики, болезненностью от введения.
 Возможно также применение цифровой рейтинговой шкалы (от 0 до 10 баллов). 7 Налбуфин, трамадол, морфин, фентанил
Возможно также применение цифровой рейтинговой шкалы (от 0 до 10 баллов). 7 Налбуфин, трамадол, морфин, фентанилПРОТОКОЛ ПЕРИОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ ПРИ ОПЕРАЦИЯХ НА ГОЛОВНОМ МОЗГЕ
pain_neuro.pdf
Hot
Скачать
ПРОТОКОЛ ПЕРИОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ ПРИ КЕСАРЕВОМ СЕЧЕНИИ
Размер файлов:
46.43 kB
Дата:
08 февраля 2016
Загрузки:
2945 x
АНЕСТЕЗИЯ//ОПЕРАЦИЯ:
А. Метод первого выбора1:
• Спинномозговая анестезия2
Б. При наличии противопоказаний к нейроаксиальной блокаде, отказе пациентки, а также
при наличии показаний3:
• Общая анестезия
В. Если проводилась эпидуральная анальгезия в родах и при отсутствии показаний к
общей анестезии:
• Эпидуральная анестезия4
Г. За 30 минут до конца операции или предполагаемой регрессии блокады:
• Парацетамол5 совместно с
• Традиционные НПВС6 (помнить о риске осложнений от традиционных НПВС при
беременности и лактации).
ПРОТОКОЛ ПЕРИОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ ПРИ КЕСАРЕВОМ СЕЧЕНИИ
pain_c_section.pdf
HotСкачать
Powered by Phoca Download
Скачать
Конференции и курсы
Авторизация
Логин
Пароль
Запомнить меня
- Забыли пароль?
- Забыли логин?
Полезные ссылки
- Последние обновление сайта:Понедельник 11 апреля 2022, 21:38:54.
Контроль послеоперационной боли — StatPearls
Непрерывное обучение
Послеоперационная боль испытывает подавляющее большинство пациентов, подвергающихся хирургическим вмешательствам. Контроль послеоперационной боли играет важную роль в облегчении восстановления нормальной функции пациента и снижает частоту неблагоприятных физиологических и психологических эффектов, связанных с острой, неконтролируемой болью. Послеоперационный контроль боли может быть достигнут различными механизмами, включая (но не ограничиваясь) использование фармакологических агентов и интервенционных методов. В этом упражнении описываются показания, оценка, лечение и последствия контроля боли у послеоперационного пациента.
Контроль послеоперационной боли играет важную роль в облегчении восстановления нормальной функции пациента и снижает частоту неблагоприятных физиологических и психологических эффектов, связанных с острой, неконтролируемой болью. Послеоперационный контроль боли может быть достигнут различными механизмами, включая (но не ограничиваясь) использование фармакологических агентов и интервенционных методов. В этом упражнении описываются показания, оценка, лечение и последствия контроля боли у послеоперационного пациента.
Цели:
Определите показания и противопоказания для послеоперационного обезболивания.
Опишите оборудование, персонал, подготовку и технику, необходимые для послеоперационного обезболивания.
Рассмотрите и оцените возможные осложнения и клиническую значимость послеоперационного обезболивания.
Опишите стратегии межпрофессиональной команды для улучшения координации ухода и коммуникации для улучшения послеоперационного контроля боли и улучшения результатов у пациентов после операции.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Цель контроля послеоперационной боли — уменьшить негативные последствия, связанные с острой послеоперационной болью, и помочь пациенту плавно вернуться к нормальному функционированию. Традиционно опиоидная анальгетическая терапия служила основой лечения острой послеоперационной боли. Однако недавний рост заболеваемости и смертности, связанный со злоупотреблением опиоидами, привел к увеличению потребности в дополнительных исследованиях по разработке стратегий лечения боли, в которых больше внимания уделяется использованию мультимодального подхода.[1] Эти усилия оказались сложными, поскольку субъективный характер восприятия боли еще больше усложняет возможность достижения удовлетворительного контроля над болью. Кроме того, специфические сопутствующие заболевания пациента и социальные факторы могут предрасполагать пациентов к повышенному восприятию боли [2].
Приблизительно 75 процентов пациентов, перенесших операцию, испытывают острую послеоперационную боль, которая часто бывает средней или высокой степени тяжести.[3] Менее половины пациентов, перенесших операцию, сообщают об адекватном послеоперационном обезболивании.[2] Этот процент представляет собой серьезную проблему, поскольку неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим эффектам у пациентов в ближайшем послеоперационном периоде и подвергнуть их повышенному риску развития хронической боли, связанной с процедурой. Сильная непрекращающаяся послеоперационная боль поражает от 2 до 10 процентов взрослых.[5]
Среди проблем, которые затрудняют контроль над болью, — отсутствие протоколов наблюдения за уровнем боли или руководств по вмешательству, которые помогли бы обеспечить более эффективные средства корректировки терапии для обеспечения лучшего облегчения боли. [5]
Анатомия и физиология
Афферентные нервные пути опосредуют ощущение боли. [6] Острую послеоперационную боль можно разделить на ноцицептивную, воспалительную или невропатическую. Ноцицептивная боль опосредована активированными немиелинизированными С-волокнами, тонкими миелинизированными А-дельта-волокнами и миелинизированными А-бета-волокнами и обычно возникает в ответ на вредные стимулы, такие как прямое интраоперационное повреждение ткани (например, разрез кожи). Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль.
[6] Острую послеоперационную боль можно разделить на ноцицептивную, воспалительную или невропатическую. Ноцицептивная боль опосредована активированными немиелинизированными С-волокнами, тонкими миелинизированными А-дельта-волокнами и миелинизированными А-бета-волокнами и обычно возникает в ответ на вредные стимулы, такие как прямое интраоперационное повреждение ткани (например, разрез кожи). Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль. [7]
[7]
Послеоперационная боль дополнительно может характеризоваться как соматическая или висцеральная. Соматическое разделение боли состоит из большого количества ноцицептивных миелинизированных, быстро проводящих А-бета-волокон, обнаруженных в кожных и глубоких тканях, которые способствуют более локализованному, острому качеству. Висцеральный отдел боли состоит из сети немиелинизированных С-волокон и тонко миелинизированных А-дельта-волокон, которые охватывают несколько внутренних органов и сходятся вместе перед входом в спинной мозг. Кроме того, висцеральные афферентные волокна проходят вблизи вегетативных ганглиев до их входа в дорсальные корешки спинного мозга. Эти характерные особенности висцеральных ноцицептивных волокон способствуют более диффузной, плохо локализованной картине боли, которая может сопровождаться вегетативными реакциями, такими как изменение частоты сердечных сокращений или артериального давления.[7]
Терапевтические вмешательства, разработанные для лечения боли, нацелены на воздействие на афферентный путь боли с помощью различных механизмов. Например, противодействуя активности болевых рецепторов или блокируя выработку провоспалительных медиаторов.[6]
Например, противодействуя активности болевых рецепторов или блокируя выработку провоспалительных медиаторов.[6]
Показания
Послеоперационное обезболивание, адаптированное индивидуально к сопутствующим заболеваниям и социальным факторам пациента, связано с уменьшением послеоперационного потребления опиоидов, сокращением продолжительности госпитализации после операции, снижением предоперационной тревожности и приводит к меньшему количеству запросов на седативные препараты.[2]
Противопоказания
Фармакологические агенты, используемые для контроля послеоперационной боли, противопоказаны, если у пациента в анамнезе были аллергические реакции, связанные с их применением.
Противопоказания к применению НПВП включают пациентов, перенесших операцию аортокоронарного шунтирования из-за повышенного риска сердечно-сосудистых событий.[2]
Оборудование
Оборудование, используемое в методах, включающих интервенционное послеоперационное обезболивание:
Периферийный IV Access
Стерильная подготовка кожи
Стерильное поле.
 аспирация, реанимационные препараты и дефибриллятор
аспирация, реанимационные препараты и дефибрилляторАппарат УЗИ
Анестетики
Полые иглы: диаметр, форма и длина игл различаются в зависимости от типа проводимой анестезии: например, иглы со скошенной кромкой, спинальные иглы
Катетер в сборе
Стимулятор периферических нервов
5
4 Оборудование, используемое для установки насосов для обезболивания, контролируемого пациентом (PCA):Периферический внутривенный доступ
Насос для АКП
Внутривенная трубка, заполненная физиологическим раствором
Канюля для обнаружения углекислого газа
Наркотические препараты
Инструменты для оценки адекватного обезболивания при острой боли:
Визуальные аналоговые шкалы (VAS)
Визуальная аналоговая шкала Heft-Parker (HPS)
Scale Scale (VRS)19
.
 (кадр/с)
(кадр/с)Шкала оценки боли Wong-Baker (WBS)
Персонал
Для разработки индивидуального плана обезболивания послеоперационного пациента следует использовать подход межпрофессиональной команды. В состав бригады должны входить лечащий врач, фармацевт, оперирующий хирург, анестезиолог, операционная и медицинский персонал, участвующие в данном случае. В зависимости от анамнеза пациента или характера процедуры, специалист по обезболиванию, физиотерапевт или психиатр также может быть включен в план обезболивания пациента.
В последние годы во многих учреждениях были реализованы группы Службы помощи при острой боли (APS) и программы ускоренного восстановления после операции (ERAS), чтобы помочь установить протоколы мониторинга оценки боли и улучшить стратегии вмешательства, чтобы помочь справиться с послеоперационной болью в хирургических отделениях. . Теоретически параметры, установленные этими программами, позволили бы медсестрам отделения играть более активную роль в мониторинге и лечении послеоперационной боли, что обеспечило бы все более адекватный контроль боли.
 [5]
[5]Подготовка
Тщательный сбор анамнеза и физикального состояния необходим пациенту перед операцией для оценки индивидуальных факторов пациента, которые могут повлиять на тяжесть его послеоперационной боли, и на выбор методов лечения, используемых в плане обезболивания. Факторы, которые следует учитывать при разработке стратегии послеоперационного обезболивания, включают тип предполагаемой процедуры, возраст пациента, хроническое употребление опиоидов в анамнезе и другие сопутствующие заболевания [6].
Сопутствующие заболевания, которые следует учитывать:
Ожирение представляет собой проблему при назначении опиоидов, поскольку эта группа населения подвержена повышенной восприимчивости к угнетению дыхания или апноэ во сне. Методы регионарной анестезии и отказ от седативных анальгетиков являются предпочтительными подходами к обезболиванию среди этой группы населения.[8]
Пациентам с хронической болью, которые полагаются на лечение опиоидами для облегчения, потребуются количества опиоидов, превышающие их базовую дозу.

Помимо недавней эпидемии опиоидов, оценка пациентов на наличие факторов риска, которые могут предрасполагать пациента к злоупотреблению опиоидами, также является важным компонентом предоперационного обследования. Имеющиеся данные свидетельствуют о том, что пациенты женского пола, подростки или старше 50 лет подвергаются повышенному риску постоянного употребления опиоидов. Ранее существовавшая в анамнезе депрессия или употребление запрещенных наркотиков, алкоголя, антидепрессантов или бензодиазепинов также подвержены повышенному риску постоянного употребления опиоидов.[6]
Техника
Многие предоперационные, интраоперационные и послеоперационные вмешательства и стратегии лечения доступны и продолжают развиваться для уменьшения и купирования послеоперационной боли. В 2012 году ASA опубликовало практическое руководство по купированию острой боли в периоперационном периоде, которое было рассмотрено и одобрено Американским обществом регионарной анестезии и медицины боли.
 [2]
[2]Ниже приведен список методов лечения, используемых для мультимодального лечения боли у послеоперационных пациентов:
Системная фармакологическая терапия
Местные, внутрисулярные или местные методы
Региональные анестезионные методы
Невросиальная анестетическая анестетическая техника, покровительственные, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики. электрическая стимуляция нервов (ЧЭНС)
Системная фармакологическая терапия: Обычно используемые препараты для контроля послеоперационной боли включают опиоиды, НПВП и/или ацетаминофен, стероиды, габапентин или прегабалин, кетамин внутривенно и лидокаин внутривенно. Пероральное введение опиоидных препаратов предпочтительнее внутривенного. Внутримышечные препараты не рекомендуются. Однако при обстоятельствах, когда необходим парентеральный путь введения лекарств (например, риск аспирации, кишечная непроходимость), рекомендуется внутривенная анальгезия, контролируемая пациентом (PCA).
 При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]
При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]Местные, внутрисуставные или топические методы: Блокады периферических нервов, внутрисуставные инъекции анестетиков, инфильтрация анестетика в рану и местные анестетики могут использоваться для купирования боли в конкретном месте.
 Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]
Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]Методы регионарной анестезии: Местная анестезия с добавлением или без внутривенного введения опиоидных препаратов является вариантом блокады фасциальной плоскости, местных инъекций анестетиков или, в некоторых случаях, эпидуральных инъекций в зависимости от типа выполняемой процедуры. Анестезиолог обычно выполняет эти методы под ультразвуковым контролем. Использование непрерывного внутривенного введения лекарств (в виде капель) предпочтительнее методов однократной инъекции в случаях, когда продолжительность послеоперационной боли удлиняется. Внутриплевральная анальгезия не рекомендуется для контроля боли, так как мало данных, подтверждающих пользу, а высокая системная абсорбция в плевральной полости увеличивает риск токсичности препарата [2].
Методы нейроаксиальной анестезии: Обычно включает эпидуральную инъекцию местного анестетика с добавлением или без внутривенного введения опиоидных препаратов.
 Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]
Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]Нефармакологические методы лечения: Примеры нефармакологических методов лечения, используемых для контроля боли, включают когнитивные методы или механические методы, такие как чрескожная электрическая стимуляция нервов (ЧЭНС).[2]
Оценка адекватного обезболивания:
Оценка тяжести боли обычно проводится с использованием шкалы боли. Острую боль, например, в послеоперационном периоде, чаще всего измеряют с помощью одномерных шкал боли. Хотя существует множество различных шкал боли, визуальная аналоговая шкала (ВАШ) является наиболее часто используемой шкалой для оценки послеоперационной боли.
 Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]
Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]Осложнения
Неадекватное купирование острой боли имеет многочисленные неблагоприятные последствия для здоровья пациента, включая, помимо прочего, снижение способности выполнять повседневные действия, нарушение сна, плохое настроение и снижение либидо. Плохое лечение острой боли не только негативно влияет на здоровье пациентов, но также может увеличить риск развития хронической боли.[10]
Применение опиоидных препаратов может вызвать сонливость, седативный эффект, угнетение дыхания, задержку мочи, тошноту/рвоту, кишечную непроходимость или зуд.[10] Передозировка опиоидов может привести к смерти или инвалидности.[6] Использование опиоидных препаратов может подвергнуть пациента повышенному риску зависимости и расстройства, связанного с употреблением психоактивных веществ.
 Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]
Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]Риск кровотечения, связанный с применением НПВП, следует учитывать у пациентов с повышенным риском кровопотери, например, у тех, кто перенес хирургическое вмешательство на структурах с большим количеством сосудов (например, тонзиллэктомия) по сравнению с другими пациентами (например, холецистэктомия) при разработке соответствующей стратегии обезболивания.[1] НПВП также коррелируют с повышенным риском желудочно-кишечного кровотечения и почечной дисфункции.[2]
Использование методов периферической регионарной анальгезии может привести к преходящей моторной блокаде, что может увеличить риск падений.
 [2]
[2]При проведении нейроаксиальной анальгезии за пациентами требуется тщательное наблюдение, так как могут возникнуть угнетение дыхания, гипотензия и двигательная слабость из-за сдавления спинного мозга (из-за гематомы или инфекции).[2] Непрерывное внутрисуставное введение бупивакаина у пациентов, перенесших операцию на плече, может увеличить риск хондролиза [2].
Клиническое значение
Неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим последствиям в остром послеоперационном периоде и увеличить вероятность развития хронического болевого синдрома. Здоровье и благополучие пациента могут еще больше пострадать из-за хронической боли. Понимание патофизиологии боли, стратегий уменьшения боли, уровня инвазивности выполняемых процедур, а также сопутствующих заболеваний и социальных факторов у отдельных пациентов может помочь врачу разработать оптимальный план лечения боли, который снижает риск этих худших исходов. Кроме того, было показано, что оптимизированный послеоперационный контроль боли уменьшает страдания пациентов, сокращает продолжительность пребывания в больнице, способствует более ранней мобилизации и способности выполнять повседневные действия, а также повышает удовлетворенность пациентов [6].

В то время как терапия опиоидными анальгетиками продолжает играть существенную роль в лечении послеоперационной боли, рост числа травм и смертей из-за передозировки опиоидов среди населения в целом требует тщательного изучения предрасположенности пациента к развитию расстройств, связанных с употреблением психоактивных веществ или лекарств. злоупотребления перед назначением опиоидной терапии. Кроме того, пациенты должны получить информацию о безопасных методах хранения и надлежащих методах утилизации своих лекарств после выписки домой.[1]
Следует подчеркнуть мультимодальный подход и индивидуальный план лечения послеоперационной боли, чтобы помочь снизить потребность в опиоидах при оптимизации обезболивания.
Улучшение результатов работы медицинской бригады
Послеоперационное обезболивание — это сложная задача, требующая межпрофессионального участия, которое начинается в предоперационной обстановке и продолжается до выздоровления пациента. Тщательное предоперационное обследование пациента лечащим врачом, практикующей медсестрой, оперирующим хирургом и анестезиологом может помочь в выявлении факторов риска пациента и сопутствующих заболеваний, которые могут повлиять на тяжесть его или ее послеоперационного периода восстановления, и позволит разработать индивидуальный индивидуальный режим обезболивания.
 Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции.
Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции. Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]
Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]Сестринское дело, Allied Health и Interprofessional Team Interventions
Медсестра играет неотъемлемую роль в лечении пациентов, которые испытывают послеоперационную боль. Информирование пациентов об их боли и правильное назначение лекарств, с правильным временем и дозировкой, является основной компетенцией, которую все медсестры должны тщательно практиковать. Медсестра должна помочь поставщику в титровании доз обезболивающих в соответствии с динамическими изменениями показателей боли у пациента. Медсестра должна предупредить медработника о любых неблагоприятных изменениях показателей жизнедеятельности пациента.
Уход за больными, союзными и межпрофессиональными мониторингом команды
Жизненные признаки
Уверенные визуальные аналоговые оценки
Любые изменения в состоянии пациента
.
 Обзорные вопросы
Обзорные вопросыПолучите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Бартелс К., Майес Л.М., Дингманн С., Буллард К.Дж., Хопфер С.Дж., Бинсвангер И.А. Модели использования и хранения опиоидов пациентами после выписки из больницы после операции. ПЛОС Один. 2016;11(1):e0147972. [Бесплатная статья PMC: PMC4732746] [PubMed: 26824844]
- 2.
Чоу Р., Гордон Д.Б., де Леон-Касасола О.А., Розенберг Дж.М., Биклер С., Бреннан Т., Картер Т., Кэссиди С.Л., Читтенден Э.Х., Дегенхардт Э., Гриффит С., Манворрен Р., Маккарберг Б., Монтгомери Р., Мерфи Дж., Перкал М.Ф., Суреш С., Слука К., Страсселс С., Тирлби Р., Вискузи Э., Уолко Г.А., Уорнер Л., Вайсман С.Дж., Ву К.Л. Управление послеоперационной болью: клиническое практическое руководство от Американского общества боли, Американского общества регионарной анестезии и медицины боли, а также Комитета по регионарной анестезии, Исполнительного комитета и Административного совета Американского общества анестезиологов.
 Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]
Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]- 3.
Suner ZC, Kalayci D, Sen O, Kaya M, Unver S, Oguz G. Послеоперационная анальгезия после тотальной абдоминальной гистерэктомии: эффективна ли блокада поперечной плоскости живота? Нигер J Clin Pract. 2019 апр; 22 (4): 478-484. [PubMed: 30975950]
- 4.
Лович-Сапола Дж., Смит К.Э., Брандт К.П. Послеоперационный контроль боли. Surg Clin North Am. 2015 Апрель; 95 (2): 301-18. [PubMed: 25814108]
- 5.
Равал Н. Актуальные проблемы послеоперационного обезболивания. Евр Дж Анаэстезиол. 2016 март; 33(3):160-71. [В паблике: 26509324]
- 6.
Lespasio MJ, Guarino AJ, Sodhi N, Mont MA. Управление болью, связанное с тотальной артропластикой суставов: учебник для начинающих. Perm J. 2019;23 [PMC free article: PMC6443359] [PubMed: 30939283]
- 7.
Blichfeldt-Eckhardt MR. От острой до хронической послеоперационной боли: значение реакции на острую боль.
 Dan Med J. 2018 Mar; 65 (3) [PubMed: 29510808]
Dan Med J. 2018 Mar; 65 (3) [PubMed: 29510808]- 8.
Garimella V, Cellini C. Послеоперационное обезболивание. Clin Colon Rectal Surg. 2013 сен;26(3):191-6. [Бесплатная статья PMC: PMC3747287] [PubMed: 24436674]
- 9.
Sirintawat N, Sawang K, Chaiyasamut T, Wongsirichat N. Измерение боли в челюстно-лицевой хирургии. J Dent Anesth Pain Med. 2017 Декабрь; 17 (4): 253-263. [Бесплатная статья PMC: PMC5766084] [PubMed: 29349347]
- 10.
Синатра Р. Причины и последствия неадекватного лечения острой боли. Боль Мед. 2010 Декабрь; 11 (12): 1859-71. [PubMed: 21040438]
Послеоперационное обезболивание — StatPearls
Непрерывное обучение
Послеоперационную боль испытывает подавляющее большинство пациентов, перенесших хирургические процедуры. Контроль послеоперационной боли играет важную роль в облегчении восстановления нормальной функции пациента и снижает частоту неблагоприятных физиологических и психологических эффектов, связанных с острой, неконтролируемой болью.
Послеоперационный контроль боли может быть достигнут различными механизмами, включая (но не ограничиваясь) использование фармакологических агентов и интервенционных методов. В этом упражнении описываются показания, оценка, лечение и последствия контроля боли у послеоперационного пациента.
Цели:
Определите показания и противопоказания для послеоперационного обезболивания.
Опишите оборудование, персонал, подготовку и технику, необходимые для послеоперационного обезболивания.
Рассмотрите и оцените возможные осложнения и клиническую значимость послеоперационного обезболивания.
Опишите стратегии межпрофессиональной команды для улучшения координации ухода и коммуникации для улучшения послеоперационного контроля боли и улучшения результатов у пациентов после операции.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Введение
Цель контроля послеоперационной боли — уменьшить негативные последствия, связанные с острой послеоперационной болью, и помочь пациенту плавно вернуться к нормальному функционированию. Традиционно опиоидная анальгетическая терапия служила основой лечения острой послеоперационной боли. Однако недавний рост заболеваемости и смертности, связанный со злоупотреблением опиоидами, привел к увеличению потребности в дополнительных исследованиях по разработке стратегий лечения боли, в которых больше внимания уделяется использованию мультимодального подхода.[1] Эти усилия оказались сложными, поскольку субъективный характер восприятия боли еще больше усложняет возможность достижения удовлетворительного контроля над болью. Кроме того, специфические сопутствующие заболевания пациента и социальные факторы могут предрасполагать пациентов к повышенному восприятию боли [2].
Приблизительно 75 процентов пациентов, перенесших операцию, испытывают острую послеоперационную боль, которая часто бывает средней или высокой степени тяжести.
 [3] Менее половины пациентов, перенесших операцию, сообщают об адекватном послеоперационном обезболивании.[2] Этот процент представляет собой серьезную проблему, поскольку неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим эффектам у пациентов в ближайшем послеоперационном периоде и подвергнуть их повышенному риску развития хронической боли, связанной с процедурой. Сильная непрекращающаяся послеоперационная боль поражает от 2 до 10 процентов взрослых.[5]
[3] Менее половины пациентов, перенесших операцию, сообщают об адекватном послеоперационном обезболивании.[2] Этот процент представляет собой серьезную проблему, поскольку неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим эффектам у пациентов в ближайшем послеоперационном периоде и подвергнуть их повышенному риску развития хронической боли, связанной с процедурой. Сильная непрекращающаяся послеоперационная боль поражает от 2 до 10 процентов взрослых.[5]Среди проблем, которые затрудняют контроль над болью, — отсутствие протоколов наблюдения за уровнем боли или руководств по вмешательству, которые помогли бы обеспечить более эффективные средства корректировки терапии для обеспечения лучшего облегчения боли. [5]
Анатомия и физиология
Афферентные нервные пути опосредуют ощущение боли. [6] Острую послеоперационную боль можно разделить на ноцицептивную, воспалительную или невропатическую. Ноцицептивная боль опосредована активированными немиелинизированными С-волокнами, тонкими миелинизированными А-дельта-волокнами и миелинизированными А-бета-волокнами и обычно возникает в ответ на вредные стимулы, такие как прямое интраоперационное повреждение ткани (например, разрез кожи).
 Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль.[7]
Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль.[7]Послеоперационная боль дополнительно может характеризоваться как соматическая или висцеральная. Соматическое разделение боли состоит из большого количества ноцицептивных миелинизированных, быстро проводящих А-бета-волокон, обнаруженных в кожных и глубоких тканях, которые способствуют более локализованному, острому качеству.
 Висцеральный отдел боли состоит из сети немиелинизированных С-волокон и тонко миелинизированных А-дельта-волокон, которые охватывают несколько внутренних органов и сходятся вместе перед входом в спинной мозг. Кроме того, висцеральные афферентные волокна проходят вблизи вегетативных ганглиев до их входа в дорсальные корешки спинного мозга. Эти характерные особенности висцеральных ноцицептивных волокон способствуют более диффузной, плохо локализованной картине боли, которая может сопровождаться вегетативными реакциями, такими как изменение частоты сердечных сокращений или артериального давления.[7]
Висцеральный отдел боли состоит из сети немиелинизированных С-волокон и тонко миелинизированных А-дельта-волокон, которые охватывают несколько внутренних органов и сходятся вместе перед входом в спинной мозг. Кроме того, висцеральные афферентные волокна проходят вблизи вегетативных ганглиев до их входа в дорсальные корешки спинного мозга. Эти характерные особенности висцеральных ноцицептивных волокон способствуют более диффузной, плохо локализованной картине боли, которая может сопровождаться вегетативными реакциями, такими как изменение частоты сердечных сокращений или артериального давления.[7]Терапевтические вмешательства, разработанные для лечения боли, нацелены на воздействие на афферентный путь боли с помощью различных механизмов. Например, противодействуя активности болевых рецепторов или блокируя выработку провоспалительных медиаторов.[6]
Показания
Послеоперационное обезболивание, адаптированное индивидуально к сопутствующим заболеваниям и социальным факторам пациента, связано с уменьшением послеоперационного потребления опиоидов, сокращением продолжительности госпитализации после операции, снижением предоперационной тревожности и приводит к меньшему количеству запросов на седативные препараты.
 [2]
[2]Противопоказания
Фармакологические агенты, используемые для контроля послеоперационной боли, противопоказаны, если у пациента в анамнезе были аллергические реакции, связанные с их применением.
Противопоказания к применению НПВП включают пациентов, перенесших операцию аортокоронарного шунтирования из-за повышенного риска сердечно-сосудистых событий.[2]
Оборудование
Оборудование, используемое в методах, включающих интервенционное послеоперационное обезболивание:
Периферийный IV Access
Стерильная подготовка кожи
Стерильное поле. аспирация, реанимационные препараты и дефибриллятор
Аппарат УЗИ
Анестетики
Полые иглы: диаметр, форма и длина игл различаются в зависимости от типа проводимой анестезии: например, иглы со скошенной кромкой, спинальные иглы
Катетер в сборе
Стимулятор периферических нервов
5
4 Оборудование, используемое для установки насосов для обезболивания, контролируемого пациентом (PCA):Периферический внутривенный доступ
Насос для АКП
Внутривенная трубка, заполненная физиологическим раствором
Канюля для обнаружения углекислого газа
Наркотические препараты
Инструменты для оценки адекватного обезболивания при острой боли:
Визуальные аналоговые шкалы (VAS)
Визуальная аналоговая шкала Heft-Parker (HPS)
Scale Scale (VRS)19
.
 (кадр/с)
(кадр/с)Шкала оценки боли Wong-Baker (WBS)
Персонал
Для разработки индивидуального плана обезболивания послеоперационного пациента следует использовать подход межпрофессиональной команды. В состав бригады должны входить лечащий врач, фармацевт, оперирующий хирург, анестезиолог, операционная и медицинский персонал, участвующие в данном случае. В зависимости от анамнеза пациента или характера процедуры, специалист по обезболиванию, физиотерапевт или психиатр также может быть включен в план обезболивания пациента.
В последние годы во многих учреждениях были реализованы группы Службы помощи при острой боли (APS) и программы ускоренного восстановления после операции (ERAS), чтобы помочь установить протоколы мониторинга оценки боли и улучшить стратегии вмешательства, чтобы помочь справиться с послеоперационной болью в хирургических отделениях. . Теоретически параметры, установленные этими программами, позволили бы медсестрам отделения играть более активную роль в мониторинге и лечении послеоперационной боли, что обеспечило бы все более адекватный контроль боли.
 [5]
[5]Подготовка
Тщательный сбор анамнеза и физикального состояния необходим пациенту перед операцией для оценки индивидуальных факторов пациента, которые могут повлиять на тяжесть его послеоперационной боли, и на выбор методов лечения, используемых в плане обезболивания. Факторы, которые следует учитывать при разработке стратегии послеоперационного обезболивания, включают тип предполагаемой процедуры, возраст пациента, хроническое употребление опиоидов в анамнезе и другие сопутствующие заболевания [6].
Сопутствующие заболевания, которые следует учитывать:
Ожирение представляет собой проблему при назначении опиоидов, поскольку эта группа населения подвержена повышенной восприимчивости к угнетению дыхания или апноэ во сне. Методы регионарной анестезии и отказ от седативных анальгетиков являются предпочтительными подходами к обезболиванию среди этой группы населения.[8]
Пациентам с хронической болью, которые полагаются на лечение опиоидами для облегчения, потребуются количества опиоидов, превышающие их базовую дозу.
 Упор на мультимодальную терапию, включающую интервенционные методы анестезии и неопиоидные анальгетики, имеет особое значение для этой группы населения.[8]
Упор на мультимодальную терапию, включающую интервенционные методы анестезии и неопиоидные анальгетики, имеет особое значение для этой группы населения.[8]Помимо недавней эпидемии опиоидов, оценка пациентов на наличие факторов риска, которые могут предрасполагать пациента к злоупотреблению опиоидами, также является важным компонентом предоперационного обследования. Имеющиеся данные свидетельствуют о том, что пациенты женского пола, подростки или старше 50 лет подвергаются повышенному риску постоянного употребления опиоидов. Ранее существовавшая в анамнезе депрессия или употребление запрещенных наркотиков, алкоголя, антидепрессантов или бензодиазепинов также подвержены повышенному риску постоянного употребления опиоидов.[6]
Техника
Многие предоперационные, интраоперационные и послеоперационные вмешательства и стратегии лечения доступны и продолжают развиваться для уменьшения и купирования послеоперационной боли. В 2012 году ASA опубликовало практическое руководство по купированию острой боли в периоперационном периоде, которое было рассмотрено и одобрено Американским обществом регионарной анестезии и медицины боли.
 [2]
[2]Ниже приведен список методов лечения, используемых для мультимодального лечения боли у послеоперационных пациентов:
Системная фармакологическая терапия
Местные, внутрисулярные или местные методы
Региональные анестезионные методы
Невросиальная анестетическая анестетическая техника, покровительственные, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики, покровительщики. электрическая стимуляция нервов (ЧЭНС)
Системная фармакологическая терапия: Обычно используемые препараты для контроля послеоперационной боли включают опиоиды, НПВП и/или ацетаминофен, стероиды, габапентин или прегабалин, кетамин внутривенно и лидокаин внутривенно. Пероральное введение опиоидных препаратов предпочтительнее внутривенного. Внутримышечные препараты не рекомендуются. Однако при обстоятельствах, когда необходим парентеральный путь введения лекарств (например, риск аспирации, кишечная непроходимость), рекомендуется внутривенная анальгезия, контролируемая пациентом (PCA).
 При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]
При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]Местные, внутрисуставные или топические методы: Блокады периферических нервов, внутрисуставные инъекции анестетиков, инфильтрация анестетика в рану и местные анестетики могут использоваться для купирования боли в конкретном месте.
 Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]
Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]Методы регионарной анестезии: Местная анестезия с добавлением или без внутривенного введения опиоидных препаратов является вариантом блокады фасциальной плоскости, местных инъекций анестетиков или, в некоторых случаях, эпидуральных инъекций в зависимости от типа выполняемой процедуры. Анестезиолог обычно выполняет эти методы под ультразвуковым контролем. Использование непрерывного внутривенного введения лекарств (в виде капель) предпочтительнее методов однократной инъекции в случаях, когда продолжительность послеоперационной боли удлиняется. Внутриплевральная анальгезия не рекомендуется для контроля боли, так как мало данных, подтверждающих пользу, а высокая системная абсорбция в плевральной полости увеличивает риск токсичности препарата [2].
Методы нейроаксиальной анестезии: Обычно включает эпидуральную инъекцию местного анестетика с добавлением или без внутривенного введения опиоидных препаратов.
 Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]
Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]Нефармакологические методы лечения: Примеры нефармакологических методов лечения, используемых для контроля боли, включают когнитивные методы или механические методы, такие как чрескожная электрическая стимуляция нервов (ЧЭНС).[2]
Оценка адекватного обезболивания:
Оценка тяжести боли обычно проводится с использованием шкалы боли. Острую боль, например, в послеоперационном периоде, чаще всего измеряют с помощью одномерных шкал боли. Хотя существует множество различных шкал боли, визуальная аналоговая шкала (ВАШ) является наиболее часто используемой шкалой для оценки послеоперационной боли.
 Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]
Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]Осложнения
Неадекватное купирование острой боли имеет многочисленные неблагоприятные последствия для здоровья пациента, включая, помимо прочего, снижение способности выполнять повседневные действия, нарушение сна, плохое настроение и снижение либидо. Плохое лечение острой боли не только негативно влияет на здоровье пациентов, но также может увеличить риск развития хронической боли.[10]
Применение опиоидных препаратов может вызвать сонливость, седативный эффект, угнетение дыхания, задержку мочи, тошноту/рвоту, кишечную непроходимость или зуд.[10] Передозировка опиоидов может привести к смерти или инвалидности.[6] Использование опиоидных препаратов может подвергнуть пациента повышенному риску зависимости и расстройства, связанного с употреблением психоактивных веществ.
 Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]
Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]Риск кровотечения, связанный с применением НПВП, следует учитывать у пациентов с повышенным риском кровопотери, например, у тех, кто перенес хирургическое вмешательство на структурах с большим количеством сосудов (например, тонзиллэктомия) по сравнению с другими пациентами (например, холецистэктомия) при разработке соответствующей стратегии обезболивания.[1] НПВП также коррелируют с повышенным риском желудочно-кишечного кровотечения и почечной дисфункции.[2]
Использование методов периферической регионарной анальгезии может привести к преходящей моторной блокаде, что может увеличить риск падений.
 [2]
[2]При проведении нейроаксиальной анальгезии за пациентами требуется тщательное наблюдение, так как могут возникнуть угнетение дыхания, гипотензия и двигательная слабость из-за сдавления спинного мозга (из-за гематомы или инфекции).[2] Непрерывное внутрисуставное введение бупивакаина у пациентов, перенесших операцию на плече, может увеличить риск хондролиза [2].
Клиническое значение
Неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим последствиям в остром послеоперационном периоде и увеличить вероятность развития хронического болевого синдрома. Здоровье и благополучие пациента могут еще больше пострадать из-за хронической боли. Понимание патофизиологии боли, стратегий уменьшения боли, уровня инвазивности выполняемых процедур, а также сопутствующих заболеваний и социальных факторов у отдельных пациентов может помочь врачу разработать оптимальный план лечения боли, который снижает риск этих худших исходов. Кроме того, было показано, что оптимизированный послеоперационный контроль боли уменьшает страдания пациентов, сокращает продолжительность пребывания в больнице, способствует более ранней мобилизации и способности выполнять повседневные действия, а также повышает удовлетворенность пациентов [6].

В то время как терапия опиоидными анальгетиками продолжает играть существенную роль в лечении послеоперационной боли, рост числа травм и смертей из-за передозировки опиоидов среди населения в целом требует тщательного изучения предрасположенности пациента к развитию расстройств, связанных с употреблением психоактивных веществ или лекарств. злоупотребления перед назначением опиоидной терапии. Кроме того, пациенты должны получить информацию о безопасных методах хранения и надлежащих методах утилизации своих лекарств после выписки домой.[1]
Следует подчеркнуть мультимодальный подход и индивидуальный план лечения послеоперационной боли, чтобы помочь снизить потребность в опиоидах при оптимизации обезболивания.
Улучшение результатов работы медицинской бригады
Послеоперационное обезболивание — это сложная задача, требующая межпрофессионального участия, которое начинается в предоперационной обстановке и продолжается до выздоровления пациента. Тщательное предоперационное обследование пациента лечащим врачом, практикующей медсестрой, оперирующим хирургом и анестезиологом может помочь в выявлении факторов риска пациента и сопутствующих заболеваний, которые могут повлиять на тяжесть его или ее послеоперационного периода восстановления, и позволит разработать индивидуальный индивидуальный режим обезболивания.
 Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции.
Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции. Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]
Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]Сестринское дело, Allied Health и Interprofessional Team Interventions
Медсестра играет неотъемлемую роль в лечении пациентов, которые испытывают послеоперационную боль. Информирование пациентов об их боли и правильное назначение лекарств, с правильным временем и дозировкой, является основной компетенцией, которую все медсестры должны тщательно практиковать. Медсестра должна помочь поставщику в титровании доз обезболивающих в соответствии с динамическими изменениями показателей боли у пациента. Медсестра должна предупредить медработника о любых неблагоприятных изменениях показателей жизнедеятельности пациента.
Уход за больными, союзными и межпрофессиональными мониторингом команды
Жизненные признаки
Уверенные визуальные аналоговые оценки
Любые изменения в состоянии пациента
.
 Обзорные вопросы
Обзорные вопросыПолучите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Бартелс К., Майес Л.М., Дингманн С., Буллард К.Дж., Хопфер С.Дж., Бинсвангер И.А. Модели использования и хранения опиоидов пациентами после выписки из больницы после операции. ПЛОС Один. 2016;11(1):e0147972. [Бесплатная статья PMC: PMC4732746] [PubMed: 26824844]
- 2.
Чоу Р., Гордон Д.Б., де Леон-Касасола О.А., Розенберг Дж.М., Биклер С., Бреннан Т., Картер Т., Кэссиди С.Л., Читтенден Э.Х., Дегенхардт Э., Гриффит С., Манворрен Р., Маккарберг Б., Монтгомери Р., Мерфи Дж., Перкал М.Ф., Суреш С., Слука К., Страсселс С., Тирлби Р., Вискузи Э., Уолко Г.А., Уорнер Л., Вайсман С.Дж., Ву К.Л. Управление послеоперационной болью: клиническое практическое руководство от Американского общества боли, Американского общества регионарной анестезии и медицины боли, а также Комитета по регионарной анестезии, Исполнительного комитета и Административного совета Американского общества анестезиологов.
 Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]
Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]- 3.
Suner ZC, Kalayci D, Sen O, Kaya M, Unver S, Oguz G. Послеоперационная анальгезия после тотальной абдоминальной гистерэктомии: эффективна ли блокада поперечной плоскости живота? Нигер J Clin Pract. 2019 апр; 22 (4): 478-484. [PubMed: 30975950]
- 4.
Лович-Сапола Дж., Смит К.Э., Брандт К.П. Послеоперационный контроль боли. Surg Clin North Am. 2015 Апрель; 95 (2): 301-18. [PubMed: 25814108]
- 5.
Равал Н. Актуальные проблемы послеоперационного обезболивания. Евр Дж Анаэстезиол. 2016 март; 33(3):160-71. [В паблике: 26509324]
- 6.
Lespasio MJ, Guarino AJ, Sodhi N, Mont MA. Управление болью, связанное с тотальной артропластикой суставов: учебник для начинающих. Perm J. 2019;23 [PMC free article: PMC6443359] [PubMed: 30939283]
- 7.
Blichfeldt-Eckhardt MR. От острой до хронической послеоперационной боли: значение реакции на острую боль.


 Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках. За 30 минут до окончания операции парацетамол 1 г в/в, инфузия в течение 15 минут
За 30 минут до окончания операции парацетамол 1 г в/в, инфузия в течение 15 минут
 аспирация, реанимационные препараты и дефибриллятор
аспирация, реанимационные препараты и дефибриллятор (кадр/с)
(кадр/с) [5]
[5]
 [2]
[2] При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]
При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2] Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]
Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2] Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]
Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2] Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]
Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».] Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]
Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2] [2]
[2]
 Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции.
Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции. Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]
Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5] Обзорные вопросы
Обзорные вопросы Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]
Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847] Dan Med J. 2018 Mar; 65 (3) [PubMed: 29510808]
Dan Med J. 2018 Mar; 65 (3) [PubMed: 29510808]

 [3] Менее половины пациентов, перенесших операцию, сообщают об адекватном послеоперационном обезболивании.[2] Этот процент представляет собой серьезную проблему, поскольку неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим эффектам у пациентов в ближайшем послеоперационном периоде и подвергнуть их повышенному риску развития хронической боли, связанной с процедурой. Сильная непрекращающаяся послеоперационная боль поражает от 2 до 10 процентов взрослых.[5]
[3] Менее половины пациентов, перенесших операцию, сообщают об адекватном послеоперационном обезболивании.[2] Этот процент представляет собой серьезную проблему, поскольку неадекватное послеоперационное обезболивание может привести к неблагоприятным физиологическим эффектам у пациентов в ближайшем послеоперационном периоде и подвергнуть их повышенному риску развития хронической боли, связанной с процедурой. Сильная непрекращающаяся послеоперационная боль поражает от 2 до 10 процентов взрослых.[5] Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль.[7]
Воспалительная боль возникает, когда ноцицептивные волокна становятся сенсибилизированными в ответ на высвобождение медиаторов воспаления, таких как цитокины. Клинические проявления воспалительной боли могут состоять из четырех классических признаков воспаления (боль, жар, эритема и отек). Воспалительная боль может длиться от нескольких часов до нескольких дней и, как правило, обратима. Нейропатическая боль возникает в результате повреждения нейронных структур (например, периферических нервов), при этом боль возникает из-за повышенной чувствительности аксонов к раздражителям. Нейропатическая боль проявляется в ближайшем послеоперационном периоде и может сохраняться как хроническая послеоперационная боль.[7] Висцеральный отдел боли состоит из сети немиелинизированных С-волокон и тонко миелинизированных А-дельта-волокон, которые охватывают несколько внутренних органов и сходятся вместе перед входом в спинной мозг. Кроме того, висцеральные афферентные волокна проходят вблизи вегетативных ганглиев до их входа в дорсальные корешки спинного мозга. Эти характерные особенности висцеральных ноцицептивных волокон способствуют более диффузной, плохо локализованной картине боли, которая может сопровождаться вегетативными реакциями, такими как изменение частоты сердечных сокращений или артериального давления.[7]
Висцеральный отдел боли состоит из сети немиелинизированных С-волокон и тонко миелинизированных А-дельта-волокон, которые охватывают несколько внутренних органов и сходятся вместе перед входом в спинной мозг. Кроме того, висцеральные афферентные волокна проходят вблизи вегетативных ганглиев до их входа в дорсальные корешки спинного мозга. Эти характерные особенности висцеральных ноцицептивных волокон способствуют более диффузной, плохо локализованной картине боли, которая может сопровождаться вегетативными реакциями, такими как изменение частоты сердечных сокращений или артериального давления.[7] [2]
[2] (кадр/с)
(кадр/с) [5]
[5] Упор на мультимодальную терапию, включающую интервенционные методы анестезии и неопиоидные анальгетики, имеет особое значение для этой группы населения.[8]
Упор на мультимодальную терапию, включающую интервенционные методы анестезии и неопиоидные анальгетики, имеет особое значение для этой группы населения.[8] [2]
[2] При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2]
При обезболивании АКП избегайте базальной инфузии опиоидных препаратов у пациентов, ранее не получавших опиоиды. Добавление ацетаминофена или НПВП связано с уменьшением потребления опиоидов и лучшим контролем боли, чем при использовании только опиоидов. Габапентин или прегабалин рекомендуются для введения до операции, особенно у пациентов с толерантностью к опиоидам, поскольку было показано, что они снижают потребность в опиоидах. Из-за обширного профиля побочных эффектов кетамин предназначен только для крупных операций, у пациентов с высокой толерантностью к опиоидам или у пациентов с непереносимостью опиоидов. Интраоперационные внутривенные инфузии лидокаина связаны с более короткой продолжительностью кишечной непроходимости и лучшим обезболивающим контролем по сравнению с плацебо.[2] Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2]
Эти методы не используются в повседневной жизни. Их введение следует рассматривать на основе полезных данных.[2] Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2]
Может также включать интратекальное (спинномозговое) введение опиоидных препаратов. Эпидуральная анестезия может проводиться в виде непрерывной инфузии или в качестве анальгезии, контролируемой пациентом. Эти методы предназначены для рутинного использования при крупных торакальных и абдоминальных операциях, кесаревом сечении и операциях на бедре или нижних конечностях. Они особенно полезны у пациентов с риском сердечных или легочных осложнений или длительной кишечной непроходимостью.[2] Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».]
Эта шкала включает в себя использование измеренной линии, отмеченной от 0 до 10, со словесными описаниями боли на каждом конце шкалы, где 0 означает «отсутствие боли», а 10 — «сильнейшую возможную боль».] Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2]
Ранние симптомы отмены опиоидов включают тревогу, беспокойство, слезотечение, насморк, потливость, бессонницу, частую зевоту и мышечные боли. Поздние симптомы отмены опиоидов могут быть более интенсивными и включать диарею, спазмы в животе, пилоэрекцию, тошноту и рвоту, тахикардию, гипертензию, расширение зрачков и нечеткость зрения.[6] Габапентин или прегабалин могут вызывать головокружение или седативный эффект.[2] [2]
[2]
 Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции.
Мультимодальный, межпрофессиональный подход к обезболиванию обеспечивает более безопасное и эффективное обезболивание у послеоперационных пациентов, в отличие от основной зависимости от опиоидной терапии. В ближайшем послеоперационном периоде медсестры играют важную роль в контроле тяжести боли у пациента и при необходимости сообщают о необходимости дальнейшего вмешательства другим членам бригады. Клинические фармацевты играют неотъемлемую роль в принятии решения о наименьшей эффективной дозе для пациентов после операции и предоставляют им адекватную информацию о различных доступных вариантах, таких как предложения по альтернативным лекарствам и знания о побочных эффектах и взаимодействиях, чтобы помочь им принять обоснованное решение об их уход в послеоперационный период. Медсестра, медицинский работник и фармацевт играют решающую роль в обучении пациентов и их семей методам контроля послеоперационной боли. Они должны гарантировать, что они предоставляют пациентам хорошо написанную информацию о том, как контролировать боль после операции. Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5]
Этот межпрофессиональный подход будет способствовать улучшению результатов послеоперационного контроля боли и повышению качества жизни пациентов. [Уровень 5] Обзорные вопросы
Обзорные вопросы Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]
Джей Пейн. 2016 фев; 17 (2): 131-57. [В паблике: 26827847]