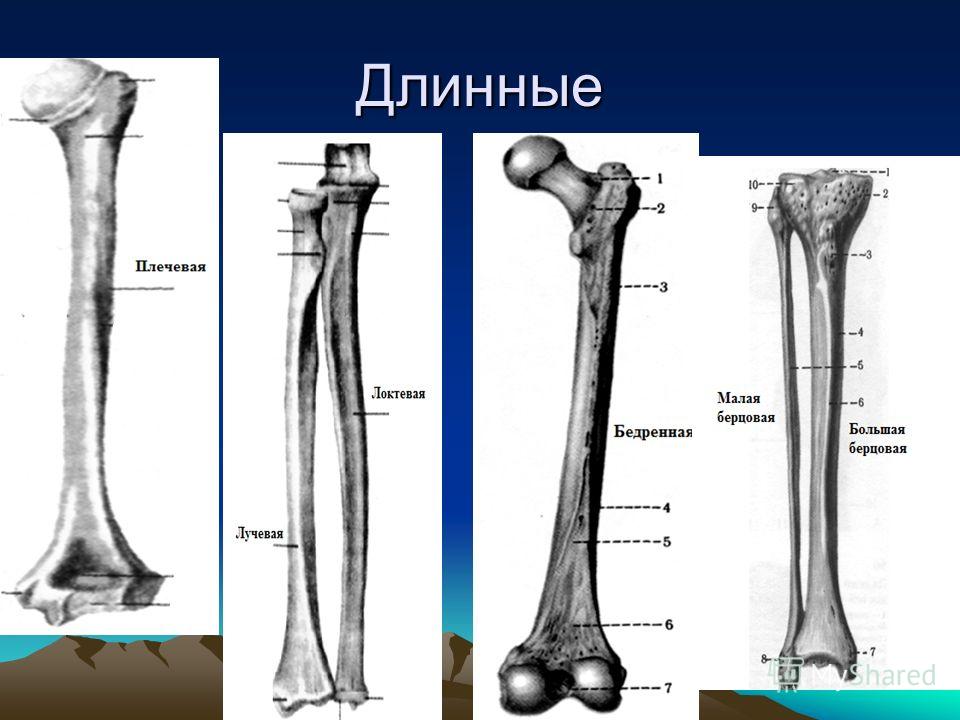
Кости верхней конечности
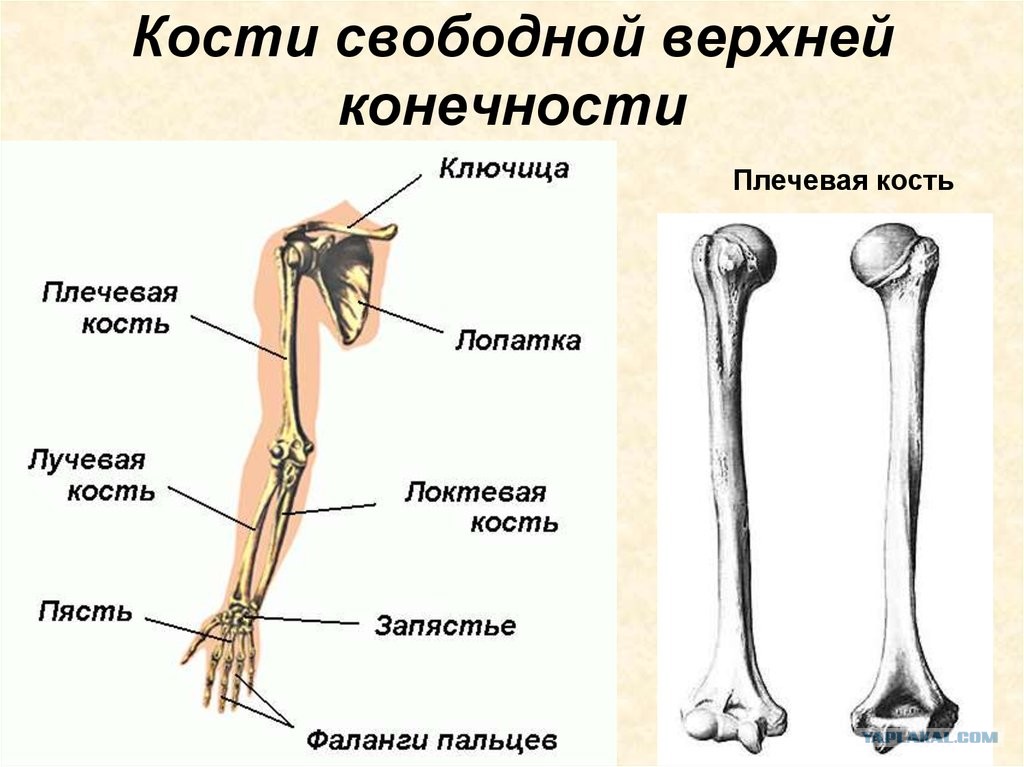
Верхние конечности включают пояс верхней конечности и свободную верхнюю конечность.
Рис. 15 Кости верхней конечности
Кости пояса верхней конечности. Ключица (clavicula) — парная, S-образно изогнутая трубчатая кость, в которой различают тело и два конца: грудинный и акромиальный. На обоих концах имеются суставные поверхности: На одном — для сочленения с грудиной, на другом — с акромиальным отростком лопатки. Ключица легко прощупывается у живого человека. Функциональная роль ключицы очень велика — она как бы отодвигает плечевой сустав от грудной клетки, обусловливая свободу движений руки.
Лопатка (scapula) — плоская кость треугольной формы, прилежащая к задней поверхности грудной клетки своей реберной поверхностью. Ее дорсальная поверхность разделена
 Ость
продолжается латерально и кпереди в акромион, на
котором имеется суставная
поверхность для
сочленения с ключицей. Три края лопатки
— медиальный, латеральный и верхний —
сходясь между собой, образуют углы: нижний,
латеральный и верхний. Верхний край
переходит в клювовидный
отросток, у
основания которого имеется глубокая вырезка
лопатки. Латеральный
угол, заканчивается утолщением с
углубленной суставной
впадиной, которая
отделена от кости незначительно
выраженной шейкой
лопатки.
Ость
продолжается латерально и кпереди в акромион, на
котором имеется суставная
поверхность для
сочленения с ключицей. Три края лопатки
— медиальный, латеральный и верхний —
сходясь между собой, образуют углы: нижний,
латеральный и верхний. Верхний край
переходит в клювовидный
отросток, у
основания которого имеется глубокая вырезка
лопатки. Латеральный
угол, заканчивается утолщением с
углубленной суставной
впадиной, которая
отделена от кости незначительно
выраженной шейкой
лопатки. Кости
свободной верхней конечности. Плечевая
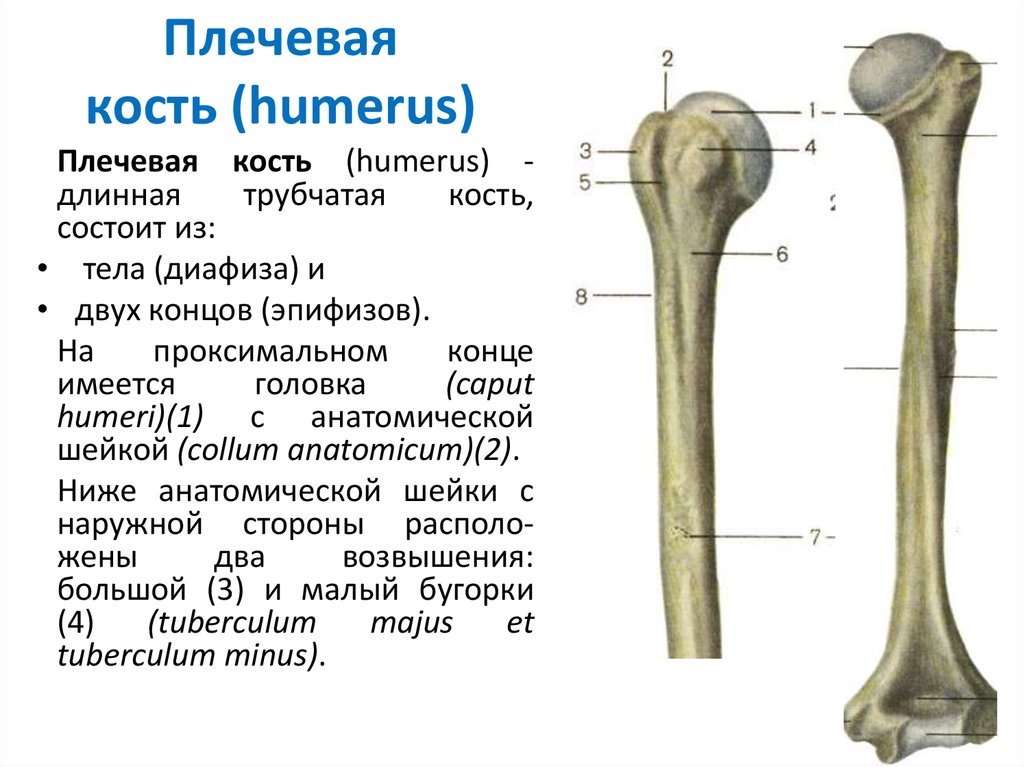
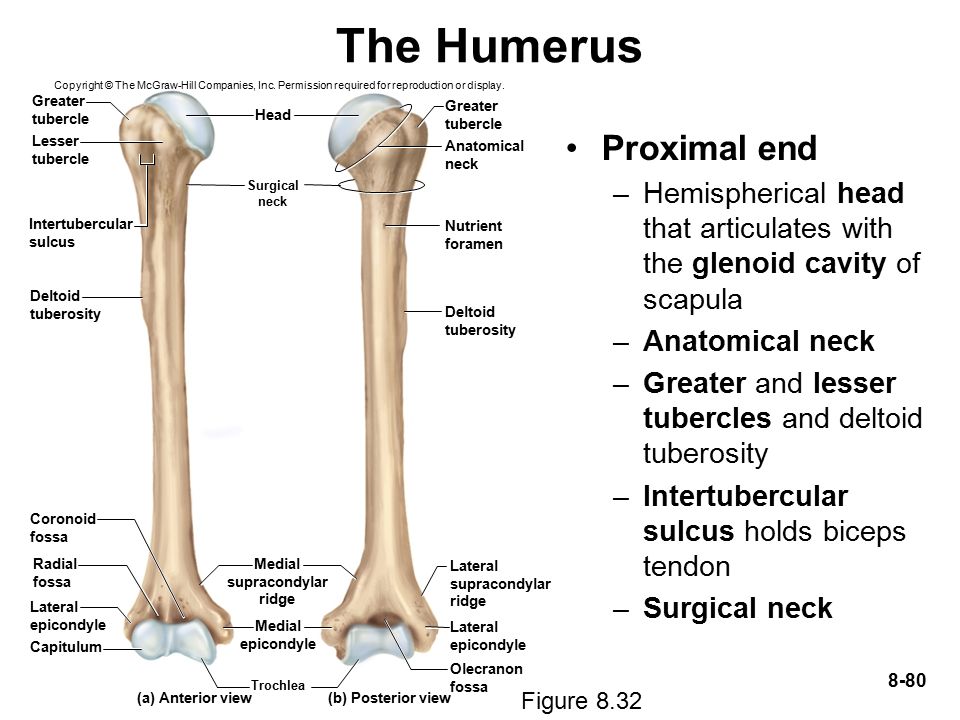
кость (humerus) – длинная трубчатая кость, состоящая,
из цилиндрического тела, которое
внизу приобретает трехгранную форму,
вверху имеет шаровидную головку, сочленяющуюся
— с лопаткой. Узкая анатомическая
шейка отделяет
головку от тела. Непосредственно
под анатомической шейкой расположены большой (латерально)
и малый (медиально) бугорки, к
которым прикрепляются мышцы. От каждого
бугорка вниз отходит гребень, между
гребнями видна межбугорковая
борозда. Ниже
бугорков располагается хирургическая
шейка, названная
так потому, что в этом участке кость при
травмах чаще всего ломается. Внизу
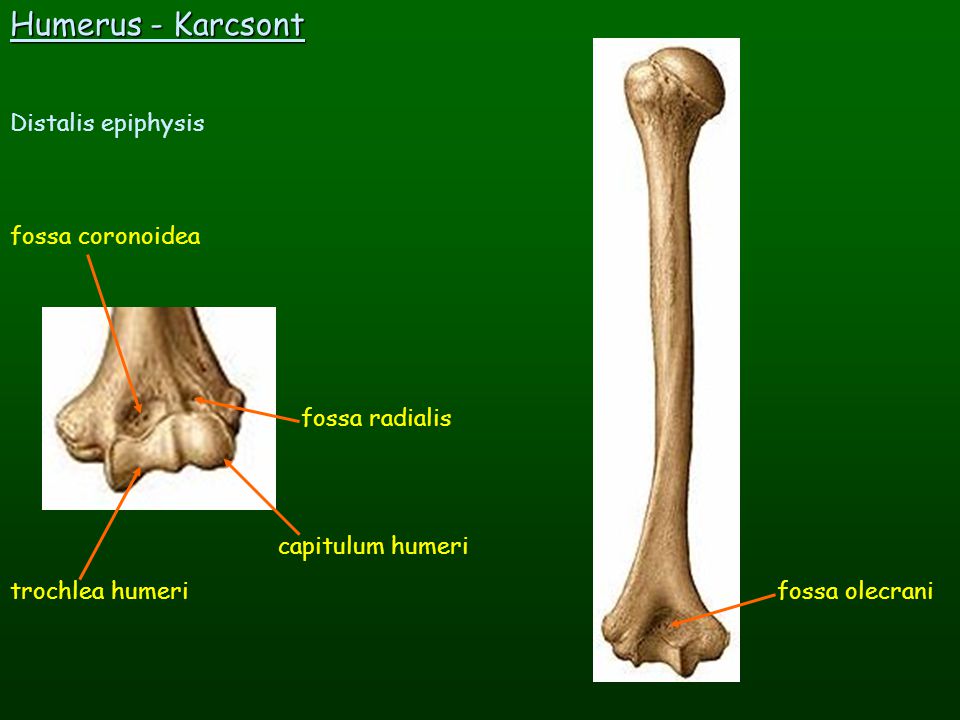
плечевая кость заканчивается сложно
устроенным мыщелком. На мыщелке имеются
две суставные
поверхности для
сочленения с обеими костями предплечья: блок, а
латеральнее него — шаровидной формы головка. Над
ними располагаются две ямки: спереди
— венечная и лучевая, а
сзади — локтевая. По
бокам от мыщелка находятся два надмыщелка: медиальный и латеральный. У
человека нижний эпифиз плечевой кости
повернут по отношению к верхнему
латерально.
От каждого
бугорка вниз отходит гребень, между
гребнями видна межбугорковая
борозда. Ниже
бугорков располагается хирургическая
шейка, названная
так потому, что в этом участке кость при
травмах чаще всего ломается. Внизу
плечевая кость заканчивается сложно
устроенным мыщелком. На мыщелке имеются
две суставные
поверхности для
сочленения с обеими костями предплечья: блок, а
латеральнее него — шаровидной формы головка. Над
ними располагаются две ямки: спереди
— венечная и лучевая, а
сзади — локтевая. По
бокам от мыщелка находятся два надмыщелка: медиальный и латеральный. У
человека нижний эпифиз плечевой кости
повернут по отношению к верхнему
латерально.
Локтевая
кость (ulna) — длинная, трубчатая, ее тело напоминает
трехгранную призму. Верхний эпифиз
более массивный, имеет два отростка:
локтевой (сзади)
и венечный (спереди),
разделенные блоковидной
вырезкой, сочленяющейся
с блоком плечевой кости. Латеральная
поверхность венечного отростка несет
на себе лучевую
вырезку, которая
образует сустав с суставной окружностью
головки лучевой кости. На нижнем эпифизе
локтевой кости (ее головке) имеется суставная
окружность для
сочленения с локтевой вырезкой лучевой
кости и медиально расположенный шиловидный
отросток. Нижняя
поверхность головки локтевой кости
плоская.
Латеральная
поверхность венечного отростка несет
на себе лучевую
вырезку, которая
образует сустав с суставной окружностью
головки лучевой кости. На нижнем эпифизе
локтевой кости (ее головке) имеется суставная
окружность для
сочленения с локтевой вырезкой лучевой
кости и медиально расположенный шиловидный
отросток. Нижняя
поверхность головки локтевой кости
плоская.
Лучевая
кость (radius) — также длинная трубчатая кость. На ее
верхнем эпифизе — головке —
имеются суставная
ямка для
сочленения с головкой мыщелка плечевой
кости и суставная
окружность для
сочленения с лучевой вырезкой локтевой
кости. Головка отделена от тела узкой шейкой, под
которой располагается бугристость
лучевой кости (место
прикрепления сухожилия двуглавой мышцы
плеча). Дистальный эпифиз несет на себе запястную
суставную поверхность для
сочленения с верхним (проксимальным)
рядом костей запястья и оканчивается
латерально расположенным шиловидным
отростком. На медиальном крае дистального
эпифиза имеется локтевая
вырезка, участвующая
в образовании сустава с локтевой костью.
На медиальном крае дистального
эпифиза имеется локтевая
вырезка, участвующая
в образовании сустава с локтевой костью.
Кисть (manus) делится на три отдела: запястье, пясть и пальцы. Скелет кисти образован 27 костями. Кости запястья (carpus) в количестве восьми располагаются в два ряда. В проксимальном ряду лежат (начиная от лучевого края) ладьевидная, полулунная, трехгранная, гороховидная
Кости
пясти (metacarpus) — пять костей, каждая из которых
представляет собой короткую трубчатую
кость, имеющую основание,
тело и головку и
сочленяющуюся с проксимальной фалангой
соответствующего пальца.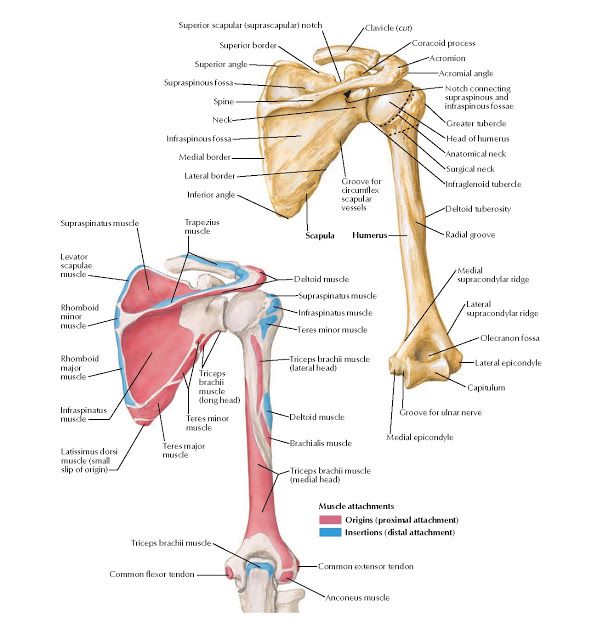
Скелет пальцев образован фалангами (phalanx), у II – V пальцев их по три (проксимальная, средняя и дистальная). Фаланги — это короткие трубчатые кости, в которых различают основание, тело и головку. Фаланги несут на себе суставные поверхности. Суставная поверхность основания у проксимальных фаланг сочленяется с головкой соответствующей пястной кости, а у остальных — с головкой проксимально лежащей фаланги.
Особенности и преимущества КТ при диагностике сложных переломов
Плечевая кость является одной из самых крупных трубчатых костей человеческого скелета. Тем не менее нередко встречаются её переломы, которые разделяют на два основных типа — перелом вблизи локтевого сустава и перелом вблизи плечевого сустава. Они могут быть как изолированными, так и сочетаться с переломом лопатки или ключицы — эти три кости формируют плечевой пояс и поддерживают все мышцы верхней конечности, а также частично мышцы груди и спины.
Самый неприятный перелом, который может случиться с плечевой костью — это перелом вблизи плечевого сустава — доктора называют такие переломы проксимальными. Чаще всего они встречаются у пожилых людей, особенно у тех, кто страдает остеопорозом. Около 70% возрастных пациентов — женщины.
Чаще всего они встречаются у пожилых людей, особенно у тех, кто страдает остеопорозом. Около 70% возрастных пациентов — женщины.
Клиническая картина
Переломы проксимального отдела плечевой кости обычно возникают в результате падения на вытянутую руку. Многие пожилые пациенты обращаются за помощью после относительно безобидного падения.
Симптомы включают резкую боль, отёк плеча, появление припухлости или деформации. Через некоторое время появляется гематома. Беспокоит также ограниченный диапазон движений руки, слабость и ощущение покалывания.
Часто встречаются переломы плеча и вывихи плечевого и акромиально-ключичного суставов. Всё это сопровождается травмой нервных сплетений, разрывом сосудов, что, конечно, усложняет клиническую ситуацию. Обычно в таком случае требуется оперативное вмешательство. Простых снимков чаще всего достаточно, чтобы охарактеризовать состояние проксимального отдела плечевой кости и, таким образом, определить лечение. Но как обстоят дела со сложными видами переломов?
Диагностические возможности простой рентгенограммы
На обычной рентгенограмме перелом плеча обычно проявляется в виде просвета или разрыва с различной степенью поворота, защемления и смещения.
Визуализация пациентов с подозрением на перелом проксимального отдела плечевой кости должна включать переднезадние снимки, снимок лопатки, а также подмышечные проекции. Последнее может быть трудным для некоторых пациентов. Таким образом, рентгенограмма обеспечивает вид сбоку и отлично подходит для оценки возможности вращения головки плечевой кости и функции плечевого сустава.
Если на рентгенограмме видно многооскольчатый перелом или перелом со смещением — это прямое показание для выполнения КТ с трехмерной реконструкцией, что оптимально для оценки смещения и поворота фрагментов.
Преимущества КТ-диагностики сложного перелома плеча
В случае травмы, захватывающей лопатку, плечевой сустав и акромиально-ключичный сустав, целесообразнее проводить КТ пояса верхней конечности, так как это даёт возможность 3D-реконструкции перелома. Такой подход очень полезен при подготовке к оперативному вмешательству — соединении обломков и формировании кости или же полной замене сустава. Также доктору очень важно оценить количество смещенных фрагментов, чтобы можно было надлежащим образом классифицировать перелом.
Также доктору очень важно оценить количество смещенных фрагментов, чтобы можно было надлежащим образом классифицировать перелом.
Компьютерная томограмма может быть полезна, если невозможно получить адекватное изображение на простой рентгенограмме, если переломы необычны или если присутствуют смещение осколков или раздробление костной ткани вследствие остеопороза – что случается довольно часто у возрастных пациентов. Очень часто КТ рекомендуют проводить после получения обычного рентгеновского снимка, на котором не так хорошо видны все фрагменты и специалист может подозревать наличие «скрытых» переломов в других частях плеча.
Не стоит забывать, что с помощью компьютерной томографии можно сделать выводы о повреждении таких важных структур, как сосуды и нервы. Ведь чем более подготовлен хирург к тому, что его ждёт во время операции, тем более выгодную тактику лечения он сможет предложить.
Відповідно до Закону України «Про захист населення від інфекційних хвороб», приймаючи до уваги офіційні рекомендації ВООЗ та МОЗ, центром комп’ютерної томографії «Преміум» затверджено план протиепідемічної готовності та тимчасово (на час дії встановленого в Україні карантину) запроваджено особливі Правила внутрішнього розпорядку, які, серед іншого, передбачають наступні заходи та обмеження щодо надання медичних послуг:
1. Перебувати на території медичного центру пацієнти/відвідувачі можуть виключно у захисних медичних масках та бахілах (ЦКТ «Преміум» забезпечує зазначеними засобами захисту кожного пацієнта/відвідувача на безоплатній основі).
Перебувати на території медичного центру пацієнти/відвідувачі можуть виключно у захисних медичних масках та бахілах (ЦКТ «Преміум» забезпечує зазначеними засобами захисту кожного пацієнта/відвідувача на безоплатній основі).
2. Перед входом до медичного центру пацієнти/відвідувачі зобов’язані здійснити дезінфікуючу обробку рук спиртовмісними дезінфікуючими засобами (засоби дезінфекції надаються пацієнтам/відвідувачам ЦКТ «Преміум» на безоплатній основі).
3. При наявності ознак хвороби (нежить, кашель, чхання, сльозотеча тощо) у пацієнта/відвідувача, персонал медичного центру має право здійснити вимірювання температури тіла безконтактними інфрачервоними термометрами.
4. Супровід пацієнта безпосередньо до приміщень медичного центру здійснюється іншими особами лише у виключних випадках, коли пацієнт не може самостійно пересуватись та/або пройти діагностику (малолітні/неповнолітні особи, пацієнти у супроводі співробітників реанімації тощо).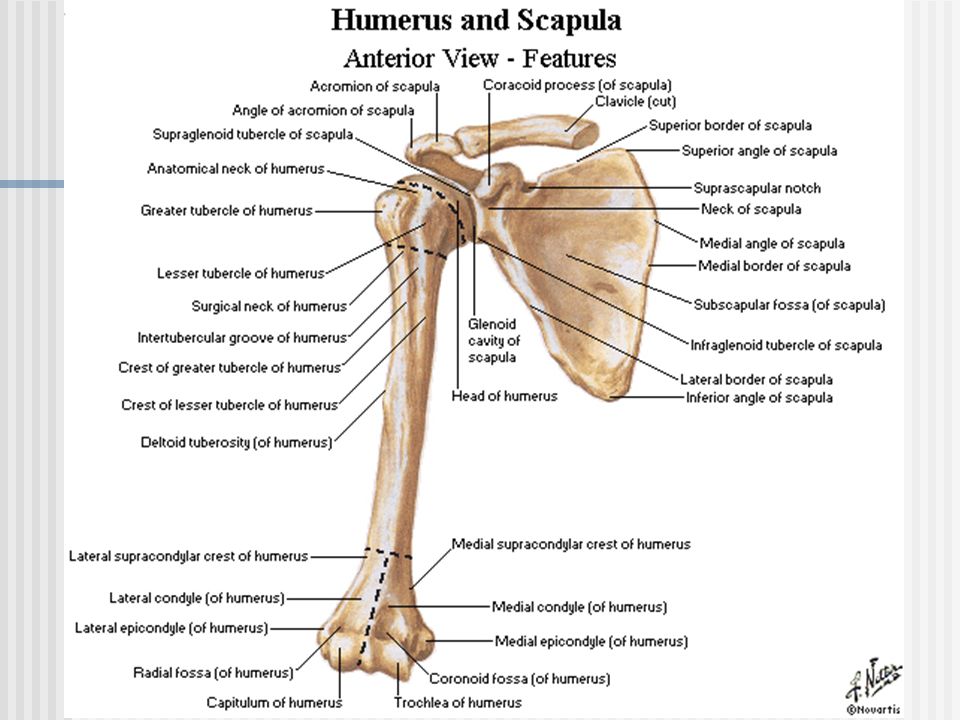
5. Персонал медичного центру має право відмовити у доступі до приміщень центру та подальшому веденні пацієнта у випадках, коли на вимогу співробітника медичного центру пацієнт/відвідувач відмовляється дотримуватись заходів, передбачених Правилами внутрішнього розпорядку та/або у разі виявлення підвищеної температури тіла пацієнта/відвідувача більше 37 градусів.
6. Наполегливо рекомендуємо пацієнтам після проходження діагностичної процедури очікувати висновки за межами території медичного центру або використовувати для отримання результатів електронний сервіс «MedOffice» (medoffice.zp.ua).
Невиконання вказаних положень Правил загрожуватиме життю і здоров’ю населення, а отже буде причиною відмови від ведення пацієнта згідно ст. ст. 11, 29 ЗУ «Про захист населення від інфекційних хвороб» та ст. 34 Закону України «Основи законодавства України про охорону здоров’я».
Ознайомлена (-ий)
плечевая кость.
 Строение плечевой кости
Строение плечевой костиДля выполнения функций опоры, движения и защиты в нашем организме существует система, включающая кости, мышцы, сухожилия и связки. Все ее части растут и развиваются в тесном взаимодействии. Их строение и свойства изучает наука анатомия. Плечевая кость входит в состав свободной верхней конечности и наряду с костями предплечья и пояса верхних конечностей — лопаткой и ключицей — обеспечивает сложные механические движения руки человека. В данной работе на примере плечевой кости мы подробно изучим принципы деятельности опорно-двигательной системы и выясним, как ее строение связано с выполняемыми функциями.
Особенности трубчатых костей
Трехгранная или цилиндрическая форма характерна для составляющих скелета – трубчатых костей, у которых различают такие элементы, как эпифизы (края кости) и ее тело (диафиз). Три слоя — надкостница, собственно кость и эндоост — входят в состав диафиза плечевой кости. Анатомия свободной верхней конечности в настоящее время изучена достаточно хорошо. Известно, что эпифизы содержат губчатое вещество, тогда как центральный отдел представлен костными пластинками. Они образуют компактное вещество. Такой вид имеют длинные трубчатые кости: плечевая, локтевая, бедренная. Анатомия плечевой кости, фото которой представлено ниже, указывает на то, что ее форма наилучшим образом соответствует образованию подвижных соединений с костями пояса верхних конечностей и предплечья.
Известно, что эпифизы содержат губчатое вещество, тогда как центральный отдел представлен костными пластинками. Они образуют компактное вещество. Такой вид имеют длинные трубчатые кости: плечевая, локтевая, бедренная. Анатомия плечевой кости, фото которой представлено ниже, указывает на то, что ее форма наилучшим образом соответствует образованию подвижных соединений с костями пояса верхних конечностей и предплечья.
Как развиваются трубчатые кости
В процессе зародышевого развития плечевая кость вместе со всем скелетом формируется из среднего зародышевого листка – мезодермы. В начале пятой недели беременности плод имеет мезенхимные участки, называемые закладками. Они растут в длину и приобретают форму плечевых трубчатых костей, оссификация которых продолжается и после рождения ребенка. Сверху плечевая кость покрывается надкостницей. Это тонкая оболочка, состоящая из соединительной ткани и имеющая разветвленную сеть кровеносных сосудов и нервных окончаний, входящих в собственно кость и обеспечивающих ее питание и иннервацию. Она располагается по всей длине трубчатой кости и формирует первый слой диафиза. Как установила наука анатомия, плечевая кость, покрытая надкостницей, содержит волокна эластичного белка – коллагена, а также специальные клетки, называемые остеобластами и остеокластами. Они группируются вблизи центрального канала Гаверса. С возрастом он заполняется желтым костным мозгом.
Она располагается по всей длине трубчатой кости и формирует первый слой диафиза. Как установила наука анатомия, плечевая кость, покрытая надкостницей, содержит волокна эластичного белка – коллагена, а также специальные клетки, называемые остеобластами и остеокластами. Они группируются вблизи центрального канала Гаверса. С возрастом он заполняется желтым костным мозгом.
Самозаживление, репарация и рост в толщину трубчатых костей в скелете человека осуществляется благодаря надкостнице. Специфична анатомия плечевой кости в срединной части диафиза. Здесь имеется бугристая поверхность, к которой присоединяется поверхностная дельтовидная мышца. Вместе с поясом верхних конечностей и костями плеча и предплечья она обеспечивает подъем и отведение локтей и рук вверх, назад и перед собой.
Значение эпифизов трубчатых костей
Концевые части трубчатой кости плеча называются эпифизами, содержат красный костный мозг и состоят из губчатого вещества. Его клетки продуцируют форменные элементы крови – тромбоциты и эритроциты. Эпифизы покрыты надкостницей, имеют костные пластинки и тяжи, называемые трабекулами. Они расположены под углом друг к другу и составляют внутренний остов в виде системы полостей, которые и заполнены кроветворной тканью. Как определила анатомия, строение плечевой кости в местах соединения ее с лопаткой и костями предплечья достаточно сложное. Суставные поверхности плечевой кости имеют проксимальный и дистальный концы. Головка кости имеет выпуклую поверхность, покрытую гиалиновым хрящом и входящую во впадину лопатки. Специальное хрящевое образование лопаточной впадины – суставная губа – служит амортизатором, смягчающим сотрясения и удары при движении плеча. Капсула плечевого сустава одним концом прикреплена к лопатке, а другим – к головке плечевой кости, опускаясь до ее шейки. Она стабилизирует связь плечевого пояса и свободной верхней конечности.
Эпифизы покрыты надкостницей, имеют костные пластинки и тяжи, называемые трабекулами. Они расположены под углом друг к другу и составляют внутренний остов в виде системы полостей, которые и заполнены кроветворной тканью. Как определила анатомия, строение плечевой кости в местах соединения ее с лопаткой и костями предплечья достаточно сложное. Суставные поверхности плечевой кости имеют проксимальный и дистальный концы. Головка кости имеет выпуклую поверхность, покрытую гиалиновым хрящом и входящую во впадину лопатки. Специальное хрящевое образование лопаточной впадины – суставная губа – служит амортизатором, смягчающим сотрясения и удары при движении плеча. Капсула плечевого сустава одним концом прикреплена к лопатке, а другим – к головке плечевой кости, опускаясь до ее шейки. Она стабилизирует связь плечевого пояса и свободной верхней конечности.
Особенности плечевого и локтевого суставов
Как установила анатомия человека, плечевая кость входит в состав не только шаровидного плечевого сустава, но и еще одного — сложного локтевого.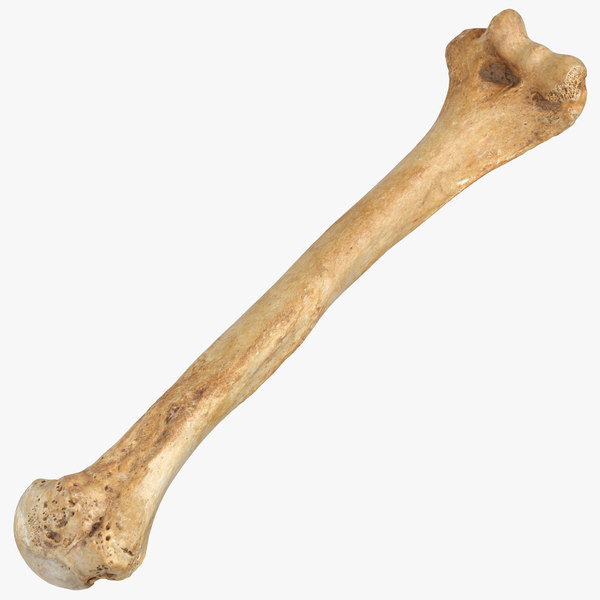 Нужно отметить, что плечевой сустав является самым подвижным в теле человека. Это вполне объяснимо, так как рука служит главным орудием трудовых операций, а ее мобильность связана с приспособлением к прямохождению и освобождению от участия в передвижении.
Нужно отметить, что плечевой сустав является самым подвижным в теле человека. Это вполне объяснимо, так как рука служит главным орудием трудовых операций, а ее мобильность связана с приспособлением к прямохождению и освобождению от участия в передвижении.
Локтевой сустав состоит из трех отдельных соединений, связанных общей суставной капсулой. Дистальный отдел плечевой кости соединяется с локтевой, образуя блоковидный сустав. Одновременно головка мыщелка плечевой кости входит в ямку проксимального конца лучевой кости, образуя плечелучевое подвижное соединение.
Дополнительные структуры плеча
Нормальная анатомия плечевой кости включает в себя большой и малый апофизы – бугорки, от которых отходят гребни. Они служат местом прикрепления мышц плеча. Здесь же находится бороздка, служащая вместилищем сухожилия бицепса. На границе с телом кости, диафизом, ниже апофизов, расположена хирургическая шейка. Она наиболее уязвима при травматических повреждениях плеча – вывихах и переломах.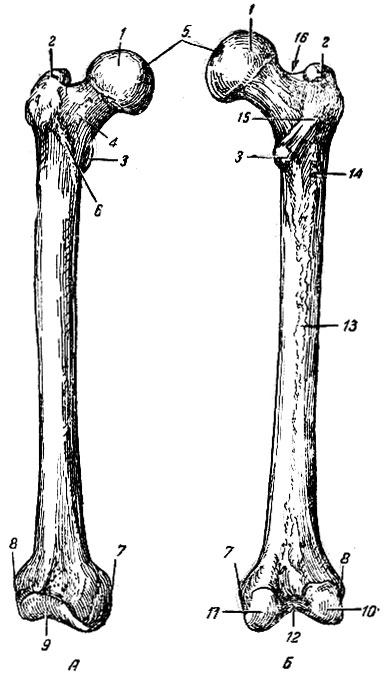 Посередине тела кости находится бугристый участок, к которому прикрепляется дельтовидная мышца, а сзади от него — борозда спиральной формы, в которую погружен лучевой нерв. На границе эпифизов и диафиза лежит участок, быстро делящиеся клетки которого обуславливают рост плечевой кости в длину.
Посередине тела кости находится бугристый участок, к которому прикрепляется дельтовидная мышца, а сзади от него — борозда спиральной формы, в которую погружен лучевой нерв. На границе эпифизов и диафиза лежит участок, быстро делящиеся клетки которого обуславливают рост плечевой кости в длину.
Нарушения функций плечевой кости
Наиболее распространенной травмой является перелом плеча при падении или сильном механическом ударе. Причина лежит в том, что сустав не имеет настоящих связок и стабилизируется только мышечным корсетом пояса верхних конечностей и вспомогательной связкой, имеющей вид пучка коллагеновых фибрилл. Достаточно распространены поражения мягких тканей плечевого сустава, например, тендинит и капсулит. В первом случае повреждаются сухожилия надостной, подостной, малой круглой мышц. Другое заболевание происходит в результате воспалительных процессов в суставной капсуле плеча.
Патологии сопровождаются туннельными болями в руке и плече, ограничением подвижности плечевого сустава при подъеме рук вверх, заведении их за спину, отведении в стороны. Все эти симптомы резко снижают работоспособность и физическую активность человека.
Все эти симптомы резко снижают работоспособность и физическую активность человека.
В данной статье мы изучили анатомическое строение плечевой кости и выяснили его связь с выполняемыми функциями.
Костная система крупного рогатого скота
- C1
- C2
- C3
- C4
- C5
- C6
- C7
- Cd 1
- Cd 10
- Cd 11
- Cd 12
- Cd 13
- Cd 14
- Cd 15
- Cd 16
- Cd 17
- Cd 18
- Cd 19
- Cd 2
- Cd 3
- Cd 4
- Cd 5
- Cd 6
- Cd 7
- Cd 8
- Cd 9
- L1
- L2
- L3
- L4
- L5
- L6
- S1
- S2
- S3
- S4
- S5
- T1
- T10
- T11
- T12
- T13
- T2
- T3
- T4
- T5
- T6
- T7
- T8
- T9
- Акромион
- Альвеолярная дуга
- Альвеолярные гребешки
- Альвеолярные гребешки
- Альвеолярный край
- Альвеолярный отросток (Верхняя челюсть)
- Антиклинальный позвонок
- Атлант
- Атлантозатылочный сустав
- Атлантоосевой сустав
- Базигиоид (тело)
- Барабанная часть (Височная кость)
- Барабанно-затылочная щель
- Барабанный пузырь
- Бедренная кость
- Бедроберцовый сустав
- Бедрочашечный сустав
- Блок
- Блок (улитка) большой берцовой кости
- Блок луча
- Блок плеча
- Блок плюсневой кости
- Блоковая вырезка
- Блоковая ямка
- Боковая (латеральная) стенка
- Боковая масса
- Боковая часть (Затылочная кость)
- Боковое позвоночное отверстие
- Большая берцовая кость
- Большая круглая шероховатость
- Большая седалищная вырезка
- Большое нёбное отверстие
- Большое нёбное отверстие
- Большое отверстие
- Большой бугорок
- Большой бугорок — Каудальная часть
- Большой бугорок — Краниальная часть
- Большой вертел
- Большой вертел — Головная часть
- Большой вертел — Каудальная часть
- Большой нёбный канал
- Борозда лучевого разгибателя запястья
- Борозда общего разгибателя пальцев
- Борозда ребра
- Борозда спинномозгового нерва
- Борозда сухожилия бокового сгибателя пальца
- Бугор локтевого отростка
- Бугор пяточной кости
- Бугорок блока бедренной кости
- Бугорок ребра
- Вдавление тройничного нерва
- Венец рогового отростка
- Венечная ямка
- Венечный край
- Венечный отросток
- Венечный шов
- Вентральная дуга
- Вентральная мыщелковая ямка
- Вентральная пластинка (шестой шейный позвонок)
- Вентральная стенка
- Вентральная суставная поверхность (Зуб)
- Вентральная ягодичная линия
- Вентральные крестцовые отверстия
- Вентральный бугорок
- Вентральный лонный бугорок
- Вентральный носовой ход
- Вентральный угол
- Вертлужная впадина
- Вертлужная ямка
- Верхнечелюстной бугор
- Верхняя челюсть
- Верхушка
- Верхушка
- Верхушка (Зуб)
- Верхушка каменистой части
- Верхушка крестца
- Верхушка надколенника
- Ветвь нижней челюсти
- Ветвь седалищной кости
- Височная кость
- Височная линия
- Височная линия (Лобная кость)
- Височная линия (Теменная кость)
- Височная площадка
- Височная поверхность (Лобная кость)
- Височная ямка
- Височно-нижнечелюстной сустав
- Височно-скуловой шов
- Височный отросток
- Влагалище шиловидного отростка
- Внутреннее слуховое отверстие
- Внутренний завиток
- Внутренний слуховой проход
- Внутренняя (медиальная) стенка
- Внутренняя губа
- Внутренняя пластинка
- Внутренняя поверхность
- Внутренняя поверхность
- Внутренняя поверхность
- Вторая и третья заплюсневые кости (промежуточно-латеральная клиновидная кость)
- Вторая и третья запястные кости (трапециевидно-головчатая кость)
- Второй моляр
- Второй премоляр
- Второй резец
- Вход в глазницу
- Вход в грудную клетку
- Выйная линия
- Выйная пластинка
- Вырезка вертлужной впадины
- Вырезка лопатки
- Вырезка между головками
- Выход из грудной клетки
- Гипофизарная ямка
- Глазница
- Глазничная поверхность (Лобная кость)
- Глазничная поверхность (Скуловая кость)
- Глазничная поверхность (Слезная кость)
- Глазничная часть (Лобная кость)
- Глазничный край
- Голенозаплюсневый сустав
- Голова, головка
- Головка
- Головка бедренной кости
- Головка локтя
- Головка лучевой кости
- Головка малоберцовой кости
- Головка нижней челюсти
- Головка плеча
- Головка плеча
- Головка проксимальной фаланги
- Головка проксимальной фаланги
- Головка ребра
- Головка средней фаланги
- Головка средней фаланги
- Горизонтальная пластинка (Нёбная кость)
- Горизонтальная пластинка: Нёбная поверхность
- Гребень большого бугорка
- Гребень каменистой части
- Гребень латерального надмыщелка
- Гребень лонной кости
- Гребень малого бугорка
- Гребень плеча
- Гребень позвонка
- Гребень сошника
- Гребень шейки ребра
- Грудина
- Грудино-реберные суставы
- Грудная полость
- Грудные позвонки
- Губная поверхность
- Губная поверхность
- Дельтовидная шероховатость
- Держатель таранной кости
- Диплоэ, губчатое вещество костей черепа
- Дистальная межкостная щель предплечья
- Дистальная сесамовидная кость
- Дистальная сесамовидная кость
- Дистальная фаланга
- Дистальная фаланга
- Дистальные межфаланговые суставы кисти
- Дистальные межфаланговые суставы стопы
- Дистальный блок таранной кости
- Дистальный канал пясти
- Дистальный межберцовый сустав
- Дистальный плюсневый канал
- Добавочная кость запястья (гороховидная кость)
- Добавочная ягодичная линия
- Дорсальная дуга
- Дорсальная мыщелковая ямка
- Дорсальная носовая раковина
- Дорсальная поверхность
- Дорсальная поверхность
- Дорсальная поверхность
- Дорсальная стенка
- Дорсальные крестцовые отверстия
- Дорсальный бугорок
- Дорсальный бугорок
- Дорсальный край
- Дорсальный край
- Дорсальный край
- Дорсальный лонный бугорок
- Дорсальный носовой ход
- Дорсальный продольный желоб
- Дорсальный продольный желоб
- Дуга позвонка
- Дугообразная линия
- Желоб плечевой мышцы
- Задний конец (ямка позвонка)
- Заостная ямка
- Запирательная борозда
- Запирательное отверстие
- Заплюсневый канал
- Заплюсневый сустав
- Заплюсно-плюсневые суставы
- Запястно-пястные суставы
- Запястный сустав
- Засуставное отверстие
- Засуставной отросток
- Затылок
- Затылочная кость
- Затылочно-барабанный шов
- Затылочно-межтеменной шов
- Затылочно-сосцевидный шов
- Затылочно-чешуйчатый шов
- Затылочный край
- Затылочный мыщелок
- Зуб
- Зубчатая поверхность
- Истинные ребра (стернальные)
- Каменистая часть (Височная кость)
- Каменисто-затылочный канал
- Канал подъязычного нерва
- Каналы губчатого вещества
- Каудальная ветвь лонной кости
- Каудальная лобная пазуха
- Каудальная межмыщелковая площадка
- Каудальная поверхность
- Каудальная поверхность
- Каудальная поверхность
- Каудальная позвоночная вырезка
- Каудальная реберная ямка
- Каудальная реберная ямка (седьмой шейный позвонок)
- Каудальная суставная ямка
- Каудальная ягодичная линия
- Каудальное нёбное отверстие
- Каудальный край
- Каудальный край
- Каудальный слезный отросток
- Каудальный суставной отросток
- Каудальный угол
- Кератогиоид (малый рог)
- Клиновидная пазуха
- Клиновидно-барабанная щель
- Клиновидно-затылочное сращение
- Клиновидно-лобный шов
- Клиновидно-нёбная вырезка
- Клиновидно-нёбное отверстие
- Клиновидно-нёбный шов
- Клиновидно-чешуйчатый шов
- Клык
- Кожная поверхность
- Коленная чашка (надколенник)
- Колено ребра
- Коракоидный отросток
- Коракоидный отросток
- Кости заплюсны
- Кости запястья
- Кости пальцев кисти
- Костная перегородка носа
- Костное нёбо
- Костный носовой вход
- Кость вентральной носовой раковины
- Край вертлужной впадины
- Краниальная ветвь лонной кости
- Краниальная межмыщелковая площадка
- Краниальная поверхность
- Краниальная поверхность
- Краниальная поверхность
- Краниальная позвоночная вырезка
- Краниальная реберная ямка
- Краниальная суставная ямка
- Краниальный край
- Краниальный край
- Краниальный суставной отросток
- Краниальный суставной отросток
- Краниальный угол
- Крестец (крестцовые позвонки)
- Крестцовая бугристость (шероховатость)
- Крестцово-подвздошный сустав
- Крестцово-тазовая поверхность
- Крестцовый бугор
- Крестцовый канал
- Крыло (Основная клиновидная кость)
- Крыло (Предклиновидная кость)
- Крыло крестцовой кости
- Крыло подвздошной кости
- Крыло сошника
- Крыловая ямка
- Крыловидная кость
- Крыловидная ямка
- Крыловидная ямка
- Крыловидно-клиновидный шов
- Крыловидно-нёбная ямка
- Крыловидно-нёбный шов
- Крыловидный отросток
- Крыловое отверстие
- Крючковидный отросток
- Крючок крыловидной кости
- Ламбдовидный шов
- Латеральная (боковая) поверхность (Скуловая кость)
- Латеральная борозда блока большой берцовой кости
- Латеральная губа
- Латеральная надмыщелковая шероховатость
- Латеральная площадка прямой мышцы бедра
- Латеральная поверхность
- Латеральная поверхность
- Латеральная поверхность
- Латеральная поверхность
- Латеральная поверхность
- Латеральная часть (Крестец)
- Латеральный венечный отросток
- Латеральный гребень блока бедренной кости
- Латеральный гребень блока таранной кости
- Латеральный край
- Латеральный край
- Латеральный край
- Латеральный крестцовый гребень
- Латеральный межмыщелковый бугорок
- Латеральный мыщелок
- Латеральный мыщелок
- Латеральный надмыщелок
- Латеральный надмыщелок
- Линия подколенной мышцы
- Линия трехглавой мышцы
- Лицевая поверхность (Верхняя челюсть)
- Лицевая поверхность (Слезная кость)
- Лицевая сосудистая вырезка
- Лицевой бугор
- Лицевой гребень
- Лицевой гребень (Скуловая кость)
- Лоб
- Лобная кость
- Лобная чешуя
- Лобно-носовой шов
- Лобно-скуловой шов
- Лобно-слезный шов
- Лобные пазухи
- Лобный бугор
- Лобный край
- Лобный отросток
- Лодыжковая борозда
- Лодыжковая борозда
- Лодыжковая кость (Малоберцовая кость)
- Ложные ребра (астернальные)
- Локоть
- Локтевая кость запястья (трехгранная кость)
- Локтевая ямка
- Локтевой отросток
- Локтевой сустав
- Лонная кость
- Лопатка
- Лопаточный хрящ
- Лучевая вырезка
- Лучевая кость
- Лучевая кость запястья (ладьевидная кость)
- Лучевая ямка
- Маклок
- Малая круглая шероховатость
- Малая седалищная вырезка
- Малоберцовая вырезка
- Малоберцовая кость
- Малые нёбные отверстия
- Малый бугорок
- Малый бугорок — Каудальная часть
- Малый бугорок — Краниальная часть
- Малый вертел
- Медиальная борозда блока большой берцовой кости
- Медиальная губа
- Медиальная лодыжка
- Медиальная надмыщелковая шероховатость
- Медиальная площадка прямой мышцы бедра
- Медиальная поверхность
- Медиальная поверхность
- Медиальная поверхность
- Медиальная поверхность
- Медиальный венечный отросток
- Медиальный гребень блока бедренной кости
- Медиальный гребень блока таранной кости
- Медиальный край
- Медиальный край
- Медиальный край
- Медиальный край
- Медиальный межмыщелковый бугорок
- Медиальный мыщелок
- Медиальный мыщелок
- Медиальный мыщелок
- Медиальный надмыщелок
- Медиальный надмыщелок
- Межальвеолярный край
- Межбугорковый желоб
- Межвертлужная линия
- Межвертлужный гребень
- Межголовчатая вырезка
- Междужковое пространство
- Межзаплюсневые суставы
- Межзапястный сустав
- Межлобный шов
- Межмыщелковая линия
- Межмыщелковая ямка
- Межмыщелковое возвышение
- Межнижнечелюстной сустав
- Межносовой шов
- Межпозвоночное отверстие
- Межпозвоночный симфиз
- Межреберные пространства
- Межрезцовая щель
- Межроговое возвышение
- Межтеменная кость
- Мечевидный отросток
- Мечевидный хрящ
- Мозговая поверхность
- Мозговая поверхность
- Моляры
- Мыс
- Мышечный бугорок
- Мышечный отросток
- Мыщелковый канал
- Мыщелковый отросток
- Мыщелок плеча
- Надбровная дуга
- Надглазничная борозда
- Надглазничный канал
- Надглазничный край
- Надглазничный край
- Надмыщелковая ямка
- Надсосцевидный гребень
- Надсуставной бугорок
- Наружная губа
- Наружная надкостница черепа
- Наружная пластинка
- Наружная поверхность
- Наружная поверхность
- Наружная поверхность
- Наружное затылочное предбугорье
- Наружный затылочный гребень
- Наружный слуховой проход
- Неосевая поверхность
- Неосевая поверхность
- Неосевое отверстие
- Нижнечелюстная вырезка
- Нижнечелюстная ямка
- Нижнечелюстное отверстие
- Нижнечелюстной канал
- Нижний край
- Нижняя челюсть
- Ножка дуги позвонка
- Носовая кость
- Носовая поверхность
- Носовая часть
- Носоверхнечелюстная щель
- Носоверхнечелюстной шов
- Носовой гребень
- Носовой край
- Носовой отросток (Резцовая кость)
- Носорезцовая вырезка
- Носослезная щель
- Нёбная кость
- Нёбная пазуха
- Нёбная пазуха
- Нёбная поверхность
- Нёбная щель
- Нёбно-верхнечелюстной шов
- Нёбный валик
- Нёбный отросток (Верхняя челюсть)
- Нёбный отросток (Резцовая кость)
- Общий носовой ход
- Овальное отверстие
- Околомыщелковый отросток (Яремный отросток)
- Осевая поверхность
- Осевая поверхность
- Осевая стенная борозда
- Осевое отверстие
- Основание
- Основание
- Основание крестца
- Основание надколенника
- Основание проксимальной фаланги
- Основание проксимальной фаланги
- Основание средней фаланги
- Основание средней фаланги
- Основная клиновидная кость
- Основная пластинка
- Основная часть (Затылочная кость)
- Остистый отросток
- Ость лопатки
- Ось
- Отверстие наружного слухового прохода
- Пазуха заплюсны
- Пальмарная поверхность
- Пальмарное латеральное возвышение
- Пальмарное медиальное возвышение
- Пальмарный продольный желоб
- Первая заплюсневая кость (медиальная клиновидная кость)
- Первый моляр
- Первый резец
- Перегородка клиновидных пазух
- Перегородка нёбной пазухи
- Передний конец (головка позвонка)
- Перпендикулярная пластинка (Нёбная кость)
- Перпендикулярная пластинка: Носовая поверхность
- Пирамидальный отросток
- Питательное отверстие
- Плантарная поверхность
- Плантарный продольный желоб
- Пластинка дуги позвонка
- Пластинка покрывающая
- Пластинка седалищной кости
- Плечевой сустав
- Плечелоктевой сустав
- Плечелучевой сустав
- Плечо
- Плюсневая сесамовидная кость
- Плюснефаланговые суставы
- Поверхность заостной мышцы
- Поверхность сгибателя
- Подбородочное отверстие
- Подвздошная кость
- Подвздошная поверхность
- Подвздошная шероховатость
- Подвздошно-лонное возвышение
- Подвздошный гребень
- Подвисочная ямка
- Подглазничное отверстие
- Подглазничный край
- Подглазничный край
- Подколенная вырезка
- Подколенная поверхность
- Подлопаточная ямка
- Подошвенная поверхность
- Подошвенный край
- Подошвенный край
- Подсуставной бугорок
- Подъязычный аппарат (подъязычная кость)
- Позвоночное отверстие
- Позвоночный канал
- Позвоночный столб
- Полость носа
- Полость черепа
- Полулунная поверхность
- Полулунная поверхность — Большая часть
- Полулунная поверхность — Малая часть
- Поперечное отверстие
- Поперечные линии
- Поперечный гребень
- Поперечный нёбный шов
- Поперечный отросток
- Поперечный отросток
- Поперечный отросток (крыло атланта)
- Пояснично-крестцовый сустав
- Поясничные позвонки
- Предклиновидная кость
- Предостная ямка
- Предплечезапястный сустав
- Премоляры
- Продырявленная пластинка
- Проксимальная межкостная щель предплечья
- Проксимальная суставная поверхность
- Проксимальная фаланга
- Проксимальная фаланга
- Проксимальные межфаланговые суставы кисти
- Проксимальные межфаланговые суставы стопы
- Проксимальные сесамовидные кости
- Проксимальные сесамовидные кости
- Проксимальный блок таранной кости
- Проксимальный канал пясти
- Проксимальный лучелоктевой сустав
- Проксимальный плюсневый канал
- Промежуточная кость запястья (полулунная кость)
- Промежуточный гребень блока большой берцовой кости
- Промежуточный крестцовый гребень
- Пястно-пальцевые суставы
- Пятая пястная кость
- Пяточная кость
- Пяточно-кубовидный сустав
- Разгибательная борозда
- Разгибательная ямка
- Разгибательный отросток
- Разгибательный отросток — Дистальная фаланга
- Разгибательный отросток — Средняя фаланга
- Реберная дуга
- Реберная поверхность (медиальная)
- Реберная ямка поперечного отростка
- Реберно-позвоночные суставы
- Реберно-поперечный сустав
- Реберно-хрящевые суставы
- Реберный отросток (Поперечный отросток)
- Реберный хрящ
- Ребра
- Ребро
- Ребро — 1
- Ребро — 10
- Ребро — 11
- Ребро — 12
- Ребро — 13
- Ребро — 2
- Ребро — 3
- Ребро — 4
- Ребро — 5
- Ребро — 6
- Ребро — 7
- Ребро — 8
- Ребро — 9
- Резцовая кость
- Резцовая часть (Тело нижней челюсти)
- Резцово-верхнечелюстной шов
- Резцовые зубы
- Решетчатая кость
- Решетчато-носовой шов
- Решетчатое отверстие
- Решетчатые ходы
- Роговой отросток
- Рукоятка грудины
- Сагиттальный гребень
- Свободный край
- Свод черепа, черепной свод
- Сгибательный отросток
- Сгибательный отросток
- Седалищная дуга
- Седалищная кость
- Седалищная ость
- Седалищный бугор
- Синхондрозы грудины, грудинные сращения
- Скуловая дуга
- Скуловая кость
- Скуловерхнечелюстной шов
- Скуловой отросток (Верхняя челюсть)
- Скуловой отросток (Височная кость)
- Скуловой отросток (Лобная кость)
- Слезная кость
- Слезно-верхнечелюстной шов
- Слезно-носовой шов
- Слезно-скуловой шов
- Слезный пузырь
- Соединение пояснично-грудного отдела позвоночника
- Соединение пояснично-крестцового отдела позвоночника
- Соединение шейно-грудного отдела позвоночника
- Сосцевидное отверстие
- Сосцевидный отросток
- Сосцевидный отросток
- Сошник
- Сошниково-верхнечелюстной шов
- Сошниково-клиновидный шов
- Сошниково-резцовый шов
- Спинка седла
- Срединная борозда блока бедренной кости
- Срединный крестцовый гребень
- Срединный нёбный шов
- Средний бугорок
- Средний запястный сустав
- Средний носовой ход
- Средняя носовая раковина
- Средняя фаланга
- Средняя фаланга
- Стилогиоид
- Сустав головки ребра
- Сустав добавочной кости запястья (гороховидной кости)
- Суставная впадина
- Суставная поверхность
- Суставная поверхность
- Суставная поверхность
- Суставная поверхность
- Суставная поверхность
- Суставная поверхность
- Суставная поверхность бугорка ребра
- Суставная поверхность головки ребра
- Суставная поверхность заплюсны
- Суставная поверхность запястья (Локоть)
- Суставная поверхность запястья (Лучевая кость)
- Суставная поверхность кубовидной кости
- Суставная поверхность лодыжки
- Суставная поверхность лодыжковой кости
- Суставная поверхность пяточной кости
- Суставная поверхность таранной кости
- Суставная ямка
- Суставная ямка
- Суставная ямка
- Суставной бугорок
- Суставы суставных отростков
- Тазобедренный сустав
- Тазовая кость
- Тазовая поверхность
- Тазовая полость, полость таза
- Таранная кость
- Таранно-пяточно-центральный сустав
- Таранно-пяточный сустав
- Тело
- Тело
- Тело бедренной кости
- Тело большой берцовой кости
- Тело верхней челюсти
- Тело грудины
- Тело локтя
- Тело лонной кости
- Тело лучевой кости
- Тело нижней челюсти
- Тело плеча
- Тело подвздошной кости
- Тело позвонка
- Тело проксимальной фаланги
- Тело ребра
- Тело резцовой кости
- Тело седалищной кости
- Тело средней фаланги
- Тело средней фаланги
- Теменная кость
- Теменной край
- Темя
- Тимпаногиоид
- Тирогиоид (большой рог)
- Третий моляр
- Третий премоляр
- Третий резец
- Третья и четвертая кости пясти
- Третья и четвертая плюсневые кости
- Турецкое седло
- Угол нижней челюсти
- Угол ребра
- Ушковидная поверхность
- Ушковидная поверхность
- Хвостовые (копчиковые) позвонки
- Хрящевой отросток
- Центральная борозда блока таранной кости
- Центральная межмыщелковая площадка
- Центральная+четвертая заплюсневая кость (ладьевидно-кубовидная кость)
- Центродистальный сустав (клиноладьевидный)
- Челюстно-подъязычный желоб
- Четвертая кость запястья (крючковидная кость)
- Четвертый премоляр
- Чешуйчатая часть (Височная кость)
- Чешуйчатый край
- Чешуйчатый шов
- Чешуя затылка
- Шейка бедренной кости
- Шейка лопатки
- Шейка лучевой кости
- Шейка нижней челюсти
- Шейка плеча
- Шейка ребра
- Шейка рогового отростка
- Шейные позвонки
- Шероховатая поверхность
- Шероховатость большой берцовой кости
- Шероховатость лучевой кости
- Шероховатость малой поясничной мышцы
- Шероховатость третьей плюсневой кости
- Шероховатость третьей пястной кости
- Шиловидный отросток
- Шиловидный отросток — Локоть
- Шиловидный отросток — Лучевая кость
- Шилоподъязычный угол
- Шовная поверхность (Седалищная кость)
- Шовный гребень
- Щечная поверхность
- Щечная часть (Тело нижней челюсти)
- Эпигиоид
- Ягодичная поверхность
- Язычная поверхность
- Язычный отросток
- Ямка большой жевательной мышцы
- Ямка вертлужной впадины
- Ямка головки бедренной кости
- Ямка зуба
- Ямка подколенной мышцы
- Ямка слезного мешка
- Яремное отверстие
Костная система вола: иллюстрированный атлас анатомии животных
Корова — Кости черепа
Крестец (крестцовые позвонки) – (Бык , Дорсальный вид)
Костная система крупного рогатого скота : Скелет грудной клетки, Ребра, Реберный хрящ, Грудина
Кости грудной конечности : Лопатка, Плечо, Лучевая кость, Локоть, Кости пальцев кисти (Корова, Вид с латеральной стороны)
Бык / Корова — Кости пальцев кисти
Анатомия животных — Тазовая кость (Корова, Вентральный вид)
Корова — Большая берцовая кость/Малоберцовая кость
Корова — Кости заплюсны (Иллюстрации)
Подписаться сейчас
Просмотреть наши планы подписки
Специальные тарифы на групповые и институциональные подписки!
Специальные тарифы на групповые и институциональные подписки!
Специальные тарифы на групповые и институциональные подписки!
Специальные тарифы на групповые и институциональные подписки!
Специальные тарифы на групповые и институциональные подписки!
Повреждения зон роста — лечение, симптомы, причины, диагностика
Зона роста также называемая эпифизарной пластиной или физисом — это участок растущей ткани в конце длинных трубчатых костей у детей и подростков. Каждая длинная кость имеет по крайней мере две пластины роста: по одному на каждом конце. Рост пластины определяет будущую длину и форму зрелой костной ткани. После завершения роста в конце пубертатного возраста рост пластин завершается и эта зона замещается твердой костной тканью.
Каждая длинная кость имеет по крайней мере две пластины роста: по одному на каждом конце. Рост пластины определяет будущую длину и форму зрелой костной ткани. После завершения роста в конце пубертатного возраста рост пластин завершается и эта зона замещается твердой костной тканью.
Повреждения пластинок возникают у детей и подростков. Пластины является самой слабой областью растущего скелета, они слабее даже, чем соседние связки и сухожилия, которые соединяют кости с другими костями и мышцами. У ребенка в период роста при серьезных травмах суставов, наиболее вероятно,будет повреждение пластин роста, чем связок, отвечающих за стабильность сустава. Травмы, которые могут вызвать растяжение связок у взрослых, могут вызвать повреждение пластин роста у детей.
Повреждения пластин роста происходят при переломах. Они составляют 15 процентов всех детских переломов. Они встречаются в два раза чаще у мальчиков чем, у девочек, и наиболее часто встречаются у 14 — 16-летних мальчиков и 11 — 13-летних девочек.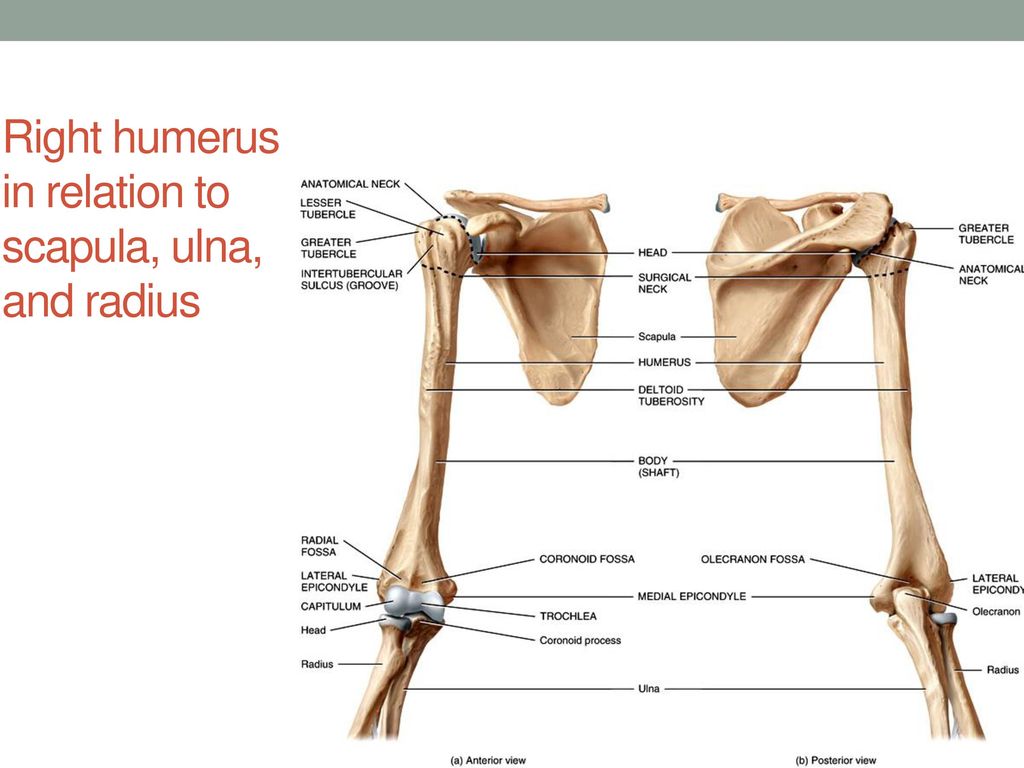 У девочек в более старшей возрастной группе реже встречаются переломы так, как опорно-двигательный аппарат у девочек созревает раньше, чем у мальчиков. В результате у девочек раньше завершается формирование костной ткани и пластинки роста сменяются плотной костной тканью. Примерно половина всех травм пластинок роста происходят в нижней части предплечья ( лучевой кости) или в локте. Эти травмы также часто встречаются в нижней части ноги (голени и малоберцовой кости). Они могут также возникать в верхней части ноги (бедре) или в лодыжке и стопе.
У девочек в более старшей возрастной группе реже встречаются переломы так, как опорно-двигательный аппарат у девочек созревает раньше, чем у мальчиков. В результате у девочек раньше завершается формирование костной ткани и пластинки роста сменяются плотной костной тканью. Примерно половина всех травм пластинок роста происходят в нижней части предплечья ( лучевой кости) или в локте. Эти травмы также часто встречаются в нижней части ноги (голени и малоберцовой кости). Они могут также возникать в верхней части ноги (бедре) или в лодыжке и стопе.
Причины
Хотя травмы пластинок роста, как правило, связаны с острой травмой ( падение или удар по конечности),повреждение может быть вызвано и хронической травмой, возникающей в результате избыточных частых нагрузок. Например, такие повреждения пластин роста могут возникнуть у спортсменов: гимнастов, легкоатлетов, игроков в бейсбол.
На основании определенных исследований травматизма у детей были получены данные, что повреждения пластин роста возникают в результате падений на детской площадке или со стульев. На такие виды спорта такие, как футбол, легкая атлетика и гимнастика, приходится одна треть всех травм. На другие виды физической активности такие, как езда на велосипеде, катание на санях, катание на лыжах и катание на роликовой доске, приходится одна пятая всех переломов пластин роста. Травмы при езде на автомобиле, мотоцикле, и связанных с ними транспортных происшествиях составляют лишь небольшой процент переломов пластин роста.
На такие виды спорта такие, как футбол, легкая атлетика и гимнастика, приходится одна треть всех травм. На другие виды физической активности такие, как езда на велосипеде, катание на санях, катание на лыжах и катание на роликовой доске, приходится одна пятая всех переломов пластин роста. Травмы при езде на автомобиле, мотоцикле, и связанных с ними транспортных происшествиях составляют лишь небольшой процент переломов пластин роста.
Eсли у ребенка после острой травмы или чрезмерной нагрузки возникает боль, которая не исчезает или проходит изменение физической активности или есть локальная болезненность,то в таком случае обязательно необходима консультация врача. Ребенок, ни в коем случае,не должен двигаться через боль. Дети, которые занимаются спортом, часто испытывают некоторый дискомфорт, так как им приходится выполнять новые движения. В некоторых случаях появление определенных неприятных ощущений вполне предсказуемо, но,тем не менее,любая жалоба ребенка заслуживает внимания так,как некоторые травмы при отсутствии адекватного лечения могут приводить к необратимым изменениям и нарушить надлежащий рост костей поврежденной конечности.
Хотя в большинстве случаев травмы пластин роста связаны с травмами во время игры или занятий спортом,тем не менее, возможны и другие причины повреждения зон роста (например, при инфекции костей ),которые могут изменить нормальный рост и развитие костной ткани.
Другие возможные причины травмы пластинок роста
Жестокое обращение с детьми может стать причиной травм костей, особенно у маленьких детей, у которых рост костных тканей только начинается.
Воздействие холода (например, обморожение) может также повредить пластинки роста у детей и в результате чего могут быть короткие пальцы в старшем возрасте или ранее развитие дегенеративного артрита.
Радиационное излучение, которое используется для лечения некоторых видов рака у детей, может привести к повреждению роста пластины. Более того, недавние исследования показали,что и химиотерапия, используемая для лечения онкологических заболеваний у детей, может негативно повлиять на рост костей. Аналогичное действие оказывает и длительное применение стероидов для при лечении ревматоидного артрита.
Наличие у детей определенных неврологических нарушений, которые приводят к сенсорному дефициту или мышечному дисбалансу, повышает риск переломов пластинок роста, особенно в области лодыжки и колена.
Подобные типы травм часто наблюдаются у детей, которые родились с нечувствительностью к боли.
Область зон роста является местом приложения многих наследственных заболеваний, которые влияют на опорно-двигательный аппарат. Наука постепенно изучает гены и мутации генов, участвующих в формировании скелета, роста и развития костной ткани. Со временем эти исследования помогут лечить различные отклонения в нормальном функционировании пластин роста.
Симптомы
- Невозможность продолжать игру из-за болей после острой травмы.
- Снижение способности играть в течение длительного времени из-за постоянной боли после перенесенной травмы.
- Визуально заметная деформация руки или ноги ребенка.
- Сильная боль и невозможность движений после травмы.

Диагностика
После выяснения обстоятельств травмы врач назначает рентгенографию для определения типа перелома и выработки плана лечения. Поскольку зоны роста не имеют такой плотности, как кости, то рентгенография их не визуализирует и они определяются как промежутки ( зазоры) между метафизом и эпифизом длинной трубчатой кости.В связи с плохой визуализацией на рентгенографии зон роста рекомендуется проводить рентгенографию парной конечности для сравнения изображений.
МРТ (магнитно-резонансная томография) позволяет достаточно четко визуализировать изменения в тканях и, поэтому, может быть назначена для диагностики повреждений пластин роста. В некоторых случаях, возможно использование другие диагностических методов, таких как компьютерная томография (КТ) или УЗИ исследование.
Классификация переломов пластин роста (Солтер и Харрис)
Переломы пластин роста делятся на 5 типов:
- Тип I
Эпифиз полностью отделен от конца кости или метафиза, через глубокий слой пластинки роста. Пластина роста остается прикрепленной к эпифизу. Врачу необходимо провести репозицию при наличии смещения. При этом типе перелома необходима иммобилизация с помощью гипса для полноценной консолидации. Как правило, вероятность полноценного восстановления кости при этом типе перелома очень высокая.
Пластина роста остается прикрепленной к эпифизу. Врачу необходимо провести репозицию при наличии смещения. При этом типе перелома необходима иммобилизация с помощью гипса для полноценной консолидации. Как правило, вероятность полноценного восстановления кости при этом типе перелома очень высокая. - Тип II
Это наиболее распространенный тип перелома пластины роста. Эпифиз, вместе с пластиной роста отделяется от метафиза. Как и при типе I,при переломах типа II обычно необходимо проводить репозицию и жесткую фиксацию гипсом. - Тип III
Этот тип перелома происходит в редких случаях, как правило, в нижней части голени, в большеберцовой кости. Это происходит, когда перелом проходит полностью через эпифиз и отделяет часть эпифиза и пластинку роста от метафиза. При таких переломах нередко требуется хирургическое восстановление суставной поверхности. Прогноз при таких переломах хороший,если нет нарушения кровоснабжения отделенной части эпифиза и нет выраженных смещений отломков.
- Тип IV
Этот перелом проходит через эпифиз, через всю пластинку роста и в метафиз.При этом типе перелома необходима хирургическая реконструкция геометрии костей и выравнивание пластинки роста. Если реконструкция не будет проведена качественно, то прогноз при таком тип перелома может быть не очень хорошим. Эта травма встречается,чаще всего,в конце плечевой кости рядом с локтем. - Тип V
Это редкий тип травмы,когда происходит дробление конца кости и пластина роста сжимается. Чаще всего,такой тип перелома встречается в колене или лодыжке.Прогноз неблагоприятный, так как преждевременное окостенение зоны роста почти неизбежно.
Новая классификация, называемая классификация Петерсона различает также перелом типа VI, при котором часть эпифиза, пластина роста, и метафиз отсутствуют. Это обычно происходит при открытых ранах или переломах (травмы при применение сельскохозяйственной техники,снегоходов, газонокосилки или при огнестрельных ранениях). При VI типе перелома обязательно требуется хирургическое вмешательство, и большинстве случаев бывают необходимы поздние реконструктивные или корректирующие операции. Рост костей почти всегда нарушен.
При VI типе перелома обязательно требуется хирургическое вмешательство, и большинстве случаев бывают необходимы поздние реконструктивные или корректирующие операции. Рост костей почти всегда нарушен.
Лечение
Как правило, лечением травм (за исключением незначительных) занимается врач-травматолог. В некоторых случаях требуется детский ортопед-травматолог так,как травмы у детей нередко имеют свои особенности.
Лечение при переломах зависит от типа перелома.Лечение, которое должно быть начато как можно раньше после травмы и, как правило, представляет собой следующие действия:
- Иммобилизация. На поврежденную конечность накладывается гипс или шина и ограничивают любую деятельность ребенка,которая может оказать давление на травмированную область.
- Репозиция. При наличии смещения отломков необходима ручная репозиция или нередко хирургическая репозиция с фиксацией отломков. Фиксация необходима для нормальной консолидации костной ткани.После проведения репозиции накладывается гипсовая повязка с захватом зоны роста и сустава.
 Иммобилизация в гипсе необходима в течение от нескольких недель до нескольких месяцев до тех пор, пока не произойдет нормальная консолидация костной ткани.Необходимость в оперативном восстановлении целостности костных структур определяется размерами смещения, наличием опасности повреждения близлежащих сосудов и нервов и возрастом ребенка.
Иммобилизация в гипсе необходима в течение от нескольких недель до нескольких месяцев до тех пор, пока не произойдет нормальная консолидация костной ткани.Необходимость в оперативном восстановлении целостности костных структур определяется размерами смещения, наличием опасности повреждения близлежащих сосудов и нервов и возрастом ребенка. - ЛФК назначается только после завершения регенерации костной ткани. Долгосрочные наблюдения врача необходимы для оценки адекватного роста костной ткани так, как происходит травма зон роста. Поэтому, рекомендуется проведение рентгенографии конечностей с интервалами 3-6 месяцев, в течение 2 лет после перелома зон роста. Некоторые переломы требуют динамического наблюдения до завершения роста ребенка.
Прогноз
Почти в 85 процентов случаев переломов пластинок роста происходит полное заживление без каких-либо последствий.
Нарушение формирования костной ткани при травме пластинки роста возникают в следующих случаях:
- Тяжесть травмы.
 Если травма вызывает нарушение притока крови к эпифизу,то происходит нарушение роста костной ткани.Также при при смещении, разрушении или компрессии пластинки роста возможно замедление роста костной ткани.Наличие открытой травмы может повлечь за собой риск инфицирования и инфекция может разрушить пластину роста.
Если травма вызывает нарушение притока крови к эпифизу,то происходит нарушение роста костной ткани.Также при при смещении, разрушении или компрессии пластинки роста возможно замедление роста костной ткани.Наличие открытой травмы может повлечь за собой риск инфицирования и инфекция может разрушить пластину роста. - Возраст ребенка. В младшем возрасте повреждение пластин роста может приводить к более серьезным нарушениям в развитии костной ткани так, как необходим большой прирост костей. И поэтому,при переломах в раннем детском возрасте требуется длительное наблюдение врача. В то же время более молодая костная ткань обладает большей регенераторной способностью.
- Локализация переломов зон роста.Например,зоны роста в колене более ответственны за экстенсивный рост костей, чем другие.
- Тип роста перелома пластин — Тип IV и V являются наиболее серьезными.
Лечение зависит от вышеперечисленных факторов, а также опирается на прогноз.
Наиболее частым осложнением перелома пластины роста является преждевременная остановка роста костей.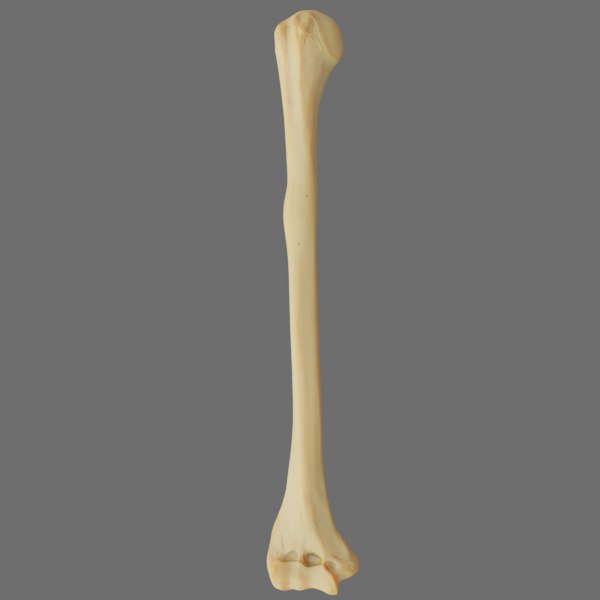 Пораженная кость растет медленнее, чем это было бы без травмы, и в результате конечность может быть короче, чем неповрежденная конечность. Если же повреждена только часть пластинки роста, рост кости может быть в одну сторону и происходит искривление конечности. Травмы зоны роста в колене подвержены наибольшему риску осложнений. Так как нередко травма зоны роста в колене сопровождается повреждением нервов и сосудов, то поэтому травмы зон роста в колене чаще сопровождаются нарушением роста костей и искривлениями конечности.
Пораженная кость растет медленнее, чем это было бы без травмы, и в результате конечность может быть короче, чем неповрежденная конечность. Если же повреждена только часть пластинки роста, рост кости может быть в одну сторону и происходит искривление конечности. Травмы зоны роста в колене подвержены наибольшему риску осложнений. Так как нередко травма зоны роста в колене сопровождается повреждением нервов и сосудов, то поэтому травмы зон роста в колене чаще сопровождаются нарушением роста костей и искривлениями конечности.
В настоящее время в ведущих исследовательских клиниках проводятся исследования, изучающие возможности стимуляции регенерации тканей с использованием результатов генной инженерии, что позволит в будущем избежать остановки роста и деформации конечностей после перенесенных травм зон роста.
Васкуляризированные надкостнично-кортикальные аутотрансплантаты в реконструктивной хирургии конечностей — диссертация
Аннотация:ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
В настоящее время в арсенале микрохирургов находится более 100 различных аутотрансплантатов. Однако известные и часто используемые аутотрансплантаты в ряде клинических наблюдений не позволяют решить вопросы остеорепарации, что может быть связано как с характером травмы, так и с анатомическими особенностями.
История использования в пластической хирургии кровоснабжаемых комплексов тканей, содержащих фрагмент кости, насчитывает более ста лет.
Вариант использования васкуляризированного малоберцового костного аутотрансплантата был впервые предложен Hahn в 1884 году. Накопленный материал анатомических исследований позволил включить в комплекс забираемых тканей костный фрагмент.
Впервые микрохирургическая пересадка свободного костного реваскуляризируемого фрагмента малоберцовой кости с мышечной муфтой была выполнена в 1975 году Taylor G.I., который использовал свободный реваскуляризируемый фрагмент гребня подвздошной кости в составе кожно-костного пахового лоскута.
Harashina T. et al., (1978), Arijan S. and Finseth F. (1978) использовали свободные реваскуляризируемые кожно-костные аутотрансплантаты, включавшие фрагмент ребра на межреберных сосудах для пластики дефектов нижней челюсти и дефекта лица.
Однако известные и часто используемые аутотрансплантаты в ряде клинических наблюдений не позволяют решить вопросы остеорепарации, что может быть связано как с характером травмы, так и с анатомическими особенностями.
История использования в пластической хирургии кровоснабжаемых комплексов тканей, содержащих фрагмент кости, насчитывает более ста лет.
Вариант использования васкуляризированного малоберцового костного аутотрансплантата был впервые предложен Hahn в 1884 году. Накопленный материал анатомических исследований позволил включить в комплекс забираемых тканей костный фрагмент.
Впервые микрохирургическая пересадка свободного костного реваскуляризируемого фрагмента малоберцовой кости с мышечной муфтой была выполнена в 1975 году Taylor G.I., который использовал свободный реваскуляризируемый фрагмент гребня подвздошной кости в составе кожно-костного пахового лоскута.
Harashina T. et al., (1978), Arijan S. and Finseth F. (1978) использовали свободные реваскуляризируемые кожно-костные аутотрансплантаты, включавшие фрагмент ребра на межреберных сосудах для пластики дефектов нижней челюсти и дефекта лица. Проведенные анатомические и экспериментальные исследования показали адекватное кровоснабжение костного сегмента в составе лучевого лоскута, что позволило в 1983 году Вiemer E. и Stock W. использовать его в клинической практике.
Для замещения дефектов длинных трубчатых костей широкое применение в составе свободных реваскуляризируемых аутотрансплантатов нашли фрагменты малоберцовой кости, гребня подвздошной кости, ребра, наружного края лопатки.
Основным преимуществом свободных реваскуляризируемых костных аутотрансплантатов является возможность замещения дефектов трубчатых костей независимо от кровоснабжения реципиентной области. Главным условием их применения является наличие магистральных сосудов или их ветвей состоятельных для наложения микрососудистых анастомозов. Именно сосуды, а не реципиентное ложе обеспечивают выживание аутотрансплантата. Ограничением выбора аутотрансплантата является максимальная длина дефекта трубчатой кости (Pho R.W.H. 1988)
По мнению различных авторов, сращение свободных реваскуляризируемых аутотрансплантатов с костными фрагментами сегмента происходит по типу первичного, а сроки сращения сопоставимы со сроками сращения переломов (Миланов Н.
Проведенные анатомические и экспериментальные исследования показали адекватное кровоснабжение костного сегмента в составе лучевого лоскута, что позволило в 1983 году Вiemer E. и Stock W. использовать его в клинической практике.
Для замещения дефектов длинных трубчатых костей широкое применение в составе свободных реваскуляризируемых аутотрансплантатов нашли фрагменты малоберцовой кости, гребня подвздошной кости, ребра, наружного края лопатки.
Основным преимуществом свободных реваскуляризируемых костных аутотрансплантатов является возможность замещения дефектов трубчатых костей независимо от кровоснабжения реципиентной области. Главным условием их применения является наличие магистральных сосудов или их ветвей состоятельных для наложения микрососудистых анастомозов. Именно сосуды, а не реципиентное ложе обеспечивают выживание аутотрансплантата. Ограничением выбора аутотрансплантата является максимальная длина дефекта трубчатой кости (Pho R.W.H. 1988)
По мнению различных авторов, сращение свободных реваскуляризируемых аутотрансплантатов с костными фрагментами сегмента происходит по типу первичного, а сроки сращения сопоставимы со сроками сращения переломов (Миланов Н.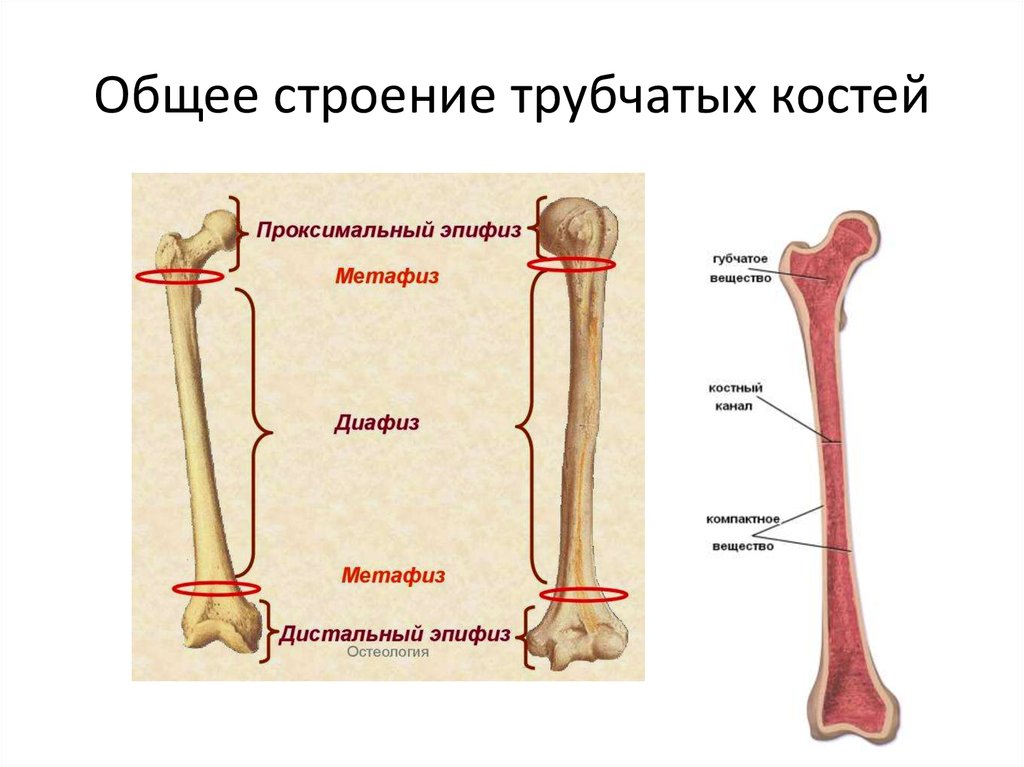 О 2002, Зелянин А.С. 2004).
В последнее время разными авторами обсуждается вопрос об использовании ротированных аутотрансплантатов на сосудистой ножке, как альтернатива свободной микрохирургической аутотрансплантации.
Вопросы топографо-анатомических исследований потенциальных донорских зон, методик забора аутотрансплантатов, показаний, рациональной тактики лечения с применением васкуляризирумых аутотрансплантатов до настоящего времени остаются недостаточно изученными.
Это послужило поводом для поиска донорских областей и изучения свойств аутотрансплантатов для повышения эффективности их применения.
Цель работы: на основании комплексных топографо-анатомических исследований и анализа клинических наблюдений обосновать возможность формирования васкуляризированных надкостнично-кортикальных аутотрансплантатов и варианты их клинического использования в реконструктивной хирургии конечностей.
Для достижения поставленной цели потребовалось решение следующих задач:
1.
О 2002, Зелянин А.С. 2004).
В последнее время разными авторами обсуждается вопрос об использовании ротированных аутотрансплантатов на сосудистой ножке, как альтернатива свободной микрохирургической аутотрансплантации.
Вопросы топографо-анатомических исследований потенциальных донорских зон, методик забора аутотрансплантатов, показаний, рациональной тактики лечения с применением васкуляризирумых аутотрансплантатов до настоящего времени остаются недостаточно изученными.
Это послужило поводом для поиска донорских областей и изучения свойств аутотрансплантатов для повышения эффективности их применения.
Цель работы: на основании комплексных топографо-анатомических исследований и анализа клинических наблюдений обосновать возможность формирования васкуляризированных надкостнично-кортикальных аутотрансплантатов и варианты их клинического использования в реконструктивной хирургии конечностей.
Для достижения поставленной цели потребовалось решение следующих задач:
1. Определить расположение донорских зон надкостнично-кортикальных аутотрансплантатов с осевым кровообращением и методы забора надкостнично-кортикальных аутотрансплантатов в различных донорских областях.
2. Изучить возможности формирования ротируемых надкостнично-кортикальных аутотрансплантатов для выполнения реконструктивных операций на различных сегментах конечностей.
3. Разработать методику и технику забора свободных реваскуляризируемых надкостнично-кортикальных аутотрансплантатов.
4. На основе топографо-анатомических и функциональных исследований разработать показания к применению различных свободных реваскуляризированных надкостнично-кортикальных аутотрансплантатов.
5. Разработать методы определения возможности забора различных васкуляризированных надкостнично-кортикальных аутотрансплантатов
6. Оценить возможности клинического применения различных васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей.
7.
Определить расположение донорских зон надкостнично-кортикальных аутотрансплантатов с осевым кровообращением и методы забора надкостнично-кортикальных аутотрансплантатов в различных донорских областях.
2. Изучить возможности формирования ротируемых надкостнично-кортикальных аутотрансплантатов для выполнения реконструктивных операций на различных сегментах конечностей.
3. Разработать методику и технику забора свободных реваскуляризируемых надкостнично-кортикальных аутотрансплантатов.
4. На основе топографо-анатомических и функциональных исследований разработать показания к применению различных свободных реваскуляризированных надкостнично-кортикальных аутотрансплантатов.
5. Разработать методы определения возможности забора различных васкуляризированных надкостнично-кортикальных аутотрансплантатов
6. Оценить возможности клинического применения различных васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей.
7. Разработать варианты клинического применения васкуляризированных надкостнично-кортикальных аутотрансплантатов в различных реципиентных областях.
Научная новизна. Впервые проведено детальное изучение анатомии ряда донорских областей для возможности забора надкостнично-кортикальных аутотрансплантатов.
Впервые разработана методика забора надкостнично-кортикальных аутотрансплантатов на переднем большеберцовом сосудистом пучке.
Впервые проведен сравнительный анализ топографо-анатомических характеристик васкуляризированных надкостнично-кортикальных аутотрансплантатов.
Разработан функциональный тест для определения компенсации кровоснабжения в дистальных отделах конечностей при выключении из магистрального кровотока фрагмента одного из основных сосудистых пучков.
Показаны возможности васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии длиных трубчатых костей.
Практическая значимость. На основании топографо-анатомических исследований определено расположение донорских зон васкуляризированных надкостнично-кортикальных аутотрансплантатов.
Разработать варианты клинического применения васкуляризированных надкостнично-кортикальных аутотрансплантатов в различных реципиентных областях.
Научная новизна. Впервые проведено детальное изучение анатомии ряда донорских областей для возможности забора надкостнично-кортикальных аутотрансплантатов.
Впервые разработана методика забора надкостнично-кортикальных аутотрансплантатов на переднем большеберцовом сосудистом пучке.
Впервые проведен сравнительный анализ топографо-анатомических характеристик васкуляризированных надкостнично-кортикальных аутотрансплантатов.
Разработан функциональный тест для определения компенсации кровоснабжения в дистальных отделах конечностей при выключении из магистрального кровотока фрагмента одного из основных сосудистых пучков.
Показаны возможности васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии длиных трубчатых костей.
Практическая значимость. На основании топографо-анатомических исследований определено расположение донорских зон васкуляризированных надкостнично-кортикальных аутотрансплантатов. Разработана методика и техника забора васкуляризированных надкостнично-кортикальных аутотранспалантатов. Показаны варианты их использования в реконструкции длинных трубчатых костей и крупных суставов.
В результате проведенного анализа результатов топографо-анатомических и функциональных исследований васкуляризированных надкостнично-кортикальных аутотрансплантатов и донорских зон определены варианты клинического использования изученных аутотрансплантатов.
Показаны возможности использования васкулиризированных надкостнично-кортикальных аутотрансплантатов при различных патологических состояниях длиных трубчатых костей и крупных суставов.
Реализация результатов работы. Результаты настоящего исследования внедрены в практическую деятельность отделении восстановительной микрохирургии ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН и отделения пластической хирурги ГБУО Первый МГМУ им. И.М. Сеченова. Основные положения используются для обучения ординаторов и аспирантов Первого МГМУ им.
Разработана методика и техника забора васкуляризированных надкостнично-кортикальных аутотранспалантатов. Показаны варианты их использования в реконструкции длинных трубчатых костей и крупных суставов.
В результате проведенного анализа результатов топографо-анатомических и функциональных исследований васкуляризированных надкостнично-кортикальных аутотрансплантатов и донорских зон определены варианты клинического использования изученных аутотрансплантатов.
Показаны возможности использования васкулиризированных надкостнично-кортикальных аутотрансплантатов при различных патологических состояниях длиных трубчатых костей и крупных суставов.
Реализация результатов работы. Результаты настоящего исследования внедрены в практическую деятельность отделении восстановительной микрохирургии ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН и отделения пластической хирурги ГБУО Первый МГМУ им. И.М. Сеченова. Основные положения используются для обучения ординаторов и аспирантов Первого МГМУ им.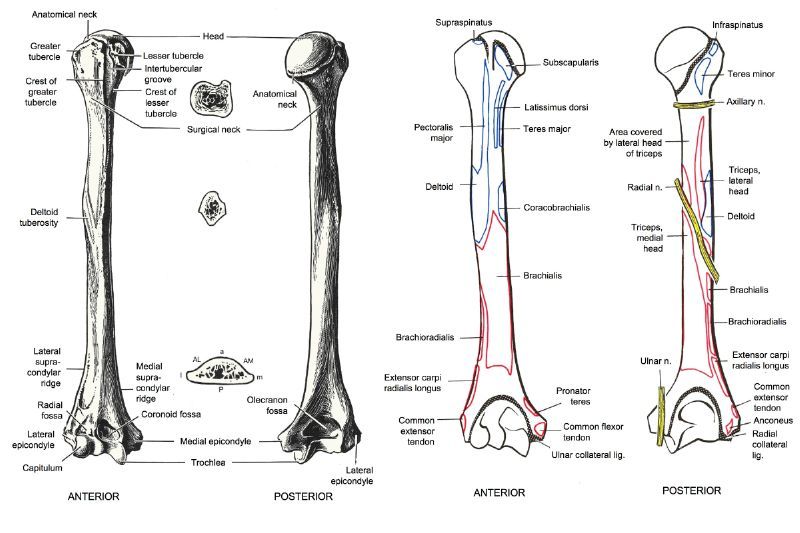 И.М. Сеченова.
Апробация работы. Основные материалы диссертации доложены и обсуждены на: 1 — научно-практической конференции «Пластическая и реконструктивная микрохи¬рургия в травматологии и ортопедии» 21 октября 2005 С-Петербург; 2 — V международном Конгрессе по пластической, реконструктивной и эстетической хирургии. Ереван. 12-14 апреля 2006г; 3 — II Международном конгрессе пластической, реконструктивной, эстетической хирургии и косметологии. Тбилиси, Грузия 4-6 июля 2008г.; 4 — Всероссийская конференция “50 лет AO/ASIF”.27-28 ноября 2008.; 5 — I(VI) Съезда Российского общества пластических, реконструктивных и эстетических хирургов 3-4 декабря 2008г.; 6 — IV научно-практической конференции травматологов и ортопедов федерального медико-биологического агентства 28-29 мая 2009г. г. Железногорск. «Новые технологии в оказании помощи пострадавшим при авариях на производстве и дорожно-транспортных происшествиях»; 7 — международной юбилейной научно-практической конференции «Современные повреждения и их лечение», посвященная 200-летию со дня рождения Н.
И.М. Сеченова.
Апробация работы. Основные материалы диссертации доложены и обсуждены на: 1 — научно-практической конференции «Пластическая и реконструктивная микрохи¬рургия в травматологии и ортопедии» 21 октября 2005 С-Петербург; 2 — V международном Конгрессе по пластической, реконструктивной и эстетической хирургии. Ереван. 12-14 апреля 2006г; 3 — II Международном конгрессе пластической, реконструктивной, эстетической хирургии и косметологии. Тбилиси, Грузия 4-6 июля 2008г.; 4 — Всероссийская конференция “50 лет AO/ASIF”.27-28 ноября 2008.; 5 — I(VI) Съезда Российского общества пластических, реконструктивных и эстетических хирургов 3-4 декабря 2008г.; 6 — IV научно-практической конференции травматологов и ортопедов федерального медико-биологического агентства 28-29 мая 2009г. г. Железногорск. «Новые технологии в оказании помощи пострадавшим при авариях на производстве и дорожно-транспортных происшествиях»; 7 — международной юбилейной научно-практической конференции «Современные повреждения и их лечение», посвященная 200-летию со дня рождения Н.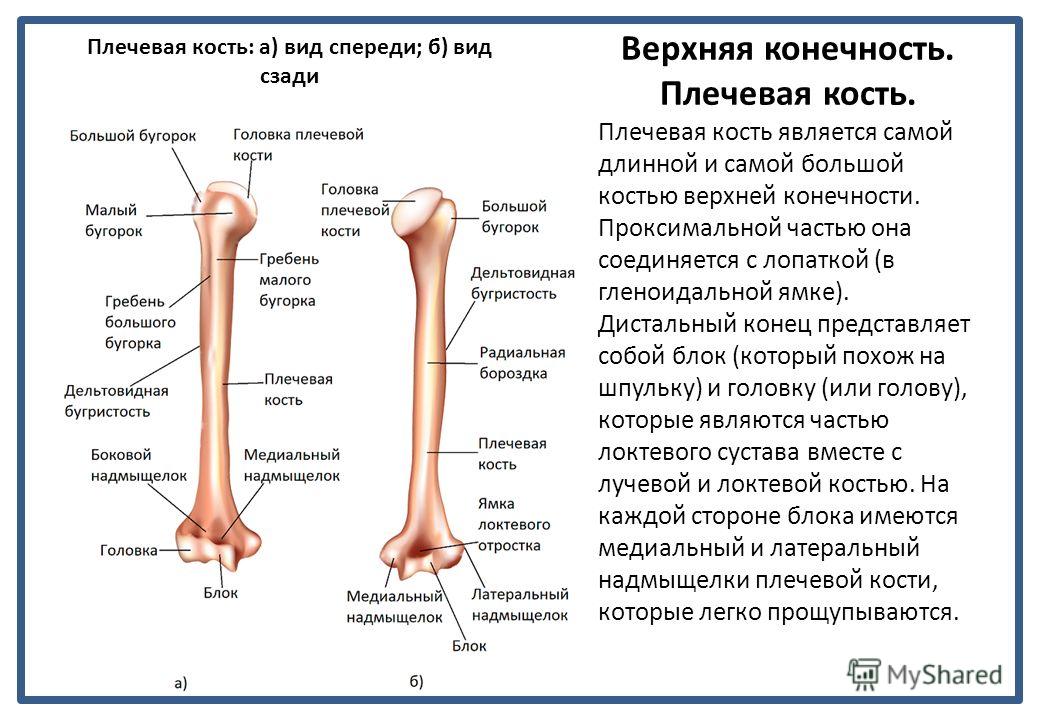 И. Пирогова. Москва 11-12 ноября 2010г.; 8 — Втором (VII) съезде Российского общества пластических, реконструктивных и эстетических хирургов. Москва 1-2 декабря 2010; 9 — совместной научной конференции травматолого-ортопедическое (хирургии позвоночника) отделения ФГБУ Российский научный центр хирургии им. академика Б.В. Петровского РАМН, кафедры пластической хирургии ФППОВ ГБОУ Первый МГМУ им. И.М. Сеченова, отделения пластической хирургии УКБ №1 ГБОУ Первый МГМУ им. И.М. Сеченова.
Публикации. По материалам диссертации опубликовано 28 печатных работ, из них в изданиях рекомендованных ВАК 15, включая 6 патентов на изобретение.
Объем и структура работы. Диссертация состоит из введения, 7 глав, заключения, выводов, практических рекомендаций, библиографического указателя. Текст диссертации изложен на 304 страницах машинописного текста, иллюстрирован 17 таблицами, 205 рисунками и схемами. Список литературы содержит 230 отечественных и 132 зарубежных источников.
СОДЕРЖАНИЕ РАБОТЫ
Представленное анатомо-клиническое исследование состоит из двух взаимосвязанных частей.
И. Пирогова. Москва 11-12 ноября 2010г.; 8 — Втором (VII) съезде Российского общества пластических, реконструктивных и эстетических хирургов. Москва 1-2 декабря 2010; 9 — совместной научной конференции травматолого-ортопедическое (хирургии позвоночника) отделения ФГБУ Российский научный центр хирургии им. академика Б.В. Петровского РАМН, кафедры пластической хирургии ФППОВ ГБОУ Первый МГМУ им. И.М. Сеченова, отделения пластической хирургии УКБ №1 ГБОУ Первый МГМУ им. И.М. Сеченова.
Публикации. По материалам диссертации опубликовано 28 печатных работ, из них в изданиях рекомендованных ВАК 15, включая 6 патентов на изобретение.
Объем и структура работы. Диссертация состоит из введения, 7 глав, заключения, выводов, практических рекомендаций, библиографического указателя. Текст диссертации изложен на 304 страницах машинописного текста, иллюстрирован 17 таблицами, 205 рисунками и схемами. Список литературы содержит 230 отечественных и 132 зарубежных источников.
СОДЕРЖАНИЕ РАБОТЫ
Представленное анатомо-клиническое исследование состоит из двух взаимосвязанных частей. Перед топографо-анатомической частью работы стояли следующие задачи:
1) изучить ангиоархитектонику комплексов тканей, включающих надкостнично-кортикальную пластинку;
2) исследовать характер периостального кровоснабжения изучаемых донорских зон, предполагаемых для забора надкостнично-кортикальных аутотрансплантатов;
3) определить размеры аутотрансплантатов с возможностью забора без риска для донорской области и объем включаемых в комплекс тканей;
4) определить максимально возможную длину сосудистой ножки забираемого комплекса, что обуславливает объем ротации аутотрансплантата;
5) обосновать возможность и технику формирования и аутотрнасплантации надкостнично-кортикальных аутотрансплантатов.
Последующее клиническое использование надкостнично-кортикальных аутотрансплантатов позволило изучить на практике выводы топографо-анатомического исследования, сопоставить анатомический и клинический материал и дать практические выводы по использованию данной категории аутотрнасплантатов.
Перед топографо-анатомической частью работы стояли следующие задачи:
1) изучить ангиоархитектонику комплексов тканей, включающих надкостнично-кортикальную пластинку;
2) исследовать характер периостального кровоснабжения изучаемых донорских зон, предполагаемых для забора надкостнично-кортикальных аутотрансплантатов;
3) определить размеры аутотрансплантатов с возможностью забора без риска для донорской области и объем включаемых в комплекс тканей;
4) определить максимально возможную длину сосудистой ножки забираемого комплекса, что обуславливает объем ротации аутотрансплантата;
5) обосновать возможность и технику формирования и аутотрнасплантации надкостнично-кортикальных аутотрансплантатов.
Последующее клиническое использование надкостнично-кортикальных аутотрансплантатов позволило изучить на практике выводы топографо-анатомического исследования, сопоставить анатомический и клинический материал и дать практические выводы по использованию данной категории аутотрнасплантатов. Анатомическое исследование выполнено на 42 нефиксированных трупах людей (13 женщин,29 мужчин), умерших от травм и заболеваний, не связанных с поражением периферических сосудов (таблица 1). Для исследования отбирали трупы умерших людей, не имеющие повреждений и деформаций или других изменений в интересующих анатомических областях.
Таблица 1.
Сведения об использованном анатомическом материале
Возраст умерших (лет) Количество трупов
Абс. число %
20 — 30 1 2,4
30 — 40 5 11,9
40 — 50 11 26,2
50 — 60 12 28,5
60 – 70 4 9,6
70 — 80 9 21,4
Топографо-анатомические исследования проводили одновременно в нескольких анатомических областях, на контрлатеральных конечностях в одноименных донорских зонах. Сведения об изученных препаратах донорских зон и анатомических областей представлены в таблице 2.
Таблица 2.
Сведения о количестве изученных препаратов различных анатомических областей
Анатомические области и донорские зоны Количество изученных препаратов
Нижняя конечность Бедро 26
Голень 20
Стопа 16
Таз 24
Верхняя конечность Плечо 32
Предплечье 22
Лопаточная область 12
Грудная клетка 22
Комплекс топографо-анатомических исследований включал в себя: 1) селективную ангиографию питающей артерии, 2) окрашивание метиленовым синим внутрикостных сосудов, 3) заливка артериального русла раствором желатина с метиленовым синим (таблица 3).
Анатомическое исследование выполнено на 42 нефиксированных трупах людей (13 женщин,29 мужчин), умерших от травм и заболеваний, не связанных с поражением периферических сосудов (таблица 1). Для исследования отбирали трупы умерших людей, не имеющие повреждений и деформаций или других изменений в интересующих анатомических областях.
Таблица 1.
Сведения об использованном анатомическом материале
Возраст умерших (лет) Количество трупов
Абс. число %
20 — 30 1 2,4
30 — 40 5 11,9
40 — 50 11 26,2
50 — 60 12 28,5
60 – 70 4 9,6
70 — 80 9 21,4
Топографо-анатомические исследования проводили одновременно в нескольких анатомических областях, на контрлатеральных конечностях в одноименных донорских зонах. Сведения об изученных препаратах донорских зон и анатомических областей представлены в таблице 2.
Таблица 2.
Сведения о количестве изученных препаратов различных анатомических областей
Анатомические области и донорские зоны Количество изученных препаратов
Нижняя конечность Бедро 26
Голень 20
Стопа 16
Таз 24
Верхняя конечность Плечо 32
Предплечье 22
Лопаточная область 12
Грудная клетка 22
Комплекс топографо-анатомических исследований включал в себя: 1) селективную ангиографию питающей артерии, 2) окрашивание метиленовым синим внутрикостных сосудов, 3) заливка артериального русла раствором желатина с метиленовым синим (таблица 3).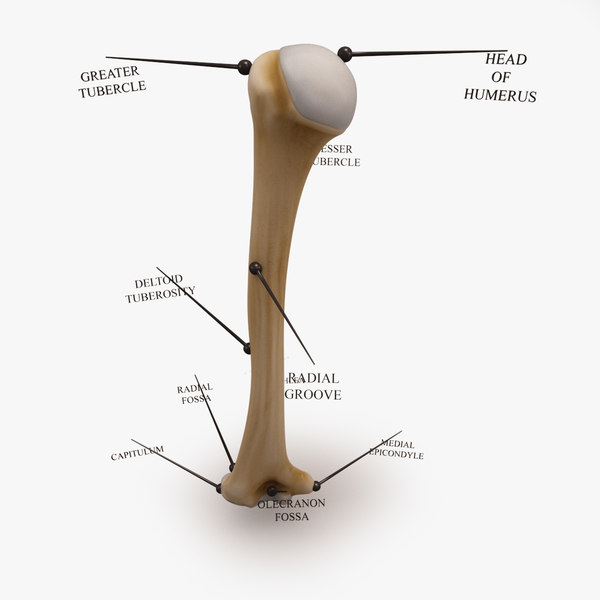 Селективную ангиографию проводили для верификации характера и степени разветвленности сосудистой сети надкостницы. Артериальное русло заполняли взвесью просеянного мелкодисперсного свинцового сурика на основе раствора жидкого мыла, промышленного приготовления.
Таблица 3.
Сведения об использованных методиках топографо-анатомических исследований
Методика исследования Изучаемые донорские области
Верхняя конечность Нижняя конечность Таз Грудная клетка
Инъекции
сосудистого русла Раствором метиленового синего 15 14 9 9
Раствором желатина с метиленовым синим 29 44 10 18
Прецизионное препарирование 29 44 10 18
Селективная ангиография 8 8 5 5
Объем вводимой рентгеноконтрастной взвеси составлял от 20 до 30 мл, в зависимости от антропометрических показателей и границ изучаемой области.
После заполнения артериального русла забирали комплекс тканей, включавший в себя фрагмент кости. Кожно-фасциальную порцию в забираемые комплексы тканей не включали.
Селективную ангиографию проводили для верификации характера и степени разветвленности сосудистой сети надкостницы. Артериальное русло заполняли взвесью просеянного мелкодисперсного свинцового сурика на основе раствора жидкого мыла, промышленного приготовления.
Таблица 3.
Сведения об использованных методиках топографо-анатомических исследований
Методика исследования Изучаемые донорские области
Верхняя конечность Нижняя конечность Таз Грудная клетка
Инъекции
сосудистого русла Раствором метиленового синего 15 14 9 9
Раствором желатина с метиленовым синим 29 44 10 18
Прецизионное препарирование 29 44 10 18
Селективная ангиография 8 8 5 5
Объем вводимой рентгеноконтрастной взвеси составлял от 20 до 30 мл, в зависимости от антропометрических показателей и границ изучаемой области.
После заполнения артериального русла забирали комплекс тканей, включавший в себя фрагмент кости. Кожно-фасциальную порцию в забираемые комплексы тканей не включали. По рентгенограммам изучали сосуды, подходящие к поверхности кости, рассматриваемой в качестве донорской.
В последующем методика проведения селективной ангиографии претерпела изменения. Исследуемый сосуд заполняли рентгеноконтрастным препаратом Омнипак 300. Объем вводимого раствора составлял от 30 до 50 мл. Снимки, сопоставимые по качеству с таковыми при введения свинцового сурика, получали на передвижном рентгенаппарате Арман. При этом не требовался забор тканей, что позволяло получать картину без какого-либо искажения и смещения структур. Относительная техническая простота и экономия времени явились преимуществом последнего варианта методики.
Раствор метиленового синего вводили в артериальный сосуд, питающий комплекс тканей, придерживаясь принципов, описанных выше (объем составил от 70 до 120 мл, что позволяло создать тугое заполнение русла и добиться проникновения красителя во внутрикостные сосуды). Кость освобождали от надкостницы, проводили остеотомию в пределах изучаемой площади и забирали кортикальную пластинку.
По рентгенограммам изучали сосуды, подходящие к поверхности кости, рассматриваемой в качестве донорской.
В последующем методика проведения селективной ангиографии претерпела изменения. Исследуемый сосуд заполняли рентгеноконтрастным препаратом Омнипак 300. Объем вводимого раствора составлял от 30 до 50 мл. Снимки, сопоставимые по качеству с таковыми при введения свинцового сурика, получали на передвижном рентгенаппарате Арман. При этом не требовался забор тканей, что позволяло получать картину без какого-либо искажения и смещения структур. Относительная техническая простота и экономия времени явились преимуществом последнего варианта методики.
Раствор метиленового синего вводили в артериальный сосуд, питающий комплекс тканей, придерживаясь принципов, описанных выше (объем составил от 70 до 120 мл, что позволяло создать тугое заполнение русла и добиться проникновения красителя во внутрикостные сосуды). Кость освобождали от надкостницы, проводили остеотомию в пределах изучаемой площади и забирали кортикальную пластинку. Затем последнюю освобождали от губчатой костной ткани и подсчитывали количество сосудов, прободающих кортикальную пластинку на единице площади на её наружной и внутренней поверхности.
Особое внимание было уделено методике заливки, т.к. получаемая картина давала представление о таких характеристиках сосудистого русла, как степень его ветвления в интересующей нас зоне, количество ветвей 1ого порядка, диаметр сосудов, выраженность сети надкостницы, отношение к смежным анатомическим структурам (нервы, мышцы).
Раствор желатина готовили при температуре 45-50°С до полного его растворения. Далее его смешивали с метиленовым синим из расчета 50 мл красителя на 400-500 мл раствора желатина и получали материал однородной консистенции и цвета. Донорскую область разогревали до температуры 38-40°С (температурный режим контролировали переносным инфракрасным датчиком IRtec MicroRay HVAC). Через артериотомное отверстие приготовленным раствором заполняли сосуд, питающий комплекс тканей, предварительно перевязав сосудистый пучок проксимальнее уровня артериотомии и дистальнее интересующей нас зоны кости.
Затем последнюю освобождали от губчатой костной ткани и подсчитывали количество сосудов, прободающих кортикальную пластинку на единице площади на её наружной и внутренней поверхности.
Особое внимание было уделено методике заливки, т.к. получаемая картина давала представление о таких характеристиках сосудистого русла, как степень его ветвления в интересующей нас зоне, количество ветвей 1ого порядка, диаметр сосудов, выраженность сети надкостницы, отношение к смежным анатомическим структурам (нервы, мышцы).
Раствор желатина готовили при температуре 45-50°С до полного его растворения. Далее его смешивали с метиленовым синим из расчета 50 мл красителя на 400-500 мл раствора желатина и получали материал однородной консистенции и цвета. Донорскую область разогревали до температуры 38-40°С (температурный режим контролировали переносным инфракрасным датчиком IRtec MicroRay HVAC). Через артериотомное отверстие приготовленным раствором заполняли сосуд, питающий комплекс тканей, предварительно перевязав сосудистый пучок проксимальнее уровня артериотомии и дистальнее интересующей нас зоны кости. Объем вводимой смеси составлял 50-80 мл. Далее донорскую область охлаждали до температуры 18-22°С и приступали к этапу препарирования тканей. Обнажали на протяжении сосудистый пучок с сохранением ветвей, идущих к надкостнице непосредственно или в качестве перфорантов через мышечную муфту. При этом так же визуализировали мышечные ветви и перфоранты, питающие кожу, т.к. их наличие или отсутствие влияло на возможность включения в комплекс мягкотканных структур.
В ходе топографо-анатомических исследований проводили измерения при помощи линейки, циркуля, сантиметровой ленты. Прежде всего измеряли длину сосудистой ножки. По ходу препарирования измеряли наружный диаметр сосудов, питающих аутотрансплантат и ветви первого и, в ряде случаев, второго порядка. Для измерения использовали линейку с ценой деления 0,1 мм. После выделения питающих сосудов в проксимальном направлении от места бифуркации главного магистрального сосуда до проксимального края поднятой надкостнично-кортикальной пластинки.
Объем вводимой смеси составлял 50-80 мл. Далее донорскую область охлаждали до температуры 18-22°С и приступали к этапу препарирования тканей. Обнажали на протяжении сосудистый пучок с сохранением ветвей, идущих к надкостнице непосредственно или в качестве перфорантов через мышечную муфту. При этом так же визуализировали мышечные ветви и перфоранты, питающие кожу, т.к. их наличие или отсутствие влияло на возможность включения в комплекс мягкотканных структур.
В ходе топографо-анатомических исследований проводили измерения при помощи линейки, циркуля, сантиметровой ленты. Прежде всего измеряли длину сосудистой ножки. По ходу препарирования измеряли наружный диаметр сосудов, питающих аутотрансплантат и ветви первого и, в ряде случаев, второго порядка. Для измерения использовали линейку с ценой деления 0,1 мм. После выделения питающих сосудов в проксимальном направлении от места бифуркации главного магистрального сосуда до проксимального края поднятой надкостнично-кортикальной пластинки. измеряли их длину, что позволяло определить объем ротации аутотрансплантата.
Помимо указанных измерений оценивали размеры прокрашенной кортикальной пластинки.
Принципиальным отличием данного исследования от ранее проводимых явился подход к изучению возможностей формирования и целесообразности использования тех или иных надкостнично-кортикальных аутотрансплантатов. В качестве основного отличия следует отметить исследование и определение донорских зон для их формирования.
Подход к изучению донорских зон, а не аутотрансплантатов позволяет выявить все источники кровоснабжения кости, определить ее наиболее кровоснабжаемую часть. Более полные прикладные топографо-анатомические знания позволяют хирургу выбирать в переделах анатомической области те или иные питающие сосуды и кортикальную пластинку для формирования надкостнично-кортикального аутотрансплантата и оптимально планировать границы выделяемого аутотрансплантата.
Вторым отличительным принципом данной работы является использование комплекса топографо-анатомических методик, взаимно дополняющих друг друга.
измеряли их длину, что позволяло определить объем ротации аутотрансплантата.
Помимо указанных измерений оценивали размеры прокрашенной кортикальной пластинки.
Принципиальным отличием данного исследования от ранее проводимых явился подход к изучению возможностей формирования и целесообразности использования тех или иных надкостнично-кортикальных аутотрансплантатов. В качестве основного отличия следует отметить исследование и определение донорских зон для их формирования.
Подход к изучению донорских зон, а не аутотрансплантатов позволяет выявить все источники кровоснабжения кости, определить ее наиболее кровоснабжаемую часть. Более полные прикладные топографо-анатомические знания позволяют хирургу выбирать в переделах анатомической области те или иные питающие сосуды и кортикальную пластинку для формирования надкостнично-кортикального аутотрансплантата и оптимально планировать границы выделяемого аутотрансплантата.
Вторым отличительным принципом данной работы является использование комплекса топографо-анатомических методик, взаимно дополняющих друг друга.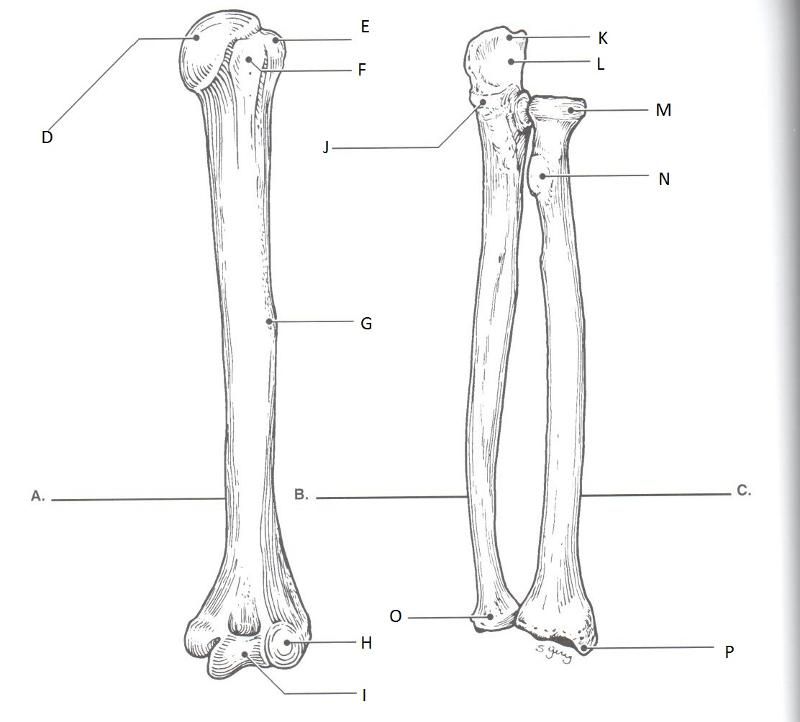 Анализ полученных результатов топографо-анатомических исследований позволял давать обоснованные рекомендации по выбору и технике выделения того или иного аутотрансплантата.
Третья особенность — проверка полученных анатомических данных клинической практикой.
Клиническая часть работы выполнена в отделе восстановительной микрохирургии РНЦХ РАМН за период с 1990г. по 2012г. Проанализирован клинический опыт микрохирургической аутотрансплантации надкостнично-кортикальных аутотрансплантатов у 82 больных.
Среди больных преобладали мужчины (52). Возраст больных составил от 4 до 70 лет. Наибольшее число больных (59) находилось в возрасте от 21 до 50 лет (табл. 4). У большинства пациентов в анамнезе было несколько безуспешных операций с длительностью лечения до 11 (в среднем около 4) лет (табл. 5).
В структуре патологии требовавшей аутотрансплантацию васкуляризированных надкостнично-кортикальных аутотрансплантатов преобладали больные с неинфицированными ложными суставами длинных трубчатых костей (таблица 6).
Анализ полученных результатов топографо-анатомических исследований позволял давать обоснованные рекомендации по выбору и технике выделения того или иного аутотрансплантата.
Третья особенность — проверка полученных анатомических данных клинической практикой.
Клиническая часть работы выполнена в отделе восстановительной микрохирургии РНЦХ РАМН за период с 1990г. по 2012г. Проанализирован клинический опыт микрохирургической аутотрансплантации надкостнично-кортикальных аутотрансплантатов у 82 больных.
Среди больных преобладали мужчины (52). Возраст больных составил от 4 до 70 лет. Наибольшее число больных (59) находилось в возрасте от 21 до 50 лет (табл. 4). У большинства пациентов в анамнезе было несколько безуспешных операций с длительностью лечения до 11 (в среднем около 4) лет (табл. 5).
В структуре патологии требовавшей аутотрансплантацию васкуляризированных надкостнично-кортикальных аутотрансплантатов преобладали больные с неинфицированными ложными суставами длинных трубчатых костей (таблица 6). Таблица 4.
Распределение больных по полу и возрасту.
Пол Возраст (в годах)
менее 20 21-30 31-40 41-50 51-60 старше 60 Всего
муж. 4 13 14 15 4 2 52
жен. — 4 8 9 8 1 30
Всего 4 17 22 24 12 3 82
Практически все больные с ложными суставами сегментов нижней конечности пользовались при ходьбе дополнительной опорой (костыли или трость). Для фиксации сегментов нижней конечности съёмную гипсовую лонгету носили 9 больных, ортопедический ортез — 12.
Из 39 больных с ложными суставами длинных костей верхней конечности съемным ортезом пользовались 16, гипсовой лонгетой — 3.
Все больные были нетрудоспособны, а 59 из них имели вторую и третью группы инвалидности.
Среди сопутствующих заболеваний чаще встречались травматическая энцефалопатия, гипертоническая болезнь, язвенная болезнь желудка и двенадцатиперстной кишки, хронический гастрит, сахарный диабет второго типа.
Таблица 5. Распределение больных по срокам предшествовавшего лечения ложного сустава.
Таблица 4.
Распределение больных по полу и возрасту.
Пол Возраст (в годах)
менее 20 21-30 31-40 41-50 51-60 старше 60 Всего
муж. 4 13 14 15 4 2 52
жен. — 4 8 9 8 1 30
Всего 4 17 22 24 12 3 82
Практически все больные с ложными суставами сегментов нижней конечности пользовались при ходьбе дополнительной опорой (костыли или трость). Для фиксации сегментов нижней конечности съёмную гипсовую лонгету носили 9 больных, ортопедический ортез — 12.
Из 39 больных с ложными суставами длинных костей верхней конечности съемным ортезом пользовались 16, гипсовой лонгетой — 3.
Все больные были нетрудоспособны, а 59 из них имели вторую и третью группы инвалидности.
Среди сопутствующих заболеваний чаще встречались травматическая энцефалопатия, гипертоническая болезнь, язвенная болезнь желудка и двенадцатиперстной кишки, хронический гастрит, сахарный диабет второго типа.
Таблица 5. Распределение больных по срокам предшествовавшего лечения ложного сустава. Давность (в годах) 1-2 3-4 5-6 7-8 9-10 более 10 Всего
Количество больных 30 29 13 6 2 2 82
Лечение по поводу первичной травмы у большинства больных (более 70%) начиналось с репозиции и иммобилизации в гипсовой повязке. Остеосинтез в аппарате наружной чрескостной фиксации применяли у 12 больных, интрамедуллярный остеосинтез – у 5, накостный остеосинтез – у 7.
Таблица 6.
Распределение больных по локализации дефекта сегмента конечности.
Локализация Группа Всего
Неинфицированные ложные суставы Деформация суставов
Нижняя конечность Бедренная кость 9 — 9
Большеберцовая кость 27 3 30
Голеностопный сустав — 2 2
Верхняя конечность Плечевая кость 21 — 21
Лучевая кость 11 — 11
Локтевая кость 4 — 4
Лучевая + локтевая кости 1 — 1
Локтевой сустав — 4 4
Всего 73 9 82
14 больным выполнены операции по поводу повреждений магистральных сосудов и нервных стволов.
До поступления в наше отделение все больные перенесли от 1 до 9 (в среднем 3-4) безуспешных оперативных вмешательств (табл.
Давность (в годах) 1-2 3-4 5-6 7-8 9-10 более 10 Всего
Количество больных 30 29 13 6 2 2 82
Лечение по поводу первичной травмы у большинства больных (более 70%) начиналось с репозиции и иммобилизации в гипсовой повязке. Остеосинтез в аппарате наружной чрескостной фиксации применяли у 12 больных, интрамедуллярный остеосинтез – у 5, накостный остеосинтез – у 7.
Таблица 6.
Распределение больных по локализации дефекта сегмента конечности.
Локализация Группа Всего
Неинфицированные ложные суставы Деформация суставов
Нижняя конечность Бедренная кость 9 — 9
Большеберцовая кость 27 3 30
Голеностопный сустав — 2 2
Верхняя конечность Плечевая кость 21 — 21
Лучевая кость 11 — 11
Локтевая кость 4 — 4
Лучевая + локтевая кости 1 — 1
Локтевой сустав — 4 4
Всего 73 9 82
14 больным выполнены операции по поводу повреждений магистральных сосудов и нервных стволов.
До поступления в наше отделение все больные перенесли от 1 до 9 (в среднем 3-4) безуспешных оперативных вмешательств (табл. 7).
Дефект боковой стенки костных фрагментов в области ложного сустава без дефекта костной ткани по длине диагностирован у 5 больных.
При отсутствии дефекта по длине концы костных фрагментов соотносились друг к другу как поперечные и косопоперечные разобщения. При наличии костного дефекта по длине чаще встречались совершенно неконгруэнтные разобщения.
Таблица 7.
Виды предшествующего лечения
Вид лечения Всего
Наружный чрескостный остеосинтез 44
Накостный остеосинтез 39
Интрамедуллярный остеосинтез 11
Гипсовая иммобилизация 85
Преобладали ложные суставы диафизарной (51) и метадиафизарной локализации 22. Ложные суставы эпиметафизарной локализации выявлены у 7 больных, ранее перенесших внутрисуставные переломы дистального отдела плеча. У 2 больных наблюдали деформацию голеностопного сустава, сопровождающуюся асептическим некрозом таранной кости.
В результате травмы, выполненных ранее операций и проведенного лечения, индивидуального течения раневого процесса у всех больных развились патологические изменения тканей как сегмента, так и конечности в целом, различной степени проявления: от функциональных расстройств до ряда сопутствующих ложному суставу анатомических изменений, заключающихся в обширных рубцовых изменениях покровных тканей, сухожильно-мышечного аппарата, патологии вен, артерий, лимфатических коллекторов, повреждений нервных стволов, несостоятельности связочного аппарата.
7).
Дефект боковой стенки костных фрагментов в области ложного сустава без дефекта костной ткани по длине диагностирован у 5 больных.
При отсутствии дефекта по длине концы костных фрагментов соотносились друг к другу как поперечные и косопоперечные разобщения. При наличии костного дефекта по длине чаще встречались совершенно неконгруэнтные разобщения.
Таблица 7.
Виды предшествующего лечения
Вид лечения Всего
Наружный чрескостный остеосинтез 44
Накостный остеосинтез 39
Интрамедуллярный остеосинтез 11
Гипсовая иммобилизация 85
Преобладали ложные суставы диафизарной (51) и метадиафизарной локализации 22. Ложные суставы эпиметафизарной локализации выявлены у 7 больных, ранее перенесших внутрисуставные переломы дистального отдела плеча. У 2 больных наблюдали деформацию голеностопного сустава, сопровождающуюся асептическим некрозом таранной кости.
В результате травмы, выполненных ранее операций и проведенного лечения, индивидуального течения раневого процесса у всех больных развились патологические изменения тканей как сегмента, так и конечности в целом, различной степени проявления: от функциональных расстройств до ряда сопутствующих ложному суставу анатомических изменений, заключающихся в обширных рубцовых изменениях покровных тканей, сухожильно-мышечного аппарата, патологии вен, артерий, лимфатических коллекторов, повреждений нервных стволов, несостоятельности связочного аппарата. Применявшаяся ранее гипсовая иммобилизация привела к стойким контрактурам смежных суставов и остеопорозу пораженного и смежных сегментов конечности у большинства больных. Контрактуры в функционально невыгодном положении при отсутствии первичного повреждения суставов наблюдались у 28 больных, из которых 21 с эквинусным и эквиноварусным положением в голеностопном суставе, 3 больных с положением кисти и предплечья в пронации, 1 больной с ограничением разгибания в коленном суставе около 10 градусов. Контрактура Фолькмана сформировалась у 3 больных с ложными суставами костей предплечья и дефектом костной ткани по длине.
Гипотрофия мышц больной конечности в той или иной степени наблюдалась у всех больных и была наиболее выражена после длительной гипсовой иммобилизации. У 2 больных ложные суставы плечевой кости сочетались с денервационной атрофией в результате повреждения нервных стволов плечевого сплетения. Отсутствие функциональной активности мышц, нарушение чувствительности выявлено в зоне иннервации малоберцового нерва у 7 больных, локтевого – у 7, лучевого – у 3, срединного – у 3 при сочетании повреждения периферических нервов предплечья у 3 больных.
Применявшаяся ранее гипсовая иммобилизация привела к стойким контрактурам смежных суставов и остеопорозу пораженного и смежных сегментов конечности у большинства больных. Контрактуры в функционально невыгодном положении при отсутствии первичного повреждения суставов наблюдались у 28 больных, из которых 21 с эквинусным и эквиноварусным положением в голеностопном суставе, 3 больных с положением кисти и предплечья в пронации, 1 больной с ограничением разгибания в коленном суставе около 10 градусов. Контрактура Фолькмана сформировалась у 3 больных с ложными суставами костей предплечья и дефектом костной ткани по длине.
Гипотрофия мышц больной конечности в той или иной степени наблюдалась у всех больных и была наиболее выражена после длительной гипсовой иммобилизации. У 2 больных ложные суставы плечевой кости сочетались с денервационной атрофией в результате повреждения нервных стволов плечевого сплетения. Отсутствие функциональной активности мышц, нарушение чувствительности выявлено в зоне иннервации малоберцового нерва у 7 больных, локтевого – у 7, лучевого – у 3, срединного – у 3 при сочетании повреждения периферических нервов предплечья у 3 больных.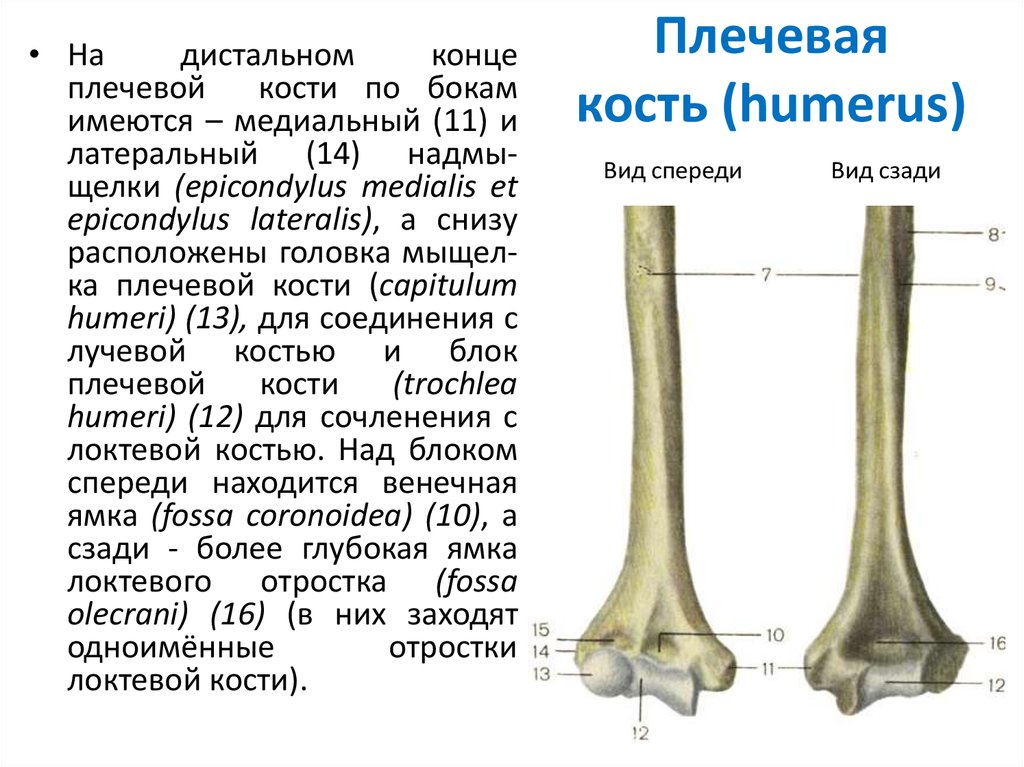 Остеопороз костных фрагментов пораженного сегмента определяли практически у всех больных. Выраженный остеопороз с угрозой смещения металлофиксаторов выявлен у 2 больных с ложным суставом бедренной кости, что потребовало отсрочки операции на сроки до 9 месяцев.
Асептический некроз костных фрагментов наблюдали у 6 больных с ложными суставами диафизарной локализации бедренной и плечевой костей.
Тактику хирургического лечения больных с ложными суставами длинных трубчатых костей определяли на основе анализа клинико-анатомических характеристик: а) наличие укорочения сегмента конечности; б) необходимость замещения дефекта боковой стенки кости; в) вовлеченность в патологический процесс крупных суставов.
Сочетанное замещение мягкотканного и костного дефекта за счет одного аутотрансплантата, включающего мягкотканный и костный компоненты, выполнено 6 больным. У 72 больных васкуляризированные надкостнично-кортикальные аутотрансплантаты использованы для поддержки остеогенеза как тканей ложного сустава (73), так и с целью васкуляризации авскулярных костных фрагментов (8).
Остеопороз костных фрагментов пораженного сегмента определяли практически у всех больных. Выраженный остеопороз с угрозой смещения металлофиксаторов выявлен у 2 больных с ложным суставом бедренной кости, что потребовало отсрочки операции на сроки до 9 месяцев.
Асептический некроз костных фрагментов наблюдали у 6 больных с ложными суставами диафизарной локализации бедренной и плечевой костей.
Тактику хирургического лечения больных с ложными суставами длинных трубчатых костей определяли на основе анализа клинико-анатомических характеристик: а) наличие укорочения сегмента конечности; б) необходимость замещения дефекта боковой стенки кости; в) вовлеченность в патологический процесс крупных суставов.
Сочетанное замещение мягкотканного и костного дефекта за счет одного аутотрансплантата, включающего мягкотканный и костный компоненты, выполнено 6 больным. У 72 больных васкуляризированные надкостнично-кортикальные аутотрансплантаты использованы для поддержки остеогенеза как тканей ложного сустава (73), так и с целью васкуляризации авскулярных костных фрагментов (8). У 2 больных с травматической деформацией голеностопного сустава и асептическим некрозом таранной кости васкуляризированные надкостнично-кортикальные аутотрансплантаты использованы для формирования артродеза голеностопного сустава (табл. 8).
Таблица 8.
Виды операций, выполненных больным с использованием реваскуляризиреумых надкостнично-кортикальных аутотрансплантатов.
Виды операций Количество больных
Замещение костного дефекта 15
Поддержка остеогенеза 59
Сочетанное замещение мягкотканного дефекта и поддержка остеогенеза 6
Артродез крупного сустава 2
Сочетанное замещение мягкотканного дефекта и оказания поддержки остеогенеза за счет одного комплекса тканей, включающего мягкотканный и надкостнично-кортикальный компоненты, выполнено 6 больным.
В ходе лечения больных с ложными суставами длинных костей применено 82 аутотрансплантата (таблица 9). Из них 73 использованы в виде свободных реваскуляризируемых и 10 — ротируемых на сосудистой ножке.
У 2 больных с травматической деформацией голеностопного сустава и асептическим некрозом таранной кости васкуляризированные надкостнично-кортикальные аутотрансплантаты использованы для формирования артродеза голеностопного сустава (табл. 8).
Таблица 8.
Виды операций, выполненных больным с использованием реваскуляризиреумых надкостнично-кортикальных аутотрансплантатов.
Виды операций Количество больных
Замещение костного дефекта 15
Поддержка остеогенеза 59
Сочетанное замещение мягкотканного дефекта и поддержка остеогенеза 6
Артродез крупного сустава 2
Сочетанное замещение мягкотканного дефекта и оказания поддержки остеогенеза за счет одного комплекса тканей, включающего мягкотканный и надкостнично-кортикальный компоненты, выполнено 6 больным.
В ходе лечения больных с ложными суставами длинных костей применено 82 аутотрансплантата (таблица 9). Из них 73 использованы в виде свободных реваскуляризируемых и 10 — ротируемых на сосудистой ножке.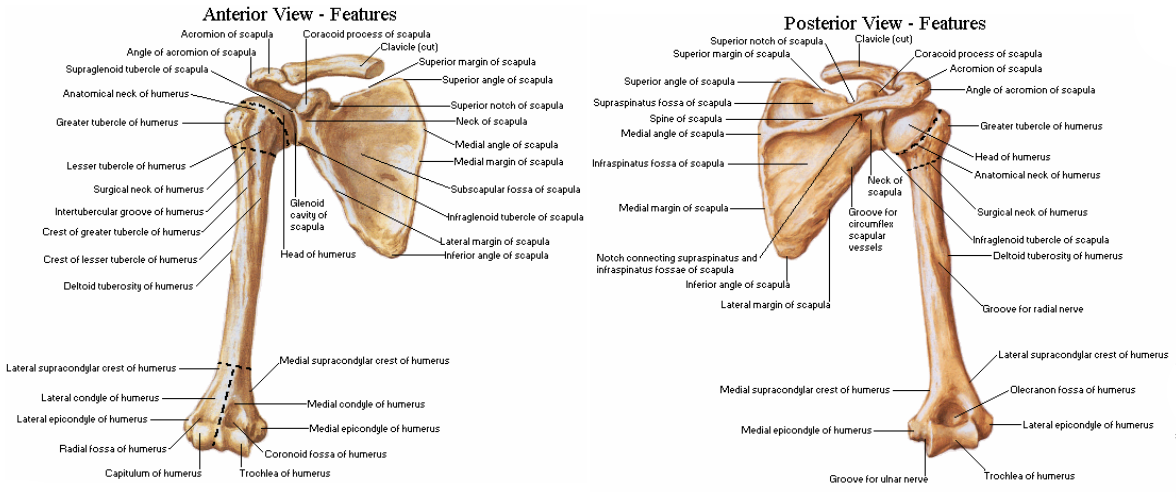 В качестве ротируемого применяли лучевой надкостнично-кортикальный аутотрансплантат на проксимальной сосудистой ножке, передний большеберцовый костный и надкостнично-кортикальный аутотрансплантаты на передней большеберцовой артерии и фрагмент II плюсневой кости на тыльной артерии стопы.
Таблица 9.
Виды и типы использованных свободых реваскуляризируемых и ротируемых на сосудистой ножке аутотрансплантатов.
Группа ТИП ВИД Кол-во
Простой составной
аутотрансплантат Костный Фрагмент гребня подвздошной кости 24
Фрагмент лучевой кости 42
Фрагмент второй плюсневой кости 2
Фрагмент большеберцовой кости 4
Сложный составной аутотрансплантат Кожно-костный Паховый кожно-костный лоскут 4
Лучевой кожно-костный 5
Мышечно-костный Передняя зубчатая мышца с наружной кортикальной пластинкой ребра 1
Всего 82
Предоперационное обследование каждого пациента включало в себя методы изучения потенциальных донорских зон.
Всем больным, у которых предполагали использование аутотрансплантата на одной из магистральных артерий конечности (лучевая, передняя большеберцовая артерия и артерия тыла стопы) проводили тест на компенсацию кровообращения в дистальных отделах конечностей после исключения из кровотока одной из магистральных артерий.
В качестве ротируемого применяли лучевой надкостнично-кортикальный аутотрансплантат на проксимальной сосудистой ножке, передний большеберцовый костный и надкостнично-кортикальный аутотрансплантаты на передней большеберцовой артерии и фрагмент II плюсневой кости на тыльной артерии стопы.
Таблица 9.
Виды и типы использованных свободых реваскуляризируемых и ротируемых на сосудистой ножке аутотрансплантатов.
Группа ТИП ВИД Кол-во
Простой составной
аутотрансплантат Костный Фрагмент гребня подвздошной кости 24
Фрагмент лучевой кости 42
Фрагмент второй плюсневой кости 2
Фрагмент большеберцовой кости 4
Сложный составной аутотрансплантат Кожно-костный Паховый кожно-костный лоскут 4
Лучевой кожно-костный 5
Мышечно-костный Передняя зубчатая мышца с наружной кортикальной пластинкой ребра 1
Всего 82
Предоперационное обследование каждого пациента включало в себя методы изучения потенциальных донорских зон.
Всем больным, у которых предполагали использование аутотрансплантата на одной из магистральных артерий конечности (лучевая, передняя большеберцовая артерия и артерия тыла стопы) проводили тест на компенсацию кровообращения в дистальных отделах конечностей после исключения из кровотока одной из магистральных артерий. На верхней конечности применяли модифицированный тест Аллена, сочетающий пережатие на уровне лучезапястного сустава или дистальной трети предплечья и исследование гемодинамики с использованием современных ультразвуковых методов.
На нижней конечности нами был предложен диагностический тест, позволяющий на предоперационном этапе моделировать ситуацию после выключения из кровотока одной из магистральных артерий голени и оценить уровень компенсации кровообращения в дистальных отделах нижней конечности.
При осуществлении данного метода диагностики нижней конечности придают возвышенное положение, чтобы опорожнить венозное русло, накладывали на бедро пневматическую манжету и нагнетали в нее воздух, полностью перекрывая кровоток в конечности. Далее в проекции межмышечной борозды передней группы мышц голени пережимали передний большеберцовый сосудистый пучок в верхней трети голени и проксимальнее верхней границы удерживателей разгибателей голени, затем восстанавливали кровоснабжение конечности, при этом продолжая пережимать передний большеберцовый пучок.
На верхней конечности применяли модифицированный тест Аллена, сочетающий пережатие на уровне лучезапястного сустава или дистальной трети предплечья и исследование гемодинамики с использованием современных ультразвуковых методов.
На нижней конечности нами был предложен диагностический тест, позволяющий на предоперационном этапе моделировать ситуацию после выключения из кровотока одной из магистральных артерий голени и оценить уровень компенсации кровообращения в дистальных отделах нижней конечности.
При осуществлении данного метода диагностики нижней конечности придают возвышенное положение, чтобы опорожнить венозное русло, накладывали на бедро пневматическую манжету и нагнетали в нее воздух, полностью перекрывая кровоток в конечности. Далее в проекции межмышечной борозды передней группы мышц голени пережимали передний большеберцовый сосудистый пучок в верхней трети голени и проксимальнее верхней границы удерживателей разгибателей голени, затем восстанавливали кровоснабжение конечности, при этом продолжая пережимать передний большеберцовый пучок. Затем определяли гемодинамические характеристики по артериям стопы.
В результате получали модель, в которой кровоснабжения сегментов нижней конечности дистальнее колена осуществлялось только по 2 магистральным артериям из трех. В данной модели с выключением фрагмента передней большеберцовой артерии устраняется сброс по перетокам из бассейнов как задней большеберцовой, так и малоберцовой артерий. В норме после запуска кровообращения в течение короткого отрезка времени в конечности происходит перераспределение кровотока, и наблюдается его реверсивный характер по артерии тыла стопы как самой крупной ветви передней большеберцовой артерии. Это свидетельствует об адекватном сбросе крови через комуникантные ветви из бассейна подошвенной артериальной дуги. При достаточных значениях пиковой систолической скорости кровотока в артерии стопы тест можно считать отрицательным. Если же восстановления кровотока по артериям стопы не наступило или же его характеристики крайне неудовлетворительны, тест является положительным.
Затем определяли гемодинамические характеристики по артериям стопы.
В результате получали модель, в которой кровоснабжения сегментов нижней конечности дистальнее колена осуществлялось только по 2 магистральным артериям из трех. В данной модели с выключением фрагмента передней большеберцовой артерии устраняется сброс по перетокам из бассейнов как задней большеберцовой, так и малоберцовой артерий. В норме после запуска кровообращения в течение короткого отрезка времени в конечности происходит перераспределение кровотока, и наблюдается его реверсивный характер по артерии тыла стопы как самой крупной ветви передней большеберцовой артерии. Это свидетельствует об адекватном сбросе крови через комуникантные ветви из бассейна подошвенной артериальной дуги. При достаточных значениях пиковой систолической скорости кровотока в артерии стопы тест можно считать отрицательным. Если же восстановления кровотока по артериям стопы не наступило или же его характеристики крайне неудовлетворительны, тест является положительным. В этом случае использование аутотрансплантатов на основе передней большеберцовой артерии не представляется возможным.
Топографо-анатомические исследования
По нашему мнению источником васкуляризации надкостнично-кортикальных аутотрансплантатов могут стать магистральные артерии и их крупные ветви с разветвленной сетью в надкостнице. Исходя из этого утверждения нами были изучены следующие комплексы тканей: 1- метадиафиз лучевой кости; 2- латеральный надмыщелок плечевой кости; 3- медиальный надмыщелок плечевой кости; 4- латеральный край лопатки; 5- кортикальная пластинка ребра; 6- гребень подвздошной кости; 7- внутренний мыщелок бедренной кости; 8- метадиафиз большеберцовой кости; 9 -вторая плюсневая кость.
При селективной ангиографии и определении характера ветвления сосудистого дерева на рентгенограммах наиболее развитую сосудистую сеть находили в бассейне лучевой и передней большеберцовой артерий.
В бассейне лучевой артерии в дистальной трети предплечья определяли множество ветвей отходящих от лучевой артерии к надкостнице лучевой кости и окружающим мышцам, а также 2-3 крупные ветви первого порядка, идущие к внутренне-лучевой поверхности метадиафиза и отдающие ветви второго, третьего и четвертого порядка, анастомозирующие между собой.
В этом случае использование аутотрансплантатов на основе передней большеберцовой артерии не представляется возможным.
Топографо-анатомические исследования
По нашему мнению источником васкуляризации надкостнично-кортикальных аутотрансплантатов могут стать магистральные артерии и их крупные ветви с разветвленной сетью в надкостнице. Исходя из этого утверждения нами были изучены следующие комплексы тканей: 1- метадиафиз лучевой кости; 2- латеральный надмыщелок плечевой кости; 3- медиальный надмыщелок плечевой кости; 4- латеральный край лопатки; 5- кортикальная пластинка ребра; 6- гребень подвздошной кости; 7- внутренний мыщелок бедренной кости; 8- метадиафиз большеберцовой кости; 9 -вторая плюсневая кость.
При селективной ангиографии и определении характера ветвления сосудистого дерева на рентгенограммах наиболее развитую сосудистую сеть находили в бассейне лучевой и передней большеберцовой артерий.
В бассейне лучевой артерии в дистальной трети предплечья определяли множество ветвей отходящих от лучевой артерии к надкостнице лучевой кости и окружающим мышцам, а также 2-3 крупные ветви первого порядка, идущие к внутренне-лучевой поверхности метадиафиза и отдающие ветви второго, третьего и четвертого порядка, анастомозирующие между собой.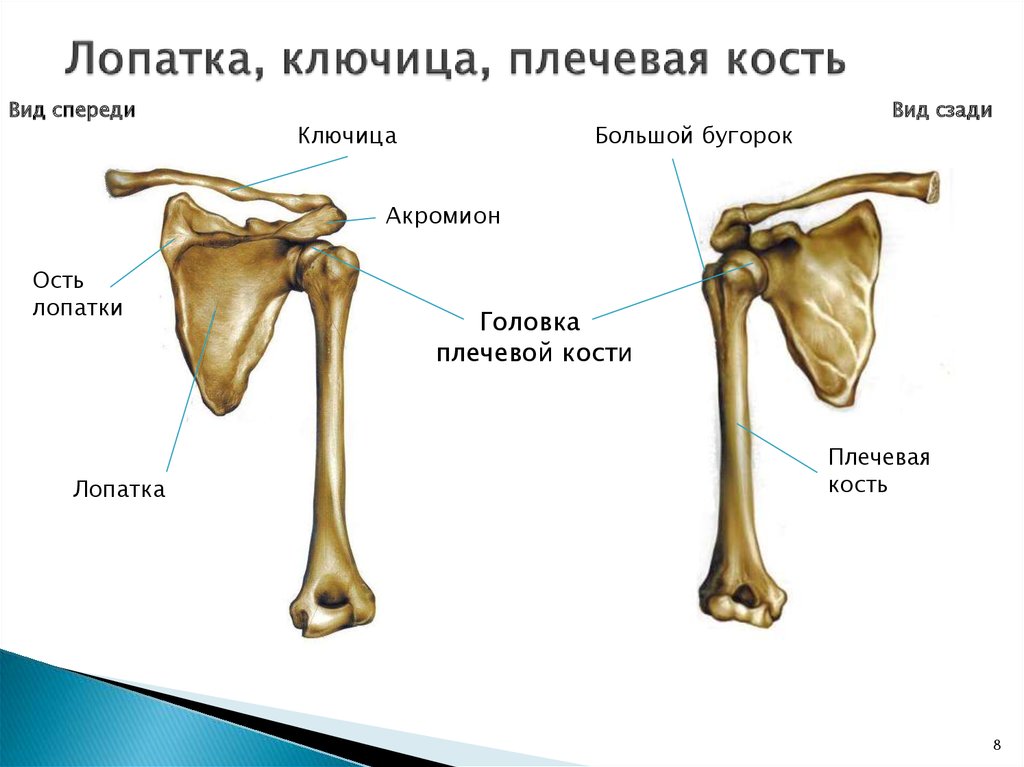 На голени в бассейне переднего большеберцового сосудистого пучка выявили обширную сеть сосудов надкостницы в области дистального эпиметафиза и метадиафиза большеберцовой кости. Четко визуализировали до 7 ветвей первого порядка, идущие медиально и латерально по поверхности кости. Также в дистальной трети голени определяли крупные мышечные ветви.
Также развитую сосудистую сеть находили в бассейне глубокой, огибающей подвздошную кость артерии. Определяли обилие контрастированных мышечных ветвей, и сосудов, располагающихся параллельно внутренней поверхности крыла подвздошной кости, отдающих ветви к надкостнице и анастомозирующих с мышечными ветвями. Наиболее крупной является восходящая ветвь глубокой огибающей подвздошную кость артерии.
Наименее развитая сосудистая сеть выявлена в бассейне нисходящей артерии колена.
На ангиограммах прослеживали единичную артериальную ветвь, в 2 наблюдениях делившуюся дистально на 2 сосуда, подходящую к поверхности внутреннего мыщелка бедренной кости.
На голени в бассейне переднего большеберцового сосудистого пучка выявили обширную сеть сосудов надкостницы в области дистального эпиметафиза и метадиафиза большеберцовой кости. Четко визуализировали до 7 ветвей первого порядка, идущие медиально и латерально по поверхности кости. Также в дистальной трети голени определяли крупные мышечные ветви.
Также развитую сосудистую сеть находили в бассейне глубокой, огибающей подвздошную кость артерии. Определяли обилие контрастированных мышечных ветвей, и сосудов, располагающихся параллельно внутренней поверхности крыла подвздошной кости, отдающих ветви к надкостнице и анастомозирующих с мышечными ветвями. Наиболее крупной является восходящая ветвь глубокой огибающей подвздошную кость артерии.
Наименее развитая сосудистая сеть выявлена в бассейне нисходящей артерии колена.
На ангиограммах прослеживали единичную артериальную ветвь, в 2 наблюдениях делившуюся дистально на 2 сосуда, подходящую к поверхности внутреннего мыщелка бедренной кости. На данном этапе работы стало ясно, что большее количество ветвей первого порядка в донорской области дистального метадиафиза передней большеберцовой кости позволяет говорить о более интенсивной васкуляризации данной зоны и большем потенциале для осуществлении поддержки остеогенеза. Во всех случаях анатомия сосудов была постоянна и принцип ветвления не нарушался.
При выполнения заливки сосудистого русла раствором желатина было получено подтверждение характера ветвления питающих сосудов изучаемых донорских областей. Так, лучевая артерия отдавала от 2 до 3 крупных перфорантных ветвей первого порядка, идущих в толщу дистальной порции длинного сгибателя первого пальца и квадратного пронатора в проекции метадиафиза лучевой кости. Ветви 2 и 3 порядка густой сетью проникали в обе мышцы и кровоснабжали также сухожилия плечелучевой мышцы и лучевого сгибателя запястья, что позволило включать паратенон сухожилий данных мышц и модифицировать метод забора лучевого аутотрансплантата.
В зоне дистального метадиафиза большеберцовой кости на протяжении всей нижней трети кости передняя большеберцовая артерия отдает от 4 до 7 ветвей первого порядка, ветвящихся в надкостнице (ветви 2 и 3 порядка), причем большинство из них (78%) идут в медиальном и проксимальном направлениях, покрывая большую площадь кости в зонах метафиза и метадиафиза.
На данном этапе работы стало ясно, что большее количество ветвей первого порядка в донорской области дистального метадиафиза передней большеберцовой кости позволяет говорить о более интенсивной васкуляризации данной зоны и большем потенциале для осуществлении поддержки остеогенеза. Во всех случаях анатомия сосудов была постоянна и принцип ветвления не нарушался.
При выполнения заливки сосудистого русла раствором желатина было получено подтверждение характера ветвления питающих сосудов изучаемых донорских областей. Так, лучевая артерия отдавала от 2 до 3 крупных перфорантных ветвей первого порядка, идущих в толщу дистальной порции длинного сгибателя первого пальца и квадратного пронатора в проекции метадиафиза лучевой кости. Ветви 2 и 3 порядка густой сетью проникали в обе мышцы и кровоснабжали также сухожилия плечелучевой мышцы и лучевого сгибателя запястья, что позволило включать паратенон сухожилий данных мышц и модифицировать метод забора лучевого аутотрансплантата.
В зоне дистального метадиафиза большеберцовой кости на протяжении всей нижней трети кости передняя большеберцовая артерия отдает от 4 до 7 ветвей первого порядка, ветвящихся в надкостнице (ветви 2 и 3 порядка), причем большинство из них (78%) идут в медиальном и проксимальном направлениях, покрывая большую площадь кости в зонах метафиза и метадиафиза.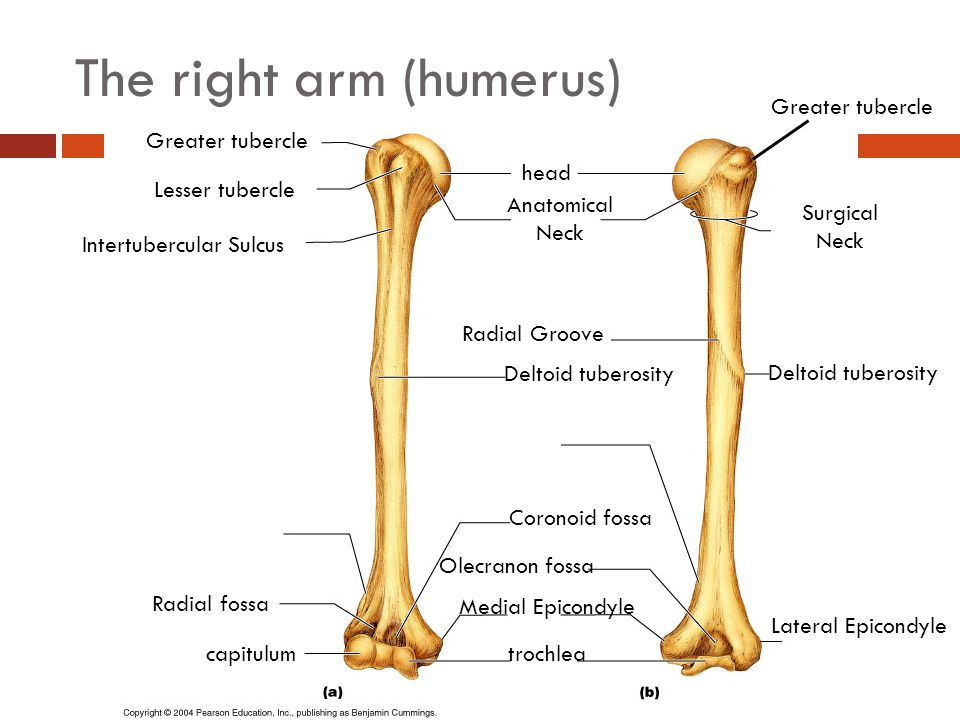 Таким образом, область забора надкостнично-кортикальной пластики можно расширить более медиально до линии прикрепления фасции голени к большеберцовой кости.
Постоянная медиальная ветвь торакодорзальной артерии отдает от 1 до 4 ветвей первого порядка диаметром от 0,5 до 1,0 мм ветвей, кровоснабжающих переднюю зубчатую и большую круглую мышцы и, прободая их, подходят к углу и латеральному краю лопатки, разветвляясь на ветви второго и третьего порядка.
Глубокая артерия, огибающая подвздошную кость отдает от 3 до 7 ветвей первого порядка из которых самой крупной и постоянной является восходящая ветвь.
Практически одинаковое количество вервей первого порядка отдают артерия тыла стопы и глубокая артерия плеча.
Нисходящая артерия колена является конечной ветвью и отдает ветви только в своей проксимальной части, которые не участвуют в кровоснабжении кости.
Таким образом, наибольшее число ветвей 1ого порядка выявлено у передней большеберцовой артерии в зоне дистального метадиафиза большеберцовой кости и у артерии, огибающей подвздошную кость и превысило число ветвей лучевой артерии в аналогичной зоне более, чем в 2 раза.
Таким образом, область забора надкостнично-кортикальной пластики можно расширить более медиально до линии прикрепления фасции голени к большеберцовой кости.
Постоянная медиальная ветвь торакодорзальной артерии отдает от 1 до 4 ветвей первого порядка диаметром от 0,5 до 1,0 мм ветвей, кровоснабжающих переднюю зубчатую и большую круглую мышцы и, прободая их, подходят к углу и латеральному краю лопатки, разветвляясь на ветви второго и третьего порядка.
Глубокая артерия, огибающая подвздошную кость отдает от 3 до 7 ветвей первого порядка из которых самой крупной и постоянной является восходящая ветвь.
Практически одинаковое количество вервей первого порядка отдают артерия тыла стопы и глубокая артерия плеча.
Нисходящая артерия колена является конечной ветвью и отдает ветви только в своей проксимальной части, которые не участвуют в кровоснабжении кости.
Таким образом, наибольшее число ветвей 1ого порядка выявлено у передней большеберцовой артерии в зоне дистального метадиафиза большеберцовой кости и у артерии, огибающей подвздошную кость и превысило число ветвей лучевой артерии в аналогичной зоне более, чем в 2 раза.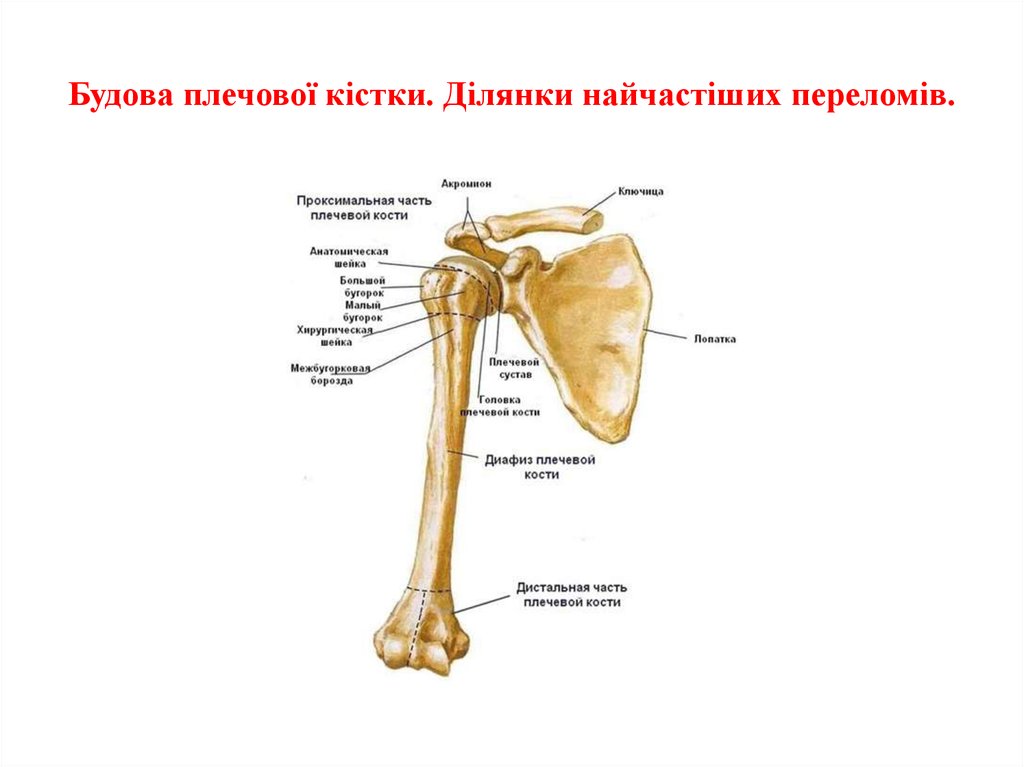 При этом обилие мышечных ветвей питающего сосуда позволяет в случае переднего большеберцового, реберного надкостнично-кортикального аутотрансплантатов, угла лопатки и гребня подвздошной кости рассматривать различные варианты включения в забираемый комплекс массива окружающих мышц. При заборе других надкостнично-кортикальных аутотрансплантатов такой возможности нет (табл.10).
По результатам проведения прокрашивания метиленовым синим внутрикостных сосудов в исследуемых зонах выявлено, что сеть сосудов надкостницы большеберцовой кости имела наиболее разветвленный характер и визуализировалась от суставной щели голеностопного сустава до границы средней и нижней трети голени. Ширина этой зоны составила все пространство между линиями прикрепления фасции голени и передней межмышечной перегородкой к большеберцовой кости.
Таблица 11.
Количество ветвей первого порядка питающей артерии соответствующей донорской области.
Донорская область Количество ветвей первого порядка
Метадиафиз большеберцовой кости 4-7
Метадиафиз лучевой кости 2-3
Угол и латеральный край лопатки 1-4
Гребень подвздошной кости 3-7
Латеральный мыщелок плечевой кости 3-5
Надмыщелок бедренной кости 1-2
Диафиз II плюсневой кости 3-5
Медиальный надмыщелок плечевой кости 3-5
7 ребро 4-6
Подсчет перфорирующих сосудов проводили после выделениея фрагмента кортикальной пластинки и освобождения ее от губчатой кости.
При этом обилие мышечных ветвей питающего сосуда позволяет в случае переднего большеберцового, реберного надкостнично-кортикального аутотрансплантатов, угла лопатки и гребня подвздошной кости рассматривать различные варианты включения в забираемый комплекс массива окружающих мышц. При заборе других надкостнично-кортикальных аутотрансплантатов такой возможности нет (табл.10).
По результатам проведения прокрашивания метиленовым синим внутрикостных сосудов в исследуемых зонах выявлено, что сеть сосудов надкостницы большеберцовой кости имела наиболее разветвленный характер и визуализировалась от суставной щели голеностопного сустава до границы средней и нижней трети голени. Ширина этой зоны составила все пространство между линиями прикрепления фасции голени и передней межмышечной перегородкой к большеберцовой кости.
Таблица 11.
Количество ветвей первого порядка питающей артерии соответствующей донорской области.
Донорская область Количество ветвей первого порядка
Метадиафиз большеберцовой кости 4-7
Метадиафиз лучевой кости 2-3
Угол и латеральный край лопатки 1-4
Гребень подвздошной кости 3-7
Латеральный мыщелок плечевой кости 3-5
Надмыщелок бедренной кости 1-2
Диафиз II плюсневой кости 3-5
Медиальный надмыщелок плечевой кости 3-5
7 ребро 4-6
Подсчет перфорирующих сосудов проводили после выделениея фрагмента кортикальной пластинки и освобождения ее от губчатой кости.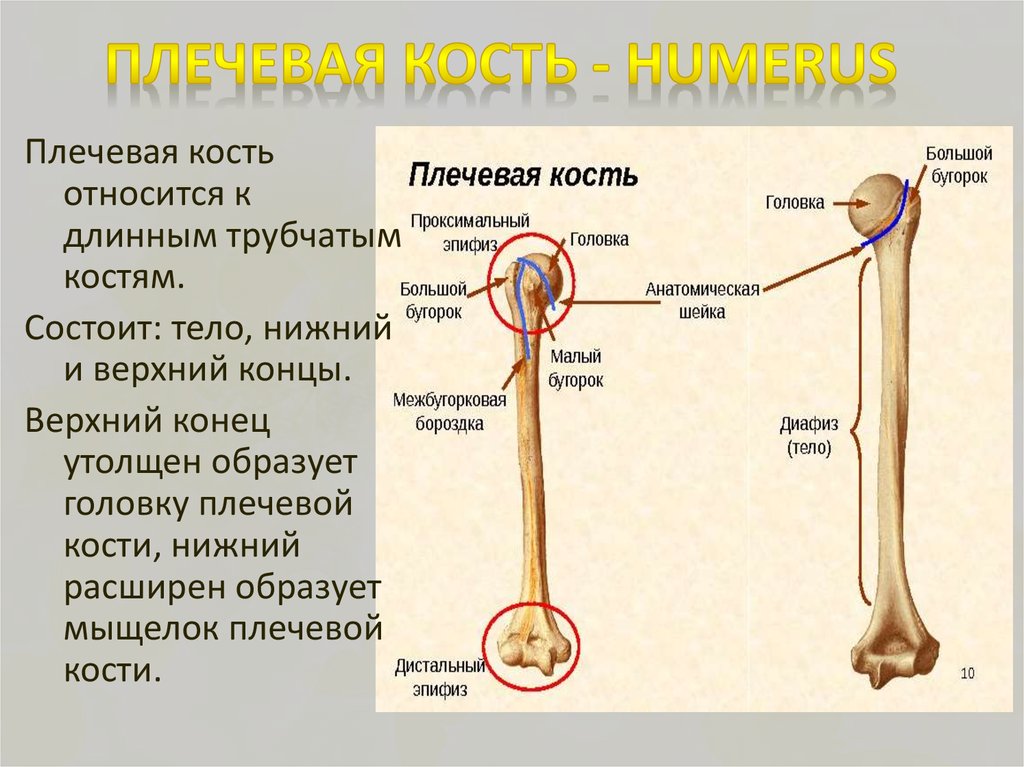 Полученные данные позволяют судить о том, что количество прокрашенных сосудов на единицу площади сопоставимы, без достоверных различий. Что можно связать с единством принципа строения системы гаверсовых и фолькмановских каналов у трубчатых костей.
Концентрация на единицу площади прокрашенных внутрикостных сосудов значительно снижалось в зонах диафизов исследуемых костей. На этом основании область забора ограничивали метафизарной и метадиафизарной зонами. Более того, в этих зонах кортикальная пластинка имеет минимальную толщину. Это, безусловно, является факторами, определяющими степень выраженности поддержки остеогенеза надкостнично-кортикальными аутотрансплантатами (табл.12).
Таблица 12.
Количество прокрашенных сосудов на единицу площади (см2).
Анатомическая область Количество перфорантных сосудов
Со стороны надкостницы Со стороны губчатой кости
Дистальный метадиафиз лучевой кости 3,6 3,4
Дистальный метадиафиз большеберцовой кости 3,8 4,2
Угол и латеральный край лопатки 3,1 4,3
Гребень подвздошной кости 3,6 3,1
Мыщелок плечевой кости 3,2 3,8
Надмыщелок бедренной кости 0,1 0,1
Метадиафиз II плюсневой кости 2,1 4,8
Эти данные, а также размер зоны ветвления сосудов надкостницы позволяли определить границы забираемой надкостнично-кортикальной и костной порций.
Полученные данные позволяют судить о том, что количество прокрашенных сосудов на единицу площади сопоставимы, без достоверных различий. Что можно связать с единством принципа строения системы гаверсовых и фолькмановских каналов у трубчатых костей.
Концентрация на единицу площади прокрашенных внутрикостных сосудов значительно снижалось в зонах диафизов исследуемых костей. На этом основании область забора ограничивали метафизарной и метадиафизарной зонами. Более того, в этих зонах кортикальная пластинка имеет минимальную толщину. Это, безусловно, является факторами, определяющими степень выраженности поддержки остеогенеза надкостнично-кортикальными аутотрансплантатами (табл.12).
Таблица 12.
Количество прокрашенных сосудов на единицу площади (см2).
Анатомическая область Количество перфорантных сосудов
Со стороны надкостницы Со стороны губчатой кости
Дистальный метадиафиз лучевой кости 3,6 3,4
Дистальный метадиафиз большеберцовой кости 3,8 4,2
Угол и латеральный край лопатки 3,1 4,3
Гребень подвздошной кости 3,6 3,1
Мыщелок плечевой кости 3,2 3,8
Надмыщелок бедренной кости 0,1 0,1
Метадиафиз II плюсневой кости 2,1 4,8
Эти данные, а также размер зоны ветвления сосудов надкостницы позволяли определить границы забираемой надкостнично-кортикальной и костной порций. Наибольшими размерами костной и надкостнично-кортикальной порцией обладает гребень подвздошной кости до 18 на 6 см. При условии включения в состав аутотрансплантата и позвздошно-поясничной артерии граница забора может увеличиться до крестцово-подвздошного сочлениения Известно, что большеберцовая кость – толстая трубчатая кость, принимающая участие в формировании скелета нижней конечности. Имеет треугольное сечение и значительную толщину компактного слоя. Благодаря такой форме кость имеет 3 ребра жесткости, что делает ее особенно прочной и устойчивой к боковым и осевым нагрузкам. В области дистального метадиафиза по передней поверхности кости имеется плоская площадка, в зоне которой и забирается кортикальная порция аутотрансплантата. Эта зона представляет интерес в свете возможности забора больших по площади надкостнично-кортикальных аутотрансплантатов без нарушения прочностных свойств кости, т.к. в ходе забора аутотрансплантата не затрагиваются ребра жесткости. Более того, поскольку размер кортикальной пластинки может достигать 12х3см, возможен вариант аутотрансплантата, состоящего из двух фрагментов на отдельных ветвях передней большеберцовой артерии 1ого порядка.
Наибольшими размерами костной и надкостнично-кортикальной порцией обладает гребень подвздошной кости до 18 на 6 см. При условии включения в состав аутотрансплантата и позвздошно-поясничной артерии граница забора может увеличиться до крестцово-подвздошного сочлениения Известно, что большеберцовая кость – толстая трубчатая кость, принимающая участие в формировании скелета нижней конечности. Имеет треугольное сечение и значительную толщину компактного слоя. Благодаря такой форме кость имеет 3 ребра жесткости, что делает ее особенно прочной и устойчивой к боковым и осевым нагрузкам. В области дистального метадиафиза по передней поверхности кости имеется плоская площадка, в зоне которой и забирается кортикальная порция аутотрансплантата. Эта зона представляет интерес в свете возможности забора больших по площади надкостнично-кортикальных аутотрансплантатов без нарушения прочностных свойств кости, т.к. в ходе забора аутотрансплантата не затрагиваются ребра жесткости. Более того, поскольку размер кортикальной пластинки может достигать 12х3см, возможен вариант аутотрансплантата, состоящего из двух фрагментов на отдельных ветвях передней большеберцовой артерии 1ого порядка. Это позволяет сформировать 2 надкостнично-кортикальных аутотрансплантата на одной сосудистой ножке.
Размеры лучевого надкостнично-кортикального аутотрансплантата едва ли могут превышать 6х1,5 см, что соответствует проекции метафиза лучевой кости с мышечной муфтой квадратного пронатора и длинного сгибателя 1ого пальца.
Наименьшими размерами костной порции обладает аутотрансплантат II плюсневой кости. Его линейные размеры уступают в 3 раза аутотрансплантату из гребня подвздошной кости, а площадь в 12раз (таблица 13).
Таблица 13.
Максимальные линейные размеры надкостнично-кортикальных порций аутотрансплантатов.
Аутотрансплантат Размеры фрагмента кортикальной пластинки (в см)
Лучевой 6х1,5
Передний большеберцовый 12х3
Угол и латеральный край лопатки 8 х 2
Гребень подвздошной кости 16 х 6
Надмыщелок плечевой кости 5 х 1,5
Мыщелок бедренной кости 7 х 5
Метадиафиз II плюсневой кости 5 х 1,5
Однако в последнее время изменилось отношение к выделению приоритетных характеристик надкостнично-кортикального аутотрансплантата, позволяющие его уверенно использовать для поддержки остеогенеза в реконструктивных операциях.
Это позволяет сформировать 2 надкостнично-кортикальных аутотрансплантата на одной сосудистой ножке.
Размеры лучевого надкостнично-кортикального аутотрансплантата едва ли могут превышать 6х1,5 см, что соответствует проекции метафиза лучевой кости с мышечной муфтой квадратного пронатора и длинного сгибателя 1ого пальца.
Наименьшими размерами костной порции обладает аутотрансплантат II плюсневой кости. Его линейные размеры уступают в 3 раза аутотрансплантату из гребня подвздошной кости, а площадь в 12раз (таблица 13).
Таблица 13.
Максимальные линейные размеры надкостнично-кортикальных порций аутотрансплантатов.
Аутотрансплантат Размеры фрагмента кортикальной пластинки (в см)
Лучевой 6х1,5
Передний большеберцовый 12х3
Угол и латеральный край лопатки 8 х 2
Гребень подвздошной кости 16 х 6
Надмыщелок плечевой кости 5 х 1,5
Мыщелок бедренной кости 7 х 5
Метадиафиз II плюсневой кости 5 х 1,5
Однако в последнее время изменилось отношение к выделению приоритетных характеристик надкостнично-кортикального аутотрансплантата, позволяющие его уверенно использовать для поддержки остеогенеза в реконструктивных операциях. Важно оценивать, в первую очередь, характер гемодинамики питающего сосуда донорской области, количество ветвей первого порядка, степень разветвленности сосудистой сети надкостницы и, наконец, длину сосудистой ножки.
В большинстве исследований диаметр и гемодинамические характеристики сосудов в симметричных зонах были практически одинаковыми (табл 14).
Таблица 14.
Диаметры питающих сосудов и данные пиковой систолической скорости кровотока по ним.
Артерия Диаметр
(мм) Пиковая систолическая скорость кровотока (см/сек)
Лучевая 2,25±0,05 53,27±2,73
Огибающая лопатку 1,77±0,04 31,6±1,29
Нисходящая артерия колена 2,43±0,09 39,83±1,18
Тыла стопы 1,99±0,05 36,64±2,6
Глубокая огибающая подвздошную кость 1,83±0,04 28,9±1,44
Передняя большеберцовая 2,12±0,26 58,7±8,6
Задняя лучевая коллатеральная 1,5±0,10 16,2±0,8
Верхняя локтевая коллатеральная артерия 1,6±0,12 41,13±2,3
Диаметр лучевой артерии при физиологическом наполнении кровью в донорской зоне был в пределах от 1,8 мм до 2,8 мм, в среднем 2,25±0,05 мм; диаметр артерии огибающей лопатку – от 1,3 мм до 2,1 мм, в среднем 1,77±0,04 мм; диаметр нисходящей артерии колена – от 1,8 мм до 3,5 мм, в среднем 2,43±0,09 мм; диаметр артерии тыла стопы – от 1,5 мм до 2,4 мм, в среднем 1,99±0,05 мм; диаметр глубокой огибающей повздошную кость артерии – от 1,4 мм до 2,1 мм, в среднем 1,83±0,04 мм.
Важно оценивать, в первую очередь, характер гемодинамики питающего сосуда донорской области, количество ветвей первого порядка, степень разветвленности сосудистой сети надкостницы и, наконец, длину сосудистой ножки.
В большинстве исследований диаметр и гемодинамические характеристики сосудов в симметричных зонах были практически одинаковыми (табл 14).
Таблица 14.
Диаметры питающих сосудов и данные пиковой систолической скорости кровотока по ним.
Артерия Диаметр
(мм) Пиковая систолическая скорость кровотока (см/сек)
Лучевая 2,25±0,05 53,27±2,73
Огибающая лопатку 1,77±0,04 31,6±1,29
Нисходящая артерия колена 2,43±0,09 39,83±1,18
Тыла стопы 1,99±0,05 36,64±2,6
Глубокая огибающая подвздошную кость 1,83±0,04 28,9±1,44
Передняя большеберцовая 2,12±0,26 58,7±8,6
Задняя лучевая коллатеральная 1,5±0,10 16,2±0,8
Верхняя локтевая коллатеральная артерия 1,6±0,12 41,13±2,3
Диаметр лучевой артерии при физиологическом наполнении кровью в донорской зоне был в пределах от 1,8 мм до 2,8 мм, в среднем 2,25±0,05 мм; диаметр артерии огибающей лопатку – от 1,3 мм до 2,1 мм, в среднем 1,77±0,04 мм; диаметр нисходящей артерии колена – от 1,8 мм до 3,5 мм, в среднем 2,43±0,09 мм; диаметр артерии тыла стопы – от 1,5 мм до 2,4 мм, в среднем 1,99±0,05 мм; диаметр глубокой огибающей повздошную кость артерии – от 1,4 мм до 2,1 мм, в среднем 1,83±0,04 мм. Линейная скорость кровотока при физиологическом наполнении кровью донорской зоны в лучевой артерии была в пределах от 37 см/сек до 88 см/сек, в среднем 53,27±2,73 см/сек; в артерии огибающей лопатку – от 24 см/сек до 48 см/сек, в среднем 31,6±1,29 см/сек; в нисходящей артерии колена — от 27 см/сек до 49 см/сек, в среднем 39,83±1,18 см/сек; в артерии тыла стопы — от 13 см/сек до 61 см/сек, в среднем 36,64±2,6 см/сек; в глубокой огибающей повздошную кость артерии — от 15 см/сек до 41 см/сек, в среднем 28,9±1,44 см/сек.
Лучевая, передняя большеберцовая артерии и нисходящая артерия колена имеют сопоставимые диаметры, однако, пиковая систолическая скорость кровотока достоверно выше по передней большеберцовой. Безусловно, это является преимуществом аутотрансплантата нижней конечности.
Таким образом, показатели кровотока отображают потенциал, заложенный в надкостнично-кортикальном аутотрансплантате и позволяют прогнозировать степень васкуляризации самого аутотрансплантата в реципиентной области.
Линейная скорость кровотока при физиологическом наполнении кровью донорской зоны в лучевой артерии была в пределах от 37 см/сек до 88 см/сек, в среднем 53,27±2,73 см/сек; в артерии огибающей лопатку – от 24 см/сек до 48 см/сек, в среднем 31,6±1,29 см/сек; в нисходящей артерии колена — от 27 см/сек до 49 см/сек, в среднем 39,83±1,18 см/сек; в артерии тыла стопы — от 13 см/сек до 61 см/сек, в среднем 36,64±2,6 см/сек; в глубокой огибающей повздошную кость артерии — от 15 см/сек до 41 см/сек, в среднем 28,9±1,44 см/сек.
Лучевая, передняя большеберцовая артерии и нисходящая артерия колена имеют сопоставимые диаметры, однако, пиковая систолическая скорость кровотока достоверно выше по передней большеберцовой. Безусловно, это является преимуществом аутотрансплантата нижней конечности.
Таким образом, показатели кровотока отображают потенциал, заложенный в надкостнично-кортикальном аутотрансплантате и позволяют прогнозировать степень васкуляризации самого аутотрансплантата в реципиентной области. Наибольшей длинной сосудистой ножки обладает большеберцовый надкостнично-кортикальный аутотрансплантат – до 24 см или 78% от длинны голени. Но при условии забора фрагмента кортикальной пластинки II плюсневой кости на передней большеберцовой артерии и как ее конечной ветви артерии тыла стопы, длинна сосудистой ножки может составлять до 32 см (табл. 15).
Сосудистая ножка лучевого аутотранспалнтата имеет длину в среднем 17 см (65% от длины предплечья), и в большинстве случаев может быть выделена на всем протяжении сегмента конечности. Правда, по данным литературы в 4% наблюдений лучевая артерия отходит от плечевой на 3-5см ниже линии локтевого сустава, однако в нашем исследовании такая анатомическая особенность не встречалась.
Задняя лучевая коллатеральная артерия имеет протяженность в среднем 8 см, но удлинить сосудистую ножку до 14см возможно за счет глубокой артерии плеча.
Таблица 15.Длины питающих сосудов донорских областей.
Питающий сосуд Длина сосудистой ножки в см (% от длины сегмента конечности)
Лучевая артерия 19±1,8 (71-76%)
Артерия огибающая лопатку (как одна из конечных ветвей торако-дорсальной артерии) 13±1,4
Нисходящая артерия колена 9±2,3 (23-26%)
Артерия тыла стопы 5±0,9 (16-21%)
Глубокая артерия, огибающая подвздошную кость 6±2,4
Передняя большеберцовая артерия 24±3,9 (74-78%)
Задняя лучевая коллатеральная артерия [с глубокой артерией плеча] 8±1,2 30-35% [14±1,5 (50-53%)]
Торако-дорсальная артерия с угловой ветвью 14±3,1
Самой короткой сосудистой ножкой обладает надкостнично-кортикальный аутотрнасплантат гребня подвздошной кости, в среднем 6 см.
Наибольшей длинной сосудистой ножки обладает большеберцовый надкостнично-кортикальный аутотрансплантат – до 24 см или 78% от длинны голени. Но при условии забора фрагмента кортикальной пластинки II плюсневой кости на передней большеберцовой артерии и как ее конечной ветви артерии тыла стопы, длинна сосудистой ножки может составлять до 32 см (табл. 15).
Сосудистая ножка лучевого аутотранспалнтата имеет длину в среднем 17 см (65% от длины предплечья), и в большинстве случаев может быть выделена на всем протяжении сегмента конечности. Правда, по данным литературы в 4% наблюдений лучевая артерия отходит от плечевой на 3-5см ниже линии локтевого сустава, однако в нашем исследовании такая анатомическая особенность не встречалась.
Задняя лучевая коллатеральная артерия имеет протяженность в среднем 8 см, но удлинить сосудистую ножку до 14см возможно за счет глубокой артерии плеча.
Таблица 15.Длины питающих сосудов донорских областей.
Питающий сосуд Длина сосудистой ножки в см (% от длины сегмента конечности)
Лучевая артерия 19±1,8 (71-76%)
Артерия огибающая лопатку (как одна из конечных ветвей торако-дорсальной артерии) 13±1,4
Нисходящая артерия колена 9±2,3 (23-26%)
Артерия тыла стопы 5±0,9 (16-21%)
Глубокая артерия, огибающая подвздошную кость 6±2,4
Передняя большеберцовая артерия 24±3,9 (74-78%)
Задняя лучевая коллатеральная артерия [с глубокой артерией плеча] 8±1,2 30-35% [14±1,5 (50-53%)]
Торако-дорсальная артерия с угловой ветвью 14±3,1
Самой короткой сосудистой ножкой обладает надкостнично-кортикальный аутотрнасплантат гребня подвздошной кости, в среднем 6 см.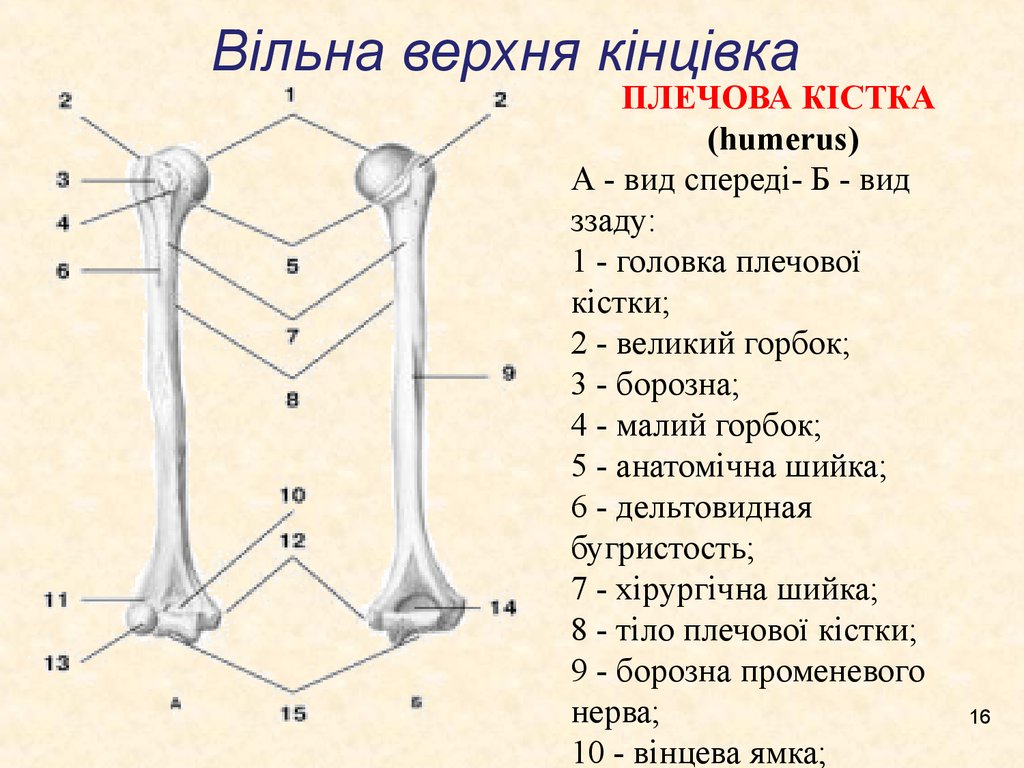 Таким образом, надкостнично-кортикальный аутотрансплантат на основе переднего большеберцового сосудистого пучка обладает достоверно большей по длине сосудистой ножкой
Переходя к анализу возможности применения изучаемых аутотрансплантатов в качестве ротируемых, следует отметить, что в клинической практике это свойство аутотрансплантата позволяет снизить временные затраты на операцию, т.к. отпадает необходимость проведения микроэтапа. Это в свою очередь делает этот метод более доступным в силу того, что он не требует специальной подготовки хирурга и операционной, а также наличие микроскопа и микроинструментария. При этом реабилитационный период сокращается, пациенту не требуется длительный пастельный режим и введение антикоагулянтов.
Обладая самыми длинными сосудистыми ножками лучевой, передний большеберцовый, надкостнично-кортикальный аутотрансплантаты, фрагмент лопатки, фрагмент II плюсневой кости позволяют ротировать данные аутотрансплантаты в смежные анатомические области.
Таким образом, надкостнично-кортикальный аутотрансплантат на основе переднего большеберцового сосудистого пучка обладает достоверно большей по длине сосудистой ножкой
Переходя к анализу возможности применения изучаемых аутотрансплантатов в качестве ротируемых, следует отметить, что в клинической практике это свойство аутотрансплантата позволяет снизить временные затраты на операцию, т.к. отпадает необходимость проведения микроэтапа. Это в свою очередь делает этот метод более доступным в силу того, что он не требует специальной подготовки хирурга и операционной, а также наличие микроскопа и микроинструментария. При этом реабилитационный период сокращается, пациенту не требуется длительный пастельный режим и введение антикоагулянтов.
Обладая самыми длинными сосудистыми ножками лучевой, передний большеберцовый, надкостнично-кортикальный аутотрансплантаты, фрагмент лопатки, фрагмент II плюсневой кости позволяют ротировать данные аутотрансплантаты в смежные анатомические области. Дуга ротации лучевого надкостнично-кортикального аутотрансплантата на лучевой артерии достигает границы средней и верхней трети плеча.
Дуга ротации надкостнично-кортикального аутотрансплантата большеберцовой кости на сосудистой ножке достигает уровня границы средней и нижней трети бедра.
Фрагмент II плюсневой кости на большеберцовой артерии и ее конечной ветви артерии тыла стопы можно ротировать до уровня средней трети бедра.
Угол лопатки на торакодорзальной артерии возможно ротировать до уровня верхней трети плеча.
Длина сосудистой ножки остальных изученных надкостнично-кортикальных аутотрансплантатов позволяет производить ротацию только в пределах донорского сегмента.
Таким образом, анализ собственных данных позволяет отдать предпочтение свободному реваскуляризируемому надкостнично-кортикальному аутотрансплантату лучевой кости и переднему большеберцовому надкостнично-кортикальному аутотрансплантату. Большой диаметр питающей артерии и пиковая систолическая скорость кровотока в нисходящей артерии колена нивелировались наличием единичных артериальных ветвей к внутреннему мыщелку бедренной кости с 1–2 сосудами, прободающими кортикальную пластинку, что свидетельствует о наибольшем сбросе артериальной крови в кожно-фасциальную составляющую донорской области.
Дуга ротации лучевого надкостнично-кортикального аутотрансплантата на лучевой артерии достигает границы средней и верхней трети плеча.
Дуга ротации надкостнично-кортикального аутотрансплантата большеберцовой кости на сосудистой ножке достигает уровня границы средней и нижней трети бедра.
Фрагмент II плюсневой кости на большеберцовой артерии и ее конечной ветви артерии тыла стопы можно ротировать до уровня средней трети бедра.
Угол лопатки на торакодорзальной артерии возможно ротировать до уровня верхней трети плеча.
Длина сосудистой ножки остальных изученных надкостнично-кортикальных аутотрансплантатов позволяет производить ротацию только в пределах донорского сегмента.
Таким образом, анализ собственных данных позволяет отдать предпочтение свободному реваскуляризируемому надкостнично-кортикальному аутотрансплантату лучевой кости и переднему большеберцовому надкостнично-кортикальному аутотрансплантату. Большой диаметр питающей артерии и пиковая систолическая скорость кровотока в нисходящей артерии колена нивелировались наличием единичных артериальных ветвей к внутреннему мыщелку бедренной кости с 1–2 сосудами, прободающими кортикальную пластинку, что свидетельствует о наибольшем сбросе артериальной крови в кожно-фасциальную составляющую донорской области. В 2 анатомических исследованиях диаметр нисходящей артерии колена был 0,7 мм, что делает использование данного аутотрансплантата нецелесообразным для остеогенетической поддержки.
На основе проведенного топографо-анатомического исследования мы систематизировали аутотрансплантаты для более удобного их клинического применения.
Прежде всего все НКАТ были разделены по анатомическому типу строения на кортикальные и губчатые (схема 1).
Схема1
Распределение надкостнично-кортикальных аутотрансплантатов по анатомическому типу.
К компактным аутотрансплантатам относим аутотрансплантаты, сформированные на уровне диафиза (лучевой, передний большеюерцовый, аутотрансплантат II плюсневой кости). К смешанным – на уровне метадиафиза длинных трубчатых костей (лучевой, латеральный и медиальный надмыщелки плечевой кости).
Лучевой надкостнично-кортикальный аутотрансплантат при условии забора его по классической методике является компактным, однако при заборе по разработанной нами методике из эпиметафиза лучевой кости данный аутотрансплантат является губчатым, а при заборе кортикальной пластинки значительной протяженности — смешанным.
В 2 анатомических исследованиях диаметр нисходящей артерии колена был 0,7 мм, что делает использование данного аутотрансплантата нецелесообразным для остеогенетической поддержки.
На основе проведенного топографо-анатомического исследования мы систематизировали аутотрансплантаты для более удобного их клинического применения.
Прежде всего все НКАТ были разделены по анатомическому типу строения на кортикальные и губчатые (схема 1).
Схема1
Распределение надкостнично-кортикальных аутотрансплантатов по анатомическому типу.
К компактным аутотрансплантатам относим аутотрансплантаты, сформированные на уровне диафиза (лучевой, передний большеюерцовый, аутотрансплантат II плюсневой кости). К смешанным – на уровне метадиафиза длинных трубчатых костей (лучевой, латеральный и медиальный надмыщелки плечевой кости).
Лучевой надкостнично-кортикальный аутотрансплантат при условии забора его по классической методике является компактным, однако при заборе по разработанной нами методике из эпиметафиза лучевой кости данный аутотрансплантат является губчатым, а при заборе кортикальной пластинки значительной протяженности — смешанным. Схема 2.
Возможности ротации надкостнично-кортикальных аутотрансплантатов в зависимости от длины сосудистой ножки.
Вторым важным критерием является длина сосудистой ножки и возможность ротации аутотрансплантата в смежные с донорской области на проксимальной сосудистой ножке (схема 2). На дистальной сосудистой ножке могут быть ротированы передний большеберцовый и лучевой аутотрансплантаты.
Клинические исследования
Перед клиническими исследованиями стояли следующие задачи:
1. Оценить возможности применения различных васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей.
2. Разработать варианты клинического применения васкуляризированных надкостнично-кортикальных аутотрансплантатов в различных реципиентных областях.
Проанализирован опыт использования 83 васкуляризированных надкостнично-кортикальных аутотрансплантатов у 82 больных с последствиями травм длинных трубчатых костей и крупных суставов.
Схема 2.
Возможности ротации надкостнично-кортикальных аутотрансплантатов в зависимости от длины сосудистой ножки.
Вторым важным критерием является длина сосудистой ножки и возможность ротации аутотрансплантата в смежные с донорской области на проксимальной сосудистой ножке (схема 2). На дистальной сосудистой ножке могут быть ротированы передний большеберцовый и лучевой аутотрансплантаты.
Клинические исследования
Перед клиническими исследованиями стояли следующие задачи:
1. Оценить возможности применения различных васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей.
2. Разработать варианты клинического применения васкуляризированных надкостнично-кортикальных аутотрансплантатов в различных реципиентных областях.
Проанализирован опыт использования 83 васкуляризированных надкостнично-кортикальных аутотрансплантатов у 82 больных с последствиями травм длинных трубчатых костей и крупных суставов.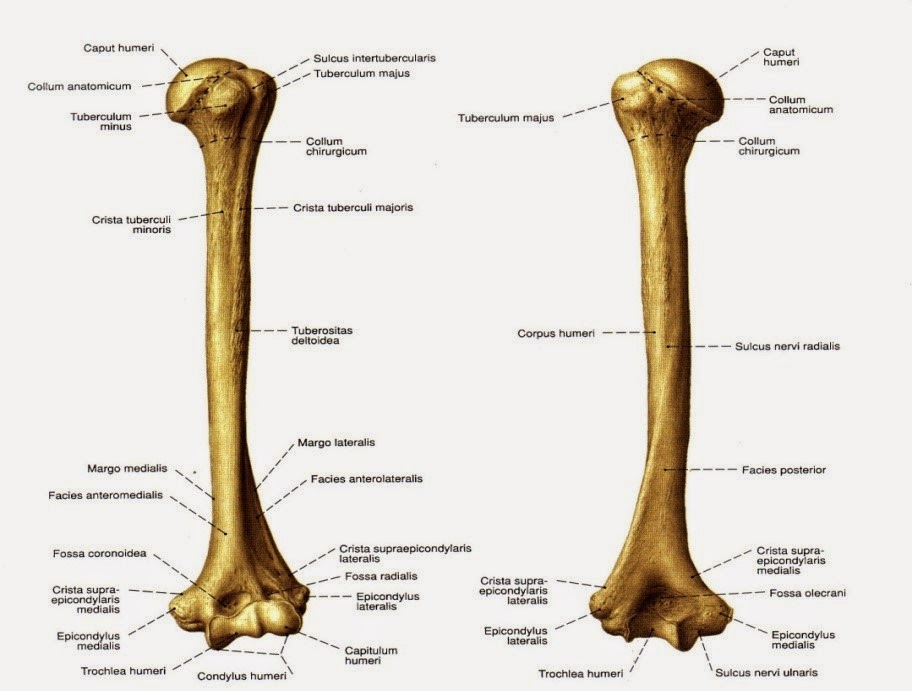 Из них у больных с последствиями травм костной системы 46 больных у которых с целью поддержки остеогенеза использованы 45 васкуляризированных надкостнично-кортикальных лучевых аутотрансплантатов и 1 васкуляризированный аутотрансплантат передней зубчатой мышцы с надкостнично-кортикальной пластинкой 7 ребра. У 7 больных с костной патологией выполнена реваскуляризация аваскулярных костных фрагментов реконструируемой кости и свободных костных аваскулярных аутотрансплантатов свободными реваскуляризируемыми или ротируемыми на сосудистой ножке надкостнично-кортикальными аутотрансплантатами в процессе хирургического лечения по поводу несросшихся и неправильно сросшихся переломов, ложных суставов длинных трубчатых костей и, дефектов костной ткани.
Хорошее собственное осевое кровоснабжение васкуляризированного надкостнично-кортикального аутотрансплантата лежит в основе механизма поддержки остеогенеза и перестройки аваскулярного костного фрагмента. «Запуск» репаративного остеогенеза происходит за счет прорастания новообразованных сосудов в аваскулярный костный фрагмент и за счет живых остеогенных клеток аутотрансплантата, которые совместно с остеогенными клетками реконструируемой кости.
Из них у больных с последствиями травм костной системы 46 больных у которых с целью поддержки остеогенеза использованы 45 васкуляризированных надкостнично-кортикальных лучевых аутотрансплантатов и 1 васкуляризированный аутотрансплантат передней зубчатой мышцы с надкостнично-кортикальной пластинкой 7 ребра. У 7 больных с костной патологией выполнена реваскуляризация аваскулярных костных фрагментов реконструируемой кости и свободных костных аваскулярных аутотрансплантатов свободными реваскуляризируемыми или ротируемыми на сосудистой ножке надкостнично-кортикальными аутотрансплантатами в процессе хирургического лечения по поводу несросшихся и неправильно сросшихся переломов, ложных суставов длинных трубчатых костей и, дефектов костной ткани.
Хорошее собственное осевое кровоснабжение васкуляризированного надкостнично-кортикального аутотрансплантата лежит в основе механизма поддержки остеогенеза и перестройки аваскулярного костного фрагмента. «Запуск» репаративного остеогенеза происходит за счет прорастания новообразованных сосудов в аваскулярный костный фрагмент и за счет живых остеогенных клеток аутотрансплантата, которые совместно с остеогенными клетками реконструируемой кости. Определяющими свойствами васкуляризированного надкостнично-кортикального аутотрансплантата, влияющими на остеогенез является не величина костного фрагмента, а характеристики магистрального кровотока питающих аутотрансплантат сосудов, разветвленная микроциркуляторная сеть надкостницы и наличие живых костных клеток.
Как известно, наибольшее количество перфорирующих кортикальную пластинку кости сосудов находится в области метадиафиза, и соответственно аутотрансплантат забранный из этой части обладает наибольшими реваскуляризирующими и остеогенетическими свойствами.
Такими свойствами по нашему мнению в большей степени обладают васкуляризированный надкостнично-кортикальный аутотрансплантат дистального метадиафиза лучевой кости на лучевой артерии и васкуляризированный надкостнично-кортикальный аутотрансплантат метадиафиза большеберцовой кости.
Остеогенетический потенциал ротированного на сосудистой ножке и свободного реваскуляризируемого надкостнично-кортикального аутотрансплантата сопоставим.
Определяющими свойствами васкуляризированного надкостнично-кортикального аутотрансплантата, влияющими на остеогенез является не величина костного фрагмента, а характеристики магистрального кровотока питающих аутотрансплантат сосудов, разветвленная микроциркуляторная сеть надкостницы и наличие живых костных клеток.
Как известно, наибольшее количество перфорирующих кортикальную пластинку кости сосудов находится в области метадиафиза, и соответственно аутотрансплантат забранный из этой части обладает наибольшими реваскуляризирующими и остеогенетическими свойствами.
Такими свойствами по нашему мнению в большей степени обладают васкуляризированный надкостнично-кортикальный аутотрансплантат дистального метадиафиза лучевой кости на лучевой артерии и васкуляризированный надкостнично-кортикальный аутотрансплантат метадиафиза большеберцовой кости.
Остеогенетический потенциал ротированного на сосудистой ножке и свободного реваскуляризируемого надкостнично-кортикального аутотрансплантата сопоставим.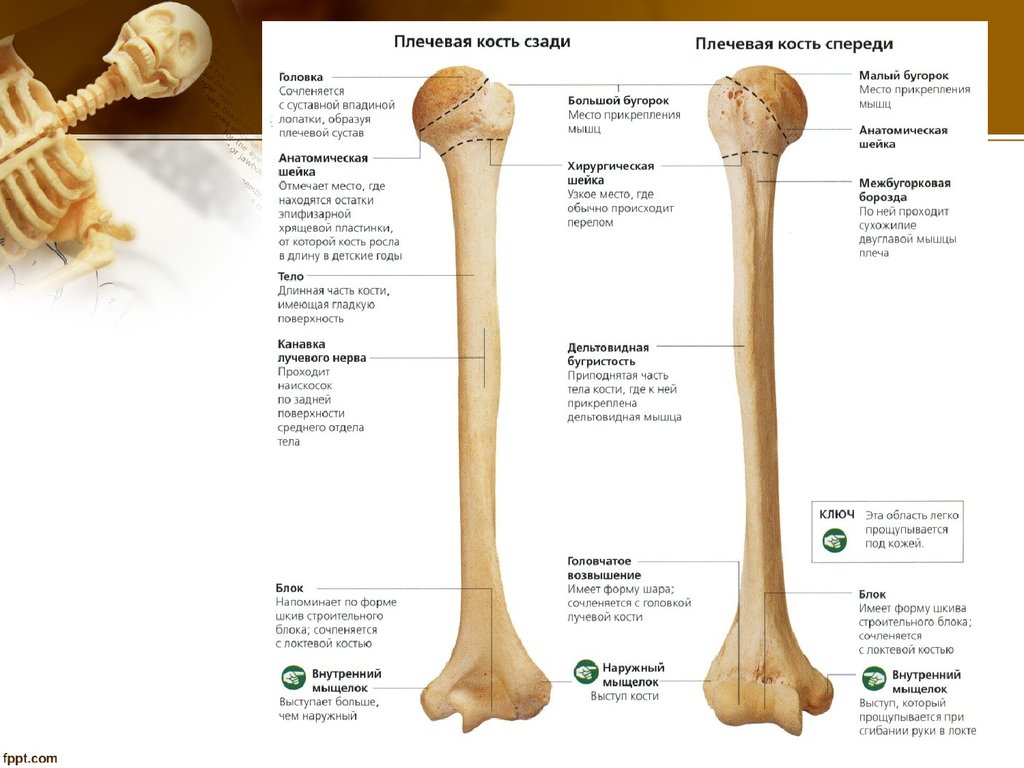 Очевидным преимуществом выполнения ротации является сокращение длительности операции, связанное с отсутствием этапов выделения реципиентных сосудов и наложения микроанастомозов, отсутствие риска тромбоза питающих сосудов в раннем послеоперационном периоде.
В общей схеме реконструкции длинных трубчатых костей при неинфицированных ложных суставов длинных трубчатых костей без дефекта костной ткани по длине и артродеза крупных суставов с поддержкой остеогенеза тканей реципиентной области хорошо кровоснабжаемым свободным реваскуляризируемым надкостнично-кортикальным аутотрансплантатом или ротированным на сосудистой ножке следует выделить несколько основных этапов:
• подготовка реципиентной области;
• забор свободного реваскуляризируемого надкостнично-кортикального аутотрансплантата или подъем надкостнично-кортикального аутотрансплантата на сосудистой ножке;
• ушивание донорской раны;
• репозиция и прочная фиксация фрагментов сегмента конечности;
• фиксация надкостнично-кортикальной части аутотрансплантата к сформированному ложу в реципиентной зоне;
• восстановление кровообращения в свободном реваскуляризируемом аутотрансплантате;
• ушивание реципиентной раны
При необходимости реваскуляризации аваскулярных костных аутотрансплантатов добавляли этап забора аваскулярной ауто кости и ее фиксацию.
Очевидным преимуществом выполнения ротации является сокращение длительности операции, связанное с отсутствием этапов выделения реципиентных сосудов и наложения микроанастомозов, отсутствие риска тромбоза питающих сосудов в раннем послеоперационном периоде.
В общей схеме реконструкции длинных трубчатых костей при неинфицированных ложных суставов длинных трубчатых костей без дефекта костной ткани по длине и артродеза крупных суставов с поддержкой остеогенеза тканей реципиентной области хорошо кровоснабжаемым свободным реваскуляризируемым надкостнично-кортикальным аутотрансплантатом или ротированным на сосудистой ножке следует выделить несколько основных этапов:
• подготовка реципиентной области;
• забор свободного реваскуляризируемого надкостнично-кортикального аутотрансплантата или подъем надкостнично-кортикального аутотрансплантата на сосудистой ножке;
• ушивание донорской раны;
• репозиция и прочная фиксация фрагментов сегмента конечности;
• фиксация надкостнично-кортикальной части аутотрансплантата к сформированному ложу в реципиентной зоне;
• восстановление кровообращения в свободном реваскуляризируемом аутотрансплантате;
• ушивание реципиентной раны
При необходимости реваскуляризации аваскулярных костных аутотрансплантатов добавляли этап забора аваскулярной ауто кости и ее фиксацию. Основную группу составили больные с неинфицированными ложными суставами (53 больных) и ложными суставами длинных трубчатых костей с хроническим остеомиелитом в стадии ремиссии — 12 больных.
При локализации ложного сустава диафизарной и метафизарной локализации без дефекта объема костной ткани концы костных фрагментов пораженного сегмента выделяли на участке несколько большем, чем площадь надкостнично-кортикальной части аутотрансплантата и достаточной для подготовки ложа и адекватной фиксации надкостнично-кортикальной части свободного реваскуляризируемого или ротируемого на сосудистой ножке аутотрансплантата.
Свободный реваскуляризируемый или ротируемый на сосудистой ножке надкостнично-кортикальный аутотрансплантат располагали поперечно линии ложного сустава с перекрытием его щели.
На уровне диафиза ложе формировали в виде равномерно сужающегося вглубь «корытца», при этом ширина средней части ложа соответствовала ширине надкостнично-кортикальной части аутотрансплантата.
Основную группу составили больные с неинфицированными ложными суставами (53 больных) и ложными суставами длинных трубчатых костей с хроническим остеомиелитом в стадии ремиссии — 12 больных.
При локализации ложного сустава диафизарной и метафизарной локализации без дефекта объема костной ткани концы костных фрагментов пораженного сегмента выделяли на участке несколько большем, чем площадь надкостнично-кортикальной части аутотрансплантата и достаточной для подготовки ложа и адекватной фиксации надкостнично-кортикальной части свободного реваскуляризируемого или ротируемого на сосудистой ножке аутотрансплантата.
Свободный реваскуляризируемый или ротируемый на сосудистой ножке надкостнично-кортикальный аутотрансплантат располагали поперечно линии ложного сустава с перекрытием его щели.
На уровне диафиза ложе формировали в виде равномерно сужающегося вглубь «корытца», при этом ширина средней части ложа соответствовала ширине надкостнично-кортикальной части аутотрансплантата.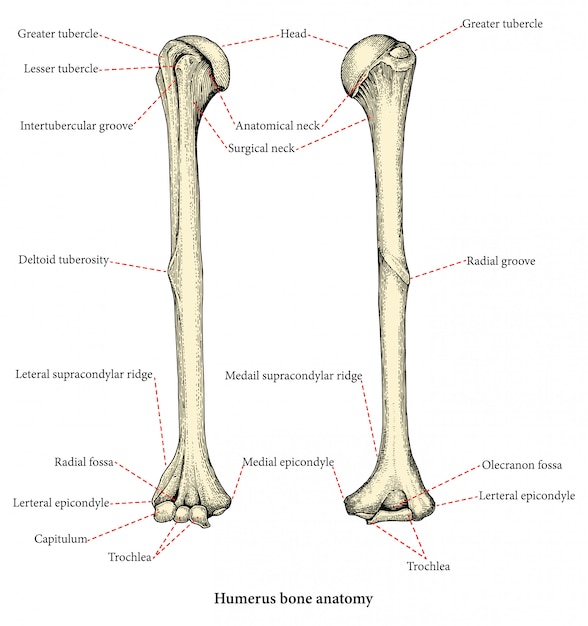 При погружении надкостнично-кортикальной части аутотрансплантата в сужающееся ложе его к «заклинивало», что являлось дополнительной фиксацией.
Ложе формировали в виде площадки, соответствующей внутренней поверхности кортикальной пластинки аутотрансплантата.
Микрохирургические анастомозы накладывали с магистральными сосудистыми пучками или их крупными ветвями.
При отдельном доступе к реципиентным сосудам формировали широкий подкожный туннель для исключения сдавления проведенных через него сосудов аутотрансплантата.
При реконструкции ложных суставов диафизарной и метадиафизарной локализации предпочтение отдавали лучевому надкостнично-кортикальному аутотрансплантату. При локализации ложного сустава на уровне средней и дистальной трети плечевой кости лучевой надкостнично-кортикальный аутотрансплантат при условии достаточной длины сосудистой ножки предпочтение отдавали ротированным надкостнично-кортикальным аутотрансплантатам. При ложных суставах других длинных трубчатых костей выполняли свободную пересадку лучевого надкостнично-кортикального аутотрансплантата.
При погружении надкостнично-кортикальной части аутотрансплантата в сужающееся ложе его к «заклинивало», что являлось дополнительной фиксацией.
Ложе формировали в виде площадки, соответствующей внутренней поверхности кортикальной пластинки аутотрансплантата.
Микрохирургические анастомозы накладывали с магистральными сосудистыми пучками или их крупными ветвями.
При отдельном доступе к реципиентным сосудам формировали широкий подкожный туннель для исключения сдавления проведенных через него сосудов аутотрансплантата.
При реконструкции ложных суставов диафизарной и метадиафизарной локализации предпочтение отдавали лучевому надкостнично-кортикальному аутотрансплантату. При локализации ложного сустава на уровне средней и дистальной трети плечевой кости лучевой надкостнично-кортикальный аутотрансплантат при условии достаточной длины сосудистой ножки предпочтение отдавали ротированным надкостнично-кортикальным аутотрансплантатам. При ложных суставах других длинных трубчатых костей выполняли свободную пересадку лучевого надкостнично-кортикального аутотрансплантата.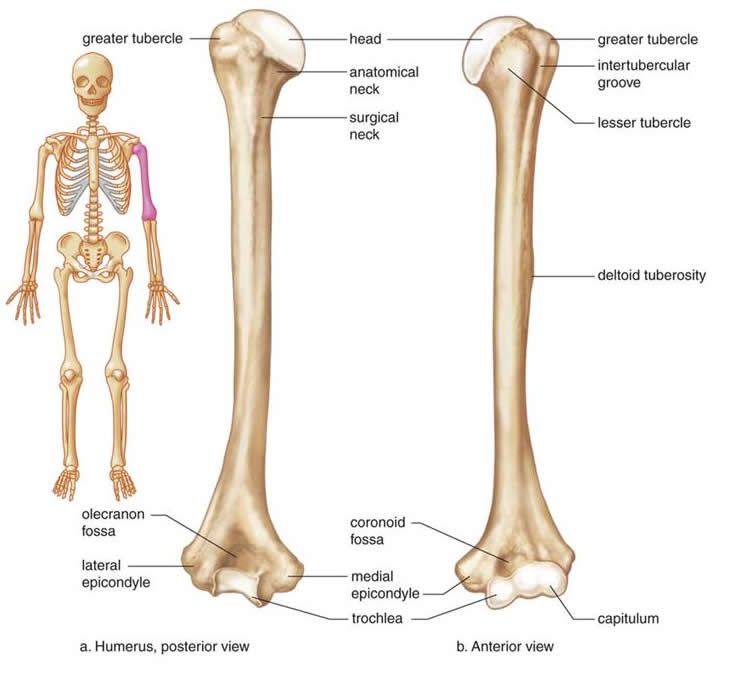 После изучения свойств васкуляризированного надкостнично-кортикального аутотрансплантата большеберцовой кости на переднем большеберцовом сосудистом пучке при реконструкции бедренной кости предпочтение отдавали именно этому аутотранспалантату. При локализации в метафизарной области и при условии достаточной длины сосудистой ножки данный аутотрансплантат использовали в виде ротированного.
При наличии объемного дефекта кости васкуляризированные надкостнично-кортикальные аутотрансплантаты использовали совместно с аваскулярными костными аутотрансплантатами. В основе метода лежит принцип реваскуляризации и перестройки аваскулярных костных фрагментов за счет васкуляризированных надкостнично-кортикальных аутотрансплантатов.
Васкуляризированные надкостнично-кортикальные аутотрансплантаты использовали при локализации дефектов кости в метаэпифизарной зоне в двух основных вариантах в зависимости от клинической ситуации 1-при неправильно сросшихся внутрисуставных переломах без дефицита костной ткани и 2- с наличием дефицита костной ткани, требовавшего использования аваскулярного костного аутотрансплантата.
После изучения свойств васкуляризированного надкостнично-кортикального аутотрансплантата большеберцовой кости на переднем большеберцовом сосудистом пучке при реконструкции бедренной кости предпочтение отдавали именно этому аутотранспалантату. При локализации в метафизарной области и при условии достаточной длины сосудистой ножки данный аутотрансплантат использовали в виде ротированного.
При наличии объемного дефекта кости васкуляризированные надкостнично-кортикальные аутотрансплантаты использовали совместно с аваскулярными костными аутотрансплантатами. В основе метода лежит принцип реваскуляризации и перестройки аваскулярных костных фрагментов за счет васкуляризированных надкостнично-кортикальных аутотрансплантатов.
Васкуляризированные надкостнично-кортикальные аутотрансплантаты использовали при локализации дефектов кости в метаэпифизарной зоне в двух основных вариантах в зависимости от клинической ситуации 1-при неправильно сросшихся внутрисуставных переломах без дефицита костной ткани и 2- с наличием дефицита костной ткани, требовавшего использования аваскулярного костного аутотрансплантата. При наличии неправильно сросшегося внутрисуставного перелома без дефицита костной ткани остеотомию выполняли по линии сращения смещенного костного фрагмента. Выполняли его скелетизацию, что позволяло фиксировать костные фрагменты с восстановлением конгруэнтности сустава, а так же являлось подготовкой поверхности костного фрагмента к формированию ложа для васкуляризированного надкостнично-кортикального аутотрансплантата.
Ложе для васкуляризированного надкостнично-кортикального аутотрансплантата при реконструкции дистального метаэпифиза плечевой кости формировали по наружной поверхности костных фрагментов, глубиной соответствующей толщине кортикальной пластинки аутотрансплантата.
При условии использования аваскулярной аутокости ложе формировали таким образом, что бы надкостница аутотрансплантата находилась на уровне поверхности аваскулярного костного фрагмента. Это позволяет создать оптимальные условия для поддержки остеогенеза.
При использовании свободного реваскуляризируемого лучевого надкостнично-кортикального аутотрансплантатов на плече в качестве реципиентных сосудов использовали плечевую артерию и коммитантные вены.
При наличии неправильно сросшегося внутрисуставного перелома без дефицита костной ткани остеотомию выполняли по линии сращения смещенного костного фрагмента. Выполняли его скелетизацию, что позволяло фиксировать костные фрагменты с восстановлением конгруэнтности сустава, а так же являлось подготовкой поверхности костного фрагмента к формированию ложа для васкуляризированного надкостнично-кортикального аутотрансплантата.
Ложе для васкуляризированного надкостнично-кортикального аутотрансплантата при реконструкции дистального метаэпифиза плечевой кости формировали по наружной поверхности костных фрагментов, глубиной соответствующей толщине кортикальной пластинки аутотрансплантата.
При условии использования аваскулярной аутокости ложе формировали таким образом, что бы надкостница аутотрансплантата находилась на уровне поверхности аваскулярного костного фрагмента. Это позволяет создать оптимальные условия для поддержки остеогенеза.
При использовании свободного реваскуляризируемого лучевого надкостнично-кортикального аутотрансплантатов на плече в качестве реципиентных сосудов использовали плечевую артерию и коммитантные вены. При ротации аутотрансплантата на сосудистой ножке подкожный тоннель формировали шириной, позволяющей провести аутотрансплантат.
Наличие массивного аваскулярного костного фрагмента, окруженного капсулой коленного сустава со связочным аппаратом отличает реконструкцию дистального отдела бедренной кости от дистального отдела плеча. Восстановление опороспособности конечности предполагает кроме оптимизации сроков реваскуляризации аваскулярного костного фрагмента, сохранение объема и формы сустава необходимо воссоздание целостности капсульно-связочного аппарата коленного сустава. С этой целью ложе для васкуляризированного надкостнично-кортикального аутотрансплантата формировали таким образом, чтобы он был погружен в глубь аваскулярного костного фрагмента, что позволяло ушить капсулу сустава и восстановить капсульно-связочный аппарат, исключая сдавления питающих аутотрансплантат сосудов, что так же оптимизирует сроки реваскуляризации и остеорепаративных процессов.
По нашему мнению, применение метода реваскуляризации аваскулярных костных фрагментов метаэпифизарной локализации, включающих суставную поверхность, васкуляризированными надкостнично-кортикальными аутотрансплантатами позволяет добиться реваскуляризации и перестройки костной ткани фрагментов, в таких ситуациях, когда выполнить репозицию костных фрагментов без скелетизации не представляется возможным.
При ротации аутотрансплантата на сосудистой ножке подкожный тоннель формировали шириной, позволяющей провести аутотрансплантат.
Наличие массивного аваскулярного костного фрагмента, окруженного капсулой коленного сустава со связочным аппаратом отличает реконструкцию дистального отдела бедренной кости от дистального отдела плеча. Восстановление опороспособности конечности предполагает кроме оптимизации сроков реваскуляризации аваскулярного костного фрагмента, сохранение объема и формы сустава необходимо воссоздание целостности капсульно-связочного аппарата коленного сустава. С этой целью ложе для васкуляризированного надкостнично-кортикального аутотрансплантата формировали таким образом, чтобы он был погружен в глубь аваскулярного костного фрагмента, что позволяло ушить капсулу сустава и восстановить капсульно-связочный аппарат, исключая сдавления питающих аутотрансплантат сосудов, что так же оптимизирует сроки реваскуляризации и остеорепаративных процессов.
По нашему мнению, применение метода реваскуляризации аваскулярных костных фрагментов метаэпифизарной локализации, включающих суставную поверхность, васкуляризированными надкостнично-кортикальными аутотрансплантатами позволяет добиться реваскуляризации и перестройки костной ткани фрагментов, в таких ситуациях, когда выполнить репозицию костных фрагментов без скелетизации не представляется возможным. Свойство васкуляризации авскулярных костных аутотрансплантатов за счет кровоснабжаемых надкостнично-кортикальных аутотрансплантатов использовали при устранении дефекта боковой стенки кости дефектах костной ткани на протяжении со склерозом концов костных фрагментов, объемными дефектами трубчатых костей с рельефной формой концов костных фрагментов, дефектами костей на протяжении без склероза концов костных фрагментов.
При устранении дефектов боковой стенки кости аваскулярному аутотрансплантату придавали форму и размер, соответствующие форме и размеру дефекта. В качестве аваскулярных использовали аутотрансплантаты, забранные из гребня подвздошной кости.
При диафизарной локализации надкостнично-кортикальную пластинку укладывали в ложе, сформированное на поверхности аваскулярного костного аутотрансплантата и на поверхности склерозированных костных фрагментов.
При наличии дефекта костной ткани на протяжении со склерозом концов костных фрагментов отдавали предпочтение надкостнично-кортикальным аутотрансплантатам гребня подвздошной кости.
Свойство васкуляризации авскулярных костных аутотрансплантатов за счет кровоснабжаемых надкостнично-кортикальных аутотрансплантатов использовали при устранении дефекта боковой стенки кости дефектах костной ткани на протяжении со склерозом концов костных фрагментов, объемными дефектами трубчатых костей с рельефной формой концов костных фрагментов, дефектами костей на протяжении без склероза концов костных фрагментов.
При устранении дефектов боковой стенки кости аваскулярному аутотрансплантату придавали форму и размер, соответствующие форме и размеру дефекта. В качестве аваскулярных использовали аутотрансплантаты, забранные из гребня подвздошной кости.
При диафизарной локализации надкостнично-кортикальную пластинку укладывали в ложе, сформированное на поверхности аваскулярного костного аутотрансплантата и на поверхности склерозированных костных фрагментов.
При наличии дефекта костной ткани на протяжении со склерозом концов костных фрагментов отдавали предпочтение надкостнично-кортикальным аутотрансплантатам гребня подвздошной кости.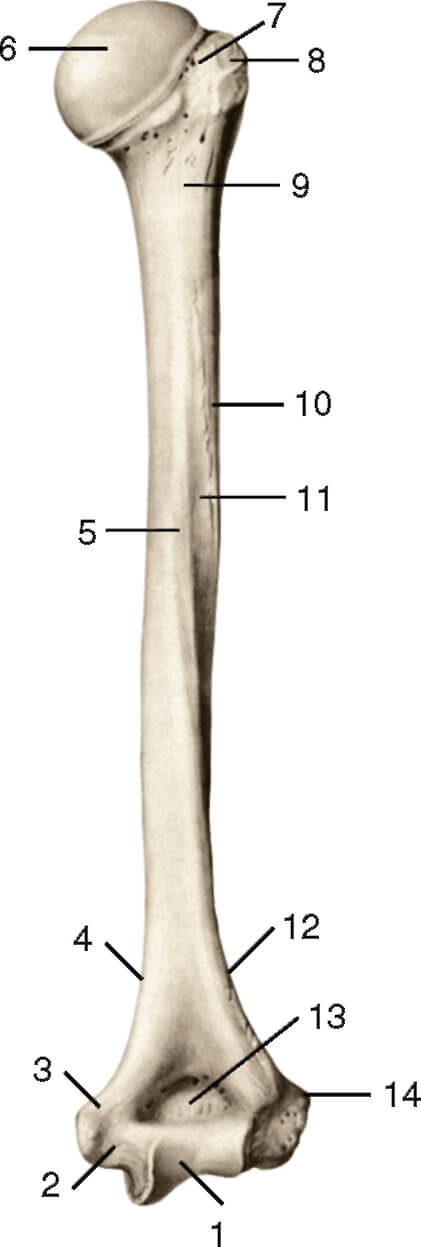 При заборе аутотрансплантата его длину формировали несколько больше протяженности дефекта, а шириной соответственно диаметру костных фрагментов пораженной кости. Ложе для надкостнично-кортикальной части васкуляризированного аутотрансплантата формировали на поверхности аваскулярного костного аутотрансплантата с наложением на концы склерозированных костных фрагментов на глубину, соответствующую толщине кортикальной пластинки. Это приводило к контакту надкостницы васкуляризированного аутотрансплантата с поверхностью аваскулярного аутотрансплантата, что создавало наилучшие условия для проявления ее остеогенных свойств.
Формирование ложа для надкостнично-кортикальной части васкуляризированного аутотрансплантата, в том числе на поверхности концов склерозированных костных фрагментов позволяет протекать репарационным процессам, как со стороны отломков реконструируемой кости, так и со стороны васкуляризированного надкостнично-кортикального аутотрансплантата.
При объемных дефектах трубчатых костей с рельефной формой концов костных фрагментов предпочтительнее сохранять объем костной ткани костных фрагментов.
При заборе аутотрансплантата его длину формировали несколько больше протяженности дефекта, а шириной соответственно диаметру костных фрагментов пораженной кости. Ложе для надкостнично-кортикальной части васкуляризированного аутотрансплантата формировали на поверхности аваскулярного костного аутотрансплантата с наложением на концы склерозированных костных фрагментов на глубину, соответствующую толщине кортикальной пластинки. Это приводило к контакту надкостницы васкуляризированного аутотрансплантата с поверхностью аваскулярного аутотрансплантата, что создавало наилучшие условия для проявления ее остеогенных свойств.
Формирование ложа для надкостнично-кортикальной части васкуляризированного аутотрансплантата, в том числе на поверхности концов склерозированных костных фрагментов позволяет протекать репарационным процессам, как со стороны отломков реконструируемой кости, так и со стороны васкуляризированного надкостнично-кортикального аутотрансплантата.
При объемных дефектах трубчатых костей с рельефной формой концов костных фрагментов предпочтительнее сохранять объем костной ткани костных фрагментов. Для этого формировали аваскулярный костный аутотрансплантат аналогичной дефекту формой.
При реконструкции костей с дефектами на протяжении без склероза концов костных фрагментов располагали васкуляризированный надкостнично-кортикальный аутотрансплантат в ложе сформированном только на аваскулярном костном аутотрансплантате, так как в данной ситуации нет необходимости в поддержке остеорепаративных процессов со стороны здоровых хорошо кровоснабжаемых костных фрагментов.
Использование васкуляризированных надкостнично-кортикальных аутотрансплантатов для артродеза крупных суставов в своей основе имеет тот же принцип объединения сосудистых связей, что в конечном итоге приводит к сращению костей, составляющих сустав в наиболее короткие сроки.
Метод использован у двух больных с травматической деформацией голеностопного, приведшей к резкому ограничению функции и включал в себя: 1- резекцию суставных поверхностей; 2- фиксацию сустава; 3- забор васкуляризированного надкостнично-кортикального аутотрансплантата; 4- фиксацию васакуляризированного надкостнично-кортикального ауторансплантат с перекрытием суставной щели.
Для этого формировали аваскулярный костный аутотрансплантат аналогичной дефекту формой.
При реконструкции костей с дефектами на протяжении без склероза концов костных фрагментов располагали васкуляризированный надкостнично-кортикальный аутотрансплантат в ложе сформированном только на аваскулярном костном аутотрансплантате, так как в данной ситуации нет необходимости в поддержке остеорепаративных процессов со стороны здоровых хорошо кровоснабжаемых костных фрагментов.
Использование васкуляризированных надкостнично-кортикальных аутотрансплантатов для артродеза крупных суставов в своей основе имеет тот же принцип объединения сосудистых связей, что в конечном итоге приводит к сращению костей, составляющих сустав в наиболее короткие сроки.
Метод использован у двух больных с травматической деформацией голеностопного, приведшей к резкому ограничению функции и включал в себя: 1- резекцию суставных поверхностей; 2- фиксацию сустава; 3- забор васкуляризированного надкостнично-кортикального аутотрансплантата; 4- фиксацию васакуляризированного надкостнично-кортикального ауторансплантат с перекрытием суставной щели. В качестве васкуляризированного надкостнично-кортикального атотранспланатата в обоих наблюдениях использовали фрагмент II плюсневой кости ротированный на артерии тыла стопы.
После фиксации сустава формировли ложе для васкуляризированного надкостнично-кортикального ауторансплантата.
В таранной кости формировали тоннель соразмерный надкостнично-кортикальному аутотрансплантату в который вставляли один его конец, а сам аутотрнасплантат укладывали в сформированное ложе на большеберцовой кости и блокировали спицами, проведенными через боковые стенки ложа и костную часть аутотрансплантата. В результате происходило «заклинивание» надкостнично-кортикальной части аутотрансплантата.
В послеоперационном периоде ультразвуковую допплерографию и ультразвуковое дуплексное сканирование использовали для контроля за кровообращением в свободном реваскуляризируемом аутотрансплантате. При исследовании в отдаленные сроки (от 1года до 2 лет) наблюдали кровоток в сосудах аутотрансплантата.
Некроза свободных реваскуляризированных накостнично-кортикальных аутотрансплантатов в послеоперационном периоде не наблюдали.
В качестве васкуляризированного надкостнично-кортикального атотранспланатата в обоих наблюдениях использовали фрагмент II плюсневой кости ротированный на артерии тыла стопы.
После фиксации сустава формировли ложе для васкуляризированного надкостнично-кортикального ауторансплантата.
В таранной кости формировали тоннель соразмерный надкостнично-кортикальному аутотрансплантату в который вставляли один его конец, а сам аутотрнасплантат укладывали в сформированное ложе на большеберцовой кости и блокировали спицами, проведенными через боковые стенки ложа и костную часть аутотрансплантата. В результате происходило «заклинивание» надкостнично-кортикальной части аутотрансплантата.
В послеоперационном периоде ультразвуковую допплерографию и ультразвуковое дуплексное сканирование использовали для контроля за кровообращением в свободном реваскуляризируемом аутотрансплантате. При исследовании в отдаленные сроки (от 1года до 2 лет) наблюдали кровоток в сосудах аутотрансплантата.
Некроза свободных реваскуляризированных накостнично-кортикальных аутотрансплантатов в послеоперационном периоде не наблюдали.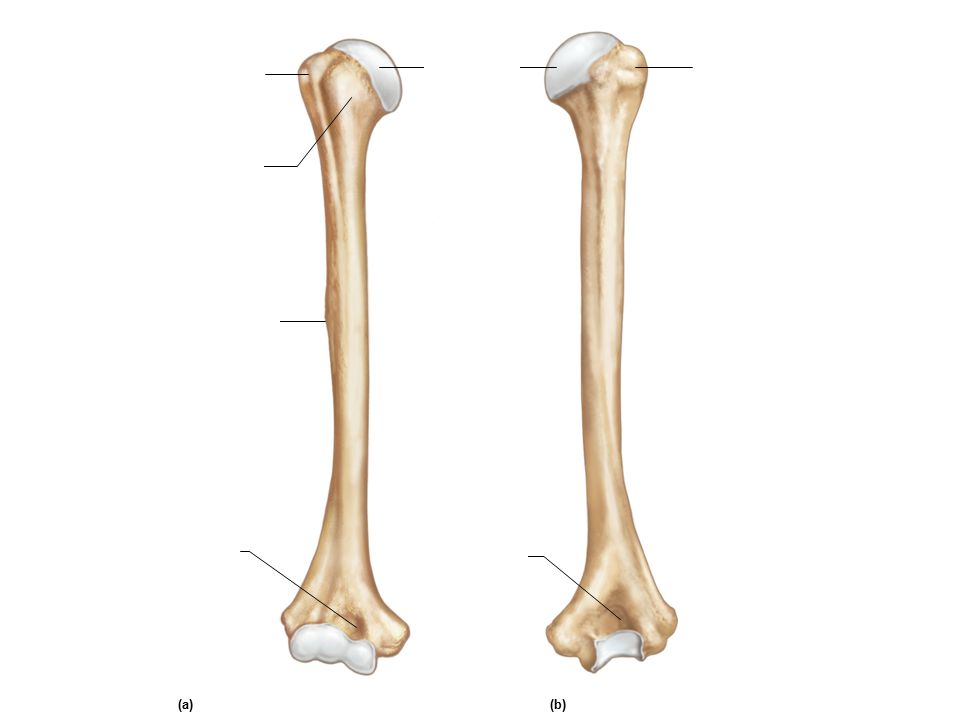 Сроки сращения костных фрагментов пораженного сегмента разных отделов длинной трубчатой кости различны. Мы выявили прямую зависимость сроков сращения от удаленности от надкостнично-кортикального аутотрансплантата. Так например, рентгенологические признаки сращения надкостнично-кортикального аутотрансплантата с ложем в различных клинических ситуациях можно выявить уже в 3-5 недель после операции. Данные сроки можно считать началом сращения. Безусловно новообразованная костная ткань не имеет достаточной механической прочности. Так, например, полное сращение ложного сустава бедренной кости на уровне диафиза после реконструкции с использованием васкуляризированных надкостнично-кортикальных аутотрансплантатов мы наблюдали в сроки от 5 до 9 месяцев, но первые признаки сращения надкостнично-кортикального аутотрансплантата с ложем наблюдали в 3-5 недель. При этом при динамическом рентгенологическом исследовании выявлен феномен формирования костной ткани в межотломковом пространстве до противоположной аутотрансплантату кортикальной пластинки в указанные сроки.
Сроки сращения костных фрагментов пораженного сегмента разных отделов длинной трубчатой кости различны. Мы выявили прямую зависимость сроков сращения от удаленности от надкостнично-кортикального аутотрансплантата. Так например, рентгенологические признаки сращения надкостнично-кортикального аутотрансплантата с ложем в различных клинических ситуациях можно выявить уже в 3-5 недель после операции. Данные сроки можно считать началом сращения. Безусловно новообразованная костная ткань не имеет достаточной механической прочности. Так, например, полное сращение ложного сустава бедренной кости на уровне диафиза после реконструкции с использованием васкуляризированных надкостнично-кортикальных аутотрансплантатов мы наблюдали в сроки от 5 до 9 месяцев, но первые признаки сращения надкостнично-кортикального аутотрансплантата с ложем наблюдали в 3-5 недель. При этом при динамическом рентгенологическом исследовании выявлен феномен формирования костной ткани в межотломковом пространстве до противоположной аутотрансплантату кортикальной пластинки в указанные сроки.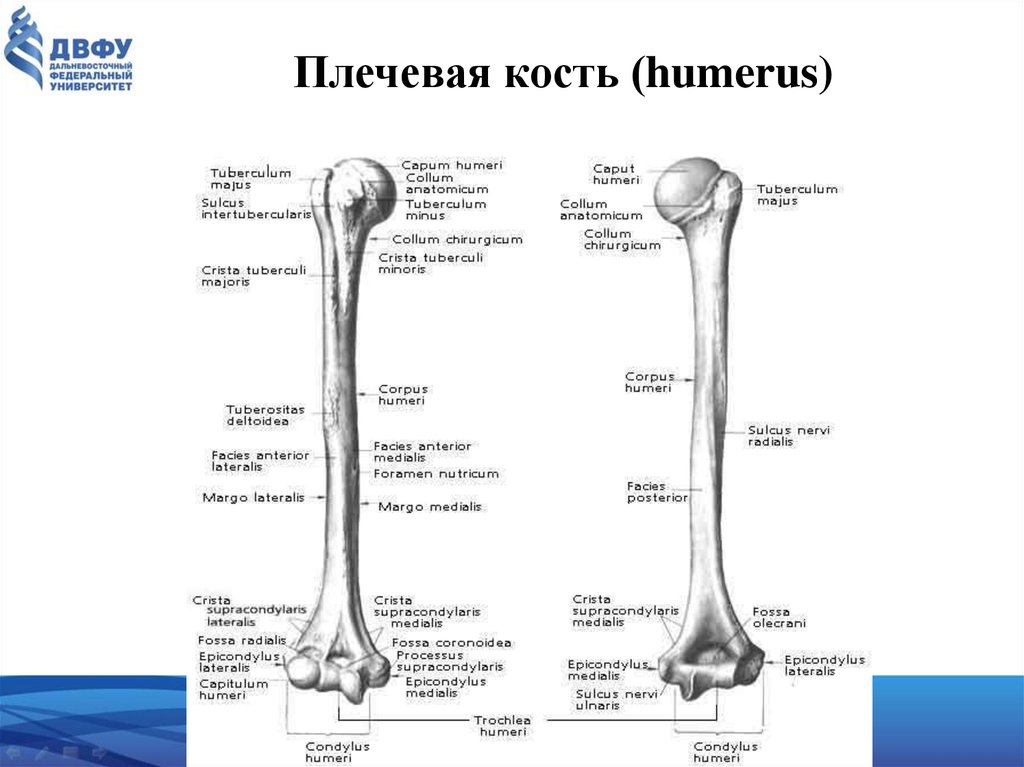 Такая динамическая рентгенологическая картина наиболее легко прослеживается после реконструкции крупных трубчатых костей (бедренная, плечевая) на уровне диафиза, поскольку, как известно, течение репаративных процессов на этом уровне ниболее продолжительное.
Сравнение сроков сращения костных фрагментов при их васкуляризации кровоснабжаемыми надкостнично-кортикальными аутотрансплантатами проводили со сроками сращения закрытых неосложненных переломов длинных трубчатых костей той же локализации.
Так на уровне метадиафиза и диафиза сращение по линии ложного сустава наблюдали в сроки, близкие к срокам сращения закрытых неосложненных переломов оперированного сегмента конечности и превысили их в 1,1 раза. Сращение в эпиметафизарной зоне проходило быстрее в 0,9 раза. Наличие дефекта боковой стенки, которое требовало использование аваскулярного костного фрагмента приводило к увеличению сроков сращения закрытых неосложненных переломов той же локализации в 1,2 раза.
Таким образом, эффективность использования васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей можно считать доказанной.
Такая динамическая рентгенологическая картина наиболее легко прослеживается после реконструкции крупных трубчатых костей (бедренная, плечевая) на уровне диафиза, поскольку, как известно, течение репаративных процессов на этом уровне ниболее продолжительное.
Сравнение сроков сращения костных фрагментов при их васкуляризации кровоснабжаемыми надкостнично-кортикальными аутотрансплантатами проводили со сроками сращения закрытых неосложненных переломов длинных трубчатых костей той же локализации.
Так на уровне метадиафиза и диафиза сращение по линии ложного сустава наблюдали в сроки, близкие к срокам сращения закрытых неосложненных переломов оперированного сегмента конечности и превысили их в 1,1 раза. Сращение в эпиметафизарной зоне проходило быстрее в 0,9 раза. Наличие дефекта боковой стенки, которое требовало использование аваскулярного костного фрагмента приводило к увеличению сроков сращения закрытых неосложненных переломов той же локализации в 1,2 раза.
Таким образом, эффективность использования васкуляризированных надкостнично-кортикальных аутотрансплантатов в реконструктивной хирургии конечностей можно считать доказанной. Выводы
1. Источником васкуляризации надкостнично-кортикальных аутотрансплантатов могут стать магистральные артерии и их крупные ветви с разветвленной сетью в надкостнице. Формирование васкуляризированных надкостнично-кортикальных аутотрансплантатов основано на выделении кортикальной пластинки в едином блоке с надкостницей, содержащей сосуды и сосудистые связи с магистральным сосудистым пучком. Сосудистые связи надкостничной сети и магистрального сосудистого пучка требуют при формировании надкостнично-кортикального аутотрансплантата их мобилизации в межмышечных перегородках или мобилизации мышечных перфорантных сосудов.
2. Возможность формирования ротируемых надкостнично-корткальных аутотрансплантатов в условиях отсутствия повреждения и аномалии развития питающих сосудов позволяет их перемещение в пределах предплечья , плеча, голени дистальной трети бедра. Ротация васкуляризированных надкостнично-кортикальных аутотрансплантатов на уровень средней трети бедра зависит от антропометрических характеристик.
Выводы
1. Источником васкуляризации надкостнично-кортикальных аутотрансплантатов могут стать магистральные артерии и их крупные ветви с разветвленной сетью в надкостнице. Формирование васкуляризированных надкостнично-кортикальных аутотрансплантатов основано на выделении кортикальной пластинки в едином блоке с надкостницей, содержащей сосуды и сосудистые связи с магистральным сосудистым пучком. Сосудистые связи надкостничной сети и магистрального сосудистого пучка требуют при формировании надкостнично-кортикального аутотрансплантата их мобилизации в межмышечных перегородках или мобилизации мышечных перфорантных сосудов.
2. Возможность формирования ротируемых надкостнично-корткальных аутотрансплантатов в условиях отсутствия повреждения и аномалии развития питающих сосудов позволяет их перемещение в пределах предплечья , плеча, голени дистальной трети бедра. Ротация васкуляризированных надкостнично-кортикальных аутотрансплантатов на уровень средней трети бедра зависит от антропометрических характеристик.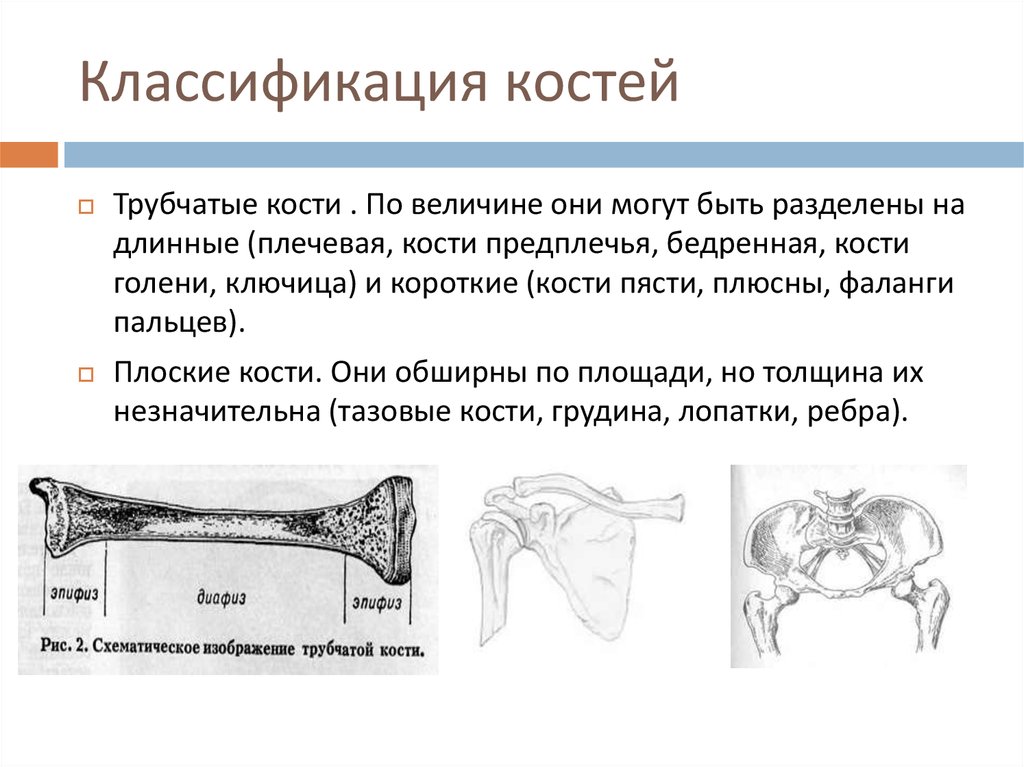 Применение ротированных надкостнично-кортикальных аутотрансплантатов оправдано при выборе оптимального аутотрансплантата или необходимости уменьшения объема операции, невозможности адекватного медикаментозного лечения и осуществления медикаментозной профилактики тромботических осложнений.
3. При равных возможностях выбора области забора васкуляризированного надкостнично-кортикального аутотрансплантата предпочтение следует отдавать метаэпифизарной зоне при формировании кортикальной пластинки в силу наибольшей концентрации перфорирующих кортикальную пластинку сосудов. Формирование кортикальной порции васкуляризированных надкостнично-кортикальных аутотрансплантатов в виде тонкой пластинки не уменьшает репарационных возможностей. Деление кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата при сохранении сосудистых связей с питающими сосудами, не влияет на репаративные свойства аутотрансплантата.
4. Основным показанием к применению васкуляризированных надкостнично-кортикальных аутотрансплантатов являются атрофические проявления костных структур и высокий риск потери формы и объема костных фрагментов эпиметафиза.
Применение ротированных надкостнично-кортикальных аутотрансплантатов оправдано при выборе оптимального аутотрансплантата или необходимости уменьшения объема операции, невозможности адекватного медикаментозного лечения и осуществления медикаментозной профилактики тромботических осложнений.
3. При равных возможностях выбора области забора васкуляризированного надкостнично-кортикального аутотрансплантата предпочтение следует отдавать метаэпифизарной зоне при формировании кортикальной пластинки в силу наибольшей концентрации перфорирующих кортикальную пластинку сосудов. Формирование кортикальной порции васкуляризированных надкостнично-кортикальных аутотрансплантатов в виде тонкой пластинки не уменьшает репарационных возможностей. Деление кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата при сохранении сосудистых связей с питающими сосудами, не влияет на репаративные свойства аутотрансплантата.
4. Основным показанием к применению васкуляризированных надкостнично-кортикальных аутотрансплантатов являются атрофические проявления костных структур и высокий риск потери формы и объема костных фрагментов эпиметафиза. Выбор васкуляризированного надкостнично-кортикального аутотрансплантата должен определяться величиной зоны репаративных нарушений. Определяющим фактором при выборе надкостнично-кортикального аутотрансплантата при равных возможностях формирования кортикальной пластинки, являются характеристики артериального кровотока питающих сосудов.
5. Определение возможности забора васкуляризированных надкостнично-кортикальных аутотрансплантатов основано на принципах выявления состоятельности сосудистого русла питающих сосудов и предотвращения возможных трофических нарушений в донорской области. Наиболее информативным является определение гемодинамических изменений в ответ на моделирование выключения из магистрального кровотока сосудов, рассматриваемых в качестве донорских.
6. Свободные реваскуляризированные и ротируемые надкостнично-кортикальные аутотрансплантаты могут быть использованы в реконструктивный хирургии и травматологии при последствиях травм длинных трубчатых костей в условиях нарушения остеорепарации.
Выбор васкуляризированного надкостнично-кортикального аутотрансплантата должен определяться величиной зоны репаративных нарушений. Определяющим фактором при выборе надкостнично-кортикального аутотрансплантата при равных возможностях формирования кортикальной пластинки, являются характеристики артериального кровотока питающих сосудов.
5. Определение возможности забора васкуляризированных надкостнично-кортикальных аутотрансплантатов основано на принципах выявления состоятельности сосудистого русла питающих сосудов и предотвращения возможных трофических нарушений в донорской области. Наиболее информативным является определение гемодинамических изменений в ответ на моделирование выключения из магистрального кровотока сосудов, рассматриваемых в качестве донорских.
6. Свободные реваскуляризированные и ротируемые надкостнично-кортикальные аутотрансплантаты могут быть использованы в реконструктивный хирургии и травматологии при последствиях травм длинных трубчатых костей в условиях нарушения остеорепарации.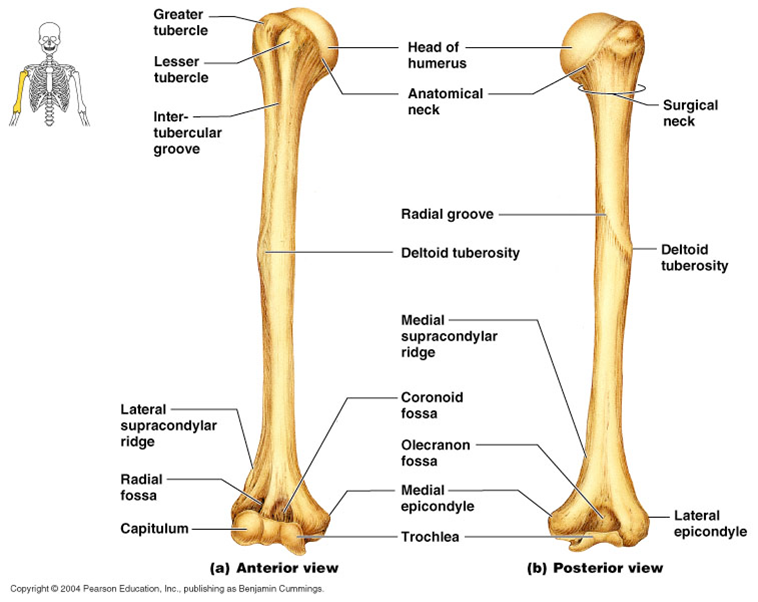 Клиническое применение васкуляризированных надкостнично-кортикальных аутотрансплантатов в условиях стабильного остеосинтеза сегмента конечности и фиксации кортикальной пластинки надкостнично-кортикального аутотрансплантата при нарушении острорепарации позволяет добиться сращения костных фрагментов в ожидаемые сроки.
7. Выбор васкуляризированного надкостнично-кортикального аутотрансплантата зависит от каждой конкретной ситуации и требует индивидуального подхода. Варианты использования васкуляризированных надкостнично-кортикальных аутотрансплантатов позволяют применять их для поддержки остеорепаративных процессов длинных трубчатых костей на уровне диафиза, эпиметафиза, в том числе с применением аваскулярных костных аутотрансплантатов и имеющихся аваскулярных костных фрагментов.
Практические рекомендации.
1. При формировании кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата следует избегать забора избыточного объема костного материала, что, не уменьшая репаративных возможностей аутотрансплантата, приводит к минимизации донорского дефекта.
Клиническое применение васкуляризированных надкостнично-кортикальных аутотрансплантатов в условиях стабильного остеосинтеза сегмента конечности и фиксации кортикальной пластинки надкостнично-кортикального аутотрансплантата при нарушении острорепарации позволяет добиться сращения костных фрагментов в ожидаемые сроки.
7. Выбор васкуляризированного надкостнично-кортикального аутотрансплантата зависит от каждой конкретной ситуации и требует индивидуального подхода. Варианты использования васкуляризированных надкостнично-кортикальных аутотрансплантатов позволяют применять их для поддержки остеорепаративных процессов длинных трубчатых костей на уровне диафиза, эпиметафиза, в том числе с применением аваскулярных костных аутотрансплантатов и имеющихся аваскулярных костных фрагментов.
Практические рекомендации.
1. При формировании кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата следует избегать забора избыточного объема костного материала, что, не уменьшая репаративных возможностей аутотрансплантата, приводит к минимизации донорского дефекта. 2. Планирование васкуляризированного надкостично-кортикального аутотрансплантата целесообразно осуществлять с учетом данных дуплексного сканирования питающих сосудов.
3. Тесты на компенсацию кровоснабжения дистальных отделов конечностей при пережатии лучевого и переднего большеберцового пучков необходимы для правильной оценки риска трофических нарушений на предоперационном этапе.
4. Для поддержки остеогенеза следует отдавать предпочтение метаэпифизарной зоне при формировании кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата.
5. В условиях одномоментного устранения дефекта объема аваскулярным костным аутотрансплантатом надкостнично-кортикальную пластинку васкуляризированного аутотрансплантата оптимально располагать на поверхности аваскулярного для его васкуляризации.
6. Для достижения положительного результата использования васкуляризированного надкостнично-кортикального аутотрансплантата необходима стабильная фиксация как сегмента конечности, так и кортикальной пластинки аутотрансплантата.
2. Планирование васкуляризированного надкостично-кортикального аутотрансплантата целесообразно осуществлять с учетом данных дуплексного сканирования питающих сосудов.
3. Тесты на компенсацию кровоснабжения дистальных отделов конечностей при пережатии лучевого и переднего большеберцового пучков необходимы для правильной оценки риска трофических нарушений на предоперационном этапе.
4. Для поддержки остеогенеза следует отдавать предпочтение метаэпифизарной зоне при формировании кортикальной пластинки васкуляризированного надкостнично-кортикального аутотрансплантата.
5. В условиях одномоментного устранения дефекта объема аваскулярным костным аутотрансплантатом надкостнично-кортикальную пластинку васкуляризированного аутотрансплантата оптимально располагать на поверхности аваскулярного для его васкуляризации.
6. Для достижения положительного результата использования васкуляризированного надкостнично-кортикального аутотрансплантата необходима стабильная фиксация как сегмента конечности, так и кортикальной пластинки аутотрансплантата. 7. Возможности формирования васкуляризованных надкостнично-кортикальных аутотрансплантатов на основе нисходящей артерии бедра и глубокой артерии плеча не дают ожидаемых результатов. Поэтому рекомендуем воздержаться от их применения при существовании альтернативных васкуляризованных надкостнично-кортикальных аутотрансплантатов.
8. При реконструкции бедренной кости с учетом гемодинамических характеристик питающих сосудов и возможностей забора пластического материала наиболее целесообразно использовать передний большеберцовый васкуляризованный надкостнично-кортикальный аутотрансплантат.
9. Лучевой васкуляризованный надкостнично-кортикальный аутотрансплантат с целью поддержки остеогенеза целесообразно формировать в виде тонкой упругой пластинки.
7. Возможности формирования васкуляризованных надкостнично-кортикальных аутотрансплантатов на основе нисходящей артерии бедра и глубокой артерии плеча не дают ожидаемых результатов. Поэтому рекомендуем воздержаться от их применения при существовании альтернативных васкуляризованных надкостнично-кортикальных аутотрансплантатов.
8. При реконструкции бедренной кости с учетом гемодинамических характеристик питающих сосудов и возможностей забора пластического материала наиболее целесообразно использовать передний большеберцовый васкуляризованный надкостнично-кортикальный аутотрансплантат.
9. Лучевой васкуляризованный надкостнично-кортикальный аутотрансплантат с целью поддержки остеогенеза целесообразно формировать в виде тонкой упругой пластинки.
Внутренняя фиксация переломов проксимального отдела плечевой кости со смещением двумя третичными трубчатыми пластинами
. 2003 март; 54 (3): 536-44.
doi: 10. 1097/01.TA.0000052365.96538.42.
1097/01.TA.0000052365.96538.42.
Гвидо А Ваннер 1 , Элизабет Ваннер-Шмид, Хосе Ромеро, Отмар Херше, Александр фон Смекал, Отмар Тренц, Вольфганг Эртель
Принадлежности
принадлежность
- 1 Отделение хирургии травм Цюрихского университета, Швейцария.
- PMID: 12634535
- DOI: 10.1097/01.ТА.0000052365.96538.42
Guido A Wanner et al. J Травма. 2003 9 марта0003
. 2003 март; 54 (3): 536-44.
doi: 10. 1097/01.TA.0000052365.96538.42.
1097/01.TA.0000052365.96538.42.
Авторы
Гвидо А Ваннер 1 , Элизабет Ваннер-Шмид, Хосе Ромеро, Отмар Херше, Александр фон Смекал, Отмар Тренц, Вольфганг Эртель
принадлежность
- 1 Отделение травматологии, Цюрихский университет, Швейцария.
- PMID: 12634535
- DOI: 10.1097/01.ТА.0000052365.96538.42
Абстрактный
Фон: Оперативное лечение переломов проксимального отдела плечевой кости со смещением часто приводит к неблагоприятному функциональному исходу. Мы сообщаем о методике, которая обеспечивает улучшенную ротационную стабильность перелома и, таким образом, позволяет проводить раннее функциональное лечение.
Мы сообщаем о методике, которая обеспечивает улучшенную ротационную стабильность перелома и, таким образом, позволяет проводить раннее функциональное лечение.
Методы: Семьдесят один последовательный пациент (67 ± 18 лет) с переломами проксимального отдела плечевой кости со смещением (двухфрагментные, n = 10; трехфрагментные, n = 41; четырехфрагментные, n = 20) лечили методом открытой репозиции. и внутренняя фиксация с использованием двух трубчатых пластин одной трети на передней и латеральной сторонах проксимального отдела плечевой кости. Пассивные движения начинались на третий день после операции, а на 6-й день выполнялись упражнения с активной поддержкой.
Полученные результаты: Семь пациентов (12%) имели осложнения (повторное смещение перелома, аваскулярный некроз головки плечевой кости, замороженное плечо, субакромиальный импинджмент и расшатывание имплантата), потребовавшие дальнейшего хирургического вмешательства. Шестьдесят пациентов (85%) были доступны для последующего наблюдения через 17 +/- 10 месяцев после травмы. Используя постоянную оценку, у 34% пациентов были очень хорошие результаты, у 29% — хорошие результаты, у 25% — удовлетворительные результаты и у 12% — плохие результаты. Возраст (< 60 лет или > или = 60 лет) и тип перелома не влияли на функциональный результат.
Шестьдесят пациентов (85%) были доступны для последующего наблюдения через 17 +/- 10 месяцев после травмы. Используя постоянную оценку, у 34% пациентов были очень хорошие результаты, у 29% — хорошие результаты, у 25% — удовлетворительные результаты и у 12% — плохие результаты. Возраст (< 60 лет или > или = 60 лет) и тип перелома не влияли на функциональный результат.
Вывод: Эти результаты демонстрируют высокую стабильность внутренней фиксации двумя трубчатыми пластинами на одну треть, что позволило провести раннюю мобилизацию плеча у всех пациентов, и подчеркивают, что этот метод является предпочтительным вариантом лечения переломов проксимального отдела плечевой кости со смещением.
Похожие статьи
Чрескостная шовная фиксация переломов проксимального отдела плечевой кости.
Димакопулос П.
 , Панагопулос А., Касиматис Г.
Димакопулос П. и соавт.
J Bone Joint Surg Am. 2007 г., август; 89 (8): 1700-9. дои: 10.2106/JBJS.F.00765.
J Bone Joint Surg Am. 2007.
PMID: 17671007
, Панагопулос А., Касиматис Г.
Димакопулос П. и соавт.
J Bone Joint Surg Am. 2007 г., август; 89 (8): 1700-9. дои: 10.2106/JBJS.F.00765.
J Bone Joint Surg Am. 2007.
PMID: 17671007Фиксация замковыми пластинами трех- и четырехфрагментарных переломов проксимального отдела плечевой кости.
Пармаксизоглу А.С., Сёкюджю С., Озкая У., Кабукчуоглу Ю., Гюль М. Пармаксизоглу А.С. и др. Acta Orthop Traumatol Turc. 2010;44(2):97-104. doi: 10.3944/АОТТ.2010.2275. Acta Orthop Traumatol Turc. 2010. PMID: 20676010
Чрескостная шовная фиксация переломов проксимального отдела плечевой кости. Хирургическая техника.
Димакопулос П., Панагопулос А., Касиматис Г. Димакопулос П. и соавт. J Bone Joint Surg Am.
 2009 март 1; 91 Приложение 2, часть 1: 8-21. дои: 10.2106/JBJS.H.01290.
J Bone Joint Surg Am. 2009.
PMID: 19255196
2009 март 1; 91 Приложение 2, часть 1: 8-21. дои: 10.2106/JBJS.H.01290.
J Bone Joint Surg Am. 2009.
PMID: 19255196Остеосинтез переломов проксимального отдела плечевой кости.
Повач П., Реш Х. Повач П. и соавт. Тер Умш. 1998 март; 55(3):192-6. Тер Умш. 1998. PMID: 9562822 Обзор. Немецкий.
Переломы проксимального отдела плечевой кости. Методы управления и ожидаемые результаты.
Шишковиц Р., Сеггл В., Шлейфер П., Канди П.Дж. Шишкович Р. и соавт. Clin Orthop Relat Relat Res. 1993 июля; (292): 13-25. Clin Orthop Relat Relat Res. 1993. PMID: 8519100 Обзор.
Посмотреть все похожие статьи
Цитируется
Артроскопическая репозиция и чрескостная фиксация швов при отрыве и смещении перелома большого бугорка плеча.

Флига БАН, Карейм С. Флига БАН и др. Артроск Тех. 2021 18 февраля; 10 (3): e821-e830. doi: 10.1016/j.eats.2020.10.074. Электронная коллекция 2021 март. Артроск Тех. 2021. PMID: 33738220 Бесплатная статья ЧВК.
[Прогресс исследований в области увеличения медиальной поддержки пластинчатого остеосинтеза при переломах проксимального отдела плечевой кости].
Чанг З., Чжан В., Тан П., Чен Х. Чанг Зи и др. Чжунго Сю Фу Чонг Цзянь Вай Кэ За Чжи. 2021 15 марта; 35 (3): 375-380. дои: 10.7507/1002-1892.202009127. Чжунго Сю Фу Чонг Цзянь Вай Кэ За Чжи. 2021. PMID: 33719248 Бесплатная статья ЧВК. Обзор. Китайский язык.
Новый хирургический подход и методика, а также краткосрочная клиническая эффективность лечения переломов проксимального отдела плечевой кости с комбинированным применением медиальной анатомической фиксации запирающими пластинами и минимально инвазивной латеральной фиксацией запирающими пластинами.

Ван Ф, Ван И, Донг Дж, Хэ И, Ли Л, Лю Ф, Донг Дж. Ван Ф и др. J Orthop Surg Res. 2021 9 января; 16 (1): 29. doi: 10.1186/s13018-020-02094-7. J Orthop Surg Res. 2021. PMID: 33422119Бесплатная статья ЧВК.
Биомеханическое поведение трех типов фиксации при двухфрагментарном переломе проксимального отдела плечевой кости без медиальной кортикальной поддержки.
ди Туллио П.О., Джордано В., Соуто Э., Ассед Х., Чекер Д.П., Беландеро В., Мариолани Д.Р.Л., Кох Х.А. ди Туллио П.О. и др. ПЛОС Один. 2019 30 июля; 14 (7): e0220523. doi: 10.1371/journal.pone.0220523. Электронная коллекция 2019. ПЛОС Один. 2019. PMID: 31361778 Бесплатная статья ЧВК.
«90/90» Пластина перелома проксимального отдела плечевой кости — техническое примечание.

Кэссиди Дж.Т., Ковени Э., Молони Д. Кэссиди Дж.Т. и др. J Orthop Surg Res. 2019 11 февраля; 14 (1): 41. doi: 10.1186/s13018-019-1083-3. J Orthop Surg Res. 2019. PMID: 30744652 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
термины MeSH
Пластинка «90/90» перелома проксимального отдела плечевой кости — техническое примечание
1. Beredjiklian PK, Iannotti JP, Norris TR, Williams GR. Оперативное лечение Малунион перелома проксимального отдела плечевой кости*. J Bone Joint Surg Am. 1998; 80:1484. doi: 10.2106/00004623-199810000-00010. [PubMed] [CrossRef] [Google Scholar]
2. Shrader MW, Sanchez-Sotelo J, Sperling JW, Rowland CM, Cofield RH. Понимание переломов проксимального отдела плечевой кости: анализ изображений, классификация и лечение. J плечо локоть Surg. 2005;14:497–505.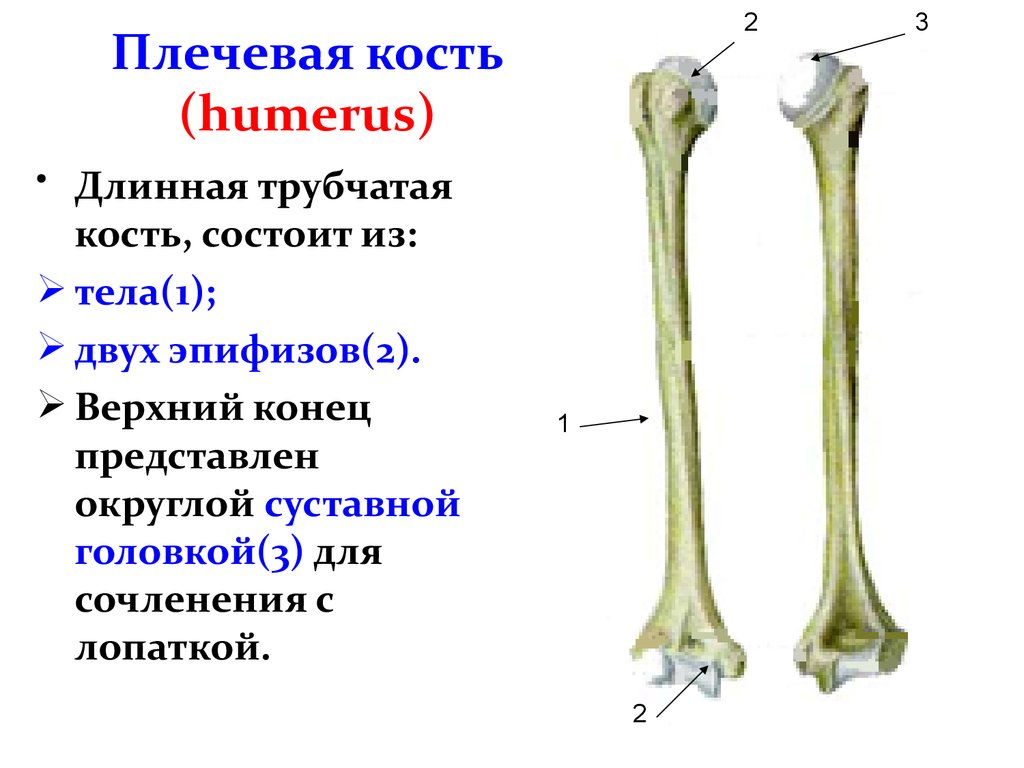 doi: 10.1016/j.jse.2005.02.014. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.jse.2005.02.014. [PubMed] [CrossRef] [Google Scholar]
3. Сандерс Б.С., Буллингтон А.Б., Макгилливэри Г.Р., Хаттон В.К. Биомеханическая оценка закрытой пластины при переломах проксимального отдела плечевой кости. J плечо локоть Surg. 2007; 16: 229–234. doi: 10.1016/j.jse.2006.03.013. [PubMed] [CrossRef] [Google Scholar]
4. Foruria AM, de Gracia MM, Larson DR, Munuera L, Sanchez-Sotelo J. Характер перелома и смещение фрагментов предсказывают исход переломов проксимального отдела плечевой кости. J Bone Joint Surg Br. 2011;93: 378–386. doi: 10.1302/0301-620X.93B3.25083. [PubMed] [CrossRef] [Google Scholar]
5. Sproul RC, Iyengar JJ, Devcic Z, Feeley BT. Систематический обзор фиксации запирающими пластинами переломов проксимального отдела плечевой кости. Рана. 2011;42:408–413. doi: 10.1016/j.injury.2010.11.058. [PubMed] [CrossRef] [Google Scholar]
6. Schliemann B, Wähnert D, Theisen C, Herbort M, Kösters C, Raschke MJ, et al. Как повысить стабильность фиксации замковой пластиной при переломах проксимального отдела плечевой кости? Обзор текущих биомеханических и клинических данных.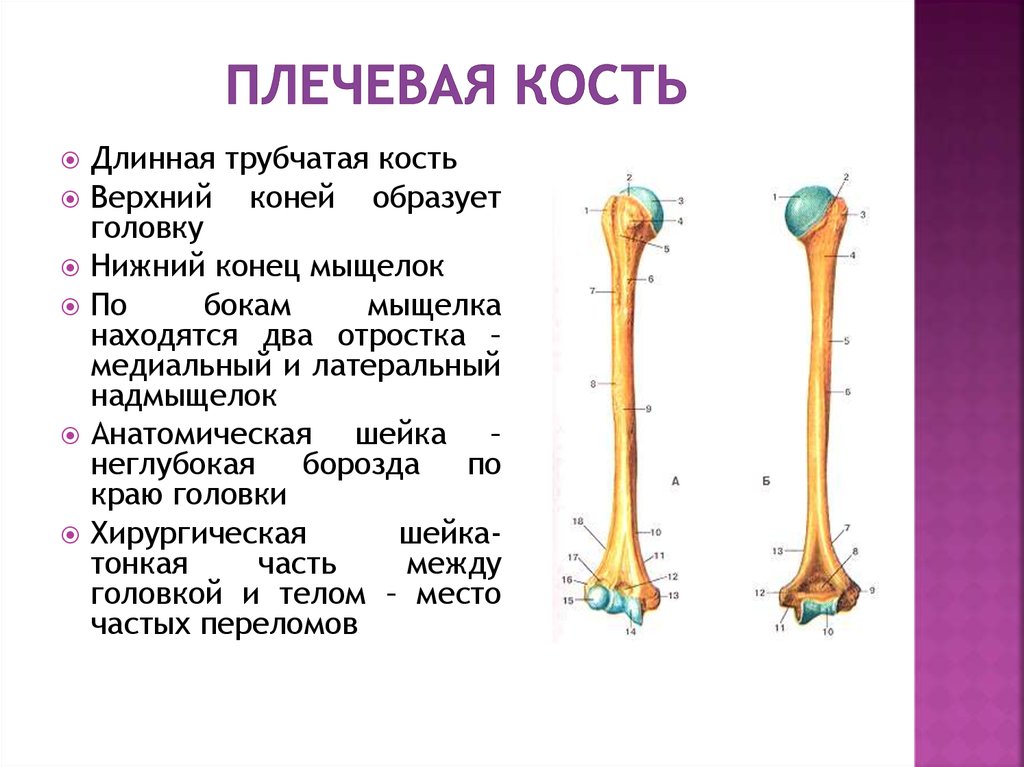 Рана. 2015;46:1207–1214. doi: 10.1016/j.injury.2015.04.020. [PubMed] [CrossRef] [Академия Google]
Рана. 2015;46:1207–1214. doi: 10.1016/j.injury.2015.04.020. [PubMed] [CrossRef] [Академия Google]
7. Юнг С.В., Шим С.Б., Ким Х.М., Ли Дж.Х., Лим Х.С. Факторы, влияющие на уменьшение потери при хирургическом лечении переломов проксимального отдела плечевой кости. J Ортопедическая травма. 2015;29:276–282. doi: 10.1097/BOT.0000000000000252. [PubMed] [CrossRef] [Google Scholar]
8. Blonna D, Rossi R, Fantino G, Maiello A, Assom M, Castoldi F. Вколоченный варусный (A2.2) перелом проксимального отдела плечевой кости у пожилых пациентов: минимальная фиксация оправдано? Исследование случай-контроль. J плечо локоть Surg. 2009; 18: 545–552. doi: 10.1016/j.jse.2009.02.004. [PubMed] [CrossRef] [Google Scholar]
9. Robinson CM, Page RS. Тяжелые вколоченные вальгусные переломы проксимального отдела плечевой кости. Результаты оперативного лечения. J Bone Joint Surg Am. 2003; 85-А: 1647–1655. doi: 10.2106/00004623-200309000-00001. [PubMed] [CrossRef] [Google Scholar]
10.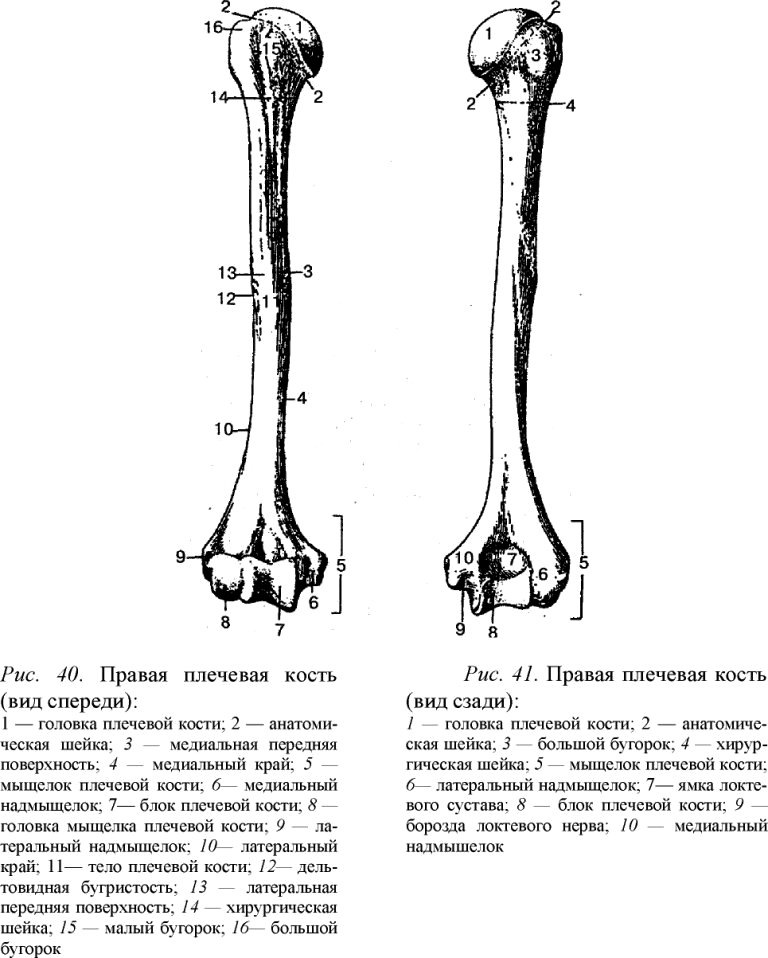 Дилисио М.Ф., Новински Р.Дж., Хацидакис А.М., Ферингер Э.В. Интрамедуллярная фиксация проксимального отдела плечевой кости: эволюция, техника и результаты. J плечевой локоть Surg. 2016;25:e130–e138. doi: 10.1016/j.jse.2015.11.016. [PubMed] [CrossRef] [Академия Google]
Дилисио М.Ф., Новински Р.Дж., Хацидакис А.М., Ферингер Э.В. Интрамедуллярная фиксация проксимального отдела плечевой кости: эволюция, техника и результаты. J плечевой локоть Surg. 2016;25:e130–e138. doi: 10.1016/j.jse.2015.11.016. [PubMed] [CrossRef] [Академия Google]
11. Cha H, Park K-B, Oh S, Jeong J. Лечение многооскольчатых переломов проксимального отдела плечевой кости с использованием блокирующей пластины с распорным аллотрансплантатом. J плечевой локоть Surg. 2017; 26: 781–785. doi: 10.1016/j.jse.2016.09.055. [PubMed] [CrossRef] [Google Scholar]
12. Gardner MJ, Weil Y, Barker JU, Kelly BT, Helfet DL, Lorich DG. Важность медиальной поддержки при закрытой пластине переломов проксимального отдела плечевой кости. J Ортопедическая травма. 2007; 21: 185–191. doi: 10.1097/BOT.0b013e3180333094. [PubMed] [CrossRef] [Академия Google]
13. Невиасер А.С., Хеттрих С.М., Бимер Б.С., Дайнс Дж.С., Лорич Д.Г. Увеличение эндостальной распорки уменьшает осложнения, связанные с блокирующими пластинами проксимального отдела плечевой кости. Clin Orthop Relat Relat Res. 2011; 469:3300–3306. doi: 10.1007/s11999-011-1949-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Clin Orthop Relat Relat Res. 2011; 469:3300–3306. doi: 10.1007/s11999-011-1949-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Zhang L, Zheng J, Wang W, Lin G, Huang Y, Zheng J, et al. Клиническая польза медиальных опорных винтов при блокировании переломов проксимального отдела плечевой кости: проспективное рандомизированное исследование. Инт Ортоп. 2011; 35:1655–1661. doi: 10.1007/s00264-011-1227-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Kwon BK, Goertzen DJ, O’Brien PJ, Broekhuyse HM, Oxland TR. Биомеханическая оценка фиксации перелома проксимального отдела плечевой кости с добавлением кальций-фосфатного цемента. J Bone Joint Surg Am. 2002; 84-А: 951–961. doi: 10.2106/00004623-200206000-00009. [PubMed] [CrossRef] [Google Scholar]
16. Krappinger D, Bizzotto N, Riedmann S, Kammerlander C, Hengg C, Kralinger FS. Прогнозирование неудач после хирургической фиксации переломов проксимального отдела плечевой кости. Рана.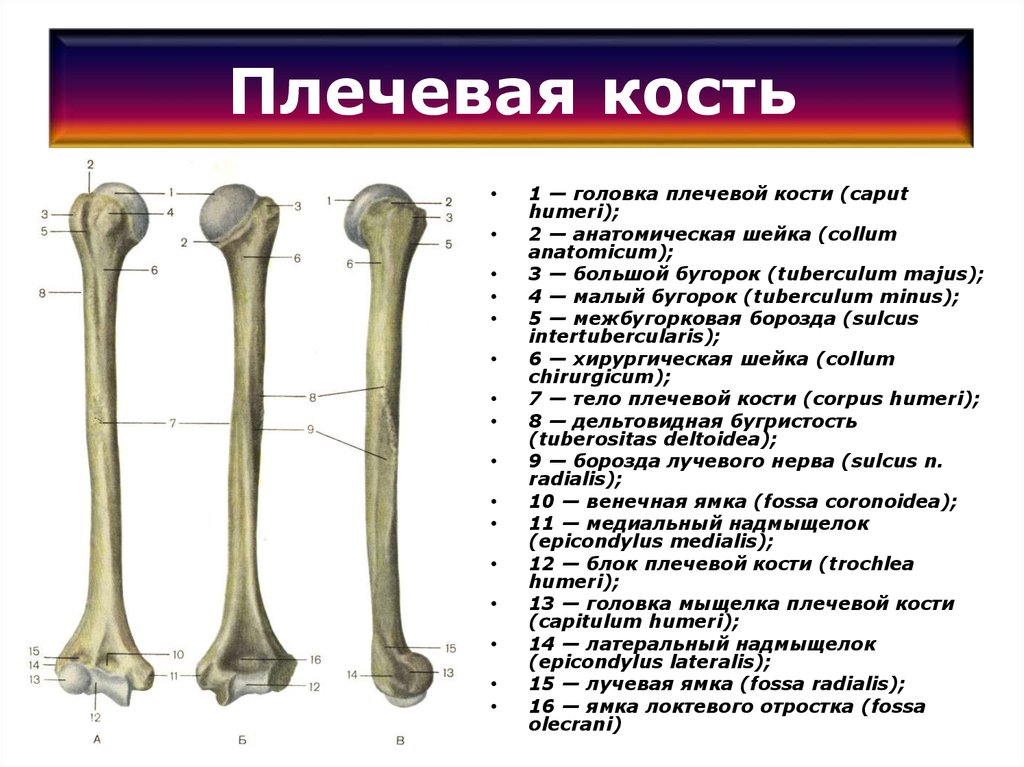 2011;42:1283–1288. doi: 10.1016/j.injury.2011.01.017. [PubMed] [CrossRef] [Академия Google]
2011;42:1283–1288. doi: 10.1016/j.injury.2011.01.017. [PubMed] [CrossRef] [Академия Google]
17. Lescheid J, Zdero R, Shah S, Kuzyk PRT, Schemitsch EH. Биомеханика закрытой пластины для восстановления переломов проксимального отдела плечевой кости с медиальной кортикальной поддержкой или без нее. J Травма неотложной помощи Surg. 2010;69:1235–1242. doi: 10.1097/TA.0b013e3181beed96. [PubMed] [CrossRef] [Google Scholar]
18. Resch H, Tauber M, Neviaser RJ, Neviaser AS, Majed A, Halsey T, et al. Классификация переломов проксимального отдела плечевой кости на основе патоморфологического анализа. J плечевой локоть Surg. 2016; 25: 455–462. doi: 10.1016/j.jse.2015.08.006. [PubMed] [CrossRef] [Академия Google]
19. Корт-Браун CM, McQueen MM. Вколоченный варусный (А2.2) перелом проксимального отдела плечевой кости: прогноз исхода и результаты консервативного лечения у 99 пациентов. Акта Ортоп Сканд. 2004; 75: 736–740. doi: 10.1080/00016470410004111. [PubMed] [CrossRef] [Google Scholar]
20.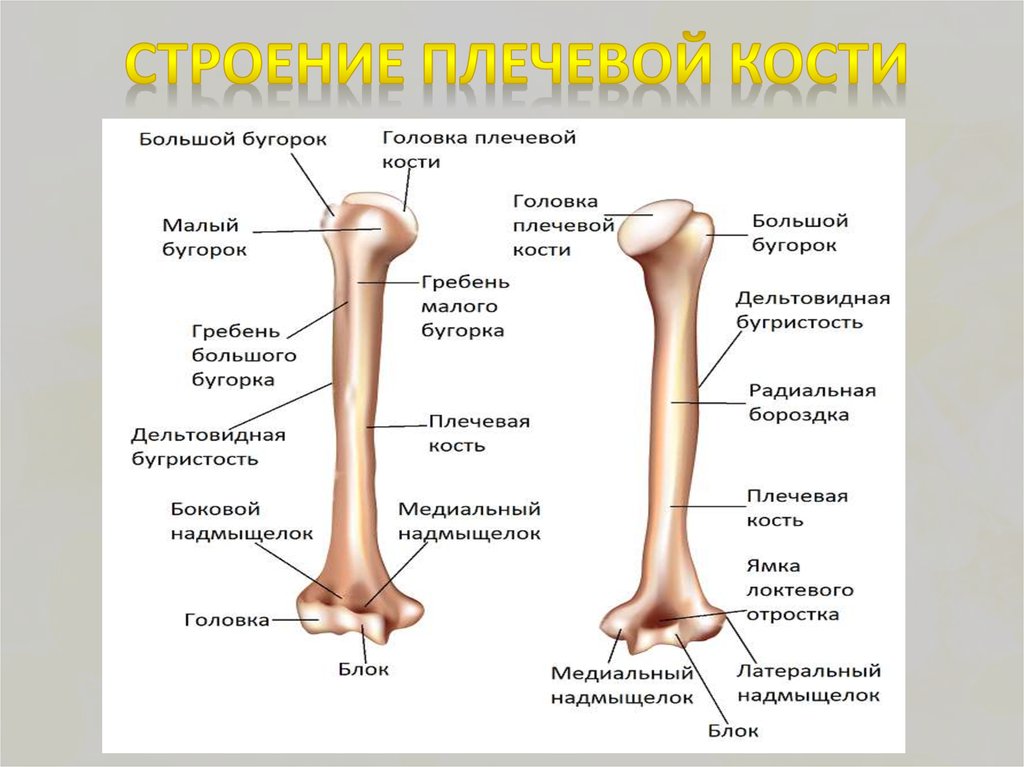 Robinson CM, Wylie JR, Ray AG, Dempster NJ, Olabi B, Seah KTM, et al. Переломы проксимального отдела плечевой кости с выраженной варусной деформацией лечили фиксацией блокирующей пластиной. J Bone Joint Surg Br. Британское редакционное общество хирургии костей и суставов; 2010;92: 672–678. [PubMed]
Robinson CM, Wylie JR, Ray AG, Dempster NJ, Olabi B, Seah KTM, et al. Переломы проксимального отдела плечевой кости с выраженной варусной деформацией лечили фиксацией блокирующей пластиной. J Bone Joint Surg Br. Британское редакционное общество хирургии костей и суставов; 2010;92: 672–678. [PubMed]
21. Voigt C, Geisler A, Hepp P, Schulz AP, Lill H. Преимущество винтов с полиаксиальной фиксацией при остеосинтезе пластинами переломов проксимального отдела плечевой кости у пожилых людей? Проспективное рандомизированное клиническое обсервационное исследование. J Ортопедическая травма. 2011; 25: 596–602. doi: 10.1097/BOT.0b013e318206eb46. [PubMed] [CrossRef] [Google Scholar]
22. Zhu Y, Lu Y, Shen J, Zhang J, Jiang C. Фиксация интрамедуллярных штифтов и блокирующих пластин при лечении хирургических переломов шейки проксимального отдела плечевой кости, состоящих из двух частей: перспектива рандомизированное исследование с последующим наблюдением не менее трех лет. J Bone Joint Surg Am.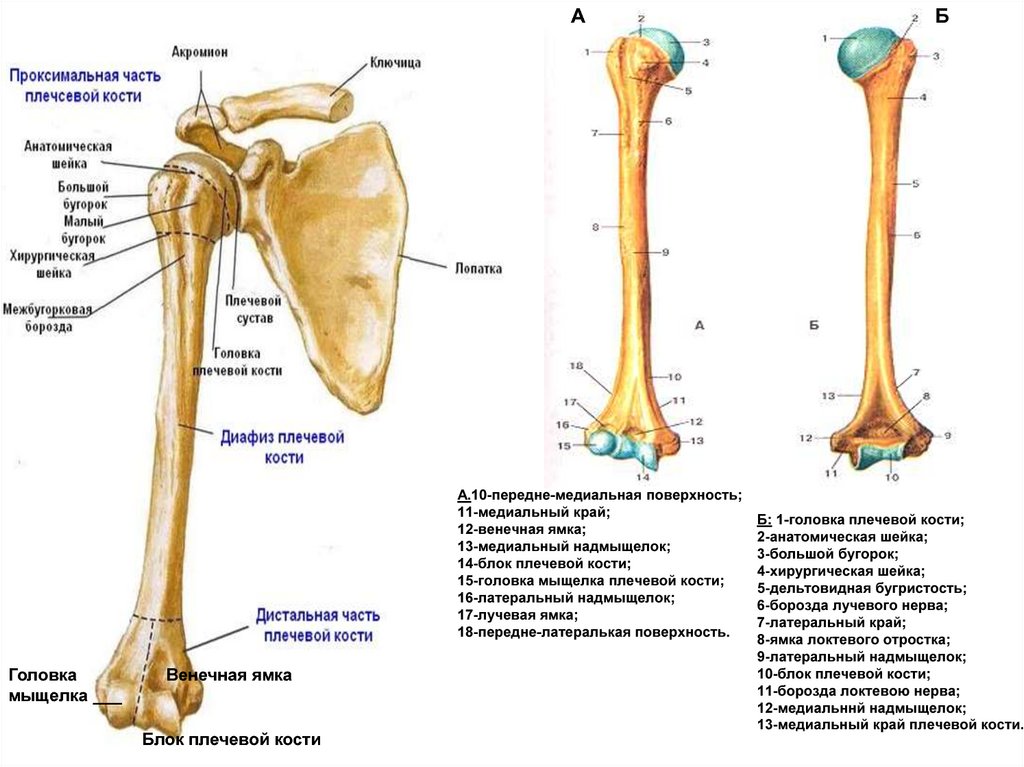 2011;93: 159–168. doi: 10.2106/JBJS.J.00155. [PubMed] [CrossRef] [Google Scholar]
2011;93: 159–168. doi: 10.2106/JBJS.J.00155. [PubMed] [CrossRef] [Google Scholar]
23. Schliemann B, Seifert R, Rosslenbroich SB, Theisen C, Wähnert D, Raschke MJ, et al. Винтовая аугментация уменьшает подвижность на границе кость-имплантат: биомеханическое исследование фиксации запирающей пластиной при переломах проксимального отдела плечевой кости. J плечевой локоть Surg. 2015; 24:1968–1973. doi: 10.1016/j.jse.2015.06.028. [PubMed] [CrossRef] [Google Scholar]
24. Got C, Shuck J, Biercevicz A, Paller D, Mulcahey M, Zimmermann M, et al. Биомеханическое сравнение параллели с 90-90 покрытие двухколонных переломов дистального отдела плечевой кости с внутрисуставным раздроблением. J Hand Surg. 2012;37:2512–2518. doi: 10.1016/j.jhsa.2012.08.042. [PubMed] [CrossRef] [Google Scholar]
25. Wanner GA, Wanner-Schmid E, Romero J, Hersche O, Smekal v A, Trentz O, et al. Внутренняя фиксация переломов проксимального отдела плечевой кости со смещением двумя третичными трубчатыми пластинами.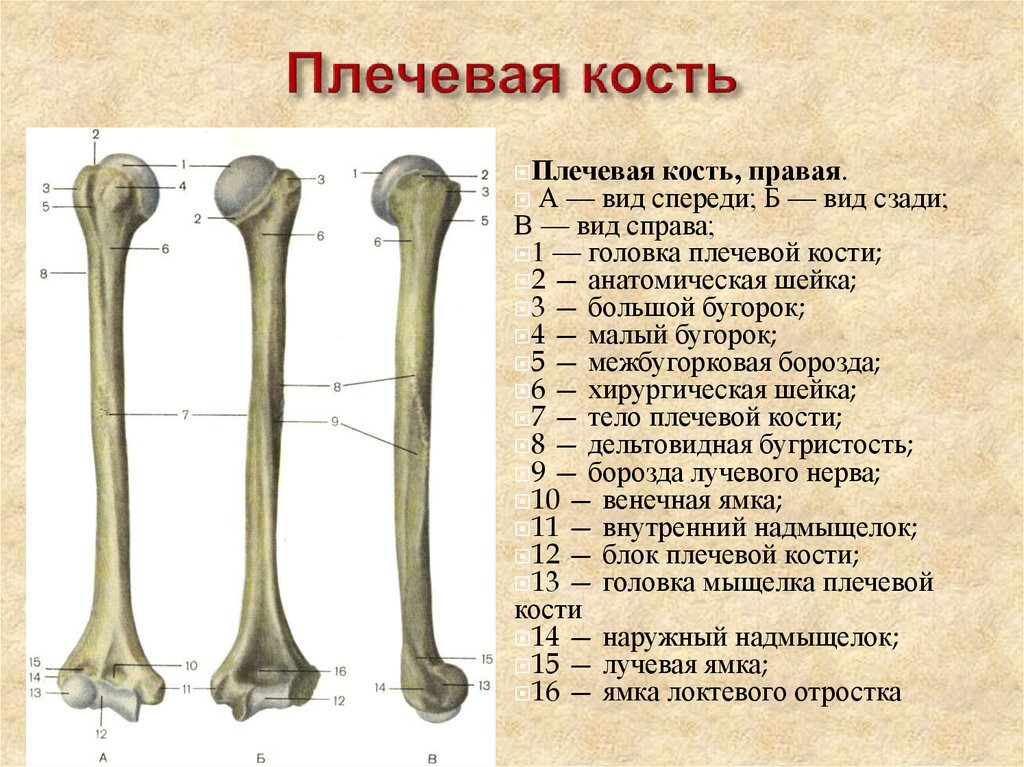 J Травматическая травма Infect Crit Care. 2003; 54: 536–544. doi: 10.1097/01.TA.0000052365.96538.42. [PubMed] [CrossRef] [Академия Google]
J Травматическая травма Infect Crit Care. 2003; 54: 536–544. doi: 10.1097/01.TA.0000052365.96538.42. [PubMed] [CrossRef] [Академия Google]
26. Hessmann MH, Korner J, Hofmann A, Sternstein W, Rommens PM. Фиксация угловой пластиной или остеосинтез двойной пластиной при переломах проксимального отдела плечевой кости: биомеханическое исследование. Biomed Tech (Берл) 2008; 53: 130–137. doi: 10.1515/BMT.2008.018. [PubMed] [CrossRef] [Google Scholar]
27. Neviaser AS, Hettrich CM, Dines JS, Lorich DG. Частота аваскулярного некроза после переломов проксимального отдела плечевой кости, леченных латеральной фиксирующей пластиной и эндостальным имплантатом. Arch Orthop Trauma Surg. 2011; 131:1617–1622. doi: 10.1007/s00402-011-1366-6. [PubMed] [CrossRef] [Академия Google]
28. Laux CJ, Grubhofer F, Werner CML, Simmen H-P, Osterhoff G. Современные концепции фиксации замковыми пластинами при переломах проксимального отдела плечевой кости. J Orthop Surg Res. 2017;12:137. doi: 10.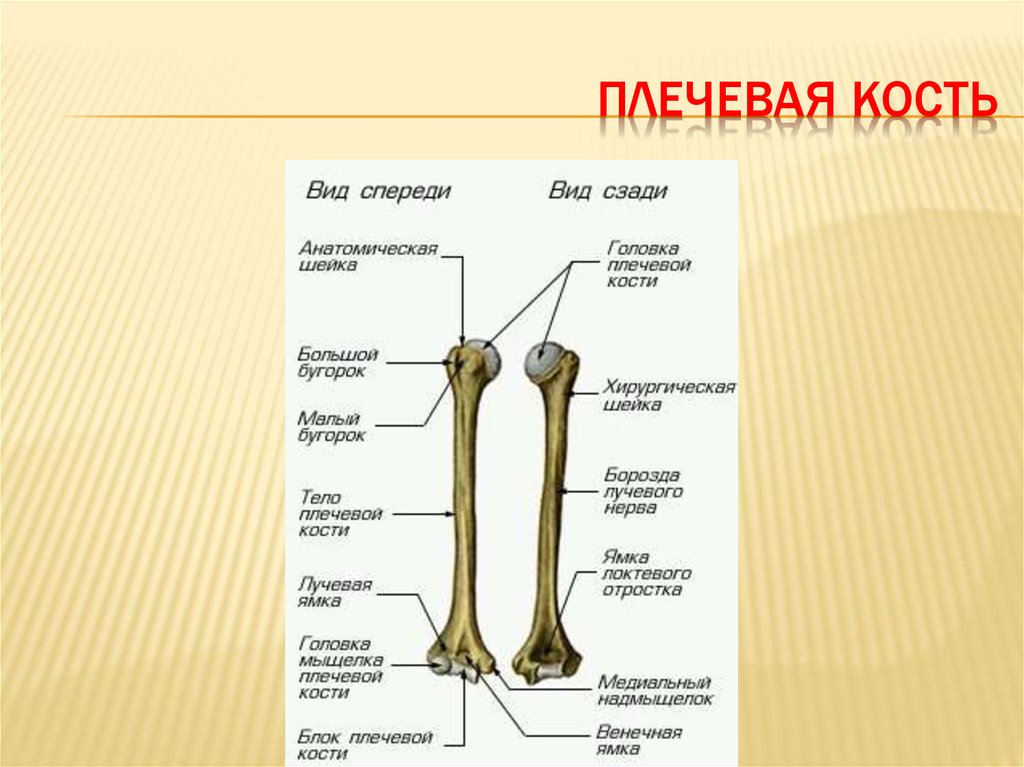 1186/s13018-017-0639-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1186/s13018-017-0639-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Gerber C, Schneeberger AG, Vinh TS. Артериальная васкуляризация головки плечевой кости. Анатомическое исследование. J Bone Joint Surg Am. 1990; 72: 1486–1494. doi: 10.2106/00004623-19
00-00009. [PubMed] [CrossRef] [Академия Google]
30. Duparc F, Muller JM, Fréger P. Артериальное кровоснабжение проксимального эпифиза плечевой кости. Сур Радиол Анат. 2001; 23: 185–190. doi: 10.1007/s00276-001-0185-9. [PubMed] [CrossRef] [Google Scholar]
Переломы плечевой кости
Введение
Переломы плечевой кости, охватывающие диафиз плечевой кости, являются распространенными переломами человеческого скелета. Хотя переломы ключицы (ключицы) и проксимального отдела плечевой кости встречаются чаще, переломы диафиза плечевой кости встречаются часто и могут быть связаны с болью и деформацией. К счастью, большинство переломов диафиза плечевой кости поддаются лечению без хирургического вмешательства.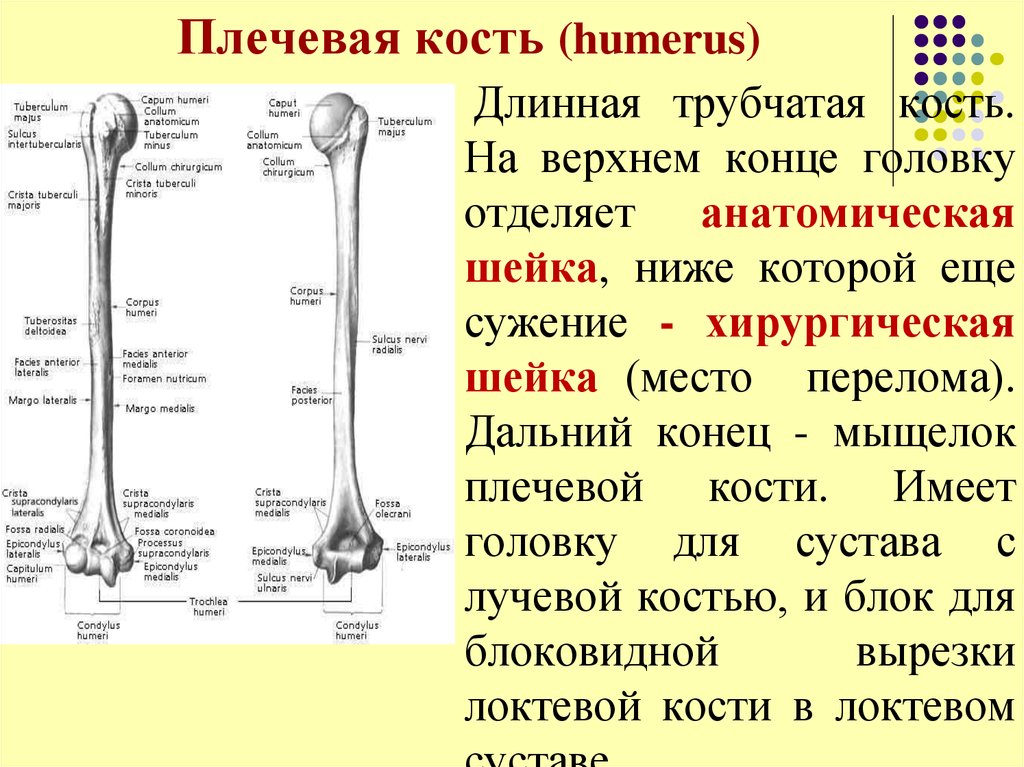
Анатомия
Плечо служит соединением между грудью и рукой. Ключица функционирует как распорка, соединенная с плечевой костью (лопаткой). Лопатка сочленяется с плечевой костью и обеспечивает примерно 70% движения плеча (остальное движение происходит между лопаткой и грудной клеткой). Ваше плечо состоит из трех костей: плечевой кости (плечевой кости), лопатки (лопатки) и ключицы (ключицы).
Правое плечо, вид спереди, показывает ключицу, плечевую кость и лопатку.
Локоть выполняет две различные функции: 1) сгибать и разгибать 2) поворачивать ладонь вверх и ладонью вниз. Для достижения этих целей в сочленении локтя используются три кости — плечевая, локтевая и лучевая.
Вид правого локтя сбоку с демонстрацией плечевой, локтевой и лучевой костей
Плечевой вал соединяется с локтевым суставом. Диафрагма плечевой кости представляет собой длинную трубчатую кость, которая внутри полая (костномозговой канал).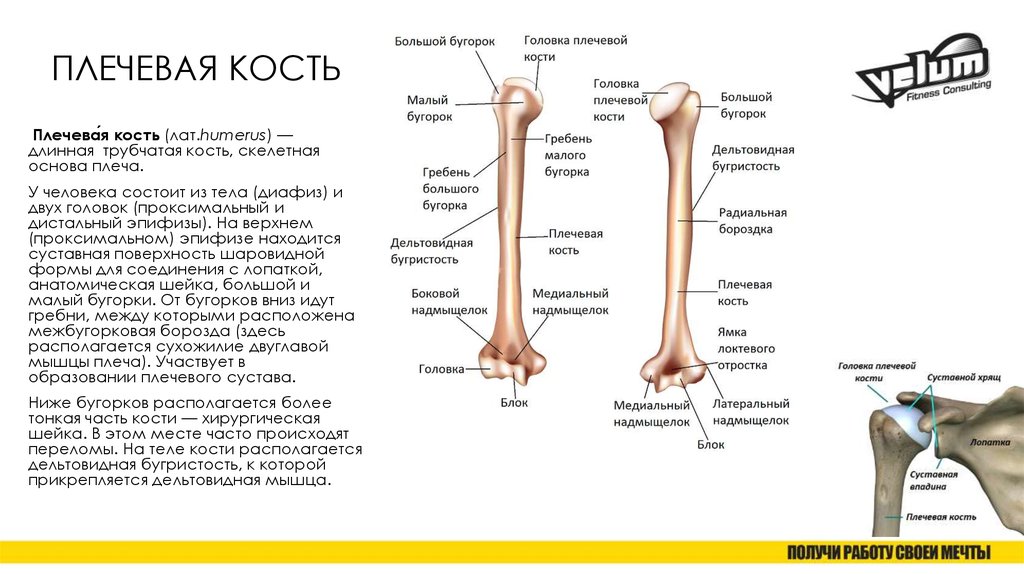 Эта кость крепкая, особенно у молодых людей, но с возрастом, связанным с ослаблением кости (остеопорозом), она может стать менее упругой и склонной к переломам.
Эта кость крепкая, особенно у молодых людей, но с возрастом, связанным с ослаблением кости (остеопорозом), она может стать менее упругой и склонной к переломам.
Правое плечо спереди (спереди) и сзади (сзади). Проксимальная часть представляет собой шаровидный компонент плеча. Дистальный компонент представляет собой шарнирный компонент локтевого сустава. Средний отдел относительно прямой, а плечевой канал позволяет размещать стержни или пластины.
Диагностика
Симптомы
Больные с переломами диафиза плечевой кости жалуются на боль, кровоподтеки, часто деформацию. Вес тяжести на руке вызывает повышенный дискомфорт.
Осмотр хирурга
После изучения симптомов пациента проводится обзор соответствующей истории болезни и семейного анамнеза. Определяют место деформации и проводят неврологическое и сосудистое обследование конечности. У пациентов с переломами диафиза плечевой кости может наблюдаться неврологическая дисфункция, возникающая из-за ушиба нерва во время травмы. Наиболее часто неврологические повреждения возникают в лучевом, мышечно-кожном, локтевом и срединном нервах.
Наиболее часто неврологические повреждения возникают в лучевом, мышечно-кожном, локтевом и срединном нервах.
Визуализирующие исследования
Рентгенологическое исследование диафиза плечевой кости обычно используется для оценки. Эти рентгенограммы должны включать плечо и локоть, поскольку также могут возникать сопутствующие травмы этих суставов. Хотя рентгеновские снимки не отображают мягкие ткани вращательной манжеты плеча, они могут добавить информацию о наличии артрита, перелома или вывиха. Часто рентген может быть единственным исследованием, необходимым для оценки переломов диафиза плечевой кости.
Рентгенограмма левой руки, демонстрирующая перелом диафиза плечевой кости. Этот перелом состоит из трех частей, что означает измельчение. Обратите внимание, что фронтальная рентгенограмма также включает локоть и плечо. Полные рентгенограммы любого перелома также включают вид сбоку (боковой) травмы.
Усовершенствованная визуализация может предоставить дополнительную информацию для понимания картины перелома. Чаще всего используется КТ, так как она дает более четкое изображение кости, чем МРТ. МРТ используется, если подозрение на дополнительные мягкие ткани оправдано.
Чаще всего используется КТ, так как она дает более четкое изображение кости, чем МРТ. МРТ используется, если подозрение на дополнительные мягкие ткани оправдано.
Трехмерная компьютерная томография показывает детали оскольчатого перелома диафиза плечевой кости.
Лечение
Неоперативное лечение
Как показано на изображении выше, большинство переломов плеча без смещения или с минимальным смещением не требуют хирургического вмешательства. Значительная деформация может быть принята без изменений общей функции после заживления. Это связано с суставами как выше, так и ниже перелома (плечевой и локтевой). Повреждения диафиза плечевой кости иммобилизуют для комфорта, и после достижения комфорта начинается программа реабилитации. Для иммобилизации может потребоваться только повязка или фиксация. Фиксация часто может включать пластиковую скобу (ортопласт или Sarmiento) в дополнение к стропе. Пациентов инструктируют по диапазону движений и прогрессируют, чтобы добавить работу на силу. Эти программы часто можно выполнять дома. Восстановление и возвращение к спорту варьируется, но колеблется от 8 до 16 недель.
Эти программы часто можно выполнять дома. Восстановление и возвращение к спорту варьируется, но колеблется от 8 до 16 недель.
Оперативное лечение
Переломы диафиза плечевой кости со смещением могут быть кандидатами на хирургическую стабилизацию. Место повреждения и степень измельчения играют роль в выборе типа стабилизации. Как правило, эти переломы можно стабилизировать либо пластинами, либо винтами, либо введением интрамедуллярных стержней.
ПОСМОТРИТЕ ВИДЕО О ЛЕЧЕНИИ ПЕРЕЛОМОВ ДИАПАЗОНА ПЛЕЧВОЙ ДИАПАЗОНА ПЛАСТИНАМИ И ВИНТАМИ ИЛИ ВНУТРИМЕДУЛЯРНЫМ СТЕРЖНИКОМРисунок A: Оскольчатый перелом диафиза проксимальной трети плечевой кости
Рисунок B и C: Репозиция перелома и стабилизация с помощью длинной пластины и винтов. Обратите внимание, что стабилизация должна охватывать перелом и включать нормальную кость как выше, так и ниже перелома. перелом перекрыт интрамедуллярным стержнем. Обратите внимание, что в проксимальной части был установлен блокирующий винт для улучшения ротационного контроля перелома
Обратите внимание, что стабилизация должна охватывать перелом и включать нормальную кость как выше, так и ниже перелома. перелом перекрыт интрамедуллярным стержнем. Обратите внимание, что в проксимальной части был установлен блокирующий винт для улучшения ротационного контроля перелома
Рисунок справа: Долговременное наблюдение за переломом, показывающее полное заживление (сращение) перелома — обратите внимание, что в дистальном отделе отсутствуют стопорные винты, поскольку стержень достаточно затянут в дистальном направлении, чтобы обеспечить контроль вращения без винтов.
Операция обычно проводится с блокадой нерва и дополнительной анестезией. Операция обычно занимает менее двух часов, а риск переливания крови в большинстве исследований составляет 1%. Выбор типа внутренней фиксации зависит от локализации перелома, раздробления и особенностей пациента. Преимущества интрамедуллярного введения гвоздей включают меньшие разрезы, поскольку стержень обычно помещается под рентгеноскопическим (рентгеновским) контролем.
Не все переломы поддаются фиксации стержнем. Пластины и винты обладают преимуществом жесткой фиксации переломов вблизи суставов (околосуставных). Необходимость медицинской профилактики образования тромбов в глубоких венах после операции является спорной и варьируется от отсутствия до применения аспирина, механической компрессии и средств, разжижающих кровь. Другие стандартные риски, связанные с хирургией и эндопротезированием, применимы к этим типам процедур.
Реабилитация
После операции рука иммобилизуется на перевязи для обеспечения заживления раны. Пациенты сообщают о боли после операции, но в целом боль уменьшается, и было показано, что использование мультимодальных методов обезболивания улучшает результаты для пациентов. Ночная боль, как правило, является наиболее проблематичной, но мультимодальные программы лечения боли, жара и сон на возвышении могут облегчить эту проблему.
Многие исследования показали, что пациенты могут успешно реабилитировать плечо самостоятельно в домашних условиях. Пациенты обычно проходят программу терапии и отлучаются от повязки в течение первых 2-6 недель. Заживление костей обычно занимает 8-12 недель. Пациенты, которые продолжают работать над движением и силой, показывают улучшение на срок до 1 года после операции.
Пациенты обычно проходят программу терапии и отлучаются от повязки в течение первых 2-6 недель. Заживление костей обычно занимает 8-12 недель. Пациенты, которые продолжают работать над движением и силой, показывают улучшение на срок до 1 года после операции.
Д-р Грох — опытный хирург плечевого сустава
- Включен в список 60 лучших хирургов плечевого сустава в США по версии Becker’s Orthopedics
- Активный член Американской ассоциации хирургов плечевого и локтевого суставов
- Написано 50 статей и учебников по травмам плеча
- Имеет патенты и разработал несколько плечевых имплантатов и устройств
Физиотерапия перелома тела плечевой кости у взрослых
Введение
Физиотерапия плеча в Корпус-Кристи
Добро пожаловать в справочник Центров физиотерапии и спортивной медицины Humpal по переломам плечевой кости у взрослых.
Плечевая кость идет от плечевого сустава к локтевому суставу и должна быть достаточно прочной, чтобы выдерживать значительный вес, когда вы что-то поднимаете или толкаете. Это одна из трех больших костей тела. Только бедренная кость (бедренная кость) и большеберцовая кость (берцовая кость) крупнее и сильнее. Без функционирующей плечевой кости вы не можете расположить руку в пространстве или использовать локоть.
Чтобы сломать плечевую кость, нужно приложить довольно много усилий, и это серьезная травма, практически полностью лишающая функции руки. С положительной стороны, поскольку она окружена мышцами, кость отлично кровоснабжается и имеет хорошую репутацию в плане заживления.
Это руководство поможет вам понять:
- какие части руки задействованы
- какие симптомы
- что может вызвать эти переломы
- как медицинские работники диагностируют эти переломы
- какие есть варианты лечения
- что такое подход центра физиотерапии и спортивной медицины Humpal к реабилитации
Анатомия
Какие структуры чаще всего повреждаются?
Плечевая кость имеет закругленный конец (головка плечевой кости), образующий часть плечевого сустава.
Он соединяется с телом кости областью, называемой шейкой плечевой кости. Большая часть стержня кости имеет трубчатую форму, но уплощается на нижнем конце.
Плечо настолько мускулистое, что нащупать настоящую кость довольно сложно. В этом руководстве мы рассматриваем травмы трубчатого стержня плечевой кости.
Диафрагма плечевой кости может быть сломана практически в любом месте по ее длине, хотя перелом чаще встречается в середине диафиза и ниже.
Существуют различные модели переломов в зависимости от механизма повреждения, но все они включают полный перелом по всей окружности трубчатой кости. У взрослых практически невозможно разорвать трубку только с одной стороны. Это важно, потому что это означает, что любой перелом плечевой кости прерывает функцию руки. Вы не можете поднять или повернуть руку ниже брейка.
Связанный документ: Humpal Physical Therapy & Sports Medicine Centers Guide to Shoulder Anatomy
Причины
Как часто происходят переломы плечевой кости?
Как и любую большую длинную кость тела, сила, которая ломает плечевую кость, может быть сгибающей, сжимающей или скручивающей. Сочетание этих сил является наиболее распространенным. Удар по плечу, вызывающий сгибающую силу кости, является наименее распространенным механизмом травмы. Этот тип травмы возникает при высокоэнергетической травме, такой как автомобильная авария или падение с высоты.
Сочетание этих сил является наиболее распространенным. Удар по плечу, вызывающий сгибающую силу кости, является наименее распространенным механизмом травмы. Этот тип травмы возникает при высокоэнергетической травме, такой как автомобильная авария или падение с высоты.
Косвенные сгибающие силы возникают при падении на вытянутую руку или локоть. Это относительно частая причина изолированного перелома плечевой кости, довольно часто встречающаяся у пожилых людей. У пожилых людей кость может быть более хрупкой, чем обычно, из-за остеопороза, поэтому она может сломаться при падениях, которые обычно кажутся безвредными.
Типы
Какие виды переломов существуют?
Из-за толстого слоя мышц вокруг диафиза плечевой кости открытые переломы встречаются редко.
Открытые переломы возникают при ударных травмах высокой энергии и огнестрельных ранениях, но гораздо реже встречаются при событиях с меньшей энергией, таких как падения и метательные травмы.
Патологические переломы через аномальную кость часто возникают при остеопорозе, а также могут возникать при наличии раковых отложений в диафизе плечевой кости.
Это редкое явление, но у некоторых людей оно может быть первым признаком рака.
Переломы диафиза плечевой кости, возникающие в результате сгибающих усилий, могут иметь короткую косую форму или могут иметь множественные отломки.
Компрессионные переломы возникают, когда сила направлена преимущественно вдоль линии кости.
Это может произойти при падении с высоты. Характер перелома чаще поперечный.
Повреждения скручивания приводят к спиральному перелому диафиза плечевой кости. Это может произойти, когда нижняя часть руки заблокирована или застряла в механизме, а тело вращается. Известно, что прямые скручивающие силы, как в армрестлинге, вызывают спиральные переломы, как и метание. При метании гранаты во время военных учений особенно высока частота спиральных переломов плечевой кости!
Повреждение мягких тканей вокруг перелома плечевой кости может быть значительным. После перелома кости острые концы разрывают близлежащие структуры, такие как мышцы и даже нервы или кровеносные сосуды. Лучевой нерв, иннервирующий мышцы, разгибающие запястье и пальцы, проходит рядом с диафизом плечевой кости. Он достаточно уязвим для травм. Другие нервы и крупные кровеносные сосуды повреждаются реже, но могут быть повреждены как часть огнестрельного ранения или обширной рваной раны.
После перелома кости острые концы разрывают близлежащие структуры, такие как мышцы и даже нервы или кровеносные сосуды. Лучевой нерв, иннервирующий мышцы, разгибающие запястье и пальцы, проходит рядом с диафизом плечевой кости. Он достаточно уязвим для травм. Другие нервы и крупные кровеносные сосуды повреждаются реже, но могут быть повреждены как часть огнестрельного ранения или обширной рваной раны.
Симптомы
Какие симптомы вызывают переломы плечевой кости?
Внезапная сильная боль после аварии или резкого удара по плечу характерна для перелома. Нижняя часть руки обмякнет, потому что нижняя часть руки неуправляема. Это может вызвать сильную боль в месте перелома при движении. Обычно пациент неподвижно держит локоть или предплечье, прижимая их к телу. Боль усиливается при попытке пошевелить рукой или при пассивных движениях предплечья. Возможна деформация плеча с явным изгибом кости.
Возможна деформация плеча с явным изгибом кости.
При открытом переломе рана обычно очевидна, и можно увидеть концы костей. Даже небольшая рваная рана при наличии перелома должна вызвать подозрение на открытый перелом. Место перелома быстро опухает после аварии, так как кости и мышцы кровоточат в ткани. Пурпурное обесцвечивание и кровоподтеки видны в течение нескольких часов после травмы.
В более редких случаях, когда имело место повреждение нерва, у пациента отмечается онемение и потеря подвижности ниже места разрыва. Наиболее частым паттерном является отсутствие движения мышц, иннервируемых лучевым нервом. Больной не может разогнуть или поднять запястье и разогнуть пальцы. Это называется опусканием запястья. Если кровеносные сосуды были повреждены, рука может стать холодной и онемевшей. Пульс на запястье может отсутствовать.
Даже после лечения, направленного на стабилизацию перелома, будут сохраняться симптомы боли, чувствительности, отека, синяков и боли при движении рукой. Они вызваны в значительной степени повреждением мышц вокруг сломанной кости и кровотечением в ткани, вызванным переломом. Эти симптомы будут продолжаться в течение нескольких недель, но постепенно улучшатся. Усиление боли, изменение качества боли или новое развитие онемения могут быть причиной для беспокойства и должны быть сообщены вашему врачу.
Они вызваны в значительной степени повреждением мышц вокруг сломанной кости и кровотечением в ткани, вызванным переломом. Эти симптомы будут продолжаться в течение нескольких недель, но постепенно улучшатся. Усиление боли, изменение качества боли или новое развитие онемения могут быть причиной для беспокойства и должны быть сообщены вашему врачу.
Оценка
Как будет оцениваться мой перелом?
Первая помощь на месте происшествия обычно состоит из лечения шока, наложения повязок на раны, если это необходимо, и наложения шины на руку. Обычная повязка немного поможет, но обертывание бинта вокруг грудной клетки, чтобы привязать руку к туловищу, может облегчить боль более полно. Пациент должен быть переведен в больницу для окончательного лечения как можно скорее.
В отделении неотложной помощи основное внимание уделяется обеспечению комфорта пациента, диагностике всех травм и получению консультации ортопеда. Медсестры и врачи скорой помощи осмотрят руку и снимут одежду, чтобы можно было осмотреть всю руку. Это может означать, что одежду отрезают, чтобы предотвратить дальнейшую боль или повреждение руки. При осмотре обращают внимание на болезненное место, любую деформацию руки, а также на иннервацию и кровоснабжение предплечья и кисти. Будет сделан рентген, чтобы показать всю плечевую кость от плеча до локтя. Обычно делаются две проекции: переднезадняя (AP) проекция спереди назад и боковая проекция сбоку.
Медсестры и врачи скорой помощи осмотрят руку и снимут одежду, чтобы можно было осмотреть всю руку. Это может означать, что одежду отрезают, чтобы предотвратить дальнейшую боль или повреждение руки. При осмотре обращают внимание на болезненное место, любую деформацию руки, а также на иннервацию и кровоснабжение предплечья и кисти. Будет сделан рентген, чтобы показать всю плечевую кость от плеча до локтя. Обычно делаются две проекции: переднезадняя (AP) проекция спереди назад и боковая проекция сбоку.
Ортопедическая оценка этой травмы обычно проводится после постановки диагноза врачом скорой помощи и командой. Хирург-ортопед оценит общее состояние здоровья пациента и повторит осмотр руки, обращая внимание на нервы и кровоснабжение, а также на любые раны. Чтобы сформировать план лечения, хирург должен просмотреть рентгеновские снимки и обсудить травму с пациентом. Это обсуждение будет включать в себя работу пациента, образ жизни и ожидания, а также варианты лечения и ожидаемый результат. Если есть необычные признаки, такие как другие серьезные медицинские проблемы или патологический перелом, могут быть вызваны другие консультанты. Обычно нет необходимости делать дополнительные рентгенограммы плечевой кости или проводить специальные тесты, такие как компьютерная томография или магнитно-резонансная томография.
Если есть необычные признаки, такие как другие серьезные медицинские проблемы или патологический перелом, могут быть вызваны другие консультанты. Обычно нет необходимости делать дополнительные рентгенограммы плечевой кости или проводить специальные тесты, такие как компьютерная томография или магнитно-резонансная томография.
Наше лечение
Какое лечение следует рассмотреть?
Нехирургическое лечение
Этот перелом часто лечится с помощью гипсовой повязки. Самый распространенный тип гипсовой повязки — висячая. Эту повязку накладывают, согнув локоть под прямым углом. Гипс проходит от локтя до суставов и предотвращает движение локтя, предплечья и запястья, оставляя пальцы свободными для движения.
Гипс подвешивается на шее к кольцу, прикрепленному к предплечью гипса. Эту точку подвеса выбирают таким образом, чтобы плечо свисало прямо, когда пациент сидит или стоит. Гипс не фиксирует перелом, а использует тягу от веса висящего гипса, чтобы расположить руку так, чтобы перелом был прямым.
Гипс не фиксирует перелом, а использует тягу от веса висящего гипса, чтобы расположить руку так, чтобы перелом был прямым.
В течение первых нескольких недель лечения вы обычно можете почувствовать некоторое движение в месте перелома, особенно когда вы ложитесь и кость имеет тенденцию сгибаться.
По мере заживления и укрепления ткани в месте перелома это ощущение движения исчезает. Как только перелом достиг этой стадии заживления, гипс можно снять. На этом этапе многие хирурги используют съемную скобу на плече и продолжают защиту в повязке.
Рентген часто делается в начале лечения, чтобы убедиться, что положение перелома является приемлемым. К шести неделям заживающая костная ткань (мозоль), перекрывающая место перелома, становится достаточно зрелой, чтобы ее можно было увидеть на рентгеновском снимке, и имеет около 50% своей возможной прочности. Эта мостовидная мозоль не такая прочная, как нормальная кость, но является хорошим признаком того, что кость заживает. К трем месяцам после травмы заживающая костная ткань примерно на 80% крепче, чем должна быть. С точки зрения функции это означает, что рука нуждается в защите в гипсовой повязке или корсете в течение шести или более недель. По истечении этого времени должно наблюдаться некоторое ограничение функции до трех месяцев после травмы. Этот график зависит от состояния заживления перелома — это может занять больше времени. Возвращение к тяжелой работе или занятиям спортом менее предсказуемо и будет зависеть от оценки хирургом прочности заживающей кости. Известно некоторое улучшение прочности заживающей кости в течение 18 месяцев после травмы.
К трем месяцам после травмы заживающая костная ткань примерно на 80% крепче, чем должна быть. С точки зрения функции это означает, что рука нуждается в защите в гипсовой повязке или корсете в течение шести или более недель. По истечении этого времени должно наблюдаться некоторое ограничение функции до трех месяцев после травмы. Этот график зависит от состояния заживления перелома — это может занять больше времени. Возвращение к тяжелой работе или занятиям спортом менее предсказуемо и будет зависеть от оценки хирургом прочности заживающей кости. Известно некоторое улучшение прочности заживающей кости в течение 18 месяцев после травмы.
Этот безоперационный метод лечения перелома диафиза плечевой кости обычно не приводит к полному выпрямлению кости. Из-за отличного диапазона движений в плече степень угла наклона в месте перелома не влияет на функцию руки и может быть допустима. Небольшой угол наклона также косметически приемлем, поскольку его скрывают мышцы руки.
Хирургия
Некоторые ситуации и некоторые модели переломов требуют хирургического вмешательства. Любой открытый перелом требует операции, чтобы вымыть весь грязный материал и удалить все мертвые ткани. Вопрос о том, следует ли фиксировать открытые переломы, является спорным. Некоторые хирурги фиксируют перелом, поскольку считают, что инфекция менее вероятна и менее опасна, если перелом остается неподвижным. Другие хирурги проводят санацию раны, чтобы очистить рану, но после этого лечат пациента в гипсовой повязке, потому что они считают, что минимальное вмешательство в кровоснабжение открытого перелома лучше. Внешняя фиксация каркасом и штифтами может использоваться при некоторых открытых переломах после хирургической обработки раны.
Любой открытый перелом требует операции, чтобы вымыть весь грязный материал и удалить все мертвые ткани. Вопрос о том, следует ли фиксировать открытые переломы, является спорным. Некоторые хирурги фиксируют перелом, поскольку считают, что инфекция менее вероятна и менее опасна, если перелом остается неподвижным. Другие хирурги проводят санацию раны, чтобы очистить рану, но после этого лечат пациента в гипсовой повязке, потому что они считают, что минимальное вмешательство в кровоснабжение открытого перелома лучше. Внешняя фиксация каркасом и штифтами может использоваться при некоторых открытых переломах после хирургической обработки раны.
Другим веским показанием к операции является наличие множественных повреждений. Если пациент попал в аварию с переломами ног или другой руки, может быть лучше зафиксировать сломанную плечевую кость, чтобы рука могла двигаться как единое целое. Очень неудобно ухаживать за больным с гипсовой повязкой на руке и сломанной ногой. Использование костылей может быть затруднено до тех пор, пока сломанная рука не окрепнет. Эта стадия достигается быстрее при хирургической фиксации.
Эта стадия достигается быстрее при хирургической фиксации.
Третьей основной причиной проведения операции по фиксации перелома плечевой кости является неприемлемость результата консервативного лечения по мнению хирурга или после обсуждения с пациентом. В эту категорию попадают модели переломов, которые приводят к неприемлемому неправильному сращению или имеют очень высокий риск несращения. Пациент может предпочесть операцию, чтобы ускорить выздоровление.
Для фиксации переломов плечевой кости используются три типа операций:
- Внутренняя фиксация пластиной и винтами
- Внутренняя фиксация интрамедуллярным стержнем
- Внешняя фиксация
Внутренняя фиксация пластиной и винтами
Операция пластиной и винтами требует вскрытия перелома, обнажения кости и соединения отломков, а затем удержания их на месте винтами из металлической пластины, входящей в кость. Эта система обеспечивает жесткую надежную фиксацию, а также может сжимать фрагменты кости вместе. Это помогает исцелению. Обнажение места перелома позволяет точно свести отломки, но не нарушает кровоснабжение места перелома. Костный трансплантат может быть помещен в место перелома, чтобы помочь заживлению, если это будет сочтено необходимым.
Это помогает исцелению. Обнажение места перелома позволяет точно свести отломки, но не нарушает кровоснабжение места перелома. Костный трансплантат может быть помещен в место перелома, чтобы помочь заживлению, если это будет сочтено необходимым.
Удаление имплантата (пластины и винтов) может быть рассмотрено после заживления и консолидации перелома, особенно если участок болезненный или болезненный. Эта операция требует повторного обнажения участка, но восстановление происходит намного быстрее, поскольку кость не требует серьезного заживления.
Внутренняя фиксация интрамедуллярным стержнем
При интрамедуллярной фиксации (интрамедуллярный стержень) плечевой кости перелом репонируется непрямым путем, без вскрытия.
На плече делают небольшой разрез, в кость на уровне плеча вводят металлический стержень, который проводят вниз внутри кости и через перелом в нижний фрагмент. Это правильно выстроит костные фрагменты. Кость надежно удерживается винтами, пропущенными через кость и в стержень с обоих концов.
Основным преимуществом этого метода фиксации является то, что место перелома не нарушается, что способствует лучшему кровоснабжению костных отломков. Он также очень прочный механически. Технически это сложная операция, требующая специальных инструментов и рентгеновской системы для наблюдения за переломом во время операции. Верхний конец стержня может вызывать раздражение и вызывать болезненные движения плечом. Почти всегда необходимо удалить стержень после заживления перелома. Удаление стержня является относительно небольшой операцией, которая требует анестезии, но обычно выполняется в рамках дневной хирургии.
Внешняя фиксация
При внешней фиксации в костные фрагменты выше и ниже перелома вставляют прочные металлические штифты.
Штифты прочно прикреплены к раме, которая охватывает трещину.
Удерживает фрагменты в неподвижном состоянии, пока кость срастается. Сама рука может двигаться, находясь в кадре, поэтому функция кисти и локтя не ухудшается.
Поскольку совмещение перелома может быть скорректировано после наложения каркаса, этот метод часто используется при более сложных переломах и переломах с потерей костной массы.
Недостатком является более высокая вероятность инфицирования при прохождении булавок через кожу.
При использовании этой методики штифты и каркас удаляют, как только кость достаточно заживет.
Эта процедура обычно не требует общего наркоза. Перелом, возможно, потребуется защитить скобой на период после удаления рамы.
Реабилитация
Если на перелом наложена гипсовая повязка, реабилитация у физиотерапевта в центрах физиотерапии и спортивной медицины Humpal обычно начинается после снятия гипсовой повязки примерно через шесть недель после травмы. Пока вы находитесь в гипсовой повязке, вашими единственными упражнениями будут простые движения пальцев, упражнения на диапазон движений шеи, а также маятниковые упражнения для облегчения боли и поддержания диапазона движений плеча.
Если вам сделали операцию по фиксации перелома плечевой кости, реабилитация в центрах физиотерапии и спортивной медицины Humpal начнется, как только ваш хирург порекомендует ее. Хирургическая фиксация направлена на то, чтобы сделать место перелома стабильным, поэтому в большинстве случаев легкие упражнения без нагрузки для поддержания диапазона движений безопасны для выполнения на раннем этапе и часто рекомендуются даже сразу после операции. В других случаях реабилитация не рекомендуется до тех пор, пока кости не продемонстрируют некоторые признаки заживления на рентгенограмме (обычно около шести недель). Каждый хирург устанавливает свои собственные ограничения в зависимости от типа перелома, использованной хирургической процедуры, личных опыт, и заживает ли перелом, как ожидалось.
Даже если интенсивная физиотерапия плечевой кости не начнется немедленно, в центрах физиотерапии и спортивной медицины Humpal мы настоятельно рекомендуем поддерживать физическую форму вашего тела с помощью регулярных упражнений. Если ваша плечевая кость была восстановлена хирургическим путем, поддержание общего сердечно-сосудистого состояния может быть достигнуто с помощью упражнений для нижних конечностей, таких как ходьба или использование велотренажера или степпера. Если ваш перелом был наложен гипсовой повязкой, такие действия, возможно, придется подождать, пока кость не покажет некоторое заживление на рентгеновском снимке, поскольку гипсовая повязка используется больше для вытяжения, чем для полной иммобилизации. После хирургической фиксации разрешено использовать утяжелители или тренажеры для нижней конечности и противоположной руки, если строго соблюдаются ограничения, касающиеся заживления плечевой кости. Как правило, поднятие любого веса с помощью поврежденной конечности не допускается и будет затруднено по мере заживления плечевой кости, поэтому вам может потребоваться друг, который поможет вам с настройкой тренировки, если вы хотите продолжать, пока заживает ваша кость. Ваш физиотерапевт может обсудить наиболее подходящий для вас способ поддержания физической формы, соблюдая ограничения вашего хирурга, и может предоставить общую программу физической подготовки, соответствующую вашим потребностям.
Если ваша плечевая кость была восстановлена хирургическим путем, поддержание общего сердечно-сосудистого состояния может быть достигнуто с помощью упражнений для нижних конечностей, таких как ходьба или использование велотренажера или степпера. Если ваш перелом был наложен гипсовой повязкой, такие действия, возможно, придется подождать, пока кость не покажет некоторое заживление на рентгеновском снимке, поскольку гипсовая повязка используется больше для вытяжения, чем для полной иммобилизации. После хирургической фиксации разрешено использовать утяжелители или тренажеры для нижней конечности и противоположной руки, если строго соблюдаются ограничения, касающиеся заживления плечевой кости. Как правило, поднятие любого веса с помощью поврежденной конечности не допускается и будет затруднено по мере заживления плечевой кости, поэтому вам может потребоваться друг, который поможет вам с настройкой тренировки, если вы хотите продолжать, пока заживает ваша кость. Ваш физиотерапевт может обсудить наиболее подходящий для вас способ поддержания физической формы, соблюдая ограничения вашего хирурга, и может предоставить общую программу физической подготовки, соответствующую вашим потребностям.
Когда первый гипс снимается или сразу после операции, вы можете испытывать некоторую боль, когда начинаете двигать плечом, запястьем, локтем и предплечьем. Если вы были в гипсе, эта боль возникает из-за того, что суставы не используются регулярно. Если у вас была операция, боль, скорее всего, связана с самим хирургическим процессом. Ваша боль также может быть вызвана одновременным повреждением мягких тканей, которое произошло при переломе плечевой кости. Сначала ваш физиотерапевт сосредоточится на облегчении вашей боли. Мы можем использовать такие методы, как тепло, лед, ультразвук или электрический ток, чтобы помочь уменьшить боль или отек вокруг места перелома или в любом месте вдоль руки, в плечо или в кисть. Из-за того, что некоторые мышцы шеи и верхней части спины соединяются с плечом, у вас также может быть некоторая боль в этих областях, которую мы будем лечить, чтобы облегчить движения всей верхней части тела. Мы можем массировать шею, верхнюю часть спины, плечо, локоть, предплечье или запястье, чтобы улучшить кровообращение и облегчить боль.
Следующая часть нашего лечения будет направлена на восстановление подвижности, силы и ловкости запястья, кисти, локтя и плеча. Если вам наложили гипс, ваша рука будет выглядеть и ощущаться довольно слабой и атрофированной после снятия гипса. Ваш физиотерапевт назначит серию упражнений на растяжку и укрепление, которые вы будете практиковать в клинике, а также научитесь выполнять в рамках своей домашней программы упражнений. Эти упражнения могут включать использование реабилитационного оборудования, такого как легкие веса или Theraband, которые обеспечивают дополнительное сопротивление для вашей верхней конечности. Плечевой сустав является связующим звеном верхней конечности с остальным телом, поэтому он должен быть сильным и хорошо контролироваться, чтобы конечность и рука могли работать хорошо. Мы также можем использовать велосипед для верхней части тела, чтобы поощрять скоординированные движения всей верхней конечности.
При необходимости ваш физиотерапевт выполнит мобилизацию ваших суставов. Эта практическая техника побуждает жесткие суставы плеча, локтя и запястья постепенно переходить в нормальный диапазон движения. К счастью, увеличение объема движений и силы после перелома плечевой кости происходит быстро. Вы заметите улучшения в функционировании вашей конечности даже после нескольких процедур с вашим физиотерапевтом. По мере того, как ваш диапазон движений и сила улучшаются, мы будем совершенствовать ваши упражнения, чтобы ваша реабилитация продвигалась так быстро, как позволяет сросшийся перелом. В соответствии с известным временем заживления костей будут добавляться более тяжелые упражнения и работа на выносливость, чтобы обеспечить устойчивость к нагрузкам.
Эта практическая техника побуждает жесткие суставы плеча, локтя и запястья постепенно переходить в нормальный диапазон движения. К счастью, увеличение объема движений и силы после перелома плечевой кости происходит быстро. Вы заметите улучшения в функционировании вашей конечности даже после нескольких процедур с вашим физиотерапевтом. По мере того, как ваш диапазон движений и сила улучшаются, мы будем совершенствовать ваши упражнения, чтобы ваша реабилитация продвигалась так быстро, как позволяет сросшийся перелом. В соответствии с известным временем заживления костей будут добавляться более тяжелые упражнения и работа на выносливость, чтобы обеспечить устойчивость к нагрузкам.
В результате какой-либо травмы рецепторы в суставах и связках, отвечающие за проприоцепцию (способность определять, где находится ваше тело, не глядя на него), перестают функционировать. Период неподвижности усугубит этот спад. Хотя плечевая кость традиционно не считается костью, несущей вес, даже такие действия, как помощь себе руками, чтобы встать со стула, или вытаскивание стакана из шкафа, требуют, чтобы вес переносился или поднимался плечевой костью. ваше тело, чтобы проприоцептивно осознавать свою конечность. Если вы спортсмен, то проприоцепция верхней конечности имеет первостепенное значение для возвращения вас в спорт после перелома плечевой кости. Ваш физиотерапевт свяжется с вашим хирургом относительно оптимального времени для начала упражнений, направленных на проприоцепцию, путем переноса веса через заживающую плечевую кость с помощью руки. Эти упражнения могут включать в себя такие действия, как катание мяча по поверхности рукой, удерживание веса над головой при движении плеча или отжимания на неустойчивой поверхности. Продвинутые упражнения включают в себя такие действия, как бросание или ловля мяча. Спортсменам мы рекомендуем выполнять упражнения, имитирующие быстрые движения тех видов спорта или занятий, в которых вам нравится участвовать.
ваше тело, чтобы проприоцептивно осознавать свою конечность. Если вы спортсмен, то проприоцепция верхней конечности имеет первостепенное значение для возвращения вас в спорт после перелома плечевой кости. Ваш физиотерапевт свяжется с вашим хирургом относительно оптимального времени для начала упражнений, направленных на проприоцепцию, путем переноса веса через заживающую плечевую кость с помощью руки. Эти упражнения могут включать в себя такие действия, как катание мяча по поверхности рукой, удерживание веса над головой при движении плеча или отжимания на неустойчивой поверхности. Продвинутые упражнения включают в себя такие действия, как бросание или ловля мяча. Спортсменам мы рекомендуем выполнять упражнения, имитирующие быстрые движения тех видов спорта или занятий, в которых вам нравится участвовать.
Как правило, сила и скованность, возникающие после перелома плечевой кости, очень хорошо реагируют на физиотерапию, которую мы предоставляем в центрах физиотерапии и спортивной медицины Humpal. Благодаря нашей первоначальной индивидуальной физиотерапии наряду с постоянными упражнениями вашей домашней программы сила, диапазон движений, выносливость и проприоцепция постепенно улучшаются до почти полного восстановления/функции в течение 3-6 месяцев, даже если фактические заключительные этапы заживления костей не наступят еще 6-12 месяцев после этого. Со временем большинство пациентов могут вернуться ко всем видам деятельности, которыми они занимались до травмы. Однако, если во время реабилитации ваша боль продолжается дольше, чем должна, или физиотерапия не прогрессирует, как ожидает ваш физиотерапевт, мы попросим вас проконсультироваться с вашим хирургом, чтобы убедиться, что место перелома хорошо переносит реабилитацию, и убедиться, что нет проблем с оборудованием, которые могут помешать вашему восстановлению.
Благодаря нашей первоначальной индивидуальной физиотерапии наряду с постоянными упражнениями вашей домашней программы сила, диапазон движений, выносливость и проприоцепция постепенно улучшаются до почти полного восстановления/функции в течение 3-6 месяцев, даже если фактические заключительные этапы заживления костей не наступят еще 6-12 месяцев после этого. Со временем большинство пациентов могут вернуться ко всем видам деятельности, которыми они занимались до травмы. Однако, если во время реабилитации ваша боль продолжается дольше, чем должна, или физиотерапия не прогрессирует, как ожидает ваш физиотерапевт, мы попросим вас проконсультироваться с вашим хирургом, чтобы убедиться, что место перелома хорошо переносит реабилитацию, и убедиться, что нет проблем с оборудованием, которые могут помешать вашему восстановлению.
Центры физиотерапии и спортивной медицины Humpal предоставляют услуги физиотерапии в Корпус-Кристи.
Осложнения
Каковы потенциальные осложнения этого перелома?
Осложнения после любого перелома могут включать синдром жировой эмболии, тромбоз глубоких вен (ТГВ), легочную эмболию и синдром компартмента. Хотя все эти проблемы могут возникать при переломах плечевой кости, они не особенно распространены. Осложнения, такие как неправильное сращение, несращение, инфекция и повреждение нерва, чаще возникают при переломе плечевой кости, поэтому они будут обсуждаться здесь.
Хотя все эти проблемы могут возникать при переломах плечевой кости, они не особенно распространены. Осложнения, такие как неправильное сращение, несращение, инфекция и повреждение нерва, чаще возникают при переломе плечевой кости, поэтому они будут обсуждаться здесь.
Неправильное сращение
Если перелом не был прооперирован и зафиксирован, совмещение перелома редко бывает точным. Чаще всего это допустимо, но ангуляция или ротация в месте перелома могут быть достаточно большими, чтобы вызвать проблемы. Это приведет к невозможности поднять руку полностью в сторону или полностью вперед. Поскольку рука может много вращаться, эти ограничения движения могут быть неочевидными, и поэтому их не нужно исправлять. Однако, если они значительны, неправильное сращение можно исправить хирургическим путем. Обычно это включает операцию по разрезанию кости и фиксации ее в исправленном положении. Это равносильно новому перелому с таким же длительным периодом заживления, поэтому исправление неправильного сращения не выполняется легкомысленно. Если неправильное сращение лечить хирургическим путем, можно ожидать заживления и восстановления полного диапазона движений и функций.
Если неправильное сращение лечить хирургическим путем, можно ожидать заживления и восстановления полного диапазона движений и функций.
Несращение
Считается, что отсроченное сращение происходит, когда в течение трех месяцев при переломе не образуется мостовидная мозоль. Это относительно распространено, но все же есть хороший шанс, что перелом заживет. В редких случаях кость полностью не срастается. Это называется несоюз. Это осложнение чаще всего возникает после лечения гипсовой повязкой, так как перелом не иммобилизуется, но может возникнуть и после хирургического вмешательства. Другие факторы риска несращения включают курение, множественные фрагменты, плохое кровоснабжение и инфекцию.
Диагноз несращения является суждением со стороны хирурга; это означает, что, по его/ее мнению, перелом не заживет, если не будет произведено дальнейшее вмешательство. Несрастание происходит из-за того, что часть рубцовой ткани, которая залегает между фрагментами кости, не может превратиться в кость. Область перелома остается чувствительной и болезненной, особенно при напряжении, и иногда все еще можно почувствовать движение между фрагментами. Рентген показывает постоянный зазор между фрагментами, хотя иногда для демонстрации этого требуется компьютерная томография.
Область перелома остается чувствительной и болезненной, особенно при напряжении, и иногда все еще можно почувствовать движение между фрагментами. Рентген показывает постоянный зазор между фрагментами, хотя иногда для демонстрации этого требуется компьютерная томография.
Несращение обычно лечится хирургическим путем. Рубцовую ткань между костными отломками удаляют и перелом жестко фиксируют пластиной или интрамедуллярным стержнем. В этой ситуации часто используют костный трансплантат или другие вещества, которые стимулируют заживление кости. Исход после лечения несращений, как правило, довольно хороший, заживление костей и восстановление функции. В очень небольшой части случаев несращение сохраняется, и это создает очень сложную проблему лечения. Два варианта лечения включают принятие ситуации или продолжение исследования хирургической техники, которая решит проблему.
Инфекция
Если перелом открытый, он инфицирован во время травмы, что может привести к инфекции. Это может помешать заживлению перелома, а также может вызвать длительную инфекцию кости (хронический остеомиелит). Существует также небольшой, но значительный риск инфицирования области хирургического вмешательства после операции на переломе плечевой кости. Рана становится красной, болезненной и опухшей, из нее может выделяться гной. У пациента часто повышается температура, а посев гноя или крови может показать наличие бактерий.
Это может помешать заживлению перелома, а также может вызвать длительную инфекцию кости (хронический остеомиелит). Существует также небольшой, но значительный риск инфицирования области хирургического вмешательства после операции на переломе плечевой кости. Рана становится красной, болезненной и опухшей, из нее может выделяться гной. У пациента часто повышается температура, а посев гноя или крови может показать наличие бактерий.
Высокие дозы антибиотиков необходимы в течение длительного периода времени. Хирургическое лечение заключается в повторной операции на месте перелома и удалении любой мертвой или инфицированной ткани, включая мертвую кость.
Инфекция, скорее всего, закрепится, когда нарастает давление, поэтому вскрытие участка и создание легкого дренажа для гноя является важной частью операции. Часто в рану вставляют шарики с антибиотиком, чтобы создать высокую локальную концентрацию лекарства. Если фиксация перелома стабильна, имплантаты можно оставить на месте. Хирурги считают, что стабильный инфицированный перелом с большей вероятностью заживет, чем нестабильный. В некоторых случаях фиксация удаляется и вместо нее используется внешняя фиксация. Как только инфекция находится под контролем или устранена, может потребоваться повторная операция, чтобы исправить перелом и разместить костный трансплантат. Сочетание инфекции и несращения является серьезной проблемой.
В некоторых случаях фиксация удаляется и вместо нее используется внешняя фиксация. Как только инфекция находится под контролем или устранена, может потребоваться повторная операция, чтобы исправить перелом и разместить костный трансплантат. Сочетание инфекции и несращения является серьезной проблемой.
После заживления перелома фиксатор снимают, так как присутствие неживого материала, такого как металл, в области помогает бактериям избежать защитной системы организма. Инфекция после перелома является серьезной проблемой, которая может потребовать ряда дополнительных операций. В большинстве случаев исход благоприятный при сросшейся кости; инфекция устранена, и функция руки восстановлена. Стойкая инфекция в кости после заживления или инфицированного несращения может вызвать долговременные проблемы.
Повреждение нерва
Повреждение лучевого нерва является довольно частым осложнением перелома диафиза плечевой кости. Это происходит во время перелома, когда концы сломанной кости прорывают ткань руки. Во время операции на плечевой кости этот нерв также уязвим для травм.
Во время операции на плечевой кости этот нерв также уязвим для травм.
Существует целый ряд повреждений лучевого нерва. Растяжение или ушиб нерва может привести к временным проблемам. Если нерв не полностью разорван, это называется аксонотомезом. Общая структура нерва не нарушена. Нервные волокна снова вырастут и соединятся с мышцами-мишенями. Это занимает много времени, и важно наложить шину на запястье и кисть, чтобы предотвратить сокращение мышц и суставов, пока они парализованы. Нервы отрастают со скоростью около 1 мм в день, поэтому восстановление после повреждения лучевого нерва в плече займет несколько месяцев.
Если нерв перерезан, это называется нейротомезом. Если нерв полностью перерезан, его необходимо восстановить, чтобы у регенерирующих нервов был шанс вырасти в правильном направлении. К сожалению, не все нервы срастаются с правильными мышцами, поэтому будет постоянная слабость.
Резюме
Перелом диафиза плечевой кости представляет собой серьезную травму, которая обычно возникает в результате крупного несчастного случая. Кость имеет хорошую репутацию заживления часто без хирургического вмешательства. Кость не обязательно полностью заживает, чтобы нормально функционировать, и восстановление нормального диапазона движений, силы и выносливости является обычным результатом.
Кость имеет хорошую репутацию заживления часто без хирургического вмешательства. Кость не обязательно полностью заживает, чтобы нормально функционировать, и восстановление нормального диапазона движений, силы и выносливости является обычным результатом.
Отдельные части этого документа защищены авторским правом MMG, LLC.
Открытая репозиция перелома руки и внутренняя фиксация
Что такое открытая репозиция и внутренняя фиксация при переломе руки?
Открытая репозиция и внутренняя фиксация (ORIF) — это тип операции, используемый для стабилизации и заживления сломанной кости. Эта процедура может понадобиться вам для лечения сломанной руки.
Плечевая кость — это кость в верхней части руки. Различные виды травм могут повредить эту кость, в результате чего она расколется на 2 или более частей. Это может произойти в части плечевой кости рядом с плечом, в середине плечевой кости или в части плечевой кости возле локтя. При определенных типах переломов плечевой кости ваша плечевая кость сломана, но ее части все еще выстраиваются правильно. При других типах переломов (переломы со смещением) в результате травмы происходит смещение фрагментов кости.
При других типах переломов (переломы со смещением) в результате травмы происходит смещение фрагментов кости.
Если вы сломали плечевую кость, вам может понадобиться ORIF, чтобы вернуть кости на место и помочь им срастись. Во время открытой репозиции хирурга-ортопеда хирургическим путем перемещают фрагменты вашей сломанной кости так, чтобы ваши кости снова заняли правильное положение. При закрытой репозиции , врач физически перемещает кости на место, не обнажая кость хирургическим путем.
Внутренняя фиксация относится к методу физического соединения костей. В этом методе используются специальные винты, пластины, проволока или гвозди для правильного выравнивания костей. Это предотвращает неправильное срастание костей. Вся операция обычно проводится во сне под общим наркозом.
Зачем мне может понадобиться открытое вправление перелома руки и внутренняя фиксация?
Определенные заболевания могут повысить вероятность перелома плечевой кости. Например, остеопороз увеличивает риск перелома руки у многих пожилых людей.
Например, остеопороз увеличивает риск перелома руки у многих пожилых людей.
Не всем с переломом плечевой кости требуется ORIF. На самом деле, большинство людей этого не делают. Если возможно, врач назначит вам более консервативные методы лечения перелома руки, такие как обезболивающие, шины и повязки.
Вам, вероятно, не понадобится ORIF, за исключением случаев, когда по какой-либо причине ваш перелом может не срастись нормально при этих консервативных методах лечения. Вам, скорее всего, понадобится ORIF, если:
- Части вашей плечевой кости значительно смещены
- Ваша плечевая кость прорвала кожу
- Ваша плечевая кость разломилась на несколько частей
В этих случаях ORIF может вернуть вашим костям их правильную конфигурацию. Это значительно увеличивает вероятность того, что ваша кость заживет должным образом.
Вам может понадобиться ORIF при переломе, произошедшем в любом месте плечевой кости, включая участки возле плеча и локтя.
В некоторых случаях ваш врач может обсудить с вами другие хирургические варианты, такие как замена плеча, если у вас есть значительное повреждение верхней части плечевой кости. Поговорите со своим врачом о рисках и преимуществах всех ваших вариантов.
Каковы риски открытой репозиции перелома руки и внутренней фиксации?
Большинство людей очень хорошо себя чувствуют после ORIF. Однако иногда могут возникать редкие осложнения. Возможные осложнения включают:
- Винтовая перфорация головки плечевой кости
- Сломанные винты или пластины
- Инфекция
- Кровотечение
- Повреждение нерва
- Отмирание тканей из-за плохого кровоснабжения (аваскулярный некроз) плечевой кости
- Потеря диапазона движения
- Смещение костей
- Осложнения после анестезии
Существует также риск того, что перелом не срастется должным образом, и вам потребуется повторная операция.
Риск осложнений зависит от вашего возраста, анатомии перелома плечевой кости и других заболеваний. Например, люди с низкой костной массой или диабетом могут подвергаться более высокому риску осложнений. Курильщик также может увеличить риск. Спросите своего врача о рисках, которые наиболее применимы к вам.
Например, люди с низкой костной массой или диабетом могут подвергаться более высокому риску осложнений. Курильщик также может увеличить риск. Спросите своего врача о рисках, которые наиболее применимы к вам.
Как подготовиться к открытой репозиции перелома руки и внутренней фиксации?
ORIF часто проводится как неотложная или неотложная процедура. Перед процедурой медицинский работник изучит вашу историю болезни и проведет медицинский осмотр. Вам сделают снимок плечевой кости, возможно, с помощью рентгена или магнитно-резонансной томографии (МРТ). Расскажите своему врачу обо всех лекарствах, которые вы принимаете, включая безрецептурные лекарства, такие как аспирин. Кроме того, сообщите своему врачу, когда вы в последний раз ели.
В некоторых случаях ваши врачи могут провести ORIF в качестве плановой процедуры. В этом случае вам следует поговорить со своим врачом о том, как вы можете подготовиться. Спросите, не следует ли вам заранее прекратить прием каких-либо лекарств, например, препаратов, разжижающих кровь. Вам нужно будет воздержаться от еды и питья после полуночи в ночь перед процедурой.
Вам нужно будет воздержаться от еды и питья после полуночи в ночь перед процедурой.
Что происходит при открытой репозиции перелома руки и внутренней фиксации?
Ваш врач может помочь объяснить детали вашей конкретной операции. Детали операции будут зависеть от локализации и тяжести травмы. Хирург-ортопед и команда специализированных медицинских работников проведут операцию. Вся операция может занять пару часов. В целом можно ожидать следующее:
- Вам сделают общий наркоз, так что вы будете спать во время операции и ничего не почувствуете. (Или вы можете получить местную анестезию и лекарство, которое поможет вам расслабиться.)
- Кто-то будет внимательно следить за вашими жизненно важными показателями, такими как частота сердечных сокращений и кровяное давление, во время операции. Во время операции вам могут вставить дыхательную трубку в горло, чтобы помочь вам дышать.
- После очистки пораженного участка хирург сделает надрез на коже и мышцах руки.
 При определенных типах травм ваш хирург может вместо этого сделать надрез в верхней части плеча.
При определенных типах травм ваш хирург может вместо этого сделать надрез в верхней части плеча. - Ваш хирург выровняет части вашей плечевой кости ( редукция ).
- Затем ваш хирург скрепит части плечевой кости друг с другом (фиксация ). Для этого он или она может использовать винты, металлические пластины, провода и штифты. (Спросите, что хирург будет использовать в вашем случае.)
- Ваш врач выполнит любой другой необходимый ремонт.
- После того, как бригада закрепит кость, врач хирургическим путем закроет слои кожи и мышц вокруг руки.
Что происходит после открытой репозиции перелома руки и внутренней фиксации?
Поговорите со своим врачом о том, что вы можете ожидать после операции. У вас может быть сильная боль после процедуры, но обезболивающие могут помочь уменьшить боль. Вы должны быть в состоянии вернуться к нормальной диете довольно быстро. Вероятно, вам сделают визуализацию, например, рентген, чтобы убедиться, что операция прошла успешно. В зависимости от степени вашей травмы и других заболеваний вы, возможно, сможете вернуться домой в тот же день.
В зависимости от степени вашей травмы и других заболеваний вы, возможно, сможете вернуться домой в тот же день.
Какое-то время после операции вам нужно будет держать руку неподвижной. Часто это означает, что вам нужно носить шину или повязку в течение нескольких недель. Обязательно защитите шину от воды. Вы получите инструкции о том, как двигать рукой.
Ваш врач может дать вам другие инструкции по уходу за рукой, например, прикладывать лед. Внимательно следуйте всем указаниям врача. Ваш врач может не захотеть, чтобы вы принимали определенные безрецептурные лекарства от боли, потому что некоторые из них могут препятствовать заживлению костей. Ваш врач может посоветовать вам придерживаться диеты с высоким содержанием кальция и витамина D, пока ваши кости заживают.
Возможно, из вашего разреза вытекает жидкость. Это нормально. Немедленно сообщите своему врачу, если:
- Вы заметили усиление покраснения, отека или выделения из разреза
- У вас высокая температура или озноб
- У вас сильная боль в руке
- Вы потеряли чувствительность в руке или кисти
Обязательно посещайте все последующие приемы. Возможно, вам придется снять швы или скобы примерно через неделю после операции.
Возможно, вам придется снять швы или скобы примерно через неделю после операции.
В какой-то момент вам может понадобиться физиотерапия для восстановления силы и гибкости мышц. Выполнение упражнений в соответствии с предписаниями может повысить ваши шансы на полное выздоровление. Большинство людей могут вернуться к своей обычной деятельности в течение нескольких месяцев.
Дальнейшие действия
Прежде чем согласиться на тест или процедуру, убедитесь, что вы знаете:
- Название теста или процедуры
- Причина, по которой вы проходите тест или процедуру
- Каких результатов ожидать и что они означают
- Риски и преимущества теста или процедуры
- Каковы возможные побочные эффекты или осложнения
- Когда и где вы должны пройти тест или процедуру
- Кто будет проводить тест или процедуру и какова квалификация этого человека
- Что произойдет, если вы не пройдете тест или процедуру
- Любые альтернативные тесты или процедуры, о которых стоит подумать
- Когда и как вы получите результаты
- Куда звонить после теста или процедуры, если у вас есть вопросы или проблемы
- Сколько вам придется заплатить за тест или процедуру
Остеосинтез одной трети трубчато-крючковой пластины для остеотомии локтевого отростка при переломах дистального отдела плечевой кости типа C: предварительный отчет о результатах и осложнениях
ScienceDirect Том 43, выпуск 3, март 2012 г. , страницы 295-300
, страницы 295-300
https://doi.org/10.1016/j.injury.2011.06.418Получить права и содержание
Введение
Переломы дистального отдела плечевой кости встречаются редко и сложны в лечении. Анатомическая редукция суставной поверхности и стабильный остеосинтез обязательны для получения удовлетворительных результатов. Транслоктевой доступ обеспечивает превосходную визуализацию сустава. Однако существуют разногласия относительно того, как лучше всего фиксировать остеотомию. Цель настоящего исследования заключалась в изучении пригодности трубчатой крючковой пластины на одну треть для остеосинтеза остеотомий локтевого отростка при переломах дистального отдела плечевой кости типа С.
Пациенты и методы
Была выявлена последовательная серия из 34 пациентов, которым была проведена остеотомия локтевого отростка и фиксация с помощью трубчатой крючковой пластины на одну треть. Тридцать один пациент (17 женщин, 14 мужчин) со средним возрастом 50 лет (14–87, стандартное отклонение (СО) 18,3) был доступен для комплексной оценки в среднем через 12,3 месяца (6–20, SD 3,7). . Используя классификацию Arbeitsgemeinschaft für Osteosynthesefragen (AO), шесть (19,4%) переломов были отнесены к типу C2, а 25 (80,6%) — к категории C3. Проведены физикальное и рентгенологическое обследование. Оценивались шкала работоспособности локтевого сустава Мэйо (MEPS) и шкала инвалидности руки, плеча и кисти (DASH).
. Используя классификацию Arbeitsgemeinschaft für Osteosynthesefragen (AO), шесть (19,4%) переломов были отнесены к типу C2, а 25 (80,6%) — к категории C3. Проведены физикальное и рентгенологическое обследование. Оценивались шкала работоспособности локтевого сустава Мэйо (MEPS) и шкала инвалидности руки, плеча и кисти (DASH).
Результаты
Среднее значение амплитуды разгибания-сгибания составило 102° (50–145°, SD 25). Пронация и супинация нарушены незначительно. Средний показатель MEPS составил 87,2 балла (50–100, SD 12,4). 14 пациентов (45,2%) получили оценку «отлично», а 15 (48,4%) — «хорошо». Один пациент был оценен как удовлетворительный, и один пациент был оценен как плохой, соответственно. Средний балл по DASH составил 24,4 балла (0–65, стандартное отклонение 20,3). Осложнения остеотомии возникли у семи пациентов (22,5%). Ревизионная операция потребовалась в пяти случаях (16%). При последующем наблюдении все остеотомии были сращены. Легкая дегенерация суставов (Broberg I) обнаружена у 10 пациентов (32,2%). Удаление имплантата было проведено у 15 пациентов (48,4%).
Удаление имплантата было проведено у 15 пациентов (48,4%).
Заключение
Основываясь на этом исследовании, остеосинтез остеотомий локтевого отростка с использованием трубчатой пластины с крючком на одну треть можно рассматривать как безопасную процедуру с низким уровнем осложнений. Необходимый имплантат широко доступен и недорог, в отличие от специально разработанных пластин или гвоздей.
Фрагменты разделов
Тридцать четыре пациента со зрелым скелетом с оперированными изолированными переломами типа С дистального отдела плечевой кости (классификация Arbeitsgemeinschaft für Osteosynthesefragen (AO)) 24 наблюдаемых в период с декабря 2005 г. по январь 2010 г. выявлены ретроспективно. Пациенты с незрелым скелетом на момент травмы, а также с переломами, леченными имплантатами, отличными от пластин с угловой стабильностью, или те, кому была проведена фиксация с использованием доступа, отличного от остеотомии локтевого отростка, составили
. трубчатая крюковая пластина на одну треть. Средний возраст 17 женщин и 14 мужчин составил 50 лет (14–87 лет, стандартное отклонение (СО) 18,3). Доминирующая рука была поражена в 11 случаях (35,5%). Шесть (190,4%) переломов дистального отдела плечевой кости классифицированы по типу С2, а 25 (80,6%) — по типу С3. Восемь переломов (25,8%) были I степени, а два перелома (6,5%) были II степени открытыми (классификация Gustilo). 31 После среднего значения 12,3
трубчатая крюковая пластина на одну треть. Средний возраст 17 женщин и 14 мужчин составил 50 лет (14–87 лет, стандартное отклонение (СО) 18,3). Доминирующая рука была поражена в 11 случаях (35,5%). Шесть (190,4%) переломов дистального отдела плечевой кости классифицированы по типу С2, а 25 (80,6%) — по типу С3. Восемь переломов (25,8%) были I степени, а два перелома (6,5%) были II степени открытыми (классификация Gustilo). 31 После среднего значения 12,3
Целью представленного исследования было определение полезности и частоты осложнений метода трубчато-крючковой пластины на одну треть при лечении остеотомий локтевого отростка при переломах дистального отдела плечевой кости.
Хотя почти у 81% пациентов были переломы типа С3, в MEPS было получено 14 отличных и 15 хороших результатов. Средний балл по шкале MEPS составил 87,2 балла, а средний балл по DASH — 24,4 балла. Все остеосинтезы остеотомии локтевого отростка считались стабильными, чтобы позволить
Обнажение увеличивается за счет остеотомии локтевого отростка, которая облегчает репозицию и внутреннюю фиксацию сложных переломов дистального отдела плечевой кости, тем самым улучшая качество анатомической реконструкции и обеспечивая превосходный результат. Остеосинтез трубчато-крючковой пластины на одну треть после остеотомии локтевого отростка в форме шеврона обеспечивает высокую первичную стабильность с относительно небольшим количеством осложнений, таким образом, не мешая послеоперационному протоколу активной двигательной активности при переломах дистального отдела плечевой кости. Кроме того, имплантат
Остеосинтез трубчато-крючковой пластины на одну треть после остеотомии локтевого отростка в форме шеврона обеспечивает высокую первичную стабильность с относительно небольшим количеством осложнений, таким образом, не мешая послеоперационному протоколу активной двигательной активности при переломах дистального отдела плечевой кости. Кроме того, имплантат
Авторы статьи «Остеосинтез одной трети трубчатой крючковой пластиной для остеотомии локтевого отростка при переломах дистального отдела плечевой кости типа С: предварительный отчет о результатах и осложнениях» заявляют об отсутствии конфликта интересов.
Каталожные номера (54)
- Т.С. Козловский и др.
Фиксация перелома локтевого отростка новым имплантатом: биомеханические и клинические аспекты Ван
и др.Проксимальный отдел локтевой кости: анатомическое исследование, связанное с остеотомией локтевого отростка и фиксацией перелома Руло
и др.Проксимальный тыльный изгиб локтевой кости: рентгенографическое исследование
J Shoulder Elbow Surg
(2010)
- R.
 Gupta et al.
Gupta et al. Межмыщелковые переломы дистального отдела плечевой кости у взрослых: критический анализ 55 случаев
Травмы
(2002)
- K. Reising et al.
Стабилизация суставных переломов дистального отдела плечевой кости: ранний опыт применения новой системы перпендикулярных пластин
Травмы
(2009)
- D. Ring et al.
Переломы дистального отдела плечевой кости
Orthop Clin North Am
(2000)
- N. Papaioannou et al.
Оперативное лечение внутрисуставных переломов дистального отдела плечевой кости типа С: роль стабильности, достигнутой во время операции, на конечный результат
Травмы
(1995)
- H. Hastings et al.
Классификация и лечение гетеротопической оссификации в области локтя и предплечья
Hand Clin
(1994)
- M.
 Palvanen et al.
Palvanen et al. Многовековые тенденции переломов дистального отдела плечевой кости у пожилых женщин: общенациональная статистика в Финляндии с 1970 по 2007 год0223 и др.
Остеотомия локтевого отростка при лечении переломов дистального отдела плечевой кости у взрослых: анатомо-функциональная оценка локтевого сустава в 14 наблюдениях
Функциональный исход переломов дистального отдела плечевой кости АО типа С
J Hand Surg Am
(2003)
- J.M. Wilkinson et al.
Задние хирургические доступы к локтевому суставу: сравнительное анатомическое исследование
J Плечевой локтевой хирург
(2001)
- М.Б. Henley
Intra-articular distal humeral fractures in adults
Orthop Clin North Am
(1987)
- R. Gupta
Intercondylar fractures of the distal humerus in adults
Injury
(1996)
- Дж.
 Корнер и др.
Корнер и др. Переломы дистального отдела плечевой кости у пожилых пациентов: результаты открытой репозиции и внутренней фиксации
Osteoporos Int
(2005)
- J.B. Jupiter et al.
Межмыщелковые переломы плечевой кости. Оперативный подход
J Bone Joint Surg Am
(1985)
- R. Letsch et al.
Внутрисуставные переломы дистального отдела плечевой кости. Хирургическое лечение и результаты
Clin Orthop Relat Res
(1989)
- J.W. Поллок и др.
Хирургические снимки при переломах дистального отдела плечевой кости: обзор
Clin Anat
(2008)
- C.P. Коулз и др.
Остеотомия локтевого отростка: шестилетний опыт лечения внутрисуставных переломов дистального отдела плечевой кости.
Остеотомия двубрюшного локтевого отростка: технико-экономическое обоснование нового доступа к локтевому суставу
Surg Radiol Anat
(2010)
- B.
 J. Gainor et al.
J. Gainor et al. Скорость заживления поперечных остеотомий локтевого отростка, используемых при реконструкции переломов дистального отдела плечевой кости Дакуре
и др.Задние хирургические доступы к локтевому суставу: простой метод сравнения экспозиции суставов
Surg Radiol Anat
(2007)
- К. Кундел и др.
Внутрисуставные переломы дистального отдела плечевой кости. Факторы, влияющие на функциональный результат
Clin Orthop Relat Res
(1996)
- M.B. Хенли и др.
Оперативное лечение внутрисуставных переломов дистального отдела плечевой кости
J Orthop Trauma
(1987)
- K. Schmidt-Horlohe et al.
Функциональные результаты после остеосинтеза перелома дистального отдела плечевой кости анатомически предоформленной системой двойных пластин с угловой стабильностью
Z Orthop Unfall
(2010)
- M.
 Palvanen et al.
Palvanen et al. Вековые тенденции остеопоротических переломов дистального отдела плечевой кости у пожилых женщин
Eur J Epidemiol
(1998)
- M. Palvanen et al.
Остеопоротические переломы дистального отдела плечевой кости у пожилых женщин
Ann Intern Med
(2003)
Язык трехглавой мышцы бедра в сравнении с переломом локтевого отростка и плечевой кости в исследовании внутрисуставной дистальной остеотомии
0013
2022, Journal of Shoulder and Elbow Surgery
Существуют различные подходы к дистальному отделу плечевой кости при лечении перелома дистального отдела плечевой кости, и существуют разногласия относительно того, какой подход является оптимальным. Цель данного исследования состояла в том, чтобы сообщить о результатах применения трехглавого язычка (ТТ) для остеосинтеза переломов дистального отдела плечевой кости типа 13-А, В и С по АО. Во-вторых, мы стремились сравнить результаты ТТ-доступа и остеотомии локтевого отростка (ОО) при использовании для остеосинтеза переломов дистального отдела плечевой кости типа AO 13-C.

Мы провели ретроспективный обзор пациентов с переломами дистального отдела плечевой кости, пролеченных методом открытой репозиции с внутренней фиксацией с использованием ТТ или ОО подхода в период с 2007 по 2019 год в 2 отдельных учреждениях. Пациенты с ТТ с переломами AO типа 13-C были сопоставлены с пациентами с OO в соотношении 1: 1 в зависимости от возраста, пола и характеристик перелома. Сравнивали время операции, интраоперационную кровопотерю, движение локтевого сустава, сращение перелома, осложнения и инвалидность руки, плеча и кисти.
Всего было оценено 28 пациентов, получавших ТТ-подход, и соответствующие группы ТТ и ОО включали по 15 пациентов каждая. Группа ТТ показала меньшую кровопотерю (119,3 мл против 268,5 мл, P = 03), большее максимальное сгибание (126° против 116°, P = 0,03) и большее сгибание-разгибание. дуги (108° против 93°, P = 0,05), чем в группе OO. В когорте OO у 27% пациентов были осложнения, непосредственно связанные с OO, и у пациентов с OO была более высокая частота послеоперационного неврита локтевого нерва (33% против 0%, 9).
 0223 P = 0,04). Не было различий в баллах инвалидности руки, плеча и кисти ( P = 0,08), времени процедуры ( P = 0,2), общем количестве пациентов с ≥1 осложнением ( P = 0,5). , трудности со сращением ( P = 0,7) или количество пациентов, нуждающихся в ревизионной операции ( P = 0,7).
0223 P = 0,04). Не было различий в баллах инвалидности руки, плеча и кисти ( P = 0,08), времени процедуры ( P = 0,2), общем количестве пациентов с ≥1 осложнением ( P = 0,5). , трудности со сращением ( P = 0,7) или количество пациентов, нуждающихся в ревизионной операции ( P = 0,7).ТТ-доступ является безопасным и эффективным методом лечения переломов дистального отдела плечевой кости. По сравнению с OO подходом для переломов АО типа 13-C, подход TT не отличался в отношении функциональных результатов, но показал увеличение диапазона движений, снижение интраоперационной кровопотери и более низкую частоту послеоперационного неврита локтевого нерва. ТТ-доступ следует рассматривать как безопасный и надежный подход первой линии при внутрисуставных переломах дистального отдела плечевой кости, поскольку он позволяет адекватно визуализировать суставную поверхность, устраняет осложнения, связанные с остеотомией, включая замедленное сращение или несращение, отказ или раздражение металлоконструкций, а также позволяет для легкой конверсии в тотальное эндопротезирование локтевого сустава.

Лечение межмыщелковых переломов плечевой кости с помощью трехглавой отражающей ножки локтевой кости (TRAP) и остеотомии локтевого отростка. Сравнительное исследование
2021, Journal of Arthroscopy and Joint Surgery
Межмыщелковые переломы дистального отдела плечевой кости встречаются редко и встречаются редко. непростая задача даже для самого опытного хирурга-ортопеда. Наше исследование было направлено на сравнение одного описанного хирургического доступа для их фиксации, подхода TRAP (группа TR), который включает подъем лоскута, состоящего из трицепса и локтевого сустава, от дистального к проксимальному, с более популярным доступом к остеотомии локтевого отростка (группа O).
В этом исследовании 35 пациентов в группе O сравнивали с 32 пациентами в группе TR. Обе группы были сопоставимы по возрасту, полу, давности травмы и степени оскольчатости перелома. Результаты сравнивались с точки зрения соединения, дуги движения, сгибательной контрактуры, достигнутого общего сгибания и силы трицепса.
 Функциональную оценку проводили с использованием шкалы производительности локтевого сустава Майоса (MEPS).
Функциональную оценку проводили с использованием шкалы производительности локтевого сустава Майоса (MEPS).Пациенты наблюдались в течение как минимум 18 месяцев. Сращение перелома наблюдалось через 6 мес или раньше у всех пациентов обеих групп, за исключением 3 случаев группы О и 2 случаев группы TR, где перелом наблюдался через 9 мес.месяцы. Среднее время до объединения было сопоставимо в обеих группах. У всех, кроме 3 в группе О и 4 в группе TR, переломы срослись с внутрисуставным шагом менее 2 мм. В группе TR средняя дуга движения составила 114,5 (SD 14,6) со средней степенью сгибания 121,9 (SD 12,1) и разгибания 7,3 (SD 5,6). В группе О дуга движения в среднем составила 113,6 (SD 18,9) со средней степенью сгибания 124,1 (SD 13,3) и разгибания 10,6 (SD 7,3).
Несмотря на технические сложности, воздействие TRAP может оказаться столь же эффективным, как остеотомия локтевого отростка, и может использоваться в качестве метода выбора для фиксации этих переломов. 9
2020, Травма -суставные переломы дистального отдела плечевой кости.
 Предварительно просверленная натяжная ленточная проволока (TBW) исторически использовалась для фиксации OCO. Тем не менее, клинические результаты отягощены вторичной потерей репозиции и частотой несращения до 21,3%. Сообщалось, что биомеханическая стабильность анатомической блокирующей компрессионной пластины (LCP) превосходит TBW при фиксации перелома локтевого отростка. Мы предположили, что этот имплантат может также превосходить TBW в анатомической реконструкции суставных поверхностей локтевой большой сигмовидной вырезки после OCO путем предварительного сверления отверстий угловой стабильной пластины с помощью направителя с резьбой перед остеотомией.
Предварительно просверленная натяжная ленточная проволока (TBW) исторически использовалась для фиксации OCO. Тем не менее, клинические результаты отягощены вторичной потерей репозиции и частотой несращения до 21,3%. Сообщалось, что биомеханическая стабильность анатомической блокирующей компрессионной пластины (LCP) превосходит TBW при фиксации перелома локтевого отростка. Мы предположили, что этот имплантат может также превосходить TBW в анатомической реконструкции суставных поверхностей локтевой большой сигмовидной вырезки после OCO путем предварительного сверления отверстий угловой стабильной пластины с помощью направителя с резьбой перед остеотомией.Стандартизированные и калиброванные боковые рентгенограммы двадцати синтетических локтевых костей были получены с использованием изготовленного на заказ держателя перед препарированием старшим хирургом-ортопедом-травматологом. Затем десять образцов были предварительно просверлены с помощью направляющей сверла с резьбой локтевого отростка LCP, а остальные десять образцов были предварительно просверлены с помощью двух спиц Киршнера диаметром 1,6 мм.
 Дистальный V-образный OCO был выполнен с использованием осциллирующей пилы 0,6 мм. После репозиции и фиксации соответствующим аппаратом повторили боковые рентгенограммы. Два независимых наблюдателя использовали программное обеспечение для планирования TraumaCad для документирования суставной геометрии локтевой большой сигмовидной вырезки до и после операции. Измеряли диаметр наиболее подходящей окружности (диаметр), расстояние между верхушкой венечного отростка и локтевого отростка (расстояние) и максимальную суставную глубину.
Дистальный V-образный OCO был выполнен с использованием осциллирующей пилы 0,6 мм. После репозиции и фиксации соответствующим аппаратом повторили боковые рентгенограммы. Два независимых наблюдателя использовали программное обеспечение для планирования TraumaCad для документирования суставной геометрии локтевой большой сигмовидной вырезки до и после операции. Измеряли диаметр наиболее подходящей окружности (диаметр), расстояние между верхушкой венечного отростка и локтевого отростка (расстояние) и максимальную суставную глубину.При использовании методики TBW после ОКО и фиксации все три послеоперационных измерения значимо (p≤0,001) отличались от дооперационных измерений. Диаметр и расстояние увеличились в среднем на 1,5±0,5 мм и 0,9±0,3 мм соответственно, а глубина уменьшилась в среднем на 0,2±0,1 мм. Напротив, при использовании метода LCP не наблюдалось существенных различий между до- и послеоперационными измерениями (p ≥ 0,13). Надежность измерений между и внутри наблюдателей была от сильной до очень высокой (коэффициенты внутриклассовой корреляции ≥0,79).
 3) для всех трех переменных.
3) для всех трех переменных.Наше исследование показывает, что методика LCP с предварительным сверлением более точна, чем TBW с предварительным сверлением, в восстановлении анатомической суставной геометрии локтевой большой сигмовидной вырезки после OCO.
Клиническая оценка остеосинтеза двумя пластинами при переломах локтевого отростка: ретроспективное исследование случай-контроль
2019, Ортопедия и травматология: хирургия и исследования
Одинарная дорсальная пластина — широко используемый метод лечения переломов локтевого отростка. Альтернативным методом лечения является двухпластинчатый остеосинтез. Цель этого исследования состояла в том, чтобы представить хирургическую технику с использованием этого нового двухпластинчатого имплантата для переломов локтевого отростка и рассмотреть клинические результаты, частоту осложнений и ревизионные операции. Результаты сравнивали с однократным дорсальным покрытием.
Улучшает ли остеосинтез двумя пластинами переломов локтевого отростка переносимость материала по сравнению с остеосинтезом одинарной дорсальной пластиной?
В период с февраля 2011 г.
 по март 2015 г. мы ретроспективно оценили 47 пациентов, которые были включены в это исследование: 25 лечили с помощью низкопрофильного остеосинтеза с двумя пластинами и 22 с анатомически предварительно сформированной 3,5 мм блокирующей компрессионной пластиной (LCP). Две группы были получены в результате замены имплантатов в нашем отделении в 2013 году. Удовлетворенность пациентов, диапазон движений, оценки результатов, связанные с пациентами (оценка работоспособности локтя Мэйо [MEPS], оценка инвалидности руки, плеча и кисти [DASH]), оценивались осложнения и ревизионные операции. Результаты между обоими типами имплантатов были статистически сопоставлены с использованием U-критерия Манна-Уитни.
по март 2015 г. мы ретроспективно оценили 47 пациентов, которые были включены в это исследование: 25 лечили с помощью низкопрофильного остеосинтеза с двумя пластинами и 22 с анатомически предварительно сформированной 3,5 мм блокирующей компрессионной пластиной (LCP). Две группы были получены в результате замены имплантатов в нашем отделении в 2013 году. Удовлетворенность пациентов, диапазон движений, оценки результатов, связанные с пациентами (оценка работоспособности локтя Мэйо [MEPS], оценка инвалидности руки, плеча и кисти [DASH]), оценивались осложнения и ревизионные операции. Результаты между обоими типами имплантатов были статистически сопоставлены с использованием U-критерия Манна-Уитни.После среднего наблюдения в течение 41 месяца (диапазон: 25–61) группа низкопрофильных двойных пластин показала диапазон движений 127°, MEPS 94 и DASH 6. Группа LCP 3,5 мм была диапазон движений составил 130°, MEPS — 96 баллов, а DASH — 8 баллов. Клинических различий между группами выявлено не было.
 Всего было зарегистрировано 9 ревизионных операций после остеосинтеза двойной пластиной, в том числе семь удалений имплантатов и двух внутрисуставных винтов. Сообщалось об одном ослаблении винта без ревизионной операции. В группе LCP 3,5 мм было 9ревизионные операции, включая удаление восьми имплантатов и одного внутрисуставного винта.
Всего было зарегистрировано 9 ревизионных операций после остеосинтеза двойной пластиной, в том числе семь удалений имплантатов и двух внутрисуставных винтов. Сообщалось об одном ослаблении винта без ревизионной операции. В группе LCP 3,5 мм было 9ревизионные операции, включая удаление восьми имплантатов и одного внутрисуставного винта.Низкопрофильный остеосинтез двумя пластинами является безопасным и эффективным альтернативным методом лечения переломов локтевого отростка. Субъективные и объективные показатели клинического исхода выявили низкую частоту осложнений и отличные результаты. Тем не менее, удаление имплантата из-за раздражения мягких тканей остается проблемой. Эти результаты были сопоставимы с обычным остеосинтезом дорсальной пластиной.
III, ретроспективное исследование случай-контроль.
Хирургическое обнажение переломов дистального отдела плечевой кости: анатомическое исследование переднего, заднего, медиального и латерального доступов
2018, Китайский журнал травматологии — английское издание остеотомический доступ обеспечивал максимальное обнажение дистального отдела плечевой суставной поверхности.
 Тем не менее, частота несращения остеотомии в 30% является частым осложнением этого доступа,11,12 наряду с пальпируемым имплантатом и длительным хирургическим временем, что также ограничивает его применение.13-15 Поскольку дистальные суставные поверхности плечевой кости в основном передние структуры (около 30° антеверсия). Обычно считается, что передний доступ к локтевому суставу обеспечивает наилучший прямой доступ для фиксации винтами спереди назад при прямой визуализации, но существует мало литературы, поддерживающей эту точку зрения.8,9,16,17
Тем не менее, частота несращения остеотомии в 30% является частым осложнением этого доступа,11,12 наряду с пальпируемым имплантатом и длительным хирургическим временем, что также ограничивает его применение.13-15 Поскольку дистальные суставные поверхности плечевой кости в основном передние структуры (около 30° антеверсия). Обычно считается, что передний доступ к локтевому суставу обеспечивает наилучший прямой доступ для фиксации винтами спереди назад при прямой визуализации, но существует мало литературы, поддерживающей эту точку зрения.8,9,16,17Обнажение суставной поверхности является залогом успешного лечения внутрисуставных переломов дистального отдела плечевой кости. Передняя, задняя остеотомия локтевого отростка, а также медиальный и латеральный доступы являются четырьмя основными доступами к локтевому суставу. Целью данного исследования было сравнить экспозицию дистальных суставных поверхностей этих хирургических доступов.
В этом исследовании использовались двенадцать трупов.
 Каждый подход выполнялся на шести локтевых суставах в соответствии с ранее опубликованными процедурами. После завершения каждого подхода открытые суставные поверхности были отмечены путем введения 0,5 мм спиц К по краям. Затем локоть отделяли, а открытые суставные поверхности окрашивали. Затем дистальные суставные поверхности плечевой кости были плотно обернуты с помощью куска сетки из стекловолокна с сетками. Открытые суставные поверхности и общие суставные поверхности рассчитывали путем подсчета количества ячеек соответственно.
Каждый подход выполнялся на шести локтевых суставах в соответствии с ранее опубликованными процедурами. После завершения каждого подхода открытые суставные поверхности были отмечены путем введения 0,5 мм спиц К по краям. Затем локоть отделяли, а открытые суставные поверхности окрашивали. Затем дистальные суставные поверхности плечевой кости были плотно обернуты с помощью куска сетки из стекловолокна с сетками. Открытые суставные поверхности и общие суставные поверхности рассчитывали путем подсчета количества ячеек соответственно.Средний процент открытых суставных поверхностей для передней, задней остеотомии локтевого отростка, медиального и латерального доступов составил 45,7% ± 2,0%, 53,9% ± 7,1%, 20,6% ± 4,9% и 28,5% ± 6,3% соответственно.
Передний и задний доступы обеспечивают большее обнажение суставной поверхности дистального отдела плечевой кости, чем медиальный и латеральный, при лечении переломов дистального отдела плечевой кости.
Отличные результаты и низкий уровень осложнений при использовании анатомических полиаксиальных блокирующих пластин при многооскольчатых переломах проксимального отдела локтевой кости
2018, Journal of Shoulder and Elbow Surgery
Оскольчатые переломы проксимального отдела локтевой кости остаются серьезной проблемой в ортопедической хирургии.
 Целью данного исследования было сообщить об исходах оскольчатых переломов проксимального отдела локтевой кости, леченных новым типом конструкции — анатомически преформированными полиаксиальными запирающими компрессионными пластинами.
Целью данного исследования было сообщить об исходах оскольчатых переломов проксимального отдела локтевой кости, леченных новым типом конструкции — анатомически преформированными полиаксиальными запирающими компрессионными пластинами.В период с 2013 по 2016 год 46 пациентов с изолированными многооскольчатыми переломами лечили 2,7-/3,5-мм пластиной VA-LCP Olecranon (Synthes, Умкирх, Германия). Из них 44 были доступны для оценки после среднего периода наблюдения 2,5 года (диапазон 12-50 месяцев). Мы оценивали диапазон движений, время до восстановления, частоту ревизий и показания, а также функциональные показатели. Были проанализированы рентгенограммы.
Исследование включало 8 переломов Mayo IB, 29 Mayo IIB и 7 Mayo IIIB. Во всех переломах наблюдалось костное сращение, и только 2 ревизионных хирургических вмешательства были выполнены из-за новой травмы. Других осложнений не возникло. Средний диапазон движений составил 139° (диапазон 105°-150°), а средний уровень боли был менее 1 по визуальной аналоговой шкале.
 Что касается функции локтя, мы обнаружили, что средний балл производительности локтевого сустава Мейо составил 98; средний балл по Оксфордскому локтю 44; и средний балл по ограничению возможностей руки, плеча и кисти 6. Из пластин 41% были удалены в среднем через 16 месяцев, при этом было обнаружено значительное улучшение дефицита разгибания (9).0223 P < .01). Девяносто пять процентов всех пациентов вернулись к своему дотравматическому спортивному уровню.
Что касается функции локтя, мы обнаружили, что средний балл производительности локтевого сустава Мейо составил 98; средний балл по Оксфордскому локтю 44; и средний балл по ограничению возможностей руки, плеча и кисти 6. Из пластин 41% были удалены в среднем через 16 месяцев, при этом было обнаружено значительное улучшение дефицита разгибания (9).0223 P < .01). Девяносто пять процентов всех пациентов вернулись к своему дотравматическому спортивному уровню.Пластина VA-LCP Olecranon 2,7-/3,5 мм представляет собой эффективный вариант с превосходным уменьшением переломов, достаточной стабильностью для ранней послеоперационной функциональной реабилитации и минимальным количеством осложнений.
Исследовательская статья
Неполимерный стент с лекарственным покрытием для неотобранной популяции пациентов: опыт одного центра
Сердечно-сосудистая реваскуляризация, том 15, выпуски 6–7, 2014 г.
 , стр. 350–353
, стр. 350–353Оценить клиническую эффективность стента Cre8™, не содержащего полимера, с лекарственным покрытием, в неотобранной реальной популяции.
Воспаление играет ключевую роль в многофакторном процессе, который в конечном итоге приводит к отказу целевого сосуда (TVF) после имплантации стента с лекарственным покрытием (DES). Локальная хроническая воспалительная реакция в стенке сосуда в месте имплантации стента, по крайней мере частично, объясняется взаимодействием между полимерным покрытием СЛП и компонентами стенки сосуда. Вера в то, что устранение полимера уменьшит возникновение краткосрочной и долгосрочной TVF, привела к разработке DES без полимеров.
В этом проспективном открытом одноцентровом неконтролируемом исследовании мы включили последовательных пациентов, перенесших ЧКВ, для установки стента Cre8™. Единственными критериями исключения были рестеноз стента и диаметр целевого сосуда <2,5 мм. Первичными конечными точками были сердечная смерть и недостаточность целевых сосудов (TVF) через 1 год.

Всего было включено 215 пациентов, которым было имплантировано 318 стентов Cre8. Исследуемая популяция характеризовалась высокой распространенностью сопутствующих заболеваний, в том числе 38% диабетиков. Более чем у 50 % выявлены острые коронарные синдромы. За 1 год наблюдения зарегистрировано 1 случай внезапной смерти и 1 случай некардиальной смерти, а также 2 случая ТВФ.
В этом небольшом одноцентровом исследовании с участием неотобранной реальной популяции безполимерный СЛП Cre8™ оказался эффективным, поскольку он был связан с очень низкой частотой отказа целевого сосуда в течение периода наблюдения до 1 года. .
Научная статья
Эндопротезирование плечевого сустава пироуглеродом: предварительные результаты проспективного многоцентрового исследования через 2 года наблюдения
Journal of Shoulder and Elbow Surgery, Volume 26, Issue 7, 2017, pp. 1143-1151
Концепция свободного интерпозиционного эндопротезирования оказалась успешной для мелких суставов кисти, лучезапястного сустава и стопы, особенно после использования имплантатов, покрытых пироуглеродом, что улучшило их трибологические и эластичные свойства.
 В настоящем исследовании представлены предварительные результаты применения имплантата с пироуглеродным покрытием для эндопротезирования плечевого сустава (PISA).
В настоящем исследовании представлены предварительные результаты применения имплантата с пироуглеродным покрытием для эндопротезирования плечевого сустава (PISA).Это было проспективное исследование 67 последовательных пациентов, которым была выполнена PISA плеча в 9 центрах. Средний возраст на момент операции составил 51 год, и только 12 пациентов были старше 60 лет. Показаниями к операции были первичный плечелопаточный артрит у 42, аваскулярный некроз у 13 и вторичный артрит у 12 пациентов.
Ревизионная операция была проведена у 7 пациентов (10,4%), 2 (3,0%) выбыли из-под наблюдения, а оценка результатов была неполной у 3 (4,4%). В результате осталось 55 пациентов в возрасте 49,3 ± 12,0 лет с полной оценкой исходов при среднем периоде наблюдения 26,8 ± 3,4 месяца. Оценка по константе улучшилась с 34,1 ± 15,1 до операции до 66,1 ± 19,7 после операции. Рентгенологически выявлены эрозии 6 суставных отростков и истончение 3 бугров плечевой кости.
В когорте молодых пациентов с артритом по шкале PISA клинические показатели и выживаемость имплантатов сопоставимы с таковыми при эндопротезировании полуплеча, но остаются ниже результатов тотального эндопротезирования плечевого сустава.
 Исследование позволило выявить противопоказания и возможные причины неудач, связанные с концепцией свободной интерпозиции и меньшим радиусом кривизны сферы. Пока не будут получены долгосрочные результаты, этот тип инновационного имплантата следует протестировать в нескольких специализированных центрах лечения плечевого сустава.
Исследование позволило выявить противопоказания и возможные причины неудач, связанные с концепцией свободной интерпозиции и меньшим радиусом кривизны сферы. Пока не будут получены долгосрочные результаты, этот тип инновационного имплантата следует протестировать в нескольких специализированных центрах лечения плечевого сустава.Исследовательская статья
Хирургические методы лечения переломов локтевого отростка
Журнал хирургии кисти, том 39, выпуск 8, 2014 г., стр. 1606-1614
Переломы локтевого отростка являются распространенными травмами верхних конечностей. Подавляющее большинство лечится оперативной фиксацией. Описано множество методов лечения, в том числе натяжные ленты и пластины. В этом обзоре подробно рассматриваются наиболее часто используемые методы фиксации, включая жемчужины и подводные камни, с примерами как успешного лечения, так и потенциальных осложнений.
Исследовательская статья
Биомеханический анализ восстановления сухожилия сгибателя в зоне 2 с помощью соединительного устройства по сравнению с фиксирующим крестообразным швом
The Journal of Hand Surgery, Volume 45, Issue 9, 2020, pp.
 878.e1-878.e6
878.e1-878.e6Для сравнения силы и скорости восстановления сухожилия сгибателя между сухожильным соединителем и стандартным швом на модели трупа.
В 5 подобранных парах рук свежего трупа мы перерезали сухожилие глубокого сгибателя пальцев каждого пальца в зоне 2 и распределили 20 сухожилий как на соединительную, так и на шовную группы. Ремонт муфты производился с помощью низкопрофильных скоб из нержавеющей стали в каждой культе сухожилия, соединенных полиэтиленовой нитью. Шовный ремонт был выполнен с использованием 8-нитевой запирающей крестообразной техники с 4-0 петлевыми полиамидными полиамидными нитями. Все ремонты выполнял один хирург с сертификатом узкой специализации в области хирургии кисти. С помощью генератора нагрузки каждый глубокий сгибатель пальцев нагружался усилием от 5 до 10 Н и подвергался циклам сгибания кончиков пальцев и полного разгибания с частотой 0,2 Гц в течение 2000 циклов, чтобы имитировать 6 недель реабилитации. Мы регистрировали ремонтные разрывы через заданные интервалы цикла.
 Нашим первичным результатом было устранение зазоров после 2000 циклов. Сухожилия, не вышедшие из строя за 2000 циклов, были нагружены до отказа на сервогидравлической раме со скоростью 1 мм/с.
Нашим первичным результатом было устранение зазоров после 2000 циклов. Сухожилия, не вышедшие из строя за 2000 циклов, были нагружены до отказа на сервогидравлической раме со скоростью 1 мм/с.Зазор при восстановлении сухожилия был одинаковым для соединенных и прошитых сухожилий после 2000 циклов. Сухожилия, восстановленные с помощью соединителя, имели более высокую остаточную нагрузку до разрыва, чем сухожилия, сшитые. Среднее время восстановления муфты было в 4 раза меньше, чем восстановление швов.
Восстановление сгибателей в зоне 2 с помощью соединителя выдержало имитацию раннего активного движения у свежих трупов. Остаточная нагрузка до отказа и скорость ремонта были лучше с муфтой.
Этот соединитель для сухожилия в конечном итоге может стать вариантом для надежного, воспроизводимого и быстрого восстановления сухожилия сгибателя.
Научная статья
Биомеханическое сравнение различных методов фиксации при переломах диафиза плюсневой кости: исследование трупа
Клиническая биомеханика, том 92, 2022 г.
 , статья 105588
, статья 105588Для оперативного лечения диафизарных переломов плюсневой кости доступны различные методы фиксации: Проволока Киршнера, титановый эластичный стержень, пластина или интрамедуллярная система стабилизации кости внутри баллонного катетера. Целью данного исследования было сравнение стабильности этих методов.
Были использованы 72 плюсневые кости со II по V из свежезамороженных стоп человеческих трупов. Диафрагмальный перелом выполняли и фиксировали спицей Киршнера 1,6 мм, титановым эластичным стержнем 1,5 мм, блокирующей пластиной с 6 отверстиями или системой интрамедуллярной стабилизации кости. В консольной конфигурации головку плюсневой кости нагружали статически (2 мм/мин до отказа; все группы) или циклически (от 0 до 20 Н на 1000 циклов со скоростью 10 мм/с, после 1000 циклов 2 мм/мин до отказа; пластины и система стабилизации кости).
Средняя прочность на разрыв при статической нагрузке составила 17 Н для проволоки Киршнера, 13 Н для титанового эластичного стержня, 73 Н для пластины и 34 Н для системы стабилизации кости ( P < 01).
 При циклической нагрузке средний цикл отказа составил 1000 для пластины и 961 для системы стабилизации кости ( P = 0,76). Средняя прочность на разрыв после циклической нагрузки составила 73 Н для пластины и 48 Н для системы стабилизации кости ( P = 0,03).
При циклической нагрузке средний цикл отказа составил 1000 для пластины и 961 для системы стабилизации кости ( P = 0,76). Средняя прочность на разрыв после циклической нагрузки составила 73 Н для пластины и 48 Н для системы стабилизации кости ( P = 0,03).Стабильность различается в зависимости от метода фиксации, при этом пластина демонстрирует наибольшую стабильность, а проволока Киршнера или титановый эластичный стержень — наименьшую. Стабильность системы стабилизации кости для фиксации переломов диафиза плюсневой кости является промежуточной.
Исследовательская статья
Прямой рычаг для уменьшения головки бедренной кости при тотальном эндопротезировании тазобедренного сустава без укорачивающей остеотомии бедренной кости при дисплазии тазобедренного сустава типа 3–4 по Кроу
The Journal of Arthroplasty, Volume 33, Issue 3, 2018, pp. 794-799
Ряд методов вправления высокого вывиха бедра при тотальном эндопротезировании тазобедренного сустава (ТЭТБ) отнимают много времени и сил, а также требуют больших хирургических навыков.
 Это исследование было направлено на внедрение новой техники вправления для достижения быстрого, безопасного и легкого вправления высокого вывиха бедра.
Это исследование было направлено на внедрение новой техники вправления для достижения быстрого, безопасного и легкого вправления высокого вывиха бедра.Мы ретроспективно рассмотрели 74 пациента с THA (82 тазобедренных сустава; 44 женщины, 30 мужчин) с тяжелой дисплазией тазобедренного сустава, которым в период с сентября 2007 г. по январь 2014 г. было выполнено прямое натяжение ретрактором Хомана в анатомическую вертлужную впадину без укорачивающей остеотомии бедренной кости. Было прооперировано 49 тазобедренных суставов. классифицированы как Crowe III, а 33 бедра были классифицированы как Crowe IV. Средний период наблюдения составил 5,1 года (от 2 до 8 лет).
Средний балл по шкале Харриса для тазобедренного сустава увеличился с 42,1 (диапазон 24–71) до операции до 89.9 (диапазон 76-100) при заключительном контрольном осмотре. После операции ноги были удлинены в среднем на 3,0 см (диапазон 1,1-5,5) и 2,5 см (диапазон 1,1-3,5) в бедрах Crowe III и 3,6 см (диапазон 1,9-5,5) в бедрах Crowe IV.

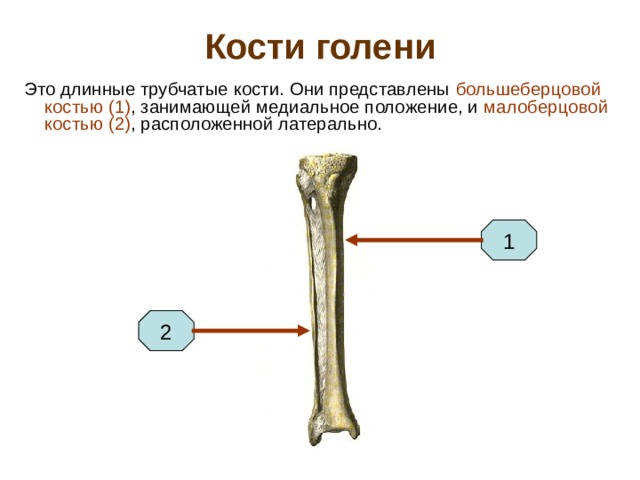
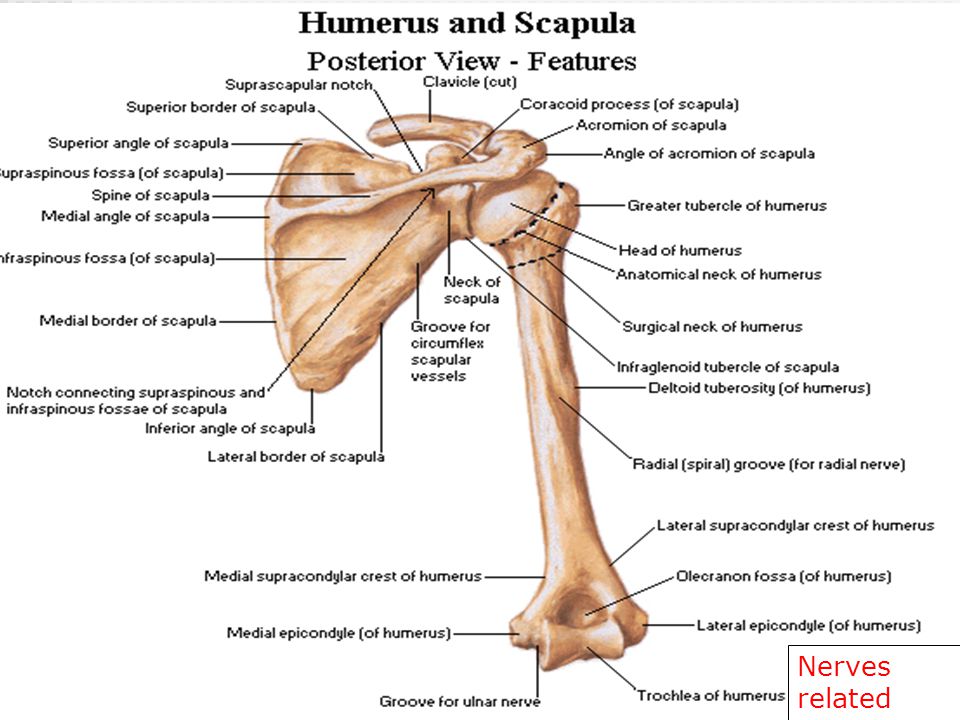 Пластина роста остается прикрепленной к эпифизу. Врачу необходимо провести репозицию при наличии смещения. При этом типе перелома необходима иммобилизация с помощью гипса для полноценной консолидации. Как правило, вероятность полноценного восстановления кости при этом типе перелома очень высокая.
Пластина роста остается прикрепленной к эпифизу. Врачу необходимо провести репозицию при наличии смещения. При этом типе перелома необходима иммобилизация с помощью гипса для полноценной консолидации. Как правило, вероятность полноценного восстановления кости при этом типе перелома очень высокая.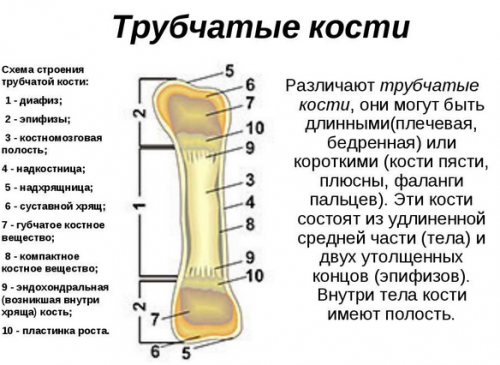
 При VI типе перелома обязательно требуется хирургическое вмешательство, и большинстве случаев бывают необходимы поздние реконструктивные или корректирующие операции. Рост костей почти всегда нарушен.
При VI типе перелома обязательно требуется хирургическое вмешательство, и большинстве случаев бывают необходимы поздние реконструктивные или корректирующие операции. Рост костей почти всегда нарушен. Иммобилизация в гипсе необходима в течение от нескольких недель до нескольких месяцев до тех пор, пока не произойдет нормальная консолидация костной ткани.Необходимость в оперативном восстановлении целостности костных структур определяется размерами смещения, наличием опасности повреждения близлежащих сосудов и нервов и возрастом ребенка.
Иммобилизация в гипсе необходима в течение от нескольких недель до нескольких месяцев до тех пор, пока не произойдет нормальная консолидация костной ткани.Необходимость в оперативном восстановлении целостности костных структур определяется размерами смещения, наличием опасности повреждения близлежащих сосудов и нервов и возрастом ребенка.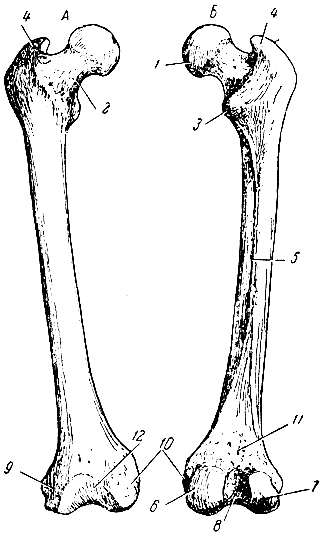 Если травма вызывает нарушение притока крови к эпифизу,то происходит нарушение роста костной ткани.Также при при смещении, разрушении или компрессии пластинки роста возможно замедление роста костной ткани.Наличие открытой травмы может повлечь за собой риск инфицирования и инфекция может разрушить пластину роста.
Если травма вызывает нарушение притока крови к эпифизу,то происходит нарушение роста костной ткани.Также при при смещении, разрушении или компрессии пластинки роста возможно замедление роста костной ткани.Наличие открытой травмы может повлечь за собой риск инфицирования и инфекция может разрушить пластину роста.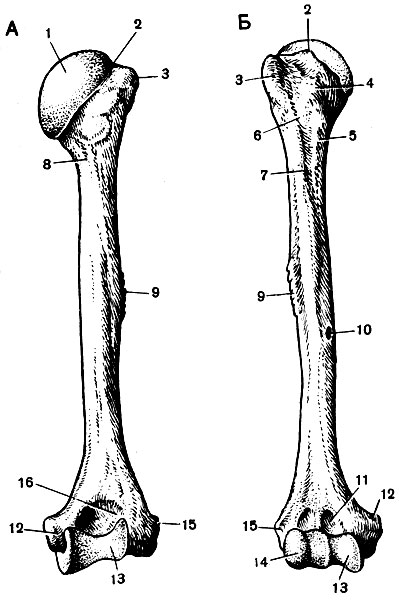 , Панагопулос А., Касиматис Г.
Димакопулос П. и соавт.
J Bone Joint Surg Am. 2007 г., август; 89 (8): 1700-9. дои: 10.2106/JBJS.F.00765.
J Bone Joint Surg Am. 2007.
PMID: 17671007
, Панагопулос А., Касиматис Г.
Димакопулос П. и соавт.
J Bone Joint Surg Am. 2007 г., август; 89 (8): 1700-9. дои: 10.2106/JBJS.F.00765.
J Bone Joint Surg Am. 2007.
PMID: 17671007 2009 март 1; 91 Приложение 2, часть 1: 8-21. дои: 10.2106/JBJS.H.01290.
J Bone Joint Surg Am. 2009.
PMID: 19255196
2009 март 1; 91 Приложение 2, часть 1: 8-21. дои: 10.2106/JBJS.H.01290.
J Bone Joint Surg Am. 2009.
PMID: 19255196