Гематогенный остеомиелит кости у детей
Оглавление
- 1Клиническая картина
- 2Острый остеомиелит
- 3Хронический остеомиелит
- 4Гематогенный остеомиелит
- 5Экзогенный (посттравматический) остеомиелит
- 6Симптомы и признаки острого гематогенного остеомиелита у детей
- 7Местная форма
- 8Септико-пиемическая
- 9Септико-токсическая
- 10Причины остеомиелита
- 11Диагностика
- 11.1Рентгенография
- 11.2УЗИ
- 11.3Фистулография
- 12Осложнения
- 13Консервативное лечение
- 14Антибиотикотерапия
- 15Инфузионная терапия
- 16Симптоматическая терапия
- 17Хирургическое лечение
- 18Клинические рекомендации
Остеомиелит – инфекционное заболевание, сопровождающееся поражением костного мозга гнойного характера, склонное распространяться на все окружающие структуры: все слои кости и мягкие ткани. Преимущественно страдают длинные трубчатые кости, в особенности бедренные, большеберцовые, малоберцовые и плечевые.
Одной из самых распространенных форм является гематогенный остеомиелит у детей, т. е. распространение инфекции с кровью из других очагов. В качестве таковых могут выступать даже миндалины, ссадины, пораженные кариесом зубы и т. д. Тем не менее у детей могут возникать и другие формы болезни. При этом важно как можно раньше диагностировать патологию, так как от этого напрямую зависит эффективность принятых мер, риск развития осложнений и прогноз.
Клиническая картина
Клинические проявления заболевания во многом зависят от формы и длительности его протекания, локализации очага поражения, типа возбудителя гнойного процесса. Поэтому они рознятся в достаточно широких пределах, что вызывает определенные трудности в диагностике и способно оттягивать момент выявления опасной патологии, а значит, и проведения соответствующего ситуации лечения.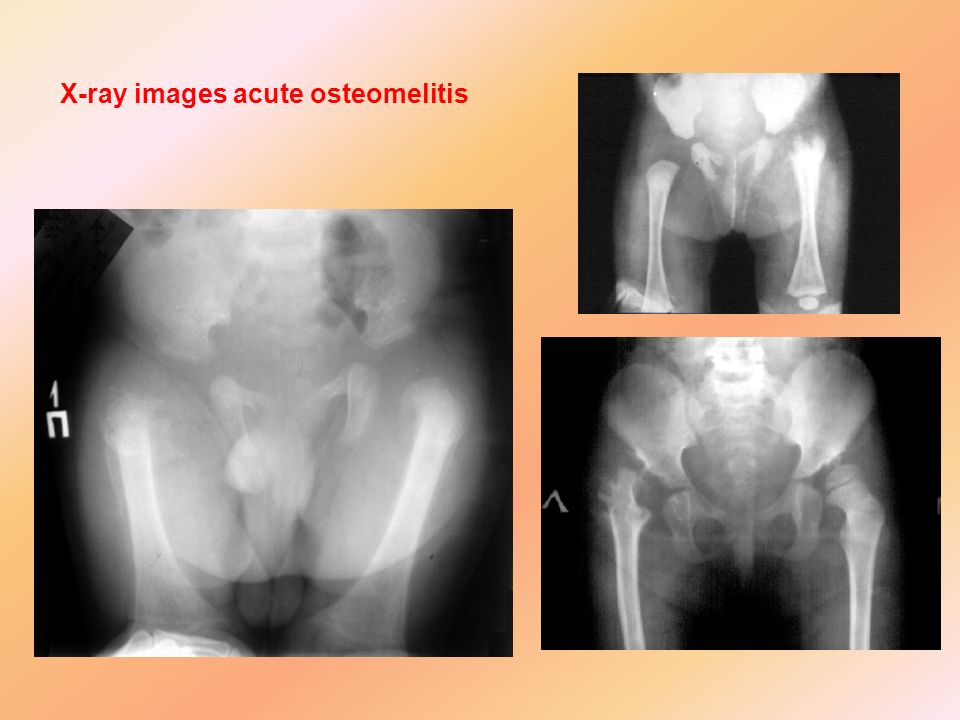
По клиническому течению различают острый и хронический остеомиелит у детей. Отдельно выделяют атипичные формы протекания заболевания: абсцесс Броди, склерозирующий остеомиелит Гарре, альбуминозный Оллье. Все их объединяют под единым термином «первично хронический остеомиелит».
В зависимости от пути проникновения инфекции в кость различают:
Непосредственно проявления заболевания во многом зависят от его формы, а также возраста больного и наличия сопутствующих патологий.
Острый остеомиелит
Для острого остеомиелита типично диффузное воспаление в костномозговом канале, склонное за короткое время распространяться на другие части кости и близлежащие мягкие ткани. Это сопровождается остеолизом, т. е. рассасыванием кости, следствием чего становится остеопороз. Ситуация усугубляется накоплением гноя, который проникает в близлежащие мягкие ткани, формируя гнойники и флегмону.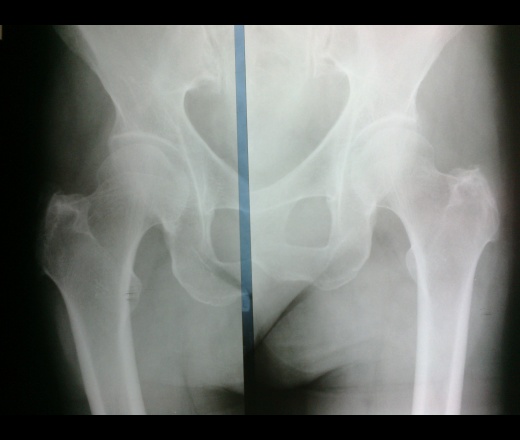
При длительном течении остеомиелита участки кости в области поражения отмирают и отторгаются. Их называют секвестрами. Подобный процесс является признаком начала перехода заболевания в хроническую форму.
Острая инфекция кости сопровождается бурным началом с резким ухудшением общего состояния больного и развитием признаков интоксикации. После этого возникают местные симптомы.
Хронический остеомиелит
В подавляющем большинстве случаев второй является следствием запущенного острого остеомиелита и развивается при сохранении симптомов больше 4—6 месяцев, хотя предпосылки для его возникновения закладываются уже спустя 0,5—1,5 месяца после начала воспалительного процесса.
При хроническом остеомиелите наблюдаются четко отграниченные от других тканей гнойники и секвестры.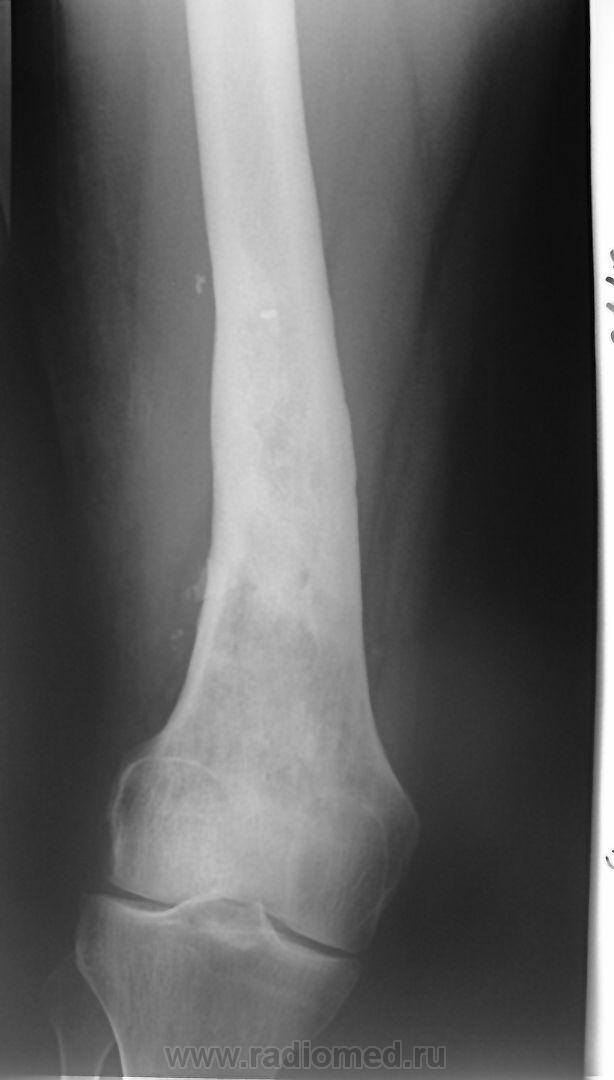 При этом в них есть специфические отверстия, посредством которых они сообщаются с мягкими тканями и свищами. Это сопряжено с прогрессированием остеопороза, остеосклероза, а также создает предпосылки для деформации кости.
При этом в них есть специфические отверстия, посредством которых они сообщаются с мягкими тканями и свищами. Это сопряжено с прогрессированием остеопороза, остеосклероза, а также создает предпосылки для деформации кости.
Характеризуется чередованием периодом затухания симптомов (ремиссий) и обострений. Последние могут вызвать существенные физические нагрузки, присутствие инфекций в организме или ослабление защитных сил пациента в результате действия других факторов. Выраженность болей и системных реакций наименее выражена, причем после открытия свища состояние улучшается и практически нормализуется.
Переход инфекции в хроническую форму наблюдается у 10—30% детей. В таком случае обострения уже могут случаться и во взрослом возрасте.
Гематогенный остеомиелит
Острый гематогенный остеомиелит у детей – самая часто диагностируемая форма заболевания. Он обусловлен заносом патогенных микроорганизмов в кость с кровью из имеющегося в организме очага инфекции (часто хронической).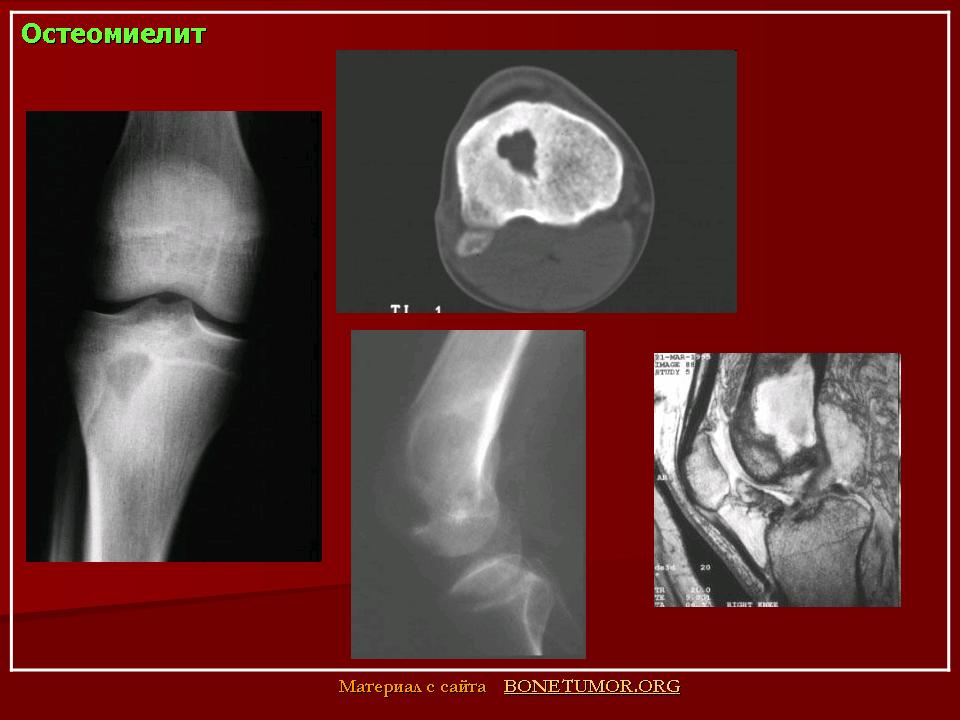 Он может возникать в любом возрасте, при этом около 30% больных составляют дети 1-го года жизни.
Он может возникать в любом возрасте, при этом около 30% больных составляют дети 1-го года жизни.
Развитие заболевания начинается с появления общих нарушений самочувствия:
У части детей может возникать гемолитическая желтуха, а также гипотония (мышечная слабость), тахикардия.
Боли в области поражения появляются через 1–2 дня и носят сверлящий, дёргающий характер. Они склонны набирать интенсивность при любом движении, что ограничивает подвижность больного. В поражённой конечности присутствуют симптомы местной воспалительной реакции:
Если происходит поражение всех слоёв кости и мягких тканей формируется свищевой ход. Сквозь него гной выходит наружу, что приводит к улучшению состояния пациента.
Хронический гематогенный остеомиелит у детей развивается после стихания острого воспаления. Подобное возможно в том числе после вскрытия гнойного очага и проведения терапии. В норме процессы репарации завершаются спустя 4—6 месяцев, но в ряде случаев все же остаются свищи и наблюдается образование гнойных масс.
-
задержка с началом проведения лечения;
-
ошибки в разработке тактики терапии, недостаточность ее продолжительности;
-
слабость иммунитета ребенка, обусловленная другими аутоиммунными, хроническими патологиями.
Экзогенный (посттравматический) остеомиелит
Развивается в результате проникновения инфекции в кость извне, например, в результате получения травмы, ранения, проведения хирургического вмешательства с нарушением правил асептики или же перехода гнойного процесса на кость с окружающих ее мягких тканей.
Симптоматика более сглаженная. Температура достигает 38°C, болезненность в области поражения менее выражена. Местно, помимо отечности и покраснения тканей, в ране появляется гной. В зависимости от размеров области поражения он может наблюдаться локально или распространяться на весь сегмент.
Симптомы и признаки острого гематогенного остеомиелита у детей
Клинические признаки острого гематогенного остеомиелита у детей определяются формой его протекания. Различают:
Местная форма
Это наиболее легкая форма заболевания. В таком случае симптомы гематогенного остеомиелита у детей представлены в основном в виде местных нарушений, которые возникают после незначительного повышения температуры. Интенсивность болей, отечности и других местных признаков достигает максимума к 10—14 дню.
Септико-пиемическая
Отличается более тяжелым течением. Первые симптомы возникают уже через несколько часов после начала развития воспаления. Они заключаются в быстром подъеме температуры тела вплоть до 40 градусов, развития озноба, головных болей, рвоты. Это приводит к обезвоживанию и утрате аппетита. Не исключен бред и гемолитическая желтуха у детей.
Характерно быстрое присоединение и нарастание выраженности местных проявлений.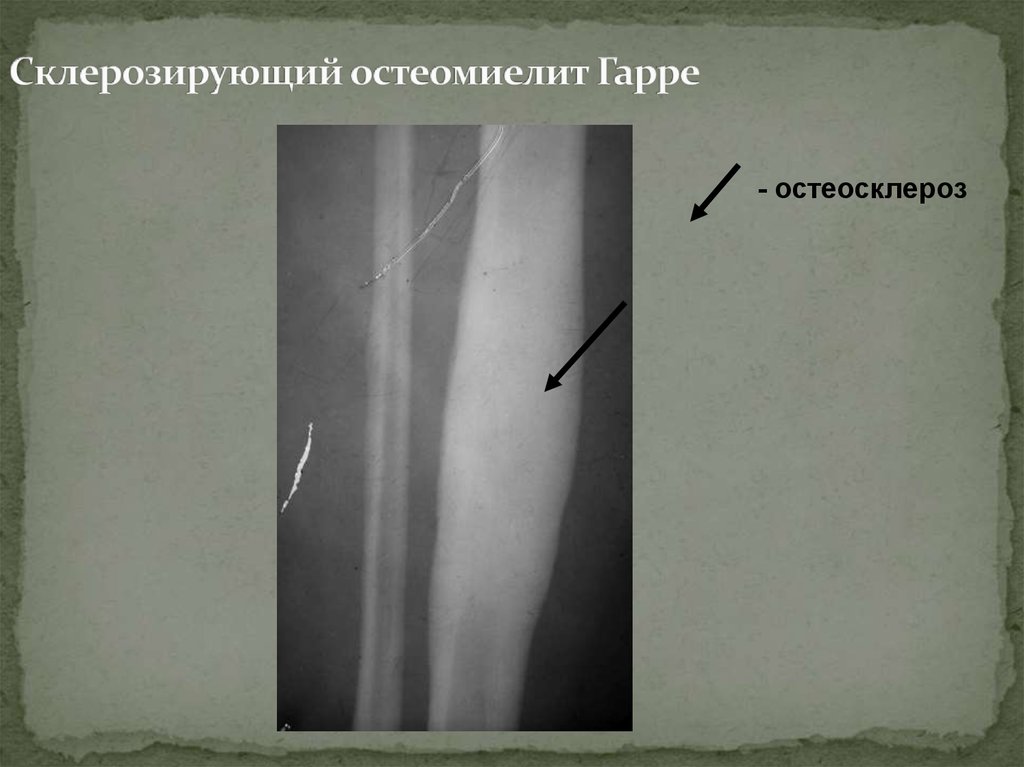 Практически сразу возникают сильные боли, ограничивающие подвижность и заставляющие больного принять вынужденное положение тела. Это сопровождается активным нарастанием отека и появления флюктуации. Нередко возникает реактивный артрит в близлежащем к области поражения суставе.
Практически сразу возникают сильные боли, ограничивающие подвижность и заставляющие больного принять вынужденное положение тела. Это сопровождается активным нарастанием отека и появления флюктуации. Нередко возникает реактивный артрит в близлежащем к области поражения суставе.
Септико-токсическая
Наиболее тяжелая клиническая форма остеомиелита, отличающаяся молниеносным развитием. Заболевание дебютирует с септического шока, который склонен быстро прогрессировать. У больных наблюдаются судороги, потеря сознания, обездвиживающая слабость, выраженная сердечно-сосудистая недостаточность. На фоне этого резко снижается температура тела и артериальное давление. Для септико-токсической формы не типичны местные признаки, что существенно затрудняет диагностику.
Причины остеомиелита
Провоцировать развитие заболевания способны любые микроорганизмы, но чаще всего это обусловлено контаминацией аэробной гноеродной микрофлорой (стафилококками и стрептококками).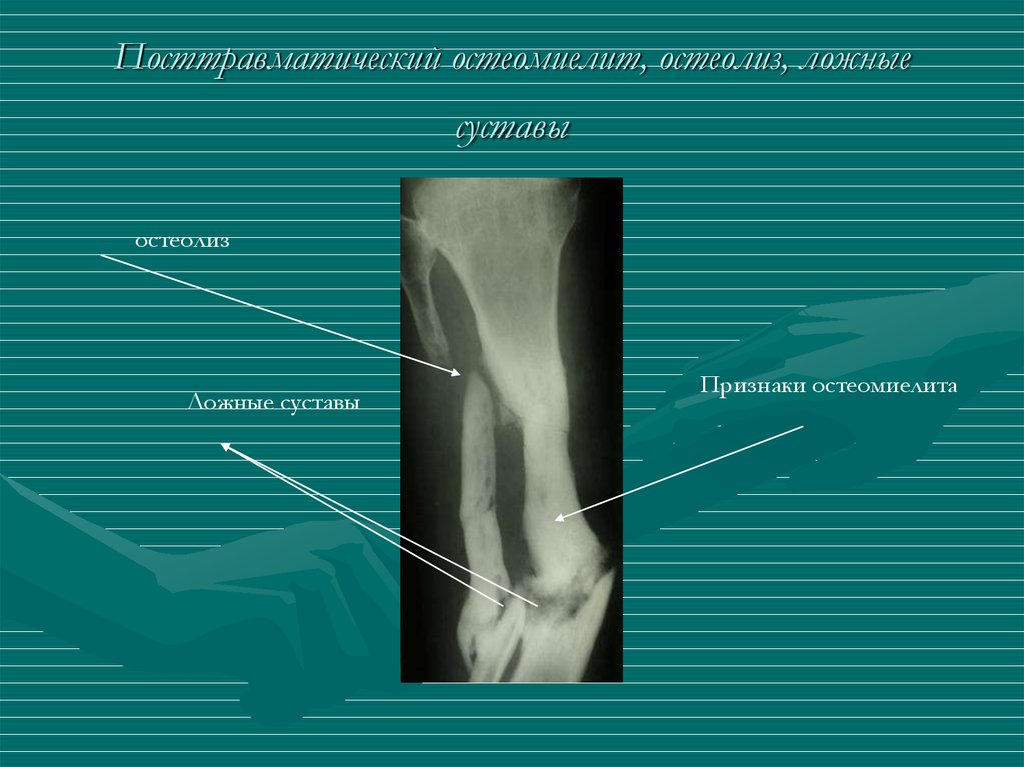 Но главным возбудителем остеомиелита является золотистый стафилококк. Он высевается у 90% больных. Тем не менее поражение также могут вызывать стрептококки, пневмококки, синегнойная палочка и др.
Но главным возбудителем остеомиелита является золотистый стафилококк. Он высевается у 90% больных. Тем не менее поражение также могут вызывать стрептококки, пневмококки, синегнойная палочка и др.
Но даже у одного больного со временем состав микрофлоры в гнойном отделяемом может изменяться. Чаще это наблюдается при хроническом остеомиелите, что обусловлено присоединением к первоначальной инфекции других микроорганизмов, проникших в кость снаружи через свищевой ход.
Выделяют 4 пути инфицирования костных структур:
-
-
Контактный – инфекция распространяется на кость от смежного источника, что возможно при открытых травмах, глубоких абсцессах, других кожных и мягкотканых инфекциях.

-
Травматический – прямое проникновение патогенной микрофлоры в кость извне при проникающем ранении, открытом переломе, выполнении пункции костей или сустава.
-
После операции из-за проникновения инфекции за счет внедрения металлических стержней и других хирургических конструкций.
Возникновению гематогенного остеомиелита у детей способствуют:
-
хронические заболевания, в особенности инфекционного характера;
-
сахарный диабет;
-
соматические патологии;
-
выраженные переохлаждение;
-
любые реакции, приводящие к ухудшению работы иммунной системы.
Диагностика
Диагностика гематогенного остеомиелита у детей осуществляется ортопедом-травматологом.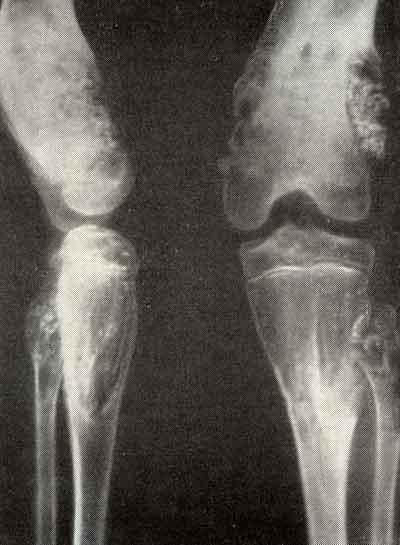 Детально собранный анамнез и особенности проявления заболевания в большинстве случаев позволяют заподозрить инфицирование костных структур патогенной микрофлорой. При экзогенном остеомиелите диагностика осуществляется быстрее, поскольку еще на этапе сбора анамнеза выявляются предпосылки для развития воспалительного процесса в кости.
Детально собранный анамнез и особенности проявления заболевания в большинстве случаев позволяют заподозрить инфицирование костных структур патогенной микрофлорой. При экзогенном остеомиелите диагностика осуществляется быстрее, поскольку еще на этапе сбора анамнеза выявляются предпосылки для развития воспалительного процесса в кости.
Диагностика острого гематогенного остеомиелита у детей производится посредством применения инструментальных методов. Но пациенты должны понимать, что лучевая диагностика становятся информативной лишь с 7-го дня от начала заболевания, когда процесс охватывает непосредственно костную ткань. Таким образом, больным назначаются:
Рентгенография
При остеомиелите становится информативной только спустя 2 недели от начала заболевания. Первым значимым и довольно специфичным признаком является периостит (воспаление надкостницы), что отображается в качестве линейной тени вблизи кортикального слоя кости.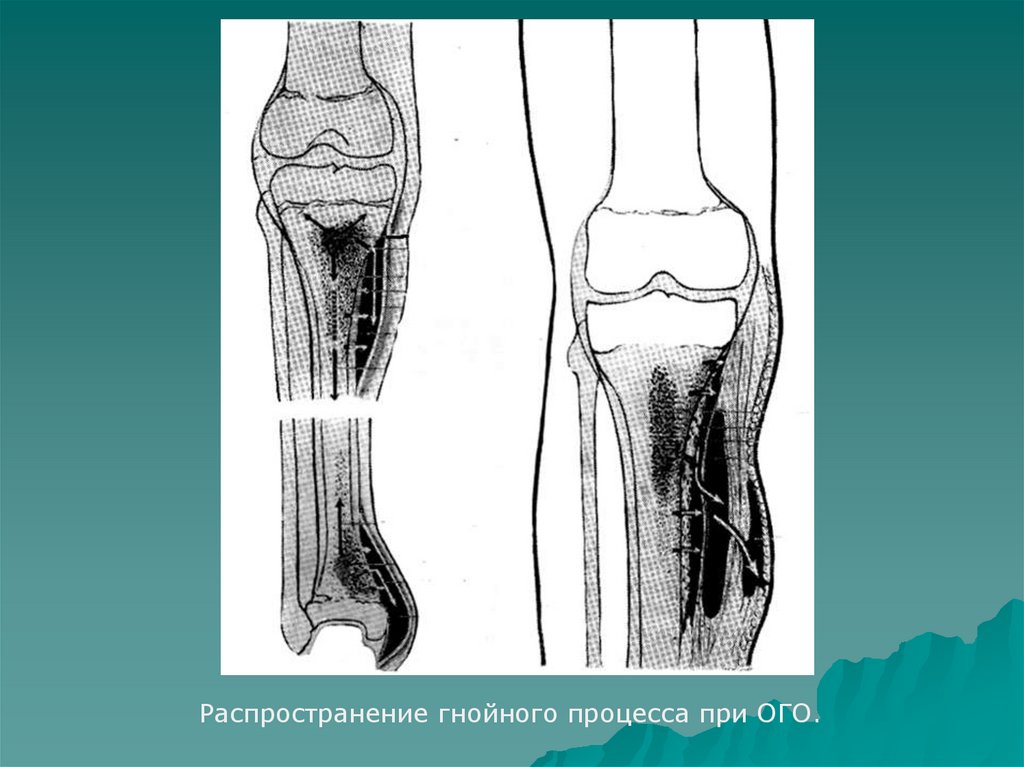 Ранее наблюдается утолщение, деформация мягких тканей, но эти признаки неспецифичны. Сроки развития периостита зависят от возраста ребенка: чем младше больной, тем раньше он возникает. Позднее вокруг очагов деструкции кости появляются признаки остеосклероза, что сопровождается образованием новых деструктивных очагов. Через 2—4 месяца на снимках можно обнаружить секвестры, что является признаком хронического остеомиелита. В таком случае полость в кости окружается зоной остеосклероза, а непосредственно костномозговой канал сужен или даже не визуализируется.
Ранее наблюдается утолщение, деформация мягких тканей, но эти признаки неспецифичны. Сроки развития периостита зависят от возраста ребенка: чем младше больной, тем раньше он возникает. Позднее вокруг очагов деструкции кости появляются признаки остеосклероза, что сопровождается образованием новых деструктивных очагов. Через 2—4 месяца на снимках можно обнаружить секвестры, что является признаком хронического остеомиелита. В таком случае полость в кости окружается зоной остеосклероза, а непосредственно костномозговой канал сужен или даже не визуализируется.
УЗИ
Используется на более ранних стадиях, чем рентгенография. Позволяет обнаружить косвенные признаки воспалительного процесса в мягких тканях, а позднее выявить периостит.
МРТ. Является методом ранней диагностики, так как позволяет выявить даже незначительные изменения в мягкотканых структурах. При использовании контрастирования можно установить характер нарушения кровоснабжения в кости и мягких тканях.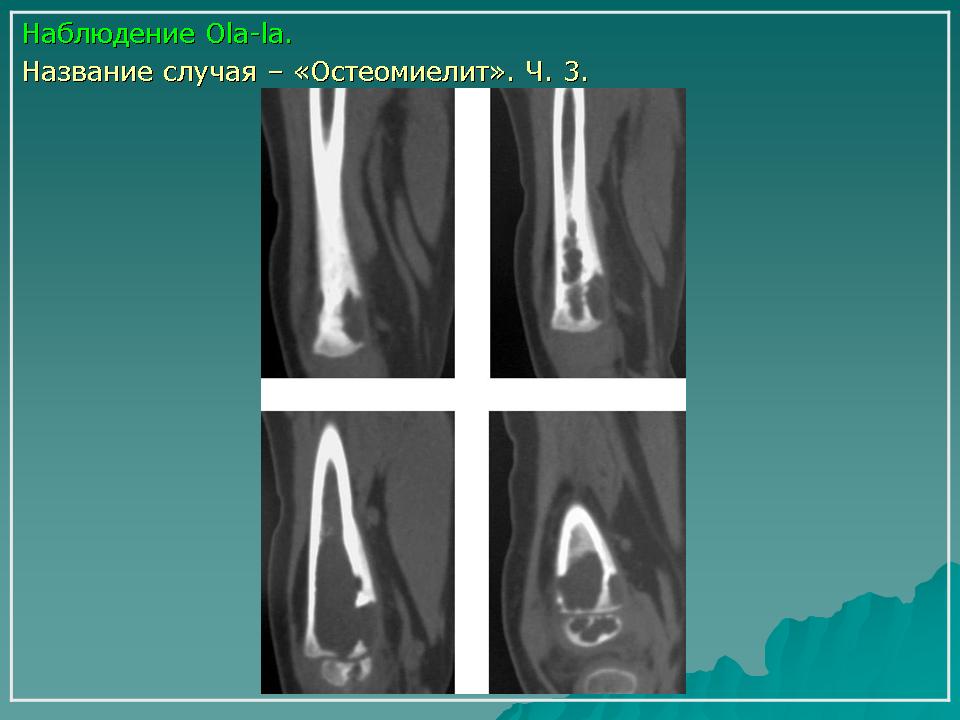
Фистулография
Чаще проводится при наличии хронического остеомиелита для уточнения локализации свищей и секвестров. Метод предполагает тугое заполнение свищей рентгенконтрастным средством с последующим выполнением рентгенографии. В результате на полученных снимках четко виден ход, размер свища и при отсутствии выраженных склеротических изменений в кости визуализируются секвестры. Возможно использование во время операции.
Дополнительно проводят остеопункцию и экспрессбактериоскопию костномозгового дендрита. Метод позволяет определить причину развития гнойного процесса и подобрать наиболее эффективный антибактериальный препарат.
Дифференциальная диагностика остеомиелита у детей осуществляется с:
-
острым ревматизмом;
-
флегмоной мягких тканей;
-
переломами;
-
глубоким лимфаденитом;
-
костно-суставным туберкулезом.

Осложнения
Осложнения гематогенного остеомиелита у детей наблюдаются редко, но несвоевременно начатое лечение или проведенное в недостаточном объеме способно стать одной из весомых причин их развития. Остеомиелит, локализующийся в области суставов, способен спровоцировать гнойный артрит. Это заболевание, помимо сильных болей и ограничения подвижности сустава, может приводить к формированию контрактур. Подобное накладывает тяжелые и стойкие ограничения подвижности вплоть до полного отсутствия движений в суставе.
Любой вид патологии так же может привести к развитию вторичных заболеваний:
Также возможно развитие сепсиса – чрезвычайно опасное летальным исходом инфекционное заражение крови, приводящее к поражению всех внутренних органов.
Консервативное лечение
Консервативная терапия обязательно назначается в качестве первого этапа лечения гематогенного остеомиелита у детей.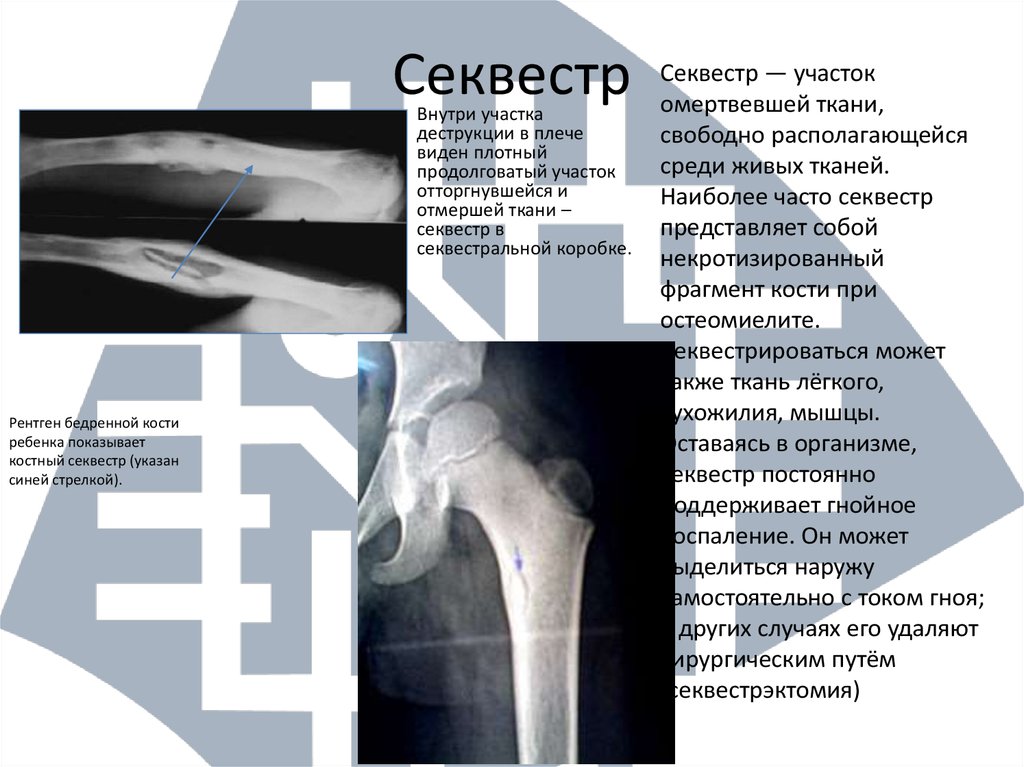 Она проводится в условиях стационара и базируется на 3-х основных принципах:
Она проводится в условиях стационара и базируется на 3-х основных принципах:
-
улучшение общего состояния пациента за счет устранения интоксикации, усиления иммунного ответа;
-
воздействие на возбудителя гнойного процесса;
-
тщательная санация местного очага.
В острый период назначается антибактериальная, инфузионная и симптоматическая терапии. Конкретные препараты подбираются строго индивидуально для каждого больного.
После перехода воспалительного процесса в подострую стадию пациентам показана иммуностимулирующая терапия, продолжение десенсибилизирующей, антибиотикотерапии. Также назначаются сеансы УВЧ и белковая диета. При необходимости проводится курс гормонотерапии.
Антибиотикотерапия
Поскольку основным возбудителем заболевания является золотистый стафилококк, изначально назначаются высокоактивные по отношению к этой бактерии антибиотики. Первоначально их вводят внутривенно или внутримышечно в течение 10—14 дней. После получения результатов бактериологического исследования антибиотик при необходимости может быть заменен на тот, к которому обнаружена максимальная чувствительность у патогена.
Первоначально их вводят внутривенно или внутримышечно в течение 10—14 дней. После получения результатов бактериологического исследования антибиотик при необходимости может быть заменен на тот, к которому обнаружена максимальная чувствительность у патогена.
Вторым этапом антибактериальной терапии является назначение пероральных средств в форме таблеток, капсул или суспензии. Длительность курса подбирается персонально и может достигать 3—4 недель.
Антибиотики вводятся и местно в форме растворов. Это позволяет добиться высокой концентрации препаратов непосредственно в области воспаления. В качестве таковых выбирают средства, не использующиеся в системной терапии. Это дополняют введением специфических бактериофагов и растворов антисептиков.
Если был поздно диагностирован острый гематогенный остеомиелит у детей, лечение включает несколько антибиотиков, в том числе активными в отношении множественно-резистентных штаммов бактерий. Дополнительно назначают препараты, содержащие метронидазол.
Инфузионная терапия
Поскольку заболевание сопровождается интоксикацией организма, пациентам назначаются дезинтоксикационная и иммуностимулирующая терапия. В зависимости от клинической картины и результатов лабораторной диагностики это может предполагать введение:
-
антистафилококкового γ-глобулина, плазмы;
-
кристаллоидных растворов;
-
заменителей крови;
-
иммуноглобулинов и иммуностимуляторов;
-
препаратов пуриновых и пиримидиновых производных.
Симптоматическая терапия
Больным назначаются лекарственные средства, способствующие устранению основных, беспокоящих их симптомов. Это способствует улучшению самочувствия и облегчает течение заболевания.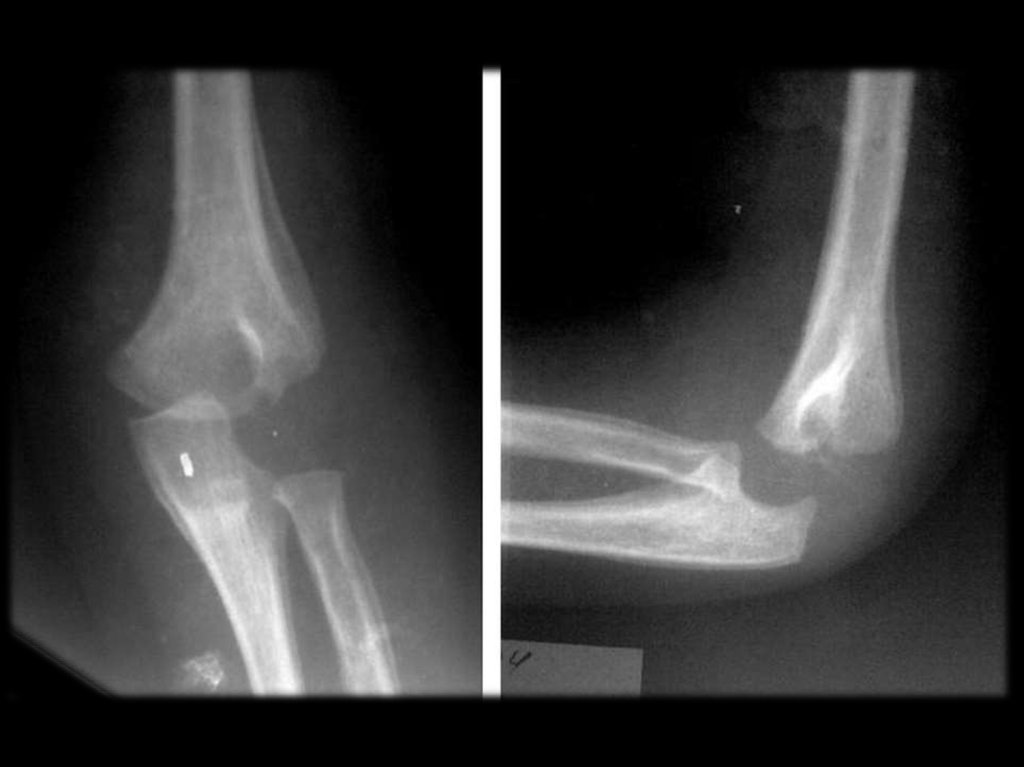 С этой целью могут использоваться:
С этой целью могут использоваться:
Хирургическое лечение
Показаниями к проведению операции являются:
-
образование секвестра;
-
присутствие остеомиелитической полости в кости;
-
формирование свища;
-
рецидивы хронического остеомиелита с развитием местных симптомов и нарушением функции пораженной конечности;
-
возникновение патологических изменений во внутренних органах из-за прогрессирования заболевания;
-
озлокачествление тканей в области свищевого хода.
Особенно важно проведение операции при хроническом остеомиелите у детей, поскольку он не способен самостоятельно переходить в фазу восстановления.
Хирургическое лечение выполняется при нормализации состояния пациента в острой фазе или в стадию ремиссии при хроническом остеомиелите.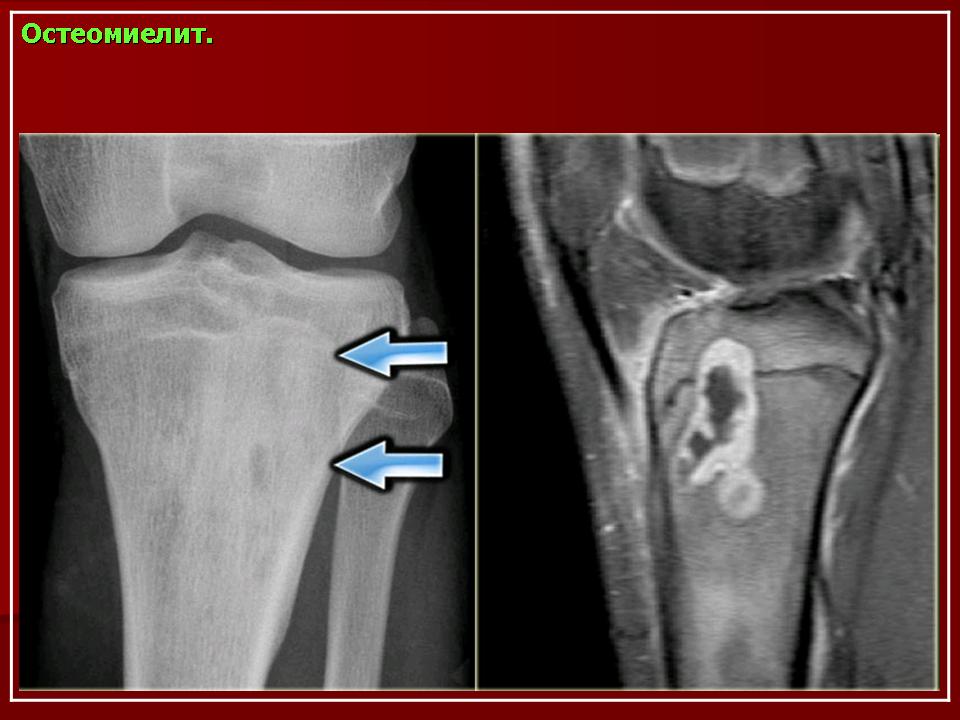 Методы оперативного вмешательства зависят от стадии заболевания. Но всегда изначально проводится санация гнойно-некротического очага с полным удалением всех нежизнеспособных тканей, а вторым этапом при необходимости проводят восстановительные манипуляции на костных структурах и мягких тканях.
Методы оперативного вмешательства зависят от стадии заболевания. Но всегда изначально проводится санация гнойно-некротического очага с полным удалением всех нежизнеспособных тканей, а вторым этапом при необходимости проводят восстановительные манипуляции на костных структурах и мягких тканях.
Сегодня основными из них являются:
-
Вскрытие и дренирование – первый этап хирургического лечения. Гнойник вскрывают до образования свища, промывают антибактериальными растворами. Также операция предполагает перфорацию кости в 2—3 зонах, что обеспечивает доступ к костномозговому каналу. Это не только обеспечивает возможность вводить лекарственные средства непосредственно в очаг воспаления, удалить из него избыток гнойных масс, продуктов распада, но и устранить чрезмерное внутрикостное давление. В результате удается снизить вероятность дальнейшего некроза кости, а также улучшить общее самочувствие больного за счет уменьшения интоксикации и снизить выраженность болевого синдрома.

-
Севестрэктомия — выполняется при хроническом остеомиелите. Подразумевает удаление отмерших фрагментов кости из секвестральной коробки. Для этого пораженную кость трепанируют или выполняют резекцию стенок имеющейся в ней полости по типу ладьевидного уплощения. Свищи иссекаются, а все образовавшиеся полости промываются антибактериальными растворами.
-
Артротомия – используется при гнойном артрите, когда удалить гной и некротические массы с помощью пункции невозможно. Разрез выполняют в проекции пораженного сустава. После получения доступа к нему, его полость промывается растворами с антибиотиками.
При посттравматическом остеомиелите в ходе хирургического вмешательства удаляются ранее установленные металлоконструкции, если они использовались для лечения переломов различных локализаций или других заболеваний опорно-двигательного аппарата.
При развитии осложнений, таких как деформации и укорочение конечности, нарушение функций сустава, возможно использование костной пластики или вмешательств на суставах, но только после полной санации очага нагноения.
После завершения операции конечность обязательно иммобилизуют. В зависимости от сложности ситуации для этого могут использоваться не только гипсы, ортезы, полимерные бинты, но и устройства для внешней фиксации.
Клинические рекомендации
По завершении лечения острого гематогенного остеомиелита у детей клинические рекомендации предполагают проведение физическое, психологической и социальной реабилитации. Особое внимание уделяется устранению очагов дремлющей инфекции в организме. С этой целью проводят:
При проведении долечивания в амбулаторных условиях пациентам иногда назначаются физиотерапевтические процедуры (электрофорез с антибиотиками, диатермию). Также клинические рекомендации в таких случаях предполагают проведение курса иммунизации стафилококковой вакциной.
Ограничение физических нагрузок требуется в течение нескольких месяцев, что зависит от тяжести перенесенного заболевания и проведенного хирургического вмешательства. Оно может достигать 3-х месяцев. Также важно избегать переохлаждения, инфекций, травм.
Оно может достигать 3-х месяцев. Также важно избегать переохлаждения, инфекций, травм.
После острого гематогенного остеомиелита дети подлежат диспансеризации в течение 2 лет. При поражении эпифиза кости она продлевается до 5 лет. Контрольные обследования проводят спустя 1, 3, 6, 12, 18 и 24 месяца после выписки.
Соблюдение клинических рекомендаций при гематогенном остеомиелите у детей позволяет максимально быстро восстановиться, вернуться к привычному образу жизни и избежать развития осложнений, как и хронизации гнойного процесса.
Лечение костных патологий и детская ортопедия
|
|
Соглашаюсь на обработку персональных данных
Продолжая работу с сайтом, вы даете согласие на использование файлов cookie.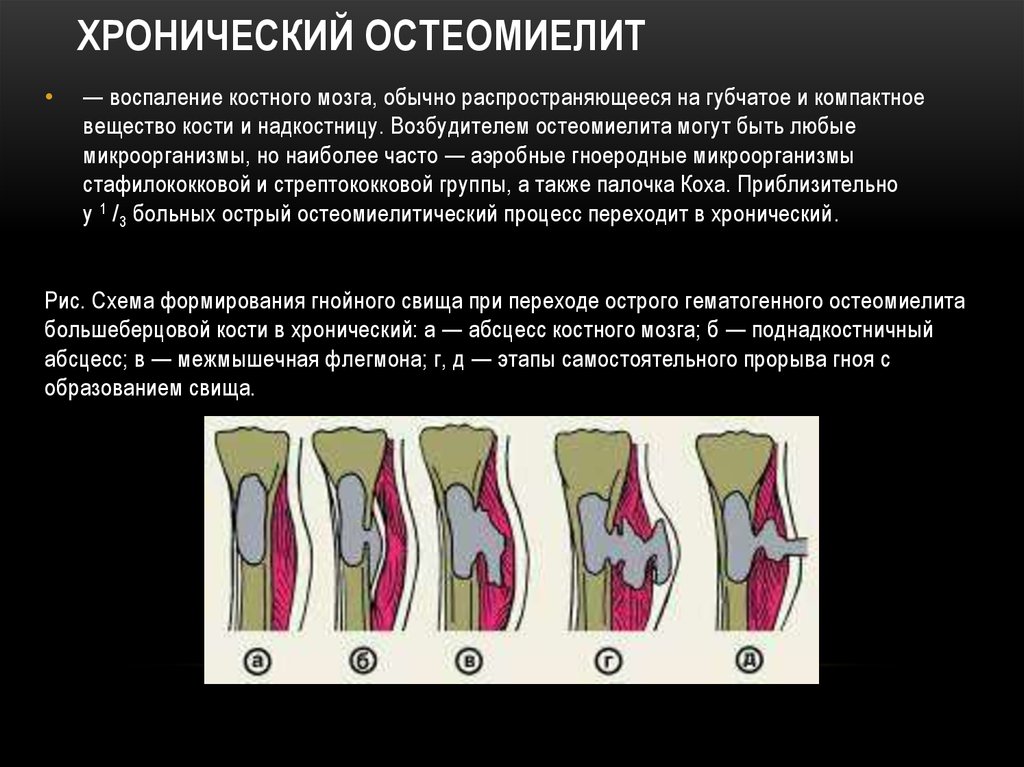
Лечение костных патологий и детская ортопедия
|
|
Соглашаюсь на обработку персональных данных
Продолжая работу с сайтом, вы даете согласие на использование файлов cookie.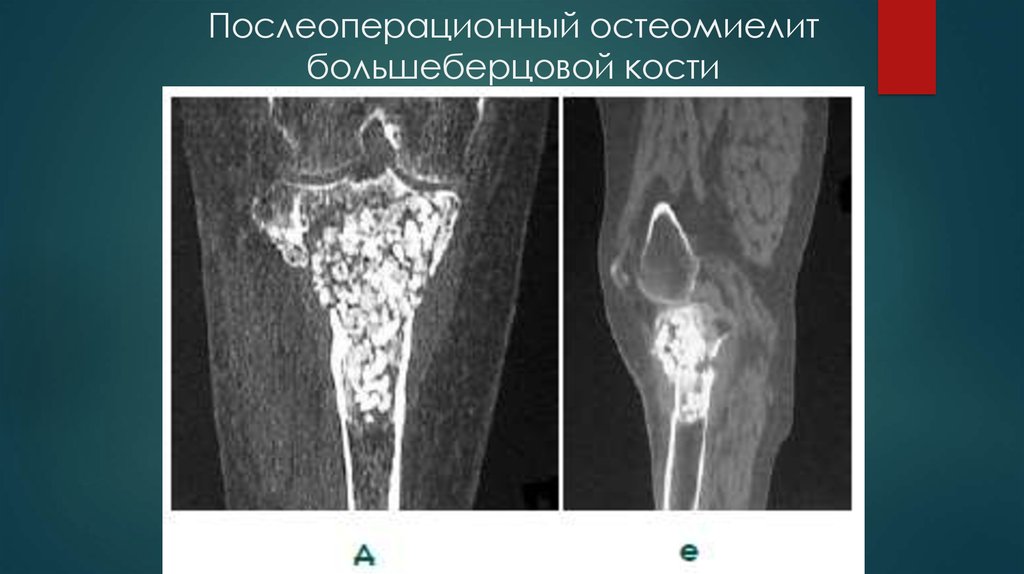
Остеомиелит (для родителей) — Nemours KidsHealth
Что такое остеомиелит?
Остеомиелит — медицинский термин для обозначения
воспаление в кости. Обычно это вызвано бактериальной инфекцией. Он часто поражает длинные кости рук и ног, но может возникнуть в любой кости.
Каковы признаки и симптомы остеомиелита?
Дети с остеомиелитом часто ощущают боль в инфицированной кости. Они также могут:
- иметь лихорадку и озноб
- чувствовать усталость или тошноту
- вообще плохо себя чувствую
- имеют болезненную, красную и опухшую кожу над инфицированной костью
Очень маленькие дети могут перестать пользоваться инфицированной конечностью и защищать ее от прикосновения. Они также могут быть суетливыми или меньше есть.
Подростки чаще заболевают остеомиелитом после несчастного случая или травмы. Поврежденный участок может снова начать болеть после того, как ему станет лучше.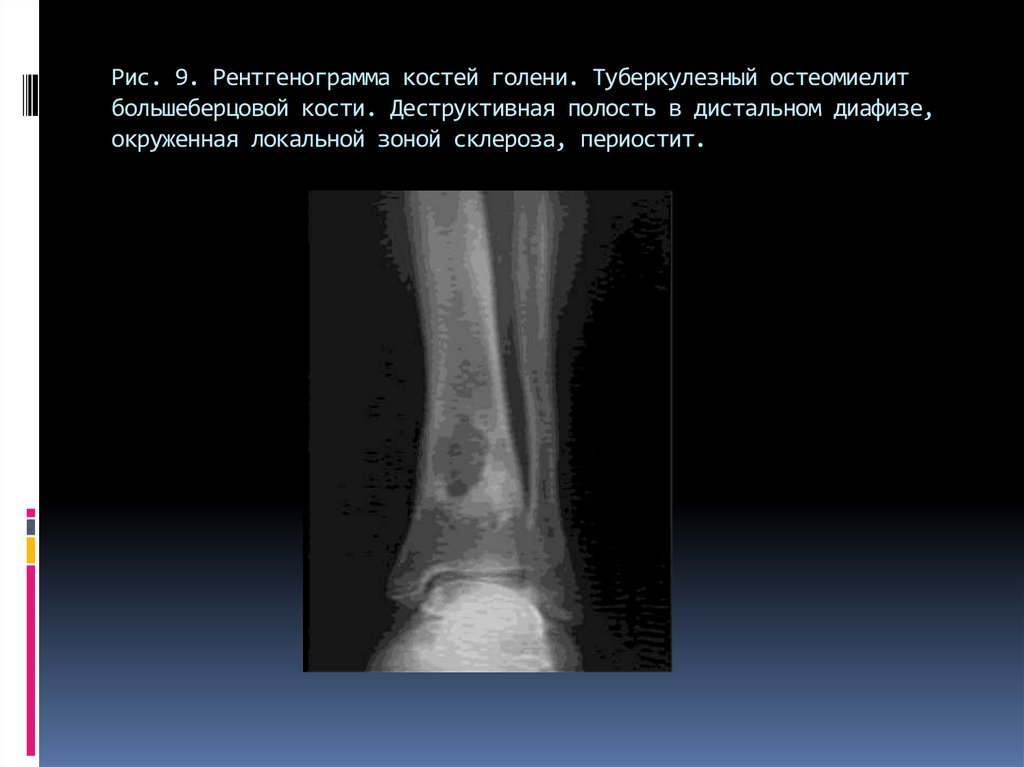
Что вызывает остеомиелит?
Бактерии могут инфицировать кости несколькими способами. Например:
- Бактерии могут попасть в кость через кровоток из других инфицированных участков тела. Это называется гематогенный (хе-ме-ТАХ-род-ус) остеомиелит . Это самый распространенный способ заражения костей у детей.
- Прямое заражение может произойти, когда бактерии попадают в рану и попадают в кость (например, после травмы или операции). Открытые переломы — разрывы кости с открытыми кожными покровами — это травмы, при которых чаще всего развивается остеомиелит.
- Иногда бактерии могут распространяться из соседней инфекции. Например, невылеченная инфекция кожи или сустава может распространиться на кости.
Кто болеет остеомиелитом?
Остеомиелит чаще всего встречается у маленьких детей в возрасте до 5 лет. Но это может произойти в любом возрасте. Мальчики получают его почти в два раза чаще, чем девочки.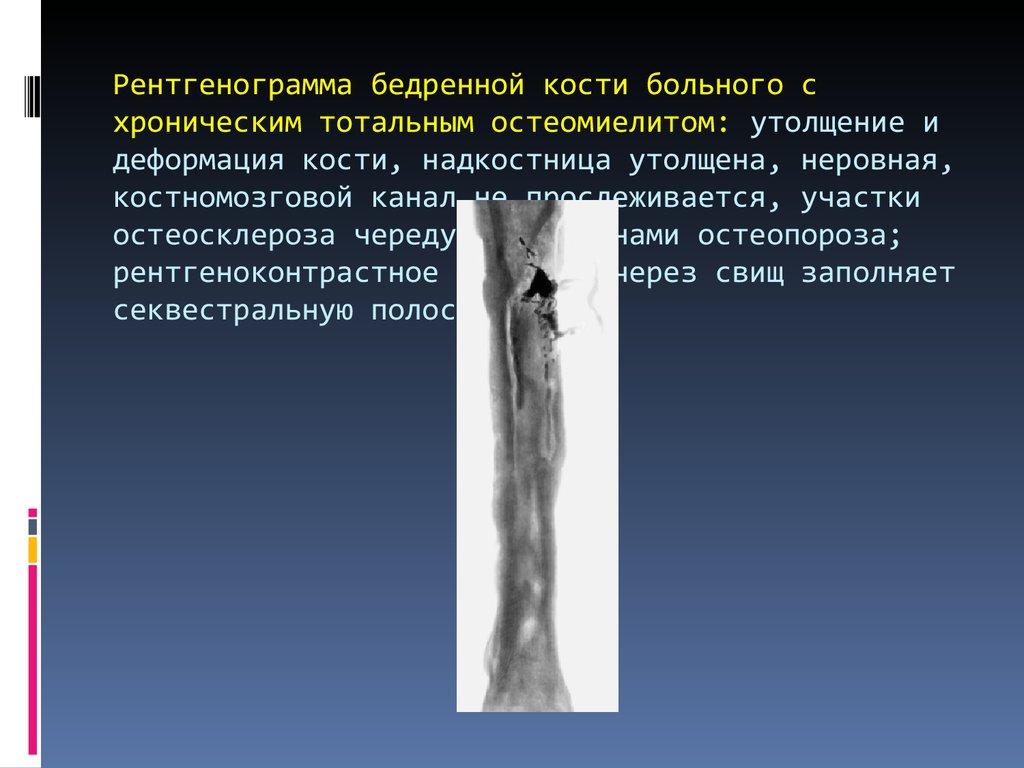
p
Заразен ли остеомиелит?
Нет, инфекции костей не заразны. Но микробы, вызывающие остеомиелит, иногда могут передаваться от одного человека к другому.
Как диагностируется остеомиелит?
Если у вашего ребенка жар и боли в костях, немедленно обратитесь к врачу. Остеомиелит может ухудшиться в течение нескольких часов или дней, и его становится гораздо труднее лечить.
Врач проведет медицинский осмотр и задаст вопросы о недавних травмах болезненной области. Анализы крови могут выявить повышенное количество лейкоцитов (признак инфекции) и другие признаки возможного воспаления или инфекции. Может быть назначен рентген, хотя рентген не всегда показывает признаки инфекции в костях на ранних стадиях.
Врач может предложить
сканирование кости, чтобы получить более детальное представление о кости. Врач также может порекомендовать МРТ, которая дает гораздо более подробные изображения, чем рентген.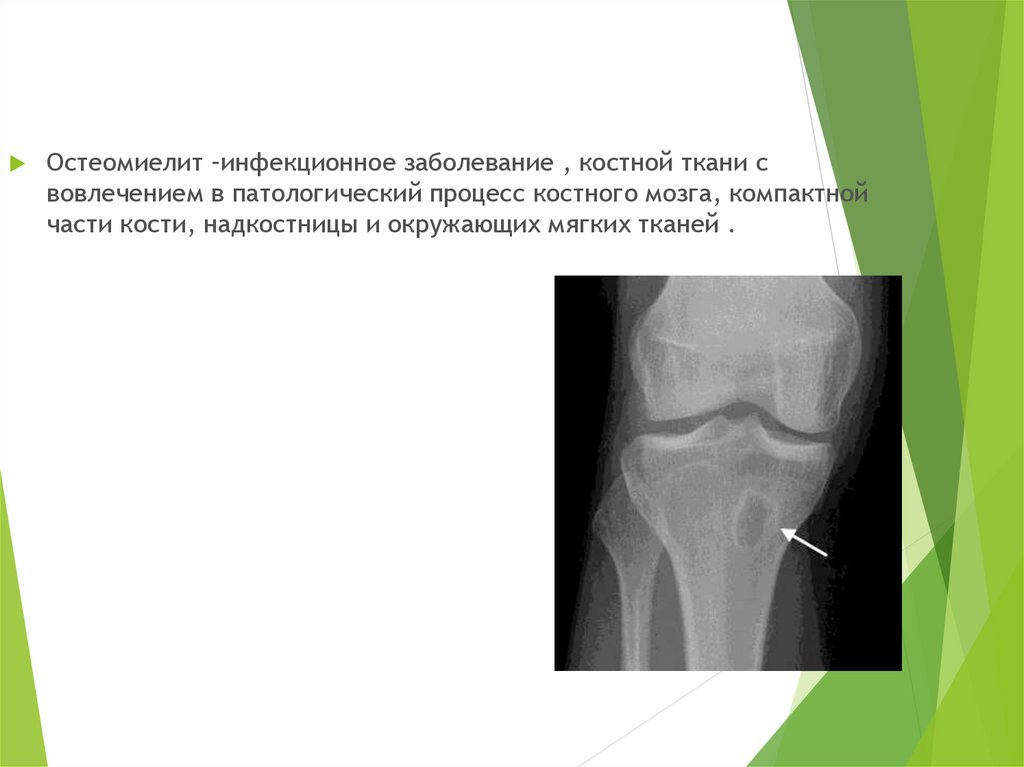 МРТ позволяет не только диагностировать остеомиелит, но и установить, как долго кость была инфицирована.
МРТ позволяет не только диагностировать остеомиелит, но и установить, как долго кость была инфицирована.
Врач может сделать
игольная аспирация для получения образца из кости. Это позволяет врачу выяснить, какие бактерии вызвали инфекцию. Это также может помочь врачу решить, какой антибиотик лучше всего подходит для лечения инфекции.
Как лечится остеомиелит?
Лечение остеомиелита зависит от:
- возраста и общего состояния здоровья ребенка
- насколько серьезна инфекция
- есть ли инфекция острый (недавний) или хронический (длительный)
Лечение включает антибиотики для лечения инфекции и обезболивающие препараты. Большинство детей с остеомиелитом ненадолго остаются в больнице, чтобы получить внутривенно (в вену) антибиотики для борьбы с инфекцией. Они могут отправиться домой, когда почувствуют себя лучше, но, возможно, им потребуется продолжить внутривенное или пероральное введение антибиотиков еще в течение нескольких недель.
Иногда требуется операция по удалению зараженной кости. Если в кости образовалась полость или отверстие, заполненное гноем (скоплением бактерий и лейкоцитов), врач проведет санацию . При этой процедуре врач очищает рану, удаляет омертвевшие ткани и выводит гной из кости, чтобы она могла зажить.
Как долго длится остеомиелит?
Большинство детей с остеомиелитом чувствуют себя лучше в течение нескольких дней после начала лечения. Внутривенные антибиотики часто заменяют на пероральные формы через 5–10 дней. Дети обычно получают антибиотики в течение как минимум месяца, а иногда и дольше, в зависимости от симптомов и результатов анализа крови.
Можно ли предотвратить остеомиелит?
Одним из способов профилактики остеомиелита является поддержание чистоты кожи. Все порезы и раны, особенно глубокие, следует хорошо очистить. Промойте рану водой с мылом, подержав ее под проточной водой не менее 5 минут, чтобы смыть ее.
Чтобы впоследствии сохранить рану в чистоте, накройте ее стерильной марлей или чистой тканью.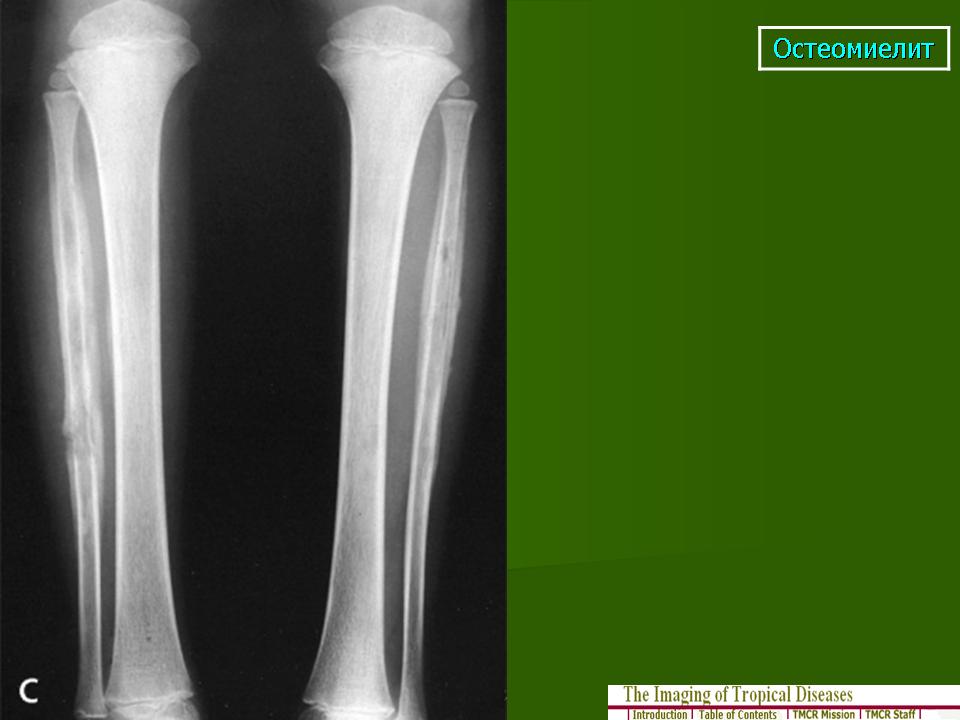 Вы можете нанести крем с антибиотиком, отпускаемый без рецепта, но самое главное — содержать область в чистоте. Раны должны начать заживать в течение 24 часов и полностью заживать в течение недели.
Вы можете нанести крем с антибиотиком, отпускаемый без рецепта, но самое главное — содержать область в чистоте. Раны должны начать заживать в течение 24 часов и полностью заживать в течение недели.
Рана, которая долго не заживает или вызывает сильную боль, должна быть осмотрена врачом.
И, как и при многих инфекциях, родители и дети должны хорошо и часто мыть руки, чтобы остановить распространение микробов. Детям также следует своевременно делать прививки.
Лечение острого гематогенного остеомиелита у детей
- Список журналов
- Рукописи авторов HHS
- PMC2836799
Expert Rev Anti Infect Ther. Авторская рукопись; доступно в PMC 2010 1 декабря.
Опубликовано в окончательной редакции как:
Expert Rev Anti Infect Ther. 2010 февраль; 8(2): 175–181.
2010 февраль; 8(2): 175–181.
doi: 10.1586/eri.09.130
PMCID: PMC2836799
NIHMSID: NIHMS180283
PMID: 20109047
, MD † и , PhD
Информация об авторе Информация об авторских правах и лицензиях Заявление об ограничении ответственности
У детей остеомиелит имеет преимущественно гематогенное происхождение и острый характер. Основной причиной остеомиелита у детей является Staphylococcus aureus , и как эпидемиология, так и патогенез инфекции S. aureus , включая остеомиелит, изменились в последние годы из-за появления внебольничной резистентности к метициллину золотистый стафилококк . Этот обзор посвящен достижениям в диагностике и общему лечению острого гематогенного остеомиелита у детей с учетом этих изменений.
Ключевые слова: острый гематогенный остеомиелит, АГО, антибиотикотерапия, CA-MRSA, дети, внебольничный метициллинрезистентный Staphylococcus aureus , визуализирующая диагностика, остеомиелит, воспаления костей и/или костного мозга, но это почти исключительно результат инфекции.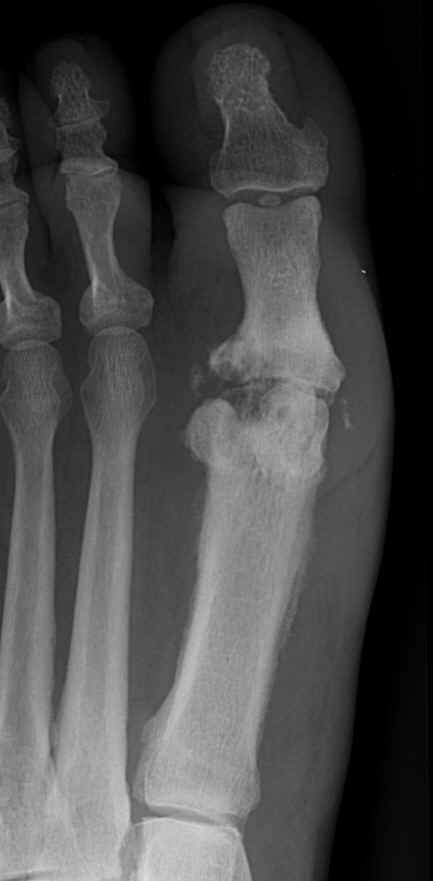 Это сложная инфекция, которая принимает различные формы, особенно с точки зрения наиболее подходящего терапевтического подхода, и по этой причине для описания остеомиелита используется несколько классификационных схем. Один из них фокусируется на источнике инфекции и различает инфекции, возникающие в результате гематогенного обсеменения из эндостального кровоснабжения, и инфекции, возникающие в результате вышележащей инфекции мягких тканей (остеомиелит, вторичный по отношению к смежному очагу инфекции) и/или сосудистой недостаточности. [1]. Вторая схема, которая применяется независимо от основного источника патогенной бактерии, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и постановкой диагноза [1].
Это сложная инфекция, которая принимает различные формы, особенно с точки зрения наиболее подходящего терапевтического подхода, и по этой причине для описания остеомиелита используется несколько классификационных схем. Один из них фокусируется на источнике инфекции и различает инфекции, возникающие в результате гематогенного обсеменения из эндостального кровоснабжения, и инфекции, возникающие в результате вышележащей инфекции мягких тканей (остеомиелит, вторичный по отношению к смежному очагу инфекции) и/или сосудистой недостаточности. [1]. Вторая схема, которая применяется независимо от основного источника патогенной бактерии, различает острую, подострую и хроническую инфекцию в зависимости от времени между появлением симптомов и постановкой диагноза [1].
Острый остеомиелит определяется как инфекция, диагностированная в течение 2 недель после появления симптомов [1,2]. Подострый остеомиелит диагностируется через 2 недели после появления симптомов, а хронический остеомиелит — через несколько месяцев после появления симптомов [2]. Хотя мы не знаем исследований, специально посвященных этому вопросу, мы считаем, что эти временные рамки должны зависеть, по крайней мере, в некоторой степени, от свойств вирулентности инфекционного штамма. Staphylococcus aureus является преобладающим возбудителем, ответственным за остеомиелит у детей (см. далее), и возможно, что временные рамки инфекции могут измениться у детей, инфицированных внебольничными метициллинрезистентными штаммами S. aureus (CA-MRSA), многие штаммы которого являются гипервирулентными по причинам, которые еще предстоит полностью объяснить [3]. Если это так, то возникла бы острая необходимость в разработке методов диагностики, способных выявлять инфекцию на ранних стадиях.
Хотя мы не знаем исследований, специально посвященных этому вопросу, мы считаем, что эти временные рамки должны зависеть, по крайней мере, в некоторой степени, от свойств вирулентности инфекционного штамма. Staphylococcus aureus является преобладающим возбудителем, ответственным за остеомиелит у детей (см. далее), и возможно, что временные рамки инфекции могут измениться у детей, инфицированных внебольничными метициллинрезистентными штаммами S. aureus (CA-MRSA), многие штаммы которого являются гипервирулентными по причинам, которые еще предстоит полностью объяснить [3]. Если это так, то возникла бы острая необходимость в разработке методов диагностики, способных выявлять инфекцию на ранних стадиях.
Обе классификационные схемы, приведенные ранее, имеют отношение к данному обсуждению, поскольку, в отличие от инфекции у взрослых, остеомиелит у детей обычно имеет гематогенное происхождение и чаще всего протекает остро [1,2,4]. Основным фактором, способствующим преобладанию гематогенного пути заражения, является характер эндостального кровоснабжения растущих костей у детей [1,2,4].
Ни одно из этих различий не является абсолютным, поскольку остеомиелит у детей может быть вызван локальным распространением инфекции смежных мягких тканей или, реже, прямой инокуляцией возбудителя в кость. Хронические инфекции возникают у детей, как правило, в результате неэффективной противомикробной терапии или наличия ортопедического имплантата. Хроническая инфекция дополнительно определяется образованием секвестра мертвой кости, и успешное разрешение таких инфекций обычно требует хирургической обработки раны и длительного антимикробного лечения, последнее иногда принимает форму как системной, так и местной доставки антибиотиков [1]. Хотя обе эти проблемы рассматриваются в этом обзоре, учитывая его преобладание среди детей, основное внимание уделяется диагностике и лечению острого гематогенного остеомиелита (ОГО) у детей.
Острый гематогенный остеомиелит обычно возникает в метафизах длинных трубчатых костей, причем примерно две трети всех случаев поражают бедренную, большеберцовую или плечевую кости [1,2,4].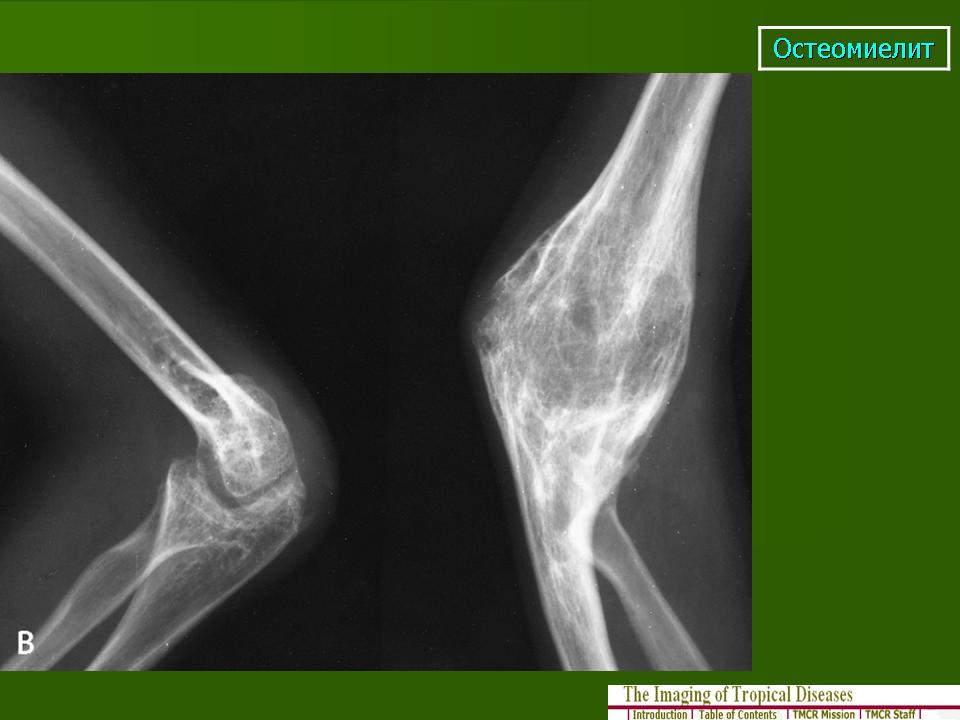 Хотя могут быть вовлечены различные бактериальные патогены, S. aureus является основным патогеном и отвечает за 70–90% инфекций AHO у детей [2,4]. Другие этиологические агенты, в произвольном порядке, включают Streptococcus pyogenes , Streptococcus pneumoniae , стрептококки группы B (у младенцев), коагулазонегативные стафилококки (особенно при инфекциях, связанных с имплантатами), Kingella kingae , кишечные грамотрицательные палочки (особенно Salmonella spp. у лиц с серповидно-клеточной анемией) и анаэробные бактерии. Haemophilus influenzae типа b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась благодаря внедрению конъюгированной Hib-вакцины [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибки ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella являются необычными причинами остеомиелита, обычно наблюдаемыми у пациентов со специфическими факторами риска, особенно при поездках или проживании в географических регионах, в которых возбудители являются эндемичными и/или имеют иммуносупрессию [4].
Хотя могут быть вовлечены различные бактериальные патогены, S. aureus является основным патогеном и отвечает за 70–90% инфекций AHO у детей [2,4]. Другие этиологические агенты, в произвольном порядке, включают Streptococcus pyogenes , Streptococcus pneumoniae , стрептококки группы B (у младенцев), коагулазонегативные стафилококки (особенно при инфекциях, связанных с имплантатами), Kingella kingae , кишечные грамотрицательные палочки (особенно Salmonella spp. у лиц с серповидно-клеточной анемией) и анаэробные бактерии. Haemophilus influenzae типа b (Hib) был частой причиной детского остеомиелита, но его распространенность снизилась благодаря внедрению конъюгированной Hib-вакцины [2,4]. Такие организмы, как Mycobacterium , Bartonella , грибки ( Histoplasma , Cryptococcus и Blastomyces ), Candida и Coxiella являются необычными причинами остеомиелита, обычно наблюдаемыми у пациентов со специфическими факторами риска, особенно при поездках или проживании в географических регионах, в которых возбудители являются эндемичными и/или имеют иммуносупрессию [4].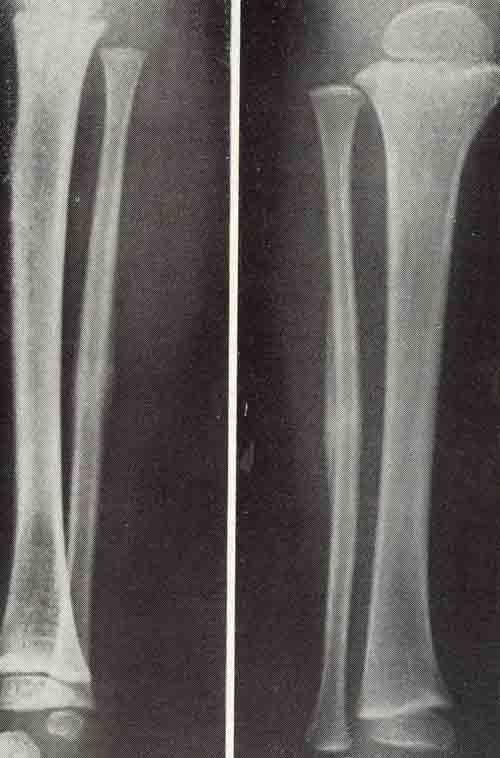 Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерий-нарушителей, в первую очередь ПЦР, этиология ОГО у детей в значительном числе случаев остается неизвестной [5].
Также важно отметить, что, несмотря на все более широкое использование более чувствительных диагностических методов, которые в меньшей степени зависят от культуры бактерий-нарушителей, в первую очередь ПЦР, этиология ОГО у детей в значительном числе случаев остается неизвестной [5].
Например, в недавнем отчете было обнаружено, что K. kingae является наиболее частой причиной костно-суставных инфекций у французских детей в возрасте до 3 лет [6]. Однако примерно 70% этих случаев были ограничены септическим артритом, и только примерно 18% имели клинические признаки остеомиелита [6]. Это согласуется с обзором педиатрических случаев в Северной Америке, который показал, что, помимо грамположительных кокков, K. kingae были основной причиной костно-суставных инфекций у детей младше 5 лет [4]. Это также согласуется с нашим опытом в Детской больнице Арканзаса (АР, США), где мы обнаружили, что K. kingae является наиболее частой причиной септического артрита у детей в возрасте до 2 лет [Juretschko S, Arkansas Children’s Hospital, Pers. Комм.]. K. kingae является прихотливым микроорганизмом, который трудно культивировать, и его очевидное увеличение распространенности в качестве возбудителя костно-суставных инфекций вряд ли связано с изменением общей эпидемиологии заболевания, а скорее с растущим использованием более чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость альтернативных диагностических методов, которые можно использовать для выбора окончательной антимикробной терапии. Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus , в частности, являются наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
Комм.]. K. kingae является прихотливым микроорганизмом, который трудно культивировать, и его очевидное увеличение распространенности в качестве возбудителя костно-суставных инфекций вряд ли связано с изменением общей эпидемиологии заболевания, а скорее с растущим использованием более чувствительные диагностические методы, такие как ПЦР, для прямой идентификации патогенов, присутствующих в суставной жидкости и образцах костей. Такие исследования подчеркивают необходимость альтернативных диагностических методов, которые можно использовать для выбора окончательной антимикробной терапии. Однако они не меняют вывода о том, что грамположительные кокки в целом и Staphylococcus aureus , в частности, являются наиболее распространенной причиной всех типов костно-суставных инфекций у детей всех возрастных групп [2,4].
Как и при всех формах инфекции S. aureus , постоянное появление штаммов, устойчивых к метициллину, вызывает растущую озабоченность. Обзор данных из 33 различных детских больниц, представляющих 17 из 20 крупных мегаполисов США, показал, что распространенность остеомиелита, вызванного метициллинрезистентными S. aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного S. aureus (MSSA) остеомиелита оставалась стабильной [7]. В целом, 51% пациентов, госпитализированных с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что примерно 65% стационарных инфекций S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers. Комм.]. Важно отметить, что в исследовании всех детей, поступивших в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в возрасте 19[8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8]. Следует отметить, что в этом исследовании у детей, получивших соответствующую терапию MRSA в течение 2 дней, частота осложнений была такой же, как и у детей, у которых была 2-дневная или более задержка в начале соответствующей антибактериальной терапии острого остеомиелита MRSA [8].
aureus (MRSA) увеличилась с 0,3 до 1,4 на 1000 госпитализаций в период с 2002 по 2007 год, в то время как частота метициллин-чувствительного S. aureus (MSSA) остеомиелита оставалась стабильной [7]. В целом, 51% пациентов, госпитализированных с инфекцией S. aureus , были инфицированы MRSA [7]. Это согласуется с нашим опытом в Детской больнице Арканзаса, где мы обнаружили, что примерно 65% стационарных инфекций S. aureus вызваны MRSA [Juretschko S, Arkansas Children’s Hospital, Pers. Комм.]. Важно отметить, что в исследовании всех детей, поступивших в Детский медицинский центр Далласа (Техас, США) с острым остеомиелитом в возрасте 19[8]. Осложнения включали миозит, абсцесс кости, патологический перелом, тромбоз глубоких вен и диссеминированное заболевание [8]. Следует отметить, что в этом исследовании у детей, получивших соответствующую терапию MRSA в течение 2 дней, частота осложнений была такой же, как и у детей, у которых была 2-дневная или более задержка в начале соответствующей антибактериальной терапии острого остеомиелита MRSA [8].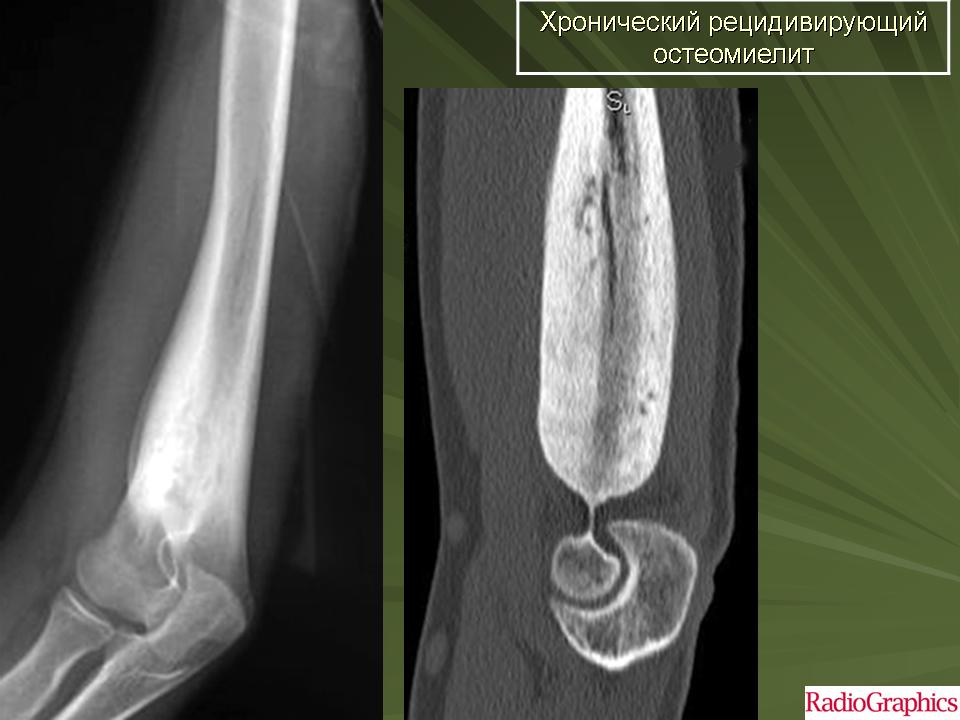 Это означает, что использование только соответствующих противомикробных препаратов может быть недостаточным для лечения остеомиелита, ассоциированного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленную воспалительную реакцию, многоочаговое заболевание и более частые абсцессы костей, требующие хирургического дренирования [8,9].,10]. В этом отношении важно отметить, что временные рамки Далласского исследования [8] соответствуют времени, когда появление инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего апогея.
Это означает, что использование только соответствующих противомикробных препаратов может быть недостаточным для лечения остеомиелита, ассоциированного с MRSA. Это особенно верно в отношении инфекций, вызванных CA-MRSA, поскольку у этих пациентов часто наблюдаются более серьезные клинические проявления, которые включают усиленную воспалительную реакцию, многоочаговое заболевание и более частые абсцессы костей, требующие хирургического дренирования [8,9].,10]. В этом отношении важно отметить, что временные рамки Далласского исследования [8] соответствуют времени, когда появление инфекций CA-MRSA началось, но еще не достигло (или, возможно, даже сейчас) своего апогея.
У большинства детей и подростков с ОГО в анамнезе отмечаются боли в костях в течение нескольких дней [2,4]. Отличительной чертой боли AHO является ее постоянный характер с постепенным нарастанием уровня боли [2,4]. У маленьких детей часто бывает трудно определить локализацию боли, тогда как у детей старшего возраста она обычно более локализована [2,4].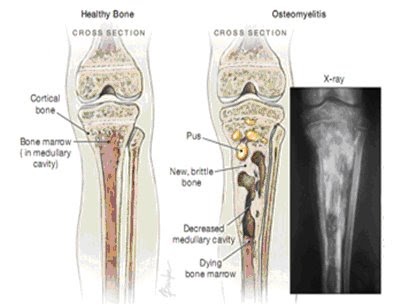 Боль обычно приводит к ограничению движений пораженной конечности [2,4]. Поскольку чаще всего поражаются длинные кости нижних конечностей, дети часто хромают [2,11]. Во всех случаях локальная боль в костях и лихорадка должны вызвать клиническое подозрение на ОГА. Преувеличенная неподвижность сустава и отсутствие точечной болезненности над метафизом предполагают септический артрит, а не остеомиелит (или в дополнение к нему). Классические признаки воспаления (покраснение, повышение температуры и припухлость) не появляются, если инфекция не распространилась через метафизарную кору в поднадкостничное пространство [2]. Такое прогрессирование чаще встречается у младенцев и детей младшего возраста с более тонкой корой кости.
Боль обычно приводит к ограничению движений пораженной конечности [2,4]. Поскольку чаще всего поражаются длинные кости нижних конечностей, дети часто хромают [2,11]. Во всех случаях локальная боль в костях и лихорадка должны вызвать клиническое подозрение на ОГА. Преувеличенная неподвижность сустава и отсутствие точечной болезненности над метафизом предполагают септический артрит, а не остеомиелит (или в дополнение к нему). Классические признаки воспаления (покраснение, повышение температуры и припухлость) не появляются, если инфекция не распространилась через метафизарную кору в поднадкостничное пространство [2]. Такое прогрессирование чаще встречается у младенцев и детей младшего возраста с более тонкой корой кости.
Повышенная скорость оседания эритроцитов (СОЭ), повышенный уровень С-реактивного белка (СРБ) и лейкоцитоз часто наблюдаются при ОГО, при этом повышенный СРБ является наиболее чувствительным лабораторным показателем [12]. Однако это также зависит от агента-нарушителя.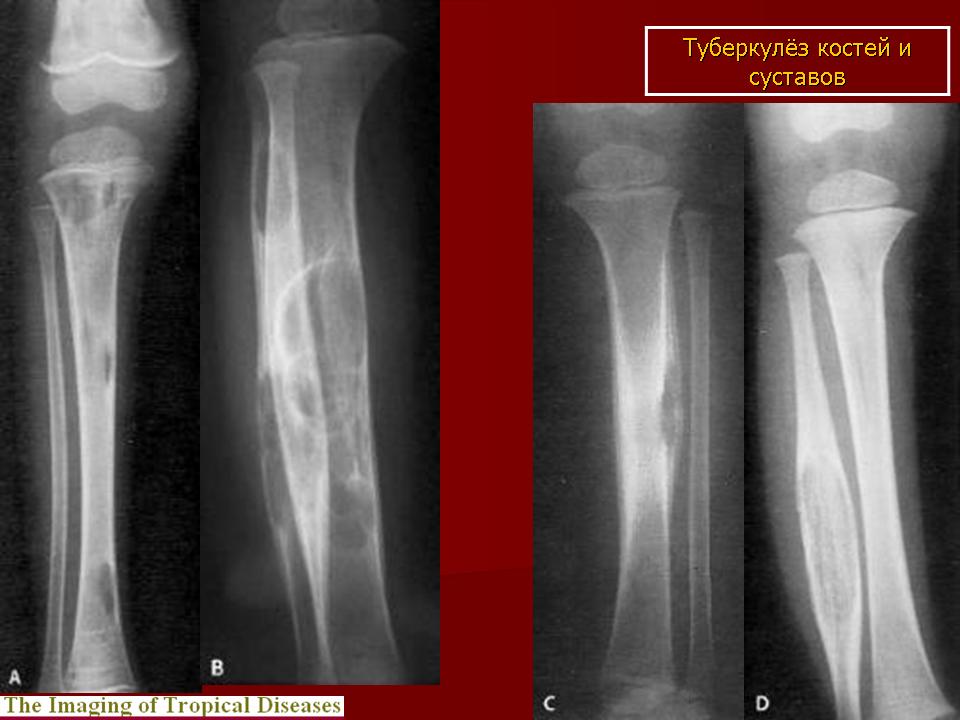 Например, недавнее исследование показало, что заметно повышенный уровень СРБ (>4 мг/дл) наблюдался у 86% детей с ОГА, вызванной MRSA, и только у 58% детей с острым остеомиелитом MSSA [8].
Например, недавнее исследование показало, что заметно повышенный уровень СРБ (>4 мг/дл) наблюдался у 86% детей с ОГА, вызванной MRSA, и только у 58% детей с острым остеомиелитом MSSA [8].
Поскольку физикальное обследование и лабораторные тесты носят предположительный, а не окончательный характер, для облегчения диагностики остеомиелита использовались различные методы визуализации. К ним относятся обычные рентгенограммы, сцинтиграфия скелета, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Простые рентгенограммы необходимы для исключения других диагнозов, таких как перелом. Хотя глубокий отек мягких тканей можно увидеть рентгенологически в течение первых нескольких дней после начала заболевания, остеопения или остеолитические поражения вследствие разрушения кости обычно не видны до 2–3 недель после появления симптомов [13]. По этой причине диагностическая ценность простых рентгенограмм для диагностики остеомиелита ограничена пациентами с длительными симптомами, и, как отмечалось ранее, у детей это обычно не так.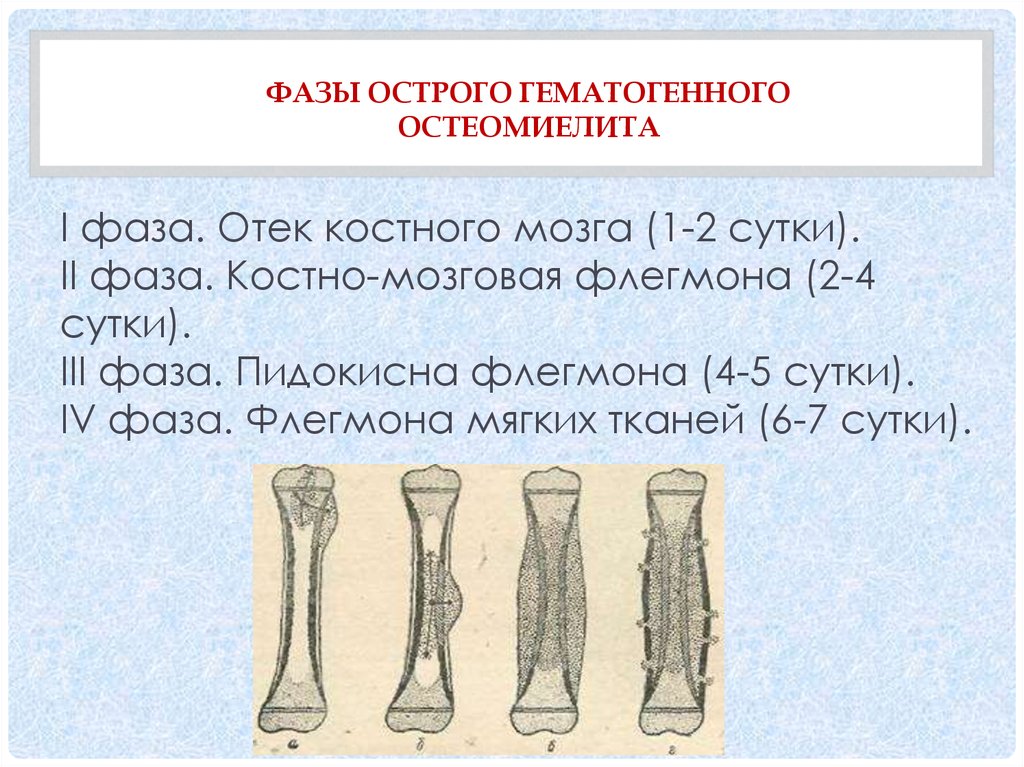 В результате другие методы визуализации чаще используются для диагностики ОГО у детей [13]. Сцинтиграфия скелета с использованием технеция-99m дифосфонат позволяет проводить обследование всего тела, что полезно для пациентов с плохо локализованными симптомами или при подозрении на мультифокальный остеомиелит, чувствительность которого составляет более 90% [14]. Однако это требует воздействия ионизирующего излучения, а чувствительность у новорожденных ниже, что делает сцинтиграфию скелета менее полезной в этой возрастной группе. Дифференциация остеомиелита от инфаркта, связанного с серповидно-клеточной анемией, и других заболеваний, не связанных с инфекцией, включая новообразования и переломы, также может быть затруднена [14]. Кроме того, сцинтиграфия скелета может иметь ограниченную полезность в диагностике внебольничной S. aureus остеомиелит. Недавнее исследование показало, что сцинтиграфия скелета диагностировала остеомиелит только у 53% детей с внебольничным остеомиелитом S.
В результате другие методы визуализации чаще используются для диагностики ОГО у детей [13]. Сцинтиграфия скелета с использованием технеция-99m дифосфонат позволяет проводить обследование всего тела, что полезно для пациентов с плохо локализованными симптомами или при подозрении на мультифокальный остеомиелит, чувствительность которого составляет более 90% [14]. Однако это требует воздействия ионизирующего излучения, а чувствительность у новорожденных ниже, что делает сцинтиграфию скелета менее полезной в этой возрастной группе. Дифференциация остеомиелита от инфаркта, связанного с серповидно-клеточной анемией, и других заболеваний, не связанных с инфекцией, включая новообразования и переломы, также может быть затруднена [14]. Кроме того, сцинтиграфия скелета может иметь ограниченную полезность в диагностике внебольничной S. aureus остеомиелит. Недавнее исследование показало, что сцинтиграфия скелета диагностировала остеомиелит только у 53% детей с внебольничным остеомиелитом S.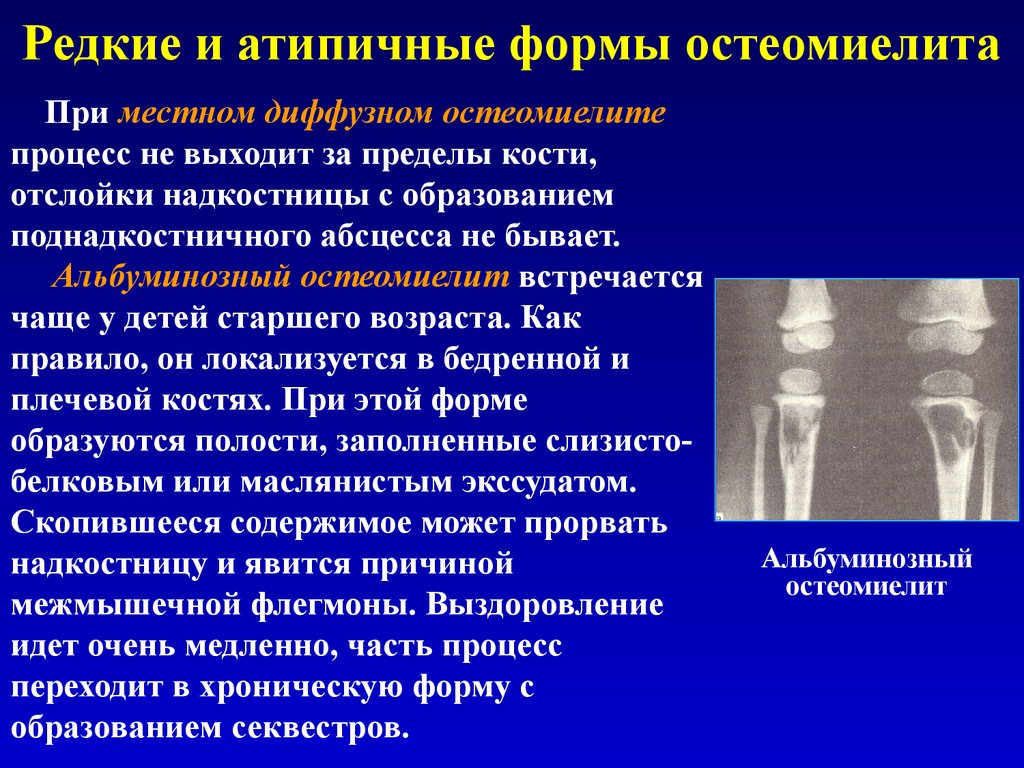 aureus [15].
aureus [15].
Одним из преимуществ компьютерной томографии является то, что она предоставляет конкретную анатомическую информацию о статусе инфекции [13]. КТ может обнаружить секвестры (свидетельствующие о хроническом остеомиелите) и внутрикостный газ, а также определить поднадкостничные абсцессы, что является важным фактором при разработке общего терапевтического подхода [13]. Однако КТ также требует облучения. Есть исследования, предполагающие, что позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) может быть полезной альтернативой для диагностики у взрослых, особенно в сочетании с КТ [16,17]. Однако этот вопрос не был должным образом изучен в конкретном контексте педиатрического пациента. МРТ можно использовать для выявления внутрикостных, поднадкостничных и абсцессов мягких тканей, что позволяет проводить раннее дренирование абсцесса без воздействия радиации [13,18]. Отек и экссудаты в костномозговом пространстве являются частыми проявлениями острого остеомиелита и могут быть визуализированы с помощью МРТ [13,18].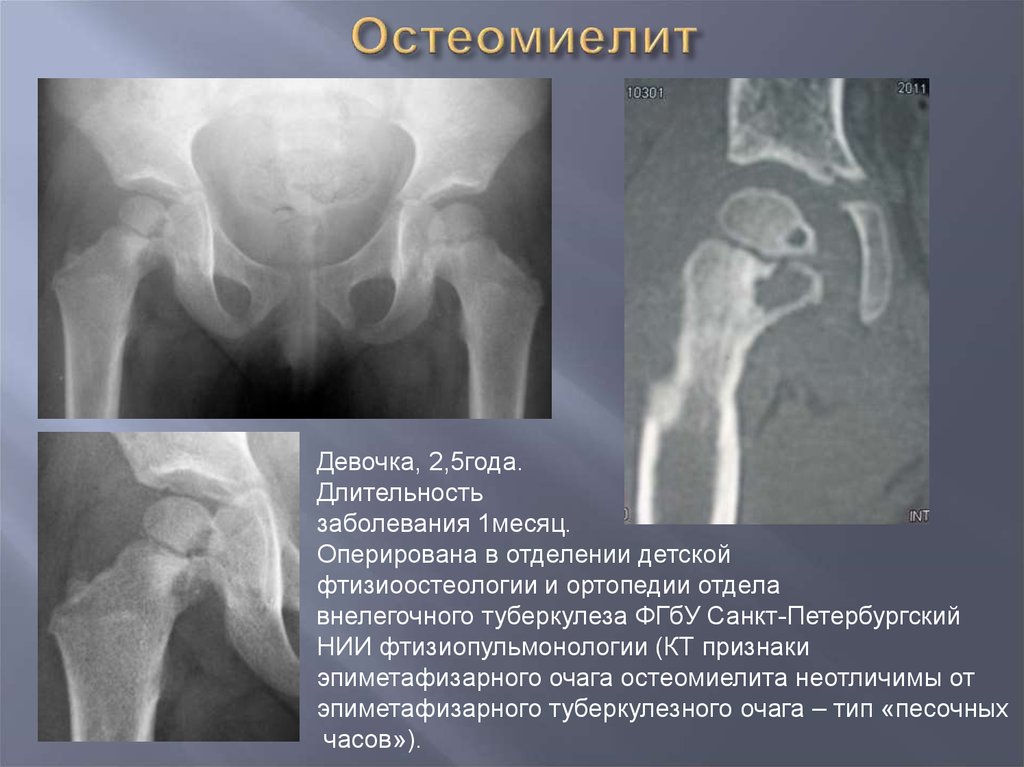 Однако эти результаты можно увидеть и при других состояниях, таких как переломы и инфаркты [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если им будет показано хирургическое вмешательство. По этим причинам МРТ становится методом выбора при ОГО у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблется от 82–100% до 75–9%.6% соответственно [13]. Стоимость, доступность и необходимость седации являются важными ограничениями использования МРТ.
Однако эти результаты можно увидеть и при других состояниях, таких как переломы и инфаркты [13,18]. Миозит также легко выявляется с помощью МРТ [18]. МРТ дает лучшую анатомическую информацию, предоставляя анатомический атлас для ортопедов, если им будет показано хирургическое вмешательство. По этим причинам МРТ становится методом выбора при ОГО у детей [2,13–15,18]. Чувствительность и специфичность МРТ для диагностики остеомиелита колеблется от 82–100% до 75–9%.6% соответственно [13]. Стоимость, доступность и необходимость седации являются важными ограничениями использования МРТ.
Хотя осмотр пациента, лабораторные исследования и диагностическая визуализация важны, ни один из них не является окончательным в отношении диагноза ОГО и, что более важно, ни один из них не дает информации о статусе антибиотикорезистентности возбудителя. По этой причине выделение возбудителя остается золотым стандартом диагностики и в настоящее время является единственным способом установления окончательного микробиологического диагноза [1,2].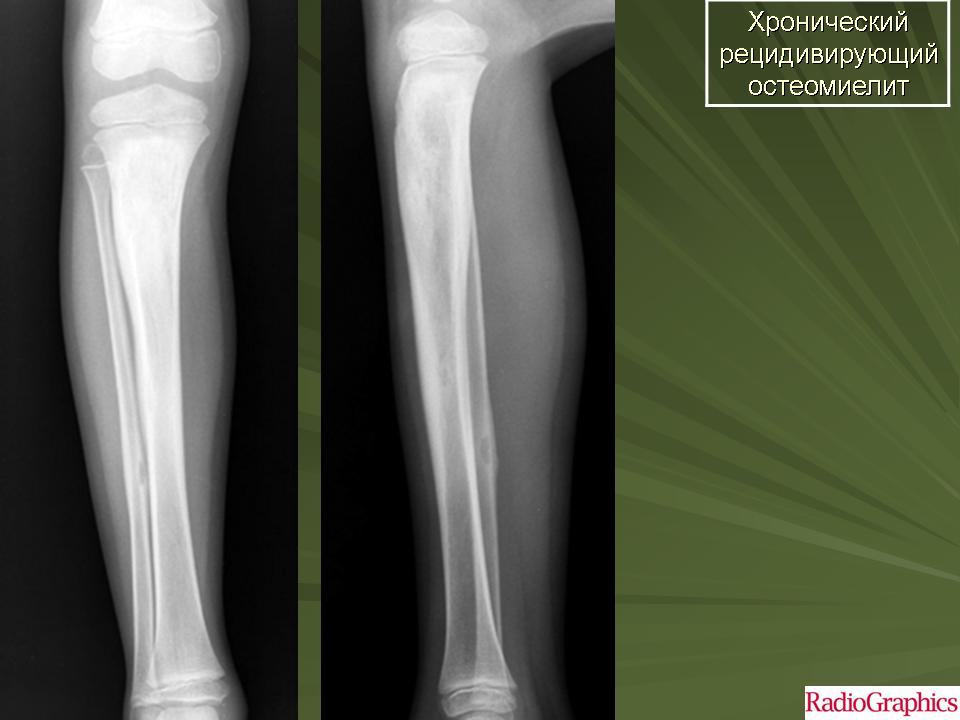 В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо из-за сложности культивирования патогенных организмов, либо из-за того, что эмпирическая антимикробная терапия испортила микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическая антимикробная терапия должна быть скорректирована на основе специфического профиля чувствительности возбудителя бактериального штамма. Культуральные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с посевами крови [2]. Тем не менее, необходимо также получить посев крови, так как примерно в 50% всех случаев AHO-инфекций организм выявляется [2]. Аспирация пораженной кости иглой может быть выполнена с использованием относительно неинвазивных процедур у новорожденных и детей младшего возраста, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или рассечение кости.
В значительном числе случаев невозможно установить окончательную бактериальную этиологию либо из-за сложности культивирования патогенных организмов, либо из-за того, что эмпирическая антимикробная терапия испортила микробиологический анализ [2,5]. Когда этиологический агент может быть идентифицирован, эмпирическая антимикробная терапия должна быть скорректирована на основе специфического профиля чувствительности возбудителя бактериального штамма. Культуральные образцы должны включать образцы костей, которые имеют более высокую диагностическую ценность по сравнению с посевами крови [2]. Тем не менее, необходимо также получить посев крови, так как примерно в 50% всех случаев AHO-инфекций организм выявляется [2]. Аспирация пораженной кости иглой может быть выполнена с использованием относительно неинвазивных процедур у новорожденных и детей младшего возраста, в то время как детям старшего возраста и подросткам часто требуются более инвазивные хирургические методы, такие как сверление или рассечение кости. Прямая инокуляция культивируемого материала во флакон с гемокультурой увеличивает вероятность выделения прихотливого микроорганизма, такого как К. королевский . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детской больнице Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae и, у детей младше 8 лет, K. kingae . Также необходимо получить окрашивание и посев на грибы и микобактерии, особенно в случаях со специфическими факторами риска и в случаях с отрицательным посевом ОГО, которые не отвечают на эмпирическую терапию. Образцы тканей также следует отправить на гистологическое исследование для подтверждения диагноза остеомиелита. Получение посевов на ранних стадиях ОГО полезно, поскольку длительная эмпирическая антимикробная терапия снижает вероятность выделения возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибактериальную терапию следует отложить до получения культур тканей.
Прямая инокуляция культивируемого материала во флакон с гемокультурой увеличивает вероятность выделения прихотливого микроорганизма, такого как К. королевский . Использование ПЦР для выявления патогенов в образцах костей также становится все более распространенным. В Детской больнице Арканзаса все образцы костей отправляются на ПЦР-анализ с акцентом на S. aureus, S. pneumoniae и, у детей младше 8 лет, K. kingae . Также необходимо получить окрашивание и посев на грибы и микобактерии, особенно в случаях со специфическими факторами риска и в случаях с отрицательным посевом ОГО, которые не отвечают на эмпирическую терапию. Образцы тканей также следует отправить на гистологическое исследование для подтверждения диагноза остеомиелита. Получение посевов на ранних стадиях ОГО полезно, поскольку длительная эмпирическая антимикробная терапия снижает вероятность выделения возбудителя. Действительно, у стабильного пациента, если имеется план быстрого получения культур тканей, мы считаем, что эмпирическую антибактериальную терапию следует отложить до получения культур тканей.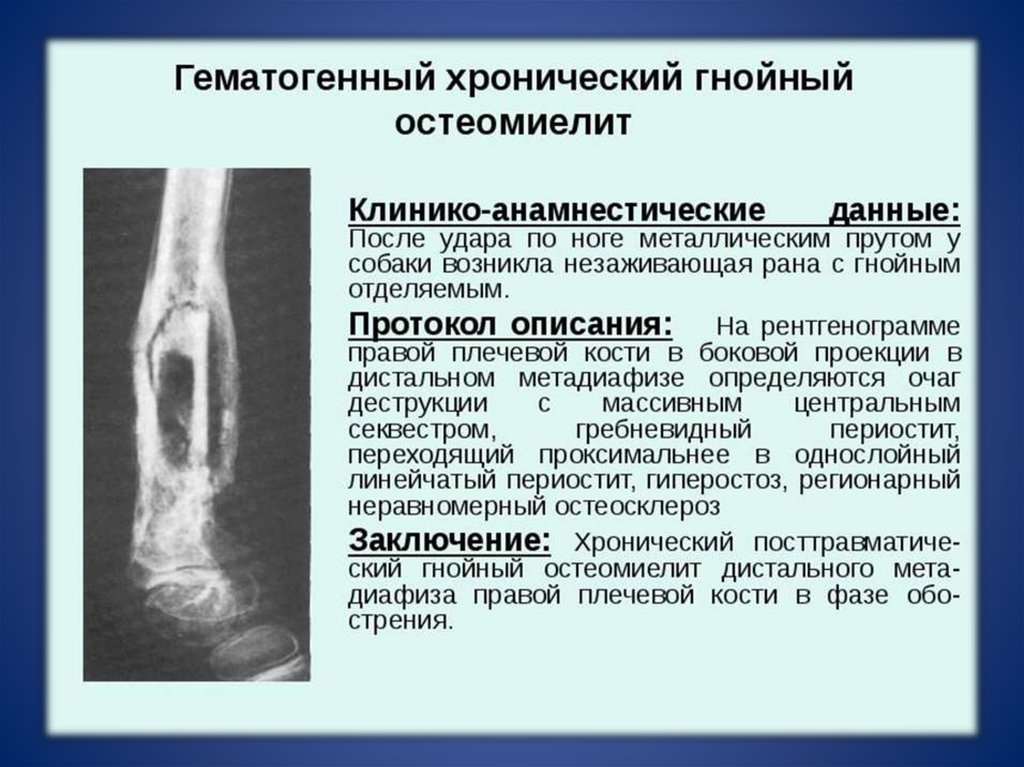
Лечение ОГО требует соответствующей антимикробной терапии во всех случаях и может потребовать хирургического разреза и дренирования. По причинам, обсужденным ранее, соответствующий дренаж стал особенно важным в последние годы из-за продолжающегося появления CA-MRSA. Разрез и дренирование следует выполнять при наличии абсцесса (внутрикостного, поднадкостничного и/или мягкотканного) [2]. Следует проводить хирургическое удаление омертвевшей кости и санацию пораженных мягких тканей [1,2]. По нашему опыту, у детей и подростков с остеомиелитом CA-MRSA часто необходимы множественные процедуры разреза и дренирования, даже при соответствующей антибактериальной терапии. Хирургическое дренирование также следует рассматривать, когда ребенок не отвечает на эмпирическую антибактериальную терапию. В этом случае хирургическое вмешательство может улучшить лечение. Кроме того, хирургическое вмешательство позволяет собрать ткань, которую можно подвергнуть микробиологической оценке на предмет необычной этиологии остеомиелита и гистологическому исследованию для подтверждения диагноза.
Независимо от того, требуется ли хирургическое вмешательство, успешное лечение всех форм остеомиелита требует соответствующей антибактериальной терапии [1,2,4]. Антибиотики, доказавшие свою эффективность против S. aureus инфекций костей и суставов, включают нафциллин, клиндамицин, цефалоспорины первого поколения и ванкомицин [1,2]. Если MRSA не вызывает беспокойства (сообщества с ≤10% CA-MRSA, определяемые местной антибиотикограммой), то, по нашему мнению, эмпирическая терапия для детей (дети, определенные здесь как дети в возрасте 3 месяцев и старше) должна быть антистафилококковым пенициллином (нафциллин). и оксациллин) или цефалоспорин первого поколения (цефазолин). Эти агенты эффективны не только против MSSA, но и против других причин AHO, включая S. pyogenes и K. kingae . К сожалению, постоянное появление MRSA среди внебольничных изолятов имеет ограниченные возможности лечения, поскольку все β-лактамные антибиотики исключены из рассмотрения.
В сообществах с 10% или более CA-MRSA, ванкомицин или клиндамицин (если локальный уровень резистентности к клиндамицину ≤25%), по нашему мнению, следует использовать для эмпирического лечения детей. Однако следует отметить, что ни ванкомицин, ни клиндамицин не активны в отношении К. королевский . Если рассматривается возможность лечения клиндамицином, индуцируемый фенотип устойчивости к макролидам, линкозамиду и стрептограмину В (MLS B ) должен быть исключен с помощью D-теста (тест индукции эритромицина, который показывает притупление зоны ингибирования клиндамицином на стороне соседний диск с эритромицином, когда присутствует фенотип устойчивости MLS B ), поскольку этот фенотип был связан с неэффективностью лечения [19,20]. По нашему мнению, ванкомицин является основным средством выбора для лечения резистентности, индуцируемой клиндамицином, и в сообществах с резистентностью к клиндамицину более 25%. Если K. kingae вызывает особую озабоченность в районе со значительным MRSA, следует рассмотреть возможность терапии цефазолином в дополнение к соответствующей эмпирической терапии MRSA. Следует также еще раз подчеркнуть, что если посев позволяет поставить окончательный диагноз, антимикробное лечение должно быть немедленно скорректировано на основе профиля чувствительности микроорганизма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии ОГО у детей в возрасте 3 мес и старше.
Следует также еще раз подчеркнуть, что если посев позволяет поставить окончательный диагноз, антимикробное лечение должно быть немедленно скорректировано на основе профиля чувствительности микроорганизма-нарушителя. представляет собой алгоритм предлагаемой начальной антибактериальной терапии ОГО у детей в возрасте 3 мес и старше.
Открыть в отдельном окне
Алгоритм рекомендуемой начальной антибактериальной терапии острого гематогенного остеомиелита у детей в возрасте 3 месяцев и старше
Если в культуре обнаружен микроорганизм, антимикробную терапию следует немедленно скорректировать (при необходимости).
*Если Kingella kingae вызывает особую озабоченность, добавьте терапию цефазолином.
‡ Если рассматривается возможность лечения клиндамицином, индуцируемый фенотип устойчивости к макролидам, линкозамиду и стрептограмину В должен быть исключен с помощью D-теста, поскольку этот фенотип связан с неэффективностью лечения.
АГО: Острый гематогенный остеомиелит; CA-MRSA: внебольничный устойчивый к метициллину Staphylococcus aureus .
Триметоприм-сульфаметоксазол (TMP-SMX) успешно применялся для лечения инфекций кожи и мягких тканей (ИКМТ), вызванных CA-MRSA. Однако эффективность TMP-SMX при лечении MRSA-остеомиелита у детей изучена недостаточно. Точно так же доксициклин может быть эффективным вариантом лечения чувствительных к MRSA SSTI у детей старше 8 лет, но его использование для лечения MRSA-остеомиелита у детей остается неизученным. В последние годы также стали доступны новые антимикробные агенты для лечения инфекций, вызванных MRSA. К ним относятся линезолид (оксазолидиноновый антибиотик) и даптомицин (липопептидный антибиотик). К настоящему времени клинический опыт применения этих препаратов в конкретном контексте костной инфекции у детей ограничен, хотя в одном исследовании 13 детей, получавших линезолид в качестве ступенчатой или альтернативной терапии костно-суставных инфекций, 11 из 13 детей добились хороших результатов [21].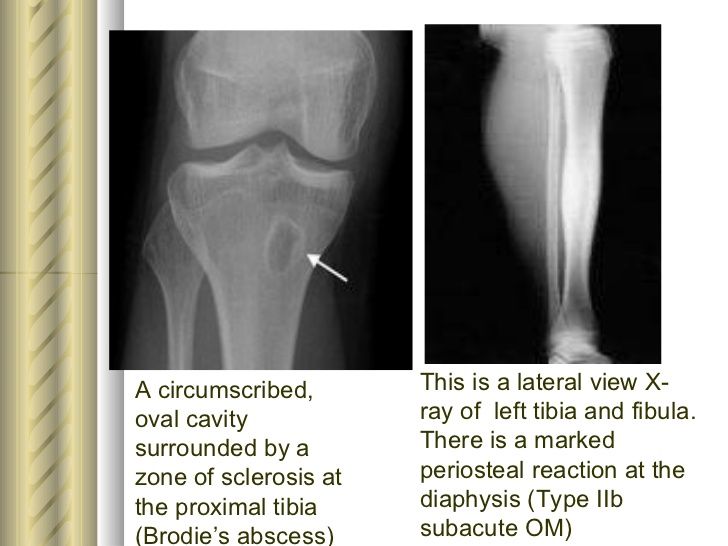 ]. Средняя продолжительность терапии составила 20 дней, в ходе терапии у двух детей развилась анемия [21]. Миелосупрессия является известным побочным эффектом длительной терапии линезолидом, равно как и оптическая и периферическая нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает применение линезолида при лечении ОГО у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения ОГО у детей ограничено, поскольку MRSA, осложненная пневмонией, представляет собой растущую проблему, а даптомицин инактивируется легочными сурфактантами и не может использоваться для лечения таких сложных инфекций. Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. Если используется даптомицин, следует тщательно контролировать уровень креатининфосфокиназы, так как может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в отношении специфического контекста биопленки [22] и при лечении инфекций, связанных с биопленкой, в том числе вызванных MRSA [23–25].
]. Средняя продолжительность терапии составила 20 дней, в ходе терапии у двух детей развилась анемия [21]. Миелосупрессия является известным побочным эффектом длительной терапии линезолидом, равно как и оптическая и периферическая нейропатии. По этой причине не рекомендуется курс лечения более 21 дня. Это ограничивает применение линезолида при лечении ОГО у детей, что требует длительной антимикробной терапии. Педиатрические исследования эффективности даптомицина отсутствуют. Использование даптомицина для лечения ОГО у детей ограничено, поскольку MRSA, осложненная пневмонией, представляет собой растущую проблему, а даптомицин инактивируется легочными сурфактантами и не может использоваться для лечения таких сложных инфекций. Также известно, что даптомицин вызывает повышение уровня креатининфосфокиназы. Если используется даптомицин, следует тщательно контролировать уровень креатининфосфокиназы, так как может возникнуть опасный рабдомиолиз. Недавние исследования показали, что даптомицин особенно эффективен в отношении специфического контекста биопленки [22] и при лечении инфекций, связанных с биопленкой, в том числе вызванных MRSA [23–25]. Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Это может быть особенно важно, особенно в контексте хронического остеомиелита.
Стандартная терапия ОГО длится от 4 до 6 недель. Доказательные данные о пути и продолжительности введения антибиотиков при ОГО ограничены, а критерии, устанавливающие, когда следует переходить с парентеральной на пероральную терапию, не определены [26]. Продление лечения антибиотиками может быть необходимо при замедленной или неполной хирургической эвакуации или при наличии отдаленных очагов инфекции (например, эндокардита). Интервенционная рентгенологическая установка постоянных венозных катетеров в периферических венах легкодоступна, но затраты на установку катетера, внутривенное введение антибиотиков на дому и уход на дому значительно выше, чем при пероральной терапии. Кроме того, следует учитывать осложнения, связанные с установкой центрального венозного катетера, такие как бактериемия, возникающая из-за постоянного устройства и неисправности катетера. В обзоре, сравнивающем результаты короткого (<7 дней) и длительного (>7 дней) курса внутривенного лечения ОГО, вызванной главным образом MSSA, у детей в возрасте от 3 месяцев до 16 лет, 12 проспективных исследований выявили общую частоту излечения.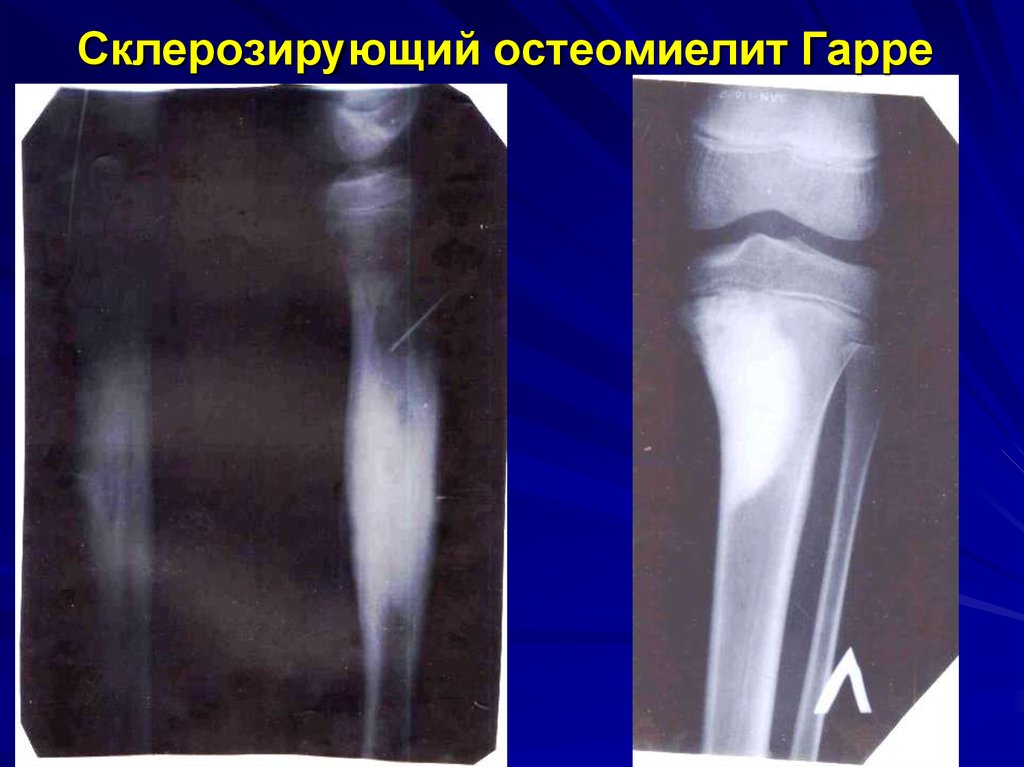 из 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93,6–99,8) для более длительного курса в течение 6 месяцев [26], что является скромной разницей в свете потенциальных осложнений и расходы, указанные выше. Кроме того, не было существенной разницы в терапевтических результатах в зависимости от продолжительности пероральной терапии между двумя группами [26].
из 95,2% (95% ДИ: 90,4–97,7) для короткого курса по сравнению с 98,8% (95% ДИ: 93,6–99,8) для более длительного курса в течение 6 месяцев [26], что является скромной разницей в свете потенциальных осложнений и расходы, указанные выше. Кроме того, не было существенной разницы в терапевтических результатах в зависимости от продолжительности пероральной терапии между двумя группами [26].
Наш опыт показывает, что детей можно эффективно лечить последовательной парентеральной/пероральной терапией при соблюдении нескольких условий. Парентеральные антибиотики следует назначать до тех пор, пока у ребенка не исчезнет лихорадка и не продемонстрирует улучшение как по данным физического осмотра, так и по лабораторным анализам. Мы рекомендуем 7–14 дней парентеральной терапии для пациентов с бактериемией; более короткий курс внутривенной терапии допустим для детей без бактериемии. В начале лечения следует еженедельно контролировать СРБ и СОЭ для оценки ответа на терапию. СРБ обычно возвращается к исходному уровню в течение недели после начала эффективной терапии и используется многими в качестве маркера перехода от парентеральной к пероральной терапии [2]. Еженедельно следует проводить общий анализ крови для оценки ответа на терапию и контроля нейтропении, потенциального последствия антибактериальной терапии. Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные лица, осуществляющие уход, и должно быть организовано регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь ту же степень антибактериального действия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Тем не менее, в связи с ростом числа случаев CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соблюдение этих критериев может вскоре оказаться затруднительным в США.
Еженедельно следует проводить общий анализ крови для оценки ответа на терапию и контроля нейтропении, потенциального последствия антибактериальной терапии. Общая продолжительность терапии должна основываться на разрешении симптомов и нормализации СОЭ, что обычно занимает 4–6 недель. Должны присутствовать надежные лица, осуществляющие уход, и должно быть организовано регулярное плановое амбулаторное наблюдение. Пероральный антибиотик должен демонстрировать отличное проникновение в кости, иметь ту же степень антибактериального действия, что и парентеральный препарат, и ребенок должен иметь возможность принимать пероральные препараты. Тем не менее, в связи с ростом числа случаев CA-MRSA, который также устойчив к клиндамицину, и отсутствием исследований, касающихся использования других пероральных антибиотиков у детей, соблюдение этих критериев может вскоре оказаться затруднительным в США.
До появления антибиотиков ОГО была серьезным заболеванием с высокой заболеваемостью и смертностью [2].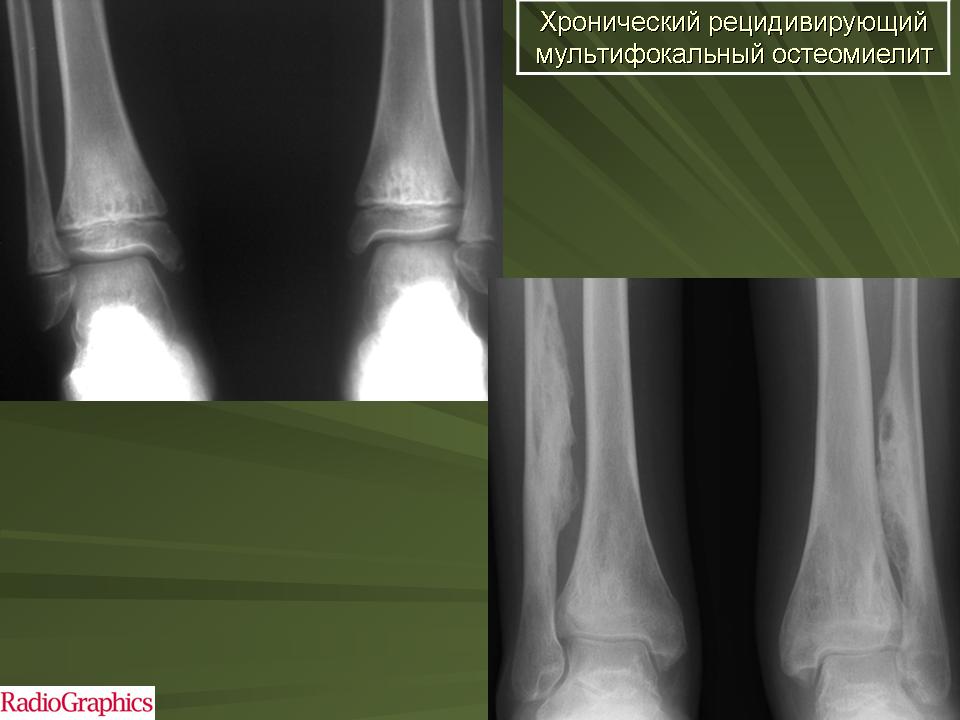 Благодаря усовершенствованию методов диагностики и лечения смертность от этого заболевания в развитых странах в настоящее время незначительна [4]. Однако вариабельность клинического течения ОГО у детей затрудняет рекомендации стандартизированной терапии. Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие детских инфекционистов и ортопедов.
Благодаря усовершенствованию методов диагностики и лечения смертность от этого заболевания в развитых странах в настоящее время незначительна [4]. Однако вариабельность клинического течения ОГО у детей затрудняет рекомендации стандартизированной терапии. Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие детских инфекционистов и ортопедов.
Эпидемиология ОГО у детей также изменилась с появлением CA-MRSA в качестве основного патогена. Прошлые исследования клинического течения, диагностики и лечения ОГО могут быть неприменимы к CA-MRSA, и по этой причине срочно необходимы дальнейшие исследования всех вопросов, обсуждаемых в этом обзоре. Крайне важно, чтобы эти исследования включали оценку новых противомикробных препаратов, эффективных против стафилококковых штаммов, устойчивых к современным бета-лактамным, линкозамидным и гликопептидным антибиотикам. К ним относятся липогликопептиды (бактерицидные агенты с длительным периодом полураспада) телаванцин, оритаванцин и далбаванцин, все из которых получены из существующих гликопептидных антибиотиков, а некоторые из них эффективны против штаммов, устойчивых к ванкомицину [27].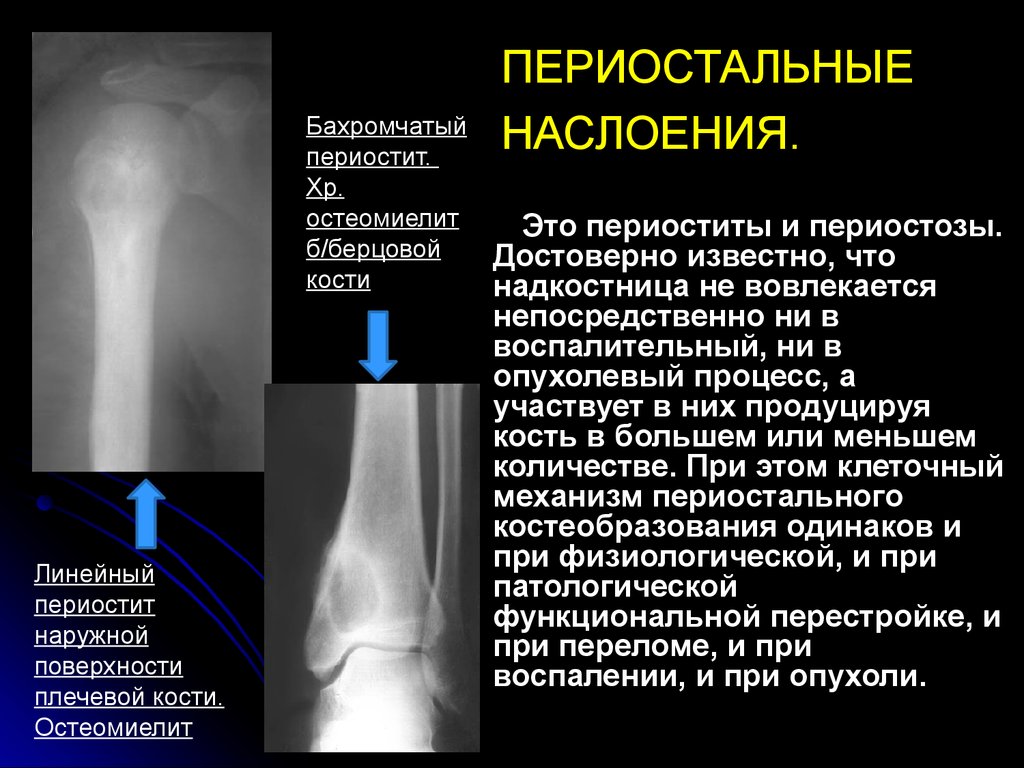 Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы с возможностью перорального применения, а также новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Другие антибиотики включают иклаприм, ингибитор дигидрофолатредуктазы с возможностью перорального применения, а также новые цефалоспорины цефтобипрол и цефтаролин [27]. Важно, чтобы эффективность всех этих новых антибиотиков оценивалась в конкретном контексте детей и в более конкретном контексте детского остеомиелита.
Независимо от наличия каких-либо новых антимикробных средств, основной терапевтической задачей при всех формах остеомиелита является возможность как можно быстрее начать наиболее подходящую терапию. В этом отношении важны два соображения: первое — это трудности, связанные со своевременным подтверждением наличия инфекции, а второе — возможность идентифицировать патоген-возбудитель и оценить его профиль устойчивости к антибиотикам. Поскольку традиционные методы физического и лабораторного анализа имеют ограниченную специфичность, обращение к первому из них потребует разработки специальных методов визуализации, способных дифференцировать инфекцию от других форм воспаления и, что не менее важно, определять стадию инфекции как необходимую предпосылку для диагностики. разработать эффективную тактику лечения. Одной из возможностей в этом отношении является ФДГ-ПЭТ, хотя еще раз диагностическая полезность этого метода визуализации не была адекватно оценена, особенно в конкретном контексте детского остеомиелита. Своевременная идентификация этиологических агентов ОГО в образцах костей и крови, вероятно, будет повышена за счет более широкого использования методов молекулярной диагностики, включая ПЦР.
разработать эффективную тактику лечения. Одной из возможностей в этом отношении является ФДГ-ПЭТ, хотя еще раз диагностическая полезность этого метода визуализации не была адекватно оценена, особенно в конкретном контексте детского остеомиелита. Своевременная идентификация этиологических агентов ОГО в образцах костей и крови, вероятно, будет повышена за счет более широкого использования методов молекулярной диагностики, включая ПЦР.
Наконец, хотя ОГО в настоящее время является наиболее распространенной формой остеомиелита у детей, ситуация может начать меняться в свете появления инфекций CA-MRSA. Штаммы CA-MRSA, особенно штаммы клональной линии USA300 [3], проявляют повышенную вирулентность, что приводит к осложнениям как в контексте самого остеомиелита, так и в возникновении диссеминированных инфекций у детей. По этой причине кажется вероятным, что для эффективного лечения детского остеомиелита все чаще будут требоваться терапевтические подходы, чаще связанные с хронической инфекцией, включая хирургическую обработку раны и локальное введение антибиотиков.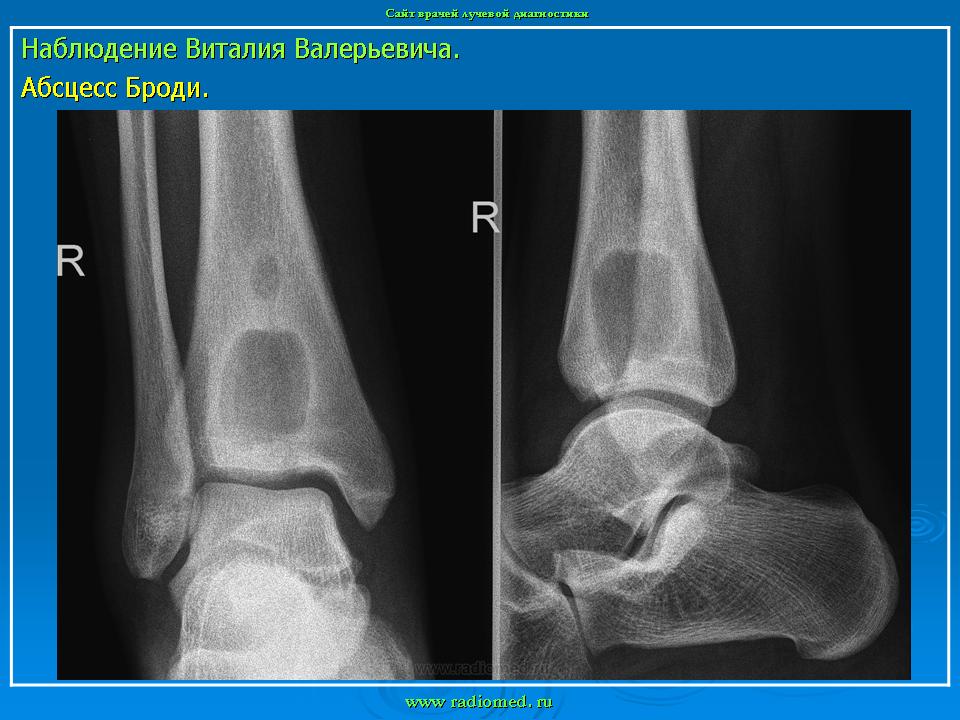 Локальная доставка антибиотиков имеет несколько преимуществ, наиболее важным из которых является возможность достижения высоких уровней антибиотиков в очаге инфекции без риска системной токсичности. Исходя из этого, мы считаем, что основное внимание в исследованиях следует уделять разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей для доставки, особенно в случаях, когда санация приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Пропитанные антибиотиками гранулы ПММА коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы ПММА. Альтернативным подходом является имплантация биорассасывающегося матрикса для доставки, который подходит для пациентов, у которых хирургическая обработка не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку она не требует удаления шариков по завершении терапии [28, 29].
Локальная доставка антибиотиков имеет несколько преимуществ, наиболее важным из которых является возможность достижения высоких уровней антибиотиков в очаге инфекции без риска системной токсичности. Исходя из этого, мы считаем, что основное внимание в исследованиях следует уделять разработке и оценке как стабильных, так и биоабсорбируемых матриц для локальной доставки антибиотиков. Наиболее часто используемой матрицей для доставки, особенно в случаях, когда санация приводит к структурно-нестабильному дефекту, требующему последующей реконструкции, является полиметилметакрилат (ПММА). Пропитанные антибиотиками гранулы ПММА коммерчески доступны в некоторых странах, в то время как в других хирурги должны производить свои собственные гранулы ПММА. Альтернативным подходом является имплантация биорассасывающегося матрикса для доставки, который подходит для пациентов, у которых хирургическая обработка не создает структурно нестабильного дефекта. Действительно, в таких случаях использование биорассасывающейся матрицы для доставки предпочтительнее ПММА, поскольку она не требует удаления шариков по завершении терапии [28, 29].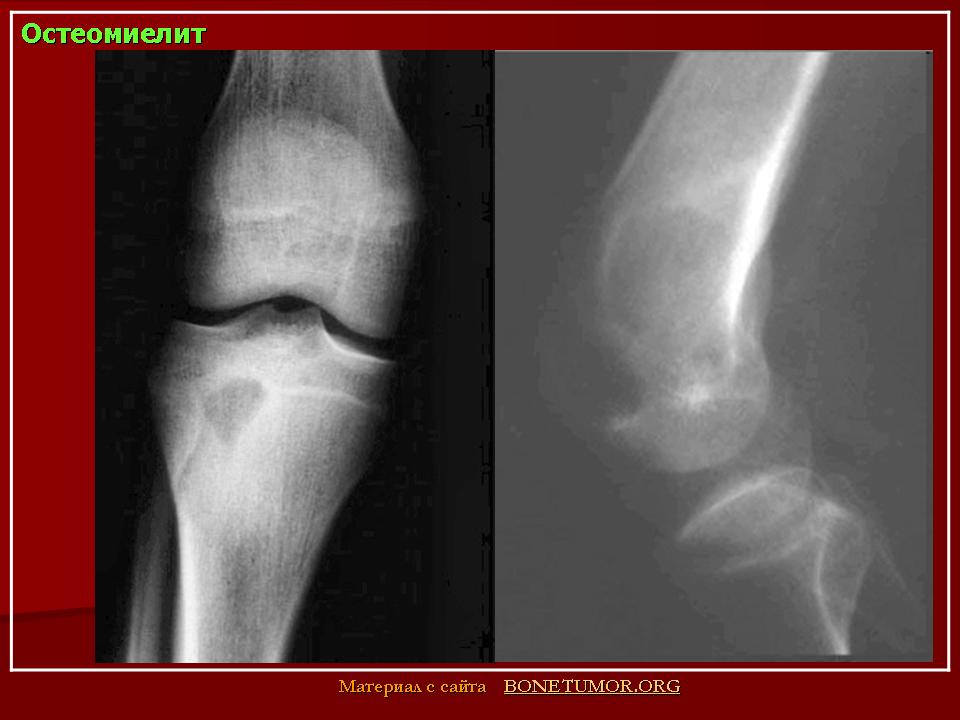 ].
].
Независимо от матрицы доставки наиболее часто используемыми антибиотиками являются гентамицин, тобрамицин и ванкомицин, при этом имеется относительно мало экспериментальных данных в отношении других противомикробных агентов. Недавно было продемонстрировано, что даптомицин может быть включен как в ПММА, так и в другие матрицы для доставки (например, сульфат кальция) без потери активности и что он сохраняет эту активность по мере элюирования из гранул с течением времени [30–32]. Клинический опыт применения шариков, импрегнированных антибиотиками, в контексте костной инфекции, особенно в отношении этих новых антибиотиков, ограничен у взрослых, но в еще большей степени у детей. Как отмечалось выше, важно, чтобы все формы терапии с использованием любых доступных антибиотиков оценивались на основе как эффективности, так и фармакологических соображений в конкретном контексте педиатрической инфекции. Исходя из этого, крайне важно, чтобы будущие исследования изучали использование как существующих, так и новых антибиотиков в конкретном контексте локальной доставки антибиотиков при лечении остеомиелита у детей.
Ключевые вопросы
У детей остеомиелит имеет преимущественно гематогенное происхождение и острый характер.
Staphylococcus aureus является преобладающим возбудителем остеомиелита.
Метициллин-резистентный Распространенность S. aureus (MRSA) увеличилась во всем мире, что изменило эпидемиологию остеомиелита.
Инфекции, вызванные внебольничным MRSA (CA-MRSA), имеют более серьезное течение, чем метициллин-чувствительные S. aureus острый гематогенный остеомиелит.
МРТ является предпочтительным методом визуализации при остром гематогенном остеомиелите у детей, но, учитывая текущие ограничения всех методов визуализации, разработка и оптимизация альтернативных методов визуализации является важной клинической задачей.
Если этиологический агент остеомиелита идентифицирован, следует назначить специфическое противомикробное лечение, основанное на профиле чувствительности организма.
 Чтобы облегчить это, следует по возможности получать соответствующие культуры, включая биопсию кости, и альтернативные диагностические методы, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).
Чтобы облегчить это, следует по возможности получать соответствующие культуры, включая биопсию кости, и альтернативные диагностические методы, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).В сообществах с более чем 10% CA-MRSA для эмпирического лечения острого гематогенного остеомиелита следует использовать ванкомицин или клиндамицин. Ванкомицин является основным выбором для терапии CA-MRSA в сообществах с резистентностью к клиндамицину более 25% и в условиях резистентности, индуцируемой клиндамицином.
Стандартная антимикробная терапия острого гематогенного остеомиелита длится от 4 до 6 недель. Исследования, основанные на фактических данных, относительно пути и продолжительности лечения антибиотиками при остром гематогенном остеомиелите ограничены, а рекомендации о том, когда следует переходить с парентеральной терапии на пероральную, отсутствуют.
Изменчивое клиническое течение острого гематогенного остеомиелита у детей затрудняет рекомендации стандартизированной терапии.
 Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Раскрытие информации о финансовых и конкурирующих интересах
Авторы получают финансирование от NIH (RO1-{«type»:»entrez-нуклеотид»,»attrs»:{«text»:»AI043356″,»term_id» :»3286613″,»term_text»:»AI043356″}}AI043356, RO1-{«type»:»entrez-нуклеотид»,»attrs»:{«текст»:»AI069087″,»term_id»:»3392062″,»term_text»:»AI069087″}}AI069087 и RO1-{«type»:»entrez-нуклеотид»,»attrs»:{«text»:»AI074007″,»term_id «:»3400651″,»term_text»:»AI074007″}}AI074007) и от Cubist Pharmaceuticals. Авторы не имеют других соответствующих связей или финансового участия с какой-либо организацией или юридическим лицом, имеющим финансовый интерес или финансовый конфликт с предметом или материалы, обсуждаемые в рукописи, кроме раскрытых
При написании этой рукописи помощь в написании не использовалась
Нада С.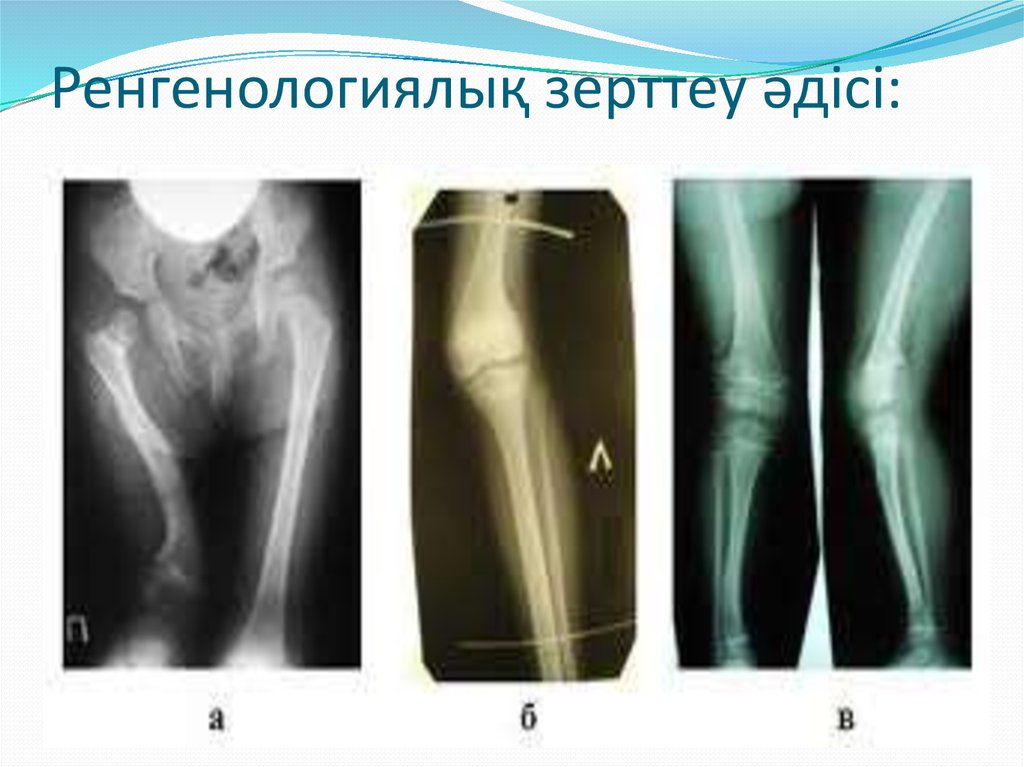 Харик, кафедра педиатрии и кафедра микробиологии и иммунологии, Университет медицинских наук Арканзаса и детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Харик, кафедра педиатрии и кафедра микробиологии и иммунологии, Университет медицинских наук Арканзаса и детская больница Арканзаса, Литл-Рок, AR 72205, США, тел.: +1 501 364 1416, факс: +1 501 364 3551, ude.smau@adankirah.
Mark Smeltzer, отделение микробиологии и иммунологии и отделение ортопедической хирургии, Арканзасский университет медицинских наук, Литл-Рок, AR 72205, США.
1. Лью Д.П., Вальдвогель Ф.А. Остеомиелит. Ланцет. 2004;364(9431): 369–379. [PubMed] [Google Scholar]
2. Крогстад П. Остеомиелит. В: Фейгин Р.Д., Черри Д.Д., Деммлер-Харрисон Г.Д., Каплан С.Л., редакторы. Учебник детских инфекционных болезней. 6-е издание. Пенсильвания, США: Saunders Elsevier; 2009. стр. 725–742. [Google Scholar]
3. Li M, An Diep B, Villaruz AE, et al. Эволюция вирулентности у эпидемического метициллин-резистентного штамма Staphylococcus aureus . проц. Натл акад. науч. США. 2009;106(14):5883–5888. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4.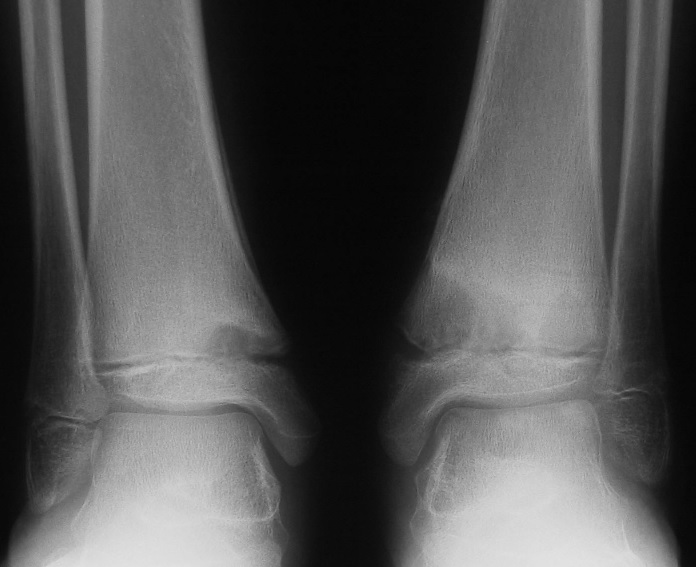 Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. клин. Н. Ам. 2005;52(3):779–794. [PubMed] [Google Scholar]
Гутьеррес К. Инфекции костей и суставов у детей. Педиатр. клин. Н. Ам. 2005;52(3):779–794. [PubMed] [Google Scholar]
5. Floyed RL, Steele RW. Культурально-негативный остеомиелит. Педиатр. Заразить. Дис. Дж. 2003;22(8):731–736. [PubMed] [Google Scholar]
6. Chometon S, Benito Y, Chaker M, et al. Специфическая полимеразная цепная реакция в режиме реального времени делает Kingella kingae наиболее распространенной причиной костно-суставных инфекций у детей раннего возраста. Педиатр. Заразить. Дис. Дж. 2007;26(5):377–381. [PubMed] [Академия Google]
7. Gerber JS, Coffin SE, Smathers SA, Zaoutis TE. Тенденции заболеваемости метициллин-резистентным штаммом Staphylococcus aureus в детских больницах США. клин. Заразить. Дис. 2009;49(1):65–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Saavedra-Lozano J, Mejias A, Ahmad N, et al. Изменение тенденций острого остеомиелита у детей: влияние метициллин-резистентных инфекций Staphylococcus aureus . Дж. Педиатр. Ортоп. 2008;28(5):569–575. [PubMed] [Google Scholar]
Дж. Педиатр. Ортоп. 2008;28(5):569–575. [PubMed] [Google Scholar]
9. Martinez-Aguilar GA, Avalos-Mishaan A, Hulten K, et al. Внебольничные, метициллин-резистентные и метициллин-чувствительные Staphylococcus aureus инфекции опорно-двигательного аппарата у детей. Педиатр. Заразить. Дис. Дж. 2004;23(8):701–706. [PubMed] [Google Scholar]
10. Bocchini CE, Hulten KG, Mason EO, Jr, et al. Гены лейкоцидина Пантона-Валентайна ассоциированы с усиленным воспалительным ответом и местным заболеванием при остром гематогенном Staphylococcus aureus остеомиелит у детей. Педиатрия. 2006;117(2):433–440. [PubMed] [Google Scholar]
11. Сойер Дж. Р., Капур М. Хромающий ребенок: системный подход к диагностике. Являюсь. фам. Врач. 2009;79(3):215–224. [PubMed] [Google Scholar]
12. Ункила-Каллио Л., Каллио М.Дж., Пелтола Х., Эскола Дж. С-реактивный белок сыворотки, скорость оседания эритроцитов и количество лейкоцитов при остром гематогенном остеомиелите у детей. Педиатрия. 1994;93(1):59–62. [PubMed] [Google Scholar]
Педиатрия. 1994;93(1):59–62. [PubMed] [Google Scholar]
13. Пинеда С., Варгас А., Родригес А.В. Визуализация остеомиелита: современные представления. Заразить. Дис. клин. Н. Ам. 2006;20(4):789–825. [PubMed] [Google Scholar]
14. Connolly LP, Connolly SA, Drubach LA, Jaramillo D, Treves ST. Острый гематогенный остеомиелит у детей: оценка скелетной сцинтиграфической диагностики в эпоху МРТ. Дж. Нукл. Мед. 2002;43(10):1310–1316. [PubMed] [Google Scholar]
15. Browne LP, Mason EO, Kaplan SL, Cassady CI, Krishnamurthy R, Guillerman RP. Оптимальная стратегия визуализации для внебольничных Staphylococcus aureus инфекции опорно-двигательного аппарата у детей. Педиатр. Радиол. 2008;38(8):841–847. [PubMed] [Google Scholar]
16. Basu S, Chryssikos T, Moghadem-Kia S, Zhuang H, Torigian DA, Alavi A. Позитронно-эмиссионная томография как инструмент диагностики инфекции: настоящая роль и будущие возможности. Семин. Нукл. Мед. 2009;39(1):36–51. [PubMed] [Google Scholar]
17.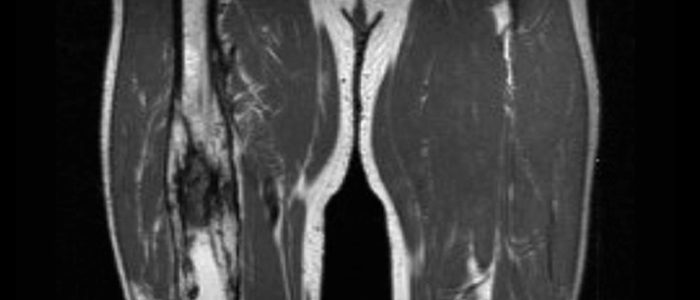 Strobel K, Stumpe KD. ПЭТ/КТ при инфекциях опорно-двигательного аппарата. Семин. Опорно-двигательный аппарат. Радиол. 2007;11(4):353–364. [PubMed] [Академия Google]
Strobel K, Stumpe KD. ПЭТ/КТ при инфекциях опорно-двигательного аппарата. Семин. Опорно-двигательный аппарат. Радиол. 2007;11(4):353–364. [PubMed] [Академия Google]
18. Chung T. Магнитно-резонансная томография при остром остеомиелите у детей. Педиатр. Заразить. Дис. Дж. 2002;21(9):869–870. [PubMed] [Google Scholar]
19. Frank AL, Marcinak JF, Mangat D, et al. Лечение клиндамицином метициллин-резистентных Staphylococcus aureus инфекций у детей. Педиатр. Заразить. Дис. Дж. 2002;21(6):530–534. [PubMed] [Google Scholar]
20. Siberry GK, Tekle T, Carroll K, Dick J. Неэффективность лечения клиндамицином устойчивых к метициллину Staphylococcus aureus , экспрессирующий индуцируемую устойчивость к клиндамицину in vitro . клин. Заразить. Дис. 2003;37(9):1257–1260. [PubMed] [Google Scholar]
21. Chen CJ, Chiu CH, Lin TY, Lee ZL, Yang WE, Huang YC. Опыт терапии линезолидом у детей с костно-суставными инфекциями. Педиатр. Заразить. Дис.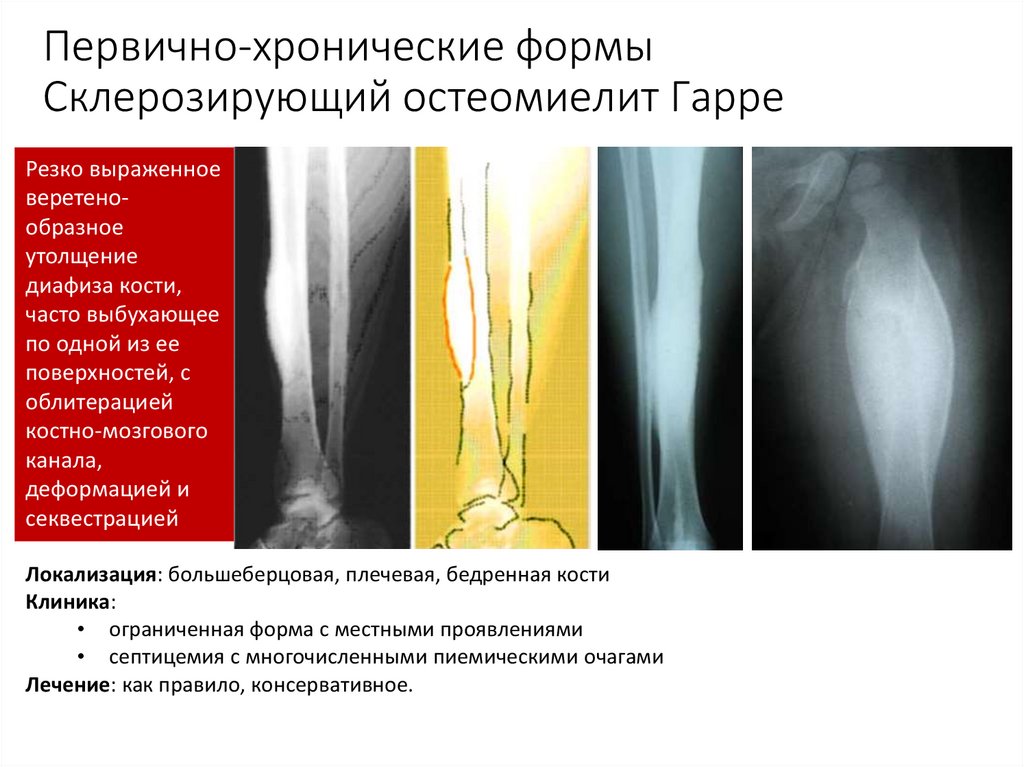 Дж. 2008;26(11):985–988. [PubMed] [Google Scholar]
Дж. 2008;26(11):985–988. [PubMed] [Google Scholar]
22. Weiss EC, Spencer HJ, Daily SJ, Weiss BD, Smeltzer MS. Влияние sarA на чувствительность к антибиотикам Staphylococcus aureus в связанной с катетером модели in vitro образования биопленки. Антимикроб. Агенты Чемотер. 2009;53(6):2475–2482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Weiss ED, Zielinska A, Beenken KE, Spencer HJ, Daily SJ, Smeltzer MS. Влияние sarA на чувствительность биопленок Staphylococcus aureus к даптомицину in vivo . Антимикроб. Агенты Чемотер. 2009;53(10):4096–4102. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Miro JM, Garcia-de-la-Maria C, Armero Y, et al. Добавление гентамицина или рифампина не повышает эффективность даптомицина при лечении экспериментального эндокардита, вызванного устойчивым к метициллину Staphylococcus aureus . Антимикроб. Агенты Чемотер. 2009;53(10):4172–4177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Murillo O, Garrigos C, Pachon ME, et al. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллинрезистентными Золотистый стафилококк . Антимикроб. Агенты Чемотер. 2009;53(10):4252–4257. [PMC free article] [PubMed] [Google Scholar]
Murillo O, Garrigos C, Pachon ME, et al. Эффективность высоких доз даптомицина по сравнению с альтернативными методами лечения экспериментальной инфекции инородного тела метициллинрезистентными Золотистый стафилококк . Антимикроб. Агенты Чемотер. 2009;53(10):4252–4257. [PMC free article] [PubMed] [Google Scholar]
26. Le Saux N, Howard A, Barrowman NJ, Gaboury, Sampson M, Moher D. Более короткие курсы парентеральной антибиотикотерапии, по-видимому, не влияют на частоту ответа у детей с острый гематогенный остеомиелит: систематический обзор. Заражение BMC. Дис. 2002; 2:16–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Stryjewski ME, Corey GR. Новые методы лечения метициллин-резистентных Золотистый стафилококк . Курс. мнение крит. Уход. 2009;15(5):403–412. [PubMed] [Google Scholar]
28. Томас М.В., Пулео Д.А. Сульфат кальция: свойства и клиническое применение. Дж. Биомед. Матер. Рез. Б. Заявл. Биоматер. 2009;88(2):597–610. [PubMed] [Google Scholar]
29. Zalavras CG, Patzakis MJ, Holtom P. Местная антибиотикотерапия при лечении открытых переломов и остеомиелита. клин. Ортоп. Относ. Рез. 2004; 427:86–93. [PubMed] [Google Scholar]
Zalavras CG, Patzakis MJ, Holtom P. Местная антибиотикотерапия при лечении открытых переломов и остеомиелита. клин. Ортоп. Относ. Рез. 2004; 427:86–93. [PubMed] [Google Scholar]
30. Webb ND, McCanless JD, Courtney HS, Bumgardner JD, Haggard WO. Даптомицин, элюированный из сульфата кальция, оказался эффективным против Стафилококк . клин. Ортоп. Относ. Рез. 2008;466(6):1383–1387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Weiss BD, Weiss EC, Haggard WO, Evans RP, McLaren SG, Smeltzer MS. Оптимизированная элюция даптомицина из гранул полиметилметакрилата. Антимикроб. Агенты Чемотер. 2008;53(1):264–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Kanellakopoulou K, Panagopoulos P, Giannitsioti E, et al. In vitro элюирование даптомицина синтетической кристаллической полугидратной формой сульфата кальция, стимуляном. Антимикроб. Агенты Чемотер. 2009 г.;53(7):3106–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Если у вашего ребенка остеомиелит
У вашего ребенка диагностирован
остеомиелит. Это инфицирование кости микробами (бактериями или грибками). У детей,
инфекция в длинных костях рук и ног наиболее распространена. Ваш ребенок может быть
упомянутый
к ортопеду (специалисту по проблемам костей и суставов) или инфекционисту
специалист (специалист по инфекциям) для оценки и лечения.
Это инфицирование кости микробами (бактериями или грибками). У детей,
инфекция в длинных костях рук и ног наиболее распространена. Ваш ребенок может быть
упомянутый
к ортопеду (специалисту по проблемам костей и суставов) или инфекционисту
специалист (специалист по инфекциям) для оценки и лечения.
Что вызывает остеомиелит?
Микробы, такие как бактерии и грибки, могут вызывать остеомиелит. Самый распространенный тип бактерии, вызывающие остеомиелит, называются золотистым стафилококком или стафилококком. Бактерии и грибки могут попасть в организм через:
Инфицированные раны или суставы
Инфекции, распространяющиеся из других частей тела
Сломанные кости, пробившие кожу
Инородный предмет, который повреждает кожу
К группе повышенного риска инфекции костей относятся дети:
Но любой ребенок может заболеть
инфекционное заболевание.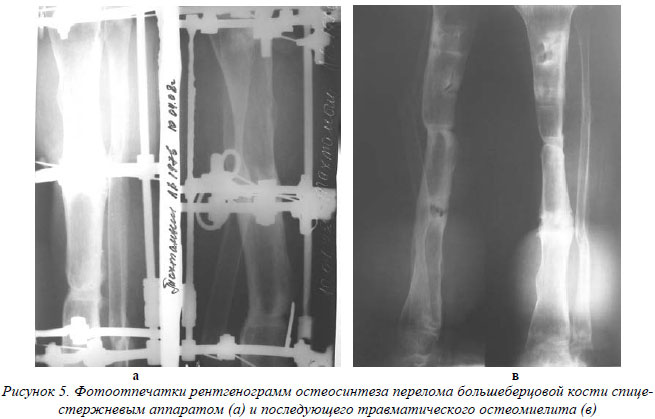 В некоторых случаях причина инфекции никогда не известна.
В некоторых случаях причина инфекции никогда не известна.
Каковы симптомы остеомиелит?
Если у вашего ребенка есть какие-либо из этих симптомы, немедленно обратитесь за медицинской помощью.
Лихорадка 100,4°F ( 38°C) или выше, или как по рекомендации поставщика услуг вашего ребенка
- Озноб
Боль в костях
Отек рук или ноги
Покраснение или повышение температуры кожи на руках или ногах
Выделение гноя из кожа
Не позволять рукам или ногам быть тронутым
Не использовать руки или ноги (конечность не может удерживать вес)
- Младенцы могут быть раздражительными или вялыми, отказываться от еды или
рвота.

Инфекция часто возникает в результате недавней травмы. Симптомы инфекции маскируются симптомами травмы. Из-за этого может потребоваться дольше, чтобы заметить инфекцию. Важно привести ребенка к врачу поставщика услуг, если симптомы быстро не улучшаются.
Как диагностируется остеомиелит?
Если поставщик медицинских услуг считает у вашего ребенка может быть остеомиелит, эти тесты могут быть выполнены:
Рентгенологическое исследование области для поиска инфекции
Анализы крови для подтверждения инфекции и найти микроб, вызывающий инфекцию
Визуализирующие исследования, такие как сканирование костей, компьютерная томография, МРТ или УЗИ
Биопсия (процедура взятия образца кости) для обнаружения микроба, вызывающего инфекцию
Как лечится остеомиелит?
Вначале лечение часто занимает
место в больнице.

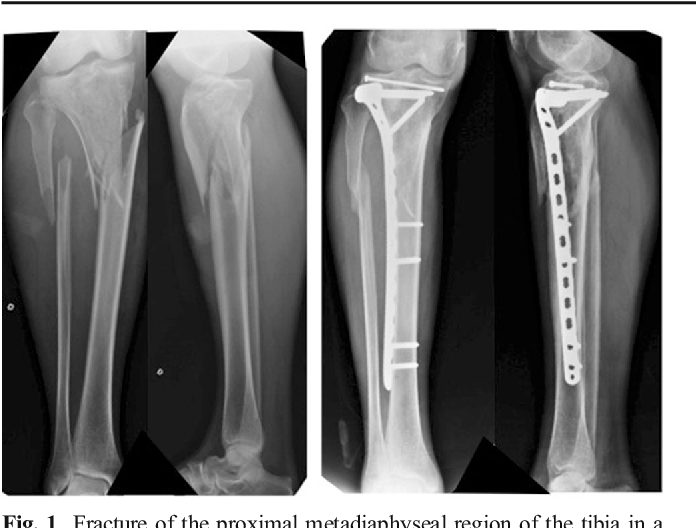
 Болезнь Лобштейна-Вролика
Болезнь Лобштейна-Вролика Чтобы облегчить это, следует по возможности получать соответствующие культуры, включая биопсию кости, и альтернативные диагностические методы, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).
Чтобы облегчить это, следует по возможности получать соответствующие культуры, включая биопсию кости, и альтернативные диагностические методы, способные обнаруживать патогены независимо от их характеристик роста (например, ПЦР).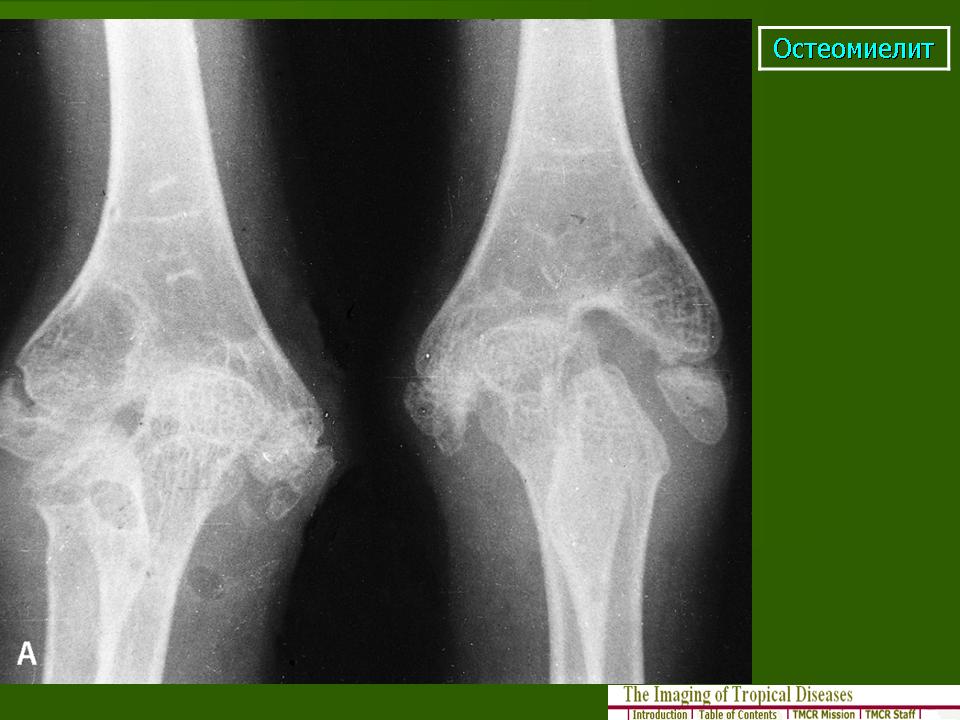 Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.
Лечение всегда должно быть индивидуализированным с применением командного подхода, включающего участие специалистов как в области детских инфекционных заболеваний, так и в области ортопедии.