Анаболизм и катаболизм. Метаболизм
Метаболизм
Известный факт, что спортсмен забросивший на продолжительное время тренировки, постепенно уменьшает в мышечной массе – это прямой результат работы рычагов катаболизма. Для поддержания жизни твоему организму требуются питательные вещества в качестве топлива и строительного материала, каждая клетка нашего организма живая и просит своевременной подпитки. Если организм недополучает достаточно пищи, для поддержания корректной работы внутренних органов и мозга, питательные вещества в первую очередь берутся из мышечной массы с помощью процесса катаболизма (разрушения).
Чтобы понять процесс катаболизма следует понять что такое жизнь в одном из пониманий. Жизнь – это обмен питательных веществ внутри клетки, жизнь вне клетки невозможна, все что лишено клеток – не имеет жизни, оно мертво. Миллионы клеток из которых мы состоим представляют из себя миллионы живых организмов, которые в совокупности и образуют нас. Наши руки, глаза, сознание. Выполняя свои функции клетка, не имеет значения какая – мозговая или мышечная, требует питательные вещества для продолжения функционирования, но жизнь такова, что питательных веществ никогда не бывает слишком много и всем клеткам не “угодить”. Борьба за выживание – основной и первейший инстинкт (чтобы не говорили пошлые американские фильмы) и чтобы прожить как можно дольше организм научился контролировать смерть клеток, распределять их по ступеням приоритезации, и мышечная масса стоит на одной из последних ступенек этой лестницы.
Выполняя свои функции клетка, не имеет значения какая – мозговая или мышечная, требует питательные вещества для продолжения функционирования, но жизнь такова, что питательных веществ никогда не бывает слишком много и всем клеткам не “угодить”. Борьба за выживание – основной и первейший инстинкт (чтобы не говорили пошлые американские фильмы) и чтобы прожить как можно дольше организм научился контролировать смерть клеток, распределять их по ступеням приоритезации, и мышечная масса стоит на одной из последних ступенек этой лестницы.
Катаболизм
При получении физических повреждений (к примеру микроразрывы мышечных волокон во время тренировки), организм постарается восстановить их используя белки поступающие с пищей, повреждения будут устранены и целостности организма больше ничего не будет угрожать. Но что если возникнет нередкая ситуация, при которое человек получает неполноценное количество питательных веществ, как быть в данном случае?
Для этого и создан процесс катаболизма.
При недостатке питательных веществ тело попытается получить питательные вещества посредством деликатного разрушения уже имеющихся структур, к примеру, расщепляя наименее используемые части мышечного скелета. Мышечные волокна наименее используемой части тела будут расщеплены на аминокислоты и отправлены в ту часть тела, где они наиболее востребованы.
Таких ситуаций, когда питательных веществ недостаточно крайне много (забыл позавтракать, отстоял очередь в банке и не успел на обед), поэтому потеря мышечной массы в период пассивности все равно будет происходить, но ее можно существенно замедлить потребляя достаточно белковой пищи. Т.е. тот кто плотнее ест – меньше теряет в массе во время бездействия. Но катаболизм будет запускаться все равно, это закон – мышечная масса гибнет первой сразу после жировой. На примере тяжело больных людей можно увидеть как их организм борится с болезнью буквально переваривая себя – больных людей можно сразу узнать по дистрофическому телосложению, их мышцы уничтожаются и передаются в пораженные болезнью части тела.
Анаболизм
Противоположный катаболизму процесс, который включается сразу же после выключения последнего. Так уж вышло, что анаболизм и катаболизм – это неразрывная парочка, выключение катаболизма включает катаболизм, и наоборот. Никакого промежуточного состояния между ними нет, всегда работает один из них. Вещества полученные из разрушенных клеток в результате работы катаболизма используют при анаболизме.
При анаболизме простые вещества превращаются в более сложные, к примеру аминокислоты становятся полноценными мышечными волокнами. Описывать этот процесс – значит пудрить тебе мозги, разбирая биохимические реакции, которые никому не нужны. Рассмотрим иное.
Как заставить превалировать анаболизм над катаболизмом
- Требуется крепкий сон, в совокупности не менее 7 часов в сутки. Доказано, что фиксированный ритм жизни (без походов по клубам и просиживанием по ночам за партией в доту), улучшает качество сна, а значит и эффект от него. При этом чем раньше спортсмен ложится спать, тем большую отдачу ото сна он может получить.
 Во время сна процессы катаболизма практически не работают, тот же кто хронически не досыпает – заставляет организм испытывать стресс и постоянно использовать катаболизм как средство борьбы с ним.
Во время сна процессы катаболизма практически не работают, тот же кто хронически не досыпает – заставляет организм испытывать стресс и постоянно использовать катаболизм как средство борьбы с ним. - Правильно поставленный тренировочный процесс также является необходимым атрибутом роста. Занятие на “массу” требуют небольшого количества повторений, без задрачиваний и “забивания” мышц, это неверный путь. Для роста общей мышечной массы требуется использовать небольшое число повторений с серьезными весами, в таком стрессовом режиме и включается процесс анаболизма.
- Поддержка гормонального фона. При достаточно высоком уровне тестостерона процессы анаболизма работают дольше и эффективней.
- Слежение за иммунитетом, т.к. чем слабее иммунитет тем больше питательных веществ требуется организму для борьбы с инфекциями. В периоды эпидемий различных болезней и в сырое время года следует принимать иммуностимуляторы (например иммунал). Организм занятый безуспешной борьбой с болезнью не растит мышечную массу.

- И самое важное – питание, без крепкой подкормки белком и качественными (медленными) углеводами роста не будет.
“Жир в мышцы” – утверждение кретинов
Анаболизмом называется не только рост мышечной массы, но и жировой, набирая мышечную массу организм неизбежно запасается жиром, это закон. Набор мышечной массы с одновременным сжиганием жира – миф, который не реализуем без применения грамотно составленных курсов анаболических стероидов и гормона роста, и даже с ними не всегда получается набирать качественную массу. Плюс ко всему жировая прослойка не несет в себе профиля аминокислот, поэтому из нее невозможно сделать мышечную клетку.
Катаболизм и биоэнергетика
Глава 1 | Метаболизм азотистых оснований
Глава 2 | Биосинтез макромолекул
Речь пойдет о распаде макромолекул — преимущественно липидов и сахаров — до мономеров и воды с пеплом. А также обо всем, что с этими путями связано (а связано очень много). Тема важная.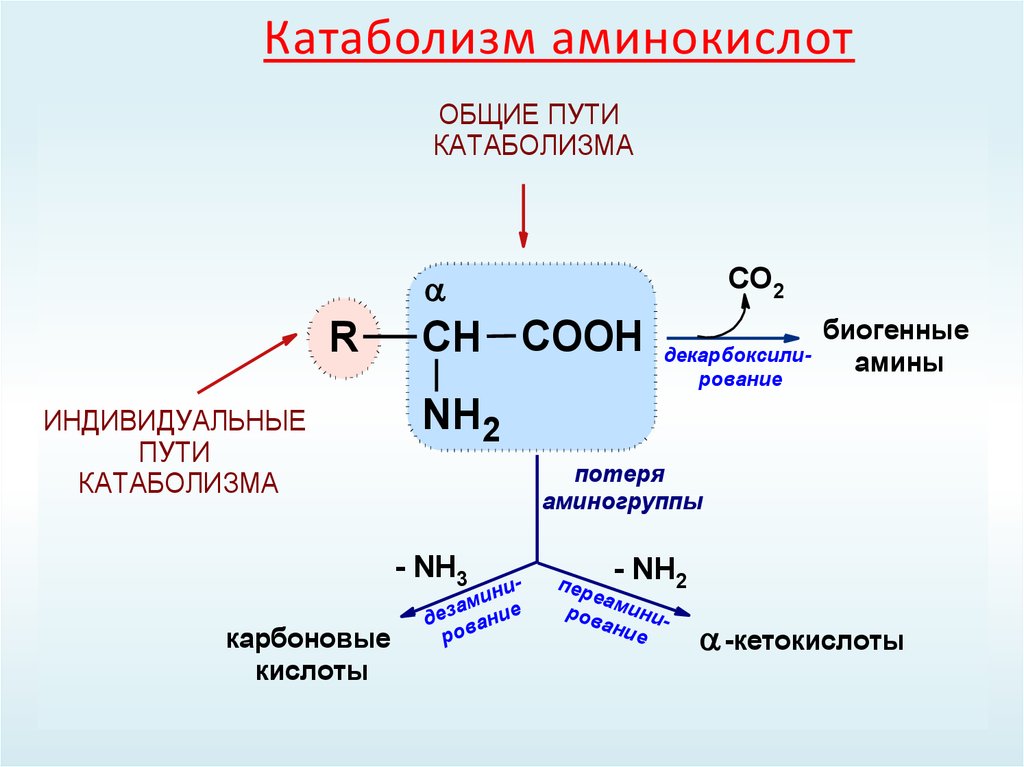 Тема интересная. Порою ее понимание дает ответы на ряд вопросов и вскрывает тайны происхождения ужасных картин, которые ты можешь наблюдать в стационаре и в жизни, дает адекватное понимание диететики и в целом делает тебя адекватнее. В этот раз ты узнаешь, как и почему вафли со сгущенкой и шоколадом не сделают тебя сладкой конфеткой, а приведут к отложению ненужного жира в боках. Как выживает мозг, когда у тебя пять пар. А если серьезно, то осилив этот раздел, ты поймешь, почему бессмысленна безуглеводная диета, почему развивается ацидоз и к каким последствиям это может привести. Мы коснемся базы, необходимой для понимания множества клинических проблем. Отрывки, объясняющие процессы распада углеводов и липидов, местами могут показаться нудными; если знаешь их, пропусти (только попробуй).
Тема интересная. Порою ее понимание дает ответы на ряд вопросов и вскрывает тайны происхождения ужасных картин, которые ты можешь наблюдать в стационаре и в жизни, дает адекватное понимание диететики и в целом делает тебя адекватнее. В этот раз ты узнаешь, как и почему вафли со сгущенкой и шоколадом не сделают тебя сладкой конфеткой, а приведут к отложению ненужного жира в боках. Как выживает мозг, когда у тебя пять пар. А если серьезно, то осилив этот раздел, ты поймешь, почему бессмысленна безуглеводная диета, почему развивается ацидоз и к каким последствиям это может привести. Мы коснемся базы, необходимой для понимания множества клинических проблем. Отрывки, объясняющие процессы распада углеводов и липидов, местами могут показаться нудными; если знаешь их, пропусти (только попробуй).
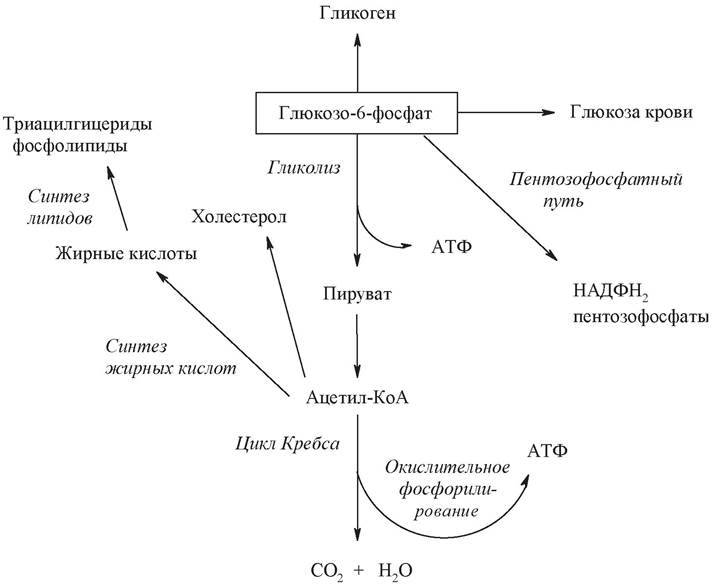
Взгляни на эту красоту. На это настоящее чудо биохимии, на одну из самых активных молекул нашего организма. По количеству реакций, в которых она фигурирует, можно поначалу подумать, что наша жизнь есть способ существования глюкозы [1].
Мы имеем дело гидроксиальдегидом на основе шести атомов углерода и имеющим пять гидроксильных групп. Это делает глюкозу чрезвычайно водолюбивой и открывает просторы для биохимического синтеза. В нашем организме функционирует D-форма глюкозы, и только такая форма способна участвовать в ферментативных реакциях.
О пищевых источниках глюкозы тебе хорошо известно. Это различные овощи и фрукты, оциллококцинум, сладости, пряности и прочее. Гораздо интереснее, что с ней происходит при приеме через рот [3].
Глюкоза попадает в организм в виде полимеров — крахмала, целлюлозы, гликогена. Но не из всех них можно с одинаковой эффективностью вылущить глюкозу. Крахмал и гликоген начинает расщепляться ещё в ротовой полости благодаря α-амилазе из слюнных желез. Происходит разрушение α-1,4-гликозидных связей (связей между первым атомом углерода одной молекулы и четвертым атомом соседней молекулы углевода). К слову, в организме расщепляются только такие связи.
Процесс продолжается в кишечнике (просвете двенадцатиперстной кишки), где под действием α-амилазы поджелудочной железы происходит образование углеводных мономеров и димеров. В качестве мономеров не обязательно получается только глюкоза. Это может быть и фруктоза, и галактоза, но, как мы увидим дальше, все они имеют одинаковую судьбу. Далее начинается их абсорбция [1, 3].
В качестве мономеров не обязательно получается только глюкоза. Это может быть и фруктоза, и галактоза, но, как мы увидим дальше, все они имеют одинаковую судьбу. Далее начинается их абсорбция [1, 3].
В абсорбции молекул моносахаров в кишечнике важную роль играет вторичный активный транспорт.
Здесь все максимально просто. Глюкоза (как и другие мономеры) нагло использует натрий. Увидев в нем внутренний потенциал в виде электрохимического градиента, она заманивает его на специальный белковый переносчик в мембране энтероцита. Тут то она и берет его в оборот, заставляя оборачиваться вокруг своей оси еще и белок-переносчик. Это происходит в результате изменения его конформации — взаимной пространственной ориентации компонентов этой большой молекулы. В итоге и глюкоза, и натрий оказываются внутри клетки. Поскольку натрий двигается по своему градиенту, освобождаясь от белка-переносчика, он выделяет малое количество энергии. Но этого количества достаточно, чтобы глюкоза расплатилась с переносчиком за такси через клеточную мембрану и спокойно ушла вглубь энтероцита.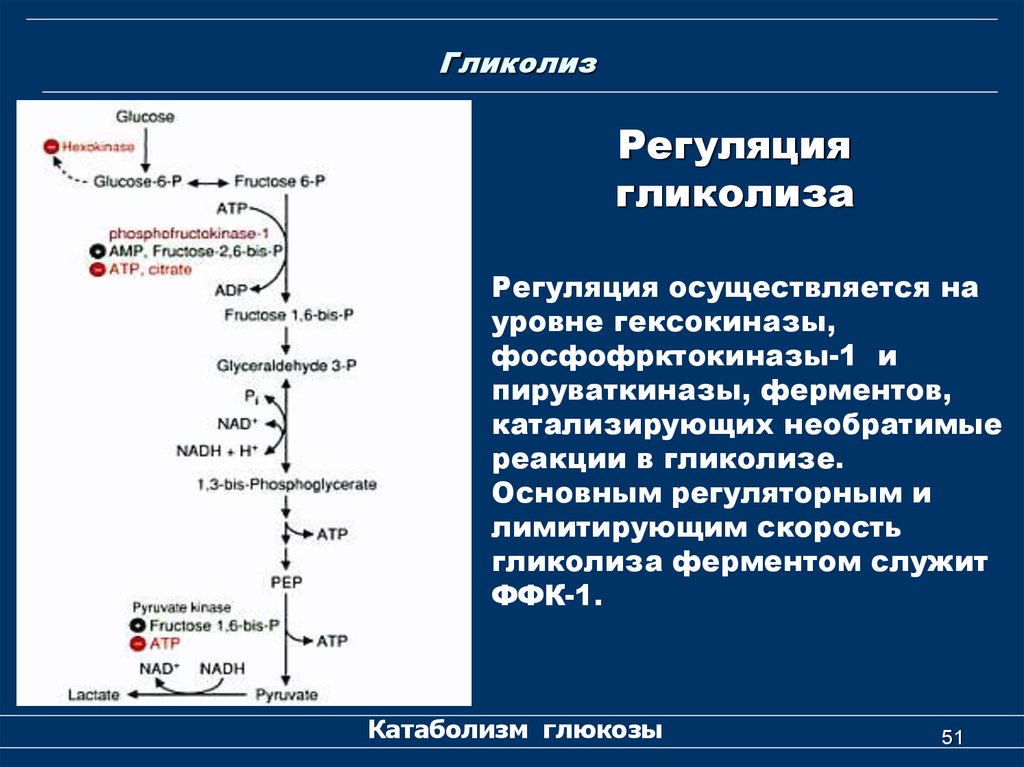 Увидев большой город в виде цитоплазмы энтероцита, глюкоза имеет два пути: остаться здесь (потом расскажу, что произойдет) или же двигаться дальше к своей мечте, для чего она прыгает в кровь. И тут начинаются высокие материи [2].
Увидев большой город в виде цитоплазмы энтероцита, глюкоза имеет два пути: остаться здесь (потом расскажу, что произойдет) или же двигаться дальше к своей мечте, для чего она прыгает в кровь. И тут начинаются высокие материи [2].
Существует гомеостатический механизм, обеспечивающий поддержание физиологического уровня глюкозы в крови, и он сложнее, чем кажется на первый взгляд. Главным его компонентом и сигналом, — хэдлайнером — является глюкоза. А один из основных датчиков — «подчиняющихся» элементов этой игры — В-клетки поджелудочной железы. С них и начнем [1–3, 4].
Шаг 1. Попадание глюкозы в клетку. В-клетки поджелудочной активно экспрессируют ГЛЮТ2 — переносчик глюкозы. Попадая в В-клетки, глюкоза подвергается фосфорилированию (активации):
Данная реакция необходима по нескольким причинам:
- Глюкозо-6-фосфат (Г6Ф) — это активная форма глюкозы, необходимая для осуществления реакций в клетке с ее участием.

- Образование Г6Ф нужно для постоянного притока глюкозы в клетку. (Глюкоза и Г6Ф — разные молекулы, что имеет значение для диффузии глюкозы в клетку и поддержания концентрационного градиента.)
В печени и В-клетках поджелудочной железы работает гексокиназа 4, или глюкокиназа. Этот фермент характеризуется тем, что не ингибируется конечным продуктом реакции — Г6Ф. Это значит, что образование Г6Ф будет пропорциональным количеству глюкозы. Отсюда вытекают и иные особенности, о которых мы скажем позже. Примечательно, что образование Г6Ф невозможно без магния [2].
Попадая в В-клетки, Г6Ф вовлекается в гликолиз и активно включается в цикл трикарбоновых кислот (ЦТК). Чуть позже мы разберем их более детально. Главное, на что здесь надо обратить внимание, — это результат ЦТК в В-клетках. Ты наверняка где-то слышал о том, что ЦТК сопряжен с митохондриальным дыханием, то есть с синтезом АТФ — главного источника энергии в клетки. При резком повышении глюкозы в В-клетке растет интенсивность ЦТК, что приводит к повышению концентрации АТФ и увеличению соотношения АТФ/АДФ [4].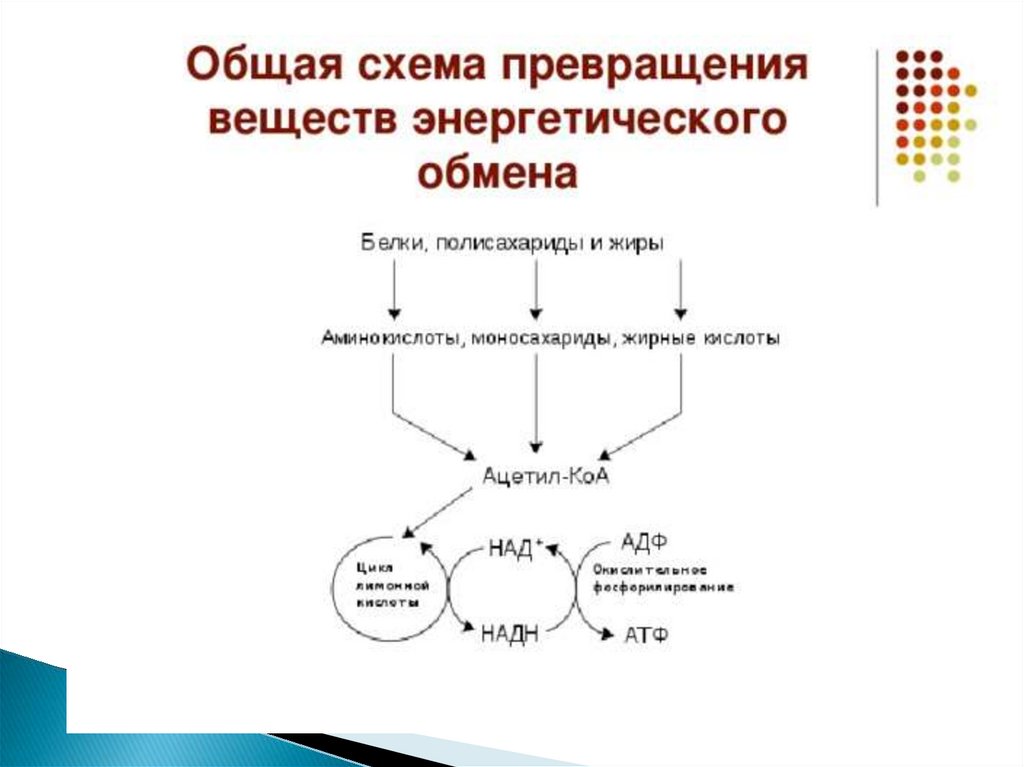
Шаг 2. Секреция инсулина. Сдвиг соотношения АТФ/АДФ снижает активность мембранных калиевых каналов (тем самым их закрывая). Эти каналы очень интересны в силу наличия в них множества рецепторных мишеней (см. далее) [2, 4].
В результате возникает деполяризация мембраны. Это становится пинком для открытия кальциевых каналов L-типа. Кальций, универсальный посредник экзоцитоза, индуцирует экзоцитоз и здесь: повышение его концентрации истерически провоцирует выброс инсулина.
Резюмируя, проследим цепь реакций: попадание глюкозы в кровь 🡪 попадание глюкозы в В-клетки поджелудочной железы 🡪 интенсификация ЦТК и рост АТФ 🡪 аллостерическое ингибирование калиевых каналов молекулами АТФ 🡪 деполяризация мембраны🡪 рост концентрации кальция в клетке (его выход из внутриклеточных депо) 🡪 экзоцитоз инсулина [4].
Шаг 2.1. Другой регуляторный механизм. Секреция инсулина зависит и от концентрации в В-клетках цАМФ. цАМФ участвует в фосфорилировании белков, ответственных за секрецию инсулина (иными словами, чем больше цАМФ в клетке, тем активнее белки-участники экзоцитоза и тем выше секреция инсулина). Это относительно новые данные: не удивляйся, что их нет в библиотечных учебниках. Зато теперь ты знаешь, что секреция инсулина может усиливаться через изменение концентрации цАМФ. А увеличивается она при действии кишечных гормонов на В-клетки. К ним относится инкретины. Они воздействуют на свои рецепторы, что приводит к увеличению содержания цАМФ [4].
цАМФ участвует в фосфорилировании белков, ответственных за секрецию инсулина (иными словами, чем больше цАМФ в клетке, тем активнее белки-участники экзоцитоза и тем выше секреция инсулина). Это относительно новые данные: не удивляйся, что их нет в библиотечных учебниках. Зато теперь ты знаешь, что секреция инсулина может усиливаться через изменение концентрации цАМФ. А увеличивается она при действии кишечных гормонов на В-клетки. К ним относится инкретины. Они воздействуют на свои рецепторы, что приводит к увеличению содержания цАМФ [4].
Инкретины — класс гормонов, продукция которых организмом начинается после приема пищи и которые являются стимуляторами секреции инсулина. К инкретинам относятся пептидные гормоны: глюкозозависимый инсулинотропный полипептид (ГИП) и энтероглюкагон (он же — глюкагоноподобный пептид-1; ГПП-1).
Инкретины вырабатываются в кишечнике в ответ на прием пищи. До 70 % секреции инсулина после приема пищи у здоровых людей обусловлено именно эффектом инкретинов.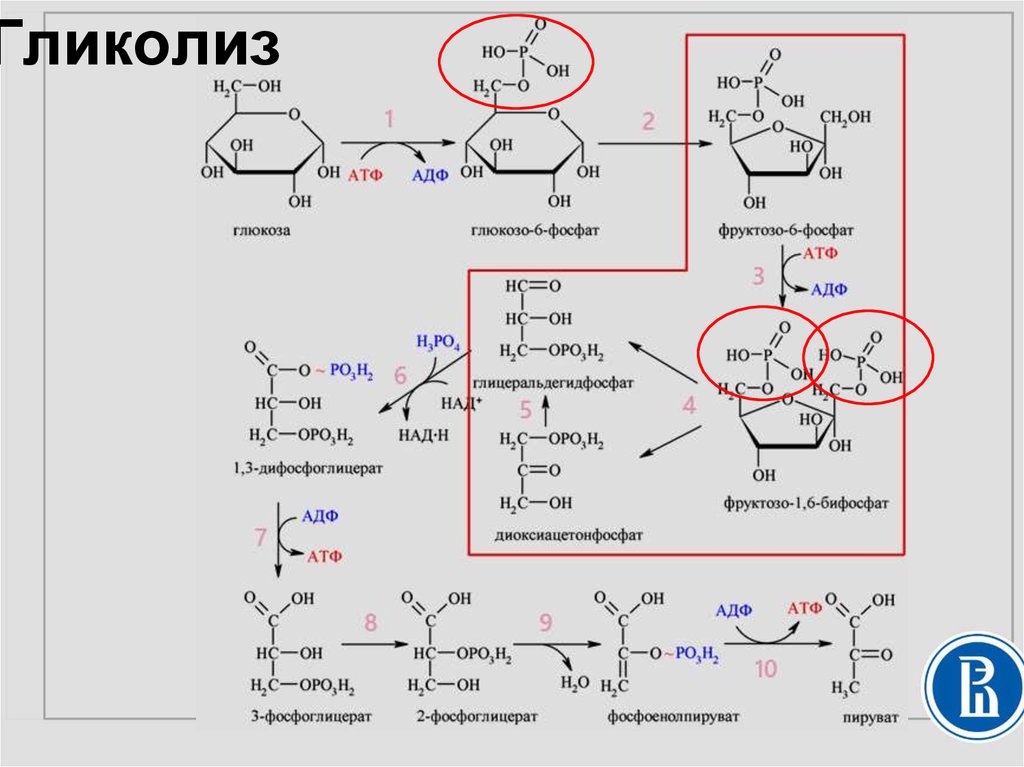 У больных сахарным диабетом 2-го типа этот эффект значительно снижен.
У больных сахарным диабетом 2-го типа этот эффект значительно снижен.
Куда стекает кровь от кишечника? Надеюсь, для тебя не будет открытием, что в воротную вену печени — в эту биохимическую лабораторию, которая способна не только эффективно перерабатывать этанол и ибупрофен при месячных, но и осуществлять кучу других функций. Одной из них является контроль уровня глюкозы в крови путем высвобождения глюкозы из гликогена. Впрочем, печень не единственная, кто получает лакомый кусок. Глюкозы обычно хватает на все клетки. А вот что с ней происходит дальше, мы сейчас и посмотрим [3, 4].
Попадая в клетку, как мы и обсуждали ранее, глюкоза претерпевает превращение в Г6Ф. Это делает ее молекулой легкого поведения, которая вступает в самые разные, подчас поражающие своей извращенностью, реакции [1].
Первая группа реакций — синтетические:
- Глюкоза — субстрат пентозофосфатного пути —источника рибозо-5-фосфата (для синтеза нуклеотидов) и НАДФН (восстановительного эквивалента, участвующего в целой серии синтетических реакций)
- Сахара могут быть элементом гликокаликса и частью некоторых поверхностных рецепторов в клетке.
 В процесс синтеза таких рецепторов глюкоза вписывается уже будучи производной самой себя — например, N-ацетилсиаловой кислотой. Сиаловая кислота включается в процесс на стадии посттрансляционной модификации протеинов (когда к белку в комплексе Гольджи после трансляции на рибосомах присоединяется небелковый компонент). Пример таких рецепторов — вирусные рецепторы (рецепторы к нейраминидазе вируса гриппа). Это тот самый рецептор клеток мерцательного эпителия дыхательных путей, который позволяет вирусу гриппа проникать в клетку и реализовать свой пролиферативный потенциал.
В процесс синтеза таких рецепторов глюкоза вписывается уже будучи производной самой себя — например, N-ацетилсиаловой кислотой. Сиаловая кислота включается в процесс на стадии посттрансляционной модификации протеинов (когда к белку в комплексе Гольджи после трансляции на рибосомах присоединяется небелковый компонент). Пример таких рецепторов — вирусные рецепторы (рецепторы к нейраминидазе вируса гриппа). Это тот самый рецептор клеток мерцательного эпителия дыхательных путей, который позволяет вирусу гриппа проникать в клетку и реализовать свой пролиферативный потенциал. - Синтез в печени и мышцах гликогена — запасающей формы глюкозы. Данный процесс осуществляется следующим образом [1, 4];
Здесь присутствует знакомый нам по предыдущей лекции УДФ-глюкуронид (УДФ-ГЛК) (глава 1). Примечательно, что исходным субстратом для синтеза этого кофермента служит сама глюкоза (глюкоза 🡪 рибозо-1-фосфат 🡪 УТФ 🡪 УДФ 🡪 УДФ-глюкоза). Все переплетено [1]…
Вторая группа реакций — катаболические.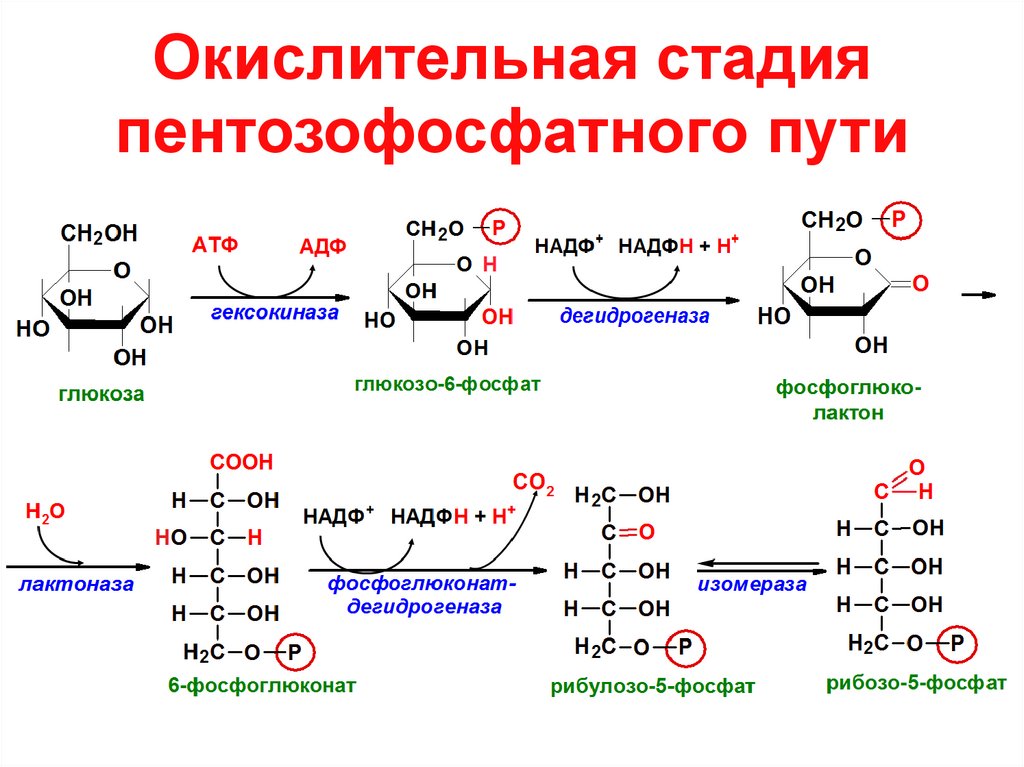
Но основное предназначение глюкозы — светить другим, сгорая самой. Получается это у нее неплохо, поэтому мы получаем просто нескончаемый поток энергии. Поговорим, как это происходит.
Схема проста, смысл — тоже: из одной молекулы глюкозы должно получиться две молекулы пировиноградной кислоты. Это ты знаешь еще с пятого класса своей коррекционной школы:
Глюкоза🡪 2 ПВК + 2 АТФ
Гликолиз включает в себя два этапа [1, 3]:
Реакции просты для запоминания (просто прописывай их в перерывах между отработками), дам пару комментариев.
- Фосфофруктокиназная реакция здесь — главная реакция. Она является лимитирующей, и ее скорость определяет скорость гликолиза. Это настолько важная реакция, что на нее даже расходуется АТФ.
- Первый этап заканчивается раздроблением сахара на два триуглеродных (С3) фрагмента: глицеральдегид-3-фосфат и дифосфоглицерат. Они взаимно превращаются друг в друга. 95 % продуктов реакции составляет глицеральдегид.

По мере истощения пула кетона дифосфоглицерата глицеральдегид любезно и по-джентельменски превращается в указанное соединение.
Глицеральдегид-3-фосфат служит мостиком между углеводным и липидным обменом, а также мостиком к твоим бокам. Глицеральдегид — субстрат для синтеза глицерола, а тот — для синтеза триацилглицеридов — основной запасающей формы жиров. Так что возьми с полки еще одну шоколадку и продолжаем [1–3].
Для экзамена тебе нужно знать, в каких реакциях образуются АТФ и НАДН, а в каких они используется, и при каких обстоятельствах. Взгляни, всмотрись в схему и перепиши ее пару раз.
Интересен фермент енолаза. В клетках нервной ткани и диффузной нейроэндокринной системы обнаружили ее особую форму — нейро-специфическую енолазу (НСЕ). Существуют работы, где НСЕ пытались оценить как онкомаркер для мелкоклеточного рака легкого, несмотря на то, что НСЕ не является строго специфичной для данного заболевания. Также были попытки использовать ее для оценки повреждения ЦНС при черепно-мозговой травме.
Фосфоенолпируват — один из промежуточных соединений глюконеогенеза — синтеза глюкозы из неуглеводных предшественников через ПВК. После фосфоенолпирувата глюконеогенез становится повторением реакции гликолиза, только в обратном направлении (за исключением фосфофруктокиназной реакции — она неповторима и незаменима).
Гликолиз бывает аэробным — осуществляемым в присутствии кислорода и способствующим образованию ПВК. А может быть анаэробным — физиологическим (в эритроцитах, в скелетных мышцах после работы) и патологическим (гипоксия различного генеза).
Разница в исходе гликолиза следующая. Если есть кислород, гликолиз закончится на образовании пировиноградной кислоты, которая станет ацетил-КоА и даст много-много энергии. А если у нас гипоксия, то будет работать лактатдегидрогеназа, и из ПВК получится лактат (молочная кислота). Этот фермент имеет колоссальное значение, а реакция важна с точки зрения развития многих патологических процессов.
Мы коснемся промежуточного этапа на пути к образованию конечных метаболитов и к твоему отчислению. Здесь мы имеем дело с пируватдегидрогеназным комплексом. Это конгломерат пяти ферментов, которые последовательно превращают ПВК в ацетил-КоА — субстрат для цикла Кребса (ЦТК) [1–3].
Здесь мы имеем дело с пируватдегидрогеназным комплексом. Это конгломерат пяти ферментов, которые последовательно превращают ПВК в ацетил-КоА — субстрат для цикла Кребса (ЦТК) [1–3].
Сможешь ли ты это выучить? Мне все равно, я лишь хочу акцентировать внимание на том, что здесь активно участвует тиамин (В1). Сладкоежкам и алкоголикам рекомендуют получать дополнительную дотацию витамина В1 в силу того, что при указанных поведенческих особенностях биоэнергетика может несколько страдать: в первом случае часть глюкозы уйдет в бока, а во втором — глюкоза в принципе не нужна для ЦТК (и тоже уйдет в бока, если ты выпиваешь в прикуску с чем-то сладким и жирным). (Уровень доказательности — мнение отдельных экспертов).
И мы подошли к самому главному и любимому всеми студентами (даже троечниками) — к циклу трикарбоновых кислот.
Его суть проста: пока ацетил-КоА сгорает в серии реакций, в некоторых из них высвобождаются восстановительные эквиваленты — 2 НАДН и ФАДН2. Они являются донорами электронов для электрон-транспортной цепи. Электрон-транспортная цепь, в свою очередь, служит базой формирования энергии АТФ. Не надо говорить на экзамене, что смысл ЦТК — сжечь ацетил-КоА до воды и углекислоты. Углекислота — это побочный продукт ЦТК. Но имеющий для клинической практики важное значение.
Они являются донорами электронов для электрон-транспортной цепи. Электрон-транспортная цепь, в свою очередь, служит базой формирования энергии АТФ. Не надо говорить на экзамене, что смысл ЦТК — сжечь ацетил-КоА до воды и углекислоты. Углекислота — это побочный продукт ЦТК. Но имеющий для клинической практики важное значение.
▶ Читать по теме: Цикл трикарбоновых кислот (доступно в PDF)
Также хочу акцентировать внимание на том, что ЦТК является множественным по значению циклом: здесь можно найти молекулы, активно участвующие в различных анаболических процессах. (Например, сукцинат служит субстратом для синтеза гема; ацетил-КоА — для синтеза жирных кислот, кетоновых тел и холестерола; α-кетоглутарат — для синтеза глутамата и реакций трансаминирования [1–3]).
Комментарии к ЦТК, которые пригодятся на экзамене и по жизни:
- ЦТК — это вечеринка для молекул из самых разных серий метаболизма. Здесь можно найти субстрат для ряда анаболических реакций:
(Глюконеогенез)
(Синтез самых разных кетокислот из соответствующих аминокислот) - Глутамат можно превратить в глутамин и тем самым утилизировать азот, образующийся в клетках и являющийся токсичным в больших концентрациях (см.
 главу 5).
главу 5). - Оксалоацетат можно превратить в аспартат. Аспартат участвует в цикле мочевины (процесс превращения азота в нечто безопасное и растворимое) и в синтезе пуриновых колец (пиримидиновых вроде тоже).
Здесь можно найти продукты метаболизма ряда веществ. - Фумарат является одним из продуктов метаболизма тирозина, а также обмена пиримидиновых нуклеотидов.
- Сукцинил КоА — продукт β-окисления жирных кислот с нечетным числом углеродных атомов.
- α-кетоглутарат — это продукт реакций трансаминирования.
Обрати внимание на то, что одним из субстратов является оксалоацетат. Ему тоже нужно откуда-то браться. Есть чудесный фермент — аспартатаминотрансфераза (АсТ). Это органоспецифичный фермент, обнаруживающийся преимущественно в печени и в сердце и имеющий колоссальное значение для биоэнергетики: без него ЦТК не «заработает», потому как ЦТК надо запустить двумя субстратами: ацетил-КоА и оксалоацетатом.
Если ацетил-КоА будет слишком много (кетонемия при сахарном диабете, массивное поступление жиров, алкогольная атака), он будет расходоваться на синтетические процессы.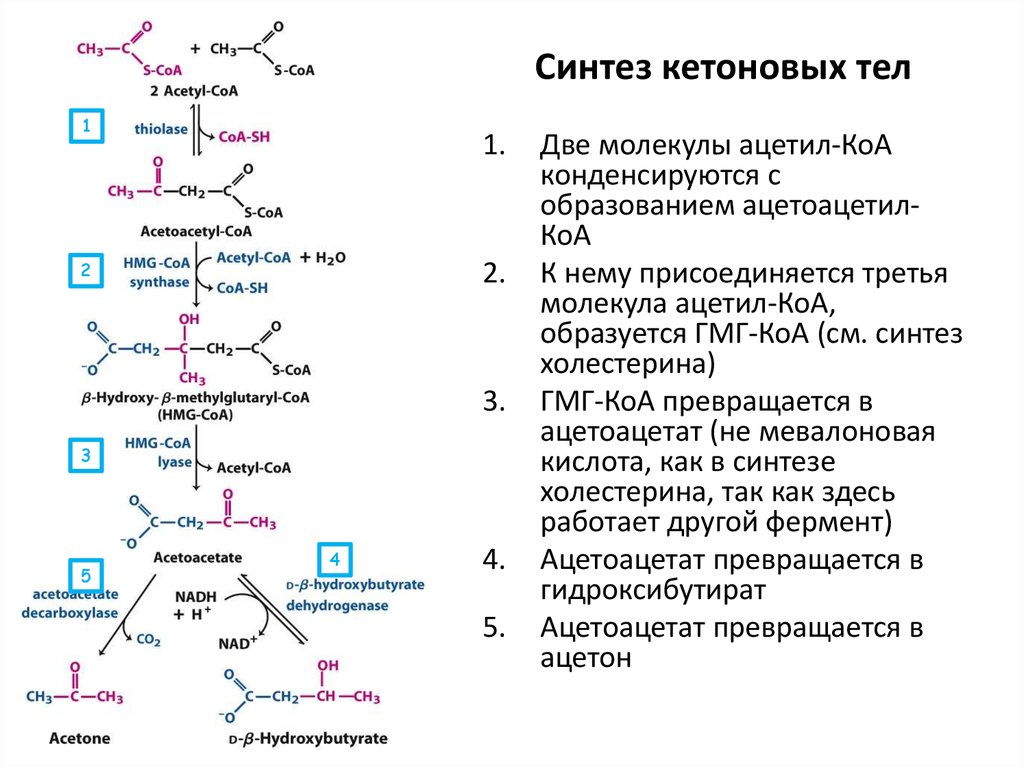 Это может быть синтез холестерола или кетоновых тел. Ничто в нашем организме не пропадает без дела — кроме жира на боках, естественно…
Это может быть синтез холестерола или кетоновых тел. Ничто в нашем организме не пропадает без дела — кроме жира на боках, естественно…
Глава 4 | Катаболизм липидов
Источники:
- Тимин О. А. Основы биологической химии, 2018 г., с. 181–220.
- Портал «Биохимия для студента», раздел «Обмен углеводов».
- Я. Кольман, К.-Г. Рём. Наглядная биохимия, 5-е издание, 2018 г., с. 38–44, 138–152.
- А. Д. Таганович, Э. И. Олецкий, И. Л. Котович. Патологическая биохимия, 2015 г., c. 44–47.
Анаболизм и катаболизм
Анаболизм и катаболизм – это основные метаболические процессы.
Катаболизм – это ферментативное расщепление сложных органических соединений, осуществляющееся внутри клетки за счет реакций окисления. Катаболизм сопровождается выделением энергии и запасанием ее в макроэргических фосфатных связях АТФ.
Анаболизм
– это синтез сложных органических
соединений – белков, нуклеиновых кислот,
полисахаридов – из простых предшественников,
поступающих в клетку из окружающей
среды или образующихся в процессе
катаболизма. Процессы синтеза связаны
с потреблением свободной энергии,
которая поставляется АТФ (рис. 31).
Процессы синтеза связаны
с потреблением свободной энергии,
которая поставляется АТФ (рис. 31).
Рис. 31 Схема путей метаболизма в бактериальной клетке
В зависимости от биохимии процесса диссимиляции (катаболизма) различают дыхание и брожение.
Дыхание– это сложный процесс биологического окисления различных соединений), сопряженный с образованием большого количества энергии, аккумулируемой в виде макроэргических связей в структуре АТФ (аденозинтрифосфат), УТФ (уридинтрифосфат) и т.д., и образованием углекислого газа и воды. Различают аэробное и анаэробное дыхание.
Брожение– неполный распад органических соединений с образованием незначительного количества энергии и продуктов, богатых энергией.
Анаболизм
включает процессы синтеза, при которых
используется энергия, вырабатываемая
в процессе катаболизма. В живой клетке
одновременно и непрерывно протекают
процессы катаболизма и анаболизма.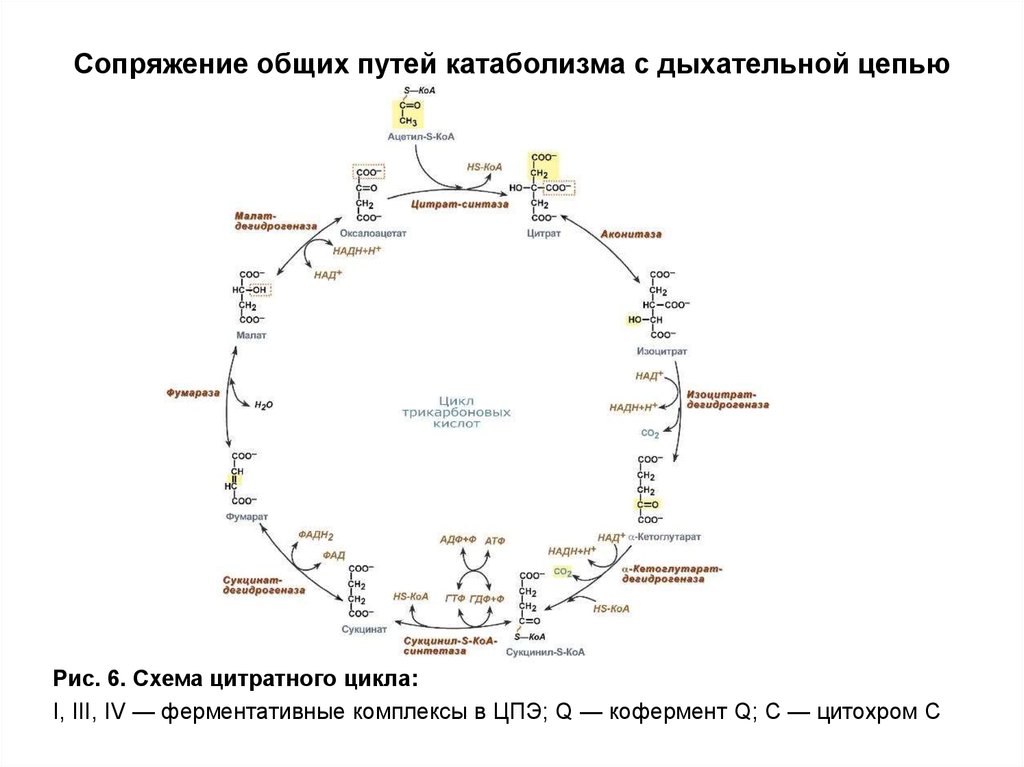 Многие реакции и промежуточные продукты
являются для них общими.
Многие реакции и промежуточные продукты
являются для них общими.
Живые организмы классифицируют в соответствии с тем, какой источник энергии или углерода они используют. Углерод – основной элемент живой материи. В конструктивном метаболизме ему принадлежит ведущая роль.
В зависимости от источника клеточного углерода все организмы, включая прокариотные, делят на автотрофы и гетеротрофы.
Автотрофыиспользуют CO2 в качестве единственного источника углерода, восстанавливая его водородом, который отщепляется от воды или другого вещества. Органические вещества они синтезируют из простых неорганических соединений в процессе фото- или хемосинтеза.
Гетеротрофы получают углерод из органических соединений.
Живые
организмы могут использовать световую
или химическую энергию. Организмы,
живущие за счет энергии света, называют фототрофными.Органические вещества
они синтезируют, поглощая электромагнитное
излучение Солнца (свет). К ним относятся
растения, сине-зеленые водоросли, зеленые
и пурпурные серобактерии.
К ним относятся
растения, сине-зеленые водоросли, зеленые
и пурпурные серобактерии.
Организмы, получающие энергию из субстратов, источников питания (энергия окисления неорганических веществ), называют
Существует немногочисленная группа хемоавтотрофов. К таким хемосинтезирующим микроорганизмам относятся нитрифицирующие бактерии, которые, окисляя аммиак до азотистой кислоты, высвобождают необходимую для синтеза энергию. К хемосинтетикам относятся также водородные бактерии, получающие энергию в процессе окисления молекулярного водорода.
У
большинства организмов расщепление
органических веществ происходит в
присутствии кислорода – аэробный обмен.
В результате такого обмена остаются
бедные энергией конечные продукты (СО2и Н2О), но высвобождается много
энергии. Процесс аэробного обмена
называется дыханием, анаэробного –
брожением.
Углеводы – основной энергетический материал, который клетки используют в первую очередь для получения химической энергии. Кроме того, при дыхании могут использоваться также белки и жиры, а при брожении – спирты и органические кислоты.
Расщепление углеводов организмы осуществляют разными путями, в которых важнейшим промежуточным продуктом является пировиноградная кислота (пируват). Пируват занимает центральное место в метаболизме при дыхании и брожении. Выделяют три основных механизма образования ПВК.
1.Фруктозодифосфатный (гликолиз) или путь Эмбдена-Мейергофа-Парнаса– универсальный путь.
Процесс начинается с фосфорилирования (рис. 32). При участии фермента гексокиназы и АТФ глюкоза фосфорилируется по шестому углеродному атому с образованием глюкозо-6-фосфата. Это активная форма глюкозы. Она служит исходным продуктом при расщеплении углеводов любым из трех путей.
При
гликолизе глюкозо-6-фосфат изомеризуется
во фруктозо-6-фосфат, а затем под действием
6-фосфофруктокиназы фосфорилируется
по первому углеродному атому.
Баланс:
Максимальное количество энергии, получаемое клеткой при окислении одной молекулы углеводов гликолитическим путем, равно 2·10 5Дж.
Рис.32. Фруктозодифосфатный путь расщепления глюкозы
2.Пентозофосфатный (Варбурга-Дикенса-Хорекера)путь характерен также для большинства
организмов (в большей степени для
растений, а для микроорганизмов играет
вспомогательную роль). В отличие от
гликолиза ПФ путь не образует пируват.
В отличие от
гликолиза ПФ путь не образует пируват.
Глюкозо-6-фосфат превращается в 6-фосфоглюколактон, который декарбоксилируется (рис. 33). При этом образуется рибулозо-5-фосфат, на котором завершается процесс окисления. Последующие реакции рассматриваются как процессы превращения пентозофосфатов в гексозофосфаты и обратно, т.е. образуется цикл. Считают, что пентозофосфатный путь на одном из этапов переходит в гликолиз.
При
прохождении через ПФ путь каждых шести
молекул глюкозы происходит полное
окисление одной молекулы глюкозо-6-фосфата
до CO
Рис. 33. Пентозофосфатный путь расщепления глюкозо-6-фосфата
Основное
назначение этого пути – поставлять
пентозы, необходимые для синтеза
нуклеиновых кислот, и обеспечивать
образование большей части НАДФ·Н2,
необходимого для синтеза жирных кислот,
стероидов.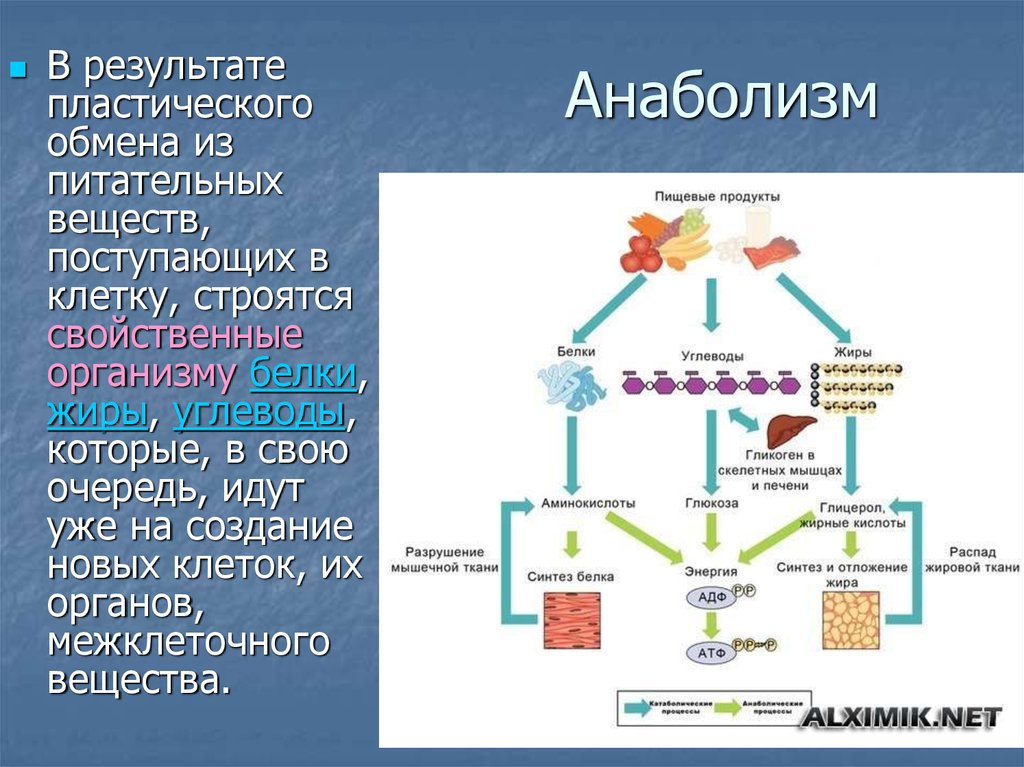
3.Путь Энтнера-Дудорова (кетодезоксифосфоглюконатный или КДФГ-путь)встречается только у бактерий. Глюкоза фосфорилируется молекулой АТФ при участии фермента гексокиназы (рис. 34).
Рис.34. Путь Энтнера-Дудорова расщепления глюкозыПродукт фосфорилирования – глюкозо-6-фосфат – дегидрируется до 6-фосфоглюконата. Под действием фермента фосфоглюконатдегидрогеназы от него отщепляется вода и образуется 2-кето-3-дезокси-6-фосфоглюконат (КДФГ). Последний расщепляется специфичной альдолазой на пируват и глицеральдегид-3-фосфат. Глицеральдегид далее подвергается действию ферментов гликолитического пути и трансформируется во вторую молекулу пирувата. Кроме того, этот путь поставляет клетке 1 молекулу АТФ и 2 молекулы НАД·Н2.
Таким
образом, основным промежуточным продуктом
окислительного расщепления углеводов
является пировиноградная кислота,
которая при участии ферментов превращается
в различные вещества. Образовавшаяся
одним из путей ПВК в клетке подвергается
дальнейшему окислению. Освобождающиеся
углерод и водород удаляются из клетки.
Углерод выделяется в форме CO
Образовавшаяся
одним из путей ПВК в клетке подвергается
дальнейшему окислению. Освобождающиеся
углерод и водород удаляются из клетки.
Углерод выделяется в форме CO
Дыхание
Дыхание – окислительно-восстановительный процесс, идущий с образованием АТФ; роль доноров водорода (электронов) в нем играют органические или неорганические соединения, акцепторами водорода (электронов) в большинстве случаев служат неорганические соединения.
Если
конечный акцептор электронов –
молекулярный кислород, дыхательный
процесс называют аэробным
дыханием.
У некоторых микроорганизмов конечным
акцептором электронов служат такие
соединения, как нитраты, сульфаты и
карбонаты. Этот процесс называется анаэробным
дыханием.
Этот процесс называется анаэробным
дыханием.
Аэробное дыхание – процесс полного окисления субстратов до CO2 и Н2О с образованием большого количества энергии в форме АТФ.
Полное окисление пировиноградной кислоты происходит в аэробных условиях в цикле трикарбоновых кислот (ЦТК или цикл Кребса) и дыхательной цепи.
Аэробное дыхание состоит из двух фаз:
1). Образующийся в процессе гликолиза пируват окисляется до ацетил-КоА, а затем до CO2, а освобождающиеся атомы водорода перемещаются к акцепторам. Так осуществляется ЦТК.
2). Атомы водорода, отщепленные дегидрогеназами, акцептируются коферментами анаэробных и аэробных дегидрогеназ. Затем они переносятся по дыхательной цепи, на отдельных участках которой образуется значительное количество свободной энергии в виде высокоэнергетических фосфатов.
Цикл трикарбоновых кислот (цикл Кребса, ЦТК)
Пируват,
образующийся в процессе гликолиза, при
участии мультиферментного комплекса
пируватдегидрогеназы декарбоксилируется
до ацетальдегида. Ацетальдегид, соединяясь
с коферментом одного из окислительных
ферментов – коферментом А (КоА-SH),
образует «активированную уксусную
кислоту» — ацетил-КоА – высокоэнергетическое
соединение.
Ацетальдегид, соединяясь
с коферментом одного из окислительных
ферментов – коферментом А (КоА-SH),
образует «активированную уксусную
кислоту» — ацетил-КоА – высокоэнергетическое
соединение.
Ацетил-КоА
под действием цитрат-синтетазы вступает
в реакцию со щавелевоуксусной кислотой
(оксалоацетат), образуя лимонную кислоту
(цитрат С6),
которая является основным звеном ЦТК
(рис. 35). Цитрат после изомеризации
превращается в изоцитрат. Затем следует
окислительное (отщепление Н)
декарбоксилирование (отщепление СО2)
изоцитрата, продуктом которого является
2-оксоглутарат (С5).
Под влиянием ферментного комплекса
ɑ-кетоглутаратдегидрогеназы с активной
группой НАД он превращается в сукцинат,
теряя СО2 и два атома водорода. Сукцинат затем
окисляется в фумарат (С4),
а последний гидратируется (присоединение
Н2О)
в малат. В завершающей цикл Кребса
реакции происходит окисление малата,
что приводит к регенерации оксалоацетата
(С4). Оксалоацетат взаимодействует с
ацетил-КоА, и цикл повторяется снова.
Каждая из 10 реакций ЦТК, за исключением
одной, легко обратима. В цикл вступают
два атома углерода в виде ацетил-КоА и
такое же количество атомов углерода
покидают этот цикл в виде СО2.
Оксалоацетат взаимодействует с
ацетил-КоА, и цикл повторяется снова.
Каждая из 10 реакций ЦТК, за исключением
одной, легко обратима. В цикл вступают
два атома углерода в виде ацетил-КоА и
такое же количество атомов углерода
покидают этот цикл в виде СО2.
Рис. 35. Цикл Кребса (по В.Л. Кретовичу):
1, 6 – система окислительного декарбоксилирования; 2 – цитратсинтетаза, кофермент А; 3, 4 – аконитатгидратаза; 5 – изоцитратдегидрогеназа; 7 – сукцинатдегидрогеназа; 8 – фумаратгидратаза; 9 – малатдегидрогеназа; 10 – спонтанное превращение; 11 — пируваткарбоксилаза
В
результате четырех окислительно-восстановительных
реакций цикла Кребса осуществляется
перенос трех пар электронов на НАД и
одной пары электронов на ФАД. Восстановленные
таким путем переносчики электронов НАД
и ФАД подвергаются затем окислению уже
в цепи переноса электронов. В цикле
образуется одна молекула АТФ, 2 молекулы
СО2 и 8 атомов водорода.
Биологическое значение цикла Кребса заключается в том, что он является мощным поставщиком энергии и «строительных блоков» для биосинтетических процессов. Цикл Кребса действует только в аэробных условиях, в анаэробных он разомкнут на уровне α-кетоглутаратдегидрогеназы.
Дыхательная цепь
Последней стадией катаболизма является окислительное фосфорилирование. В ходе этого процесса высвобождается большая часть метаболической энергии.
Восстановленные в цикле Кребса переносчики электронов НАД и ФАД подвергаются окислению в дыхательной цепи или цепи транспорта электронов. Молекулы-переносчики – это дегидрогеназы, хиноны и цитохромы.
Обе
ферментные системы у прокариот находятся
в плазматической мембране, а у эукариот
– во внутренней мембране митохондрий.
Электроны от атомов водорода (НАД, ФАД)
по сложной цепи переносчиков переходят
к молекулярному кислороду, восстанавливая
его, при этом образуется вода.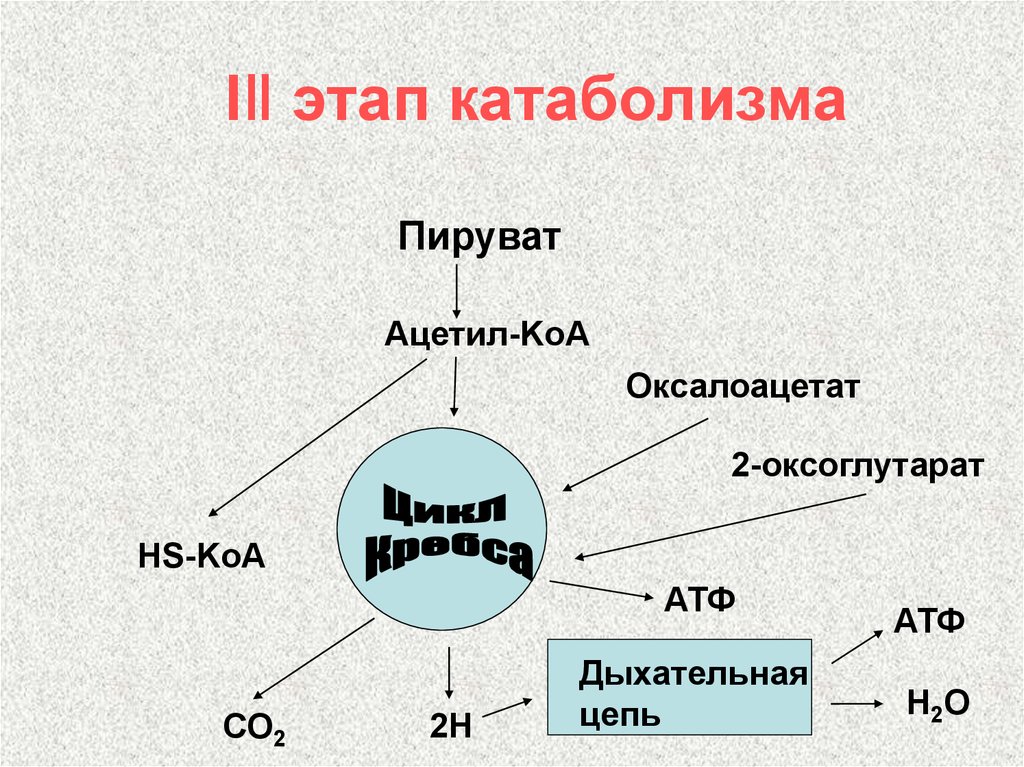
Баланс. Расчеты энергетического баланса показали, что при расщеплении глюкозы гликолитическим путем и через цикл Кребса с последующим окислением в дыхательной цепи до СО2 и Н2О на каждую молекулу глюкозы образуется 38 молекул АТФ. Причем максимальное количество АТФ образуется в дыхательной цепи – 34 молекулы, 2 молекулы — в ЭМП-пути и 2 молекулы – в ЦТК (рис. 36).
|
Неполное окисление органических соединений
Дыхание обычно связано с полным окислением органического субстрата, т.е. конечными продуктами распада являются СО2 и Н2О.
Однако
некоторые бактерии и ряд грибов не до
конца окисляют углеводы. Конечными
продуктами неполного окисления являются
органические кислоты: уксусная, лимонная,
фумаровая, глюконовая и др., которые
аккумулируются в среде. Этот окислительный
процесс используется микроорганизмами
для получения энергии. Однако общий
выход энергии при этом значительно
меньший, чем при полном окислении. Часть
энергии окисляемого исходного субстрата
сохраняется в образующихся органических
кислотах.
Конечными
продуктами неполного окисления являются
органические кислоты: уксусная, лимонная,
фумаровая, глюконовая и др., которые
аккумулируются в среде. Этот окислительный
процесс используется микроорганизмами
для получения энергии. Однако общий
выход энергии при этом значительно
меньший, чем при полном окислении. Часть
энергии окисляемого исходного субстрата
сохраняется в образующихся органических
кислотах.
Микроорганизмы, развивающиеся за счет энергии неполного окисления, используются в микробиологической промышленности для получения органических кислот и аминокислот.
Анаболизм и катаболизм. Масса и сушка.
Вас может удивить то, что спортивный курс так много времени уделяет питанию, однако 80% Вашего успеха будет зависеть именно от того, что Вы едите и только 20% от тренировок. К тому же Вашей фулбади тренировки вам хватит как минимум на месяц, все-таки ваша задача в этот период — освоить технику и разбудить мышцы, а не накачать их.
Для начала хотелось бы убедиться, что у Вас подсчитана Ваша суточная калорийность(а в идеале ещё и БЖУ). На второй неделе мы её поменяем. Для тех, у кого есть лишний вес — уменьшаем калорийность на 10%. Для тех, у кого лишнего веса нет и хочется набрать мышц — увеличиваем калорийность на 10% Прирост или урезание на 10% достаточны для того, чтобы в Вашем организме начали происходить изменения. Если урезать сильнее — то для организма это будет шоком и он начнет адаптироваться и вместо того, чтобы сжигать жир начнет урезать расход калорий. Но об этом чуть позднее.
Для начала хотел бы поговорить про желаемый результат. Желание всех женщин — это похудеть. Я в свою очередь стараюсь убедить, что для этого необходимо качать мышцы. Но сразу получаю кучу опасений, что если качаться, то можно стать перекачанной. Я уже сорвал голос, объясняя, что это возможно ТОЛЬКО с применением фармакологии. Даже если вы будете работать с весами наравне с мужчинами.
Максимум, что появится — это выраженные бедра.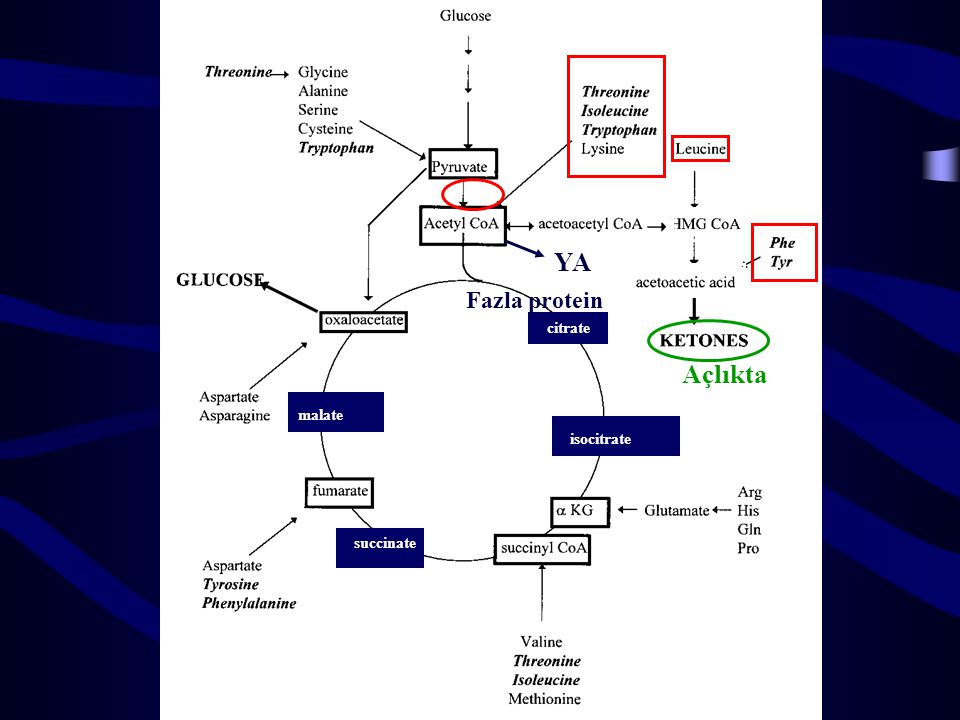 А рельеф мышц будет только в случае, если будет экстремально низкий % подкожного жира. Так что дамы, не бойтесь нагрузок — ваш шанс перекачаться без фармакологии = 0 целых 0 десятых.
А рельеф мышц будет только в случае, если будет экстремально низкий % подкожного жира. Так что дамы, не бойтесь нагрузок — ваш шанс перекачаться без фармакологии = 0 целых 0 десятых.
Зачем женщинам качать мышцы? Потому что чем больше у Вас мышц, тем больше сжигает калорий Ваша бытовая активность. То есть Вы будете тратить больше энергии сами по себе. Также силовые нагрузки запускают синтез самототропного гормона(гормон роста), а он является липолитическим (жиросжигающим).
Чем больше у Вас будет активных мышечных волокон, тем легче Вам будет сжигать жир.
Ещё раз скажу — не нужно боятся и переоценивать количество мышц — Вы удивитесь тому, как их у Вас мало, когда начнёте заниматься и худеть.
Переходим к мужским хотелкам. Мужики по большей части хотят накачать мышцы(причем как можно меньшими усилиями) и держать их в тонусе. У большинства из них нет цели выглядеть как атлет(хотя это абсолютно реально и поддерживать эту форму не так уж сложно, а со временем станет просто в кайф). Желание похудеть для них является каким-то женским, к тому же по аналогии с женщинами, которые боятся быть перекачанными, мужчины не хотят быть НИ перекачанными, НИ дрищами.
Желание похудеть для них является каким-то женским, к тому же по аналогии с женщинами, которые боятся быть перекачанными, мужчины не хотят быть НИ перекачанными, НИ дрищами.
В итоге никто не хочет качаться и никто не хочет худеть.
Я же призываю делать именно это. Почему? Во-первых, без значительных усилий Вы не перекачаетесь. Опять же — это сложнее, чем Вы думаете, а во-вторых, без очень строгих диет Вы не станете дрищом. Так зачем нужны целенаправленные усилия по наращиванию мышц и уменьшению жира? По аналогии с женщинами, чем больше у Вас мышц, тем больше самототропного гормона и тем меньше жира. Но у Вас есть ещё один анаболический гормон — тестостерон, он же мужской половой гормон. Он также участвует в росте мышц и сжигании жира, а его выработка зависит от наличия силовых нагрузок и % жира в Вашем теле(всего причин гораздо больше, но эти — самые основные, на которые влияет наш курс).
Когда Вы начинаете худеть — повышается тестостерон, от этого начинают расти мышцы, от этого Вы ещё больше худеете и получаете ещё больше тестостерона.
Прекрасный замкнутый круг, который у большинства мужчин, к сожалению, работает в другую сторону. Тестостерон, кстати, влияет не только на количество мышц и жира, он также укрепляет иммунитет, повышает либидо, уверенность в себе и пр. Если хотите знать подробней — Гугл Вам в помощь. Кстати, женщинам не нужно боятся повышенной выработки тестостерона, её не будет, если не будете прибегать к фармакологии.
Итак, мы определились с тем, что нам нужно сжечь как можно больше жира и нарастить как можно больше мышц в разумных пределах, которые продиктует нам наша генетика и образ жизни. И это одинаково нужно как мужчинам, так и женщинам. Теперь перейдём к тому, как эти процессы происходят в нашем теле.
Вы наверняка знаете про такое понятие, как Метаболизм — он же обмен веществ. Разберем его поподробнее. Метаболизм подразделяется на 2 стадии: Анаболизм и Катаболизм.
Анаболизм — это процесс синтеза клеток.
Например, наращивание мышц — это анаболизм. Вы наверняка слышали слово «Анаболики». Их название происходит как раз от анаболизма. Но пугаться тут нечего, анаболизм — это естественный процесс, в то время, как анаболики — это фармакологические препараты, которые позволяют обойти естественно функционирование организма и имеют довольно сильные побочные эффекты. Здесь они рассматриваться не будут.
Их название происходит как раз от анаболизма. Но пугаться тут нечего, анаболизм — это естественный процесс, в то время, как анаболики — это фармакологические препараты, которые позволяют обойти естественно функционирование организма и имеют довольно сильные побочные эффекты. Здесь они рассматриваться не будут.
Катаболизм — это процесс расщепления клеток.
Так вот, эти процессы не проходят в нашем организме одновременно. Мы либо синтезируем ткань, либо расщепляем. На самом деле, это очень сильное упрощение — все процессы в организме немного сложнее, но если у вас нет желания получить научную степень по микробиологии и биохимии- то примите эту упрощенную схему, на дистанции она работает ни чуть не хуже. Чтобы выразиться точнее, можно сказать так:
Наше тело не может ЭФФЕКТИВНО сжигать жир и ЭФФЕКТИВНО наращивать мышцы ОДНОВРЕМЕННО.
Чем занимается наш организм ана- или ката- болизмом, зависит от нашего энергетического баланса, то есть от того, что у нас больше — потребление калорий или их расход. Если потребление больше — мы наращиваем массу — мышцы или жир в зависимости от того, что едим и чем занимаемся. Если больше расход — то мы начинаем сбрасывать массу — опять же мы можем сбрасывать как жир, так и мышцы. Причем организм старается избавиться от мышц в первую очередь, так как они более энергозатратны в содержании.
Если потребление больше — мы наращиваем массу — мышцы или жир в зависимости от того, что едим и чем занимаемся. Если больше расход — то мы начинаем сбрасывать массу — опять же мы можем сбрасывать как жир, так и мышцы. Причем организм старается избавиться от мышц в первую очередь, так как они более энергозатратны в содержании.
Жир и мышцы — абсолютно разные нутриенты и преобразовать одно в другое, то есть пережечь жир в мышцы, не получится. Жир можно только сжечь, а мышцы только нарастить, причем не одновременно, как вы понимаете. Вы наверняка слышали про такие понятие как «на массе» и «на сушке». Так вот, это схема не просто рабочая, а единственно рабочая. Нужно сначала набирать мышцы, причем вместе с ними вы наберете немного жира, а потом сжечь лишний жир, при этом немного уменьшиться Ваш объем мышц. Не пугайтесь, объем уменьшится, но, если все делать с умом, то он будет связан лишь с уменьшением количества питательных веществ в мышечных клетках, который быстро восстановится, когда сушка закончится.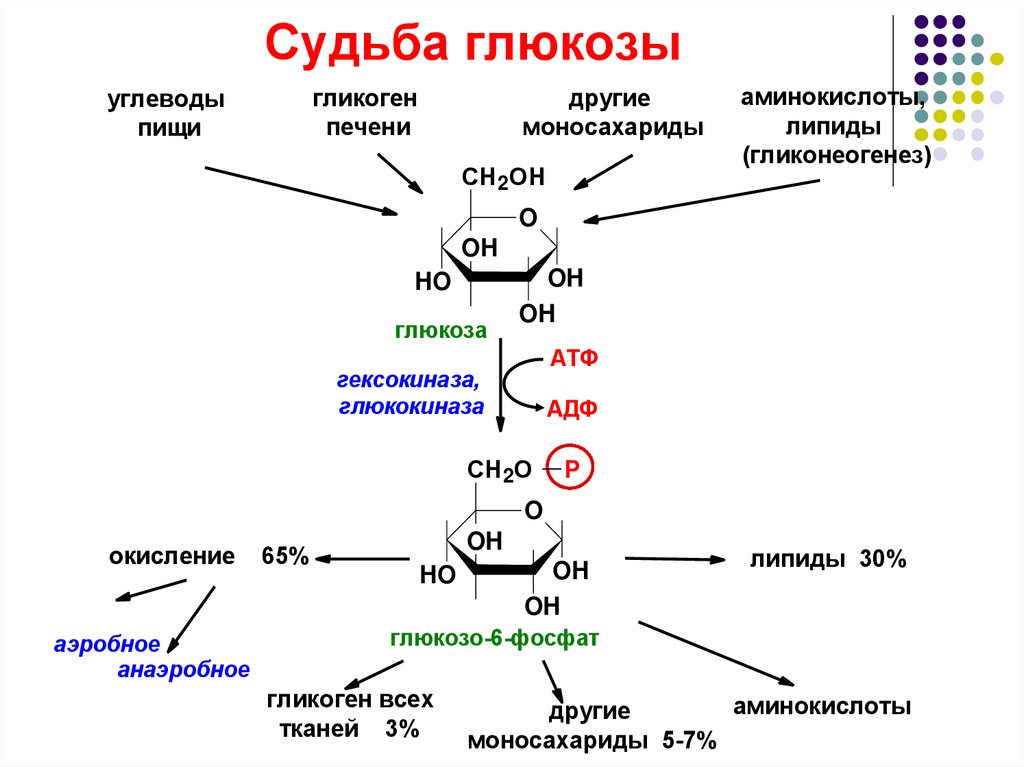
Однако у всех правил есть исключения. И если Вы обладаете немного лишним весом, а со спортом связаны примерно также, как депутат с народом, то у меня для Вас отличная новость! Вы можете и сжечь жир и нарастить мышцы одновременно и эффективно. Какого хрена я тогда утверждал, что это невозможно? Тут нет противоречия.
Дело в том, что если нетренированный человек ограничит свою калорийность и начнет заниматься — он будет сбрасывать жир(так как энергетический баланс отрицателен), а мышцы будут расти за счет того, что будут активироваться «дремлющие» мышечные волокна. Активируясь, он будут наполняться питательными веществами, увеличивая свои объем и силу. Причём, чем тренированней Вы были в прошлом, тем лучше у вас будут результаты. То есть сработает так называемый феномен мышечной памяти. Если когда-то Вы были накачанным, а сейчас стали пухляком — значительная часть Ваших мышц быстро вернется.
Переходим к плану действий. Вы уже определились с целью — нужно ли Вам сбрасывать вес или набирать(если колеблетесь — лучше сбрасывайте, как я объяснил в предыдущем абзаце — мышцы все равно будут расти в этот период). Для начала нужно поменять состав Вашего рациона по нутриентам, то есть по белкам, жирам и углеводам.
Для начала нужно поменять состав Вашего рациона по нутриентам, то есть по белкам, жирам и углеводам.
Вот Вам рекомендации:
Белки — кушать 1,5-2г на кг веса.
То есть 80 килограммовый человек должен потреблять в день 120-160 грамм белка. Потреблять меньше — ограничивать рост мышц, потреблять больше — давать лишнюю нагрузку на почки и ЖКТ, т.к. все равно больше белка организм не пустит на строительство новых клеток. Какой белок выбирать я рассказал в предыдущем письме.
Жиры — от 0,7 до 1 г на кг веса. Учитывайте ВСЕ жиры, которые Вы потребляете в пищу, вплоть до масла, на котором Вы жарите картошку. В порцию картофеля может впитаться на 30г масла, что будет составлять 300 калорий. Также старайтесь потреблять больше жиров Омега-3. От 12 до 25% потребляемых жиров должны быть омега-3. Лучше источники — это льняное масло, кедровые орехи и рыбий жир.
Углеводы ДО 4 г на кг веса. Как понять точное количество? Просто посчитайте, сколько у вас остается запас по калориям. То есть общая логика такая — потребляем жиры и углеводы в зависимости от Вашего веса, а нехватающие калории добиваем углеводами.
То есть общая логика такая — потребляем жиры и углеводы в зависимости от Вашего веса, а нехватающие калории добиваем углеводами.
Что получаем в итоге?
Питание становится сбалансированным, белка достаточно, чтобы строить новые клетки, нет жира, кроме того минимума, который нам необходим.
Увеличивается термический коэффициент пищи. Это связано с увеличением потребления белка. Термический коэффициент пищи -это относительное количество калорий, которое тратится на ее переваривание. У углеводов и жиров он варьируется от 5 до 15%, а у белков достигает 30%. То есть 30% калорий, полученных из белков будет потрачено на переваривание этого самого белка! Таким образом мы увеличиваем расход калорий организма без каких либо усилий. Если Ваше питание более-менее сбалансировано или балансировка перестала давать результаты(а со временем это случится), то нужно будет корректировать калорийность. Для тех, кто хочет нарастить массу — прибавляем 10% калорий. Для тех, кто хочет сбросить — снижаем на 10%.
Чем корректировать? Ответ очевиден. Белки и жиры должны соответствовать Вашему весу, соответственно корректировать нужно будет углеводы. Если в школе Вы болели и пропустили тему процентов — даю примерные цифры: убавьте 30-80 грамм углеводов, где 30 нужно убавить хрупкой девушке, а 80 — гордому обладателю тельца тяжелее центнера.
Как я уже и говорил, я не буду сразу давать готовых рационов. Но дам список рекомендаций, который лучше начать применять сейчас. Некоторые рекомендации Вас удивят, но не волнуйтесь, позже я их объясню.
1) Ешьте 4-5 раз в день. Конечно, тут все индивидуально и зависит от вашего пищеварения и графика. Но как показывает практика — питание 1-2 раза в день или 6-7 раз в день не дают преимуществ в усваивании пищи и некомфортны для распорядка дня.
Последний прием пищи должен быть не до 18, а за 2-3 часа до сна. То есть если вы ложитесь в 00:00 — поужинать в 22 нормально, дадите подпитку мышцам для ночного роста.
Не можете добрать норму белка обычным питанием? Тогда добирайте ее сывороточным протеином. Это не химия, а простой белок, очищенный от примесей, вроде сухого молока или яичного порошка. Но не увлекайтесь — старайтесь, чтобы белка из спортивного питания было не более 30%.
Это не химия, а простой белок, очищенный от примесей, вроде сухого молока или яичного порошка. Но не увлекайтесь — старайтесь, чтобы белка из спортивного питания было не более 30%.
2) Не совмещайте основные приемы пищи с другими занятиями. Ешьте за столом без просмотра сериалов или работы. Кушать станете меньше, а удовольствия будете получать больше.
3) Проявляйте умеренность в еде. Это уже рекомендация всех врачей в мире.
4) Не бойтесь, что здоровая пища поначалу будет недостаточно вкусной — со временем ваши вкусовые рецепторы адаптируются и здоровая пища станет для вас вкуснее фастфуда.
5) Планируйте питание заранее. Не стоит отодвигать решение о том, что Вы будете есть на момент перед тем, как собственно начнете есть. Вы сытый и Вы голодный — это 2 разных человека. Голодный Вы нерационален и спровоцирует Вас на вредную пищу.
6) Ходите в магазин со списком продуктов и покупайте ТОЛЬКО по списку. Захотели что-то еще — внесите в список следующего похода в магазин и придите позже и не вините себя, если впишите в список вкусняшку:)
7) Старайтесь есть овощи с основными приемами пищи
8) Вместе с углеводами принимайте клетчатку — отруби или отдельную клетчатку(она продается в диетическом отделе)
9) 10-25% потребляемых жиров должны быть жирами омега-3, но употребляя омега-3 отдельно, не забывайте учитывать их калорийность и БЖУ.
10) Между приемами пищи НИЧЕГО не едим, не кусочничаем. Даже совсем меленький прием пищи останавливает липолиз.
11) Полностью исключите жидкие калории, соки в том числе.
12) Сахарозаменители имеют место быть — используйте их или продукты, который на них основаны(ту же диетическую газировку), если тянет на сладенькое
13) Пейте больше чистой воды. Жажда наступает, когда у Вас УЖЕ началось обезвоживание. Норма — примерно 30мл на кг веса. Но она также зависит от образа жизни.
14) Откажитесь от алкоголя. Это не так ужасно, как Вы думаете.
15) Овощи имеют следующие приоритеты предпочтений: самые лучшие — свежие овощи с грядки. На втором месте — заморозка. Свежие овощи из магазина идут на третьем месте по полезности.
16) Ешьте то, что приготовили сами.
17) Приоритеты по приготовлению мяса: вареное — в пароварке — на гриле — жареное Самый лучший вариант — варить и потом сливать воду. Так из мяса выварится вся дрянь, которой его пичкали, когда оно еще бегало по травке(а точнее сидело в загоне).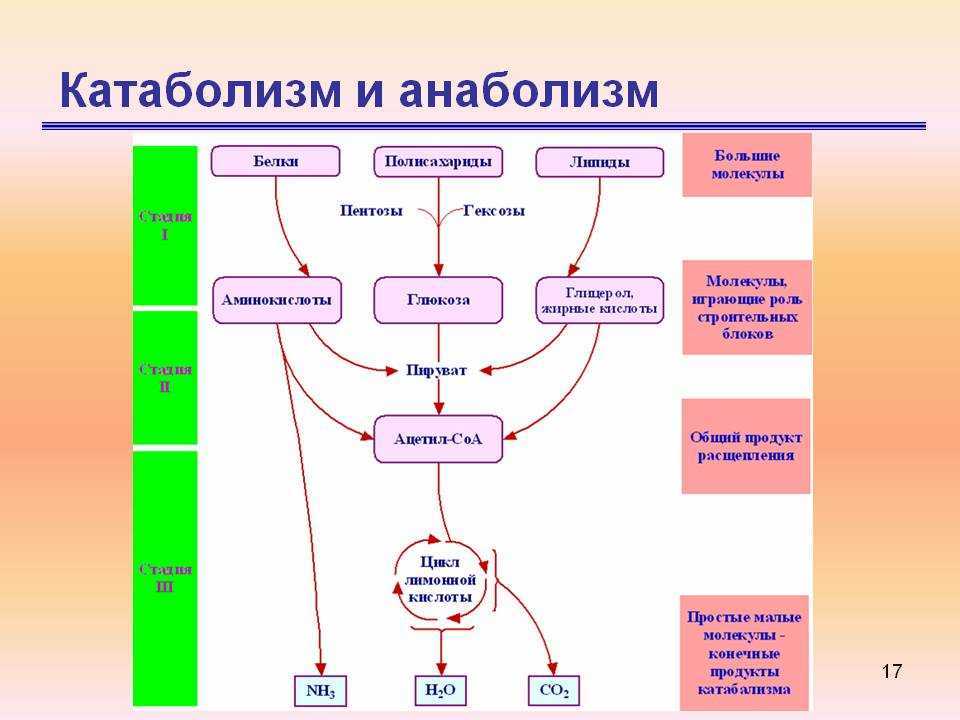 Жареное лучше вообще исключить.
Жареное лучше вообще исключить.
18) НИКОГДА не терпите голод
19) Отличайте голод от психологической тяги к еде. Представьте, что Вам предлагают тарелку брокколи и в ближайшие 2 часа еды не будет. Если Вы готовы подождать 2 часа, то Вы не голодны.
20) Если после балансировки питания у вас получилось значительно меньше калорий, чем вы ели раньше и при этом вы наедаетесь досыта и думаете как в себя впихнуть еще — вот Вам золотое правило: НЕ ХОЧЕТСЯ — НЕ ПИХАЙ! Если Вы сыты — значит Вам хватает калорий.
21) Будьте осторожней с фруктами и сахаросодержащими овощами(например морковь и свекла). Мы привыкли, что натуральное всегда полезно, состоит из света и от него не толстеют. Но фрукты далеко не безобидны, скорее наоборот.
Никому ничего не объясняйте и не доказывайте. Если окружение смотри на вас косо — скажите, что прописал врач. Делитесь своим опытом, если спросят, но не рекомендуйте, сэкономите силы.
Фух, я разошелся. Пожалуй, на этом хватит. Удачи Вам в Ваших начинаниях, остаюсь на связи.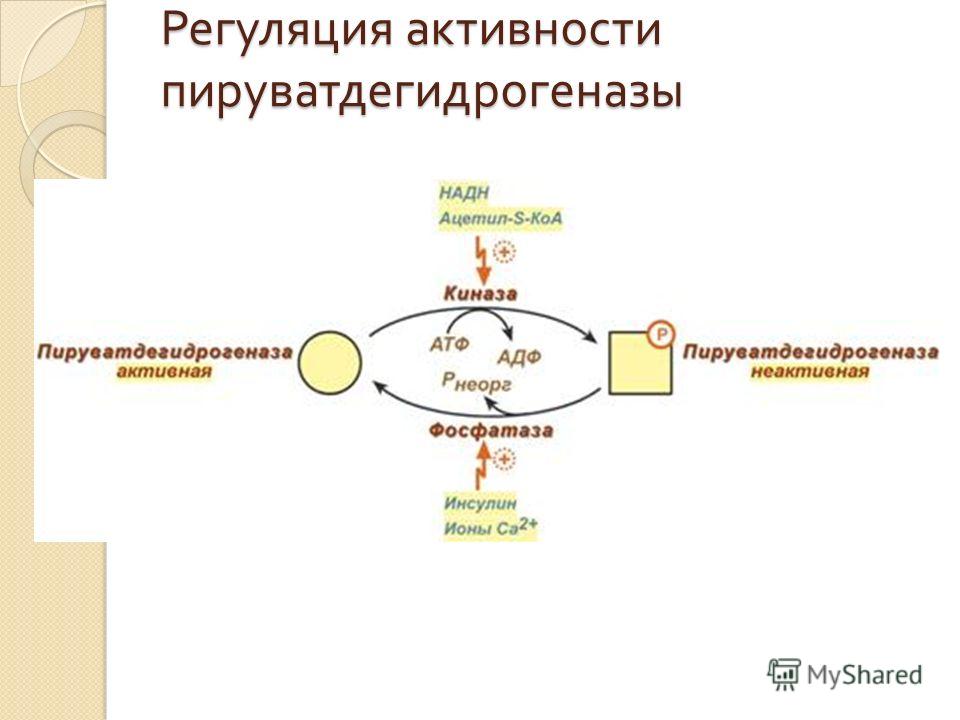 До следующих писем! Ваш Барфитс.
До следующих писем! Ваш Барфитс.
Что такое метаболизм — Здоровая Россия
Как энергия откладывается в жир, почему надо больше двигаться, если хочешь похудеть, и чем мужчины кардинально отличаются от женщин?
Слово «метаболизм» употребляют в речи диетологи и спортсмены, фитнес-инструкторы и вечно худеющие. Чаще всего термин употребляется в значении «обмен веществ». Но что это такое на самом деле, знают далеко не все. Попробуем разобраться.
Что это такое?
Метаболизм – это процессы, проходящие в любом живом организме для поддержания его жизни. Метаболизм позволяет телу расти, размножаться, заживлять повреждения и реагировать на окружающую среду. Для этого действительно необходим постоянный обмен веществ. Разделить процессы можно на два потока. Один разрушительный – катаболизм, другой созидательный – анаболизм.
Как похудеть с помощью спорта?
Основные правила тренировок, режим питания и полезные ссылки в специальном материале для тех, кто хочет похудеть.
Разборка на молекулярном уровне…
Любое питательное вещество, попадающее в организм, не может сразу пойти на его нужды. Например, белки из орехов, молока и человеческих мышц – совершенно разные, и друг друга заменить не могут. Однако они состоят из одних и тех же «кирпичиков» — аминокислот. Хотя в каждом из белков их разный набор и соотношение. Чтобы получить стройматериал для, например, бицепса, специальные ферменты разбирают содержащийся в молоке или котлете белок на отдельные аминокислоты, которые уже и идут в дело. Параллельно высвобождается энергия, измеряемая в калориях. Процесс разбора и есть катаболизм. Другой пример катаболизма – расщепление обычного сахара-рафинада на фруктозу и глюкозу.
… и сборочный цех
Организму недостаточно разобрать белки из съеденного на аминокислоты.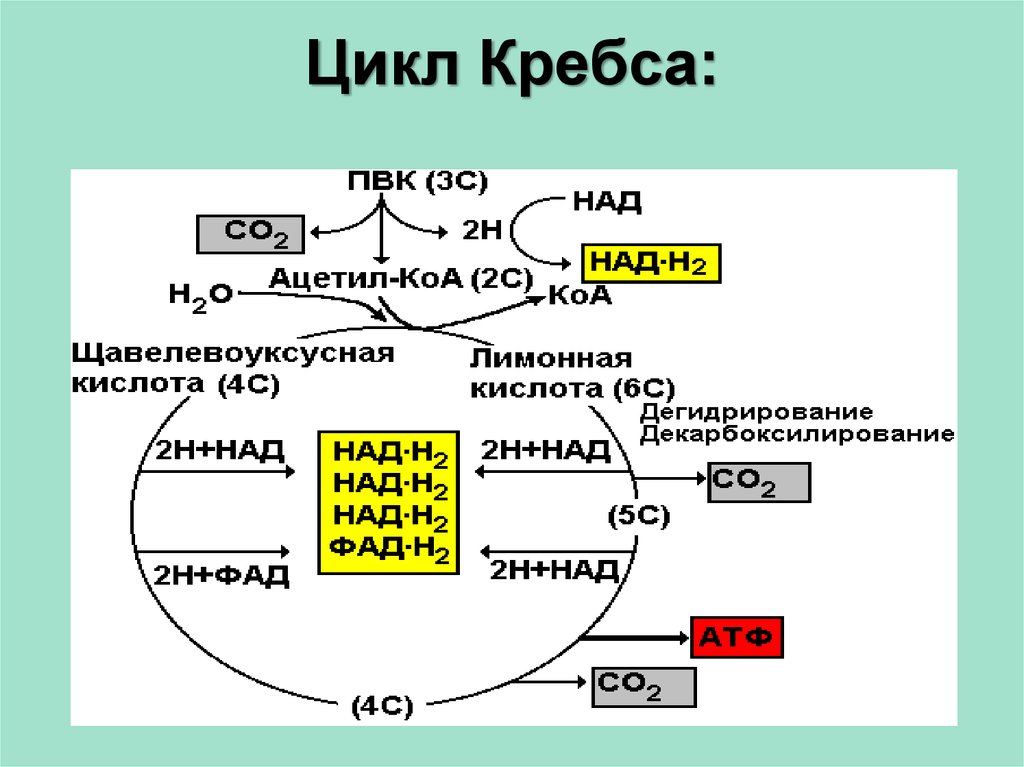 Из них необходимо собрать новые белки для той же мышцы бицепса.
Из них необходимо собрать новые белки для той же мышцы бицепса.
Мифы и правда о похудении
Можно ли сбросить несколько кило за одну тренировку, полезны ли миостимуляторы, и другие истории для ленивых.
Постройка сложных молекул из более мелких компонентов требует энергозатрат. На нее идут те самые калории, которые организм получил при «разборке». Этот процесс называется анаболизм. Еще пара наглядных примеров работы «сборочного цеха» организма – рост ногтей и заживление трещин в костях.
А откуда берется жир?
Если в процессе расщепления питательных веществ производится энергии больше, чем ее требуется на постройку новых клеток организма, появляется явный избыток, который надо куда-то деть.
Когда организм находится в состоянии покоя, метаболизм протекает в «фоновом» режиме и не требует активного расщепления и синтеза веществ.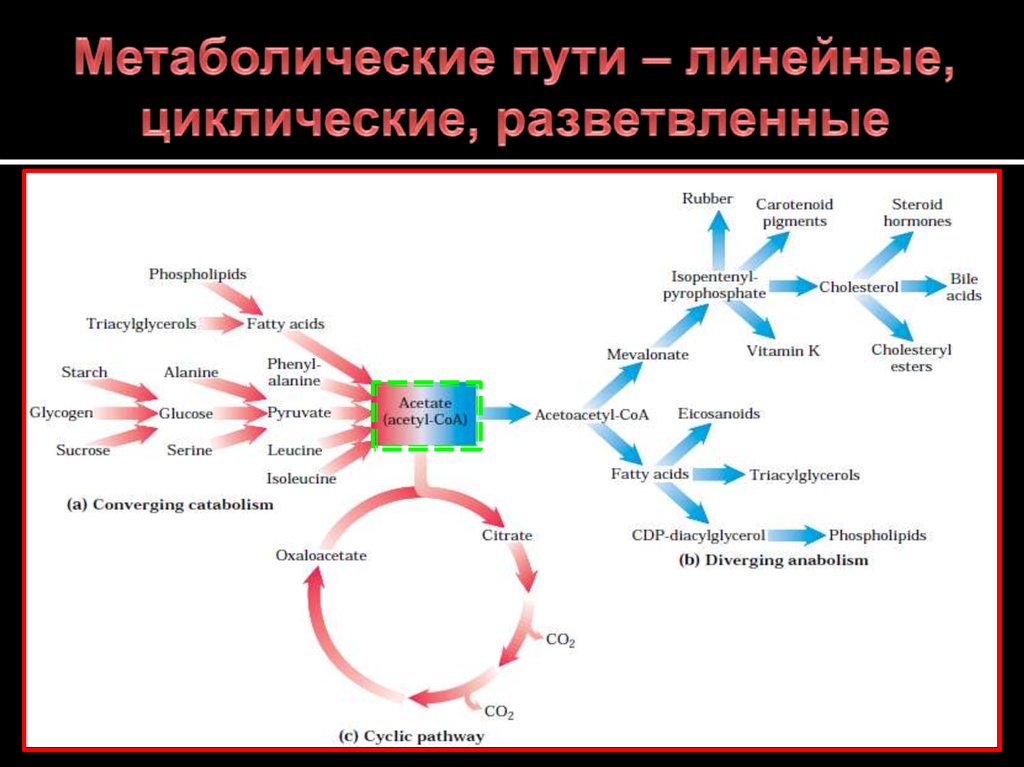 Но как только тело начинает двигаться, все процессы ускоряются и усиливаются. Возрастает и потребность в энергии и питательных веществах.
Но даже у подвижного организма могут оставаться излишки калорий, если их поступает слишком много с пищей.
Небольшая часть полученной и нерастраченной энергии складывается в виде углевода гликогена – источника энергии для активной работы мышц. Он запасается в самих мышцах и печени.
Остальное накапливается в жировых клетках. Причем для их образования и жизни требуется гораздо меньше энергии, чем для постройки мышц или костей.
Но как только тело начинает двигаться, все процессы ускоряются и усиливаются. Возрастает и потребность в энергии и питательных веществах.
Но даже у подвижного организма могут оставаться излишки калорий, если их поступает слишком много с пищей.
Небольшая часть полученной и нерастраченной энергии складывается в виде углевода гликогена – источника энергии для активной работы мышц. Он запасается в самих мышцах и печени.
Остальное накапливается в жировых клетках. Причем для их образования и жизни требуется гораздо меньше энергии, чем для постройки мышц или костей.
Как метаболизм связан с массой тела
Можно сказать, что вес тела — это катаболизм минус анаболизм. Другими словами, разница между количеством поступившей в организм энергии и использованной им.
Так, один грамм съеденного жира дает 9 ккал, а то же количества белка или углевода – 4 ккал. Те же 9 ккал организм отложит в 1 грамм жира уже в своем теле, если не сумеет потратить. Несложный пример: съедаете бутерброд и ложитесь на диван. Из хлеба и колбасы организм получил жиры, белки, углеводы и 140 ккал. При этом лежащее тело потратит полученные калории только на расщепление съеденной пищи и немного на поддержание функций дыхания и кровообращения – около 50 ккал в час. Остальные 90 ккал превратятся в 10 г жира и отложатся в жировое депо.
Если же любитель бутербродов выйдет на спокойную прогулку, полученные калории организм потратит примерно за час.
Несложный пример: съедаете бутерброд и ложитесь на диван. Из хлеба и колбасы организм получил жиры, белки, углеводы и 140 ккал. При этом лежащее тело потратит полученные калории только на расщепление съеденной пищи и немного на поддержание функций дыхания и кровообращения – около 50 ккал в час. Остальные 90 ккал превратятся в 10 г жира и отложатся в жировое депо.
Если же любитель бутербродов выйдет на спокойную прогулку, полученные калории организм потратит примерно за час.
«Хороший» и «плохой» метаболизм?
Многие с завистью глядят на хрупкую девушку, регулярно лакомящуюся пирожными и не прибавляющую ни грамма веса. Принято считать, что у таких счастливчиков метаболизм хороший, а у тех, для кого кусочек сахара в чае грозит прибавкой веса – метаболизм плохой.
На самом деле результаты исследований показывают, что действительно замедленный метаболизм наблюдается только при ряде заболеваний, например, гипотиреозе – недостатке гормона щитовидной железы.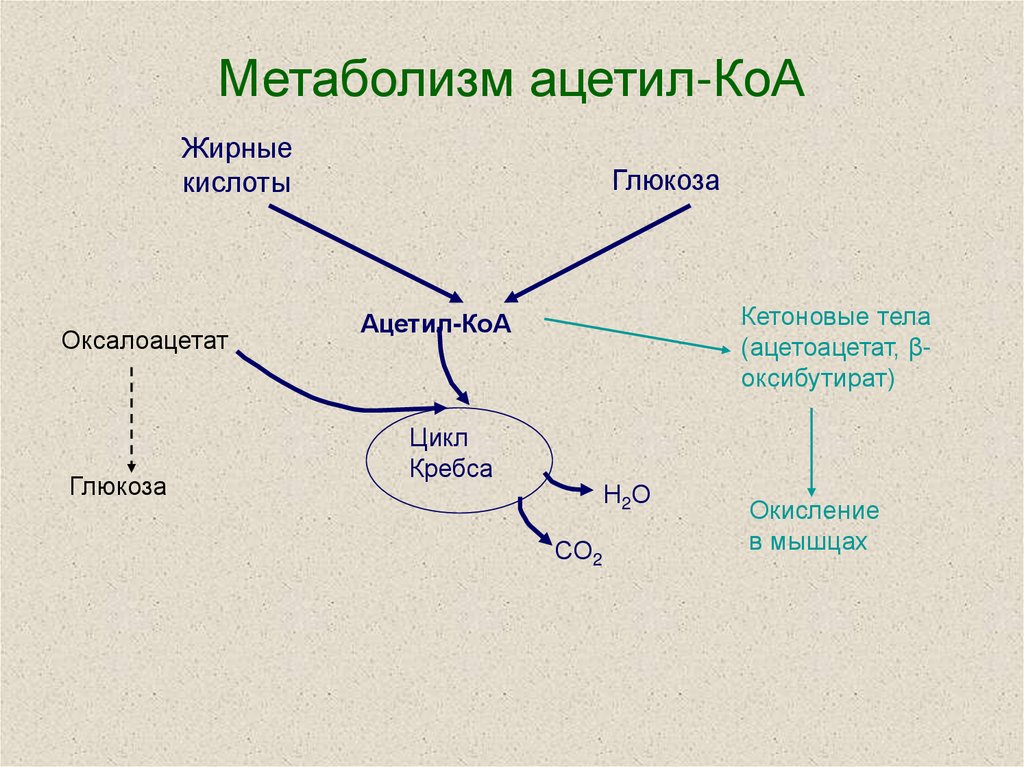 А у большинства людей с лишним весом нет никаких болезней, но наблюдается энергетический дисбаланс.
То есть, энергии в организм поступает гораздо больше, чем ее нужно на самом деле, и она складируется про запас.
А у большинства людей с лишним весом нет никаких болезней, но наблюдается энергетический дисбаланс.
То есть, энергии в организм поступает гораздо больше, чем ее нужно на самом деле, и она складируется про запас.
Статьи расхода калорий
Чтобы расход и получение калорий держать под контролем, стоит помнить основные направления дополнительных энергозатрат.
1. Чем выше масса тела, тем больше калорий ему требуется. Но, как мы знаем, жировой ткани надо совсем мало энергии для жизни, а вот мышечная потребляет достаточно.
Поэтому 100-килограммовый культурист потратит больше калорий на ту же работу, что и его 100-килограммовый ровесник с неразвитыми мышцами и высоким процентом жира.
2. Чем старше становится человек, тем выше у него разница между поступлением энергии и ее тратами за счет гормонального дисбаланса и резкого снижения физической активности.
3. В метаболизме мужского организма активно участвует гормон тестостерон.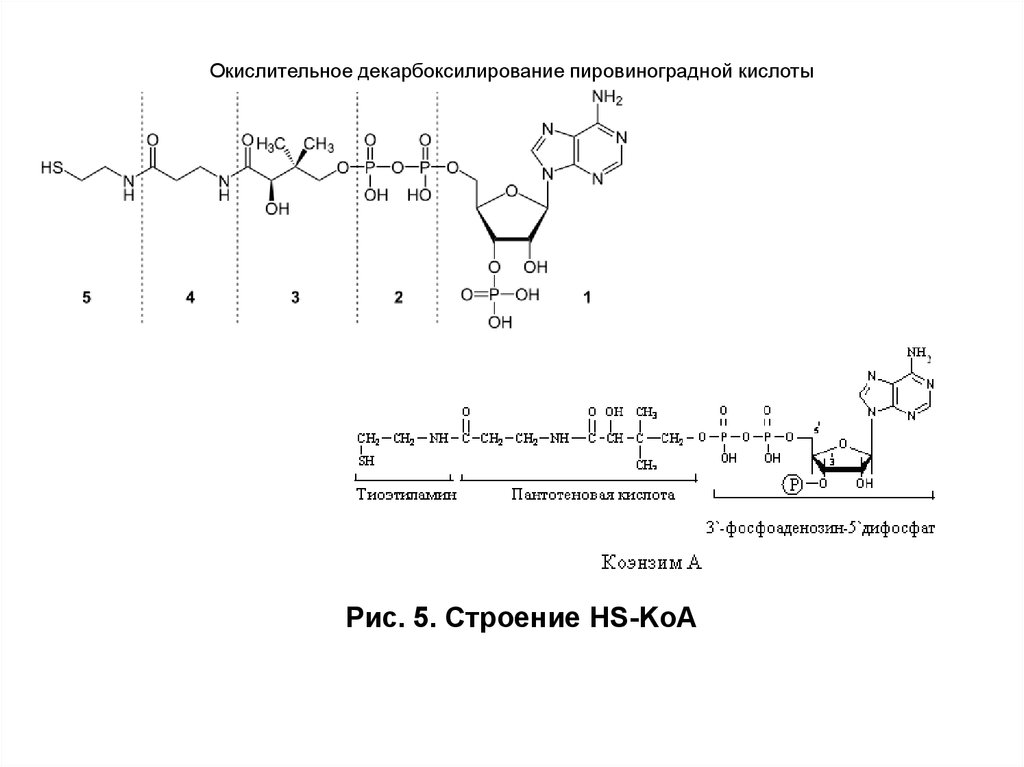 Это настоящий естественный анаболик, заставляющий организм тратить энергию и ресурсы на выращивание дополнительных мышц. Именно поэтому мышечная масса у мужчин обычно гораздо выше, чем у женщин.
А поскольку на поддержание жизнедеятельности мышц требуется гораздо больше энергии, чем для сохранения жира, то мужчина и женщина одного роста и веса тратят неодинаковое количество калорий на одни и те же действия.
Проще говоря: мужчины больше тратят энергии, им требуется больше еды, а при желании они гораздо быстрее худеют.
Это настоящий естественный анаболик, заставляющий организм тратить энергию и ресурсы на выращивание дополнительных мышц. Именно поэтому мышечная масса у мужчин обычно гораздо выше, чем у женщин.
А поскольку на поддержание жизнедеятельности мышц требуется гораздо больше энергии, чем для сохранения жира, то мужчина и женщина одного роста и веса тратят неодинаковое количество калорий на одни и те же действия.
Проще говоря: мужчины больше тратят энергии, им требуется больше еды, а при желании они гораздо быстрее худеют.
Что надо знать о метаболизме
Вся жизнь организма – это баланс между расщеплением питательных веществ и получением из них энергии и энергозатратах при создании новых молекул и клеток. Если энергии поступает слишком много – она откладывается про запас в виде жировой ткани. Увеличить энергозатраты можно, много двигаясь или вырастив достаточное количество мышечной массы.
1 комментарий •
Чтобы оставить комментарий — необходимо быть авторизованным пользователем
Метаболический мониторинг у больных в остром периоде тяжелой черепно-мозговой травмы
Скачать статью. pdf
pdf
Резюме
Цель исследования: оценка методом непрямой калориметрии метаболического ответа организма на тяжелую черепно-мозговую травму. В исследование вошли 23 пациента с черепно-мозговой травмой. Протокол исследования включал: измерение антропометрических показателей – роста и массы тела, измерение потерь азота, выявление и оценка степени катаболизма, расчет энергетических потребностей пациента по потерям азота с мочой, определение энергетических затрат покоя (ЭЗП) методом непрямой калориметрии. Было проведено 67 исследований. Величина ЭЗП варьировала от 54% до 214% от расчетных значений. Для точного расчета нутритивных потребностей пациентов в остром периоде черепно-мозговой травмы следует проводить оценку ЭЗП и необходимых потребностей в энергии и белке с помощью метаболического мониторинга.
Черепно-мозговая травма (ЧМТ) является социально значимым заболеванием, от которого страдает по большей части трудоспособная часть населения, поэтому большое значение придается разработке и внедрению стандартов, протоколов и принципов диагностики и лечения ЧМТ.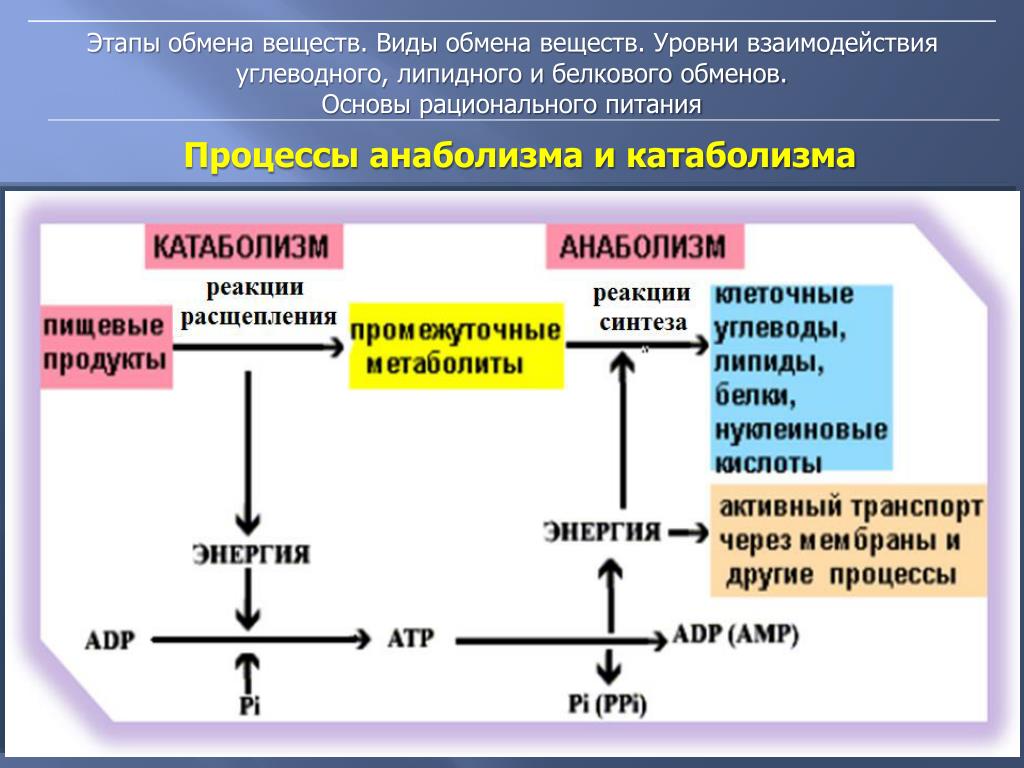 Наряду с экстренными мероприятиями по поддержанию основных функций организма и предотвращения вторичных осложнений, важная роль отводится и нутритивной поддержке пациентов с ЧМТ [3, 4, 12].
Наряду с экстренными мероприятиями по поддержанию основных функций организма и предотвращения вторичных осложнений, важная роль отводится и нутритивной поддержке пациентов с ЧМТ [3, 4, 12].
В настоящее время сформулировано несколько принципов назначения нутритивной поддержки больным в остром периоде тяжелой ЧМТ: расчет потребностей в энергии на килограмм массы тела, расчеты по потребностям белка, расчет необходимых энергетических потребностей по потерям азота [1, 4, 5, 12]. Однако ЧМТ – тяжелое заболевание, приводящее к изменению метаболизма и его структуры, что делает крайне затруднительным оценку необходимых потребностей расчетными методами.
Цель исследования
Целью нашего исследования явилась оценка методом непрямой калориметрии метаболического ответа организма на тяжелую ЧМТ.
Материалы и методы исследования.
Нами выполнено проспективное, когортное исследование, включающее в себя 23 пациента с ЧМТ, последовательно включенных в исследование в период с января 2010 по декабрь 2011 г.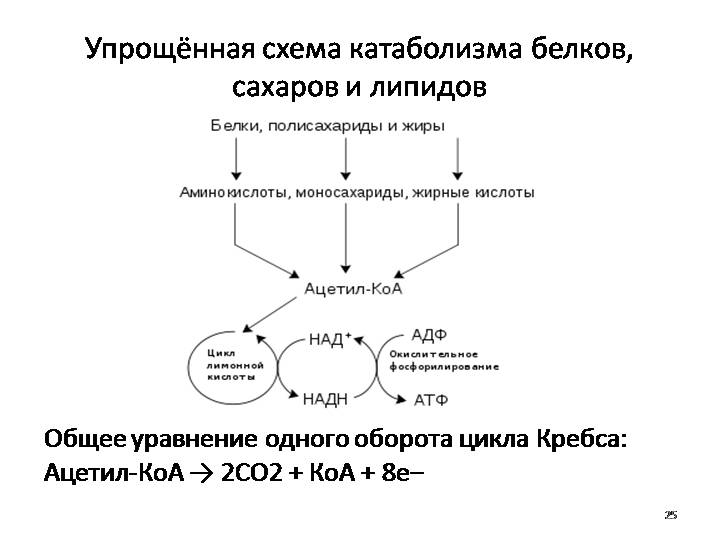 , и соответствующих критериям включения.
Критерии включения и исключения. В исследование включались проспективно все пациенты с диагнозом острая тяжелая ЧМТ, поступившие в Институт не позднее, чем на 7 сутки от момента получения травмы с уровнем нарушения сознания по Шкале Комы Глазго (ШКГ) 7 баллов и менее.
Из исследования исключали пациентов, имеющих следующие факторы и сопутствующие заболевания.
Уровень сознания по ШКГ более 7 баллов или менее 4 баллов.
, и соответствующих критериям включения.
Критерии включения и исключения. В исследование включались проспективно все пациенты с диагнозом острая тяжелая ЧМТ, поступившие в Институт не позднее, чем на 7 сутки от момента получения травмы с уровнем нарушения сознания по Шкале Комы Глазго (ШКГ) 7 баллов и менее.
Из исследования исключали пациентов, имеющих следующие факторы и сопутствующие заболевания.
Уровень сознания по ШКГ более 7 баллов или менее 4 баллов.
Тяжелая сочетанная травма.
Наличие у пациента сопуствующей патологии в виде печеночной или почечной недостаточности, делающими невозможным проведение оценки нутритивного статуса.
Диаррейный синдром, делающим невозможным корректный учет потери азота.
Наличие противопоказаний для проведения искусственного питания: острейшая фаза повреждения – 12–24 ч; рефрактерный шок; уровень сывороточного лактата >3–4 ммоль/л; гипоксия – рО2 80 мм рт. ст.
Психо-моторное возбуждение.
Негерметичность манжеты интубационной или трахеостомической трубки, утечка в контуре «пациент–аппарат». Наличие у пациента тремора и судорог.
Бронхоплевральный свищ.
Процентное содержание кислорода во вдыхаемой смеси более 60%, или нестабильность фракции кислорода во вдыхаемом воздухе.
Гипервентиляция (респираторный коэффициент более 1,2).
Уровень положительного давления в дыхательных путях в конце выдоха ≥12 см h3O.
Наличие у пациента тремора и судорог.
Бронхоплевральный свищ.
Процентное содержание кислорода во вдыхаемой смеси более 60%, или нестабильность фракции кислорода во вдыхаемом воздухе.
Гипервентиляция (респираторный коэффициент более 1,2).
Уровень положительного давления в дыхательных путях в конце выдоха ≥12 см h3O.
Проведение гемодиализа.
Все пациенты трудоспособного возраста от 18 до 63 лет (средний возраст составил 35 лет) и до поступления в клинику не имели сопутствующей патологии, без признаков истощения. Как правило, все пациенты поступали в клинику с изолированной ЧМТ либо с незначительной сочетанными травмами (переломы ребер, длинных трубчатых костей, переломы челюсти и т.п.). По половому признаку пациенты распределились следующим образом – мужчины – 16 и женщины – 7 человек.
Состояние пациентов оценивали при поступлении. Проводили детальный неврологический осмотр с определением уровня сознания. Во время осуществления основного лечебного процесса, когда требовались коррекция внутричерепной гипертензии и поддержание систем гомеостаза, пациентам проводили продолженную седацию путем внтуривенной инфузии препаратов для анестезии (пропофол, фентанил и т.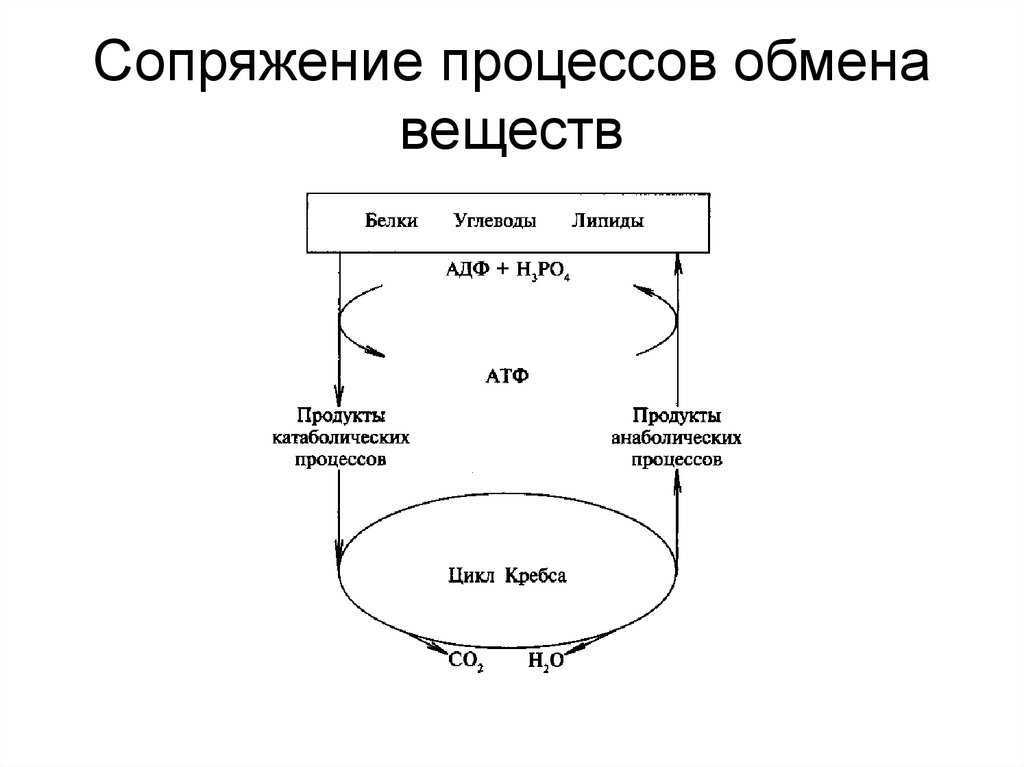 п.). У этих пациентов неврологический статус не оценивали.
п.). У этих пациентов неврологический статус не оценивали.
После проведения оценки нутритивного статуса и метаболических потребностей при условии отсутствия критериев исключения пациенту назначали нутритивную поддержку из расчета 25 ккал/кг массы тела в сутки, с постепенным увеличением энергетической нагрузки до 35–50 ккал/кг массы тела в сутки к 14–21 суткам. Питание начинали стандартными гиперкалорическими смесями с пищевыми волокнами (Нутризон Энергия с Пищевыми Волокнами, 1,5 ккал/мл, «Нутриция»), после проверки функции желудочно-кишечного тракта, через назогастральный зонд. При необходимости, в случае нарушения толерантности к проводимому энтеральному питанию пациента переводили на смешанное питание (энтеральное/парентеральное).
Исследование проводили по следующей программе.
Измерение антропометрических показателей – роста и массы тела.
Измерение потерь азота, выявление и оценка степени катаболизма. Методика представляет собой сбор суточной мочи у пациента и определение общего количества мочевины в суточной моче. Потери азота рассчитываются по известной формуле:
Потери азота(г/сут)= (Мочевина мочи (ммоль/л) Х объем мочи (л) Х 28/1000) +6 [1]
С целью выявления катаболизма у пациентов после получения данных об общей потере азота по формуле рассчитывали азотистый баланс. Этот показатель характеризует потери азота организмом и степень белкового катаболизма (табл.).
Потери азота рассчитываются по известной формуле:
Потери азота(г/сут)= (Мочевина мочи (ммоль/л) Х объем мочи (л) Х 28/1000) +6 [1]
С целью выявления катаболизма у пациентов после получения данных об общей потере азота по формуле рассчитывали азотистый баланс. Этот показатель характеризует потери азота организмом и степень белкового катаболизма (табл.).
Таблица. Степень тяжести катаболизма [1].
| Степень катаболизма | Величина потерь азота (г/сутки) |
| Норма | Нет |
| Легкий | До 6 |
| Средней тяжести | 7-12 |
| Тяжелый | Более 12 |
Азотистый баланс = поступивший азот (г/сут) – общие потери азота (г/сут) [1]
Определение энергетических затрат покоя (ЭЗП) методом непрямой калориметрии (НК). Метод заключается в определении объема потребленного кислорода (Vo2) и объема выделенного углекислого газа (Vсо2) [2]. Исследования метаболизма методом непрямой калориметрии проводили на системе анализа газообмена и метаболизма CCM Express компании MedGraphics, США. Непосредственно перед исследованием пациента в интерфейсную программу прибора вносили основные данные пациента (паспортная часть, индивидуальный номер, антропометрические данные, режим и показатели вентиляции, состояние сознания пациента). Исследование проводили в течение минимум 30 мин у каждого пациента. После окончания исследования вносили данные о величине общих потерь азота за сутки.
Исследования метаболизма методом непрямой калориметрии проводили на системе анализа газообмена и метаболизма CCM Express компании MedGraphics, США. Непосредственно перед исследованием пациента в интерфейсную программу прибора вносили основные данные пациента (паспортная часть, индивидуальный номер, антропометрические данные, режим и показатели вентиляции, состояние сознания пациента). Исследование проводили в течение минимум 30 мин у каждого пациента. После окончания исследования вносили данные о величине общих потерь азота за сутки.
Всего по стандартной программе у 23 пациентов было проведено 67 исследований.
Результаты исследования и их обсуждение.
У пациентов при поступлении в клинику индекс массы тела в среднем составил 27,64±4,45 кг/м2 (норма 20–25,9). У 2/3 пациентов отмечали катаболизм тяжелой или средней степени выраженности, в оставшихся наблюдениях катаболизм у пациентов отсутствовал или был легкой степени выраженности. Известно, что катаболизм – это разрушение собственных запасов белка (преимущественного мышечной массы) с целью обеспечения белково-энергетических потребностей организма в отсутствии пищи. В ходе стресс-голодания это процесс протекает более быстро и тяжело [5]. Наиболее ярким признаком катаболизма, помимо резко отрицательного азотистого баланса, является быстрая потеря мышечной массы тела пациентами.
В ходе стресс-голодания это процесс протекает более быстро и тяжело [5]. Наиболее ярким признаком катаболизма, помимо резко отрицательного азотистого баланса, является быстрая потеря мышечной массы тела пациентами.
При анализе зависимостей между сроками получения ЧМТ и величиной энергозатрат покоя и респираторного коэффициента (РК) не было выявлено значимых закономерностей. Наше исследование метаболизма выявило высокую вариабельность как показателей энергетических затрат покоя, так и респираторного коэффициента. Величина ЭЗП варьировала от 1152 ккал/сут до 3158 ккал/сут, что составляло от 54% до 214% от расчетных значений. При том, что большинству пациентов, особенно в острейшем периоде, проводили продленную седацию.
На рисунке 1 показана динамика ЭЗП, измеренных методом НК в процентном соотношении от расчетных величин у двух, идентичных по тяжести, пациентов, поступивших в остром периоде тяжелой ЧМТ. На рисунке видно, как метаболизм у Пациента «Ф» остается в пределах нормальных значений, в то время как метаболизм пациента «А», повышается до двух раз от контрольных значений.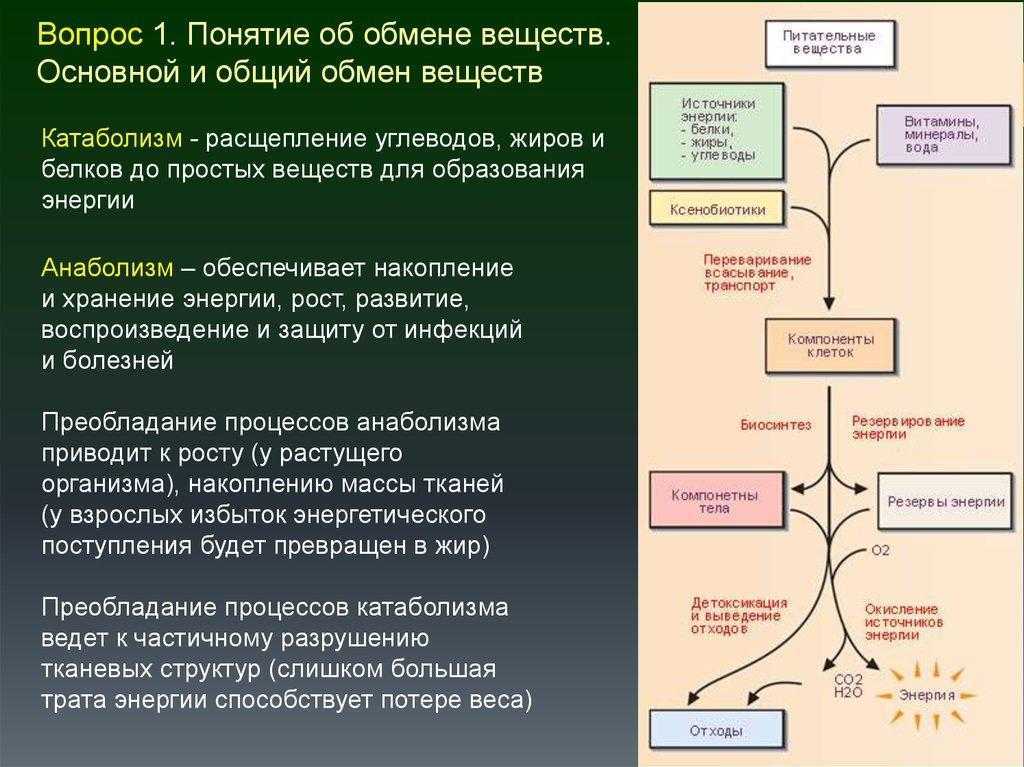
Наши результаты совпадают с заключением обзора N. Foley et al. [7] включающем в себя 24 исследования, три из которых были рандомизированными контролируемыми исследованиями. Установлено, что уровень энергозатрат покоя варьировал у пациентов с тяжелой ЧМТ от 75% до 200% от расчетных значений, причем минимальный уровень энергозатрат покоя был зафиксирован у пациента с погибшим мозгом. Проведенный обзор литературы K. Krakau et al., основанный на 30 исследованиях, показал, что скорость обмена веществ у пациентов с тяжелой ЧМТ варьировала от 96 до 160% [10].
Проведенный анализ данных выявил слабую корреляцию (y=1153,5 + 0,374*x; r=0,628; p<0,0001; r2=0,39) расчетных показателей ЭЗП, полученных стандартным уравнением Харриса–Бенедикта на основании антропометрических данных, и данных, полученных в результате проведения измерения методом непрямой калориметрии (рис. 2). Уравнение Харриса–Бенедикта было выведено в 1919 г., на основании данных полученных методом НК у здоровых добровольцев [9].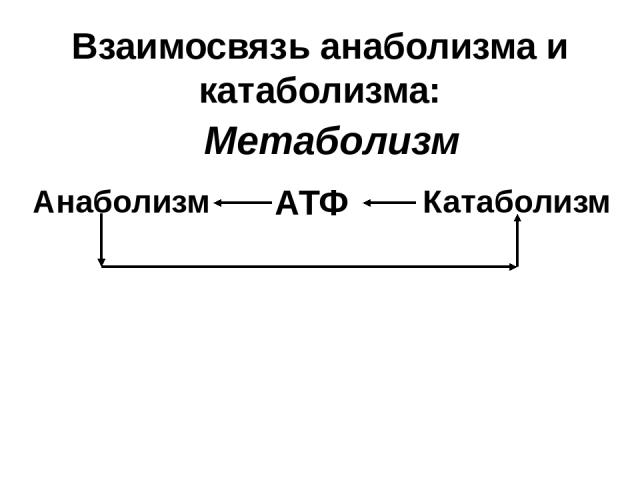
Рядом авторов также была сделана попытка провести корреляционный анализ между расчетными значениями уровня энергозатрат покоя и измеренными с помощью метода непрямой калориметрии [7, 11]. В исследовании P. M. Sunderland et al. проведенный анализ показал слабую зависимость между расчетными и измеренными показателями ЭЗП [14]. Очевидно, что использование этого уравнения допустимо только у нетяжелых больных для оценки их метаболизма.
Современные мировые тенденции диктуют необходимость отказываться от стандартизации расчетов белково-энергетических потребностей пациента и все больше делать акцент на индивидуализацию определения и назначения рациона питания. P. Singer et al. в своем исследовании показали снижение госпитальной смертности у пациентов, которым проводили динамический метаболический мониторинг энергозатрат покоя методом непрямой калориметрии [13]. Мы также придерживаемся мнения, что индивидуальный подход к осуществлению нутритивной поддержки пациентов в критическом состоянии позволяет избежать не только недостаточного поступления энергетических и пластических материалов в организм, но и риска их чрезмерного поступления.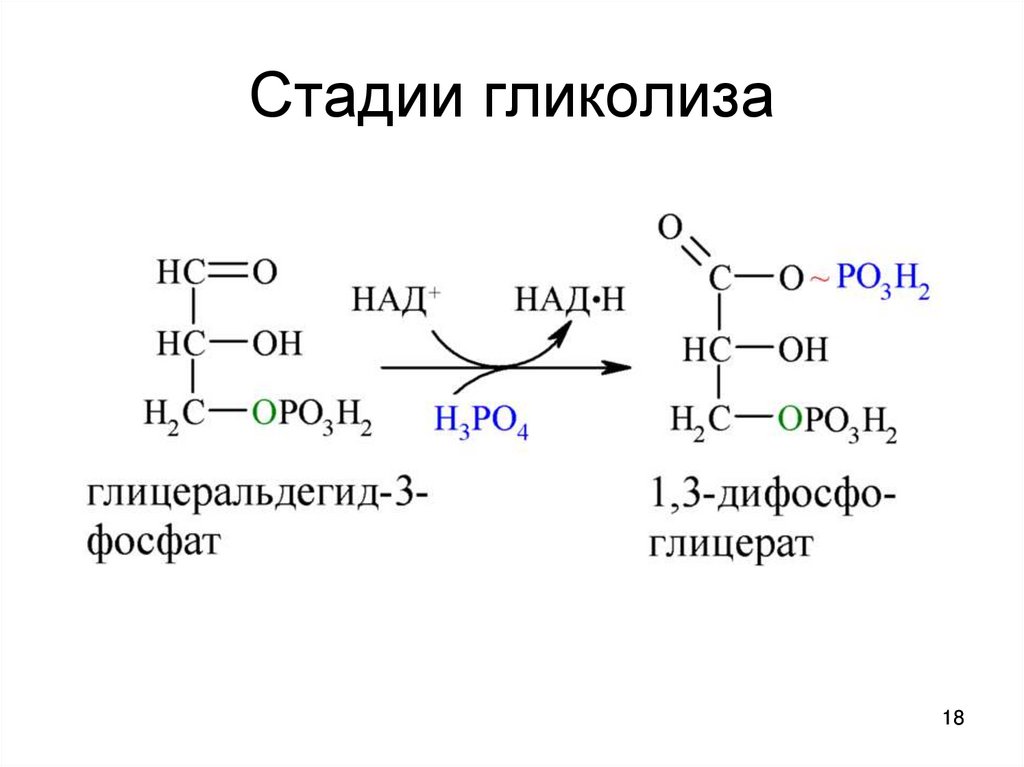 Нельзя осуществлять питание пациента в критическом состоянии по принципу «чем больше, тем лучше». Чрезмерное поступление в организм пациента энергетических субстратов сопряжено с рядом осложнений, таких как: увеличение частоты вторичных инфекций, дисфункция печени, гипертермия, гипергликемия, гипертриглециридемия и перегрузка жидкостью [6, 8].
Нельзя осуществлять питание пациента в критическом состоянии по принципу «чем больше, тем лучше». Чрезмерное поступление в организм пациента энергетических субстратов сопряжено с рядом осложнений, таких как: увеличение частоты вторичных инфекций, дисфункция печени, гипертермия, гипергликемия, гипертриглециридемия и перегрузка жидкостью [6, 8].
В заключение стоит отметить, что методика определения ЭЗП методом непрямой калориметрии требует специальных навыков, равно как и корректное определение потерь азота. Однако для получения более высокого качества лечения пациентов в остром периоде ЧМТ следует опираться на правильное и точное определение необходимых потребностей в энергии и белке. При невозможности использования метода непрямой калориметрии у пациентов в остром периоде тяжелой ЧМТ, возможно использование уравнения Харриса–Бенедикта. Однако не следует оставлять без внимания тот факт, что такой метод расчета ЭЗП может допускать значительную ошибку.
Необходимо проведение дальнейших исследований с оценкой взаимосвязи между величиной ЭЗП, структурой метаболизма и стрессовыми факторами, такими, как вторичная инфекция, внутричерепная гипертензия и др.
Выводы.
При оценке метаболизма методом непрямой калориметрии у пациентов в остром периоде черепно-мозговой травмы выявляется высокая вариабельность показателей энергетических затрат покоя, не зависящая от сроков получения травмы.
В ходе проводимого исследования выявляется слабая корреляция (y = 1153,5 + 0,374*x; r=0,628; p<0,0001; r2=0,39) расчетных показателей ЭЗП полученных стандартным уравнением Харриса–Бенедикта на основании антропометрических данных и данных, полученных в результате проведения измерения методом непрямой калориметрии.
В 2/3 наблюдений у пациентов с тяжелой черепно-мозговой травмой развивается катаболизм тяжелой или среднетяжелой степени тяжести.
В связи с установленной вариабельностью нарушений метаболизма, выявленных при измерении ЭЗП методом непрямой калориметрии, и невозможностью расчетным методом по стандартному уравнению Харриса–Бенедикта оценить нарушение структуры метаболизма, всем пациентам в остром периоде тяжелой черепно-мозговой травмы необходимо проводить динамический метаболический мониторинг методом непрямой калориметрии.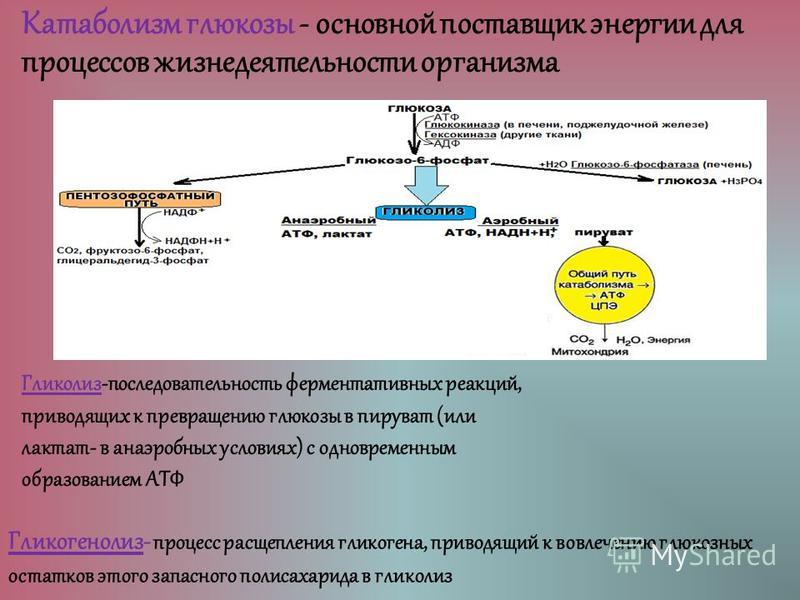
Литература
- Бутров А.В., Попова Т.С., Свиридов С.В., и др., Парентеральное питание в интенсивной терапии и хирургии: Методические рекомендации. Москва. – 2006. – C. 10-18.
- Завертайло Л.Л., Мальков О.А, Лейдерман И.Н. Технология метаболического мониторинга и выбор программы нутритивной поддержки у больного в критическом состоянии // Интенсивная терапия. – 2007. – Т. 1. – С. 65-77.
- Коновалов А.Н., Лихтерман Л.Б, Потапов А.А. Черепно-мозговая травма. Клиническое руководство. В трех томах. – Москва. Антидор. 1998-2002.
- Никифоров А.С., Коновалов А.Н., Гусев Е.И Клиническая неврология». Том III. Часть 1. Москва. Медицина. – 2004. – С. 418-459.
- Руководство по клиническому питанию. Под редакцией Луфта В.М., Багненко С.Ф., Щербука Ю.А. Санкт-Петербургский НИИ скорой помощи им. И.И. Джанелидзе. – Санкт-Петербург. – 2010. – С. 94-114.
- Dissanaike S., Shelton M., Warner K. et al. The risk for bloodstream infections is associated with increased parenteral caloric intake in patients receiving parenteral nutrition // Crit.
 Care. – 2007. – Vol. 11. – P. R114.
Care. – 2007. – Vol. 11. – P. R114. - Foley N., Marshall S., Pikul J. et.al. Hypermetabolism following moderate to severe traumatic acute brain injury: a systematic review // J. Neurotrauma. – 2008. – Vol. 25. – P. 1415-1431.
- Grau T., Bonet A. Caloric intake and liver dysfunction in critically ill patients // Curr. Opin. Clin. Nutr. Metab. Care. – 2009. – Vol. 12. – P. 175-179.
- Harris J.A., Benedict F.G., Biometric studies of human basal metabolism // Proc Natl Acad Sci U S A. – 1918. – Vol. 4 – P. 370-373.
- Krakau K., Omne-Pontén M., Karlsson T. et.al. Metabolism and nutrition in patients with moderate and severe traumatic brain injury: A systematic review // Brain Inj. – 2006. – Vol. 20. – P. 345-367.
- McEvoy C.T., Cran G.W., Cooke S.R. et al. Resting energy expenditure in non-ventilated, non-sedated patients recovering from serious traumatic brain injury: Comparison of prediction equations with indirect calorimetry values // Clinical Nutrition.
 – 2009. – Vol. 28. – P. 526-532.
– 2009. – Vol. 28. – P. 526-532. - Povlishock J.T., Bullock M.R., Hillered L.T. et аl. Guidelines for the Management of Severe Traumatic Brain Injury 3rd Edition // J. neurotrauma. – 2007. – Vol. 24. Suppl. 1. – P. S77-S82.
- Singer P., Anbar R., Cohen J., et al. The tight calorie control study (TICACOS): a prospective, randomized, controlled pilot study of nutritional support in critically ill patients // Intensive Care Med. – 2011. – Vol. 37. – P. 601-609.
- Sunderland P.M., Heilbrun M.P. Estimating energy expenditure in traumatic brain injury: comparison of indirect calorimetry with predictive formulas // Neurosurgery. – 1992. – Vol. 31. – P. 246-252.
Please enable JavaScript to view the comments powered by Disqus.
Гормоны, масса тела и упражнения
Обзор
Ваш метаболизм включает набор процессов, которые все живые существа используют для поддержания своего тела. Эти процессы включают как анаболизм, так и катаболизм.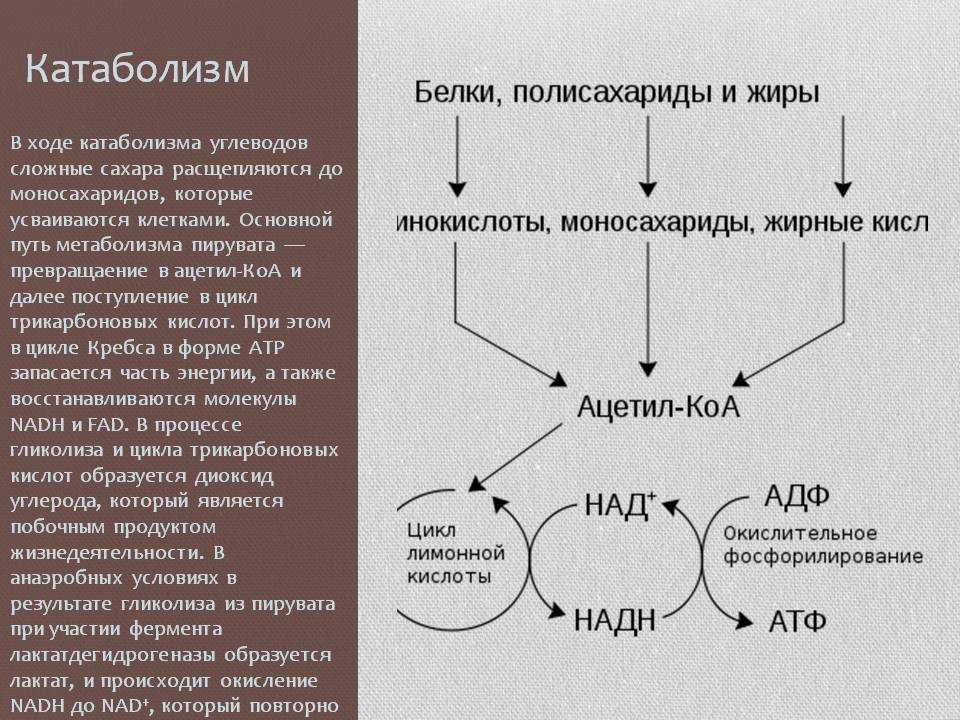 Оба помогают организовать молекулы, высвобождая и улавливая энергию, чтобы тело оставалось сильным. Эти фазы метаболизма происходят одновременно.
Оба помогают организовать молекулы, высвобождая и улавливая энергию, чтобы тело оставалось сильным. Эти фазы метаболизма происходят одновременно.
Анаболизм сосредоточен вокруг роста и построения — организации молекул. В этом процессе маленькие простые молекулы превращаются в более крупные и сложные. Примером анаболизма является глюконеогенез. Это когда печень и почки производят глюкозу из неуглеводных источников.
Катаболизм — это то, что происходит, когда вы перевариваете пищу и молекулы расщепляются в организме для использования в качестве энергии. Большие сложные молекулы в организме распадаются на более мелкие простые. Примером катаболизма является гликолиз. Этот процесс почти обратный глюконеогенезу.
Понимание анаболизма и катаболизма может помочь вам тренироваться более эффективно, чтобы сбросить жир и нарастить мышечную массу. Отдых также является частью уравнения. Ваш метаболизм работает, даже когда вы спите.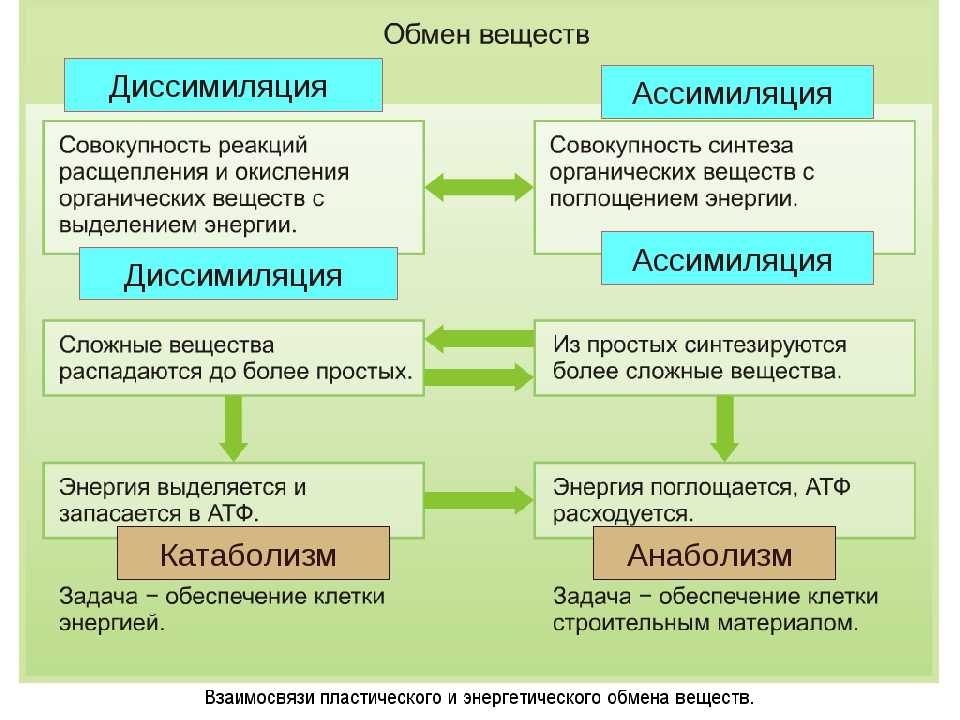
Гормоны играют важную роль в этих процессах. Различные гормоны в организме связаны либо с анаболизмом, либо с катаболизмом.
Anabolism involves the hormones:
- estrogen
- insulin
- growth hormone
- testosterone
Catabolism involves the hormones:
- adrenaline
- cortisol
- cytokines
- glucagon
Any нарушение гормонального фона, например, заболевания щитовидной железы, также может повлиять на эти процессы и общий обмен веществ. Например, небольшое исследование бодибилдеров изучало их гормональный анаболо-катаболический баланс, когда они готовились к соревнованиям. Некоторые мужчины продолжали тренироваться и питаться как обычно, в то время как другие были ограничены в энергии, чтобы уменьшить жировые отложения.
В группе с ограничением энергии наблюдалось значительное снижение жировой и мышечной массы тела по сравнению с контрольной группой. Их уровни инсулина и гормона роста также снижались на протяжении всего исследования. Уровень тестостерона также снизился между 11 и 5 неделями перед соревнованиями. Другими словами, «анаболические пути» мужчин были нарушены, даже у тех, кто потреблял много белка.
Их уровни инсулина и гормона роста также снижались на протяжении всего исследования. Уровень тестостерона также снизился между 11 и 5 неделями перед соревнованиями. Другими словами, «анаболические пути» мужчин были нарушены, даже у тех, кто потреблял много белка.
Исследователи пришли к выводу, что бодибилдерам, возможно, придется использовать другие стратегии питания, чтобы предотвратить эффект катаболического распада перед соревнованиями.
Поскольку анаболизм и катаболизм являются частью вашего метаболизма, эти процессы влияют на массу вашего тела. Помните: когда вы находитесь в анаболическом состоянии, вы наращиваете и поддерживаете свою мышечную массу. Когда вы находитесь в катаболическом состоянии, вы разрушаете или теряете общую массу, как жировую, так и мышечную.
Возможно, вы сможете управлять массой тела, поняв эти процессы и свой общий обмен веществ. И анаболический, и катаболический процессы со временем приводят к потере жира. Однако, что касается вашего веса на напольных весах в качестве эталона, все может стать немного сложнее.
- Если вы много занимаетесь анаболическими тренировками, вы склонны терять жир и поддерживать или даже наращивать мышечную массу. Мышцы плотнее жира, поэтому ваш вес и индекс массы тела могут оставаться выше, несмотря на худощавое телосложение.
- Катаболические тренировки, с другой стороны, могут помочь вам сбросить лишние килограммы, работая как с жиром, так и с мышцами. Вы будете весить меньше, но у вас также будет гораздо меньше критической мышечной массы.
Вы можете думать об этих процессах как об уравнении, позволяющем предсказать, сможете ли вы похудеть или набрать вес.
Возьмите катаболизм (сколько энергии производит ваше тело) и вычтите анаболизм (сколько энергии использует ваше тело). Если вы производите больше, чем используете, вы можете набрать вес, так как энергия откладывается в виде жира. Если вы используете больше, чем производите, может произойти обратное.
Конечно, есть исключения, особенно если у вас есть сопутствующие заболевания, влияющие на ваши гормоны.
Работая над своим телом по-разному, можно получить разные результаты. Кардио и силовые тренировки связаны с разными метаболическими процессами. Вот как получить максимальную отдачу от тренировок в зависимости от ваших целей.
Катаболические
Катаболические упражнения — это аэробные или кардиоупражнения. Они могут включать движения, такие как бег, плавание и езда на велосипеде, когда вы находитесь в стабильном активном состоянии в течение относительно длительного периода времени. По данным Американского колледжа спортивной медицины, старайтесь еженедельно выполнять как минимум следующее количество аэробных упражнений:
- 150 минут умеренной интенсивности или
- 75 минут интенсивной интенсивности
Это обычно разбивается на три до пяти дней обучения. Если у вас есть проблемы со здоровьем в анамнезе, проконсультируйтесь с врачом, чтобы получить разрешение, прежде чем начинать этот режим.
Частота сердечных сокращений, кровяное давление и частота дыхания повышаются во время катаболических упражнений.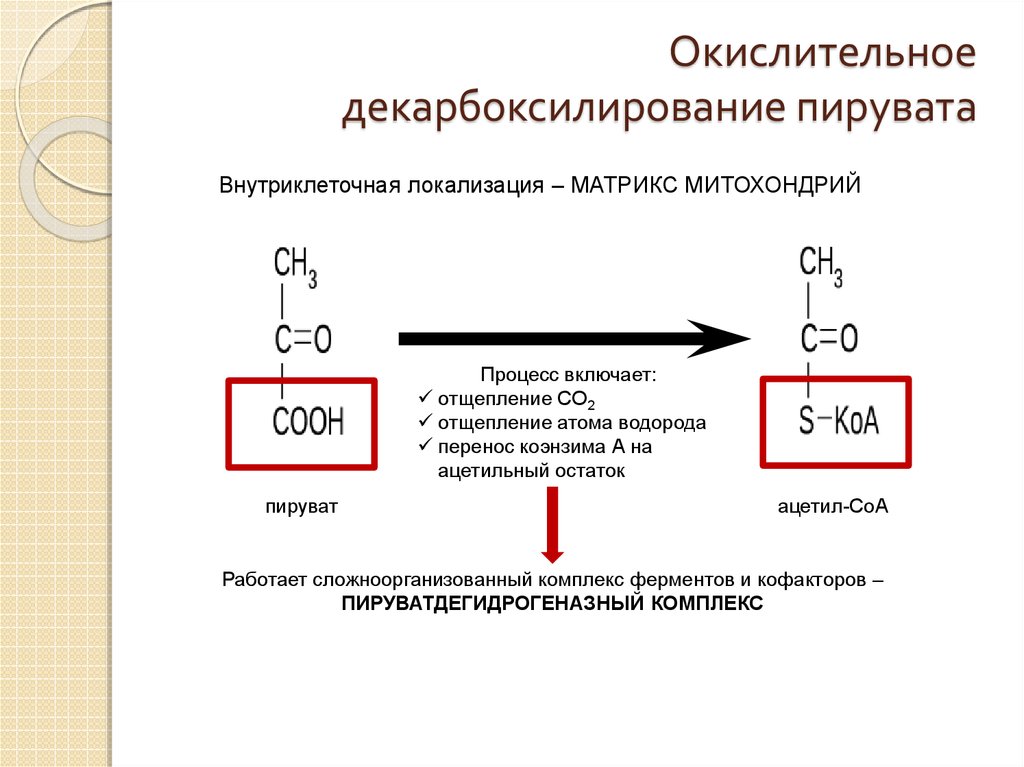 Тело расщепляет гликоген во время сеансов потоотделения, чтобы использовать его в качестве топлива. Когда у вас заканчиваются запасы углеводов, кортизол вашего тела использует аминокислоты для создания энергии.
Тело расщепляет гликоген во время сеансов потоотделения, чтобы использовать его в качестве топлива. Когда у вас заканчиваются запасы углеводов, кортизол вашего тела использует аминокислоты для создания энергии.
В результате катаболические упражнения могут помочь вам построить здоровое сердце и легкие. Но они также могут привести к потере массы тела, как мышечной, так и жировой. Он эффективно разрушает мышцы с течением времени. Некоторые из этих мышц могут быть восстановлены во время сна или отдыха в течение восьми или более часов посредством спонтанных анаболических процессов.
Анаболический
Если вы хотите нарастить мышечную массу, слишком долгое пребывание в катаболическом состоянии может сработать против вас. Это может уменьшить вашу мышечную массу и даже поставить под угрозу ваше общее состояние здоровья. Предотвращение катаболизма заключается в поддержании хорошего баланса между питанием, тренировками и восстановлением.
Мышцы можно поддерживать, тренируясь три или четыре раза в неделю.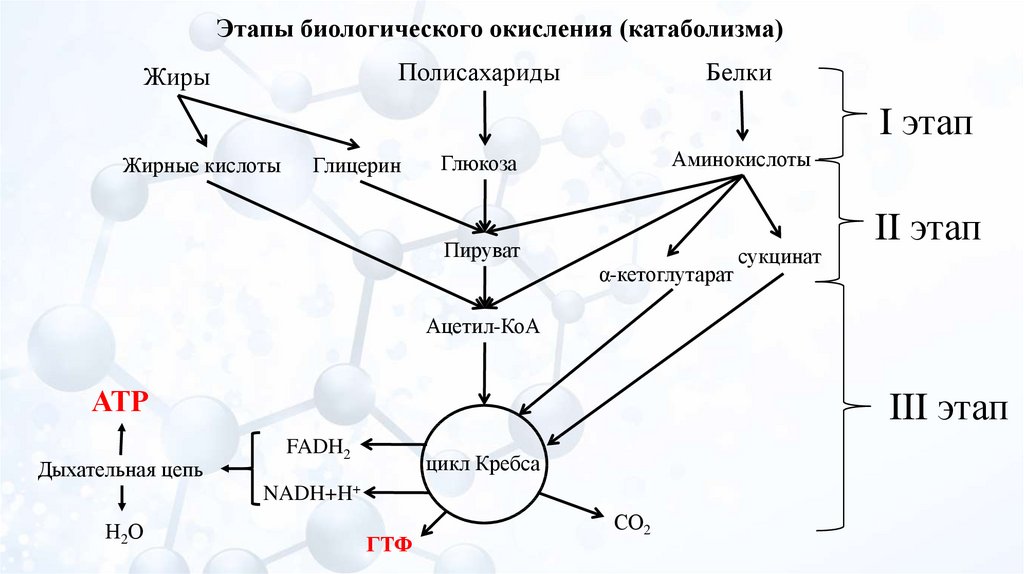 Следующая примерная программа упражнений может помочь вам оставаться в строительном или анаболическом состоянии. Попробуйте сосредоточиться на одной области в день, отдыхая между ними.
Следующая примерная программа упражнений может помочь вам оставаться в строительном или анаболическом состоянии. Попробуйте сосредоточиться на одной области в день, отдыхая между ними.
Анаболизм требует энергии для роста и развития. Катаболизм использует энергию для распада. Эти метаболические процессы работают вместе во всех живых организмах, чтобы делать такие вещи, как производство энергии и восстановление клеток.
Понимание разницы между анаболическими и катаболическими процессами может помочь вам достичь своих целей в спортзале и на весах. Чего бы вы ни хотели достичь, регулярные физические упражнения — кардио и силовые тренировки — плюс диета, богатая цельными продуктами, помогут вам оставаться здоровыми как внутри, так и снаружи.
Биохимия, катаболизм белков — StatPearls
Введение
Катаболизм белков — это расщепление белков на усваиваемые мономеры для дальнейшей деградации или повторной сборки. Катаболизм белков в просвете кишечника важен по нескольким причинам, одна из которых — мобилизация незаменимых аминокислот для всасывания.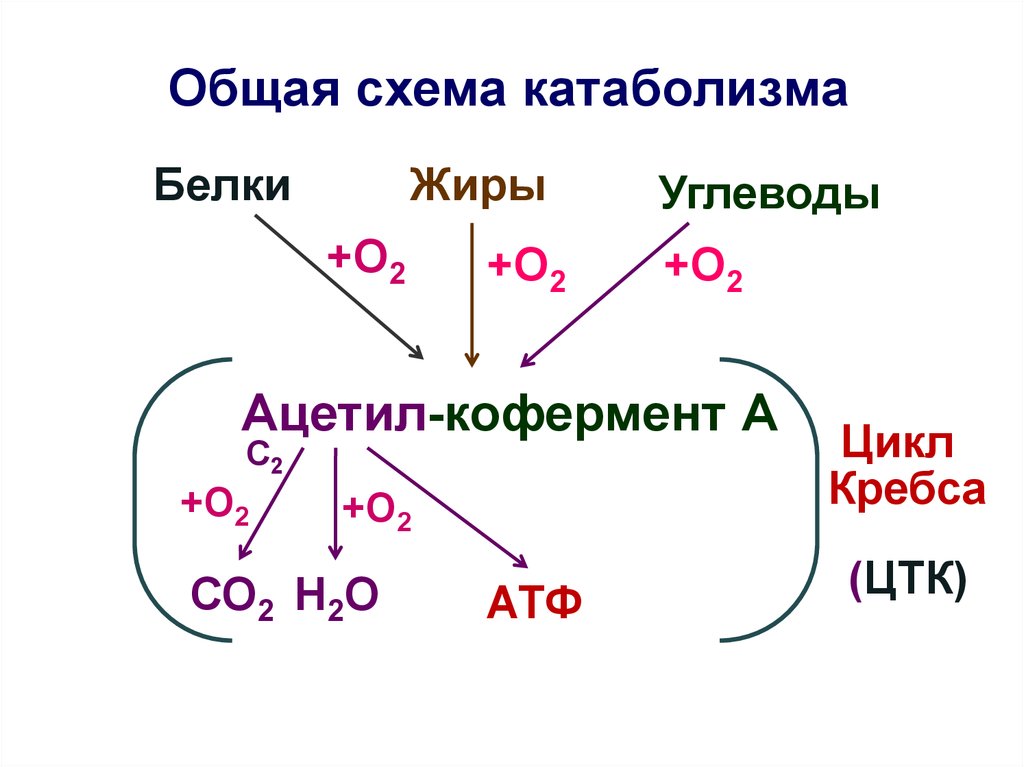 Незаменимые аминокислоты не могут синтезироваться в организме человека, но необходимы для биосинтеза жизненно важных белков, поэтому их единственным источником является расщепление полипептидов с помощью пищеварительных ферментов. Этот процесс начинается в желудке и продолжается в тонкой кишке. Большие белковые цепи разбираются, чтобы в конечном итоге оставить свободные аминокислоты, которые могут попасть в кровь и транспортироваться к различным клеткам тела для дальнейшего расщепления.
Незаменимые аминокислоты не могут синтезироваться в организме человека, но необходимы для биосинтеза жизненно важных белков, поэтому их единственным источником является расщепление полипептидов с помощью пищеварительных ферментов. Этот процесс начинается в желудке и продолжается в тонкой кишке. Большие белковые цепи разбираются, чтобы в конечном итоге оставить свободные аминокислоты, которые могут попасть в кровь и транспортироваться к различным клеткам тела для дальнейшего расщепления.
Эндопептидазы в форме зимогена высвобождаются слизистой оболочкой желудка и экзокринной частью поджелудочной железы для расщепления полипептидной цепи между определенными аминокислотными остатками. Находясь в меньшей форме, экзопептидазы удаляют последние аминокислоты с C- или N-конца дипептида или трипептида одну за другой, способствуя абсорбции в микроворсинках. Клетки могут использовать эти аминокислоты для создания жизненно важных белков или в качестве субстратов для производства энергии. Белки, созданные внутриклеточно, также могут катаболизироваться по тем же причинам. Внутриклеточные белки, которые либо были неправильно свернуты, либо больше не функционируют в клетке, также подвергаются внутриклеточному белковому катаболизму в лизосомах с помощью образования убиквитина и протеасом. Если клетка находится в низкоэнергетическом состоянии, свободные аминокислоты в цитозоле подвергаются дальнейшей деградации с образованием промежуточных продуктов цикла лимонной кислоты и направляются туда для производства АТФ. В то время как углеродный остов вступает в пути выработки энергии, азотный остов модифицируется и выводится в основном через почки.
Внутриклеточные белки, которые либо были неправильно свернуты, либо больше не функционируют в клетке, также подвергаются внутриклеточному белковому катаболизму в лизосомах с помощью образования убиквитина и протеасом. Если клетка находится в низкоэнергетическом состоянии, свободные аминокислоты в цитозоле подвергаются дальнейшей деградации с образованием промежуточных продуктов цикла лимонной кислоты и направляются туда для производства АТФ. В то время как углеродный остов вступает в пути выработки энергии, азотный остов модифицируется и выводится в основном через почки.
Основы
rКатаболический процесс начинается, когда протеолитические ферменты высвобождаются в форме зимогена из слизистой оболочки желудочно-кишечного тракта. После секретирования зимогены расщепляются на активные протеазы. Пепсин из слизистой оболочки желудка гидролизует более крупный полипептид на более мелкие полипептиды, которые впоследствии могут быть дополнительно расщеплены панкреатическими протеазами, высвобождаемыми в двенадцатиперстной кишке.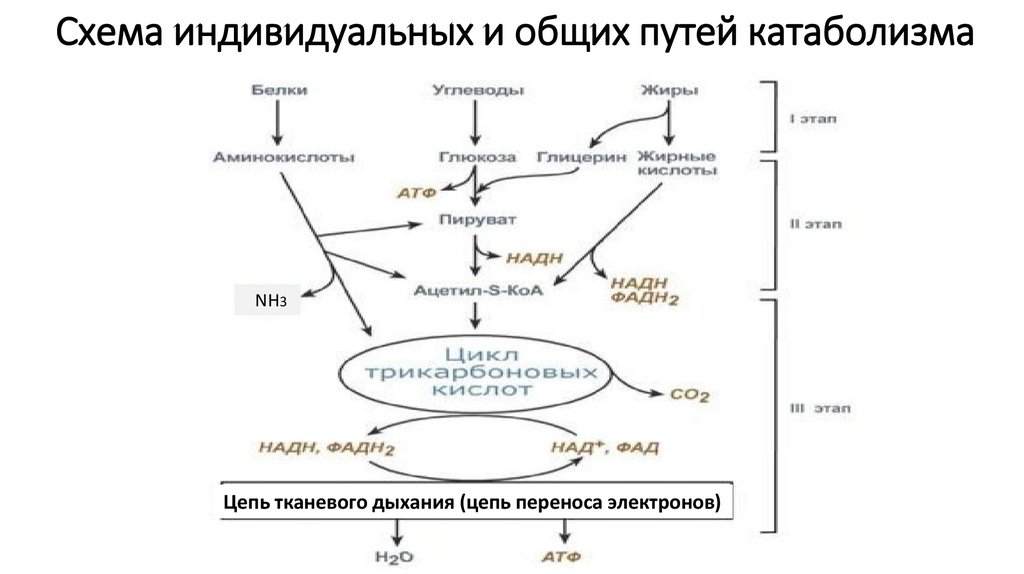 Трипсин, химотрипсин, эластаза и карбоксипептидазы, синтезируемые экзокринной частью поджелудочной железы, могут расщеплять полипептид в определенных точках расщепления на аминокислоты и олигопептиды. Аминопептидазы, расположенные на щеточной кайме эпителиальных клеток кишечника, гидролизуют оставшиеся олигопептиды до аминокислот, которые затем всасываются в кровоток через трансмембранные транспортные системы. Существуют как облегченные, так и активные транспортные механизмы для транспорта аминокислот в клетки.
Трипсин, химотрипсин, эластаза и карбоксипептидазы, синтезируемые экзокринной частью поджелудочной железы, могут расщеплять полипептид в определенных точках расщепления на аминокислоты и олигопептиды. Аминопептидазы, расположенные на щеточной кайме эпителиальных клеток кишечника, гидролизуют оставшиеся олигопептиды до аминокислот, которые затем всасываются в кровоток через трансмембранные транспортные системы. Существуют как облегченные, так и активные транспортные механизмы для транспорта аминокислот в клетки.
Катаболизм белков является жизненно важной частью клеточного обмена. Когда цитозольные белки, такие как сигнальные или структурные пептиды, больше не нужны, они должны расщепляться в лизосомах для создания новых белков, которые могут выполнять необходимые метаболические функции. Если полученные аминокислоты не используются для синтеза новых белков для жизненно важных внутриклеточных функций, они могут войти в цикл лимонной кислоты для выработки энергии. Когда запрограммированная смерть является судьбой клетки, катепсины и другие катаболические ферменты работают вместе в процессе апоптоза.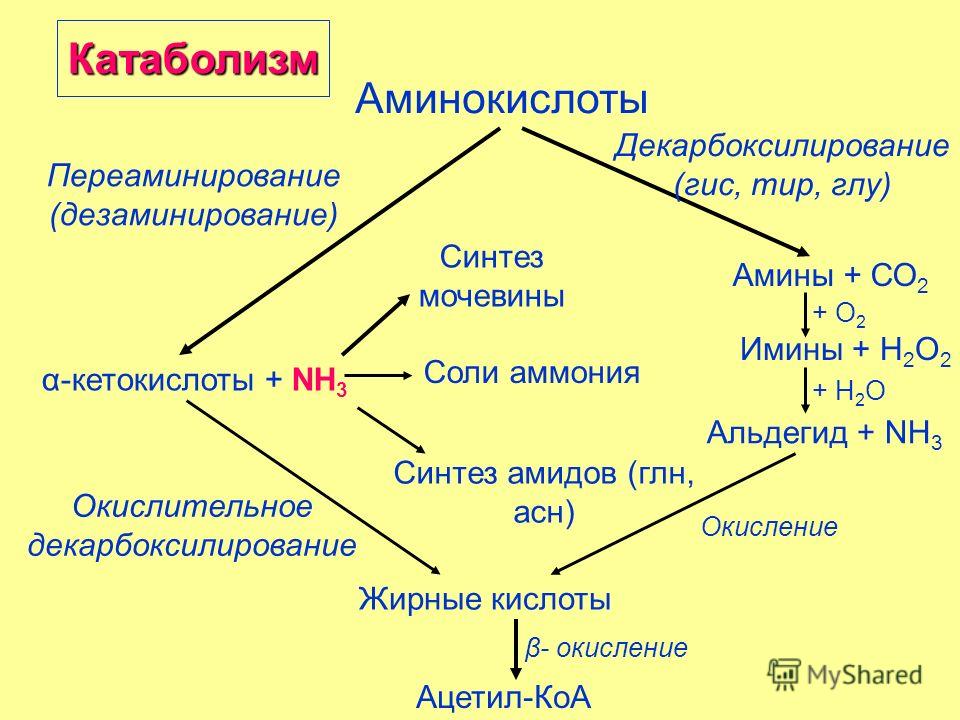
Желудочные пептидазы: главные клетки слизистой оболочки желудка секретируют пепсиноген.[1] С помощью соляной кислоты, выделяемой париетальными клетками желудка, пепсиноген изменяет конформацию в сильнокислой среде желудка и расщепляется до активной протеазы — пепсина. Кислота также денатурирует пищевые белки и частично разворачивает их для облегчения протеолиза. Пепсин обычно расщепляет пептидные связи, содержащие карбоксильную группу, от кислой или ароматической аминокислоты; однако его широкая специфичность позволяет ему расщеплять пептидные связи и в других точках. Более мелкие пептиды, а иногда и свободные аминокислоты, затем попадают в двенадцатиперстную кишку, где встречаются с пептидазами, секретируемыми поджелудочной железой.
Панкреатические и кишечные пептидазы: Экзокринная часть поджелудочной железы секретирует различные пищеварительные ферменты, включая амилазу, липазу, колипазу, бикарбонат и неактивные протеазы. Бикарбонат, высвобождаемый в просвет кишечника, повышает рН и позволяет протеазам поджелудочной железы активироваться из их зимогенной формы.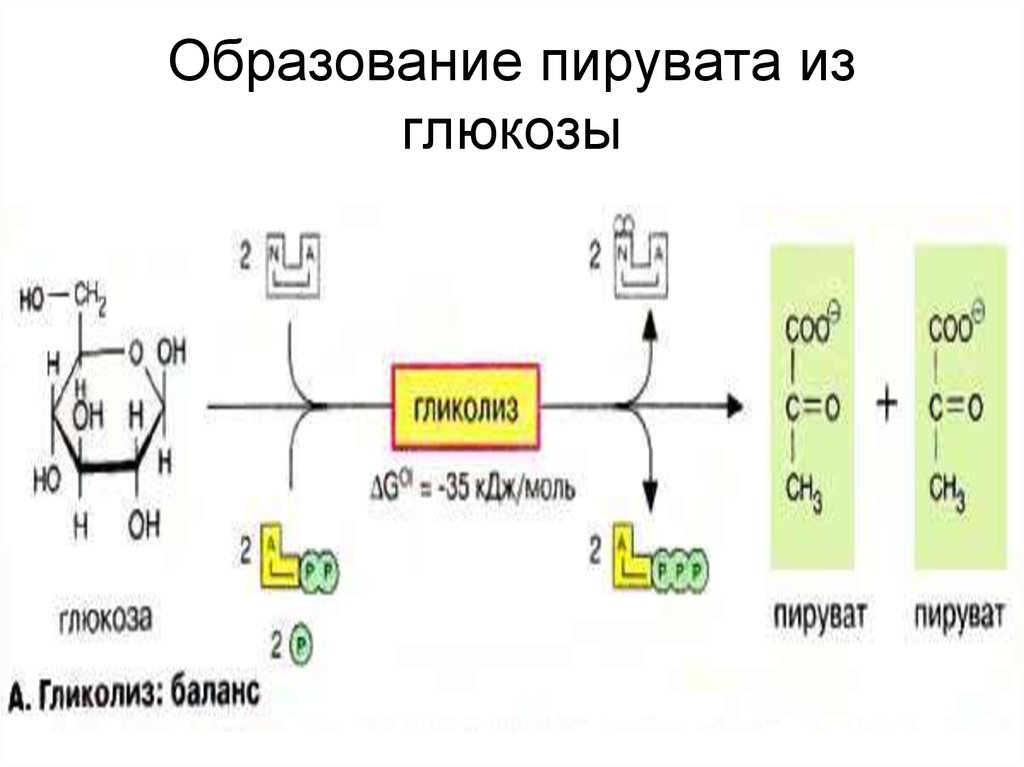 Одна конкретная протеаза, трипсин, является наиболее важной для пищеварительного процесса, потому что она сама расщепляет белки, а также активирует другие протеазы из их неактивных форм. Трипсин отщепляется от проферментной формы трипсиногена энтеропептидазой. Затем трипсин продолжает активировать химотрипсиноген, проэластазу и прокарбоксипептидазы в химотрипсин, эластазу и карбоксипептидазы соответственно. Трипсин гидролизует пептидные связи с карбоксильной группой аргинина или лизина. С другой стороны, химотрипсин имеет тенденцию воздействовать на пептидные связи между гидрофобными аминокислотами.[4] Трипсин и химотрипсин относятся к категории сериновых протеаз и имеют сходный метод протеолиза. Они образуют каталитический тетраэдрический промежуточный продукт, располагая каталитическую триаду таким образом, что протоны, образующие водородные связи, могут разорвать пептидную связь между двумя аминокислотами белка-субстрата.[4] Эти два фермента также очень похожи по своему карману связывания S1, который имеет основную аминокислоту в трипсине и гидрофобную аминокислоту в химотрипсине.
Одна конкретная протеаза, трипсин, является наиболее важной для пищеварительного процесса, потому что она сама расщепляет белки, а также активирует другие протеазы из их неактивных форм. Трипсин отщепляется от проферментной формы трипсиногена энтеропептидазой. Затем трипсин продолжает активировать химотрипсиноген, проэластазу и прокарбоксипептидазы в химотрипсин, эластазу и карбоксипептидазы соответственно. Трипсин гидролизует пептидные связи с карбоксильной группой аргинина или лизина. С другой стороны, химотрипсин имеет тенденцию воздействовать на пептидные связи между гидрофобными аминокислотами.[4] Трипсин и химотрипсин относятся к категории сериновых протеаз и имеют сходный метод протеолиза. Они образуют каталитический тетраэдрический промежуточный продукт, располагая каталитическую триаду таким образом, что протоны, образующие водородные связи, могут разорвать пептидную связь между двумя аминокислотами белка-субстрата.[4] Эти два фермента также очень похожи по своему карману связывания S1, который имеет основную аминокислоту в трипсине и гидрофобную аминокислоту в химотрипсине. Тем не менее, особенности и механизмы имеют гораздо большую сложность с их динамическими свойствами, структурная гибкость является одним из наиболее важных.
Тем не менее, особенности и механизмы имеют гораздо большую сложность с их динамическими свойствами, структурная гибкость является одним из наиболее важных.
Эластаза, также сериновая протеаза, расщепляет эластин, а также белки с небольшими гидрофобными боковыми цепями, такие как глицин или аланин. Ацинарные клетки поджелудочной железы выделяют две формы эластазы, причем эластаза II обладает более широкой специфичностью, чем эластаза I.[5] Нуклеофильная аминокислота в активном центре эндопептидазы гидролизует пептидную связь на более мелкие пептидные цепи, которые нуждаются в дальнейшей деградации; это может происходить с помощью экзопептидаз, которые удаляют одну аминокислоту с конца белковой цепи. Примером экзопептидазы является активируемая трипсином панкреатическая протеаза карбоксипептидаза. Существует две формы этого протеолитического фермента, А и В. Карбоксипептидаза А имеет тенденцию отщеплять гидрофобные аминокислоты от пептидной цепи, а карбоксипептидаза В отщепляет основные аминокислоты от пептида. Эпителиальные клетки кишечника также содержат экзопептидазы на щеточной кайме, называемые аминопептидазами, которые высвобождают отдельные аминокислоты, транспортируемые в клетки.[6]
Эпителиальные клетки кишечника также содержат экзопептидазы на щеточной кайме, называемые аминопептидазами, которые высвобождают отдельные аминокислоты, транспортируемые в клетки.[6]
Внутриклеточный обмен белков: белки внутри клетки также подвергаются катаболизму для восполнения внутриклеточного пула аминокислот. Хотя у всех белков есть период полураспада, некоторые из них разлагаются в течение нескольких минут, а некоторые — в течение нескольких часов или дней. Некоторыми примерами сильно синтезированных и деградированных белков являются белки мышечных клеток, гемоглобин, эпителиальные клетки желудочно-кишечного тракта и сами протеолитические ферменты. Многие из этих белков расщепляются лизосомальными протеазами, так что составляющие их аминокислоты можно использовать для восстановления белков, потребности которых зависят от текущего физиологического состояния клетки. Например, в периоды голодания аминокислоты, высвобождаемые при катаболизме мышечных белков, могут направляться на глюконеогенез и выступать в качестве источника энергии. В состоянии сытости или во время метаболического ацидоза глютамин может быть топливом для почечной системы. Скелетные мышцы могут поглощать аланин, аспартат и глутамат и посредством переаминирования образовывать полезные промежуточные продукты цикла Кребса.
В состоянии сытости или во время метаболического ацидоза глютамин может быть топливом для почечной системы. Скелетные мышцы могут поглощать аланин, аспартат и глутамат и посредством переаминирования образовывать полезные промежуточные продукты цикла Кребса.
Клеточный
Трансмембранный транспорт: работа эндопептидаз, химотрипсина, эластазы и карбоксипептидазы и экзопептидаз, карбоксипептидазы и аминопептидазы, в конечном итоге дает свободные аминокислоты. Существуют механизмы облегченной диффузии и активного транспорта для поглощения этих соединений из просвета кишечника посредством вторичного активного транспорта [7]. Аминокислоты пересекают щеточную границу кишечных клеток через натрий-зависимую транспортную систему, в которой низкая внутриклеточная концентрация натрия обеспечивает совместное проникновение натрия и аминокислоты. Натрий-калиевая АТФаза на базолатеральной мембране поддерживает низкую концентрацию натрия внутри клетки. Как только аминокислоты попадают в клетку на апикальной мембране, они транспортируются вниз по градиенту на базальной мембране в кровоток, обычно в портальную циркуляцию. Шесть различных натрий-зависимых переносчиков аминокислот перекрываются по своей специфичности в отношении аминокислот, которые они транспортируют через апикальную мембрану щеточной каймы; однако носители отдают предпочтение типам транспортируемых аминокислот. Предпочтительные аминокислоты включают нейтральные аминокислоты, кислые аминокислоты, основные аминокислоты, цистин, пролин и гидроксипролин. Натрийзависимые переносчики аминокислот в клетках просвета кишечника также присутствуют в почечном эпителии в различных изоферментных формах.[8] С другой стороны, облегченные транспортные системы на базальной стороне сравнимы с обнаруженными в других типах тканей. Аминокислоты также могут всасываться из крови через эти облегченные транспортеры и использоваться в качестве субстратов для цикла лимонной кислоты для выработки энергии — двунаправленность облегченных транспортеров способствует выживанию кишечного эпителия во время голодания.
Шесть различных натрий-зависимых переносчиков аминокислот перекрываются по своей специфичности в отношении аминокислот, которые они транспортируют через апикальную мембрану щеточной каймы; однако носители отдают предпочтение типам транспортируемых аминокислот. Предпочтительные аминокислоты включают нейтральные аминокислоты, кислые аминокислоты, основные аминокислоты, цистин, пролин и гидроксипролин. Натрийзависимые переносчики аминокислот в клетках просвета кишечника также присутствуют в почечном эпителии в различных изоферментных формах.[8] С другой стороны, облегченные транспортные системы на базальной стороне сравнимы с обнаруженными в других типах тканей. Аминокислоты также могут всасываться из крови через эти облегченные транспортеры и использоваться в качестве субстратов для цикла лимонной кислоты для выработки энергии — двунаправленность облегченных транспортеров способствует выживанию кишечного эпителия во время голодания.
Транспортеры на апикальной поверхности мышц, печени и других тканей поглощают аминокислоты из крови и концентрируют их. Хотя они похожи на люминальные натрий-зависимые переносчики аминокислот в эпителии кишечника, эти переносчики различаются по своей генетической основе, белковому составу и специфичности.[8] Многие ткани экспрессируют A-систему, ASC-систему и L-систему для транспорта аминокислот в клетку; однако из них L-система является единственной без натрий-зависимого механизма. Клетки кишечника и почек экспрессируют В-систему, Х-систему и иминосистему [9].] Определенный тип ткани может содержать определенный тип переносчика аминокислот, не встречающийся в других тканях, например, экспрессия N-системы печени и ее специфичность в отношении абсорбции глутамина. Изоформа N-системы поглощения глутамина может экспрессироваться в тканях другого типа. Однако он будет иметь другие свойства и состав, чем тот, который присутствует в печени. Каждая система отличается своей специфичностью в отношении аминокислот и имеет значение при различных патологиях.
Хотя они похожи на люминальные натрий-зависимые переносчики аминокислот в эпителии кишечника, эти переносчики различаются по своей генетической основе, белковому составу и специфичности.[8] Многие ткани экспрессируют A-систему, ASC-систему и L-систему для транспорта аминокислот в клетку; однако из них L-система является единственной без натрий-зависимого механизма. Клетки кишечника и почек экспрессируют В-систему, Х-систему и иминосистему [9].] Определенный тип ткани может содержать определенный тип переносчика аминокислот, не встречающийся в других тканях, например, экспрессия N-системы печени и ее специфичность в отношении абсорбции глутамина. Изоформа N-системы поглощения глутамина может экспрессироваться в тканях другого типа. Однако он будет иметь другие свойства и состав, чем тот, который присутствует в печени. Каждая система отличается своей специфичностью в отношении аминокислот и имеет значение при различных патологиях.
Лизосомальная деградация: если белки больше не нужны или синтезируются неправильно, внутриклеточные белки расщепляются с помощью лизосом и протеасомного комплекса. Белки попадают в лизосому посредством аутофагии, строго регулируемого процесса, при котором везикулы сливаются с мембраной лизосомы.[10] Аутофагии могут способствовать низкоэнергетические состояния, такие как низкий уровень АТФ или высокий уровень АМФ в клетке. Поскольку AMP-активированная протеинкиназа активируется при высоких уровнях AMP, она может фосфорилировать комплексы туберозного склероза 1 и 2, что приводит к активации Rheb-GTPase. Эта активация важна, потому что она инактивирует Rheb и, таким образом, также инактивирует mTOR, главный ингибитор аутофагии; именно так низкоэнергетические состояния способствуют катаболизму белков. И наоборот, активация комплексов туберозного склероза 1 и 2 инсулином через Akt-киназу приводит к активизации mTOR. Активированный mTOR способствует синтезу белка, а не деградации.
Белки попадают в лизосому посредством аутофагии, строго регулируемого процесса, при котором везикулы сливаются с мембраной лизосомы.[10] Аутофагии могут способствовать низкоэнергетические состояния, такие как низкий уровень АТФ или высокий уровень АМФ в клетке. Поскольку AMP-активированная протеинкиназа активируется при высоких уровнях AMP, она может фосфорилировать комплексы туберозного склероза 1 и 2, что приводит к активации Rheb-GTPase. Эта активация важна, потому что она инактивирует Rheb и, таким образом, также инактивирует mTOR, главный ингибитор аутофагии; именно так низкоэнергетические состояния способствуют катаболизму белков. И наоборот, активация комплексов туберозного склероза 1 и 2 инсулином через Akt-киназу приводит к активизации mTOR. Активированный mTOR способствует синтезу белка, а не деградации.
Убиквитинирование — это процесс, при котором молекула убиквитина ковалентно присоединяется к белкам, подлежащим деградации, и взаимодействует с протеасомой внутри лизосомы для расщепления указанного белка с использованием АТФ-зависимого процесса.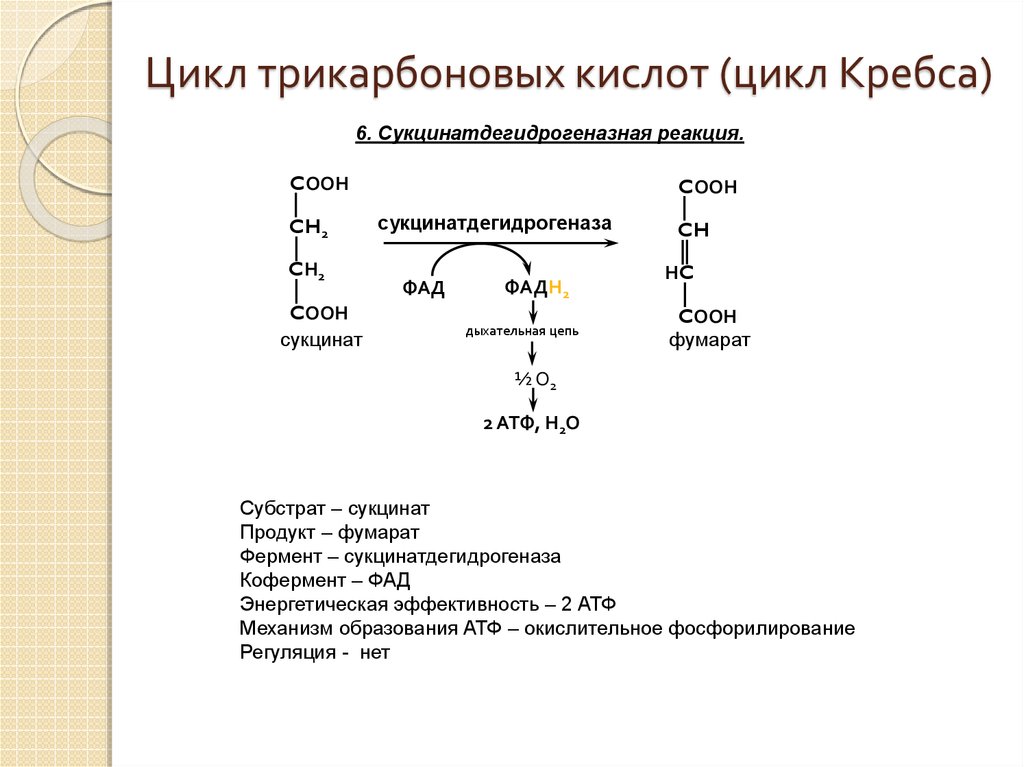 [12] Убиквитин должен сначала активироваться через E1, E2 и E3, прежде чем стать ковалентно присоединенным к эпсилон-аминогруппе боковых цепей лизина через ферментный комплекс. Обычно белок получает больше молекул убиквитина на концевом лизине, образуя хвост. После формирования хвоста убиквитинированный белок отделяется от лигирующего ферментного комплекса и перемещается к протеасоме. Протеасома представляет собой цилиндрический протеазный комплекс 26S с несколькими каталитическими центрами внутри. Протеасомный комплекс 26S имеет два альфа- и два бета-кольца, содержащие три внутренних каталитических центра, подобных трипсину, химотрипсину и постглутамилпептидилгидролазе. Конструкция четырехкольцевой структуры такова, что альфа-кольца играют стабилизирующую роль, тогда как бета-субъединицы являются активными каталитическими частями комплекса.[13] Он сохраняет молекулы убиквитина, но использует гидролиз АТФ для разворачивания и перемещения белка глубже в комплекс и высвобождения свободных аминокислот.
[12] Убиквитин должен сначала активироваться через E1, E2 и E3, прежде чем стать ковалентно присоединенным к эпсилон-аминогруппе боковых цепей лизина через ферментный комплекс. Обычно белок получает больше молекул убиквитина на концевом лизине, образуя хвост. После формирования хвоста убиквитинированный белок отделяется от лигирующего ферментного комплекса и перемещается к протеасоме. Протеасома представляет собой цилиндрический протеазный комплекс 26S с несколькими каталитическими центрами внутри. Протеасомный комплекс 26S имеет два альфа- и два бета-кольца, содержащие три внутренних каталитических центра, подобных трипсину, химотрипсину и постглутамилпептидилгидролазе. Конструкция четырехкольцевой структуры такова, что альфа-кольца играют стабилизирующую роль, тогда как бета-субъединицы являются активными каталитическими частями комплекса.[13] Он сохраняет молекулы убиквитина, но использует гидролиз АТФ для разворачивания и перемещения белка глубже в комплекс и высвобождения свободных аминокислот.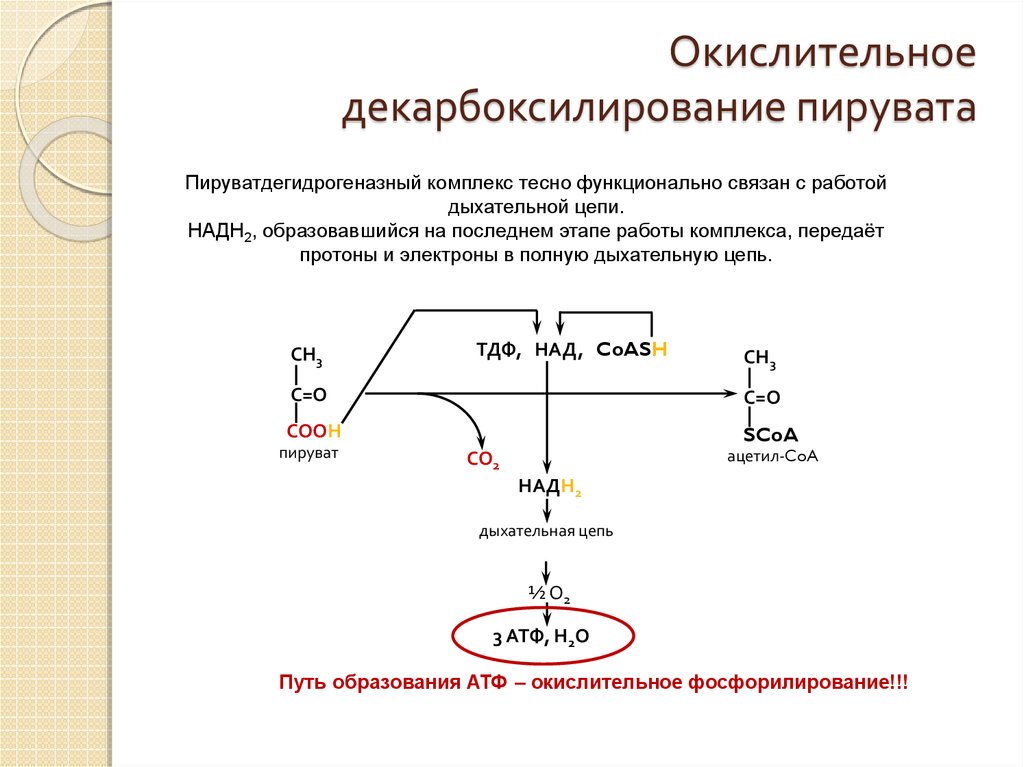 [10] Белки, гидролизуемые этим процессом, известны как последовательности PEST, названные так в честь общих аминокислот, включенных в цепь. Аминокислоты пролин, глутамат, серин и треонин находятся в высоких концентрациях в белках последовательности PEST.[14]
[10] Белки, гидролизуемые этим процессом, известны как последовательности PEST, названные так в честь общих аминокислот, включенных в цепь. Аминокислоты пролин, глутамат, серин и треонин находятся в высоких концентрациях в белках последовательности PEST.[14]
Оказавшись внутри лизосомы, лизосомальные протеазы, называемые катепсины, могут также расщеплять цитозольные белки, помеченные для катаболизма. Катепсины представляют собой еще один тип цистеиновых протеаз, присутствующих в перицеллюлярной среде, ядрах цитозоля и митохондриях.[15] Передача сигналов фактора некроза опухоли, клеточный стресс и каспазы могут запускать лизосомальное высвобождение катепсина, расщепляющего внутриклеточные белки, такие как Bid, что приводит к последующей активации апоптотического каскада каспаз [16].
Молекулярный
Судьба внутриклеточного пула аминокислот сильно зависит от метаболического состояния отдельной ткани и организма в целом. В сытом физиологическом состоянии аминокислоты могут расщепляться дальше до их углеродного и азотного скелетов. В то время как углеродный скелет может подвергаться окислению для получения энергии, азотный компонент выводится из организма через азотсодержащие отходы. Первоначально азот присутствует в виде аммиака, ядовитого для человеческого организма вещества. Печень превращает токсичный аммиак в мочевину посредством цикла мочевины в нетоксичную водорастворимую форму азота, которая легко выводится почками.
В то время как углеродный скелет может подвергаться окислению для получения энергии, азотный компонент выводится из организма через азотсодержащие отходы. Первоначально азот присутствует в виде аммиака, ядовитого для человеческого организма вещества. Печень превращает токсичный аммиак в мочевину посредством цикла мочевины в нетоксичную водорастворимую форму азота, которая легко выводится почками.
По мере того, как азотный скелет отбрасывается, углеродный скелет аминокислот может использоваться для производства энергии путем окисления в пируват (триптофан, глицин, аланин, серин, цистеин) и ацетил-КоА. Пируват и ацетил-Коэнзим А являются субстратами цикла лимонной кислоты, в конечном итоге производящего АТФ и углекислый газ. Ацетил-КоА также может образовывать кетоновые тела, выбрасываемые в кровоток для использования в качестве источника энергии определенными тканями. Аминокислоты, которые превращаются в ацетил-КоА или ацетоацетат, называются кетогенными из-за их склонности превращаться в кетоновые тела. [17] Например, лизин и лейцин являются одновременно кетогенными и незаменимыми аминокислотами.
[17] Например, лизин и лейцин являются одновременно кетогенными и незаменимыми аминокислотами.
Другая возможная судьба — превращение углеродного скелета в промежуточные продукты цикла лимонной кислоты альфа-кетоглутарат (аргинин, гистидин, глутамин, пролин, глутамат), сукцинил-КоА (валин, треонин, изолейцин, метионин), фумарат (аспартат, тирозин, фенилаланин) и оксалоацетат (аспартат, аспарагин) [18]. Стоит отметить, что малат, промежуточное звено цикла лимонной кислоты, может перемещаться по кровотоку в печень и участвовать в глюконеогенезе.[19] Если аминокислота может стать предшественником глюкозы, ее называют глюкогенной. Из-за различных промежуточных продуктов и точек входа в цикл Кребса аминокислоты могут быть как глюкогенными, так и кетогенными.
Тестирование
Убиквитинирование — это начало катаболизма внутриклеточных белков. Проверка функции этого процесса для понимания конкретных патологий включает объединение культивируемых клеток с плазмидами, содержащими белок с убиквитином, меченным эпитопом.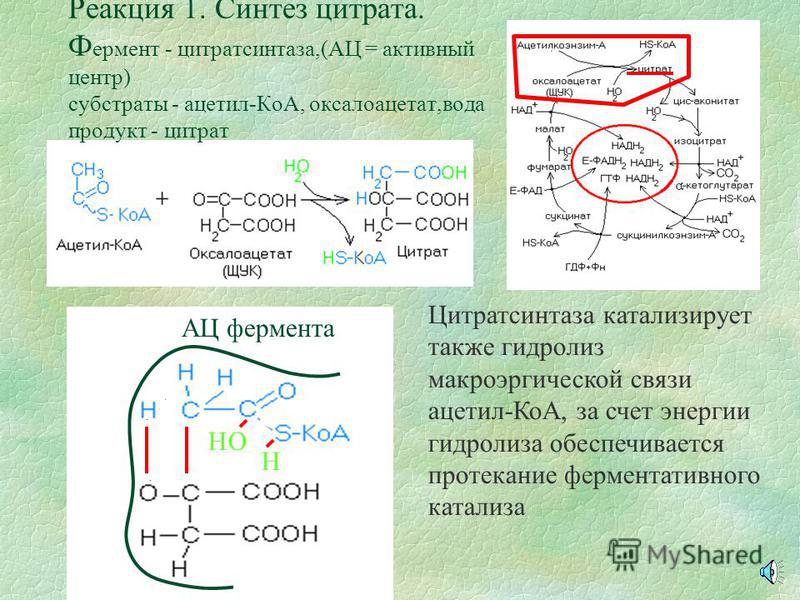 Следующие шаги включают добавление стабилизирующих буферов, лизис и обработку клеток ультразвуком с последующими раундами инкубации. Поскольку окончательная форма анализа включает иммуноблоттинг в геле SDS-PAGE, должны образовываться конъюгированные антитела против белка [20]. Существуют также способы анализа процесса убиквитинирования in vitro, а не in vivo.[20]
Следующие шаги включают добавление стабилизирующих буферов, лизис и обработку клеток ультразвуком с последующими раундами инкубации. Поскольку окончательная форма анализа включает иммуноблоттинг в геле SDS-PAGE, должны образовываться конъюгированные антитела против белка [20]. Существуют также способы анализа процесса убиквитинирования in vitro, а не in vivo.[20]
Существуют способы определения ферментов, выделяемых экзокринной поджелудочной железой, трипсина, химотрипсина и эластазы. Одним из тестов является фекальный тест на эластазу, при котором стул анализируется на концентрацию эластазы, что подтверждает проходимость панкреатического протока, секреторную функцию экзокринной поджелудочной железы и наличие активирующего трипсина. Этот анализ является наиболее широко используемым тестом из-за его высокой специфичности и неинвазивного метода. Более инвазивным тестом является эндоскопический тест функции поджелудочной железы, который доступен только в некоторых медицинских учреждениях.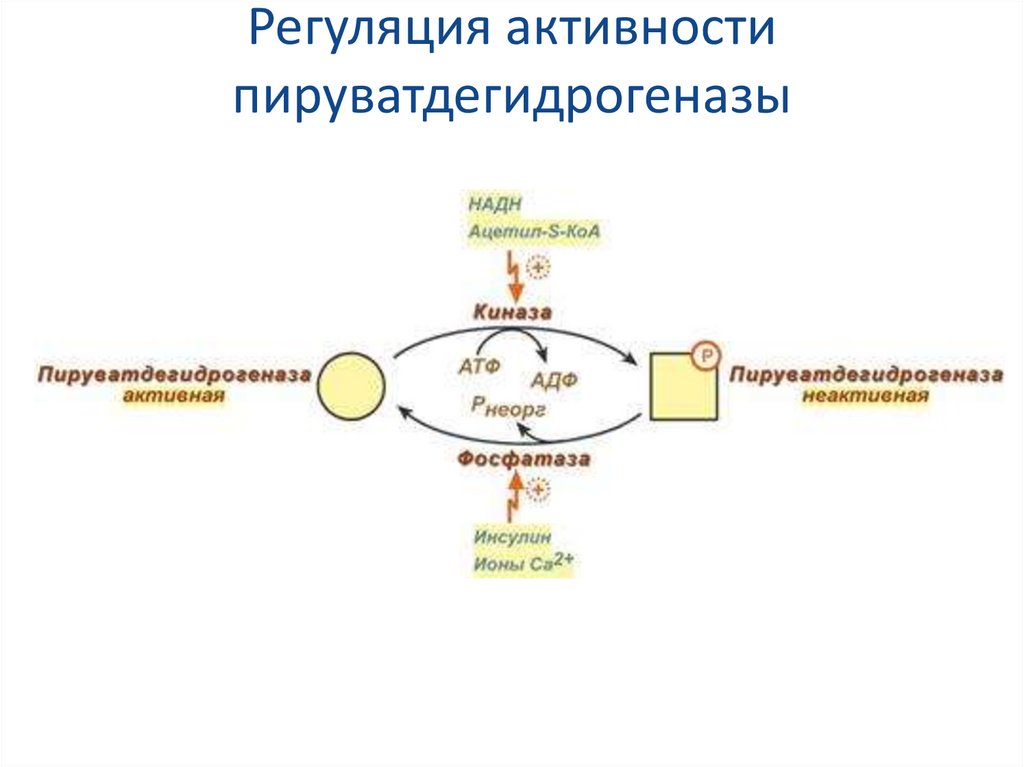 В этом тесте пациенту вводят седативное средство и вводят секретин перед эндоскопической процедурой.[22] Эндоскоп отсасывает другую жидкость из верхних отделов желудочно-кишечного тракта по пути в двенадцатиперстную кишку. Затем образцы секрета поджелудочной железы берут из большого сосочка и анализируют на бикарбонат в лаборатории.[22] Обычно пробы отбирают с интервалом в 15, 30, 45 и 60 минут. Оценка секреции и активности этих ферментов важна для оценки патологий мальабсорбции белков.
В этом тесте пациенту вводят седативное средство и вводят секретин перед эндоскопической процедурой.[22] Эндоскоп отсасывает другую жидкость из верхних отделов желудочно-кишечного тракта по пути в двенадцатиперстную кишку. Затем образцы секрета поджелудочной железы берут из большого сосочка и анализируют на бикарбонат в лаборатории.[22] Обычно пробы отбирают с интервалом в 15, 30, 45 и 60 минут. Оценка секреции и активности этих ферментов важна для оценки патологий мальабсорбции белков.
Патофизиология
Кистозный фиброз представляет собой аутосомно-рецессивную мутацию в гене CFTR, который кодирует белки, составляющие поры хлоридных каналов.[23] Тяжесть заболевания различна, но некоторые черты являются общими для всех форм, например, образование густых слизистых пробок в протоке поджелудочной железы, легких, мочеполовой системе у мужчин. Поскольку для всасывания белки должны расщепляться, слизистая пробка, блокирующая высвобождение зимогена из экзокринной части поджелудочной железы, приводит к отсутствию катаболизма жизненно важных белков в просвете кишечника.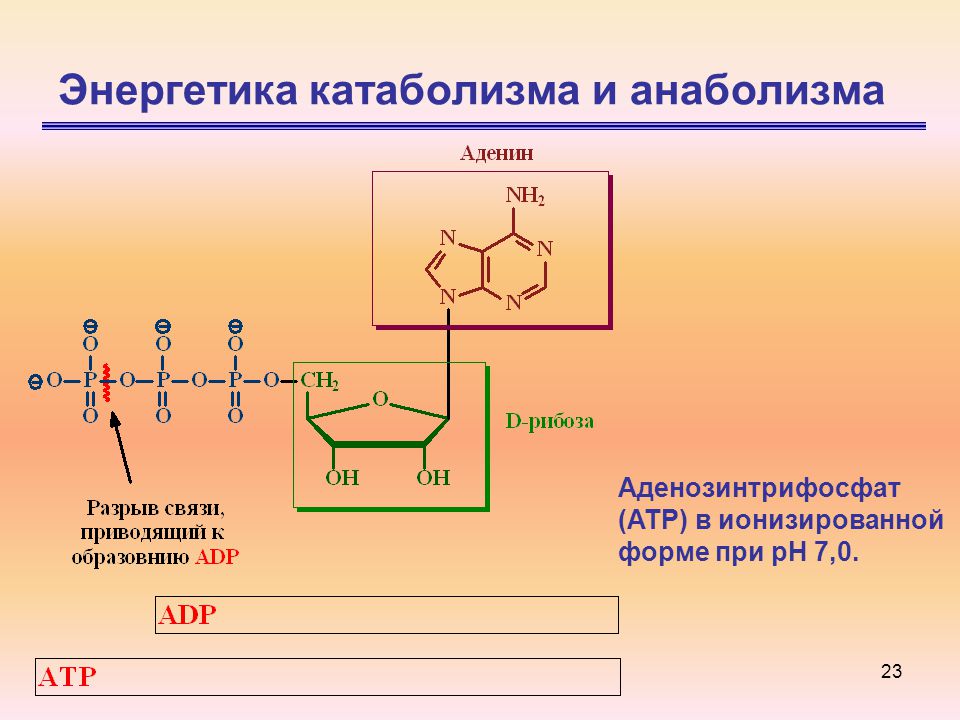 [23] Пациенты с муковисцидозом имеют тяжелый дефицит белка и должны получать добавки экзогенных ферментов поджелудочной железы, хотя следует упомянуть, что побочные эффекты длительного приема ферментов поджелудочной железы в настоящее время неизвестны [24].
[23] Пациенты с муковисцидозом имеют тяжелый дефицит белка и должны получать добавки экзогенных ферментов поджелудочной железы, хотя следует упомянуть, что побочные эффекты длительного приема ферментов поджелудочной железы в настоящее время неизвестны [24].
Квашиоркор — еще один серьезный дефицит белка; однако это связано с недостаточным потреблением белка, а не с генетическим заболеванием. Пищеварительные ферменты присутствуют в квашиоркоре; однако из-за того, что потребляется мало белка, присутствуют симптомы дефицита белка. У истощенных людей с квашиоркором жизненно важные реакции в организме поддерживаются за счет внутриклеточного катаболизма белков. Потребность в доступных незаменимых аминокислотах приводит к значительному снижению периферической мышечной массы из-за разрушения мышц.[10] Дефицит белка также приводит к снижению уровня альбумина в сыворотке, что снижает внутрисосудистое коллоидное давление, что приводит к отеку и вздутию живота. Тяжелый квашиоркор быстро ухудшается, поскольку пищеварительные ферменты перестают вырабатываться, а эпителий тонкой кишки не регенерируется.
Дефект в механизмах облегченного и активного транспорта может привести к патологическим состояниям мальабсорбции. Цистинурия и болезнь Хартнупа являются генетическими нарушениями, затрагивающими мембранные переносчики аминокислот, но различаются по группам транспортируемых аминокислот и поэтому проявляются по-разному клинически.[9] Цистинурия — нарушение транспорта основных аминокислот через мембраны почечной и желудочно-кишечной систем. Отличительной чертой этого расстройства является образование камней в почках из-за неспособности резорбировать основную аминокислоту цистин из клубочкового фильтрата. Поскольку транспортер также присутствует в эпителии тонкой кишки, цистин и другие основные аминокислоты плохо всасываются из просвета кишечника. Механически похожее заболевание, болезнь Хартнупа представляет собой дефект транспорта нейтральных аминокислот через почечную и кишечную систему. Поскольку триптофан является одной из плохо усваиваемых нейтральных аминокислот, при медицинском осмотре выявляются симптомы пеллагры в виде сыпи, диареи и психических расстройств.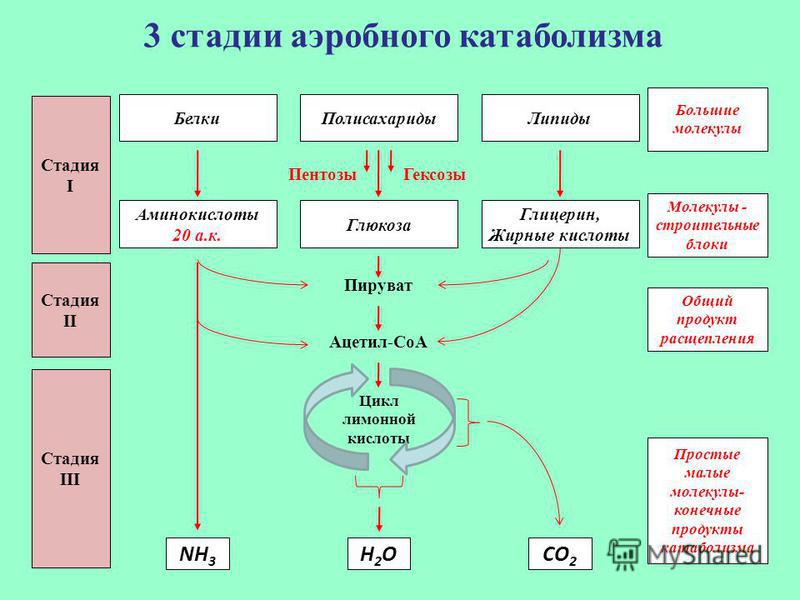 В отличие от пеллагры, добавки с ниацином мало уменьшают симптомы и должны выявить необходимость генетического тестирования.
В отличие от пеллагры, добавки с ниацином мало уменьшают симптомы и должны выявить необходимость генетического тестирования.
Клиническое значение
Надлежащее функционирование белкового катаболизма имеет первостепенное значение для поддержания метаболических потребностей человеческого организма. Разрушение больших полипептидных цепей с высвобождением свободных незаменимых и заменимых аминокислот обеспечивает клетки необходимыми субстратами для синтеза белка или выработки энергии. Расщепление внутриклеточного белка важно для нормального обмена, а также при физиологических состояниях недоедания и истощения для мобилизации аминокислот для экспорта для поддержки энергетических потребностей жизненно важных органов. Дефекты белкового катаболизма могут привести к разнообразным клиническим проявлениям, поражающим почти все системы органов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Каталожные номера
- 1.
Magee DF. Пепсин. Мед Клин Норт Ам. 1974 г., ноябрь; 58 (6): 1277-87. [PubMed: 4610293]
- 2.
Fruton JS. Специфичность и механизм действия пепсина. Adv Enzymol Relat Areas Mol Biol. 1970; 33:401-43. [PubMed: 48]
- 3.
Ji B, Logsdon CD. Переваривание новой информации о роли трипсина при панкреатите. Гастроэнтерология. 2011 декабрь; 141 (6): 1972-5. [Статья бесплатно PMC: PMC4327863] [PubMed: 22033179]
- 4.
Ma W, Tang C, Lai L. Специфичность трипсина и химотрипсина: динамическая корреляция, контролируемая движением петли, как детерминант. Biophys J. 2005 Aug;89(2):1183-93. [Бесплатная статья PMC: PMC1366603] [PubMed: 15
- 3]
- 5.
Дель Мар Э.Г., Ларгман С., Бродрик Дж.В., Фассет М., Геокас М.С. Субстратная специфичность эластазы поджелудочной железы человека 2. Биохимия. 1980 февраля 05;19(3):468-72.
 [PubMed: 6898442]
[PubMed: 6898442]- 6.
Tobey N, Heizer W, Yeh R, Huang TI, Hoffner C. Пептидазы щеточной каймы кишечника человека. Гастроэнтерология. 1985 г., апрель 88(4):913-26. [PubMed: 3882510]
- 7.
Холмс Р., Лобли Р.В. Пересмотрена граница щетки кишечника. Кишка. 1989 декабря; 30 (12): 1667-78. [Статья бесплатно PMC: PMC1434444] [PubMed: 2693228]
- 8.
Bröer S. Транспорт аминокислот через эпителий кишечника и почек млекопитающих. Physiol Rev. 2008 Янв; 88 (1): 249-86. [PubMed: 18195088]
- 9.
Броер С., Фэйрвезер С.Дж. Транспорт аминокислот через кишечник млекопитающих. сост. физиол. 2018 13 декабря; 9 (1): 343-373. [PubMed: 30549024]
- 10.
Сандри М. Распад белка при истощении мышц: роль аутофагии-лизосомы и убиквитин-протеасомы. Int J Biochem Cell Biol. 2013 Октябрь; 45 (10): 2121-9. [Статья PMC бесплатно: PMC3775123] [PubMed: 23665154]
- 11.

Puertollano R. mTOR и регулирование лизосом. F1000Prime Rep. 2014; 6:52. [Бесплатная статья PMC: PMC4108950] [PubMed: 25184042]
- 12.
Доэрти Ф.Дж., Доусон С., Майер Р.Дж. Убиквитин-протеасомный путь внутриклеточного протеолиза. Очерки биохим. 2002;38:51-63. [PubMed: 12463161]
- 13.
Чехановер А. Убиквитин-протеасомный путь: о гибели белков и жизни клеток. EMBO J. 15 декабря 1998 г.; 17 (24): 7151-60. [Бесплатная статья PMC: PMC1171061] [PubMed: 9857172]
- 14.
Rechsteiner M, Rogers SW. Последовательности PEST и регуляция протеолиза. Тенденции биохимических наук. 1996 июля; 21 (7): 267-71. [PubMed: 8755249]
- 15.
Брикс К., Данкхорст А., Майер К., Джорданс С. Цистеиновые катепсины: клеточная дорожная карта для различных функций. Биохимия. 2008 г., февраль; 90 (2): 194–207. [PubMed: 17825974]
- 16.
Leist M, Jäättelä M. Запуск апоптоза катепсинами.
 Смерть клеток 2001 Апрель; 8 (4): 324-6. [PubMed: 11550083]
Смерть клеток 2001 Апрель; 8 (4): 324-6. [PubMed: 11550083]- 17.
Harris RA, Joshi M, Jeoung NH, Obayashi M. Обзор молекулярных и биохимических основ катаболизма аминокислот с разветвленной цепью. Дж Нутр. 2005 г., июнь; 135 (6 доп.): 1527S-30S. [В паблике: 15930464]
- 18.
БЕЛЛАМИ Д. Эндогенные промежуточные продукты цикла лимонной кислоты и аминокислоты митохондрий. Biochem J. 1962 Jan; 82:218-24. [Бесплатная статья PMC: PMC1243435] [PubMed: 13866863]
- 19.
Айкава Т., Мацутака Х., Ямамото Х., Окуда Т., Исикава Э. Глюконеогенез и метаболизм аминокислот. II. Межорганные отношения и роль глютамина и аланина в метаболизме аминокислот у голодающих крыс. Дж Биохим. 1973 г., ноябрь; 74 (5): 1003-17. [В паблике: 4770365]
- 20.
Choo YS, Zhang Z. Обнаружение убиквитинирования белка. J Vis Exp. 2009, 19 августа; (30) [бесплатная статья PMC: PMC3149903] [PubMed: 19692941]
- 21.

Löser C, Möllgaard A, Fölsch UR. Фекальная эластаза 1: новый, высокочувствительный и специфический бескамерный функциональный тест поджелудочной железы. Кишка. 1996 г., октябрь; 39 (4): 580-6. [Бесплатная статья PMC: PMC1383273] [PubMed: 8944569]
- 22.
Forsmark C, Adams PC. Тестирование функции поджелудочной железы — полезно, но используется недостаточно. Можно J Гастроэнтерол. 2009 г.авг; 23 (8): 529-30. [Бесплатная статья PMC: PMC2732171] [PubMed: 19668794]
- 23.
Ooi CY, Durie PR. Мутации гена трансмембранного регулятора проводимости (CFTR) при муковисцидозе при панкреатите. J Кистозные волокна. 2012 сен; 11 (5): 355-62. [PubMed: 22658665]
- 24.
Somaraju UR, Solis-Moya A. Заместительная терапия ферментами поджелудочной железы для людей с муковисцидозом. Cochrane Database Syst Rev. 2016 Nov 23;11:CD008227. [Бесплатная статья PMC: PMC6734127] [PubMed: 27878805]
Обратный катаболизм бета-блокаторами после тяжелых ожогов
Клинические испытания
. 25 октября 2001 г .; 345 (17): 1223-9.
25 октября 2001 г .; 345 (17): 1223-9.
дои: 10.1056/NEJMoa010342.
Д Н Херндон 1 , Д. У. Харт, С. Э. Вольф, Д. Л. Чинкс, Р. Р. Вулф
принадлежность
- 1 Отделение хирургии, Медицинское отделение Техасского университета, Детская больница Шрайнерс, Галвестон 77550, США. [email protected]
- PMID: 11680441
- DOI: 10.1056/NEJMoa010342
Бесплатная статья
Клинические испытания
Д.Н. Herndon et al.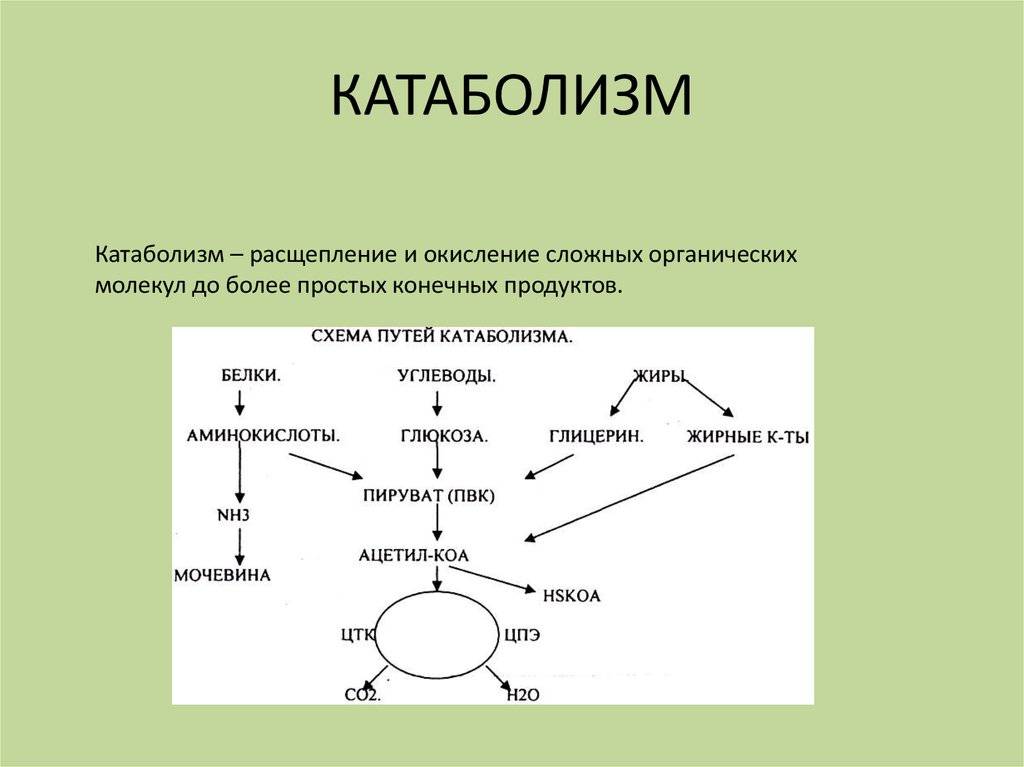 N Engl J Med. .
N Engl J Med. .
Бесплатная статья
. 25 октября 2001 г .; 345 (17): 1223-9.
дои: 10.1056/NEJMoa010342.
Авторы
Д Н Херндон 1 , Д. У. Харт, С. Э. Вольф, Д. Л. Чинкс, Р. Р. Вулф
принадлежность
- 1 Хирургическое отделение Медицинского отделения Техасского университета, Детская больница Шрайнерс, Галвестон 77550, США. [email protected]
- PMID: 11680441
- DOI:
10.
 1056/NEJMoa010342
1056/NEJMoa010342
Абстрактный
Фон: Опосредованный катехоламинами гиперметаболический ответ на тяжелые ожоги вызывает повышенный расход энергии и катаболизм мышечных белков. Мы предположили, что блокада бета-адренергической стимуляции пропранололом уменьшит расход энергии в покое и мышечный катаболизм у пациентов с тяжелыми ожогами.
Методы: В рандомизированном исследовании приняли участие 25 детей с острыми и тяжелыми ожогами (более 40% общей площади поверхности тела). Тринадцать получали пероральный пропранолол в течение как минимум двух недель, а 12 служили контрольной группой, не получавшей лечения. Доза пропранолола была скорректирована для снижения частоты сердечных сокращений в покое на 20% по сравнению с исходным значением у каждого пациента. Расход энергии в покое и кинетика белков скелетных мышц измерялись до и после двух недель бета-блокады (или без терапии, в контрольной группе). Состав тела измеряли последовательно на протяжении всей госпитализации.
Расход энергии в покое и кинетика белков скелетных мышц измерялись до и после двух недель бета-блокады (или без терапии, в контрольной группе). Состав тела измеряли последовательно на протяжении всей госпитализации.
Полученные результаты: Пациенты в контрольной группе и группе пропранолола были схожими по возрасту, массе тела, проценту общей площади поверхности тела с ожогами, проценту площади поверхности тела с ожогами третьей степени и продолжительности времени от травмы до метаболического исследования. Бета-блокада снижала частоту сердечных сокращений и расход энергии в покое в группе пропранолола как по сравнению с исходными значениями (P<0,001 и P=0,01 соответственно), так и по сравнению со значениями в контрольной группе (P=0,03). и P=0,001 соответственно). Чистый баланс мышечного белка увеличился на 82 процента по сравнению с исходными значениями в группе пропранолола (P = 0,002), тогда как в контрольной группе он снизился на 27 процентов (P незначимо). Масса без жира, измеренная с помощью сканирования уровня калия в организме, существенно не изменилась в группе, принимавшей пропранолол, тогда как она уменьшилась в среднем (+/-SE) на 9+/-2 процента в контрольной группе (P=0,003).
Масса без жира, измеренная с помощью сканирования уровня калия в организме, существенно не изменилась в группе, принимавшей пропранолол, тогда как она уменьшилась в среднем (+/-SE) на 9+/-2 процента в контрольной группе (P=0,003).
Выводы: У детей с ожогами лечение пропранололом во время госпитализации ослабляет гиперметаболизм и обращает вспять катаболизм мышечных белков.
Похожие статьи
Комбинация рекомбинантного гормона роста человека и пропранолола снижает гиперметаболизм и воспаление у детей с тяжелыми ожогами.
Йешке М.Г., Финнерти К.С., Кулп Г.А., Пшкора Р., Млчак Р.П., Херндон Д.Н. Йешке М.Г. и соавт. Pediatr Crit Care Med. 2008 март;9(2):209-16. doi: 10.1097/PCC.0b013e318166d414. Pediatr Crit Care Med. 2008. PMID: 18477935 Клиническое испытание.

Профили экспрессии генов и белковый баланс в скелетных мышцах обожженных детей после бета-адреноблокаторов.
Херндон Д.Н., Дасу М.Р., Вулф Р.Р., Бэрроу Р.Э. Херндон Д.Н. и соавт. Am J Physiol Endocrinol Metab. 2003 г., октябрь; 285 (4): E783-9. doi: 10.1152/ajpendo.00508.2002. Epub 2003 17 июня. Am J Physiol Endocrinol Metab. 2003. PMID: 12812919 Клиническое испытание.
Стойкий мышечный катаболизм после сильного ожога.
Харт Д.В., Вольф С.Э., Млчак Р., Чинкс Д.Л., Рамзи П.И., Обенг М.К., Феррандо А.А., Вулф Р.Р., Херндон Д.Н. Харт Д.У. и др. Операция. 2000 г., август; 128 (2): 312-9. doi: 10.1067/msy.2000.108059. Операция. 2000. PMID: 10
- 0
Влияние фармакологических вмешательств на синтез и распад мышечного белка при восстановлении после ожогов.

Диас Э.К., Херндон Д.Н., Портер С., Сидоссис Л.С., Суман О.Е., Борсхайм Э. Диаз ЕС и др. Бернс. 2015 июнь;41(4):649-57. doi: 10.1016/j.burns.2014.10.010. Epub 2014 16 ноября. Бернс. 2015. PMID: 25468473 Бесплатная статья ЧВК. Обзор.
Систематический обзор влияния пропанолола на гиперметаболизм при ожоговых травмах.
Нуньес-Вильявейран Т., Санчес М., Миллан П., Гарсия-де-Лоренцо А. Нуньес-Вильявейран Т. и др. Мед Интенсив. 2015 март; 39(2):101-13. doi: 10.1016/j.medin.2014.08.002. Epub 2014 7 октября. Мед Интенсив. 2015. PMID: 25305241 Обзор. Английский испанский.
Посмотреть все похожие статьи
Цитируется
Современное понимание термо(дис)регуляции при тяжелой ожоговой травме и патофизиологическое влияние гиперметаболизма, адренергического стресса и регуляции гипоталамуса – систематический обзор.

Мертин В., Мост П., Буш М., Троян С., Тапкинг С., Хауг В., Кнезер У., Хундешаген Г. Мертин В. и др. Ожоговая травма. 2022 сен 23;10:tkac031. doi: 10.1093/burnst/tkac031. Электронная коллекция 2022. Ожоговая травма. 2022. PMID: 36168403 Бесплатная статья ЧВК.
Гиперкатаболизм и антикатаболическая терапия при стойком воспалении, иммуносупрессии и синдроме катаболизма.
Чжан Дж., Луо В., Мяо С., Чжун Дж. Чжан Дж. и др. Фронт Нутр. 2022, 13 июля; 9:941097. doi: 10.3389/фнут.2022.941097. Электронная коллекция 2022. Фронт Нутр. 2022. PMID: 35
7 Бесплатная статья ЧВК. Обзор.Литический коктейль: эффективный метод облегчения гиперметаболизма, вызванного сильным ожогом, путем регулирования потемнения белой жировой ткани.

Чжан М., Ян П., Ю. Т., Хармсен М. С., Гао М., Лю Д., Ши Ю., Лю Ю., Чжан Х. Чжан М. и др. Гелион. 2022 17 марта; 8 (3): e09128. doi: 10.1016/j.heliyon.2022.e09128. Электронная коллекция 2022 март. Гелион. 2022. PMID: 35846468 Бесплатная статья ЧВК.
Лечение бета-блокаторами тяжелобольных: систематический обзор и метаанализ.
Хелисте М., Петтиля В., Бергер Д., Якоб С.М., Вилкман Э. Хелисте М. и др. Энн Мед. 2022 декабрь; 54(1):1994-2010. дои: 10.1080/07853890.2022.2098376. Энн Мед. 2022. PMID: 35838226 Бесплатная статья ЧВК.
Большие ожоги: часть 2. Анестезия, интенсивная терапия и обезболивание.
Макговерн С., Паксти К., Патон Л. Макговерн С. и др. BJA Образование.
 2022 апр; 22(4):138-145. doi: 10.1016/j.bjae.2022.01.001. Epub 2022 8 февраля.
BJA Образование. 2022.
PMID: 35531075
Обзор.
Аннотация недоступна.
2022 апр; 22(4):138-145. doi: 10.1016/j.bjae.2022.01.001. Epub 2022 8 февраля.
BJA Образование. 2022.
PMID: 35531075
Обзор.
Аннотация недоступна.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- 1P50GM60338-01/GM/NIGMS NIH HHS/США
- 2T32GM0825611/GM/NIGMS NIH HHS/США
- GM56687-02/GM/NIGMS NIH HHS/США
- MO1 RR 00073/RR/NCRR NIH HHS/США
Метаболизм во взрослом возрасте не замедляется, как принято считать, показало исследование Не так быстро.

Новое международное исследование опровергает распространенное мнение о неизбежном снижении метаболизма во взрослой жизни. Ну, во всяком случае, пока нам не за 60.
Исследователи обнаружили, что пик метаболизма приходится на возраст 1 год, когда дети сжигают калории на 50 процентов быстрее, чем взрослые, а затем постепенно снижается примерно на 3 процента в год примерно до 20 лет. Согласно выводам, опубликованным в четверг в журнале Science.
Чтобы выявить конкретное влияние возраста на обмен веществ, исследователи сделали поправку на такие факторы, как размер тела (большие тела сжигают больше калорий в целом, чем маленькие) и обезжиренная мышечная масса (мышцы сжигают больше калорий, чем жир).
«Скорость метаболизма действительно стабильна на протяжении всей взрослой жизни, от 20 до 60 лет», — сказал автор исследования Герман Понцер, адъюнкт-профессор эволюционной антропологии в Университете Дьюка и автор новой книги «Burn» о метаболизме. «Например, мы не видим никакого эффекта менопаузы. И вы знаете, люди скажут: «Ну, когда мне исполнилось 30 лет, мой метаболизм развалился». На самом деле мы не видим никаких доказательств этого».
И вы знаете, люди скажут: «Ну, когда мне исполнилось 30 лет, мой метаболизм развалился». На самом деле мы не видим никаких доказательств этого».
Понтцер и его коллеги изучили базу данных более чем 6400 человек в возрасте от 8 дней до 95 лет из 29 стран мира, которые участвовали в тестах на «воду с двойной маркировкой». С помощью этого метода люди пьют воду, в которой часть водорода и кислорода заменена изотопами этих элементов, которые можно обнаружить в образцах мочи.
«Подсчитав, сколько водорода вы теряете в день и сколько кислорода вы теряете в день, мы можем рассчитать, сколько углекислого газа производит ваше тело каждый день», — объяснил Понцер. «И это очень точное измерение того, сколько калорий вы сжигаете каждый день, потому что вы не можете сжигать калории, не выделяя углекислый газ».
Исследователи проанализировали средние общие ежедневные затраты энергии, которые включают калории, которые мы сжигаем, делая все, от дыхания и переваривания пищи до мышления и движения тела.
«Нет ничего более фундаментального и фундаментального, чем то, как наши тела сжигают энергию, потому что это показывает, как все наши клетки заняты весь день, выполняя свои различные задачи, и у нас не было четкого представления о том, как это меняется в течение дня. всей жизни», — сказал Понцер. «Вам нужны действительно большие наборы данных, чтобы ответить на этот вопрос. И это был первый раз, когда у нас была возможность сделать это с действительно большим набором данных, который позволил бы нам разделить влияние размера тела, возраста, пола и всего прочего на наши энергетические затраты в течение дня».
Возьмем, к примеру, обнаружение снижения скорости обмена веществ у пожилых людей, чего можно было ожидать.
«Люди думали: «Ну, может быть, это потому, что вы менее активны, или, может быть, это потому, что люди склонны терять мышечную массу, когда им за 60, 70 и старше», — сказал он. «Но мы можем исправить все эти вещи. Мы можем сказать: «Нет, нет, нет, это нечто большее». Дело в том, что наши клетки на самом деле меняются».
Дело в том, что наши клетки на самом деле меняются».
Результаты не показали резкого увеличения скорости метаболизма в подростковом возрасте или во время беременности, как это принято считать, или что между мужчинами и женщинами существовали определенные различия после учета размера и состава тела.
Зарегистрированный врач-диетолог Коллин Тьюксбери, старший научный сотрудник Пенсильванского университета и представитель Академии питания и диетологии, заявила, что новое исследование вызывает удивление.
«Исторически сложилось так, что при различных изменениях жизненного цикла — полового созревания, беременности, менопаузы — мы думали, что происходит некоторый сдвиг в обмене веществ, и это влияло на статус питания и на то, как мы подходили к вещам с точки зрения питания», — сказала она. . «Эта строгая оценка на высоком уровне этого не показывает».
Дело не в том, что увеличение веса происходит не потому, что вы больше не «сжигаете те же калории».
Но если изменение метаболизма не играет роли в увеличении веса в определенные моменты взрослой жизни, могут быть и другие способствующие факторы, сказала она.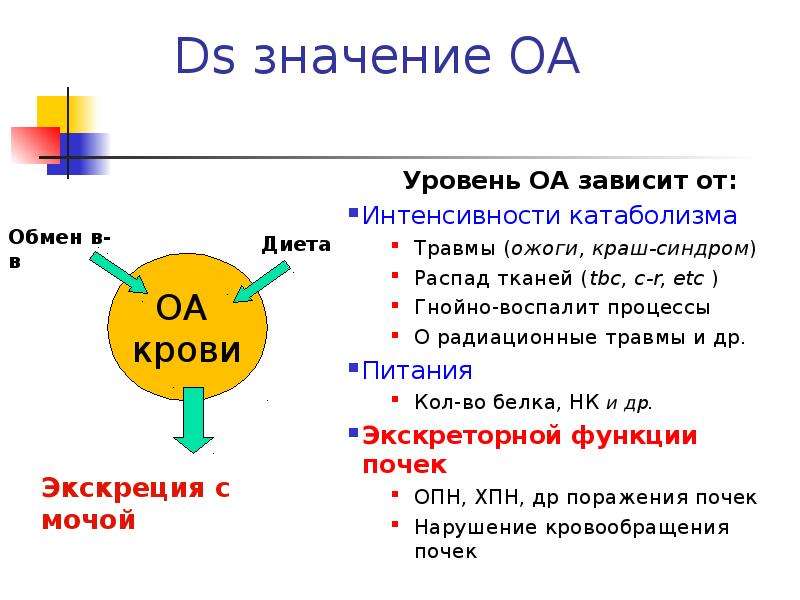
«Есть множество вещей, влияющих на вес, а также на чье-то питание», — сказал Тьюксбери. «Это не так просто, как один продукт питания или одно изменение образа жизни или одно изменение с биологической точки зрения. Скорее всего, это гораздо более сложная сеть множества различных изменений, происходящих одновременно. Таким образом, это могут быть изменения в рационе питания. Это могут быть изменения в уровне активности. Это может быть место, где они живут, к чему у них есть доступ, каковы изменения их сна».
Стивен Малин, адъюнкт-профессор кинезиологии и здоровья и директор Лаборатории прикладного метаболизма и физиологии Рутгерса, назвал результаты исследования «проливающими свет на то, о чем, как мы думали, мы много знаем, и понимаем, что еще многое предстоит открыть».
Малин сказал, что результаты, например, противоречат убеждению, что у взрослых людей наблюдается снижение метаболизма по мере того, как они переходят от 20 к 30 годам, и что это может способствовать эпидемии ожирения.
«Прибавка в весе происходит не потому, что вы больше не «сжигаете те же калории», — сказал он.
Понцер сказал, что выводы в ранней жизни выдвигают на первый план критическую важность детского питания, отвечающего возрастающим энергетическим потребностям растущих младенцев.
In addition, он сказал, результаты изучения smogли иметь значения для как много люди микстуры в различном времени, когда они smogли быть метаболизмом снадобиь по-разному.
В комментарии, опубликованном вместе с новым исследованием, Тимоти Роудс и Розалин Андерсон, работающие в области гериатрии в Университете Висконсина, заявили, что результаты также могут иметь значение для изучения возрастных заболеваний.
«Считается, что снижение с 60 лет отражает изменение тканеспецифического метаболизма, энергии, затрачиваемой на поддержание», — писали они. «Не может быть совпадением, что рост заболеваемости неинфекционными заболеваниями и расстройствами начинается именно в эти же сроки».
Жаклин Стенсон
Сотрудник NBC News Жаклин Стенсон — журналистка по вопросам здоровья и фитнеса, которая пишет для Los Angeles Times, Reuters, Health, Self and Shape и других. Она также преподает в программе UCLA Extension Writers.
Определение и примеры катаболизма — Биологический онлайн-словарь
Катаболизм
сущ., [kəˈtæbəˌlɪzəm]
Серия деструктивных химических реакций, которые расщепляют сложные молекулы на более мелкие единицы
Изображение предоставлено: Muessig, CC BY-SA 3.0.
Содержание
Катаболизм Определение
Катаболизм — это ветвь метаболического процесса, которая расщепляет сложные большие молекулы на более мелкие с выделением энергии. это деструктивная ветвь обмена веществ, приводящая к высвобождению энергии . Каждая живая клетка зависит от энергии для своего существования. Метаболизм – это совокупность основных видов деятельности, происходящих в живом существе для его поддержания. Катаболизм и анаболизм вместе образуют метаболизм.
Катаболизм и анаболизм вместе образуют метаболизм.
Итак, возникает вопрос, что такое катаболизм и анаболизм? По существу, есть две основные ветви метаболизма: разрушительная (или расщепляющая ) ветвь, дающая энергию, т. е. катаболизм, и конструктивная или строительная ветвь метаболизма, использующая высвобожденную энергию, т. е. анаболизм.
Каждая живая клетка осуществляет последовательный набор реакций, которые расщепляют и производят молекулы. Эти последовательные реакции или пути известны как метаболических путей . Каждая стадия этих последовательных реакций происходит под действием определенного фермента. Ферменты действуют на молекулы, называемые субстрат , тогда как молекула, образующаяся в результате химической реакции, известна как продукт . Большинство ферментов связываются с определенным субстратом.
Ниже приведены некоторые общие черты всех метаболических реакций:
- Все реакции катализируются ферментом.

- Метаболические пути и реакции универсальны, и все организмы проявляют сходство в основных путях.
- Во всех метаболических путях используется очень мало химических реакций.
- Метаболические реакции включают коферментов . Коэнзимы являются общими субстратами, которые участвуют в ряде различных метаболических реакций, например, для НАДН или кофермента А.
- Катаболические пути полностью отличаются от анаболических путей, что позволяет лучше контролировать метаболизм.
- Ключевые регуляторные ферменты контролируют и модулируют эти метаболические реакции.
- Большинство метаболических реакций происходит в специфических клеточных органеллах.
Биологическое определение:
Катаболизм — это процесс, включающий ряд химических реакций разложения, которые расщепляют сложные молекулы на более мелкие единицы, обычно сопровождающиеся выделением энергии. Например, большие молекулы, такие как полисахариды, нуклеиновые кислоты и белки, расщепляются на более мелкие единицы, такие как моносахариды, нуклеотиды и аминокислоты, соответственно . Этимология: Греческое «катаболе», что означает «бросать». Синонимы: деструктивный метаболизм. Вариант: катаболизм. Сравните: анаболизм
Этимология: Греческое «катаболе», что означает «бросать». Синонимы: деструктивный метаболизм. Вариант: катаболизм. Сравните: анаболизм
Родственное слово « катаболизм ». Итак, что значит катаболический? Определение катаболизма — это то, что отмечено или способствует катаболизму, т. е. метаболическому процессу, включающему расщепление довольно сложной молекулы на более простую форму.
Стадии катаболизма
Катаболизм не является одностадийным процессом, протекающим в клетке. Важно понять, где происходит катаболизм. Часть клетки, где в первую очередь происходит катаболизм, — это митохондрии. Это многоэтапный процесс. Итак, давайте разберемся, какие бывают стадии катаболизма. Выделяют три основных стадии катаболизма:
Стадия 1 – Стадия пищеварения
Сложные органические молекулы, такие как белки, липиды и полисахариды, катаболизируются до более мелких компонентов или мономеров вне клеток. Эти сложные молекулы не всасываются в своем сложном состоянии и, следовательно, для их всасывания важно, чтобы эти основные и незаменимые молекулы распадались на легко усваиваемые и более мелкие мономеры .
Эти сложные молекулы не всасываются в своем сложном состоянии и, следовательно, для их всасывания важно, чтобы эти основные и незаменимые молекулы распадались на легко усваиваемые и более мелкие мономеры .
Стадия 2 — Высвобождение энергии
Меньшие молекулы или мономеры представляют собой усваиваемую форму и поглощаются клетками, а затем преобразуются в более мелкие молекулы, такие как ацетил-кофермент А (ацетил-КоА), и в процессе высвобождается энергия.
Стадия 3 – накопление энергии
Наконец, ацетильная группа КоА окисляется до воды и диоксида углерода в цикле лимонной кислоты и цепи переноса электронов. В этом процессе накопленная энергия высвобождается за счет восстановления кофермента никотинамидадениндинуклеотида 9.0010 (НАД+) в НАДН .
Стадии катаболизма. Предоставлено: библиотеки LibreTexts, CC BY-NC-SA 3.0.Катаболизм против анаболизма
Цель двух ветвей метаболизма, а именно катаболизм и анаболизм , полностью противоположны друг другу. Анаболические процессы — это процессы построения метаболизма, в которых простые молекулы превращаются в сложные молекулы , тогда как катаболический процесс — это процессы распада, в которых сложные молекулы расщепляются на простые молекулы с высвобождением энергии . Основные различия между катаболизмом и анаболизмом перечислены в таблице ниже.
Анаболические процессы — это процессы построения метаболизма, в которых простые молекулы превращаются в сложные молекулы , тогда как катаболический процесс — это процессы распада, в которых сложные молекулы расщепляются на простые молекулы с высвобождением энергии . Основные различия между катаболизмом и анаболизмом перечислены в таблице ниже.
| Table 1: Key differences between Catabolism and Anabolism | |
|---|---|
| Anabolism | Catabolism |
| Building up or constructive branch of metabolism | Breakdown or destructive branch of metabolism |
| Complex molecules are generated from более простые | Сложные молекулы распадаются на более простые |
| В этом процессе сохраняется энергия. | В этом процессе выделяется энергия |
| Эндергоническая реакция, т.е. поглощается теплота | Экзергоническая реакция, т. е. выделяется теплота е. выделяется теплота |
| Кинетическая энергия преобразуется в потенциальную энергию. | Потенциальная энергия преобразуется в кинетическую энергию. |
| Это необходимо для роста, сохранения и хранения. | Требуется для обеспечения энергией различных основных видов деятельности живых существ. |
| Анаболизм не использует кислород, т. е. анаэробный | Катаболизм использует кислород, т. е. аэробный |
| Функционирует, даже когда тело находится в фазе отдыха или сна. | Функционирует, когда организм находится в активном состоянии |
| Несколько предшественников образуют различные типы продуктов, т. е. дивергентные реакции | Большое количество сложных молекул упрощается до обычных типов малых и простых молекул, т. е. конвергентных реакций |
| К анаболическим гормонам относятся эстроген, тестостерон, гормоны роста и инсулин. | Некоторыми из катаболических гормонов являются адреналин, цитокин, глюкагон и кортизол. |
| Синтез полипептидов из аминокислот, гликогена из глюкозы и триглицеридов из жирных кислот является одним из анаболических процессов. | Расщепление белков до аминокислот, гликогена до глюкозы и триглицеридов до жирных кислот является одним из катаболических процессов. |
| Обычно протекают реакции конденсации и восстановления. | Обычно протекают реакции гидролиза и окисления. Источник: Мария Виктория Гонзага из Biology Online. Метаболизм относится ко всем химическим реакциям, связанным с преобразованием одной молекулы в другую. Его можно разделить на две категории: катаболизм и анаболизм . Катаболизм относится к процессам, включающим ряд химических реакций разложения, которые расщепляют сложные молекулы на более мелкие единицы. При этом часто выделяется энергия. Таким образом, катаболизм включает деструктивные метаболические процессы. Напротив, анаболизм — это конструктивный метаболизм, поскольку он включает в себя создание или синтез сложных молекул, которые в конечном итоге используются для построения тканей и органов. Катаболические гормоныКатаболизм – механизм нарушения обменных процессов. В катаболических процессах участвуют многочисленные незаменимые ферменты. Некоторые гормоны также обладают катаболическим действием. Это:
Примеры катаболизма у эукариотКаковы примеры катаболизма? По сути, во время катаболизма сложные молекулы, такие как белки, полисахариды и жиры, расщепляются на небольшие молекулы, такие как аминокислоты, моносахариды и жирные кислоты. Вот некоторые из основных или ключевых катаболических процессов:
Citric acid cycle, glycolysis, lipolysis, oxidative deamination, and oxidative phosphorylation are the key catabolic reactions examples that occur во всех эукариотических клетках. Цикл Кребса, названный в честь ученого сэра Ганса Кребса (1900-1981), открывшего его, также известен как цикл трикарбоновых кислот (TCA). Сэр Ганс Креб был удостоен Нобелевской премии по медицине (1937). Ключевым источником энергии в цикле трикарбоновых кислот является ацетил-КоА, который окисляется до СО2 и Н3О внутри митохондриального матрикса с одновременным восстановлением НАД до НАДН и ФАД до ФАДН 2 . NADH и FADH 2 известны как восстанавливающие эквиваленты в цикле трикарбоновых кислот. 3 молекулы НАДН и одна молекула того и другого впоследствии используются для образования АТФ в цепи переноса электронов. При окислении NADH приводит к образованию 3 молекул АТФ, а FADH 2 — к 2 молекулам АТФ. Цикл ТСА представляет собой общий путь окисления углеводов, белков и жиров. Один цикл Кребса или цикл ТСА приводит к образованию семи продуктов: GTP, 3 NADH, 3FADH 2 , 2 CO 2 . Его также иногда классифицируют как амфиболический путь , поскольку он является частью как катаболического, так и анаболического путей. Ключевыми восемью промежуточными соединениями цикла Кребса/ЦТК являются: цитрат, изоцитрат, оксоглутарат, сукцинил-КоА, сукцинат, фумарат, малат, оксалоацетат (щавелевоуксусная кислота). Ключевыми ферментами, участвующими в цикле ТСА/Креба, являются яблочная дегидрогеназа, α-кетоглутаратдегидрогеназа, цитратсинтаза, фумараза, и конитаза. Гликолиз – катаболический процесс, происходящий во всех эукариотических клетках. Расщепление или лизис глюкозы до пировиноградная кислота в аэробных условиях, тогда как в анаэробных условиях глюкоза превращается в молочную кислоту. Анаэробный гликолиз также известен как Путь Эмбдена-Мейергофа (EMP). Когда уровень клеточного АТФ низкий, гликолиз инициируется в цитозоле клетки. Гликолиз далее делится на две стадии:
Метаболизм глюкозы по этому пути происходит во всех клетках организма. Аэробный гликолиз происходит в головном мозге, тогда как анаэробный гликолиз происходит в эритроцитах из-за отсутствия митохондрий. Этот цикл в эритроцитах также известен как 9-й.0007 Цикл рапапорта-лесозаготовки . Распад гликогена инициирует процесс гликолиза в мышцах человека. Однако клетки головного мозга не имеют запасов гликогена и, следовательно, зависят от уровня глюкозы в крови, чтобы инициировать гликолиз. Скелетные мышцы человека подвергаются аэробному гликолизу почти в 90% случаев, а также в нормальных условиях. Однако энергичные мышечные сокращения и физические упражнения вызывают анаэробный гликолиз. Липолиз — это расщепление триглицеридов для получения энергии. В этом процессе триацилглицерин (TAG), хранящийся в клеточных каплях липидов, подвергается гидролитическому расщеплению с образованием неэтерифицированных жирных кислот. Эти неэтерифицированные жирные кислоты впоследствии используются в качестве субстрата для производства энергии, незаменимых предшественников для синтеза липидов и мембран или медиаторов клеточных сигнальных процессов. Липиды или триглицериды гидролизуются до свободных жирных кислот и глицерина. Образовавшийся глицерин впоследствии становится частью гликолиза, а образующиеся жирные кислоты далее расщепляются путем бета-окисления с высвобождением ацетил-КоА. Этот ацетил-Ко-А является ключевым компонентом цикла лимонной кислоты. При окислении жирных кислот выделяется больше энергии, чем при окислении углеводов. Основными ферментами, участвующими в процессе липолиза, являются липопротеинлипаза и гормоночувствительная липаза . Эпинефрин , глюкагон или адренокортикотропный гормон (АКТГ) являются ключевыми гормонами, стимулирующими липолиз. Полное окисление жирных кислот, особенно триглицеридов, дает максимальное количество АТФ (энергии на грамм), поэтому жирные кислоты являются основной формой хранения топлива у большинства животных. Катаболизм аминокислот происходит путем переаминирования и окислительного дезаминирования аминокислоты, что приводит к образованию метаболизируемой формы аминокислоты. Окислительное дезаминирование и трансаминирование являются двумя ключевыми этапами катаболизма белков или аминокислот. Отделение аминогруппы от углеродного скелета аминокислот осуществляется в процессе трансаминирования. При окислительном дезаминировании удаление аминогруппы в аминокислоте приводит к образованию соответствующей кетокислоты. Эта реакция происходит в печени. Аминовая функциональная группа заменяется кетоновой группой, и в качестве побочного продукта образуется аммиак. В конце концов, этот токсичный аммиак нейтрализуется в мочевину в цикле мочевины. На аминокислоту глутаминовую кислоту , конечный продукт многих реакций трансаминирования, действует фермент глутаматдегидрогеназа 9.0010 (ГДГ) вместе с коферментами НАД или НАДФ, что приводит к образованию α-кетоглутарата (α-КГ) и аммиака . Моноаминоксидаза является другим ключевым ферментом для окислительного дезаминирования моноаминов. В митохондриях перенос электронов от НАДН или ФАДН 2 к О 2 с помощью серии переносчиков электронов приводит к образованию АТФ. Этот процесс известен как окислительное фосфорилирование и является основным источником АТФ в аэробных организмах. Более высокая скорость деградации белка по сравнению с его синтезом стимулирует распад ткани скелетных мышц. Это полностью катаболическое состояние организма. Это может произойти в случаях старения, недоедания или болезненных состояний, а именно сепсиса, рака, СПИДа, диабета и почечной недостаточности. Длительное состояние разрушения мышечной ткани или мышечной атрофии может привести к органной недостаточности и может быть опасным для жизни. Аминокислоты из запасов белка, особенно в мышечной ткани, высвобождаются в кровь. Эти аминокислоты превращаются в альфа-кетокислоты в печени. Альфа-кетокислоты превращаются в глюкозу, чтобы удовлетворить потребность в глюкозе крови. Примеры катаболизма у прокариотПрокариоты также нуждаются в энергии и углероде для своего существования. Большинство прокариот зависят от других организмов в отношении энергии и углерода, то есть от хемогетеротрофов. Эти потребности прокариот в углероде и энергии удовлетворяются за счет:
В зависимости от источника углерода прокариоты можно классифицировать как
На основании энергетического метаболизма прокариоты классифицируются как:
Таким образом, все организмы можно разделить на четыре основные категории
Попробуйте ответить на приведенный ниже тест, чтобы проверить, что вы уже узнали о катаболизме. ВикторинаВыберите лучший ответ. 1. Что из следующего правильно описывает катаболизм? Метаболический процесс, при котором мелкие молекулы превращаются в более крупные вещества Метаболический процесс, при котором расщепляются сложные молекулы Энергоемкий метаболический процесс 2. Молекулы, воздействующие на ферменты Катализаторы Продукты субстраты 3. Катаболизм ядерных кислот дает … моносахарады ядрет 4. 40002. дает …Аминокислоты Моносахариды Нуклеотиды 5. Какой из следующих процессов является катаболическим? Цикл лимонной кислоты глюконеогенез Рост костей Отправить свои результаты (необязательно)Ваше имя по электронной почте Следующие Регуляторные механизмы, лежащие в основе103. 10101103.10101103.10103. , бактерии часто подвергаются постоянному изменению потока питательных веществ 1,2 . Чтобы обеспечить рост и выживание, бактерии постоянно ощущают метаболические изменения и быстро адаптируются к появлению или истощению питательных веществ 3 . С этой целью клетки интегрируют сложные и динамические внешние входы, чтобы решить, какие питательные вещества потреблять и когда переключаться на потребление альтернативных доступных субстратов 4,5 . Мониторинг динамических изменений внутриклеточного метаболизма является ключом к пониманию регуляторных механизмов, лежащих в основе адаптации к изменчивой среде 6,7 . Однако разрешение динамических перестроек потока является сложной задачей, особенно в сложных средах с параллельным потреблением нескольких питательных веществ 8,9 . 10101103.10101103.10103. , бактерии часто подвергаются постоянному изменению потока питательных веществ 1,2 . Чтобы обеспечить рост и выживание, бактерии постоянно ощущают метаболические изменения и быстро адаптируются к появлению или истощению питательных веществ 3 . С этой целью клетки интегрируют сложные и динамические внешние входы, чтобы решить, какие питательные вещества потреблять и когда переключаться на потребление альтернативных доступных субстратов 4,5 . Мониторинг динамических изменений внутриклеточного метаболизма является ключом к пониманию регуляторных механизмов, лежащих в основе адаптации к изменчивой среде 6,7 . Однако разрешение динамических перестроек потока является сложной задачей, особенно в сложных средах с параллельным потреблением нескольких питательных веществ 8,9 . Наиболее строгие подходы делают выводы о внутриклеточных потоках на основе экспериментов с изотопными индикаторами, которые обычно ограничиваются стационарными условиями и потреблением одного ограничивающего рост питательного вещества 10,11,12 . Здесь мы используем нецелевую масс-спектрометрию 19 и разработали новый вычислительный подход для определения динамической метаболической адаптации бактерий в сложных химических средах с непрерывными изменениями доступных питательных веществ. В частности, мы применили эту методологию к Escherichia coli , растущим в среде с минимальным содержанием глюкозы, дополненной казаминокислотами, неопределенной смесью аминокислот и олигопептидов, в качестве показателя неопределенных условий окружающей среды 20 . Непрерывные изменения в доступности питательных веществ отслеживаются с помощью масс-спектрометрического профиля относительного содержания питательных веществ и побочных продуктов в надосадочной жидкости. Чтобы удовлетворить требования временного разрешения и охвата для флуктуирующих сред с большим химическим разнообразием, мы отслеживали относительные зависящие от времени изменения концентраций внеклеточных метаболитов с использованием высокопроизводительного метода нецелевой масс-спектрометрии 21,22 . РезультатыВывод динамики потока из профилей экзометаболома В качестве примера сложной питательной среды мы культивировали E. coli дикого типа BW25113 в минимальной среде M9 с глюкозой (5 г/л). и казаминокислоты (CAA) (2 г/л), неопределенная смесь аминокислот и олигопептидов из переваренного молочного белка 23 . Культура демонстрировала классическую кривую периодического роста с 4-часовым ростом, колеблющимся вокруг максимальной экспоненциальной скорости роста, с последующим непрерывным снижением скорости роста (рис. 1a и дополнительная рис. 1). Чтобы определить условия питания, которые лежат в основе изменений скорости роста, мы собрали аликвоты культурального супернатанта в десяти временных точках на кривой роста. Профилирование экзометаболома. a Оптические плотности (OD 600 ; синяя линия) и мгновенная скорость роста, т. е. OD 600 разница между двумя смежными временными точками, деленная на временной интервал (красная линия), роста культуры E. Полноразмерное изображение В то время как наша платформа метаболомики выявила неожиданно сложную динамику экзо-метаболома, предполагающую широко распространенную секрецию метаболитов как гомеостатический механизм, полученные относительные изменения концентрации не позволяют сделать прямой вывод о внутриклеточных потоках в рамках классической схемы FBA 8, 15,29 . Чтобы интегрировать такие нецелевые измерения метаболомики прямого потока 21 в масштабную модель генома для оценки динамического потока, мы использовали моделирование на основе ограничений и разработали структуру, которая состоит из трех основных этапов. Во-первых, мы определили абсолютные концентрации для обильных компонентов среды, а именно глюкозы, ацетата и 20 аминокислот (дополнительные данные 1). Прогноз метаболических потоков в зависимости от времени. a Процент неактивных (фиолетовый) и активных (зеленый) реакций в течение всего времени и реакций, которые несут поток в течение ограниченного времени (желтый). b z — нормированные значения зависимых от времени потоков для транзиторных реакций с прогнозируемым потоком более 1 ммоль/гВт/ч по крайней мере в один момент времени. c Прогнозируемые зависящие от времени потоки через НАД- и НАДФ-зависимые яблочные ферменты MaeA и MaeB соответственно. Изображение в полный размер Для вывода неизвестных v ( t ) и c , мы последовательно минимизировали три цели: (i) расстояние L1-нормы между предсказанными ( v ( t )) и оцененными (\(\tilde v(t)\)) обменными потоками от абсолютные измерения метаболитов, (ii) расстояние нормы L1 между предсказанными v 91 189 ( 91 155 t 91 156 ) и оценочные относительные обменные курсы ( 91 191 u 91 189 ( 91 155 t 91 156 )), и (iii) сумма абсолютных потоков за весь временной ход (\(\mathop {\sum}\limits_t { |v\влево( t \вправо)|}\)). Чтобы проверить неопределенность в оценках потоков, мы провели анализ изменчивости потоков (FVA) оптимального решения по потокам: для каждой реакции мы рассчитали максимальную и минимальную сумму потоков во времени. Мы обнаружили, что для подавляющего большинства (81%) метаболических реакций вариабельность потока была в пределах 10% от заявленного решения потока (дополнительная рис. 6). 738 реакций (29%) из 2583 в модели были активны на протяжении большей части временного хода, в основном представляя собой реакции, необходимые для производства энергии и биомассы. Особый интерес представляют те реакции (8%), которые были только временно активными и, следовательно, могут отражать специфические адаптивные механизмы, лежащие в основе изменений в доступности питательных веществ (рис. Среди временно активных реакций мы обнаружили НАД- и НАДФ-зависимые яблочные ферменты, которые катализируют анаплеротическую реакцию превращения малата в пируват (рис. 2c и дополнительная рис. 7). Хотя эти анаплеротические реакции неактивны в среде с минимальным содержанием глюкозы 34 , зависящие от времени оценки потока через яблочные ферменты MaeA и MaeB предполагают раннюю временную активацию потока от малата к пирувату в присутствии CAA (рис. 2c). Чтобы подтвердить это предсказание и проверить функциональность яблочных ферментов в сложной среде, мы наблюдали за ростом двух отдельных мутантов с нокаутом яблочного фермента Δ 9.1155 maeA и Δ maeB в M9 + CAA. В соответствии с предсказаниями модели о более ранней и сильной активации NAD-зависимого фермента MaeA (рис. 2c), мы наблюдали, что максимальные скорости роста были аналогичны показателям дикого типа в глюкозе M9, в то время как Δ maeA демонстрирует значительно более низкий максимум. Динамическая координация потребления аминокислот и глюкозы Наш основанный на модели анализ выявил в основном две фазы роста, примерно до и после того, как культура достигает ОП 600 , равной 1. Расчетная скорость усвоения аминокислот. Измеренные концентрации аминокислот в супернатанте (крестики) и интерполированные значения (синие линии). Черная линия представляет рассчитанную мгновенную скорость поглощения, а серая заштрихованная область — доверительные интервалы. Потребность в потоке для биосинтеза белка (зеленая линия) оценивалась по стехиометрии состава биомассы, умноженной на мгновенную скорость роста. Области, заштрихованные красным цветом, обозначают нижнюю и верхнюю границы потребности в аминокислотах для биосинтеза белка, рассчитанной на основе экспериментальных измерений содержания белка в E. coli , выращенные на богатой среде (время удвоения ~ 20 мин) и среде с минимальным содержанием глюкозы (время удвоения ~ 60 мин) 43 . Изображение в полный размер На протяжении этих двух фаз скорость потребления аминокислот варьировала примерно на один порядок (рис. 3). Скорость поглощения всех семи неразлагаемых аминокислот (рис. 3, желтые области диаграммы) была ниже или соответствовала теоретическим требованиям для биосинтеза белка при данной скорости роста. Подобно поглощению метионина, которое ингибируется внутренними уровнями метионина 38 , похоже, что скорость поглощения всех неразлагаемых аминокислот жестко регулируется внутренними петлями обратной связи, возможно, чтобы избежать накопления токсичных промежуточных соединений 39 . Потребление против стоимости аминокислот. a Каждая точка представляет одну аминокислоту, а красная линия представляет собой мгновенную скорость роста клеток. Для каждой аминокислоты начальная концентрация связана с ОП 600 , при которой аминокислота была удалена из среды. b Для каждой аминокислоты ее метаболическая стоимость, т. е. количество высокоэнергетических фосфатных связей, необходимых для биосинтеза 41 , сравнивается с соотношением между исходной концентрацией аминокислоты и культуральной ОП 600 во время истощения, показанного в a . c Для каждой аминокислоты ее метаболическая стоимость 41 сравнивается со средней оценкой скорости ее поглощения, рассчитанной как начальная концентрация аминокислоты, деленная на часы и грамм культуры сухой биомассы (gDW) во время аминокислоты. Изображение с полным размером В целом, наши данные свидетельствуют о том, что аминокислоты, которые «дешевы» в производстве, такие как серин, глицин, треонин и аспартат, поглощаются в гораздо большей степени. выше скорость и разлагается, тем самым потенциально снижая потребность в глюкозе в качестве источника углерода и энергии (рис. Роль пирувата в координации катаболизма глюкозы Выше мы обнаружили, что некоторые аминокислоты подвергаются катаболизму и даже снижают катаболизм глюкозы на ранних стадиях роста.  5 5 Координация катаболизма глюкозы и аминокислот. a Среднее ± стандартное отклонение активности Crp в различных питательных средах: минимальная среда с глюкозой (GLC) или сукцинатом (SUC выделена зеленым цветом, положительный контроль) и минимальная среда с глюкозой, дополненная казаминокислотами (CAA), смесь синтетических аминокислот (SAA), SAA, лишенные аминокислот, которые могут расщепляться до пирувата: (i) треонин, глицин и серин (STG) или (ii) треонин, глицин, серин, триптофан, цистеин и аланин (STGTCA), или α- кетоглутарат: (iii) глутамат, глутамин, пролин и аргинин (GGPA) или оксалоацетат: (iv) аспартат и аспарагин (AA) и минимальная глюкозная среда с 0,125 г/л глутамата (GLT). b Динамические изменения соотношения между фосфоенолпируватом и пируватом при добавлении CAA. c Динамические относительные изменения содержания пирувата (синий), оксалоацетата (красный) и α-кетоглутарата (желтый) при добавлении различных смесей аминокислот и глюкозы в качестве основного источника углерода. Изображение в полный размер Альтернативный механизм более быстрого контроля усвоения глюкозы основан на изменении активности транспортера либо посредством фосфорилирования 49 или связывание малых молекул 5 . Дефосфорилирование первой стадии системы сахар-фосфоенолпируватфосфотрансфераза (PTS), EIIA Glc , приводит к ингибированию транспорта нескольких не-PTS источников углерода. Согласно текущей модели, быстрое увеличение соотношения между уровнями фосфоенолпирувата и пирувата будет соответствовать усилению фосфорилирования EIIA Glc 49 и, следовательно, снижению поглощения глюкозы. Чтобы проверить эту гипотезу и идентифицировать предполагаемые эффекторные метаболиты, мы добавили культур E. coli во время среднего экспоненциального роста на минимальной среде с глюкозой с восемью различными смесями аминокислот. Каждая смесь была лишена одного класса аминокислот, которые катаболизируются в любой из трех конечных продуктов разложения, а именно в α-кетокислоты: пируват, α-кетоглутарат или оксалоацетат. В каждом эксперименте мы определяли скорость роста, поглощение глюкозы и секрецию ацетата и измеряли динамическую реакцию внутриклеточного метаболома до 90 мин после добавления аминокислот с помощью нецелевого FIA-TOFMS 9.0329 51 (дополнительный рисунок 15 и дополнительные данные 2). Как правило, добавление аминокислот влияло на потребление глюкозы и секрецию ацетата (таблица 1) и вызывало большие изменения концентрации промежуточных продуктов центрального метаболизма, в первую очередь пирувата и оксалоацетата (см. Дополнительное обсуждение и Дополнительный рисунок 15). Полная таблица Быстрое накопление и последующее истощение внутриклеточных Добавление CAA было совместимо с начальной фазой роста, во время которой потребление глюкозы было снижено, и последующей фазой, после истощения недорогих аминокислот, характеризующейся повышенным поглощением глюкозы и снижением секреции ацетата (рис. Собранные данные свидетельствуют о том, что пируват может использоваться для регуляции поглощения глюкозы и секреции ацетата. Активация секреции ацетата пируватом уже была известна, поскольку пируват является сильным активатором фосфотрансацетилазы, катализирующей обратимое взаимопревращение ацетил-КоА и ацетилфосфата 9. Чтобы проверить, может ли пируват также напрямую регулировать поглощение глюкозы, мы очистили PtsI, компонент системы PTS, который катализирует фосфорилирование глюкозы до глюкозо-6-фосфата с фосфоенолпируватом (ФЕП) в качестве донора фосфата. Мы определили активность PtsI in vitro в присутствии девяти различных промежуточных продуктов центрального метаболизма, используя известный ингибитор α-кетоглутарата в качестве положительного контроля 5,56 . Поскольку пируват является одним из продуктов реакции и результатом анализа, для исследования ингибирования пируватом необходимо было использовать оксамат-аналог пирувата (рис. 5e). В соответствии с нашей гипотезой мы обнаружили, что соединения со сходными химическими свойствами с пируватом, такие как оксамат, оксалоацетат и α-кетоглутарат, но не глиоксилат, ингибируют PtsI (двухвостый парный t -тест, p -значение ≤ 0,05), в то время как другие промежуточные продукты центрального метаболизма, такие как глутамат, аланин, аспартат, фруктозобисфосфат и сукцинат, не проявляли ингибирующей активности (рис. Чтобы дополнительно продемонстрировать, что повышенное содержание пирувата может избирательно ингибировать систему поглощения PTS, мы проверили потенциальное ингибирующее рост действие добавления внеклеточного пирувата к E. coli , растущему либо с глюкозой, источником углерода PTS, либо с источником углерода, не содержащим PTS. сукцинат. Поскольку Crp-опосредованная катаболическая репрессия предотвращает поглощение пирувата во время экспоненциального роста на глюкозе, мы сначала выращивали E. coli в среде с глюкозой M9 в течение ночи до стационарной фазы, когда активность Crp высока, что позволяет поглощать альтернативные источники углерода. Координация катаболизма сукцината и аминокислот. a Изменения мгновенной скорости роста E. coli в глюкозе M9 (черный), с 20 (синий) или 40 (красный) мМ пирувата. b Изменения мгновенной скорости роста E. coli в сукцинате М9 (черный) с 20 (синий) или 40 (красный) мМ пирувата. c Относительная скорость поглощения сукцината E. coli в сукцинате M9, дополненном 2 г/л CAA или синтетической смесью аминокислот (SAA), состоящей из тех же аминокислот, и концентрации, измеренные в 2 г/л CAA. Столбики ошибок представляют 95% доверительный интервал на основе анализа подгонки трех биологических повторов (см. Дополнительный рисунок 21). Изображение в натуральную величину Обсуждение Разрешение динамических изменений потока в постоянно меняющихся и сложных с точки зрения питания средах остается серьезной проблемой 9.0329 59 . Бактерии, растущие в богатых средах, не могут потреблять все питательные вещества сразу, а должны решить, какие из них потреблять в первую очередь и как их утилизировать. Изменение концентрации питательных веществ вынуждает бактерии постоянно адаптировать свое поглощение, что, в свою очередь, требует непрерывного и быстрого перенаправления внутриклеточных потоков. Здесь мы разработали экспериментальный и вычислительный подход, который позволяет вывести фазы динамической метаболической адаптации E. coli во время роста в сложной среде. Паттерны экзометаболома выявили сложную динамику потребления нутриентов и секреции метаболитов. Чтобы понять, как E. coli координирует потребление различных питательных веществ и адаптирует свои внутриклеточные потоки, мы отслеживали реакцию внутриклеточного метаболома на внезапное добавление различных комбинаций аминокислот. Представленный экспериментальный и вычислительный метод может количественно моделировать перестройки внутриклеточного потока во время роста микробов и потенциально высших клеток в сложных средах за пределами исследованных здесь аминокислот. Мы предполагаем, что этот новый подход в сочетании с высоким временным разрешением и охватом достигается с помощью масс-спектрометрии с прямой инфузией 24,51,61 в сочетании с более количественными методами, такими как ЖХ-МС или ядерно-магнитный резонанс 62,63 , имеет потенциал для получения поддающихся проверке предсказаний регуляторных механизмов, лежащих в основе исследуемых метаболических фенотипов, даже за пределами ограниченных лабораторных условий. МетодыШтаммы и среды Для всех экспериментов по выращиванию E. coli BW25113 первоначально выращивали в течение 5 ч в среде Луриа-Бертани (LB), а затем в течение ночи в минимальной среде М9. КультивированиеРост E. coli в минимальной среде M9 с глюкозой и CAA отслеживали в 48-луночном планшете с помощью планшет-ридера Tecan Infinite M200 (Tecan) (37 °C, линейное встряхивание), измеряя поглощение при 600 нм. Сухой вес клеток определяли по заданному переводному коэффициенту 0,48 г клеток/ОП 600 64 . Для профилирования экзометаболома отбирали 50 мкл культуральной жидкости в моменты времени, указанные на рис. 1а, и клетки отделяли от супернатанта центрифугированием (4 ° C, 4000 об / мин, 10 мин). Профилирование экзометаболома Абсолютные концентрации глюкозы и ацетата в культуральных супернатантах определяли с помощью ферментных наборов (Megazyme). Параллельно мы использовали метод масс-спектрометрии с прямой проточной инъекцией (FIA-Q-TOF) 21 для профилирования относительных изменений концентраций метаболитов в супернатанте. В частности, культуральные супернатанты вводили в квадрупольный времяпролетный масс-спектрометр Agilent серии 6550 (Agilent, Санта-Клара, Калифорния), работавший в отрицательном режиме. Эксперименты по добавлению аминокислот Для отслеживания быстрых метаболических изменений в ответ на различные смеси аминокислот и для облегчения динамического отбора проб с высокой пропускной способностью, снижая риск артефактов обработки образцов, мы использовали 96-луночный бульон для цельной культуры. протокол извлечения 51 . Аликвоты клеточной культуры экстрагировали без разделения клеток с помощью экстракции холодным растворителем, а затем непосредственно вводили в времяпролетный масс-спектрометр 9.0329 21 . Мы дополняли экспоненциально растущие клетки E.coli смесями синтетических аминокислот (SAA), содержащими те же концентрации отдельных аминокислот, что и в CAA, но лишенные групп аминокислот, катаболизируемых в пируват (например, треонин, глицин и серин (SAA-TGS) или треонин, глицин, серин, триптофан, цистеин и аланин (SAA-TGSTCA)) и другие α-кетокислоты, такие как α-кетоглутарат (например, глутамат, глутамин, пролин и аргинин (SAA-GGAP). Чтобы подтвердить, что измерения в цельноклеточном бульоне (WCB) были репрезентативными для изменений внутриклеточного метаболома, мы также использовали протокол быстрой фильтрации 4 исключительно для мониторинга внутриклеточных изменений при возмущениях CAA и SAA и показали, что большинство моделей, которые мы получили в Образцы WCB напоминали измеренные внутриклеточные изменения (дополнительные данные 2). Для экспериментов с добавками, E. coli культивировали в 150 мл минимальной среды М9 с глюкозой в 1-литровых встряхиваемых колбах (37°С, 300 об/мин) до экспоненциальной фазы (OD 600 0,2–0,3) перед разделением культуры на равные части для дальнейшего культивирования (30 мл на 500 мл встряхиваемой колбы и 1,2 мл на лунку для 96-луночного культивирования соответственно). При ОП 600 , равной 0,5, в культуры добавляли смеси аминокислот до конечной концентрации 2 г/л. Для экстракции внутриклеточных метаболитов фильтр с клетками переносили в предварительно охлажденный (-20 °C) экстракционный раствор (ацетонитрил/метанол/вода; 2:2:1) с добавлением 25 мкМ фенилгидразина для дериватизации α-кетокислот 50 . Только для целенаправленного анализа 100 мкл экстракта E. coli 13 C добавляли в качестве внутреннего стандарта к экстракционному раствору 9.0329 66 , сразу после добавления фильтра. После инкубации при –20 °C в течение 1 часа образцы немедленно высушивали в вакууме при 30 °C для целевого анализа с помощью ЖХ-МС 62 или использовали непосредственно без высушивания для нецелевого анализа с помощью FIA-Q-TOF 21,51 , соответственно. Для целевого анализа с помощью ЖХ-МС высушенные образцы ресуспендировали в 100 мкл воды, 10 мкл которых вводили на УЭЖХ Waters Acquity с обращенно-фазовой колонкой Waters Acquity T3 (150 х 2,1 х 1,8 мм; Waters Corporation). (1) где v представляет собой вектор потоков, S стехиометрическую матрицу MxR (т.е. M метаболитов, R реакций), Sv = 0 является ограничением баланса массы и U / L — термодинамические и емкостные ограничения. Как правило, только один субстрат является лимитирующим, и максимальный рост соответствует максимальному урожаю. Среда in-silico определяется путем обеспечения импорта метаболита из внешнего компартмента во внутриклеточные (например, цитозольные) путем адаптации нижней/верхней границы соответствующей реакции. Часто выбирается распределение потока, которое оптимизирует производство биомассы и является наиболее экономичным, т. е. с минимальной суммой абсолютных значений 67 . Геномная модель E. coli , используемая в этом исследовании, учитывает 324 реакции обмена 25 . Когда среда становится сложной, а ограничивающий ресурс неизвестен, пространство допустимых решений увеличивается, и простые целевые функции, такие как чистая максимизация биомассы, больше не подходят 17,68 . (2) Здесь Ω – множество абсолютных измеренных потоков, ψ – множество измеренных потоков с относительными расчетными скоростями, c – неизвестный масштабный коэффициент, Δ t — интервал времени в часах между двумя соседними экземплярами, OD( t ) — оптическая плотность, измеренная в момент времени t и ɣ = 0,413 — коэффициент пересчета, используемый для преобразования показаний OD в грамм сухой биомассы (gDW). Решения были рассчитаны с использованием программного обеспечения оптимизации CPLEX IBM. Три минимизации проводились одна за другой в порядке, описанном выше. Активность белка рецептора цАМФ (CRP) Культивирование штамма E. Ферментный анализ PtsI Ферментный анализ PtsI проводили, как описано ранее Doucette et al. 5 . PtsI (фермент I), содержащий N-концевую гистидиновую метку, был очищен из штамма библиотеки ASKA b2416 73 , и его идентичность была подтверждена с помощью SDS page. Очищенный PtsI предварительно инкубировали в течение 5 мин при 37°С со смесью 1:4 2 мМ фосфоенолпирувата натрия (Sigma-Aldrich, ≥ 97%) и пирувата натрия (Sigma-Aldrich, ≥ 99%), в буфере, содержащем 25 мМ фосфата натрия, доведенного до pH 7, и 2,5 мМ MgCl 2 . (3) к среднему и с.с.м. из трех повторов эксперимента. L представляет собой 13 C-меченую фракцию пула PEP во время t , а k представляет собой подобранный параметр, представляющий константу скорости реакции мечения; 0,45 — это 13 C-меченая доля общего углерода. Расчетные значения k- для каждого анализа затем сравнивали с использованием анализа t для выявления соединений со значительным ингибирующим эффектом (рис. Сводка отчетаДополнительную информацию о дизайне исследования можно найти в Сводке отчета об исследовании природы, связанной с этой статьей. Ссылки
Теппер, Н. и Шломи, Т. Интегрированный вычислительный подход к анализу метаболических потоков в сочетании с выводом фрагментов столкновений тандем-МС. Биоинформа. Оксф. англ. 29 , 3045–3052 (2013). КАС Статья Google ученый Basan, M. et al. Избыточный метаболизм в Escherichia coli является результатом эффективного распределения протеома. Природа 528 , 99–104 (2015). ОБЪЯВЛЕНИЕ КАС Статья Google ученый Кремлинг А., Гейзельманн Дж., Роперс Д. и де Йонг Х. Понимание репрессии углеродного катаболита в Escherichia coli с использованием количественных моделей. Тенденции микробиол. 23 , 99–109 (2015). КАС Статья Google ученый Вемури, Г. Н., Альтман, Э., Сангурдекар, Д. П., Ходурский, А. Б. и Эйтман, М. А. Метаболизм переполнения в Escherichia coli во время стационарного роста: регуляция транскрипции и влияние окислительно-восстановительного отношения. заявл. Окружающая среда. микробиол. 72 , 3653–3661 (2006). КАС Статья Google ученый Zampar, G.G. et al. Временная системная организация переключения от гликолитической к глюконеогенной работе у дрожжей. Мол. Сист. биол. 9 , 651 (2013). Артикул Google ученый |
 Во время сна процессы катаболизма практически не работают, тот же кто хронически не досыпает – заставляет организм испытывать стресс и постоянно использовать катаболизм как средство борьбы с ним.
Во время сна процессы катаболизма практически не работают, тот же кто хронически не досыпает – заставляет организм испытывать стресс и постоянно использовать катаболизм как средство борьбы с ним.
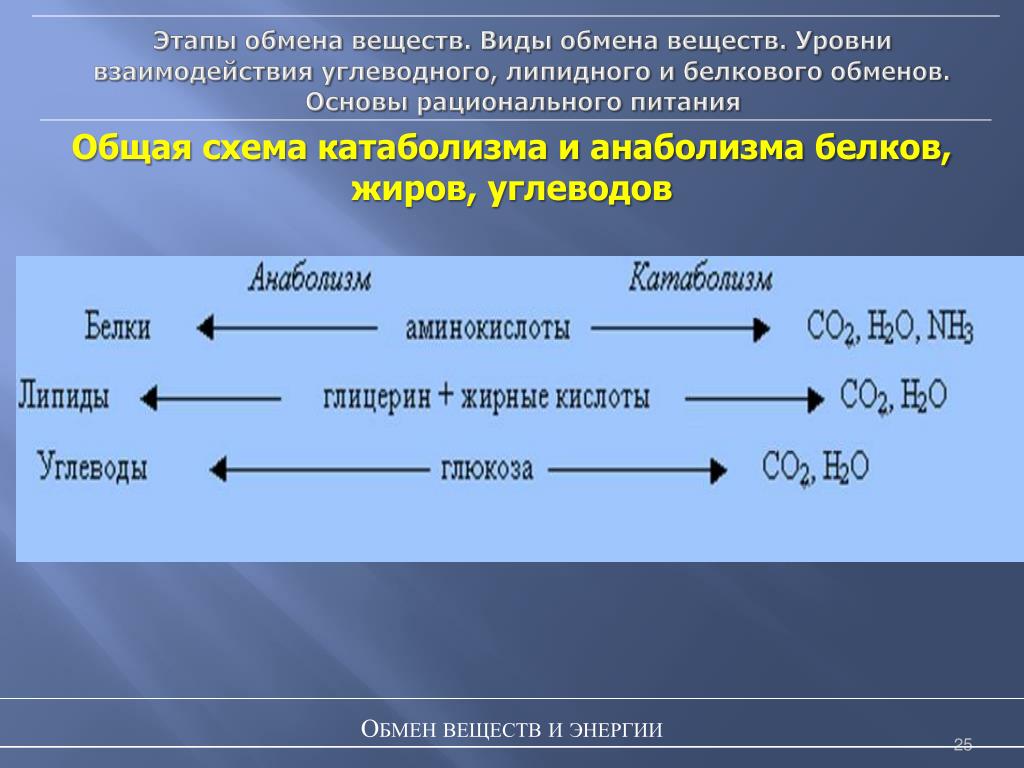
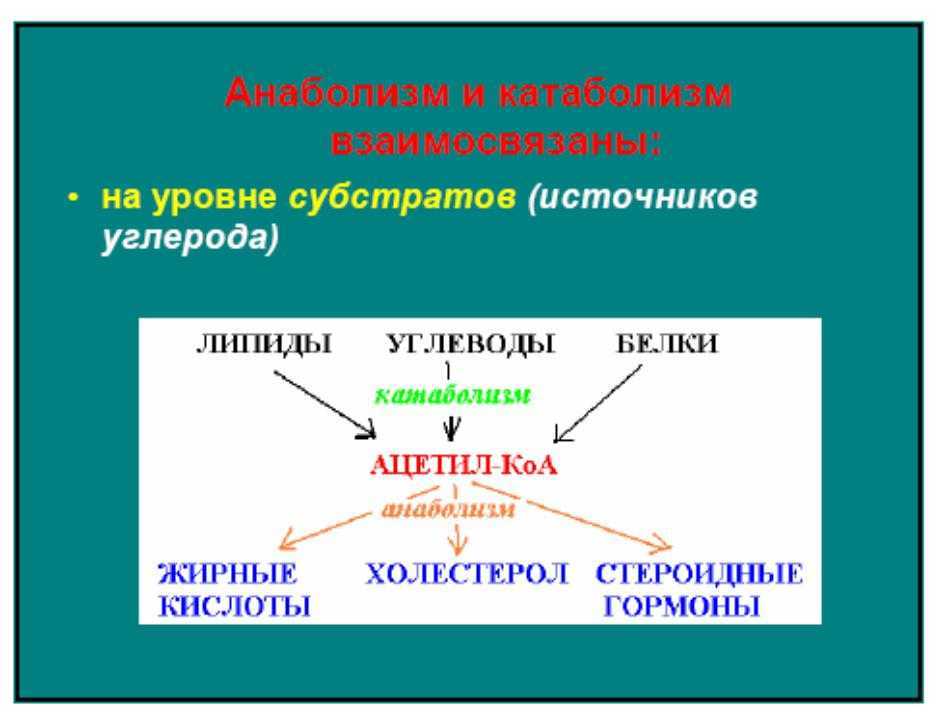 В процесс синтеза таких рецепторов глюкоза вписывается уже будучи производной самой себя — например, N-ацетилсиаловой кислотой. Сиаловая кислота включается в процесс на стадии посттрансляционной модификации протеинов (когда к белку в комплексе Гольджи после трансляции на рибосомах присоединяется небелковый компонент). Пример таких рецепторов — вирусные рецепторы (рецепторы к нейраминидазе вируса гриппа). Это тот самый рецептор клеток мерцательного эпителия дыхательных путей, который позволяет вирусу гриппа проникать в клетку и реализовать свой пролиферативный потенциал.
В процесс синтеза таких рецепторов глюкоза вписывается уже будучи производной самой себя — например, N-ацетилсиаловой кислотой. Сиаловая кислота включается в процесс на стадии посттрансляционной модификации протеинов (когда к белку в комплексе Гольджи после трансляции на рибосомах присоединяется небелковый компонент). Пример таких рецепторов — вирусные рецепторы (рецепторы к нейраминидазе вируса гриппа). Это тот самый рецептор клеток мерцательного эпителия дыхательных путей, который позволяет вирусу гриппа проникать в клетку и реализовать свой пролиферативный потенциал.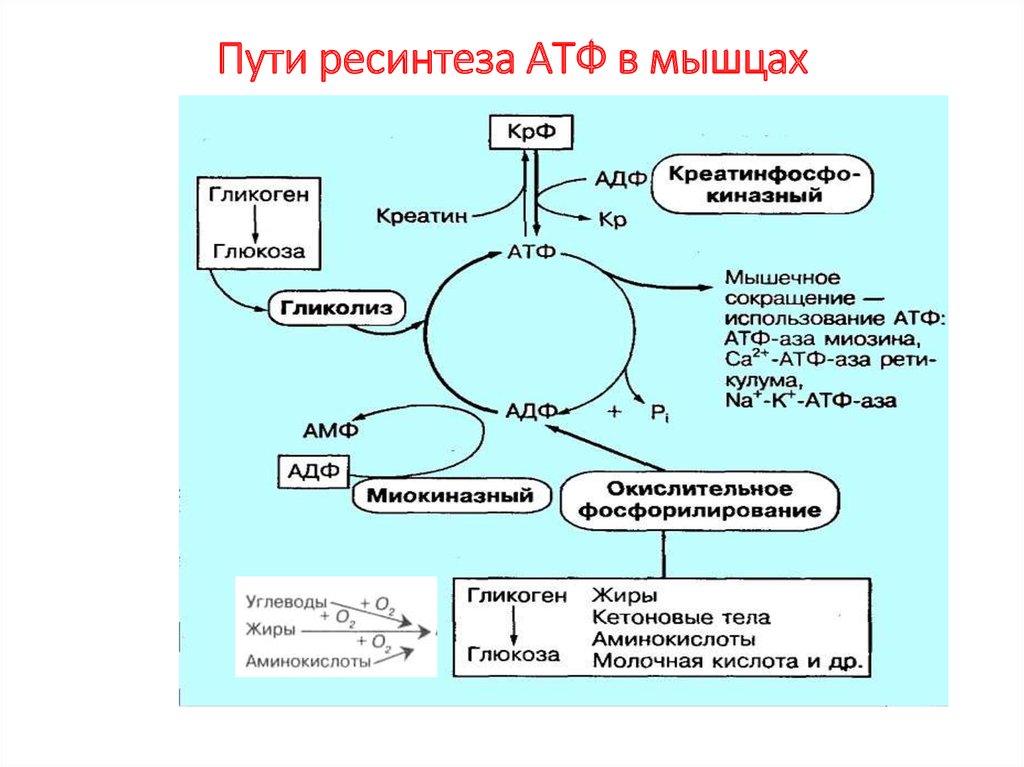
 главу 5).
главу 5).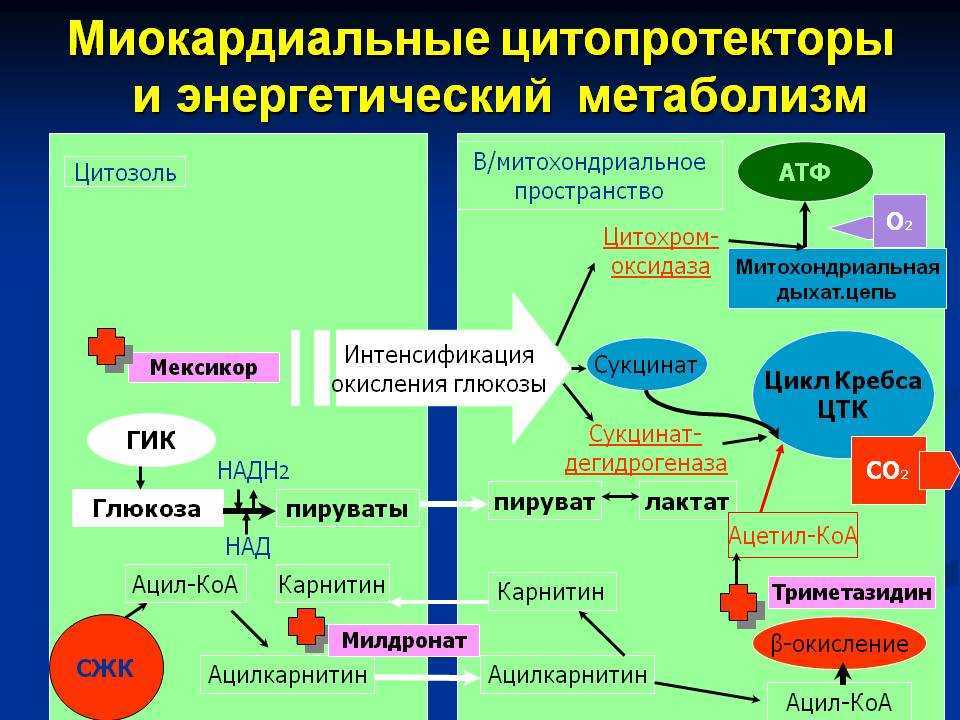 Care. – 2007. – Vol. 11. – P. R114.
Care. – 2007. – Vol. 11. – P. R114. – 2009. – Vol. 28. – P. 526-532.
– 2009. – Vol. 28. – P. 526-532.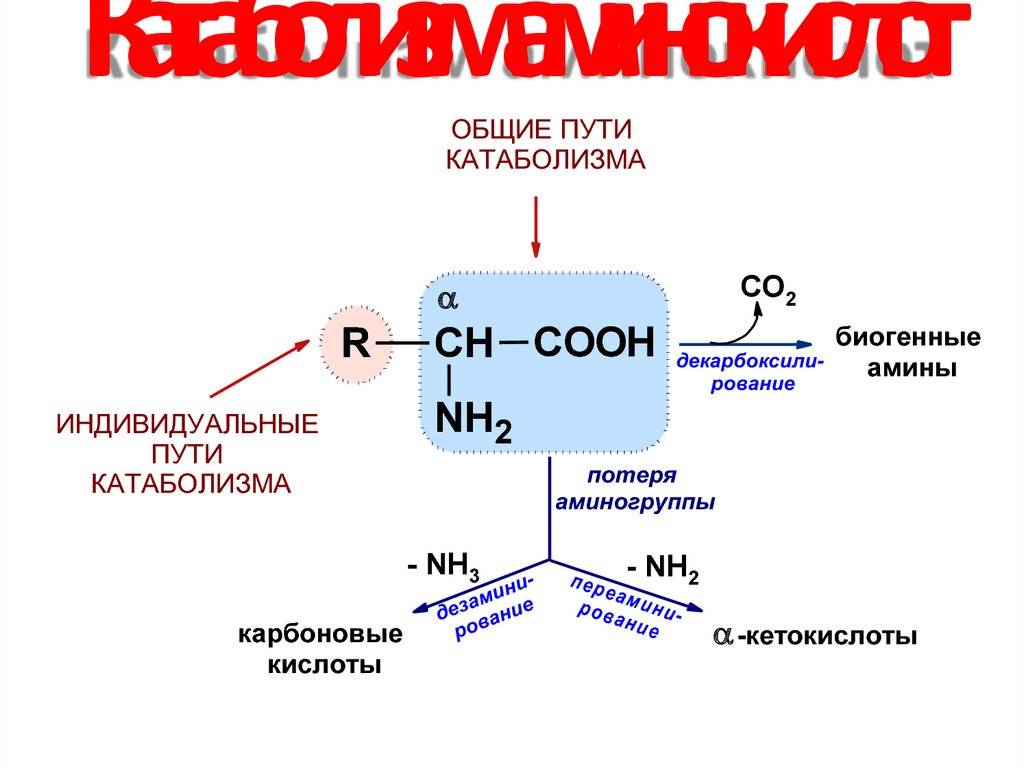
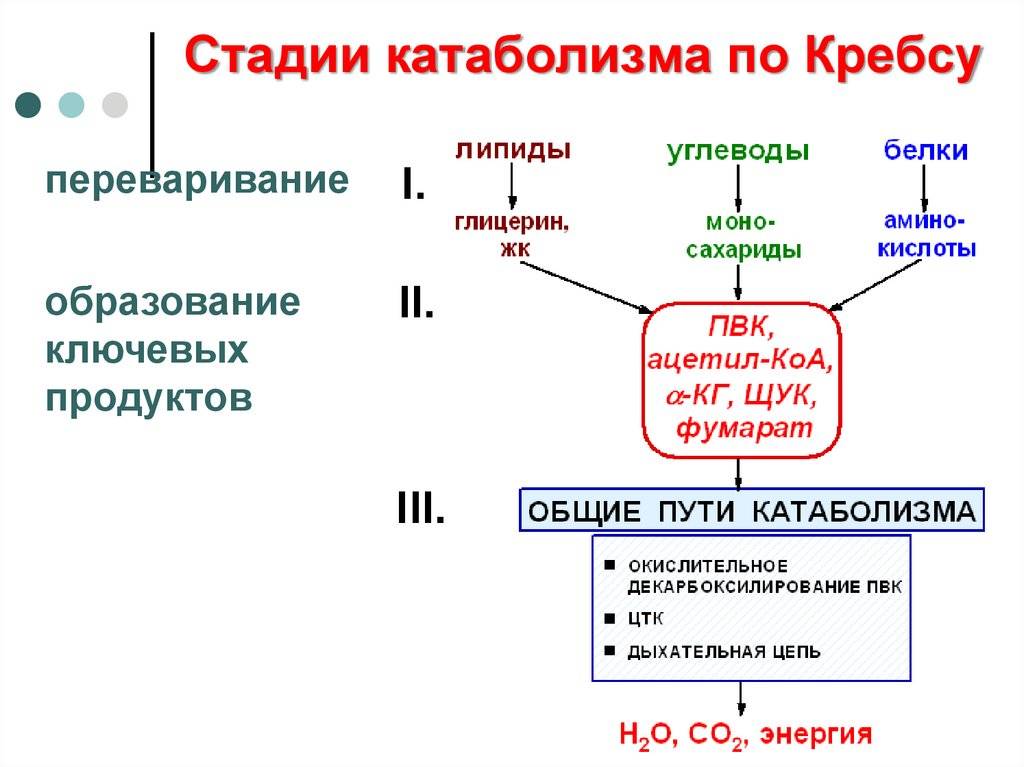 [PubMed: 6898442]
[PubMed: 6898442]
 Смерть клеток 2001 Апрель; 8 (4): 324-6. [PubMed: 11550083]
Смерть клеток 2001 Апрель; 8 (4): 324-6. [PubMed: 11550083]
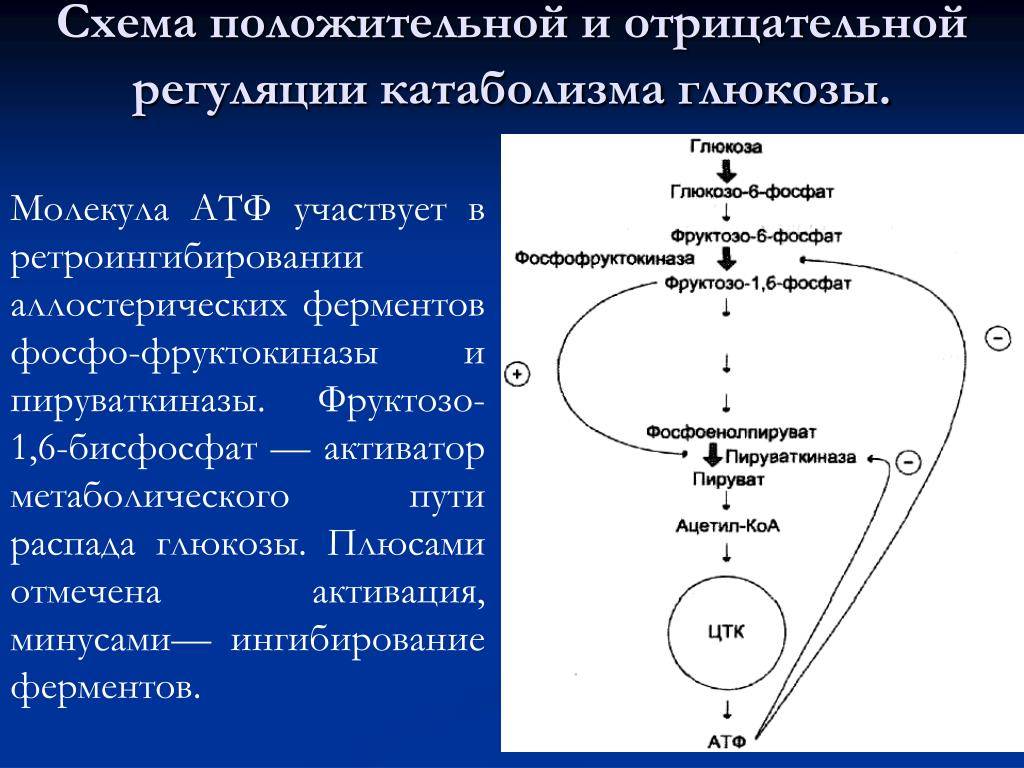 1056/NEJMoa010342
1056/NEJMoa010342
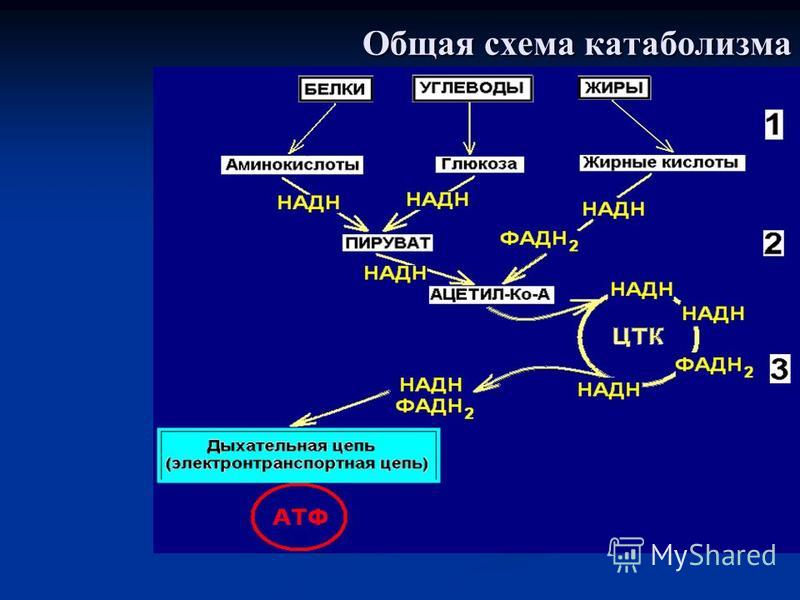

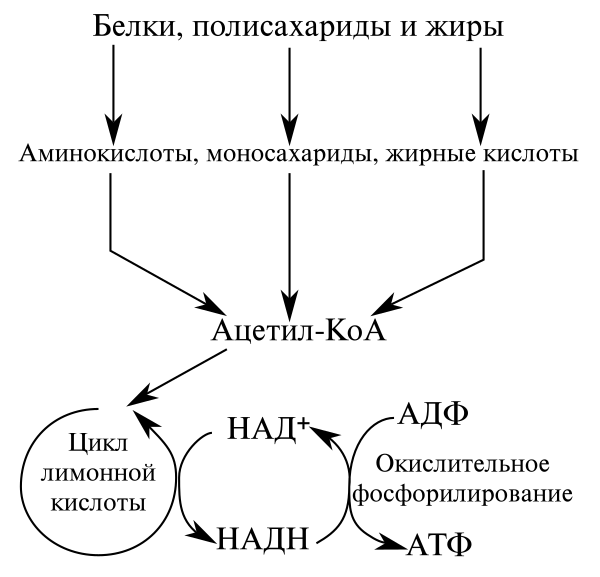
 2022 апр; 22(4):138-145. doi: 10.1016/j.bjae.2022.01.001. Epub 2022 8 февраля.
BJA Образование. 2022.
PMID: 35531075
Обзор.
Аннотация недоступна.
2022 апр; 22(4):138-145. doi: 10.1016/j.bjae.2022.01.001. Epub 2022 8 февраля.
BJA Образование. 2022.
PMID: 35531075
Обзор.
Аннотация недоступна.