Значение повышенного уровня мочевой кислоты в развитии и профилактике хронических неинфекционных заболеваний
Введение
Мочевая кислота (МК) — это конечный продукт пуринового обмена, являющийся основной составляющей клеточных запасов энергии, таких как АТФ, а также компонентом ДНК и РНК. В организме МК под воздействием фермента печени уриказы, который контролируется геном, способна подвергаться расщеплению до аллантоина — растворимого метаболита, который проще вывести из организма, что способствует снижению уровня МК в плазме крови. Однако в организме человека ген, который отвечает за выработку уриказы, нефункционален, что приводит к более высоким и подверженным колебаниям уровням МК в плазме крови человека в отличие от метаболизма МК в организме животных. Важнейшее последствие неактивного гена уриказы — повышение концентрации МК в крови людей по сравнению с животными, у которых не отмечается повышения уровня МК. В этой связи B. De Becker и соавт. [1] в 2018 г. в своем обзоре приводят данные о том, что мутация гена с потерей функции уриказы обеспечивает человеку некоторые эволюционные преимущества за счет антиоксидантных свойств МК.
Подагра
Формирование кристаллов моноурата натрия является основным звеном в патогенезе развития такого хронического неинфекционного заболевания, как подагра. Вследствие нарушения обмена МК, кристаллы могут откладываться в тканях, где нет активного кровотока: в суставах, сухожилиях, в которых возникает воспаление, ведущее к острой форме заболевания, при которой значения МК стабильном повышены и достигают концентрации более 60 мг/дл. Увеличению концентрации МК могут способствовать систематическое переедание, пристрастие к жирной мясной пище, богатой пуринами, тучность, недостаток физических нагрузок и наследственная предрасположенность, а основные причины повышения уровня МК перечислены в таблице (адаптирована по De Becker и соавт. , 2018) и отражены все причины увеличения МК в сыворотке крови, которые, по мнению авторов и в соответствии с самыми современными представлениями, считаются самыми главными причинами повышения МК. Как видно из таблицы, для профилактики повышения уровня МК необходимо сократить или совсем отказаться от алкогольных напитков, поскольку одной из основных причин гиперурекии является потребление алкоголя. Следующие профилактические рекомендации направлены на изменение рациона питания, включающее ограничение потребления фруктозы, морепродуктов и жирного мяса, которые позволят контролировать уровень МК. Далее следует ограничение калорийности суточного рациона питания для предупреждения развития ожирения и, как следствие, развития резистентности к инсулину. К профилактическим мероприятиям относится также лечение хронических воспалительных заболеваний почек и тонкого кишечника, так как эти органы участвуют в метаболизме МК, активно выводя МК из организма и препятствуя тем самым развитию гиперурикемии.
, 2018) и отражены все причины увеличения МК в сыворотке крови, которые, по мнению авторов и в соответствии с самыми современными представлениями, считаются самыми главными причинами повышения МК. Как видно из таблицы, для профилактики повышения уровня МК необходимо сократить или совсем отказаться от алкогольных напитков, поскольку одной из основных причин гиперурекии является потребление алкоголя. Следующие профилактические рекомендации направлены на изменение рациона питания, включающее ограничение потребления фруктозы, морепродуктов и жирного мяса, которые позволят контролировать уровень МК. Далее следует ограничение калорийности суточного рациона питания для предупреждения развития ожирения и, как следствие, развития резистентности к инсулину. К профилактическим мероприятиям относится также лечение хронических воспалительных заболеваний почек и тонкого кишечника, так как эти органы участвуют в метаболизме МК, активно выводя МК из организма и препятствуя тем самым развитию гиперурикемии.
Помимо развития подагры повышение МК в крови связывают с заболеваниями сердечно-сосудистой системы. На независимую связь повышенного уровня МК и развития сердечно-сосудистых заболеваний (ССЗ) указывают авторы исследования по изучению МК и маркеров воспаления как факторов, предшествующих многим хроническим неинфекционным заболеваниям [2]. О прямой и независимой связи c развитием ССЗ и смертности от них указывают результаты Фрамингемского исследования, опубликованные еще 20 лет назад [3].
Влияние повышенного уровня мочевой кислоты на развитие сердечно-сосудистых заболеваний
В течение длительного времени, как указано выше, известна взаимосвязь сывороточной концентрации МК и ССЗ, однако до настоящего времени остается неизвестным, является ли концентрация МК просто маркером риска или причинным фактором развития ССЗ, а также влияет ли лечение, направленное на снижение уровня МК, на выживаемость пациентов с такими заболеваниями. Уровень МК тесно взаимосвязан с такими состояниями, как артериальная гипертензия (АГ), дислипидемия, ожирение, нарушение обмена глюкозы, которые часто сопутствуют ССЗ или являются причиной развития и ухудшают течение этих заболеваний [2].
Исследователи предполагают, что повышенный уровень МК у пациентов с ССЗ может представлять собой компенсаторную реакцию, направленную на противодействие оксидантному стрессу [4]. Эта теория подтверждается известными мощными антиоксидантными свойствами МК, судя по результатам доклинических in vitro, так и в экспериментальных исследованиях [5].
Мочевая кислота и ожирение
Результаты нескольких эпидемиологических исследований, которые приводят в своей работе S. Nielsen и соавт. [6], продемонстрировали наличие положительной взаимосвязи между уровнем МК в сыворотке крови и ожирением. Так, в ходе 10-летнего наблюдательного исследования во всех группах участников вне зависимости от пола и этнической принадлежности обнаружили значительное увеличение индекса массы тела (ИМТ) на фоне повышения уровня МК [4, 7]. При этом не только повышение концентрации МК в сыворотке крови было связано с увеличением риска развития ожирения, но имела место и обратная взаимосвязь. K. Tanaka и соавт. [6] в своей работе, опубликованной в 2015 г., описали значимую взаимосвязь ИМТ и МК в сыворотке крови у взрослых близнецов в Японии после коррекции как по генетическим, так и по средовым факторам [8]. В ходе длительного проспективного исследования у 60 пациентов с сахарным диабетом II типа и выраженным ожирением (ИМТ>35 кг/м 2) отмечалось значительное снижение концентрации МК в сыворотке крови (p=0,0002 по сравнению с исходным уровнем) после хирургических вмешательств, приводивших к снижению массы тела в среднем на 34,3 кг и отсутствие снижения уровня МК после уменьшения массы тела более чем на 5 кг после нехирургических вмешательств.
Мочевая кислота и артериальная гипертензия
В рамках Национальной программы проверки здоровья и питания было обнаружено, что концентрация МК в сыворотке крови, превышающая 5,5 мг/дл, связана с увеличением риска развития АГ в 2 раза, а увеличение уровня МК в сыворотке крови на каждые 0,1 мг/дл приводит к увеличению риска развития АГ на 38% у лиц в возрасте от 12 до 17 лет [9]. J. Fang и M. Alderman [9] писали о том, что в когорте пожилых китайцев в возрасте от 90 до 108 лет такой взаимосвязи между концентрацией МК в сыворотке крови и уровнем АД зарегистрировано не было.
Из полученных данных можно сделать вывод о том, что у молодых людей выражена взаимосвязь между риском АГ и уровнем МК, а у очень пожилых представителей азиатской популяции взаимосвязь между уровнем МК и АД не была выявлена. Сходные данные получены в другой азиатской популяции, а именно в корейской, в которой у лиц моложе 40 лет была выявлена значимая связь между уровнем МК и АД, а у лиц старше 40 лет — нет. А в японской популяции, наоборот, у молодых участников не было обнаружена взаимосвязь между уровнем МК и АД, а у лиц старше 40 лет данная взаимосвязь имела место. Однако эти исследования были проведены в различных азиатских популяциях, и существовали дополнительные факторы, повлиявшие на результаты исследований, но тем не менее обнаруженная взаимосвязь была значимой и в той или иной мере зависела от возраста.
Эпидемиологические, клинические и экспериментальные данные указывают на наличие взаимосвязи между повышенным уровнем МК и риском развития АГ. Так, D. Feig и соавт. [4] в обзоре 16 длительных исследований, проведенном в 2008 г., продемонстрировали независимое от других факторов повышение риска развития АГ в течение 5 лет на фоне гиперурикемии. В более поздних исследованиях авторы подтвердили увеличение риска развития АГ в связи с повышенным уровнем МК. Гиперурикемия чаще встречается при первичной, чем при вторичной АГ. У 25—60% обследуемых с нелеченной АГ регистрируется гиперурикемия. У 90% подростков с эссенциальной АГ уровень МК был выше 5,5 мг/дл. В когортном исследовании подростков в возрасте 12—17 лет продемонстрировано наличие прогностической, независимой от других факторов риска, связи уровня МК с развитием АГ в будущем [10].
У пациентов с АГ изменение уровня МК в сыворотке крови позволяет прогнозировать ответ на антигипертензивную терапию. В ходе клинического исследования систолической гипертензии у пожилых людей (SHEP), включавшего 4327 мужчин и женщин в возрасте старше 60 лет с изолированной систолической АГ, пациентов случайным образом распределяли в группы для назначения тиазидоподобного диуретика хлорталидона или плацебо [11].
Диуретики, часто назначаемые больным АГ и сердечной недостаточностью (СН), способствуют увеличению концентрации МК (см. таблицу). Однако согласно представленным выше данным важное значение имеет то, на сколько возрастает МК при лечении диуретиками, а незначительное увеличение, как доказано в исследовании SHEP (менее чем на 0,06 ммоль/л) даже способствует снижению частоты коронарных событий более чем на 40% у пожилых людей [11].
Мочевая кислота, ишемическая болезнь сердца и смертность
В ходе первого исследования в рамках Национальной программы проверки здоровья и питания (NHANES I), представлявшего собой одномоментное популяционное исследование, включавшее 5926 обследуемых в возрасте 25—74 лет, повышенный уровень МК в сыворотке их крови сопровождался увеличением отношения рисков (ОР), связанных со смертностью от ишемической болезни сердца (ИБС), до 1,77 (95% ДИ 1,08–3,98) у мужчин и до 3,0 (95% ДИ 1,45—6,28) у женщин. После выполнения статистической коррекции по смещающим факторам было выявлено, что повышение уровня МК на каждые 59,48 ммоль/л приводит к увеличению риска смерти в связи с ССЗ и ИБС на 9% и 17% у мужчин и 26 и 30% у женщин соответственно [9].
После выполнения статистической коррекции по смещающим факторам было выявлено, что повышение уровня МК на каждые 59,48 ммоль/л приводит к увеличению риска смерти в связи с ССЗ и ИБС на 9% и 17% у мужчин и 26 и 30% у женщин соответственно [9].
В ходе исследования AMORIS (Apolipoprotein MOrtality RISk study; Аполипопротеины: исследование риска смертности) оценивалась взаимосвязь между уровнем МК в сыворотке крови и риском несмертельного инфаркта миокарда, инсульта или СН у 417 734 мужчин и женщин, проходивших диспансеризацию, со средним периодом наблюдения 11,8 года (диапазон от 7 до 17 лет) [12]. В ходе нескольких исследований не удалось продемонстрировать значимой взаимосвязи между повышением уровня МК и сердечно-сосудистыми событиями и смертностью. В ходе Фрамингемского исследования, включавшего 6763 участников, было зарегистрировано 617 событий, связанных с ИБС, 429 случаев смерти от ССЗ и 1460 — от любых других причин. У мужчин после коррекции по возрасту повышенный уровень МК не был связан с риском нежелательных событий. У женщин была обнаружена взаимосвязь между уровнем МК и повышением риска смерти от ИБС (p=0,002), ССЗ (p=0,009) или любых причин (p=0,03) [3].
У женщин была обнаружена взаимосвязь между уровнем МК и повышением риска смерти от ИБС (p=0,002), ССЗ (p=0,009) или любых причин (p=0,03) [3].
B. De Becker и соавт. [1] в своем обзоре описали два крупных исследования, проведенных в Азии, и обнаружили значимую взаимосвязь между уровнем МК, заболеваемостью и смертностью от ИБС. В одном проспективном когортном исследовании, включившем 41 879 мужчин и 48 514 женщин (старше 35 лет) с периодом наблюдения в среднем 8,2 года, продемонстрировано, что гиперурикемия (уровень МК в сыворотке крови более 7 мг/дл) связана со значительным повышением скорректированного риска смертности от разных причин, ССЗ или инсульта на 16, 39 и 35% соответственно. В другом исследовании, включившем почти в 3 раза больше участников (n=128 569) старше 20 лет со средним периодом наблюдения более 7,33 года, было продемонстрировано повышение риска ИБС у мужчин (ОР=1,25; 95% ДИ 1,11—1,40) и женщин (ОР=1,19; 95% ДИ 1,02—1,38) с гиперурикемией (МК более 7 мг/дл).
Еще одно когортное исследование, включавшее 28 613 пожилых женщин (средний возраст 62,3 года), проведенного в Австрии, с периодом наблюдения 15,2 года, продемонстрировало, что уровень МК является независимым фактором риска смерти от любых ССЗ, включая острые, подострые и хронические формы ИБС, СН и инсульта [13].
В ходе проспективного популяционного исследования, известного как The Tromsо Study с периодом наблюдения более 15,2 года, включавшего 2696 мужчин и 3004 женщин с продолжительностью периода наблюдения 15 лет, о котором также упоминается в обзоре о взаимосвязи МК и ССЗ, была продемонстрирована ассоциация уровня МК в сыворотке крови и смертности от любых причин у мужчин (ОР=1,11; 95% ДИ 1,02—1,20) и у женщин (ОР=1,16; 95% ДИ 1,05—1,29) при повышении уровня МК на величину одного стандартного отклонения (87 мкмоль/л) [14].
В рамках длительного наблюдательного исследования у 127 771 пожилых людей (в возрасте старше 65 лет), проведенного в Тайване [15], выявлена U-образная зависимость между уровнем МК и смертностью от любых причин или ССЗ. Повышение смертности отмечалось при уровне МК более 4 мг/дл (ОР=1,16; 95% ДИ 1,07—1,25) и не менее 8 мг/дл (ОР=1,13; 95% ДИ 1,06—1,21) по сравнению с нормальным уровнем МК (4—5 мг/дл) в течение среднего периода наблюдения продолжительностью 5,8 года. Также отмечалась более высокая смертность от ССЗ при уровне МК менее 4 мг/дл (ОР=1,19; 95% ДИ 1,00—1,40) и не менее 7 мг/дл (ОР=1,17; 95% ДИ 1,04—1,32). Среди обследуемых с низким уровнем МК (менее 4 мг/дл) повышение смертности от любых причин или ССЗ отмечалось только при недостаточном питании.
Повышение смертности отмечалось при уровне МК более 4 мг/дл (ОР=1,16; 95% ДИ 1,07—1,25) и не менее 8 мг/дл (ОР=1,13; 95% ДИ 1,06—1,21) по сравнению с нормальным уровнем МК (4—5 мг/дл) в течение среднего периода наблюдения продолжительностью 5,8 года. Также отмечалась более высокая смертность от ССЗ при уровне МК менее 4 мг/дл (ОР=1,19; 95% ДИ 1,00—1,40) и не менее 7 мг/дл (ОР=1,17; 95% ДИ 1,04—1,32). Среди обследуемых с низким уровнем МК (менее 4 мг/дл) повышение смертности от любых причин или ССЗ отмечалось только при недостаточном питании.
Кроме того, в обзоре опубликованы результаты проведенного метаанализа, где было проанализировано 12 популяционных исследований с 457 915 участниками, оценивающих взаимосвязь между уровнем МК и ИБС, а также 7 исследований с 237 433 участниками, оценивающих взаимосвязь между уровнем МК и смертностью от ИБС [4]. Общий показатель ОР составил 1,206 (95% ДИ 1,066—1,364; p=0,003) для заболеваемости ИБС и 1,209 (95% ДИ 1,003—1,457; p=0,047) для смертности от ИБС.
В другом метаанализе, проведенном M. Li и соавт. и включившем 29 проспективных когортных исследований с общим числом участников 958 410, гиперурикемия была связана с повышением риска заболеваемости ИБС (ОР=1,13; 95% ДИ 1,05—1,21) и смертности от ИБС (ОР=1,27; 95% ДИ 1,16—1,39) [16]. Увеличение уровня МК на каждый 1 мг/дл приводило к увеличению риска смерти от ИБС на 13% (ОР=1,13; 95% ДИ 1,06—1,20). Анализ «доза—ответ» продемонстрировал увеличение риска смертности от ИБС при повышении уровня МК на каждый 1 мг/дл у женщин (ОР=2,44; 95% ДИ 1,69—3,54) при отсутствии повышения у мужчин (ОР=1,02; 95% ДИ 0,84—1,24). Результаты этого метаанализа указывают, что гиперурикемия может повышать риск событий, связанных с ИБС (особенно смертность от ИБС у женщин).
Кроме того, в недавнем исследовании, выполненном в 2018 г., было показано, что повышенный уровень МК сыворотки крови более чем на 5,6 мг/дл связан с риском смертности от различных причин у пациентов с острым коронарным синдромом (ОКС) после чрескожных коронарных вмешательств (ЧКВ) [17]. На рисунке изображена кривая, обозначающие все случаи смерти (в %) в зависимости от уровня МК в плазме крови [17]. Так, если у пациентов, перенесших ОКС, после ЧКВ уровень МК был ниже 5,6 мг/дл, то смертность от всех причин была самой низкой.
На рисунке изображена кривая, обозначающие все случаи смерти (в %) в зависимости от уровня МК в плазме крови [17]. Так, если у пациентов, перенесших ОКС, после ЧКВ уровень МК был ниже 5,6 мг/дл, то смертность от всех причин была самой низкой.
Примечание. Если уровень МК не превышает 5,6 мг/дл, смертность от всех причин самая низкая.
В этом исследовании была изучена и общая смертность, и смертность от любых причин. Время среднего наблюдения составило 246,31±49,16 сут; 168 (7,32%) пациентов умерли за время наблюдения; 53 (9,36%) из этих пациентов были в группе с высоким уровнем МК и 115 (6,65%) — в группе с низким уровнем МК. Разница в показателях смертности от всех причин была статистически значима между группами (р=0,031).
Все авторы описанных выше исследований с данными, собранными в разных частях света и популяционных, и наблюдательных и проведенных метаанализах доказали наличие значимой взаимосвязи между повышенным уровнем МК и заболеваемости и смертности от ИБС. Так что напрашивается вывод о возможном контроле повышенного уровня МК для профилактики развития и смертности от ИБС.
Так что напрашивается вывод о возможном контроле повышенного уровня МК для профилактики развития и смертности от ИБС.
Мочевая кислота и сердечная недостаточность
У пациентов с СН часто отмечается повышенный уровень МК. В ходе Фрамингемского когортного исследования изучали взаимосвязь между уровнем МК и заболеваемостью СН у 4912 участников в течение в среднем 29 лет. Заболеваемость СН у обследуемых коррелирует с показателем МК на уровне максимального квартиля (более 6,3 мг/дл), повышается в 6 раз по сравнению с обследуемыми с МК на уровне наиболее низкого квартиля (менее 3,4 мг/дл) [3]. В рамках исследования здоровья сердечно-сосудистой системы (Cardiovascular health study) среди пожилых пациентов (старше 65 лет) без СН на момент включения в исследование отмечалось повышение риска развития СН на 30% у лиц с гиперурикемией (исходный уровень МК не менее 6 мг/дл у женщин и не менее 7 мг/дл у мужчин) по сравнению с пациентами без гиперурикемии в течение периода наблюдения длительностью 8,1 года (21% против 18%; ОР=1,30; 95% ДИ 1,05—1,60; p=0,015). Взаимосвязь гиперурикемии и заболеваемости СН была значимой только в подгруппах с нормальной функцией почек, а также у лиц без АГ, приема тиазидовых диуретиков или гиперинсулинемии. Повышение уровня МК на 1 мг/дл было связано с увеличением риска заболеваемости ИБС на 12% (ОР=1,12; 95% ДИ 1,03—1,22; p=0,006) [18].
Взаимосвязь гиперурикемии и заболеваемости СН была значимой только в подгруппах с нормальной функцией почек, а также у лиц без АГ, приема тиазидовых диуретиков или гиперинсулинемии. Повышение уровня МК на 1 мг/дл было связано с увеличением риска заболеваемости ИБС на 12% (ОР=1,12; 95% ДИ 1,03—1,22; p=0,006) [18].
В ходе метаанализа 28 клинических исследований продемонстрировано повышение риска развития ИБС (ОР=1,65; 95% ДИ 1,41—1,94), смертности от всех причин (ОР=2,15; 95% ДИ 1,64—2,83), смертности от ССЗ (ОР=1,45; 95% ДИ 1,18—1,78) и совокупного показателя смертности или заболеваемости ССЗ (ОР=1,39; 95% ДИ 1,18—1,63) на фоне гиперурикемии у пациентов с СН [19].
Авторы исследования [20] обнаружили, что при повышении уровня МК на 1 мг/мл увеличивает риск развития СН на 19% (ОР=1,19; 95% ДИ 1,17—1,21) и риск смертности от всех причин на 4% (ОР=1,04; 95% ДИ 1,02—1,06). В течение 15 лет наблюдения в рамках Британского регионального исследования заболеваний сердца (3440 мужчин в возрасте 60—79 лет без инфаркта миокарда или СН в анамнезе, как получающих, так и не получающих антигипертензивные препараты) было зарегистрировано 260 случаев развития СН. Повышенный уровень МК в сыворотке крови был связан со значительным увеличением риска развития СН у мужчин, получающих антигипертензивную терапию при отсутствии повышения риска у лиц, не получавших препаратов для контроля АД (p=0,003). Среди мужчин, получавших антигипертензивную терапию, уровень МК более 410 мкмоль/л был связан с увеличением риска развития СН более чем в 2 раза по сравнению с пациентами с МК ниже 350 мкмоль/л после коррекции по образу жизни и имеющимся факторам риска (ОР=2,26; 95% ДИ 1,23—4,15).
Повышенный уровень МК в сыворотке крови был связан со значительным увеличением риска развития СН у мужчин, получающих антигипертензивную терапию при отсутствии повышения риска у лиц, не получавших препаратов для контроля АД (p=0,003). Среди мужчин, получавших антигипертензивную терапию, уровень МК более 410 мкмоль/л был связан с увеличением риска развития СН более чем в 2 раза по сравнению с пациентами с МК ниже 350 мкмоль/л после коррекции по образу жизни и имеющимся факторам риска (ОР=2,26; 95% ДИ 1,23—4,15).
В приведенных выше исследованиях доказана высоко значимая связь между повышенным уровнем МК и развитием СН независимо от медикаментозного лечения. Более того, в исследовании было подчеркнуто, что даже при незначительном повышении уровня МК на 1 мг/мл увеличивается риск СН на 19% и риск смертности от всех причин на 4% [20].
Мочевая кислота и фибрилляция предсердий
Результаты нескольких исследований указывают на взаимосвязь повышения уровня МК и риска развития фибрилляции предсердий. В ходе исследования риска развития атеросклероза (ARIC) повышение уровня МК на каждый квартиль относительно исходного уровня было связано с увеличением риска фибрилляции предсердий (ОР=1,16; 95% ДИ 1,06—1,26) [21].
В ходе исследования риска развития атеросклероза (ARIC) повышение уровня МК на каждый квартиль относительно исходного уровня было связано с увеличением риска фибрилляции предсердий (ОР=1,16; 95% ДИ 1,06—1,26) [21].
В ходе крупного японского исследования [22], включавшего 285 882 последовательно набранных пациентов, продемонстрирована значимая независимая взаимосвязь уровня МК и риска фибрилляции предсердий со скорректированным ОР 1,19 (95% ДИ 1,14—1,24; p<0,0001) у мужчин и 1,44 (95% ДИ 1,34—1,55; р<0,0001) у женщин. В ходе одномоментных исследований [23] среднее значение уровня МК составляла 6,2 мг/дл (диапазон от 5,4 до 6,4мг/дл) у пациентов с фибрилляцией предсердий по сравнению с 5,1 мг/дл (диапазон от 4,9 до 5,7 мг/дл) у пациентов без фибрилляции предсердий. В когортных исследованиях ОР фибрилляции предсердий составил 1,67 (95% ДИ 1,23—2,27) для лиц с высоким уровнем МК (более 7 мг/дл) по сравнению с обследуемыми с низким уровнем МК.
Представленные результаты исследований по взаимосвязи повышенного уровня МК и риска мерцательной аритмии показали, что повышенный уровень МК достоверно увеличивает риска развития мерцательной аритмии. Существует порог уровня МК — более 7 мг/дл, значимо связанный с риском развития мерцательной аритмии.
Существует порог уровня МК — более 7 мг/дл, значимо связанный с риском развития мерцательной аритмии.
Патофизиологические механизмы взаимосвязи сердечно-сосудистых заболеваний и мочевой кислоты
Предполагаемые механизмы участия МК в развитии ССЗ можно разделить на три категории. Во-первых, уровень МК тесно коррелирует практически со всеми известными сердечно-сосудистыми факторами риска развития ССЗ, инсулинорезистентностью, метаболическим синдромом, ожирением, часто сопутствующей ожирению неалкогольной жировой болезнью печени и хронической болезнью почек [24]. Во многих случаях существует тесная взаимосвязь МК и этих состояний, что затрудняет оценку индивидуального вклада каждого из факторов в развитие заболевания. В этом отношении повышенный уровень МК может рассматриваться в качестве сердечно-сосудистого фактора риска заболевания или эпифеномена, сопутствующего имеющимся кардиометаболическим факторам риска (маркеры риска развития ССЗ) [2].
Во-вторых, МК является продуктом активности ксантиноксидазы, которая, в свою очередь, представляет собой один из основных источников активных форм кислорода в организме (АФК). Повышенный уровень МК может быть маркером или последствием повышенной активности ксантиноксидазы и повышенного уровня оксидантного стресса. Ксантиноксидаза сама по себе тесно связана с развитием ССЗ, однако эта взаимосвязь не определяется исключительно образованием АФК и усилением оксидантного стресса. Функционирование ксантиноксидазы тесно связано с другим ферментом, образующим большое количество АФК, — NADPH-оксидазой (АФК, образуемые ксантиноксидазой, активируют NADPH-оксидазу и наоборот) [25].
Повышенный уровень МК может быть маркером или последствием повышенной активности ксантиноксидазы и повышенного уровня оксидантного стресса. Ксантиноксидаза сама по себе тесно связана с развитием ССЗ, однако эта взаимосвязь не определяется исключительно образованием АФК и усилением оксидантного стресса. Функционирование ксантиноксидазы тесно связано с другим ферментом, образующим большое количество АФК, — NADPH-оксидазой (АФК, образуемые ксантиноксидазой, активируют NADPH-оксидазу и наоборот) [25].
В-третьих, МК сама по себе способна оказывать широкий спектр негативных воздействий на клеточном уровне и может быть напрямую вовлечена в патогенез развития ССЗ [4].
В целом прооксидантное действие, истощение запасов оксида азота (NO), эндотелиальная дисфункция, провоспалительное действие и стимуляция вазоконстрикторных и пролиферативных сосудистых изменений относятся к наиболее широко рассматриваемым механизмам вовлечения МК в патогенез ССЗ. Тем не менее МК действует в качестве антиоксиданта и играет важную физиологическую роль в защите организма от оксидантного стресса [2].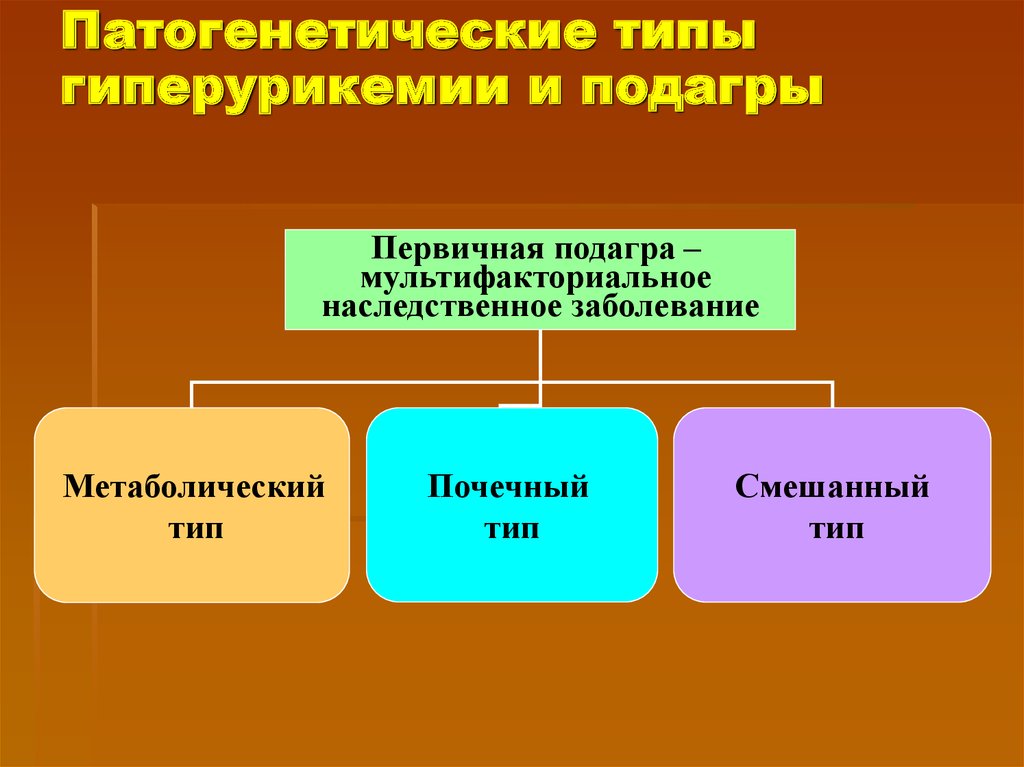
Возрастные различия и взаимосвязь между мочевой кислотой и факторами, способствующими здоровью сердечно-сосудистой системы
Гиперурикемия чаще встречается у мужчин, чем у женщин. Доля мужчин с гиперурикемией (31,9%) сопоставима с долей мужчин с гиперхолестеринемией с повышенным уровнем ЛПНП (36,5%). В то же время гиперурикемия отмечается у 5,3% женщин. Несмотря на небольшое число женщин с гиперурикемией в популяции, эта группа пациентов заслуживает особого внимания, так как результаты нескольких эпидемиологических исследований указывают, что пороговое значение уровня МК в сыворотке крови, при котором отмечается повышение риска ССЗ, у женщин ниже, чем у мужчин (6,2 и 7,5 мг/дл соответственно) [26].
Результаты исследований указывают на наличие возрастных особенностей взаимосвязи МК и сердечно-сосудистых факторов риска. Так, продемонстрировано отсутствие значимой взаимосвязи между уровнем МК и риском развития АГ у лиц в возрасте старше 60 лет. Также обнаружено, что распространенность идеального АД линейно снижается пропорционально уровню МК в более молодом возрасте (от 20 до 59 лет), в то время как у лиц в возрасте 60 лет и старше не обнаруживается тенденций к изменению распространенности идеального АД в зависимости от уровня МК. Точный механизм возрастных различий по взаимосвязи уровня МК и сердечно-сосудистых факторов риска остается неизученным. Возможно, вышеописанные механизмы становятся менее заметными в более пожилом возрасте на фоне характерных для старения изменений, включающих активацию воспаления и ренин-ангиотензин-альдостероновой системы почек. Другой возможный механизм уменьшения влияния уровня МК может быть связан с тем, что уплотнение аорты является ведущей причиной повышения АД в пожилом возрасте [26, 27].
Точный механизм возрастных различий по взаимосвязи уровня МК и сердечно-сосудистых факторов риска остается неизученным. Возможно, вышеописанные механизмы становятся менее заметными в более пожилом возрасте на фоне характерных для старения изменений, включающих активацию воспаления и ренин-ангиотензин-альдостероновой системы почек. Другой возможный механизм уменьшения влияния уровня МК может быть связан с тем, что уплотнение аорты является ведущей причиной повышения АД в пожилом возрасте [26, 27].
Современные представления о роли диеты для снижения уровня мочевой кислоты в профилактике гиперурикемии
Считается, что питание является одним из основных факторов, оказывающих влияние на уровень МК в плазме крови. Так, известны пятнадцать различных пищевых продуктов, которые могут оказывать влияние на уровень МК в сыворотке крови. К ним относятся пиво, вино, другие алкогольные напитки, газированные напитки, обезжиренное молоко и мясо (говядина, свинина или баранина), которые способствуют повышению МК; а также продукты, которые способствуют снижению МК, к ним относят сыр, все фрукты, кроме цитрусовых, мясо птицы, картофель, черный хлеб, арахис, маргарин, зерновые злаки в термически необработанном виде и яйца. Однако следует отметить, что каждый из указанных продуктов может объяснять менее 1% вариабельности уровня МК в сыворотке крови. В настоящее время большое внимание уделяется наследственным факторам, на долю которых отводят до 8% вариабельности уровня МК в сыворотке крови [28].
Однако следует отметить, что каждый из указанных продуктов может объяснять менее 1% вариабельности уровня МК в сыворотке крови. В настоящее время большое внимание уделяется наследственным факторам, на долю которых отводят до 8% вариабельности уровня МК в сыворотке крови [28].
Заключение
Мочевая кислота — конечный продукт метаболизма эндогенных и поступающих с пищей пуриновых соединений у человека, образующийся из ксантина под действием ксантиноксидазы. Существуют многочисленные данные о взаимосвязи гиперурикемии с заболеваемостью и смертностью вследствие ССЗ. В то время как в части исследований уровень МК в сыворотке крови рассматривается в качестве маркера определенных патофизиологических процессов, другие авторы предполагают наличие причинно-следственной связи между уровнем МК в сыворотке крови и ССЗ, рассматривают гиперурикемию в качестве кардиометаболического нарушения. Требуются дальнейшие исследования с целью определения взаимосвязи уровня МК и ССЗ для мощной доказательной базы.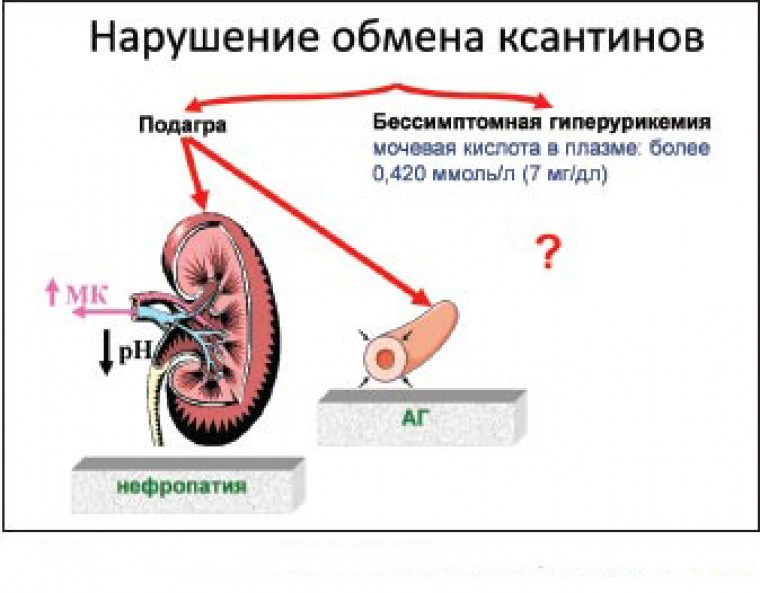 Возможно, при проведении диспансеризации и профилактического консультирования врачам следует обращать внимание на повышенный уровень мочевой кислоты и рекомендовать пациентам диспансерное наблюдение из-за повышенного риска развития не только ССЗ, но и других неинфекционных хронических заболеваний.
Возможно, при проведении диспансеризации и профилактического консультирования врачам следует обращать внимание на повышенный уровень мочевой кислоты и рекомендовать пациентам диспансерное наблюдение из-за повышенного риска развития не только ССЗ, но и других неинфекционных хронических заболеваний.
Авторы заявляют об отсутствии конфликта интересов.
Современные аспекты патогенеза и коррекции гиперурикемии, а также ассоциированных с ней состояний uMEDp
Рассмотрены причины возникновения гиперурикемии, в том числе влияние таких факторов, как ожирение, метаболический синдром, снижение функции почек, злоупотребление алкоголем, длительный прием препаратов ацетилсалициловой кислоты и диуретиков. Проанализирована роль гиперурикемии в нарушении метаболизма, развитии атеросклероза, заболеваний сердечно-сосудистой системы и почек. Продемонстрированы возможности уратснижающей терапии в коррекции гиперурикемии при подагре, а также при бессимптомной гиперурикемии. Обсуждаются перспективы такого лечения в отношении снижения риска кардио- и цереброваскулярных осложнений, прогрессирования почечной недостаточности.
Обсуждаются перспективы такого лечения в отношении снижения риска кардио- и цереброваскулярных осложнений, прогрессирования почечной недостаточности.
Стремительный прогресс медицинской науки в последние десятилетия не мог не затронуть такую проблему, как гиперурикемия. Установлено, что повышение уровня мочевой кислоты неразрывно связано с развитием сердечно-сосудистой патологии и хронической болезни почек, а также с метаболическими нарушениями.
Мочевая кислота образуется при метаболизме пуриносодержащих соединений. Большая часть последних получается при распаде клеточных структур, меньшая – поступает извне.
При превышении пороговой концентрации мочевой кислоты происходит осаждение ее ионов и формирование кристаллов.
Наиболее распространенной формой кристаллизованного урата в организме является моноурат натрия (NaC5H3N4O3 – H2O), в котором молекула урата соединена с одной молекулой натрия и одной – воды [1].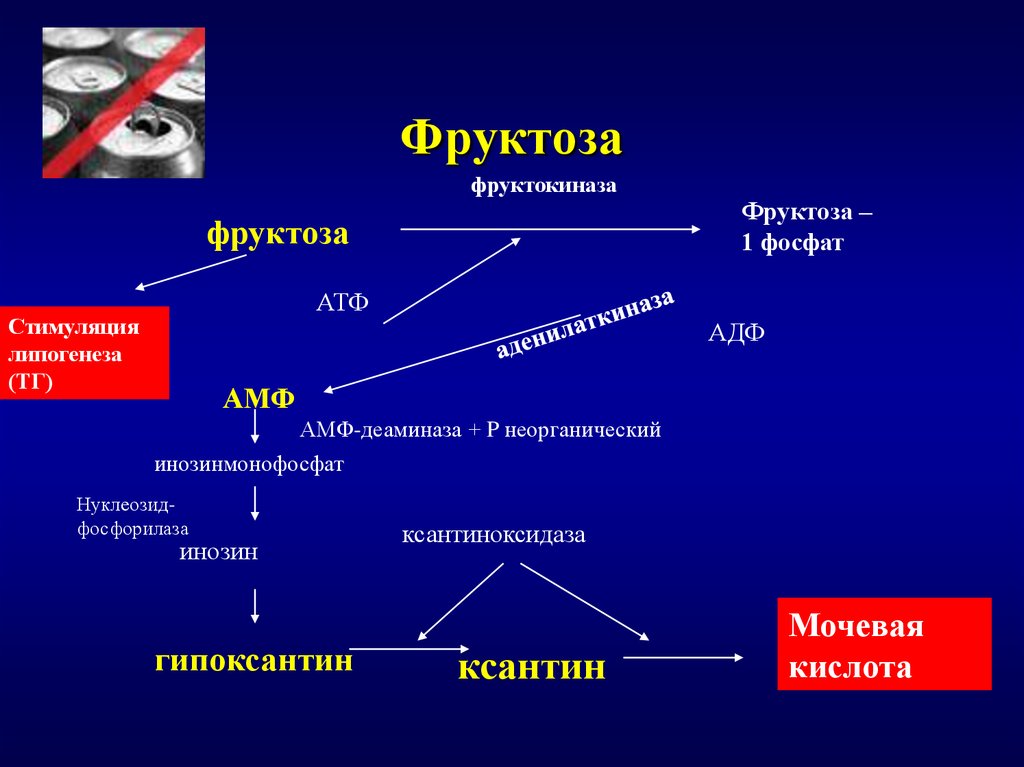 Процессу кристаллизации способствует ряд факторов. Один из них – понижение температуры. Так, по данным исследований in vitro, снижение температуры с 37 до 35 °C является достаточным для падения точки растворимости уратов – с 6,8 до 6,0 мг/дл. К другим факторам следует отнести умеренное повышение рН (в пределах 7–9), электролитный состав тканей, наличие и концентрацию некоторых структурных компонентов тканей [2–4].
Процессу кристаллизации способствует ряд факторов. Один из них – понижение температуры. Так, по данным исследований in vitro, снижение температуры с 37 до 35 °C является достаточным для падения точки растворимости уратов – с 6,8 до 6,0 мг/дл. К другим факторам следует отнести умеренное повышение рН (в пределах 7–9), электролитный состав тканей, наличие и концентрацию некоторых структурных компонентов тканей [2–4].
В настоящее время под гиперурикемией понимается повышение сывороточного уровня мочевой кислоты, при котором в физиологических условиях происходит ее кристаллизация, – более 6,0 мг/дл, или более 360 мкмоль/л [5]. Данный показатель един для лиц обоего пола. Необходимо отметить, что в большинстве эпидемиологических работ в качестве критерия гиперурикемии использовали значения более 420 мкмоль/л для мужчин и более 360 мкмоль/л для женщин [6].
Если клинические симптомы подагры отсутствуют, гиперурикемию характеризуют как асимптоматическую (бессимптомную). В свою очередь ее подразделяют на гиперурикемию с и без кристаллов моноурата натрия [7]. Это обусловлено тем, что кристаллы могут быть обнаружены и в отсутствие приступов подагры [8].
В свою очередь ее подразделяют на гиперурикемию с и без кристаллов моноурата натрия [7]. Это обусловлено тем, что кристаллы могут быть обнаружены и в отсутствие приступов подагры [8].
Частота встречаемости гиперурикемии обусловлена половозрастными особенностями. Так, распространенность патологии увеличивается после 30 лет у мужчин и после 50 лет у женщин. Прежде всего это связано со снижением количества эстрогенов в период постменопаузы. Известно, что эстрогены обладают урикозурическим действием [9, 10]. В норме у лиц мужского пола в детском возрасте концентрация мочевой кислоты составляет около 208 мкмоль/л, в период пубертата повышается до уровня взрослых и остается в этих пределах до 30 лет. После 30 лет уровень мочевой кислоты продолжает увеличиваться. У женщин до наступления менопаузы уровень мочевой кислоты стабилен, после – начинает повышаться [10]. Помимо эндокринного механизма гендерные различия в отношении заболеваемости обусловлены генетическими, а также внешними факторами (например, меньшим количеством потребляемого алкоголя) [11–13].
Отмечено, что у горожан гиперурикемия встречается чаще, чем у жителей сельской местности. Кроме того, существует связь между развитием патологии и питанием [14].
В Китае распространенность гиперурикемии достигает 6,4% среди лиц среднего и пожилого возраста (7,9% среди мужчин и 4,9% среди женщин) [15], в США – 21,2% среди мужчин и 21,6% среди женщин [16]. В Турции патология отмечается у 12,1% взрослого населения городов (у 19,0% мужчин и 5,8% женщин) [17], в Непале – у 21,42% [18]. Среди жителей Сейшельских островов таковых насчитывается 10,6% (18,4% мужчин и 7,8% женщин) [19]. На острове Ява гиперурикемия встречается у 24,3% населения сельской местности [20]. В Саудовской Аравии – значительно реже: в 8,84% случаев [21]. В Российской Федерации распространенность гиперурикемии достигает 16,8%, в том числе 25,3% среди мужчин и 11,3% среди женщин [22].
Риск развития гиперурикемии также зависит от этнической и расовой принадлежности. Например, в Новой Зеландии среди представителей маори гиперурикемия встречается чаще, чем среди проживающих на этой территории европейцев – 27,1% мужчин и 26,6% женщин против 9,4 и 10,5% лиц мужского и женского пола соответственно [23]. Среди коренной народности Тайваня аяталов распространенность патологии составляет 49,4%, среди неаборигенов – 27,4% [24].
Например, в Новой Зеландии среди представителей маори гиперурикемия встречается чаще, чем среди проживающих на этой территории европейцев – 27,1% мужчин и 26,6% женщин против 9,4 и 10,5% лиц мужского и женского пола соответственно [23]. Среди коренной народности Тайваня аяталов распространенность патологии составляет 49,4%, среди неаборигенов – 27,4% [24].
Патогенез
Исходя из особенностей метаболизма, к причинам возникновения гиперурикемии следует отнести снижение экскреции и/или повышение продукции мочевой кислоты.
Среди факторов риска у лиц среднего и пожилого возраста указывают артериальную гипертензию, метаболический синдром, в том числе ожирение, длительный прием диуретиков и ацетилсалициловой кислоты [25, 26]. Так, снижение экскреции мочевой кислоты ассоциировано с инсулинорезистентностью, являющейся составной частью метаболического синдрома [27]. Продукция мочевой кислоты может повышаться вследствие стимуляции синтеза пуринов, спровоцированной гипертриглицеридемией [28, 29], а также злоупотребления алкоголем [30]. Кроме того, содержащийся в крепких напитках свинец снижает выведение уратов, что может обусловить развитие патологии [30]. Использование диуретиков в большинстве случаев для снижения артериального давления, а не для уменьшения объема циркулирующей крови при декомпенсированной сердечной недостаточности, когда их ведущая роль неоспорима, также способствует повышению распространенности гиперурикемии у лиц среднего и пожилого возраста [26, 31]. Еще в 1988 г. J. Тakala и соавт. установили, что среднее значение сывороточной концентрации мочевой кислоты у регулярно принимавших мочегонные препараты было достоверно выше [32]. Выдвинутое исследователями предположение о влиянии диуретиков на риск развития подагры получило подтверждение в последующих работах [33]. В частности, было доказано, что воздействие препаратов данной группы на уровень мочевой кислоты обусловлено как повышением реабсорбции, так и уменьшением секреции в почечных канальцах [34]. Нередко развитие гиперурикемии связывают с приемом низких доз аспирина (75–100 мг).
Кроме того, содержащийся в крепких напитках свинец снижает выведение уратов, что может обусловить развитие патологии [30]. Использование диуретиков в большинстве случаев для снижения артериального давления, а не для уменьшения объема циркулирующей крови при декомпенсированной сердечной недостаточности, когда их ведущая роль неоспорима, также способствует повышению распространенности гиперурикемии у лиц среднего и пожилого возраста [26, 31]. Еще в 1988 г. J. Тakala и соавт. установили, что среднее значение сывороточной концентрации мочевой кислоты у регулярно принимавших мочегонные препараты было достоверно выше [32]. Выдвинутое исследователями предположение о влиянии диуретиков на риск развития подагры получило подтверждение в последующих работах [33]. В частности, было доказано, что воздействие препаратов данной группы на уровень мочевой кислоты обусловлено как повышением реабсорбции, так и уменьшением секреции в почечных канальцах [34]. Нередко развитие гиперурикемии связывают с приемом низких доз аспирина (75–100 мг). Известно, что такая терапия нарушает выведение мочевой кислоты [35].
Известно, что такая терапия нарушает выведение мочевой кислоты [35].
Безусловно, немаловажную роль в возникновении данного заболевания играет снижение функции почек – как врожденное, так и приобретенное. В последнем случае – вследствие артериальной гипертензии, мочекаменной болезни, приема нефротоксичных препаратов и т.д. [36, 37].
Роль в развитии хронических заболеваний
Подагра
Гиперурикемия является единственным облигатным фактором развития подагры, хотя риск возникновения последней сравнительно невелик. По данным разных авторов, он варьируется от 2 до 36% в течение пяти – десяти лет [38, 39]. Бессимптомное течение гиперурикемии на ранних стадиях более чем в 20% случаев ассоциируется с образованием кристаллов мочевой кислоты в разных органах и тканях [7]. Так, у пациентов, не страдавших подагрой, при оперативном вмешательстве кристаллы моноурата натрия были обнаружены в коронарных артериях, тканях предстательной железы [40]. Системный характер процесса отложения кристаллов моноурата натрия удалось выявить благодаря современным методам диагностики. Однако необходимо отметить, что чаще таковые формируются в суставах нижних конечностей [8].
Системный характер процесса отложения кристаллов моноурата натрия удалось выявить благодаря современным методам диагностики. Однако необходимо отметить, что чаще таковые формируются в суставах нижних конечностей [8].
Клинически подагра проявляется острым приступом воспаления сустава, возникающим внезапно, чаще в ночные и ранние утренние часы. Острый подагрический артрит, или подагрическая атака, сопровождается интенсивной болью, гиперемией, отеком и гипертермией в области сустава. В большинстве случаев с дебютом подагры ассоциируется воспаление первого плюснефалангового сустава, реже – других суставов нижних конечностей, значительно реже – суставов верхних конечностей. Последняя локализация более характерна для женщин, страдающих остеоартритом, и соответствует топике поражения суставов [41]. Отсутствие в течение длительного периода времени контроля уровня мочевой кислоты провоцирует хронизацию процесса, возникновение тофусов и функциональных нарушений суставов.
Хроническая болезнь почек
Гиперурикемия приводит к снижению функции почек и протеинурии [42, 43].
В исследовании с участием 170 000 пациентов была доказана связь между повышением уровня мочевой кислоты и риском развития терминальной почечной недостаточности [44]. Так, у пациентов с наиболее высокими значениями мочевой кислоты в сыворотке крови (6,0–14,9 мг/дл) риск достижения терминальной стадии хронической почечной недостаточности оказался в два раза выше, чем у больных с наименьшим уровнем мочевой кислоты (0,10–4,17 мг/дл). Скорректированный относительный риск (ОР) составил 2,14 при 95%-ном доверительном интервале (ДИ) 1,65–2,77.
В проспективном когортном исследовании с участием 14 939 корейцев в возрасте от 20 до 84 лет установлено, что при верхних квартилях уровня мочевой кислоты по сравнению с нижними квартилями риск развития хронической болезни почек увеличивается. Для мужчин ОР – 2,1 (95% ДИ 1,6–2,9), для женщин – 1,3 (95% ДИ 1,0–1,8). Необходимо отметить, что длительность наблюдения составила 10,2 года [45].
Артериальная гипертензия
Роль гиперурикемии в качестве предиктора артериальной гипертензии доказана достаточно давно [46, 47].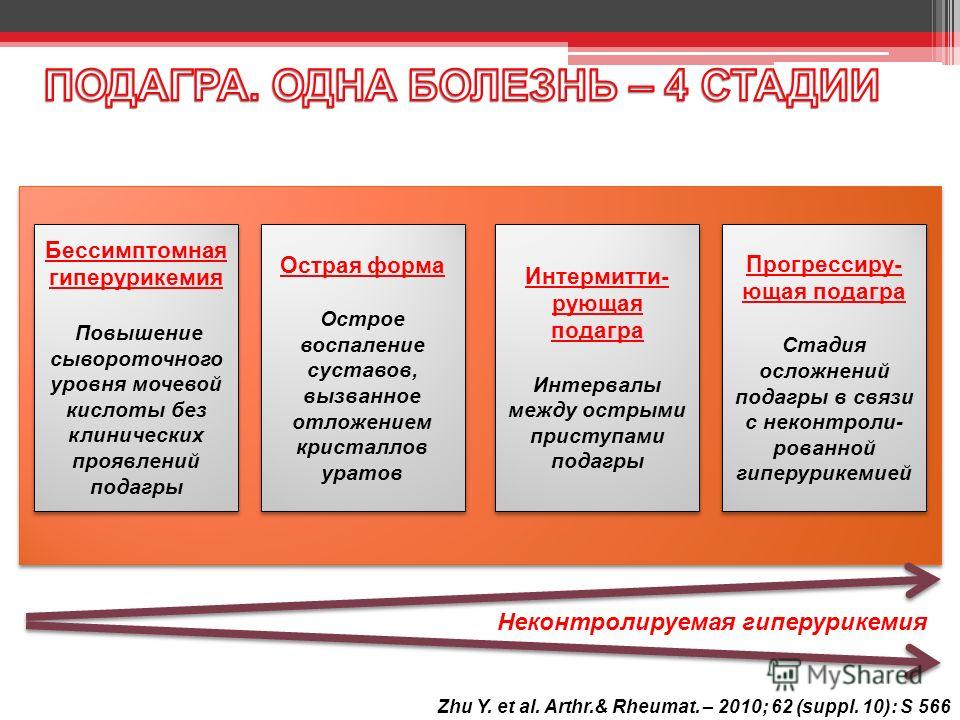 Нарушая внутрипочечную гемодинамику и выделение эндотелиальными клетками оксида азота, мочевая кислота провоцирует вазоконстрикцию и артериосклероз. Кроме того, она становится причиной увеличения жесткости сосудистой стенки [48–51].
Нарушая внутрипочечную гемодинамику и выделение эндотелиальными клетками оксида азота, мочевая кислота провоцирует вазоконстрикцию и артериосклероз. Кроме того, она становится причиной увеличения жесткости сосудистой стенки [48–51].
Доказано, что на фоне гиперурикемии скорректированный ОР артериальной гипертензии составил 1,41 (95% ДИ 1,23–1,58) [52].
A.L. Gaffo и соавт. у 25-летних представителей обоего пола обнаружили значительную связь между повышением уровня мочевой кислоты в сыворотке крови и развитием артериальной гипертензии. Она прослеживалась даже при умеренной гиперурикемии – уровне мочевой кислоты менее 6,8 мг/дл (404 мкмоль/л) [53].
Сердечно-сосудистые заболевания
Мочевая кислота стимулирует выработку ангиотензина II, окислительный стресс и пролиферацию гладкомышечных клеток сосудов [54]. Таким образом она оказывает влияние на выраженность сердечной недостаточности [55] и риск смерти от сердечно-сосудистой патологии [56, 57].
Кроме того, у пациентов с подагрой доказана роль мочевой кислоты в ремоделировании клеток миокарда и развитии фибрилляции предсердий [58, 59].
Ожирение и метаболический синдром
Ассоциация гиперурикемии с ожирением в рамках метаболического синдрома обусловлена влиянием мочевой кислоты на развитие хронического субклинического воспаления в жировой ткани и резистентности к инсулину [60].
Связь между гиперурикемией и метаболическим синдромом, в частности с его классическими компонентами – абдоминальным ожирением, гипертриглицеридемией, гипергликемией и артериальной гипертензией, доказана не только у лиц подросткового возраста [61], но и у лиц пожилого возраста. Согласно результатам когортного исследования, проведенного A.F. Cicero и соавт., у пациентов старше 60 лет уровень мочевой кислоты коррелировал с основными компонентами метаболического синдрома. Кроме того, он служил предиктором последнего. У женщин при пороговых значениях мочевой кислоты в сыворотке крови (среднепопуляционные значения) более 4,8 мг/дл, или 286 мкмоль/л, отношение шансов развития метаболического синдрома составило 2,12 (95% ДИ 1,55–2,90). У мужчин при значениях мочевой кислоты более 5,6 мг/дл, или 333 мкмоль/л, – 2,59 (95% ДИ 1,58–4,24) [61].
У мужчин при значениях мочевой кислоты более 5,6 мг/дл, или 333 мкмоль/л, – 2,59 (95% ДИ 1,58–4,24) [61].
В здоровой популяции повышенный уровень мочевой кислоты ассоциируется с потенциальным риском развития указанных состояний. T. da Silva Ferreira и соавт. на примере 149 здоровых жителей Бразилии в возрасте 20–55 лет доказали, что повышенный уровень мочевой кислоты в сыворотке крови следует рассматривать в качестве критерия неблагоприятного метаболического фенотипа, развития окислительного стресса и нарушения функции эндотелия [62].
L. Pacifico и соавт. выявили корреляцию между значениями мочевой кислоты и атеросклерозом сонных артерий у детей, страдающих ожирением. Толщина комплекса «интима – медиа» каротидных артерий значительно увеличивалась при четвертом квартиле уровня мочевой кислоты по сравнению с первым, вторым и третьим квартилями – 0,61 (95% ДИ 0,58–0,64) против 0,49 (0,46–0,53), 0,53 (0,49–0,56) и 0,55 (0,52–0,59) соответственно, p
Гиперурикемия и риск смерти
Результаты первых работ, посвященных влиянию гиперурикемии на риск смерти, оказались противоречивыми. Благодаря последним работам удалось получить более точные данные. Так, в метаанализе, проведенном T. Zuo и соавт., статистически значимое увеличение риска общей смерти и развития сердечно-сосудистой патологии ассоциировалось с гиперурикемией [64]. Доказано также, что повышение мочевой кислоты на каждый 1 мг/дл приводит к возрастанию риска общей смерти (смерти от всех причин) на 9% и риска развития сердечно-сосудистых заболеваний на 20% [65]. S.P. Juraschek и соавт., проанализировав 3980 случаев смертей за 23 года, пришли к выводу, что высокий уровень мочевой кислоты ассоциируется с более ранней смертью. В качестве основной причины смерти при наивысших значениях мочевой кислоты указана хроническая болезнь почек [66].
Благодаря последним работам удалось получить более точные данные. Так, в метаанализе, проведенном T. Zuo и соавт., статистически значимое увеличение риска общей смерти и развития сердечно-сосудистой патологии ассоциировалось с гиперурикемией [64]. Доказано также, что повышение мочевой кислоты на каждый 1 мг/дл приводит к возрастанию риска общей смерти (смерти от всех причин) на 9% и риска развития сердечно-сосудистых заболеваний на 20% [65]. S.P. Juraschek и соавт., проанализировав 3980 случаев смертей за 23 года, пришли к выводу, что высокий уровень мочевой кислоты ассоциируется с более ранней смертью. В качестве основной причины смерти при наивысших значениях мочевой кислоты указана хроническая болезнь почек [66].
Длительно неконтролируемая гиперурикемия в силу связанных с ней сердечно-сосудистых, ренальных и метаболических расстройств признана одной из ведущих причин высокой смертности среди пациентов с подагрой [67].
Лечение гиперурикемии и подагры
Поскольку в настоящее время гиперурикемия рассматривается как патологическое состояние, ассоциированное с сердечно-сосудистой и ренальной патологией, а также метаболическими расстройствами, основной задачей терапии является достижение целевых значений мочевой кислоты в сыворотке крови и их пожизненное поддержание.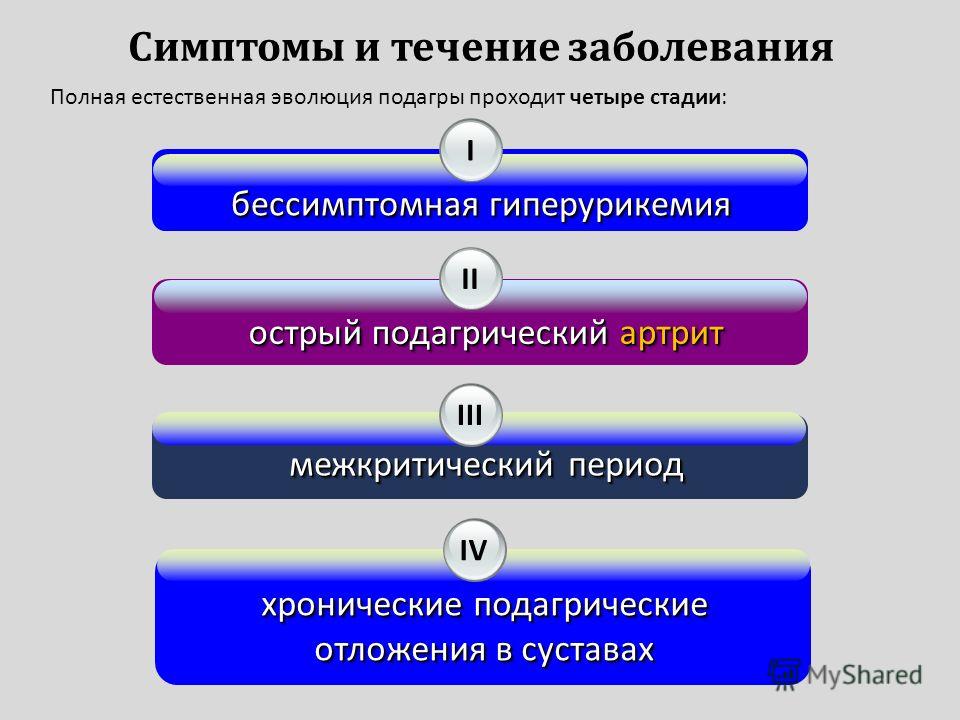
Грамотно подобранная терапия позволяет значительно улучшить качество жизни пациентов с подагрой, уменьшить частоту приступов артрита вплоть до полного их прекращения, стабилизировать течение сопутствующей патологии [68–71].
Необходимым компонентом лечения гиперурикемии и подагры является изменение образа жизни, что позволяет также скорректировать артериальное давление, гипергликемию, гиперлипидемию, массу тела.
Немедикаментозные методы коррекции уровня мочевой кислоты включают ограничение приема богатой пуринами пищи животного происхождения, алкоголя, сахаросодержащих напитков, добавление в рацион овощей, молочных продуктов [72].
Однако немедикаментозные методы эффективны лишь при длительном и комплексном воздействии, поэтому нередко назначаются совместно с лекарственной терапией [73].
Согласно обновленным международным рекомендациям, начинать уратснижающую терапию сразу после установления диагноза «подагра» необходимо у пациентов в возрасте менее 40 лет, при сывороточном уровне мочевой кислоты более 8,0 мг/дл (480 мкмоль/л) и/или наличии сопутствующих заболеваний (почечной недостаточности, артериальной гипертензии, ишемической болезни сердца, сердечной недостаточности) [70]. В остальных случаях медикаментозное лечение инициируют при рецидивах артрита (два и более раза в год), наличии тофусов, уратной артропатии, уратном нефролитиазе.
В остальных случаях медикаментозное лечение инициируют при рецидивах артрита (два и более раза в год), наличии тофусов, уратной артропатии, уратном нефролитиазе.
Цель терапии – предотвращение образования кристаллов моноурата натрия и растворение уже сформированных посредством поддержания уровня мочевой кислоты менее 6 мг/дл (360 мкмоль/л). При образовании тофусов (вне зависимости от локализации), подагрической артропатии или частых приступах артрита целевой считается концентрация менее 5 мг/дл (300 мкмоль/л) [74].
Препаратом первой линии является аллопуринол. Он снижает уровень мочевой кислоты за счет подавления эндогенной продукции ксантиноксидазы (уменьшения окисления гипоксантина до ксантина и ксантина до мочевой кислоты).
Начальная доза аллопуринола составляет 50–100 мг/сут, каждые две – четыре недели она повышается до достижения целевых значений терапии [70]. При правильном титровании дозы эффект отмечается практически в 70% случаев [75–77].
В случае неэффективности аллопуринола в максимальных дозах, а также при снижении функции почек альтернативой может стать фебуксостат – селективный ингибитор ксантиноксидазы. Суточная доза препарата может варьироваться от 40 до 120 мг.
Необходимо отметить, что именно эффективная уратснижающая терапия способна уменьшить потребность в медицинской помощи и смертность среди больных подагрой [78, 79].
По данным A. Shoji и соавт., снижение уровня мочевой кислоты в сыворотке крови менее 6 мг/дл позволяет уменьшить частоту и предотвратить новые подагрические атаки [80]. Напротив, неэффективная уратснижающая терапия приводит к хронизации заболевания, увеличению его тяжести, частоты новых приступов артрита, а также риска развития коморбидной патологии, сердечно-сосудистой и общей смерти [81–84].
G. Levy и соавт. установили, что медикаментозное снижение мочевой кислоты менее 6 мг/дл позволяет замедлить прогрессирование хронической болезни почек [85].
Согласно результатам исследования M. Goicoechea и соавт., у пациентов, принимавших аллопуринол в дозе 100 мг/дл в среднем семь лет, достоверно реже развивались почечная недостаточность, определяемая как начало проведения диализа, двукратное увеличение концентрации креатинина или снижение почечной фильтрации на 50%. Аналогичная тенденция прослеживалась в отношении сердечно-сосудистой патологии (инфаркта миокарда, реваскуляризации коронарных артерий или стенокардии, хронической сердечной недостаточности, цереброваскулярной болезни, заболеваний периферических сосудов) [86].
Регрессионный анализ позволил установить связь между приемом аллопуринола и снижением как систолического, так и диастолического артериального давления, зависимость гипотензивного эффекта от дозы аллопуринола у пожилых пациентов (р
В настоящее время активно обсуждается роль аллопуринола в профилактике цереброваскулярной патологии. Так, согласно результатам исследования «случай – контроль», проведенного в Тайване, длительное лечение аллопуринолом ассоциировалось со снижением риска ишемических атак в случае цереброваскулярной болезни. Основную группу данного исследования составили 14 937 пациентов от 20 до 84 лет, контрольную – такое же количество лиц такого же возраста [89].
Основную группу данного исследования составили 14 937 пациентов от 20 до 84 лет, контрольную – такое же количество лиц такого же возраста [89].
Необходимо отметить, что на данный момент времени существуют разные алгоритмы контроля уровня мочевой кислоты. Наиболее перспективными представляются изложенные в экспертном заключении европейских ученых по диагностике и лечению пациентов с гиперурикемией, подверженных высокому риску развития сердечно-сосудистых заболеваний [90]. Стратегия ведения таких пациентов предполагает пять этапов.
Этап 1. Снижение мочевой кислоты менее 5 мг/дл при высоком сердечно-сосудистом риске. Последний устанавливается при наличии не менее двух из следующих факторов: артериальная гипертензия, сахарный диабет 2 типа, дислипидемия, недавно перенесенный инсульт или инфаркт миокарда, хроническая болезнь почек. Достижение уровня мочевой кислоты менее 6 мг/дл – для пациентов в отсутствие указанных выше факторов риска.
Этап 2. Контроль заболеваний, являющихся факторами риска повышения уровня мочевой кислоты: сердечно-сосудистой патологии, метаболического синдрома, хронической почечной недостаточности. Необходимо отметить, что эксперты подчеркивают значимость стабилизации сопутствующей патологии как неотъемлемой части коррекции гиперурикемии, при этом они затрагивают проблему длительного использования для лечения коморбидных заболеваний препаратов, негативно влияющих на обмен мочевой кислоты, прежде всего малых доз аспирина и диуретиков.
Контроль заболеваний, являющихся факторами риска повышения уровня мочевой кислоты: сердечно-сосудистой патологии, метаболического синдрома, хронической почечной недостаточности. Необходимо отметить, что эксперты подчеркивают значимость стабилизации сопутствующей патологии как неотъемлемой части коррекции гиперурикемии, при этом они затрагивают проблему длительного использования для лечения коморбидных заболеваний препаратов, негативно влияющих на обмен мочевой кислоты, прежде всего малых доз аспирина и диуретиков.
Этап 3. Формирование системы долговременного контроля уровня мочевой кислоты, включающей профилактические и лечебные мероприятия. Речь, в частности, идет о повышении осведомленности пациентов о гиперурикемии и связанных с ней сопутствующих заболеваниях, приверженности лечению, об осознанном подходе к модификации внешних факторов, способствующих развитию патологии. К таковым относятся снижение и поддержание на нормальном уровне массы тела, соблюдение умеренной физической активности и рекомендаций по диете.
Этап 4. Медикаментозная коррекция гиперурикемии ингибиторами ксантиноксидазы как препаратами первого ряда (аллопуринол 100 мг/сут, затем титрование до 300–600 мг/сут для достижения целевого уровня мочевой кислоты).
Этап 5. Контроль мочевой кислоты с помощью комбинированной терапии аллопуринолом и урикозуриками в отсутствие достижения целевого уровня на монотерапии аллопуринолом, а также альтернативной терапии бензбромароном в случае непереносимости аллопуринола, выраженного снижения функции почек, не позволяющего назначить адекватную дозу последнего.
Заключение
Выявление патогенетической взаимосвязи между гиперурикемией и рядом хронических заболеваний открывает новые возможности коррекции и профилактики последних – посредством контроля уровня мочевой кислоты. Данное направление, несомненно, является перспективным и требует более глубокого изучения.
Гиперурикемия — StatPearls — NCBI Bookshelf
Продолжение обучения
Гиперурикемия — распространенное заболевание, поражающее пациентов всех возрастов и полов. Наиболее частым проявлением гиперурикемии является подагра, которая может быть очень болезненной и легко поддается лечению. В этом упражнении рассматриваются патофизиология, проявления, оценка и лечение гиперурикемии, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Наиболее частым проявлением гиперурикемии является подагра, которая может быть очень болезненной и легко поддается лечению. В этом упражнении рассматриваются патофизиология, проявления, оценка и лечение гиперурикемии, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Объясните патофизиологию гиперурикемии.
Опишите типичный анамнез и данные физического осмотра пациента с гиперурикемией.
Определить методы лечения острой и хронической гиперурикемии.
Опишите важность улучшения координации ухода за пациентами между межпрофессиональными бригадами для улучшения долгосрочных результатов лечения пациентов с гиперурикемией.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Гиперурикемия — это повышенный уровень мочевой кислоты в крови. Нормальный верхний предел составляет 6,8 мг/дл, а все, что выше 7 мг/дл, считается насыщением, и могут возникнуть симптомы.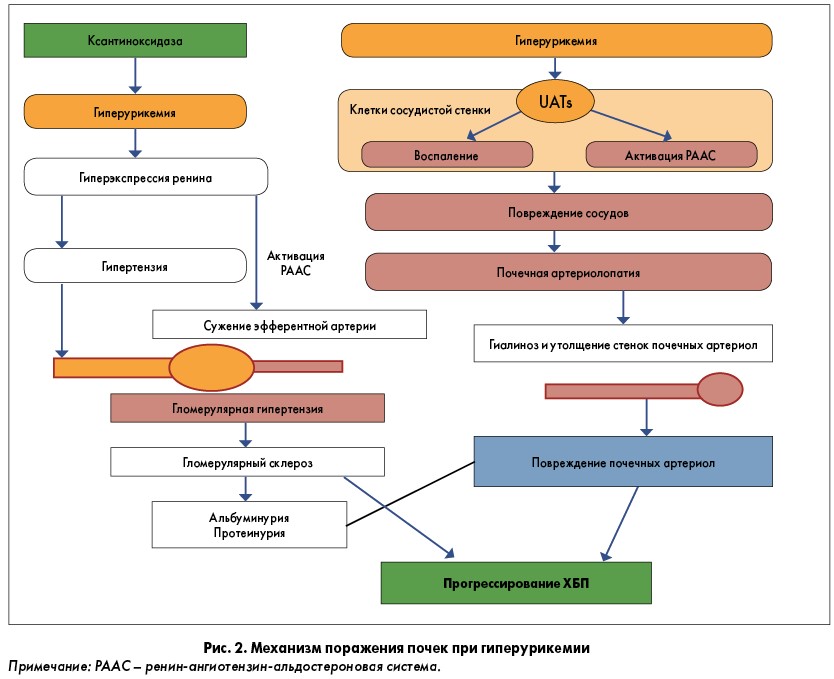
Этот повышенный уровень является результатом увеличения производства, снижения экскреции мочевой кислоты или комбинации обоих процессов.
Повышенное содержание мочевой кислоты также может наблюдаться при ускоренной деградации пуринов, состояниях с высоким клеточным оборотом (гемолиз, рабдомиолиз и лизис опухоли) и пониженной экскреции (почечная недостаточность и метаболический ацидоз). Гиперурикемия может привести к подагре и нефролитиазу. Он также используется в качестве индикатора таких заболеваний, как метаболический синдром, сахарный диабет, сердечно-сосудистые заболевания и хроническая почечная недостаточность.[1]
Etiology
Urate Overproduction
Purine rich diet
Error of purine metabolism: hypoxanthine phosphoribosyltransferase (HPRT) deficiency, phosphoribosylpyrophosphate (PRPP) synthetase over activity
Cell breakdown or turnover: lymphoproliferative diseases, myeloproliferative болезнь, истинная полицитемия, болезнь Педжета, псориаз, лизис опухоли, гемолиз, рабдомиолиз, физическая нагрузка
Снижение экскреции мочевой кислоты
Острая или хроническая болезнь почек, ацидоз (молочнокислый ацидоз, кетоацидоз), гиповолемия, лекарственные препараты/токсины (диуретики, никотиновая кислота, пиразинамид, этамбутол, циклоспорин, бериллий, салицилаты, свинец, алкоголь), саркоидоз, гиперпаратиреоз, гипотиреоз, синдром Барттера, синдром Дауна[2]
Эпидемиология
По оценкам, 21% населения в целом и 25% госпитализированных пациентов имеют бессимптомную гиперурикемию. Наиболее частым осложнением гиперурикемии является подагра, которая наблюдается в 3,9% населения США. Гиперурикемия сама по себе не указывает на патологическое состояние, потому что она очень распространена среди населения в целом.
Наиболее частым осложнением гиперурикемии является подагра, которая наблюдается в 3,9% населения США. Гиперурикемия сама по себе не указывает на патологическое состояние, потому что она очень распространена среди населения в целом.
Патофизиология
Мочевая кислота (2,6,8-триоксипурин-C5h5N4O3) является результатом распада пуринов. При нормальном физиологическом рН 7,4 мочевая кислота циркулирует в ионизированной форме уратов. Метаболизм пуринов в основном происходит в печени, но он также может образовываться в любой другой ткани, содержащей ксантиноксидазу (кишечник). Около двух третей мочевой кислоты выводится почками, а треть выводится в кишечник. В почках он фильтруется и секретируется, а 90% реабсорбируется. У других млекопитающих уровень мочевой кислоты ниже из-за активности уриказы. Этот фермент превращает ураты в более водорастворимую форму аллантоина.[3]
Производство уратов ускоряется за счет диеты, богатой пуринами, эндогенного производства пуринов и интенсивного распада клеток, и это ответственно за меньшинство случаев гиперурикемии. Продукты, богатые пурином, включают все виды мяса, но особенно субпродукты (почки, печень, «сладкий хлеб»), дичь и некоторые морепродукты (анчоусы, сельдь, морские гребешки). Пиво, богатое пуринами, также повышает уровень мочевой кислоты, уменьшая ее выведение почками. Эндогенное производство продукции пуринов может быть ускорено активностью фосфорибозилпирофосфата (PRPP) синтетазы, а также дефектом регуляторного фермента гипоксантинфосфорибозилтрансферазы (HPRT). Условия ускоренного распада или обновления клеток, такие как рабдомиолиз, гемолиз и лизис опухоли, также могут быть источником пуринов и, таким образом, увеличивать продукцию уратов.
Продукты, богатые пурином, включают все виды мяса, но особенно субпродукты (почки, печень, «сладкий хлеб»), дичь и некоторые морепродукты (анчоусы, сельдь, морские гребешки). Пиво, богатое пуринами, также повышает уровень мочевой кислоты, уменьшая ее выведение почками. Эндогенное производство продукции пуринов может быть ускорено активностью фосфорибозилпирофосфата (PRPP) синтетазы, а также дефектом регуляторного фермента гипоксантинфосфорибозилтрансферазы (HPRT). Условия ускоренного распада или обновления клеток, такие как рабдомиолиз, гемолиз и лизис опухоли, также могут быть источником пуринов и, таким образом, увеличивать продукцию уратов.
Экскреция уратов происходит преимущественно почками и является причиной гиперурикемии у 90% людей. Недостаточная экскреция, по-видимому, является комбинацией сниженной клубочковой фильтрации, сниженной канальцевой секреции и повышенной канальцевой реабсорбции. Острое или хроническое снижение клубочковой фильтрации может привести к гиперурикемии. Реабсорбция мочевой кислоты в проксимальных канальцах контролируется URAT1 (переносчик мочевой кислоты 1). Этот транспорт может стимулироваться органическими кислотами (лактат, ацетоацетат и бета-гидроксибутират), лекарствами (ниацин, пиразинамид, этамбутол, циклоспорин и химиотерапия) и уменьшением объема внеклеточной жидкости, что приводит к гиперурикемии.
Реабсорбция мочевой кислоты в проксимальных канальцах контролируется URAT1 (переносчик мочевой кислоты 1). Этот транспорт может стимулироваться органическими кислотами (лактат, ацетоацетат и бета-гидроксибутират), лекарствами (ниацин, пиразинамид, этамбутол, циклоспорин и химиотерапия) и уменьшением объема внеклеточной жидкости, что приводит к гиперурикемии.
История и физика
Клинические проявления
Подагра — это нарушение обмена веществ, при котором происходит накопление мочевой кислоты в крови и тканях. Это приводит к осаждению кристаллов моногидрата урата в суставе. Когда ткани насыщаются уратами, кристаллы выпадают в осадок. Осадки увеличиваются в кислой и холодной среде, что приводит к увеличению их количества в периферических суставах, например, в большом пальце ноги. Подагра имеет преобладание мужчин в соотношении мужчин и женщин 4: 1. Уровни мочевой кислоты могут быть повышены за 10–15 лет до клинических проявлений подагры.[4]
При мочекислом нефролитиазе мочевая кислота обрабатывается почечной системой, и на образование камней из мочевой кислоты могут влиять три фактора.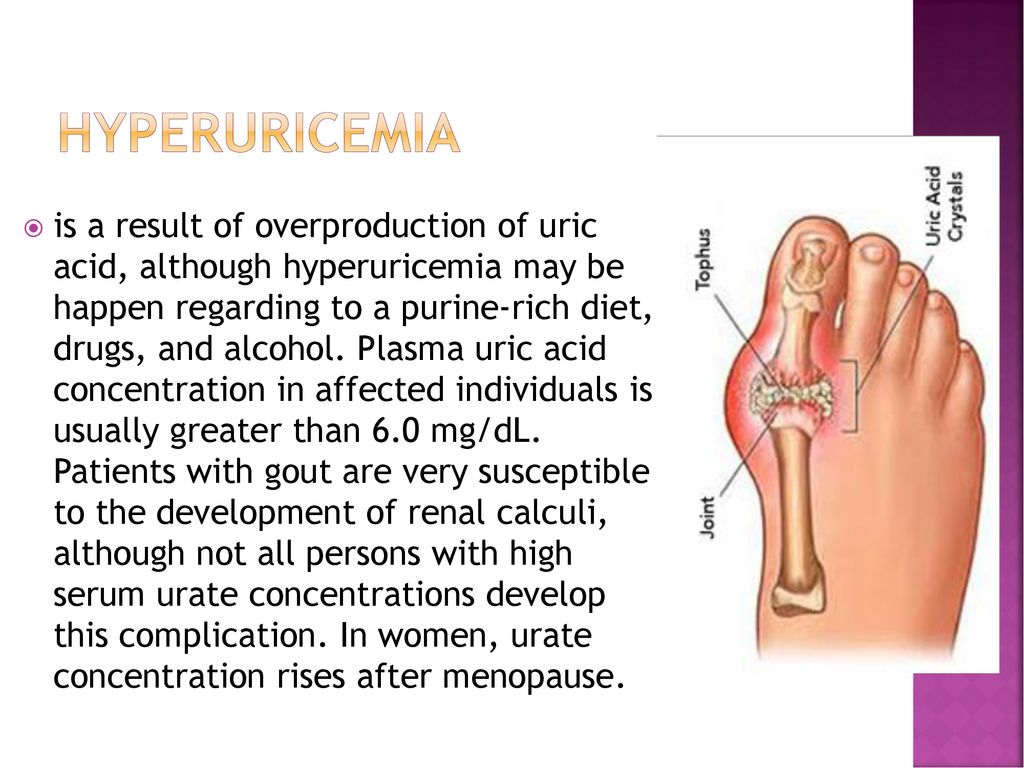 Этими факторами являются кислая моча TH, обезвоживание и гиперурикозурия. Стойкая кислая моча является наиболее частой причиной образования камней из мочевой кислоты. Гиперурикозурия определяется как уровень мочевой кислоты, превышающий 800 мг/сут у мужчин и 750 мг/сут у женщин. Чаще всего это связано с повышенным потреблением пищи. Камни мочевой кислоты составляют от 5% до 10% всех мочевых камней.[5]
Этими факторами являются кислая моча TH, обезвоживание и гиперурикозурия. Стойкая кислая моча является наиболее частой причиной образования камней из мочевой кислоты. Гиперурикозурия определяется как уровень мочевой кислоты, превышающий 800 мг/сут у мужчин и 750 мг/сут у женщин. Чаще всего это связано с повышенным потреблением пищи. Камни мочевой кислоты составляют от 5% до 10% всех мочевых камней.[5]
История
Гиперурикемия не является заболеванием или конкретным показанием к терапии. У большинства пациентов с повышенным уровнем мочевой кислоты заболевание протекает бессимптомно и не требует длительной терапии. Пациент может рассказать о диете, богатой пуринами, или употреблении алкоголя, особенно пива. Прошлый анамнез, а также текущие лекарства должны быть пересмотрены, чтобы найти корреляцию с плохой экскрецией уратов почками или повышенным производством.
Двумя наиболее распространенными жалобами, связанными с гиперурикемией, являются подагра и мочекислый нефролитиаз.
При подагре больной жалуется на распухший докрасна сустав, чаще всего на большом пальце ноги.
При нефролитиазе пациенты жалуются на боль в боку, гематурию, тошноту/рвоту и коликообразные боли.
Медицинский осмотр
Не будет каких-либо конкретных результатов медицинского осмотра, которые указывали бы на гиперурикемию, если только пациент не предъявляет жалобы на подагру или нефролитиаз.
При подагре имеются признаки эритематозного, теплого и опухшего сустава. Чаще всего поражает большой палец ноги, но может поражать любой сустав в организме. Обычно подагра поражает один сустав за раз.
Нефролитиаз не имеет специфических признаков физического осмотра, но может иметь болезненность реберно-позвоночного угла. Ищите гематурию в анализе мочи.
Оценка
Лабораторные исследования, скорее всего, выявят следующее:
Мочевая кислота в сыворотке: норма менее 6,8 мг/дл
взрослый мужчина на беспуриновой диете. Уровень выше этого подразумевает повышенную выработку мочевой кислоты.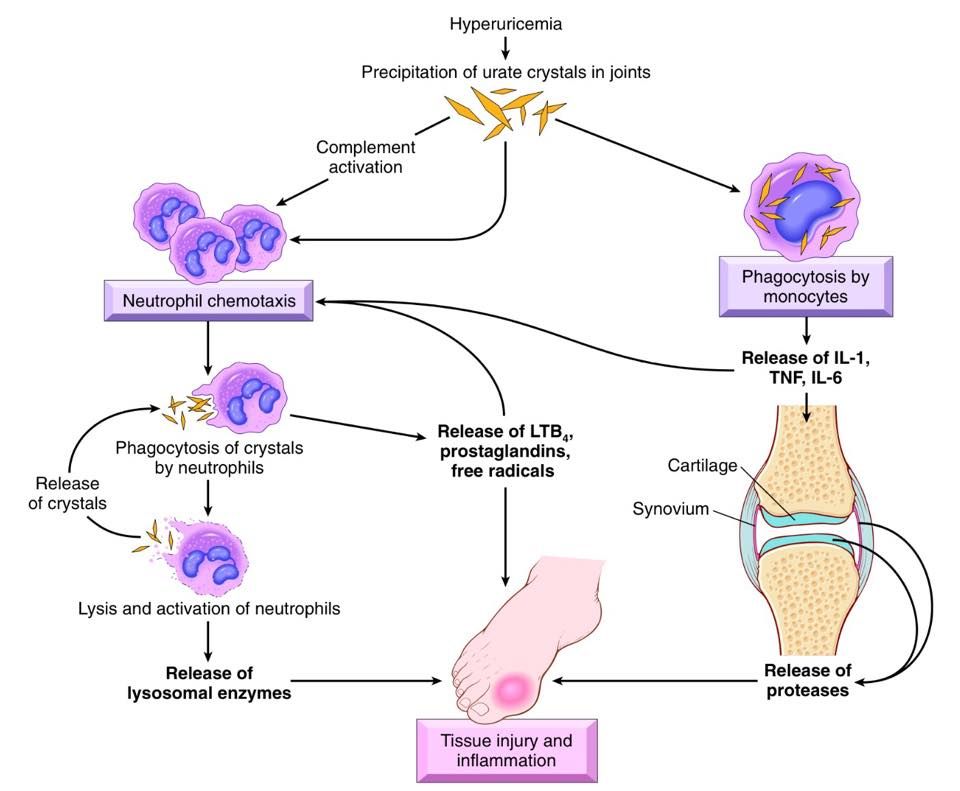
Рассмотрите общий анализ крови (CBC), CMP, профиль липидов, уровни кальция и фосфата. Эти лабораторные исследования предназначены для оценки основного заболевания, приводящего к повышению уровня мочевой кислоты, но являются дополнительными исследованиями.
Рассмотреть возможность рентгенографии суставов для оценки отека суставов; однако рентген не является необходимым для диагностики подагры.
Ультразвуковое исследование почек показано пациентам с мочекислым нефролитиазом.
Процедуры
Рассмотрите совместную аспирацию для оценки кристаллов мочевой кислоты, ищите отрицательно двулучепреломляющие при поляризованной микроскопии.
Рутинный скрининг гиперурикемии не рекомендуется.[3]
Лечение/управление
Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Препараты, снижающие уровень уратов, у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли.]
Препараты, снижающие уровень уратов, у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли.]
Уратснижающие препараты:
Аллопуринол: ингибиторы ксантиноксидазы; используется для профилактики подагрического артрита, нефролитиаза и гиперурикемии, связанной с химиотерапией
мочевой кислоты в аллантоин, который гораздо более растворим в воде и легко выводится из почек и используется в качестве профилактики гиперурикемии, связанной с химиотерапией [3]
Differential Diagnosis
Gout and pseudogout
Hemolytic anaemia
Hodgkin lymphoma
Hyperparathyroidism
Hypothyroidism
Nephrolithiasis
Преэклампсия
Улучшение результатов работы команды здравоохранения
Поскольку существует множество причин гиперурикемии, с этим состоянием лучше всего справится межпрофессиональная команда, в которую входят терапевт, лечащий врач, практикующая медсестра, эндокринолог, ревматолог и онколог. Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Уратснижающие препараты у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли. [10][11]
Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Уратснижающие препараты у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли. [10][11]
Перспективы доброкачественных причин гиперурикемии хорошие, но у больных со злокачественными новообразованиями могут развиться осложнения, такие как подагра или камни в почках. Большинство этих пациентов нуждаются в тщательном наблюдении, чтобы определить, улучшается ли их состояние на фоне лечения.[12]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.

Barkas F, Elisaf M, Liberopoulos E, Kalaitzidis R, Liamis G. Мочевая кислота и хроническое заболевание почек у лиц с дислипидемией. Curr Med Res Opin. 2018 июль; 34 (7): 1193-1199. [PubMed: 28836857]
- 2.
Dong H, Xu Y, Zhang X, Tian S. Индекс висцерального ожирения тесно связан с гиперурикемией независимо от метаболического здоровья и фенотипов ожирения. Научный представитель 2017 г., 18 августа; 7 (1): 8822. [Бесплатная статья PMC: PMC5562916] [PubMed: 28821853]
- 3.
Якупова С.П. Подагра. Новые возможности диагностики и лечения. Тер Арх. 2018 11 мая; 90 (5): 88-92. [PubMed: 30701896]
- 4.
Уильямс, Лос-Анджелес. История, симптомы, причины, факторы риска, типы, диагностика, лечение и профилактика подагры, часть 2. Int J Pharm Compd. 2019 янв-февраль;23(1):14-21. [PubMed: 30668531]
- 5.
Paquot N, Scheen AJ. [Добавление ингибитора DPP-4 или SGLT2 к метформину отдельно при диабете 2 типа].
 Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]
Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]- 6.
Ян Н, Ю И, Чжан А, Эстилл Дж, Ван Х, Чжэн М, Чжоу Ц, Чжан Дж, Ло Х, Цянь С, Мао И, Ван Ц, Ян И, Чен Ю. Отчетность, представление и формулировка рекомендаций в клиническом руководстве по подагре: систематический анализ. Открытый БМЖ. 29 января 2019 г .; 9 (1): e024315. [Бесплатная статья PMC: PMC6352818] [PubMed: 30700479]
- 7.
Алькарни Н.А., Хассан А.Х. Знания и практика лечения бессимптомной гиперурикемии среди врачей первичной медико-санитарной помощи в Джидде, Западный регион Саудовской Аравии. Saudi Med J. 2018 Dec;39(12):1218-1225. [Бесплатная статья PMC: PMC6344656] [PubMed: 30520504]
- 8.
Engel B, Schacher S, Weckbecker K, Stausberg A, Gräff I. [Острая подагра при поступлении в неотложную Текущие рекомендации]. Z Orthop Unfall. 2018 декабрь; 156 (6): 653-661. [PubMed: 29986356]
- 9.
Бузас Р.
 , Тауту О.Ф., Доробанту М., Иван В., Лигезан Д. Мочевая кислота в сыворотке и артериальная гипертензия – данные исследования Sephar III. ПЛОС Один. 2018;13(7):e0199865. [Бесплатная статья PMC: PMC6028095] [PubMed: 29966019]
, Тауту О.Ф., Доробанту М., Иван В., Лигезан Д. Мочевая кислота в сыворотке и артериальная гипертензия – данные исследования Sephar III. ПЛОС Один. 2018;13(7):e0199865. [Бесплатная статья PMC: PMC6028095] [PubMed: 29966019]- 10.
Yu KH, Chen DY, Chen JH, Chen SY, Chen SM, Cheng TT, Hsieh SC, Hsieh TY, Hsu PF, Kuo CF, Kuo MC, Lam HC, Lee IT, Liang TH, Lin HY, Lin SC, Tsai WP, Tsay GJ, Wei JC, Yang CH, Tsai WC. Лечение подагры и гиперурикемии: междисциплинарный консенсус на Тайване. Int J Rheum Dis. 2018 апр; 21 (4): 772-787. [PubMed: 29363262]
- 11.
Janssen CA, Jansen TLTA, Oude Voshaar MAH, Vonkeman HE, van de Laar MAFJ. Качество помощи при подагре: клинический аудит лечения до цели уратснижающей терапией у реальных пациентов с подагрой. Ревматол Интерн. 2017 сен;37(9)):1435-1440. [Статья бесплатно PMC: PMC5570767] [PubMed: 28748426]
- 12.
Huang G, Qin J, Deng X, Luo G, Yu D, Zhang M, Zhou S, Wang L. Прогностическое значение мочевой кислоты в сыворотке у пациентов с острой сердечной недостаточностью: метаанализ.
 Медицина (Балтимор). 2019 Февраль;98(8):e14525. [Бесплатная статья PMC: PMC6408052] [PubMed: 30813158]
Медицина (Балтимор). 2019 Февраль;98(8):e14525. [Бесплатная статья PMC: PMC6408052] [PubMed: 30813158]
Гиперурикемия — StatPearls — NCBI Bookshelf
Continuing Education Activity
Гиперурикемия — распространенное заболевание, поражающее пациентов всех возрастов и полов. Наиболее частым проявлением гиперурикемии является подагра, которая может быть очень болезненной и легко поддается лечению. В этом упражнении рассматриваются патофизиология, проявления, оценка и лечение гиперурикемии, а также подчеркивается роль межпрофессиональной команды в уходе за больными пациентами.
Цели:
Объясните патофизиологию гиперурикемии.
Опишите типичный анамнез и данные физического осмотра пациента с гиперурикемией.
Определить методы лечения острой и хронической гиперурикемии.
Опишите важность улучшения координации ухода за пациентами между межпрофессиональными бригадами для улучшения долгосрочных результатов лечения пациентов с гиперурикемией.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Гиперурикемия — это повышенный уровень мочевой кислоты в крови. Нормальный верхний предел составляет 6,8 мг/дл, а все, что выше 7 мг/дл, считается насыщением, и могут возникнуть симптомы.
Этот повышенный уровень является результатом увеличения производства, снижения экскреции мочевой кислоты или комбинации обоих процессов.
Повышенное содержание мочевой кислоты также может наблюдаться при ускоренной деградации пуринов, состояниях с высоким клеточным оборотом (гемолиз, рабдомиолиз и лизис опухоли) и пониженной экскреции (почечная недостаточность и метаболический ацидоз). Гиперурикемия может привести к подагре и нефролитиазу. Он также используется в качестве индикатора таких заболеваний, как метаболический синдром, сахарный диабет, сердечно-сосудистые заболевания и хроническая почечная недостаточность.[1]
Etiology
Urate Overproduction
Purine rich diet
Error of purine metabolism: hypoxanthine phosphoribosyltransferase (HPRT) deficiency, phosphoribosylpyrophosphate (PRPP) synthetase over activity
Cell breakdown or turnover: lymphoproliferative diseases, myeloproliferative болезнь, истинная полицитемия, болезнь Педжета, псориаз, лизис опухоли, гемолиз, рабдомиолиз, физическая нагрузка
Снижение экскреции мочевой кислоты
Острая или хроническая болезнь почек, ацидоз (молочнокислый ацидоз, кетоацидоз), гиповолемия, лекарственные препараты/токсины (диуретики, никотиновая кислота, пиразинамид, этамбутол, циклоспорин, бериллий, салицилаты, свинец, алкоголь), саркоидоз, гиперпаратиреоз, гипотиреоз, синдром Барттера, синдром Дауна[2]
Эпидемиология
По оценкам, 21% населения в целом и 25% госпитализированных пациентов имеют бессимптомную гиперурикемию. Наиболее частым осложнением гиперурикемии является подагра, которая наблюдается в 3,9% населения США. Гиперурикемия сама по себе не указывает на патологическое состояние, потому что она очень распространена среди населения в целом.
Наиболее частым осложнением гиперурикемии является подагра, которая наблюдается в 3,9% населения США. Гиперурикемия сама по себе не указывает на патологическое состояние, потому что она очень распространена среди населения в целом.
Патофизиология
Мочевая кислота (2,6,8-триоксипурин-C5h5N4O3) является результатом распада пуринов. При нормальном физиологическом рН 7,4 мочевая кислота циркулирует в ионизированной форме уратов. Метаболизм пуринов в основном происходит в печени, но он также может образовываться в любой другой ткани, содержащей ксантиноксидазу (кишечник). Около двух третей мочевой кислоты выводится почками, а треть выводится в кишечник. В почках он фильтруется и секретируется, а 90% реабсорбируется. У других млекопитающих уровень мочевой кислоты ниже из-за активности уриказы. Этот фермент превращает ураты в более водорастворимую форму аллантоина.[3]
Производство уратов ускоряется за счет диеты, богатой пуринами, эндогенного производства пуринов и интенсивного распада клеток, и это ответственно за меньшинство случаев гиперурикемии.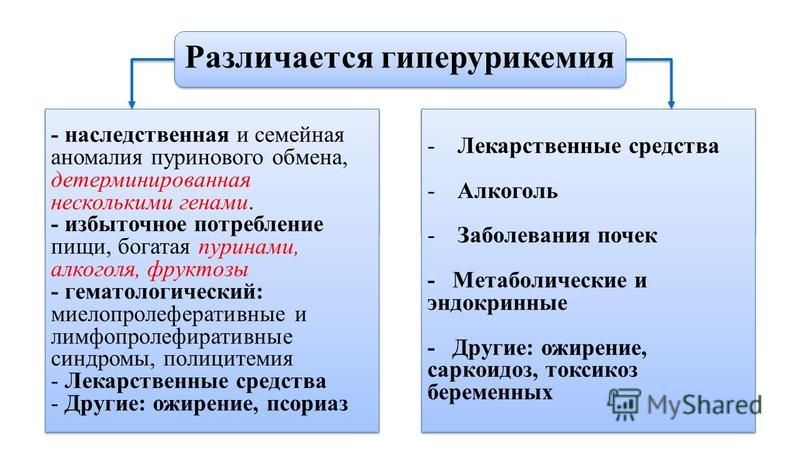 Продукты, богатые пурином, включают все виды мяса, но особенно субпродукты (почки, печень, «сладкий хлеб»), дичь и некоторые морепродукты (анчоусы, сельдь, морские гребешки). Пиво, богатое пуринами, также повышает уровень мочевой кислоты, уменьшая ее выведение почками. Эндогенное производство продукции пуринов может быть ускорено активностью фосфорибозилпирофосфата (PRPP) синтетазы, а также дефектом регуляторного фермента гипоксантинфосфорибозилтрансферазы (HPRT). Условия ускоренного распада или обновления клеток, такие как рабдомиолиз, гемолиз и лизис опухоли, также могут быть источником пуринов и, таким образом, увеличивать продукцию уратов.
Продукты, богатые пурином, включают все виды мяса, но особенно субпродукты (почки, печень, «сладкий хлеб»), дичь и некоторые морепродукты (анчоусы, сельдь, морские гребешки). Пиво, богатое пуринами, также повышает уровень мочевой кислоты, уменьшая ее выведение почками. Эндогенное производство продукции пуринов может быть ускорено активностью фосфорибозилпирофосфата (PRPP) синтетазы, а также дефектом регуляторного фермента гипоксантинфосфорибозилтрансферазы (HPRT). Условия ускоренного распада или обновления клеток, такие как рабдомиолиз, гемолиз и лизис опухоли, также могут быть источником пуринов и, таким образом, увеличивать продукцию уратов.
Экскреция уратов происходит преимущественно почками и является причиной гиперурикемии у 90% людей. Недостаточная экскреция, по-видимому, является комбинацией сниженной клубочковой фильтрации, сниженной канальцевой секреции и повышенной канальцевой реабсорбции. Острое или хроническое снижение клубочковой фильтрации может привести к гиперурикемии. Реабсорбция мочевой кислоты в проксимальных канальцах контролируется URAT1 (переносчик мочевой кислоты 1). Этот транспорт может стимулироваться органическими кислотами (лактат, ацетоацетат и бета-гидроксибутират), лекарствами (ниацин, пиразинамид, этамбутол, циклоспорин и химиотерапия) и уменьшением объема внеклеточной жидкости, что приводит к гиперурикемии.
Реабсорбция мочевой кислоты в проксимальных канальцах контролируется URAT1 (переносчик мочевой кислоты 1). Этот транспорт может стимулироваться органическими кислотами (лактат, ацетоацетат и бета-гидроксибутират), лекарствами (ниацин, пиразинамид, этамбутол, циклоспорин и химиотерапия) и уменьшением объема внеклеточной жидкости, что приводит к гиперурикемии.
История и физика
Клинические проявления
Подагра — это нарушение обмена веществ, при котором происходит накопление мочевой кислоты в крови и тканях. Это приводит к осаждению кристаллов моногидрата урата в суставе. Когда ткани насыщаются уратами, кристаллы выпадают в осадок. Осадки увеличиваются в кислой и холодной среде, что приводит к увеличению их количества в периферических суставах, например, в большом пальце ноги. Подагра имеет преобладание мужчин в соотношении мужчин и женщин 4: 1. Уровни мочевой кислоты могут быть повышены за 10–15 лет до клинических проявлений подагры.[4]
При мочекислом нефролитиазе мочевая кислота обрабатывается почечной системой, и на образование камней из мочевой кислоты могут влиять три фактора. Этими факторами являются кислая моча TH, обезвоживание и гиперурикозурия. Стойкая кислая моча является наиболее частой причиной образования камней из мочевой кислоты. Гиперурикозурия определяется как уровень мочевой кислоты, превышающий 800 мг/сут у мужчин и 750 мг/сут у женщин. Чаще всего это связано с повышенным потреблением пищи. Камни мочевой кислоты составляют от 5% до 10% всех мочевых камней.[5]
Этими факторами являются кислая моча TH, обезвоживание и гиперурикозурия. Стойкая кислая моча является наиболее частой причиной образования камней из мочевой кислоты. Гиперурикозурия определяется как уровень мочевой кислоты, превышающий 800 мг/сут у мужчин и 750 мг/сут у женщин. Чаще всего это связано с повышенным потреблением пищи. Камни мочевой кислоты составляют от 5% до 10% всех мочевых камней.[5]
История
Гиперурикемия не является заболеванием или конкретным показанием к терапии. У большинства пациентов с повышенным уровнем мочевой кислоты заболевание протекает бессимптомно и не требует длительной терапии. Пациент может рассказать о диете, богатой пуринами, или употреблении алкоголя, особенно пива. Прошлый анамнез, а также текущие лекарства должны быть пересмотрены, чтобы найти корреляцию с плохой экскрецией уратов почками или повышенным производством.
Двумя наиболее распространенными жалобами, связанными с гиперурикемией, являются подагра и мочекислый нефролитиаз.
При подагре больной жалуется на распухший докрасна сустав, чаще всего на большом пальце ноги.
При нефролитиазе пациенты жалуются на боль в боку, гематурию, тошноту/рвоту и коликообразные боли.
Медицинский осмотр
Не будет каких-либо конкретных результатов медицинского осмотра, которые указывали бы на гиперурикемию, если только пациент не предъявляет жалобы на подагру или нефролитиаз.
При подагре имеются признаки эритематозного, теплого и опухшего сустава. Чаще всего поражает большой палец ноги, но может поражать любой сустав в организме. Обычно подагра поражает один сустав за раз.
Нефролитиаз не имеет специфических признаков физического осмотра, но может иметь болезненность реберно-позвоночного угла. Ищите гематурию в анализе мочи.
Оценка
Лабораторные исследования, скорее всего, выявят следующее:
Мочевая кислота в сыворотке: норма менее 6,8 мг/дл
взрослый мужчина на беспуриновой диете. Уровень выше этого подразумевает повышенную выработку мочевой кислоты.
Рассмотрите общий анализ крови (CBC), CMP, профиль липидов, уровни кальция и фосфата. Эти лабораторные исследования предназначены для оценки основного заболевания, приводящего к повышению уровня мочевой кислоты, но являются дополнительными исследованиями.
Рассмотреть возможность рентгенографии суставов для оценки отека суставов; однако рентген не является необходимым для диагностики подагры.
Ультразвуковое исследование почек показано пациентам с мочекислым нефролитиазом.
Процедуры
Рассмотрите совместную аспирацию для оценки кристаллов мочевой кислоты, ищите отрицательно двулучепреломляющие при поляризованной микроскопии.
Рутинный скрининг гиперурикемии не рекомендуется.[3]
Лечение/управление
Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Препараты, снижающие уровень уратов, у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли.]
Препараты, снижающие уровень уратов, у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли.]
Уратснижающие препараты:
Аллопуринол: ингибиторы ксантиноксидазы; используется для профилактики подагрического артрита, нефролитиаза и гиперурикемии, связанной с химиотерапией
мочевой кислоты в аллантоин, который гораздо более растворим в воде и легко выводится из почек и используется в качестве профилактики гиперурикемии, связанной с химиотерапией [3]
Differential Diagnosis
Gout and pseudogout
Hemolytic anaemia
Hodgkin lymphoma
Hyperparathyroidism
Hypothyroidism
Nephrolithiasis
Преэклампсия
Улучшение результатов работы команды здравоохранения
Поскольку существует множество причин гиперурикемии, с этим состоянием лучше всего справится межпрофессиональная команда, в которую входят терапевт, лечащий врач, практикующая медсестра, эндокринолог, ревматолог и онколог. Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Уратснижающие препараты у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли. [10][11]
Большинство пациентов не имеют симптомов и не нуждаются в медикаментозной терапии гиперурикемии, поскольку у них никогда не разовьется подагра или нефролитиаз. Необоснованная стоимость лекарств и вероятность побочных эффектов перевешивают пользу от начала лечения. Уратснижающие препараты у бессимптомных пациентов показаны только тем, кто проходит цитолитическую терапию по поводу злокачественных новообразований, чтобы предотвратить синдром лизиса опухоли. [10][11]
Перспективы доброкачественных причин гиперурикемии хорошие, но у больных со злокачественными новообразованиями могут развиться осложнения, такие как подагра или камни в почках. Большинство этих пациентов нуждаются в тщательном наблюдении, чтобы определить, улучшается ли их состояние на фоне лечения.[12]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.

Barkas F, Elisaf M, Liberopoulos E, Kalaitzidis R, Liamis G. Мочевая кислота и хроническое заболевание почек у лиц с дислипидемией. Curr Med Res Opin. 2018 июль; 34 (7): 1193-1199. [PubMed: 28836857]
- 2.
Dong H, Xu Y, Zhang X, Tian S. Индекс висцерального ожирения тесно связан с гиперурикемией независимо от метаболического здоровья и фенотипов ожирения. Научный представитель 2017 г., 18 августа; 7 (1): 8822. [Бесплатная статья PMC: PMC5562916] [PubMed: 28821853]
- 3.
Якупова С.П. Подагра. Новые возможности диагностики и лечения. Тер Арх. 2018 11 мая; 90 (5): 88-92. [PubMed: 30701896]
- 4.
Уильямс, Лос-Анджелес. История, симптомы, причины, факторы риска, типы, диагностика, лечение и профилактика подагры, часть 2. Int J Pharm Compd. 2019 янв-февраль;23(1):14-21. [PubMed: 30668531]
- 5.
Paquot N, Scheen AJ. [Добавление ингибитора DPP-4 или SGLT2 к метформину отдельно при диабете 2 типа].
 Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]
Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]- 6.
Ян Н, Ю И, Чжан А, Эстилл Дж, Ван Х, Чжэн М, Чжоу Ц, Чжан Дж, Ло Х, Цянь С, Мао И, Ван Ц, Ян И, Чен Ю. Отчетность, представление и формулировка рекомендаций в клиническом руководстве по подагре: систематический анализ. Открытый БМЖ. 29 января 2019 г .; 9 (1): e024315. [Бесплатная статья PMC: PMC6352818] [PubMed: 30700479]
- 7.
Алькарни Н.А., Хассан А.Х. Знания и практика лечения бессимптомной гиперурикемии среди врачей первичной медико-санитарной помощи в Джидде, Западный регион Саудовской Аравии. Saudi Med J. 2018 Dec;39(12):1218-1225. [Бесплатная статья PMC: PMC6344656] [PubMed: 30520504]
- 8.
Engel B, Schacher S, Weckbecker K, Stausberg A, Gräff I. [Острая подагра при поступлении в неотложную Текущие рекомендации]. Z Orthop Unfall. 2018 декабрь; 156 (6): 653-661. [PubMed: 29986356]
- 9.
Бузас Р.


 Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]
Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277] , Тауту О.Ф., Доробанту М., Иван В., Лигезан Д. Мочевая кислота в сыворотке и артериальная гипертензия – данные исследования Sephar III. ПЛОС Один. 2018;13(7):e0199865. [Бесплатная статья PMC: PMC6028095] [PubMed: 29966019]
, Тауту О.Ф., Доробанту М., Иван В., Лигезан Д. Мочевая кислота в сыворотке и артериальная гипертензия – данные исследования Sephar III. ПЛОС Один. 2018;13(7):e0199865. [Бесплатная статья PMC: PMC6028095] [PubMed: 29966019] Медицина (Балтимор). 2019 Февраль;98(8):e14525. [Бесплатная статья PMC: PMC6408052] [PubMed: 30813158]
Медицина (Балтимор). 2019 Февраль;98(8):e14525. [Бесплатная статья PMC: PMC6408052] [PubMed: 30813158]

 Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]
Преподобный Мед Свисс. 2017 23 августа; 13 (571): 1410-1415. [В паблике: 28837277]