ДРУГИЕ БОЛЕЗНИ МЯГКИХ ТКАНЕЙ (M70-M79) «МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ БОЛЕЗНЕЙ (МКБ-10)» (утв. Приказом Минздрава РФ от 27.05.97 N 170) (Часть I)
действует Редакция от 27.05.1997Подробная информация
ДРУГИЕ БОЛЕЗНИ МЯГКИХ ТКАНЕЙ (M70-M79)
| M70 | Болезни мягких тканей, связанные с нагрузкой, перегрузкой и давлением |
| Включено: | |
| профессиональные болезни мягких тканей | |
| Исключено: | |
| бурсит: | |
| — БДУ (M71.9) | |
| — плеча (M75.5) | |
| энтезопатии (M76-M77) | |
| M70.0 Хронический крепитирующий синовит кисти и запястья | |
M70. 1 Бурсит кисти 1 Бурсит кисти | |
| M70.2 Бурсит локтевого отростка | |
| M70.3 Другие бурситы локтевого сустава | |
| M70.4 Препателлярный бурсит | |
| M70.5 Другие бурситы коленного сустава | |
| M70.6 Бурсит большого вертела (бедренной кости) | |
| M70.7 Другие бурситы бедра | |
| M70.8 Другие болезни мягких тканей, связанные с нагрузкой, перегрузкой и давлением | |
| M70.9 Болезни мягких тканей, связанные с нагрузкой, перегрузкой и давлением неуточненные | |
| M71 | Другие бурсопатии |
| Исключено: | |
| бурсит большого пальца стопы (M20.1) | |
бурситы, связанные с нагрузкой, перегрузкой и давлением (M70. -) -) | |
| энтезопатии (M76-M77) | |
| M71.0 Абсцесс синовиальной сумки | |
| M71.1 Другие инфекционные бурситы | |
| M71.2 Синовиальная киста подколенной области [Бейкера] | |
| Исключено: с разрывом (M66.0) | |
| M71.3 Другая киста синовиальной сумки | |
| Исключено: синовиальная киста с разрывом (M66.1) | |
| M71.4 Отложения кальция в синовиальной сумке | |
| Исключено: в плече (M75.3) | |
| M71.5 Другие бурситы, не классифицированные в других рубриках | |
| Исключено: бурсит: | |
— коллатеральный большеберцовый Пеллегрини-Штиды (M76. 4) 4) | |
| — плеча (M75.5) | |
| M71.8 Другие уточненные бурсопатии | |
| M71.9 Бурсопатия неуточненная | |
| M72 | Фибробластические нарушения |
| Исключено: ретроперитонеальный фиброматоз (D48.3) | |
| M72.0 Ладонный фасциальный фиброматоз [Дюпюитрена] | |
| M72.1 Соединительнотканные узелки на тыльной поверхности пальцев | |
| M72.2 Подошвенный фасциальный фиброматоз | |
| M72.3 Узелковый фасциит | |
| M72.4 Псевдосаркоматозный фиброматоз | |
| M72.5 Фасциит, не классифицированный в других рубриках | |
| Исключено: фасциит: | |
— диффузный (эозинофильный) (M35. 4) 4) | |
| — подошвенный (M72.2) | |
| — узелковый (M72.3) | |
| M72.8 Другие фибробластические нарушения | |
| M72.9 Фибробластические нарушения неуточненные | |
| M73* | Поражения мягких тканей при болезнях, классифицированных в других рубриках |
| M73.0* Гонококковый бурсит (A54.4+) | |
| M73.1* Сифилитический бурсит (A52.7+) | |
| M73.8* Другие поражения мягких тканей при болезнях, классифицированных в других рубриках | |
| M75 | Поражения плеча |
| Исключено: синдром плечо-кисть (M89.0) | |
| M75.0 Адгезивный капсулит плеча | |
M75. 1 Синдром сдавления ротатора плеча 1 Синдром сдавления ротатора плеча | |
| M75.2 Тендинит двуглавой мышцы | |
| M75.3 Кальцифицирующий тендинит плеча | |
| M75.4 Синдром удара плеча | |
| M75.5 Бурсит плеча | |
| M75.8 Другие поражения плеча | |
| M75.9 Поражение плеча неуточненное | |
| M76 | Энтезопатии нижней конечности, исключая стопу |
| Исключено: бурсит вследствие нагрузки, перегрузки и давления (M70.-) | |
| M76.0 Тендинит ягодичных мышц | |
| M76.1 Тендинит поясничных мышц | |
| M76.2 Шпора подвздошного гребешка | |
| M76.3 Подвздошный большеберцовый связочный синдром | |
M76.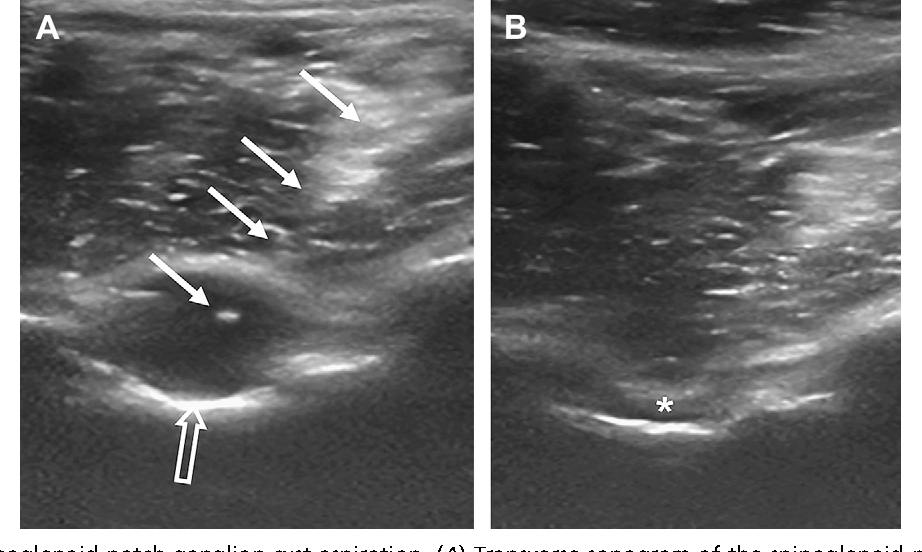 4 Большеберцовый коллатеральный бурсит [Пеллегрини-Штиды] 4 Большеберцовый коллатеральный бурсит [Пеллегрини-Штиды] | |
| M76.5 Тендинит области надколенника | |
| M76.6 Тендинит пяточного [ахиллова] сухожилия | |
| M76.7 Тендинит малоберцовой кости | |
| M76.8 Другие энтезопатии нижней конечности, исключая стопу | |
| M76.9 Энтезопатия нижней конечности неуточненная | |
| M77 | Другие энтезопатии |
| Исключено: | |
| бурсит: | |
| — БДУ (M71.9) | |
| — вследствие нагрузки, перегрузки и давления (M70.-) | |
| остеофит (M25.7) | |
| энтезопатия позвоночника (M46.0) | |
M77. 0 Медиальный эпикондилит 0 Медиальный эпикондилит | |
| M77.1 Латеральный эпикондилит | |
| M77.2 Периартериит запястья | |
| M77.3 Пяточная шпора | |
| M77.4 Метатарзалгия | |
| Исключено: метатарзалгия Мортона (G57.6) | |
| M77.5 Другие энтезопатии стопы | |
| M77.8 Другие энтезопатии, не классифицированные в других рубриках | |
| M77.9 Энтезопатия неуточненная | |
| M79 | Другие болезни мягких тканей, не классифицированные в других рубриках |
| Исключено: боль в мягких тканях, психогенная (F45.4) | |
| M79.0 Ревматизм неуточненный | |
Исключено: палиндромный ревматизм (M12. | |
| M79.1 Миалгия | |
| Исключено: миозит (M60.-) | |
| M79.2 Невралгия и неврит неуточненные | |
| Исключено: | |
| ишиас (M54.3-M54.4) | |
| мононевропатии (G56-G58) | |
| радикулит: | |
| — БДУ } | |
| — плечевой } (M54.1) | |
| — пояснично-крестцовый } | |
| M79.3 Панникулит неуточненный | |
| Исключено: панникулит: | |
| — волчаночный (L93.2) | |
| — рецидивирующий [Вебера-Крисчена] (M35.6) | |
| — шеи и позвоночника (M54.0) | |
M79. 4 Гипертрофия (подколенной) жировой подушечки 4 Гипертрофия (подколенной) жировой подушечки | |
| M79.5 Остаточное инородное тело в мягких тканях | |
| Исключено: | |
| гранулема (вызванная попаданием инородного тела в): | |
| — кожу и подкожную ткань (L92.3) | |
| — мягких тканей (M60.2) | |
| M79.6 Боль в конечности | |
| M79.8 Другие уточненные поражения мягких тканей | |
| M79.9 Болезнь мягких тканей неуточненная |
Обязательное медицинское страхование
| Обязательное медицинское страхование |
Первая частная клиника оказывает медицинскую помощь жителям Томска и Томской области в рамках системы обязательного медицинского страхования (ОМС) по хирургическим видам медицинской помощи согласно условиям Областной программы государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи на территории Томской области на 2022. Для плановой госпитализации в круглосуточный или дневной стационар хирургического профиля пациент должен иметь на руках действующий полис ОМС, подписанное направление на госпитализацию установленной формы №057у-04 (действительно в течение 1 месяца) с указанием Круглосуточный или Дневной стационар, и обследования, необходимые для госпитализации. Виды стационарной помощи: Виды помощи в рамках дневного стационара: Чтобы прооперироваться в нашей Клинике по полису ОМС, Вам необходимо обратиться в поликлинику по месту прикрепления за направлением на госпитализацию. Направление может выдать либо участковый терапевт (семейный врач, врач общей практики), либо узкий специалист (зависит от заболевания) – хирург, уролог, травматолог-ортопед и др. Данное направление обязательно заверяется подписью главного врача (заместителем главного врача по лечебной работе) и печатью учреждения.
На консультации врач определит перечень обследований на догоспитальном этапе (зависит от объема оперативного вмешательства и вида анестезии) и назначит дату госпитализации.
Предоперационное обследование Вы можете пройти в поликлинике по месту прикрепления (бесплатно, по полису ОМС) или в нашей Клинике платно. При отсутствии обследований госпитализация не проводится! Формулярный перечень лекарственных препаратов и медицинских изделий, необходимых для оказания медицинской помощи.
Показатели доступности медицинской помощи
http://1klinika.ru/component/content/article/261 |
Боль в запястье — Медицинский портал про здоровье
Боль в запястье – это специфические неприятные ощущения, свидетельствующие о наличии патологического процесса в области лучезапястного сустава, костей запястья, близлежащих мягких тканей. Бывает тупой, острой, постоянной, кратковременной, разлитой, локальной, иррадиирующей и пр. Нередко связана со временем суток или физической нагрузкой. Причины болей в запястье определяются по данным опроса, физикального осмотра, рентгенографии, УЗИ, МРТ, КТ, артроскопии, лабораторных анализов. До установления этиологии болевого синдрома рекомендован покой, прием анальгетиков.
Бывает тупой, острой, постоянной, кратковременной, разлитой, локальной, иррадиирующей и пр. Нередко связана со временем суток или физической нагрузкой. Причины болей в запястье определяются по данным опроса, физикального осмотра, рентгенографии, УЗИ, МРТ, КТ, артроскопии, лабораторных анализов. До установления этиологии болевого синдрома рекомендован покой, прием анальгетиков.
Причины боли в запястье
Травмы мягких тканей
Наиболее распространенные травматические причины болевых ощущений в запястье – ушибы и повреждения связок лучезапястного сустава. Ушиб возникает при ударе, характеризуется умеренной болью. В последующем боль становится тупой, постепенно стихает в течение нескольких суток. Может выявляться локальная припухлость, гиперемия, кровоподтеки. Функция конечности ограничивается умеренно или незначительно.
Повреждения связок (растяжения, надрывы, разрывы) развиваются при падении на разогнутую или согнутую кисть, выворачивании кисти. В момент повреждения пострадавшие иногда ощущают треск, обусловленный разрывом волокон. Боль резкая, взрывная, поверхностная, локализуется в проекции связки. После травмы утихает, но затем опять усиливается из-за нарастающего отека. Функция кисти ограничена, отмечается резкая болезненность при попытке отклонить руку в сторону, противоположную поврежденной связке.
Боль резкая, взрывная, поверхностная, локализуется в проекции связки. После травмы утихает, но затем опять усиливается из-за нарастающего отека. Функция кисти ограничена, отмечается резкая болезненность при попытке отклонить руку в сторону, противоположную поврежденной связке.
Компартмент-синдром не является самостоятельным состоянием, формируется на фоне тяжелых повреждений (переломов, вывихов), сдавления конечности, опухолей, воспалительных процессов. Особенно часто выявляется у детей с травмами руки, может стать причиной контрактуры Фолькмана. Сопровождается значительным отеком, нарастающей давящей либо распирающей болью, которая не соответствует тяжести патологии, не устраняется обычными обезболивающими средствами.
Травмы костей и суставов
Перелом луча в типичном месте развивается при падении с опорой на ладонь, сопровождается невыносимой взрывной глубокой болью, иногда – в сочетании с хрустом. Потом интенсивность боли несколько уменьшается, но болевые ощущения остаются очень яркими, усиливаются при малейших движениях. Сустав быстро отекает, возможна деформация. При эпифизеолизе лучевой кости у детей симптомы аналогичные, но менее выраженные, поэтому патологию иногда принимают за ушиб.
Сустав быстро отекает, возможна деформация. При эпифизеолизе лучевой кости у детей симптомы аналогичные, но менее выраженные, поэтому патологию иногда принимают за ушиб.
Повреждение Галеацци представляет собой сочетание перелома нижней трети луча и дистального вывиха локтевой кости. Сопровождается нестерпимой болью в предплечье и лучезапястном суставе, деформацией предплечья, выстоянием головки локтевой кости со стороны мизинца. При вывихах кисти, вызываемых ударом или падением на кисть, боль также взрывная, невыносимая, но распространяется по запястью, сочетается с резкой деформацией конечности.
Переломы костей запястья формируются при прямом ударе или падении, проявляются очень интенсивной болью в глубине основания ладони, быстро нарастающим отеком. Отличительными признаками являются невозможность сжать руку в кулак из-за боли (переломы ладьевидной и гороховидной кости, переломовывих де Кервена) или усиление болевого синдрома при тыльном разгибании кисти (перелом полулунной кости).
Дегенеративные процессы
При артрозе лучезапястного сустава, суставов запястья боли вначале кратковременные, неинтенсивные, без четкой локализации. Появляются преимущественно в начале движений, после значительных нагрузок, иногда беспокоят «на погоду». В дальнейшем становятся более длительными, разлитыми, сочетаются с преходящей скованностью. На заключительных стадиях болевой синдром длительный, возникает в покое, по ночам. Сустав деформируется, движения в нем ограничиваются.
Болезнь Кинбека характеризуется внезапными болями при движениях, нагрузке на руку. Боль глубокая, локализуется по средней линии в основании запястья, усиливается при давлении на тыльную поверхность, сгибании кисти. Болевой синдром постепенно нарастает на протяжении нескольких месяцев, дополняется нарастающим ограничением пассивных и активных движений. Часто наблюдается двустороннее поражение.
Пациенты с хондроматозом предъявляют жалобы на незначительные или умеренные глубокие разлитые боли нечеткой локализации, ограничение движений, похрустывание при движениях. Ущемление свободно лежащих внутрисуставных тел провоцирует блокады, проявляющиеся резкой болью, ограничением или невозможностью движений. При частых блокадах могут формироваться контрактуры.
Ущемление свободно лежащих внутрисуставных тел провоцирует блокады, проявляющиеся резкой болью, ограничением или невозможностью движений. При частых блокадах могут формироваться контрактуры.
Воспалительные заболевания
Асептический артрит характеризуется разлитыми тупыми тянущими или ноющими болевыми ощущениями. Пусковым моментом становится травма, инфекция или ревматический процесс. Вначале боли незначительные, непостоянные, появляются или усиливаются во второй половине дня и после нагрузки. Затем артралгии становятся длительными, распространяются по всему суставу, не исчезают в покое.
При инфекционном артрите боли дергающие, стреляющие, распирающие, пульсирующие. Их интенсивность быстро усиливается до степени непереносимых. Выявляются нарастающая отечность, разлитое покраснение сустава, значительная местная гипертермия, ухудшение состояния, повышение температуры тела. Попытки движений и прикосновения к суставу резко болезненны.
Остеомиелит лучевой кости и костей запястья обычно развивается после открытых травм и операций на суставе. В области раны обнаруживаются признаки нагноения. Боли нарастают, из тупых трансформируются в острые, сверлящие, рвущие. Общее состояние пациента прогрессивно ухудшается. Наблюдаются признаки интоксикации, общая и местная гипертермия.
В области раны обнаруживаются признаки нагноения. Боли нарастают, из тупых трансформируются в острые, сверлящие, рвущие. Общее состояние пациента прогрессивно ухудшается. Наблюдаются признаки интоксикации, общая и местная гипертермия.
Синовит лучезапястного сустава возникает на фоне других заболеваний. Сопровождается распирающей тупой болью, которая постепенно усиливается по мере накопления жидкости, быстро ослабевает после пункции сустава. При осмотре сустав увеличен в объеме, его контуры сглажены.
Специфические инфекции
Туберкулез костей запястья, лучезапястного сустава встречается редко, обычно сочетается с туберкулезным поражением другого сустава (коленного, локтевого), может иметь двухсторонний характер. Вначале отмечается незначительная тянущая или ноющая боль в мышцах, неинтенсивные артралгии после нагрузки. При прогрессировании болевой синдром усиливается, дополняется краснотой, отечностью, деформацией сустава, общей слабостью, субфебрилитетом.
Гонорейный артрит лучезапястного сустава чаще встречается у женщин, может сочетаться с поражением локтевого сустава. Наблюдаются резкие разлитые боли в покое и при движениях. При пассивных движениях болевой синдром выражен меньше, чем при активных. Пальпаторно выявляются болезненные точки в областях прикрепления сухожилий и связок к костям. Сустав отечен, гиперемирован. Температура тела повышена до фебрильных цифр, возможны ознобы.
Наблюдаются резкие разлитые боли в покое и при движениях. При пассивных движениях болевой синдром выражен меньше, чем при активных. Пальпаторно выявляются болезненные точки в областях прикрепления сухожилий и связок к костям. Сустав отечен, гиперемирован. Температура тела повышена до фебрильных цифр, возможны ознобы.
Костно-суставной вариант споротрихоза по клиническим проявлениям напоминает хронический артрит. Боли волнообразные, ноющие или тянущие, усиливающиеся после физической нагрузки. Возможны отечность, локальная гиперемия. Со временем формируются деформации.
Заболевания мягких тканей
Болезнь де Кервена (стенозирующий лигаментит) проявляется ноющей, давящей болью при отведении и разгибании 1 пальца, отклонении кисти в сторону мизинца. Боли постепенно прогрессируют, начинают беспокоить даже при незначительных движениях, иногда носят постоянный характер или появляются в покое. Локализуются в основании кисти, лучезапястном суставе, нижней части предплечья со стороны тенара. В половине случаев отмечается иррадиация в 1 палец, предплечье, плечо, локтевой сустав.
В половине случаев отмечается иррадиация в 1 палец, предплечье, плечо, локтевой сустав.
Профессиональный тендовагинит кисти развивается остро, начинается с тянущей боли в проекции того или иного сухожилия (в зависимости от характера нагрузки), усиливающейся при движениях. Сопровождается отеком, гиперемией. Затем воспаление переходит в хроническую форму. Боли уменьшатся, беспокоят только при повторяющихся движениях, давлении на область сухожилия. При инфекционных тендовагинитах все симптомы выражены ярче, боли дергающие или распирающие, хронизации не наблюдается.
Гигрома лучезапястного сустава может протекать безболезненно или сопровождаться неинтенсивными тянущими болями во время движений. Чаще образуется на тыльной, реже – на ладонной поверхности сустава. Представляет собой мягкое или тугоэластичное образование без отека и покраснения.
Новообразования
Доброкачественные опухоли протекают длительно. Остеоид-остеомы костей запястья чаще диагностируются у молодых мужчин, из-за небольших размеров могут оставаться визуально незаметными, но проявляются резкими болями в зоне поражения. При хондромах боли неинтенсивные, из-за роста неоплазии со временем возникает деформация, при пальпации обнаруживается твердое безболезненное образование в области запястья.
При хондромах боли неинтенсивные, из-за роста неоплазии со временем возникает деформация, при пальпации обнаруживается твердое безболезненное образование в области запястья.
Злокачественные опухоли в проекции запястья возникают достаточно редко. Характеризуются прогрессирующим болевым синдромом, быстрым ухудшением общего состояния. Сначала боли неинтенсивные, тупые, ноющие, без определенной локализации, затем – острые, дергающие, распирающие, жгучие, режущие. В финальной стадии болевой синдром становится непереносимым, устраняется только наркотическими анальгетиками.
Ревматические патологии
Для ревматоидного артрита типично симметричное поражение суставов. Выраженность болей определяется активностью патологического процесса.
- При 1 степени боли неинтенсивные, кратковременные, сочетаются с быстро преходящей скованностью.
- 2 степень проявляется тупой распирающей или давящей болью, которая вынуждает пациента ограничивать движения. Скованность сохраняется в течение многих часов.
 Возникают рецидивирующие синовиты. Сустав краснеет, отекает.
Возникают рецидивирующие синовиты. Сустав краснеет, отекает. - При 3 степени боли сильные, постоянные, дополняются упорными синовитами, яркими признаками воспаления.
При первичном и вторичном (на фоне иных ревматических патологий) полимиозите суставной синдром часто проявляется вовлечением лучезапястных суставов и суставов кисти. Боли тупые, ноющие, давящие или распирающие, усиливаются после нагрузки, ограничивают движения. Суставы отечные, кожа над ними гиперемирована. Обнаруживаются распространенные боли в мышцах, прогрессирующая мышечная слабость.
Множественное поражение суставов, включая лучезапястные, может наблюдаться при системной склеродермии. Болевые ощущения ноющие, тянущие, усиливаются во время двигательной активности. Пациенты жалуются на скованность. При осмотре определяется отечность, иногда формируются сгибательные контрактуры. Кожа на теле утолщенная, сухая, грубая. Возможны нарушения функций внутренних органов.
Обменные нарушения
При ревматоидноподобной и псевдофлегмонозной формах подагры наблюдается поражение одного или нескольких суставов. В первом случае болевой синдром напоминает таковой при ревматоидном артрите, во втором отмечаются острые боли и признаки воспаления. При инфекционно-аллергической форме подагры боли могут возникать в различных суставах, в том числе – в лучезапястном, быстро мигрируют от одного сустава к другому.
В первом случае болевой синдром напоминает таковой при ревматоидном артрите, во втором отмечаются острые боли и признаки воспаления. При инфекционно-аллергической форме подагры боли могут возникать в различных суставах, в том числе – в лучезапястном, быстро мигрируют от одного сустава к другому.
Поражение лучезапястного сустава типично для псевдоподагры (пирофосфатной и гидроксиапатитной артропатии). Обычно вовлекается один сустав. При острой форме боли интенсивные, жгучие или режущие, кожа над суставом отечная, покрасневшая, движения болезненны. Приступы проходят в течение недели, в межприступный период у половины больных жалобы отсутствуют. У остальных выявляется умеренный болевой синдром, усиливающийся при движениях и ослабевающий в покое.
Неврологические причины
Синдром запястного канала, обусловленный сдавлением срединного нерва, характеризуется жгучими стреляющими болями, покалыванием, онемением ладонной поверхности кисти. Боли иррадиируют в лучезапястный сустав, предплечье, реже – в пальцы. Из-за болевых приступов пациенты просыпаются по ночам. Выраженность болевого синдрома снижается при опускании рук, размахивании или встряхивании опущенными руками, растирании ладоней. Возможно одностороннее и двухстороннее поражение.
Из-за болевых приступов пациенты просыпаются по ночам. Выраженность болевого синдрома снижается при опускании рук, размахивании или встряхивании опущенными руками, растирании ладоней. Возможно одностороннее и двухстороннее поражение.
Аналогичная клиническая картина отмечается при других невропатиях срединного нерва (например, посттравматических). При невропатии локтевого нерва из-за сдавления в канале Гийона боли локализуются зоне гипотенара и основании кисти, при других поражениях этого же нерва – распространяются на запястье и кисть с предплечья. При поражении лучевого нерва беспокоят боли на тыле кисти, усиливающиеся при сгибании локтя. При всех невропатиях боль имеет характер каузалгической, наблюдаются парестезии, слабость, онемение кисти.
Диагностика
При травмах диагноз выставляется врачами-травматологами. При других патологиях обследование проводят ортопеды или ревматологи. В процессе диагностики используются данные опросы, физикального обследования, дополнительных исследований. Применяются следующие инструментальные и лабораторные методики:
Применяются следующие инструментальные и лабораторные методики:
- Рентгенография. С учетом особенностей патологии выполняют рентгенографию лучезапястного сустава или кисти. На снимках оценивают размеры суставной щели, контуры суставного конца лучевой кости, головки локтевой кости, мелких костей запястья. Выявляют линии переломов, очаги разрежения, костные разрастания.
- Ультразвуковое исследование. Сонография используется для изучения состояния суставной полости и мягких тканей. Выявляет кальцификаты, участки дегенерации, воспалительные процессы, кровоизлияния, суставные мыши, жидкость в полости сустава.
- МРТ и КТ. Являются дополнительными методами обследования, обычно назначаются при недостаточной информативности других исследований либо для уточнения плана лечебных мероприятий. На МРТ хорошо отображаются мягкотканные, на КТ – твердые структуры. Методики визуализируют опухоли, воспалительные процессы, травматические повреждения.
- Пункция сустава.
 Имеет диагностический или лечебно-диагностический характер. Выполняется для удаления жидкости, забора ее образца для цитологического или микробиологического анализа, иммунологического исследования.
Имеет диагностический или лечебно-диагностический характер. Выполняется для удаления жидкости, забора ее образца для цитологического или микробиологического анализа, иммунологического исследования. - Артроскопия. Позволяет визуально исследовать суставные поверхности и синовиальную оболочку, обнаружить признаки травмы, воспаления, дегенеративного, опухолевого процесса. В процессе процедуры могут производиться заборы биоптатов, выполняться лечебные мероприятия.
- Лабораторные исследования. По данным общего анализа крови выявляют признаки воспаления. По результатам исследований на аутоантитела обнаруживают маркеры ревматических заболеваний. По общим и биохимическим анализам определяют общее состояние организма, нарушения функции различных органов, характерные для системных процессов.
Лечение
Помощь до постановки диагноза
При травмах осуществляют иммобилизацию шиной либо подвешивают руку на косыночную повязку. Прикладывают холод. При интенсивном болевом синдроме дают обезболивающий препарат. При болях нетравматического генеза руке обеспечивают покой, при отсутствии признаков воспаления используют местные обезболивающие и согревающие средства. Сильные боли, значительная отечность, гиперемия запястья, общая гипертермия, слабость, разбитость свидетельствуют о наличии воспалительного процесса, требующего незамедлительного специализированного лечения.
При интенсивном болевом синдроме дают обезболивающий препарат. При болях нетравматического генеза руке обеспечивают покой, при отсутствии признаков воспаления используют местные обезболивающие и согревающие средства. Сильные боли, значительная отечность, гиперемия запястья, общая гипертермия, слабость, разбитость свидетельствуют о наличии воспалительного процесса, требующего незамедлительного специализированного лечения.
Консервативная терапия
Базовым лечебным мероприятием при болях в запястье является специальный режим, предусматривающий снижение нагрузки на руку. Пациенту накладывают гипсовую шину, рекомендуют использование ортезов, исключение определенных видов физической активности. При травматических повреждениях производят репозицию или вправление. Больным назначают:
- Лекарственную терапию. На пораженную область наносят лечебные гели и мази. При некоторых заболеваниях назначают НПВП, хондропротекторы внутрь или в виде инъекций.
- Внутрисуставные введения.
 При дегенеративных процессах в сустав вводят хондропротекторы, аналоги синовиальной жидкости. При упорном болевом синдроме производят блокады с гормональными средствами.
При дегенеративных процессах в сустав вводят хондропротекторы, аналоги синовиальной жидкости. При упорном болевом синдроме производят блокады с гормональными средствами. - Физиотерапевтические мероприятия. В лечении заболеваний и повреждений запястья используют УВЧ, ультразвук, электрофорез, магнитотерапию, лазеротерапию, другие методики.
- Другие немедикаментозные методы. Пациентов обучают комплексам лечебной гимнастики, проводят массаж, мануальную терапию, кинезиотерапию.
Хирургическое лечение
Хирургические вмешательства осуществляют открытым доступом или с использованием артроскопического оборудования. С учетом характера патологического процесса выполняют:
- Свежие травмы и последствия травм: остеосинтез метаэпифиза лучевой кости, остеосинтез ладьевидной кости, вправление вывиха полулунной кости, пластика ладьевидной кости.
- Дегенеративные поражения: артроскопическая хондропластика лучезапястного сустава.

- Опухоли: иссечение неоплазии, резекция кости, удаление мелкой кости, ампутация предплечья.
- Ограничения подвижности: редрессация, артролиз, артропластика, эндопротезирование.
- Неврологические патологии: пластика, декомпрессия или невролиз нерва.
В послеоперационном периоде проводят реабилитационные мероприятия, включающие массаж, ЛФК, физиотерапию. При опухолевых процессах план лечения по показаниям дополняют химиотерапией или лучевой терапией.
3. Клиническое обследование заболеваний суставов. Методическое пособие/ Ионов А.Ю., Гонтмахер Ю.В. и др. – 2003.
Чаще всего гигрома запястья не причиняет боли и медленно увеличивается в размере, а люди обращаются к врачу лишь с целью устранить косметический дефект. Но нередко шишка сопровождается скованностью в движении, резкой болью, воспалениями и нагноениями. В этом случае лечение только оперативное, другие методы результата не дают.
Чтобы понимать, почему врачи предпочитают лечить гигрому с помощью операций, необходимо иметь представления о ее особенностях и о строении лучезапястного сустава.
Считается, что гигрома запястья формируется из-за появившегося дефекта суставных капсул, сухожилий или синовиальных влагалищ. Поэтому возможны случаи, когда опухоль развивается на разных участках тела в месте расположения сустава. При этом есть важное условие: сустав должен обеспечивать движение в разных проекциях. Именно в местах, имеющих большую активность и амплитуду движений, создаются благоприятные условия для образования гигромы. Поэтому чаще всего патология возникает именно в области запястья, реже – на определенном пальце кисти рук.
Лучезапястный сустав, в силу сложного строения, является одним из наиболее уязвимых в этом плане участков. Он состоит из множества сухожилий и мелких суставов, тут расположены нервные рецепторы и проходят кровеносные сосуды. Поэтому гигрома запястья вызывает множество проблем как для больного, так и для врача. Чтобы удалить неприятную шишку нужно выяснить, в каком из сухожильных влагалищ она сформировалась.
Суставная капсула лучезапястного сустава состоит из двух слоев. Внешний – из соединительной ткани, внутренний – из синовиального эпителия. Именно в нем вырабатывается синовиальная жидкость, обеспечивающая нужное давление в суставе, питание тканей и снижение трения между хрящами. Герметичность суставной капсулы обеспечивается особыми складками, расположенными в физиологических полостях сустава.Наиболее уязвимым местом является тыльная сторона кисти – тут расположена самая крупная капсула лучезапястного сустава. Сам сустав имеет свои особенности: он образован мельчайшими костными пластинками, скрепленными между собой связками. Такое строение повышает риск получения травмы. При неправильном движении или положении кисти рук возникают растяжения, влекущие за собой ослабление тканей. Кроме того, лучезапястный сустав обеспечивает движение кисти руки в разном направлении, что приводит к износу суставной капсулы. Совокупность этих двух факторов создает все условия для формирования гигромы запястья с тыльной стороны.
Внешний – из соединительной ткани, внутренний – из синовиального эпителия. Именно в нем вырабатывается синовиальная жидкость, обеспечивающая нужное давление в суставе, питание тканей и снижение трения между хрящами. Герметичность суставной капсулы обеспечивается особыми складками, расположенными в физиологических полостях сустава.Наиболее уязвимым местом является тыльная сторона кисти – тут расположена самая крупная капсула лучезапястного сустава. Сам сустав имеет свои особенности: он образован мельчайшими костными пластинками, скрепленными между собой связками. Такое строение повышает риск получения травмы. При неправильном движении или положении кисти рук возникают растяжения, влекущие за собой ослабление тканей. Кроме того, лучезапястный сустав обеспечивает движение кисти руки в разном направлении, что приводит к износу суставной капсулы. Совокупность этих двух факторов создает все условия для формирования гигромы запястья с тыльной стороны.
Отдельную опасность представляет расположение синовиальных влагалищ мышц, с помощью которых сгибается кисть руки и большой палец. Они обе тянутся от концов большого пальца и мизинца, покрывают практически всю ладонь и заканчиваются в лучезапястном суставе. Если в этом пальце есть очаг инфекции, например, заноза с нагноением, то для проникновения патогенной микрофлоры в лучезапястный сустав и образовавшуюся на нем гигрому нужно всего 2-3 часа. Поэтому гигрома запястья часто может сопровождаться воспалительными процессами или провоцироваться ими.
Они обе тянутся от концов большого пальца и мизинца, покрывают практически всю ладонь и заканчиваются в лучезапястном суставе. Если в этом пальце есть очаг инфекции, например, заноза с нагноением, то для проникновения патогенной микрофлоры в лучезапястный сустав и образовавшуюся на нем гигрому нужно всего 2-3 часа. Поэтому гигрома запястья часто может сопровождаться воспалительными процессами или провоцироваться ими.
Гигрома всегда напрямую связана с суставом, а патологические процессы, протекающие в нем, могут стать причиной опухоли.
Основные причины проблемы
Гигрому запястья часто называют «болезнью пианистов». Считается, что монотонная работа пальцами рук, и нахождение лучезапястного сустава в неудобном с анатомической точки зрения положении способствуют развитию гигромы. Но некоторые музыканты за все время карьеры не сталкиваются с гигромой запястья. Более того, эта патология может развиваться и у людей, занятых тяжелым физическим трудом.
До сих пор не удалось выяснить, что является непосредственной причиной появления гигромы запястья. Есть несколько теорий, рассмотрим наиболее вероятные.
Есть несколько теорий, рассмотрим наиболее вероятные.
При воспалениях в суставе, например, бурсите, патогенная микрофлора проникает в эпителиальный слой суставной капсулы, вызывая нарушение ее целостности. Разрушенные участки слоя заменяются соединительной тканью (рубцом), который не может выдерживать внутрисуставное давление, созданное синовиальной жидкостью. В этом случае часть суставной капсулы выступает за анатомические пределы и на этом месте формируется полость. Со временем она заполняется синовиальной жидкостью. Многие врачи считают, что гигрома запястья развивается именно так, на ослабленной соединительной ткани.
Если гигрома, действительно, вызывается воспалительными процессами, то она имеет больше сходств с грыжей, чем с классическими опухолями. Например, грыжа белой линии живота также развивается на участках со слабой соединительной тканью, только заполнена не жидкостью, как гигрома, а частью внутреннего органа.
Также, как и грыжу, гигрому можно «вправить». Появившаяся шишка, если на нее длительное время оказывается давление, размягчается и исчезает. При этом синовиальная жидкость перетекает обратно в суставную капсулу. Если давление убрать – гигрома запястья появляется вновь.
Появившаяся шишка, если на нее длительное время оказывается давление, размягчается и исчезает. При этом синовиальная жидкость перетекает обратно в суставную капсулу. Если давление убрать – гигрома запястья появляется вновь.
Некоторые виды гигром запястья не имеют канала, соединяющего полость образования с суставной капсулой. В этом случае речь идет о кистозной форме, которая может быть вызвана паразитами или опухолями.
Некоторые врачи считают, что гигрома запястья является разновидностью доброкачественной опухоли. В этом случае формирование капсулы шишки происходит из-за нарушения деления клеток суставной капсулы, точнее – их деление никак не регулируется организмом. При продолжительном процессе формируется еще одна полость, которая заполняется синовиальной жидкостью, что влечет образование гигромы запястья. Исключение – когда клетки растут внутрь сустава и приводят к образованию синовиом.
Аутоиммунные факторы
Еще одна теория, объясняющая, почему у одних людей развивается гигрома запястья, а у других, имеющих такие же нагрузки на запястье, шишка не появляется ни разу.
Эпителиальный слой капсулы сустава производит синовиальную жидкость на протяжение всей жизни человека. Но ее количество непостоянно и регулируется особыми молекулами клеток – медиаторами. При физической активности и возросшей нагрузке на сустав они «дают команду» на повышенную секрецию.
При аутоиммунных заболеваниях в крови повышается количество медиаторов. Попадая в эпителиальный слой капсулы сустава, они усиливают секрецию синовиальной жидкости, тем самым создают ее избыточное давление. В итоге стенки суставной капсулы не выдерживают воздействия и выпирают наружу. Образовывается гигрома.
Симптомы гигромы запястья
Некоторые виды гигром не вызывают болезненности, другие, напротив, провоцируют сильную боль. Клиническая картина будет зависеть от того, на каком участке кисти сформировалась гигрома. Кроме этого, важное значение имеют сопутствующие патологические процессы.
Признаки гигромы тыла запястья
В этой части руки гигромы встречаются наиболее часто. Объяснение этому следующее: в тыльной части запястья расположена широкая связка, которая травмирует синовиальные влагалища мышц. Кроме того, при движении кистью сухожилия чаще растягиваются, чем сокращаются, что приводит к их утончению. Создаются необходимые условия для развития гигромы тыльной части запястья.
Объяснение этому следующее: в тыльной части запястья расположена широкая связка, которая травмирует синовиальные влагалища мышц. Кроме того, при движении кистью сухожилия чаще растягиваются, чем сокращаются, что приводит к их утончению. Создаются необходимые условия для развития гигромы тыльной части запястья.
Образовавшаяся шишка имеет следующие характеристики:
- диаметр до 5 см;
- высота до 2 см;
- консистенция плотная;
- подвижность различная, зависит от расположения;
- при надавливании может исчезнуть на некоторое время.
Если шишка растет из суставной капсулы, она неподвижна. В остальных случаях незначительно смещается в стороны под кожей. При длительном нажатии, например, из-за давящей повязки, гигрома запястья может исчезнуть, останется лишь небольшая шишка. При отмене давления она появится вновь спустя несколько часов или дней.
Увеличиваясь в размере, гигрома тыльной стороны запястья сдавливает часть лучевой артерии. Поэтому для этой патологии характерно постоянно нарастающее болезненное ощущение в большом пальце пораженной руки. Боли усиливаются при попытке согнуть палец.
Боли усиливаются при попытке согнуть палец.
Болезненность в самом запястье возникает из-за сдавливания нервов. В месте локализации расположено три нерва:
- лучевой;
- задний межкостный;
- задний локтевой.
Гигрома редко достигает таких размеров, при которых задевались бы сразу три нерва. Чаще всего новообразование сдавливает один или два нерва, поэтому боли, в большинстве случаев, носят умеренный характер. Нарушение иннервации в этом случае может проявиться снижением чувствительности пальцев.
Признаки гигромы внутренней стороны запястья
Гигромы этой локализации занимают второе место по частоте возникновения. Если шишка растет из синовиального влагалища большого пальца – она имеет большую плотность и относительную подвижность. При развитии гигромы из капсулы лучезапястного сустава картина несколько иная:
- размер 2 см;
- эластичная консистенция;
- не смещается относительно места положения.
Развитие гигром на внутренней стороне запястья сопряжено с высоким риском защемления локтевого нерва и компрессии локтевой артерии. Если это случается, то характерным симптомом является боль в мизинце и большом пальце, усиливающаяся при их сгибании. Кроме того, снижается чувствительность мизинца, безымянного и среднего пальца (частично).
Если это случается, то характерным симптомом является боль в мизинце и большом пальце, усиливающаяся при их сгибании. Кроме того, снижается чувствительность мизинца, безымянного и среднего пальца (частично).
Методы лечения гигромы запястья
Для лечения гигромы запястья применяют консервативный и хирургический методы. К сожалению, оба они не дают 100 % эффекта, но после операций частота рецидивов составляет лишь 20 %, а после медикаментозного лечения это значение в несколько раз больше. Тактику терапии врач выбирает исходя из размеров гигромы, поэтому рассмотрим оба метода.
1. Консервативное лечение гигромы
Медикаментозные препараты назначаются только в том случае, если гигрома запястья осложнилась воспалительным процессом. При нагноении антибиотики не успевают уничтожать стремительно размножающиеся бактерии, поэтому не назначаются. Единственным методом лечения гнойной гигромы является операция.
В качестве противовоспалительных препаратов врач может назначить.
- Нестероидные средства. Порошок «Нимесил» для приема внутрь или мазь «Диклофенак», которую нужно наносить тонким слоем на область воспаления.
- Антигистаминные препараты. Для внутреннего применения назначается «Клемастин», для нанесения на кожу – мазь «Гистан». Ее разрешено использовать и для детей в возрасте от двух лет.
- Кортикостероидные средства. Чаще всего рекомендуется применение мази «Дипросалик».
Дозировка препаратов подбирается для каждого пациента. Врачу важно знать, что у больного нет нарушений функции почек или печени. Поэтому самостоятельное лечение указанными медикаментозными средствами недопустимо.
При гигромах запястья небольшого размера хороший эффект может дать физиотерапия. Больному следует знать, что эта методика не уменьшит размер шишки, но снизит степень воспаления. Поэтому физиотерапию можно рассматривать лишь в качестве симптоматического метода. Наилучший эффект дают следующие способы:
- Прогревание запястья с помощью УВЧ.
 Достаточно десяти ежедневных процедур.
Достаточно десяти ежедневных процедур. - Воздействие на мышцы ультразвуком.
- Магнитотерапия – снимает воспаления в суставах и хрящах.
- Солевые или содовые ванны. Как вариант – с морской водой. Уменьшают степень воспалительного процесса.
Более радикальным методом лечения гигромы запястья является пункция. По своей сути, этот метод находится между консервативным и хирургическим лечением и способен на время полностью устранить гигрому.
Суть пункции заключается в проколе полости гигромы специальной иглой с последующей откачкой содержимого образования. В некоторых случаях в полость вводятся склерозирующие растворы. Это может предупредить развитие рецидива, но сопряжено с риском проникновения жидкости в капсулу сустава. Если это случится – запястье может потерять подвижность.
2. Операционное лечение гигромы запястья
В большинстве случаев гигрома запястья не представляет опасности для здоровья и целью операции является устранение косметического дефекта. Но могут возникнуть ситуации, когда новообразование грозит потерей функций кисти руки. Поэтому показаниями к операции являются:
Но могут возникнуть ситуации, когда новообразование грозит потерей функций кисти руки. Поэтому показаниями к операции являются:
- пережатие нервных волокон и кровеносных сосудов;
- снижение работоспособности кисти руки;
- вероятность разрыва капсулы гигромы и инфицирования тканей;
- гнойные процессы;
- осложнение гигромы запястья бурситом или тендовагинитом.
Во время проведения операции хирург стремится восстановить изначальное состояние суставной капсулы и удалить как можно больше измененных тканей.
Подготовка к операции
Даже если операция связана с устранением косметического дефекта, необходима серьезная подготовка пациента. В противном случае повышается риск рецидива и возникает вероятность нарушение функций лучезапястного сустава.Чтобы избежать неприятных последствий, необходимо сдать следующие анализы крови:
- на количество тромбоцитов и протромбина;
- на уровень глюкозы;
- на электролитный баланс.

Если выявляются какие-либо недостатки, принимаются меры для их устранения. Например, если у больного есть проблемы со свертыванием крови, может быть проведено переливание донорской плазмы.
Важное значение имеет и выбор анестезии. Большинство хирургов предпочитают выполнять операцию при местной анестезии, но, если от нее нет должного эффекта, может проводиться и общий наркоз. В любом случае, за день до проводимой операции пациент сдает накожную пробу, чтобы выявить возможные аллергические реакции на действующее вещество.
Утром того дня, на который назначена операция, пациенту назначается ударная доза антибиотика широкого спектра действия. Эта мера необходима, чтобы снизить вероятность инфицирования. Операционное поле выбривается, причем по сухой коже. Так не возникает раздражения.
Как проходит послеоперационный период
Если после операции нет осложнений – швы снимают через неделю, иногда – на несколько дней раньше. Для профилактики заражения назначается курс антибиотиков, а при болях – обезболивающие средства. Если возникает такое осложнение, как нагноение – необходима повторная операция с целью устранения причины и удаления отмерших тканей. Но, если операцию проводил опытный хирург – риск нагноения минимальный.
Если возникает такое осложнение, как нагноение – необходима повторная операция с целью устранения причины и удаления отмерших тканей. Но, если операцию проводил опытный хирург – риск нагноения минимальный.
Кисть руки обездвиживается с помощью специальных средств, эта мера ускорит заживление после удаления гигромы. На второй или третий день рекомендуется специальная гимнастика, целью которой является предупреждение образования спаек и снижения подвижности в суставе. Массаж при гигроме запястья не проводится.При благоприятном течении и соблюдении больным рекомендаций реабилитационный период длится две недели. Затем человек может вернуться к привычному образу жизни.
В большинстве случаев гигрома запястья не опасна для жизни и здоровья человека. Эта патология может встречаться у людей, занятых монотонным физическим трудом, при котором мышцы и связки запястного сустава напряжены. Однако известны случаи, когда проблема встречалась и у других категорий людей.
Вылечить гигрому запястья с помощью различных мазей или таблеток невозможно. Медикаментозное лечение направлено лишь на устранение воспалительных процессов и снятие болей. Такое же действие имеют и рецепты народной медицины.
Медикаментозное лечение направлено лишь на устранение воспалительных процессов и снятие болей. Такое же действие имеют и рецепты народной медицины.
Единственный метод, дающий низкую частоту развития рецидивов – хирургический. Если не игнорировать рекомендации врача и проводить операцию по удалению гигромы запястья в амбулаторных или стационарных условиях, вероятность осложнений сводится практически к нулю. В противном случае могут развиваться гнойные процессы, грозящие нарушениями функций кисти руки.
Ушиб руки – закрытая травма верхней конечности, не сопровождающаяся существенным нарушением структуры тканей. Возникает при падении или ударе. Возможно повреждение всех сегментов конечности: пальцев, кисти, предплечья, локтевого сустава, плеча и плечевого сустава. Проявляется болью и припухлостью, в месте ушиба нередко образуются гематомы. Движения обычно сохранены, но ограничены. При повреждении сустава может возникать гемартроз. Для исключения более тяжелых повреждений выполняют рентгенографию, КТ и другие исследования. Лечение консервативное.
Лечение консервативное.
МКБ-10
Общие сведения
Ушиб руки – травматическое повреждение мягких тканей верхней конечности. Кожа при таком повреждении остается целой, однако в ее толще, а также в толще мышц и подкожной жировой клетчатки, возникают кровоизлияния. В 70% случаев диагностируются легкие ушибы, в 25% случаев – ушибы средней степени тяжести и в 5% случаев – тяжелые ушибы.
Симптомы повреждения вначале постепенно нарастают, а затем полностью исчезают в течение 1-3 недель, исходом становится полное выздоровление. В отдельных случаях ушибы осложняются образованием крупных не рассасывающихся гематом или гемартрозом. Основной задачей травматолога является тщательное исключение более серьезных травм (разрывов связок, переломов, вывихов) и профилактика развития осложнений.
Причины
Ушибы руки, как правило, являются следствием бытовой или спортивной травмы. Могут выявляться у лиц любого возраста, чаще диагностируются у детей, что обусловлено их высокой физической активностью. Взрослые пациенты в зимнее время обычно травмируются при падении на улице. В летний период увеличивается количество больных с травмами, полученными во время работы на даче.
Взрослые пациенты в зимнее время обычно травмируются при падении на улице. В летний период увеличивается количество больных с травмами, полученными во время работы на даче.
Патогенез
При ушибах повреждаются кожа, мышцы и подкожная жировая клетчатка. Мелкие сосуды разрываются. Если кровь пропитывает ткани, образуется кровоизлияние, если «раздвигает» — формируется гематома (заполненная кровью полость). Вытекающая кровь и нарастающий отек сдавливают нервные окончания, поэтому боль после травмы постепенно усиливается. Если ушиб находится в зоне сустава, возникают микроскопические повреждения внутрисуставных структур, что может приводить к развитию гемартроза.
Размер гематом и кровоизлияний зависит от количества и диаметра поврежденных сосудов, а также от состояния свертывающей системы крови. Мелкие сосуды закупориваются в течение нескольких минут, крупные могут кровоточить сутки и более. У людей, страдающих гемофилией, тяжелыми болезнями печени, некоторыми аутоиммунными заболеваниями и болезнями сосудов, а также у пациентов, принимающих тромболитики, фенилин и гепарин, обширные кровоизлияния и гематомы могут возникать даже при повреждении небольшого количества мелких сосудов.
В первые 3-4 суток кровоизлияния (синяки) имеют синюшную или багровую окраску, в последующем начинают желтеть. Кровь, находящаяся в полости поверхностно расположенной гематомы, просвечивает через кожу, поэтому область гематомы выглядит темно-багровой, темно-синюшной или почти черной. Глубоко расположенные гематомы представляют собой объемные образования мягкоэластической консистенции, кожа над ними может быть не изменена или покрыта кровоподтеками.
Ушиб плечевого сустава
Симптомы
Возникает при резком ударе или падении на область плечевого сустава. Болевой синдром обычно умеренный. Выявляется отечность, ограничения движений и кровоизлияния (чаще по наружной поверхности сустава). При тяжелых ушибах с надрывом капсулы и повреждением внутрисуставных структур боли могут быть интенсивными, напоминающими болевой синдром при переломе. Возможен гемартроз или посттравматический синовит. Иногда при таком ушибе руки повреждается суставной хрящ – его мелкие кусочки откалываются и попадают в полость сустава, образуя свободно лежащие внутрисуставные тела.
Диагностика
Ушиб данной области следует в первую очередь дифференцировать от перелома хирургической шейки плеча (особенно у пожилых больных). При ушибе руки движения в суставе ограничены незначительно либо умеренно, при переломах больной не может поднять руку или отвести ее в сторону. Поколачивание по локтю при переломе вызывает боль в области плечевого сустава, при ушибе не сопровождается неприятными ощущениями. Отсутствие крепитации и патологической подвижности позволяет предположить ушиб руки, но не позволяет исключить перелом, поскольку при вколоченных повреждениях данные симптомы отсутствуют. Для постановки окончательного диагноза назначают рентгенографию плечевого сустава.
Лечение
Лечение ушибов осуществляют врачи, специализирующиеся в области травматологии и ортопедии. Руку подвешивают на косыночную повязку, рекомендуют прикладывать холод для уменьшения отека и кровоизлияний. При болях назначают анальгетики. С третьего дня выдают направление на УВЧ. Дома советуют прикладывать сухое тепло и аккуратно натирать сустав рассасывающими мазями. Пункции сустава при ушибах руки требуются чрезвычайно редко, поскольку количество жидкости обычно невелико, и она рассасывается самостоятельно. Срок нетрудоспособности колеблется от 1-2 недель при легких ушибах до 3-4 недель при тяжелых повреждениях с нарушением целостности хряща.
Пункции сустава при ушибах руки требуются чрезвычайно редко, поскольку количество жидкости обычно невелико, и она рассасывается самостоятельно. Срок нетрудоспособности колеблется от 1-2 недель при легких ушибах до 3-4 недель при тяжелых повреждениях с нарушением целостности хряща.
Ушиб плеча
Ушиб плеча обычно является следствием прямого удара. Появляются все характерные для ушиба симптомы: припухлость, кровоизлияния и боль. Дифференцировка с переломом плеча несложна: переломы диафиза сопровождаются нарушением оси сегмента (иногда – в сочетании с его укорочением), грубой деформацией, патологической подвижностью, костным хрустом и практически полной утратой возможности совершать активные движения. При ушибе руки все перечисленные признаки отсутствуют, движения сохранены, но несколько ограничены. Рентгенография плеча без изменений.
Лечение проводится в травмпункте. Используют косыночную повязку, холод, а затем тепло. Назначают УВЧ, при необходимости выписывают анальгетики. Обычно все признаки травмы исчезают в течение 1-3 недель. В отдельных случаях исходом ушиба руки становится оссифицирующий миозит – воспаление мышцы, при котором в ее толще образуются мелкие участки окостенения. При тяжелых ушибах, сопровождающихся травмой надкостницы, в отдаленном периоде иногда образуются экзостозы.
Обычно все признаки травмы исчезают в течение 1-3 недель. В отдельных случаях исходом ушиба руки становится оссифицирующий миозит – воспаление мышцы, при котором в ее толще образуются мелкие участки окостенения. При тяжелых ушибах, сопровождающихся травмой надкостницы, в отдаленном периоде иногда образуются экзостозы.
Ушиб локтевого сустава
Ушибы локтевого сустава могут возникать как при ударе, так и при падении. Пострадавший жалуется на боль. Мягкие ткани припухают, на коже появляются кровоизлияния. Движения обычно сохраняются, но их амплитуда уменьшается. Дифференциальный диагноз с вывихом костей предплечья обычно несложен. При ушибе руки, в отличие от вывиха, нет грубой деформации, сохраняются активные движения, отсутствует пружинящее сопротивление при пассивных движениях. Болевой синдром выражен менее ярко.
Труднее дифференцировать тяжелые ушибы сустава с изолированными вывихами одной из костей предплечья и переломом головки локтевой кости. Об ушибе руки свидетельствуют менее интенсивные боли и отсутствие выраженных ограничений при вращении предплечья. Рентгенография локтевого сустава подтверждает целостность костей и сохранение конгруэнтности суставных поверхностей. При нечеткой рентгенологической картине назначают сравнительные снимки обоих суставов или КТ локтевого сустава.
Рентгенография локтевого сустава подтверждает целостность костей и сохранение конгруэнтности суставных поверхностей. При нечеткой рентгенологической картине назначают сравнительные снимки обоих суставов или КТ локтевого сустава.
Лечение проводится амбулаторно. Как и при других ушибах руки, рекомендуют покой, косыночную повязку и холод к месту повреждения. К тепловым процедурам большинство травматологов относится с осторожностью, поскольку локтевой сустав «капризен» и прогревание может обернуться различными осложнениями. При легких ушибах выбирают выжидательную тактику, при тяжелых применяют электрофорез. Гемартроз обычно незначительный или отсутствует, пункции не требуются. Восстановление занимает от 1 недели до месяца.
Ушиб предплечья и лучезапястного сустава
Возникает при ударах и падениях, проявляется болью, припухлостью, кровоизлияниями и гематомами. Ушиб руки несложно отличить от перелома костей предплечья – при ушибе нет деформации, отсутствует патологическая подвижность, сохраняется ось конечности.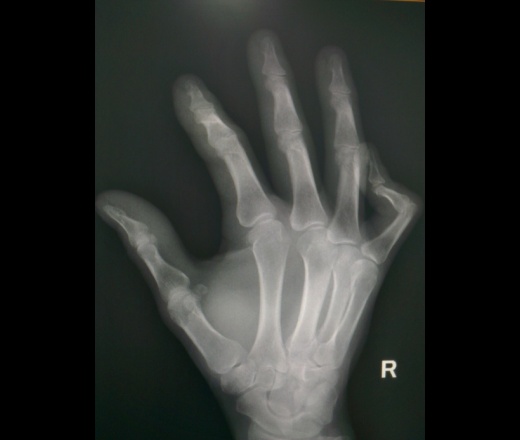 Некоторые затруднения может представлять дифференцировка ушиба и перелома одной кости предплечья. Об ушибе свидетельствует отсутствие боли при осевой нагрузке и пальпации кости. Рентгенография предплечья в норме. Лечение – как при других ушибах руки.
Некоторые затруднения может представлять дифференцировка ушиба и перелома одной кости предплечья. Об ушибе свидетельствует отсутствие боли при осевой нагрузке и пальпации кости. Рентгенография предплечья в норме. Лечение – как при других ушибах руки.
Ушиб лучезапястного сустава дифференцируют от перелома луча в типичном месте. При ушибе руки движения ограничены незначительно, отек небольшой или умеренный, осевая нагрузка безболезненна. Отсутствие деформации не является поводом для исключения перелома, поскольку при переломах луча смещение наблюдается далеко не всегда. Рентгенография лучезапястного сустава без изменений. Лечение – как при ушибах плеча и плечевого сустава.
КТ предплечья. Геморрагическое пропитывание и отек мягких тканей предплечья со стороны лучевой кости (ушиб, подкожная гематома).
Ушиб кисти и пальцев
Локальные ушибы кисти и пальцев обычно возникают при ударе, обширные – при сдавлении. Отличительными особенностями таких травм являются выраженный болевой синдром и значительный отек тыла кисти. Кроме того, тяжелые ушибы руки сопровождаются онемением, ощущением тяжести и выраженным нарушением функции. После сдавления нередко возникают очаги некроза. Кровоизлияния в мелкие суставы слабо выражены (исключение – суставы фаланг пальцев).
Кроме того, тяжелые ушибы руки сопровождаются онемением, ощущением тяжести и выраженным нарушением функции. После сдавления нередко возникают очаги некроза. Кровоизлияния в мелкие суставы слабо выражены (исключение – суставы фаланг пальцев).
При повреждении проксимальных отделов кисти в отдаленном периоде могут возникать дистрофические изменения костей запястья. При ушибах руки в области запястья и в проекции пястных костей из-за значительного отека иногда нарушается кровоснабжение кисти, что ведет к усилению болевого синдрома, возникновению застойных явлений, повреждению мелких нервов и формированию когтеобразной кисти. Ушибы ногтевых фаланг с образованием подногтевой гематомы в каждом третьем случае сочетаются с трудно диагностируемыми краевыми переломами пальцев.
Предупредить осложнения в отдаленном периоде помогает тщательная дифференциальная диагностика и продуманное лечение. Больных направляют на рентгенографию кисти, при сомнительном результате назначают КТ кисти. Руку охлаждают хлорэтилом, струей холодной воды или пакетом со льдом. При тяжелых ушибах накладывают гипс. При выраженном напряжении тканей осуществляют послабляющие разрезы. Выдают направление на УВЧ или УФО. В тяжелых случаях в восстановительном периоде применяют массаж и ЛФК.
При тяжелых ушибах накладывают гипс. При выраженном напряжении тканей осуществляют послабляющие разрезы. Выдают направление на УВЧ или УФО. В тяжелых случаях в восстановительном периоде применяют массаж и ЛФК.
Карта сайта
Карта сайтаx
ОФИЦИАЛЬНЫЙ САЙТ Департамента здравоохранения Вологодской области
Департамент здравоохранения Вологодской области
Главная
|
|
Удаление гигром лазером в Москве 🎀
Оценка: 5/5
Мила
В клинике Эл.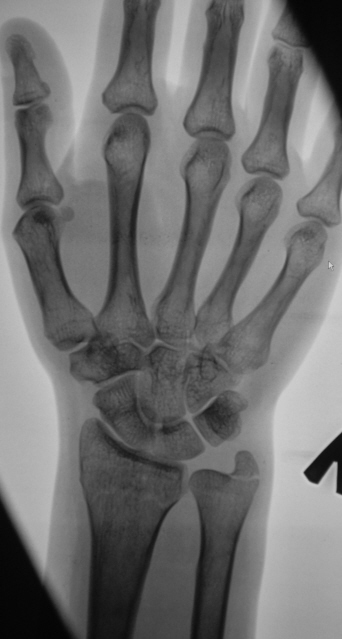 Эн. мне удаляли кисту, все прошло быстро и успешно. У вас замечательный персонал. Спасибо вам!
Эн. мне удаляли кисту, все прошло быстро и успешно. У вас замечательный персонал. Спасибо вам!
Оценка: 5/5
Мария
Огромное спасибо вашей клинике! Не жалею, что увеличивала грудь именно у вас! Я получила потрясающий результат, и мужу очень нравится. Шрамчики совсем маленькие. Ценю вас за профессионализм и особенное отношение к пациентам!
Оценка: 5/5
Ирина
Я очень рада, что наконец увеличила грудь, так как с подросткового возраста сильно комплексовала из-за ее можно сказать отсутствия. Импланты смотрятся естественно, форма груди полностью меня устраивает. На консультации мне посоветовали не сильно увеличивать объем, потому как я очень худая, и потом, это было бы серьезной нагрузкой на спину. Теперь я наслаждаюсь своим отражением в зеркале! Большое спасибо вашей клинике и всему дружелюбному и ответственному персоналу!
Оценка: 5/5
Ангелина
Помню, что на операцию в клинику Эл.Эн. ехала, как на праздник. Отопластика требовалась мне еще с детства, но раньше на то не было возможности. У меня не было никаких сомнений, что все пройдет на ура. Меня выписали в тот же день, болей не было – анальгетики отлично справлялись со своей задачей. Результат меня очень радует – ушки маленькие, аккуратные. Благодарю вашу клинику и буду советовать вас всем!
У меня не было никаких сомнений, что все пройдет на ура. Меня выписали в тот же день, болей не было – анальгетики отлично справлялись со своей задачей. Результат меня очень радует – ушки маленькие, аккуратные. Благодарю вашу клинику и буду советовать вас всем!
Оценка: 5/5
Кристина
Уже почти решилась на операбельное вмешательство, но знакомая посоветовала для начала сделать склеротерапию. Так как я очень боюсь операций, да и отзывы о них пугающие, решила попробовать этот метод лечения. Была удивлена стоимостью склеро, по сравнению с операцией это практически копейки, да и то, что не придется даже в больницу ложиться, тоже вдохновило. Для собственного спокойствия выбрала современную клинику – Эл. Эн. Сейчас курс уже закончила и результатом я довольна. Надеюсь, что мне не понадобится операция. По крайней мере, на несколько лет я ее точно отсрочила. Спасибо специалистам клиники!
Оценка: 5/5
Ольга
Операция по подтяжке живота меня спасла от послеоперационных рубцов. Еще в 25 лет мне сделали кесарево сечение, оставившее уродливый шрам на животе. Это сегодня практикуются косметические швы, а 19 лет назад о такой методике никто и не слышал. Поэтому мне и пришлось мучиться со шрамом, пока сестра не посоветовала обратиться в клинику лазерной хирургии. Оказалось, что обычная щадящая мини-абдоминопластика способна избавить меня от проблемы, которая отравляла мне всю жизнь. Спасибо центру Эл. Эн. и его специалистам за возможность вновь почувствовать себя молодой и красивой!
Еще в 25 лет мне сделали кесарево сечение, оставившее уродливый шрам на животе. Это сегодня практикуются косметические швы, а 19 лет назад о такой методике никто и не слышал. Поэтому мне и пришлось мучиться со шрамом, пока сестра не посоветовала обратиться в клинику лазерной хирургии. Оказалось, что обычная щадящая мини-абдоминопластика способна избавить меня от проблемы, которая отравляла мне всю жизнь. Спасибо центру Эл. Эн. и его специалистам за возможность вновь почувствовать себя молодой и красивой!
Оценка: 5/5
Александр
Ходил на отбеливание зубов в клинику ЭлЭн месяц назад. Все сделали даже меньше чем за час, и уже после этого было видно что эмаль посветлела на несколько тонов. Так как зубы у меня очень чувствительные, сразу возникли довольно неприятные ощущения, но в течение часа-двух после процедуры все прошло. Надеюсь эффект действительно продержится долго. Благодарю за внимательное отношение и отличную работу.
Оценка: 5/5
Людмила
Темные пятна на лице появились с возрастом. Чтобы от них избавиться, попробовала огромное количество средств, потратила большую сумму денег, но ожидаемого эффекта так и не получила. Поэтому я думала, что никакое лечение мне уже не поможет. Но все же решила сходить на консультацию к косметологу в Эл.Эн. На консультации врач расспросила меня, когда появились пигментные пятна, как я от них лечилась, чем болела, и лишь потом предложила лечение. Мне удаляли пигментные пятна лазером. Кожа стала как у молодой девушки, потемнения ушли, состояние кожи значительно улучшилось.
Чтобы от них избавиться, попробовала огромное количество средств, потратила большую сумму денег, но ожидаемого эффекта так и не получила. Поэтому я думала, что никакое лечение мне уже не поможет. Но все же решила сходить на консультацию к косметологу в Эл.Эн. На консультации врач расспросила меня, когда появились пигментные пятна, как я от них лечилась, чем болела, и лишь потом предложила лечение. Мне удаляли пигментные пятна лазером. Кожа стала как у молодой девушки, потемнения ушли, состояние кожи значительно улучшилось.
Оценка: 5/5
Алена
Три года назад сделала липосакцию бедер и ягодиц в одной областной клинике. В результате заработала неэстетичные выемки на коже, с которыми не могли справиться никакие крема и массажи. Массажистка и посоветовала сделать липофилинг. После своего неудачного опыта лазерной хирургии я очень боялась вновь довериться врачам, но клиника Эл. Эн. приятно удивила меня современной аппаратурой и высокой квалификацией врачей. Я записалась на прием, а потом и на операцию. Мне исправили все недоработки прошлой пластики, и кожа снова стала гладкой и красивой. Мне все очень понравилось. Рекомендую!
Мне исправили все недоработки прошлой пластики, и кожа снова стала гладкой и красивой. Мне все очень понравилось. Рекомендую!
Оценка: 5/5
Ирина
«Эл. Эн.», спасибо вам! Очень довольна результатом, притом прошло все действительно безболезненно – а я так боялась! Сначала сомнения одолели, да и мой молодой человек не хотел, чтобы ходила на какие-то процедуры. Но узнав, что коррекция абсолютно безопасна и не предполагает использование скальпеля, сказал, что можно попробовать. И оно того стоило!
Оценка: 5/5
Роман
Большое спасибо Калашникову А. Н. за проведенную операцию по лечению водянки яичка! Пришел к нему, мучаясь от болей и постоянного дискомфорта. Мне назначили операцию Бергмана. Отказался от общего наркоза, так как плохо его переношу. Вся процедура прошла очень аккуратно, шов заживает, выглядит уже не слишком заметно. Наконец-то могу сказать, что чувствую себя отлично!
Оценка: 5/5
Марина
На днях была в клинике ЭлЭн, делала отбеливание зубов с помощью зеленого лазера. Процедура заняла всего полчаса, при этом была совершенно безболезненна. Стоимость отбеливания зубов по такой технологии довольно высокая. Однако мне обещали, что эффект сохранится до 5 лет. Очень на это надеюсь!)
Процедура заняла всего полчаса, при этом была совершенно безболезненна. Стоимость отбеливания зубов по такой технологии довольно высокая. Однако мне обещали, что эффект сохранится до 5 лет. Очень на это надеюсь!)
Оценка: 5/5
Настя
Давно хотела увеличить себе губы, но не с помощью силикона. Силикон выглядит неестественно, а я хотела, чтобы никто не понял, что я делала пластику. Хирург клиники Эл. Эн. посоветовала мне операцию, при которой берется мой собственный жир и закачивается в область губ. Получается безопасная операция, так как вводятся собственные клетки, которые точно приживутся. А так как нужно было откуда-то брать жировые клетки, я решила сразу сделать и липосакцию бедер. Когда я очнулась от наркоза, то пожалела, что решилась сразу на две операции, потому что после липосакции очень все болело. Но потом, когда все зажило, я поняла, что все правильно сделала. Так что, девочки, не нужен вам силикон в губы, лучше решать этот вопрос более безопасным путем.
Оценка: 5/5
Оксана
Для меня лазерная липосакция стала единственным способом привести свою фигуру в порядок, так как обычных операций я панически боюсь, а всякие диеты, которых я уже перепробовала миллион, не дают желаемого результата.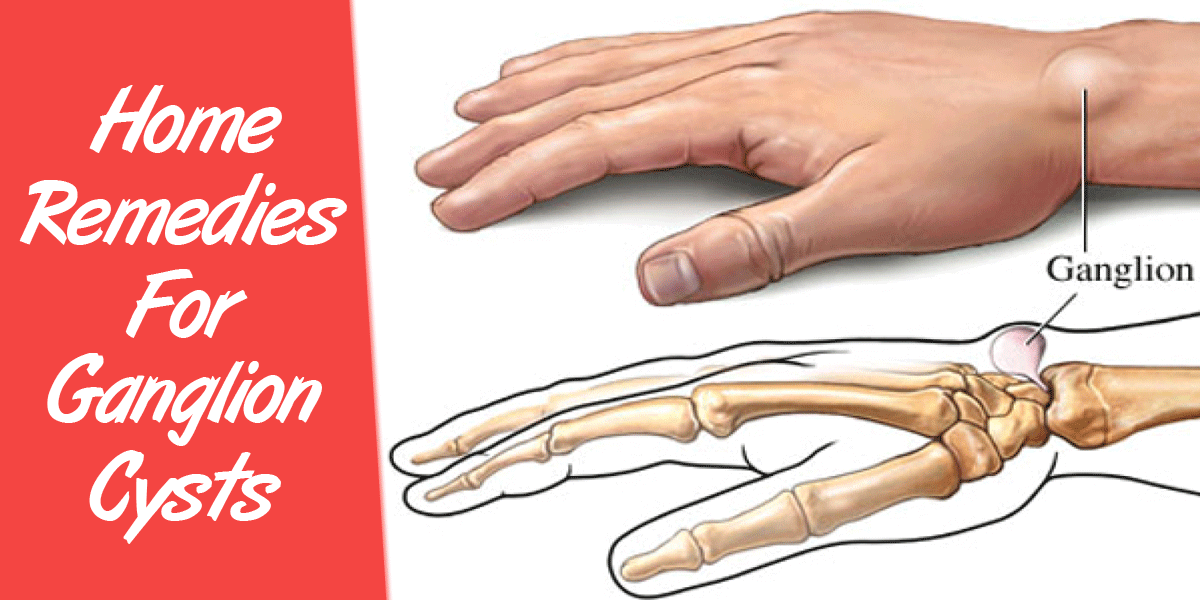 Процедуру мне делали под местной анестезией на аппарате SmartLipo. После операции на коже были видны только несколько проколов, но все зажило очень быстро. Ни боли, ни дискомфорта не было. В общем, я довольна 🙂
Процедуру мне делали под местной анестезией на аппарате SmartLipo. После операции на коже были видны только несколько проколов, но все зажило очень быстро. Ни боли, ни дискомфорта не было. В общем, я довольна 🙂
Оценка: 5/5
Мария
Я от природы худенькая, но при этом имею большую грудь. Из-за этого у меня постоянно болела спина, причем врачи только разводили руками, так как снять нагрузку с позвоночника не было возможности. Поэтому операция по уменьшению груди стала для меня настоящим спасением. Я уже настолько устала носить такую тяжесть, что меня не пугала ни операция, ни период реабилитации. Но все прошло лучше, чем я думала. Облегчение я ощутила практически сразу, так как ушла лишняя тяжесть, которая тянула меня к земле. Швы сравнительно быстро зажили, и я увидела окончательный результат. Грудь не только стала меньше, она приобрела красивую форму. Я очень довольна и всем рекомендую клинику Эл. Эн.!
Оценка: 5/5
Лилия
Сделала в клинике ЭнЭл фотодинамическое отбеливание зубов примерно неделю назад. Процедура довольно необычная, но очень эффективная и «щадящая» для зубов. Весь процесс занимает около получаса, которые пролетели довольно быстро. В результате зубки стали на несколько оттенков светлее, при этом нет никакой чувствительности или боли. Очень довольна что выбрала эту клинику!
Процедура довольно необычная, но очень эффективная и «щадящая» для зубов. Весь процесс занимает около получаса, которые пролетели довольно быстро. В результате зубки стали на несколько оттенков светлее, при этом нет никакой чувствительности или боли. Очень довольна что выбрала эту клинику!
Оценка: 5/5
Елена
Долго решалась на операцию по исправлению формы носа после старой травмы и все-таки сделала ее. В клинике ЭлЭн меня проконсультировали, провели все необходимые анализы и назначили дату. Сама операция прошла хорошо, а реабилитация быстро и без всяких осложнений. Спасибо хирургу Светлане Мишаевне за качественную и аккуратную работу. Теперь не перестаю радоваться своему аккуратному ровному носику. Нужно было не трусить, а сразу обращаться за помощью к специалисту.
Оценка: 5/5
Варвара
Перепробовав все возможные средства избавления от акне, решилась на крайнюю меру – лазерное лечение акне. Процедура не очень приятная – не больно, а горячо в некоторых местах, особенно если есть воспаления. Но вытерпеть вполне можно. Сеанс длился около 50 минут. Состоял из двух этапов. Второй, когда кожу начинают непосредственно обрабатывать лазером, более неприятный. После процедуры ощущение такое, будто вся кожа горит. А лицо было очень красным, но краснота спала уже через несколько часов. Уже на утро воспаленные прыщи почти сошли, но угри пока остались. Завтра пойду на второй сеанс, посмотрим, какой результат будет после него.
Но вытерпеть вполне можно. Сеанс длился около 50 минут. Состоял из двух этапов. Второй, когда кожу начинают непосредственно обрабатывать лазером, более неприятный. После процедуры ощущение такое, будто вся кожа горит. А лицо было очень красным, но краснота спала уже через несколько часов. Уже на утро воспаленные прыщи почти сошли, но угри пока остались. Завтра пойду на второй сеанс, посмотрим, какой результат будет после него.
Оценка: 5/5
Вика
При обращении в клинику лазерных технологий у меня был диагностирован крауроз вульвы. К счастью, заболевание находилось на самой ранней стадии, и после проведения комплексной терапии полностью прошли все симптомы. Я очень благодарна за это Инне Владимировне, которая действительно является настоящим профессионалом. Здоровья Вам и удачи!
Оценка: 5/5
Катя
Невероятно, я даже не предполагала, что возможно удалить мою застарелую татуировку на ноге. Когда-то я сделала глупость в виде татуировки плюща с цветами. Цветная татуировка надоела и стала не актуальной, приходилось прятать под брюками. Порекомендовали обратиться к Вам, так как ваши доктора являются тренерами по работе с лазерами. Действительно, после нескольких процедур татуировка побледнела и сошла на нет. Я в восторге. Всем рекомендую!!!!!!
Порекомендовали обратиться к Вам, так как ваши доктора являются тренерами по работе с лазерами. Действительно, после нескольких процедур татуировка побледнела и сошла на нет. Я в восторге. Всем рекомендую!!!!!!
Оценка: 5/5
Ирина
Очень понравилась работа доктора, Елены Гордеевой. Сразу видно – опытный мастер. Умело, со знанием дела, она взялась за лечение моего лица. Провела ряд процедур, после которых кожа преобразилась: цвет выровнялся, ушли высыпания. Ну, что еще можно сказать – рекомендую!
Оценка: 5/5
Николай
Давно мучила боль от вросшего ногтя. Наслушался историй, как друзья боролись с такой проблемой: полное удаление ногтевой пластины, кратеры от операций — жуть. Решил искать более щадящий способ лечения, и нашел вас. В день обращения провели лазерную процедуру. Ощущения терпимые, после заживления врастания не повторялось. Вполне доволен.
Оценка: 5/5
Максим Фоменко
Записывался на прием в косметологу по рекомендации, остался доволен. Помогли решить мою проблему и назначили необходимое лечение, которое мне достаточно быстро помогло. Спасибо!
Помогли решить мою проблему и назначили необходимое лечение, которое мне достаточно быстро помогло. Спасибо!
Оценка: 5/5
Жданова Ирина
Наверное это единственный раз в моей жизни, когда я не прогадала с клиникой. Очень помогли. Спасибо большое! И отдельное спасибо за то, что в самой клинике такая непринуждённая, в какой-то мере спокойная обстановка. Сразу же успокаиваешься перед
Оценка: 5/5
Роман Владимирович
У меня был грибок и я уже все перепробовал в плане лечения, но толку не было. Обратился сюда к Булановой Елене Геннадьевне и результат превзошел все мои ожидания, грибок вылечен, конечно не за один день, но вылечен. Доволен это мало сказать.
Боковая киста шеи мкб 10
Содержание
- Виды и причины появления кист шеи
- Срединные кисты шеи
- Боковые кисты шеи
- Лечение кист шеи
- Киста шеи — основные разновидности и лечение
- Механизм развития
- Классификация
- Диагностика
- Профилактика
- Заключение
- Классификация
- Симптоматика
- Диагностика
- Профилактика
- Виды и причины появления кист шеи
- Срединные кисты шеи
- Боковые кисты шеи
- Лечение кист шеи
- Киста шеи — основные разновидности и лечение
- Механизм развития
- Классификация
- Диагностика
- Профилактика
- Заключение
Киста шеи – это опухолевидное полое образование, которое располагается на боковой или передней поверхности шеи. Имеет содержание в виде жидкости или кашицы. Может иметь осложнения – злокачественное перерождение, нагноение или возникновение свища. Нагнаиваются кисты шеи в 50% случаев, а свищи могут образовываться после опорожнения кисты шеи через кожу.
Имеет содержание в виде жидкости или кашицы. Может иметь осложнения – злокачественное перерождение, нагноение или возникновение свища. Нагнаиваются кисты шеи в 50% случаев, а свищи могут образовываться после опорожнения кисты шеи через кожу.
Виды и причины появления кист шеи
Кисты шеи бывают срединными и боковыми.
Срединные кисты шеи иногда могут протекать бессимптомно, обнаруживают их зачастую в возрасте от 4 до 7 лет или от 10 до 14 лет. Образуются срединные кисты шеи в результате перемещения зачатка щитовидной железы по щитовидно-язычному протоку с места ее образования на переднюю часть шеи. Происходит это на 6-7 неделях беременности.
Боковые кисты шеи, как правило, выявляют с рождением ребенка. Они представляют собой полость в промежутке между жаберными бороздами, которая при нормальном развитии должна исчезать. Формирование боковых кист шеи происходит на 4-6 неделях беременности вследствие аномалий развития жаберных борозд.
Срединные кисты шеи
Срединные кисты шеи представляют собой безболезненное, плотное, эластичное, не спаянное с кожей образование с четкими границами, имеющее диаметр около двух сантиметров.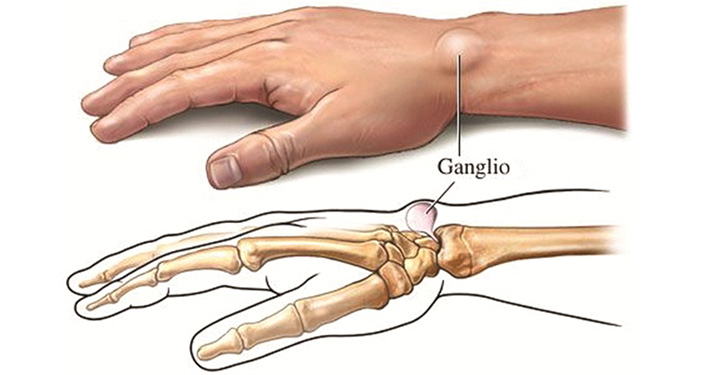 Расположены по средней линии на передней поверхности шеи и составляют примерно 40% от всех кист шеи. Срединные кисты шеи имеют свойство смещаться во время глотания, спаяны с подъязычной костью и немного подвижны. Иногда могут располагаться в язычном корне. В таких случаях язык немного приподнят, часто развиваются нарушения глотания и речи.
Расположены по средней линии на передней поверхности шеи и составляют примерно 40% от всех кист шеи. Срединные кисты шеи имеют свойство смещаться во время глотания, спаяны с подъязычной костью и немного подвижны. Иногда могут располагаться в язычном корне. В таких случаях язык немного приподнят, часто развиваются нарушения глотания и речи.
Срединные кисты шеи очень часто нагнаиваются (в 60% случаев). При попадании инфекции увеличиваются в размерах и становятся болезненными. Близлежащие ткани краснеют и отекают.
Диагностируют срединные кисты шеи с помощью УЗИ и пункции кисты шеи с дальнейшими цитологическими исследованиями. Во время пункции образуется тягучая мутная желтоватая жидкость, которая содержит элементы лимфоидов и клетки плоского многослойного эпителия. Диагноз устанавливается на основании клинических данных и анамнеза. Свищевые ходы исследуют с помощью зондирования и фистулографии.
Срединные кисты шеи имеют схожесть со струмами языка, дермоидными кистами, лимфаденитами, специфическими воспалительными процессами и аденомами аномально расположенной щитовидной железы.
Боковые кисты шеи
Боковые кисты шеи находятся на передне-боковой части шеи, в ее средней или верхней трети. Локализация боковых кист шеи – рядом с внутренней яремной веной прямо на сосудисто-нервном пучке. Боковые кисты шеи могут быть как однокамерными, так и многокамерными. В тех случаях, когда они имеют большой размер, могут сдавливаться нервы, сосуды, а также близлежащие органы.
Если нет сдавливания сосудисто-нервного пучка или нагноения, боковые кисты шеи не болезненны. Представляют собой овальное или округлое опухолевидное образование, которое легко заметить во время поворота пациентом головы в противоположную сторону. При пальпации наблюдаются болезненные ощущения. Над боковыми кистами шеи кожа, как правило, не изменена, а сами кисты подвижны, эластичны и не спаяны с кожей.
При нагноении боковых кист шеи они увеличиваются в размерах и становятся болезненными. Кожа над ними краснеет, а в дальнейшем образовывается свищ.
Диагностируют боковые кисты шеи с помощью пункции с последующими цитологическими исследованиями полученной жидкости, УЗИ, зондирования и фистулографии с рентгенконтрастным веществом. Диагноз устанавливается на основании клинической картины болезни и анамнеза.
Диагноз устанавливается на основании клинической картины болезни и анамнеза.
Неинфицированные боковые кисты шеи схожи с внеорганными опухолями шеи (липомами, невриномами) и лимфогранулематозом. Нагноившиеся – с лимфаденитом и аденофлегмоном.
Лечение кист шеи
Лечение кист шеи исключительно оперативное. Операции на кистах шеи показаны при всех боковых кистах шеи, а также при срединных кистах шеи любого размера у детей и диаметром более одного сантиметра у взрослых. Операция на кисте шеи проводится под внутривенным наркозом, ее удаляют вместе с капсулой, чтобы предупредить рецидивы. Во время операции на кисте шее хирургом сначала делается разрез над кистой, далее он выделяет и удаляет кисту вместе с оболочками. При удалении срединных кист также удаляется часть подъязычной кости, так как через нее проходит тяж от кисты. Операции на боковых кистах шеи являются более тяжелыми из-за близлежащих нервов и сосудов.
У больных пожилого возраста с наличием сопутствующих тяжелых заболеваний могут проводить аспирацию содержимого кисты шеи с дальнейшим промыванием полости кисты антисептиками. В других случаях этот метод не используется, так как он недостаточно эффективен и имеет высокий риск развития рецидивов.
В других случаях этот метод не используется, так как он недостаточно эффективен и имеет высокий риск развития рецидивов.
Благодаря минимальной травматизации тканей при операциях на кистах шеи, использованию современной техники и наложению внутренних косметических швов пациенты в минимальные сроки возвращаются к обычному образу жизни.
© 2013-2017г. МКБ 10 — Международная классификация болезней 10-го пересмотра
Киста шеи — основные разновидности и лечение
Киста шеи представляет собой доброкачественное новообразование, полость которого заполнена жидкостью, волосяными фолликулами, соединительной тканью. В соответствии с международной классификацией МКБ-10 срединная киста шеи входит в блок Q10-Q18. В большинстве случаев она локализуется с спереди или боковой стороны (боковые диагностируются в 60% случаев), реже — на шее сзади в зоне позвоночника. Патология редко сопровождается дискомфортными ощущениями, болевой синдром отсутствует, киста не оказывает влияния на обычный образ жизни, с ней можно дожить без проблем до старости. Иногда существует угроза преобразование такой опухоли в злокачественную, в таких случаях требуется срочное удаление.
Иногда существует угроза преобразование такой опухоли в злокачественную, в таких случаях требуется срочное удаление.
Патология диагностируется достаточно редко, встречается в 2-5 % от всех опухолей челюстно-лицевой зоны и шейного отдела.
Механизм развития
Киста на мягких тканях формируется вследствие патологических процессов, происходящих на этапе эмбрионального развития, чаще всего новообразование диагностируется в течение первого года после рождения малыша. При локализации спереди врожденная киста на протяжении долгого времени может оставаться незаметной и обнаруживается в подростковом возрасте.
Чаще всего киста не представляет опасности, но некоторые разновидности, кистозная гигрома в частности, становится причиной внутриутробной смерти ребенка.
Классификация
Существует несколько групп классификаций по структуре опухоли и месту локализации (спереди, сбоку, сзади).
Разновидности по характеру образования:
- бранхиогенная киста (жаберная) — формируется вследствие патологий развития эмбриона, в ходе ее разрастания незарастающие жаберные карманы наполняются жидкостью;
- дермоидная киста шеи — заполнена клетками сальных и потовых желез, соединительной тканью;
- лимфогенная — возникает в результате дисфункций развития лимфы, заполнена серозной жидкостью;
- кистозная — распространена среди детей, в 90% случаев требуется хирургической вмешательство;
- эпидермальная — образуется вследствие закупоривания сальных желез эпидермальными клетками, возникает около позвоночника на линии роста волос.

- срединная киста развивается в результате травм, инфекций, заболеваний крови и лимфы, в 50 % случаев патология сопровождается нагноением, формированием свищей, которые открываются в ротовую полость или наружу; через свищи выходит гнойная жидкость, ее проникновение в организм может стать причиной сильной интоксикации.
Новообразования меньше 1 см визуально незаметны, установить ее наличие может только профессиональный врач.
Симптоматика несколько отличается в зависимости от типа новообразования, при осмотре она определяется как эластичная опухоль, безболезненная при надавливании. При боковой кисте признаки можно перепутать с другими патологиями шейного отдела, чаще всего доброкачественное новообразование проявляется после механического повреждения или бактериальное/вирусного заражения.
В результате возникают следующие симптомы:
- отечность тканей, боль при глотании;
- подвижность новообразования;
- воспаление лимфоузлов;
- деформация гортани;
- абсцесс — после наполнения гноем и воспаления развивается абсцесс или сепсис, что приводит к заражению крови, воспалению тканей, некрозу и инфицированию всего организма.

Диагностика
Симптоматика часто бывает скрытой, выявить заболевание помогает только плановый медицинский осмотр. При диагностировании доброкачественной опухли проводится проверка капсулы на карциномы, их наличие считается опасным осложнением болезни.
- изучение состояния пациента, проверка случаев онкозаболеваний среди родственников;
- первичная пальпация пораженного участка;
- УЗИ;
- томография и гистологическое исследование;
- пункция, микробиологическое исследование клеток, наполняющих новообразование.
Единственным способом лечения кисты считается хирургическое удаление, медикаментозная терапия неэффективна. У детей операция проводится после достижения трехлетнего возраста — у взрослых после выявления патологической симптоматики. Метод удаления выбирается после тщательного изучения новообразования, установления его разновидности, размеров и других индивидуальных особенностей. Продолжительность операции не превышает часа, для ее проведения обязателен общий наркоз. Вмешательство требует профессионализма и внимания, неполное удаление грозит рецидивом, операция проводится в амбулаторных условиях, необходимость в госпитализации отсутствует.
Вмешательство требует профессионализма и внимания, неполное удаление грозит рецидивом, операция проводится в амбулаторных условиях, необходимость в госпитализации отсутствует.
Кистозные образования отличаются чувствительностью к любым тепловым процедурам, поэтому самолечение в данном случае строго противопоказано, компрессы и примочки могут нанести организму ущерб.
Показания к операции:
- превышение размеров опухоли 1 см;
- болевые ощущения;
- трудности при глотании и произнесении фраз.
Особенности проведения операции:
- Важную роль играет операбельность, при серьезных заболеваниях и пожилом возрасте операция противопоказана. Вместо этого проводится удаление содержимого новообразования, после чего полость очищается антисептическими средствами.
- Обострение воспалительного процесса — вскрывается полость, проводится дренаж, удаляется гной, операция проводится через 2-3 недели противовоспалительной терапии, допускается повторное промывание капсулы.
 Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе.
Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе. - Удаление мелких кист может производиться через ротовую полость, такой метод позволяет избежать образования швов.
- Большие опухоли удаляются через кожные разрезы, особая осторожность требуется при устранении боковых новообразований, так как они затрагивают нервы.
- Срединная киста соединяется с подъязычной костью, поэтому опухоль удаляется совместно с ее частью.
- Операция осложняется наличием свищей, выявить все тонкие выходы которых помогает контрастное вещество. При боковой локализации киста ситуация утяжеляется наличием большим кровеносных сосудов.
После проведения операции врач прописывает антибиотикотерапию и прием противовоспалительных средств, в качестве дополнительного лечения показана физиотерапия. Снятие швов проводится через неделю после проведения операции.
Вероятность рецидива повышается при диагностированном лимфадените, избежать повторного образования кисты поможет курс специальных полосканий, из рациона должны быть исключены острые и грубые блюда.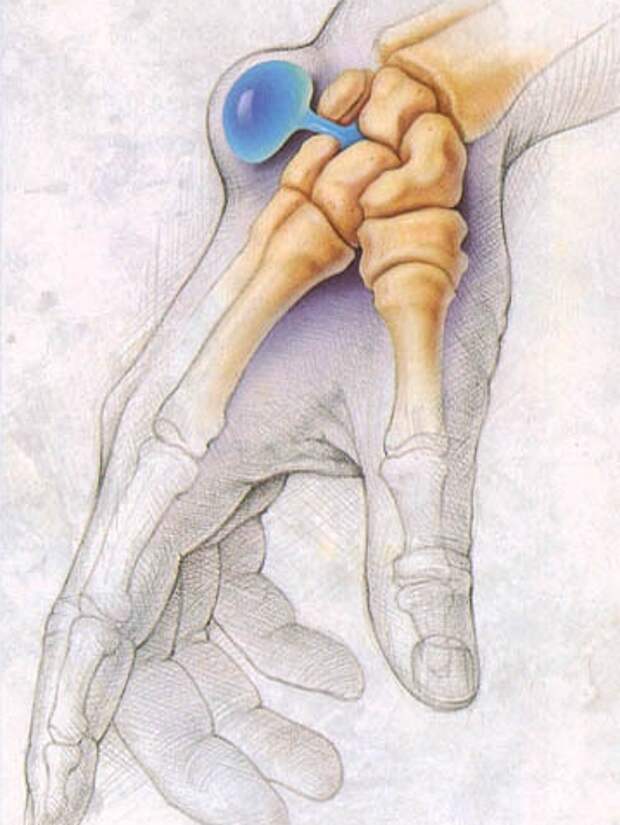
Профилактика
Киста шеи является врожденным заболеванием, поэтому меры профилактики часто отсутствуют, предотвратить нагноения поможет прохождение регулярных профилактических осмотров. Опытный врач диагностирует кисту на ранней стадии развития, после чего проводится операция.
Поскольку единственным методом лечения является оперативное вмешательство, существует риск осложнений. В 95 % случаев вмешательство заканчивается успешно, прогноз зависит от восстановительного периода, опасность могут представлять обнаруженные во время операции злокачественные очаги.
Заключение
Киста шеи — врожденное заболевание, которое встречается достаточно редко, чаще всего диагностируется в детском возрасте. Опухоль заметна визуально, симптоматика выражена при механическом повреждении или бактериальном, вирусном инфицировании. Основным методом лечения считается хирургическое вмешательство, выбор метода иссечения зависит от типа и особенностей опухоли. После операции назначается медикаментозное лечение, прогноз чаще всего положительный.
- Боль при надавливании на новообразование
- Выделение гноя из свища
- Вялость
- Головокружение
- Интоксикация
- Невозможность полного сгибания шеи
- Отечность в пораженном месте
- Повышенная температура в пораженной области
- Покраснение кожи в месте поражения
- Рвота
- Ребенок не может держать голову
- Слабость
- Субфебрильная температура
- Тошнота
- Ухудшение общего состояния
- Шишка на шее
Киста шеи – опухолевидное образование полого типа, которое располагается на боковой или передней поверхности шеи, чаще всего врождённого характера, однако может быть следствием врождённого свища шеи. Боковые кисты являются следствием врождённой патологии развития плода, тогда как срединная киста шеи у ребёнка диагностируется в возрасте от 4 до 7 лет, довольно часто может протекать бессимптомно. В половине случаев новообразование нагнаивается, что приводит к опорожнению гнойника и формированию свища.
Лечение только хирургическое. Пункцию используют крайне редко, так как скапливание жидкости или кашеобразной массы через некоторое время происходит повторно. Согласно международной классификации болезней этот патологический процесс относится к другим врождённым аномалиям лица и шеи. Код по МКБ-10 – Q18.
Боковая или бранхиогенная киста шеи, в большинстве случаев, является врождённой патологией и диагностируется при рождении. Происходит это из-за неправильного развития жаберной щели и дуг, формирование полого новообразования происходит на 4–6 неделе беременности.
Следует отметить, что боковая киста шеи опаснее срединной формы, так как в большинстве случаев, при условии отсутствия своевременного лечения, перерождается в злокачественное образование. Также при разрастании такая форма кисты шеи может сдавливать нервные окончания и близлежащие органы, что может приводить к сопутствующим патологическим процессам. Так же, как и другие формы полых опухолевидных образований, может самопроизвольно вскрываться и приводит к незаживающим жаберным свищам.
Срединная киста у взрослых (тиреоглоссальная) может быть следствием таких этиологических факторов:
- лимфаденит;
- развитие онкологического процесса в организме;
- травма;
- инфекционное заболевание.
В 60% случаев срединная киста шеи нагнаивается, что может вызывать нарушения глотательной функции и речи. В некоторых случаях такое новообразование самопроизвольно вскрывается, что приводит к формированию свища.
Точные причины развития патологии жаберной щели и дуг во время развития плода, не установлены. Однако клиницисты выделяют такие возможные предрасполагающие факторы:
- генетическая предрасположенность – если в анамнезе родителей или одного из них есть такой патологический процесс, подобное клиническое проявление может наблюдаться у новорождённого;
- сильные стрессы, постоянное нервное напряжение матери во время вынашивания ребёнка;
- злоупотребление спиртными напитками и курение;
- лечение «тяжёлыми» препаратами во время беременности, особенно на ранних сроках.
 Сюда следует отнести антибиотики, противовоспалительные, обезболивающие, кортикостероиды;
Сюда следует отнести антибиотики, противовоспалительные, обезболивающие, кортикостероиды; - системные заболевания у матери;
- наличие хронических заболеваний.
При наличии такого симптома у ребёнка следует незамедлительно обращаться к врачу. Игнорировать такое клиническое проявление крайне опасно, так как велика вероятность перерождения новообразования в злокачественную опухоль.
Классификация
Выделяют два основных вида новообразований на шее:
- боковая или бранхиогенная;
- срединная или тиреоглоссальная.
Боковые кисты, в свою очередь, разделяются на:
По структуре и принципу образования выделяют такие формы новообразований:
- дермоидная киста шеи – относится к врождённым патологиям, лежит на поверхности, не прикрепляется к глотке. Как правило, такое новообразование наполнено клетками сальных и потовых желез, волосяных фолликул;
- жаберная — располагается в области кости под языком, состоит из эпителий карманов жабр.

Также может использоваться следующая классификация кист шеи, по характеру образования и локализации:
- гигрома — мягкое и гладкое образование, которое располагается в нижнем шейном отделе;
- венозная гемангиома;
- первичная лимфома – группа спаянных уплотнённых узлов;
- нейрофиброма – неподвижные, плотные по консистенции образования, диаметр от 1 до 4 сантиметров;
- щитовидная-язычковая – может локализоваться в области гортани и шеи, передвигается вверх или вниз в процессе глотания;
- жировые опухоли.
Вне зависимости от того, какая этиология у новообразования, оно подлежит хирургическому удалению, так как риск перехода в злокачественную форму есть практически всегда.
Симптоматика
Некоторые формы новообразования на шее у детей или взрослого длительное время могут протекать бессимптомно. По мере разрастания полой опухоли могут присутствовать такие симптомы:
- невозможность полного сгибания шеи;
- при пальпации новообразования ощущается боль;
- опухоль подвижна, кожные покровы неизменены, но возможно покраснение;
- ребёнок не может держать голову;
- слабость, вялость;
- субфебрильная температура тела, также возможно местное повышение температуры;
- признаки общей интоксикации организма — тошнота, рвота, общее недомогание.

Если начался процесс нагноения, то могут присутствовать такие симптомы клинической картины:
- местное покраснение кожи, отёчность;
- повышенная температура тела;
- слабость, головокружение;
- сильная болезненность при пальпации;
- гнойный экссудат вытекает наружу, реже в ротовую полость;
- кожа вокруг устья может покрываться корками.
При наличии таких клинических признаков следует незамедлительно обращаться за медицинской помощью. Гнойный процесс может привести к абсцессу, флегмоне и другим заболеваниям, опасным для жизни.
Следует понимать, что выход наружу гнойного экссудата нельзя расценивать как выздоровление и исключение потребности обращения к врачу. Образованный свищ никогда не заживает самостоятельно, а скопление жидкости в опухоли практически всегда происходит повторно через некоторое время. Кроме этого, существенно возрастает риск малигнизации.
Диагностика
В первую очередь проводится физикальный осмотр больного с пальпацией кисты на шее. Также во время первичного обследования врач должен собрать личный и семейный анамнез.
Также во время первичного обследования врач должен собрать личный и семейный анамнез.
Для уточнения диагноза могут проводить такие лабораторно-инструментальные методы исследования:
- пункция жидкости из полого образования для последующего гистологического исследования;
- анализ крови на онкомаркеры;
- УЗИ шеи;
- фистулография;
- КТ при необходимости.
Общие клинические исследования крови и мочи, в этом случае, не представляют диагностической ценности, поэтому проводятся только при необходимости.
В этом случае лечение только операбельное, консервативные методики не эффективны. Пункция используется только в самых крайних случаях, когда проведение операции не представляется возможным по медицинским показателям. Чаще всего это касается пожилых людей. В таком случае осуществляется аспирация содержимого опухоли с последующим промыванием антисептическими растворами.
Что касается традиционного удаления кисты шеи, то такая операция проводится под наркозом, иссечение может осуществляться как через рот, так и наружно, в зависимости от клинических показателей. Для предупреждения рецидива иссечение проводится вместе с капсулой.
Для предупреждения рецидива иссечение проводится вместе с капсулой.
Удаление боковых опухолей сложнее, так как новообразование локализуется около сосудов и нервных окончаний.
Если больной поступил уже с гнойным процессом и образованием, то выполнятся вскрытие и дренирование опухоли с последующим удалением свищей. Иссечению подлежат все свищи, даже тонкие и малозаметные, так как они могут стать причиной рецидива. Для уточнения их локализации хирург предварительно может вводить окрашивающий препарат (метиленовый синий, бриллиантовую зелень).
После операции больному назначается противовоспалительная и антибактериальная терапия. Также следует осуществлять регулярные перевязки с обязательной обработкой ротовой полости антисептическими веществами.
В постоперационный период больному следует соблюдать диету, которая подразумевает следующее:
- из рациона на период лечения нужно исключить кислую, острую и слишком солённую, грубую пищу;
- напитки и блюда нужно употреблять только тёплыми;
- блюда должна быть жидкими или пюреобразными.

Если оперативное вмешательство будет осуществлено своевременно, то риск рецидива или развития онкологического процесса практически отсутствует. Длительной реабилитации не требуется.
Профилактика
К сожалению, в этом случае нет действенных методов профилактики. Настоятельно рекомендуется не заниматься самолечением и своевременно обращаться к квалифицированному врачу. В таком случае риск развития осложнений минимальный.
Киста шеи – это опухолевидное полое образование, которое располагается на боковой или передней поверхности шеи. Имеет содержание в виде жидкости или кашицы. Может иметь осложнения – злокачественное перерождение, нагноение или возникновение свища. Нагнаиваются кисты шеи в 50% случаев, а свищи могут образовываться после опорожнения кисты шеи через кожу.
Виды и причины появления кист шеи
Кисты шеи бывают срединными и боковыми.
Срединные кисты шеи иногда могут протекать бессимптомно, обнаруживают их зачастую в возрасте от 4 до 7 лет или от 10 до 14 лет. Образуются срединные кисты шеи в результате перемещения зачатка щитовидной железы по щитовидно-язычному протоку с места ее образования на переднюю часть шеи. Происходит это на 6-7 неделях беременности.
Образуются срединные кисты шеи в результате перемещения зачатка щитовидной железы по щитовидно-язычному протоку с места ее образования на переднюю часть шеи. Происходит это на 6-7 неделях беременности.
Боковые кисты шеи, как правило, выявляют с рождением ребенка. Они представляют собой полость в промежутке между жаберными бороздами, которая при нормальном развитии должна исчезать. Формирование боковых кист шеи происходит на 4-6 неделях беременности вследствие аномалий развития жаберных борозд.
Срединные кисты шеи
Срединные кисты шеи представляют собой безболезненное, плотное, эластичное, не спаянное с кожей образование с четкими границами, имеющее диаметр около двух сантиметров. Расположены по средней линии на передней поверхности шеи и составляют примерно 40% от всех кист шеи. Срединные кисты шеи имеют свойство смещаться во время глотания, спаяны с подъязычной костью и немного подвижны. Иногда могут располагаться в язычном корне. В таких случаях язык немного приподнят, часто развиваются нарушения глотания и речи.
Срединные кисты шеи очень часто нагнаиваются (в 60% случаев). При попадании инфекции увеличиваются в размерах и становятся болезненными. Близлежащие ткани краснеют и отекают.
Диагностируют срединные кисты шеи с помощью УЗИ и пункции кисты шеи с дальнейшими цитологическими исследованиями. Во время пункции образуется тягучая мутная желтоватая жидкость, которая содержит элементы лимфоидов и клетки плоского многослойного эпителия. Диагноз устанавливается на основании клинических данных и анамнеза. Свищевые ходы исследуют с помощью зондирования и фистулографии.
Срединные кисты шеи имеют схожесть со струмами языка, дермоидными кистами, лимфаденитами, специфическими воспалительными процессами и аденомами аномально расположенной щитовидной железы.
Боковые кисты шеи
Боковые кисты шеи находятся на передне-боковой части шеи, в ее средней или верхней трети. Локализация боковых кист шеи – рядом с внутренней яремной веной прямо на сосудисто-нервном пучке. Боковые кисты шеи могут быть как однокамерными, так и многокамерными. В тех случаях, когда они имеют большой размер, могут сдавливаться нервы, сосуды, а также близлежащие органы.
В тех случаях, когда они имеют большой размер, могут сдавливаться нервы, сосуды, а также близлежащие органы.
Если нет сдавливания сосудисто-нервного пучка или нагноения, боковые кисты шеи не болезненны. Представляют собой овальное или округлое опухолевидное образование, которое легко заметить во время поворота пациентом головы в противоположную сторону. При пальпации наблюдаются болезненные ощущения. Над боковыми кистами шеи кожа, как правило, не изменена, а сами кисты подвижны, эластичны и не спаяны с кожей.
При нагноении боковых кист шеи они увеличиваются в размерах и становятся болезненными. Кожа над ними краснеет, а в дальнейшем образовывается свищ.
Диагностируют боковые кисты шеи с помощью пункции с последующими цитологическими исследованиями полученной жидкости, УЗИ, зондирования и фистулографии с рентгенконтрастным веществом. Диагноз устанавливается на основании клинической картины болезни и анамнеза.
Неинфицированные боковые кисты шеи схожи с внеорганными опухолями шеи (липомами, невриномами) и лимфогранулематозом.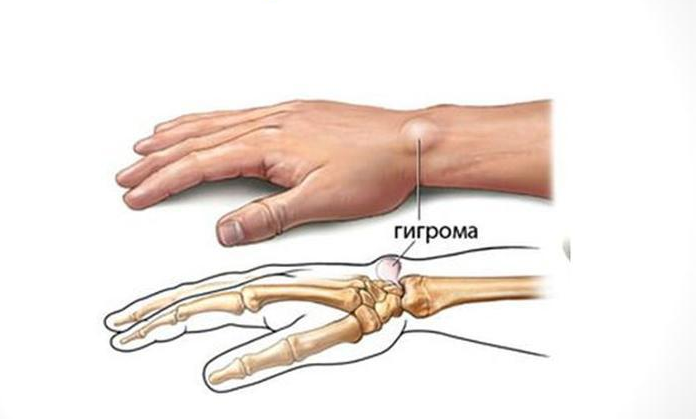 Нагноившиеся – с лимфаденитом и аденофлегмоном.
Нагноившиеся – с лимфаденитом и аденофлегмоном.
Лечение кист шеи
Лечение кист шеи исключительно оперативное. Операции на кистах шеи показаны при всех боковых кистах шеи, а также при срединных кистах шеи любого размера у детей и диаметром более одного сантиметра у взрослых. Операция на кисте шеи проводится под внутривенным наркозом, ее удаляют вместе с капсулой, чтобы предупредить рецидивы. Во время операции на кисте шее хирургом сначала делается разрез над кистой, далее он выделяет и удаляет кисту вместе с оболочками. При удалении срединных кист также удаляется часть подъязычной кости, так как через нее проходит тяж от кисты. Операции на боковых кистах шеи являются более тяжелыми из-за близлежащих нервов и сосудов.
У больных пожилого возраста с наличием сопутствующих тяжелых заболеваний могут проводить аспирацию содержимого кисты шеи с дальнейшим промыванием полости кисты антисептиками. В других случаях этот метод не используется, так как он недостаточно эффективен и имеет высокий риск развития рецидивов.
Благодаря минимальной травматизации тканей при операциях на кистах шеи, использованию современной техники и наложению внутренних косметических швов пациенты в минимальные сроки возвращаются к обычному образу жизни.
© 2013-2017г. МКБ 10 — Международная классификация болезней 10-го пересмотра
Киста шеи — основные разновидности и лечение
Киста шеи представляет собой доброкачественное новообразование, полость которого заполнена жидкостью, волосяными фолликулами, соединительной тканью. В соответствии с международной классификацией МКБ-10 срединная киста шеи входит в блок Q10-Q18. В большинстве случаев она локализуется с спереди или боковой стороны (боковые диагностируются в 60% случаев), реже — на шее сзади в зоне позвоночника. Патология редко сопровождается дискомфортными ощущениями, болевой синдром отсутствует, киста не оказывает влияния на обычный образ жизни, с ней можно дожить без проблем до старости. Иногда существует угроза преобразование такой опухоли в злокачественную, в таких случаях требуется срочное удаление.
Патология диагностируется достаточно редко, встречается в 2-5 % от всех опухолей челюстно-лицевой зоны и шейного отдела.
Механизм развития
Киста на мягких тканях формируется вследствие патологических процессов, происходящих на этапе эмбрионального развития, чаще всего новообразование диагностируется в течение первого года после рождения малыша. При локализации спереди врожденная киста на протяжении долгого времени может оставаться незаметной и обнаруживается в подростковом возрасте.
Чаще всего киста не представляет опасности, но некоторые разновидности, кистозная гигрома в частности, становится причиной внутриутробной смерти ребенка.
Классификация
Существует несколько групп классификаций по структуре опухоли и месту локализации (спереди, сбоку, сзади).
Разновидности по характеру образования:
- бранхиогенная киста (жаберная) — формируется вследствие патологий развития эмбриона, в ходе ее разрастания незарастающие жаберные карманы наполняются жидкостью;
- дермоидная киста шеи — заполнена клетками сальных и потовых желез, соединительной тканью;
- лимфогенная — возникает в результате дисфункций развития лимфы, заполнена серозной жидкостью;
- кистозная — распространена среди детей, в 90% случаев требуется хирургической вмешательство;
- эпидермальная — образуется вследствие закупоривания сальных желез эпидермальными клетками, возникает около позвоночника на линии роста волос.

- срединная киста развивается в результате травм, инфекций, заболеваний крови и лимфы, в 50 % случаев патология сопровождается нагноением, формированием свищей, которые открываются в ротовую полость или наружу; через свищи выходит гнойная жидкость, ее проникновение в организм может стать причиной сильной интоксикации.
Новообразования меньше 1 см визуально незаметны, установить ее наличие может только профессиональный врач.
Симптоматика несколько отличается в зависимости от типа новообразования, при осмотре она определяется как эластичная опухоль, безболезненная при надавливании. При боковой кисте признаки можно перепутать с другими патологиями шейного отдела, чаще всего доброкачественное новообразование проявляется после механического повреждения или бактериальное/вирусного заражения.
В результате возникают следующие симптомы:
- отечность тканей, боль при глотании;
- подвижность новообразования;
- воспаление лимфоузлов;
- деформация гортани;
- абсцесс — после наполнения гноем и воспаления развивается абсцесс или сепсис, что приводит к заражению крови, воспалению тканей, некрозу и инфицированию всего организма.

Диагностика
Симптоматика часто бывает скрытой, выявить заболевание помогает только плановый медицинский осмотр. При диагностировании доброкачественной опухли проводится проверка капсулы на карциномы, их наличие считается опасным осложнением болезни.
- изучение состояния пациента, проверка случаев онкозаболеваний среди родственников;
- первичная пальпация пораженного участка;
- УЗИ;
- томография и гистологическое исследование;
- пункция, микробиологическое исследование клеток, наполняющих новообразование.
Единственным способом лечения кисты считается хирургическое удаление, медикаментозная терапия неэффективна. У детей операция проводится после достижения трехлетнего возраста — у взрослых после выявления патологической симптоматики. Метод удаления выбирается после тщательного изучения новообразования, установления его разновидности, размеров и других индивидуальных особенностей. Продолжительность операции не превышает часа, для ее проведения обязателен общий наркоз. Вмешательство требует профессионализма и внимания, неполное удаление грозит рецидивом, операция проводится в амбулаторных условиях, необходимость в госпитализации отсутствует.
Вмешательство требует профессионализма и внимания, неполное удаление грозит рецидивом, операция проводится в амбулаторных условиях, необходимость в госпитализации отсутствует.
Кистозные образования отличаются чувствительностью к любым тепловым процедурам, поэтому самолечение в данном случае строго противопоказано, компрессы и примочки могут нанести организму ущерб.
Показания к операции:
- превышение размеров опухоли 1 см;
- болевые ощущения;
- трудности при глотании и произнесении фраз.
Особенности проведения операции:
- Важную роль играет операбельность, при серьезных заболеваниях и пожилом возрасте операция противопоказана. Вместо этого проводится удаление содержимого новообразования, после чего полость очищается антисептическими средствами.
- Обострение воспалительного процесса — вскрывается полость, проводится дренаж, удаляется гной, операция проводится через 2-3 недели противовоспалительной терапии, допускается повторное промывание капсулы.
 Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе.
Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе. - Удаление мелких кист может производиться через ротовую полость, такой метод позволяет избежать образования швов.
- Большие опухоли удаляются через кожные разрезы, особая осторожность требуется при устранении боковых новообразований, так как они затрагивают нервы.
- Срединная киста соединяется с подъязычной костью, поэтому опухоль удаляется совместно с ее частью.
- Операция осложняется наличием свищей, выявить все тонкие выходы которых помогает контрастное вещество. При боковой локализации киста ситуация утяжеляется наличием большим кровеносных сосудов.
После проведения операции врач прописывает антибиотикотерапию и прием противовоспалительных средств, в качестве дополнительного лечения показана физиотерапия. Снятие швов проводится через неделю после проведения операции.
Вероятность рецидива повышается при диагностированном лимфадените, избежать повторного образования кисты поможет курс специальных полосканий, из рациона должны быть исключены острые и грубые блюда.
Профилактика
Киста шеи является врожденным заболеванием, поэтому меры профилактики часто отсутствуют, предотвратить нагноения поможет прохождение регулярных профилактических осмотров. Опытный врач диагностирует кисту на ранней стадии развития, после чего проводится операция.
Поскольку единственным методом лечения является оперативное вмешательство, существует риск осложнений. В 95 % случаев вмешательство заканчивается успешно, прогноз зависит от восстановительного периода, опасность могут представлять обнаруженные во время операции злокачественные очаги.
Заключение
Киста шеи — врожденное заболевание, которое встречается достаточно редко, чаще всего диагностируется в детском возрасте. Опухоль заметна визуально, симптоматика выражена при механическом повреждении или бактериальном, вирусном инфицировании. Основным методом лечения считается хирургическое вмешательство, выбор метода иссечения зависит от типа и особенностей опухоли. После операции назначается медикаментозное лечение, прогноз чаще всего положительный.
Гипоплазия лимфатических капилляров в коже плодов с повышенной воротниковой прозрачностью и синдромом Тернера: сравнение с трисомиями и контролем | Молекулярная репродукция человека
Журнальная статья
К. С. фон Кайзенберг,
К. С. фон Кайзенберг *
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Дж. Уилтинг,
Дж. Уилтинг
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Т. Дёрк,
Т. Дёрк
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
К.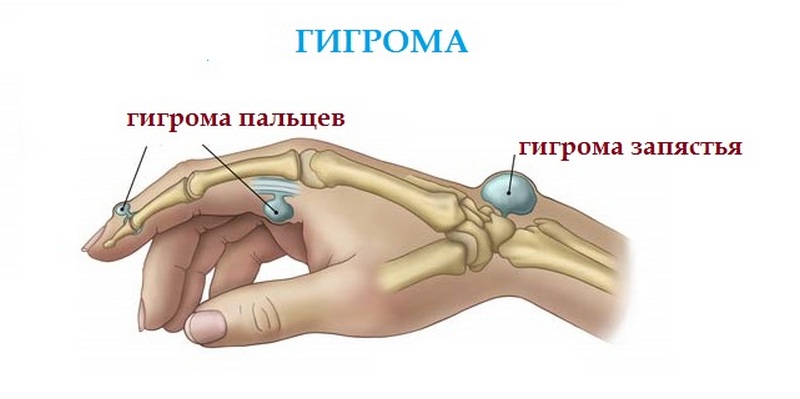 Х. Николаидес,
Х. Николаидес,
К.Х. Николаидес
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
И. Майнхольд-Херляйн,
И. Мейнхольд-Херляйн
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
П. Хиллеманнс,
П. Хиллеманнс
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Б. Бранд-Сабери
Б. Бранд-Сабери
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Молекулярная репродукция человека , том 16, выпуск 10, октябрь 2010 г. , страницы 778–789, https://doi.org/10.1093/molehr/gaq035
, страницы 778–789, https://doi.org/10.1093/molehr/gaq035
Опубликовано:
10 мая 2010 г.
История статьи
Получен:
28 февраля 2010 г.
Полученная ревизия:
27 апреля 2010 г.
Принято:
04 мая 2010
Опубликовано:
10 мая 2010
Фильтр поиска панели навигации Молекулярная репродукция человекаЭтот выпускЖурналы ESHREРепродуктивная медицинаКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Молекулярная репродукция человекаЭтот выпускЖурналы ESHREРепродуктивная медицинаКнигиЖурналыOxford Academic Термин поиска на микросайте
Расширенный поиск
Цель этого исследования заключалась в том, чтобы получить представление о развитии и распределении кровеносных сосудов, лимфатических капилляров кожи и лимфатических коллекторов кожи и подкожного слоя, а также изучить изменения в развитии по мере увеличения срока беременности. Иммунофлуоресценцию криосрезов с 10 специфическими антителами использовали для исследования кожи затылка трех плодов с синдромом Тернера и дифференцировки лимфатических сосудов, лимфатических капилляров (FLT4, PTN 63, LYVE1, PROX1), кровеносных сосудов (KDR, CD 31, PDPN), крови свертывающая активность (фактор фон Виллебранда), базальные мембраны и крупные сосуды (ламинин, коллаген IV типа). Результаты сравнивали с таковыми у семи плодов с трисомией 21 и у двух плодов с трисомией 18 или 13 соответственно, а также у шести нормальных контролей. Иммунореактивные рецепторы фактора роста эндотелия сосудов (FLT4) были снижены в лимфатических капиллярах кожи плодов Тернера. Соответственно, LYVE1 было мало, а окрашивание PROX1 было менее интенсивным в дерме плодов Тернера. Однако лимфатические коллекторы окрашивались равномерно. У нормальных плодов и у плодов с трисомиями лимфатические капилляры были распределены равномерно. Мы пришли к выводу, что гипоплазия лимфатических капилляров может быть причиной воротниковой кистозной гигромы при синдроме Тернера. Однако биологическая основа повышенной прозрачности воротникового пространства при трисомиях может быть иной.
Однако лимфатические коллекторы окрашивались равномерно. У нормальных плодов и у плодов с трисомиями лимфатические капилляры были распределены равномерно. Мы пришли к выводу, что гипоплазия лимфатических капилляров может быть причиной воротниковой кистозной гигромы при синдроме Тернера. Однако биологическая основа повышенной прозрачности воротникового пространства при трисомиях может быть иной.анеуплоидия, кровеносные сосуды, лимфатические сосуды, просвет воротникового пространства, патофизиология
систем (ван дер Путте, 1977). У нормальных эмбрионов затылочные лимфатические сосуды в основном развиваются из яремных сегментов кардинальных вен (Wigle and Oliver, 1999). Ранние лимфатические сосуды временно уменьшают свои связи с венами, образуя яремно-подмышечные лимфатические мешки. Впоследствии они могут снова соединяться с яремными венами и отводить лимфатическую жидкость (Van der Putte and Van Limborgh, 1980). Поскольку лимфатическая система млекопитающих происходит из эмбриональных вен, ее морфогенез включает приобретение идентичности лимфатических эндотелиальных клеток и отделение от сети кровеносных сосудов (Adams and Alitalo, 2007; Karpanen and Alitalo, 2008). Развитие лимфатических сосудов включает в себя несколько этапов, молекулярные компоненты которых только начали формироваться (Hong и др. ., 2004; Адамс и Алитало, 2007 г.; Карпанен и Алитало, 2008). К ним относятся детерминация судьбы посредством последовательного действия транскрипционных факторов SRY (определяющая пол область Y) бокса 18 и связанных с Prospero гомеобокса 1 (PROX1), SOX18 и PROX1, для запуска дифференцировки лимфатических эндотелиальных клеток из кардинальной вены (Wigle and Oliver). , 1999; Wigle et al. ., 2002; François et al. ., 2008), а также латеральную миграцию в ответ на фактор роста эндотелия сосудов VEGF-C, который способствует прорастанию PROX1-позитивных лимфатических эндотелиальных клеток через VEGFR3. рецептор (Карккайнен и др. ., 2004). В созревании лимфатического зачатка на более поздних стадиях участвуют транскрипционные факторы FOXC2 и NFATc1, артериальный регулятор эфрин B2 и контакты гладкомышечных клеток (Petrova et al ., 2004; Mäkinen et al ., 2005; Adams and Alitalo, 2007; Norrmén и др. ., 2009). Для разделения двух основных сосудистых сетей у млекопитающих также необходим гематопоэтический сигнальный путь через тирозинкиназу SYC и домен SRC-гомологии 2 (Sh3), содержащий лейкоцит-специфический фосфопротеин 76 кДа, SLP76 (Abtahian и др. ., 2003). Эмбрионы мышей, лишенные киназы SYK и адапторного белка SLP76, развивают аномальные кровяно-лимфатические эндотелиальные соединения (Sebzda et al.
, 1999; Wigle et al. ., 2002; François et al. ., 2008), а также латеральную миграцию в ответ на фактор роста эндотелия сосудов VEGF-C, который способствует прорастанию PROX1-позитивных лимфатических эндотелиальных клеток через VEGFR3. рецептор (Карккайнен и др. ., 2004). В созревании лимфатического зачатка на более поздних стадиях участвуют транскрипционные факторы FOXC2 и NFATc1, артериальный регулятор эфрин B2 и контакты гладкомышечных клеток (Petrova et al ., 2004; Mäkinen et al ., 2005; Adams and Alitalo, 2007; Norrmén и др. ., 2009). Для разделения двух основных сосудистых сетей у млекопитающих также необходим гематопоэтический сигнальный путь через тирозинкиназу SYC и домен SRC-гомологии 2 (Sh3), содержащий лейкоцит-специфический фосфопротеин 76 кДа, SLP76 (Abtahian и др. ., 2003). Эмбрионы мышей, лишенные киназы SYK и адапторного белка SLP76, развивают аномальные кровяно-лимфатические эндотелиальные соединения (Sebzda et al. ., 2006). SYK и SLP76 являются сигнальными медиаторами, активируемыми ниже иммунорецепторов и интегринов, содержащих «мотив активации на основе тирозина иммунорецепторов» (ITAM), а основные домены SLP76 для сигналов ITAM — это те, которые наиболее эффективно поддерживают разделение между лимфатическими и кровеносными сосудами (Abtahian et al. ., 2006), предполагая, что Syk и Slp76 могут быть необходимы для опосредованного интегрином направления циркулирующих эндотелиальных клеток-предшественников в эндотелий сосудов (Karpanen and Alitalo, 2008).
., 2006). SYK и SLP76 являются сигнальными медиаторами, активируемыми ниже иммунорецепторов и интегринов, содержащих «мотив активации на основе тирозина иммунорецепторов» (ITAM), а основные домены SLP76 для сигналов ITAM — это те, которые наиболее эффективно поддерживают разделение между лимфатическими и кровеносными сосудами (Abtahian et al. ., 2006), предполагая, что Syk и Slp76 могут быть необходимы для опосредованного интегрином направления циркулирующих эндотелиальных клеток-предшественников в эндотелий сосудов (Karpanen and Alitalo, 2008).
Ранее были указания на то, что аномальное увеличение воротникового пространства может быть связано с аномальным развитием лимфатических и венозных сосудов шеи плода. Микроскопическое исследование с использованием гематоксилина и эозина, окрашивание трихромом по Массону и окрашивание антигена, связанного с фактором VIII (Mukai и др. ., 1980), исследуя лимфатические сосуды в коже самопроизвольно абортированных плодов с кистозными гигромами шейки матки, сообщают о многочисленных расширенных лимфатических сосудах, тогда как при синдроме Тернера таких сосудов очень мало. В коже нормальных плодов лимфатические сосуды были распределены равномерно (Читаят и др. ., 1989). Более недавнее исследование объема яремного лимфатического мешка с помощью ультразвука показало, что увеличение воротникового пространства предшествует увеличению яремного лимфатического мешка (Bekker 9).0089 и др. ., 2006а). Кроме того, антитело против лимфатического маркера PROX1 показало отсутствие или уменьшение окрашивания в увеличенных яремных лимфатических мешках плодов с анеуплоидией и отеком затылка, тогда как окрашивание LYVE1 было нормальным (Bekker et al. ., 2006b, 2008). Кроме того, увеличенные яремные лимфатические мешки имели некоторые характеристики кровеносных сосудов, а просвет содержал клетки крови и гладкомышечные клетки, выстилающие стенку, что совместимо с потерей лимфатической идентичности (Bekker 9).0089 и др. ., 2006b, 2008).
В коже нормальных плодов лимфатические сосуды были распределены равномерно (Читаят и др. ., 1989). Более недавнее исследование объема яремного лимфатического мешка с помощью ультразвука показало, что увеличение воротникового пространства предшествует увеличению яремного лимфатического мешка (Bekker 9).0089 и др. ., 2006а). Кроме того, антитело против лимфатического маркера PROX1 показало отсутствие или уменьшение окрашивания в увеличенных яремных лимфатических мешках плодов с анеуплоидией и отеком затылка, тогда как окрашивание LYVE1 было нормальным (Bekker et al. ., 2006b, 2008). Кроме того, увеличенные яремные лимфатические мешки имели некоторые характеристики кровеносных сосудов, а просвет содержал клетки крови и гладкомышечные клетки, выстилающие стенку, что совместимо с потерей лимфатической идентичности (Bekker 9).0089 и др. ., 2006b, 2008).
Целью данного исследования было получить более глубокое представление о развитии и распределении кровеносных и лимфатических сосудов в коже шеи анеуплоидных плодов, помимо изучения увеличенных яремных лимфатических мешков между 11 и 20 неделями, путем индивидуального изучения лимфатических сосудов, обоих лимфатических и кровеносные сосуды, сосуды со свертывающей активностью и крупные сосуды с базальными мембранами. В частности, были подробно изучены лимфатические капилляры кожи и лимфатические коллекторы на границе между кожей и подкожной клетчаткой, чтобы выяснить, может ли дефицит лимфатических капилляров быть причиной характерного фенотипа кистозной гигромы воротникового пространства.
В частности, были подробно изучены лимфатические капилляры кожи и лимфатические коллекторы на границе между кожей и подкожной клетчаткой, чтобы выяснить, может ли дефицит лимфатических капилляров быть причиной характерного фенотипа кистозной гигромы воротникового пространства.
22″ data-legacy-id=»s2a»> Материал пациента
Кожа затылка трех плодов с синдромом Тернера, семи плодов с трисомией 21, двух плодов с трисомией 18, двух плодов с трисомией 13 и шести нормальных контрольных плодов от 11 до 16 недель беременности был исследован (таблица I). Были включены шесть дополнительных нормальных контрольных плодов на 11 +1 , 12 +2 , 13 +5 , 15 +2 , 17 +4 или 19 +1 недели беременности, соответственно. изучить развитие сосудов с увеличением гестационного возраста. Беременность отсчитывали от первого дня последней менструации. Забор ворсин хориона проводили по просьбе родителей для определения кариотипа. Было получено письменное информированное согласие, и исследование было одобрено этическим комитетом больницы. Сбор тканей производили в соответствии с рекомендациями Полкингхорна по использованию тканей плода в исследованиях (Polkinghorne, 19).89). Ткани кожи рассекали после терапевтического прерывания беременности или беременностей, прерванных по психосоциальным причинам. Ткани помещали в Tissue Tek (Leica, Бенсхайм, Германия), замораживали и хранили при температуре -70°C до проведения дальнейших процедур.
Забор ворсин хориона проводили по просьбе родителей для определения кариотипа. Было получено письменное информированное согласие, и исследование было одобрено этическим комитетом больницы. Сбор тканей производили в соответствии с рекомендациями Полкингхорна по использованию тканей плода в исследованиях (Polkinghorne, 19).89). Ткани кожи рассекали после терапевтического прерывания беременности или беременностей, прерванных по психосоциальным причинам. Ткани помещали в Tissue Tek (Leica, Бенсхайм, Германия), замораживали и хранили при температуре -70°C до проведения дальнейших процедур.
Таблица I
Кожа затылка трех плодов с синдромом Тернера, семи плодов с трисомией 21, двух плодов с трисомией 18, двух плодов с трисомией 13 и шести эуплоидных контролей от 11 до 16 недель беременности.
| Кариотип . | Недели беременности (ВЕРХ) . | CRL (мм) . | НТ (мм)
. | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Turner | 11 +0 | 40 a/ 44 b | 7.4 | ||||||||||||||||||||||||
| Turner | 11 +6 | 54 a | 6.2 | ||||||||||||||||||||||||
| Тернер | 14 +0 | 52 a | 6.0 | ||||||||||||||||||||||||
| Trisomy 21 | 12 +6 | 50 a | Nk | ||||||||||||||||||||||||
| Trisomy 21 | 14 +3 | 69 a /86 b | 8.8 | ||||||||||||||||||||||||
| Trisomy 21 | 14 +4 | 57 a | 2.2 | ||||||||||||||||||||||||
| Trisomy 21 | 14 +5 | 59 a | 2 | ||||||||||||||||||||||||
| Trisomy 21 | 20 +1 | 59 a | 8.5 | ||||||||||||||||||||||||
| Trisomy 21 | 13 +4 | nk | nk | ||||||||||||||||||||||||
| Trisomy 21 | 16 +0 | nk | nk | ||||||||||||||||||||||||
| Trisomy 18 | 16 +4 | 64 a | 1. 7 7 | ||||||||||||||||||||||||
| Trisomy 18 | nk | nk | nk | ||||||||||||||||||||||||
| Trisomy 13 | 14 +1 | 65 a | 3.8 | ||||||||||||||||||||||||
| Trisomy 13 | 14 +4 | 76 A /83 B | 5,6 | ||||||||||||||||||||||||
| Контроль | +1 +1| +1 +1 | +1 +1 | 0271 | <2 | control | 11 +6 | 27 a /55 b | <2 | control | 12 +2 | 35 a / 60 b | <2 | control | 13 +6 | 29 a /83 b | <2 | control | 14 +5 | 61 a /94 b | <2 | control | 16 +4 | BPD 37 | <2 | |
Karyotype
. | Недели беременности (ВЕРХ) . | CRL (мм) . | НТ (мм) . |
|---|---|---|---|
| Тернер | 11 +0 | 40 a/ 44 b | 7.4 |
| Turner | 11 +6 | 54 a | 6.2 |
| Turner | 14 +0 | 52 a | 6.0 |
| Trisomy 21 | 12 +6 | 50 a | Nk |
| Trisomy 21 | 14 +3 | 69 a /86 b | 8.8 |
| Trisomy 21 | 14 +4 | 57 a | 2.2 |
| Trisomy 21 | 14 +5 | 59 a | 2 |
| Trisomy 21 | 20 +1 | 59 a | 8. 5 5 |
| Trisomy 21 | 13 +4 | nk | nk |
| Trisomy 21 | 16 +0 | nk | nk |
| Trisomy 18 | 16 +4 | 64 a | 1.7 |
| Trisomy 18 | nk | nk | nk |
| Trisomy 13 | 14 +1 | 65 a | 3.8 |
| Trisomy 13 | 14 +4 | 76 a /83 b | 5.6 |
| control | 11 +1 | 39 a /58 b | <2 |
| control | 11 +6 | 27 a /55 b | <2 |
| control | 12 +2 | 35 a /60 b | < 2 |
| control | 13 +6 | 29 a /83 b | <2 |
| control | 14 +5 | 61 a /94 b | <2 |
| контроль | 16 +4 | БПД 37 | <2 |
| Кариотип . | Недели беременности (ВЕРХ) . | CRL (мм) . | НТ (мм) . |
|---|---|---|---|
| Turner | 11 +0 | 40 a/ 44 b | 7.4 |
| Turner | 11 +6 | 54 a | 6.2 |
| Тернер | 14 +0 | 52 и | 6.0 |
| Trisomy 21 | 12 +6 | 50 a | Nk |
| Trisomy 21 | 14 +3 | 69 a /86 b | 8. 8 8 |
| Trisomy 21 | 14 +4 | 57 a | 2.2 |
| Trisomy 21 | 14 +5 | 59 a | 2 |
| Trisomy 21 | 20 +1 | 59 a | 8.5 |
| Trisomy 21 | 13 +4 | nk | nk |
| Trisomy 21 | 16 +0 | nk | nk |
| Trisomy 18 | 16 +4 | 64 a | 1.7 |
| Trisomy 18 | nk | nk | nk |
| Trisomy 13 | 14 +1 | 65 a | 3.8 |
| Trisomy 13 | 14 +4 | 76 a /83 b | 5. 6 6 |
| control | 11 +1 | 39 a /58 b | <2 |
| control | 11 +6 | 27 a /55 b | <2 |
| control | 12 +2 | 35 a /60 b | <2 |
| control | 13 +6 | 29 a /83 b | <2 |
| control | 14 +5 | 61 a /94 b | <2 |
| Control | 16 +4 | BPD 37 | <2 |
5559966
5559669
555575755555555555555555555555555555555555555555555555555555555555555556695555 .
 5
5 нк, неизвестно; CRL: длина макушки от крестца; NT, воротниковая прозрачность.
a Измерения во время сканирования шеи.
b Измерения во время прерывания беременности (ТОР).
Открыть в новой вкладке
Для всех плодов с анеуплоидиями и для контрольной группы с нормальными хромосомами гестация при постановке диагноза и при прерывании, а также измерение воротникового пространства приведены в Таблице I. Плоды с синдромом Тернера были прекращены в 11 +0 , 11 +6 и 14 +0 недель, соответствующие измерения воротникового пространства составили 7,4, 6,2 и 6,0 мм.
Антитела
Десять антител применяли для характеристики распределения кровеносных и лимфатических сосудов в криосрезах плода. Их характеристики приведены в Таблице II (Kato et al. ., 2006; Baluk and McDonald, 2008). Чтобы дифференцировать кровеносные и лимфатические сосуды, для селективного окрашивания лимфатических сосудов использовали антитела (FLT4, PTN63, LYVE1 и PROX1; таблица II). Мы использовали антитела против рецептора сосудистого эндотелиального фактора роста FLT4 (VEGFR3), поскольку его экспрессия во время развития становится в основном ограниченной лимфатическим эндотелием, за исключением венул с высоким эндотелием в лимфатических органах (Kaipainen 9).0089 и др. ., 1995). Кроме того, мы использовали антитела против PTN63 (5′-нуклеотидаза), поскольку она специфически экспрессируется в лимфатических эндотелиальных клетках, и LYVE1, эндотелиальный трансмембранный рецептор, который может связывать гиалуронан. Биологическая функция еще не идентифицирована, так как нокаут не имеет фенотипа развития (Gale et al. ., 2007). Он служит ранним и специфическим маркером лимфатических эндотелиальных клеток в лимфатических капиллярах, но отсутствует в кровеносных сосудах (Banerji 9).0089 и др. ., 1999; Мякинен и др. ., 2005). Кроме того, мы использовали антитела против PROX1, ядерного фактора транскрипции, экспрессируемого в субпопуляции эндотелиальных клеток (Wilting et al.
Мы использовали антитела против рецептора сосудистого эндотелиального фактора роста FLT4 (VEGFR3), поскольку его экспрессия во время развития становится в основном ограниченной лимфатическим эндотелием, за исключением венул с высоким эндотелием в лимфатических органах (Kaipainen 9).0089 и др. ., 1995). Кроме того, мы использовали антитела против PTN63 (5′-нуклеотидаза), поскольку она специфически экспрессируется в лимфатических эндотелиальных клетках, и LYVE1, эндотелиальный трансмембранный рецептор, который может связывать гиалуронан. Биологическая функция еще не идентифицирована, так как нокаут не имеет фенотипа развития (Gale et al. ., 2007). Он служит ранним и специфическим маркером лимфатических эндотелиальных клеток в лимфатических капиллярах, но отсутствует в кровеносных сосудах (Banerji 9).0089 и др. ., 1999; Мякинен и др. ., 2005). Кроме того, мы использовали антитела против PROX1, ядерного фактора транскрипции, экспрессируемого в субпопуляции эндотелиальных клеток (Wilting et al. ., 2002), которые путем почкования и прорастания дают начало лимфатической системе (Wigle and Oliver 1999; Wigle et al. ., 2002). Некоторые предметные стекла дополнительно окрашивали антисывороткой против подопланина (PDPN), трансмембранного гликопротеина, который способствует адгезии, миграции и тубулогенезу лимфатических эндотелиальных клеток (Schacht 9).0089 и др. ., 2003).
., 2002), которые путем почкования и прорастания дают начало лимфатической системе (Wigle and Oliver 1999; Wigle et al. ., 2002). Некоторые предметные стекла дополнительно окрашивали антисывороткой против подопланина (PDPN), трансмембранного гликопротеина, который способствует адгезии, миграции и тубулогенезу лимфатических эндотелиальных клеток (Schacht 9).0089 и др. ., 2003).
Таблица II
Десять антител для характеристики развития и распределения кровеносных и лимфатических сосудов в сосудах малого, среднего и большого диаметра.
| Антитело . | Характеристика . | Кровеносный сосуд . | Лимфатика . |
|---|---|---|---|
| FLT4 (VEGFR3) | Специфическая тирозинкиназная активность и распределение только в лимфатических сосудах, экспрессия становится в основном ограниченной лимфатическим эндотелием во время развития, за исключением венул с высоким эндотелием в лимфатических органах | − | + |
| PTN 63 | Selectively stains lymphatic endothelial cells | − | + |
| LYVE1 | A lymphatic vessel endothelial hyaluronan receptor (hyaluronan-binding protein) which is degrading hyaluronan in lymphatics и отсутствует в кровеносных сосудах, окрашивание лимфатических капилляров | − | + |
| PROX1 | Ген гомеобокса экспрессируется в субпопуляции эндотелиальных клеток, которые путем почкования и прорастания дают начало лимфатической системе | − | + |
| KDR (VEGFR2) | Specific tyrosine kinase activity and distribution of both blood vessels and lymphatics | + | + |
| CD 31 | Endothelial cell adhesion molecule, staining of both кровеносные и лимфатические сосуды | + | + |
| PDPN | Панлимфатический сосудистый маркер, базальные клетки эпидермиса и лимфатические сосуды | − | + |
| vWF | Staining of vessels with blood clotting activity in both blood and lymphatic vessels | + | + |
| Laminin | Staining of basement membranes of the skin and of most blood vessels | + | + |
| Коллаген типа IV | Окрашивание базальных мембран кожи и большинства кровеносных сосудов, а также собирательных лимфатических сосудов большого диаметра | + | + |
Антитело
. | Характеристика . | Кровеносный сосуд . | Лимфатика . |
|---|---|---|---|
| FLT4 (VEGFR3) | Специфическая тирозинкиназная активность и распределение только в лимфатических сосудах, экспрессия становится в основном ограниченной лимфатическим эндотелием во время развития, за исключением венул с высоким эндотелием в лимфатических органах | − | + |
| PTN 63 | Selectively stains lymphatic endothelial cells | − | + |
| LYVE1 | A lymphatic vessel endothelial hyaluronan receptor (hyaluronan-binding protein) which is degrading hyaluronan in lymphatics и отсутствует в кровеносных сосудах, окрашивание лимфатических капилляров | − | + |
| PROX1 | Ген гомеобокса экспрессируется в субпопуляции эндотелиальных клеток, которые путем почкования и прорастания дают начало лимфатической системе | − | + |
| KDR (VEGFR2) | Specific tyrosine kinase activity and distribution of both blood vessels and lymphatics | + | + |
| CD 31 | Endothelial cell adhesion molecule, staining of both кровеносные и лимфатические сосуды | + | + |
| PDPN | Панлимфатический сосудистый маркер, базальные клетки эпидермиса и лимфатические сосуды | − | + |
| vWF | Staining of vessels with blood clotting activity in both blood and lymphatic vessels | + | + |
| Laminin | Staining of basement membranes of the skin and of most blood vessels | + | + |
| Коллаген типа IV | Окрашивание базальных мембран кожи и большинства кровеносных сосудов, а также собирательных лимфатических сосудов большого диаметра | + | + |
Тип сосуда и характер каждого антитела суммированы.
Открыть в новой вкладке
Таблица II
Десять антител для характеристики развития и распределения кровеносных и лимфатических сосудов в сосудах малого, среднего и большого диаметра.
| Антитело . | Характеристика . | Кровеносный сосуд . | Лимфатика . | ||
|---|---|---|---|---|---|
| FLT4 (VEGFR3) | Специфическая активность тирозинкиназы и распределение только на лимфатических веществах, экспрессия в основном ограничивается лимфатическим эндотелием во время развития, за исключением высоких эндотелиальных венул в лимфатических или лимфатических или 92 -й эндотелий, за исключением высоких эндотелиальных венул в лимфатических или лимфатических или лимфатических эндотелия. | PTN 63 | Селективно окрашивает лимфатические эндотелиальные клетки | − | + |
| LYVE1 | A lymphatic vessel endothelial hyaluronan receptor (hyaluronan-binding protein) which is degrading hyaluronan in lymphatics and is absent in blood vessels, staining of lymphatic capillary vessels | − | + | ||
| PROX1 | Ген гомеобокса экспрессируется в субпопуляции эндотелиальных клеток, которые путем почкования и прорастания дают начало лимфатической системе | − | + | ||
| кдр (VEGFR2) | Специфическая активность тирозинкиназы и распределение как кровеносных сосудов, так и Lymphatics | + | + | ||
| + | |||||
| + | |||||
| + | |||||
| + | |||||
| + | |||||
| + | 77. 10277.1027. 10277.1027. | + | + | ||
| PDPN | Панлимфатический сосудистый маркер, базальные клетки эпидермиса и лимфатические сосуды | − | + | ||
| vWF | Окрашивание сосудов с активностью свертывания крови как в кровеносных, так и в лимфатических сосудах | + | + | ||
| Ламинин | собирательные сосуды | + | + | ||
| Коллаген типа IV | Окрашивание базальных мембран кожи и большинства кровеносных сосудов, а также собирательных лимфатических сосудов большого диаметра | + | + |
| Антитело . | Характеристика . | Кровеносный сосуд . | Лимфатика . |
|---|---|---|---|
| FLT4 (VEGFR3) | Специфическая тирозинкиназная активность и распределение только в лимфатических сосудах, экспрессия становится в основном ограниченной лимфатическим эндотелием во время развития, за исключением венул с высоким эндотелием в лимфатических органах | − | + |
| PTN 63 | Selectively stains lymphatic endothelial cells | − | + |
| LYVE1 | A lymphatic vessel endothelial hyaluronan receptor (hyaluronan-binding protein) which is degrading hyaluronan in lymphatics и отсутствует в кровеносных сосудах, окрашивание лимфатических капилляров | − | + |
| PROX1 | Ген гомеобокса экспрессируется в субпопуляции эндотелиальных клеток, которые путем почкования и прорастания дают начало лимфатической системе | − | + |
| KDR (VEGFR2) | Specific tyrosine kinase activity and distribution of both blood vessels and lymphatics | + | + |
| CD 31 | Endothelial cell adhesion molecule, staining of both кровеносные и лимфатические сосуды | + | + |
| PDPN | Панлимфатический сосудистый маркер, базальные клетки эпидермиса и лимфатические сосуды | − | + |
| vWF | Staining of vessels with blood clotting activity in both blood and lymphatic vessels | + | + |
| Laminin | Staining of basement membranes of the skin and of most blood vessels | + | + |
| Коллаген типа IV | Окрашивание базальных мембран кожи и большинства кровеносных сосудов, а также собирательных лимфатических сосудов большого диаметра | + | + |
Тип сосуда и характер каждого антитела суммированы.
Открыть в новой вкладке
Чтобы еще больше отличить кровеносные и лимфатические сосуды, для окрашивания кровеносных и лимфатических сосудов использовали антитела против KDR или CD31 (таблица II). KDR (VEGFR2) на 81% идентичен FLT4 в домене тирозинкиназы (Pajusola et al. , 1992) и, как известно, окрашивает оба типа сосудов в активированной ткани (Partanen 9).0089 et al. ., 1999) и эмбрионов (Wilting et al. ., 1997). CD31 представляет собой молекулу адгезии эндотелиальных клеток, присутствующую как в кровеносных, так и в лимфатических сосудах.
Антитело, обнаруживающее фактор фон Виллебранда (vWF) (таблица II), служило маркером активности свертывания крови и использовалось для окрашивания кровеносных и лимфатических сосудов, а также для дальнейшей характеристики лимфатических сосудов.
Наконец, базальные мембраны окрашивали с использованием антител против ламинина и коллагена IV типа (таблица II), чтобы отличить лимфатические капилляры от крупных сосудов, включая собирательные лимфатические сосуды (Петрова и др. ., 2004).
., 2004).
Иммуногистохимия
Криосрезы кожи затылка плодов с синдромом Тернера, трисомиями 21, 18 и 13 и хромосомно нормальных контролей для специфического окрашивания «лимфатических сосудов» окрашивали антителами против FLT4 (кроличьи античеловеческие, Santa Cruz Biotechnology, Санта-Крус, Калифорния, США, поликональный, 1:100), PTN63 (любезно предоставленный H.-G. Mannherz из отдела анатомии и эмбриологии, Бохум, Германия, античеловеческий мышиный, моноклональный, 1:4), как описано ранее (Беккер et al. ., 2008), LYVE1 (кроличьи античеловеческие; Reliatech, Брауншвейг, Германия, поликлональные, 1:200) и PROX1 (кроличьи античеловеческие; Reliatech, Брауншвейг, Германия, поликлональные, 1:1000). Некоторые предметные стекла дополнительно окрашивали антисывороткой против PDPN (мышиная античеловеческая; Reliatech, Вольфенбюттель, Германия, моноклональная, 1:100). Криосрезы для окрашивания «как кровеносных, так и лимфатических сосудов» окрашивали с использованием антител против KDR (любезно предоставленных доктором Х. А. Вейхом из Центра исследований инфекций им. Гельмгольца, Брауншвейг, Германия, поликлональные, 1:50) и CD31 (мышиные античеловеческие; RDI). , Биозол, Эхинг, Германия, моноклональный, 1:50). Для измерения активности «свертывания крови» использовали антитела против vWF (кроличьи античеловеческие, Dako, Гамбург, Германия, поликлональные, 1:100). Для окрашивания «базальных мембран» использовали антитела против коллагена IV типа (Heyl, Берлин, Германия; моноклональные, 1:100) и ламинина (кроличьи античеловеческие, Sigma, Мюнхен, Германия, поликлональные, 1:100).
А. Вейхом из Центра исследований инфекций им. Гельмгольца, Брауншвейг, Германия, поликлональные, 1:50) и CD31 (мышиные античеловеческие; RDI). , Биозол, Эхинг, Германия, моноклональный, 1:50). Для измерения активности «свертывания крови» использовали антитела против vWF (кроличьи античеловеческие, Dako, Гамбург, Германия, поликлональные, 1:100). Для окрашивания «базальных мембран» использовали антитела против коллагена IV типа (Heyl, Берлин, Германия; моноклональные, 1:100) и ламинина (кроличьи античеловеческие, Sigma, Мюнхен, Германия, поликлональные, 1:100).
Замороженные срезы (20 мкм) собирали на предметные стекла, покрытые хром-алюмо-желатином. После сушки их блокировали 1% бычьим сывороточным альбумином в 0,1 М калий-фосфатном буфере (рН 7,6) в течение 10 мин и инкубировали с первичными моноклональными или поликлональными антителами против различных компонентов внеклеточного матрикса (60 мин при комнатной температуре). После промывания фосфатным буфером срезы инкубировали с аффинно-очищенным козьим антимышиным IgG для моноклональных антител и с козьим антикроличьим IgG для поликлональных антител, оба конъюгированы с Cy3 от Dianova (Гамбург, Германия, 1 :200). Контроль осуществлялся двумя способами. Криостатные срезы анеуплоидных и эуплоидных плодов обрабатывали так же, как описано выше, за исключением исключения первичных антител для оценки степени неспецифического окрашивания. Альтернативно, сыворотку предиммунизированных мышей использовали вместо первого моноклонального антитела и сыворотку предиммунизированных кроликов вместо первого поликлонального антитела для контроля специфичности. Срезы исследовали с помощью эпифлуоресцентной микроскопии (Zeiss, Axio Imager Z1).
Контроль осуществлялся двумя способами. Криостатные срезы анеуплоидных и эуплоидных плодов обрабатывали так же, как описано выше, за исключением исключения первичных антител для оценки степени неспецифического окрашивания. Альтернативно, сыворотку предиммунизированных мышей использовали вместо первого моноклонального антитела и сыворотку предиммунизированных кроликов вместо первого поликлонального антитела для контроля специфичности. Срезы исследовали с помощью эпифлуоресцентной микроскопии (Zeiss, Axio Imager Z1).
Результаты
Иммуноокрашивание лимфатических сосудов
У плодов с синдромом Тернера цепочка расширенных сосудов в месте соединения дермы и подкожной клетчатки была окрашена антителом FLT4, что указывает на их лимфатическое происхождение. В дерме было мало окрашенных сосудов, что указывало на лимфатическую гипоплазию в дерме (рис. 1f и 2b, d). Антитело FLT4 окрашивало сосуды как большого, так и малого диаметра по всей дерме и подкожному слою в коже воротникового пространства плодов с трисомией, с меньшим количеством сосудов при трисомии 13 (рис. 3a–c, средняя панель). Не было никаких явных изменений от сосудов большого диаметра к сосудам меньшего диаметра в хромосомно нормальном контроле (рис. 3d, средняя панель, таблица III).
3a–c, средняя панель). Не было никаких явных изменений от сосудов большого диаметра к сосудам меньшего диаметра в хромосомно нормальном контроле (рис. 3d, средняя панель, таблица III).
Таблица III
Результаты исследований антител в коже воротникового пространства плодов с синдромом Тернера, трисомиями и нормальным контролем.
| . | Тернер ( n = 3) . | Управление ( n = 6) . | Трисомия 21 ( n = 7) . | Трисомия 18 ( n = 2) . | Трисомия 13 ( n = 2) . |
|---|---|---|---|---|---|
| vessels | Chain of large diameter vessels at dermis/subcutis junction | Normal capillary pattern for gestation | No morphological abnormality | No morphological abnormality | Fewer capillaries subepidermally |
| FLT4 (VEGFR3) | − | + | + | + | +/− |
| ПТН 63 | − | + | + | + | + |
| LYVE1 | − | + | nk | nk | nk |
| PROX1 | − | + | nk | nk | nk |
| KDR (VEGFR2) | + | + | + | + | + |
| CD 31 | ++ | ++ | nk | nk | nk |
| PDPN | − | + | ++ | nk | Nk |
| vWF | − | + | + | + | + |
| Laminin | ++ | ++ | ++ | ++ | ++ |
| Collagen type IV | ++ | ++ | ++ | ++ | ++ |
. | Тернер ( n = 3) . | Управление ( n = 6) . | Трисомия 21 ( n = 7) . | Трисомия 18 ( n = 2) . | Трисомия 13 ( n = 2) . |
|---|---|---|---|---|---|
| сосуды | Цепочка сосудов большого диаметра на границе дермы и подкожной клетчатки | Normal capillary pattern for gestation | No morphological abnormality | No morphological abnormality | Fewer capillaries subepidermally |
| FLT4 (VEGFR3) | − | + | + | + | +/− |
| PTN 63 | − | + | + | + | + |
| LYVE1 | − | + | nk | nk | nk |
| PROX1 | − | + | nk | nk | nk |
| KDR (VEGFR2) | + | + | + | + | + |
| CD 31 | ++ | ++ | nk | nk | nk |
| PDPN | − | + | ++ | nk | Nk |
| vWF | − | + | + | + | + |
| Laminin | ++ | ++ | ++ | ++ | ++ |
| Collagen Тип IV | ++ | ++ | ++ | ++ | ++ |
Antibodies против FLT4, PTN63, LYVE1, POX -neM1. KDR и CD31 использовали для окрашивания как кровеносных, так и лимфатических сосудов; vWf использовался для окрашивания как кровеносных, так и лимфатических сосудов с активностью свертывания крови, а ламинин и коллаген IV типа окрашивали базальные мембраны сосудов. Эпидермис не был частью этого исследования, но базальная мембрана эпидермиса была сильно окрашена с использованием ламинина и коллагена IV типа. Верхняя часть подкожной клетчатки не содержала большого количества сосудов и поэтому также не учитывалась в этой таблице. Каждый слайд был изучен двумя независимыми исследователями, и интенсивность иммунофлуоресцентного окрашивания была широко классифицирована с использованием четырех категорий: — отсутствует; +/-, плохое окрашивание; +, умеренное окрашивание; ++, сильное окрашивание; НК, неизвестно.
KDR и CD31 использовали для окрашивания как кровеносных, так и лимфатических сосудов; vWf использовался для окрашивания как кровеносных, так и лимфатических сосудов с активностью свертывания крови, а ламинин и коллаген IV типа окрашивали базальные мембраны сосудов. Эпидермис не был частью этого исследования, но базальная мембрана эпидермиса была сильно окрашена с использованием ламинина и коллагена IV типа. Верхняя часть подкожной клетчатки не содержала большого количества сосудов и поэтому также не учитывалась в этой таблице. Каждый слайд был изучен двумя независимыми исследователями, и интенсивность иммунофлуоресцентного окрашивания была широко классифицирована с использованием четырех категорий: — отсутствует; +/-, плохое окрашивание; +, умеренное окрашивание; ++, сильное окрашивание; НК, неизвестно.
Открыть в новой вкладке
Таблица III
Результаты исследований антител в коже воротникового пространства плодов с синдромом Тернера, трисомиями и нормальным контролем.
| . | Тернер ( n = 3) . | Управление ( n = 6) . | Трисомия 21 ( n = 7) . | Трисомия 18 ( n = 2) . | Трисомия 13 ( n = 2) . |
|---|---|---|---|---|---|
| vessels | Chain of large diameter vessels at dermis/subcutis junction | Normal capillary pattern for gestation | No morphological abnormality | No morphological abnormality | Fewer capillaries subepidermally |
| FLT4 (VEGFR3) | − | + | + | + | +/− |
| PTN 63 | − | + | + | + | + |
| LYVE1 | − | + | nk | nk | nk |
| PROX1 | − | + | nk | nk | nk |
| KDR (VEGFR2) | + | + | + | + | + |
| CD 31 | ++ | ++ | nk | nk | nk |
| PDPN | − | + | ++ | nk | Nk |
| vWF | − | + | + | + | + |
| Laminin | ++ | ++ | ++ | ++ | ++ |
| Collagen type IV | ++ | ++ | ++ | ++ | ++ |
. | Тернер ( n = 3) . | Управление ( n = 6) . | Трисомия 21 ( n = 7) . | Трисомия 18 ( n = 2) . | Трисомия 13 ( n = 2) . |
|---|---|---|---|---|---|
| суда | Chain of large diameter vessels at dermis/subcutis junction | Normal capillary pattern for gestation | No morphological abnormality | No morphological abnormality | Fewer capillaries subepidermally |
| FLT4 (VEGFR3) | − | + | + | + | +/− |
| ПТН 63 | − | + | + | + 7 | 1 6 |
| LYVE1 | − | + | nk | nk | nk |
| PROX1 | − | + | nk | nk | nk |
| KDR (VEGFR2) | + | + | + | + | + |
| CD 31 | ++ | ++ | nk | nk | nk |
| PDPN | − | + | ++ | nk | Nk |
| vWF | − | + | + | + | + |
| Laminin | ++ | ++ | ++ | ++ | ++ |
| Collagen type IV | ++ | ++ | ++ | ++ | ++ |
Antibodies against FLT4, PTN63, LYVE1 , PROX1 и PDPN являются лимфатическими эндотелиальными маркерами; KDR и CD31 использовали для окрашивания как кровеносных, так и лимфатических сосудов; vWf использовался для окрашивания как кровеносных, так и лимфатических сосудов с активностью свертывания крови, а ламинин и коллаген IV типа окрашивали базальные мембраны сосудов. Эпидермис не был частью этого исследования, но базальная мембрана эпидермиса была сильно окрашена с использованием ламинина и коллагена IV типа. Верхняя часть подкожной клетчатки не содержала большого количества сосудов и поэтому также не учитывалась в этой таблице. Каждый слайд был изучен двумя независимыми исследователями, и интенсивность иммунофлуоресцентного окрашивания была широко классифицирована с использованием четырех категорий: — отсутствует; +/-, плохое окрашивание; +, умеренное окрашивание; ++, сильное окрашивание; НК, неизвестно.
Эпидермис не был частью этого исследования, но базальная мембрана эпидермиса была сильно окрашена с использованием ламинина и коллагена IV типа. Верхняя часть подкожной клетчатки не содержала большого количества сосудов и поэтому также не учитывалась в этой таблице. Каждый слайд был изучен двумя независимыми исследователями, и интенсивность иммунофлуоресцентного окрашивания была широко классифицирована с использованием четырех категорий: — отсутствует; +/-, плохое окрашивание; +, умеренное окрашивание; ++, сильное окрашивание; НК, неизвестно.
Открыть в новой вкладке
Рисунок 1
Открыть в новой вкладкеСкачать слайд
Иммуногистохимия кожи затылка плода с синдромом Тернера в 11 +0 нед с использованием антител против коллагена IV типа ( a ), ламинина ( b ), KDR ( c ), vWF ( d ), PTN63 (5′-нуклеотидаза) ( e ) и FLT4 ( f ), полоса: 50 мкм. Обратите внимание на интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы с использованием как коллагена типа IV, так и антител к ламинину (а и б). Цепочка расширенных сосудов в месте соединения дермы и подкожного слоя окрашивается антителом KDR. Мелкие сосуды в верхних слоях дермы и в подкожной клетчатке также окрашиваются (в). Цепочка расширенных сосудов на границе дермы и подкожного слоя окрашивается с помощью vWF, в верхней части дермы имеются сосуды среднего размера (d). С помощью антитела PTN63 на границе между дермой и подкожным слоем имеется цепочка сосудов большого диаметра. Верхняя дерма без окрашенных сосудов (д). Аналогичные данные получены с использованием антитела FLT4 с цепочкой расширенных сосудов в месте соединения дермы и подкожного слоя и скудостью окрашенных сосудов в верхней части дермы, что указывает на лимфатическую гипоплазию (f). Специфические антитела изучают индивидуально и сравнивают с контролями (ep, эпидермис; de, дерма; sc, подкожный слой).
Обратите внимание на интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы с использованием как коллагена типа IV, так и антител к ламинину (а и б). Цепочка расширенных сосудов в месте соединения дермы и подкожного слоя окрашивается антителом KDR. Мелкие сосуды в верхних слоях дермы и в подкожной клетчатке также окрашиваются (в). Цепочка расширенных сосудов на границе дермы и подкожного слоя окрашивается с помощью vWF, в верхней части дермы имеются сосуды среднего размера (d). С помощью антитела PTN63 на границе между дермой и подкожным слоем имеется цепочка сосудов большого диаметра. Верхняя дерма без окрашенных сосудов (д). Аналогичные данные получены с использованием антитела FLT4 с цепочкой расширенных сосудов в месте соединения дермы и подкожного слоя и скудостью окрашенных сосудов в верхней части дермы, что указывает на лимфатическую гипоплазию (f). Специфические антитела изучают индивидуально и сравнивают с контролями (ep, эпидермис; de, дерма; sc, подкожный слой).
Рисунок 2
Открыть в новой вкладкеСкачать слайд
Окрашивание антител против KDR ( a ) и FLT4 ( b ) в коже воротникового пространства плода с синдромом Тернера в 11 +0 недель (NT 7,4 мм) и KDR ( c ) и FLT4 ( d ) у другого плода с синдромом Тернера в возрасте 14 +0 недель (NT 6,0 мм), полоса: 50 мкм. В коже затылка плода Тернера в возрасте 11 +0 недель цепочка расширенных сосудов в месте соединения дермы и подкожного слоя окрашивается антителами к KDR. Мелкие сосуды в верхних слоях дермы и подкожной клетчатке также окрашиваются (а). Цепочка расширенных сосудов в месте соединения дермы и подкожного слоя у плодов Тернера также окрашивается антителом FLT4. В дерме мало окрашенных сосудов, что указывает на лимфатическую гипоплазию в дерме (б). У плода с синдромом Тернера в возрасте 14:9 окрашиваются лимфатические и кровеносные сосуды среднего и крупного размера. 0181 +0 недели с использованием KDR (c). Опять же, при использовании антитела FLT4 наблюдается меньшее окрашивание средних и мелких сосудов, что указывает на гипоплазию лимфатических сосудов (d). Следовательно, иммуногистохимические данные и размер воротникового пространства у обоих плодов с синдромом Тернера схожи. Рис. 3 b ), трисомия 13 ( c ) и нормальный возрастной контроль ( d ) в возрасте 15–16 недель, полоса 50 мкм. В коже затылка трисомных плодов антитела KDR обнаруживают как крупные, так и мелкие сосуды в дерме и подкожном слое. Окрашиваются также кератиноциты развивающегося эпидермиса, преимущественно в поверхностных слоях. У плодов с трисомией окрашивание FLT4 визуализирует сосуды в дерме и подкожной клетчатке, при трисомии 13 сосудов меньше. контроль.
0181 +0 недели с использованием KDR (c). Опять же, при использовании антитела FLT4 наблюдается меньшее окрашивание средних и мелких сосудов, что указывает на гипоплазию лимфатических сосудов (d). Следовательно, иммуногистохимические данные и размер воротникового пространства у обоих плодов с синдромом Тернера схожи. Рис. 3 b ), трисомия 13 ( c ) и нормальный возрастной контроль ( d ) в возрасте 15–16 недель, полоса 50 мкм. В коже затылка трисомных плодов антитела KDR обнаруживают как крупные, так и мелкие сосуды в дерме и подкожном слое. Окрашиваются также кератиноциты развивающегося эпидермиса, преимущественно в поверхностных слоях. У плодов с трисомией окрашивание FLT4 визуализирует сосуды в дерме и подкожной клетчатке, при трисомии 13 сосудов меньше. контроль.
В коже затылка плодов с синдромом Тернера на границе между дермой и подкожным слоем была обнаружена цепочка сосудов большого диаметра, которые окрашивались положительно на PTN63. Верхняя дерма была лишена окрашенных сосудов (рис. 1e, таблица III). Эти результаты согласуются с ранними исследованиями антител PTN63 (von Kaisenberg et al. ., 1999a) и исследованиями антител к базальной мембране с использованием ламинина и коллагена типа IV (von Kaisenberg et al. ., 1998a, b).
Верхняя дерма была лишена окрашенных сосудов (рис. 1e, таблица III). Эти результаты согласуются с ранними исследованиями антител PTN63 (von Kaisenberg et al. ., 1999a) и исследованиями антител к базальной мембране с использованием ламинина и коллагена типа IV (von Kaisenberg et al. ., 1998a, b).
Антитела к лимфатическому маркеру PROX1 выявили сосуды малого диаметра по всей дерме и подкожному слою в коже затылка хромосомно нормальных плодов от 11 до 16 недель (рис. 4b). Напротив, специфическое окрашивание антителом PROX1 отсутствовало в коже воротникового пространства плодов Тернера (рис. 4а). Аналогичный результат был получен с использованием антитела LYVE1, которое окрашивало мелкие сосуды и, возможно, группы клеток в воротниковой дерме и подкожной клетчатке плодов с нормальными хромосомами (рис. 4d), но не окрашивало сосуды в коже воротникового пространства плодов Тернера (рис. 4c). . 9Рисунок 4 CD31 ( e и f ). Антитело PROX1 выявляет сосуды малого диаметра в дерме и подкожном слое кожи затылка хромосомно нормальных плодов в возрасте от 11 до 16 недель. Для сравнения, специфическое окрашивание антителом PROX11 отсутствует в коже шеи плодов Тернера. Антитело LYVE1 также окрашивает мелкие лимфатические капилляры и, возможно, группы клеток воротниковой дермы и подкожной клетчатки плодов с нормальными хромосомами, но не окрашивает кожу воротниковой зоны плодов Тернера. Антитело к CD31 четко окрашивает сосуды в дерме и подкожной клетчатке как у эуплоидных плодов, так и у плодов с синдромом Тернера того же гестационного возраста по сходной схеме.
Для сравнения, специфическое окрашивание антителом PROX11 отсутствует в коже шеи плодов Тернера. Антитело LYVE1 также окрашивает мелкие лимфатические капилляры и, возможно, группы клеток воротниковой дермы и подкожной клетчатки плодов с нормальными хромосомами, но не окрашивает кожу воротниковой зоны плодов Тернера. Антитело к CD31 четко окрашивает сосуды в дерме и подкожной клетчатке как у эуплоидных плодов, так и у плодов с синдромом Тернера того же гестационного возраста по сходной схеме.
Совместное окрашивание кровеносных и лимфатических сосудов
В коже затылка плодов Тернера антитела против KDR окрашивали цепочку расширенных сосудов в месте соединения дермы и подкожного слоя. Также были окрашены более мелкие сосуды в верхней дерме и подкожной клетчатке (рис. 1с и 2а). У плодов с трисомиями 21, 18 и 13 сосуды окрашивались по всей коже без заметных различий (рис. 3a–c, верхняя панель). Также не было значительных различий в окрашивании сосудов у двух плодов с синдромом Тернера на 11 и 14 неделе беременности с одинаковой прозрачностью воротникового пространства (рис. 2a и c). Распределение сосудов было типичным для синдрома Тернера, как было описано ранее (рис. 1с и 2а; фон Кайзенберг 9).0089 и др. ., 1999а). В коже затылка хромосомно нормальных плодов антитела к KDR обнаруживали как крупные, так и мелкие сосуды в дерме и подкожной клетчатке (рис. 3d, верхняя панель). Кератиноциты развивающегося эпидермиса у нормальных и хромосомно аномальных плодов также окрашивались, преимущественно в поверхностных слоях (рис. 3d, верхняя панель).
2a и c). Распределение сосудов было типичным для синдрома Тернера, как было описано ранее (рис. 1с и 2а; фон Кайзенберг 9).0089 и др. ., 1999а). В коже затылка хромосомно нормальных плодов антитела к KDR обнаруживали как крупные, так и мелкие сосуды в дерме и подкожной клетчатке (рис. 3d, верхняя панель). Кератиноциты развивающегося эпидермиса у нормальных и хромосомно аномальных плодов также окрашивались, преимущественно в поверхностных слоях (рис. 3d, верхняя панель).
Антитело к CD31, обнаруживающее оба типа сосудов, четко окрашивает сосуды в дерме и подкожной клетчатке как эуплоидных плодов, так и плодов с синдромом Тернера по аналогичной схеме (рис. 4e и f, таблица III). Затем мы хотели дополнительно подтвердить наши предыдущие результаты с помощью двойного иммунофлуоресцентного окрашивания маркера кровеносных сосудов вместе с маркером лимфатических сосудов. Поэтому мы выбрали слайды из одного контроля, одного плода с синдромом Тернера и одного плода с трисомией 21 соответственно и провели иммуноокрашивание CD31 в качестве маркера кровеносных сосудов вместе с PDPN в качестве панлимфатического сосудистого маркера. Этот анализ выявил PDPN в базальных клетках эпидермиса и в лимфатических сосудах (рис. 5, зеленый), тогда как CD31 в основном был обнаружен в кровеносных сосудах (рис. 5, красный). В соответствии с нашими результатами, описанными выше, ткань плода Тернера демонстрировала некоторое окрашивание CD31, но окрашивание PDPN для лимфатических сосудов отсутствовало.
Этот анализ выявил PDPN в базальных клетках эпидермиса и в лимфатических сосудах (рис. 5, зеленый), тогда как CD31 в основном был обнаружен в кровеносных сосудах (рис. 5, красный). В соответствии с нашими результатами, описанными выше, ткань плода Тернера демонстрировала некоторое окрашивание CD31, но окрашивание PDPN для лимфатических сосудов отсутствовало.
Рисунок 5
Открыть в новой вкладкеСкачать слайд
Двойное иммунофлуоресцентное окрашивание срезов тканей, полученных от одного контрольного плода в возрасте 13 лет +6 недель ( a и c ), одного плода с синдромом Тернера в возрасте 11 лет 60181 недели ( d ) и одна трисомия 21 плода в 12 +6 недель ( b ) против CD31 в качестве маркера кровеносных сосудов вместе с подопланином в качестве панлимфатического сосудистого маркера. Иммунореактивность подопланина обнаруживается в базальных клетках эпидермиса и в лимфатических сосудах (зеленый цвет), тогда как CD31 в основном обнаруживается в кровеносных сосудах (красный цвет). Ткань плода Тернера демонстрирует некоторое окрашивание CD31, но не окрашивает подопланин для лимфатических сосудов. Верхняя панель 10-кратное увеличение, нижняя панель 20-кратное увеличение.
Ткань плода Тернера демонстрирует некоторое окрашивание CD31, но не окрашивает подопланин для лимфатических сосудов. Верхняя панель 10-кратное увеличение, нижняя панель 20-кратное увеличение.
Свертывающая активность сосудов
Антитела против vWF окрашивали цепочку расширенных сосудов на границе дермы и подкожного слоя у плодов с синдромом Тернера и визуализировали сосуды среднего размера в верхней части дермы (рис. 1d). У трисомных плодов окрашивание было обнаружено в эпидермисе, а сосуды были обнаружены в дерме и подкожной клетчатке (рис. 3a–c, нижняя панель). Контрольные эксперименты после предварительной обработки ацетоном не показали различий в фоновом окрашивании. Антитело против Виллебранда окрашивало сосуды большого и малого диаметра в дерме и подкожном слое кожи воротникового пространства хромосомно нормальных плодов в возрасте от 11 до 16 недель (рис. 3d, нижняя панель).
Базальные мембраны и крупные сосуды
Антитела к ламинину окрашивали все базальные мембраны у эуплоидов, плодов с трисомиями и синдромом Тернера (рис. 1b), особенно эпидермальную базальную мембрану и базальные мембраны всех крупных сосудов, кровеносных капилляров и кожи придатки. Ламинин также был обнаружен в дермальных фибробластах плодов с трисомией 18 (не показано). При синдроме Тернера отмечалось интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы (таблица III).
1b), особенно эпидермальную базальную мембрану и базальные мембраны всех крупных сосудов, кровеносных капилляров и кожи придатки. Ламинин также был обнаружен в дермальных фибробластах плодов с трисомией 18 (не показано). При синдроме Тернера отмечалось интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы (таблица III).
Иммуноокрашивание антителами к коллагену IV типа визуализировало все базальные мембраны у нормальных хромосом, плодов с трисомией и синдромом Тернера, в частности базальную мембрану эпидермиса и базальные мембраны собирательных сосудов, кровеносных капилляров и придатков кожи. Кожная соединительная ткань практически не окрашивалась, за исключением случайной маркировки дермальных фибробластов, которая была наиболее заметной при трисомии 13 (не показано). При синдроме Тернера наблюдалось интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы (таблица III, рис. 1а).
Развитие сосудов по мере увеличения срока беременности
Развитие сосудов по мере увеличения срока беременности от 11 до 19 недель исследовали с использованием антител против KDR (рис. 6, верхняя панель), FLT4 (рис. 6, средняя панель), vWF (рис. 6, нижняя панель), коллаген типа IV (рис. 7, верхняя панель), ламинин (рис. 7, средняя панель) и PTN63 (рис. 7, нижняя панель) на срезах нормальной ткани плода. Никаких существенных изменений во время беременности не наблюдалось ни для одного из используемых антител, что еще раз подтверждает мнение о том, что наши результаты, наблюдаемые в патологической ситуации, не могут быть отнесены к изменениям в зависимости от гестационного возраста.
6, верхняя панель), FLT4 (рис. 6, средняя панель), vWF (рис. 6, нижняя панель), коллаген типа IV (рис. 7, верхняя панель), ламинин (рис. 7, средняя панель) и PTN63 (рис. 7, нижняя панель) на срезах нормальной ткани плода. Никаких существенных изменений во время беременности не наблюдалось ни для одного из используемых антител, что еще раз подтверждает мнение о том, что наши результаты, наблюдаемые в патологической ситуации, не могут быть отнесены к изменениям в зависимости от гестационного возраста.
Рисунок 6
Открыть в новой вкладкеСкачать слайд
Иммуноокрашивание KDR (верхняя панель), FLT4 (средняя панель) или vWF (нижняя панель) в коже воротникового пространства нормальных плодов при увеличении срока беременности в 11 лет +1 ( a ), 12 +2 ( b ), 13 +5 ( c ), 15 +2 ( d ), 17 +6 ( e ) and 19 + 1 ( f ), Пруток: 50 мкм. В коже шеи нормального плода все три антитела выявляют сосуды как большого, так и малого диаметра в дерме и подкожной клетчатке. Существенных изменений во время беременности нет.
В коже шеи нормального плода все три антитела выявляют сосуды как большого, так и малого диаметра в дерме и подкожной клетчатке. Существенных изменений во время беременности нет.
Figure 7
Open in new tabDownload slide
Normal control fetuses at 11 +1 ( a ), 12 +2 ( b ), 13 +5 ( c ), 15 +2 ( d ), 17 +6 ( e ) и 19 +1 ( f ) недель беременности, окрашенные на коллаген типа IV (верхняя панель), ламинин (средняя панель) и PTN63 (нижняя панель) соответственно. Существенных изменений во время беременности нет. са, придатки кожи, стрелки: мелкие и средние сосуды.
Обсуждение
Цель этого исследования состояла в том, чтобы получить более полное представление о развитии и распределении кровеносных и лимфатических сосудов в коже воротникового пространства плодов с синдромом Тернера или трисомиями 21, 18 и 13, а также контрольных хромосомно нормальных животных, все между 11 и 20 недель, а также изучить потенциальные изменения развития с увеличением гестационного возраста.
Основными результатами этого исследования при синдроме Тернера являются цепочка расширенных сосудов в месте соединения дермы и подкожного слоя, обнаруженная с помощью антител FLT4, и небольшое количество окрашенных сосудов в дерме, что указывает на лимфатическую гипоплазию. Это контрастирует с хромосомно нормальной тканью плода, где сосуды большого и малого диаметра были более равномерно распределены в дерме и подкожном слое. При трисомиях сосуды также окрашивались в дерме и подкожной клетчатке, хотя при трисомии 13 сосудов было меньше. Дифференциальная экспрессия VEGFR3 (FLT4) может иметь важные последствия для передачи сигналов VEGF. VEGF играет важную роль в ангиогенезе и развитии сосудов во время эмбриогенеза посредством аутокринной и паракринной передачи сигналов (Aitkenhead 9).0089 и др. ., 1989; Shifren и др. ., 1994; Адамс и Алитало, 2007 г.; Карпанен и Алитало, 2008). Известно три рецептора VEGF: VEGFR1, VEGFR2 и VEGFR3, каждый из которых обладает специфической тирозинкиназной активностью (Joukov et al. , 1996). Однако экспрессия VEGFR3 жестко регулируется (Joukov et al. ., 1996; Partanen et al. ., 1999). Мы использовали моноклональные антитела против FLT4 (VEGFR3), домена тирозинкиназы в этом рецепторе, потому что во время развития он становится в основном ограниченным лимфатическим эндотелием, за исключением некоторых высокоэндотелиальных венул (Joukov 9).0089 и др. ., 1996). Ранее было показано, что FLT4 является маркером лимфатических сосудов, за исключением некоторых посткапиллярных венул с высоким эндотелием, которые расположены в лимфатических узлах тканей взрослого человека и могут также играть роль во время развития (Joukov et al. ., 1996). При развитии мыши антитело FLT4 сначала выявляет тирозинкиназный рецептор VEGFR3 в ангиобластах мезенхимы головы, кардинальной вены и аллантоиса (8,5 дней п.к.; Kaipainen et al. ., 19).95). На 12,5 день п.к. может быть обнаружен развивающийся венозный и предполагаемый лимфатический эндотелий, при этом артериальный эндотелий является отрицательным (Kaipainen et al.
, 1996). Однако экспрессия VEGFR3 жестко регулируется (Joukov et al. ., 1996; Partanen et al. ., 1999). Мы использовали моноклональные антитела против FLT4 (VEGFR3), домена тирозинкиназы в этом рецепторе, потому что во время развития он становится в основном ограниченным лимфатическим эндотелием, за исключением некоторых высокоэндотелиальных венул (Joukov 9).0089 и др. ., 1996). Ранее было показано, что FLT4 является маркером лимфатических сосудов, за исключением некоторых посткапиллярных венул с высоким эндотелием, которые расположены в лимфатических узлах тканей взрослого человека и могут также играть роль во время развития (Joukov et al. ., 1996). При развитии мыши антитело FLT4 сначала выявляет тирозинкиназный рецептор VEGFR3 в ангиобластах мезенхимы головы, кардинальной вены и аллантоиса (8,5 дней п.к.; Kaipainen et al. ., 19).95). На 12,5 день п.к. может быть обнаружен развивающийся венозный и предполагаемый лимфатический эндотелий, при этом артериальный эндотелий является отрицательным (Kaipainen et al. ., 1995). Позже FLT4 ограничивается сосудистыми сплетениями, лишенными окрашенных клеток, представляющих развивающиеся лимфатические сосуды (Kaipainen et al. ., 1995). У взрослых только лимфатический эндотелий и некоторые высокоэндотелиальные венулы экспрессируют мРНК FLT4 (Kaipainen et al. ., 1995).
., 1995). Позже FLT4 ограничивается сосудистыми сплетениями, лишенными окрашенных клеток, представляющих развивающиеся лимфатические сосуды (Kaipainen et al. ., 1995). У взрослых только лимфатический эндотелий и некоторые высокоэндотелиальные венулы экспрессируют мРНК FLT4 (Kaipainen et al. ., 1995).
Важность гена рецептора-3 фактора роста эндотелия сосудов ( VEGFR3 , FLT4 ) для развития лимфатических сосудов также было четко подтверждено его идентификацией как гена, ответственного за наследственный лимфатический отек типа I (болезнь Нонна-Милроя), аутосомно-доминантное состояние, характеризующееся недостаточным лимфодренажем из-за гипопластического/апластического лимфатические сосуды. У ребенка больного отца на 13-й неделе жизни было повышено просветление воротниковой зоны. Хотя отек кожи прошел в 20 недель, лимфедема нижних конечностей развилась после рождения (Соука 9 лет).0089 и др. ., 2002). Инактивирующая мутация в этом гене изменяет белок-рецептор и вызывает недостаточность передачи сигнала VEGFR3 (Irthum et al. ., 2000; Karkkainen et al. ., 2000). С тех пор были зарегистрированы другие случаи тяжелых мутаций VEGFR3 у пациентов с болезнью Милроя (Connell et al , 2009), а рецессивный тип наследования был приписан гипоморфным мутациям VEGFR3 (Ghalamkarpour et al . , 2009 г.а). Совсем недавно сообщалось о мутациях VEGFR3 , а также мутаций FOXC2 в подгруппе спорадических пациентов с диагнозом отек плода (Ghalamkarpour et al ., 2009b).
., 2000; Karkkainen et al. ., 2000). С тех пор были зарегистрированы другие случаи тяжелых мутаций VEGFR3 у пациентов с болезнью Милроя (Connell et al , 2009), а рецессивный тип наследования был приписан гипоморфным мутациям VEGFR3 (Ghalamkarpour et al . , 2009 г.а). Совсем недавно сообщалось о мутациях VEGFR3 , а также мутаций FOXC2 в подгруппе спорадических пациентов с диагнозом отек плода (Ghalamkarpour et al ., 2009b).
Еще одно антитело, направленное против LYVE1, связывающего гиалуронан белка, который расщепляет гиалуронан в лимфатических сосудах и отсутствует в кровеносных сосудах (Banerji et al ., 1999), показал небольшое окрашивание в дерме плодов Тернера. Это заслуживает внимания в связи с предыдущим исследованием гиалуроновой кислоты в коже плодов с анеуплоидиями, в котором не было обнаружено повышенного количества гиалуроновой кислоты у плодов Тернера (Böhlandt 9).0089 и др. ., 2000). Похоже, что большая часть деградации гиалуроновой кислоты не происходит внутри самой кожи; гиалуронан скорее транспортируется через лимфатическую систему в отдаленные лимфатические узлы, где >90% гликозаминогликанов в афферентной лимфе разрушается или повторно поступает в кровоток для быстрого эндоцитоза эндотелиальными рецепторами гиалуронана печени (Fraser et al. ., 1988; Фрейзер и Лоран, 1989). Если бы LYVE1 было мало, деградация гиалуроновой кислоты могла бы быть уменьшена, и можно было бы ожидать накопления гиалуроновой кислоты. Однако содержание гиалуронана было увеличено (Böhlandt et al ., 2000), и окрашивание LYVE1 было нормальным при трисомии 21 в настоящем исследовании, что указывает на то, что регуляция гиалуроновой кислоты может быть не просто результатом LYVE1-опосредованной деградации.
., 2000). Похоже, что большая часть деградации гиалуроновой кислоты не происходит внутри самой кожи; гиалуронан скорее транспортируется через лимфатическую систему в отдаленные лимфатические узлы, где >90% гликозаминогликанов в афферентной лимфе разрушается или повторно поступает в кровоток для быстрого эндоцитоза эндотелиальными рецепторами гиалуронана печени (Fraser et al. ., 1988; Фрейзер и Лоран, 1989). Если бы LYVE1 было мало, деградация гиалуроновой кислоты могла бы быть уменьшена, и можно было бы ожидать накопления гиалуроновой кислоты. Однако содержание гиалуронана было увеличено (Böhlandt et al ., 2000), и окрашивание LYVE1 было нормальным при трисомии 21 в настоящем исследовании, что указывает на то, что регуляция гиалуроновой кислоты может быть не просто результатом LYVE1-опосредованной деградации.
Ген гомеобокса PROX1 кодирует специфический маркер субпопуляции эндотелиальных клеток, которые путем почкования и прорастания дают начало мышиной лимфатической системе (Zinovieva et al . , 1996; Wigle and Oliver, 1999). При остановке развития лимфатических сосудов в 9У мышей с нокаутом 0089 Prox1 на ст. E14.5 у большинства гетерозиготных и у всех гомозиготных эмбрионов Prox1 развился тяжелый отек кожи, сходный с наблюдаемым у плодов Turner (Wigle and Oliver, 1999). В нашем исследовании антитела к лимфатическому маркеру PROX1 выявили сосуды малого диаметра на всем протяжении дермы и подкожной клетчатки в коже воротникового пространства у эуплоидных плодов от 11 до 16 недель. Для сравнения, специфическое окрашивание антителом PROX1 отсутствовало в коже шеи плодов Тернера. Хотя были предложены различные теории относительно происхождения лимфатической системы, наиболее широко принята теория Сэбина (19).09), предполагая венозное происхождение лимфатических сосудов. Венозные эндотелиальные клетки дают начало лимфатическим мешочкам путем локального разрастания. Такие лимфатические мешочки могут затем расти и прорастать дальше, образуя лимфатические сосуды всех органов (Sabin, 1909).
, 1996; Wigle and Oliver, 1999). При остановке развития лимфатических сосудов в 9У мышей с нокаутом 0089 Prox1 на ст. E14.5 у большинства гетерозиготных и у всех гомозиготных эмбрионов Prox1 развился тяжелый отек кожи, сходный с наблюдаемым у плодов Turner (Wigle and Oliver, 1999). В нашем исследовании антитела к лимфатическому маркеру PROX1 выявили сосуды малого диаметра на всем протяжении дермы и подкожной клетчатки в коже воротникового пространства у эуплоидных плодов от 11 до 16 недель. Для сравнения, специфическое окрашивание антителом PROX1 отсутствовало в коже шеи плодов Тернера. Хотя были предложены различные теории относительно происхождения лимфатической системы, наиболее широко принята теория Сэбина (19).09), предполагая венозное происхождение лимфатических сосудов. Венозные эндотелиальные клетки дают начало лимфатическим мешочкам путем локального разрастания. Такие лимфатические мешочки могут затем расти и прорастать дальше, образуя лимфатические сосуды всех органов (Sabin, 1909). Развитие лимфатических сосудов из мезенхимальных клеток рядом с кровеносными сосудами предполагали и другие (Кампмейер, 1912). Предполагалось также венозное происхождение лимфатических мешков, но также предполагалось мезенхимальное происхождение других лимфатических сосудов (Huntington, 1908). Однако эксперименты по прививке перепелам и цыплятам показали, что лимфатические мешки не являются единственным источником лимфатических сосудов (Увядание 9).0089 и др. ., 2000; Papoutsi и др. ., 2001). Исследования на куриных эмбрионах и плодах человека с использованием PROX1 показали, что PROX1 экспрессируется в ограниченных эктодермальных, мезодермальных и энтодермальных компартментах, а также в некоторых рассеянных мезодермальных клетках ранних эмбрионов, подтверждая предыдущие наблюдения лимфангиобластов в параксиальной и внутренностной мезодерме (Rodriguez- Niedenfuhr и др. ., 2001).
Развитие лимфатических сосудов из мезенхимальных клеток рядом с кровеносными сосудами предполагали и другие (Кампмейер, 1912). Предполагалось также венозное происхождение лимфатических мешков, но также предполагалось мезенхимальное происхождение других лимфатических сосудов (Huntington, 1908). Однако эксперименты по прививке перепелам и цыплятам показали, что лимфатические мешки не являются единственным источником лимфатических сосудов (Увядание 9).0089 и др. ., 2000; Papoutsi и др. ., 2001). Исследования на куриных эмбрионах и плодах человека с использованием PROX1 показали, что PROX1 экспрессируется в ограниченных эктодермальных, мезодермальных и энтодермальных компартментах, а также в некоторых рассеянных мезодермальных клетках ранних эмбрионов, подтверждая предыдущие наблюдения лимфангиобластов в параксиальной и внутренностной мезодерме (Rodriguez- Niedenfuhr и др. ., 2001).
Дополнительное окрашивание лимфатических сосудов с использованием FLT4, PROX1 и LYVE1 в настоящем исследовании подтверждает и расширяет наш предыдущий отчет о гипоплазии лимфатических сосудов в коже плодов Тернера (фон Кайзенберг и др. ., 1999а). Обнаружение лимфатической гипоплазии в коже пациенток с синдромом Тернера также согласуется с исследованиями женщин с дисгенезией яичников вследствие моносомии X. Лимфангиография показала гипоплазию поверхностных лимфатических сосудов нижних конечностей, таза и забрюшинного пространства (Vittay и др. ., 1980). Хотя гипоплазия лимфатических сосудов может быть четко продемонстрирована, остается неясным, почему лимфатические сосуды недостаточно развиваются у плодов с синдромом Тернера. Гаплонедостаточность регуляторного гена, кодируемого Х-хромосомой, может играть еще недооцененную роль в лимфатической гипоплазии.
., 1999а). Обнаружение лимфатической гипоплазии в коже пациенток с синдромом Тернера также согласуется с исследованиями женщин с дисгенезией яичников вследствие моносомии X. Лимфангиография показала гипоплазию поверхностных лимфатических сосудов нижних конечностей, таза и забрюшинного пространства (Vittay и др. ., 1980). Хотя гипоплазия лимфатических сосудов может быть четко продемонстрирована, остается неясным, почему лимфатические сосуды недостаточно развиваются у плодов с синдромом Тернера. Гаплонедостаточность регуляторного гена, кодируемого Х-хромосомой, может играть еще недооцененную роль в лимфатической гипоплазии.
Было проведено несколько дополнительных экспериментов, которые подтвердили вышеописанные результаты. В коже затылка плодов Тернера как KDR, так и антитело к CD31 окрашивали цепочку расширенных сосудов в месте соединения дермы и подкожного слоя, но также окрашивались более мелкие сосуды в верхней дерме и подкожном слое, и обе иммунореактивности были равномерно распределены в кровеносных сосудах. и лимфатические сосуды эуплоидов и плодов с трисомиями. Эти результаты помогли отличить лимфоспецифические антитела от тех, которые также окрашивают кровеносные сосуды, и результаты подтверждают лимфоспецифический характер FLT4, PTN64, LYVE1 и PROX1. У плодов с синдромом Тернера также окрашивалась цепочка расширенных сосудов в месте соединения дермы и подкожного слоя и имелись сосуды среднего размера в верхней части дермы с использованием антител против vWF. Результаты показывают, что кровеносные сосуды в верхних слоях дермы плодов с синдромом Тернера были окрашены так же, как и в трисомиях и контроле. Опять же, это помогает подтвердить лимфоспецифический характер FLT4, PTN63, LYVE1 и PROX1 и значимость результатов, полученных с этими маркерами. И ламинин, и антитело к коллагену IV типа окрашивали все базальные мембраны. При синдроме Тернера наблюдается интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы. У эуплоидных плодов с трисомиями и синдромом Тернера окрашивались, в частности, эпидермальная базальная мембрана и базальные мембраны всех крупных сосудов, кровеносных капилляров и придатков кожи (таблица III).
и лимфатические сосуды эуплоидов и плодов с трисомиями. Эти результаты помогли отличить лимфоспецифические антитела от тех, которые также окрашивают кровеносные сосуды, и результаты подтверждают лимфоспецифический характер FLT4, PTN64, LYVE1 и PROX1. У плодов с синдромом Тернера также окрашивалась цепочка расширенных сосудов в месте соединения дермы и подкожного слоя и имелись сосуды среднего размера в верхней части дермы с использованием антител против vWF. Результаты показывают, что кровеносные сосуды в верхних слоях дермы плодов с синдромом Тернера были окрашены так же, как и в трисомиях и контроле. Опять же, это помогает подтвердить лимфоспецифический характер FLT4, PTN63, LYVE1 и PROX1 и значимость результатов, полученных с этими маркерами. И ламинин, и антитело к коллагену IV типа окрашивали все базальные мембраны. При синдроме Тернера наблюдается интенсивное окрашивание мелких и средних сосудов в верхних слоях дермы. У эуплоидных плодов с трисомиями и синдромом Тернера окрашивались, в частности, эпидермальная базальная мембрана и базальные мембраны всех крупных сосудов, кровеносных капилляров и придатков кожи (таблица III). Это помогло различить мелкие, средние и крупные сосуды.
Это помогло различить мелкие, средние и крупные сосуды.
При нормальном развитии лимфатической системы плода существует фаза, во время которой лимфатические мешки плохо связаны с венозной системой (Sabin, 1909; Huntington, 1914). При задержке связи, распространяющейся на конец первого триместра, лимфатические мешки не могут эффективно дренироваться и в них скапливается лимфатическая жидкость. Если связи вообще не происходит, лимфатические мешочки могут увеличиваться с образованием кистозных структур, как при кистозной гигроме (Castelli et al ., 2003; Gittenberger-de Groot 9).0089 и др. ., 2004; Хаак и др. ., 2002; Bekker и др. ., 2006a, b, 2008). Хотя предыдущие иммуногистохимические исследования описывали аномалии выстилки полостей яремных лимфатических мешков (Bekker et al. ., 2008), в нашем исследовании использовались специфические маркеры для изучения распределения лимфатических капилляров у плодов первого триместра с анеуплоидиями.
Мы сообщаем, что рецепторы для факторов роста эндотелия сосудов (FLT4) менее распространены в лимфатических сосудах кожи плодов Тернера, что указывает на дефицит лимфатических капилляров. Параллельно с этим гиалуронан-связывающий белок, участвующий в деградации гиалуронана в лимфатических сосудах (LYVE1), отсутствует в кровеносных сосудах и малочислен в дерме плодов Тернера, а гомеобоксный белок, который у мышей с нокаутом, по-видимому, ответственен за фенотип, сходный с Синдром Тернера (PROX1) также меньше окрашивается в коже плодов с синдромом Тернера. Эти результаты подтверждают очень ранние наблюдения с использованием антител против 5′-нуклеотидазы лимфатического эндотелия (PTN63) (von Kaisenberg и др. ., 1999а). Однако у плодов с нормальными хромосомами и у плодов с трисомиями наблюдается равномерное распределение лимфатических сосудов, окрашенных этими антителами. Недавнее исследование с использованием экспрессии sonic hedgehog (Shh) и транскрипционного фактора forkhead FOXC2 в коже плодов с трисомией 21 в первом триместре показало потерю лимфатической идентичности у плодов с трисомией 21 и сдвиг в сторону фенотипа стенки кровеносного сосуда (de Mooij et al. ., 2009).
., 2009).
Общий патофизиологический путь для всех хромосомных аномалий, объясняющий преходящий характер и гестацию появления повышенной прозрачности воротникового пространства в конце первого триместра, еще не выявлен. В качестве одного из механизмов было предложено сужение перешейка аорты, которое обычно встречается при всех трисомиях и наиболее заметно при синдроме Тернера, где увеличение просвета воротникового пространства является самым высоким (Hyett 9).0089 и др. ., 1995а, б, 1997). Возможно, небольшое увеличение диаметра перешейка аорты существенно снижает сосудистое сопротивление (уравнение Хагена-Пуасселья), что приводит к спонтанному разрешению отека (von Kaisenberg et al ., 1999b).
В целом, наши результаты убедительно свидетельствуют о том, что при синдроме Тернера гипоплазия лимфатических сосудов может быть причиной клинически видимой кистозной гигромы воротникового пространства. Онтогенетический базис повышенной прозрачности воротникового пространства у трисомных плодов, по-видимому, отличается от синдрома Тернера (von Kaisenberg 9). 0089 и др. ., 1998а, б, 1999а, б).
0089 и др. ., 1998а, б, 1999а, б).
Авторские роли
C.S.K. и Б.Б.-С. были главными исследователями, J.W. провели обширную лабораторную работу, Т.Д., К.Х.Н. и П.Х. сделал критическую переработку рукописи, а И.М.-Х. внес существенный вклад в эту работу.
Финансирование
Эта работа была поддержана грантом Deutsche Forschungsgemeinschaft [Ka1136/1-1] и Фондом медицины плода.
Благодарности
Авторы благодарят проф. Х.-Г. Mannherz за предоставление антитела PTN63, Dr H.A. Weich за предоставление антитела к KDR, Ellen Gimbel за прекрасную техническую помощь и Christa Micucci за помощь в фотографировании.
References
Abtahian
F
,
Bezman
N
,
Clemens
R
,
Sebzda
E
,
Cheng
L
,
Shattil
SJ
,
Кан
ML
,
Корецки
GA
.
Доказательства потребности доменов ITAM, но не взаимодействия SLP-76/Gads для передачи сигналов интегрина в гемопоэтических клетках
,
Mol Cell Biol
,
2006
, vol.
26
(pg.
6936
—
6949
)
10.1128/MCB.01040-06
Abtahian
F
,
Guerriero
A
,
Sebzda
E
,
,
,
Моксай
A
,
Майерс
EE
,
Huang
B
,
Jackson
DG
,
Ferrari
VA
, et al.
Регуляция разделения крови и лимфатических сосудов с помощью сигнальных белков SLP-76 и Syk
299
(стр.
247
—
251
)
10.1126/наука.1079477
Адамс
RH
,
Alitalo
K
.
Молекулярная регуляция ангиогенеза и лимфангиогенеза
8
(pg.
464
—
478
)
10.1038/nrm2183
Aitkenhead
M
,
Christ
B
,
Eichmann
A
,
Feucht
M
,
Wilson
DJ
,
Wilting
J
.
Паракринная и аутокринная регуляция фактора роста эндотелия сосудов при тканевой дифференцировке у перепела
212
(стр.
1
—
13
)
10.1002/(SICI) 1097-0177 (199805) 212: 1 <1 :: AID-AJA1> 3,0.CO; 2-L
BALUK
P
,
McDonald
Немецкая немецкая марка
.
Маркеры для микроскопической визуализации лимфангиогенеза и ангиогенеза
1131
(стр.
1
—
12
)
10.1196/annals.1413.001
Banerji
S
,
,
Wang
SX
,
Clasper
S
,
,
Tammi
R
,
Джонс
М
,
Джексон
ДГ
.
LYVE 1, новый гомолог гликопротеина CD44, является лимфоспецифическим рецептором гиалуроновой кислоты
,
J Cell Biol
,
1999
, том.
144
(pg.
789
—
801
)
10.1083/jcb.144.4.789
Bekker
MN
,
Twisk
JW
,
Bartelings
MM
,
Gittenberger-de Groot
AC
,
van Vugt
JM
.
Временная связь между повышенной прозрачностью воротникового пространства и увеличением яремного лимфатического мешка
108
(pg.
846
—
853
)
10.1097/01.AOG.0000238340.64966.81
Bekker
MN
,
van den Akker
NM
,
Бартелингс
ММ
,
Arkesteijn
JB
,
Fischer
SG
,
Polman
JA
,
Haak
MC
,
,
Poelmann
RE
,
Ван Вугт
JM
, и др.
Отек затылка и нарушение венозно-лимфатического фенотипа у плодов человека и эмбрионов мышей с анеуплоидией
,
J Soc Gynecol Investig
,
2006
, том.
13
(pg.
209
—
216
)
10.1016/j.jsgi.2006.02.003
Bekker
MN
,
van den Akker
NM
,
de Mooij
YM
,
Bartelings
MM
,
фургон Vugt
2 JM
0004 ,Гиттенбергер-де Гроот
AC
.
Яремная лимфатическая недостаточность при синдроме Тернера и трисомии 21: различные аномалии, приводящие к отеку шеи
15
(стр.
295
—
304
)
10.1177/1
14062Böhlandt
S
,
Von KAHLAGIST,
,
,
Von Kahlandt
S
,
Von Kahlandt
S
,
Von Kahlandt
S
,
Von Kahlandt
S
,
. 0003
0003
CS
,
Wewetzer
C
,
Христос
B
,
Nicolaides
KH
,
Brand-Saberi
B
.
Гиалуроновая кислота в коже затылка у плодов с хромосомными аномалиями
15
(стр.
1155
—
1158
)
10.1093/humrep/15.5.1155
Castelli
E
,
Todros
T
,
Mattutino
G
,
Torre
C
,
Панаттони
Г
.
Исследование просвета воротникового пространства с помощью светового и сканирующего электронного микроскопов у нормального плода0002 2003
, том.
21
(pg.
514
—
520
)
10.1002/uog.95
Chitayat
D
,
Kalousek
DK
,
Bamforth
JS
.
Лимфатические аномалии у плодов с задней кистозной гигромой шейки матки
33
(pg.
352
—
356
)
10.1002/ajmg.1320330313
Connell
FC
,
Ostergaard
P
,
Carver
C
,
Brice
G
,
Williams
N
,
Mansour
S
,
Mortimer
PS
,
Mortimer
PS
,PS
,
PS
,
PS
,
PS
0004 ,Джеффри
S
.
Консорциум лимфедемы. Анализ кодирующих областей VEGFR3 и VEGFC при болезни Милроя и других первичных лимфатических отеках
124
(стр.
625
—
631
)
10.1007/S00439-008-0586-5
DE MOOIJ
YM
,
VAN DEN.0003
NM
,
Bekker
MN
,
Bartelings
MM
,
Wisse
LJ
,
van Vugt
JM
,
Gittenberger-de Groot
АС
.
Аномальная экспрессия Shh и FOXC2 коррелирует с аберрантным лимфатическим развитием у плодов человека с повышенной прозрачностью воротникового пространства
,
Prenat Diagn
,
2009
, том.
29
(pg.
840
—
846
)
10.1002/pd.2316
François
M
,
Caprini
A
,
Hosking
B
,
Орсениго
F
,
Вильгельм
D
,
Браун 3
,
003
Paavonen
K
,
Karnezis
T
,
Shayan
R
,
Downes
M
, et al.
Sox18 индуцирует развитие лимфатических сосудов у мышей
456
(стр.
643
—
647
)
10.1038/nature07391
Фрейзер
JR
,
Лоран
TC
.
Оборот и метаболизм гиалуроновой кислоты
143
(pg.
41
—
53
)
Fraser
JR
,
Kimpton
WG
,
Laurent
TC
,
Кэхилл
RN
,
Вакакис
N
.
Поглощение и расщепление гиалуроновой кислоты в лимфатической ткани
256
(стр.
153
—
158
)
GALE
NW
,
Prevo
R
,
Espinosaa
R
,
R
,
R
,
R
,
R
,
R
,
0003
J
,
Ferguson
DJ
,
Dominguez
MG
,
Yancopoulos
GD
,
Thurston
G
,
Jackson
DG
.
Нормальное развитие и функция лимфатической системы у мышей с недостаточностью лимфатического рецептора гиалуроновой кислоты LYVE-10003
, том.
27
(pg.
595
—
604
)
10.1128/MCB.01503-06
Ghalamkarpour
A
,
Holnthoner
W
,
Saharinen
P
,
BOON
LM
,
Mulliken
JB
,
Alitalo
K
,
Vikkul0003
М
.
Рецессивный первичный врожденный лимфатический отек, вызванный мутацией VEGFR3
46
(pg.
399
—
404
)
10.1136/jmg.2008.064469
Ghalamkarpour
A
,
Debauche
C
,
,
Ван Регемортер
N
,
Sznajer
Y
,
Thomas
D
,
Revencu
N
,
Gillerot
Y
,
Boon
LM
,
Виккула
М
.
Спорадический Внутриутробный Генерализованный отек, вызванный мутациями в лимфангиогенных генах VEGFR3 и FOXC2
,
J Педиатр
,
2009
, том.
155
(pg.
90
—
93
)
Gittenberger-de Groot
AC
,
van den Akker
NM
,
Bartelings
MM
,
,
фургон Vugt
JM
,
Хаак
MC
.
Аномальное развитие лимфы у эмбрионов мышей с трисомией 16 предшествует отеку воротникового пространства
,
Dev Dyn
,
2004
, vol.
230
(pg.
378
—
384
)
10. 1002/dvdy.20054
1002/dvdy.20054
Haak
MC
,
Bartelings
MM
,
Jackson
DG
,
,
van Vugt
JM
,
Gittenberger-de Groot
АС
.
Повышенная прозрачность шеи связана с растяжением яремных лимфатических узлов
17
(pg.
1086
—
1092
)
10.1093/humrep/17.4.1086
Hong
YK
,
Shin
JW
,
Detmar
М
.
Развитие лимфатической сосудистой системы: разгадка тайны
231
(стр.
462
—
473
)
10,1002/DVDY.20179
Хантингтон
GS
.
Генетическая интерпретация развития лимфатической системы млекопитающих
,
Anat Rec
,
1908
, том.
2
(стр.
19
—
46
)
10.1002/AR.10
3
Развитие яремного лимфатического мешка млекопитающих, примитивных локтевых лимфатических и грудных протоков с точки зрения недавних исследований лимфатического онтогенеза позвоночных вместе с рассмотрением генетических отношений лимфатических и гемальных сосудистых каналов у эмбрионов амниоты
,
Ам Ж Анат
,
1914
, том.
16
(pg.
259
—
317
)
10.1002/aja.1000160302
Hyett
JA
,
Moscoso
G
,
Nicolaides
КН
.
Морфометрический анализ крупных сосудов в раннем периоде внутриутробного развития
,
Hum Reprod
,
1995
, том.
10
(pg.
3045
—
3048
)
Hyett
JA
,
Moscoso
G
,
Nicolaides
KH
.
Увеличение воротникового пространства при трисомии 21 плода: в связи с сужением перешейка аорты0003
, том.
10
(pg.
3049
—
3051
)
Hyett
JA
,
Moscoso
G
,
Nicolaides
KH
.
Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре беременности
69
(стр.
207
—
216
)
10.1002/(SICI) 1096-8628 (19
7) 69: 2 <207 :: AID-AJMG18> 3.0.CO; 2-P:: AID-AJMG18> 3.0.CO; IRRSHUM
A
,
Karkkainen
M
,
Devriendt
K
,
Alitalo
K
,
Vikkula
M4444444444444444444444444444444444444444444444444444444444444444444444.
4444444444444444.
Врожденная наследственная лимфедема, вызванная мутацией, инактивирующей тирозинкиназу 9 VEGFR30003
,
Am J Hum Genet
,
2000
, том.
67
(pg.
295
—
301
)
10.1086/303019
Joukov
V
,
Pajusola
K
,
Kaipainen
A
,
Чилов
D
,
Лахтинен
I
,
,
Саксела
O
,
Калккинен
N
,
Alitalo
K3
.
Новый фактор роста эндотелия сосудов, VEGF-C, является лигандом для тирозинкиназ рецепторов Flt4 (VEGFR-3) и KDR (VEGFR-2) об.
15
(стр.
290
—
298
)
Kaipainen
A
,
Korhonen
J
,
Mustonen
T
,
Van Hinsbergh
VWM
,
Fang
GH
,
Dumont
D
,
Breitman
M
,
Alitalo
K
.
Экспрессия гена fms-подобной тирозинкиназы 4 становится ограниченной лимфатическим эндотелием во время развития
,
Proc Natl Acad Sci USA
,
1995
, vol.
92
(стр.
3566
—
3570
)
10,1073/PNAS.92.8.3566
Kampmeier
из
.
Значение инъекционного метода в изучении развития лимфатических сосудов
6
(pg.
223
—
233
)
10.1002/ar.10
602
Karkkainen
MJ
,
Ferrell
RE
,
Lawrence
EC
,
Kimak
MA
,
Levinson
KL
,
MC Tigue
MA
,
Alitalo
K
,
FINEGOL0003
ДН
.
Миссенс-мутации мешают передаче сигналов VEGFR-3 при первичной лимфедеме
25
(pg.
153
—
159
)
Karkkainen
MJ
,
Haiko
P
,
Sainio
K
,
Partanen
J
,
Taipale
J
,
Petrova
TV
,
Jeltsch
M
,
Jackson
DG
,
Talikka
M
,
Раувала
H
и др.
Фактор роста эндотелия сосудов С необходим для прорастания первых лимфатических сосудов из вен эмбриона
,
Нат Иммунол
,
2004
, том.
5
(стр.
74
—
80
)
10.1038/NI1013
Karpanen
T
,
.
Молекулярная биология и патология лимфангиогенеза
3
(стр.
367
—
397
)
10.1146/annurev.pathmechdis.3.121806.151515
,
Shimoda
H
,
,
Miura
M
.
Лимфангиогенез и экспрессия специфических молекул в качестве маркеров лимфатических эндотелиальных клеток
81
(стр.
71
—
83
)
10.1111/j.1447-073X.2006.00142.x
Mäkinen
T
,
Adams
RH
,
Bailey
J
,
,
Ziemiecki
A
,
Alitalo
K
,
Klein
R
,
Wilkinson
GA
.
Сайт взаимодействия PDZ в эфрине B2 необходим для ремоделирования лимфатических сосудов
,
Гены Дев
,
2005
, том.
19
(pg.
397
—
410
)
10.1101/gad.330105
Mukai
K
,
Rosai
J
,
Burgdorf
ВХ
.
Локализация антигена, родственного фактору VIII, в эндотелиальных клетках сосудов с помощью иммунопероксидазного метода
,
Am J Surg Pathol
,
1980
, vol.
4
(pg.
273
—
276
)
Nicolaides
KH
,
Brizot
ML
,
Snijders
RJM
.
Затылочная прозрачность плода: ультразвуковой скрининг трисомии плода в первом триместре беременности
,
Br J Obstet Gynaecol
,
1994
, том.
101
(pg.
782
—
786
)
Norrmén
C
,
Ivanov
KI
,
Cheng
J
,
Zangger
N
,
Delorenzi
M
,
Jaquet
M
,
Миура
N
,
Пуолаккайнен
P
,
Хорсли
V
, 3
, 3
, 3
.
FOXC2 контролирует формирование и созревание собирательных лимфатических сосудов посредством взаимодействия с NFATc1
185
(стр.
439
—
457
)
Пажусола
K
,
Aprelikova
O
,
Korhonen
J
,
Kaipainen
A
,
Pertovaara
L
,
Alitalo
R
,
Алитало
К
.
Тирозинкиназа рецептора FLT4 содержит семь иммуноглобулиноподобных петель и экспрессируется во многих тканях и клеточных линиях человека
,
Рак Рез
,
1992
, том.
52
(pg.
5738
—
5743
)
Papoutsi
M
,
Tomarev
SI
,
Eichmann
A
,
Pröls
F
,
Христос
B
,
Увядание
J
.
Эндогенное происхождение лимфатических сосудов в хориоаллантоисной мембране птиц
222
(pg.
238
—
251
)
10.1002/dvdy.1187
Partanen
TA
,
Makinen
T
,
Arola
Дж
,
,
Вейх
HA
,
Alitalo
K
.
Рецепторы эндотелиального фактора роста в сердце плода человека
100
(pg.
583
—
586
)
Petrova
TV
,
Karpanen
T
,
Norrmén
C
,
Mellor
R
,
Tamakoshi
T
,
Finegold
D
,
Ferrell
R
,
Kerjaschki
D
,
Mortimer
P
,
Юля-Херттуала
S
, и др.
Дефекты клапанов и аномальное рекрутирование пристеночных клеток лежат в основе недостаточности лимфатических сосудов при дистихиазе лимфедемы
,
Nature Med
,
2004
, том.
10
(стр.
974
—
981
)
Polkinghorne
2 J
32 . ,
Обзор руководства по использованию плодов и фетального материала в исследованиях.
,
1989
Лондон
Канцелярия Ее Величества
Родригес-Ниденфур
M
,
Papoutsi
M
,
Христос
B
,
Nicolaides
KH
,
Von Kaisenberg
9000V 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000v 9000V.
Увядание
J
.
Prox1 является маркером эктодермальных плакод, энтодермальных компартментов, лимфатического эндотелия и лимфангиобластов
,
Anat Embryol
,
2001
, том.
204
(стр.
399
—
406
)
10.1007/S00429-001-0214-9
Сабин
FR
.
Лимфатическая система эмбрионов человека с учетом морфологии системы в целом
9
(стр.
43
—
91
)
10.1002/aja.10000
Schacht
V
,
Ramirez
MI
,
Hong
YK
,
Hirakawa
S
,
,
Harvey
N
,
Williams
M
,
DVORAK
,
DVORAK
HF
,
DVORAK
HF
,DVORAK
HF
,DVORAK
HF
003
,
Оливер
G
, и др.
Дефицит T1α/подопланина нарушает нормальное формирование лимфатических сосудов и вызывает лимфедему
22
(pg.
3546
—
3556
)
10.1093/emboj/cdg342
Sebzda
E
,
Hibbard
C
,
Sweeney
S
,
Abtahian
F
,
Bezman
N
,
Clemens
G
,
Maltzman
JS
,
Cheng
L
,
,
Тернер
M
, и др.
Мутантные мыши SYK и Slp-76 обнаруживают вклад клеточно-автономных гемопоэтических клеток в развитие сосудов
,
Dev Cell
,
2006
, том.
11
(pg.
349
—
361
)
10.1016/j.devcel.2006.07.007
Shifren
JL
,
Doldi
N
,
Феррара
N
,
Мезиано
S
,
Джаффе
RB
.
У плода человека фактор роста эндотелия сосудов экспрессируется в эпителиальных клетках и миоцитах, но не в эндотелии сосудов: последствия для механизма действия
79
(стр.
316
—
322
)
10.1210/jc.79.1.316
Jonijders
RJM
,
9000 2
,
.0003
,
Sebire
NJ
,
Noble
PL
,
Николаидес 3 0 KH
9000Ультразвуковой скрининг в первом триместре беременности на хромосомные дефекты
7
(стр.
216
—
226
)
10.1046/j.1469-0705.100003
Souka
AP
,
Krampl
E
,
Geerts
L
,
Николаид
KH
.
Врожденная лимфедема, проявляющаяся повышенной прозрачностью воротникового пространства на 13 неделе беременности
22
(стр.
91
—
92
)
10.1002/pd.104
Van der Putte
SCJ
.
Лимфатическая мальформация у плодов человека
376
(стр.
233
—
246
)
Van der Putte
SCJ
,
Van Limborøgh
J
.
Эмбриональное развитие главных лимфатических сосудов человека
,
Acta Morphol Neerl Scand
,
1980
, vol.
18
(pg.
323
—
335
)
Vittay
P
,
Bosze
P
,
,
Laszlo
J
.
Дефекты лимфатических сосудов у пациенток с дисгенезией яичников
,
Clin Genet
,
1980
, том.
18
(pg.
387
—
391
)
von Kaisenberg
CS
,
Krenn
V
,
Ludwig
M
,
Николаидес
KH
,
Бренд-Сабери
B
.
Морфологическая классификация кожи затылка у плодов с трисомией 21, 18 и 13 в возрасте 12–18 недель и с трисомией 16 мыши
,
Анат Эмбриол
,
1998
, том.
197
(pg.
105
—
124
)
10.1007/s0042
123
von Kaisenberg
CS
,
Brand-Saberi
B
,
Christ
B
,
Валлиан
S
,
Фарзане
F
,
Николаидес
KH
.
Экспрессия гена коллагена VI типа в коже плода с трисомией 21
91
(pg.
319
—
323
)
von Kaisenberg
CS
,
Nicolaides
KH
,
Brand-Saberi
B
.
Гипоплазия лимфатических сосудов у плодов с синдромом Тернера
14
(pg.
823
—
826
)
10.1093/humrep/14.3.823
von Kaisenberg
CS
,
Hyett
JA
.
Николаидес
KH
,
Себире
NJ
,
Snijders
RJM
,
Николаидес
KH
.
Патофизиология повышенной прозрачности воротникового пространства
,
Сканирование 11–14 недель.
,
1999
Carnforth, Lancs
The Parthenon Publishing Group Ltd
(стр.
95
—
110
)
Wigle
)
)0003
Оливер
Г
.
Функция Prox1 необходима для развития лимфатической системы мышей
98
(pg.
769
—
778
)
10.1016/S0092-8674(00)81511-1
Wigle
JT
,
Harvey
N
,
Детмар
M
,
Lagutina
I
,
Grosveld
G
,
Gunn
MD
,
Jackson
DG
,
Oliver
G
.
Важнейшая роль Prox1 в индукции фенотипа лимфатических эндотелиальных клеток
21
(pg.
1505
—
1513
)
10.1093/emboj/21.7.1505
Wilting
J
,
Eichmann
A
,
Christ
B
.
Экспрессия гомологов птичьего рецептора VEGF Quek1 и Quek2 в эндотелиальных и неэндотелиальных клетках кровеносных и лимфатических сосудов во время эмбрионального развития перепела
,
Cell Tissue Res
,
1997
, том.
288
(pg.
207
—
223
)
10. 1007/s004410050807
1007/s004410050807
Wilting
J
,
Papoutsi
M
,
Schneider
M
,
Христос
Б
.
Лимфатический эндотелий птичьего крыла сомитного происхождения
,
Dev Dyn
,
2000
, vol.
217
(стр.
271
—
278
)
10.1002/(SICI) 1097-0177 (200003) 217: 3 <271 :: aid-dvdy5> 3.0.co; 2
Wilting
J
,
Papoutsi
M
,
Христос
B
,
Nicolaides
KH
,
Von KAISENBERG
,
Von KAISENBERG
,
. 0002 CS
0002 CS
,
Borges
J
,
Stark
G
,
Alitalo
K
,
Tomarev
SJ
,
Niemayer
C
, и другие.
Фактор транскрипции Prox1 является маркером лимфатических эндотелиальных клеток у нормальных и больных плодов человека
16
(pg.
1271
—
1273
)
Zinovieva
RD
,
Duncan
MK
,
Johnson
TR
,
Torres
R
,
Полимеропулос
MH
,
Томарев
SI
.
Структура и хромосомная локализация гена гомеобокса человека Prox 1
,
Геномика
,
1996
, том.
35
(стр.
517
—
522
)
Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
© The Author, 2010. Опубликовано издательством Oxford University Press от имени Европейского общества репродукции человека и эмбриологии. Все права защищены. Чтобы получить разрешения, отправьте электронное письмо по адресу: [email protected]
Раздел выпуска:
Статьи
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Оповещение о текущей проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Самые читаемые
Самые цитируемые
Потенциальное влияние COVID-19/ACE2 на женскую репродуктивную систему
Изменение сигнатуры модификации РНК в сперме человека коррелирует с подвижностью сперматозоидов
Деградация сперматозоидов после вазэктомии следует механизму, зависящему от фрагментации хроматина сперматозоидов, вызывающему разрывы ДНК в тороидальных линкерных областях
Интегрированный стресс-контроль трансляции и пролиферации клеток гранулезы во время нормального развития фолликулов яичников
Специфический для матки дефицит SIRT1 вызывает преждевременное старение матки и нарушает инвазию и расположение бластоцист, а также децидуализацию стромальных клеток у мышей
Реклама
Лечение внутричерепной гипертензии – ПМЦ
1. Доци Т. Регуляция объема мозговой ткани – обзор. Acta Neurochir (Вена) 1993; 121: 1–8. [PubMed] [Google Scholar]
Доци Т. Регуляция объема мозговой ткани – обзор. Acta Neurochir (Вена) 1993; 121: 1–8. [PubMed] [Google Scholar]
2. Лангфитт Т.В., Вайнштейн Д.Д., Касселл Н.Ф. Церебральный вазомоторный паралич, вызванный внутричерепной гипертензией. Неврология. 1965;15:622–641. [PubMed] [Google Scholar]
3. Миллер Д.Д., Салливан Х.Г. Тяжелая внутричерепная гипертензия. Int Anesthesiol Clin. 1979; 17:19–75. [PubMed] [Google Scholar]
4. Уэлч К. Внутричерепное давление у детей раннего возраста. Дж Нейрохирург. 1980; 52: 693–9. [PubMed] [Google Scholar]
5. Andrews BT, Chiles BW, III, Oslen WL, et al. Влияние расположения внутримозговой гематомы на риск сдавления ствола головного мозга и клинический исход. Дж Нейрохирург. 1988; 69: 518–22. [PubMed] [Академия Google]
6. Хлатки Р., Валадка А., Робертсон К.С. Прогнозирование ответа ВЧД на индуцированную артериальную гипертензию с помощью динамического тестирования ауторегуляции мозгового давления. J Нейротравма. 2004;21:1152. [Google Scholar]
[Google Scholar]
7. Рознер М.Дж., Коли И.Б. Церебральное перфузионное давление, внутричерепное давление и подъем головы. Дж Нейрохирург. 1986; 65: 636–41. [PubMed] [Google Scholar]
8. Gobiet W, Grote W, Bock WJ. Взаимосвязь между внутричерепным давлением, средним артериальным давлением и мозговым кровотоком у пострадавших с тяжелой черепно-мозговой травмой. Acta Neurochir (Вена) 1975;32:13–24. [PubMed] [Google Scholar]
9. Фридман Д.И. Медикаментозная внутричерепная гипертензия в дерматологии. Am J Clin Дерматол. 2005; 6: 29–37. [PubMed] [Google Scholar]
10. Джейкоб С., Раджабалли Ю.А. Внутричерепная гипертензия, вызванная рофекоксибом. Головная боль. 2005; 45:75–76. [PubMed] [Google Scholar]
11. Дигре К., Уорнер Дж. Участвует ли витамин А в патофизиологии повышенного внутричерепного давления? Неврология. 2005; 64:1827. [PubMed] [Академия Google]
12. Адельсон П.Д., Браттон С.Л., Карни Н.А. и соавт. Руководство по неотложной медицинской помощи при тяжелой черепно-мозговой травме у младенцев, детей и подростков: Глава 5. Показания к мониторингу внутричерепного давления у детей с тяжелой черепно-мозговой травмой. Pediatr Crit Care Med. 2003;4:С19–24. [PubMed] [Google Scholar]
Показания к мониторингу внутричерепного давления у детей с тяжелой черепно-мозговой травмой. Pediatr Crit Care Med. 2003;4:С19–24. [PubMed] [Google Scholar]
13. Asgeirsson B, Grande PO, Nordstrom CH. Новая терапия посттравматического отека головного мозга, основанная на гемодинамических принципах регуляции объема головного мозга. Интенсивная терапия Мед. 1994;20:260–7. [PubMed] [Google Scholar]
14. Брюс Д.А., Алави А., Биланюк Л. и соавт. Диффузный отек головного мозга после черепно-мозговых травм у детей: синдром «злокачественного отека головного мозга» Ж. Нейрохирург. 1981; 54: 170–178. [PubMed] [Google Scholar]
15. Marmarou A, Fatouros PP, Barzo P, et al. Вклад отека и объема мозговой крови в травматический отек головного мозга у пострадавших с черепно-мозговой травмой. Дж Нейрохирург. 2000;93:183–93. [PubMed] [Google Scholar]
16. Unterberg A, Kiening K, Schmiedek P, et al. Многолетние наблюдения внутричерепного давления после тяжелой черепно-мозговой травмы: феномен вторичного подъема внутричерепного давления. Нейрохирургия. 1993;32:17–23. [PubMed] [Google Scholar]
Нейрохирургия. 1993;32:17–23. [PubMed] [Google Scholar]
17. Taneda M, Kataoka K, Akai F, et al. Травматическое субарахноидальное кровоизлияние как предсказуемый показатель отсроченных симптомов ишемии. Дж Нейрохирург. 1996; 84: 762–8. [PubMed] [Google Scholar]
18. Selhorst JB, Gudeman SK, Butterworth JF, et al. Отек диска зрительного нерва после острой черепно-мозговой травмы. Нейрохирургия. 1985; 16: 357–63. [PubMed] [Google Scholar]
19. Kishore PR, Lipper MH, Becker DP, et al. Значение КТ при черепно-мозговой травме: корреляция с внутричерепным давлением. AJR Am J Рентгенол. 1981;137:829–33. [PubMed] [Google Scholar]
20. Adelson PD, Bratton SL, Carney NA, et al. Руководство по неотложной медицинской помощи при тяжелой черепно-мозговой травме у младенцев, детей и подростков: Глава 7 Технология мониторинга внутричерепного давления. Pediatr Crit Care Med. 2003;4:С28–30. [PubMed] [Google Scholar]
21. Gopinath SP, Robertson CS, Contant CF, et al. Клиническая оценка миниатюрного тензодатчика для контроля внутричерепного давления. Нейрохирургия. 1995;36:1137–40. [PubMed] [Google Scholar]
Клиническая оценка миниатюрного тензодатчика для контроля внутричерепного давления. Нейрохирургия. 1995;36:1137–40. [PubMed] [Google Scholar]
22. Czosnyka M, Czosnyka Z, Pickard JD. Лабораторные испытания трех микропреобразователей внутричерепного давления: технический отчет. Нейрохирургия. 1996; 38: 219–24. [PubMed] [Google Scholar]
23. Лундберг Н. Непрерывная регистрация и контроль давления желудочковой жидкости в нейрохирургической практике. Acta Psychiatr Scand. 1960; 36 (Приложение 149): 1–193. [PubMed] [Google Scholar]
24. O’Sullivan MG, Statham PF, Jones PA, et al. Роль мониторирования внутричерепного давления у пострадавших с тяжелой черепно-мозговой травмой без признаков внутричерепной гипертензии на первичной компьютерной томографии. Дж Нейрохирург. 1994;80:46–50. [PubMed] [Google Scholar]
25. Mayhall CG, Archer NH, Lamb VA, et al. Инфекции, связанные с вентрикулостомией: проспективное эпидемиологическое исследование. N Engl J Med. 1984; 310: 553–9. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
26. Holloway KL, Barnes T, Choi S, et al. Инфекции вентрикулостомы: влияние продолжительности мониторинга и замены катетера у 584 пациентов. Дж Нейрохирург. 1996; 85: 419–424. [PubMed] [Google Scholar]
27. Park P, Garton HJL, Kocan MJ, et al. Риск заражения при длительной катетеризации желудочков. Нейрохирургия. 2004;55:594–601. [PubMed] [Google Scholar]
28. Zabramski JM, Whiting D, Darouiche RO, et al. Эффективность импрегнированных противомикробными препаратами катетеров наружного вентрикулярного дренажа: проспективное рандомизированное контролируемое исследование. Дж Нейрохирург. 2003; 98: 725–30. [PubMed] [Google Scholar]
29. Feldman Z, Kanter MJ, Robertson CS, et al. Влияние подъема головы на внутричерепное давление, церебральное перфузионное давление и мозговой кровоток у пациентов с черепно-мозговой травмой. Дж Нейрохирург. 1992; 76: 207–11. [PubMed] [Академия Google]
30. Нг И, Лим Дж., Вонг Х.Б. Влияние положения головы на церебральную гемодинамику: ее влияние на внутричерепное давление, церебральное перфузионное давление и церебральную оксигенацию. Нейрохирургия. 2004; 54: 593–597. [PubMed] [Google Scholar]
Нейрохирургия. 2004; 54: 593–597. [PubMed] [Google Scholar]
31. Joseph DK, Dutton RP, Aarabi B, Scalea TM. Декомпрессивная лапаротомия для лечения трудноизлечимой внутричерепной гипертензии после черепно-мозговой травмы. J Травма. 2004; 57: 687–93. [PubMed] [Google Scholar]
32. Норт Дж. Б., Дженнет С. Аномальные паттерны дыхания, связанные с острым повреждением головного мозга. Арх Нейрол. 1974;31:338–44. [PubMed] [Google Scholar]
33. Миллер Д.Д., Беккер Д.П. Вторичные повреждения поврежденного головного мозга. JR Coll Surg Edinb. 1982; 27: 292–8. [PubMed] [Google Scholar]
34. Caricato A, Conti G, Della CF, et al. Влияние ПДКВ на внутричерепную систему пациентов с черепно-мозговой травмой и субарахноидальным кровоизлиянием: роль податливости дыхательной системы. J Травма. 2005; 58: 571–576. [PubMed] [Google Scholar]
35. Albanese J, Viviand X, Potie F, et al. Суфентанил, фентанил и альфентанил у пациентов с черепно-мозговой травмой: исследование церебральной гемодинамики. Крит Уход Мед. 1999;27:407–11. [PubMed] [Google Scholar]
Крит Уход Мед. 1999;27:407–11. [PubMed] [Google Scholar]
36. Dietrich WD, Alonso O, Halley M, et al. Отсроченная посттравматическая гипертермия головного мозга ухудшает исход после жидкостной перкуссионной травмы головного мозга: световое и электронно-микроскопическое исследование на крысах. Нейрохирургия. 1996; 38: 533–41. [PubMed] [Google Scholar]
37. Jones PA, Andrews PJD, Midgley S, et al. Измерение бремени вторичных инсультов у пациентов с черепно-мозговой травмой во время интенсивной терапии. J Нейросург Анест. 1994; 6: 4–14. [PubMed] [Академия Google]
38. Робертсон С.С., Клифтон Г.Л., Тейлор А.А. и соавт. Лечение артериальной гипертензии, связанной с травмой головы. Дж Нейрохирург. 1983; 59: 455–60. [PubMed] [Google Scholar]
39. Biousse V, Rucker JC, Vignal C, et al. Анемия и отек диска зрительного нерва. Am J Офтальмол. 2003; 135: 437–46. [PubMed] [Google Scholar]
40. Hebert PC, Wells G, Blajchman MA, et al. Многоцентровое, рандомизированное, контролируемое клиническое исследование требований к переливанию крови при интенсивной терапии. Требования к переливанию крови у исследователей интенсивной терапии, Канадская группа исследований в области интенсивной терапии. N Engl J Med. 1999;340:409–17. [PubMed] [Google Scholar]
Требования к переливанию крови у исследователей интенсивной терапии, Канадская группа исследований в области интенсивной терапии. N Engl J Med. 1999;340:409–17. [PubMed] [Google Scholar]
41. Lee ST, Lui TN, Wong CW, et al. Ранние приступы после тяжелой закрытой черепно-мозговой травмы. Может J Neurol Sci. 1997; 24:40–3. [PubMed] [Google Scholar]
42. Vespa PM, Nuwer MR, Nenov V, et al. Увеличение частоты и влияния бессудорожных и судорожных припадков после черепно-мозговой травмы, выявляемое при непрерывном электроэнцефалографическом мониторинге. Дж Нейрохирург. 1999; 91: 750–60. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Tempkin NR, Dikmen SS, Wilensky AJ, et al. Рандомизированное двойное слепое исследование фенитоина для профилактики посттравматических судорог. N Engl J Med. 1990;323:497–502. [PubMed] [Google Scholar]
44. Bratton SL, Chestnut RM, Ghajar J, et al. Противосудорожная профилактика. J Нейротравма. 2007;24(прил.1):С-83–С-86. [PubMed] [Google Scholar]
45. Schramm WM, Papousek A, Michalek-Sauberer A, et al. Церебральные и сердечно-сосудистые эффекты цисатракурия и атракурия у нейрохирургических пациентов. Анест Анальг. 1998; 86: 123–7. [PubMed] [Google Scholar]
Schramm WM, Papousek A, Michalek-Sauberer A, et al. Церебральные и сердечно-сосудистые эффекты цисатракурия и атракурия у нейрохирургических пациентов. Анест Анальг. 1998; 86: 123–7. [PubMed] [Google Scholar]
46. Nates JL, Cooper DJ, Day B, et al. Синдромы острой слабости у пациентов в критическом состоянии — переоценка. Интенсивная терапия Анест. 1997;25:502–13. [PubMed] [Google Scholar]
47. Prielipp RC, Coursin DB, Scuderi PE, et al. Сравнение требований к инфузии и профилей восстановления векурония и цисатракурия 51W89 у пациентов отделения интенсивной терапии. Анест Анальг. 1995; 81: 3–12. [PubMed] [Google Scholar]
48. Кнапп Дж.М. Гиперосмолярная терапия при лечении тяжелой черепно-мозговой травмы у детей: маннитол и гипертонический раствор. Проблемы с клиникой AACN. 2005; 16: 199–211. [PubMed] [Google Scholar]
49. Cruz J, Minoja G, Okuchi K, et al. Успешное использование нового лечения высокими дозами маннитола у пациентов с 3 баллами по шкале комы Глазго и двусторонним аномальным расширением зрачков: рандомизированное исследование. Дж Нейрохирург. 2004; 100:376–83. [PubMed] [Академия Google]
Дж Нейрохирург. 2004; 100:376–83. [PubMed] [Академия Google]
50. Cruz J, Minoja G, Okuchi K. Улучшение клинических исходов острых субдуральных гематом при экстренном предоперационном введении высоких доз маннитола: рандомизированное исследование. Нейрохирургия. 2001; 49: 864–71. [PubMed] [Google Scholar]
51. Muizelaar JP, Lutz HA, Becker DP. Влияние маннитола на ВЧД и CBF и корреляция с ауторегуляцией давления у пациентов с тяжелой травмой головы. Дж Нейрохирург. 1984; 61: 700–6. [PubMed] [Google Scholar]
52. Battison C, Andrews PJ, Graham C, et al. Рандомизированное контролируемое исследование влияния 20% раствора маннитола и 7,5% солевого раствора/6% раствора декстрана на повышение внутричерепного давления после черепно-мозговой травмы. Крит Уход Мед. 2005;33:196–202. [PubMed] [Google Scholar]
53. Vialet R, Albanese J, Thomachot L, et al. Isovolume гипертонических растворов (хлорида натрия или маннита) при лечении рефрактерной посттравматической внутричерепной гипертензии: 2 мл/кг 7,5% физиологического раствора более эффективны, чем 2 мл/кг 20% маннита. Крит Уход Мед. 2003; 31: 1683–1687. [PubMed] [Google Scholar]
Крит Уход Мед. 2003; 31: 1683–1687. [PubMed] [Google Scholar]
54. Cooper DJ, Myles PS, McDermott FT и др. Догоспитальная реанимация гипертоническим солевым раствором пациентов с гипотензией и тяжелой черепно-мозговой травмой: рандомизированное контролируемое исследование. ДЖАМА. 2004;291:1350–7. [PubMed] [Google Scholar]
55. Дойл Дж. А., Дэвис Д. П., Хойт Д. Б.. Применение гипертонического раствора при черепно-мозговой травме. J Травма. 2001; 50: 367–83. [PubMed] [Google Scholar]
56. Bratton SL, Chestnut RM, Ghajar J, et al. Гиперосмолярная терапия. J Нейротравма. 2007;24(прил.1):С-14–С-20. [PubMed] [Google Scholar]
57. Stocchetti N, Maas AI, Chieregato A, et al. Гипервентиляция при черепно-мозговой травме: обзор. Грудь. 2005; 127:1812–27. [PubMed] [Академия Google]
58. Юндт К.Д., Дирингер М.Н. Применение гипервентиляции и ее влияние на ишемию головного мозга при лечении черепно-мозговой травмы. Крит Уход Клин. 1997; 13: 163–84. [PubMed] [Google Scholar]
59. Muizelaar JP, van der Poel HG, Li ZC, et al. Диаметр пиальных артериол и реактивность СО2 при длительной гипервентиляции у кролика. Дж Нейрохирург. 1988; 69: 923–7. [PubMed] [Google Scholar]
Muizelaar JP, van der Poel HG, Li ZC, et al. Диаметр пиальных артериол и реактивность СО2 при длительной гипервентиляции у кролика. Дж Нейрохирург. 1988; 69: 923–7. [PubMed] [Google Scholar]
60. Coles JP, Steiner LA, Johnston AJ, et al. Уменьшает ли индуцированная гипертензия церебральную ишемию в травмированном человеческом мозгу? Мозг. 2004;127:2479–90. [PubMed] [Google Scholar]
61. Diringer MN, Videen TO, Yundt K, et al. Регионарные цереброваскулярные и метаболические эффекты гипервентиляции после тяжелой черепно-мозговой травмы. Дж Нейрохирург. 2002; 96: 103–8. [PubMed] [Google Scholar]
62. Бадер М.К., Арбор Р., Палмер С. Рефрактерное повышение внутричерепного давления при тяжелой черепно-мозговой травме: барбитуратная кома и мониторинг биспектрального индекса. Проблемы с клиникой AACN. 2005; 16: 526–41. [PubMed] [Google Scholar]
63. Schwartz ML, Tator CH, Rowed DW, et al. Исследование лечения травм головы Университета Торонто: проспективное рандомизированное сравнение пентобарбитала и маннита. Может J Neurol Sci. 1984;11:434–40. [PubMed] [Google Scholar]
Может J Neurol Sci. 1984;11:434–40. [PubMed] [Google Scholar]
64. Ward JD, Becker DP, Miller JD, et al. Неэффективность профилактической барбитуровой комы при лечении тяжелой черепно-мозговой травмы. Дж Нейрохирург. 1985; 62: 383–8. [PubMed] [Google Scholar]
65. Eisenberg HM, Frankowski RF, Contant CF, et al. Высокие дозы барбитуратов контролируют повышенное внутричерепное давление у пациентов с тяжелой черепно-мозговой травмой. Дж Нейрохирург. 1988; 69: 15–23. [PubMed] [Google Scholar]
66. Messeter K, Nordstrom CH, Sundbarg G, et al. Церебральная гемодинамика у пострадавших с острой тяжелой черепно-мозговой травмой. Дж Нейрохирург. 1986;64:231–237. [PubMed] [Google Scholar]
67. Nordstrom CH, Messeter K, Sundbarg G, et al. Мозговой кровоток, вазореактивность и потребление кислорода на фоне терапии барбитуратами при тяжелых травматических поражениях головного мозга. Дж Нейрохирург. 1988; 68: 424–31. [PubMed] [Google Scholar]
68. Schalen W, Sonesson B, Messeter K, et al. Клинические исходы и когнитивные нарушения у пациентов с тяжелыми черепно-мозговыми травмами, получавших барбитуратную кому. Acta Neurochir (Вена) 1992; 117: 153–9. [PubMed] [Академия Google]
Клинические исходы и когнитивные нарушения у пациентов с тяжелыми черепно-мозговыми травмами, получавших барбитуратную кому. Acta Neurochir (Вена) 1992; 117: 153–9. [PubMed] [Академия Google]
69. Сато М., Ниияма К., Курода Р. и соавт. Влияние дофамина на мозговой кровоток и метаболизм кислорода и глюкозы при введении барбитуратов у кошек. Acta Neurochir (Вена) 1991; 110: 174–80. [PubMed] [Google Scholar]
70. Clifton GL, Miller ER, Choi SC, et al. Отсутствие эффекта индукции гипотермии после острой черепно-мозговой травмы. N Engl J Med. 2001; 344: 556–63. [PubMed] [Google Scholar]
71. Adelson PD, Ragheb J, Kanev P, et al. Клинические испытания фазы II умеренной гипотермии после тяжелой черепно-мозговой травмы у детей. Нейрохирургия. 2005; 56: 740–54. [PubMed] [Академия Google]
72. Каал EC, Vecht CJ. Лечение отека головного мозга при опухолях головного мозга. Curr Opin Oncol. 2004; 16: 593–600. [PubMed] [Google Scholar]
73. Гудеман С., Миллер Дж. , Беккер Д. Неспособность высоких доз стероидной терапии повлиять на внутричерепное давление у пациентов с тяжелой травмой головы. Дж Нейрохирург. 1979; 51: 301–6. [PubMed] [Google Scholar]
, Беккер Д. Неспособность высоких доз стероидной терапии повлиять на внутричерепное давление у пациентов с тяжелой травмой головы. Дж Нейрохирург. 1979; 51: 301–6. [PubMed] [Google Scholar]
74. Saul T, Ducker T, Saleman M, et al. Стероиды при тяжелой травме головы: проспективное рандомизированное клиническое исследование. Дж Нейрохирург. 1981;54:596–600. [PubMed] [Google Scholar]
75. Эдвардс П., Аранго М., Балика Л. и соавт. Окончательные результаты MRC CRASH, рандомизированного плацебо-контролируемого исследования внутривенного введения кортикостероидов у взрослых с черепно-мозговой травмой — результаты через 6 месяцев. Ланцет. 2005; 365: 1957–9. [PubMed] [Google Scholar]
76. Feigin VL, Anderson N, Rinkel GJ, et al. Кортикостероиды при аневризматическом субарахноидальном кровоизлиянии и первичном внутримозговом кровоизлиянии. Кокрановская система базы данных, ред. 2005: CD004583. [PubMed] [Академия Google]
77. Марчук Г., Кауфманн А.М. Спонтанное супратенториальное внутримозговое кровоизлияние: роль хирургического лечения. Может J Neurol Sci. 2005; 32 (Приложение 2): S22–30. [PubMed] [Google Scholar]
Может J Neurol Sci. 2005; 32 (Приложение 2): S22–30. [PubMed] [Google Scholar]
78. Cheung A, Telaghani CK, Wang J, et al. Неврологическое восстановление после декомпрессивной трепанации черепа по поводу массивного ишемического инсульта. Нейрокрит Уход. 2005; 3: 216–23. [PubMed] [Google Scholar]
79. Sahuquillo J, Arikan F. Декомпрессивная краниэктомия для лечения рефрактерного высокого внутричерепного давления при черепно-мозговой травме. Кокрановская система базы данных, ред. 2006:CD003983. [PubMed] [Google Scholar]
80. Taylor A, Butt W, Rosenfeld J, et al. Рандомизированное исследование очень ранней декомпрессивной трепанации черепа у детей с черепно-мозговой травмой и устойчивой внутричерепной гипертензией. Чайлдс Нерв Сист. 2001; 17: 154–62. [PubMed] [Google Scholar]
81. Aarabi B, Hesdorffer DC, Ahn ES, et al. Исход после декомпрессивной краниэктомии по поводу злокачественного отека вследствие тяжелой черепно-мозговой травмы. Дж Нейрохирург. 2006; 104: 469–79. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
82. Polin RS, Shaffrey ME, Bogaev CA, et al. Декомпрессивная бифронтальная трепанация черепа в лечении тяжелого рефрактерного посттравматического отека головного мозга. Нейрохирургия. 1997;41:84–92. [PubMed] [Google Scholar]
83. Stiefel MF, Heuer GG, Smith MJ, et al. Церебральная оксигенация после декомпрессивной гемикраниэктомии для лечения рефрактерной внутричерепной гипертензии. Дж Нейрохирург. 2004; 101: 241–7. [PubMed] [Google Scholar]
84. Bor-Seng-Shu E, Hirsch R, Teixeira MJ, et al. Изменения церебральной гемодинамики, оцениваемые с помощью транскраниальной допплерографии у пациентов с посттравматическим отеком головного мозга, леченных хирургической декомпрессией. Дж Нейрохирург. 2006;104:93–100. [PubMed] [Google Scholar]
85. Engberg J, Oberg B, Christensen KS, et al. Церебральная артериовенозная разница содержания кислорода (АВДО 2 ) при галотановом и нейролептическом наркозе у больных, перенесших трепанацию черепа. Acta Anaesthesiol Scand. 1989; 33:642. [PubMed] [Google Scholar]
Acta Anaesthesiol Scand. 1989; 33:642. [PubMed] [Google Scholar]
86. Hutchinson PJ, Corteen E, Czosnyka M, et al. Декомпрессивная краниоэктомия при черепно-мозговой травме: рандомизированное многоцентровое исследование RESCUEicp. Акта Нейрохир. 2006. С. 17–20. www.RESCUEicp.com. [ПубМед]
87. Vahedi K, Hofmeijer J, Juettler E, et al. Ранняя декомпрессивная хирургия при злокачественном инфаркте средней мозговой артерии: объединенный анализ трех рандомизированных контролируемых исследований. Ланцет Нейрол. 2007; 6: 215–22. [PubMed] [Google Scholar]
Запись — *134934 — РЕЦЕПТОР ФИБРОБЛАСТНОГО ФАКТОРА РОСТА 3; ФГФР3
Алмейда, М.Р., Кампос-Хавьер, А.Б., Медейра, А., Кордейро, И., Соуза, А.Б., Лима, М., Соареш, Г., Роша, М., Сарайва, Дж., Рамос, Л., Соуза , С., Марселино, Дж. П., Коррейя, А., Сантос, Х. Г. Клиническая и молекулярная диагностика скелетных дисплазий, связанных с мутациями в гене, кодирующем рецептор фактора роста фибробластов 3 (FGFR3), в Португалии. клин. Жене. 75: 150-156, 2009.
[В паблике: 1
клин. Жене. 75: 150-156, 2009.
[В паблике: 1
Энгл Б., Херш Дж. Х., Кристенсен К. М. Молекулярно доказанная гипохондроплазия с клеверной деформацией черепа: новая ассоциация. клин. Жене. 54: 417-420, 1998.
[В паблике: 95]
[Полный текст: https://doi.org/10.1111/j.1399-0004.1998.tb03756.x]
клин. Жене. 54: 417-420, 1998.
[В паблике: 95]
[Полный текст: https://doi.org/10.1111/j.1399-0004.1998.tb03756.x]
Арно-Лопес, Л., Фрагозо, Р., Мантилья-Капачо, Дж., Баррос-Нуньес, П. Крузон с черным акантозом: дальнейшее описание синдрома. клин. Жене. 72: 405-410, 2007.
[В паблике: 17
клин. Жене. 72: 405-410, 2007.
[В паблике: 17
5] [Полный текст: https://doi.org/10.1111/j.1399-0004.2007.00884.x]
Авраам К.Б., Гивол Д., Авиви А., Яйон А., Коупленд Н.Г., Дженкинс Н.А. Картирование рецепторов фактора роста фибробластов мыши уточняет области гомологии между хромосомами мыши и человека. Геномика 21: 656-658, 1994.
[В паблике: 7
Геномика 21: 656-658, 1994.
[В паблике: 7
7] [Полный текст: https://doi.org/10.1006/geno.1994.1330]
Барросо, Э., Перес-Каррисоса, В., Гарсия-Рекуэро, И., Глюксман, М.Дж., Уилки, А.О., Гарсия-Минаур, С., Хит, К.Е. Легкий изолированный краниосиностоз, вызванный новой мутацией FGFR3, p. Ala334Thr. Являюсь. Дж. Мед. Жене. 155А: 3050-3053, 2011.
[Пубмед: 22038757]
[Полный текст: https://doi.org/10.1002/ajmg.a.34199]
Ala334Thr. Являюсь. Дж. Мед. Жене. 155А: 3050-3053, 2011.
[Пубмед: 22038757]
[Полный текст: https://doi.org/10.1002/ajmg.a.34199]
Беллус, Г. А., Гауденц, К., Закаи, Э. Х., Кларк, Л. А., Сабо, Дж., Франкомано, К. А., Мюнке, М. Идентичные мутации в трех разных генах рецептора фактора роста фибробластов при синдромах аутосомно-доминантного краниосиностоза. Природа Жене. 14: 174-176, 1996.
[В паблике: 8841188]
[Полный текст: https://doi.org/10.1038/ng1096-174]
Природа Жене. 14: 174-176, 1996.
[В паблике: 8841188]
[Полный текст: https://doi.org/10.1038/ng1096-174]
Беллус, Г. А., Хефферон, Т. В., Ортис де Луна, Р. И., Хект, Дж. Т., Хортон, В. А., Мачадо, М., Кайтила, И., Макинтош, И., Франкомано, К. А. Ахондроплазия определяется повторяющимися мутациями G380R FGFR3. Являюсь. Дж. Хам. Жене. 56: 368-373, 1995.
[В паблике: 7847369]
Ахондроплазия определяется повторяющимися мутациями G380R FGFR3. Являюсь. Дж. Хам. Жене. 56: 368-373, 1995.
[В паблике: 7847369]
Беллус, Г. А., Макинтош, И., Смит, Э. А., Эйлсворт, А. С., Каитила, И., Хортон, В. А., Гринхоу, Г. А., Хект, Дж. Т., Франкомано, К. А. Рекуррентная мутация в тирозинкиназном домене рецептора 3 фактора роста фибробластов вызывает гипохондроплазию. Природа Жене. 10: 357-359, 1995.
[В паблике: 7670477]
[Полный текст: https://doi.org/10.1038/ng0795-357]
Природа Жене. 10: 357-359, 1995.
[В паблике: 7670477]
[Полный текст: https://doi.org/10.1038/ng0795-357]
Беллус, Г. А., Спектор, Э. Б., Спейзер, П. В., Уивер, К. А., Гарбер, А. Т., Брайк, С. Р., Исраэль, Дж., Розенгрен, С. С., Вебстер, М. К., Донохью, Д. Дж., Франкомано, К. А. Различные миссенс-мутации кодона FGFR3 lys650 модулируют активацию рецепторной киназы и тяжесть фенотипа скелетной дисплазии. Являюсь. Дж. Хам. Жене. 67: 1411-1421, 2000.
[В паблике: 11055896]
[Полный текст: https://doi.org/10.1086/316892]
Дж., Франкомано, К. А. Различные миссенс-мутации кодона FGFR3 lys650 модулируют активацию рецепторной киназы и тяжесть фенотипа скелетной дисплазии. Являюсь. Дж. Хам. Жене. 67: 1411-1421, 2000.
[В паблике: 11055896]
[Полный текст: https://doi.org/10.1086/316892]
Бергсагель П. Л., Чези М., Нардини Э., Брентс Л.А., Кирби С.Л., Кюль В.М. Беспорядочные транслокации в участки переключения тяжелой цепи иммуноглобулина при множественной миеломе. проц. Нац. акад. науч. 93: 13931-13936, 1996.
[В паблике: 8
Л., Чези М., Нардини Э., Брентс Л.А., Кирби С.Л., Кюль В.М. Беспорядочные транслокации в участки переключения тяжелой цепи иммуноглобулина при множественной миеломе. проц. Нац. акад. науч. 93: 13931-13936, 1996.
[В паблике: 8
Броди, С. Г., Кито, Х., Лахман, Р.С., Ноласко, Л.М., Мекикян, П.Б., Уилкокс, В.Р. Платиспондиловая летальная скелетная дисплазия типа Сан-Диего вызывается мутациями FGFR3. Являюсь. Дж. Мед. Жене. 84: 476-480, 1999.
[В паблике: 10360402]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=476]
Г., Кито, Х., Лахман, Р.С., Ноласко, Л.М., Мекикян, П.Б., Уилкокс, В.Р. Платиспондиловая летальная скелетная дисплазия типа Сан-Диего вызывается мутациями FGFR3. Являюсь. Дж. Мед. Жене. 84: 476-480, 1999.
[В паблике: 10360402]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=476]
Броди, С. Г., Кито, Х., Липсон, М., Сифри-Платт, М., Уилкокс, В.Р. Танатофорная дисплазия I типа с синдактилией. Являюсь. Дж. Мед. Жене. 80: 260-262, 1998.
[В паблике:
Г., Кито, Х., Липсон, М., Сифри-Платт, М., Уилкокс, В.Р. Танатофорная дисплазия I типа с синдактилией. Являюсь. Дж. Мед. Жене. 80: 260-262, 1998.
[В паблике:
49]
[Полный текст: https://doi.org/10.1002/(sici)1096-8628(19
6)80:3<260::aid-ajmg15>3.0.co;2-s]
Каппеллен, Д. , Де Оливейра, К., Рикол, Д., Жиль Диез де Медина, С., Бурден, Дж., Састре-Гарау, X., Шопен, Д., Тьери, Дж. П., Радваньи, Ф. Частые активирующие мутации FGFR3 в карциномах мочевого пузыря и шейки матки человека. (Письмо) Природа Жене. 23: 18-20, 1999.
[В паблике: 10471491]
[Полный текст: https://doi.org/10.1038/12615]
, Де Оливейра, К., Рикол, Д., Жиль Диез де Медина, С., Бурден, Дж., Састре-Гарау, X., Шопен, Д., Тьери, Дж. П., Радваньи, Ф. Частые активирующие мутации FGFR3 в карциномах мочевого пузыря и шейки матки человека. (Письмо) Природа Жене. 23: 18-20, 1999.
[В паблике: 10471491]
[Полный текст: https://doi.org/10.1038/12615]
Чен Л. , Адар Р., Ян X., Монсонего Э. О., Ли К., Хаушка П. В., Яён А., Дэн С.-Х.
Мутация Gly369-to-cys в мышином FGFR3 вызывает ахондроплазию, влияя как на хондрогенез, так и на остеогенез. Дж. Клин. Инвестировать. 104: 1517-1525, 1999.
[В паблике: 10587515]
[Полный текст: https://doi.org/10.1172/JCI6690]
, Адар Р., Ян X., Монсонего Э. О., Ли К., Хаушка П. В., Яён А., Дэн С.-Х.
Мутация Gly369-to-cys в мышином FGFR3 вызывает ахондроплазию, влияя как на хондрогенез, так и на остеогенез. Дж. Клин. Инвестировать. 104: 1517-1525, 1999.
[В паблике: 10587515]
[Полный текст: https://doi.org/10.1172/JCI6690]
Чен Л. , Ли К., Цяо В., Сюй С., Дэн С. Мутация ser365-cys рецептора 3 фактора роста фибробластов у мышей подавляет сигналы Ihh/PTHrP и вызывает тяжелую ахондроплазию. Гум. молек. Жене. 10: 457-465, 2001.
[В паблике: 11181569]
[Полный текст: https://doi.org/10.1093/hmg/10.5.457]
, Ли К., Цяо В., Сюй С., Дэн С. Мутация ser365-cys рецептора 3 фактора роста фибробластов у мышей подавляет сигналы Ihh/PTHrP и вызывает тяжелую ахондроплазию. Гум. молек. Жене. 10: 457-465, 2001.
[В паблике: 11181569]
[Полный текст: https://doi.org/10.1093/hmg/10.5.457]
Чези М. , Нардини Э., Брентс Л. А., Шрок Э., Рид Т., Кюль В. М., Бергсагель П. Л. Частая транслокация t(4;14)(p16.3;q32.3) при множественной миеломе связана с повышенной экспрессией и активирующими мутациями рецептора фактора роста фибробластов 3. Природа Жене. 16: 260-264, 1997.
[В паблике:
, Нардини Э., Брентс Л. А., Шрок Э., Рид Т., Кюль В. М., Бергсагель П. Л. Частая транслокация t(4;14)(p16.3;q32.3) при множественной миеломе связана с повышенной экспрессией и активирующими мутациями рецептора фактора роста фибробластов 3. Природа Жене. 16: 260-264, 1997.
[В паблике:
Читаят Д. , Фернандес Б., Гарднер А., Мур Л., Гланс П., Данн М., Чун К., Сгро М., Рэй П., Аллингем-Хокинс Д. . Сложная гетерозиготность по ахондроплазии-гипохондроплазии FGFR3 мутации: пренатальная диагностика и постнатальный исход. Являюсь. Дж. Мед. Жене. 84: 401-405, 1999.
[В паблике: 10360393]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=401]
, Фернандес Б., Гарднер А., Мур Л., Гланс П., Данн М., Чун К., Сгро М., Рэй П., Аллингем-Хокинс Д. . Сложная гетерозиготность по ахондроплазии-гипохондроплазии FGFR3 мутации: пренатальная диагностика и постнатальный исход. Являюсь. Дж. Мед. Жене. 84: 401-405, 1999.
[В паблике: 10360393]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=401]
Чо, Дж. Ю., Го, К., Торелло, М., Лунструм, Г. П., Ивата, Т., Денг, К., Хортон, В. А. Дефект лизосомального нацеливания на активированный рецептор 3 фактора роста фибробластов при ахондроплазии. проц. Нац. акад. науч. 101: 609-614, 2004.
[В паблике: 14699054]
[Полный текст: https://doi.org/10.1073/pnas.2237184100]
Ю., Го, К., Торелло, М., Лунструм, Г. П., Ивата, Т., Денг, К., Хортон, В. А. Дефект лизосомального нацеливания на активированный рецептор 3 фактора роста фибробластов при ахондроплазии. проц. Нац. акад. науч. 101: 609-614, 2004.
[В паблике: 14699054]
[Полный текст: https://doi.org/10.1073/pnas.2237184100]
Колвин, Дж. С., Боне, Б. А., Хардинг, Г. В., Макьюэн, Д. Г., Орниц, Д. М. Разрастание скелета и глухота у мышей, лишенных рецептора фактора роста фибробластов 3. Природа Жене. 12:390-397, 1996.
[В паблике: 8630492]
[Полный текст: https://doi.org/10.1038/ng0496-390]
С., Боне, Б. А., Хардинг, Г. В., Макьюэн, Д. Г., Орниц, Д. М. Разрастание скелета и глухота у мышей, лишенных рецептора фактора роста фибробластов 3. Природа Жене. 12:390-397, 1996.
[В паблике: 8630492]
[Полный текст: https://doi.org/10.1038/ng0496-390]
Дэвидсон, Д. , Блан, А., Филион, Д., Ван, Х., Плут, П., Пфеффер, Г., Бушманн, М. Д., Хендерсон, Дж. Э. Фактор роста фибробластов (FGF) 18 передает сигнал через рецептор FGF 3 для стимуляции хондрогенеза. Дж. Биол. хим. 280: 20509-20515, 2005.
[В паблике: 15781473]
[Полный текст: https://doi.org/10.1074/jbc.M410148200]
, Блан, А., Филион, Д., Ван, Х., Плут, П., Пфеффер, Г., Бушманн, М. Д., Хендерсон, Дж. Э. Фактор роста фибробластов (FGF) 18 передает сигнал через рецептор FGF 3 для стимуляции хондрогенеза. Дж. Биол. хим. 280: 20509-20515, 2005.
[В паблике: 15781473]
[Полный текст: https://doi.org/10.1074/jbc.M410148200]
Дэн К. , Уиншоу-Борис А., Чжоу Ф., Куо А., Ледер П. Рецептор 3 фактора роста фибробластов является негативным регулятором роста костей. Сотовый 84: 911-921, 1996.
[В паблике: 8601314]
[Полный текст: https://doi.org/10.1016/s0092-8674(00)81069-7]
, Уиншоу-Борис А., Чжоу Ф., Куо А., Ледер П. Рецептор 3 фактора роста фибробластов является негативным регулятором роста костей. Сотовый 84: 911-921, 1996.
[В паблике: 8601314]
[Полный текст: https://doi.org/10.1016/s0092-8674(00)81069-7]
Дойц-Терлоу, П. П., Лосекут, М., Алфс, К. М., Хеннекам, Р. К. М., Баккер, Э. Замена Asn540thr в тирозинкиназном домене рецептора фактора роста фибробластов 3, вызывающая гипохондроплазию. Гум. Мутат. Доп. 1: С62-С65, 1998.
[Пубмед:
П., Лосекут, М., Алфс, К. М., Хеннекам, Р. К. М., Баккер, Э. Замена Asn540thr в тирозинкиназном домене рецептора фактора роста фибробластов 3, вызывающая гипохондроплазию. Гум. Мутат. Доп. 1: С62-С65, 1998.
[Пубмед:
43] [Полный текст: https://doi.org/10.1002/humu.1380110122]
Эль Гуцци, В. , Лажени, Э., Ле Меррер, М., Кормье-Дайр, В., Ренье, Д., Миних, А., Бонавентура, Дж. Мутации внутри или выше основного домена спираль-петля-спираль гена TWIST специфичны для синдрома Сетре-Чотцена. европ. Дж. Хам. Жене. 7: 27-33, 1999.
[В паблике: 100
, Лажени, Э., Ле Меррер, М., Кормье-Дайр, В., Ренье, Д., Миних, А., Бонавентура, Дж. Мутации внутри или выше основного домена спираль-петля-спираль гена TWIST специфичны для синдрома Сетре-Чотцена. европ. Дж. Хам. Жене. 7: 27-33, 1999.
[В паблике: 100
] [Полный текст: https://doi.org/10.1038/sj.ejhg.5200240]
Эсваракумар, В. П., Шлезингер, Дж. Избыточный рост скелета опосредуется дефицитом специфической изоформы рецептора фактора роста фибробластов 3. проц. Нац. акад. науч. 104: 3937-3942, 2007.
[В паблике: 17360456]
[Полный текст: https://doi.org/10.1073/pnas.0700012104]
П., Шлезингер, Дж. Избыточный рост скелета опосредуется дефицитом специфической изоформы рецептора фактора роста фибробластов 3. проц. Нац. акад. науч. 104: 3937-3942, 2007.
[В паблике: 17360456]
[Полный текст: https://doi.org/10.1073/pnas.0700012104]
Фофанова О. В., Такамура Н., Киношита Э., Меерсон Э.М., Ильина В.К., Нечволодова О.Л., Евграфов О.В., Петеркова В.А., Ямашита С. Миссенс-мутация С1659 в гене рецептора 3 фактора роста фибробластов у российских больных гипохондроплазией. Эндокр. Дж. 45: 791-795, 1998.
[В паблике: 103
В., Такамура Н., Киношита Э., Меерсон Э.М., Ильина В.К., Нечволодова О.Л., Евграфов О.В., Петеркова В.А., Ямашита С. Миссенс-мутация С1659 в гене рецептора 3 фактора роста фибробластов у российских больных гипохондроплазией. Эндокр. Дж. 45: 791-795, 1998.
[В паблике: 103
] [Полный текст: https://doi.org/10.1507/endocrj.45.791]
Франкомано, К. А., Беллус, Г.А., Сабо, Дж., Макинтош, И., Дорст, Дж., Ли, Р., Хурко, О., Фрэйли, А.Е., Бамшад, М.Дж. Новая скелетная дисплазия с тяжелым искривлением большеберцовой кости, глубокой задержкой развития и черным акантозом вызвана мутацией Lys 650 Met в рецепторе 3 фактора роста фибробластов (FGFR3). (Аннотация) Являюсь. Дж. Хам. Жене. 59 (дополнение): только A25, 1996 г.
А., Беллус, Г.А., Сабо, Дж., Макинтош, И., Дорст, Дж., Ли, Р., Хурко, О., Фрэйли, А.Е., Бамшад, М.Дж. Новая скелетная дисплазия с тяжелым искривлением большеберцовой кости, глубокой задержкой развития и черным акантозом вызвана мутацией Lys 650 Met в рецепторе 3 фактора роста фибробластов (FGFR3). (Аннотация) Являюсь. Дж. Хам. Жене. 59 (дополнение): только A25, 1996 г.
Фраттини В., Паньотта С.М., Тала, Фан, Дж.Дж., Руссо, М.В., Ли, С.Б., Гарофано, Л., Чжан, Дж., Ши, П., Льюис, Г., Сансон, Х., Фредерик, В. и еще 11 человек. Метаболическая функция слияния генов FGFR3-TACC3 при раке. Природа 553: 222-227, 2018.
[В паблике: 2
Природа 553: 222-227, 2018.
[В паблике: 2
98] [Полный текст: https://doi.org/10.1038/nature25171]
Friez, M.J., Wilson, J.A.P. Новые мутации FGFR3 в экзоне 7 и значение для расширенного скрининга ахондроплазии и гипохондроплазии: ответ на Heuertz et al. (Письмо) европ. Дж. Хам. Жене. 16: 277-278, 2008.
[Пубмед: 178
(Письмо) европ. Дж. Хам. Жене. 16: 277-278, 2008.
[Пубмед: 178
] [Полный текст: https://doi.org/10.1038/sj.ejhg.5201931]
Гарсия-Варгас А., Хафнер К., Перес-Родригес А.Г., Родригес-Рохас Л.Х., Гонсалес-Эскеда П., Стоер Р., Эрнандес-Торрес М., Хаппл Р. Синдром эпидермального невуса с поражением головного мозга, вызванный мозаичной мутацией FGFR3. Являюсь. Дж. Мед. Жене. 146А: 2275-2279, 2008.
[В паблике: 18642369]
[Полный текст: https://doi.org/10.1002/ajmg.a.32429]
Синдром эпидермального невуса с поражением головного мозга, вызванный мозаичной мутацией FGFR3. Являюсь. Дж. Мед. Жене. 146А: 2275-2279, 2008.
[В паблике: 18642369]
[Полный текст: https://doi.org/10.1002/ajmg.a.32429]
Голла А. , Лихтнер П., фон Гернет С., Винтерпахт А., Фэрли Дж., Муркен Дж., Шуффенхауэр С. Фенотипическая экспрессия мутации P250R рецептора фактора роста фибробластов 3 (FGFR3) в большой семье с краниосиностозами. Дж. Мед. Жене. 34: 683-684, 1997.
[В паблике:
, Лихтнер П., фон Гернет С., Винтерпахт А., Фэрли Дж., Муркен Дж., Шуффенхауэр С. Фенотипическая экспрессия мутации P250R рецептора фактора роста фибробластов 3 (FGFR3) в большой семье с краниосиностозами. Дж. Мед. Жене. 34: 683-684, 1997.
[В паблике:
Гориели А. , Хансен Р. М. С., Тейлор И. Б., Олесен И. А., Якобсен Г. К., Макгоуэн С. Дж., Пфайфер С. П., Маквин Г. А. Т., Райперт-Де Мейтс Э., Уилки А. О. М. Активирующие мутации в FGFR3 и HRAS указывают на общее генетическое происхождение врожденных нарушений и опухолей яичек. Природа Жене. 41: 1247-1252, 2009.
[В паблике: 1
, Хансен Р. М. С., Тейлор И. Б., Олесен И. А., Якобсен Г. К., Макгоуэн С. Дж., Пфайфер С. П., Маквин Г. А. Т., Райперт-Де Мейтс Э., Уилки А. О. М. Активирующие мутации в FGFR3 и HRAS указывают на общее генетическое происхождение врожденных нарушений и опухолей яичек. Природа Жене. 41: 1247-1252, 2009.
[В паблике: 1
93]
[Полный текст: https://doi.org/10.1038/ng.470]
Грэм, Дж. М., младший, Брэддок, С. Р., Мортье, Г. Р., Лахман, Р., Ван Доп, К., Джабс, Э. У. Синдром венечного краниосиностоза с брахидактилией и запястно-тарзальной коалицией вследствие мутации Pro250Arg в гене FGFR3. Являюсь. Дж. Мед. Жене. 77: 322-329, 1998.
[В паблике:
М., младший, Брэддок, С. Р., Мортье, Г. Р., Лахман, Р., Ван Доп, К., Джабс, Э. У. Синдром венечного краниосиностоза с брахидактилией и запястно-тарзальной коалицией вследствие мутации Pro250Arg в гене FGFR3. Являюсь. Дж. Мед. Жене. 77: 322-329, 1998.
[В паблике:
Григелионине Г. , Хагенас Л., Эклоф О., Ноймайер Л., Херейд П. Э., Анврет М. Новая миссенс-мутация ile538-to-val в рецепторе 3 фактора роста фибробластов при гипохондроплазии. (Аннотация) Гум. Мутат. 11: 333 только, 1998.
[В паблике: 10215410]
[Полный текст: https://doi.org/10.1002/(SICI)1098-1004(1998)11:4<333::AID-HUMU18>3.0.CO;2-G]
, Хагенас Л., Эклоф О., Ноймайер Л., Херейд П. Э., Анврет М. Новая миссенс-мутация ile538-to-val в рецепторе 3 фактора роста фибробластов при гипохондроплазии. (Аннотация) Гум. Мутат. 11: 333 только, 1998.
[В паблике: 10215410]
[Полный текст: https://doi.org/10.1002/(SICI)1098-1004(1998)11:4<333::AID-HUMU18>3.0.CO;2-G]
Грипп, К. В., Макдональд-Макгинн, Д.М., Гауденц, К., Уитакер, Л.А., Бартлетт, С.П., Глат, П.М., Кассилет, Л.Б., Майро, Р., Закай, Э.Х., Мюнке, М. Идентификация генетической причины изолированного одностороннего коронарного синостоза: уникальная мутация в рецепторе фактора роста фибробластов 3. Дж. Педиат. 132: 714-716, 1998.
[В паблике:
В., Макдональд-Макгинн, Д.М., Гауденц, К., Уитакер, Л.А., Бартлетт, С.П., Глат, П.М., Кассилет, Л.Б., Майро, Р., Закай, Э.Х., Мюнке, М. Идентификация генетической причины изолированного одностороннего коронарного синостоза: уникальная мутация в рецепторе фактора роста фибробластов 3. Дж. Педиат. 132: 714-716, 1998.
[В паблике:
Хафнер, К. , ван Эрс, Дж. М. М., Фогт, Т., Ландталер, М., Штёр, Р., Блашик, Х., Хофштедтер, Ф., Цвартоф, Э. С., Хартманн, А. Мозаика активирующих мутаций FGFR3 в коже человека вызывает эпидермальные невусы. Дж. Клин. Инвестировать. 116: 2201-2207, 2006.
[В паблике: 16841094]
[Полный текст: https://doi.org/10.1172/JCI28163]
, ван Эрс, Дж. М. М., Фогт, Т., Ландталер, М., Штёр, Р., Блашик, Х., Хофштедтер, Ф., Цвартоф, Э. С., Хартманн, А. Мозаика активирующих мутаций FGFR3 в коже человека вызывает эпидермальные невусы. Дж. Клин. Инвестировать. 116: 2201-2207, 2006.
[В паблике: 16841094]
[Полный текст: https://doi.org/10.1172/JCI28163]
Хе Л. , Хортон В., Христова К. Физическая основа ахондроплазии, наиболее распространенной формы человеческой карликовости. Дж. Биол. хим. 285: 30103-30114, 2010.
[ПубМед: 20624921]
[Полный текст: https://doi.org/10.1074/jbc.M109.0
, Хортон В., Христова К. Физическая основа ахондроплазии, наиболее распространенной формы человеческой карликовости. Дж. Биол. хим. 285: 30103-30114, 2010.
[ПубМед: 20624921]
[Полный текст: https://doi.org/10.1074/jbc.M109.0
]
Хе, Л. , Шобнам, Н., Уимли, В. К., Христова, К. Гетеродимеризация FGFR3 при ахондроплазии, наиболее распространенной форме карликовости человека. Дж. Биол. хим. 286: 13272-13281, 2011.
[В паблике: 21324899]
[Полный текст: https://doi.org/10.1074/jbc.M110.205583]
, Шобнам, Н., Уимли, В. К., Христова, К. Гетеродимеризация FGFR3 при ахондроплазии, наиболее распространенной форме карликовости человека. Дж. Биол. хим. 286: 13272-13281, 2011.
[В паблике: 21324899]
[Полный текст: https://doi.org/10.1074/jbc.M110.205583]
Хендерсон, Дж. Э., Наски, М. К., Аартс, М. М., Ван, Д., Ченг, Л., Гольцман, Д., Орниц, Д. М. Экспрессия FGFR3 с мутацией ахондроплазии G380R ингибирует пролиферацию и созревание хондроцитарных клеток CFK2. Дж. Боун Шахтер. Рез. 15: 155-165, 2000.
[В паблике: 10646125]
[Полный текст: https://doi.org/10.1359/jbmr.2000.15.1.155]
Э., Наски, М. К., Аартс, М. М., Ван, Д., Ченг, Л., Гольцман, Д., Орниц, Д. М. Экспрессия FGFR3 с мутацией ахондроплазии G380R ингибирует пролиферацию и созревание хондроцитарных клеток CFK2. Дж. Боун Шахтер. Рез. 15: 155-165, 2000.
[В паблике: 10646125]
[Полный текст: https://doi.org/10.1359/jbmr.2000.15.1.155]
Хендерсон С. , Силленс Д., Лафлин Дж., Беннеттс Б., Сайкс Б. Зародышевый и соматический мозаицизм при ахондроплазии. Дж. Мед. Жене. 37: 956-958, 2000.
[В паблике: 11186939]
[Полный текст: https://doi.org/10.1136/jmg.37.12.956]
, Силленс Д., Лафлин Дж., Беннеттс Б., Сайкс Б. Зародышевый и соматический мозаицизм при ахондроплазии. Дж. Мед. Жене. 37: 956-958, 2000.
[В паблике: 11186939]
[Полный текст: https://doi.org/10.1136/jmg.37.12.956]
Хойертц С. , Ле Меррер М., Забель Б., Райт М., Леге-Малле Л., Кормье-Дэр В., Гиббс Л., Бонавентура Дж. Новые мутации FGFR3, создающие остатки цистеина во внеклеточном домене рецептора, вызывают ахондроплазию или тяжелые формы гипохондроплазии. европ. Дж. Хам. Жене. 14: 1240-1247, 2006. Примечание: Erratum: Europ. Дж. Хам. Жене. 14: только 1321, 2006 г.
[В паблике: 164]
[Полный текст: https://doi.org/10.1038/sj.ejhg.5201700]
, Ле Меррер М., Забель Б., Райт М., Леге-Малле Л., Кормье-Дэр В., Гиббс Л., Бонавентура Дж. Новые мутации FGFR3, создающие остатки цистеина во внеклеточном домене рецептора, вызывают ахондроплазию или тяжелые формы гипохондроплазии. европ. Дж. Хам. Жене. 14: 1240-1247, 2006. Примечание: Erratum: Europ. Дж. Хам. Жене. 14: только 1321, 2006 г.
[В паблике: 164]
[Полный текст: https://doi.org/10.1038/sj.ejhg.5201700]
Холлуэй, Г. Э., Сазерс, Г. К., Баттиз, К. М., Тернер, А. М., Дэвид, Д. Дж., Малли, Дж. К. Глухота из-за мутации pro250-to-arg FGFR3. (Письмо) Ланцет 351: 877-878, 1998.
[В паблике:
Э., Сазерс, Г. К., Баттиз, К. М., Тернер, А. М., Дэвид, Д. Дж., Малли, Дж. К. Глухота из-за мутации pro250-to-arg FGFR3. (Письмо) Ланцет 351: 877-878, 1998.
[В паблике:
Хаггинс, М. Дж., Смит, Дж. Р., Чун, К., Рэй, П. Н., Шах, Дж. К., Уилан, Д. Т. Комплекс ахондроплазия-гипохондроплазия у новорожденного. Являюсь. Дж. Мед. Жене. 84: 396-400, 1999.
[В паблике: 10360392]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=396]
Дж., Смит, Дж. Р., Чун, К., Рэй, П. Н., Шах, Дж. К., Уилан, Д. Т. Комплекс ахондроплазия-гипохондроплазия у новорожденного. Являюсь. Дж. Мед. Жене. 84: 396-400, 1999.
[В паблике: 10360392]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=84&issue=5&spage=396]
Хайланд, В. Дж., Робертсон, С.П., Фланаган, С., Саварираян, Р., Роскиоли, Т., Масел, Дж., Хейс, М., Гласс, И.А. Соматический и зародышевый мозаицизм миссенс-мутации R248C в FGFR3, приводящий к скелетной дисплазии, отличной от танатофорной дисплазии. Являюсь. Дж. Мед. Жене. 120А: 157-168, 2003.
[В паблике: 12833394]
[Полный текст: https://doi.org/10.1002/ajmg.a.20012]
Дж., Робертсон, С.П., Фланаган, С., Саварираян, Р., Роскиоли, Т., Масел, Дж., Хейс, М., Гласс, И.А. Соматический и зародышевый мозаицизм миссенс-мутации R248C в FGFR3, приводящий к скелетной дисплазии, отличной от танатофорной дисплазии. Являюсь. Дж. Мед. Жене. 120А: 157-168, 2003.
[В паблике: 12833394]
[Полный текст: https://doi.org/10.1002/ajmg.a.20012]
Ибрахими О. А., Чжан Ф., Елисеенкова А. В., Линхардт Р. Дж., Мохаммади М. Мутации пролина в аргинин в рецепторах FGF 1 и 3 приводят к синдромам краниосиностоза Пфайффера и Мюнке за счет повышения аффинности связывания FGF. Гум. молек. Жене. 13: 69-78, 2004.
[В паблике: 14613973]
[Полный текст: https://doi.org/10.1093/hmg/ddh011]
А., Чжан Ф., Елисеенкова А. В., Линхардт Р. Дж., Мохаммади М. Мутации пролина в аргинин в рецепторах FGF 1 и 3 приводят к синдромам краниосиностоза Пфайффера и Мюнке за счет повышения аффинности связывания FGF. Гум. молек. Жене. 13: 69-78, 2004.
[В паблике: 14613973]
[Полный текст: https://doi.org/10.1093/hmg/ddh011]
Икегава С. , Фукусима Ю., Исомура М., Такада Ф., Накамура Ю. Мутации гена рецептора-3 фактора роста фибробластов в одном семейном и шести спорадических случаях ахондроплазии у японских пациентов. Гум. Жене. 96: 309-311, 1995.
[В паблике: 7649548]
[Полный текст: https://doi.org/10.1007/BF00210413]
, Фукусима Ю., Исомура М., Такада Ф., Накамура Ю. Мутации гена рецептора-3 фактора роста фибробластов в одном семейном и шести спорадических случаях ахондроплазии у японских пациентов. Гум. Жене. 96: 309-311, 1995.
[В паблике: 7649548]
[Полный текст: https://doi.org/10.1007/BF00210413]
Интини Д. , Бальдини Л., Фабрис С., Ломбарди Л., Чичери Г., Майоло А. Т., Нери А. Анализ мутаций гена FGFR3 у больных множественной миеломой с t(4;14). Брит. Дж. Хэмат. 114: 362-364, 2001.
[В паблике: 11529856]
[Полный текст: https://doi.org/10.1046/j.1365-2141.2001.02957.x]
, Бальдини Л., Фабрис С., Ломбарди Л., Чичери Г., Майоло А. Т., Нери А. Анализ мутаций гена FGFR3 у больных множественной миеломой с t(4;14). Брит. Дж. Хэмат. 114: 362-364, 2001.
[В паблике: 11529856]
[Полный текст: https://doi.org/10.1046/j.1365-2141.2001.02957.x]
Ивата Т. , Чен Л., Ли С., Овчинников Д. А., Берингер Р. Р., Франкомано С. А., Денг С.-Х. Неонатальная летальная мутация в FGFR3 разделяет пролиферацию и дифференцировку хондроцитов ростовой пластинки у эмбрионов. Гум. молек. Жене. 9: 1603-1613, 2000.
[В паблике: 10861287]
[Полный текст: https://doi.org/10.1093/hmg/9.11.1603]
, Чен Л., Ли С., Овчинников Д. А., Берингер Р. Р., Франкомано С. А., Денг С.-Х. Неонатальная летальная мутация в FGFR3 разделяет пролиферацию и дифференцировку хондроцитов ростовой пластинки у эмбрионов. Гум. молек. Жене. 9: 1603-1613, 2000.
[В паблике: 10861287]
[Полный текст: https://doi.org/10.1093/hmg/9.11.1603]
Ивата, Т. , Ли, К.-Л., Денг, К.-Х., Франкомано, К.А. Высокоактивированный Fgfr3 с мутацией K644M вызывает пролонгированное выживание тяжелых карликовых мышей. Гум. молек. Жене. 10: 1255-1264, 2001.
[В паблике: 11406607]
[Полный текст: https://doi.org/10.1093/hmg/10.12.1255]
, Ли, К.-Л., Денг, К.-Х., Франкомано, К.А. Высокоактивированный Fgfr3 с мутацией K644M вызывает пролонгированное выживание тяжелых карликовых мышей. Гум. молек. Жене. 10: 1255-1264, 2001.
[В паблике: 11406607]
[Полный текст: https://doi.org/10.1093/hmg/10.12.1255]
Джеки, Б. П.С., Гарай, П.Е., Дюпюи, Дж., Нельсон, Дж.Б., Кай, Б., Молина, Ю., Ван, Дж., Стюард, Л.Е., Бройд, Р.С., Фрэнсис, Дж., Аоки, К.Р., Стивенс , Р. К., Фернандес-Салас, Э. Идентификация рецептора 3 фактора роста фибробластов (FGFR3) в качестве белкового рецептора ботулинического нейротоксина серотипа А (BoNT/A). PLoS Патог. 9: e1003369, 2013. Примечание: электронная статья.
[В паблике: 236
П.С., Гарай, П.Е., Дюпюи, Дж., Нельсон, Дж.Б., Кай, Б., Молина, Ю., Ван, Дж., Стюард, Л.Е., Бройд, Р.С., Фрэнсис, Дж., Аоки, К.Р., Стивенс , Р. К., Фернандес-Салас, Э. Идентификация рецептора 3 фактора роста фибробластов (FGFR3) в качестве белкового рецептора ботулинического нейротоксина серотипа А (BoNT/A). PLoS Патог. 9: e1003369, 2013. Примечание: электронная статья.
[В паблике: 236
] [Полный текст: https://doi.org/10.1371/journal.ppat.1003369]
Джанг, Дж. -Х., Шин, К.-Х., Пак, Дж.-Г. Мутации в генах рецептора 2 фактора роста фибробластов и рецептора 3 фактора роста фибробластов связаны с раком желудка и толстой кишки человека. Рак рез. 61: 3541-3543, 2001.
[В паблике: 11325814]
-Х., Шин, К.-Х., Пак, Дж.-Г. Мутации в генах рецептора 2 фактора роста фибробластов и рецептора 3 фактора роста фибробластов связаны с раком желудка и толстой кишки человека. Рак рез. 61: 3541-3543, 2001.
[В паблике: 11325814]
Джанг, Дж.-Х. Идентификация и характеристика растворимой изоформы рецептора 3 фактора роста фибробластов в клетках остеосаркомы SaOS-2 человека. Биохим. Биофиз. Рез. коммун. 292: 378-382, 2002.
[В паблике: 11
Биохим. Биофиз. Рез. коммун. 292: 378-382, 2002.
[В паблике: 11
Каруи М., Хофманн-Радвани Х., Циммерманн У., Кувелар А., Деготт К., Фаридони-Лауренс Л., Ахомадегбе Ж.-К., Газзери С., Брамбилла Э. ., Клеричи Т., Шарбонье П., Тресалле К. и еще 8 человек. Нет доказательств соматической мутации FGFR3 при различных типах карциномы. Онкоген 20: 5059-5061, 2001.
[В паблике: 11526491]
[Полный текст: https://doi.org/10.1038/sj.onc.1204651]
., Клеричи Т., Шарбонье П., Тресалле К. и еще 8 человек. Нет доказательств соматической мутации FGFR3 при различных типах карциномы. Онкоген 20: 5059-5061, 2001.
[В паблике: 11526491]
[Полный текст: https://doi.org/10.1038/sj.onc.1204651]
Киган К. , Джонсон Д. Э., Уильямс Л. Т., Хейман М. Дж. Выделение дополнительного члена семейства рецепторов фактора роста фибробластов, FGFR-3. проц. Нац. акад. науч. 88: 1095-1099, 1991.
[В паблике: 1847508]
[Полный текст: https://doi.org/10.1073/pnas.88.4.1095]
, Джонсон Д. Э., Уильямс Л. Т., Хейман М. Дж. Выделение дополнительного члена семейства рецепторов фактора роста фибробластов, FGFR-3. проц. Нац. акад. науч. 88: 1095-1099, 1991.
[В паблике: 1847508]
[Полный текст: https://doi.org/10.1073/pnas.88.4.1095]
Кимура Т. , Судзуки Х., Охаши Т., Киёта Х., Это Ю. Частота мутаций танатофорной дисплазии в карциномах мочевого пузыря FGFR3. Рак 92: 2555-2561, 2001. Примечание: опечатка: Рак 94: только 2117, 2002.
[В паблике: 11745189]
[Полный текст: https://doi.org/10.1002/1097-0142(20011115)92:10<2555::aid-cncr1607>3.0.co;2-m]
, Судзуки Х., Охаши Т., Киёта Х., Это Ю. Частота мутаций танатофорной дисплазии в карциномах мочевого пузыря FGFR3. Рак 92: 2555-2561, 2001. Примечание: опечатка: Рак 94: только 2117, 2002.
[В паблике: 11745189]
[Полный текст: https://doi.org/10.1002/1097-0142(20011115)92:10<2555::aid-cncr1607>3.0.co;2-m]
Кито, Х. , Броди, С.Г., Купке, К.Г., Лахман, Р.С., Уилкокс, В.Р. Замена Lys650-to-met в тирозинкиназном домене гена рецептора фактора роста фибробластов вызывает танатофорную дисплазию I типа. (Аннотация) Гум. Мутат. 12: 362-363, 1998.
[В паблике: 10671061]
, Броди, С.Г., Купке, К.Г., Лахман, Р.С., Уилкокс, В.Р. Замена Lys650-to-met в тирозинкиназном домене гена рецептора фактора роста фибробластов вызывает танатофорную дисплазию I типа. (Аннотация) Гум. Мутат. 12: 362-363, 1998.
[В паблике: 10671061]
Лажени Э., Эль Гуцци В., Ле Меррер М., Миних А. , Бонавентура Дж., Ренье Д. Связанная с полом экспрессивность фенотипа коронарного краниосиностоза, вызванного рекуррентной мутацией P250R FGFR3. Дж. Мед. Жене. 36: 9-13, 1999.
[В паблике: 9
, Бонавентура Дж., Ренье Д. Связанная с полом экспрессивность фенотипа коронарного краниосиностоза, вызванного рекуррентной мутацией P250R FGFR3. Дж. Мед. Жене. 36: 9-13, 1999.
[В паблике: 9
Лэннинг, Р. В., Браун, К. А. Усовершенствованная методология обнаружения распространенной мутации в гене FGFR3, ответственной за ахондроплазию. Гум. Мутат. 10:496-499, 1997.
[В паблике:
В., Браун, К. А. Усовершенствованная методология обнаружения распространенной мутации в гене FGFR3, ответственной за ахондроплазию. Гум. Мутат. 10:496-499, 1997.
[В паблике:
15] [Полный текст: https://doi.org/10.1002/(SICI)1098-1004(1997)10:6<496::AID-HUMU13>3.0.CO;2-V]
Лерой, Дж. Г., Найтинк, Л., Ламберт, Дж., Найярт, Дж.-М., Мортье, Г. Р. Acanthosis nigricans у ребенка с остеохондродисплазией легкой степени и мутацией K650Q в гене FGFR3. Являюсь. Дж. Мед. Жене. 143А: 3144-3149, 2007.
[В паблике: 18000903]
[Полный текст: https://doi.org/10.1002/ajmg.a.31966]
Г., Найтинк, Л., Ламберт, Дж., Найярт, Дж.-М., Мортье, Г. Р. Acanthosis nigricans у ребенка с остеохондродисплазией легкой степени и мутацией K650Q в гене FGFR3. Являюсь. Дж. Мед. Жене. 143А: 3144-3149, 2007.
[В паблике: 18000903]
[Полный текст: https://doi.org/10.1002/ajmg.a.31966]
Ли, К. , Чен, Л., Ивата, Т., Китагава, М., Фу, X.-Y., Дэн, C.-X. Замена Lys644Glu в рецепторе 3 фактора роста фибробластов (FGFR3) вызывает карликовость у мышей за счет активации STAT и ингибиторов клеточного цикла ink4. Гум. молек. Жене. 8: 35-44, 1999.
[PubMed: 9887329]
[Полный текст: https://doi.org/10.1093/hmg/8.1.35]
, Чен, Л., Ивата, Т., Китагава, М., Фу, X.-Y., Дэн, C.-X. Замена Lys644Glu в рецепторе 3 фактора роста фибробластов (FGFR3) вызывает карликовость у мышей за счет активации STAT и ингибиторов клеточного цикла ink4. Гум. молек. Жене. 8: 35-44, 1999.
[PubMed: 9887329]
[Полный текст: https://doi.org/10.1093/hmg/8.1.35]
Ли, Д. , Ляо, К., Ма, X., Ли, Q., Тан, X. Танатофорная дисплазия 2 типа с энцефалоцеле во втором триместре. Являюсь. Дж. Мед. Жене. 140А: 1476-1477, 2006.
[В паблике: 16752380]
[Полный текст: https://doi.org/10.1002/ajmg.a.31293]
, Ляо, К., Ма, X., Ли, Q., Тан, X. Танатофорная дисплазия 2 типа с энцефалоцеле во втором триместре. Являюсь. Дж. Мед. Жене. 140А: 1476-1477, 2006.
[В паблике: 16752380]
[Полный текст: https://doi.org/10.1002/ajmg.a.31293]
Ливенс, П. М.-Дж., Либой, Э. Мутация танатофорной дисплазии II типа препятствует полному созреванию рецептора фактора роста фибробластов 3 (FGFR3), который активирует преобразователь сигнала и активатор транскрипции 1 (STAT1) из эндоплазматического ретикулума. Дж. Биол. хим. 278: 17344-17349, 2003.
[В паблике: 12624096]
[Полный текст: https://doi.org/10.1074/jbc.M212710200]
М.-Дж., Либой, Э. Мутация танатофорной дисплазии II типа препятствует полному созреванию рецептора фактора роста фибробластов 3 (FGFR3), который активирует преобразователь сигнала и активатор транскрипции 1 (STAT1) из эндоплазматического ретикулума. Дж. Биол. хим. 278: 17344-17349, 2003.
[В паблике: 12624096]
[Полный текст: https://doi.org/10.1074/jbc.M212710200]
Лин, Т. , Сандаски, С. Б., Сюэ, Х., Фишбейн, К. В., Спенсер, Р. Г., Рао, М. С., Франкомано, К. А. Мышиная модель танатофорной дисплазии II типа, специфичная для центральной нервной системы. Гум. молек. Жене. 12: 2863-2871, 2003.
[В паблике: 12
, Сандаски, С. Б., Сюэ, Х., Фишбейн, К. В., Спенсер, Р. Г., Рао, М. С., Франкомано, К. А. Мышиная модель танатофорной дисплазии II типа, специфичная для центральной нервной системы. Гум. молек. Жене. 12: 2863-2871, 2003.
[В паблике: 12
Логи А. , Дюнуа-Лард К., Рости К., Леврель О., Бланш М., Рибейро А., Гаск Ж.-М., Джоркано Дж., Вернер С., Састр-Гарау, X., Тьери, Дж. П., Радваньи, Ф. Активирующие мутации тирозинкиназного рецептора FGFR3 связаны с доброкачественными опухолями кожи у мышей и людей. Гум. молек. Жене. 14: 1153-1160, 2005.
[В паблике: 15772091]
[Полный текст: https://doi.org/10.1093/hmg/ddi127]
, Дюнуа-Лард К., Рости К., Леврель О., Бланш М., Рибейро А., Гаск Ж.-М., Джоркано Дж., Вернер С., Састр-Гарау, X., Тьери, Дж. П., Радваньи, Ф. Активирующие мутации тирозинкиназного рецептора FGFR3 связаны с доброкачественными опухолями кожи у мышей и людей. Гум. молек. Жене. 14: 1153-1160, 2005.
[В паблике: 15772091]
[Полный текст: https://doi.org/10.1093/hmg/ddi127]
Лоури, Р. Б., Джабс, Э. У., Грэм, Г. Э., Герритсен, Дж., Флеминг, Дж. Синдром венечного краниосиностоза, аномалии Клиппеля-Фейля и плеча Шпренгеля с мутацией pro250arg в гене FGFR3 и без нее. Являюсь. Дж. Мед. Жене. 104: 112-119, 2001.
[В паблике: 11746040]
[Полный текст: https://doi.org/10.1002/ajmg.10049]
Б., Джабс, Э. У., Грэм, Г. Э., Герритсен, Дж., Флеминг, Дж. Синдром венечного краниосиностоза, аномалии Клиппеля-Фейля и плеча Шпренгеля с мутацией pro250arg в гене FGFR3 и без нее. Являюсь. Дж. Мед. Жене. 104: 112-119, 2001.
[В паблике: 11746040]
[Полный текст: https://doi.org/10.1002/ajmg.10049]
Макританасис П. , Темтами С., Аглан М., Отаифи Г. А., Хамами Х., Антонаракис С. Э. Новая гомозиготная мутация в FGFR3 вызывает высокий рост, серьезное боковое отклонение большеберцовой кости, сколиоз, нарушение слуха, камптодактилию и арахнодактилию. Гум. Мутат. 35: 959-963, 2014.
[В паблике: 24864036]
[Полный текст: https://doi.org/10.1002/humu.22597]
, Темтами С., Аглан М., Отаифи Г. А., Хамами Х., Антонаракис С. Э. Новая гомозиготная мутация в FGFR3 вызывает высокий рост, серьезное боковое отклонение большеберцовой кости, сколиоз, нарушение слуха, камптодактилию и арахнодактилию. Гум. Мутат. 35: 959-963, 2014.
[В паблике: 24864036]
[Полный текст: https://doi.org/10.1002/humu.22597]
Мансур, С. Л., Твигг, С.Р.Ф., Фриланд, Р.М., Уолл, С.А., Ли, К., Уилки, А.О.М. Потеря слуха у мышиной модели синдрома Мюнке. Гум. молек. Жене. 18: 43-50, 2009.
[В паблике: 18818193]
[Полный текст: https://doi.org/10.1093/hmg/ddn311]
Л., Твигг, С.Р.Ф., Фриланд, Р.М., Уолл, С.А., Ли, К., Уилки, А.О.М. Потеря слуха у мышиной модели синдрома Мюнке. Гум. молек. Жене. 18: 43-50, 2009.
[В паблике: 18818193]
[Полный текст: https://doi.org/10.1093/hmg/ddn311]
Мацусита Т. , Уилкокс В. Р., Чан Ю. Ю., Каванами А., Букулмез Х., Балмес Г., Крейчи П., Мекикян П. Б., Отани К., Ямаура И., Варман М. Л. , Гивол Д., Мураками С. FGFR3 способствует закрытию синхондроза и слиянию центров окостенения посредством пути MAPK. Гум. молек. Жене. 18: 227-240, 2009.
[В паблике: 18
, Уилкокс В. Р., Чан Ю. Ю., Каванами А., Букулмез Х., Балмес Г., Крейчи П., Мекикян П. Б., Отани К., Ямаура И., Варман М. Л. , Гивол Д., Мураками С. FGFR3 способствует закрытию синхондроза и слиянию центров окостенения посредством пути MAPK. Гум. молек. Жене. 18: 227-240, 2009.
[В паблике: 18
МакКьюсик В. А., Келли Т.Е., Дорст Дж.П. Наблюдения, указывающие на аллелизм генов ахондроплазии и гипохондроплазии. Дж. Мед. Жене. 10: 11-16, 1973.
[В паблике: 46
А., Келли Т.Е., Дорст Дж.П. Наблюдения, указывающие на аллелизм генов ахондроплазии и гипохондроплазии. Дж. Мед. Жене. 10: 11-16, 1973.
[В паблике: 46
Мейерс, Г. А., Орлоу, С. Дж., Манро, И. Р., Пржилепа, К. А., Джабс, Э. У. Трансмембранная мутация рецептора 3 фактора роста фибробластов (FGFR3) при синдроме Крузона с черным акантозом. Природа Жене. 11: 462-464, 1995.
[В паблике: 74]
[Полный текст: https://doi.org/10.1038/ng1295-462]
А., Орлоу, С. Дж., Манро, И. Р., Пржилепа, К. А., Джабс, Э. У. Трансмембранная мутация рецептора 3 фактора роста фибробластов (FGFR3) при синдроме Крузона с черным акантозом. Природа Жене. 11: 462-464, 1995.
[В паблике: 74]
[Полный текст: https://doi.org/10.1038/ng1295-462]
Молони Д. М., Слейни С.Ф., Олдридж М., Уолл С.А., Салин П., Стенман Г., Уилки А.О.М. Исключительное отцовское происхождение новых мутаций при синдроме Аперта. Природа Жене. 13: 48-53, 1996.
[В паблике: 8673103]
[Полный текст: https://doi.org/10.1038/ng0596-48]
М., Слейни С.Ф., Олдридж М., Уолл С.А., Салин П., Стенман Г., Уилки А.О.М. Исключительное отцовское происхождение новых мутаций при синдроме Аперта. Природа Жене. 13: 48-53, 1996.
[В паблике: 8673103]
[Полный текст: https://doi.org/10.1038/ng0596-48]
Молони, Д. М., Уолл, С. А., Эшворт, Г. Дж., Олдридж, М., Гласс, И. А., Франкомано, К. А., Мюнке, М., Уилки, А. О. М. Распространенность мутации pro250arg рецептора 3 фактора роста фибробластов при коронарном краниосиностозе. Ланцет 349: 1059-1062, 1997.
[В паблике:
М., Уолл, С. А., Эшворт, Г. Дж., Олдридж, М., Гласс, И. А., Франкомано, К. А., Мюнке, М., Уилки, А. О. М. Распространенность мутации pro250arg рецептора 3 фактора роста фибробластов при коронарном краниосиностозе. Ланцет 349: 1059-1062, 1997.
[В паблике:
Монсонего-Орнан Э. , Адар Р., Феферман Т., Сегев О., Яйон А. Трансмембранная мутация G380R в рецепторе 3 фактора роста фибробластов отделяет опосредованную лигандом активацию рецептора от подавления. молек. Клетка. биол. 20: 516-522, 2000.
[В паблике: 10611230]
[Полный текст: https://doi.org/10.1128/MCB.20.2.516-522.2000]
, Адар Р., Феферман Т., Сегев О., Яйон А. Трансмембранная мутация G380R в рецепторе 3 фактора роста фибробластов отделяет опосредованную лигандом активацию рецептора от подавления. молек. Клетка. биол. 20: 516-522, 2000.
[В паблике: 10611230]
[Полный текст: https://doi.org/10.1128/MCB.20.2.516-522.2000]
Мортье, Г. , Найтинк, Л., Краен, М., Ренар, Ж.-П., Лерой, Ж. Г., Де Паэпе, А. Клинические и рентгенологические особенности семьи с гипохондроплазией вследствие новой мутации asn540ser в гене рецептора 3 фактора роста фибробластов. Дж. Мед. Жене. 37: 220-224, 2000.
[В паблике: 10777366]
[Полный текст: https://doi.org/10.1136/jmg.37.3.220]
, Найтинк, Л., Краен, М., Ренар, Ж.-П., Лерой, Ж. Г., Де Паэпе, А. Клинические и рентгенологические особенности семьи с гипохондроплазией вследствие новой мутации asn540ser в гене рецептора 3 фактора роста фибробластов. Дж. Мед. Жене. 37: 220-224, 2000.
[В паблике: 10777366]
[Полный текст: https://doi.org/10.1136/jmg.37.3.220]
Мюнке М. , Грипп К.В., Макдональд-Макгинн Д.М., Гауденц К., Уитакер Л.А., Бартлетт С.П., Марковиц Р.И., Робин Н.Х., Нвокоро Н., Малвихилл Дж.Дж., Лоскен В., Малликен, Дж. Б., Гуттмахер, А. Э., Уилрой, Р. С., Кларк, Л. А., Холлуэй, Г., Адес, Л. К., Хаан, Э. А., Малли, Дж. К., Коэн, М. М., младший, Беллус, Г. А., Франкомано, К. А., Молони, Д. М., Уолл, С. А., Уилки, А. О. М., Закаи, Э. Х. Уникальная точечная мутация в гене рецептора 3 фактора роста фибробластов (FGFR3) определяет новый синдром краниосиностоза. Являюсь. Дж. Хам. Жене. 60: 555-564, 1997.
[В паблике:
, Грипп К.В., Макдональд-Макгинн Д.М., Гауденц К., Уитакер Л.А., Бартлетт С.П., Марковиц Р.И., Робин Н.Х., Нвокоро Н., Малвихилл Дж.Дж., Лоскен В., Малликен, Дж. Б., Гуттмахер, А. Э., Уилрой, Р. С., Кларк, Л. А., Холлуэй, Г., Адес, Л. К., Хаан, Э. А., Малли, Дж. К., Коэн, М. М., младший, Беллус, Г. А., Франкомано, К. А., Молони, Д. М., Уолл, С. А., Уилки, А. О. М., Закаи, Э. Х. Уникальная точечная мутация в гене рецептора 3 фактора роста фибробластов (FGFR3) определяет новый синдром краниосиностоза. Являюсь. Дж. Хам. Жене. 60: 555-564, 1997.
[В паблике:
Наски, М. К., Колвин, Дж. С., Коффин, Дж. Д., Орниц, Д. М. Репрессия передачи сигналов hedgehog и экспрессии BMP4 в хряще пластинки роста с помощью рецептора фактора роста фибробластов 3. Развертка 125:4977-4988, 1998.
[В паблике:
К., Колвин, Дж. С., Коффин, Дж. Д., Орниц, Д. М. Репрессия передачи сигналов hedgehog и экспрессии BMP4 в хряще пластинки роста с помощью рецептора фактора роста фибробластов 3. Развертка 125:4977-4988, 1998.
[В паблике:
82] [Полный текст: https://doi.org/10.1242/dev.125.24.4977]
Наски, М. С., Ван, К., Сюй, Дж., Орниц, Д.М. Постепенная активация рецептора 3 фактора роста фибробластов мутациями, вызывающими ахондроплазию и танатофорную дисплазию. Природа Жене. 13: 233-237, 1996.
[В паблике: 8640234]
[Полный текст: https://doi.org/10.1038/ng0696-233]
С., Ван, К., Сюй, Дж., Орниц, Д.М. Постепенная активация рецептора 3 фактора роста фибробластов мутациями, вызывающими ахондроплазию и танатофорную дисплазию. Природа Жене. 13: 233-237, 1996.
[В паблике: 8640234]
[Полный текст: https://doi.org/10.1038/ng0696-233]
Натаччи Ф. , Баффико М., Каваллари У., Бедески М. Ф., Мура И., Паффони А., Сетти П. Л., Бальди М., Лалатта Ф. Мозаицизм зародышевой линии при ахондроплазии обнаружен в ДНК сперматозоидов отца трех больных сибсов. Являюсь. Дж. Мед. Жене. 146А: 784-786, 2008.
[В паблике: 18266238]
[Полный текст: https://doi.org/10.1002/ajmg.a.32228]
, Баффико М., Каваллари У., Бедески М. Ф., Мура И., Паффони А., Сетти П. Л., Бальди М., Лалатта Ф. Мозаицизм зародышевой линии при ахондроплазии обнаружен в ДНК сперматозоидов отца трех больных сибсов. Являюсь. Дж. Мед. Жене. 146А: 784-786, 2008.
[В паблике: 18266238]
[Полный текст: https://doi.org/10.1002/ajmg.a.32228]
Нисимура Г. , Фукусима Ю., Охаси Х., Икегава С. Атипичные рентгенологические данные при ахондроплазии с редкой мутацией гена рецептора фактора роста фибробластов-3 (FGFR-3) (переход gly в cys в кодоне 375). (Письмо) Являюсь. Дж. Мед. Жене. 59: 393-395, 1995.
[В паблике: 8599370]
[Полный текст: https://doi.org/10.1002/ajmg.13205
, Фукусима Ю., Охаси Х., Икегава С. Атипичные рентгенологические данные при ахондроплазии с редкой мутацией гена рецептора фактора роста фибробластов-3 (FGFR-3) (переход gly в cys в кодоне 375). (Письмо) Являюсь. Дж. Мед. Жене. 59: 393-395, 1995.
[В паблике: 8599370]
[Полный текст: https://doi.org/10.1002/ajmg.13205
Нисимура Г. , Такада Ф. Другое наблюдение атипичных рентгенологических данных при ахондроплазии, не связанное с распространенной мутацией гена FGFR-3: ответ доктору Горлину. (Письмо) Являюсь. Дж. Мед. Жене. 70: 203-205, 1997.
, Такада Ф. Другое наблюдение атипичных рентгенологических данных при ахондроплазии, не связанное с распространенной мутацией гена FGFR-3: ответ доктору Горлину. (Письмо) Являюсь. Дж. Мед. Жене. 70: 203-205, 1997.
Наврузи, Н., Раффиони, С., Ван, Т., Апостол, Б.Л., Брэдшоу, Р.А., Томпсон, Л.М. Для фенотипов танатофорной дисплазии в клетках PC12 требуется устойчивая активация ERK1/2, но не STAT1 или 3. Гум. молек. Жене. 14: 1529-1538, 2005.
[В паблике: 15843401]
[Полный текст: https://doi. org/10.1093/hmg/ddi161]
org/10.1093/hmg/ddi161]
Паннье, С., Мартинович, Дж., Хойертц, С., Делезойд, А.-Л., Мюнних, А., Шиблер, Л., Серр, В., Легеай-Малле, Л. Танатофорная дисплазия, вызванная двойной миссенс-мутацией FGFR3. Являюсь. Дж. Мед. Жене. 149А: 1296-1301, 2009. [В паблике: 1
30]
[Полный текст: https://doi. org/10.1002/ajmg.a.32880]
org/10.1002/ajmg.a.32880]
Пассос-Буэно, М.Р., Уилкокс, В.Р., Джабс, Э.В., Серти, А.Л., Алонсо, Л.Г., Кито, Х. Клинический спектр мутаций рецептора фактора роста фибробластов. Гум. Мутат. 14: 115-125, 1999. Примечание: Опечатка: Hum. Мутат. 17: 431 только, 2001.
[В паблике: 10425034]
[Полный текст: https://doi. org/10.1002/(SICI)1098-1004(1999)14:2<115::AID-HUMU3>3.0.CO;2-2]
org/10.1002/(SICI)1098-1004(1999)14:2<115::AID-HUMU3>3.0.CO;2-2]
Помар-Эрнандес Б., Берже-Сориа Дж., Барросо Э., Ривера-Педроса С.И., Перес-Каррисоса В., Бенито-Санс С., Лопес-Месса Э., Сантос Ф. , Гарсия-Рекуэро, И.И., Романс, А., Бальеста-Мартинес, М.Х., Лопес-Гонсалес, В., Кампос-Баррос, А., Крус, Дж., Гильен-Наварро, Э., Санчес дель Посо, Дж. , Лапунзина П., Гарсия-Минаур С., Хит К.Е. Расширение спектра мутаций у 182 испанских пробандов с краниосиностозом: идентификация и характеристика новых вариантов TCF12. европ. Дж. Хам. Жене. 23: 907-914, 2015.
[В паблике: 25271085]
[Полный текст: https://doi.org/10.1038/ejhg.2014.205]
Дж. Хам. Жене. 23: 907-914, 2015.
[В паблике: 25271085]
[Полный текст: https://doi.org/10.1038/ejhg.2014.205]
Пазнекас В.А., Каннингем М.Л., Ховард Т.Д., Корф Б.Р., Липсон М.Х., Грикс А.В., Фейнгольд М., Голдберг Р., Бороховиц З., Алек К., Малликен Дж., Инь , М., Джабс, Э. У. Генетическая гетерогенность синдрома Сетре-Чотцена, обусловленная мутациями TWIST и FGFR. Являюсь. Дж. Хам. Жене. 62: 1370-1380, 1998.
[В паблике:
Являюсь. Дж. Хам. Жене. 62: 1370-1380, 1998.
[В паблике:
Перес-Кастро А.В., Уилсон Дж., Альтерр М.Р. Геномная организация гена рецептора 3 фактора роста фибробластов человека (FGFR3) и сравнительный анализ последовательности с геном мышиного Fgfr3. Геномика 41: 10-16, 1997.
[В паблике: 76]
[Полный текст: https://doi.org/10.1006/geno.1997.4616]
Геномика 41: 10-16, 1997.
[В паблике: 76]
[Полный текст: https://doi.org/10.1006/geno.1997.4616]
Покхарел Р.К., Алимсарджоно Х., Такэсима Ю., Накамура Х., Наритоми К., Хиросе С., Ониши С., Мацуо М. Японские случаи танатофорной дисплазии типа 1 несут исключительно переход C в T в нуклеотиде 742 гена рецептора 3 фактора роста фибробластов. Биохим. Биофиз. Рез. коммун. 227: 236-239, 1996.
[В паблике: 8858131]
[Полный текст: https://doi.org/10.1006/bbrc.1996.1495]
Биохим. Биофиз. Рез. коммун. 227: 236-239, 1996.
[В паблике: 8858131]
[Полный текст: https://doi.org/10.1006/bbrc.1996.1495]
Принос П., Коста Т., Соммер А., Килпатрик М. В., Ципурас П. Распространенная мутация гена FGFR3 при гипохондроплазии. Гум. молек. Жене. 4: 2097-2101, 1995.
[В паблике: 8589686]
[Полный текст: https://doi.org/10.1093/hmg/4.11.2097]
Гум. молек. Жене. 4: 2097-2101, 1995.
[В паблике: 8589686]
[Полный текст: https://doi.org/10.1093/hmg/4.11.2097]
Принстер К., Каррера П., Дель Маскио М., Вебер Г., Магни М., Вигоне М. К., Мора С., Тонини Г., Ригон Ф., Белуффи Г., Севери Ф., Кьюмелло Г. , Феррари М. Сравнение клинико-рентгенологических и молекулярных данных при гипохондроплазии. Являюсь. Дж. Мед. Жене. 75: 109-112, 1998.
[В паблике:
, Феррари М. Сравнение клинико-рентгенологических и молекулярных данных при гипохондроплазии. Являюсь. Дж. Мед. Жене. 75: 109-112, 1998.
[В паблике:
68] [Полный текст: https://doi.org/10.1002/(sici)1096-8628(19
6)75:1<109::aid-ajmg22>3.0.co;2-p] Рамасвами У. , Рамсби Г., Хиндмарш П. К., Брук С. Г. Д. Генотип и фенотип при гипохондроплазии. Дж. Педиат. 133: 99-102, 1998.
[В паблике:
, Рамсби Г., Хиндмарш П. К., Брук С. Г. Д. Генотип и фенотип при гипохондроплазии. Дж. Педиат. 133: 99-102, 1998.
[В паблике:
Раннан-Элия, С. В., Тейлор, И.Б., де Хеер, И.М., ван ден Оувеланд, А.М.В., Уолл, С.А., Уилки, А.О.М. Отцовское происхождение мутаций FGFR3 при краниосиностозе типа Мюнке. Гум. Жене. 115: 200-207, 2004.
[В паблике: 15241680]
[Полный текст: https://doi.org/10.1007/s00439-004-1151-5]
В., Тейлор, И.Б., де Хеер, И.М., ван ден Оувеланд, А.М.В., Уолл, С.А., Уилки, А.О.М. Отцовское происхождение мутаций FGFR3 при краниосиностозе типа Мюнке. Гум. Жене. 115: 200-207, 2004.
[В паблике: 15241680]
[Полный текст: https://doi.org/10.1007/s00439-004-1151-5]
Расмуссен Т. , Хадлебуш Х. Р., Кнудсен Л. М., Йонсен Х. Э. Дисрегуляция FGFR3 при множественной миеломе: частота и прогностическое значение. Брит. Дж. Хэмат. 117: 626-628, 2002.
[В паблике: 12028033]
[Полный текст: https://doi.org/10.1046/j.1365-2141.2002.03429.Икс]
, Хадлебуш Х. Р., Кнудсен Л. М., Йонсен Х. Э. Дисрегуляция FGFR3 при множественной миеломе: частота и прогностическое значение. Брит. Дж. Хэмат. 117: 626-628, 2002.
[В паблике: 12028033]
[Полный текст: https://doi.org/10.1046/j.1365-2141.2002.03429.Икс]
Рирдон, В. , Уилкс, Д., Ратленд, П., Пуллейн, Л.Дж., Малкольм, С., Дин, Дж.К.С., Эванс, Р.Д., Джонс, Б.М., Хейворд, Р., Холл, К.М., Невин, Н.К., Барайтсер , М., Винтер, Р. М. Краниосиностоз, связанный с мутацией pro250-to-arg в FGFR3, приводит к ряду клинических проявлений, включая спорадический одношовный краниосиностоз. Дж. Мед. Жене. 34: 632-636, 1997.
[В паблике:
, Уилкс, Д., Ратленд, П., Пуллейн, Л.Дж., Малкольм, С., Дин, Дж.К.С., Эванс, Р.Д., Джонс, Б.М., Хейворд, Р., Холл, К.М., Невин, Н.К., Барайтсер , М., Винтер, Р. М. Краниосиностоз, связанный с мутацией pro250-to-arg в FGFR3, приводит к ряду клинических проявлений, включая спорадический одношовный краниосиностоз. Дж. Мед. Жене. 34: 632-636, 1997.
[В паблике:
Райли Б. М., Мансилла М.А., Ма Дж., Даак-Хирш С., Махер Б.С., Раффенспергер Л.М., Руссо Э.Т., Виейра А.Р., Доде К., Мохаммади М., Маразита М.Л., Мюррей, Дж. К. Нарушение передачи сигналов FGF способствует расщелине губы и неба. проц. Нац. акад. науч. 104: 4512-4517, 2007.
[В паблике: 17360555]
[Полный текст: https://doi.org/10.1073/pnas.0607
М., Мансилла М.А., Ма Дж., Даак-Хирш С., Махер Б.С., Раффенспергер Л.М., Руссо Э.Т., Виейра А.Р., Доде К., Мохаммади М., Маразита М.Л., Мюррей, Дж. К. Нарушение передачи сигналов FGF способствует расщелине губы и неба. проц. Нац. акад. науч. 104: 4512-4517, 2007.
[В паблике: 17360555]
[Полный текст: https://doi.org/10.1073/pnas.0607
4]
Робин, Н. Х., Скотт, Дж. А., Коэн, А. Р., Гольдштейн, Дж. А. Непенетрантность при синдроме коронарного синостоза, связанном с FGFR3. (Письмо) Являюсь. Дж. Мед. Жене. 80: 296-297, 1998.
[В паблике:
Х., Скотт, Дж. А., Коэн, А. Р., Гольдштейн, Дж. А. Непенетрантность при синдроме коронарного синостоза, связанном с FGFR3. (Письмо) Являюсь. Дж. Мед. Жене. 80: 296-297, 1998.
[В паблике:
59]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1998&volume=80&issue=3&spage=296]
Романн Э. , Бруннер Х.Г., Кайсерили Х., Уйгунер О., Нюрнберг Г., Лью Э.Д., Добби А., Эсваракумар В.П., Узумджу А., Улубил-Эмероглу М., Лерой , Дж. Г., Ли, Ю., и 9другие. Мутации в различных компонентах передачи сигналов FGF при синдроме LADD. Природа Жене. 38: 414-417, 2006. Примечание: опечатка: Nature Genet. 38: только 495, 2006 г.
[В паблике: 16501574]
[Полный текст: https://doi.org/10.1038/ng1757]
, Бруннер Х.Г., Кайсерили Х., Уйгунер О., Нюрнберг Г., Лью Э.Д., Добби А., Эсваракумар В.П., Узумджу А., Улубил-Эмероглу М., Лерой , Дж. Г., Ли, Ю., и 9другие. Мутации в различных компонентах передачи сигналов FGF при синдроме LADD. Природа Жене. 38: 414-417, 2006. Примечание: опечатка: Nature Genet. 38: только 495, 2006 г.
[В паблике: 16501574]
[Полный текст: https://doi.org/10.1038/ng1757]
Роскиоли Т. , Фланаган С., Мортимор Р. Дж., Кумар П., Уидон Д., Мазел Дж., Левандовски Р., Хайланд В., Гласс И. А. Преждевременный синостоз свода черепа и эпидермальная гиперплазия (аномалии, подобные синдрому Беара-Стивенсона), возникающие в результате миссенс-мутации P250R в гене, кодирующем рецептор фактора роста фибробластов 3. Являюсь. Дж. Мед. Жене. 101: 187-194, 2001.
[В паблике: 11424131]
[Полный текст: https://doi.org/10.1002/ajmg.1369]
, Фланаган С., Мортимор Р. Дж., Кумар П., Уидон Д., Мазел Дж., Левандовски Р., Хайланд В., Гласс И. А. Преждевременный синостоз свода черепа и эпидермальная гиперплазия (аномалии, подобные синдрому Беара-Стивенсона), возникающие в результате миссенс-мутации P250R в гене, кодирующем рецептор фактора роста фибробластов 3. Являюсь. Дж. Мед. Жене. 101: 187-194, 2001.
[В паблике: 11424131]
[Полный текст: https://doi.org/10.1002/ajmg.1369]
Руссо Ф. , Бонавентура Ж., Леге-Малле Л., Пеле А., Розе Ж.-М., Марото П., Ле Меррер М., Миних А. Мутации в гене, кодирующем рецептор фактора роста фибробластов-3, при ахондроплазии. Природа 371: 252-254, 1994.
[В паблике: 8078586]
[Полный текст: https://doi.org/10.1038/371252a0]
, Бонавентура Ж., Леге-Малле Л., Пеле А., Розе Ж.-М., Марото П., Ле Меррер М., Миних А. Мутации в гене, кодирующем рецептор фактора роста фибробластов-3, при ахондроплазии. Природа 371: 252-254, 1994.
[В паблике: 8078586]
[Полный текст: https://doi.org/10.1038/371252a0]
Руссо Ф. , Эль Гуцци В., Делезойд А. Л., Легеай-Малле Л., Ле Меррер М., Миних А., Бонавентура Дж. мутаций Missense FGFR3 создают остатки цистеина при танатофорной карликовости типа I (TD1). Гум. молек. Жене. 5: 509-512, 1996.
[В паблике: 8845844]
[Полный текст: https://doi.org/10.1093/hmg/5.4.509]
, Эль Гуцци В., Делезойд А. Л., Легеай-Малле Л., Ле Меррер М., Миних А., Бонавентура Дж. мутаций Missense FGFR3 создают остатки цистеина при танатофорной карликовости типа I (TD1). Гум. молек. Жене. 5: 509-512, 1996.
[В паблике: 8845844]
[Полный текст: https://doi.org/10.1093/hmg/5.4.509]
Руссо Ф. , Сожье П., Ле Меррер М., Миних А., Делезойд А.-Л., Марото П., Бонавентура Дж., Нарси Ф., Санак М. Мутации стоп-кодона FGFR3 при танатофорной карликовости типа 1. Природа Жене. 10:11-12, 1995.
[В паблике: 7647778]
[Полный текст: https://doi.org/10.1038/ng0595-11]
, Сожье П., Ле Меррер М., Миних А., Делезойд А.-Л., Марото П., Бонавентура Дж., Нарси Ф., Санак М. Мутации стоп-кодона FGFR3 при танатофорной карликовости типа 1. Природа Жене. 10:11-12, 1995.
[В паблике: 7647778]
[Полный текст: https://doi.org/10.1038/ng0595-11]
Румп П. , Леттебур Т.Г.В., Гилле Дж.Дж.П., Торринга М.Дж.Л., Бэртс В., ван Гестель Дж.П.Дж., Верхейдж Дж.Б.Г.М., ван Эссен А.Дж. Тяжелые осложнения у ребенка с ахондроплазией и двумя мутациями FGFR3 на одном и том же аллеле. Являюсь. Дж. Мед. Жене. 140А: 284-290, 2006.
[В паблике: 16411219]
[Полный текст: https://doi.org/10.1002/ajmg.a.31084]
, Леттебур Т.Г.В., Гилле Дж.Дж.П., Торринга М.Дж.Л., Бэртс В., ван Гестель Дж.П.Дж., Верхейдж Дж.Б.Г.М., ван Эссен А.Дж. Тяжелые осложнения у ребенка с ахондроплазией и двумя мутациями FGFR3 на одном и том же аллеле. Являюсь. Дж. Мед. Жене. 140А: 284-290, 2006.
[В паблике: 16411219]
[Полный текст: https://doi.org/10.1002/ajmg.a.31084]
Сайто Х. , Секизава А., Моримото Т., Судзуки М., Янаихара Т. Пренатальная ДНК-диагностика моногенного заболевания из материнской плазмы. Ланцет 356: только 1170, 2000.
[В паблике: 11030304]
[Полный текст: https://doi.org/10.1016/S0140-6736(00)02767-7]
, Секизава А., Моримото Т., Судзуки М., Янаихара Т. Пренатальная ДНК-диагностика моногенного заболевания из материнской плазмы. Ланцет 356: только 1170, 2000.
[В паблике: 11030304]
[Полный текст: https://doi.org/10.1016/S0140-6736(00)02767-7]
Салазар Л. , Кашивада Т., Крейчи П., Муховски П., Донохью Д., Уилкокс В. Р., Томпсон Л. М. Новое взаимодействие между рецептором 3 фактора роста фибробластов и субъединицей p85 фосфоинозитид-3-киназы: зависимая от активации регуляция ERK с помощью p85 в клетках множественной миеломы. Гум. молек. Жене. 18: 1951-1961, 2009.
[В паблике: 1
, Кашивада Т., Крейчи П., Муховски П., Донохью Д., Уилкокс В. Р., Томпсон Л. М. Новое взаимодействие между рецептором 3 фактора роста фибробластов и субъединицей p85 фосфоинозитид-3-киназы: зависимая от активации регуляция ERK с помощью p85 в клетках множественной миеломы. Гум. молек. Жене. 18: 1951-1961, 2009.
[В паблике: 1
72] [Полный текст: https://doi.org/10.1093/hmg/ddp116]
Савай Х. , Комори С., Ида А., Хенми Т., Бессё Т., Кояма К. Пренатальная диагностика танатофорной дисплазии с помощью мутационного анализа гена рецептора 3 фактора роста фибробластов и предложенной коррекции ранее опубликованных результатов ПЦР. Пренатальная диагностика 19: 21-24, 1999.
[В паблике: 10073901]
[Полный текст: https://doi.org/10.1002/(sici)1097-0223(199901)19:1<21::aid-pd457>3.0.co;2-5]
, Комори С., Ида А., Хенми Т., Бессё Т., Кояма К. Пренатальная диагностика танатофорной дисплазии с помощью мутационного анализа гена рецептора 3 фактора роста фибробластов и предложенной коррекции ранее опубликованных результатов ПЦР. Пренатальная диагностика 19: 21-24, 1999.
[В паблике: 10073901]
[Полный текст: https://doi.org/10.1002/(sici)1097-0223(199901)19:1<21::aid-pd457>3.0.co;2-5]
Скоттет, Э. , Уссен, Э. Выбор между альтернативными экзонами IIIb и IIIc гена FGFR-3 не является строго тканеспецифическим. Биохим. Биофиз. Акта 1264: 238-242, 1995.
[В паблике: 74
, Уссен, Э. Выбор между альтернативными экзонами IIIb и IIIc гена FGFR-3 не является строго тканеспецифическим. Биохим. Биофиз. Акта 1264: 238-242, 1995.
[В паблике: 74
Шианг Р. , Томпсон Л. М., Чжу Ю.-З., Черч Д. М., Филдер Т. Дж., Боциан М., Винокур С. Т., Васмут Дж. Дж. Мутации в трансмембранном домене FGFR3 вызывают наиболее распространенную генетическую форму карликовости, ахондроплазию. Ячейка 78: 335-342, 1994.
[В паблике: 7
, Томпсон Л. М., Чжу Ю.-З., Черч Д. М., Филдер Т. Дж., Боциан М., Винокур С. Т., Васмут Дж. Дж. Мутации в трансмембранном домене FGFR3 вызывают наиболее распространенную генетическую форму карликовости, ахондроплазию. Ячейка 78: 335-342, 1994.
[В паблике: 7
Симидзу А. , Тада К., Шукунами К., Хираки Ю., Курокава Т., Магане Н., Курокава-Сео М. Новая изоформа рецептора 3 фактора роста фибробластов с альтернативным сплайсингом, лишенная домена кислотного бокса, экспрессируется во время хондрогенной дифференцировки клеток ATDC5. Дж. Биол. хим. 276: 11031-11040, 2001.
[В паблике: 11134040]
[Полный текст: https://doi.org/10.1074/jbc.M003535200]
, Тада К., Шукунами К., Хираки Ю., Курокава Т., Магане Н., Курокава-Сео М. Новая изоформа рецептора 3 фактора роста фибробластов с альтернативным сплайсингом, лишенная домена кислотного бокса, экспрессируется во время хондрогенной дифференцировки клеток ATDC5. Дж. Биол. хим. 276: 11031-11040, 2001.
[В паблике: 11134040]
[Полный текст: https://doi.org/10.1074/jbc.M003535200]
Симидзу А. , Такашима Ю., Курокава-Сео М. изоформ FGFR3 выполняют различные функции в регуляции роста и морфологии клеток. Биохим. Биофиз. Рез. коммун. 290: 113-120, 2002.
[В паблике: 11779141]
[Полный текст: https://doi.org/10.1006/bbrc.2001.6190]
, Такашима Ю., Курокава-Сео М. изоформ FGFR3 выполняют различные функции в регуляции роста и морфологии клеток. Биохим. Биофиз. Рез. коммун. 290: 113-120, 2002.
[В паблике: 11779141]
[Полный текст: https://doi.org/10.1006/bbrc.2001.6190]
Сибли, К. , Катберт-Хэвенс, Д., Ноулз, М. А. Потеря гетерозиготности по 4p16.3 и мутация FGFR3 при переходно-клеточной карциноме. Онкоген 20: 686-691, 2001.
[В паблике: 11314002]
[Полный текст: https://doi.org/10.1038/sj.onc.1204110]
, Катберт-Хэвенс, Д., Ноулз, М. А. Потеря гетерозиготности по 4p16.3 и мутация FGFR3 при переходно-клеточной карциноме. Онкоген 20: 686-691, 2001.
[В паблике: 11314002]
[Полный текст: https://doi.org/10.1038/sj.onc.1204110]
Сингх Д. , Чан Дж. М., Зопполи П., Ниола Ф., Салливан Р., Кастано А., Лю Э. М., Райхель Дж., Поррати П., Пеллегатта С., Цю, К., Гао З. и еще 12 человек. Трансформирующие слияния генов FGFR и TACC в глиобластоме человека. Наука 337: 1231-1235, 2012.
[Пубмед: 22837387]
[Полный текст: https://doi.org/10.1126/science.1220834]
, Чан Дж. М., Зопполи П., Ниола Ф., Салливан Р., Кастано А., Лю Э. М., Райхель Дж., Поррати П., Пеллегатта С., Цю, К., Гао З. и еще 12 человек. Трансформирующие слияния генов FGFR и TACC в глиобластоме человека. Наука 337: 1231-1235, 2012.
[Пубмед: 22837387]
[Полный текст: https://doi.org/10.1126/science.1220834]
Собецко Д. , Брага С., Рудеберг А., Суперти-Фурга А. Ахондроплазия с мутацией FGFR3 1138g-a (G380R) у двух братьев и сестер, имеющих общий гаплотип 4p, полученный от их здорового отца. (Письмо) Дж. Мед. Жене. 37: 958-959, 2000.
[В паблике: 11186940]
[Полный текст: https://doi.org/10.1136/jmg.37.12.958]
, Брага С., Рудеберг А., Суперти-Фурга А. Ахондроплазия с мутацией FGFR3 1138g-a (G380R) у двух братьев и сестер, имеющих общий гаплотип 4p, полученный от их здорового отца. (Письмо) Дж. Мед. Жене. 37: 958-959, 2000.
[В паблике: 11186940]
[Полный текст: https://doi.org/10.1136/jmg.37.12.958]
Спрангер, Дж. Костная дисплазия «семейства». Дорожка. Иммунопат. Рез. 7: 76-80, 1988.
[В паблике: 3222210]
[Полный текст: https://doi.org/10.1159/000157098]
Костная дисплазия «семейства». Дорожка. Иммунопат. Рез. 7: 76-80, 1988.
[В паблике: 3222210]
[Полный текст: https://doi.org/10.1159/000157098]
Су, Н., Сунь, К., Ли, Ц., Лу, Х., Ци, Х., Чен, С. , Ян, Дж., Ду, Х., Чжао, Л., Хэ, К., Джин М., Шен Ю., Чен Д., Чен Л. Мутация с приобретением функции в FGFR3 у мышей приводит к снижению костной массы, влияя как на остеобластогенез, так и на остеокластогенез. Гум. молек. Жене. 19: 1199-1210, 2010.
[Пубмед: 20053668]
[Полный текст: https://doi.org/10.1093/hmg/ddp590]
, Ян, Дж., Ду, Х., Чжао, Л., Хэ, К., Джин М., Шен Ю., Чен Д., Чен Л. Мутация с приобретением функции в FGFR3 у мышей приводит к снижению костной массы, влияя как на остеобластогенез, так и на остеокластогенез. Гум. молек. Жене. 19: 1199-1210, 2010.
[Пубмед: 20053668]
[Полный текст: https://doi.org/10.1093/hmg/ddp590]
Вс, В. -К. С., Китагава М., Сюэ Н., Се Б., Гарофало С., Чо Дж., Денг С., Хортон В. А., Фу X.-Y. Активация Stat1 мутантным рецептором фактора роста фибробластов при карликовости танатофорной дисплазии II типа. Природа 386: 288-292, 1997.
[В паблике:
-К. С., Китагава М., Сюэ Н., Се Б., Гарофало С., Чо Дж., Денг С., Хортон В. А., Фу X.-Y. Активация Stat1 мутантным рецептором фактора роста фибробластов при карликовости танатофорной дисплазии II типа. Природа 386: 288-292, 1997.
[В паблике:
Су, Ю. -Н., Ли, К.-Н., Чиен, С.-К., Хунг, К.-К., Чиен, Ю.-Х., Чен, К.-А. Быстрое обнаружение мутации гена FGFR3 при ахондроплазии с помощью анализа гетеродуплекса, связывающего систему ДВЭЖХ, и анализа удлинения праймера с усилением флуоресценции. Дж. Хам. Жене. 49: 399-403, 2004.
[В паблике: 15221641]
[Полный текст: https://doi.org/10.1007/s10038-004-0165-0]
-Н., Ли, К.-Н., Чиен, С.-К., Хунг, К.-К., Чиен, Ю.-Х., Чен, К.-А. Быстрое обнаружение мутации гена FGFR3 при ахондроплазии с помощью анализа гетеродуплекса, связывающего систему ДВЭЖХ, и анализа удлинения праймера с усилением флуоресценции. Дж. Хам. Жене. 49: 399-403, 2004.
[В паблике: 15221641]
[Полный текст: https://doi.org/10.1007/s10038-004-0165-0]
Суперти-Фурга, А. , Эйх, Г., Бухер, Х.У., Виссер, Дж., Гидион, А., Гитцельманн, Р., Штейнманн, Б. Замена глицина 375 на цистеин в трансмембранном домене рецептора фактора роста фибробластов-3 у новорожденного с ахондроплазией. европ. Дж. Педиат. 154: 215-219, 1995.
[В паблике: 7758520]
[Полный текст: https://doi.org/10.1007/BF01
, Эйх, Г., Бухер, Х.У., Виссер, Дж., Гидион, А., Гитцельманн, Р., Штейнманн, Б. Замена глицина 375 на цистеин в трансмембранном домене рецептора фактора роста фибробластов-3 у новорожденного с ахондроплазией. европ. Дж. Педиат. 154: 215-219, 1995.
[В паблике: 7758520]
[Полный текст: https://doi.org/10.1007/BF01
Сабо, Дж. , Беллус, Г. А., Каитила, И., Франкомано, К. А. Мутации рецептора 3 фактора роста фибробластов (FGFR3) в спорадических случаях ахондроплазии происходят исключительно на отцовской хромосоме. (Аннотация) Являюсь. Дж. Хам. Жене. 59 (дополнение): только A287, 1996 г.
, Беллус, Г. А., Каитила, И., Франкомано, К. А. Мутации рецептора 3 фактора роста фибробластов (FGFR3) в спорадических случаях ахондроплазии происходят исключительно на отцовской хромосоме. (Аннотация) Являюсь. Дж. Хам. Жене. 59 (дополнение): только A287, 1996 г.
Талеби Ф., Ганбари Мардаси Ф., Мохаммади Асл Дж., Баварсад А. Х., Тизно С. Идентификация новой миссенс-мутации в гене FGFR3 в иранской семье с синдромом LADD с помощью секвенирования нового поколения. Междунар. Дж. Педиат. Оториноларинг. 97: 192-196, 2017.
[В паблике: 28483234]
[Полный текст: https://doi.org/10.1016/j.ijporl.2017.04.016]
Дж. Педиат. Оториноларинг. 97: 192-196, 2017.
[В паблике: 28483234]
[Полный текст: https://doi.org/10.1016/j.ijporl.2017.04.016]
Тавормина, П.Л., Беллус, Г.А., Вебстер, М.К., Бамшад, М.Дж., Фрэйли, А.Е., Макинтош, И., Сабо, Дж., Цзян, В., Джабс, Э.В., Уилкокс, В.Р., Васмут, Дж.Дж., Донохью, Д.Дж. , Томпсон Л. М., Франкомано С.А. Новая скелетная дисплазия с задержкой развития и черным акантозом вызвана мутацией lys650-to-met в гене рецептора 3 фактора роста фибробластов. Являюсь. Дж. Хам. Жене. 64: 722-731, 1999.
[В паблике: 10053006]
[Полный текст: https://doi.org/10.1086/302275]
М., Франкомано С.А. Новая скелетная дисплазия с задержкой развития и черным акантозом вызвана мутацией lys650-to-met в гене рецептора 3 фактора роста фибробластов. Являюсь. Дж. Хам. Жене. 64: 722-731, 1999.
[В паблике: 10053006]
[Полный текст: https://doi.org/10.1086/302275]
Тавормина П. Л., Римойн Д.Л., Кон Д.Х., Чжу Ю.-З., Шианг Р., Васмут Дж.Дж. Другая мутация, приводящая к замене неспаренного цистеинового остатка во внеклеточном домене FGFR3 при танатофорной дисплазии типа I. Гум. молек. Жене. 4: 2175-2177, 1995.
[В паблике: 8589699]
[Полный текст: https://doi.org/10.1093/hmg/4.11.2175]
Л., Римойн Д.Л., Кон Д.Х., Чжу Ю.-З., Шианг Р., Васмут Дж.Дж. Другая мутация, приводящая к замене неспаренного цистеинового остатка во внеклеточном домене FGFR3 при танатофорной дисплазии типа I. Гум. молек. Жене. 4: 2175-2177, 1995.
[В паблике: 8589699]
[Полный текст: https://doi.org/10.1093/hmg/4.11.2175]
Тавормина П. Л., Шианг Р., Томпсон Л.М., Чжу Ю.-З., Уилкин Д.Дж., Лахман Р.С., Уилкокс В.Р., Римуан Д.Л., Кон Д.Х., Васмут Дж.Дж. Танатофорная дисплазия (типы I и II), вызванная отчетливыми мутациями в рецепторе фактора роста фибробластов 3. Природа Жене. 9: 321-328, 1995.
[В паблике: 7773297]
[Полный текст: https://doi.org/10.1038/ng0395-321]
Л., Шианг Р., Томпсон Л.М., Чжу Ю.-З., Уилкин Д.Дж., Лахман Р.С., Уилкокс В.Р., Римуан Д.Л., Кон Д.Х., Васмут Дж.Дж. Танатофорная дисплазия (типы I и II), вызванная отчетливыми мутациями в рецепторе фактора роста фибробластов 3. Природа Жене. 9: 321-328, 1995.
[В паблике: 7773297]
[Полный текст: https://doi.org/10.1038/ng0395-321]
Товен-Робине, К. , Фавр, Л., Левин, П., Де Монлеон, Ж.-В., Франсуа, К., Юэ, Ф., Куайе, Ж.-Ф., Кампос-Ксавьер, А.Б., Бонавентура Дж., Ле Меррер М. Гипохондроплазия и рост в пределах нормы: еще одна семья с мутацией asn540-to-ser в гене рецептора 3 фактора роста фибробластов. (Письмо) Являюсь. Дж. Мед. Жене. 119А: 81-84, 2003.
[В паблике: 12707965]
[Полный текст: https://doi.org/10.1002/ajmg.a.10238]
, Фавр, Л., Левин, П., Де Монлеон, Ж.-В., Франсуа, К., Юэ, Ф., Куайе, Ж.-Ф., Кампос-Ксавьер, А.Б., Бонавентура Дж., Ле Меррер М. Гипохондроплазия и рост в пределах нормы: еще одна семья с мутацией asn540-to-ser в гене рецептора 3 фактора роста фибробластов. (Письмо) Являюсь. Дж. Мед. Жене. 119А: 81-84, 2003.
[В паблике: 12707965]
[Полный текст: https://doi.org/10.1002/ajmg.a.10238]
Томпсон, Л. М., Пламмер, С., Шаллинг, М., Альтерр, М. Р., Гузелла, Дж. Ф., Хаусман, Д. Э., Васмут, Дж. Дж. Ген, кодирующий рецептор фактора роста фибробластов, выделенный из области гена болезни Гентингтона на хромосоме 4 человека. Геномика 11: 1133-1142, 1991.
[В паблике: 1664411]
[Полный текст: https://doi.org/10.1016/0888-7543(91)
М., Пламмер, С., Шаллинг, М., Альтерр, М. Р., Гузелла, Дж. Ф., Хаусман, Д. Э., Васмут, Дж. Дж. Ген, кодирующий рецептор фактора роста фибробластов, выделенный из области гена болезни Гентингтона на хромосоме 4 человека. Геномика 11: 1133-1142, 1991.
[В паблике: 1664411]
[Полный текст: https://doi.org/10.1016/0888-7543(91)
Тойдемир Р. М., Брассингтон А. Э., Байрак-Тойдемир П., Краковяк П. А., Джорде Л. Б., Уитби Ф. Г., Лонго Н., Вискочил Д. Х., Кэри Дж. К., Бамшад М. Дж. Новая мутация в FGFR3 вызывает синдром камптодактилии, высокого роста и потери слуха (CATSHL). Являюсь. Дж. Хам. Жене. 79: 935-941, 2006.
[В паблике: 17033969]
[Полный текст: https://doi.org/10.1086/508433]
М., Брассингтон А. Э., Байрак-Тойдемир П., Краковяк П. А., Джорде Л. Б., Уитби Ф. Г., Лонго Н., Вискочил Д. Х., Кэри Дж. К., Бамшад М. Дж. Новая мутация в FGFR3 вызывает синдром камптодактилии, высокого роста и потери слуха (CATSHL). Являюсь. Дж. Хам. Жене. 79: 935-941, 2006.
[В паблике: 17033969]
[Полный текст: https://doi.org/10.1086/508433]
Цай, Ф. -Дж., Цай, К.-Х., Чанг, Дж.-Г., Ву, Дж.-Ю. Мутации в рецепторе 3 фактора роста фибробластов (FGFR3) вызывают ахондроплазию, гипохондроплазию и танатофорную дисплазию: тайваньские данные. (Письмо) Являюсь. Дж. Мед. Жене. 86: 300-301, 1999.
[В паблике: 10482885]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=86&issue=3&spage=300]
-Дж., Цай, К.-Х., Чанг, Дж.-Г., Ву, Дж.-Ю. Мутации в рецепторе 3 фактора роста фибробластов (FGFR3) вызывают ахондроплазию, гипохондроплазию и танатофорную дисплазию: тайваньские данные. (Письмо) Являюсь. Дж. Мед. Жене. 86: 300-301, 1999.
[В паблике: 10482885]
[Полный текст: https://onlinelibrary.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=0148-7299&date=1999&volume=86&issue=3&spage=300]
Цай, Ф. -Дж., Ву, Дж.-Ю., Цай, К.-Х., Чанг, Дж.-Г. Идентификация распространенной мутации N540K у 8 из 18 тайваньских пациентов с гипохондроплазией: дополнительные доказательства генетической гетерогенности. (Письмо) клин. Жене. 55: 279-280, 1999.
[Пубмед: 10361991]
[Полный текст: https://doi.org/10.1034/j.1399-0004.1999.550412.x]
-Дж., Ву, Дж.-Ю., Цай, К.-Х., Чанг, Дж.-Г. Идентификация распространенной мутации N540K у 8 из 18 тайваньских пациентов с гипохондроплазией: дополнительные доказательства генетической гетерогенности. (Письмо) клин. Жене. 55: 279-280, 1999.
[Пубмед: 10361991]
[Полный текст: https://doi.org/10.1034/j.1399-0004.1999.550412.x]
Вальверде-Франко, Г. , Лю, Х., Дэвидсон, Д., Чай, С., Вальдеррама-Карвахаль, Х., Гольцман, Д., Орниц, Д. М., Хендерсон, Дж. Э. Дефектная минерализация костей и остеопения у молодых взрослых мышей FGFR3 -/-. Гум. молек. Жене. 13: 271-284, 2004.
[В паблике: 14681299]
[Полный текст: https://doi.org/10.1093/hmg/ddh034]
, Лю, Х., Дэвидсон, Д., Чай, С., Вальдеррама-Карвахаль, Х., Гольцман, Д., Орниц, Д. М., Хендерсон, Дж. Э. Дефектная минерализация костей и остеопения у молодых взрослых мышей FGFR3 -/-. Гум. молек. Жене. 13: 271-284, 2004.
[В паблике: 14681299]
[Полный текст: https://doi.org/10.1093/hmg/ddh034]
Ван Эш, Х. , Фринс, Дж. П. Acanthosis nigricans у мальчика с ахондроплазией, вызванной классической мутацией gly380arg в FGFR3. Жене. Советник. 15: 375-377, 2004.
[В паблике: 15517832]
, Фринс, Дж. П. Acanthosis nigricans у мальчика с ахондроплазией, вызванной классической мутацией gly380arg в FGFR3. Жене. Советник. 15: 375-377, 2004.
[В паблике: 15517832]
фон Гернет С., Шуффенхауэр С., Голла А., Лихтнер П., Балг С., Мюльбауэр В., Муркен Дж., Фэрли Дж., Мейтингер Т. Краниосиностоз, наводящий на мысль о синдроме Сетре-Чотцена: клиническое описание большого родства и исключение областей-кандидатов на 7p. Являюсь. Дж. Мед. Жене. 63: 177-184, 1996.
[В паблике: 8723106]
[Полный текст: https://doi.org/10.1002/(SICI)1096-8628(19
Являюсь. Дж. Мед. Жене. 63: 177-184, 1996.
[В паблике: 8723106]
[Полный текст: https://doi.org/10.1002/(SICI)1096-8628(19
3)63:1<177::AID-AJMG31>3.0.CO;2-J]
Ван, Х., Сунь, Ю., Ву, В., Вэй, X., Лан, З., Се, Дж. Новая миссенс-мутация FGFR3 у китаянки и ее плода с гипохондроплазией в результате секвенирования нового поколения. клин. Чим. Акта 423: 62-65, 2013.
[В паблике: 23726269]
[Полный текст: https://doi.org/10.1016/j.cca.2013.04.015]
клин. Чим. Акта 423: 62-65, 2013.
[В паблике: 23726269]
[Полный текст: https://doi.org/10.1016/j.cca.2013.04.015]
Уилкокс В. Р., Тавормина П. Л., Краков Д., Кито Х., Лахман Р. С., Васмут Дж. Дж., Томпсон Л. М., Римуан Д. Л. Молекулярные, радиологические и гистопатологические корреляции при танатофорной дисплазии. Являюсь. Дж. Мед. Жене. 78: 274-281, 1998.
[В паблике:
Являюсь. Дж. Мед. Жене. 78: 274-281, 1998.
[В паблике:
66] [Полный текст: https://doi.org/10.1002/(sici)1096-8628(19
7)78:3<274::aid-ajmg14>3.0.co;2-c] Уилки, А. О. М., Бочукова, Э. Г., Хансен, Р. М. С., Тейлор, И. Б., Раннан-Элия, С. В., Байрен, Дж. К., Уолл, С. А., Рамос, Л., Венансио, М., Херст, Дж. А., О’Рурк, А. В., Уильямс Л.Дж., Селлер А., Лестер Т. Клинические дивиденды молекулярно-генетической диагностики краниосиностоза. Являюсь. Дж. Мед. Жене. 143А: 1941-1949, 2007. Примечание: переиздание с исправлением статьи, первоначально опубликованной в Am. Дж. Мед. Жене. 140А: 2631-2639, 2006.
[В паблике: 17621648]
[Полный текст: https://doi.org/10.1002/ajmg.a.31905]
К., Уолл, С. А., Рамос, Л., Венансио, М., Херст, Дж. А., О’Рурк, А. В., Уильямс Л.Дж., Селлер А., Лестер Т. Клинические дивиденды молекулярно-генетической диагностики краниосиностоза. Являюсь. Дж. Мед. Жене. 143А: 1941-1949, 2007. Примечание: переиздание с исправлением статьи, первоначально опубликованной в Am. Дж. Мед. Жене. 140А: 2631-2639, 2006.
[В паблике: 17621648]
[Полный текст: https://doi.org/10.1002/ajmg.a.31905]
Уилки, А. О.М., Байрен, Дж.К., Херст, Дж.А., Джаямохан, Дж., Джонсон, Д., Найт, С.Дж.Л., Лестер, Т., Ричардс, П.Г., Твигг, С.Р.Ф., Уолл, С.А. Распространенность и осложнения моногенных и хромосомных нарушений при краниосиностозах. Педиатрия 126: e391-e400, 2010.
[Пубмед: 20643727]
[Полный текст: https://doi.org/10.1542/peds.2009-3491]
О.М., Байрен, Дж.К., Херст, Дж.А., Джаямохан, Дж., Джонсон, Д., Найт, С.Дж.Л., Лестер, Т., Ричардс, П.Г., Твигг, С.Р.Ф., Уолл, С.А. Распространенность и осложнения моногенных и хромосомных нарушений при краниосиностозах. Педиатрия 126: e391-e400, 2010.
[Пубмед: 20643727]
[Полный текст: https://doi.org/10.1542/peds.2009-3491]
Уилки, А. О.М. Краниосиностоз: гены и механизмы. Гум. молек. Жене. 6: 1647-1656, 1997.
[В паблике: 56]
[Полный текст: https://doi.org/10.1093/hmg/6.10.1647]
О.М. Краниосиностоз: гены и механизмы. Гум. молек. Жене. 6: 1647-1656, 1997.
[В паблике: 56]
[Полный текст: https://doi.org/10.1093/hmg/6.10.1647]
Выробек, А. Дж., Эскенази, Б., Янг, С. , Арнхейм, Н., Тиманн-Боге, И., Джабс, Э. У., Глейзер, Р. Л., Пирсон, Ф. С., Эвенсон, Д. Старение по-разному влияет на повреждение ДНК, целостность хроматина, генные мутации и анеуплоидии в сперме. проц. Нац. акад. науч. 103: 9601-9606, 2006.
[В паблике: 16766665]
[Полный текст: https://doi.org/10.1073/pnas.0506468103]
, Арнхейм, Н., Тиманн-Боге, И., Джабс, Э. У., Глейзер, Р. Л., Пирсон, Ф. С., Эвенсон, Д. Старение по-разному влияет на повреждение ДНК, целостность хроматина, генные мутации и анеуплоидии в сперме. проц. Нац. акад. науч. 103: 9601-9606, 2006.
[В паблике: 16766665]
[Полный текст: https://doi.org/10.1073/pnas.0506468103]
Ямасита А. , Мориока М., Киши Х., Кимура Т., Яхара Ю., Окада М., Фудзита К., Савай Х., Икегава С., Цумаки Н. Лечение статинами восстанавливает фенотипы скелетной дисплазии FGFR3. Природа 513: 507-511, 2014.
[В паблике: 25231866]
[Полный текст: https://doi.org/10.1038/nature13775]
, Мориока М., Киши Х., Кимура Т., Яхара Ю., Окада М., Фудзита К., Савай Х., Икегава С., Цумаки Н. Лечение статинами восстанавливает фенотипы скелетной дисплазии FGFR3. Природа 513: 507-511, 2014.
[В паблике: 25231866]
[Полный текст: https://doi.org/10.1038/nature13775]
Яшода А. , Комацу Ю., Тюсё Х., Миядзава Т., Одзаса А., Миура М., Курихара Т., Роги Т., Танака С., Суда М., Тамура Н., Огава Ю., Накао К. Сверхэкспрессия CNP в хондроцитах спасает от ахондроплазии через MAPK-зависимый путь. Природа Мед. 10: 80-86, 2004.
[В паблике: 14702637]
[Полный текст: https://doi.org/10.1038/nm971]
, Комацу Ю., Тюсё Х., Миядзава Т., Одзаса А., Миура М., Курихара Т., Роги Т., Танака С., Суда М., Тамура Н., Огава Ю., Накао К. Сверхэкспрессия CNP в хондроцитах спасает от ахондроплазии через MAPK-зависимый путь. Природа Мед. 10: 80-86, 2004.
[В паблике: 14702637]
[Полный текст: https://doi.org/10.1038/nm971]
Занкл А. , Элакис Г., Зусман Р. Д., Инглис Г., Гарденер Г., Бакли М. Ф., Роскиоли Т. Пренатальные и постнатальные проявления тяжелой ахондроплазии с задержкой развития и черным акантозом (SADDAN) из-за мутации FGFR3 lys650met. Являюсь. Дж. Мед. Жене. 146А: 212-218, 2008.
[В паблике: 18076102]
[Полный текст: https://doi.org/10.1002/ajmg.a.32085]
, Элакис Г., Зусман Р. Д., Инглис Г., Гарденер Г., Бакли М. Ф., Роскиоли Т. Пренатальные и постнатальные проявления тяжелой ахондроплазии с задержкой развития и черным акантозом (SADDAN) из-за мутации FGFR3 lys650met. Являюсь. Дж. Мед. Жене. 146А: 212-218, 2008.
[В паблике: 18076102]
[Полный текст: https://doi.org/10.1002/ajmg.a.32085]
Идентификация с помощью флуоресцентной гибридизации in situ и сравнительной геномной гибридизации у плода с двумя одновременными хромосомными перестройками
%PDF-1. 7
%
1 0 объект
>
эндообъект
10 0 объект
>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
ручей
application/pdfdoi:10.1016/j.tjog.2012.04.015
7
%
1 0 объект
>
эндообъект
10 0 объект
>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
ручей
application/pdfdoi:10.1016/j.tjog.2012.04.015
 doi:10.1016/j.tjog.2012.04.015
doi:10.1016/j.tjog.2012.04.015Publikationen
 Детский случай de novo Т-клеточной лимфобластной лейкоз с высоким гипердиплоидным кариотипом, несущий незарегистрированную сбалансированную транслокацию t(X;5)(q26;q31.3~32) у пациента мужского пола OBM Genetics 2019; 3; doi:10.21926/obm.genet.1
Детский случай de novo Т-клеточной лимфобластной лейкоз с высоким гипердиплоидным кариотипом, несущий незарегистрированную сбалансированную транслокацию t(X;5)(q26;q31.3~32) у пациента мужского пола OBM Genetics 2019; 3; doi:10.21926/obm.genet.1Аммер-Херрменау С., Кулкарни У., Андреас Н., Унгеленк М., Рэйвенс С., Хюбнер С., Катер А., Курт И., Бауэр М., Камрадт Т. Сепсис вызывает длительные нарушения Т-клеточного ответа CD4+, несмотря на быстрое численное восстановление Популяции Т-лимфоцитов. ПЛОС Один. 2019;14:e0211716.
 Научный представитель 2019; 9:1112.
Научный представитель 2019; 9:1112.Бокер Х.Т., Генрих Т., Либманн Л., Хеннингс Дж.К., Зееманн Э., Герт М., Яковчевский И., Преобращенски Дж., Кесселс М.М., Вестерманн М., Исбрандт Д., Ян Р., Квалманн Б., Хюбнер К.А. Обменник Na+/H+ Nhe1 модулирует возбудимость сети посредством высвобождения ГАМК. Кора головного мозга 2019; 29:4263-4276.
 J Histochem Cytochem 2019; 67:151-158.
J Histochem Cytochem 2019; 67:151-158. ПЛОС Один 2019; 14: e0214225.
ПЛОС Один 2019; 14: e0214225. Международная научно-практическая выставка, 2019 г.; 20:3545.
Международная научно-практическая выставка, 2019 г.; 20:3545. Гёппнер К. , Ороско И.Дж., Хегг-Бейлер М.Б., Сориа А.Х., Хюбнер К.А., Фернандес-Роса Ф.Л., Булкроун С., Зеннаро М.К., Дженч Т.Дж. Патогенез гипертензии на мышиной модели связанного с CLCN2 гиперальдостеронизма человека. Нацкоммуна 2019;10:4678.
, Ороско И.Дж., Хегг-Бейлер М.Б., Сориа А.Х., Хюбнер К.А., Фернандес-Роса Ф.Л., Булкроун С., Зеннаро М.К., Дженч Т.Дж. Патогенез гипертензии на мышиной модели связанного с CLCN2 гиперальдостеронизма человека. Нацкоммуна 2019;10:4678.
Хюбнер А.К., Майер Х., Мол А., Ницше С., Херрманн Т., Преториус Дж., Хюбнер К.А. Ранняя потеря слуха при разрушении Slc4a10 у мышей C57BL/6. J Assoc Res Otolaryngol 2019; 20:233-245.
 ; 20:4723.
; 20:4723. Нейробиол Дис. 2019;127:419-431.
Нейробиол Дис. 2019;127:419-431.Lakshmana G, Baniahmad A. Влияние на стабильность белка рецептора андрогена при резистентном к терапии раке предстательной железы. Международный Рак 2019; 144:1775-1779.
Лиер Т. От цитогенетики человека к хромосоме человека. Международная научно-практическая выставка, 2019 г.; 20:826.
Международная научно-практическая выставка, 2019 г.; 20:826.
 Границы генетики 2019; 10:1165
Границы генетики 2019; 10:1165 Первое сообщение о гетероморфизме 20qh+, характеризуемом молекулярной цитогенетикой как амплификация последовательностей D20Z1. Результаты исследований в области биомедицины 2019 г., 5:22-24.
Первое сообщение о гетероморфизме 20qh+, характеризуемом молекулярной цитогенетикой как амплификация последовательностей D20Z1. Результаты исследований в области биомедицины 2019 г., 5:22-24. Roell D, Rösler TW, Hessenkemper W, Kraft F, Hauschild M, Bartsch S, Abraham TE, Houtsmuller AB, Matusch R, van Royen ME, Baniahmad A. Галогензамещенные производные антраниловой кислоты представляют собой новую химическую платформу для антагонистов андрогенных рецепторов. . J Steroid Biochem Mol Biol. 2019;188:59-70.
. J Steroid Biochem Mol Biol. 2019;188:59-70.
Шмуклер Б.Е., Ривера А., Бхаргава П., Нишимура К., Хсу А., Ким Э.Х., Трудель М., Руст М.Б., Хюбнер К.А., Бругнара С., Альпер С.Л. Комбинированное генетическое нарушение котранспортеров K-Cl и канала Gardos KCNN4 спасает от обезвоживания эритроцитов в модели серповидно-клеточной анемии у мышей SAD. Клетки крови Мол Дис 2019; 79:102346.
 Ф., Бертолло Л.А.К., Оливейра Э.А., Лавуэ С., Гестич К.С., Раб П., Эзаз Т., Лиер Т., Виана П.Ф., Фельдберг Э., Чоффи М.Б. Межвидовые генетические различия и историческая демография южноамериканских арован (Osteoglossiformes, Osteoglossidae, Osteoglossum). Гены 2019; 10: 693.
Ф., Бертолло Л.А.К., Оливейра Э.А., Лавуэ С., Гестич К.С., Раб П., Эзаз Т., Лиер Т., Виана П.Ф., Фельдберг Э., Чоффи М.Б. Межвидовые генетические различия и историческая демография южноамериканских арован (Osteoglossiformes, Osteoglossidae, Osteoglossum). Гены 2019; 10: 693.Supiwong W, Pinthong K, Seetapan K, Sanjundaeng P, Bertollo LAC, Aguiar de Oliveira E, Yano CF , Liehr T, Phimphan S, Tanomtong A, de Bello Cioffi M. Разнообразие кариотипов и тенденции эволюции азиатского болотного угря Monopterus albus (Синбранхиобразные, Синжаберные). Случай хромосомного видообразования? Эволюционная биология BMC 2019; 19:73.
Symmank J, Gölling V, Gerstmann K, Zimmer G. Фактор транскрипции LHX1 регулирует выживание и направленную миграцию кортикальных интернейронов, полученных из POA. Кора головного мозга. 2019; 29:1644-1658.
Кора головного мозга. 2019; 29:1644-1658.
Teichert M, Isstas M, Liebmann L, Hübner CA, Wieske F, Winter C, Lehmann K, Bolz J. Независимый от зрительной депривации сдвиг глазного доминирования, вызванный кросс-модальной пластичностью. ПЛОС Один. 2019;14:e0213616.
Уоррен А.И., Мэсси К.Е., Ватт К., Луко К., Орафидия Ф., Селт Л.А., Мохаммед Х., Чохан Б.С., Менон С., Бариди А., Чжао В., Эскриу С., Пунгсринонт Т., Д’Сантос С., Ян Х, Тейлор С. , Qureshi A, Zecchini VR, Shaw GL, Dehm SM, Mills IG, Carroll JS, Tilley WD, McEwan IJ, Baniahmad A, Neal DE, Asim M. Взаимная обратная связь между PDZ-связывающей киназой и рецептором андрогена вызывает рак простаты. Онкоген 2019; 38:1136-1150.
Онкоген 2019; 38:1136-1150.
Weise A, Liehr T. Экспресс-скрининг пренатальной анеуплоидии с помощью флуоресцентной гибридизации in situ (FISH). Методы Мол Биол 2019; 1885: 129-137.
рефератов | Nasir A. Quraishi
Протокол уменьшенного облучения для навигации с помощью О-образной руки у детей с деформацией позвоночника: технико-экономическое обоснование Презентация на подиуме.
С. Капур, К. О’Дауд, А. Хилис, Н. А. Курайши . European Spine Journal, том 28, страницы 2805–2872 (2019)
Систематический обзор результатов эндоскопической дискэктомии и минимально инвазивной дискэктомии по сравнению с обычной микродискэктомией.
Джузеппе Ламброс Морасси, шериф Эльсайед, Насир Курайши . Том 27, выпуск 5, приложение, август 2018 г.
Влияние трехколонной остеотомии на показатели качества жизни, связанные со здоровьем, при деформации позвоночника у взрослых: систематический обзор и метаанализ.
Муралидхарн Венкатесан, Джагдип Атвал, Дритан Паску, Саранг Сапаре, Насир Курайши . Eur Spine J. 2017 Sep; 26 (Suppl 2): 406-411
Субаксиальная шейная транспедикулярная фиксация: безопасная зона для установки винтов — систематический обзор.
С. Халим, М. Малик, Н. А. Курайши . The Spine Journal, март 2017 г. 17(3S)
17(3S)
Паралич C5 после ACDF: топографическая корреляция с бугорком Шассена (C6)? Исследование свежего трупа.
Раджабский, Н. А. Курайшитский . The Spine Journal, март 2017 г. 17(3S)
Является ли дисфагия после ACDF следствием нейропраксии возвратного гортанного нерва (RLN)? Исследование свежего трупа.
Раджабский, Н. А. Курайшитский . The Spine Journal, март 2017 г. 17 (3S)
Четырехстержневые инструменты в конструкциях длинных задних отделов позвоночника для предотвращения отказа стержня у пациентов с высоким риском после операции по поводу деформации у взрослых.
Г Морасси, А Капинас, Н Курайши , М Шафафи. The Spine Journal Mar 2017 17(3S)
Фрактальный анализ трабекулярной структуры кости на основе КТ может помочь в выявлении ухудшения качества кости перед неотложными операциями на позвоночнике
Marcin Czyz, Hesham Radwan, Kamil Eyvazov, Nasir Quraishi , Bronek Boszczyk
European Spine Journal, Volume 25, Issue 3 Supplement, September 2016
Паралич C5 после ACDF: топографическая корреляция с бугорком Шассена (C6)? A Fresh Cadaveric Study
Ali Rajabian, Nasir A. Quraishi
Quraishi
European Spine Journal, Volume 25, Issue 3 Supplement, September 2016
Влияют ли различные методы на кровопотерю во время транспедикулярной остеотомии при хирургии деформации у взрослых?
Джузеппе Ламброс Морасси, Рузбех Шафафи, Суджай Дхерендра, Nasir Quraishi , Masood Shafafy
European Spine Journal, том 25, выпуск 3, приложение, сентябрь 2016 г. Spine Journal, апрель 2016 г., 16(4S)
Служебная оценка влияния медсестры, специализирующейся на остеопорозе позвоночника, в инициировании оценки состояния костей у пациентов, госпитализированных с остеопорозными переломами позвонков (ФВ)
A Haseeb, T Ong, O Sahota, N Marsh, N A Quraishi
The Spine Journal, апрель 2016 г., 16(4S)
Влияние трех различных хирургических инструментов на общую кровопотерю при субтракционной остеотомии бедренной кости
R Shafafy, G Morassi, N Quraishi , M Shafafy
The Spine Journal, апрель 2016 г. , 16(4S)
, 16(4S)
Надежная мера безопасной зоны для операций на шейном отделе позвоночника с учетом эмбриологического происхождения хода возвратного гортанного нерва (RLN) с правой и левой стороны
A Rajabian, M Walsh, N A Quraishi
The Spine Journal, апрель 2016 г., 16(4S)
Результат и качество жизни, связанное со здоровьем, после операции по поводу метастазов в позвоночник
Area2, D Guraishi 9 Pasku, B Boszczyk, K Edwards
The Spine Journal, апрель 2016 г., 16(4S)
Основные осложнения первичной и ревизионной хирургии у пациентов, перенесших корректирующую операцию по поводу деформации позвоночника у взрослых с использованием трехколонной остеотомии позвоночника
Nasir Quraishi , S Sabou, K Salem
The Spine Journal, апрель 2016 г., 16(4S)
Качество жизни, связанное со здоровьем, у пациентов, перенесших шейно-грудную остеотомию по поводу фиксированного шейно-грудного кифоза у пациентов с анкилозирующим спондилитом 9 , D Pasku, N A Quraishi , H Mehdian
The Spine Journal, апрель 2016 г. , 16(4S)
, 16(4S)
Крестцовые остеотомии для коррекции высокого тазового падения
Nasir Quraishi , A Kapinas, D Pasku
The Spine Journal, апрель 2016 г., 16(4S)
Систематический обзор результатов изучения нейробиологии боли (PNE) при лечении хронической боли в пояснице
Lianne Wood, Paul Hendrick, Nasir A. Quraishi
The Spine Journal, апрель 2016 г., 16(4S)
Правая и левая экспозиции возвратного гортанного нерва (RLN) и его ветвей: исследование свежего трупа, имеющее отношение к Шейный отдел позвоночника
Раджабиан, Н. А. Курайши
The Spine Journal 10/2015; 15(10):S229. DOI: 10.1016/j.spinee.2015.07.333
Связка Берри и нижняя щитовидная артерия как надежные анатомические ориентиры для возвратного гортанного нерва (RLN): исследование свежего трупа, относящееся к шейному отделу позвоночника
, 9 A Rajabian Курайшиты
The Spine Journal 10/2015; 15(10):S105. DOI: 10.1016/j.spinee.2015.07.06
DOI: 10.1016/j.spinee.2015.07.06
Остеоид-остеома позвоночника: многоцентровое ретроспективное когортное исследование, сравнение результатов с аппендикулярной остеоид-остеомой
Ричард Уильямс, Р. Уильямс, Б. Соуман, С. Бориани, П.П. Варга, А. Луццати, З.Л. Гокаслан, М.Г. Фелингс, К.Г. Фишер, М.Б.
Декутоски, Л.Д. Rhines, J. Reynolds, C. Bettegowda, N. Kawahara, N.A. Quraishi
The Spine Journal, 2 марта 2015 г., том 15, выпуск 3, S65
хордомы крестца: прогностические переменные для местного рецидива и общей выживаемости
Петер Варга, З. Северфи, З. Гокаслан, К. Фишер, С. Бориани, М. Декутоски, Д. Чоу, Н. Курайши , эт. al
The Spine Journal, 2 марта 2015 г., том 15, выпуск 3, S62
Систематический обзор резекции единым блоком при лечении саркомы Юинга подвижного отдела позвоночника в отношении местного контроля и безрецидивной выживаемости
Richard Williams, М. Сьюэлл, П.П. Varga, N. Quraishi
Сьюэлл, П.П. Varga, N. Quraishi
The Spine Journal, 2 марта 2015 г., том 15, выпуск 3, S65
Устойчивое улучшение качества жизни после операции по поводу метастазов в позвоночник: когортное исследование 922 пациента
Дэвид Чой, Насир Курайши , Алан Крокард
The Spine Journal, Vol. 15, выпуск 3, S64
02 марта 2015 г. The Spine Journal, том 15, выпуск 3, S64
Результаты лечения и риски рецидива симптоматических гемангиом позвоночника: многоцентровая серия из 68 случаев.
Кристина Л. Гольдштейн, Зия Л. Гокаслан, Алессандро Луццати, Лоуренс Д. Райнс, Чарльз Г. Фишер, Дин Чоу, Ричард Уильямс, Насир А. Курайши , Четан Беттеговда, Норио Кавахара, Майкл Г. Фелингс. Журнал позвоночника
Том 14, выпуск 11, страницы S171-S172
Рентгенографический анализ параметров шейки матки и таза после сегментарной коррекции кифоза Шейерманна . Хоссейн Мехдиан, Георгиос Ареалис, шериф Эльсайед, Оливер Стоукс, , Насир Курайши, . Eur Spine J (2014) 23 (Suppl 5):S469–S496
Eur Spine J (2014) 23 (Suppl 5):S469–S496
Прогностические переменные для местного рецидива и общей выживаемости после хордомы крестца Анализ из ретроспективной базы данных Форума знаний об опухолях аоспина Первичная опухоль позвоночника . Питер Пал Варга, Жолт Соверфи, Зия Гокаслан, Чарльз Фишер, Стефано Бориани, Марк Декутоски, Дин Чоу, Насир Курайши , Майкл Фелингс, Лоуренс Райнс. Eur Spine J (2014) 23 (Suppl 5):S469–S496
V-Y Остеотомия тела позвонка для лечения фиксированной деформации сгибания позвоночника . . Eur Spine J (2014) 23 (Suppl 5):S497–S526
Многоцентровое ретроспективное когортное исследование остеоидных остеом позвоночника: результаты местных рецидивов Насир А. Курайши , Стефано Бориани, Питер Пал Варга, Алессандро Луццати, Зия Л. Гокаслан, Майкл Г. Фелингс, Чарльз Г. Фишер, Лоуренс Д. Райнс, Джереми Дж. Рейнольдс, Ричард Уильямс. Eur Spine J (2014) 23 (Suppl 5):S497–S526
Первичные остеосаркомы позвоночника: многоцентровый обзор 57 хирургических случаев . Мишель Дж. Кларк, Питер Пал Варга, Лоуренс Д. Райнс, Чарльз Г. Фишер, Дин Чоу, Насир А. Курайши , Майкл Г. Фелингс, Зия Л. Гокаслан, Стефано Бориани. Европейский позвоночник J (2014) 23 (Приложение 5): S497–S526
Мишель Дж. Кларк, Питер Пал Варга, Лоуренс Д. Райнс, Чарльз Г. Фишер, Дин Чоу, Насир А. Курайши , Майкл Г. Фелингс, Зия Л. Гокаслан, Стефано Бориани. Европейский позвоночник J (2014) 23 (Приложение 5): S497–S526
Результаты лечения и риски рецидива симптоматических гемангиом позвоночника: многоцентровая серия из 68 случаев.
Кристина Л. Гольдштейн, Зия Л. Гокаслан, Алессандро Луццати, Лоуренс Д. Райнс, Чарльз Дж. Фишер, Дин Чоу, Ричард Уильямс, Насир А. Курайши, Четан Беттеговда, Норио Кавахара, Майкл Г. Фелингс. Eur Spine J (2014) 23 (Прил. 5):S469–S496
Уменьшение тазового предлежания посредством вычитания ножки S2 Крестцовая остеотомия2810
Тазовая дисартикуляция и передняя ротация таза
A Khurana, NA Курайши
European Spine Journal 23 (1), S117-118, апрель 2014 г. результаты
Н. А. Курайши, С. Бориани, П. Варга, А. Луццати, З. Л. Гокаслан, М. Г. Фелингс, К. Фишер, М. Декутоски, Л. Райнс, Дж. Рейнольдс, К. Беттеговда, Н. Кавахара, Р. Уильямс
Луццати, З. Л. Гокаслан, М. Г. Фелингс, К. Фишер, М. Декутоски, Л. Райнс, Дж. Рейнольдс, К. Беттеговда, Н. Кавахара, Р. Уильямс
European Spine Journal 23 (1 ), S105, апрель 2014 г.
Трансоральный подход к лечению нейробластомы C2
Salem, J Visser, NA Quraishi
European Spine Journal 23 (1), S107, апрель 2014 г. Качество жизни при нейромышечном сколиозе
Hoda Mohajer-Bastami, Ann Marriott, Jim Hegarty, George Arealis, Bev Beeson, Nasir A Quraishi, Hossein Mehdian
European Spine Journal 23 (1), S116-117, апрель 2014 г.
Тридцатидневная смертность у пациентов с метастатической компрессией спинного мозга
Н. А. Курайши, С. Р. Манохаран, С. Раджан, Г. Ареалис, Б. М. Божчик
The Spine Journal 13 (9), S68-S69, 2013 9002 Неизвестная первичная опухоль, представляющая собой метастатическую компрессию спинного мозга
NA Quraishi, R Manoharan, S Rajan, G Arealis, H Mehdian, BM Boszczyk
The Spine Journal 13 (9), S129-S129, 2013
2 A Новая модель доказательной медицины для редких и часто игнорируемых опухолевых состояний: База данных опухолей Международного форума знаний AOSpine для первичных опухолей позвоночника
Николь М. Гермшайд, Чарльз Г. Фишер, Стефано Бориани, Питер П. Варга, Майкл Г. Фелингс, Марк Х. Билски, Марк Б. Декутоски, Ричард П. Уильямс, Сигурд Х. Бервен, Дин Чоу, Джереми Дж. Рейнольдс, Насир А. Курайши, Laurence D Rhines, Chetan Bettegowda, Ziya L Gokaslan
Гермшайд, Чарльз Г. Фишер, Стефано Бориани, Питер П. Варга, Майкл Г. Фелингс, Марк Х. Билски, Марк Б. Декутоски, Ричард П. Уильямс, Сигурд Х. Бервен, Дин Чоу, Джереми Дж. Рейнольдс, Насир А. Курайши, Laurence D Rhines, Chetan Bettegowda, Ziya L Gokaslan
The Spine Journal 13 (9), S69-S69, 2013
Сегментарные саморастущие стержневые конструкции в лечении нервно-мышечного сколиоза с ранним началом
H Mehdian, G Arealis, Н.А. Курайшиты , S Elsayed
The Spine Journal 13 (9), S135-S135, 2013
Выбор уровня дистального инструментария в кривых Lenke типа 1A с использованием сегментарной винтовой фиксации: опыт Ноттингема
H Mehdian, G Arealis, NA Quraishi , S Elsayed
The Spine Journal 13 (9), S110-S110, 2013
Частота повторных операций при метастатической компрессии спинного мозга
NA Quraishi, R Manoharan, S Rajan, H A Kkhdian , БМ Бощик
The Spine Journal 13 (9), S70-S71, 2013
VY Остеотомия тела позвонка для лечения фиксированной деформации сгибания позвоночника
H Mehdian, G Arealis, MCB Elsayed, NA Quraishi , A Ranganathan 98 The Spine Journal 13 (9), S110-S110, 2013
Внутричерепная гипотензия с параличом шестого черепного нерва после массивной гигромы грудного отдела спинномозговой жидкости: редкое осложнение удаления грудного диска
A Khurana, J Brousil, A Russo, A Эванс, 9 лет2809 NA Quraishi , BM Boszczyk
European Spine Journal, 1-8, 2013
Интраоперационный мониторинг спинного мозга при хирургической коррекции сколиоза вследствие церебрального паралича и других нервно-мышечных заболеваний
TC Hammett, B Boreham, , NA SMH Mehdian
European Spine Journal, 1-4, 2013
Точность пересмотренной шкалы Tokuhashi в прогнозировании выживаемости пациентов с метастатической компрессией спинного мозга (MSCC)
NA Курайши , SR Manoharan, G Arealis, A Khurana, S Elsayed, KL Edwards, BM . ..
..
European Spine Journal 22 (1), 21-26, 2013
Заднебоковой доступ к срединно- шейный отдел позвоночника при метастатических опухолях позвоночника: технический отчет
NA Quraishi , T Hammett, KMI Salem, H Mehdian
Acta neurochirurgica, 1-2, 2013
Минимальный доступ, двусторонний трансфораминальный поясничный межтеловой спондилодез при высокосортной истмической спондилопатии
NA Quraishi, YR Rampersaud
European Spine Journal, 1-7, 2013
Результат эмболизированных сосудистых метастатических почечно-клеточных опухолей, вызывающих компрессию спинного мозга Lenthall, MP Grevitt
European Spine Journal, 1-6, 2013
Влияние времени операции на неврологический исход и выживаемость при метастатическом сдавлении спинного мозга.
Н/Д Курайши , TS Rajagopal, SR Manoharan, S Elsayed, KL Edwards, BM Boszczyk
Европейский журнал по позвоночнику: официальная публикация Европейского общества позвоночника 2013
Осложнения, связанные с доступом, в передней поясничной хирургии, выполняемой спинальными хирургами.
Н. А. Курайши, М. Кониг, С. Дж. Букер, М. Шафафи, Б. М. Бощик, М. П. Гревитт, Х .
Европейский журнал позвоночника: официальная публикация Европейского общества позвоночника 2013
компрессии конского хвоста в результате метастатических опухолей пояснично-крестцового перехода и крестца.
NA Quraishi, KE Giannoulis, SR Manoharan, KL Edwards, BM Boszczyk
Европейский журнал по позвоночнику: официальная публикация Европейского общества позвоночника, 2013 г. S Purusothamdas, R Lenthall, MP Grevitt
The Spine Journal 12 (9), S15 2013
Анализ уровней метастатической компрессии спинного мозга и результатов хирургического вмешательства в зависимости от гистологического типа первичной опухоли
T Rajagopal, Na Quraishi
The Spine Journal 12 (9), S103
Управление метастатическими сакральными опухолями
Na Quraishi , Ke Giannoulis, Kl Edwards, Bmzczyzy 9810, Ke Giannoulis, Kl Edwards, Bmzczyzy 9810, Ke Giannoulis, Kl Edwards, Bmzczyzy , Ke Giannoulis, Kl Edwards, Bmzczyzy.
Сроки радиологической диагностики и хирургического вмешательства у пациентов с метастатической компрессией спинного мозга4 (SUPP XXVI), 53-53
Сравнение риска смертности у прооперированных (вертебропалстии или баллонной кифопластики) и неоперированных пациентов: 410 965 пациентов с переломами позвонков из населения США Medicare Population
NA Quraishi, , S A Edidin Kurtz, K Ong, E Lau
Journal of Bone & Joint Surgery, British Volume 94 (SUPP XXVI), 22-22
Интраоперационная локализация уровня грудного отдела позвоночника – простая техника «K’wire In Pedicle»
NA Quraishi , S Thambiraj
Journal of Bone & Joint Surgery, British Volume 94 (SUPP XXVI), 59-59
Метастатические опухоли пояснично-крестцового соединения и крестцового отдела позвоночника
NA Quraishi, K Gianno Journals K Gianno Journals of Bone & Joint Surgery, British Volume 94 (SUPP XXVI), 19-19
Минимально-инвазивная чрескожная репозиция и транссакральная винтовая фиксация при U-образных переломах
MA König, U Seidel, P Heini, R Orler, NA Quraishi, AA Boszczyk, BM Boszczyk
Journal of Spinal Disorders & Techniques
Experience Of A Spine Fellowship: A Quality Analysis
S Elsayed, S Hansen, NA Quraishi
Joint Surgery, British Volume & Journal of Bone Surgery 94 (SUPP X), 043-043
Местная клиника боли в спине: промежуточные результаты с использованием оценки MDT
RS Ahluwalia, NA Quraishi, SP Hughes
Journal of Bone & Joint Surgery, British Volume 94 (SUPP X), 137-137
Пересмотренная шкала Tokuhashi и выживаемость у пациентов с метастатической компрессией спинного мозга (Mscc)
S Elsayed, V Dvorak, NA Quraishi
Journal of Bone & Joint Surgery, British Volume 94 (SUPP X), 035-035
Влияние сроков операции на восстановление у пациентов с метастатической компрессией спинного мозга (Mscc)
S Эльсайед, В.

 30.001.002
30.001.002 04.017
04.017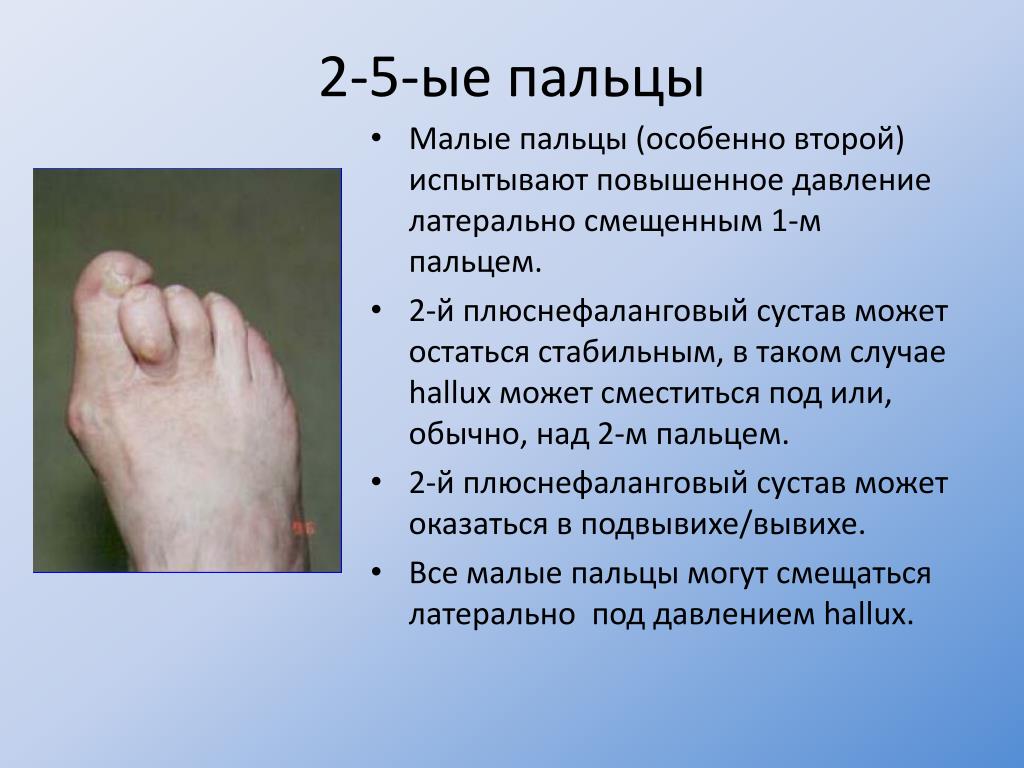 01.018
01.018 0
0
 Возникают рецидивирующие синовиты. Сустав краснеет, отекает.
Возникают рецидивирующие синовиты. Сустав краснеет, отекает. Имеет диагностический или лечебно-диагностический характер. Выполняется для удаления жидкости, забора ее образца для цитологического или микробиологического анализа, иммунологического исследования.
Имеет диагностический или лечебно-диагностический характер. Выполняется для удаления жидкости, забора ее образца для цитологического или микробиологического анализа, иммунологического исследования. При дегенеративных процессах в сустав вводят хондропротекторы, аналоги синовиальной жидкости. При упорном болевом синдроме производят блокады с гормональными средствами.
При дегенеративных процессах в сустав вводят хондропротекторы, аналоги синовиальной жидкости. При упорном болевом синдроме производят блокады с гормональными средствами.
 Достаточно десяти ежедневных процедур.
Достаточно десяти ежедневных процедур.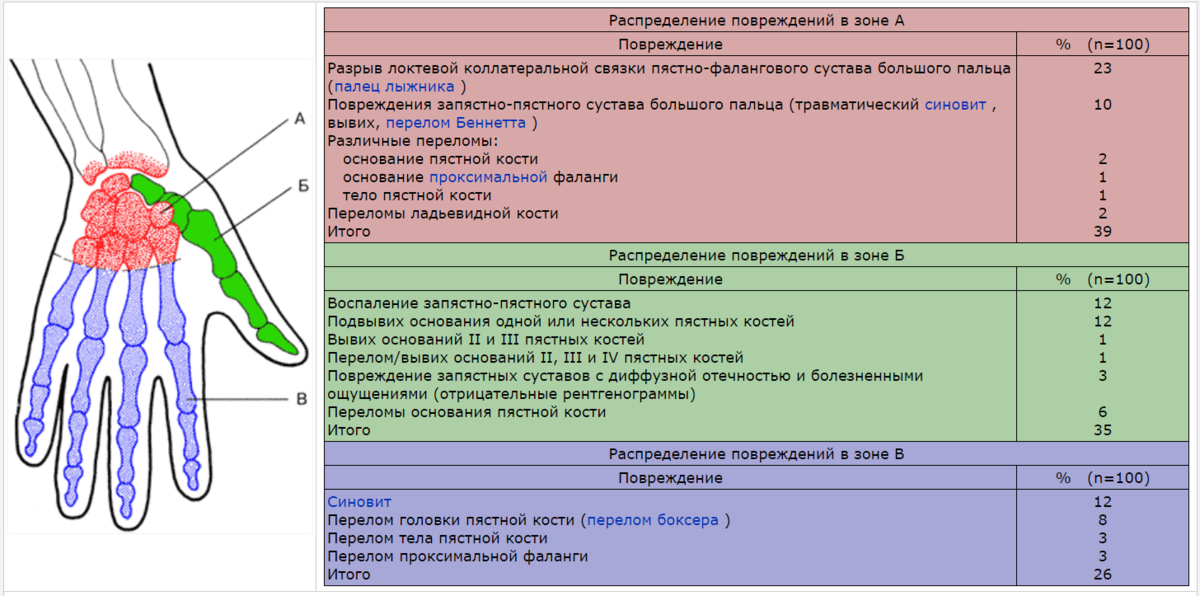


 Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе.
Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе. Сюда следует отнести антибиотики, противовоспалительные, обезболивающие, кортикостероиды;
Сюда следует отнести антибиотики, противовоспалительные, обезболивающие, кортикостероиды;




 Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе.
Иногда необходимость в оперативном вмешательстве отсутствует, поскольку полость зарубцовывается сама по себе.