Терапия генно-инженерными биологическими препаратами и инфекции у больных ревматоидным артритом: актуальность и перспективы | Белов
1. Salliot C, Gossec L, Ruyssen-Witrand A, et al. Infections during tumour necrosis factor-alpha blocker therapy for rheumatic dis- eases in daily practice: a systematic retrospective study of 709 patients. Rheumatology (Oxford). 2007;46(2):327–34. DOI:10.1093/rheumatology/kel23.
2. Kroesen S, Widmer AF, Tyndall A, Hasler P. Serious bacterial infections in patients with rheumatoid arthritis under anti-TNF- alpha therapy. Rheumatology (Oxford). 2003;42(5):617–21. DOI: 10.1093/rheumatology/keg263.
3. Curtis JR, Patkar N, Xie A, et al. Risk of serious bacterial infec- tions among rheumatoid arthritis patients exposed to tumor necro- sis factor alpha antagonists. Arthritis Rheum. 2007;56(4):1125–33. DOI: 10.1002/art.22504.
4. Dixon WG, Symmons DP, Lunt M, et al.; British Society for Rheumatology Biologics Register Control Centre Consortium; British Society for Rheumatology Biologics Register. Serious infection following anti-tumor necrosis factor alpha therapy in patients with rheumatoid arthritis: Lessons from interpreting data from observational studies. Arthritis Rheum. 2007;56(9):2896–904. DOI: 10.1002/art.22808
Serious infection following anti-tumor necrosis factor alpha therapy in patients with rheumatoid arthritis: Lessons from interpreting data from observational studies. Arthritis Rheum. 2007;56(9):2896–904. DOI: 10.1002/art.22808
5. Galloway JB, Hyrich KL, Mercer LK, et al.; BSRBR Control Centre Consortium; British Society for Rheumatology Biologics Register. Anti-TNF therapy is associated with an increased risk of serious infections in patients with rheumatoid arthritis especially in the first 6 months of treatment: updated results from the British Society for Rheumatology Biologics Register with special empha- sis on risks in the elderly. Rheumatology (Oxford). 2011;50(1):124–31. DOI: 10.1093/rheumatology/keq242
6. Listing J, Strangfeld A, Kary S, et al. Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum. 2005;52(11):3403–12. DOI: 10.1002/art.21386.
7. Listing J, Gerhold K, Zink A. The risk of infections associated with rheumatoid arthritis, with its comorbidity and treatment. Rheumatology (Oxford). 2013;52(1):53–61. DOI: 10.1093/rheuma- tology/kes305.
Rheumatology (Oxford). 2013;52(1):53–61. DOI: 10.1093/rheuma- tology/kes305.
8. Askling J, Fored CM, Brandt L, et al. Time-dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis. 2007;66(10):1339–44. DOI:10.1136/ard.2006.062760.
9. Van Dartel SA, Fransen J, Kievit W, et al. Predictors for the 5-year risk of serious infections in patients with rheumatoid arthritis treated with anti-tumour necrosis factor therapy: a cohort study in the Dutch Rheumatoid Arthritis Monitoring (DREAM) registry. Rheumatology (Oxford). 2013;52(6):1052–7. DOI: 10.1093/rheumatology/kes413.
10. Saurit V, De La Vega MC, Citera G, et al. Argentinian register of biologics treatments (Biobadasar). Results. Ann Rheum Dis. 2013;72(Suppl 3):564. DOI: 10.1136/annrheumdis-2013- eular.1687.
11. Kay J, Fleischmann R, Keystone E, et al. Golimumab 3-year safe- ty update: an analysis of pooled data from the long-term exten- sions of randomised, double-blind, placebo-controlled trials con- ducted in patients with rheumatoid arthritis, psoriatic arthritis or ankylosing spondylitis.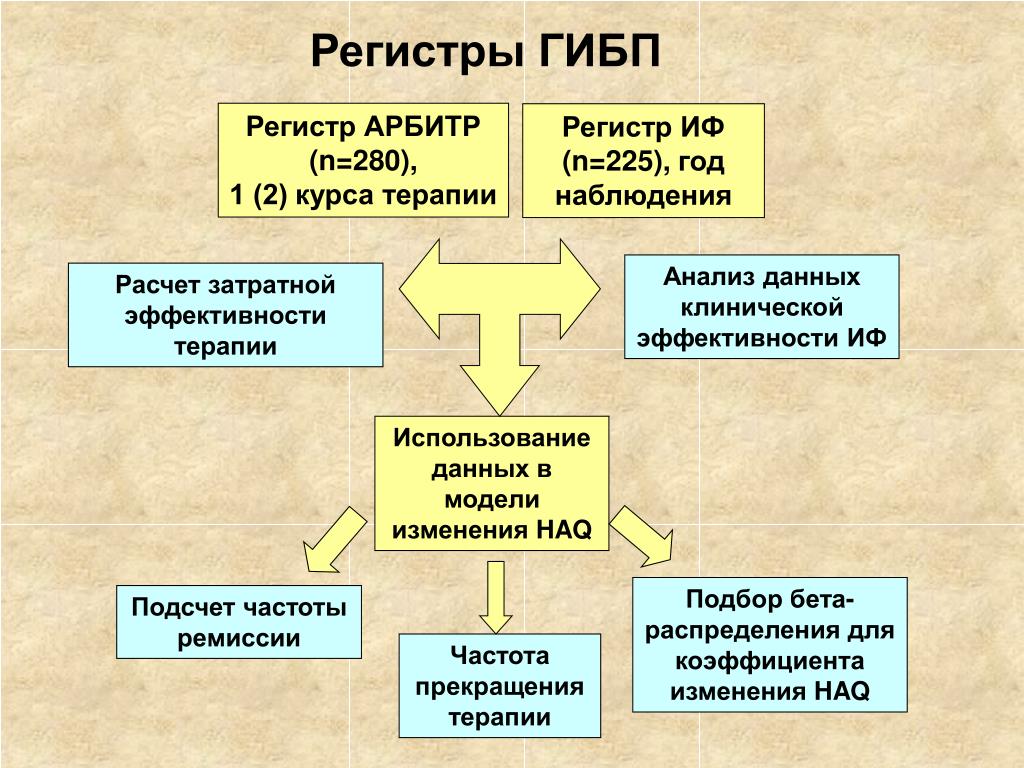 Ann Rheum Dis. 2013 Dec 16. DOI: 10.1136/ annrheumdis-2013-204195.
Ann Rheum Dis. 2013 Dec 16. DOI: 10.1136/ annrheumdis-2013-204195.
12. Keystone E, Genovese MC, Hall S, et al. Five-year safety and effi- cacy of golimumab in patients with active rheumatoid arthritis despite prior treatment with methotrexate: final study results of the phase 3, randomized placebo-controlled go-forward trial. Ann Rheum Dis. 2013;72 (Suppl 3):867–8. DOI: 10.1136/annrheumdis-2013-eular.2589.
13. Bykerk VP, Cush J, Winthrop K, et al. Update on the safety profile of certolizumab pegol in rheumatoid arthritis: an integrated analy- sis from clinical trials. Ann Rheum Dis. 2013 Oct 3. DOI: 10.1136/annrheumdis-2013-203660.
14. Cohen SB, Emery P, Greenwald MW, et al.; REFLEX Trial Group. Rituximab for rheumatoid arthritis refractory to anti- tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum. 2006;54(9):2793–806. DOI: 10. 1002/art.22025.
1002/art.22025.
15. Saag KG, Winthrop KL, Alexander K, et al. Long-term safety event rates in RA patients following inirtiation of rituximab: inter- im analysis from SUNSTONE registry. Arthritis Rheum. 2013;65(10 Suppl):1002.
16. Mariette X, Gottenberg JE, Ravaud P, Combe B. Registries in rheumatoid arthritis and autoimmune diseases: data from the French registries. Rheumatology (Oxford). 2011;50(1):222–9. DOI: 10.1093/rheumatology/keq368.
17. Gottenberg JE, Ravaud P, Cacoub P, et al. The rate of serious infections remains stable in patients with multiple retreatments in real life: data from the «Autoimmunity and rituximab» (AIR) reg- istry. Arthritis Rheum. 2013;65(10 Suppl):606–7.
18. Kremer JM, Genant HK, Moreland LW, et al. Effects of abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med. 2006;144(12):865–76. DOI:10.7326/0003-4819-144-12-200606200-00003.
19. Weinblatt M, Combe B, Covucci A, et al.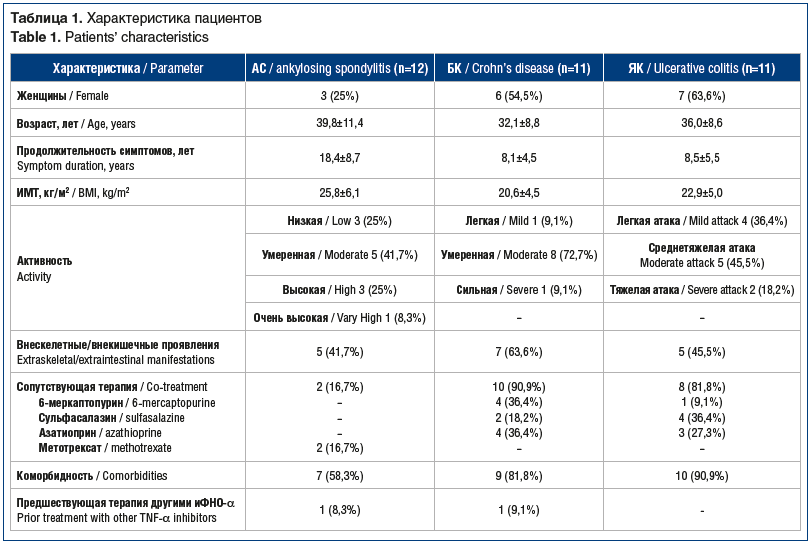 Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum. 2006;54(9):2807–16. DOI: 10.1002/art.22070.
Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum. 2006;54(9):2807–16. DOI: 10.1002/art.22070.
20. Weinblatt M, Schiff M, Goldman A, et al. Selective costimulation modulation using abatacept in patients with active rheumatoid arthritis while receiving etanercept: a randomised clinical trial. Ann Rheum Dis. 2007;66(2):228–34. DOI:10.1136/ard.2006.055111.
21. Weinblatt ME, Moreland LW, Westhovens R, et al. Safety of abata- cept administered intravenously in treatment of rheumatoid arthri- tis: integrated analyses of up to 8 years of treatment from the abat- acept clinical trial program. J Rheumatol. 2013;40(6):787–97. DOI: 10.3899/jrheum.120906.
22. Gottenberg JE, Ravaud P, Bardin T, et al.; French Society of Rheumatology. Prospective follow-up of RA patients (1200 patient/years) treated with abatacept in real life: results from the ORA registry. Ann Rheum Dis. 2011;70 (Suppl 3):466.
Ann Rheum Dis. 2011;70 (Suppl 3):466.
23. Sibilia J, Westhovens R. Safety of T-cell co-stimulation modula- tion with abatacept in patients with rheumatoid arthritis. Clin Exp Rheumatol. 2007;25(5 Suppl 46):46–56.
24. Smitten A, Simon T, Qi K, et al. Hospitalized infections in the abatacept RA clinical development program: an updated epidemi- ological assessment with >10,000 person-years of exposure. Arthritis Rheum. 2008;58 (Suppl 9):786–7.
25. Schiff MN. Subcutaneous abatacept for the treatment of rheuma- toid arthritis. Rheumatology (Oxford). 2013;52(6):986–97. DOI: 10.1093/rheumatology/ket018.
26. Schiff MH, Kremer JM, Jahreis A, et al. Integrated safety in tocilizumab clinical trials. Arthritis Res Ther. 2011;13(5):R141. DOI: 10.1186/ar3455.
27. Yazici Y, Curtis JR, Ince A, et al. Efficacy of tocilizumab in patients with moderate to severe active rheumatoid arthritis and a previous inadequate response to disease-modifying antirheumatic drugs: the ROSE study. Ann Rheum Dis. 2012;71(2):198–205. DOI: 10.1136/ard.2010.148700.
Ann Rheum Dis. 2012;71(2):198–205. DOI: 10.1136/ard.2010.148700.
28. Morel J, Duzanski MO, Bardin T, et al. Prospective follow-up of tocilizumab treatment in 764 patients with refractory rheumatoid arthritis: tolerance and efficacy data from the French registry Regate (REGistry-RoAcTEmra). Arthritis Rheum. 2012;64(10 Suppl):152.
29. Genovese MC, Rubbert-Roth A, Smolen JS, et al. Long-term safety and efficacy of tocilizumab in patients with rheumatoid arthritis: a cumulative analysis of up to 4.6 years of exposure.
30. J Rheumatol. 2013;40(6):768–80. DOI: 10.3899/jrheum.120687. Epub 2013 Mar 1.
31. Koike T, Harigai M, Inokuma S, et al. Effectiveness and safety of tocilizumab: postmarketing surveillance of 7901 patients with rheumatoid arthritis in Japan. J Rheumatol. 2014;41(1):15–23. DOI: 10.3899/jrheum.130466
32. Campbell L, Chen C, Bhagat SS, et al. Risk of adverse events including serious infections in rheumatoid arthritis patients treated with tocilizumab: a systematic literature review and meta-analysis of randomized controlled trials. Rheumatology (Oxford). 2011;50(3):552–62. DOI: 10.1093/rheumatology/keq343.
Rheumatology (Oxford). 2011;50(3):552–62. DOI: 10.1093/rheumatology/keq343.
33. Koike R, Harigai M, Atsumi T, et al. Japan College of Rheumatology 2009 guidelines for the use of tocilizumab, a humanized anti-interleukin-6 receptor monoclonal antibody, in rheumatoid arthritis. Mod Rheumatol. 2009;19(4):351–7. DOI: 10.1007/s10165-009-0197-6.
34. Fujiwara H, Nishimoto N, Hamano Y, et al. Masked early symp- toms of pneumonia in patients with rheumatoid arthritis during tocilizumab treatment: a report of two cases. Mod Rheumatol. 2009;19(1):64–8. DOI: 10.1007/s10165-008-0111-7.
35. Burmester GR, Charles-Schloeman C, Isaacs JD, et al. Tofacitinib, an oral Janus kinase inhibitor: safety comparisonin patients with rheumatoid arthritis and an inadequate response to nonbiologic or biologic disease-modifying anti-rheumatic drugs. Arthritis Rheum. 2013;65(10 Suppl):192.
36. Gomez-Reino J, Hazra A, Fosser C, et al. Post-hoc analysis of serious infection events and selected clinical factors in rheumatoid arthritis patients treated with tofacitinib. Arthritis Rheum. 2013;65(10 Suppl):194.
Arthritis Rheum. 2013;65(10 Suppl):194.
37. Singh JA, Wells GA, Christensen R, et al. Adverse effects of bio- logics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev. 2011;2: CD008794. DOI: 10.1002/14651858. CD 00894.
38. Gabay C, Emery P, van Vollenhoven R, et al.; ADACTA Study Investigators. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double-blind, controlled phase 4 trial. Lancet. 2013;381(9877):1541–50. DOI: 10.1016/S0140-6736(13)60250-0.
39. Schiff M, Weinblatt ME, Valente R, et al. Head-to-head compari- son of subcutaneous abatacept versus adalimumab for rheumatoid arthritis: two-year efficacy and safety findings from AMPLE trial. Ann Rheum Dis. 2014;73(1):86–94. DOI: 10.1136/annrheumdis- 2013-203843.
40. Yun H, Xie F, Delzel ES, et al. Comparative safety of biological agents among Medicare rheumatoid arthritis patients. Arthritis Rheum. 2013;65(10 Suppl):987.
41. Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent.
42. N Engl J Med. 2001;345(15):1098–104. DOI: 10.1056/NEJMoa011110.
43. Gomez-Reino JJ, Carmona L, Valverde VR, et al.; BIOBADASER Group. Treatment of rheumatoid arthritis with tumor necrosis fac- tor inhibitors may predispose to significant increase in tuberculosis risk: a multicenter active-surveillance report. Arthritis Rheum. 2003;48(8):2122–7. DOI: 10.1002/art.11137.
44. Tubach F, Salmon D, Ravaud P, et al.; Research Axed on Tolerance of Biotherapies Group. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three- year prospective French research axed on tolerance of biotherapies registry. Arthritis Rheum. 2009;60(7):1884–94. DOI: 10.1002/art.24632.
45. Dixon WG, Hyrich KL, Watson KD, et al.; BSRBR Control Centre Consortium, Symmons DP; BSR Biologics Register..jpg) Drug- specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti-TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann Rheum Dis. 2010;69(3):522–8. DOI: 10.1136/ard.2009.118935.
Drug- specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti-TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann Rheum Dis. 2010;69(3):522–8. DOI: 10.1136/ard.2009.118935.
46. Перельман МИ, Насонов ЕЛ, редакторы. Диагностика туберкулезной инфекции при планировании и проведении терапии блокаторами ФНОα у больных ревматическими заболеваниями. Пособие для врачей. Москва; 2008. 40 с. [Perel’man MI, Nasonov EL, editors. Diagnostika tuberkuleznoi infektsii pri planirovanii i provedenii terapii blokatorami FNOα u bol’nykh revmaticheskimi zabolevaniyami. Posobie dlya vrachei [Diagnostics of a tubercular infection when planning and carrying out therapy by blockers TNFα at patients with rheumatic diseases. Grant for doctors]. Moscow; 2008. 40 p.]
47. Борисов СЕ, Лукина ГВ. Рекомендации по скринингу
48. и мониторингу туберкулезной инфекции у больных, получающих генно-инженерные биологические препараты. Доступ по ссылке: www. rheumatolog.ru/files/natrec21/.pdf [Borisov SE, Lukina GV. Rekomendatsii po skriningu i moni- toringu tuberkuleznoi infektsii u bol’nykh, poluchayushchikh genno-inzhenernye biologicheskie preparaty [Recommendations about screening and monitoring of a tubercular infection at the patients receiving genetically engineered biological preparations]. Available from: www.rheumatolog.ru/files/natrec21/.pdf]
rheumatolog.ru/files/natrec21/.pdf [Borisov SE, Lukina GV. Rekomendatsii po skriningu i moni- toringu tuberkuleznoi infektsii u bol’nykh, poluchayushchikh genno-inzhenernye biologicheskie preparaty [Recommendations about screening and monitoring of a tubercular infection at the patients receiving genetically engineered biological preparations]. Available from: www.rheumatolog.ru/files/natrec21/.pdf]
49. Wotton CJ, Goldacre MJ. Risk of invasive pneumococcal disease in people admitted to hospital with selected immune-mediated diseases: record linkage cohort analyses. J Epidemiol Community Health. 2012;66(12):1177–81. DOI: 10.1136/jech-2011-200168.
50. Lane MA, McDonald JR, Zeringue AL, et al.TNF-α antagonist use and risk of hospitalization for infection in a national cohort of veterans with rheumatoid arthritis. Medicine (Baltimore). 2011;90(2):139–45. DOI: 10.1097/MD.0b013e318211106a.
51. Van Vollenhoven RF, Emery P, Bingham CO 3rd, et al. Long-term safety of rituximab: pooled analysis of the rheumatoid arthritis global clinical trial programm over 11 years. Arthritis Rheum. 2013;65(10 Suppl):1000.
Arthritis Rheum. 2013;65(10 Suppl):1000.
52. Hoshi D, Nakajima A, Inoue E, et al. Incidence of serious respira- tory infections in patients with rheumatoid arthritis treated with tocilizumab. Mod Rheumatol. 2012;22(1):122–7. DOI: 10.1007/s10165-011-0488-6.
53. Mori S, Sugimoto M. Pneumocystis jirovecii infection: an emerg- ing threat to patients with rheumatoid arthritis. Rheumatology (Oxford). 2012;51(12):2120–30. DOI: 10.1093/rheumatology/kes244.
54. Watanabe K, Sakai R, Koike R, et al. Clinical characteristics and risk factors for Pneumocystis jirovecii pneumonia in patients with rheumatoid arthritis receiving adalimumab: a retrospective review and case-control study of 17 patients. Mod Rheumatol. 2013;23(6):1085–93. DOI: 10.1007/s10165-012-0796-5.
55. Stamp LK, Hurst M. Is there a role for consensus guidelines for P. jiroveci pneumonia prophylaxis in immunosuppressed patients with rheumatic diseases? J Rheumatol. 2010;37(4):686–8. DOI: 10.3899/jrheum.091426.
56. Caporali R, Bobbio-Pallavicini F, Atzeni F, et al. Safety of tumor necrosis factor alpha blockers in hepatitis B virus occult carriers (hepatitis B surface antigen negative/anti-hepatitis B core antigen positive) with rheumatic diseases. Arthritis Care Res (Hoboken). 2010;62(6):749–54. DOI: 10.1002/acr.20130.
57. Mori S. Past hepatitis B virus infection in rheumatoid arthritis patients receiving biological and/or nonbiological disease-modify- ing antirheumatic drugs. Mod Rheumatol. 2011;21(6):621–7. DOI: 10.1007/s10165-011-0458-z.
58. Urata Y, Uesato R, Tanaka D, et al. Prevalence of reactivation of hepatitis B virus replication in rheumatoid arthritis patients. Mod Rheumatol. 2011;21(1):16–23. DOI: 10.1007/s10165-010-0337-z.
59. Tan J, Zhou J, Zhao P, Wei J. Prospective study of HBV reactiva- tion risk in rheumatoid arthritis patients who received convention- al disease-modifying antirheumatic drugs. Clin Rheumatol. 2012;31(8):1169–75. DOI: 10.1007/s10067-012-1988-2.
60. Vukatana G, Gamal N, Trevisani M, et al. Serological prevalence of hepatitis B virus infection among patients with different rheu- matic diseases. Ann Rheum Dis. 2013;72(Suppl 3):310. DOI: 10.1136/annrheumdis-2013-eular.958
61. Michel M, Duvoux C, Hezode C, Cherqui D. Fulminant hepatitis after infliximab in a patient with hepatitis B virus treated for an adult onset Still’s disease. J Rheumatol. 2003;30(7):1624–5.
62. Ostuni P, Botsios C, Punzi L, et al. Hepatitis B reactivation in a chronic hepatitis B surface antigen carrier with rheumatoid arthri- tis treated with infliximab and low dose methotrexate. Ann Rheum Dis. 2003;62(7):686–7. DOI: 10.1136/ard.62.7.686.
63. Pyrpasopoulou A, Douma S, Vassiliadis T, et al. Reactivation of chronic hepatitis B virus infection following rituximab administra- tion for rheumatoid arthritis. Rheumatol Int. 2011;31(3):403–4. DOI: 10.1007/s00296-009-1202-2.
64. Ghrenassia E, Mekinian A, Rouaghe S, et al. Reactivation of resolved hepatitis B during rituximab therapy for rheumatoid arthritis. Joint Bone Spine. 2012;79(1):100–1. DOI: 10.1016/j.jbspin.2011.07.003.
Joint Bone Spine. 2012;79(1):100–1. DOI: 10.1016/j.jbspin.2011.07.003.
65. Gigi E, Georgiou T, Mougiou D, et al. Hepatitis B reactivation in a patient with rheumatoid arthritis with antibodies to hepatitis B surface antigen treated with rituximab. Hippokratia. 2013;17(1):91–3.
66. Salman-Monte TC, Lisbona MP, Garcia-Retortillo M, Maymo J. Reactivation of hepatitis virus B infection in a patient with rheumatoid arthritis after treatment with rituximab. Reumatol Clin. 2014 May–June;10(3):196–7. DOI: 10.1016/j.reuma.2013.05.011. Epub 2013 Sep 17
67. Oshima Y, Tsukamoto H, Tojo A. Association of hepatitis B with antirheumatic drugs: a case-control study. Mod Rheumatol. 2013;23(4):694–704. DOI: 10.1007/s10165-012-0709-7.
68. Furst DE, Keystone EC, So AK, et al. Updated Consensus Statement on Biological Agents for the Treatment of Rheumatic Diseases, 2012. Ann Rrheum Dis. 2013;72 Suppl 2:2–34. DOI: 10.1136/annrheumdis-2013-203348.
69. Vassilopoulos D, Apostolopoulou A, Hadziyannis E, et al. Long- term safety of anti-TNF treatment in patients with rheumatic dis- eases and chronic or resolved hepatitis B virus infection. Ann Rheum Dis. 2010;69(7):1352–5. DOI: 10.1136/ard.2009.127233.
Long- term safety of anti-TNF treatment in patients with rheumatic dis- eases and chronic or resolved hepatitis B virus infection. Ann Rheum Dis. 2010;69(7):1352–5. DOI: 10.1136/ard.2009.127233.
70. Lan JL, Chen YM, Hsieh TY, et al. Kinetics of viral loads and risk of hepatitis B virus reactivation in hepatitis B core antibody-posi- tive rheumatoid arthritis patients undergoing anti-tumour necrosis factor alpha therapy. Ann Rheum Dis. 2011;70(10):1719–25. DOI: 10.1136/ard.2010.148783.
71. Kim PS, Ho GY, Prete PE, Furst DE. Safety and efficacy of abata- cept in eight rheumatoid arthritis patients with chronic hepatitis B. Arthritis Care Res (Hoboken). 2012;64(8):1265–8. DOI: 10.1002/acr.21654.
72. Carroll MB. The impact of biologic response modifiers on hepati- tis B virus infection. Expert Opin Biol Ther. 2011;11(4):533–44. DOI: 10.1517/14712598.2011.554810.
73. Vassilopoulos D, Calabrese LH. Management of rheumatic disease with comorbid HBV or HCV infection. Nat Rev Rheumatol. 2012;8(6):348–57. DOI: 10.1038/nrrheum.2012.63.
2012;8(6):348–57. DOI: 10.1038/nrrheum.2012.63.
74. Peterson JR, Hsu FC, Simkin PA, Wener MH. Effect of tumor necrosis factor alpha antagonists on serum transaminases and viraemia in patients with rheumatoid arthritis and chronic hepati- tis C infection. Ann Rheum Dis. 2003;62:1078–82. DOI: 10.1136/ard.62.11.1078.
75. Zein NN; Etanercept Study Group. Etanercept as an adjuvant to interferon and ribavirin in treatment-naive patients with chronic hepatitis C virus infection: a phase 2 randomised, double-blind, placebo-controlled study. J Hepatol. 2005;42(3):315–22.
76. Brunasso AM, Puntoni M, Gulia A, Massone C. Safety of anti- tumour necrosis factor agents in patients with chronic hepatitis C infection: a systematic review. Rheumatology (Oxford). 2011;50(9):1700–11. DOI: 10.1093/rheumatology/ker190.
77. Pompili M, Biolato M, Miele L, Grieco A. Tumor necrosis factor- α inhibitors and chronic hepatitis C: A comprehensive literature review. World J Gastroenterol. 2013;19(44):7867–73. DOI: 10.3748/wjg.v19.i44.7867.
DOI: 10.3748/wjg.v19.i44.7867.
78. Inanc N, Direskeneli H. Serious infections under treatment with TNF-alpha antagonists compared to traditional DMARDs in patients with rheumatoid arthritis. Rheumatol Int. 2006;27(1):67–71. DOI: 10.1007/s00296-006-0165-9.
79. McDonald JR, Zeringue AL, Caplan L, et al. Herpes zoster risk factors in a national cohort of veterans with rheumatoid arthritis. Clin Infect Dis. 2009;48(10):1364–71. DOI: 10.1086/598331.
80. Strangfeld A, Listing J, Herzer P, et al. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA. 2009;301(7):737–44. DOI: 10.1001/jama.2009.146.
81. Che H, Lukas C, Morel J, Combe B. Risk of herpes/herpes zoster during anti-tumor necrosis factor therapy in patients with rheuma- toid arthritis. Systematic review and meta-analysis. Joint Bone Spine. 2013;pii:S1297–319X(13)00194-2. DOI: 10.1016/j.jbspin.2013.07.009.
82. Yun H, Xie F, Delzell ES, et al. Comparative risk of Herpes zoster among RA patients switching biologics in the U. S. care medical program. Arthritis Rheum. 2013;65(10 Suppl):1179.
S. care medical program. Arthritis Rheum. 2013;65(10 Suppl):1179.
83. Cohen SB, Fleischmann RM, Kremer JM, et al. Efficacy and safety analyses of tofacitinib from pooled phase 2, phase 3 and long-term extension rheumatoid arthritis studies: US compared with non-US population. Arthritis Rheum. 2013;65(10 Suppl):192.
84. Wendling D, Streit G, Toussirot E, Prati C. Herpes zoster in patients taking TNF-alpha antagonists for chronic inflammatory joint disease. Joint Bone Spine. 2008;75(5):540–3. DOI: 10.1016/j.jbspin.2007.10.011.
85. Molloy ES, Calabrese LH. Progressive multifocal leukoen- cephalopathy associated with immunosuppressive therapy in rheu- matic diseases: evolving role of biologic therapies. Arthritis Rheum. 2012;64(9):3043–51. DOI: 10.1002/art.34468.
86. Yamamoto M, Takahashi H, Wakasugi H, et al. Leukoencephalopathy during administration of etanercept for refractory rheumatoid arthritis. Mod Rheumatol. 2007;17(1):72–4. DOI:10.1007/s10165-006-0530-2.
87. Kobayashi K, Okamoto Y, Inoue H, et al. Leukoencephalopathy with cognitive impairment following tocilizumab for the treatment of rheumatoid arthritis. Intern Med. 2009;48(15):1307–9. DOI: http://dx.doi.org/10.2169/internalmedicine.48.1926.
Kobayashi K, Okamoto Y, Inoue H, et al. Leukoencephalopathy with cognitive impairment following tocilizumab for the treatment of rheumatoid arthritis. Intern Med. 2009;48(15):1307–9. DOI: http://dx.doi.org/10.2169/internalmedicine.48.1926.
88. Kumar D, Bouldin TW, Berger RG. A case of progressive multifo- cal leukoencephalopathy in a patient treated with infliximab the University of North Carolina at Chapel Hill. Arthritis Rheum. 2010;62(11):3191–5. DOI: 10.1002/art.27687.
89. Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised Host. Clin Infect Dis. 2014;58(3):44–100. DOI: 10.1093/cid/cit684.
90. Hua C, Barnetche T, Combe B, Morel J. Effect of methotrexate, anti-TNFα and rituximab on the immune response to influenza and pneumococcal vaccines in patients with rheumatoid arthritis: A systematic review and meta-analysis. Arthritis Care Res (Hoboken). 2013. DOI: 10.1002/acr.22246.
91. Kapetanovic MC, Kristensen LE, Saxne T, et al. Impact of anti- rheumatic treatment on immunogenicity of pandemic h2N1 influenza vaccine in patients with arthritis. Arthritis Res Ther. 2014;16(1):R2. DOI: 10.1186/ar4427.
Impact of anti- rheumatic treatment on immunogenicity of pandemic h2N1 influenza vaccine in patients with arthritis. Arthritis Res Ther. 2014;16(1):R2. DOI: 10.1186/ar4427.
Генно-инженерные биологические препараты при основных моногенных аутовоспалительных заболеваниях. Опыт применения в ревматологической практике | Салугина
1. Goldbach-Mansky R, Kastner DL. Autoinflammation: The prominent role of IL-1 in monogenic autoinflammatory diseases and implication for common illnesses. J Allergy Clin Immunol. 2009 Dec;124(6): 1141-9; quiz 1150-1. doi: 10.1016/j.jaci.2009.11.016.
2. Federici S, Martini A, Gattorno M. The central role of anti-IL-1 blockade in the treatment of monogenic and multifactorial autoinflammatory diseases. Front Immunol. 2013 Oct 31;4:351. doi: 10.3389/fimmu.2013.00351.
3. Ильина АЕ, Станислав МЛ, Денисов ЛН, Насонов ЕЛ. Интерлейкин -1 как медиатор воспаления и терапевтическая мишень. Научно-практическая ревматология. 2011;(3):62-71.
4. Насонов ЕЛ, Елисеев МС. Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология. 2016;54(1):60-77.
Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология. 2016;54(1):60-77.
5. Hansman S, Lainka E, Horneff G, et al. Consensus protocols for the diagnosis and management of the hereditary autoinflammatory syndromes CAPS, TRAPS and MKD/HIDS: a German PRO-KIND initiative. Pediatr Rheumatol Online J. 2020 Feb 17; 18(1):17. doi: 10.1186/s12969-020-0409-3.
6. Ozen S, Kuemmerle-Deschner JB, Cimaz R, et al. International Retrospective Chart Review of Treatment Patterns in Severe Familial Mediterranean Fever, Tumor Necrosis Factor Receptor-Associated Periodic Syndrome, and Mevalonate Kinase Deficiency/Hyperimmunoglobulinemia D Syndrome. Arthritis Care Res (Hoboken). 2017 Apr;69(4):578-86. doi: 10.1002/acr.23120. Epub 2017 Mar 3..
7. Gattorno M, Obici L, Meini A, et al. Efficacy and safety of Canakinumab in patients with TNF receptor associated periodic syndrome. Arthritis Rheum. 2012 Jan; 64(1):321-2; author reply 322-3. doi: 10.1002/art.33397.
8. Ter Haar NM, Oswald M, Jeyaratnam J, et al. Recommendations for the management of autoinflammatory diseases. Ann Rheum Dis. 2015 Sep;74(9):1636-44. doi: 10.1136/annrheumdis-2015-207546. Epub 2015 Jun 24.
Ter Haar NM, Oswald M, Jeyaratnam J, et al. Recommendations for the management of autoinflammatory diseases. Ann Rheum Dis. 2015 Sep;74(9):1636-44. doi: 10.1136/annrheumdis-2015-207546. Epub 2015 Jun 24.
9. Ter Haar N, Lachmann H, Ozen S, et al. Treatment of autoinflammatory diseases: results from the Eurofever Registry and a literature review. Ann Rheum Dis. 2013 May; 72(5):678-85. doi: 10.1136/annrheumdis2011-201268. Epub 2012 Jun 29.
10. Benedetti F, Gattorno M, Anton J, et al. Canakinumab for the treatment of autoinflammatory recurrent fever syndromes. N Engl J Med. 2018 May 17;378(20):1908-19. doi: 10.1056/NEJMoa1706314.
11. Ozen S, Demirkaya E, Erer B, et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis. 2016 Apr;75(4):644-51. doi: 10.1136/annrheumdis-2015-208690. Epub 2016 Jan 22.
12. Soriano A, Soriano M, Espinosa G, et al. Current Therapeutic Options for the Main Monogenic Autoinflammatory Diseases and PFAPA Syndrome: Evidence-Based Approach and Proposal of a Practical Guide.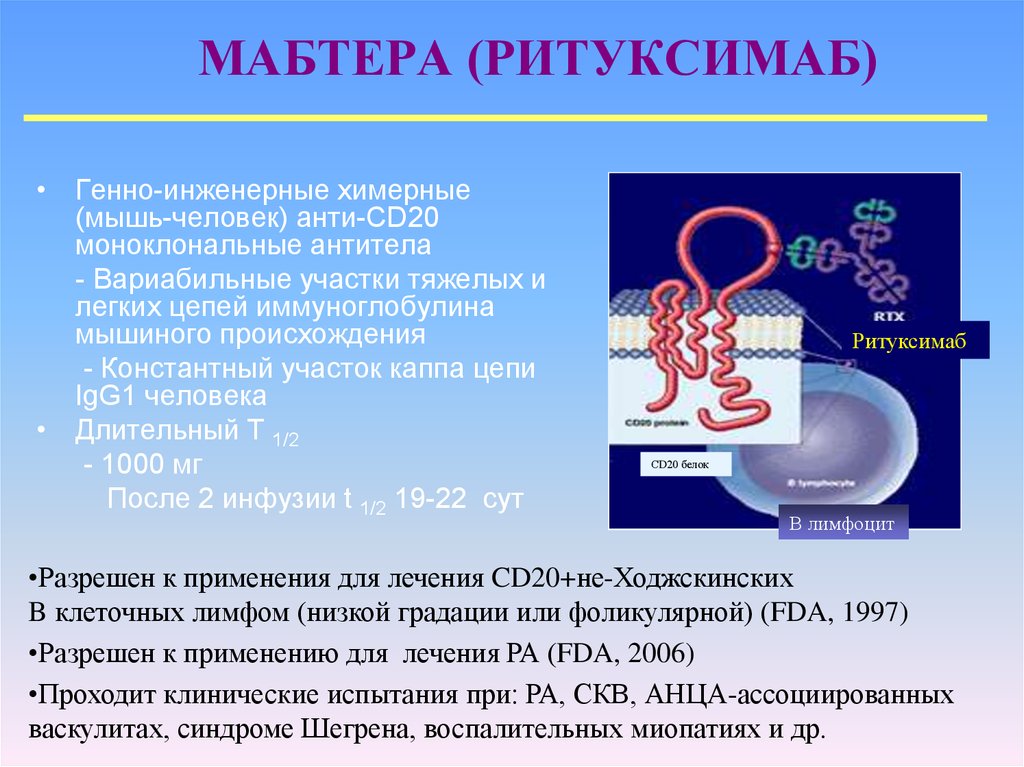 Front Immunol. 2020 Jun 3;11:865. doi: 10.3389/fimmu.2020.00865. eCollection 2020.
Front Immunol. 2020 Jun 3;11:865. doi: 10.3389/fimmu.2020.00865. eCollection 2020.
13. Kuemmerle-Deschner JB, Hofer F, Endres T, et al. Real-life effectiveness of canakinumab in cryopyrin-associated periodic syndrome. Rheumatology (Oxford). 2016 Apr;55(4):689-96. doi: 10.1093/rheumatology/kev416. Epub 2015 Dec 14.
14. Walker UA, Tilson HH, Hawkins PN, et al. Long-term safety and effectiveness of canakinumab therapy in patients with cryopyrin-associated periodic syndrome: results from the β-Confident Registy. RMD Open. 2021 May;7(2):e001663. doi: 10.1136/rmdopen-2021-001663.
15. Kuemmerle-Deschner J, Gautam R, George A, et al. Systematic literature review of efficacy/effectiveness and safety of current therapies for the treatment of cryopyrinassociated periodic syndrome, hyperimmunoglobulin D syndrome and tumour necrosis factor receptor-associated periodic syndrome. RMD Open. 2020 Jul;6(2):e001227. doi: 10.1136/rmdopen-2020-001227.
16. De Benedetti F, Frenkel J, Calvo I, et al. Efficacy and safety of canakinumab in patients with colchicine-resistant familial Mediterranean fever, hyperimmunoglobulin D syndrome/mevalonate kinase deficiency and TNF receptor-associated periodic syndrome: 40 week results from the pivotal phase 3 umbrella cluster trial. Arthritis Rheum 2016; 68:4369-71.
Efficacy and safety of canakinumab in patients with colchicine-resistant familial Mediterranean fever, hyperimmunoglobulin D syndrome/mevalonate kinase deficiency and TNF receptor-associated periodic syndrome: 40 week results from the pivotal phase 3 umbrella cluster trial. Arthritis Rheum 2016; 68:4369-71.
17. Козлова АЛ, Варламова ТВ, Зимин СБ и др. Опыт ведения больных с гипер-IgDсиндромом (синдромом дефицита мевалонаткиназы). Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2016;15(1):46–53.
Биологические методы лечения ревматоидного артрита: обзор для клинициста
1. Алетаха Д., Смолен Дж. Диагностика и лечение ревматоидного артрита: обзор. ЯМА . 2018;320(13):1360–1372. doi: 10.1001/jama.2018.13103 [PubMed] [CrossRef] [Google Scholar]
2. Crowson CS, Rollefstad S, Ikdahl E, et al. Влияние факторов риска на сердечно-сосудистые исходы у больных ревматоидным артритом. Энн Реум Дис . 2018;77(1):48–54. doi: 10.1136/annrheumdis-2017-211735 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Almutair K, Nossent J, Preen D, Keen H, Inderjeeth C. Глобальная распространенность ревматоидного артрита: метаанализ, основанный на систематическом обзоре. Ревматол Инт . 2021;41(5):863–877. doi: 10.1007/s00296-020-04731-0 [PubMed] [CrossRef] [Google Scholar]
Almutair K, Nossent J, Preen D, Keen H, Inderjeeth C. Глобальная распространенность ревматоидного артрита: метаанализ, основанный на систематическом обзоре. Ревматол Инт . 2021;41(5):863–877. doi: 10.1007/s00296-020-04731-0 [PubMed] [CrossRef] [Google Scholar]
4. Smolen J, Aaletaha D, Barton A, et al. Ревматоидный артрит. Nat Rev Dis Primers . 2018;4:18001. doi: 10.1038/nrdp.2018.1 [PubMed] [CrossRef] [Google Scholar]
5. Бреннан Ф.М., Майни Р.Н., Фельдман М. ФНО-альфа – ключевая роль при ревматоидном артрите? Br J Реумтол . 1992;31(5):293. doi: 10.1093/rheumatology/31.5.293 [PubMed] [CrossRef] [Google Scholar]
6. Keystone E, Genovese M, Klareskog L, et al. Голимумаб, человеческое антитело к фактору некроза опухоли {альфа}, вводимое в виде ежемесячных подкожных инъекций при активном ревматоидном артрите, несмотря на терапию метотрексатом: исследование GO-FORWARD. Энн Реум Дис . 2009;68(6):789–796. doi: 10.1136/ard.2008. 099010 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
099010 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Maini R, St Clair E, Breedveld F, et al. Инфликсимаб (химерное моноклональное антитело против фактора некроза опухоли альфа) в сравнении с плацебо у пациентов с ревматоидным артритом, получающих сопутствующую терапию метотрексатом: рандомизированное исследование фазы III. Ланцет . 1999;354(9194):1932–1939. doi: 10.1016/s0140-6736(99)05246-0 [PubMed] [CrossRef] [Google Scholar]
8. Keystone E, Kavanaugh A, Sharp J, et al. Рентгенологические, клинические и функциональные результаты лечения адалимумабом (человеческое моноклональное антитело против фактора некроза опухоли) у пациентов с активным ревматоидным артритом, получающих сопутствующую терапию метотрексатом. Рандомизированное плацебо-контролируемое 52-недельное исследование. Ревматоидный артрит . 2004;50(5):1400–1411. doi: 10.1002/art.20217 [PubMed] [CrossRef] [Google Scholar]
9. Keystone E, van der Heijde D, Mason D, et al. Цертолизумаб пегол плюс метотрексат значительно более эффективен, чем плацебо плюс метотрексат при активном ревматоидном артрите: результаты многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования с параллельными группами, длившегося пятьдесят две недели, фазы III. Ревматоидный артрит . 2008;58(11):3319–3329. дои: 10.1002/ст.23964 [PubMed] [CrossRef] [Google Scholar]
Цертолизумаб пегол плюс метотрексат значительно более эффективен, чем плацебо плюс метотрексат при активном ревматоидном артрите: результаты многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования с параллельными группами, длившегося пятьдесят две недели, фазы III. Ревматоидный артрит . 2008;58(11):3319–3329. дои: 10.1002/ст.23964 [PubMed] [CrossRef] [Google Scholar]
10. Weinblatt M, Kremer J, Bankhurst A, et al. Испытание этанерцепта, рекомбинантного рецептора фактора некроза опухоли: белка fcfusion, у пациентов с ревматоидным артритом, получающих метотрексат. N Английский J Med . 1999;340(4):253-259. doi: 10.1056/NEJM1993400401 [PubMed] [CrossRef] [Google Scholar]
11. Breedveld FC, Weisman MH, Kavanaugh AF, et al. Исследование PREMIER — многоцентровое рандомизированное двойное слепое клиническое исследование комбинированной терапии адалимумабом и метотрексатом в сравнении с монотерапией метотрексатом или монотерапией адалимумабом у пациентов с ранним агрессивным ревматоидным артритом, которые ранее не лечились метотрексатом. Ревматоидный артрит . 2006;54(1):26–37. doi: 10.1002/art.21519 [PubMed] [CrossRef] [Google Scholar]
Ревматоидный артрит . 2006;54(1):26–37. doi: 10.1002/art.21519 [PubMed] [CrossRef] [Google Scholar]
12. Smolen JS, Kay J, Doyle MK, et al. Голимумаб у пациентов с активным ревматоидным артритом после лечения ингибиторами фактора некроза опухоли альфа (исследование GO-AFTER): многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы. Ланцет . 2009;374(9685):210–221. doi: 10.1016/S0140-6736(09)60506-7 [PubMed] [CrossRef] [Google Scholar]
13. Gottenberg JE, Brocq O, Perdriger A, et al. Биопрепарат, не нацеленный на ФНО, по сравнению со вторым препаратом против ФНО для лечения ревматоидного артрита у пациентов с недостаточным ответом на первый препарат против ФНО: рандомизированное клиническое исследование. ЯМА . 2016;316(11):1172–1180. doi: 10.1001/jama.2016.13512 [PubMed] [CrossRef] [Google Scholar]
14. Fraenkel L, Bathon J, England B, et al. Руководство Американского колледжа ревматологов 2021 года по лечению ревматоидного артрита. Рес для лечения артрита . 2021;73(7):924–939. doi: 10.1002/acr.24596 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Рес для лечения артрита . 2021;73(7):924–939. doi: 10.1002/acr.24596 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Dubois E, Cohen A. Abatacept. Бр Дж Клин Фармакол . 2009;68(4):480–481. дои: 10.1111/j.1365-2125.2009.03502.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Westhovens R, Robles M, Zimenes AC, et al. Клиническая эффективность и безопасность абатацепта у пациентов, ранее не получавших метотрексат, с ранним ревматоидным артритом и плохими прогностическими факторами. Энн Реум Дис . 2009;68(12):1870–1877. doi: 10.1136/ard.2008.101121 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Kremer K, Genant H, Moreland L, et al. Эффекты абатацепта у пациентов с устойчивым к метотрексату активным ревматоидным артритом: рандомизированное исследование. Энн Интерн Мед . 2006;144(12):865–876. doi: 10.7326/0003-4819-144-12-200606200-00003 [PubMed] [CrossRef] [Google Scholar]
18. Schiff M, Keiserman M, Codding C, et al. Эффективность и безопасность абатацепта или инфликсимаба по сравнению с плацебо в ATTEST: многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы у пациентов с ревматоидным артритом и неадекватным ответом на метотрексат. Энн Реум Дис . 2008;67(8):1096–1103. doi: 10.1136/ard.2007.080002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Schiff M, Keiserman M, Codding C, et al. Эффективность и безопасность абатацепта или инфликсимаба по сравнению с плацебо в ATTEST: многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы у пациентов с ревматоидным артритом и неадекватным ответом на метотрексат. Энн Реум Дис . 2008;67(8):1096–1103. doi: 10.1136/ard.2007.080002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Genovese MC, Becker JC, Schiff M, et al. Абатацепт при ревматоидном артрите, рефрактерном к ингибированию фактора некроза опухоли альфа. N Английский J Med . 2005;353(11):1114–1123. doi: 10.1056/NEJMoa050524 [PubMed] [CrossRef] [Google Scholar]
20. Burmester GR, Rigby WF, van Vollenhoven RF, et al. Тоцилизумаб при раннем прогрессирующем ревматоидном артрите: FUNCTION, рандомизированное контролируемое исследование. Энн Реум Дис . 2015;75(6):1081–1091. doi: 10.1136/annrheumdis-2015-207628 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Эмери П., Кистоун Э., Тони Х.П. и др. Ингибирование рецептора IL-6 с помощью тоцилизумаба улучшает результаты лечения пациентов с ревматоидным артритом, рефрактерным к биологическим препаратам против фактора некроза опухоли: результаты 24-недельного многоцентрового рандомизированного плацебо-контролируемого исследования. Энн Реум Дис . 2008;67(11):1516–1523. doi: 10.1136/ard.2008.09293 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эмери П., Кистоун Э., Тони Х.П. и др. Ингибирование рецептора IL-6 с помощью тоцилизумаба улучшает результаты лечения пациентов с ревматоидным артритом, рефрактерным к биологическим препаратам против фактора некроза опухоли: результаты 24-недельного многоцентрового рандомизированного плацебо-контролируемого исследования. Энн Реум Дис . 2008;67(11):1516–1523. doi: 10.1136/ard.2008.09293 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Gabay C, Emery P, van Vollenhoven R, et al. Монотерапия тоцилизумабом по сравнению с монотерапией адалимумабом для лечения ревматоидного артрита (ADACTA): рандомизированное двойное слепое контролируемое исследование 4 фазы. Ланцет . 2013;381(9877):1541–1550. doi: 10.1016/S0140-6736(13)60250-0 [PubMed] [CrossRef] [Google Scholar]
23. Burmester GR, Lin Y, Patel R, et al. Эффективность и безопасность монотерапии сарилумабом по сравнению с монотерапией адалимумабом для лечения пациентов с активным ревматоидным артритом (MONARCH): рандомизированное двойное слепое исследование III фазы с параллельными группами.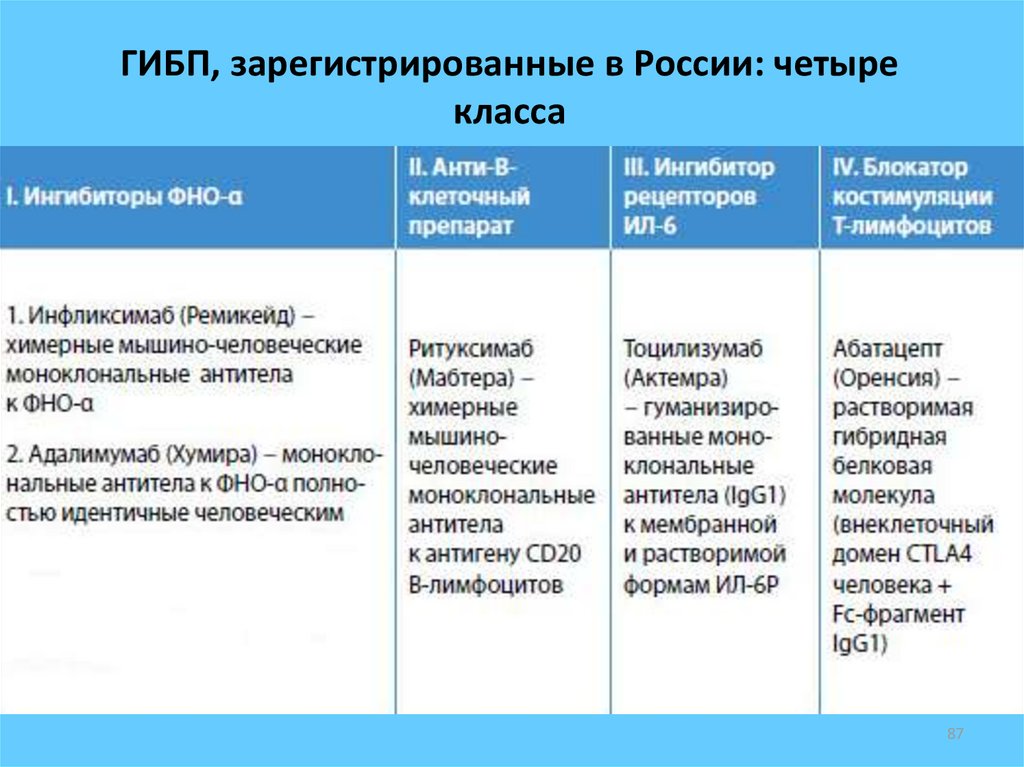 Энн Реум Дис . 2017;76(5):840–847. doi: 10.1136/annrheumdis-2016-210310 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Энн Реум Дис . 2017;76(5):840–847. doi: 10.1136/annrheumdis-2016-210310 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Vershueren P, Emery P, van Hoogstraten H, et al. Эффективность сарилумаба у пациентов с ревматоидным артритом с предшествующим ответом на тоцилизумаб и без него. Энн Реум Дис . 2018;77(доп. 2):327–328. doi: 10.1136/annrheumdis-2018-eular.1376 [CrossRef] [Google Scholar]
25. Porter D, van Melckebeke J, Dale J, et al. Ингибирование фактора некроза опухоли по сравнению с ритуксимабом у пациентов с ревматоидным артритом, нуждающихся в биологическом лечении (ORBIT): открытое рандомизированное контролируемое исследование не меньшей эффективности. Ланцет . 2016;18(388):239–247. doi: 10.1016/S0140-6736(16)00380-9 [PubMed] [CrossRef] [Google Scholar]
26. Emery P, Gottenberg JE, Rubbert-Roth A, et al. Ритуксимаб по сравнению с альтернативным ингибитором ФНО у пациентов с ревматоидным артритом, которые не ответили на один предыдущий ингибитор ФНО: SWITCH-RA, глобальное обсервационное сравнительное исследование эффективности. Энн Реум Дис . 2015;74(6):979–984. doi: 10.1136/annrheumdis-2013-203993 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Энн Реум Дис . 2015;74(6):979–984. doi: 10.1136/annrheumdis-2013-203993 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Мертен М., Сингх Дж. Анакинра при ревматоидном артрите. Кокрановская база данных Syst Rev . 2009. doi: 10.1002/14651858.CD005121.pub3 [PubMed] [CrossRef] [Google Scholar]
28. Smolen J, Goncalves J, Quinn M, Benedetti F, Lee JY. Эра биоаналогов в ревматологии: изменение среды здравоохранения. РМД Открыть . 2019;5(1):e000900. doi: 10.1136/rmdopen-2019-000900 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Feagan BG, Marabani M, Wu JJ, Facacin F, Spronk C, Castaneda-Hernandez G. Проблемы о смене терапии в развивающемся ландшафте множественных биоаналогов: описательный обзор текущих данных. Доп Тер . 2020;37(11):4491–4518. doi: 10.1007/s12325-020-01472-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Van Vollenhoven RF, Fleischmann R, Cohen S, et al. Тофацитиниб или адалимумаб по сравнению с плацебо при ревматоидном артрите. N Английский J Med . 2012;367(6):508–519. doi: 10.1056/NEJMoa1112072 [PubMed] [CrossRef] [Google Scholar]
Тофацитиниб или адалимумаб по сравнению с плацебо при ревматоидном артрите. N Английский J Med . 2012;367(6):508–519. doi: 10.1056/NEJMoa1112072 [PubMed] [CrossRef] [Google Scholar]
31. Ramiro S, Gaujoux-Viala C, Nam JL, et al. Безопасность синтетических и биологических DMARD: систематический обзор литературы, информирующий об обновлении 2013 года рекомендаций EULAR по лечению ревматоидного артрита. Энн Реум Дис . 2014;73(3):529–535. doi: 10.1136/annrheumdis-2013-204575 [PubMed] [CrossRef] [Google Scholar]
32. Элерс С. Роль фактора некроза опухоли (TNF) в защите хозяина от туберкулеза: последствия для иммунотерапии, нацеленной на TNF. Энн Реум Дис . 2003;62(2):37–42. doi: 10.1136/ard.62.suppl_2.ii37 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Listing J, Gerhold K, Zink A. Риск инфекции, связанный с ревматоидным артритом, с его сопутствующие заболевания и лечение. Ревматология . 2012;51(1):53–61. doi: 10. 1093/rheumatology/kes305 [PubMed] [CrossRef] [Google Scholar]
1093/rheumatology/kes305 [PubMed] [CrossRef] [Google Scholar]
34. Askling J, Fored CM, Brandt L, et al. Риск и характеристики случаев туберкулеза при ревматоидном артрите, ассоциированном с антагонистами фактора некроза опухоли, в Швеции. Ревматоидный артрит . 2005;53(7):1986–1992. doi: 10.1002/art.21137 [PubMed] [CrossRef] [Google Scholar]
35. Dixon WG, Hyrich KL, Watson KD, et al. Лекарственно-специфический риск туберкулеза у пациентов с ревматоидным артритом, получавших терапию против TNF: результаты из Регистра биологических препаратов Британского общества ревматологов (BSRBR). Энн Реум Дис . 2010;69(3):522–528. doi: 10.1136/ard.2009.118935 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Mitka M. FDA: повышенный риск реактивации HBV при применении офатумумаба или ритуксимаба. ЯМА . 2012;310(16):1664. doi: 10.1001/jama.2013.281115 [PubMed] [CrossRef] [Google Scholar]
37. Clifford DB, Ances B, Costello C, et al.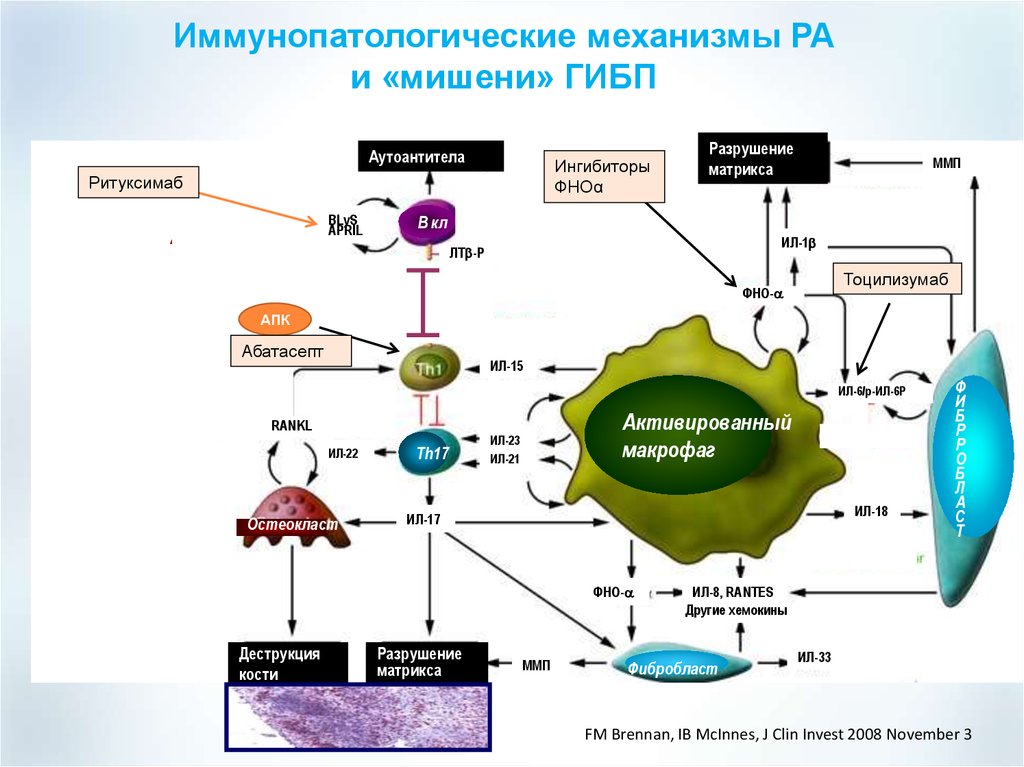 Ритуксимаб-ассоциированная прогрессирующая мультифокальная лейкоэнцефалопатия при ревматоидном артрите. Арка Нейрол . 2001;68(9): 1156–1164. doi: 10.1001/archneurol.2011.103 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ритуксимаб-ассоциированная прогрессирующая мультифокальная лейкоэнцефалопатия при ревматоидном артрите. Арка Нейрол . 2001;68(9): 1156–1164. doi: 10.1001/archneurol.2011.103 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Chen SK, Liao KP, Liu J, Kim SC. Риск госпитализации инфекции и начало лечения абатацептом по сравнению с ингибиторами фактора некроза опухоли среди пациентов с ревматоидным артритом: когортное исследование с сопоставлением показателей предрасположенности. Рес для лечения артрита . 2020;72(1):9–17. doi: 10.1002/acr.23824 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Holroyd CR, Seth R, Bukhari M, et al. Руководство по безопасности биологического DMARD Британского общества ревматологов при воспалительном артрите. Ревматология . 2019;58(2):e3–e42. doi: 10.1093/rheumatology/key208 [PubMed] [CrossRef] [Google Scholar]
40. Mercer LK, Askling J, Raaschou P, et al. Риск инвазивной меланомы у пациентов с ревматоидным артритом, получающих лечение биологическими препаратами: результаты совместного проекта 11 европейских биологических регистров. Энн Реум Дис . 2017;76(2):386–391. doi: 10.1136/annrheumdis-2016-209285 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Энн Реум Дис . 2017;76(2):386–391. doi: 10.1136/annrheumdis-2016-209285 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Wang KL, Yin WJ, Zhou LY, et al. Риск немеланомного рака кожи у пациентов с ревматоидным артритом, получающих антагонист ФНО: систематический обзор и метаанализ. Клин Ревматол . 2020;39(3):769–778. doi: 10.1007/s10067-019-04865-y [PubMed] [CrossRef] [Google Scholar]
42. Chatzidionysiou K, Delcoigne B, Frisell T, et al. Как мы используем биопрепараты у пациентов с ревматоидным артритом со злокачественными новообразованиями в анамнезе? Оценка моделей лечения с использованием скандинавских регистров. РМД Открыть . 2020;6(2):e001363. doi: 10.1136/rmdopen-2020-001363 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Regierer AC, Strangfeld A. Лечение ревматоидного артрита у пациентов с раком в анамнезе. Curr Opin Rheumatol . 2018;30(3):288–294. doi: 10.1097/BOR.0000000000000492 [PubMed] [CrossRef] [Google Scholar]
44. Pappas D, Rebello S, Liu M, et al. Терапия биологическими агентами после диагностики солидных злокачественных новообразований: результаты регистра corrona. J Ревматол . 2019;46(11):1438–1444. doi: 10.3899/jrheum.171457 [PubMed] [CrossRef] [Google Scholar]
Pappas D, Rebello S, Liu M, et al. Терапия биологическими агентами после диагностики солидных злокачественных новообразований: результаты регистра corrona. J Ревматол . 2019;46(11):1438–1444. doi: 10.3899/jrheum.171457 [PubMed] [CrossRef] [Google Scholar]
45. Brahmer JR, Lacchetti C, Schneider BJ, et al. Лечение связанных с иммунитетом нежелательных явлений у пациентов, получавших терапию ингибиторами контрольных точек иммунного ответа: практическое руководство Американского общества клинической онкологии. J Клин Онкол . 2018;36(17):1714–1768. doi: 10.1200/JCO.2017.77.6385 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Chen AY, Wolchok JD, Bass AR. ФНО в эпоху ингибиторов иммунных контрольных точек: друг или враг? Nat Rev Ревматол . 2021;17(4):213–223. doi: 10.1038/s41584-021-00584-4 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Mohan N, Edwards ET, Cupps TR, et al. Демиелинизация, происходящая во время терапии фактором некроза опухоли альфа при воспалительных артритах.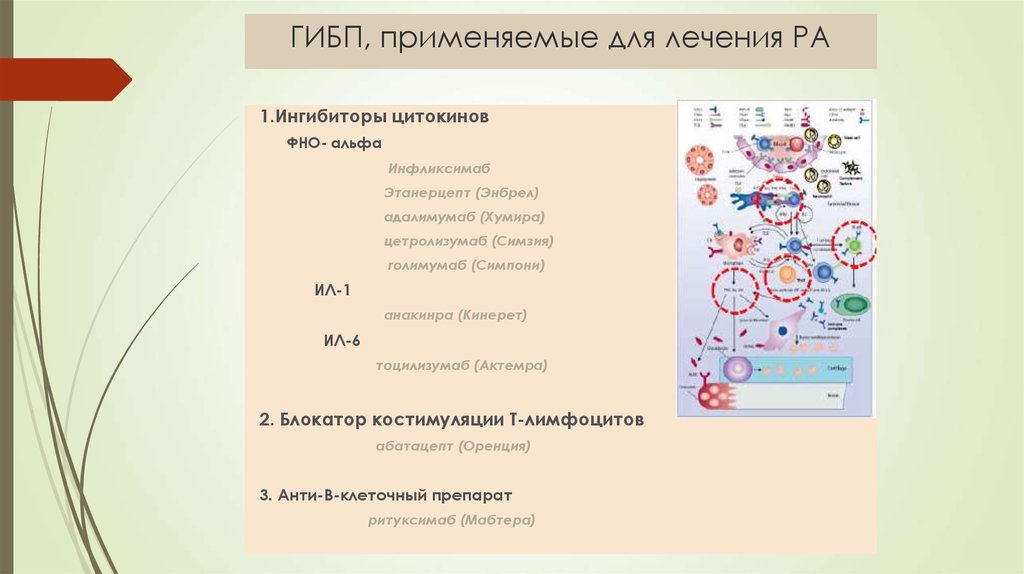 Ревматоидный артрит . 2001;44(12):2862–2869. doi: 10.1002/1529-0131(200112)44:12<2862::aid-art474>3.0.co;2-w [PubMed] [CrossRef] [Google Scholar]
Ревматоидный артрит . 2001;44(12):2862–2869. doi: 10.1002/1529-0131(200112)44:12<2862::aid-art474>3.0.co;2-w [PubMed] [CrossRef] [Google Scholar]
48. Kwon HJ, Cote TR, Cuffe MS , Крамер Дж.М., Браун М.М. Сообщения о случаях сердечной недостаточности после терапии антагонистом фактора некроза опухоли. Энн Интерн Мед . 2003;138(10):807–811. doi: 10.7326/0003-4819-138-10-200305200-00008 [PubMed] [CrossRef] [Google Scholar]
49. Strangfeld A, Richter A, Siegmund B, et al. Риск перфорации нижних отделов кишечника у пациентов с ревматоидным артритом, получающих лечение тоцилизумабом, по сравнению с лечением другими биологическими или традиционными синтетическими БПВП. Энн Реум Дис . 2017;76(3):504–510. doi: 10.1136/annrheumdis-2016-209773 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Smolen JS, Landewe RB, Bijlsma JW, et al. Рекомендации EULAR по лечению ревматоидного артрита синтетическими и биологическими противоревматическими препаратами, модифицирующими заболевание: обновление 2019 г. Энн Реум Дис . 2019;79(6):685–699. doi: 10.1136/annrheumdis-2019-216655 [PubMed] [CrossRef] [Google Scholar]
Энн Реум Дис . 2019;79(6):685–699. doi: 10.1136/annrheumdis-2019-216655 [PubMed] [CrossRef] [Google Scholar]
51. Bykerk VP, Massarotti EM. Новые критерии ремиссии ACR/EULAR: обоснование разработки новых критериев ремиссии. Ревматология . 2012;51(supp6):vi16–vi20. doi: 10.1093/rheumatology/kes281 [PubMed] [CrossRef] [Google Scholar]
52. Schaeverbeke T, Truchetet ME, Kostine M, Barnetche T, Bannwarth B, Richez C. Иммуногенность биологических агентов у пациентов с ревматоидным артритом: уроки для клиническая практика. Ревматология . 2016;55(2):210–220. doi: 10.1093/rheumatology/kev277 [PubMed] [CrossRef] [Google Scholar]
53. Skorpen CG, Hoeltzenbein M, Rincani A, et al. EULAR указывает на необходимость применения противоревматических препаратов до беременности, а также во время беременности и кормления грудью. Энн Реум Дис . 2015;75(5):795–810. doi: 10.1136/annrheumdis-2015-208840 [PubMed] [CrossRef] [Google Scholar]
54. Mariette X, Forger F, Abraham B, et al. Отсутствие плацентарного переноса цертолизумаба пегола во время беременности: результаты проспективного постмаркетингового фармакокинетического исследования CRIB. Энн Реум Дис . 2017;77(2):228–233. doi: 10.1136/annrheumdis-2017-212196 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Mariette X, Forger F, Abraham B, et al. Отсутствие плацентарного переноса цертолизумаба пегола во время беременности: результаты проспективного постмаркетингового фармакокинетического исследования CRIB. Энн Реум Дис . 2017;77(2):228–233. doi: 10.1136/annrheumdis-2017-212196 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Monti S, Balduzzi S, Delvino P, Bellis E, Quadrelli VS, Montecucco C. Клиническое течение COVID -19в группе пациентов с хроническим артритом, получавших таргетную иммуносупрессивную терапию. Энн Реум Дис . 2020;79(5):667–668. doi: 10.1136/annrheumdis-2020-217424 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Conticini E, Bargagli E, Bardelli M, et al. Пневмония COVID-19 у большой когорты пациентов, получавших биологические и таргетные синтетические противоревматические препараты. Энн Реум Дис . 2021;80(2):e14. doi: 10.1136/annrheumdis-2020-217681 [PubMed] [CrossRef] [Google Scholar]
57. Haberman R, Axelrad J, Chen A, et al. COVID-19 при иммуноопосредованных воспалительных заболеваниях — серия случаев из Нью-Йорка. N Английский J Med . 2020;383(1):85–88. doi: 10.1056/NEJMc2009567 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Haberman R, Axelrad J, Chen A, et al. COVID-19 при иммуноопосредованных воспалительных заболеваниях — серия случаев из Нью-Йорка. N Английский J Med . 2020;383(1):85–88. doi: 10.1056/NEJMc2009567 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Gianfrancesco M, Hyrich KL, Al-Adely S, et al. Характеристики, связанные с госпитализацией по поводу COVID-19 у людей с ревматическим заболеванием: данные из регистра врачей глобального ревматологического альянса COVID-19. Энн Реум Дис . 2020;79(7):859–866. doi: 10.1136/annrheumdis-2020-217871 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Damiani G, Pacifico A, Bragazzi NL, Malagoli P. Биопрепараты повышают риск SARS-CoV-2 инфекция и госпитализация, но не госпитализация и смерть в отделении интенсивной терапии: реальные данные большой когорты во время объявления красной зоны. Дерматол Тер . 2020;33(5):e13475. doi: 10.1111/dth.13475 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Mikuls TR, Johnson SR, Fraenkel L, et al. Руководство Американского колледжа ревматологов по лечению ревматических заболеваний у взрослых пациентов во время пандемии COVID-19: версия 3. Arthritis Rheumatol . 2021;73(2):e1–e12. doi: 10.1002/art.41596 [PubMed] [CrossRef] [Google Scholar]
Mikuls TR, Johnson SR, Fraenkel L, et al. Руководство Американского колледжа ревматологов по лечению ревматических заболеваний у взрослых пациентов во время пандемии COVID-19: версия 3. Arthritis Rheumatol . 2021;73(2):e1–e12. doi: 10.1002/art.41596 [PubMed] [CrossRef] [Google Scholar]
61. Совместная группа RECOVERY. Тоцилизумаб у пациентов, госпитализированных с COVID-19 (ВОССТАНОВЛЕНИЕ): рандомизированное, контролируемое, открытое, платформенное исследование. Ланцет . 2021;397 (10285): 1637–1645. doi: 10.1016/S0140-6736(21)00676-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Curtis JR, Johnson SR, Anthony DD, et al. Руководство Американского колледжа ревматологов по вакцинации против COVID-19 у пациентов с ревматическими заболеваниями и заболеваниями опорно-двигательного аппарата: версия 1. Arthritis Rheumatol . 2021;73(7):1093–1107. doi: 10.1002/art.41734 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Youssef P, Marcal B, Button P, et al. Причины прекращения применения противоревматических препаратов, модифицирующих биологические и целевые синтетические заболевания, и сохранение терапии второй линии в наборе данных по ревматоидному артриту. J Ревматол . 2020;47(8):1174–1181. doi: 10.3899/jrheum.190535 [PubMed] [CrossRef] [Google Scholar]
Youssef P, Marcal B, Button P, et al. Причины прекращения применения противоревматических препаратов, модифицирующих биологические и целевые синтетические заболевания, и сохранение терапии второй линии в наборе данных по ревматоидному артриту. J Ревматол . 2020;47(8):1174–1181. doi: 10.3899/jrheum.190535 [PubMed] [CrossRef] [Google Scholar]
64. Ebina K, Hirano T, Maeda Y, et al. Задержка лекарственного средства 7 биопрепаратов и тофацитиниба у пациентов с ревматоидным артритом, ранее не получавших биологические препараты, и пациентов, перешедших на биологические препараты: когортное исследование ANSWER. Артрит Res Ther . 2020;22(1):142. doi: 10.1186/s13075-020-02232-w [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Movaahedi M, Couta S, Cesta C, et al. Время до прекращения биологической терапии по механизму действия при ревматоидном артрите: результаты когорты инициативы по исследованию передовой практики Онтарио (OBRI). Энн Реум Дис . 2018;77(доп. 2):958. doi: 10.1136/annrheumdis-2018-eular.2131 [CrossRef] [Google Scholar]
2018;77(доп. 2):958. doi: 10.1136/annrheumdis-2018-eular.2131 [CrossRef] [Google Scholar]
66. Blaess J, Walther J, Petitdemange A, et al. Иммунодепрессанты при ревматоидном артрите: систематический обзор клинических испытаний и их текущей стадии разработки. Ther Adv Musculoskelet Dis . 2020;12:1759720X20959971. doi: 10.1177/1759720X20959971 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Emery P, Fleischmann R, Filipowicz-Sosnowska A, et al. Эффективность и безопасность ритуксимаба у пациентов с активным ревматоидным артритом, несмотря на лечение метотрексатом: результаты рандомизированного, двойного слепого, плацебо-контролируемого исследования с диапазоном доз фазы IIB. Ревматоидный артрит . 2006;54(5):1390–1400. doi: 10.1002/art.21778 [PubMed] [CrossRef] [Google Scholar]
68. Cohen S, Emery P, Greenwald M, et al. Ритуксимаб при ревматоидном артрите, рефрактерном к терапии факторами некроза опухоли: результаты многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования фазы III, оценивающего первичную эффективность и безопасность через двадцать четыре недели. Ревматоидный артрит . 2006;54(9):2793–2806. doi: 10.1002/art.22025 [PubMed] [CrossRef] [Google Scholar]
Ревматоидный артрит . 2006;54(9):2793–2806. doi: 10.1002/art.22025 [PubMed] [CrossRef] [Google Scholar]
69. Misan Gary M.H.. Australian Medicines Handbook 2020 . Аделаида: Australian Medicines Handbook Pty Ltd; Июль 2020 г. Доступно по адресу https://amhonline.amh.net.au/. По состоянию на 3 августа 2021 г. [Google Scholar]
Биологические препараты для лечения ревматоидного артрита
Модификаторы биологического ответа — это новый класс препаратов, используемых для лечения ревматоидного артрита (РА). Эти современные биопрепараты значительно улучшили лечение многих людей с ревматоидным артритом.
В отличие от старых противоревматических препаратов, модифицирующих заболевание (БМАРП), биологические БМАРП (бБМАРП) производятся с использованием биотехнологии. Они генетически спроектированы так, чтобы действовать как естественные белки в вашей иммунной системе.
Ваш врач может порекомендовать вам начать лекарственную терапию сразу после постановки диагноза, что поможет справиться с повреждением суставов.
Хотя биологические препараты не лечат ревматоидный артрит, они могут замедлить его прогрессирование. Они также могут вызывать меньше побочных эффектов, чем другие виды лекарств.
Ваш врач может дать вам биологический препарат вместе с противоревматическим препаратом метотрексатом или вместо него. Прием биологического препарата с метотрексатом эффективен при лечении ревматоидного артрита у многих людей.
Некоторые биологические препараты блокируют действие белка иммунной системы, называемого интерлейкином-1 (ИЛ-1). ИЛ-1 часто называют основным цитокином, поскольку он контролирует местное и системное воспаление в организме.
Биологические DMARD (bDMARD) воздействуют на пути иммунной системы.
Они часто ингибируют различные белки, рецепторы и клетки, вызывающие воспаление, такие как интерлейкин-6 (ИЛ-6), интерлейкин-1 (ИЛ-1), С-реактивный белок (СРБ) и CD80/86.
bDMARD в этом классе препаратов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения ревматоидного артрита, включают:0300 сарилумаб (Кевзара): ингибитор ИЛ-6
Фактор некроза опухоли альфа, или ФНО-альфа, естественным образом встречается в организме.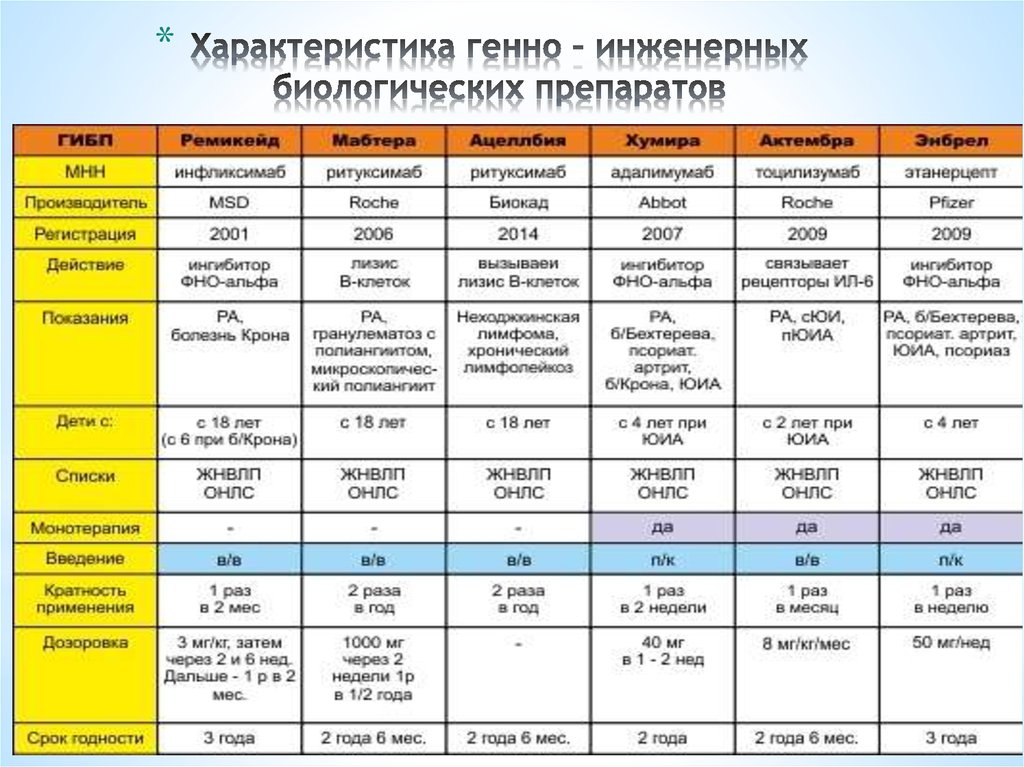 Он может увеличиваться у людей с РА, вызывая боль и отек.
Он может увеличиваться у людей с РА, вызывая боль и отек.
Ингибиторы TNF-альфа помогают ингибировать это увеличение TNF. Биологические DMARD также включают ингибиторы TNF-альфа, такие как:
- certolizumab pegol (Cimzia)
- etanercept (Enbrel)
- adalimumab (Humira)
- infliximab (Remicade)
- golimumab (Simponi), an injectable drug
- golimumab (Simponi Aria), an infusion drug
Биоаналоги классифицируются как ингибиторы TNF-альфа или bDMARD и достаточно похожи на существующие биологические препараты, чтобы давать аналогичные результаты.
Биоаналоги, используемые для лечения РА, включают:
- адалимумаб-афзб (Абрилада)
- adalimumab-atto (Amjevita)
- infliximab-axxq (Avsola)
- adalimumab-adbm (Cyltezo)
- etanercept-szzs (Erelzi)
- etanercept-ykro (Eticovo)
- adalimumab-bwwd (Hadlima)
- адалимумаб-fkjp (Hulio)
- адалимумаб-адаз (Hyrimoz)
- инфликсимаб-dyyb (Inflectra)
- инфликсимаб-абда (Renflexis)
Некоторые из этих препаратов действуют довольно быстро. Другим могут потребоваться недели или месяцы, чтобы вступить в силу. Каждый человек реагирует на эти препараты по-разному, и не все хорошо реагируют на один и тот же препарат.
Другим могут потребоваться недели или месяцы, чтобы вступить в силу. Каждый человек реагирует на эти препараты по-разному, и не все хорошо реагируют на один и тот же препарат.
Некоторые люди могут принимать только биопрепараты, но многим людям потребуется биопрепарат плюс другой класс лекарств.
Большинство биологических препаратов вводятся в виде инъекций. Некоторые вводятся под кожу. Другие должны быть введены непосредственно в вену.
Биопрепараты блокируют сигналы иммунной системы, участвующие в воспалительном процессе, который приводит к повреждению ткани сустава.
Первый тип биологических препаратов, одобренных для лечения ревматоидного артрита, был разработан для воздействия на белок под названием TNF. Эти препараты называются биологическими препаратами против TNF, и они блокируют определенные этапы воспалительного процесса.
Хотя они не подавляют иммунную систему в целом, как обычные DMARD, они влияют на функцию иммунной системы.
Методы
Биопрепараты иногда лучше контролируют прогрессирование РА, чем другие БПВП, поскольку они воздействуют на специфические медиаторы воспаления при РА. Эти новые биологические препараты действуют в организме по-разному.
Эти новые биологические препараты действуют в организме по-разному.
Некоторые из этих препаратов нарушают определенные химические сигналы, участвующие в воспалении, или они могут воздействовать непосредственно на Т- или В-клетки, препятствуя воспалительному процессу.
Многие биологические препараты воздействуют на активность фактора некроза опухоли (ФНО), ключевого белка иммунной системы.
Тофацитиниб (Xeljanz) относится к новому классу препаратов, называемых ингибиторами Янус-ассоциированной киназы (JAK).
Классифицируется как пероральный небиологический БПВП. Он работает, блокируя клеточный сигнальный путь внутри клеток. Это останавливает производство компонентов, вызывающих воспаление.
Старые биологические препараты блокируют воспаление снаружи клеток, а ингибиторы JAK действуют изнутри клеток. Тофацитиниб не вводится. Он выпускается в виде таблеток, которые принимают два раза в день.
Upadacitinib (Rinvoq) и Olumiant (барицитиниб) — другие новые ингибиторы JAK, принимаемые перорально.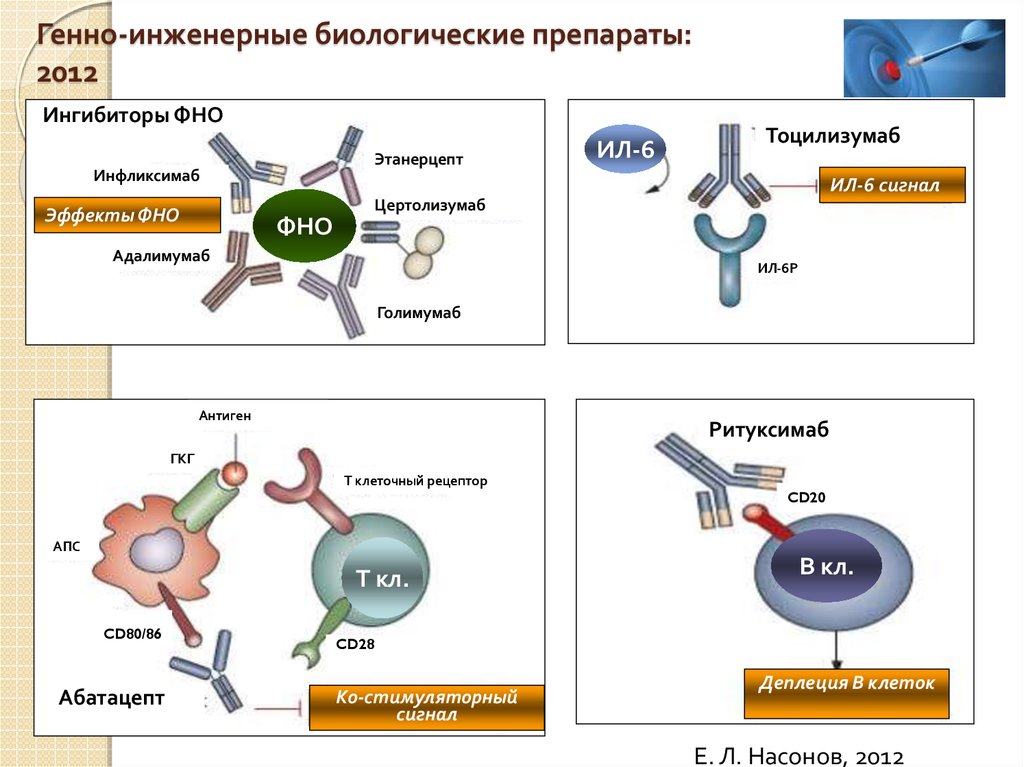 Упадацитиниб получил одобрение FDA для лечения РА в 2019 году. Олумиант получил одобрение FDA для лечения ТА в 2018 году.
Упадацитиниб получил одобрение FDA для лечения РА в 2019 году. Олумиант получил одобрение FDA для лечения ТА в 2018 году.
Биопрепараты работают в лечении РА у большего числа людей, поскольку они воздействуют на определенные части иммунной системы для уменьшения воспаления в суставах.
Это означает, что у них может быть меньше побочных эффектов, чем у других типов лекарств. Но любой препарат, подавляющий иммунную систему, несет в себе риски.
Побочные эффекты могут включать:
- тяжелые инфекции, такие как инфекции легких
- поражение печени
- снижение способности вырабатывать новые клетки крови
- тошнота
- боль или отек в месте инъекции рака
Некоторые лекарства, используемые для лечения ревматоидного артрита, влияющие на иммунную систему, могут повышать риск развития рака, особенно лимфомы.
У людей, живущих с аутоиммунным артритом, тяжесть воспаления в прошлом ассоциировалась с повышенным риском развития лимфомы.
Более поздние исследования показали, что эти лекарства могут не повышать риск развития рака, поэтому необходимы дополнительные исследования. Для многих людей, живущих с другими рисками, преимущества лечения РА перевешивают любые более высокие риски рака.
Сообщите своему врачу о любых необычных симптомах, которые у вас есть, включая лихорадку или другие симптомы, которые вы не можете объяснить.
Например, биопрепараты могут снова вызвать активацию латентной инфекции. По этой причине вам следует пройти тест на туберкулез и скрининг на гепатит, прежде чем принимать один из этих препаратов.
Люди с заболеваниями печени могут быть не в состоянии принимать биологические препараты. Если у вас есть проблемы с печенью, спросите своего врача, безопасны ли для вас биопрепараты.
Биопрепараты появились относительно недавно. Если вы и ваш врач рассматриваете биологический препарат, имейте в виду следующее:
- Биопрепараты могут лучше справляться с вашими симптомами, чем старые лекарства от ревматоидного артрита.

