Интересные факты о фторе. Применение фтора
- Блог
09-03-2019 00:00
Самый активный неметалл позволил создать совершенно инертные химические соединения: фторопласты и фреоны.
Фторопласты (тетрафторэтилены) называют органической платиной за их стойкость к химическим веществам, низко- и высокотемпературным воздействиям. Знаменитый тефлон, использующийся для изготовления антипригарной посуды, изоляционных, смазочных материалов, человеческих имплантатов и многих других продуктов — это фторопласт. В нашем блоге есть подробная статья, посвященная этим удивительным материалам.
Фреон-14 CF4 и фреон-12 CF2Cl2 считаются одними из самых безопасных хладагентов.
| Колба, фторопласт | Натрий фтористый |
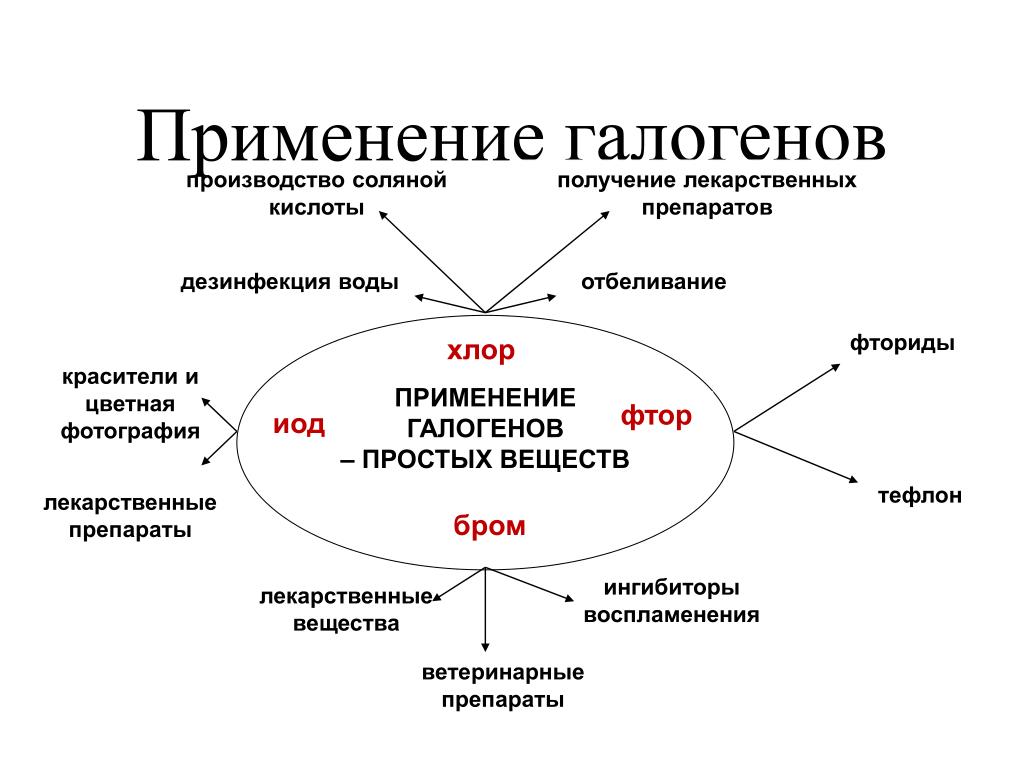
Применение фтора
- Для фторирования воды, зубных паст и даже молока для детей.
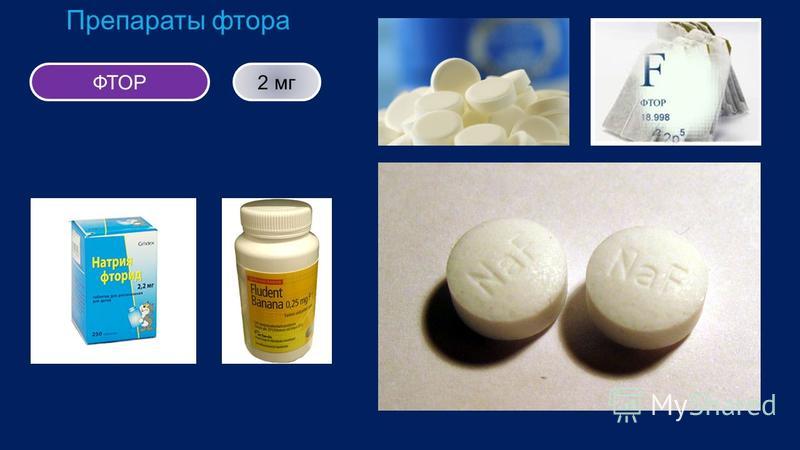
- В фармацевтике используется во многих лекарственных средствах для лечения щитовидной железы, сахарного диабета, рака, глаукомы, ревматизма, заболеваний бронхов, малярии, стрепто- и стафиллококковых инфекций, психических заболеваний (галоперидол, флуоксетин). А также в обезболивающих препаратах, средствах для наркоза. Различные формы фторида натрия применяются для восполнения недостатка фтора в организме, для лечения и профилактики кариеса. Фторуглеводороды используются как кровезаменители.
- В сельском хозяйстве — входит в состав средств для борьбы с грызунами и другими вредителями.
- Для резки металла во фтористоводородных горелках (t горения фтора в водороде +3700 °С), а также в горелках, использующих соединения хлора и фтора; трехфтористого фтора, азота и водорода.

- Для получения производных фтора, например, фторидов вольфрама и ванадия.
- Фтороводород (плавиковая кислота) применяется в стекольной (для травления стекла), химической (сырье, катализатор, растворитель), нефтяной, пищевой, металлургической, авиационной, целлюлозно-бумажной и других отраслях.
- В высоковольтной электротехнике применяется шестифтористая сера SF6 в качестве газообразного изолятора.
- Шестифтористый уран UF6 — крайне востребованное соединение для выделения урана-235 для атомных станций и военной промышленности.
- В металлургии гексафторалюминат натрия Na3[AlF6] используется как электролит при получении алюминия.
- Из фторида магния изготавливают линзы и призмы для специализированных оптических приборов.
- Фторопласты являются производными фторорганических соединений. Очень востребованы в металлургии, машино- и авиастроении, радиоэлектронике, электротехнике, медицине, текстильпроме, строительстве, в космической и военной отраслях.
 Используются при изготовлении антипригарной посуды, химически стойкой посуды и многого другого.
Используются при изготовлении антипригарной посуды, химически стойкой посуды и многого другого. - Фреоны 14 и 12 используются в качестве хладагентов в холодильниках и кондиционерах. Их применяют для тушения пожаров, в качестве смазочных материалов, инертных растворителей, как сырье для производства полимеров.
- Соединения фтора с кислородом или галогенами применяются как составная часть ракетного топлива.
Реакция фтора с другими веществами. Воздействие фтора на человека Цинк стеариновокислый — востребованный промышленностью ПАВ
Фтор
| Фтор | |
|---|---|
| Атомный номер | 9 |
| Внешний вид простого вещества |
Фтор в сосуде Бледно-жёлтый газ,чрезвычайно химически активен.  Очень ядовит. |
| Свойства атома | |
|
Атомная масса (молярная масса) |
18,998403 а. е. м. (г/моль) |
| Радиус атома | 71 пм |
|
Энергия ионизации (первый электрон) |
1680,0 (17,41) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p5 |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
|
Электроотрицательность (по Полингу) |
3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Термодинамические свойства простого вещества | |
| Плотность | (при −189 °C)1,108 г/см³ |
| Молярная теплоёмкость | 31,34 Дж/(K·моль) |
| Теплопроводность | 0,028 Вт/(м·K) |
| Температура плавления | 53,53 K |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 K |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки |
5,50 b=3,28 c=7,28 β=90. 0 Å 0 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор | |
Фтор — элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером 9. Обозначается символом F Fluorum. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор (формула F2). Очень ядовит.
Очень ядовит.
История
Схема атома фтора
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18
Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 |
2. 629 629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной со следующими параметрами решётки:
| Параметр | и значение |
|---|---|
| a | 550 пм |
| b | 328 пм |
| c | 728 пм |
| α=β=γ | 90° |
Получение
Лабораторный метод получения фтора
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
- K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2
-
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.

Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
- 2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
- XeF8 → XeF6 + F2
- MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов — химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Ракетная техника
-
Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.

Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Дополнительная информация
Фториды
Соединения фтора в ракетной технике
Соединения фтора в медицине
Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Фтор | Использование, свойства и факты
фтор
Посмотреть все СМИ
- Ключевые люди:
- Анри Муассан Эдмон Фреми
- Похожие темы:
- химический элемент галоген флюороз
См. все сопутствующие материалы →
фтор (F) , самый активный химический элемент и самый легкий из галогенных элементов, или группа 17 (группа VIIa) периодической таблицы. Его химическую активность можно объяснить чрезвычайной способностью притягивать электроны (это самый электроотрицательный элемент) и малым размером его атомов. 9Атомный номер точка
9Атомный номер точка
Фторсодержащий минерал плавиковый шпат (или флюорит) был описан в 1529 году немецким врачом и минералог Георгиус Агрикола. Представляется вероятным, что неочищенная плавиковая кислота была впервые получена неизвестным английским мастером-стекольщиком в 1720 году. В 1771 году шведский химик Карл Вильгельм Шееле получил плавиковую кислоту в нечистом состоянии путем нагревания плавикового шпата с концентрированной серной кислотой в стеклянной реторте, которая сильно разъела коррозию. продукт; в результате в последующих экспериментах с веществом использовались сосуды из металла. Почти безводная кислота была получена в 1809 г. , а два года спустя французский физик Андре-Мари Ампер предположил, что это соединение водорода с неизвестным элементом, аналогичным хлору, для которого он предложил название фтор. Затем было установлено, что плавиковый шпат представляет собой фторид кальция.
, а два года спустя французский физик Андре-Мари Ампер предположил, что это соединение водорода с неизвестным элементом, аналогичным хлору, для которого он предложил название фтор. Затем было установлено, что плавиковый шпат представляет собой фторид кальция.
Выделение фтора долгое время было одной из главных нерешенных проблем неорганической химии, и только в 1886 году французский химик Анри Муассан получил этот элемент путем электролиза раствора фтористого калия во фтористом водороде. Он получил 1906 Нобелевская премия по химии за выделение фтора. Трудность обращения с этим элементом и его токсичные свойства способствовали медленному развитию химии фтора. Действительно, вплоть до Второй мировой войны этот элемент представлял собой лабораторную диковинку. Затем, однако, использование гексафторида урана для разделения изотопов урана, наряду с разработкой органических соединений фтора, имеющих промышленное значение, сделало фтор широко используемым промышленным химическим веществом.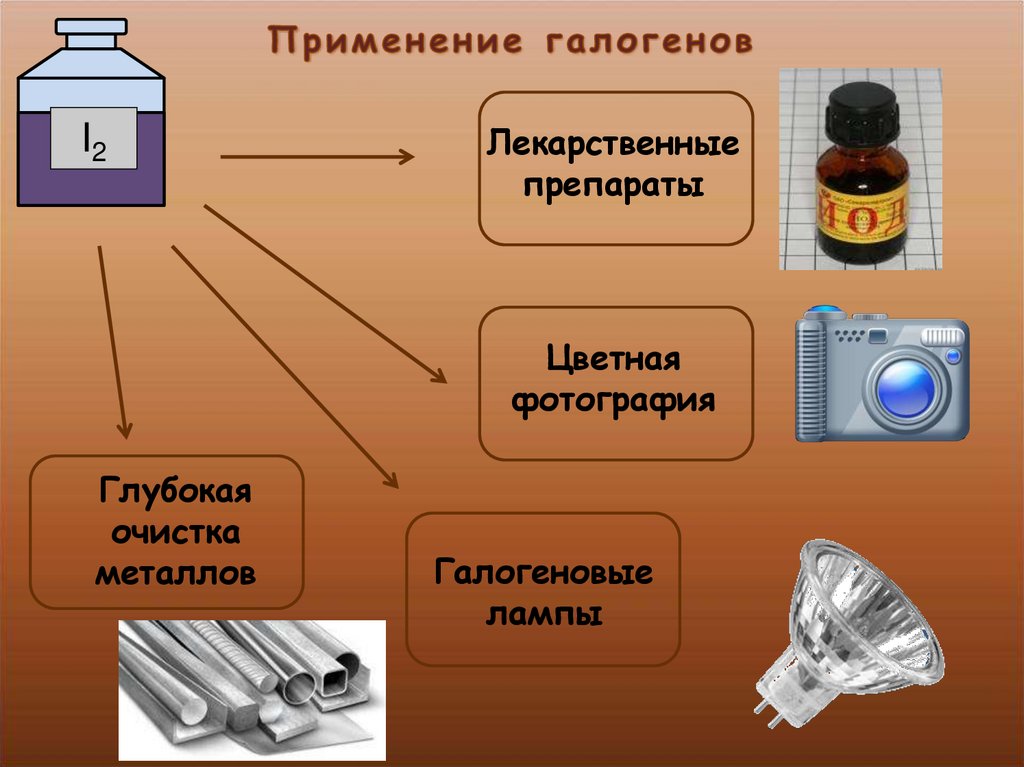
Возникновение и распространение
Фторсодержащий минеральный плавиковый шпат (флюорит, CaF 2 ) веками использовался в качестве флюса (очистителя) в различных металлургических процессах. Название плавикового шпата происходит от латинского fluere , «течь». Минерал впоследствии оказался источником элемента, который получил соответствующее название фтор. Бесцветные прозрачные кристаллы плавикового шпата при освещении приобретают голубоватый оттенок, и это свойство, соответственно, известно как флуоресценция.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Фтор встречается в природе только в виде его химических соединений, за исключением следовых количеств свободного элемента в плавиковом шпате, подвергшемся облучению радием. Нередкий элемент, он составляет около 0,065 процента земной коры. Основными фторсодержащими минералами являются (1) плавиковый шпат, месторождения которого находятся в Иллинойсе, Кентукки, Дербишире, на юге Германии, юге Франции и России и являются основным источником фтора, (2) криолит (Na 3 AlF 6 ), в основном из Гренландии, (3) фторапатит (Ca 5 [PO 4 ] 3 [F,Cl]), широко распространенный и содержащий различные количества фтора и хлора, ( 4) топаз (Al 2 SiO 4 [F,OH] 2 ), драгоценный камень, и (5) лепидолит, слюда, а также компонент костей и зубов животных.
Физические и химические свойства
При комнатной температуре фтор представляет собой газ бледно-желтого цвета с раздражающим запахом. Вдыхание газа опасно. При охлаждении фтор становится желтой жидкостью. Существует только один стабильный изотоп этого элемента — фтор-19..
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Поскольку фтор является наиболее электроотрицательным элементом, группы атомов, богатые фтором, часто заряжены отрицательно. Метилиодид (CH 3 I) и трифторйодметан (CF 3 I) имеют различное распределение заряда, как показано в следующих формулах, в которых греческий символ δ указывает на частичный заряд:
Энергия первой ионизации фтора очень высока (402 ккал на моль), что дает стандартное теплообразование для катиона F + в 420 ккал на моль.
Небольшой размер атома фтора позволяет упаковать относительно большое количество атомов или ионов фтора вокруг данного координационного центра (центрального атома), где он образует множество устойчивых комплексов, например, гексафторсиликат (SiF 6 ) 2− и гексафторалюминат (AlF 6 ) 3− . Фтор — самый сильный окислитель. Следовательно, никакое другое вещество не способно окислить фторид-анион до свободного элемента, и по этой причине этот элемент не встречается в природе в свободном состоянии. Более 150 лет ни один химический метод не позволял получить этот элемент, успех достигался только с помощью электролитических методов. Однако в 1986 году американский химик Карл О. Кристе сообщил о первом химическом получении фтора, где «химическое получение» означает метод, в котором не используются такие методы, как электролиз, фотолиз и разряд, или не используется сам фтор в синтезе любого из химических соединений. исходные материалы. Он использовал К 2 MnF 6 и пентафторид сурьмы (SbF 5 ), оба из которых могут быть легко получены из растворов HF.
Фтор — самый сильный окислитель. Следовательно, никакое другое вещество не способно окислить фторид-анион до свободного элемента, и по этой причине этот элемент не встречается в природе в свободном состоянии. Более 150 лет ни один химический метод не позволял получить этот элемент, успех достигался только с помощью электролитических методов. Однако в 1986 году американский химик Карл О. Кристе сообщил о первом химическом получении фтора, где «химическое получение» означает метод, в котором не используются такие методы, как электролиз, фотолиз и разряд, или не используется сам фтор в синтезе любого из химических соединений. исходные материалы. Он использовал К 2 MnF 6 и пентафторид сурьмы (SbF 5 ), оба из которых могут быть легко получены из растворов HF.
Высокая окислительная способность фтора позволяет этому элементу давать самые высокие степени окисления, возможные среди других элементов, и известно много фторидов элементов с высокой степенью окисления, для которых нет других соответствующих галогенидов, например, дифторид серебра (AgF 2 ), трифторид кобальта (CoF 3 ), гептафторид рения (ReF 7 ), пентафторид брома (BrF 5 ) и гептафторид йода (IF 7 ).
Фтор (F 2 ), состоящий из двух атомов фтора, соединяется со всеми другими элементами, кроме гелия и неона, с образованием ионных или ковалентных фторидов. Некоторые металлы, такие как никель, быстро покрываются фторидным слоем, что предотвращает дальнейшее воздействие элемента на металл. Некоторые сухие металлы, такие как мягкая сталь, медь, алюминий или монель (66 % никеля, 31,5 % медного сплава), не подвергаются воздействию фтора при обычных температурах. Для работы со фтором при температуре до 600 °C (1100 °F) подходит монель; спеченный оксид алюминия устойчив до 700 ° C (1300 ° F). Когда требуются смазочные материалы, лучше всего подходят фторуглеродные масла. Фтор бурно реагирует с органическими веществами (например, с каучуком, деревом, тканью), и контролируемое фторирование органических соединений действием элементарного фтора возможно только при соблюдении особых мер предосторожности.
Факты о фторе | Live Science
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Вот как это работает.
Наиболее реакционноспособный элемент Периодической таблицы, фтор имеет бурную историю в поисках своего открытия. Несмотря на сложные, а иногда и взрывоопасные свойства фтора, он является жизненно важным элементом для людей и животных, поэтому он обычно содержится в питьевой воде и зубной пасте.
Только факты
- Атомный номер (количество протонов в ядре): 9
- Символ атома (в Периодической таблице элементов): F
- Атомный вес (средняя масса атома): 18,998
- Плотность : 0,001696 грамм на кубический сантиметр
- Фаза при комнатной температуре: газ
- Температура плавления: минус 363,32 градуса по Фаренгейту (минус 219,62 градуса по Цельсию)
- Температура кипения: минус 306,62 градуса по Фаренгейту (минус 188,12 градуса по Цельсию)
- 0183 Количество изотопов (атомы одного и того же элемента с разным числом нейтронов): 18
- Наиболее распространенные изотопы: F-19 (100% естественное содержание)
История
Ранние химики годами пытались выделить этот элемент из различных фторидов. Только в 1986 году немецкий химик Карл О. Кристи успешно синтезировал фтор и сообщил о своих результатах в журнале «Неорганическая химия». Фтор не встречается в природе в свободном виде; но в 2012 году исследователи обнаружили небольшое количество фтора в антозоните, разновидности радиоактивного флюорита.
Только в 1986 году немецкий химик Карл О. Кристи успешно синтезировал фтор и сообщил о своих результатах в журнале «Неорганическая химия». Фтор не встречается в природе в свободном виде; но в 2012 году исследователи обнаружили небольшое количество фтора в антозоните, разновидности радиоактивного флюорита.
Веками минеральный плавиковый шпат использовался для очистки металлов. Согласно Chemicool, известный сегодня как фторид кальция (CaF 2 ), он использовался в качестве флюса для отделения чистого металла от нежелательных минералов в руде. «Флуор» происходит от латинского слова «fluere», что означает «течь», потому что плавиковый шпат позволяет металлам делать это. По данным Лаборатории Джефферсона, этот минерал также называли богемским изумрудом и использовали для травления стекла.
Многие ученые на протяжении десятилетий пытались экспериментировать с плавиковым шпатом, чтобы лучше изучить его свойства, а также состав. В своих экспериментах химики часто получали плавиковую кислоту (сегодня известную как плавиковая кислота, HF), невероятно реактивную и опасную кислоту. Согласно Chemicool, даже небольшие брызги этой кислоты на кожу могут быть смертельными. Несколько ученых были ранены, ослеплены или убиты в ходе некоторых экспериментов.
Согласно Chemicool, даже небольшие брызги этой кислоты на кожу могут быть смертельными. Несколько ученых были ранены, ослеплены или убиты в ходе некоторых экспериментов.
В начале 19 века ученые Андре-Мари Ампер из Франции и Хамфри Дэви из Англии вели переписку о возможности появления нового элемента в кислоте. В 1813 году Дэви объявил об открытии нового элемента и назвал его фтором по предложению Ампера.
Анри Муассан, французский химик, наконец выделил фтор в 1886 году — после того, как его несколько раз отравили. Он был удостоен Нобелевской премии в 1906 году за выделение фтора электролизом сухого фтороводорода калия (KHF 2 ) и сухая плавиковая кислота.
Использование фтора
По данным Королевского общества, в течение многих лет соли фтора или фториды использовались при сварке и матировании стекла. Например, плавиковая кислота используется для травления стекла лампочек.
По данным Королевского общества, фтор является жизненно важным элементом в ядерной энергетике. Он используется для получения гексафторида урана, необходимого для разделения изотопов урана. Гексафторид серы — это газ, используемый для изоляции мощных электрических трансформаторов.
Он используется для получения гексафторида урана, необходимого для разделения изотопов урана. Гексафторид серы — это газ, используемый для изоляции мощных электрических трансформаторов.
Хлорфторуглероды (ХФУ) когда-то использовались в аэрозолях, холодильниках, кондиционерах, пенной упаковке пищевых продуктов и огнетушителях. По данным Национального института здравоохранения, эти виды использования запрещены с 1996 года, поскольку они способствуют разрушению озонового слоя. До 2009 г. ХФУ использовались в ингаляторах для борьбы с астмой, но в 2013 г. эти типы ингаляторов были выведены из эксплуатации. ). Тефлон хорошо известен своими антипригарными свойствами и используется в сковородах. Он также используется для изоляции кабелей, для сантехнической ленты и в качестве основы Gore-Tex® (используется в водонепроницаемой обуви и одежде).
По данным лаборатории Джефферсона, фтор добавляется в городское водоснабжение в пропорции примерно одна часть на миллион для предотвращения кариеса. В зубную пасту добавляют несколько соединений фтора, которые также помогают предотвратить кариес.
В зубную пасту добавляют несколько соединений фтора, которые также помогают предотвратить кариес.
Воздействие фтора на здоровье и окружающую среду
Хотя все люди и животные подвергаются воздействию фтора в незначительных количествах и нуждаются в нем, элемент в любой достаточно большой дозе чрезвычайно токсичен и опасен. По данным Lenntech, фтор естественным образом содержится в воде, воздухе, а также в небольших количествах как в продуктах растительного, так и животного происхождения. Большее количество фтора содержится в некоторых пищевых продуктах, таких как чай и моллюски.
В то время как небольшое количество фтора необходимо для поддержания прочности наших костей и зубов, слишком большое его количество может иметь обратный эффект, вызывая остеопороз или кариес, а также может нанести вред почкам, нервам и мышцам.
В газообразной форме фтор невероятно опасен. По данным Lenntech, небольшие количества газообразного фтора могут вызывать раздражение глаз и носа, а большие количества могут быть смертельными. Согласно Chemicool, фтористоводородная кислота, как еще один пример, также может оказаться фатальной при попадании даже небольшого брызга на кожу.
Согласно Chemicool, фтористоводородная кислота, как еще один пример, также может оказаться фатальной при попадании даже небольшого брызга на кожу.
По данным Lenntech, в окружающей среде фтор, 13-й наиболее распространенный элемент в земной коре, обычно оседает в почве и легко соединяется с почвой, горными породами, углем и глиной. Растения могут поглощать фтор из почвы, хотя высокие концентрации могут привести к повреждению. Кукуруза и абрикосы, например, относятся к числу растений, которые наиболее подвержены повреждению и ослаблению роста при воздействии повышенных уровней фтора.
Кто знал?
- Поскольку фтор является наиболее химически активным элементом, с ним следует обращаться с особой осторожностью, поскольку иногда он может взорваться при контакте со всеми другими элементами, кроме кислорода, гелия, неона и криптона, согласно Chemicool.
- Стальная вата воспламеняется при воздействии фтора, по данным Королевского химического общества.
- Фтор также является наиболее электроотрицательным элементом.
 Фтор притягивает электроны легче, чем любой другой элемент.
Фтор притягивает электроны легче, чем любой другой элемент. - В среднем количество фтора в организме человека составляет три миллиграмма.
- По данным Minerals Education Coalition, фтор в основном добывается в Китае, Монголии, России, Мексике и Южной Африке.
- Фтор образуется в солнцеподобных звездах ближе к концу их жизни, согласно статье 2014 года, опубликованной в Astrophysical Journal Letters. Этот элемент формируется при более высоких давлениях и температурах внутри звезды, когда она расширяется и становится красным гигантом. Когда внешние слои звезды отталкиваются, образуя планетарную туманность, фтор перемещается вместе с другими газами в межзвездную среду, в конечном итоге образуя новые звезды и планеты.
- По данным журнала «Химия», примерно 25 процентов лекарств и лекарств, в том числе для лечения рака, центральной нервной и сердечно-сосудистой систем, содержат ту или иную форму фтора.
Текущие исследования
Хотя фтор может быть токсичным при слишком высокой концентрации в организме, он также может быть полезным элементом для включения в противораковые препараты, согласно статье 2018 года, опубликованной в Journal of Fluorine Chemistry. Согласно исследованиям, замена углерод-водородных или углерод-кислородных связей на углерод-фтор-связь в активных компонентах препарата обычно свидетельствует об улучшении эффективности препаратов, включая более высокую метаболическую стабильность, усиление связывания с молекулами-мишенями и усиление проницаемость мембраны. Есть надежда, что с повышенной эффективностью лекарств в сочетании с опухолеспецифическими мишенями или системами доставки лекарств качество жизни больных раком может быть значительно улучшено по сравнению с традиционными методами, такими как химиотерапия, при которой раковые клетки, как а также здоровые клетки, являются мишенью для препаратов.
Согласно исследованиям, замена углерод-водородных или углерод-кислородных связей на углерод-фтор-связь в активных компонентах препарата обычно свидетельствует об улучшении эффективности препаратов, включая более высокую метаболическую стабильность, усиление связывания с молекулами-мишенями и усиление проницаемость мембраны. Есть надежда, что с повышенной эффективностью лекарств в сочетании с опухолеспецифическими мишенями или системами доставки лекарств качество жизни больных раком может быть значительно улучшено по сравнению с традиционными методами, такими как химиотерапия, при которой раковые клетки, как а также здоровые клетки, являются мишенью для препаратов.
Это новое поколение лекарств для борьбы с раком, а также фторсодержащие зонды для доставки лекарств, были протестированы против раковых стволовых клеток и показали многообещающие результаты в нацеливании и борьбе с раковыми стволовыми клетками, согласно исследованию. Исследователи обнаружили, что препараты, в состав которых входит фтор, в несколько раз более активны в отношении различных раковых стволовых клеток и проявляют лучшую стабильность, чем традиционные противораковые препараты.
Дополнительные ресурсы
- Лаборатория Джефферсона: фтор
- Chemicool: факты об элементе фтора
- Королевское химическое общество: фтор
Эта статья была обновлена 24 ноября 2020 г., чтобы включить информацию о химическом синтезе фтора и открытии фтора в природе. .
Будьте в курсе последних научных новостей, подписавшись на нашу рассылку Essentials.
Свяжитесь со мной, чтобы сообщить о новостях и предложениях от других брендов Future. Получайте электронные письма от нас от имени наших надежных партнеров или спонсоров. Рэйчел Росс — научный писатель и редактор, специализирующийся на астрономии, науках о Земле, физических науках и математике. Она имеет степень бакалавра философии Калифорнийского университета в Дэвисе и степень магистра астрономии Университета Джеймса Кука. У нее также есть сертификат Стэнфордского университета в области научного письма. До того, как стать научным писателем, Рэйчел работала в обсерватории Лас-Кумбрес в Калифорнии, где специализировалась на образовании и просветительской деятельности, а также на научных исследованиях и работе с телескопами.

 Используются при изготовлении антипригарной посуды, химически стойкой посуды и многого другого.
Используются при изготовлении антипригарной посуды, химически стойкой посуды и многого другого.
 Фтор притягивает электроны легче, чем любой другой элемент.
Фтор притягивает электроны легче, чем любой другой элемент.