Дачные дела | Портал огородников
Тыква Грибовская кустовая 189 была выведена советскими селекционерами и внесена в Госреестр, в 1964 году. Оригинатором сорта является ФГБНУ «Федеральный научный центр овощеводства», расположенный в Одинцовском районе Московской области. Культура данного сорта рекомендована к выращиванию во всех областях России. Описание…
Read More→
Растение гейхерелла было получено искусственным путем, поэтому его просто невозможно повстречать в природных условиях. Селекционеры, создавшие его, хотели вывести очень красивое растение, идеально подходящее для ландшафтного дизайна. И у них это получилось. Особенности гейхереллы Гибрид гейхерелла является многолетником. Он был…
Read More→
От прочности и надежности фундамента зависит вся построенная конструкция. Именно поэтому следует учитывать правильность осуществления мероприятий при плохих погодных условиях, ведь это может отразиться на прочности основания. Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Read More→
Манник большой интересное злаковое растение.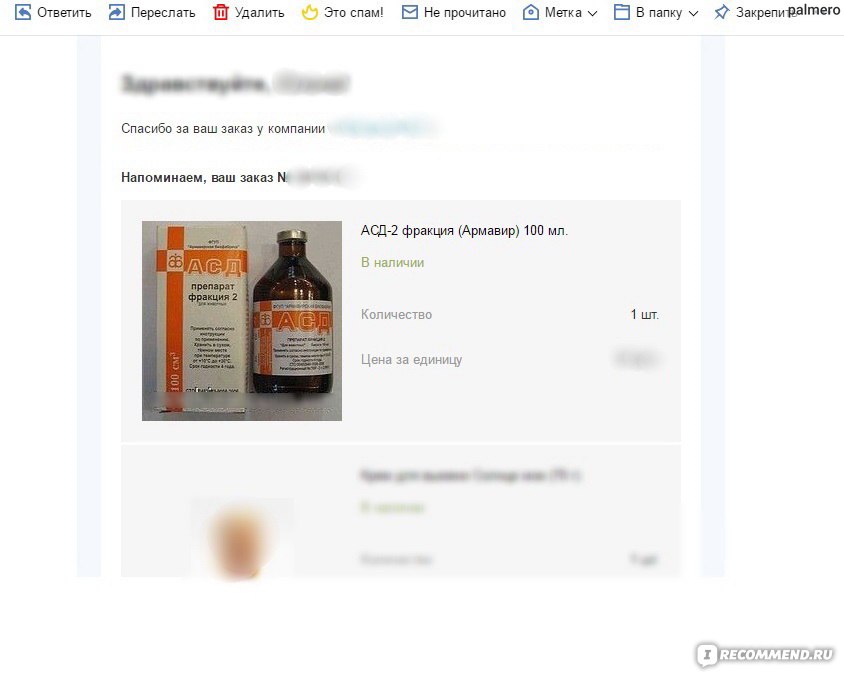 Он прекрасно растет и на солнце, и в тени, в воде и на суше. Очень неприхотлив и как нельзя лучше подходит для нашей цели – создать сад без хлопот. В цветниках его можно сочетать практически…
Он прекрасно растет и на солнце, и в тени, в воде и на суше. Очень неприхотлив и как нельзя лучше подходит для нашей цели – создать сад без хлопот. В цветниках его можно сочетать практически…
Read More→
Если вы приняли решение выращивать огурцы на открытых грядках, следует обратить внимание на то, сможет ли выбранный сорт комфортно себя чувствовать в погодных условиях региона. Так, теплолюбивые сорта не смогут обеспечить хороший урожай в северных широтах. Поэтому опытные огородники подбирают…
Read More→
С торфяными таблетками для рассады знаком практически каждый дачник, а слышали ли вы о таких помощниках, как кокосовые таблетки для рассады? Многие садоводы и огородники уже благополучно заменили торфяные таблетки именно кокосовыми! Что же они из себя представляют? Все очень…
Read More→
Как разбудить спящие почки? Детки — это новые миниатюрные растения со своими корнями и листиками. Чаще всего детки орхидеи появляются сами по себе. В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
Read More→
В садах и агрокультуре часто встречаются мелкие вредители. Их бывает сложно распознать из-за маленьких размеров или разнообразной окраски. Одними из таких насекомых является тля, с которыми часто борются садовники. Чтобы обезопасить растения от паразитов стоит знать, как выглядит тля, ее…
Read More→
Род Блехнум – Blechnum Семейство Асплениевые (Aspleniaceae). Описание Род Блехнум – это наземные папоротники со стелющимися, косыми или прямостоячими чешуйчатыми корневищами. Вайи все одинаковые или бесплодные, отличаются от спороносных. Бесплодные вайи перистосложные или перистораздельные, реже более или менее цельные, голые,…
Read More→
Если вы обнаружили в цветочном горшке белых червей, пора бить тревогу, потому что они отнюдь не безобидны. Из-за этих вредителей в земле не сможет взойти ни одно новое растение, а взрослое — может погибнуть. Если в почве присутствуют белые червячки,…
Если в почве присутствуют белые червячки,…
Read More→
Дачные дела | Портал огородников
Тыква Грибовская кустовая 189 была выведена советскими селекционерами и внесена в Госреестр, в 1964 году. Оригинатором сорта является ФГБНУ «Федеральный научный центр овощеводства», расположенный в Одинцовском районе Московской области. Культура данного сорта рекомендована к выращиванию во всех областях России. Описание…
Read More→
Растение гейхерелла было получено искусственным путем, поэтому его просто невозможно повстречать в природных условиях. Селекционеры, создавшие его, хотели вывести очень красивое растение, идеально подходящее для ландшафтного дизайна. И у них это получилось. Особенности гейхереллы Гибрид гейхерелла является многолетником. Он был…
Read More→
От прочности и надежности фундамента зависит вся построенная конструкция. Именно поэтому следует учитывать правильность осуществления мероприятий при плохих погодных условиях, ведь это может отразиться на прочности основания. Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Read More→
Манник большой интересное злаковое растение. Он прекрасно растет и на солнце, и в тени, в воде и на суше. Очень неприхотлив и как нельзя лучше подходит для нашей цели – создать сад без хлопот. В цветниках его можно сочетать практически…
Read More→
Если вы приняли решение выращивать огурцы на открытых грядках, следует обратить внимание на то, сможет ли выбранный сорт комфортно себя чувствовать в погодных условиях региона. Так, теплолюбивые сорта не смогут обеспечить хороший урожай в северных широтах. Поэтому опытные огородники подбирают…
Read More→
С торфяными таблетками для рассады знаком практически каждый дачник, а слышали ли вы о таких помощниках, как кокосовые таблетки для рассады? Многие садоводы и огородники уже благополучно заменили торфяные таблетки именно кокосовыми! Что же они из себя представляют? Все очень…
Read More→
Как разбудить спящие почки? Детки — это новые миниатюрные растения со своими корнями и листиками.
Read More→
В садах и агрокультуре часто встречаются мелкие вредители. Их бывает сложно распознать из-за маленьких размеров или разнообразной окраски. Одними из таких насекомых является тля, с которыми часто борются садовники. Чтобы обезопасить растения от паразитов стоит знать, как выглядит тля, ее…
Read More→
Род Блехнум – Blechnum Семейство Асплениевые (Aspleniaceae). Описание Род Блехнум – это наземные папоротники со стелющимися, косыми или прямостоячими чешуйчатыми корневищами. Вайи все одинаковые или бесплодные, отличаются от спороносных. Бесплодные вайи перистосложные или перистораздельные, реже более или менее цельные, голые,…
Read More→
Если вы обнаружили в цветочном горшке белых червей, пора бить тревогу, потому что они отнюдь не безобидны. Из-за этих вредителей в земле не сможет взойти ни одно новое растение, а взрослое — может погибнуть.
Read More→
Дачные дела | Портал огородников
Тыква Грибовская кустовая 189 была выведена советскими селекционерами и внесена в Госреестр, в 1964 году. Оригинатором сорта является ФГБНУ «Федеральный научный центр овощеводства», расположенный в Одинцовском районе Московской области. Культура данного сорта рекомендована к выращиванию во всех областях России. Описание…
Read More→
Растение гейхерелла было получено искусственным путем, поэтому его просто невозможно повстречать в природных условиях. Селекционеры, создавшие его, хотели вывести очень красивое растение, идеально подходящее для ландшафтного дизайна. И у них это получилось. Особенности гейхереллы Гибрид гейхерелла является многолетником. Он был…
Read More→
От прочности и надежности фундамента зависит вся построенная конструкция. Именно поэтому следует учитывать правильность осуществления мероприятий при плохих погодных условиях, ведь это может отразиться на прочности основания. Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Read More→
Манник большой интересное злаковое растение. Он прекрасно растет и на солнце, и в тени, в воде и на суше. Очень неприхотлив и как нельзя лучше подходит для нашей цели – создать сад без хлопот. В цветниках его можно сочетать практически…
Read More→
Если вы приняли решение выращивать огурцы на открытых грядках, следует обратить внимание на то, сможет ли выбранный сорт комфортно себя чувствовать в погодных условиях региона. Так, теплолюбивые сорта не смогут обеспечить хороший урожай в северных широтах. Поэтому опытные огородники подбирают…
Read More→
С торфяными таблетками для рассады знаком практически каждый дачник, а слышали ли вы о таких помощниках, как кокосовые таблетки для рассады? Многие садоводы и огородники уже благополучно заменили торфяные таблетки именно кокосовыми! Что же они из себя представляют? Все очень…
Read More→
Как разбудить спящие почки? Детки — это новые миниатюрные растения со своими корнями и листиками. Чаще всего детки орхидеи появляются сами по себе. В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
Чаще всего детки орхидеи появляются сами по себе. В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
Read More→
В садах и агрокультуре часто встречаются мелкие вредители. Их бывает сложно распознать из-за маленьких размеров или разнообразной окраски. Одними из таких насекомых является тля, с которыми часто борются садовники. Чтобы обезопасить растения от паразитов стоит знать, как выглядит тля, ее…
Read More→
Род Блехнум – Blechnum Семейство Асплениевые (Aspleniaceae). Описание Род Блехнум – это наземные папоротники со стелющимися, косыми или прямостоячими чешуйчатыми корневищами. Вайи все одинаковые или бесплодные, отличаются от спороносных. Бесплодные вайи перистосложные или перистораздельные, реже более или менее цельные, голые,…
Read More→
Если вы обнаружили в цветочном горшке белых червей, пора бить тревогу, потому что они отнюдь не безобидны. Из-за этих вредителей в земле не сможет взойти ни одно новое растение, а взрослое — может погибнуть. Если в почве присутствуют белые червячки,…
Если в почве присутствуют белые червячки,…
Read More→
Дачные дела | Портал огородников
Тыква Грибовская кустовая 189 была выведена советскими селекционерами и внесена в Госреестр, в 1964 году. Оригинатором сорта является ФГБНУ «Федеральный научный центр овощеводства», расположенный в Одинцовском районе Московской области. Культура данного сорта рекомендована к выращиванию во всех областях России. Описание…
Read More→
Растение гейхерелла было получено искусственным путем, поэтому его просто невозможно повстречать в природных условиях. Селекционеры, создавшие его, хотели вывести очень красивое растение, идеально подходящее для ландшафтного дизайна. И у них это получилось. Особенности гейхереллы Гибрид гейхерелла является многолетником. Он был…
Read More→
От прочности и надежности фундамента зависит вся построенная конструкция. Именно поэтому следует учитывать правильность осуществления мероприятий при плохих погодных условиях, ведь это может отразиться на прочности основания. Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Если случилось так, что бетонировать приходится в дождь, специалисты рекомендуют внимательно изучить правила…
Read More→
Манник большой интересное злаковое растение. Он прекрасно растет и на солнце, и в тени, в воде и на суше. Очень неприхотлив и как нельзя лучше подходит для нашей цели – создать сад без хлопот. В цветниках его можно сочетать практически…
Read More→
Если вы приняли решение выращивать огурцы на открытых грядках, следует обратить внимание на то, сможет ли выбранный сорт комфортно себя чувствовать в погодных условиях региона. Так, теплолюбивые сорта не смогут обеспечить хороший урожай в северных широтах. Поэтому опытные огородники подбирают…
Read More→
С торфяными таблетками для рассады знаком практически каждый дачник, а слышали ли вы о таких помощниках, как кокосовые таблетки для рассады? Многие садоводы и огородники уже благополучно заменили торфяные таблетки именно кокосовыми! Что же они из себя представляют? Все очень…
Read More→
Как разбудить спящие почки? Детки — это новые миниатюрные растения со своими корнями и листиками. Чаще всего детки орхидеи появляются сами по себе. В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
Чаще всего детки орхидеи появляются сами по себе. В тех случаях, когда хочется новых саженцев, а взрослое растение их не дает, требуется искусственная стимуляция. Для…
Read More→
В садах и агрокультуре часто встречаются мелкие вредители. Их бывает сложно распознать из-за маленьких размеров или разнообразной окраски. Одними из таких насекомых является тля, с которыми часто борются садовники. Чтобы обезопасить растения от паразитов стоит знать, как выглядит тля, ее…
Read More→
Род Блехнум – Blechnum Семейство Асплениевые (Aspleniaceae). Описание Род Блехнум – это наземные папоротники со стелющимися, косыми или прямостоячими чешуйчатыми корневищами. Вайи все одинаковые или бесплодные, отличаются от спороносных. Бесплодные вайи перистосложные или перистораздельные, реже более или менее цельные, голые,…
Read More→
Если вы обнаружили в цветочном горшке белых червей, пора бить тревогу, потому что они отнюдь не безобидны. Из-за этих вредителей в земле не сможет взойти ни одно новое растение, а взрослое — может погибнуть. Если в почве присутствуют белые червячки,…
Если в почве присутствуют белые червячки,…
Read More→
Токсикологическая Оценка Препарата Асд-2ф – Публикации
Автор: С. В. Енгашев, О. А. Дорогова, В. Е. Абрамов
УДК 619:615.1/4
С. В. Енгашев
д.в.н., профессор, член-корреспондент РАН
О. А. Дорогова
к.б.н., ООО «НВЦ Агроветзащита»,
г. Москва, Российская федерация
В. Е. Абрамов
д.в.н., профессор, ведущий научный сотрудник,
ФГБНУ «Всероссийский НИИ фундаментальной
и прикладной паразитологии животных
и растений имени К.И. Скрябина»,
г. Москва, Российская Федерация
Токсикологическая Оценка Препарата Асд-2ф
Аннотация
АСД является оригинальным отечественным препаратом, созданным А. В. Дороговым. По механизму действия относится к адаптогенам. Активирует работу ЦНС, регулирует работу иммунной и эндокринной систем, повышает активность тканевых ферментов. Обеспечивает нормальное развитие, рост и стрессоустойчивость животных. В работе представлены результаты изучения токсикологических свойств АСД-2Ф. Исследование острой токсичности проводилось на белых мышах при внутрижелудочном способе введения и на белых крысах при накожном нанесении. Исследования по острой токсичности при внутрижелудочном введении и нанесении на кожу показали, что указанное средство относится к умеренно опасным при введении в желудок (3-й класс опасности) и к малоопасным (4-й класс опасности) при нанесении на кожу. Изучение кумулятивных свойств определило лд50-7887±100 мг/кг, коэффициент кумуляции более 6,6, что свидетельствует о слабовыраженных кумулятивных свойствах препарата. При изучении местно-раздражающего и кожно-резорбтивного действия АСД-2Ф полученная реакция кожи оценивалась 0 – при однократном нанесении и 1- при пятикратном нанесении.
В. Дороговым. По механизму действия относится к адаптогенам. Активирует работу ЦНС, регулирует работу иммунной и эндокринной систем, повышает активность тканевых ферментов. Обеспечивает нормальное развитие, рост и стрессоустойчивость животных. В работе представлены результаты изучения токсикологических свойств АСД-2Ф. Исследование острой токсичности проводилось на белых мышах при внутрижелудочном способе введения и на белых крысах при накожном нанесении. Исследования по острой токсичности при внутрижелудочном введении и нанесении на кожу показали, что указанное средство относится к умеренно опасным при введении в желудок (3-й класс опасности) и к малоопасным (4-й класс опасности) при нанесении на кожу. Изучение кумулятивных свойств определило лд50-7887±100 мг/кг, коэффициент кумуляции более 6,6, что свидетельствует о слабовыраженных кумулятивных свойствах препарата. При изучении местно-раздражающего и кожно-резорбтивного действия АСД-2Ф полученная реакция кожи оценивалась 0 – при однократном нанесении и 1- при пятикратном нанесении. Изучение эмбриотоксического и тератогенного действия препарата проводили на беременных крысах. Введение АСД-2Ф крысам в дозе 1 мл/кг массы тела ежедневно в течение всей беременности не показало патологического влияния на течение беременности и состояние плодов. Результаты исследования переносимости препарата АСД-2Ф на телятах показали, что введение в терапевтической и трехкратно увеличенной дозах не влияет на физиологические показатели организма.
Изучение эмбриотоксического и тератогенного действия препарата проводили на беременных крысах. Введение АСД-2Ф крысам в дозе 1 мл/кг массы тела ежедневно в течение всей беременности не показало патологического влияния на течение беременности и состояние плодов. Результаты исследования переносимости препарата АСД-2Ф на телятах показали, что введение в терапевтической и трехкратно увеличенной дозах не влияет на физиологические показатели организма.
Ключевые слова
Острая токсичность, кумулятивные свойства, местно-раздражающие, кожно-резорбтивные, эмбриотоксические, тератогенные.
АСД является оригинальным отечественным препаратом, созданным А.В. Дороговым. По механизму действия АСД-2Ф относится к адаптогенам. Легко проникая через гематоэнцефалический барьер, активизирует работу ЦНС и её вегетативных отделов. Оказывает регулирующее действие на иммунную и эндокринную системы, повышает обмен веществ, резервную щелочность крови, процессы регенерации тканей. Значительно повышает функциональную активность многих органов и систем организма. АСД стимулирует моторную деятельность желудочно-кишечного тракта, секрецию пищевых желез и активность пищеварительных ферментов [1, 2, 3, 4].
Значительно повышает функциональную активность многих органов и систем организма. АСД стимулирует моторную деятельность желудочно-кишечного тракта, секрецию пищевых желез и активность пищеварительных ферментов [1, 2, 3, 4].
По современным представлениям под действием АСД повышается активность тканевых ферментов Na+и K+-АТФазы, рибонуклеазы, щелочной фосфотазы, изменяется синтез и транспорт аминокислот, нуклеотидов, жирных кислот. Конечным результатом действия АСД-2Ф является повышение жизнедеятельности и жизнеспособности организма, его стрессоустойчивости к различным неблагоприятным факторам внешней среды [6, 8].
Не обладая непосредственным эстрагеноподобным, гонадотропным и лютеолитическим действием, АСД оказывает опосредованное стимулирующее влияние на развитие и созревание фолликулов, рост матки и эмбриогенез. Его введение высоко продуктивным коровам в критические периоды стельности повышает выживаемость эмбрионов на 24% [2, 9].
Все перечисленные эффекты обуславливают нормальное развитие, рост и более высокие привесы у молодняка сельскохозяйственных животных и птиц, а так же повышение продуктивности у взрослых животных и птиц.
Материал и методы исследования. В основу выполнения работы по фармакотоксикологии препарата АСД-2Ф были положены «Методические рекомендации по доклиническому изучению репродуктивной токсичности фармакологических средств», утвержденные Минздравом РФ, 2005 г.
Острую токсичность АСД-2Ф изучали на клинически здоровых, беспородных белых мышах обоего пола массой тела 18-20 г. при внутрижелудочном способе введения и на белых крысах массой тела 180-210 г. при накожном нанесении препарата. При внутрижелудочном способе введения препарат вводили в форме раствора в желудок с помощью шприца с оливой в дозах 400-2000 мг/кг однократно. Изучение острой токсичности препарата при накожных аппликациях провели на крысах и мышах, которым на депилированные участки кожи спины наносили средство в максимально возможных количествах-0,2-0,5 мл на мышь (соответствует 10-25 г/кг массы) и 2,5-5,0 мл на крысу (соответствует 12,5-50 г/кг). После нанесения препарата животных поместили в индивидуальные камеры на 4 часа во избежание потерь препарата. В дальнейшем их содержали в обычных клетках.
После нанесения препарата животных поместили в индивидуальные камеры на 4 часа во избежание потерь препарата. В дальнейшем их содержали в обычных клетках.
Учет состояния мышей и крыс вели на протяжении 14 дней. Учитывали следующие показатели: внешний вид и поведение животных, состояние шерстного покрова и видимых слизистых оболочек, отношение к корму, подвижность, ритм и частоту дыхания, отправление физиологических функций, время возникновения и характер интоксикации, её тяжесть, обратимость, сроки гибели животных или их выздоровления.
Исследование кумулятивных свойств препарата провели на белых мышах в эксперименте по методу Лима (1961 г.). Первоначальная доза составила 1/10 от ЛД 50, установленной в остром опыте-140,0 мг/кг массы животного. Через каждые 4 дня эту дозу увеличивали в 1,5 раза, регистрировали изменение массы тела у мышей и в зависимости от этого рассчитывали величину вводимой дозы препарата. Коэффициент кумуляции вычисляли по соотношению средних летальных доз подострого и острого опыта.
Изучение местно-раздражающего, кожно-резорбтивного и сенсибилизирующего действия проводили при однократном и многократном применении препарата.
В целях изучения местно-раздражающего действия были проведены опыты на 9 кроликах массой 3,0 кг, из которых сформировали 3 группы. На спине животных выстригли шерсть на двух участках (5х3 см). В течение 5 дней ежедневно препарат в дозе 1,0 мл/кг массы наносили на один выстриженный участок и слегка втирали в кожу, через 4 часа снимали влажным тампоном. Местное действие оценивали визуально, учитывая поведение кроликов, состояние кожи и толщину кожной складки (в сравнении с контрольным участком). Реакцию кожи учитывали ежедневно по шкале оценки кожных проб С.В. Суворова.
Сенсибилизирующее действие препарата изучали в опытах на морских свинках методом накожных аппликаций. Препарат в нативном виде наносили на предварительно выстриженные участки кожи (1,5х2 см) от задней части спины к голове на 4 часа, затем снимали влажным тампоном. Всего было проведено 15 аппликаций в течение 21 дня. Через 14 дней на выстриженный участок кожи противоположной стороны спины разрешающую дозу испытуемого средства в концентрации, примененной в ходе сенсибилизации и в трех разведениях: 1:10, 1:50,1:100. Спустя 12 и 24 часа был проведен учет реакции кожи.
Всего было проведено 15 аппликаций в течение 21 дня. Через 14 дней на выстриженный участок кожи противоположной стороны спины разрешающую дозу испытуемого средства в концентрации, примененной в ходе сенсибилизации и в трех разведениях: 1:10, 1:50,1:100. Спустя 12 и 24 часа был проведен учет реакции кожи.
Опыты по определению возможного эмбриотоксического действия препарата АСД-2Ф проводили на 24 беременных самках белых крыс массой 220-250 г и 6 самцах. К самкам, в стадии эструса и проэструса, на ночь подсаживали самцов из расчета один самец на 4 самки. Обнаружение спермиев во влагалищном мазке на следующее утро считали первым днем беременности. Исследования начинали при введении препарата АСД-2Ф в двукратной терапевтической дозе 1 мл/кг, так как, если она не вызовет указанного действия — не будет необходимости продолжать работу с терапевтической дозой — 0,5 мл/кг. Препарат вводили в желудок 8 крысам с 1 по 17-й день беременности. Контрольным животным препарат не вводили. За течением беременности наблюдали путем исследования влагалищных мазков самок на четвертый-пятый дни после оплодотворения и течением беременности, на 10-11-й дни беременности и путем взвешивания самок на 1, 7, 14 и 20-й дни беременности. На 20-й день беременности самок декапитировали, подсчитывали количество желтых тел беременности в яичниках и мест имплантации.
За течением беременности наблюдали путем исследования влагалищных мазков самок на четвертый-пятый дни после оплодотворения и течением беременности, на 10-11-й дни беременности и путем взвешивания самок на 1, 7, 14 и 20-й дни беременности. На 20-й день беременности самок декапитировали, подсчитывали количество желтых тел беременности в яичниках и мест имплантации.
Для определения эмбрионального действия препарата АСД-2Ф определяли предимплантационную гибель зигот (разность между количеством желтых тел беременности в яичниках и количеством мест имплантации в матке от общего числа желтых тел), постимплантационную гибель эмбрионов (разность между количеством мест имплантации и количеством живых плодов в матке от числа мест имплантации) и общую эмбриональную смертность (разницу между числом желтых тел беременности и живыми плодами в процентах от числа желтых тел в яичниках).
Переносимость АСД-2Ф изучали на телятах при назначении препарата внутрь в терапевтической и трехкратной терапевтической дозе. Исследование проводили на 18 бычках черно-пестрой породы массой тела 110-130 кг, которые по принципу аналогов были разделены на три группы по 6 голов в каждой. Первой группе из 6 голов препарат давали в терапевтической дозе — 5 мл. АСД-2Ф смешивали с 50 мл воды — один раз в день в течение 15 дней. Второй группе из 6 голов давали препарат в трехкратной терапевтической дозе 15 мл. АСД-2Ф смешивали с 50 мл воды – один раз в день также в течение 15 дней. Третья группа из 6 голов служила контролем, ей препарат не давали.
Исследование проводили на 18 бычках черно-пестрой породы массой тела 110-130 кг, которые по принципу аналогов были разделены на три группы по 6 голов в каждой. Первой группе из 6 голов препарат давали в терапевтической дозе — 5 мл. АСД-2Ф смешивали с 50 мл воды — один раз в день в течение 15 дней. Второй группе из 6 голов давали препарат в трехкратной терапевтической дозе 15 мл. АСД-2Ф смешивали с 50 мл воды – один раз в день также в течение 15 дней. Третья группа из 6 голов служила контролем, ей препарат не давали.
За телятами вели наблюдение, отмечая их общее состояние, поведение, аппетит, отправление физиологических функций, а так же контролировали температуру тела, брали кровь и мочу до начала опыта и через 15 дней для исследования ряда параметров.
Результаты исследований. Как показали проведенные исследования, введение мышам препарата АСД-2Ф в дозах 400-600 мг/кг внутрижелудочно не вызывает изменений в общем состоянии и физиологических отправлениях организма. Введение АСД в дозах от 800 до 2000 мг/кг вызывало появление первых признаков интоксикации через 40-50 минут в виде кратковременного возбуждения, которое сменялось угнетением, животные были малоподвижны, не реагировали на внешние раздражители. Результаты исследований по оценки острой токсичности капель показали, что препарат относится к умеренно токсичным веществам (3-й класс опасности по ГОСТ 12.1.007-76). Максимально переносимая доза препарата (ЛД0) составила 600 мг/кг, абсолютно смертельная доза – 1850 мг/кг, среднесмертельная — 1400 мг/кг массы животного.
Введение АСД в дозах от 800 до 2000 мг/кг вызывало появление первых признаков интоксикации через 40-50 минут в виде кратковременного возбуждения, которое сменялось угнетением, животные были малоподвижны, не реагировали на внешние раздражители. Результаты исследований по оценки острой токсичности капель показали, что препарат относится к умеренно токсичным веществам (3-й класс опасности по ГОСТ 12.1.007-76). Максимально переносимая доза препарата (ЛД0) составила 600 мг/кг, абсолютно смертельная доза – 1850 мг/кг, среднесмертельная — 1400 мг/кг массы животного.
Таблица 1 — Параметры токсичности препарата АСД-2Ф при введении в желудок белым мышам
|
Дозы (мг/кг) |
600 |
900 |
1200 |
1500 |
1700 |
1850 |
||||
|
Пало/было |
0/10 |
2/10 |
3/10 |
5/10 |
7/10 |
10\10 |
||||
|
Z |
1,0 |
2,5 |
4,0 |
6,0 |
8,5 |
|||||
|
d |
300 |
300 |
300 |
200 |
150 |
|||||
|
Zd |
300 |
750 |
1200 |
1200 |
1275 |
|||||
∑Zd=4725
ЛД50=ЛД100-∑Zd/ m =1850-472,5=1377,5 мг/кг
Таблица 2 — Токсичность препарата АСД-2Ф при введении в желудок белым мышам
|
Вид животного |
Показатели токсичности, мг/кг |
||
|
Белые мыши |
ЛД0 |
ЛД50 |
ЛД100 |
|
|
600 |
1377,5 |
1850 |
В результате опытов было установлено, что при накожном применении препарат хорошо всасывается, на коже было отмечено незначительное покраснение, которое исчезало в течение 24 часов. Гибели животных в опытах и контрольных группах мышей и крыс зарегистрировано не было и, следовательно, не представилось возможным установить ЛД50 (среднесмертельная доза). В соответствии с общепринятой гигиенической классификацией препарат может быть отнесет к малоопасным соединениям при однократном нанесении на кожу (ЛД50 более 2500 мг\кг).
Гибели животных в опытах и контрольных группах мышей и крыс зарегистрировано не было и, следовательно, не представилось возможным установить ЛД50 (среднесмертельная доза). В соответствии с общепринятой гигиенической классификацией препарат может быть отнесет к малоопасным соединениям при однократном нанесении на кожу (ЛД50 более 2500 мг\кг).
Таким образом, изучение острой токсичности при введении в желудок и нанесении на кожу АСД-2Ф показало, что указанное средство относится к умеренно опасным веществам при введении в желудок (3 класс опасности) и к малоопасным (4 класс опасности) при нанесении на кожу.
При изучении кумулятивных свойств препарата, введение АСД-2Ф в суммарной дозе 1560 мг/кг, у мышей появились клинические признаки отравления, характеризующиеся кратковременным возбуждением, которое постепенно сменялось угнетением и атаксией. Смерть животных отмечалась на 7-15 сутки при введении препарата в суммарной дозе от 5600 мг/кг до 8000 мг/кг. ЛД50 составила 7887±100 мг/кг, коэффициент кумуляции — более 6,6, что свидетельствует о слабовыраженных кумулятивных свойствах препарата.
ЛД50 составила 7887±100 мг/кг, коэффициент кумуляции — более 6,6, что свидетельствует о слабовыраженных кумулятивных свойствах препарата.
При изучении местно-раздражающих и кожно-резорбтивных свойств АСД-2Ф проведенные исследования показали, что однократное и пятикратное нанесение препарата не вызывает гибели животных и изменений в их поведении. Покраснения кожи, расчесов, отека, утолщения кожной складки и болезненной реакции при пальпации места обработки после однократного нанесения препарата не наблюдалось, после 5-ти кратного нанесения препарата была отмечена слабая гиперемия и сухость кожи в месте нанесения. Таким образом, реакция кожи может быть оценена в 0 (однократное нанесение препарата) и 1 балл (5-кратное нанесение препарата), что позволяет отнести предлагаемое средство к 4 классу опасности (таблица 3).
Таблица 3 — Показатели функционального состояния кожи кроликов после повторных аппликаций АСД-2Ф
|
Показатели |
Группы животных |
|
|
Опыт |
Контроль |
|
|
РН кожи |
5,4±0,04 |
5,5+0,01 |
|
Эритема, баллы |
0 |
0 |
|
Толщина кожной складки, мм. |
3,5±0,5 |
3,4±0,7 |
|
Температура кожи, 0С |
36,5+0,5 |
36,4±0,3 |
Кровь для исследования брали из ушной вены до обработки, через 5 часов, 5, 7, 10 и 15 суток после аппликации исследуемого средства. Гематологические исследования не выявили изменений в содержании лейкоцитов, эритроцитов, уровне гемоглобина и СОЭ как при однократном, так и многократных аппликациях испытуемого средства на кожу.
Раздражающее действие препарата изучали на кроликах методом конъюнктевальных проб и на крысах методом погружения хвоста. Шести кроликам под верхнее веко правого глаза вносили по одной капле испытуемого средства. Для контроля в левый глаз вносили по одной капле дистиллированной воды. Учет реакции проводили через 5 минут, 2, 24, 48, 72 и 96 часов с момента закапывания. При оценки раздражающего действия препарата учитывали состояние слизистой оболочки глаза и век, наличие инъекции сосудов и секреции слезных желез. В результате у подопытных животных наблюдали покраснение слезного протока и инъецирование склеры глаза, слезотечение, сужение глазной щели, отечности век. Указанные явления сохранялись в течение 2 суток, на 3-5 сутки они постепенно исчезли, что свидетельствует об умеренно выраженном раздражающем действии препарата на слизистые оболочки.
Для контроля в левый глаз вносили по одной капле дистиллированной воды. Учет реакции проводили через 5 минут, 2, 24, 48, 72 и 96 часов с момента закапывания. При оценки раздражающего действия препарата учитывали состояние слизистой оболочки глаза и век, наличие инъекции сосудов и секреции слезных желез. В результате у подопытных животных наблюдали покраснение слезного протока и инъецирование склеры глаза, слезотечение, сужение глазной щели, отечности век. Указанные явления сохранялись в течение 2 суток, на 3-5 сутки они постепенно исчезли, что свидетельствует об умеренно выраженном раздражающем действии препарата на слизистые оболочки.
Кожно-резорбтивное действие препарата изучали также на белых крысах методом погружения хвоста. Опыты проводили в течение 10 дней. Для этого приготовили 50% водную эмульсию испытуемого средства и поместили его в пробирки. Крыс фиксировали в специальной клетке так, чтобы хвосты животных были погружены на 2/3 в пробирки. Экспозиция составляла 30 минут. Учет реакции проводили через 4 часа после погружения по наличию местных изменений кожи хвоста, наличию и степени выраженности интоксикации, изменению массы тела животных и числу смертельных исходов. Во всех экспериментах не было выявлено выраженного действия на кожу и каких-либо признаков интоксикации, изменений массы тела и смертельных исходов, свидетельствующих о способности испытуемого препарата проникать в организм через неповрежденную кожу при однократном и повторных контактах.
Учет реакции проводили через 4 часа после погружения по наличию местных изменений кожи хвоста, наличию и степени выраженности интоксикации, изменению массы тела животных и числу смертельных исходов. Во всех экспериментах не было выявлено выраженного действия на кожу и каких-либо признаков интоксикации, изменений массы тела и смертельных исходов, свидетельствующих о способности испытуемого препарата проникать в организм через неповрежденную кожу при однократном и повторных контактах.
В процессе опыта проводили обследование животных с помощью интегральных показателей, характеризующих функциональное состояние различных систем и органов. При убое определяли массу внутренних органов животных и их весовые коэффициенты.
Результаты исследования функционального состояния центральной нервной системы крыс после нанесения капель показали, что у животных опытной группы наблюдается незначительное – статистически недостоверное повышение двигательной активности по сравнению с контролем (16,10±6,6 против 11,09±1,0).
Результаты исследований по изучению влияния препарата на весовые коэффициента показали, что у животных, подвергавшихся воздействию препарата, отмечается незначительное увеличение весовых коэффициентов печени. Весовые коэффициенты других внутренних органов достоверно не отличались от контроля.
Полученные результаты изучения кожно-резорбтивного действия свидетельствуют о том, что препарат АСД-2Ф не обладает способностью проникать в организм через неповрежденную кожу в количествах, вызывающих отравление животных, а также изменения функционального состояния жизненно важных органов и систем организма.
Эритемы, инфильтрации, изъязвления и других кожных признаков аллергии установлено не было. Не было выявлено аллергических реакций в ответ на воздействие изучаемых средств в гематологических показателях. Количество эритроцитов, лейкоцитов и уровень гемоглобина крови находились в пределах физиологических показателей, как у крыс подопытной группы, так и в контрольной группе.
Результаты проведенных токсикологических исследований показали, что препарат АСД-2Ф по степени токсического воздействия на организм теплокровных относится при введении в желудок к умеренно опасным веществам и при нанесении на кожу – к малоопасным веществам (соответственно 3 и 4 классам опасности по ГОСТ 12.1.007-76).
Препарат при однократном и повторных нанесениях на неповрежденную кожу не оказывает местно-раздражающего, резорбтивно-токсического и сенсибилизирующего действия.
Изучение эмбриотоксических и тератогенных свойств препарата АСД-2Ф провели на беременных крысах. Им вводили препарат в дозе 1 мл/кг ежедневно в течение всего эмбриогенеза и органогенеза (с первого по семнадцатый день беременности). При этом не нашли нарушений в течение беременности, а также при дальнейшем исследовании внутренних органов по Вильсону и костной системы по Даусону.
Основные показатели – предимплантационная гибель зигот в опытной группе равнялась 2,54, а в контрольной 3,03%, постимплантационная гибель эмбрионов-3,02 и 2,96% соответственно, общая эмбриональная смертность -5,56 и 5,59% соответственно были в близких пределах, что свидетельствовало об отсутствии эмбриотоксического действия препарата АСД-2Ф в дозе 1 мл/кг (таблица 4). Масса, размеры, число плодов и плодоплацентарный коэффициент в подопытной и контрольной группах не имели статистических различий и находились в пределах колебаний физиологической нормы. Так, среднее число плодов на одну самку при введении препарата составляло 11,3±0,07, а в контроле – 11,30±0,08, соответственно масса – 2285,2±10,2 и 2262,2±11,2 мг и размеры – 3,0±0,01 и 2,98±0,01 см. при Р ˃0,05.
Масса, размеры, число плодов и плодоплацентарный коэффициент в подопытной и контрольной группах не имели статистических различий и находились в пределах колебаний физиологической нормы. Так, среднее число плодов на одну самку при введении препарата составляло 11,3±0,07, а в контроле – 11,30±0,08, соответственно масса – 2285,2±10,2 и 2262,2±11,2 мг и размеры – 3,0±0,01 и 2,98±0,01 см. при Р ˃0,05.
При визуальном осмотре и микроскопическом исследовании внутренних органов по Вильсону, от крыс, получивших препарат АСД-2Ф, не выявлено уродливых плодов (внешние и внутренние аномалии отсутствовали).
При микроскопическом исследовании костей скелета плодов по Даусону установлено, что препарат АСД-2Ф в течение всего периода эмбриогенеза не вызывал отклонений в костной системе плодов.
Таблица 4 — Влияние препарата АСД-2Ф, введенного в дозе 1 мл/кг крысам перорально ежедневно с 1 по 17 дни на развитие беременности
|
Наименование показателей |
Группы животных |
|
|
Подопытные М±m |
Контрольные M±m |
|
|
Количество беременных самок |
18 |
6 |
|
Количество желтых тел беременности в яичниках |
149 |
135 |
|
Число желтых тел беременности на одно животное |
12,8±0,08 |
11,28±0,08 |
|
Число мест имплантации |
148 |
131 |
|
Число мест имплантации на одно животное |
11,75±,09 |
11,0±0,10 |
|
Число живых плодов |
141 |
129 |
|
Число живых плодов на одно животное |
11,3±0,02 |
11,38±0,01 |
|
Предимплантационная гибель зигот, % |
2,54 |
3,03 |
|
Постимпоантационная гибель эмбрионов, % |
3,02 |
0,96 |
|
Общая эмбриональная смертность, % |
5,56 |
5,99 |
|
Продолжение таблицы 4 |
||
|
Масса плодов, в среднем, мг |
2285,2±10,2 |
2262,0±11,3 |
|
Кранио-каудальная длина плодов, см |
3,0±0,10 |
2,98±0,01 |
|
Масса плаценты, в среднем, мг |
355,74±6,20 |
528,11±6,12 |
|
Диаметр плаценты, см |
1,44±0,05 |
1,41±0,07 |
|
Плодоплацентарный коэффициент |
23,40 |
29,20 |
|
Число резорбированных эмбрионов на одно животное |
0,71±0,08 |
0,42±0,09 |
|
Количество женских плодов, % |
43,15 |
46,04 |
|
Количество мужских плодов, % |
56,12 |
53,43 |
Отсутствие отклонений в костной системе плодов подтверждается идентичной их массой от подопытных и контрольных животных (таблица 5), а также плодоплацентарным коэффициентом (23,40 и 29,20 соответственно).
Установлено, что препарат АСД-2Ф в дозе 1 мл/кг массы тела ежедневно в течение всей беременности (с 1-го по 17-й дни) не показал ни эмбриотоксического, ни тератогенного действия. Животные хорошо переносили ежедневное введение препарата и результаты исследований материала от них – масса и размеры плодов, состояние внутренних органов и костной системы были идентичными (в отдельных показателях – масса, размеры плодов и размер отдельных костей даже выше) в сравнении с таковыми от контрольных животных, что подтверждено и уровнем вероятности, который был равен или больше 0,05.
Таким образом, препарат АСД-2Ф в двукратно повышенной дозе не обладает эмбриотоксическими и тератогенными свойствами для крыс.
Таблица 5 — Влияние препарата АСД-2Ф, введенного в дозе 1 мл\кг крысам в каждый день беременности (с 1 по 17-й), на костную систему
|
Наименование костей |
Размер костей мм |
||
|
Подопытные М±m |
Контрольные M±m |
||
|
лопаточная |
Левая правая |
2,34±0,1 2,35±0,09 |
2,34±0,09 2,34±0,1 |
|
плечевая |
Левая правая |
2,56±0,12 2,54±0,1 |
2,55±0,1 2,57±0,11 |
|
локтевая |
Левая правая |
2,69±0,09 2,7±0,1 |
2,69±0,1 2,7±0,1 |
|
лучевая |
Левая правая |
2,01±0,05 2,02±0,02 |
2,00±0,01 1,99±0,02 |
|
бедренная |
Левая правая |
1,77±0,02 1,78±0,02 |
1,780±0,02 1,77±0,03 |
|
б. |
Левая правая |
2,00±0,02 2,1±0,08 |
2,09±0,03 2,1±0,02 |
|
м. берцовая |
Левая Правая |
1,94±0,02 1,93±0,03 |
1,94±0,02 1,93±0,03 |
Переносимость. Изучение переносимости препарата АСД-2Ф на телятах показали, что введение препарата как в терапевтической, так и трехкратно увеличенной дозе не вызывает изменений в температуре тела, в опытных и контрольной группе телят. Все физиологические показатели находились в пределах нормы до и после опыта.
Изучение переносимости препарата АСД-2Ф на телятах показали, что введение препарата как в терапевтической, так и трехкратно увеличенной дозе не вызывает изменений в температуре тела, в опытных и контрольной группе телят. Все физиологические показатели находились в пределах нормы до и после опыта.
Результаты исследования ряда гематологических показателей у телят опытных и контрольной групп представлены в таблице 6.
Таблица 6 — Гематологические показатели у бычков до и после опыта
|
Сроки исследования |
Эритроциты, 1012/л |
Лейкоциты 109/л |
Гемоглобин г/л |
СОЭ, мм/час по Панченкову |
|
Опытная группа 1 |
||||
|
До опыта Через 15 дней |
6,8±0,1 5,9±0,2 |
10,3±0,2 9,6±0,3 |
88,3±3,4 76,2±2,3 |
0,8±0,02 1,2±0,01 |
|
Опытная группа 2 |
||||
|
До опыта Через 15 дней |
6,2±0,2 6,4±0,2 |
8,2±0,2 9,4±0,1 |
80,1±3,6 75,3±2,3 |
1,0±0,02 1,2±0,02 |
|
Контрольная группа |
||||
|
До опыта Через 15 дней |
6,6±0,2 6,5±0,2 |
9,2±0,2 8,4±0,1 |
81,1±3,2 72,3±2,3 |
1,1±0,03 1,0±0,02 |
Из таблицы 6 видно, что количество эритроцитов, лейкоцитов, уровень гемоглобина и скорость оседания эритроцитов у телят опытных и контрольных групп находилось в пределах физиологических норм до и после опыта.
Лейкограммы крови телят опытных и контрольной групп не изменялась, процентное соотношение отдельных видов лейкоцитов находилось в пределах физиологической нормы до и после опыта.
Результаты исследования биохимических показателей крови телят, которым ежедневно в течение 15 дней давали препарат АСД-2Ф в терапевтической и трехкратно увеличенной дозах представлены в таблице 7.
Таблица 7 — Биохимические показатели сыворотки крови телят до и после опыта по изучению переносимости АСД-2Ф
|
Сроки исследования |
Щелочная фосфотаза, ЕД/л |
Биллирубин общий ммоль/л |
АСТ, ЕД/л |
Глюкоза, ммоль/л |
|
Опытная группа 1 |
||||
|
Продолжение таблицы 7 |
||||
|
До опыта Через 15 дней |
55,6±4,1 59,7±2,2 |
3,62±0,32 5,33±0,51 |
49,3±2,3 46,2±2,1 |
3,68±0,15 3,88±0,12 |
|
Опытная группа 2 |
||||
|
До опыта Через 15 дней |
65,1±2,2 62,8±2,9 |
3,42±0,21 6,61±0,13 |
55,7±3,3 45,3±2,1 |
3,74±0,20 4,15±0,23 |
|
Контрольная группа |
||||
|
До опыта Через 15 дней |
66,1±2,7 60,8±2,5 |
3,42±0,21 1,70±0,12 |
55,7±3,3 42,3±2,1 |
3,74±0,20 4,14±0,21 |
Из таблицы 7 видно, что исследуемые биохимические показатели сыворотки крови у телят опытной и контрольной групп достоверно не отличались и находились в пределах физиологический нормы до и после опыта.
Исследование мочи телят опытных и контрольной групп до кормления и в течение 15 дней не выявило патологических изменений. Моча телят имела характеристики, специфичные для данного вида клинически здоровых животных.
Установлено, что АСД-2Ф в рекомендуемой терапевтический и трехкратной терапевтической дозах не оказывает отрицательного воздействия на общее состояние телят: на протяжении опыта телята оставались подвижными, охотно поедали корм и потребляли воду, температура, пульс, дыхание, были в пределах нормы, нарушений функций пищеварительного тракта и мочеотделения не установлено.
Заключение. Препарат АСД-2Ф относится к умеренно опасным веществам при введении в желудок (третий класс опасности ЛД50-1377,5 мг/кг) и к малоопасным (четвертый класс опасности ЛД50-более 2500 мг/кг) при нанесении на кожу. Препарат не обладает кумулятивной активностью, не оказывает местно-раздражающего, резорбтивно-токсического, сенсибилизирующего, эмбриотоксического и тератогенного действий. Препарат АСД-2Ф в терапевтической и трехкратно увеличенной терапевтической дозах не оказывает отрицательного воздействия на общее состояние телят.
Препарат АСД-2Ф в терапевтической и трехкратно увеличенной терапевтической дозах не оказывает отрицательного воздействия на общее состояние телят.
Препарат нашел широкое применение для повышения резистентности животных.
Список использованной литературы
1. Абрамов В.Е., Абдрахманов В.И., Дорогова О.А. и др. Определение показателей качества препарата АСД-2Ф, Ветеринария, 2004, № 9, с. 13-16
2. Дерябина З.И., Биохимический механизм фармакологического действия препарата АСД-2Ф на организм. Ж. Сельскохозяйственная биология, 1980, Т. 15, № 6.
3. Дерябина З.И., Николаев А.В. Химикофармацевтическая характеристика АСД. Труды ВИЭВ, 1968, Т. 35.
4. Дерябина З.И. Химикофармакологическая характеристика препарата АСД, Труды ВИЭВ, 1952, т. 25, с. 326-339.
5. Дорогов А. В. Труды ВИЭВ, 1951, Т. 2, с. 216.
В. Труды ВИЭВ, 1951, Т. 2, с. 216.
6. Мозгов И.Е. Тканевая терапия в ветеринарной практике, Сельхозгиз, 1955, с. 138-141.
7. Николаев А.В. О химическом составе и новых фракциях препарата АСД. Труды ВИЭВ, М 1952, Т. 22, с. 317-326.
8. Торосян С.В. Биостимулятор АСД, Журнал Птицеводство, 1961, № 5.
9. Решетникова Н.Н., Мороз Т.А. Применение АСД-2Ф для профилактики эмбриональной смертности у высокопродуктивных коров, Труды Всероссийского научно-исследовательского института племенного дела, 1985, № 7.
© С.В. Енгашев, О.А. Дорогова, В.Е. Абрамов, 2017
Инструкция по использованию препарата АСД при лечении кожных болезней человека
Disclaimer:
Эта веб-страница сделана для меня самого и моих друзей. Информация полностью неофициальна. Рекомендую не читать и не использовать.

Напоминаю, что эта инструкция отменена, и применение препарата АСД фракция 2 для медицинских целей запрещено.
Если вы планируете лечиться препаратом АСД, рекомендую трижды подумать, особенно если в организме есть новообразования — препарат АСД фракция 2 стимулирует рост клеток.
Инструкция 1951 года приводится потому, что в ней правильно описаны свойства препарата. Кочующее по современным справочникам описание АСД — неправильное, хотя явно скомпилировано из старой инструкции.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ СССР
Инструкция по использованию препарата АСД при лечении кожных болезней человека (экземы, эпидермофитии, нейродермиты, сикозы, лишаи и др.)
Препарат АСД является жидкостью, приготовленной по особой методике из тканей животного.
Препарат АСД выпускается в двух формах: Ф-2 (фракция № 2) и Ф-3 (фракция № 3).
АСД Ф-2 представляет летучую жидкость от желтого до темно-красного цвета
со своеобразным запахом.
АСД Ф-3 — густая жидкость, черного цвета, со своеобразным запахом.
Свойства: АСД Ф-2 — жидкость, хорошо растворимая в воде, имеющая щелочную реакцию. АСД Ф-3 — густая жидкость, слабо растворимая в воде, но растворимая в спирту и в жирах.
Упаковка: препарат АСД упаковывается в стеклянную посуду, закрытую корковыми пробками, залитыми парафином, или стеклянными пробками, плотно прошлифованными. На флаконах с препаратом АСД имеется этикетка с указанием даты и места изготовления, номера серий, названия препарата и его формы (Ф-2, Ф-3), причем на упаковке флакона Ф-3 должно быть указано «Для наружного употребления».
Хранение: препарат АСД хранится в темном месте при комнатной температуре. При длительном хранении препарата АСД Ф-2 могут выпадать смолистые вещества. Выпадание осадка не снижает активности препарата.
При назначении препарата человеку необходимо учитывать характер заболевания, общее
состояние и возраст больного, стадию развития болезненного процесса.
Однократные дозы препарата АСД Ф-2 для человека при употреблении внутрь следующие (см. таблицу).
| Возраст больного | К-во препарата | К-во воды для развед. препар. в мл. | Примечание |
|---|---|---|---|
| От 20 лет и старше | 2,0-5,0 | 40-100 | При резком нервном истощении и повышен, нервной возбудимости больн. препар. АСД Ф-2 может назнач. по рецепту врача в доз. в 5—3 раза меньше указан, в данной табл. |
| От 15 до 20 лет | 0,5-1,0 | 10-20 | |
| От 5 до 15 лет | 0,2-0,7 | 5-15 | |
| От 1 года до 5 лет | 0,2-0,5 | 5-10 | |
| До года | 0,05-0,1 | 3-5 |
Лечение кожных болезней производится препаратом АСД фракциями № 2 и №3. Фракция № 2 дается внутрь в водном растворе в дозировках, указанных в таблице (вода должна быть кипяченой и охлажденной). Препарат дается один раз в день утром натощак, за 30—40 минут до еды. Одновременно пораженные участки кожи смазываются препаратом АСД Ф-3. Сверху на смазанный участок кожи накладывают пергаментную бумагу с целью предотвращения испарения препарата, затем накладывают толстый слой ваты 1,5-2 см и забинтовывают.
При большой поверхности пораженного участка кожи и при наличии многих участков поражения необходимо накладывание мазевых компрессов, назначать не больше, чем на 3—4 участка, в последующем участки применения препарата чередовать. Накладывание мазевых повязок может вызвать перенагревание кожи и общую реакцию в виде повышения температуры. Компресс необходимо оставлять па сутки, после чего повторить вновь до исчезновения очагов поражения на коже.
Очень часто возникает обострение процесса, появляется небольшое покраснение и раздражение кожи. В таких случаях применение препарата прекращается на 1-2 дня. Внутрь препарат АСД Ф-2 употребляется в течение 5 дней подряд, после чего делается на 2-3 дня перерыв и затем снова назначается препарат в течение 5 дней. Препарат в такой последовательности следует назначать до полной ликвидации каждого поражения.
Необходимо отметить, что при длительных хронических заболеваниях кожи после первого курса лечения (20—30 дней) возможно развитие рецидива, который может быть ликвидировал повторным применением препарата АСД Ф-2 и Ф-3.
Во время лечения этим препаратом противопоказано употребление алкоголя и курение табака, а также употребление раздражающих кожу веществ (бензин, керосин, скипидар и др.), нежелательно также мочить кожу водой.
Утверждена фармакологическим комитетом Ученого медицинского совета Министерства здравоохранения СССР 17-III-51 г. протокол № 5.
Выходные данные инструкции: Кременчуг. гор. тип. № 2546-10000, 8-5-75 г.
Сканы инструкции (ксерокопия мерзкого качества начала 1990-х гг.).
АСД – 2, фл. 100 мл
ИНСТРУКЦИЯ
по применению антисептика-стимулятора Дорогова АСД-2 (ASD Frakcia 2), продукта сухой перегонки мясокостной муки
СОСТАВ И ФОРМА ВЫПУСКА
Препарат АСД-2 содержит в своем составе соединения с активной сульфгидрильной группой, производные алифатических аминов, карбоновые кислоты, алифатические и циклические углеводороды, производные амидов и воду. По внешнему виду представляет собой жидкость от желтого до темно-красного цвета со специфическим запахом, хорошо смешивающуюся с водой. Допускается наличие мелкого черного осадка. Выпускают препарат в форме стерильного раствора, расфасованного по 20 мл и 100 мл в стеклянные флаконы.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Препарат АСД фракция 2 является продуктом сухой перегонки сырья животного происхождения. При пероральном применении оказывает активизирующее действие на ЦНС и вегетативную нервную систему, стимулирует моторную деятельность желудочно-кишечного тракта, секрецию пищеварительных желез, повышает активность пищеварительных и тканевых ферментов, улучшает проникновение ионов Na+ и К+ через клеточные мембраны, способствует нормализации процессов пищеварения, усвоения питательных веществ и повышению естественной резистентности организма. При наружном применении препарат стимулирует активность ретикулоэндотелиальной системы, нормализует трофику и ускоряет регенерацию поврежденных тканей, обладает выраженным антисептическим и противовоспалительным действием. Препарат относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007-76). В рекомендуемых дозах не оказывает резорбтивно-токсического и сенсибилизирующего действия.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Назначают сельскохозяйственным животным (в том числе птице) и собакам, с лечебной и профилактической целью при болезнях желудочно-кишечного тракта, органов дыхания, мочеполовой системы, поражениях кожных покровов, нарушениях обмена веществ, для стимуляции деятельности центральной и вегетативной нервной системы, повышения естественной резистентности у ослабленных и переболевших инфекционными и инвазионными болезнями животных, а также для стимуляции роста и развития поросят, цыплят и повышения яйценоскости кур.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Внутрь препарат АСД-2 назначают животным с питьевой водой перед кормлением или в смеси с комбикормом в утреннее кормление в дозах указанных в таблице:
|
Вид животных, возраст |
Количество препарата, (см³) |
Количество воды, (см³) |
|
Лошади |
||
|
от 3 лет и старше |
10-20 |
200-600 |
|
Крупный рогатый скот |
||
|
от 3 лет и старше |
20-30 |
200-400 |
|
Овцы |
||
|
от 1 года и старше |
2-5 |
40-100 |
|
Свиньи |
||
|
от 1 года и старше |
5-10 |
100-200 |
|
Собаки взрослые от 6 месяцев |
2 |
40 |
Наружно АСД-2 применяют в виде 2-20% растворов, приготовленных на стерильном физиологическом растворе или кипяченой воде. При приготовлении лечебного раствора требуемой концентрации, исходный стерильный раствор АСД-2 принимают за 100%. Лечебный раствор готовят в асептических условиях.
При диспепсии, гастроэнтероколитах, гастроэнтеритах, а также дистрофических состояниях, вызванных расстройствами пищеварения и нарушениями обмена веществ, препарат назначают внутрь один раз в сутки, в разовых дозах, указанных в таблице. Лечение проводят курсами по 5 дней с интервалом 2 — 3 дня до выздоровления животного.
При тимпании крупного рогатого скота препарат выпаивают животному или вводят в рубец через желудочный зонд один-два раза в сутки в разовой дозе, указанной в таблице. В процессе лечения назначают теплые клизмы, массаж рубца и другие процедуры, предусмотренные при указанной патологии.
При метеоризме кишечника у лошадей препарат выпаивают животным или вводят через желудочный зонд однократно в дозах указанных в таблице. В процессе лечения назначают теплые клизмы, массаж живота и другие процедуры, предусмотренные при указанной патологии. При необходимости лечение повторяют.
При катаральной пневмонии поросят наряду с этиотропным лечением препарат назначают один раз в день с питьевой водой за 30 — 40 минут до кормления или в утреннее кормление с комбикормом в дозах, указанных в таблице. Лечение проводят курсами по 5 дней с интервалом 2 — 3 дня до выздоровления.
При вагинитах и задержании последа у коров (после его удаления) применяют 3 — 5% раствор препарата, подогретый до 40°С, которым промывают влагалище один раз в сутки в течение 4 — 5 дней, расходуя по 1,5 — 2 л раствора на каждую обработку. Если шейка матки открыта, то 200 — 300 мл раствора вводят в матку.
При острых и хронических эндометритах, миометрите и пиометре у коров, если шейка матки открыта, в полость матки вводят 15% раствор препарата, подогретый до 40°С в количестве 200 — 300 мл и сразу же его удаляют. Для этих целей используют катетер с обратным током жидкости. Обработку проводят один раз в сутки до выздоровления.
Наряду с этиотропным лечением при трихомонозе коровам вводят во влагалище 20% раствор препарата при помощи шприца Жанэ с резиновой трубкой и специального катетера, имеющего на конечной части большое количество отверстий. Лечение проводят один раз в сутки в течение 5 — 7 дней, расходуя по 200 — 300 мл раствора на каждую процедуру. При лечении быков, больных острой формой трихомоноза, наряду с этиотропным лечением препуциальный мешок промывают 2 — 3% раствором препарата, который вводят с помощью катетера, соединенного резиновой трубкой с кружкой Эсмарха в количестве 0,5 — 1,0 л. После этого наружное отверстие препуциального мешка зажимают на 3 — 5 мин рукой и производят легкий массаж. Лечение проводят один раз в сутки в течение 5 — 7 дней.
В целях стимуляции центральной и вегетативной нервной системы, повышения резистентности у переболевших инфекционными и инвазионными болезнями животных, ускорения процессов заживления кожных покровов, при некробактериозе, экземах, дерматитах, трофических язвах препарат применяют с питьевой водой или в смеси с кормом один раз в сутки в дозах, указанных в таблице. Лечение проводят курсами по 5 дней с интервалом 3 дня до выздоровления.
В целях стимуляции роста и развития телят, поросят и цыплят, препарат применяют способом группового скармливания из расчета 0,1 мл АСД-2 на 1 кг массы тела через день в течение 1 — 2 месяцев.
Инфицированные вяло заживающие раны промывают 15 — 20% раствором препарата и после этого накладывают смоченную этим раствором повязку. Лечение проводят один раз в сутки до очищения раны от гноя. При наличии свищей, вскрытых полостей абсцессов, флегмон, в их полость вводят марлевый дренаж, смоченный раствором препарата и сверху накладывают стерильную повязку. Дренаж меняют ежедневно до образования грануляционного вала.
При мыте лошадей и наличии абсцессов в подчелюстном пространстве и на других частях тела после предварительного туалета, полости абсцессов промывают 15 — 20% раствором препарата или вводят в них пропитанные раствором тампоны, один раз в день до очищения раны от гноя и появления грануляции.
ОСОБЫЕ УКАЗАНИЯ
В период применения препарата АСД фракция 2 не отменяется этиотропное лечение животных. Молоко дойных животных и яйцо птицы после применения препарата используется без ограничений. В случае вынужденного убоя животных мясо используется без ограничений.
При работе с препаратом следует пользоваться резиновыми перчатками. По окончании работы лицо и руки следует вымыть теплой водой, вымыть и просушить перчатки. Пустые емкости из-под препарата запрещается использовать для бытовых целей, их выбрасывают в контейнеры для мусора. Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
ПОБОЧНЫЕ ДЕЙСТВИЯ
При применении препарата АСД-2 в соответствии с наставлением побочных явлений и осложнений не наблюдается.
ПРОТИВОПОКАЗАНИЯ
Противопоказаний не установлено.
УСЛОВИЯ ХРАНЕНИЯ
В местах, недоступных для детей, в упаковке предприятия-изготовителя отдельно от пищевых продуктов и кормов, в сухом, защищенном от света месте, при температуре от 10 до 30°С. Препарат пригоден для применения в течение 4 лет с даты изготовления при соблюдении указанных условий хранения. После первого вскрытия флакона препарат пригоден к применению в течение 14 суток. Запрещается использовать лекарственный препарат после окончания срока годности.
ПРОИЗВОДИТЕЛЬ
Армавирская биофабрика ФГУП
Использование больших наборов геномных данных для освещения патобиологии расстройств аутистического спектра
Американская психиатрическая ассоциация. Диагностическое и статистическое руководство по психическим расстройствам. 5-е изд. Арлингтон, Вирджиния: Американская психиатрическая ассоциация; 2013.
Google Scholar
Байо Дж., Виггинс Л., Кристенсен Д.Л., Меннер М., Дэниэлс Дж., Уоррен З. и др. Распространенность расстройств аутистического спектра среди детей в возрасте 8 лет — сеть мониторинга аутизма и нарушений развития, 11 сайтов, США, 2014 г.MMWR Surveill Summ. 2018; 67 (SS-6): 1–23.
Google Scholar
Фолштейн С., Раттер М. Детский аутизм: генетическое исследование пар близнецов. Том 18. Pergamon Press; 1977.
Саттерстром Ф.К., Космицки Дж. А., Ван Дж., Брин М., Де Рубейс С., Ан Дж. И др. Крупномасштабное исследование секвенирования экзома вовлекает как изменения в развитии, так и функциональные изменения в нейробиологию аутизма. Клетка. 2020; 180: 568–584.e23.
CAS Google Scholar
Сандерс SJ, He X, Willsey AJ, Ercan-Sencicek A, Samocha K, Cicek A, et al. Понимание геномной архитектуры и биологии расстройства аутистического спектра по 71 локусу риска. Нейрон. 2015; 87: 1215–33.
CAS Google Scholar
Тимпсон, штат Нью-Джерси, Гринвуд CMT, Соранцо Н., Лоусон Д. Д., Ричардс Дж. Б.. Генетическая архитектура: форма генетического вклада в человеческие черты и болезни. Nat Rev Genet. 2018; 19: 110–24.
CAS Google Scholar
Cross-Disorder Group Консорциума психиатрической геномики. Идентификация локусов риска с общим воздействием на пять основных психических расстройств: полногеномный анализ. Ланцет. 2013; 381: 1371–9.
Google Scholar
Честе П., Рёдер К., Девлин Б. Инь и Ян генетики аутизма: как редкие de novo и общие вариации влияют на ответственность. Анну Рев Геномикс Хум Генет. 2017; 18: 167–87.
CAS Google Scholar
Weiner DJ, Wigdor EM, Ripke S, Walters R, Kosmicki A, Grove J, et al. Неравновесие по полигенной передаче подтверждает, что общие и редкие вариации действуют аддитивно, создавая риск расстройств аутистического спектра. Нат Жене. 2017; 49: 978–85.
CAS Google Scholar
Иосифов И., Леви Д., Аллен Дж., Йе К., Ронемус М., Ли Ю. и др. Низкая нагрузка для разрушительных мутаций в генах аутизма и их предвзятой передачи. Proc Natl Acad Sci USA.2015; 112: E5600–7.
CAS Google Scholar
Сандерс С.Дж., Мурта М.Т., Гупта А.Р., Мердок Дж., Раубесон М., Уилси Дж. И др. Мутации de novo, выявленные при секвенировании всего экзома, тесно связаны с аутизмом. Природа. 2012; 485: 237–41.
CAS Google Scholar
Де Рубейс С., Хе Х, Голдберг А.П., Поултни С., Самоча К., Чичек А. и др. Синаптические, транскрипционные и хроматиновые гены нарушены при аутизме.Природа. 2014; 515: 209–15.
Google Scholar
Willsey AJ, Morris MT, Wang S, Willsey H, Sun N, Teerikorpi N, et al. Инициатива карты психиатрических клеток: конвергентный системный биологический подход к освещению ключевых молекулярных путей при нервно-психических расстройствах. Клетка. 2018; 174: 505–20.
CAS Google Scholar
Lajonchere CM. Консорциум AGRE.Изменение ландшафта исследований аутизма: обмен генетическими ресурсами аутизма. Нейрон. 2010; 68: 187–91.
CAS Google Scholar
Кремер Э.Дж., Притчард М., Линч М., Ю.С., Холман К., Бейкер Э. и др. Картирование нестабильности ДНК в хрупкой X с последовательностью тринуклеотидного повтора p (CCG) n. Наука. 1991; 252: 1711–4.
CAS Google Scholar
Пиеретти М., Чжан Ф.П., Фу Й.Х., Уоррен С., Остра Б., Каски С. и др.Отсутствие экспрессии гена FMR-1 при синдроме ломкой Х-хромосомы. Клетка. 1991; 66: 817–22.
CAS Google Scholar
Verkerk AJ, Pieretti M, Sutcliffe JS, Fu Y, Kuhl D, Pizzuti A, et al. Идентификация гена (FMR-1), содержащего повтор CGG, совпадающий с областью кластера контрольной точки, демонстрирующей вариацию длины при синдроме ломкой Х-хромосомы. Клетка. 1991; 65: 905–14.
CAS Google Scholar
Amir RE, Van den Veyver IB, Wan M, Tran CQ, Francke U, Zoghbi HY. Синдром Ретта вызывается мутациями в X-сцепленном MECP2, кодирующем метил-CpG-связывающий белок 2. Nat Genet. 1999; 23: 185–8.
CAS Google Scholar
European Chromosome 16 Tuberous Consortium. Идентификация и характеристика гена туберозного склероза на 16 хромосоме. Cell. 1993; 75: 1305–15.
Google Scholar
ван Слегтенхорст М., де Хугт Р., Херманс К., Неллист М., Янссен Б., Верхофф С. и др. Идентификация гена туберозного склероза TSC1 на хромосоме 9q34. Наука. 1997. 277: 805–8.
Google Scholar
Мухле Р.А., Сандерс С.Дж., Рид Х.Э., Стейт М.В. Глава 29 — Расстройство аутистического спектра: от генов к проводящим путям. В: Ленер Т., Миллер Б.Л., редакторы. Государственные схемы и пути в клинической нейропсихиатрии. Академическая пресса; 2016 г.п. 443–65.
Wiśniowiecka-Kowalnik B, Nowakowska BA. Генетика и эпигенетика расстройства аутистического спектра — актуальные данные в этой области. J Appl Genet. 2019; 60: 37–47.
Google Scholar
Робинсон Э.Б., Сен-Пуркэн Б., Анттила В., Космицки Дж. А., Булик-Салливан Б., Гроув Дж. И др. Генетический риск расстройств аутистического спектра и психоневрологические изменения в общей популяции. Нат Генет, 2016; 48: 552–5.
Bergen SE, Ploner A, Howrigan D, CNV Analysis Group и Рабочая группа по шизофрении Консорциума психиатрической геномики. Совместное влияние редких вариантов числа копий и общих SNP на риск шизофрении. Am J Psychiatry. 2019; 176: 29–35.
Bernier R, Golzio C, Xiong B, Stessman H, Coe B., Penn O, et al. Деструктивные мутации CHD8 определяют подтип аутизма на ранней стадии развития. Клетка. 2014; 158: 263–76.
CAS Google Scholar
О’Роак Б.Дж., Вивес Л., Фу В., Эгертсон Дж., Стэнэуэй И., Фелпс И. и др. Мультиплексное целевое секвенирование позволяет идентифицировать гены с повторяющимися мутациями при расстройствах аутистического спектра. Наука. 2012; 338: 1619–22.
Google Scholar
Нил Б.М., Коу Й., Лю Л., Мааян А., Самоча К., Сабо А. и др. Паттерны и частота экзонных мутаций de novo при расстройствах аутистического спектра. Природа. 2012; 485: 242–5.
CAS Google Scholar
Fu YH, Kuhl DP, Pizzuti A, Pieretti M, Sutcliffe JS, Richards S и др. Вариация CGG-повтора в хрупком Х-сайте приводит к генетической нестабильности — разрешению парадокса Шермана. Prog Brain Res. 1991; 197: 237–47.
Google Scholar
Эшли К. Т. младший, Уилкинсон К. Д., Рейнес Д., Уоррен СТ. Белок FMR1: консервативные домены семейства РНП и избирательное связывание РНК. Наука. 1993; 262: 563–6.
CAS Google Scholar
Hinds HL, Ashley CT, Nelson DL, Warren ST, Housman DE, Schalling M. Тканеспецифическая экспрессия FMR1 свидетельствует о его функциональной роли в синдроме ломкой Х-хромосомы. Нат Жене. 1993; 3: 36–43.
CAS Google Scholar
Siomi H, Siomi MC, Nussbaum RL, Dreyfuss G. Белок, продуцируемый ломким геном X, FMR1, имеет характеристики белка, связывающего РНК. Клетка. 1993; 74: 291–8.
CAS Google Scholar
Zoghbi HY, Медведь MF. Синаптическая дисфункция при нарушениях развития нервной системы, связанных с аутизмом и умственной отсталостью. Cold Spring Harb Perspect Biol. 2012; 4: a009886.
Jamain S, Quach H, Betancur C, Rastam M, Colineaux C, Gillber I, et al. Мутации X-сцепленных генов, кодирующих нейролигины NLGN3 и NLGN4, связаны с аутизмом. Нат Жене. 2003; 34: 27–9.
CAS Google Scholar
Себат Дж., Лакшми Б., Малхотра Д., Троге Дж., Лезе-Мартин С., Уолш Т. и др. Сильная связь мутаций числа копий de novo с аутизмом. Наука. 2007; 316: 445–9.
CAS Google Scholar
Леви Д., Ронемус М., Ямром Б., Ли Ю., Леотта А., Кендалл Дж. И др. Редкие de novo и переданные вариации числа копий при расстройствах аутистического спектра. Нейрон. 2011; 70: 886–97.
CAS Google Scholar
Сандерс С.Дж., Эркан-Сенсичек АГ, Хус В., Луо Р., Мурта М., Морено-Де-Лука Д. и др. Множественные рецидивирующие de novo CNV, включая дупликации области синдрома Вильямса 7q11.23, тесно связаны с аутизмом. Нейрон. 2011; 70: 863–85.
CAS Google Scholar
О’Роак Б.Дж., Деризиотис П., Ли К., Вивес Л., Шварц Дж. Дж., Гирираджан С. и др. Секвенирование экзома при спорадических расстройствах аутистического спектра выявляет тяжелые мутации de novo [опубликованные исправления опубликованы в Nat Genet.2012 Apr; 44 (4): 471]. Нат Жене. 2011. 43 (6): 585–9.
Иосифов И., Ронемус М., Леви Д., Ван З., Хаккер И., Розенбаум Дж. И др. Нарушения генов de novo у детей аутичного спектра. Нейрон. 2012; 74: 285–99.
CAS Google Scholar
О’Роак Б.Дж., Вивес Л., Гирираджан С., Каракоч Е., Крумм Н., Коу Б.П. и др. Спорадические экзомы аутизма обнаруживают сильно взаимосвязанную белковую сеть мутаций de novo.Природа. 2012; 485: 246–50.
Google Scholar
Иосифов И., О’Роак Б.Дж., Сандерс С.Дж., Ронемус М., Крумм Н., Леви Д. и др. Вклад кодирующих мутаций de novo в расстройство аутистического спектра. Природа. 2014; 515: 216–21.
CAS Google Scholar
Thomas NS, Sharp AJ, Browne CE, Skuse D, Hardie C, Dennis NR. Делеции Xp, связанные с аутизмом, у трех женщин.Hum Genet. 1999; 104: 43–48.
CAS Google Scholar
Жакмонт М.Л., Санлавиль Д., Редон Р., Рауль О., Кормье-Дайр В., Лионне С. и др. Сравнительная геномная гибридизация на основе массива выявляет высокую частоту скрытых хромосомных перестроек у пациентов с синдромными расстройствами аутистического спектра. J Med Genet. 2006; 43: 843–9.
CAS Google Scholar
Консорциум проекта генома аутизма, Сатмари П., Патерсон А.Д., Цвайгенбаум Л., Робертс В., Брайан Дж. И др. Картирование локусов риска аутизма с использованием генетического сцепления и хромосомных перестроек. Нат Жене. 2007. 39: 319–28.
Google Scholar
Weiss LA, Shen Y, Korn JM, Arking D, Miler D, Fossdal R, et al. Связь между микроделецией и микродупликацией на 16p11.2 и аутизмом. N. Engl J Med. 2008; 358: 667–75.
CAS Google Scholar
Кумар Р.А., Карамохамед С., Суди Дж., Конрад Д., Брун С., Баднер Дж. И др. Рецидивирующие микроделеции 16p11.2 при аутизме. Hum Mol Genet. 2008; 17: 628–38.
CAS Google Scholar
Itsara A, Wu H, Smith JD, Nickerson D, Romieu I, London SJ, et al. Ставки de novo и выбор большого количества копий. Genome Res. 2010; 20: 1469–81.
CAS Google Scholar
Пинто Д., Делаби Е., Мерико Д., Барбоса М., Мерикангас А., Клей Л. и др. Конвергенция генов и нарушение регуляции клеточных путей при расстройствах аутистического спектра. Am J Hum Genet. 2014; 94: 677–94.
Пинто Д., Пагнамента А.Т., Клей Л., Анни Р., Мерико Д., Реган Р. и др. Функциональное влияние глобальной вариации числа редких копий на расстройства аутистического спектра. Природа. 2010; 466: 368–72.
CAS Google Scholar
Морено-Де-Лука Д., Морено-Де-Лука А., Кубеллс Дж. Ф., Сандерс С. Дж..Сравнение перекрестных расстройств четырех нейропсихиатрических локусов CNV. Curr Genet Med Rep. 2014; 2: 151–61.
Google Scholar
Fernandez TV, Sanders SJ, Yurkiewicz IR, Ercan-Sencicek AG, Kim YS, Fishman DO, et al. Редкие варианты числа копий при синдроме Туретта нарушают гены гистаминергических путей и перекрываются с аутизмом. Биол Психиатрия. 2012; 71: 392–402.
CAS Google Scholar
Гудмундссон О.О., Уолтерс Г.Б., Ингасон А., Йоханссон С., Заяц Т., Атанасиу Л. и др. Синдром дефицита внимания и гиперактивности имеет тот же риск, что и шизофрения и расстройство аутистического спектра. Перевод Психиатрия. 2019; 9: 258.
Google Scholar
Чжао М., Ван Ц., Ван Ц. и др. Вычислительные инструменты для обнаружения вариации числа копий (CNV) с использованием данных секвенирования следующего поколения: особенности и перспективы. BMC Bioinforma.2013; 14: С1.
Google Scholar
Treangen TJ, Salzberg SL. Повторяющаяся ДНК и секвенирование следующего поколения: вычислительные задачи и решения. Nat Rev Genet. 2012; 13: 36–46.
CAS Google Scholar
Teo SM, Pawitan Y, Ku CS, Chia KS, Salim A. Статистические проблемы, связанные с обнаружением вариаций числа копий с помощью секвенирования следующего поколения.Биоинформатика. 2012; 28: 2711–8.
CAS Google Scholar
Narzisi G, Schatz MC. Проблема малых масштабов повторяется для неизведанных открытий. Фронт Bioeng Biotechnol. 2015; 3: 8.
Hill T, Unckless RL. Подход глубокого обучения для обнаружения изменения количества копий в данных секвенирования следующего поколения. G3: Гены, геномы, генетика. 2019; 9: 3575–82.
Astling DP, Heft IE, Jones KL, Sikela JM.Измерение с высоким разрешением числа копий домена DUF1220 на основе данных последовательности всего генома. BMC Genomics. 2017; 18: 614.
O’Bleness M, Searles VB, Dickens CM, Astling D, Albracht D, Mak ACY, et al. Завершенная последовательность и сборка богатой DUF1220 области 1q21 с использованием гаплоидного генома человека. BMC Genomics. 2014; 15: 387.
Google Scholar
Fischbach GD, Lord C. Simons Simplex Collection: ресурс для определения генетических факторов риска аутизма.Нейрон. 2010; 68: 192–5.
CAS Google Scholar
Grove J, Ripke S, Als TD, Mattheisen M, Walters RK, Won H, et al. Выявление общих вариантов генетического риска для расстройств аутистического спектра. Нат Жене. 2019; 51: 431–44.
CAS Google Scholar
Weiss LA, Arking DE, Daly MJ, Chakravarti A. Сканирование связей и ассоциаций по всему геному выявляет новые локусы аутизма.Природа. 2009; 461: 802–8.
CAS Google Scholar
Анни Р., Клей Л., Пинто Д., Алмейда Дж., Бакчелли Е., Бэрд Дж. И др. Отдельные общие варианты слабо влияют на риск расстройств аутистического спектра. Hum Mol Genet. 2012; 21: 4781–92.
CAS Google Scholar
Ма Д., Салякина Д., Яворски Дж. М., Конидари И., Уайтхед П. Л., Андерсен А. Н. и др.Полногеномное ассоциативное исследование аутизма обнаруживает общий новый локус риска в 5p14.1. Энн Хам Жене. 2009. 73: 263–73.
CAS Google Scholar
Ван К., Чжан Х., Ма Д., Букан М., Глесснер Дж. Т., Абрахамс Б.С. и др. Общие генетические варианты 5p14.1 связаны с расстройствами аутистического спектра. Природа. 2009. 459: 528–33.
CAS Google Scholar
He X, Sanders SJ, Liu L, De Rubeis S, Lim ET, Sutcliffe J, et al.Интегрированная модель de novo и унаследованных генетических вариантов дает больше возможностей для идентификации генов риска. PLoS Genet. 2013; 9: e1003671.
CAS Google Scholar
Самоча К.Э., Робинсон Э.Б., Сандерс С.Дж., Стивенс К., Сабо А., МакГрат Л.М. и др. Рамки для интерпретации мутации de novo при заболеваниях человека. Нат Жене. 2014; 46: 944–50.
CAS Google Scholar
Цзян Y, Хан Y, Петровски S, Owzar K, Goldstein DB, Allen AS. Включение функциональной информации в тесты на избыточную мутационную нагрузку de novo. Am J Hum Genet. 2015; 97: 272–83.
Лю И, Лян И, Чичек А.Е., Ли З, Ли Дж., Мюле Р.А. и др. Статистическая основа для картирования генов риска от мутаций de novo в исследованиях полногеномного секвенирования. Am J Hum Genet. 2018; 102: 1031–47.
Куанг Д., Чен Ю., Се Х. ДАНН: метод глубокого обучения для аннотирования патогенности генетических вариантов.Биоинформатика. 2015; 31: 761–3.
CAS Google Scholar
Lek M, Karczewski KJ, Minikel EV, Samocha KE, Banks E, Fennell T, et al. Анализ генетической изменчивости, кодирующей белок, у 60 706 человек. Природа. 2016; 536: 285–91.
Рентч П., Виттен Д., Купер Г.М., Шендур Дж., Кирчер М. CADD: прогнозирование вредоносности вариантов во всем геноме человека. Nucleic Acids Res. 2019; 47 (D1): D886–94.
CAS Google Scholar
Samocha KE, Kosmicki JA, Karczewski KJ, O’Donnell-Luria AH, Pierce-Hoffman E, MacArthur DG, et al. Ограничение регионального миссенс улучшает прогнозирование вредоносности вариантов. Препринт на https://www.biorxiv.org/content/10.1101/148353v1; 2017.
Ронемус М., Иосифов И., Леви Д., Виглер М. Роль мутаций de novo в генетике расстройств аутистического спектра. Nat Rev Genet.2014; 15: 133–41.
CAS Google Scholar
Sanders SJ, Neale BM, Huang H, Werling DM, An J-Y, Dong S, et al. Секвенирование всего генома при психических расстройствах: консорциум WGSPD. Nat Neurosci. 2017; 20: 1661–8.
CAS Google Scholar
Тернер Т.Н., Хормоздиари Ф., Дуйзенд М.Х., МакКлимонт С.А., Хук П.В., Иосифов И. и др. Секвенирование генома семей, затронутых аутизмом, показывает нарушение предполагаемой некодирующей регуляторной ДНК.Am J Hum Genet. 2016; 98: 58–74.
CAS Google Scholar
Тернер Т.Н., Коу Б.П., Дикель Д.Е., Хукзема К., Нельсон Б.Дж., Зоди М.К. и др. Геномные паттерны мутации de novo при симплексном аутизме. Клетка. 2017; 171: 710–722.e12.
CAS Google Scholar
Ruzzo EK, Perez-Cano L, Jung J-Y, Wang L-K, Kashef-Haghighi D, Hartl C, et al. Унаследованный и de novo генетический риск аутизма влияет на общие сети.Клетка. 2019; 178: 850–866.e26.
CAS Google Scholar
Yuen RKC, Merico D, Cao H, Pellecchia G, Alipanahi B, Thiruvahindrapuram B, et al. Полногеномные характеристики мутаций de novo при аутизме. npj Genom Med. 2016; 1: 16027.
Google Scholar
Yuen RKC, Thiruvahindrapuram B, Merico D, Walker S, Tammimies K, Hoang N, et al. Полногеномное секвенирование квартетов семей с расстройством аутистического спектра.Nat Med. 2015; 21: 185–91.
CAS Google Scholar
Jiang Y, Yuen RKC, Jin X, Wang M, Chen N, Wu X и др. Обнаружение клинически значимых генетических вариантов при расстройствах аутистического спектра путем полногеномного секвенирования. Am J Hum Genet. 2013; 93: 249–63.
CAS Google Scholar
Sanders SJ. Секвенирование следующего поколения при расстройствах аутистического спектра. Cold Spring Harb Perspect Med.2019; 9: a026872.
Верлинг Д.М., Брэнд Н, Ан J-Y, Стоун М.Р., Чжу Л., Глесснер Дж. Т. и др. Аналитическая основа для исследований ассоциации полногеномных последовательностей и их значения для расстройств аутистического спектра. Нат Жене. 2018; 50: 727–36.
CAS Google Scholar
Брандлер В., Антаки Д., Гуджрал М., Клейбер М., Уитни Дж., Майл М. и др. Наследственные отцовские цис-регуляторные структурные варианты связаны с аутизмом.Наука. 2018; 360: 327–31.
CAS Google Scholar
Фаррелл М.С., Верге Т., Склар П., Оуэн М.Дж., Офофф Р.А., О’Донован М.С. и др. Оценка исторических генов-кандидатов на шизофрению. Мол Психиатрия. 2015; 20: 555–62.
CAS Google Scholar
Johnson EC, Border R, Melroy-Greif WE, de Leeuw CA, Ehringer MA, Keller MC, et al. Нет доказательств того, что гены-кандидаты в шизофрению больше связаны с шизофренией, чем гены-кандидаты.Биол Психиатрия. 2017; 82: 702–8.
CAS Google Scholar
Джайн М., Корен С., Мига К.Х., Квик Дж., Рэнд А.С., Сасани Т.А. и др. Секвенирование нанопор и сборка генома человека со сверхдлинными считываниями. Nat Biotechnol. 2018; 36: 338–45.
CAS Google Scholar
Там В., Патель Н., Тюркотт М., Боссе Й., Паре Дж., Мейре Д. и др. Преимущества и недостатки полногеномных ассоциативных исследований.Nat Rev Genet. 2019; 20: 467–84.
CAS Google Scholar
Visscher PM, Wray NR, Zhang Q, Sklar P, McCarthy MI, Brown MA, et al. 10 лет открытия GWAS: биология, функции и перевод. Am J Hum Genet. 2017; 101: 5–22.
CAS Google Scholar
Руководящий комитет Психиатрического консорциума GWAS. Структура для интерпретации полногеномных ассоциативных исследований психических расстройств.Мол Психиатрия. 2009; 14: 10–7.
Google Scholar
Дункан Л.Е., Остахер М., Баллон Дж. Как исследования геномных ассоциаций (GWAS) сделали традиционные исследования генов-кандидатов устаревшими. Нейропсихофармакология. 2019; 44: 1518–23.
Google Scholar
Хорвиц Т., Лам К., Чен Й, Ся Й, Лю К. Десять лет в психиатрических исследованиях GWAS. Мол Психиатрия. 2019; 24: 378–89.
Google Scholar
Психиатрическая рабочая группа по биполярному расстройству Консорциума GWAS. Широкомасштабный анализ ассоциации биполярного расстройства по всему геному позволяет идентифицировать новый локус восприимчивости рядом с ODZ4. Нат Жене. 2011; 43: 977–83.
Google Scholar
Рабочая группа по шизофрении Консорциума психиатрической геномики, Рипке С., Нил Б.М., Корвин А., Уолтерс Дж.Т.Р., Фар К.Х. и др.Биологические выводы из 108 генетических локусов, связанных с шизофренией. Природа. 2014; 511: 421–7.
Google Scholar
Рабочая группа по расстройствам аутистического спектра Консорциума психиатрической геномики. Мета-анализ GWAS более 16000 человек с расстройством аутистического спектра выявил новый локус в 10q24.32 и значительное совпадение с шизофренией. Молочный аутизм. 2017; 8: 21.
Google Scholar
Power RA, Kyaga S, Uher R, MacCabe JH, Långström N, Landen M и др. Плодовитость пациентов с шизофренией, аутизмом, биполярным расстройством, депрессией, нервной анорексией или токсикоманией по сравнению с их здоровыми братьями и сестрами. JAMA Psychiatry. 2013; 70: 22–30.
Google Scholar
Irish Schizophrenia Genomics Consortium и Wellcome Trust Case Control Consortium 2. Общегеномное исследование ассоциации указывает на HLA-C * 01: 02 как фактор риска в главном локусе комплекса гистосовместимости при шизофрении.Биол Психиатрия. 2012; 72: 620–8.
Google Scholar
International Schizophrenia Consortium, Purcell SM, Wray NR, Stone JL, Visscher PM, O’Donovan MC, et al. Общие полигенные вариации повышают риск шизофрении и биполярного расстройства. Природа. 2009; 460: 748–52.
Google Scholar
Чаттерджи Н., Ши Дж., Гарсия-Клосас М. Разработка и оценка полигенных моделей прогнозирования риска для стратифицированной профилактики заболеваний.Nat Rev Genet. 2016; 17: 392–406.
CAS Google Scholar
Мартин А.Р., Канаи М., Каматани И., Окада И., Нил Б., Дейли М. и др. Клиническое использование текущих полигенных оценок риска может усугубить диспропорции в отношении здоровья. Нат Жене. 2019; 51: 584–91.
CAS Google Scholar
Гуо Х, Ван Т., Ву Х, Лонг М., Коу Б.П., Ли Х и др. Унаследованные и множественные мутации de novo в генах риска аутизма / задержки развития предполагают многофакторную модель.Молочный аутизм. 2018; 9: 64.
CAS Google Scholar
Такахаши Н., Харада Т., Нисимура Т., Окумура А., Чой Д., Ивабучи Т. и др. Связь генетических рисков с расстройством аутистического спектра и ранней задержкой нервного развития у детей без умственной отсталости. JAMA Netw Open. 2020; 3: e14.
Google Scholar
Торске Т., Наерланд Т., Беттелла Ф., Бьелла Т., Солод Е, Хойланд А.Л. и др.Полигенные показатели расстройства аутистического спектра связаны с повседневной исполнительной функцией детей, допущенных для клинической оценки. Autism Res. 2020; 13: 207–20.
Google Scholar
Сердаревич Ф., Таймайер Х., Янсен П.Р., Алемани С., Ксерка Й., Нойман А. и др. Полигенные оценки риска нарушений развития, нейромоторного функционирования в младенчестве и аутистических черт в детстве. Биол Психиатрия. 2020; 87: 132–8.
CAS Google Scholar
Willsey AJ, State MW. Расстройства аутистического спектра: от генов до нейробиологии. Curr Opin Neurobiol. 2015; 30: 92–9.
Google Scholar
Пиццо Л., Дженсен М., Поляк А., Розенфельд Дж. А., Манник К., Кришнан А. и др. Редкие варианты генетического фона модулируют когнитивные фенотипы и фенотипы развития у людей, несущих связанные с заболеванием варианты. Genet Med. 2019; 21: 816–25.
Цю З., Юань Б.На пути к пониманию расстройств аутистического спектра. Neurosci Bull. 2019; 35: 1110–2.
Google Scholar
Кришнан А., Чжан Р., Яо В., Тисфельд К.Л., Вонг А.К., Тадыч А. и др. Полногеномное прогнозирование и функциональная характеристика генетической основы расстройства аутистического спектра. Nat Neurosci. 2016; 19: 1454–62.
CAS Google Scholar
Zoghbi HY.Постнатальные нарушения психического развития: встреча в синапсе? Наука. 2003; 302: 826–30.
CAS Google Scholar
Парикшак Н.Н., Луо Р., Чжан А., Вон Х., Лоу Дж. К., Чандран В. и др. Интегративный функциональный геномный анализ указывает на определенные молекулярные пути и цепи при аутизме. Клетка. 2013; 155: 1008–21.
CAS Google Scholar
Uddin LQ, Supekar KS, Ryali S, Menon V.Динамическая реконфигурация структурных и функциональных связей в основных нейрокогнитивных сетях мозга по мере развития. J Neurosci. 2011; 31: 18578–89.
CAS Google Scholar
Бен-Дэвид Э., Шифман С. Сети нейрональных генов, подверженных распространенным и редким вариантам при расстройствах аутистического спектра. PLoS Genet. 2012; 8: e1002556.
CAS Google Scholar
Уилси А.Дж., Сандерс С.Дж., Ли М., Донг С., Теббенкамп А.Т., Мюле Р.А. и др. Сети коэкспрессии вовлекают нейроны глубокой корковой проекции средней части плода человека в патогенез аутизма. Клетка. 2013; 155: 997–1007.
Канг Х.Дж., Кавасава Ю.И., Ченг Ф., Чжу Й., Сюй Х, Ли М. и др. Пространственно-временной транскриптом человеческого мозга. Природа. 2011; 478: 483–9.
CAS Google Scholar
Ходж Р.Д., Баккен Т.Э., Миллер Дж.А., Смит К.А., Баркан Е.Р., Грейбак Л.Т. и др.Консервативные типы клеток с разными характеристиками в коре головного мозга человека и мыши. Природа. 2019; 573: 61–8.
CAS Google Scholar
Акбарян С., Лю С., Ноулз Дж. А., Ваккарино Ф.М., Фарнхэм П.Дж., Кроуфорд Г.Е. и др. Проект PsychENCODE. Nat Neurosci. 2015; 18: 1707–12.
CAS Google Scholar
Lein ES, Hawrylycz MJ, Ao N, Ayres M, Bensinger A, Bernard A, et al.Полногеномный атлас экспрессии генов в мозге взрослой мыши. Природа. 2007; 445: 168–76.
CAS Google Scholar
Tasic B, Yao Z, Graybuck LT, Smith KA, Nguyen TN, Bertagnolli D, et al. Общие и отдельные типы транскриптомных клеток в неокортикальных областях. Природа. 2018; 563: 72–78.
CAS Google Scholar
Тасич Б., Менон В., Нгуен Т.Н., Ким Т.К., Джарски Т., Яо З. и др.Таксономия кортикальных клеток взрослых мышей, выявленная с помощью транскриптомики одиночных клеток. Nat Neurosci. 2016; 19: 335–46.
CAS Google Scholar
Верлинг Д.М., Почаредди С., Чой Дж., Ан Дж-Йи, Шеппард Б., Пэн М. и др. Полногеном и секвенирование РНК выявляют вариации и транскриптомную координацию в развивающейся префронтальной коре головного мозга человека. Cell Rep 2020; 31: 107489.
CAS Google Scholar
Loo L, Саймон JM, Xing L, McCoy ES, Niehaus JK, Guo J и др. Одноклеточный транскриптомный анализ неокортикального развития мышей. Nat Commun. 2019; 10: 134.
Google Scholar
Macosko EZ, Basu A, Satija R, Nemesh J, Shekhar K, Goldman M, et al. Профилирование экспрессии отдельных клеток с высокой степенью параллельности генома с использованием нанолитровых капель. Клетка. 2015; 161: 1202–14.
CAS Google Scholar
Hrvatin S, Hochbaum DR, Nagy MA, Cicconet M, Robertson K, Cheadle L, et al. Одноклеточный анализ зависимых от опыта транскриптомных состояний в зрительной коре головного мозга мыши. Nat Neurosci. 2018; 21: 120–9.
CAS Google Scholar
Zeisel A, Munoz-Manchado AB, Codeluppi S, Lonnerberg P, La Manno G, Jureus A, et al. Строение мозга. Типы клеток коры головного мозга и гиппокампа мышей, выявленные с помощью одноклеточной RNA-seq. Наука.2015; 347: 1138–42.
CAS Google Scholar
Shekhar K, Lapan SW, Whitney IE, Tran NM, Macosko EZ, Kowalczyk M, et al. Комплексная классификация биполярных нейронов сетчатки по одноклеточной транскриптомике. Клетка. 2016; 166: 1308–1323.e30.
CAS Google Scholar
Чжун С., Чжан С., Фан Х, Ву Кью, Ян Л., Донг Джи и др. Одноклеточный РНК-seq обзор ландшафта развития префронтальной коры головного мозга человека.Природа. 2018; 555: 524–8.
CAS Google Scholar
Пыльца А.А., Новаковски Т.Дж., Чен Дж., Реталлак Х., Сандовал-Эспиноза С., Николас С.Р. и др. Молекулярная идентичность наружной радиальной глии человека во время коркового развития. Клетка. 2015; 163: 55–67.
CAS Google Scholar
Новаковски Т.Дж., Бхадури А., Пыльца А.А., Альварадо Б., Мостаджо-Раджи М.А., Ди Лулло Е. и др.Траектории пространственно-временной экспрессии генов показывают иерархию развития коры головного мозга человека. Наука. 2017; 358: 1318–23.
CAS Google Scholar
Saunders A, Macosko EZ, Wysoker A, Goldman M, Krienen FM, de Rivera H, et al. Молекулярное разнообразие и специализация клеток мозга взрослой мыши. Клетка. 2018; 174: 1015–1030.e16.
CAS Google Scholar
Polioudakis D, Torre-Ubieta L de la, Langerman J, Elkins AG, Stein JL, Vuong CK, et al. Одноклеточный транскриптомный атлас неокортикального развития человека в середине беременности. Нейрон. 2019; 103: 785–801.e8.
CAS Google Scholar
Zeisel A, Hochgerner H, Lonnerberg P, Johnsson A, Memic F, van der Zwan J, et al. Молекулярная архитектура нервной системы мыши. Клетка. 2018; 174: 999–1014.e22.
CAS Google Scholar
Велмешев Д., Ширмер Л., Юнг Д., Хаусслер М., Перес И., Майер С. и др. Одноклеточная геномика выявляет молекулярные изменения, специфичные для типа клеток, при аутизме. Наука. 2019; 364: 685–9.
CAS Google Scholar
Стюарт Т., Сатия Р. Интегративный одноклеточный анализ. Nat Rev Genet. 2019; 20: 257–72.
CAS Google Scholar
Адамсон Б., Норман Т.М., Йост М., Чо М.Ю., Нуньес Дж. К., Чен Ю. и др.Платформа мультиплексного одноэлементного скрининга CRISPR позволяет систематически анализировать развернутый белковый ответ. Клетка. 2016; 167: 1867–1882. E21.
Джайтин Д.А., Вайнер А., Йофе И., Лара-Астиасо Д., Керен-Шауль Н., Дэвид Е. и др. Рассечение иммунных цепей путем связывания CRISPR-объединенных экранов с одноклеточной RNA-Seq. Клетка. 2016; 167: 1883–1896. E15.
CAS Google Scholar
Датлингер П., Рендейро А.Ф., Шмидл С., Краусгрубер Т., Тракслер П., Клухаммер Дж. И др.Объединенный CRISPR-скрининг со считыванием одноклеточного транскриптома. Нат методы. 2017; 14: 297–301.
CAS Google Scholar
Диксит А., Парнас О., Ли Б., Чен Дж., Фулко С.П., Джерби-Арнон Л. и др. Perturb-Seq: рассечение молекулярных цепей с масштабируемым профилированием одноклеточной РНК объединенных генетических скринингов. Клетка. 2016; 167: 1853–1866. E17.
CAS Google Scholar
Buenrostro JD, Wu B, Litzenburger UM, Ruff D, Gonzales ML, Снайдер М.П. и др. Доступность одноклеточного хроматина раскрывает принципы регуляторной изменчивости. Природа. 2015; 523: 486–90.
CAS Google Scholar
Кусанович Д.А., Даза Р., Адей А., Плинер Х.А., Кристиансен Л., Гундерсон К.Л. и др. Мультиплексное профилирование отдельных клеток доступности хроматина с помощью комбинаторной клеточной индексации. Наука. 2015; 348: 910–4.
CAS Google Scholar
Lake BB, Chen S, Sos BC, Fan J, Kaeser GE, Yung YC, et al. Интегративный одноклеточный анализ транскрипционных и эпигенетических состояний в мозге взрослого человека. Nat Biotechnol. 2018; 36: 70–80.
Ecker JR, Geschwind DH, Kriegstein AR, Ngai J, Osten P, Polioudakis D, et al. Консорциум переписи клеток BRAIN Initiative: извлеченные уроки для создания всеобъемлющего атласа клеток мозга. Нейрон. 2017; 96: 542–57.
CAS Google Scholar
Степанова Е., Доулинг С., Фелпс М., Финдлинг Р.Л. Фармакотерапия эмоциональных и поведенческих симптомов, связанных с расстройством аутистического спектра у детей и подростков. Диалоги Clin Neurosci. 2017; 19: 395–402.
Google Scholar
Френч Л., Kennedy EMM. Ежегодный обзор исследований: раннее вмешательство для младенцев и детей раннего возраста с расстройством аутистического спектра или находящихся в группе риска: систематический обзор. J Детская психическая психиатрия.2018; 59: 444–56.
Google Scholar
Goel R, Hong JS, Findling RL, Ji NY. Обновленная информация о фармакотерапии расстройства аутистического спектра у детей и подростков. Int Rev Psychiatry. 2018; 30: 78–95.
Google Scholar
Griesi-Oliveira K, Sertié AL. Расстройства аутистического спектра: обновленное руководство по генетическому консультированию. Эйнштейн (Сан-Паулу). 2017; 15: 233–8.
Бартон К.С., Табор Х.К., Старкс Х., Гарнизон Н.А., Лаурино М., Берк В. и др. Пути от диагностики расстройства аутистического спектра к генетическому тестированию. Genet Med. 2018; 20: 737–44.
Google Scholar
Росси М., Эль-Хечен Д., Блэк М.Х., Фарвелл Хагман К.Д., Тан С., Повис З. и др. Результаты диагностического секвенирования экзома у пациентов с диагностированными или подозреваемыми расстройствами аутистического спектра. Pediatr Neurol. 2017; 70: 34–43.e2.
Google Scholar
Srivastava S, Love-Nichols JA, Dies KA, Ledbetter DH, Martin CL, Chung WK, et al. Мета-анализ и мультидисциплинарное консенсусное заявление: секвенирование экзома — это клинический диагностический тест первого уровня для людей с нарушениями развития нервной системы. Genet Med. 2019; 21: 2413–21.
Google Scholar
Schaefer GB, Mendelsohn NJ.Комитет по профессиональной практике и руководящим принципам. Клиническая генетическая оценка в определении этиологии расстройств аутистического спектра: пересмотр рекомендаций 2013 г. Genet Med. 2013; 15: 399–407.
CAS Google Scholar
Munnich A, Demily C, Frugère L, Duwime C, Malan V, Barcia G, et al. Влияние клинических генетических консультаций на частоту диагностики у детей и молодых людей с расстройствами аутистического спектра.Молочный аутизм. 2019; 10:33.
Tammimies K, Marshall CR, Walker S, Kaur G, Thiruvahindrapuram B, Lionel AC, et al. Молекулярная диагностическая ценность анализа хромосомных микрочипов и секвенирования всего экзома у детей с расстройствами аутистического спектра. J Am Med Assoc. 2015; 314: 595–903.
Webb SJ, Shic F, Murias M, Sugar CA, Naples AJ, Barney E, et al. Получение биомаркеров и контроль качества для многоцентровых исследований: консорциум биомаркеров аутизма для клинических испытаний.Front Integr Neurosci. 2019; 13:71.
Google Scholar
Stessman HA, Bernier R, Eichler EE. Подход, основанный на генотипе, для определения подтипов сложного заболевания. Клетка. 2014; 156: 872–7.
CAS Google Scholar
Duyzend MH, Eichler EE. Первоначальный анализ генотипа делеции 16p11.2 определяет новый тип «аутизма». Биол Психиатрия. 2015; 77: 769–71.
CAS Google Scholar
Mendell JR, Al-Zaidy S, Shell R, Arnold WD, Rodino-Klapac LR, Prior TW, et al. Однодозная генно-заместительная терапия при мышечной атрофии позвоночника. N. Engl J Med. 2017; 377: 1713–22.
CAS Google Scholar
Чирибога К.А., Свобода К.Дж., Даррас Б.Т., Яннакконе С.Т., Монтес Дж., Де Виво Д.К. и др. Результаты исследования фазы 1 нусинерсена (ISIS-SMN (Rx)) у детей со спинальной мышечной атрофией.Неврология. 2016; 86: 890–7.
CAS Google Scholar
Сестан Н., Гос. МВ. Трудности перевода: преодоление сложного пути от геномики к терапии расстройства аутистического спектра. Нейрон. 2018; 100: 406–23.
CAS Google Scholar
Dagli A, Buiting K, Williams CA. Молекулярные и клинические аспекты синдрома Ангельмана. Мол Синдромол. 2012; 2: 100–12.
CAS Google Scholar
Meng L, Person RE, Huang W., Zhu PJ, Costa-Mattioli M, Beaudet AL. Усечение Ube3a-ATS приводит к отключению отцовского Ube3a и улучшению поведенческих дефектов на мышиной модели с синдромом Ангельмана. PLoS Genet. 2013; 9: e1004039.
Google Scholar
Сильва-Сантос С., ван Верден Г.М., Брюинсма С.Ф., Ментес Э., Джолфаей М.А., Дистел Б. и др.Восстановление Ube3a идентифицирует отдельные окна развития в модели синдрома Ангельмана у мышей. Clin Invest. 2015; 125: 206
6.
Google Scholar
Sztainberg Y, Chen H, Swann J, Hao S, Tang B, Wu Z, et al. Изменение фенотипов у мышей с дупликацией MECP2 с использованием генетического спасения или антисмысловых олигонуклеотидов. Природа. 2015; 528: 123–6.
CAS Google Scholar
Луони М., Джаннелли С., Индриго М.Т., Ниро А., Массимино Л., Янниелли А. и др. Доставка в весь мозг нестабильного трансгена Mecp2 улучшает поведенческие и молекулярные патологические дефекты в моделях синдрома Ретта у мышей. eLife. 2020; 9: e52629.
CAS Google Scholar
Ehninger D, Han S, Shilyansky C, Zhou Y, Li W, Kwiatkowski DJ, et al. Устранение дефицита обучения в модели туберозного склероза на мышах Tsc2 +/-.Nat Med. 2008; 14: 843–8.
Гай Дж., Ган Дж., Селфридж Дж., Кобб С., Берд А. Обращение неврологических дефектов в мышиной модели синдрома Ретта. Наука. 2007; 315: 1143–7.
CAS Google Scholar
Квон С.Х., Чжу Х, Чжан Дж., Бейкер С.Дж. mTor необходим для гипертрофии Pten-дефицитной нейрональной сомы. Proc Natl Acad Sci USA. 2003. 100: 12923–8.
CAS Google Scholar
Smith AM, King JJ, West PR, Ludwig MA, Donley EL, Burrier RE и др. Метаботипы с нарушением регуляции аминокислот: потенциальные биомаркеры для диагностики и индивидуального лечения подтипов расстройства аутистического спектра. Биол Психиатрия. 2019; 85: 345–54.
Озтан О., Гарнер Дж. П., Константино Дж. Н., Паркер К. Дж. Концентрация вазопрессина в спинномозговой жидкости новорожденных позволяет прогнозировать более поздние медицинские диагнозы расстройства аутистического спектра. Proc Natl Acad Sci USA 2020; 117: 10609–13.
McPartland JC, Bernier RA, Jeste SS и др. Консорциум клинических испытаний биомаркеров аутизма (ABC-CT): научный контекст, дизайн исследования и продвижение к квалификации биомаркера. Front Integr Neurosci. 2020; 14:16.
Google Scholar
Hazlett HC, Gu H, Munsell BC, Kim SH, Styner M, Wolff JJ, et al. Раннее развитие мозга у младенцев с высоким риском расстройства аутистического спектра. Природа. 2017; 542: 348–51.
Szatmari P, Georgiades S, Duku E, Bennett TA, Bryson S, Fombonne E, et al. Траектории развития тяжести симптомов и адаптивного функционирования в начальной когорте дошкольников с расстройством аутистического спектра. JAMA Psychiatry. 2015; 72: 276–83.
WeBuyBlack> Здоровье и красота> АСД-2 Дорогов ДЛЯ ВНУТРЕННЕГО ПРИМЕНЕНИЯ 100мл лечение онкологических заболеваний антисептическим стимулятором иммуномодулятор
FAQ:
> Вопрос: Где это сделано? Какая страна?
> Ответ: Страна производства: Российская Федерация (ФКП «Армавирская биофабрика»).
> Вопрос: Как долго он действительно может использоваться после открытия? На этикетке написано 14 дней — слишком мало времени, чтобы использовать его, если принимать всего несколько капель на порцию.
> Ответ: Срок годности полностью открытой бутылки — 14 дней. Но можно проткнуть резиновую пробку бутылки с АСД, оставив в ней иглу. И по мере необходимости берут необходимый объем АСД, периодически подсоединяя шприц к игле. Раствор без доступа воздуха подойдет на 1-2 месяца.
ОТЗЫВЫ ПРОДУКТА:
1: DINA
Это волшебный продукт
2: Joe Horyn
Я использую его для лечения рака у людей, он отлично работает в тандеме с пищевой содой
3:
Если у вас рак Хорошая идея попробовать этот продукт!
Мне кажется, что это лекарство работает,
После операции на простате уровень ПСА был равен 0.3 и примерно через месяц мой PSA упал до -0,3
4: ivank
Что меня поразило, потребовалось около десяти дней, чтобы …
20 лет назад у нас были эти вещи дома, в Украине, и я спас человека с ужасными трофическими ранами, для лечения которых несколько рецептов не помогли. Что меня поразило, потребовалось около десяти дней, чтобы его многочисленные трофические раны, покрытые новой кожей, зажили! Мне было трудно поверить в это самому! По моему опыту, этот препарат может лечить безнадежные раны, если ничего не помогает, но будьте готовы, что он пахнет невероятно, вам, вероятно, придется применять его снаружи.ОН ДОЛЖЕН БЫТЬ РАЗБАВЛЕН ДЛЯ АКТУАЛЬНОГО ПРИМЕНЕНИЯ, ВЫ ДОЛЖНЫ УЗНАТЬ, КАК ИСПОЛЬЗОВАТЬ ЭТО ПРАВИЛЬНО. Целебная сила этого вещества — факт, который я сам видел. Я думаю, что вряд ли что-то может сравниться с этим. Сейчас я живу в Сакраменто, Калифорния, и приятно удивлен, что он доступен на ecrater, и при необходимости я могу получить его в любое время
5: Genuine Me
Запах — одна из самых ужасных вещей, которые я когда-либо ощущал, поэтому откройте его снаружи
Запах — одна из самых ужасных вещей, которые я когда-либо нюхал, так что откройте его снаружи.Хотя продукт был хорош. 🙂
6: ecrater Customer
Очень хорошо для моей мамы
7: Anna L.
Я только что получил товар, он очень хорошо упакован, и срок годности хороший. Мы еще не пробовали, но я верю, что это сработает. Спасибо, Елена, что решила вопрос с почтой и отправила письмо во второй раз. Обязательно порекомендую сделать заказ у этого продавца.
8: Томас Либерис
, и мне лучше никогда не узнать
Это очень мощный иммуномодулятор, спасающий жизнь.Первоначально изобрели для военных, если многие годы продавались людям, а затем перешли в ветеринарную фармакопею по одной-единственной причине, люди почти не покупали другие лекарства, это настолько эффективно! Я чувствую, что это действительно повышает мой иммунитет, невероятно! Я чувствую, что это потрясающе против моего гепатита С! Я слышал, как люди говорили, что это помогло многим людям с раком, не знаю об этом, и лучше мне никогда не узнать! Как по мне офигенно. Запах хоть и невозможен, но меня это не волнует, мне нужно, чтобы он мне помогал Я из Сакраменто, Калифорния. Еще в Украине 20 лет назад у меня был опыт с фракцией 3, которая является внешней, она в несколько раз ужаснее пахнет, но это сделало меня верующим.Мой сосед выпил себя почти до смерти, многим людям было противно видеть, как он это делает, но ему было все равно … Он пил так много и столько лет, что в конце концов на его ногах ниже колен открылись ужасные раны они были примерно от 1/8 до 1/16 глубины, от дюйма до двух в ширину и от трех до пяти дюймов в длину. Их было по несколько на каждой ноге. Раны выглядели такими страшными, это было живое мясо, я видел, как шевелятся его мускулы! Если бы вы посмотрели на этот ужас, вы бы подумали, что может потребоваться три месяца или больше, чтобы заставить его зажить, и, вероятно, не были бы уверены, что он излечит.Это случилось с ним, потому что из-за многих лет пьянства он наверняка недоедал, и поэтому казалось, что раны классифицируются как трофические раны. Значит, вылечить будет сложно. Он также выразил сомнение, что это заживет, потому что он уже испробовал несколько рецептов, и все усилия были бесполезны … К моему удивлению, его раны зажили с помощью фракции 3 ASD! Это было абсолютно невероятно, мне было трудно поверить в себя, когда я увидел, что все его раны покрыты новой кожей, довольно удивительно! Это заставило меня поверить в фракции Дорогова.Основываясь на этом опыте с внешней фракцией 3 ДМПП, я недавно купил в другом, отличном от ecrater, источнике, Фракцию 2 для внутреннего применения
и обнаружил, что это невероятно сильный препарат для повышения иммунитета. Одним словом потрясающе, огромное спасибо изобретателю
9: Alex
Отличный продукт, прибыл, как и ожидалось.
10: Георгий Попа
Это очень полезно для здоровья
11: Филипп
Полезно для людей.
12: Надя Николаева
Посылка пришла быстро и была очень хорошо упакована.Используйте его 2 дня, и он уже помогает при псориазе.
13: СОФИ
УШИ УШЛИ!
Я получил посылку с ASD-2 (для внутреннего использования) и ASD-3 (для наружного применения) в течение 3 недель. Стеклянные бутылки были надежно упакованы в пузырчатую пленку. Согласно этикетке, оба решения были недавно изготовлены в декабре 2018 и январе 2019 года и прослужили 4 года. Немного истории. Изначально ASD был изобретен российским исследователем А. В. Дороговым в 40-х годах для содействия восстановлению животных и людей от радиации.У меня есть личное свидетельство относительно лечения моего питомца с ASD 3 от хронических ушных инфекций и заражения ушными клещами. Мой сильно зараженный кот тряс и тер голову, в результате чего его наружные уши становились раздраженными и раздраженными. Поначалу я не верил своим глазам, потребовалось всего одно приложение ASD 3. А через неделю уши были чистыми! Моей кошке больше не нужно трясти и тереть голову!
14: mefromhere
Поистине чудо!
Живая / мертвая вода из русского фольклора 🙂
Я дал это нашей большой собаке только 3 раза.Плюсы: наш гигантский щенок с хроническими проблемами суставов и дрожжевыми ушами (несмотря на то, что он был сырым) буквально стал новой собакой. Она игрива, полна жизни и укрепила свою выносливость! Нет ничего другого, чтобы приписать это массовое изменение, кроме дроби.
Минусы: я, возможно, никогда не смогу дать ей еще одну дремоту, потому что она ненавидит вонь так же сильно, как и я 🙁 И она весит 150 фунтов. Если у вас есть трюк — пожалуйста, поделитесь.
15: Ирина Янкович
Счастлив с доставкой!
Как всегда, мы находимся на пороге очередной эпидемии, и, конечно, заболеть совсем не входит в наши планы.Итак, что мы можем сделать, как мы можем помочь себе не заболеть, а если вы все же заболели, то как быстро вылечиться. Всем известно, что в нашем организме есть мощная система защиты и регулирования.
Но современному человеку довольно сложно и сложно оставаться и оставаться в боеспособном состоянии. У нас нет времени, мы постоянно в стрессе: много работаем, мало спим, плохо едим, не позволяем себе расслабиться и тем самым вводим свой организм в состояние длительного стресса.
Что делать?
Активационная терапия с ASD — это решение! Препарат Антисептик Стимулятор Дорогова является (является) полностью идеальным готовым сырьем для синтеза наших собственных белков в нашем организме! [! Brand: COVID-19 PROTECTION!] [! Upc: 4605894002848!] [! Ean: 4605894002114!] [! Feature_product: лечение рака!] [! материал: Дорогов А.!] [! стиль: Армавир!]
границ | Состав коричневой жировой ткани человека, оцениваемый с помощью магнитно-резонансной томографии, претерпевает изменения в составе после воздействия холода: исследование МРТ in vivo на здоровых добровольцах
Введение
Основная функция коричневой жировой ткани (BAT) заключается в преобразовании химической энергии, хранящейся в липидах, в тепловую энергию (тепло). Воздействие низких температур является основным физиологическим стимулом для активации BAT (1). При адренергической стимуляции симпатическими нервами внутриклеточный липолиз происходит в коричневых адипоцитах (2), и образующиеся свободные жирные кислоты связываются с разобщающим белком 1 (UCP1), который, в свою очередь, функционирует как молекулярные ворота, которые рассеивают генерируемый митохондриальный протонный градиент. как тепло.Чтобы восполнить внутриклеточные запасы липидов, BAT забирает глюкозу и жирные кислоты из большого круга кровообращения (3, 4). У грызунов о визуализации BAT с помощью магнитно-резонансной томографии (МРТ) впервые сообщили почти три десятилетия назад (5), и вскоре было показано, что этот метод точно отражает структуру ткани (6), а также гистологические изменения, вызванные температурной акклиматизацией (7). ). Совсем недавно, когда исследования были расширены в сторону физиологии человека, несколько исследований изучали этот метод, свободный от ионизирующего излучения, с целью понимания функции BAT (8).Из доклинических моделей известно, что химически оцененное содержание жира в тканях соответствует массе жира, оцененной с помощью МРТ (9), и что жировая фракция (FF) отрицательно коррелирует с количеством экспрессирующих UCP1 клеток в BAT (10) и положительно с размер адипоцитов (11). Во внутрилопаточных летучих мышах грызунов, содержащихся на обычном питании и при комнатной температуре (около 21 ° C), МРТ оценки FF варьируются от 20 до 50%, в зависимости от глубины ткани (12). Однако при термонейтральном содержании животных FF может достигать почти 80% (13).У младенцев BAT напоминает классическое внутрилопаточное депо, обнаруживаемое у грызунов, как по морфологии, так и по функциям (14). У взрослых, однако, наблюдается заметное отсутствие легко различимых границ, например, надключичного депо, что затрудняет достижение консенсуса по оптимальным пороговым значениям FF, которые следует использовать для специфической визуализации BAT (15). Как следствие, FF в составе BAT человека по-разному описывается как примерно 60% (16), 65% (17), 80% (18, 19) и 94% (20) у пожилых людей, а также различные пороговые уровни FF. используется для сегментации BAT (19, 21–24).Только в одном недавнем исследовании изучалось влияние определенных пороговых уровней FF (0–100, 40–100 и 50–100%) на холодовую реакцию при FF (25), но анализ других параметров исходов МРТ не проводился. Время релаксации T2 * также изучалось как косвенный показатель активности BAT с помощью МРТ (16, 21, 24, 26, 27). Было продемонстрировано, что T2 * BAT короче по сравнению с белой жировой тканью (WAT), что, скорее всего, связано с обилием богатых железом митохондрий, присутствующих в коричневых адипоцитах.Активация BAT, вызванная холодом, увеличивает потребление кислорода из-за повышенной метаболической активности, что, в свою очередь, увеличивает перфузию крови. Последний увеличивает T2 *, тогда как потребление кислорода сокращает T2 * (21). Существуют разные сообщения о направлении изменений Т2 * во время воздействия холода, скорее всего, из-за этих противоречивых эффектов (17, 28, 29). БАТ по своей природе гетерогенны: в молекулярном масштабе это проявляется в различиях в экспрессии белка UCP-1 в соседних клетках, которые после иммуноокрашивания создают многоцветный узор, названный «феноменом арлекина» (30).Отсутствие однородности между депо жировой ткани в пределах одного организма также было отмечено на функциональном уровне (31–33). Хотя структурная неоднородность была отмечена в исследованиях визуализации BAT (34–37), ее обычно считают смешивающим фактором. Более того, хотя основная цель медицинских исследований НДТ заключается в понимании и управлении потоками энергии, количественная оценка массы ткани в виде калорийных эквивалентов встречается редко. Есть несколько интересных примеров применения такой концепции, например, путем сопоставления состава тела с потенциальными запасами энергии и прогнозирования расхода энергии всего тела (38, 39) или выводов относительно поглощения энергии BAT путем оценки содержания энергии в меченых макромолекулах (40). Однако, насколько нам известно, оценка накопителей энергии BAT in vivo еще не проводилась. Учитывая важность BAT в текущих исследованиях метаболизма, мы стремились изучить влияние различных диапазонов пороговых значений жировой фракции на несколько исходов, измеряемых с помощью МРТ.Более того, мы впервые поставили перед собой задачу исследовать влияние холода на массу и энергоемкость НДТ. С этой целью мы сначала оценили предполагаемые объемы BAT в термонейтральных и холодных условиях, чтобы установить более низкий порог FF для исключения нежирных вокселей. Впоследствии мы определили предполагаемый объем BAT, FF, T2 *, массу и энергосодержание и исследовали влияние различных пороговых значений FF на эти параметры. Наконец, мы оценили локальные изменения FF и T2 * при воздействии холода на уровне вокселей.Мы демонстрируем важность участков ткани с высоким содержанием липидов и предполагаем, что концептуальная основа этой работы может способствовать дальнейшим исследованиям BAT как мишени для ожирения и метаболических нарушений у людей.
Материалы и методы
Субъекты
Десять здоровых, некурящих, худых (ИМТ 18–25 кг / м) 2 ) мужчин-добровольцев-европидов, родившихся в Нидерландах, в возрасте от 18 до 30 лет, были набраны в рамках более крупного интервенционного исследования, в котором изучалось влияние воздействия холода и агониста β3-рецепторов мирабегрона на BAT (номер клинических испытаний: NCT03012113).Исследование было проведено в соответствии с принципами новой редакции Хельсинкской декларации (41) и с одобрения местного комитета по медицинской этике. Критериями исключения были недавнее чрезмерное изменение веса (> 3 кг в течение последних 3 месяцев), энергичные упражнения, использование любых лекарств, которые, как известно, влияют на метаболизм липидов и / или глюкозы, активность BAT, сердечную функцию или время интервала QT, курение и любые соответствующие хронические заболевания. болезнь. Противопоказаниями для прохождения МРТ было наличие в теле небезопасных для МРТ металлических имплантатов или предметов (т.например, кардиостимулятор, нейростимулятор, гидроцефалия или лекарственная помпа, несъемный слуховой аппарат или большие недавние татуировки), а также наличие в анамнезе клаустрофобии, шума в ушах или гиперакузии.
Дизайн исследования и протокол активации BAT
Субъектам было сказано воздержаться от алкоголя и кофеина в течение 24 часов и голодать в течение 10 часов до эксперимента. Испытуемые оставались голодными до конца эксперимента. Чтобы активировать BAT, был проведен индивидуальный протокол охлаждения, как описано ранее (42).Каждый субъект был помещен между перфузируемыми матрасами с контролируемой температурой с водой, изначально циркулирующей при 32 ° C. Температуру воды постепенно снижали в течение первого часа до достижения 9 ° C или сообщения о дрожи у субъекта. В любом случае температура была повышена на 3 ° C, и пациент лежал еще на один час в этих условиях. В случае возобновления дрожи температура была немного повышена, чтобы прекратить дрожь и гарантировать, что НДТ остаются доминирующим источником производства тепла (2).МРТ-сканирование было получено до и после протокола охлаждения на 3 Т МРТ-сканере (Philips Ingenia, Philips Healthcare, Best, Нидерланды). Субъекты располагались в сканере на спине головой вперед. Сканирование проводилось в одно и то же время дня у всех участников (до охлаждения: утром, после охлаждения: днем).
Получение изображения
Трехмерное шеститочечное кодирование градиентного эхо-сигнала с химическим сдвигом с использованием 16-канального переднего массива, 12-канального заднего массива и заднего участка 16-канальной катушки для головы и шеи использовалось для получения изображения надключичного жирового депо. (Фигура 1).Были использованы следующие параметры визуализации: время повторения TR = 15 мс, время первого эхо-сигнала TE = 1,98 мс, временное разделение эхо-сигналов ΔTE = 1,75 мс, угол поворота = 8 °, поле зрения 480 × 300 × 90 мм 3 (правый-левый, ступня-головка, передне-задний), изотропное разрешение 1,1 мм, четыре средних сигнала. Усреднение производилось после приобретения; в случае значительного движения объекта соответствующие средние значения отклонялись. Массовое движение из-за дрожи или дискомфорта испытуемого было основным источником движения.Общее время визуализации составляло 12 мин. Чтобы повысить воспроизводимость положения объекта, участников просили как можно дальше дотянуться пальцами до ступней после того, как их поместили на стол сканера, а затем расслабить плечи.
Рисунок 1 . Пример регистрации изображения и реконструированная карта фракции жира до и после охлаждения. В первом столбце показаны термонейтральные изображения и изображения после охлаждения (один срез от первого эхо-сигнала в захвате).Во втором столбце показано наложение одних и тех же изображений до (вверху) и после регистрации (внизу). Изображения окрашены в оранжевый (термонейтральный) и синий (после охлаждения) для лучшей визуализации различий между сканированными изображениями. В третьем столбце показаны карты термонейтральной жировой ткани и жировой фракции после охлаждения надключичного жирового депо, наложенные на соответствующие изображения. Содержание липидов в надключичной области отображается на цветной карте в диапазоне фракции 30–100% жира.
Реконструкция и анализ данных
Реконструкция данных
Количественные изображения воды и жира были реконструированы в автономном режиме с использованием собственного алгоритма разделения воды и жира, основанного на известных частотах многопикового спектра жира и в предположении моноэкспоненциального T2 * в сочетании со схемой увеличения области для смягчить сильные эффекты неоднородности основного поля.Первоначально реконструкция с низким разрешением проводилась с использованием оценки неоднородности основного магнитного поля. Впоследствии схема выращивания области была использована для экстраполяции решения из правильно реконструированных частей, чтобы получить реконструированные изображения воды и жира с высоким разрешением (43–46). Карты FF были созданы в соответствии со следующим уравнением, где x, y и z обозначают положение вокселя на изображении.
Доля сигнального жира (x, y, z) = SignalFat (x, y, z) SignalFat (x, y, z) + SignalWater (x, y, z)Регистрация изображения и определение области интереса
Регистрация была выполнена с использованием набора инструментов для регистрации изображений с открытым исходным кодом Elastix (47, 48).Первое эхо пакета термонейтральных изображений было зарегистрировано с эхом пакета постохлаждения путем их предварительного аффинного выравнивания с последующей деформируемой регистрацией с помощью трехмерного преобразования B-сплайна с размером 10 × 10 × 10 мм 3 сетка. В обоих случаях в качестве меры сходства использовался адаптивный стохастический градиентный спуск с двумя разрешениями для оптимизации и взаимная информация Матта. Во время регистрации использовались маски областей, определяемые как часть выборки каждого стека изображений.Файлы параметров, которые использовались для выполнения регистрации, можно загрузить с http://elastix.bigr.nl/wiki/index.php/Par0048. Области интереса (ROI), охватывающие известное расположение левого надключичного жирового депо (49) (Рисунок 1), были нарисованы вручную на термонейтральном сканировании одним наблюдателем. Кроме того, чтобы гарантировать, что потенциальные изменения в FF надключичного депо BAT были специфичными для этой области, представляющие интерес области, включающие дельтовидную подкожную жировую ткань (SAT), были вручную очерчены как при термонейтральном сканировании, так и при сканировании после охлаждения (дополнительный рисунок S1).Чтобы исключить потенциальное смещение, вызванное направлением регистрации, мы также выполнили регистрацию в обратном направлении (пост-охлаждение → термонейтрально) и получили результаты (не показаны), которые были практически идентичны тем, о которых сообщается ниже.
Анализ данных
Изменения надключичного жирового депо, вызванные холодом, оценивали с помощью двух дополнительных анализов. Сначала с помощью глобального анализа оценивали изменения FF, T2 *, объема, массы и энергетического содержания надключичного жирового депо.Поскольку этот анализ использует только поле деформации для отображения области интереса на изображении после охлаждения, это позволяет не только оценить FF, но также любые изменения в предполагаемом объеме BAT. Недавно было показано, что оценка объема BAT сильно зависит от критериев сегментации в исследованиях [ 18 F] FDG PET-CT (50). Поэтому мы решили изучить влияние критериев сегментации FF как на предполагаемый объем BAT, так и на FF с помощью МРТ.
Расчетный объем BAT был определен путем умножения объема одного воксела (0.548 мкл) на количество вокселей, попадающих в определенный диапазон сегментации жировой фракции (например, 30–100% FF). Например: при использовании диапазона порога сегментации 30–100% FF 93275 вокселей были сегментированы из термонейтрального изображения. Умноженный на объем одного воксела (0,548 мкл), расчетный объем BAT составит 51 мл. Данные этого анализа также использовались для изучения различных пороговых значений FF. Во-вторых, мы провели локальный анализ для изучения изменений FF и времени релаксации T2 * на уровне вокселей.Поскольку этот метод напрямую деформирует термонейтральные изображения и области интереса в координаты изображения после охлаждения, нельзя сделать никаких выводов относительно истинного объема. Подробности методов изложены ниже. Из-за чрезмерного движения во время получения изображения данные МРТ от одного участника не могли быть восстановлены и были исключены из всех анализов.
I. Общий анализ: FF Glob , FF SAT , T2Glob * и Vol BAT
Общий анализ FF надключичной жировой ткани (FF Glob ), времени релаксации T2 * (T2Glob *) и расчетного объема BAT (Vol BAT ) был выполнен путем сопоставления определенных областей интереса с координатами изображения после охлаждения.С этой целью рассчитанное поле деформации из регистрации использовалось для преобразования термонейтральных областей интереса в координаты сканирования после охлаждения. Поле деформации ROI было преобразовано в тип изображения с плавающей запятой. Это позволило провести анализ необработанных (не интерполированных) данных. Распределение термонейтрального и постохлаждения Vol BAT по диапазону FF оценивалось с использованием гистограмм объема с ячейками FF 0,5%. Затем это оценивали статистически, определяя, в каких диапазонах FF (интервалы 10%) расчетный объем BAT значительно изменился после воздействия холода.Чтобы исследовать влияние различных верхних и нижних пороговых значений FF для анализа BAT, изменения, вызванные холодом, в Vol , BAT , FF Glob и T2Glob * были количественно определены при всех вариантах пороговых значений FF. Чтобы проиллюстрировать эти эффекты, мы проверили для конкретных диапазонов FF: 30–100, 50–100 и 70–100%, изменились ли Vol BAT , FF Glob и T2Glob * значительно после воздействия холода. Воксели ниже выбранных нижних пороговых значений FF (т.е. 30, 50 или 70%) были исключены как в термонейтральной, так и в области интереса после охлаждения.Построив ROI с использованием различных нижних порогов сегментации FF, мы заметили, что вокселы в интервале FF 10-30% в основном располагались на границах надключичного жирового депо, которые прилегают к мышцам (дополнительный рисунок S2). Поэтому, чтобы избежать включения нежировой ткани и минимизировать эффекты частичного объема, для последующих анализов был принят более низкий порог FF, равный 30%. Области интереса, содержащие SAT дельтовидной мышцы, были вручную очерчены как при термонейтральном сканировании, так и при сканировании после охлаждения, чтобы исключить систематическую ошибку анализа, возникающую из-за сложности регистрации областей интереса, расположенных на границе раздела ткани и воздуха (дополнительный рисунок S1).Средний FF депо SAT дельтовидной мышцы (FF SAT ) определяли с использованием интервала FF 70–100% до и после охлаждения, чтобы избежать вокселей, содержащих мышцы и воздух, и минимизировать эффекты частичного объема.
II. Глобальный анализ: оценка массы и энергоемкости НДТ
Для оценки массы BAT и содержания энергии, FF использовался для расчета массы воды и жира, а затем общая энергия ткани была оценена аналогично (38-40). Предполагалось, что 1 мкл липида соответствует 0.92 мг по массе, что соответствует 9,4 × 10 -3 ккал. Измерения безжировой массы были получены на основе сигнала MR воды и представляют собой комбинацию связанных с водой структур, таких как белки, глюкоза и внутривнеклеточные жидкости. Мышечная масса 1 мкл соответствовала 1,06 мг и 1,0 · 10 9 · 1047 −3 9 · 1048 ккал соответственно. Изменение энергии и изменения безжировой / жировой массы рассчитывались на основе FF. Следовательно, воксель объемом 1 мкл с FF 50% эквивалентен 0,5 мкл тощей массы и 0,5 мкл жира, которые после корректировки плотности представляют 0.455 мг жира и 0,540 мг мышечной массы.
III. Воксельный анализ: FF Loc и T2Loc *
Для воксельного анализа надключичного жирового депо, поле деформации из регистрации использовалось для преобразования термонейтральных областей интереса, карт FF и T2 * в координаты изображения после охлаждения для сравнения FF и T2 * на уровне вокселей. (FF Loc и T2Loc *). Чтобы компенсировать потенциальное смещение из-за интерполяции движущегося изображения и мелкомасштабных несоответствий между совместно зарегистрированными изображениями, каждому вокселю как термонейтрального, так и постохлаждаемого стеков изображений было присвоено среднее значение из его окрестности вокселей 3 × 3.
Было созданокарт FF для визуализации изменений состава FF в надключичном жировом депо на воксельном уровне. Индуцированные холодом изменения FF на уровне вокселей (FF Loc ) были дополнительно изучены с использованием двумерных гистограмм суставов. На этих графиках для каждого вокселя его начальный FF был нанесен на график в зависимости от его изменения в FF после воздействия холода, и количество вокселей, принадлежащих каждой комбинации, было добавлено для представления подсчетов (цветовая шкала). Аналогичные графики плотности вокселей были использованы для оценки (i) связи между термонейтральным T2Loc * и FF Loc , (ii) связи между ΔT2Loc * после воздействия холода и измерениями термонейтрального FF и (iii) связи между ΔT2Loc * и ΔFF Loc после воздействия холода.Распределение термонейтральных FF Loc , ΔFF Loc и ΔT2Loc * после воздействия холода оценивали с использованием кластеризации K-средних. Метод локтя (51) использовался для получения оптимального количества кластеров путем оценки процента объясненной дисперсии как функции количества кластеров. Процент объясненной дисперсии был определен как отношение дисперсии между группами к общей дисперсии. В общем, когда объясненная дисперсия отображается в зависимости от номера кластера, первые несколько кластеров будут добавлять информацию (объяснять дисперсию), поэтому их можно наблюдать как скачки от одного значения k к другому.Однако при определенном значении k добавляется мало информации, что приводит к возникновению точки перегиба. Для анализа распределений вокселей оптимальное значение k было определено визуальным осмотром и применением значения отсечения для 95% объясненной дисперсии.
Статистический анализ
Данные были проверены на нормальное распределение согласно критерию Шапиро-Уилка. Для глобального анализа сравнения между термонейтральными данными и данными после охлаждения проводились с помощью парных тестов Стьюдента t , при этом результаты считались статистически значимыми, когда p <0.05. Коррекция множественных сравнений не производилась. Для локального анализа мы использовали воксельное сравнение и выполнили кластеризацию k-средних для анализа. Поскольку в этом подходе используется алгоритм обучения без учителя, который просто визуализирует лежащие в основе кластеры в распределении вокселей без предоставления каких-либо подробностей, касающихся значимости различных кластеров, поправки на множественные сравнения не требуются (51). Линейная регрессия использовалась для оценки связи между массой надключичной жировой ткани и объемом с использованием 0.05 и дан R-квадрат. Анализ данных, включая статистический, был выполнен в MATLAB (версия R2018b). Данные представлены как среднее ± стандартная ошибка среднего.
Результаты
Объемные изменения расчетного объема НДТ после воздействия холода
Анализ гистограммы изменений объема BAT показал общий сдвиг расчетного объема BAT после охлаждения от более высоких FF к более низким FF (рис. 2A). При разбиении на интервалы 10% FF это привело к значительному увеличению расчетного объема BAT выше FF 30%, в то время как расчетный объем BAT был значительно уменьшен выше FF 80% (Рисунок 2B).Интересно, что Vol BAT существенно не изменился в диапазоне 70–80% FF, который находится на пересечении гистограмм термонейтрального режима и гистограммы после охлаждения (вставка на рис. 2A). Влияние различных вариантов пороговых значений FF на вызванные холодом изменения Vol BAT показано на рисунке 3A. Для нижнего порога FF 30% и верхнего порога FF 100% не произошло явных изменений в Vol BAT . Однако с увеличением нижних пороговых значений FF Vol BAT уменьшался при воздействии холода.Впоследствии это было проверено на статистическую значимость для диапазонов FF с относительно низким (30–100%), промежуточным (50–100%) и высоким (70–100%) нижним порогом. Для самого широкого диапазона FF (30–100%) не было обнаружено значительных изменений в Vol BAT после воздействия холода (Рисунок 3B). Для промежуточного диапазона FF (50–100%) объем BAT снизился с 26,9 ± 2,4 до 25,2 ± 2,2 мл (-1,8%; p = 0,031, рисунок 3C) после воздействия холода. Для диапазона 70–100% FF Vol BAT уменьшился с 14.7 ± 1,8 до 11,0 ± 1,5 мл (-3,8%; p = 0,0022, рис. 3D) после воздействия холода.
Рисунок 2 . Предполагаемый объемный анализ НДТ. Гистограммы термонейтрального объема и объема после охлаждения в зависимости от фракции жира с размером бункера 0,5%: термонейтральные объемы показаны красным цветом, а объемы после охлаждения — синим. (A) . Изменения объема под действием холода, построенные как функция фракций жира (интервал FF 10%) (B) . Данные представлены как среднее значение ± стандартная ошибка среднего для n = 9.В (B) парный образец t -тест был использован для анализа изменений объема после воздействия холода. * p <0,05, ** p <0,01 и *** p <0,001.
Рисунок 3 . Влияние пороговых значений FF на предполагаемую разницу в объеме BAT. Тепловая карта влияния различных пороговых значений сегментации FF на предполагаемую разницу в объеме BAT после охлаждения. Цвет (вторая ось Y) отображает расчетную разницу объемов BAT для каждого нижнего (ось x) и верхнего левого (ось y) порогового значения.Наибольшее снижение оценочного объема НДТ наблюдается при нижнем пороге 72% и отсутствии верхнего порога. Треугольник в правом нижнем углу указывает на недопустимые параметры порога FF, поскольку мы реализовали минимальный порог FF, равный 30%. (A) Изменения объема, вызванные холодом, проанализированы с использованием парной выборки t -тест (* p <0,05, ** p <0,01) в различных диапазонах пороговых значений: 30–100% (B) , 50–100% (C) и 70–100% (D) .Данные представлены как среднее значение ± стандартная ошибка среднего для всех участников ( n = 9).
FF
SAT и влияние пороговых значений FF на глобальные FF и T2 *Затем мы изучили, как нижний и верхний пороги FF влияют на вызванное холодом изменение в FF Glob (ΔFF Glob ; пост-охлаждение минус предварительное охлаждение) и FF SAT (ΔFF SAT ; пост-охлаждение минус предварительное охлаждение), а также T2Glob * (ΔT2Glob *; пост-охлаждение минус предварительное охлаждение). Наибольшее снижение FF Glob произошло при нижнем пороговом значении FF, равном 34%, и верхнем пороговом значении FF, равном 100% (дополнительный рисунок S3).Это уменьшение FF становилось меньше при смещении нижнего порога FF в сторону более высоких значений. Это было дополнительно проверено на статистическую значимость для следующих диапазонов FF: 30–100, 50–100 и 70–100%. При применении диапазона 30–100% FF, FF Glob снизился с 62,0 ± 1,6 до 58,5 ± 1,3% (-3,5%; p = 5,0e-4, рисунок 4A). При промежуточном пороге 50–100% FF Glob снизился с 71,6 ± 1,2 до 68,4 ± 1,0% (-3,2%; 5,6e-4, рис. 4B). Когда был принят нижний порог 70%, FF Glob уменьшился с 81.От 0 ± 0,7 до 79,3 ± 0,4% (-1,6%; p = 0,006, рисунок 4C). Напротив, никаких значительных изменений не было отмечено в FF SAT после воздействия холода (дополнительный рисунок S1B). Для T2Glob * не было замечено явных изменений в зависимости от различных вариантов пороговых значений (дополнительный рисунок S3, рисунки 4D – F).
Рисунок 4 . Влияние различных пороговых значений FF на глобальные FF и T2 * надключичной жировой ткани. Изменения FF и T2 *, вызванные холодом, проанализированы с помощью парного t -теста в разных диапазонах пороговых значений: 30–100% (A, D) , 50–100% (B, E) и 70–100 % (C, F) .Данные представлены в виде среднего значения ± стандартная ошибка среднего для n = 9. Тест на парной выборке t был использован для анализа изменений объема после воздействия холода (** p <0,01 и *** p <0,001 ).
Оценка липидов BAT и сухой массы после холода
Определив эффект воздействия холода на Vol BAT , FF Glob и T2Glob *, мы решили охарактеризовать тонкие изменения, происходящие в составе ткани.Надключичная жировая ткань состоит из двух отделов, которые можно различить при МРТ: жировой массы и безжировой массы. В то время как жировая масса состоит из накопленных липидных капель, тощая масса соответствует структурам, богатым водой, широкой категории, которая включает кровь, цитоплазму и гидрофильные структуры, такие как хранилища гликогена и белки. Здесь мы использовали FF каждого вокселя, чтобы разделить лежащие в основе тощие и жировые массы (рисунок 5A, подробности см. В разделе «Методы»). Интересно, что мы наблюдали двухфазный эффект воздействия холода на массу надключичной жировой ткани (рис. 5В).Наблюдалось очевидное уменьшение количества вокселей с высоким FF, что наиболее ярко проявлялось как уменьшение липидной массы в правой части графика (т.е. 70–100% FF). В этом диапазоне также снизилась мышечная масса, хотя и в меньшей степени. Когда принималась во внимание левая часть графика (то есть воксели, включенные в диапазон FF ниже 70%), тощая и жировая массы увеличивались в аналогичной степени. Как безжировая масса, так и жировая масса объясняют большую часть дисперсии общего объема надключичного жира с небольшим преобладанием липидной массы ( R 2 = 0.92) относительно тощей массы ( R 2 = 0,85) (Рисунок 5C). Расхождение между потерей и приростом количественно оценивалось по изменению общей массы ткани, где общая безжировая масса увеличилась с 15,7 ± 1,6 до 17,2 ± 1,7 г (+1,5 г; p = 0,001) и общей липидной массе в надключичной области. депо уменьшилось с 22,1 ± 1,9 до 21,0 ± 1,7 г (-1,2 г; p = 0,02) (рис. 5D).
Рисунок 5 . Различие между мышечной и липидной массой в надключичной жировой ткани.Безжировая и липидная масса оценивалась, как описано в разделе «Методы», и представлялась как функция их удельных жировых фракций (A) . Воздействие холода уменьшило как мышечную, так и жировую массу до верхних жировых фракций (более 70%) и немного увеличило их в нижних жировых фракциях (B). (C) Корреляция между общим расчетным объемом BAT и липидной или мышечной массой, проанализированной с использованием линейной регрессии (сообщается R 2 ). Изменение общего липида и безжировой массы после воздействия холода, проанализировано с парным образцом t -тест (D) .Данные в (A, B, D) представляют собой среднее значение ± стандартная ошибка среднего для n = 9 добровольцев. * p <0,05.
Запасы энергии в тканях уменьшаются после воздействия холода
Основная функция НДТ — преобразование химической энергии в тепловую. Оценка содержания метаболической энергии в безжировой и жировой массе была подтверждена в хорошо контролируемых экспериментах, измеряющих потребление и расход энергии всем телом (38), а концепция энергетической эквивалентности использовалась для количественной оценки притока энергии к BAT во время воздействия холода ( 40).Кроме того, поскольку BAT не содержит значительных количеств костных минералов или воздуха, а вода в тканях связана с белками, их общая масса может быть принята в качестве потенциального энергетического субстрата для генерации тепла. Поэтому мы решили количественно оценить вызванное холодом изменение в накопителях энергии. BAT состоит из смеси нежирных и липидных масс, но в эквивалентном запасе химической энергии в значительной степени преобладает липидный компонент (рис. 6A). При анализе с этой биоэнергетической точки зрения изменение мышечной массы, ранее наблюдавшееся нами (рис. 5B), стало незначительным, поскольку вызванные холодом изменения в энергетическом содержании, приписываемые безжировой массе, были значительно ниже по сравнению с энергетическими изменениями липидной массы (рис. 6B).Здесь значительное уменьшение жировой массы было отражено в уменьшении накопления энергии в надключичном депо, которое уменьшилось с 126 ± 11 до 121 ± 10 ккал (-5 ккал; p = 0,03, рис. 6C). Было заметно, что это изменение не было однородным на гистограмме объема, но вместо этого были потери в начальной области с высоким содержанием липидов и прирост в изначально более постных частях ткани. Чтобы лучше визуализировать этот эффект, был создан контурный график, представляющий различные возможности установления пороговых значений для анализа изменения энергии (рис. 6D).Когда были выбраны более высокие FF ткани, предполагалось большое снижение содержания энергии. С другой стороны, анализ, сосредоточенный, например, на интервале FF между 30 и 70%, привел бы к противоположному выводу, что ткань увеличила запасы химической энергии после воздействия холода.
Рисунок 6 . Содержание метаболизируемой энергии в надключичном жировом депо. Представление содержания энергии в надключичном депо при термонейтральности с конкретными значениями, относящимися к мышечной ткани или липидам (A) .Изменения в содержании энергии, связанные с нежирной или жировой массой, представленные в различных диапазонах фракций жира (B) . Общие запасы энергии (ккал) до и после воздействия холода проанализированы с использованием парного теста t -тест (C) . Тепловая карта влияния различных пороговых значений FF сегментации на расчетные различия в энергосодержании после охлаждения. Цвет (вторая ось y) отображает расчетную разницу содержания энергии для каждого нижнего (ось x) и верхнего левого (ось y) порогового значения.Наибольшее снижение расчетной энергии наблюдается при нижнем пороге 70% и отсутствии верхнего порога. Треугольник в правом нижнем углу указывает недопустимые параметры порога FF, поскольку мы реализовали минимальный порог FF 30% (D) . Данные представляют собой среднее значение ± стандартная ошибка среднего для всех участников ( n = 9). * p <0,05.
Локальная оценка распределения FF надключичной жировой ткани после воздействия холода
Воксельные термонейтральные карты и карты FF после охлаждения показали, что надключичная жировая ткань состоит из совмещения зон с низким и высоким содержанием липидов, как показано на рисунках 7A, B.После воздействия холода, которое, как обычно показано, снижает содержание липидов BAT, мы обнаружили высокую пространственную вариабельность ответов, поскольку в некоторых областях наблюдалось ожидаемое снижение липидов, в то время как в других областях ткани, напротив, увеличивалось их содержание липидов (рис. 7C). Липидные карты других восьми субъектов представлены на дополнительном рисунке S4. Локальные изменения FF оценивались с использованием двухмерной совместной гистограммы, где каждый воксель имел свой начальный FF, используемый в качестве эталона для определения изменения FF, которому он подвергся при воздействии холода, а количество вокселей, принадлежащих каждой комбинации, было добавлено для представления подсчетов. (цветовая шкала; рис. 7D).Предполагая, что вертикальная линия представляет собой нулевое изменение, мы наблюдали изменения FF по всему термонейтральному диапазону FF с явным увеличением плотности вокселей в более высоком диапазоне FF. Чтобы количественно оценить это, была применена кластеризация K-средних с оптимальным числом кластеров, равным четырем. Результаты показаны на дополнительном рисунке S5. Кластерный анализ действительно показал, что для диапазона высоких термонейтральных FF снижение FF наблюдалось, особенно в кластере C1 (средний термонейтральный FF: 76,0 ± 11,2%). Среднее уменьшение FF после воздействия холода, соответствующее этому кластеру, составило −3.5 ± 2,2%.
Рисунок 7 . Структурная неоднородность коричневой жировой ткани в надключичной области при холодовом воздействии. Пример реконструированной карты жировой фракции с объединенными z-срезами до и после охлаждения (A, B) и изменением, вызванным холодом (после минус до) (C) для n = 1. Двухмерный воксель сустава гистограмма, представляющая изменение в изменении содержания липидов в каждом вокселе относительно его термонейтрального FF из воксельного анализа, где цвета представляют количество вокселей, принадлежащих каждой комбинации (D) для всех участников ( n = 9 ).Холодные цвета указывают на уменьшение жировой фракции, а теплые цвета указывают на увеличение жировой фракции.
Связь между надключичной жировой тканью FF и T2 * на местном уровне
Используя воксельный анализ, мы затем изучили связь базового времени релаксации T2 * с тканевым FF (рис. 8A). Значения T2Loc * были около 10 мс для нижних FF и около 20–25 мс для самых высоких FF. Однако не было четкой связи между исходными значениями FF Loc и T2Loc *.Кроме того, когда индуцированные холодом изменения в T2Loc * были нанесены на график относительно исходного уровня FF Loc , четкой связи не наблюдалось (фигура 8B). Что касается изменений в T2 * Loc и FF Loc в ответ на воздействие холода, для большинства вокселей уменьшение FF Loc сопровождалось увеличением T2Loc * (Рисунок 8C). Распределение вокселов анализировали с использованием кластеризации k-средних. Кластер C1 включал наибольшее количество вокселов на точку данных (дополнительный рисунок S5). Для этого кластера средние изменения T2Loc * и FF Loc составили 1.4 ± 1,5 мс и −2,2 ± 4,0% соответственно.
Рисунок 8 . Гистограммы вокселей, представляющие связь между термонейтральными значениями и холодовыми изменениями T2 * и FF. Термонейтральные измерения Т2 * по отношению к термонейтральным жировым фракциям (A) . Связь между холодовыми изменениями Т2 * и термонейтральных жировых фракций (B) . Связь между вызванными холодом изменениями как в T2 *, так и в FF (C) . Данные представлены как среднее значение для всех участников ( n = 9).
Обсуждение
В этом исследовании мы показываем, что уменьшение объема, массы и энергии депо надключичной жировой ткани во время воздействия холода является неоднородным и происходит наиболее заметно в богатых липидами областях ткани, тогда как в SAT FF не наблюдалось значительных изменений. . Более тонкие участки депо надключичной жировой ткани (определяемые низким термонейтральным FF), однако, имели тенденцию к увеличению объема, массы и энергии после воздействия холода. Мы также показали, что расположение и ширина интервала FF могут изменять видимый размер и направление вызванных холодом изменений параметров, полученных с помощью МРТ, используемых для анализа BAT.Максимальное изменение FF для всего надключичного жирового депо было получено при использовании диапазона FF 34–100%. Наконец, локальные изменения FF происходили во всем термонейтральном диапазоне FF (30–100%) в обоих направлениях (т.е. увеличивались и уменьшались).
Верхний пороговый диапазон FF для анализа BAT FF
Классическое различие между однокамерным WAT и мультилокулярным BAT предполагает, что между обеими тканями должно существовать четкое разделение на основе FF. С этой точки зрения ранее предполагалось, что диапазон, в котором FF превышает 70%, превышает пороговое значение BAT (52).По этой причине мы обнаружили примечательным тот факт, что в наших результатах эти области надключичного жирового депо с высоким содержанием липидов действительно показали наибольшее снижение содержания липидов и энергии после воздействия холода, что согласуется с недавними результатами (25). Эти данные предполагают, что на самом деле не следует использовать 70% в качестве верхнего порога, а воксели, показывающие до 100% FF, должны использоваться в анализе [например, как выполнено в (22, 53)]. К сожалению, было невозможно сделать вывод, состоят ли эти области одногокулярные белые адипоциты, которые частично жертвовали свои липиды для сжигания, окружая более «постные» коричневые адипоциты.Альтернативно, эта область может охватывать одноклеточные экспрессирующие UCP1 клетки, способные к термогенезу. В обоих сценариях лобулярное распределение зон с высоким содержанием жира, интеркалированных областями с более низким содержанием липидов, предполагает, что BAT человека следует рассматривать как морфологически разнообразный орган, и следует проявлять осторожность, прежде чем исключать области из его анализа. Анализ T2 * не предоставил никакой дополнительной информации для установления нижнего и верхнего пороговых значений FF для сегментации BAT.
Нижний пороговый диапазон FF для анализа BAT FF и объема
Как глобальный, так и локальный анализ показали, что изменения произошли во всем диапазоне исходных значений FF (30–100%), при этом наиболее заметное снижение FF наблюдается при использовании диапазона значений FF 34–100%.Наибольшее снижение FF, которое мы наблюдали (т.е. 3,5%), находится в диапазоне значений, описанных в литературе (19, 21, 23), но также сообщалось о гораздо меньшем (22) и более значительном снижении (25). Это может быть связано с использованием разных пороговых значений, но также важную роль могут играть различия в протоколах охлаждения (54, 55). Повышение нижнего порога выше 34% уменьшает степень различий FF при воздействии холода, поскольку мы исключили воксели, которые упали ниже порогового значения как при термонейтральном сканировании, так и при сканировании после охлаждения, чтобы избежать артефактов частичного объема и обеспечить объемный анализ.Например, когда используется нижний порог FF 70%, вокселы ниже 70% FF исключаются как в термонейтральной, так и в области интереса после охлаждения. Следовательно, области в ROI после охлаждения, которые сместились с высоких термонейтральных FF (> 70%) на FF ниже 70% при воздействии холода, исключаются, но все еще присутствуют в термонейтральных ROI. Эти области с более низким FF, следовательно, не могут способствовать снижению FF Glob в ROI после охлаждения. Недавний отчет, в котором также исследовалось использование пороговых значений FF, показал противоположный эффект, поскольку больший эффект на FF был показан при использовании порога 50% по сравнению с порогом 40%.В их подходе пороги FF применялись только к термонейтральным областям интереса (25), что могло позволить измерять большие различия FF с увеличением нижних пороговых значений, поскольку вокселы в сканированиях после охлаждения не были исключены. Это указывает на то, что следует соблюдать осторожность, прежде чем исключать из анализа участки с низким содержанием липидов.
Общий оценочный объем BAT показал противоположную тенденцию по сравнению с FF, где увеличение нижнего порога FF увеличивало различия. Это ожидается, поскольку наиболее заметное сокращение объема происходит при превышении FF примерно на 70%.
О гетерогенности надключичной жировой ткани человека
В этой работе мы расширили представление о гетерогенности надключичной жировой ткани, визуализировав ее структуру, сложное распределение липидов, и описали вариации в содержании липидов (увеличивались и уменьшались в одном депо) после воздействия холода. Эти данные убедительно свидетельствуют о том, что BAT резко модулирует приток и сжигание липидов дивергентно, здесь примером служат надключичные области, которые получают липиды после термогенной активации под воздействием холода, что также было показано в недавнем исследовании (25).Этот пример идет вразрез с ожиданиями того, что BAT только уменьшит содержание липидов, идея настолько широко принята, что потеря липидов во время охлаждения использовалась как условие sine qua non для идентификации BAT (23). Руководящие факторы, лежащие в основе индуцированного холода увеличения липидов в некоторых областях BAT, неясны. Мы предполагаем, что увеличение липидов также возможно из-за липогенеза de novo , происходящего после поглощения глюкозы (56).
Количественное определение массы в надключичном жировом депо
В настоящей работе мы оценили абсолютные количества тощей и жировой массы в надключичном жировом депо.Это дало понимание того, что, по крайней мере, у наших худых молодых людей, жирная и мышечная масса (концептуализированная как представляющая запасы липидов и метаболически активные компоненты ткани, соответственно) имели высокую линейную корреляцию с общим объемом ткани. Таким образом, мы предполагаем, что предполагаемый размер НДТ в простейшем виде, вероятно, коррелирует с его общей потенциальной термогенной функцией. Вызванное холодом снижение общей липидной массы, наблюдаемое в нашем исследовании, было ожидаемым из-за термогенной активации BAT, которая приводит к усилению β-окисления (57, 58), и согласуется с другими исследованиями визуализации с использованием FF в качестве результата ( 19, 21, 25, 59).Это сопровождалось увеличением мышечной массы, что вряд ли было вызвано острым синтезом протеина, поскольку весь наш эксперимент проходил за несколько часов. Увеличение перфузии крови, которое, как ожидается, произойдет при использовании BAT во время воздействия холода (2, 22, 60–63), может способствовать усилению сигнала воды. Однако недавно было высказано предположение, что снижение FF сразу после воздействия холода слишком велико, чтобы его можно было достичь исключительно за счет увеличения объемной доли крови (25). Кроме того, было показано, что вызванное холодом снижение FF сохраняется даже после повторного нагревания объекта, что не совпадает с быстрой динамикой перфузии (19, 25).Эти данные подтверждают обоснование того, что наблюдаемое снижение липидной массы и увеличение мышечной массы в значительной степени вызваны истощением внутриклеточных липидов в коричневых адипоцитах. Это связано с очень общей классификацией безжировой массы как совокупности структур, сильно связанных с водой, что делает ее уязвимой к резким изменениям уровня гидратации (64).
В более широком контексте метаболических исследований, мышечная масса обычно считается основным фактором, определяющим базальную скорость метаболизма всего тела.Поскольку вклад конкретных органов в базальную скорость метаболизма всего тела можно оценить на основе их общей массы (65–67), мы прогнозируем, что оценка удельной безжировой массы органов (например, выполненная в нашем исследовании) может внести свой вклад. к созданию более совершенных аллометрических моделей для вывода о скорости метаболизма в конкретных органах и их влиянии на расход энергии всего тела.
Изменение энергии после термогенной активации
Анализ состава надключичной жировой ткани продемонстрировал преобладание жировой массы над энергетической динамикой при воздействии холода.Важно отметить, что хотя безжировая масса составляла почти половину ткани, даже значительные изменения ее массы вряд ли будут играть важную роль в хранении метаболической энергии. Мы можем только предполагать, отражает ли это уменьшение объема более крупных липидных капель из-за сгорания, повышенное образование липидных капель из-за захвата липидов из кровотока или комбинацию обоих явлений. Основываясь на принципе сохранения энергии, можно предположить, что, если поглощение питательных веществ тканью полностью соответствует скорости их сжигания, потеря и прирост энергии жира в различных FF органа будут равны нулю.Результаты, отличные от нуля, можно интерпретировать как нескомпенсированный или сверхкомпенсированный захват липидов (или глюкозы) из кровотока (по отношению к расходу BAT во время охлаждения). Что наиболее важно, хотя наша установка не позволяла нам оценить общий поток энергии ткани, она обеспечила важную концептуальную веху для количественной оценки затрат энергии, специфичных для НДТ. Поскольку расходы можно оценить на основе комбинированных измерений поглощения глюкозы и липидов и вариаций в составе ткани, мы прогнозируем, что метод, использованный в нашем исследовании [связан с оценками поглощения энергии, проведенными Virtanen et al.(40)] позволит окончательно сделать вывод об энергии, сжигаемой BAT во время активации, и более точно количественно оценить конкретный вклад депо BAT в метаболизм всего тела.
Общие концептуальные приложения метода
Применение представленной здесь биоэнергетической основы не ограничивается анализом НДТ во время охлаждения. Его также можно использовать для анализа содержания метаболизма в любой ткани, где запасы энергии имеют решающее значение для патофизиологических процессов.К ним относятся мышцы, в которых изменения в доступности энергии могут повлиять на долгосрочное поддержание массы, а также печень, где чрезмерные накопления энергии в виде липидных капель считаются причиной резистентности к инсулину и метаболических заболеваний.
Ограничения
Мы могли лишь частично сделать выводы о динамических изменениях в составе тканей из-за ограниченного количества временных точек, то есть до и после охлаждения. Динамическое сканирование, возможно, предоставит больше информации об изменениях липидного состава в надключичном жировом депо.В нашем исследовании мы использовали шесть эхо-сигналов для моноэкспоненциальной подгонки T2 *. Недавнее исследование показало, что точность подгонки повышается с увеличением числа эхо-сигналов (26), и поэтому в будущих исследованиях число эхо-сигналов будет увеличено для улучшения измерения T2 * в BAT. Мы не выполняли респираторный триггер при захвате, что могло привести к артефактам движения. Мы смягчили это, используя сглаживающее ядро 3 × 3 после регистрации. Кроме того, недавнее исследование, в котором использовалась аналогичная методика МРТ без триггера дыхания, продемонстрировало ошибку менее одного пикселя после регистрации изображения (25).Это исследование включало относительно однородную исследуемую популяцию (молодые, мужчины, здоровые, худощавые белые голландцы). Поэтому следует проявлять осторожность при экстраполяции наших результатов на более широкую популяцию. Вместо этого рекомендуется исходить из того, что наши результаты отражают результаты контрольной популяции и демонстрируют методологические возможности отслеживания изменений в тестах на ожирение, болезни или наркотики. Степень индуцированных холодом изменений ФФ, о которых сообщалось в литературе и в этом исследовании, довольно скромна.Также было показано, что существует лишь небольшая, хотя и статистическая разница в надключичной FF между людьми с активностью BAT и без нее на [ 18 F] FDG PET-CT (68). Однако активность BAT, оцениваемая по поглощению глюкозы при ПЭТ / КТ и по различиям FF при воздействии холода, не позволяет измерить один и тот же точный ответ. Это не является неожиданным, поскольку в [18F] FDG PET глюкоза используется в качестве индикатора, тогда как в МРТ жир-вода мы непосредственно оцениваем содержание жира. Будущие исследования, включающие несколько последовательностей МРТ, каждая из которых настроена на разные аспекты физиологии, надеюсь, дополнительно прояснят эту проблему.
Заключение
Надключичные жировые отложения у людей очень неоднородны в отношении базального содержания липидов, а богатые липидами области интеркалированы областями с низким содержанием липидов. После термогенной активации охлаждением области ткани с высоким FF имеют тенденцию терять больше липидов, в то время как увеличение массы заметно в более постных областях. Потеря метаболической энергии, вызванная холодом, более заметна в диапазоне высоких 70–100% FF. В целом воздействие холода снижает абсолютную липидную массу и содержание энергии в тканях, что связано с увеличением безжировой массы, но не приводит к значительному изменению объема ткани.Из-за вариабельности надключичного жирового депо в ответ на воздействие холода, выбор порогового значения МРТ сильно влияет на предполагаемую величину и направление изменений. В целом, мы обнаружили, что при увеличении нижнего порогового уровня FF глобальные различия FF стали менее выраженными, тогда как оценочные различия объемов BAT стали больше по величине. Это подчеркивает, что выбор пороговых уровней FF может по-разному влиять на параметры.
Заявление о доступности данныхДанные доступны у соответствующего автора по разумному запросу.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены METC Leiden-Den Haag-Delft, Нидерланды. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
KN и LJ разработали исследование, собрали и проанализировали данные, а также отредактировали рукопись на предмет интеллектуального содержания. GA-V концептуализировал, проанализировал и интерпретировал данные и подготовил рукопись.AS повторно проанализировал данные и подготовил рукопись. JB проанализировал и интерпретировал данные, разработал протокол получения МРТ и алгоритмы постобработки, а также подготовил и отредактировал рукопись для интеллектуального содержания. OD внесла свой вклад в методы (анализ данных) и отредактировала рукопись на предмет интеллектуального содержания. JE внес свой вклад в алгоритмы постобработки. TR проанализировал и интерпретировал данные. AW отредактировал рукопись на интеллектуальное содержание. HK, PR и MB концептуализировали и разработали исследование, интерпретировали данные, внесли свой вклад в обсуждение, просмотрели и отредактировали рукопись.
Финансирование
Эта работа была поддержана премией профессора Дж. Терпстра для KN, стипендией голландского фонда исследований диабета для MB (грант 2015.81.1808). JB и HK получили частичную поддержку в рамках Седьмой рамочной программы Европейского Союза по исследованиям, технологическому развитию и демонстрации в соответствии с соглашением о гранте № 602485. Частичное финансирование было предоставлено AW от Европейского исследовательского совета (NOMA-MRI 670629). OD поддерживался голландским технологическим фондом STW (в рамках проекта STW 502 12721: Гены в космосе в рамках перспективной программы IMAGENE).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Части данных в этой рукописи были представлены на МРТ ожирения и метаболических нарушений в 2019 г. и на Конгрессе Европейского общества магнитного резонанса в медицине и биологии (ESMRMB) в 2019 г.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fendo.2019.00898/full#supplementary-material
Сокращения
BAT, Коричневая жировая ткань; FF, жирная фракция; FF Glob , Жировая фракция надключичной жировой ткани, оцененная с помощью глобального анализа; FF Loc , Жировая фракция на уровне вокселей; FF SAT , Жировая фракция депо подкожной жировой ткани; МРТ, магнитно-резонансная томография; ROI, интересующие регионы; T2 *, моноэкспоненциальное эффективное время поперечной релаксации; T2Glob *, Моноэкспоненциальное эффективное время поперечной релаксации, оцененное с помощью глобального анализа; T2Loc *, Моноэкспоненциальное эффективное время поперечной релаксации, оцененное на уровне вокселей; Vol BAT , Расчетный объем BAT; WAT, Белая жировая ткань; SAT, Подкожная жировая ткань.
Список литературы
2. Блонден Д.П., Фриш Ф., Феникс С., Герен Б., Тюркотт Э. Э., Хаман Ф. и др. Ингибирование внутриклеточного липолиза триглицеридов подавляет индуцированный холодом метаболизм коричневой жировой ткани и увеличивает дрожь у людей. Ячейка Метаб . (2017) 25: 438–47. DOI: 10.1016 / j.cmet.2016.12.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Бартельт А., Брунс О.Т., Реймер Р., Хоэнберг Х., Иттрих Х., Пельдшус К. и др. Активность коричневой жировой ткани контролирует клиренс триглицеридов. Нат Мед . (2011) 17: 200–6. DOI: 10,1038 / нм.2297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Olsen JM, Csikasz RI, Dehvari N, Lu L, Sandström A, Öberg AI, et al. β3-адренергически индуцированное поглощение глюкозы в коричневой жировой ткани не зависит от присутствия или активности UCP1: опосредование через путь mTOR. Мол Метаб . (2017) 6: 611–9. DOI: 10.1016 / j.molmet.2017.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Оскулати Ф., Леклерк Ф., Сбарбати А., Занканаро С., Чинти С., Антонакис К. Морфологическая идентификация коричневой жировой ткани у крыс с помощью магнитно-резонансной томографии. Eur J Radiol . (1989) 9: 112–4.
PubMed Аннотация | Google Scholar
6. Оскулати Ф., Сбарбати А., Леклерк Ф., Занканаро С., Аккордини С., Антонакис К. и др. Корреляция между магнитно-резонансной томографией и ультраструктурными картинами коричневой жировой ткани. J Submicrosc Cytol Pathol .(1991) 23: 167–74.
PubMed Аннотация | Google Scholar
7. Сбарбати А., Балдассарри А.М., Занканаро С., Бойчелли А., Оскулати Ф. Морфометрия in vivo и функциональная морфология коричневой жировой ткани с помощью магнитно-резонансной томографии. Анат Рек. . (1991) 231: 293–7. DOI: 10.1002 / ar.10302
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Ху ХХ, Ли Й, Надь Т.Р., Горан М.И., Наяк К.С. Количественная оценка абсолютной жировой массы с помощью магнитно-резонансной томографии: исследование, подтверждающее химический анализ. Int J Body Compos Res . (2011) 9: 111–22.
PubMed Аннотация | Google Scholar
10. Бранка Р.Т., Чжан Л., Уоррен В.С., Ауэрбах Э., Ханна А., Деган С. и др. In vivo неинвазивное обнаружение коричневой жировой ткани с помощью межмолекулярной нулевой квантовой МРТ. PLoS ONE . (2013) 8: e0074206. DOI: 10.1371 / journal.pone.0074206
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Peng XG, Ju S, Fang F, Wang Y, Fang K, Cui X и др.Сравнение жировых фракций коричневой и белой жировой ткани у мышей с нокаутом гена ob, seipin и Fsp27 с помощью визуализации с избирательным химическим сдвигом и 1H-MR-спектроскопии. Am J Physiol Endocrinol Metab . (2013) 304: E160–7. DOI: 10.1152 / ajpendo.00401.2012
CrossRef Полный текст | Google Scholar
12. Лунати Е., Марзола П., Николато Е., Федриго М., Вилла М., Сбарбати А. In vivo количественная липидная карта коричневой жировой ткани с помощью визуализации химического сдвига при 4,7 тесла. J Lipid Res . (1999) 40: 1395–400.
PubMed Аннотация | Google Scholar
13. Smith DL, Yang Y, Hu HH, Zhai G, Nagy TR. Измерение межлопаточной коричневой жировой ткани мышей при разных температурах с помощью МРТ воды и жира с кодированием химического сдвига. J Магнитно-резонансная томография . (2013) 38: 1425–33. DOI: 10.1002 / jmri.24138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Лиделл М.Э., Бец М.Дж., Дальквист Лейнхард О., Хеглинд М., Эландер Л., Славик М. и др.Доказательства двух типов коричневой жировой ткани у людей. Нат Мед . (2013) 19: 631–4. DOI: 10,1038 / нм.3017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Chen KY, Cypess AM, Laughlin MR, Haft CR, Hu HH, Bredella MA, et al. Критерии регистрации коричневого жира в исследованиях визуализации (BARCIST 1.0): рекомендации для стандартизированных экспериментов FDG-PET / CT на людях. Ячейка Метаб . (2016) 24: 210–22. DOI: 10.1016 / j.cmet.2016.07.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Гиффорд А., Тоуз Т.Ф., Уокер Р.К., Эйвисон М.Дж., Уэлч Е.Б. Характеристика активной и неактивной коричневой жировой ткани у взрослых людей с помощью ПЭТ-КТ и МРТ. Am J Physiol Endocrinol Metab . (2016) 311: E95–104. DOI: 10.1152 / ajpendo.00482.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. van Rooijen BD, van der Lans AA, Brans B, Wildberger JE, Mottaghy FM, Schrauwen P, et al. Визуализация активированной холодом коричневой жировой ткани с использованием динамической Т2 * -взвешенной магнитно-резонансной томографии и позитронно-эмиссионной томографии 2-дезокси-2- [ 18 F] фтор-d-глюкозы. Инвест Радиол . (2013) 48: 708–14. DOI: 10.1097 / RLI.0b013e31829363b8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Franssens BT, Hoogduin H, Leiner T., van der Graaf Y, Visseren FLJ. Связь между коричневой жировой тканью и показателями ожирения и метаболической дисфункции у пациентов с сердечно-сосудистыми заболеваниями. J Магнитно-резонансная томография . (2017) 46: 497–504. DOI: 10.1002 / jmri.25594
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Lundström E, Strand R, Johansson L, Bergsten P, Ahlström H, Kullberg J. Протокол охлаждения-повторного нагрева с помощью магнитно-резонансной томографии указывает на снижение фракции жира за счет потребления липидов в предполагаемой коричневой жировой ткани. PLoS ONE . (2015) 10: e0126705. DOI: 10.1371 / journal.pone.0126705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Франц Д., Карампинос Д.К., Раммени Э.Дж., Сувацоглу М., Бир А.Дж., Неколла С.Г. и др. Различение коричневой и белой жировой ткани с использованием 2-точечного метода разделения воды и жира по Диксону при одновременном проведении ПЭТ / МРТ. Дж. Nucl Med . (2015) 56: 1742–7. DOI: 10.2967 / jnumed.115.160770
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Дэн Дж., Нефф Л. М., Руберт NC, Чжан Б., Шор Р. М., Самет Дж. Д. и др. МРТ-характеристика коричневой жировой ткани при тепловых нагрузках у молодых мужчин с нормальным весом, избыточным весом и ожирением. J Магнитно-резонансная томография . (2018) 47: 936–47. DOI: 10.1002 / jmri.25836
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.Холстила М., Песола М., Саари Т., Коскенсало К., Райко Дж., Борра Р.Дж. и др. МР-сигнал-анализ жировой фракции и визуализация, взвешенная по T2 *, надежно измеряют BAT на людях без воздействия холода. Метаболизм . (2017) 70: 23–30. DOI: 10.1016 / j.metabol.2017.02.001
CrossRef Полный текст | Google Scholar
23. Шталь В., Майер Ф., Фрайтаг М.Т., Флока Р.О., Бергер М.К., Уматум Р. и др. Оценка воздействия холода на жировую фракцию бурой жировой ткани in vivo с помощью DIXON MRI. J Магнитно-резонансная томография . (2017) 45: 369–80. DOI: 10.1002 / jmri.25364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Gashi G, Madoerin P, Maushart CI, Michel R, Senn JR, Bieri O, et al. Характеристики МРТ надключичной коричневой жировой ткани в связи с индуцированным холодом термогенезом у здоровых взрослых людей. J Магнитно-резонансная томография . (2019) 50: 1160–8. DOI: 10.1002 / jmri.26733
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Coolbaugh CL, Damon BM, Bush EC, Welch EB, Towse TF. Воздействие холода вызывает динамические, неоднородные изменения содержания липидов в коричневой жировой ткани человека. Научная репутация . (2019) 9: 13600. DOI: 10.1038 / s41598-019-49936-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Франц Д., Дифенбах М.Н., Трейбель Ф., Вайдлих Д., Сювяри Дж., Рушке С. и др. Дифференциация надключичной жировой ткани от ягодичной жировой ткани на основе одновременного картирования PDFF и T2 * с использованием 20-эхо-градиентно-эхо-регистрации. J Магнитно-резонансная томография . (2019) 50: 424–34. DOI: 10.1002 / jmri.26661
CrossRef Полный текст | Google Scholar
27. Hui SCN, Ko JKL, Zhang T, Shi L, Yeung DKW, Wang D, et al. Количественная оценка коричневой и белой жировой ткани на основе модели смеси Гаусса с использованием воды и жира и T2 * МРТ у подростков. J Магнитно-резонансная томография . (2017) 46: 758–68. DOI: 10.1002 / jmri.25632
CrossRef Полный текст | Google Scholar
29. Чен Ю.С., Сайпесс А.М., Чен Ю.С., Палмер М., Колодный Г., Кан Ч.Р. и др.Измерение объема и активности коричневой жировой ткани человека с использованием анатомической МРТ и функциональной МРТ. Дж. Nucl Med . (2013) 54: 1584–7. DOI: 10.2967 / jnumed.112.117275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Чинти С., Канселло Р., Зингаретти М.С., Церези Е., Де Маттеис Р., Джордано А. и др. CL316,243 и холодовой стресс вызывают гетерогенную экспрессию мРНК и белка UCP1 в коричневых адипоцитах грызунов. Дж Histochem Cytochem .(2002) 50: 21–31. DOI: 10.1177 / 002215540205000103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. de Jong JM, Larsson O, Cannon B, Nedergaard J. Строгая проверка маркеров идентичности жировой ткани мышей. Am J Physiol Endocrinol Metab . (2015) 308: E1085–105. DOI: 10.1152 / ajpendo.00023.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Джеффри Э., Крыло А, Холтруп Б, Себо З., Каплан Дж. Л., Сааведра-Пенья Р. и др.Микроокружение жировой ткани регулирует депо-специфический адипогенез при ожирении. Ячейка Метаб . (2016) 24: 142–50. DOI: 10.1016 / j.cmet.2016.05.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Грандл Г., Мюллер С., Моэст Х., Мозер С., Волльшайд Б., Вольфрум С. Специфические различия депо в адипогенном потенциале предшественников опосредуются коллагеновым внеклеточным матриксом и зависимой от флотилина 2 передачей сигналов. Мол Метаб . (2016) 5: 937–47.DOI: 10.1016 / j.molmet.2016.07.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Бранка Р. Т., Хе Т, Чжан Л., Флойд С. С., Фриман М., Уайт С. и др. Обнаружение коричневой жировой ткани и термогенной активности у мышей с помощью МРТ с гиперполяризованным ксеноном. Proc Natl Acad Sci USA . (2014) 111: 18001–6. DOI: 10.1073 / pnas.1403697111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Бхану Пракаш К.Н., Верма С.К., Ялигар Дж., Гогги Дж., Гопалан В., Ли С.С. и др.Сегментация и характеристика межлопаточной коричневой жировой ткани у крыс с помощью многопараметрической магнитно-резонансной томографии. Magn Reson Mater Phys Biol Med . (2016) 29: 277–86. DOI: 10.1007 / s10334-015-0514-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Ху ХХ, Смит Д.Л., Наяк К.С., Горан М.И., Надь Т.Р. Идентификация коричневой жировой ткани у мышей с помощью ИДЕАЛ-МРТ жир-вода. J Магнитно-резонансная томография . (2010) 31: 1195–202. DOI: 10.1002 / jmri.22162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Ху ХХ, Ву Т.В., Инь Л., Ким М.С., Чиа Дж.М., Перкинс Т.Г. и др. Выявление МРТ коричневой жировой ткани с пониженным содержанием жира у новорожденных с переохлаждением. Магнитно-резонансная томография . (2014) 32: 107–17. DOI: 10.1016 / j.mri.2013.10.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Хеймсфилд С.Б., Петерсон С.М., Томас Д.М., Хирези М., Чжан Б., Смит С. и др. Установление потребности в энергии для поддержания массы тела: валидация метода баланса потребления NCT01672632 NCT. Примечания BMC Res . (2017) 10: 220. DOI: 10.1186 / s13104-017-2546-4
CrossRef Полный текст | Google Scholar
40. У Дин М., Райко Дж., Саари Т., Кудоми Н., Толванен Т., Ойконен В. и др. Коричневая жировая ткань человека [ 15 O] O 2 ПЭТ-изображение в присутствии и в отсутствие холодового раздражителя. Eur J Nucl Med Mol Imaging . (2016) 43: 1878–86. DOI: 10.1007 / s00259-016-3364-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Генеральная ассамблея всемирной медицины. Хельсинкская декларация Всемирной медицинской ассоциации: этические принципы медицинских исследований с участием людей. Джам Колл Дент . (2014) 81: 14–8. DOI: 10.1001 / jama.2013.281053
CrossRef Полный текст | Google Scholar
42. Баккер Л. Е., Бун М. Р., ван дер Линден Р. А., Ариас-Бауда Л. П., ван Клинкен Дж. Б., Смит Ф. и др. Объем коричневой жировой ткани у здоровых худощавых взрослых людей из Южной Азии по сравнению с белыми европейцами: проспективное наблюдательное исследование под контролем случая. Ланцет, диабет, эндокринол . (2014) 2: 210–7. DOI: 10.1016 / S2213-8587 (13) 70156-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Yu H, Reeder SB, Shimakawa A, Brittain JH, Pelc NJ. Оценка карты поля со схемой роста области для итеративного 3-точечного разложения вода-жир. Магн Резон Мед . (2005) 54: 1032–9. DOI: 10.1002 / mrm.20654
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Ридер С.Б., Вен З., Ю Х., Пинеда А.Р., Голд Дж. Э., Маркл М. и др.Разделение химических частиц Multicoil dixon с помощью итеративного метода оценки наименьших квадратов. Магн Резон Мед . (2004) 51: 35–45. DOI: 10.1002 / mrm.10675
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Yu H, McKenzie CA, Shimakawa A, Vu AT, Brau AC, Beatty PJ, et al. Реконструкция мультиэхо для одновременного разложения воды и жира и оценки T2 *. J Магнитно-резонансная томография . (2007) 26: 1153–61. DOI: 10.1002 / jmri.21090
CrossRef Полный текст | Google Scholar
46.Ридер С.Б., Пинеда А.Р., Вен З, Шимакава А., Ю Х, Бриттен Дж. Х. и др. Итерационное разложение воды и жира с оценкой асимметрии эхо-сигналов и методом наименьших квадратов (IDEAL): приложение с быстрой спин-эхо-визуализацией. Магн Резон Мед . (2005) 54: 636–44. DOI: 10.1002 / mrm.20624
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Klein S, Staring M, Murphy K, Viergever MA, Pluim JP. Elastix: набор инструментов для регистрации медицинских изображений на основе интенсивности. IEEE Trans Med Imaging .(2010) 29: 196–205. DOI: 10.1109 / TMI.2009.2035616
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Шамонин Д.П., Брон Е.Е., Леливельдт Б.П., Смитс М., Кляйн С., Старинг М. и др. Быстрая параллельная регистрация изображений на CPU и GPU для диагностической классификации болезни Альцгеймера. Фронт Нейроинформ . (2014) 7:50. DOI: 10.3389 / fninf.2013.00050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Sacks H, Symonds ME. Анатомическое расположение коричневой жировой ткани человека: функциональная значимость и значение при ожирении и диабете 2 типа. Диабет . (2013) 62: 1783–90. DOI: 10.2337 / db12-1430
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Мартинес-Теллез Б., Нахон К.Дж., Санчес-Дельгадо Дж., Абреу-Виейра Дж., Лламас-Эльвира Дж. М., ван Фельден ФХП и др. Влияние использования критериев BARCIST 1.0 на количественную оценку объема и активности BAT в трех независимых группах взрослых. Научная репутация . (2018) 8: 8567. DOI: 10.1038 / s41598-018-26878-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Ху Х. Х., Перкинс Т. Г., Чиа Дж. М., Гильсанц В. Характеристика коричневой жировой ткани человека с помощью МРТ водного жира с химическим сдвигом. Ам Дж. Рентгенол . (2013) 200: 177–83. DOI: 10.2214 / AJR.12.8996
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Маккалистер А., Чжан Л., Бурант А., Кац Л., Бранка РТ. Пилотное исследование корреляции между значениями жировой фракции и значениями поглощения глюкозы надключичным жиром с помощью одновременной ПЭТ / МРТ. Магн Резон Мед .(2017) 78: 1922–32. DOI: 10.1002 / mrm.26589
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Сан Л., Верма С., Майкл Н., Чан С.П., Ян Дж., Саданантан С.А. и др. Коричневая жировая ткань: мультимодальная оценка с помощью ПЭТ, МРТ, инфракрасной термографии и калориметрии всего тела (TACTICAL-II). Ожирение . (2019) 27: 1434–42. DOI: 10.1002 / oby.22560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Онг Ф.Дж., Ахмед Б.А., Орескович С.М., Блондин Д.П., Хак Т., Коньер Н.Б. и др.Последние достижения в обнаружении коричневой жировой ткани у взрослых людей: обзор. Clin Sci . (2018) 132: 1039–54. DOI: 10.1042 / CS20170276
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Иршад З., Дмитрий Ф., Кристиан М., Заммит В.А. Диацилглицерин ацилтрансфераза 2 связывает утилизацию глюкозы с окислением жирных кислот в коричневых адипоцитах. J Lipid Res . (2017) 58: 15–30. DOI: 10.1194 / младший M068197
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57.Ю. ХХ, Левин Д.А., Форрест В., Адамс Ш. Холод вызывает одновременную индукцию синтеза жирных кислот и β-окисления в коричневой жировой ткани мыши: прогноз на основе дифференциальной экспрессии генов и подтверждение in vivo . FASEB J . (2002) 16: 155–68. DOI: 10.1096 / fj.01-0568com
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Блонден Д.П., Лаббе С.М., Тингельстад Х.С., Нолл К., Кунах М., Феникс С. и др. Повышенная окислительная способность коричневой жировой ткани у акклиматизированных к холоду людей. Дж. Клин Эндокринол Метаб . (2014) 99: E438–46. DOI: 10.1210 / jc.2013-3901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Коскенсало К., Райко Дж., Саари Т., Саунаваара В., Эскола О., Нуутила П. и др. Температура коричневой жировой ткани человека и жировая фракция связаны с его метаболической активностью. Дж. Клин Эндокринол Метаб . (2017) 102: 1200–7. DOI: 10.1210 / jc.2016-3086
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60.Abreu-Vieira G, Hagberg CE, Spalding KL, Cannon B, Nedergaard J. Адренергически стимулированный кровоток в коричневой жировой ткани не зависит от термогенеза. Am J Physiol Endocrinol Metab . (2015) 308: E822–9. DOI: 10.1152 / ajpendo.00494.2014
CrossRef Полный текст | Google Scholar
61. Музик О., Мангнер Т.Дж., Леонард В.Р., Кумар А., Граннеман Дж.Г. Симпатическая иннервация холодного коричневого и белого жира у худых молодых людей. Дж. Nucl Med . (2017) 58: 799–806.DOI: 10.2967 / jnumed.116.180992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Музик О., Мангнер Т.Дж., Леонард В.Р., Кумар А., Янис Дж., Граннеман Дж. 15O ПЭТ-измерение кровотока и потребления кислорода в активированном холодом буром жире человека. Дж. Nucl Med . (2013) 54: 523–31. DOI: 10.2967 / jnumed.112.111336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Орава Дж., Нуутила П., Лиделл М.Э., Ойконен В., Нопонен Т., Вильянен Т. и др.Различные метаболические реакции коричневой жировой ткани человека на активацию холода и инсулина. Ячейка Метаб . (2011) 14: 272–9. DOI: 10.1016 / j.cmet.2011.06.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Томсен Т.К., Йенсен В.Дж., Хенриксен М.Г. In vivo измерение состава человеческого тела с помощью двухэнергетической рентгеновской абсорбциометрии (DXA). Eur J Surg . (1998) 164: 133–7. DOI: 10.1080 / 110241598750004797
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65.Wang Z, Ying Z, Bosy-Westphal A, Zhang J, Schautz B, Later W. и др. Удельная скорость метаболизма основных органов и тканей в зрелом возрасте: оценка механистической модели расхода энергии в состоянии покоя. Am J Clin Nutr . (2010) 92: 1369–77. DOI: 10.3945 / ajcn.2010.29885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Kaiyala KJ. Математическая модель вклада отдельных органов в ненулевые пересечения по оси Y в одно- и многокамерных линейных моделях расхода энергии всего тела. PLoS ONE . (2014) 9: e0103301. DOI: 10.1371 / journal.pone.0103301
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Галлахер Д., Бельмонте Д., Деуренберг П., Ван З., Краснов Н., Пи-Суньер FX и др. Измерение массы орган-ткань позволяет моделировать массу РЭ и метаболически активной ткани. Am J Physiol Endocrinol Metab . (1998) 275: E249–58. DOI: 10.1152 / ajpendo.1998.275.2.E249
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68.Jones TA, Wayte SC, Reddy NL, Adesanya O, Dimitriadis GK, Barber TM и др. Определение оптимального порога для обнаружения коричневой жировой ткани человека с использованием анализа рабочих характеристик приемника карт жировой фракции IDEAL MRI. Магнитно-резонансная томография . (2018) 51: 61–8. DOI: 10.1016 / j.mri.2018.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16p11.2 микроделеция вносит изменения в транскрипцию в моделях раннего нейрального развития человека, полученных из ИПСК человека
Редакции для этого документа:
Мы помним, что в настоящий момент невозможно провести дополнительные эксперименты.Однако мы считаем, что рассмотрение некоторых из этих моментов вместе с повторным анализом текущих данных сделает этот документ более полезным для тех, кто интересуется этой областью:
1) Данные в этой статье ограничены ИПСК, генерируемыми эписомальным перепрограммированием. Поскольку многие, возможно, большинство исследователей используют вирус Сендай, авторы должны упомянуть об этом. Также делают ли они вывод, что следует избегать эписомального перепрограммирования?
Хотя мы наблюдаем широко распространенную интеграцию вектора репрограммирования, мы не заключаем, что следует избегать эписомального репрограммирования.Фактически, мы утверждаем, что эписомальное репрограммирование должно быть более предпочтительным методом перепрограммирования, чем использование интегрирующего вектора, такого как AAV или лентивирусные векторы. Наши наблюдения подчеркивают важность проверки интеграции вектора, когда факторы репрограммирования вводятся в виде ДНК. Хотя это прямо не рассматривается в текущей рукописи, мы заметили, что некоторые связанные с заболеванием мутации, по-видимому, значительно снижают эффективность перепрограммирования, например, изменения LRRK2 и SNCA при болезни Паркинсона, а также CHD8 и 16p11.2 микроделеции при аутизме. Мы подозреваем, что редкая случайная интеграция обеспечивает длительную экспрессию факторов перепрограммирования и дает преимущество в селективном росте и увеличивает вероятность того, что выбранные клоны будут нести загадочные интеграции.
Редактировать рукопись:
«Наконец, мы хотели бы подчеркнуть важность скрининга клонов на наличие криптически интегрированных плазмид репрограммирования, даже несмотря на то, что опубликованные методы подчеркивают отсутствие интеграции при использовании эписомальных векторов репрограммирования.Вероятно, что эти эффекты наиболее актуальны для методов перепрограммирования, в которых используются векторы экспрессии ДНК, и менее вероятны для методов доставки на основе РНК, таких как репрограммирование модифицированной РНК или вируса Сендай ».
2) Анализ использует каждый клон как отдельную сущность. Насколько могут судить обозреватели, использовались 6 затронутых доноров, не всем из которых был поставлен диагноз РАС, у 3 из которых было 3 клона, у 1 из которых было 2, а у других 2 — по 1 каждому. Также было 3 незатронутых донора (с 3, 2 и 2 клонами).Однако вес клонов не должен быть таким же, как у отдельных доноров. Из Hoffman et al. Nat Comm 2017: «Благодаря дизайну исследования« повторяющиеся измерения », в котором люди представлены несколькими независимыми линиями hiPSC-NPC и hiPSC-нейронов, мы использовали линейную смешанную модель, применив функцию duplicateCorrelation в нашем анализе лимма / вуома. широко используется для контроля ложноположительных результатов в исследованиях повторных измерений, и его важность в наборах данных hiPSC недавно была подчеркнута (со ссылкой на Germain and Testa SCR 2017) ».Мы рекомендуем авторам повторно проанализировать свои данные, чтобы каждая запись была значением, связанным с пациентом, а не с клоном.
Мы искренне благодарим рецензентов за предложение использовать линейную смешанную модель для анализа значимости в нашем наборе данных. Вдохновленные этой обратной связью, мы не только завершили полный повторный анализ наших результатов дифференциальной экспрессии в наших клонах без интеграции, как описано в цитируемом Hoffman et al., Но также реализовали линейную смешанную модель при тестировании на ассоциация ассоциативный признак-модуль в анализе WGCNA добавлена на новые рисунки 6 и 5 — дополнение к рисунку 4.
При повторном анализе наших клонов без интеграции наши основные результаты остаются неизменными. Используя метод limma / voom DuplicateCorrelation (), мы наблюдаем, что десять генов области 16p11.2 имеют статистически значимое снижение экспрессии. Кроме того, мы обнаруживаем, что многие из тех же генов, которые обсуждаются в тексте, по-разному экспрессируются, включая MIR6723. Мы включили результаты этого нового анализа в приложение как ценный ортогональный подход для интерпретации этих данных.
Редактировать рукопись:
«Мы дополнительно подтвердили эти результаты, идентифицировав гены DE с использованием ортогонального подхода. Используя линейную смешанную модель, реализованную функцией DuplicateCorrelations () limma / voom для учета общих идентичностей пациентов в клонах, мы идентифицировали 40 генов как DE, 17 из которых были общими с генами, представленными в первом анализе дифференциальной экспрессии (рис. 5 — приложение к рисунку 4А). […] Взятые вместе, эти результаты усиливают интерпретацию этих данных как раннюю дисрегуляцию транскрипции с воздействиями, которые могут повлиять на развитие последующих генов.”
Наконец, мы хотели бы отметить, что мы включили наш исходный анализ в рукопись (пересмотренный рисунок 5), который учитывал влияние на пациента с помощью суррогатных переменных. Суррогатные переменные могут использоваться для выявления моделей вариаций, не связанных с известным экспериментальным дизайном; Здесь мы заметили, что величина нагрузки в наших рассчитанных суррогатных переменных хорошо соответствует пациенту. Здесь ось X указывает пациента, а ось Y указывает величину нагрузки суррогатной переменной для каждого образца.Клоны от каждого донора демонстрируют сильную ковариацию по 3 наиболее значимым суррогатным переменным (SV1-3). См. Изображение ответа автора 1.
3) Основываясь на результатах, представленных в этой статье, было бы немного ошибочным «настоятельно предполагать», что «делеция 16p11.2 может повлиять на многие функции, важные для развития нервной системы и нервно-психических заболеваний», учитывая, что сообщаемые изменения транскрипции весьма ограничены и что не было представлено данных о каком-либо наблюдаемом фенотипе.Было бы уместно смягчить это заявление и сделать более консервативные выводы.
В рукопись внесены многочисленные изменения формулировок, чтобы избежать преувеличения значимости наблюдений.
4) Если авторы не желают включить данные для дупликационных клонов, заголовок «16p11.2 CNV передает…» должен быть «16p11.2 microdeletion imparts…», поскольку все дупликационные клоны hiPSC в анализе были исключены на этапах анализа Рисунок 5 и 6.
Мы изменили заголовок нашей рукописи на:
«Микроделеция 16p11.2 вызывает транскрипционные изменения в моделях раннего нейронного развития человека, полученных с помощью ИПСК»
Мы также внесли текстовые правки по всей рукописи, чтобы отразить наше основное внимание на микроделеционных клонах.
5) QC вопросы:
а) В основной рукописи отсутствует информация об элементах управления. Могут ли авторы конкретно уточнить (в Результатах или Материалах и методах), в какой степени случаи и контроли совпадают по полу, этнической принадлежности и возрасту, а также были ли они перепрограммированы вместе с случаями и теми же методами?
Демографические данные по контрольным линиям теперь также включены в раздел рукописи «Материалы и методы».Все клеточные линии, использованные в этом исследовании, были перепрограммированы в одной лаборатории с использованием одного и того же метода перепрограммирования.
Редактирований текста:
«Все контрольные линии дикого типа были перепрограммированы эпизодически и совпадали по возрасту и полу. Конкретная демографическая информация для этих линий приведена ниже: WT_8343 (женщина, 5 лет), WT_2242 (мужчина, 4 года), WT_NIH511 (мужчина, 27 лет) и WT_NIh3788 (женщина, 30 лет). Все линии дикого типа получены по запросу из Stanford Neuroscience iPSC Core (https: // neuroscience.stanford.edu/research/programs/community-labs/neuroscienceipsc-core) ».
б) Какова была оценка полигенного риска для пациентов / контрольной группы? Могло ли это объяснить различные клинические проявления?
Это отличный вопрос, но у нас нет оценок для контрольных линий, и в настоящее время невозможно сравнить пациента с контрольной группой.
c) Были ли кариотипированы hiPSCs?
Мы использовали массивы SNP для документирования изменений количества копий, а не анализа кариотипа.За исключением отмеченных вариантов числа копий, все линии диплоидны, без недостающих или лишних хромосом.
d) Какой QC был проведен на RNAseq для подтверждения идентичности образца, состава клеток и т. Д.? Было бы полезно, если бы авторы применили разделение дисперсии, чтобы выявить, в какой степени вариация объясняется методом перепрограммирования, генотипом, донором, диагнозом, типом клеток и т. Д.?
Высокое качество исходных файлов input.fastqc было установлено с помощью MultiQC.
Дальнейший контроль качества проводился преимущественно путем наблюдения за анализом основных компонентов. В VST-нормализованных данных до пакетной коррекции мы наблюдаем, что 50% дисперсии улавливается в первых двух основных компонентах, а 82% дисперсии объясняется первыми десятью компонентами. Дисперсия, зафиксированная каждым главным компонентом, изображена в виде осыпи (см. Изображение ответа автора 2). Основные компоненты были рассчитаны с использованием 500 наиболее вариабельных генов в качестве входных данных, как и метод пакета DESeq2.
Очевидно, что большая часть дисперсии в первых двух компонентах обусловлена интеграционным фенотипом, на что указывает отсутствие перекрытия относительных распределений на графике плотности, изображенном на диагонали этого рисунка (изображение ответа автора 3). Здесь диагональ представляет собой график плотности тематической загрузки основных компонентов, строки и столбцы представляют основные компоненты, а каждая точка представляет клон.
Несмотря на это, очевидно, что есть некоторое разделение по генотипу в пределах нескольких первых компонентов, но это подавлено большой дисперсией в клонах DEL, на которые сильно повлиял интеграционный фенотип (см. Изображение ответа автора 4).
Также можно обнаружить разделение по полу, GrowBatch и SubjectID (донор), изображенным здесь (см. Изображения 5 и 6 ответа автора), хотя они, по-видимому, не являются доминирующими источниками вариаций в первых десяти основных компонентах.
В сочетании с корреляцией между известными потенциальными эффектами партии и анализом суррогатных переменных, эти результаты помогают мотивировать выбор пола и оттаивания клеточной линии и роста партии как эффектов партии в нашем последующем анализе.Второй подтверждающий анализ PCA направил наш выбор эффектов партии в клонах без интеграции. В качестве окончательного подтверждения идентичности образца, пол и статус пациента 16p11.2 могут быть идентифицированы по относительной экспрессии сцепленных с полом генов и 16p11. 2-региональные гены соответственно.
e) Каковы коэффициенты корреляции Спирмена для транскриптомной экспрессии генов между донорами и образцами клонов?
Мы включили в ответ автора изображение 7 тепловую карту коэффициента корреляции Спирмена для корреляции между VST-нормализованными и скорректированными выражениями между выборками.Лучшие кластеры данных по генотипу. Образцы с большей вероятностью будут сгруппированы по строке (представляющей клоны), чем по SubjectID (представляющей клоны). В общем, это говорит нам о том, что первичный сигнал в нашем анализе дифференциальной экспрессии будет представлять различия, относящиеся к генотипу.
6) Вопросы, связанные с дополнительным анализом полезных данных
a) Интеграция с существующими наборами данных и психиатрическими генетическими исследованиями: есть ли обогащение 16p11.2 DEG для локусов GWAS для ASD, SZ или ADHD? Могут ли авторы также протестировать на обогащение паттернов патологоанатомических заболеваний, как сообщает консорциум CommonMind, NIH HBCC и / или PsychEncode UCLA (Geschwind)?
Мы решили сосредоточиться на совпадении между нашим идентифицированным списком генов DE и списком генов риска аутизма SFARI, поскольку делеция 16p11.2 тесно связана с диагнозом РАС и содержит фенотипическое перекрытие даже в случаях, которые не соответствуют диагностическим критериям РАС. Мы определили 8 генов в нашем списке генов DE, которые были идентифицированы геном SFARI как гены с доказательствами риска аутизма (дополнительный файл 5).
Хотя это не представляет собой статистически значимого обогащения, мы не можем ожидать увидеть обогащение генов риска, полученных из данных SNP в этот момент времени. Установленные гены риска могут потенциально влиять на траектории развития во многие моменты времени на протяжении всего развития, и мы сосредоточили наше исследование на одной, ранней временной точке. Не каждый ген риска должен оказывать влияние в каждый момент времени, чтобы проявилось их совокупное воздействие на развитие нервной системы.
Кроме того, полевым работникам может быть полезно определить конкретные моменты времени, в которые оказывают влияние различные гены риска.Мы воодушевлены тем, что наше исследование точно определяет ограниченный набор генов области 16p11.2 и генов, связанных с РАС (например, AGMO, MUC4, EXT1), поскольку это помогает сузить фокус того, какие генные программы могут потенциально повлиять на развитие нервной системы на данном этапе.
b) Подтверждаются ли различия в экспрессии генов в существующих наборах данных 16p11.2 postmortem, hiPSC или мышей (например, PMID: 26829649)?
Мы проверили выбранный набор генов DE с помощью qRT-PCR, когда наша исследовательская группа имела доступ к нашей лабораторной среде.Кроме того, подавление транскриптов из области делеции 16p11.2 — явление, которое наблюдалось в нескольких других статьях 1,2 .
Одна из наших проблем заключается в том, что сравнение нашего набора данных с посмертной тканью 16p11.2 или тканью мыши может быть затруднено из-за смешения временных точек. Наша модель представляет собой очень раннюю временную точку в развитии нервной системы плода, которая сильно отличается от ткани взрослой мыши или посмертного мозга взрослого человека.
Что касается сравнения с другими моделями hiPSC, мы согласны с тем, что это подходящее сравнение, но тщательный мета-анализ всех доступных данных транскриптомики выходит за рамки данной рукописи.
c) Учитывая недавние дискуссии о конвергенции между эффектами CNV при психических заболеваниях, основные результаты исследования 16p11.2, сохраненного в наборах данных нейронов hiPSC из других основных CNV (например, 22q11.2 hiPSC PMID: 27846841 и PMID мыши: 29666363; 15q11. 2 BioRxiv https://doi.org/10.1101/772541; NRXN1 PMID: 31784728)
Это интересный вопрос, который заслуживает дальнейшего изучения, но, как указано выше, значимое сравнение с этими другими наборами данных может оказаться невозможным из-за смешения временных точек и существенных различий во внутренней биологии корковых нейронных предшественников на розеточной стадии и тех, более дифференцированных типов клеток.
d) Могут ли авторы обсудить, верят ли они, что транскриптомные эффекты 16p11.2 на весь геном отражают петли хроматина между локусом CNV и другими генами-мишенями? miR цели? Или последующие воздействия нарушенного созревания / активности / передачи сигналов нейронов?
Мы согласны с тем, что это убедительная концепция. Хромосомная петля наблюдается в области CNV 16p11.2 3 . Промоторы MVP и MAPK3 оба участвуют во взаимодействиях на больших расстояниях с PTEN и CHD1L.MAPK3, но не MVP, был обнаружен как дифференциально экспрессируемый ген в нашем наборе данных (рис. 5F). CHD1L был обнаружен в нашем наборе данных, но не выражен дифференциально. Возникает соблазн предположить, что этот механизм дальнего действия может помочь объяснить появление PTENP1-AS, который регулирует транскрипцию PTEN, в модуле pink4, ассоциированном с клиническими фенотипами в образцах DEL (Рис. 6).
Хотя вызов петли и тщательная характеристика состояния хроматина выходят за рамки этого исследования, мы согласны с тем, что это будет интересная область для дальнейшего наблюдения.
7) Могут ли авторы прокомментировать какие-либо фенотипические различия, которые они наблюдали между линиями микроделеций и линиями wt?
На протяжении всего проекта были предприняты значительные усилия для выявления фенотипических различий между микроделециями и линиями дикого типа.
Например, мы были очень заинтересованы в том, чтобы определить, были ли обнаружены ранее описанные изменения пролиферации нейральных предшественников, наблюдаемые на мышиных моделях, в предшественниках, происходящих от ИПСК.
Снижение экспрессии MAPK3, ключевого компонента пути Ras / MAPK, участвующего в клеточной пролиферации, и экспрессии KCTD13, другого гена интервала 16p11.2, оказывает реципрокный эффект на размер мозга 5 . Мы тщательно исследовали митотический индекс, скорость роста или скорость дифференциации NPC в различные моменты времени на протяжении всего протокола дифференциации. Единственные наблюдаемые различия были полностью обусловлены загадочной интеграцией векторов репрограммирования, экспрессирующих Oct3 / 4.
В дополнение к оценке пролиферативной способности 16p11.2 NPCs мы охарактеризовали способность к дифференцировке, способность формировать нервную розетку, размер нервной розетки, степень поляризации, скорость созревания и динамику клеточного цикла. Ни один из этих количественных показателей не отличался между микроделециями и NPC, происходящими от hiPSC дикого типа.
Мы находимся в процессе анализа транскриптомики единичных клеток в коре плода синтенных мышей 16p11.2, созданных Alea Mills, и наша предварительная кластеризация предполагает, что нет никакой разницы в относительном количестве корковых нейральных предшественников в коре плода DEL и WT. .Мы понимаем, что это противоречит предыдущим анатомическим исследованиям, основанным на окрашивании антителами корковых тканей мышей, и мы надеемся, что транскриптомика отдельных клеток у мышей, наряду с отсутствием пролиферативных различий в клетках-предшественниках, происходящих от 16p11.2 DEL iPSC, может привести к лучшему пониманию более ранних данных.
Ожидаемые изменения в ходе последующей работы:
1) Характеристика линий микродупликации.
В настоящее время мы поддерживаем связь с Фондом Саймонса, чтобы получить и охарактеризовать дополнительные 16p11.2 линии дупликации с учетом относительной нехватки дупликационных клонов без интеграции.
2) Выявление фенотипических различий на стадии нейральных предшественников или в дифференцированных нейронах.
В настоящее время мы проводим эксперименты с одним ядром RNAseq со зрелыми нейронами из линий делеции 16p11.2 и довольны некоторыми обнадеживающими результатами. Мы надеемся, что эксперименты in vitro, необходимые для тщательной проверки этих результатов, можно будет провести в ближайшем будущем.
Список литературы
Blumenthal, I. et al. Транскрипционные последствия делеции и дупликации 16p11.2 в коре головного мозга мышей и семьях с множественным аутизмом. Am J Hum Genet 94, 870-883, DOI: 10.1016 / j.ajhg.2014.05.004 (2014).
Ward, T. R. et al. Полногеномные молекулярные эффекты нейропсихиатрических CNV 16p11 в нейронной модели iPSCto-iN. bioRxiv , 2020.2002.2009.940965, DOI: 10.1101 / 2020.02.09.940965 (2020).
Поот, М. Синдромы, скрытые в области удаления 16p11.2. Mol Syndromol 9, 171-174, DOI: 10,1159 / 0004
(2018).
Kusenda, M. et al. Влияние микроделеций и микродупликаций 16p11.2 на глобальные профили транскрипции. J Детский Neurol 30, 1947–1953, DOI: 10,1177 / 0883073815602066 (2015).
Golzio, C. et al. KCTD13 является основным драйвером зеркальных нейроанатомических фенотипов варианта с числом копий 16p11.2. Nature 485, 363-367, DOI: 10.1038 / nature11091 (2012).
https://doi.org/10.7554/eLife.58178.sa2CHD8 регулирует баланс между пролиферацией и дифференцировкой ИПСК человека в нервном развитии
% PDF-1.5 % 1 0 объект > / Метаданные 524 0 R / Страницы 2 0 R / StructTreeRoot 3 0 R / Тип / Каталог >> эндобдж 524 0 объект > поток application / pdf
Мировые языки и программы погружения / Seal of Biliteracy
ОБЗОР
Знак билиграмотности — это награда, вручаемая школьным округом Анкориджа выпускникам младших и старших классов. * в знак признания учащихся, которые достигли уровня владения двумя или более языками к моменту окончания средней школы.Знак также признает, поддерживает и одобряет родной / домашний язык учащихся. Знак поощряет студентов развивать билиграмотность, отдает должное навыкам, которые получают наши студенты, и может свидетельствовать о навыках, привлекательных для будущих работодателей и приемных комиссий колледжей. Он имеет форму печати, которая ставится на диплом выпускника, а также указывается в их официальной транскрипте.
По данным Бюро переписи населения США, более шестидесяти пяти миллионов единиц U.Жители С. дома говорят на другом языке, кроме английского, — число, которое с 1970-х годов растет десятилетие за десятилетием. Тем не менее, это число составляет лишь 20,7% от общей численности населения, и только часть этой когорты говорит, читает и понимает второй язык достаточно хорошо, чтобы использовать его в повседневной жизни. Подавляющее большинство американских граждан остаются одноязычными.
В то время как английский по-прежнему является лингва-франка для мировой торговли и дипломатии, среди лидеров бизнеса и политики, учителей, ученых и членов сообщества складывается консенсус в отношении того, что владения английским языком недостаточно для удовлетворения потребностей страны в сужающемся мире. , ни потребности отдельных граждан, которые взаимодействуют с другими народами и культурами больше, чем когда-либо в истории человечества (Комиссия по изучению языков, 2017, Американская академия искусств и наук).
юниоров / пожилых людей с ASD, получившие знак билитарности, получают квалификационное письмо, сертификат, подписанный суперинтендантом, и бронзовую булавку на лацкане. На диплом студента ставится золотая печать, а документация печати с указанием языка заносится в транскрипт студента.
* Изменения на весну 2021 года: теперь и юниоры, и пожилые люди могут подать заявку на получение Знака безграмотности. Это позволит студентам, получившим квалификацию ранее, включить это признание в свои заявления в колледж / университет.Кроме того, утвержденные оценки по второму языку (STAMP и т. Д.) Теперь будут приниматься со второго, младшего и старшего курсов. Учащиеся должны указать, с какого учебного года они запрашивают оценки, когда они заполняют заявку на получение печати весны 2021 года.
КВАЛИФИКАЦИЯ
Студенты должны соответствовать следующим требованиям, чтобы получить Знак грамотности округа весной 2021 года:
- Должен быть младшим или старшим в 2020-2021 учебном году
- Выполнение всех требований для получения диплома по английскому языку ASD до конца 10 класса (4 семестра) с общим средним баллом по английскому языку 2.5 или выше по шкале 4,0.
- Продемонстрировать владение одним или несколькими утвержденными * мировыми языками, кроме английского:
* В настоящее время утвержденные языки включают: амхарский, арабский, армянский, ASL, чин (хаха), китайский (мандаринский диалект), чукский, чешский, французский, немецкий, гаитянско-креольский, иврит, хинди, хмонг, илокано, итальянский, японский, Каннада, корейский, латынь, маратхи, маршалльский, польский, португальский, русский, самоанский, сомалийский (Maxaa и Maay Maay), испанский, тагальский (филиппинский), тамильский, телугу, тайский, турецкий, урду, вьетнамский и юпик ( Ожидается, что гавайский будет доступен в конце весны)
ASD покрывает только стоимость STAMP 4S, WorldSpeak, SLPI и AAPPL (только на тайском языке).
Студенты, желающие получить ASL, латинский или тайский язык, должны связаться с нами, отправив электронное письмо по адресу [email protected] .
Оценка диагностической стабильности раннего фенотипа расстройства аутистического спектра в общей популяции, начиная с 12 месяцев | Расстройства аутистического спектра | JAMA Педиатрия
Ключевые моментыВопрос Стабильно ли диагноз расстройства аутистического спектра к 18 месяцам, самому раннему возрасту, рекомендованному Американской академией педиатрии для скрининга?
Выводы В когортном исследовании 1269 детей ясельного возраста с расстройством аутистического спектра и без него, получивших первую диагностическую оценку в возрасте от 12 до 36 месяцев, общая стабильность диагноза аутистического спектра была равна 0.84, что было выше, чем в других группах.
Значение Возможна точная диагностика расстройства аутистического спектра в возрасте до 18 месяцев, и могут быть возможности проверить эффективность лечения расстройства аутистического спектра в раннем возрасте.
Важность Универсальный ранний скрининг расстройств аутистического спектра (РАС) в первичной медико-санитарной помощи становится все более распространенным явлением и считается важным шагом на пути к раннему лечению.Однако диагностическая стабильность РАС в больших когортах населения в целом, особенно среди лиц моложе 18 месяцев, неизвестна. Изменения фенотипической экспрессии РАС на раннем этапе развития по сравнению с малышами с другими задержками также неизвестны.
Цели Изучить диагностическую стабильность РАС в большой когорте детей ясельного возраста, начиная с 12-месячного возраста, и сравнить эту стабильность со стабильностью детей ясельного возраста с другими расстройствами, такими как задержка развития.
Дизайн, обстановка и участники В этом проспективном когортном исследовании, проведенном с 1 января 2006 г. по 31 декабря 2018 г., в общей сложности 2241 ребенок ясельного возраста был направлен из общей популяции через универсальную программу скрининга в первичную медико-санитарную помощь или направление к специалистам по месту жительства. Соответствующие критериям дети ясельного возраста прошли первое диагностическое обследование в возрасте от 12 до 36 месяцев и прошли как минимум 1 последующее обследование.
Открытия После каждого оценочного визита диагноз обозначался как РАС, особенности РАС, задержка речевого развития, задержка в развитии, другие проблемы развития, типичный брат или сестра пробанда РАС или типичное развитие.
Основные результаты и мероприятия Коэффициенты диагностической стабильности рассчитывались в пределах 2-месячных возрастных групп, а модели логистической регрессии использовались для изучения связи пола, возраста, диагноза при первом посещении и интервала между первым и последним диагнозом со стабильностью. Малыши с диагнозом, не относящимся к РАС, при первом посещении, у которых в последний раз был диагностирован РАС, были обозначены как дети с поздним выявлением РАС.
Результаты Среди 1269 детей ясельного возраста, включенных в исследование (918 [72.3%] мужской; средний возраст при первой оценке 17,6 месяцев [межквартильный размах 14,0-24,4 месяца]; средний возраст при окончательной оценке — 36,2 месяца [межквартильный размах, 33,4-40,9 месяцев]), общая диагностическая стабильность для РАС составила 0,84 (95% ДИ, 0,80-0,87), что было выше, чем в любой другой диагностической группе. Только у 7 малышей (1,8%) изначально считалось, что РАС перешло в окончательный диагноз типичного развития. Диагностическая стабильность РАС в самой молодой возрастной группе (12-13 месяцев) была самой низкой в 0.50 (95% ДИ, 0,32-0,69), но увеличился до 0,79 к 14 месяцам и 0,83 к 16 месяцам (возрастные группы 12 против 14 и 16 месяцев; отношение шансов, 4,25; 95% ДИ, 1,59-11,74). В общей сложности 105 детей ясельного возраста (23,8%) не были определены как имеющие РАС при их первом посещении, но были идентифицированы при более позднем посещении.
Выводы и значимость Полученные данные свидетельствуют о том, что диагноз РАС становится стабильным, начиная с 14-месячного возраста, и в целом является более стабильным, чем другие диагностические категории, включая задержку речи или развития.После того, как у малыша диагностирован РАС, вероятность того, что он или она проведет тестирование в пределах обычных уровней в 3-летнем возрасте, мала. Это открытие открывает возможность проверить влияние лечения РАС в очень раннем возрасте.
Расстройство аутистического спектра (РАС) — распространенное детское заболевание, которым страдает 1 из 59 детей. 1 Становится ясно, что РАС зародились во время пренатальной жизни. 2 Поскольку у многих детей с РАС в течение первого года появляются клинические признаки, такие как неспособность ответить на свое имя 3 и снижение положительного аффекта, 4 существует значительный спрос на раннее выявление, вмешательство и услуги. 5 Хотя несколько исследований показали, что ранние признаки РАС иногда можно обнаружить с помощью экранов отчетов родителей уже в возрасте 12 6 -8 или 18 месяцев, 9 , 10 средний возраст пациента в Распознавание РАС происходит через несколько лет, обычно в возрасте от 3 до 4 лет. 1 Поздний возраст обнаружения — это упущенная возможность, учитывая ускоренные темпы развития мозга, которые происходят между рождением и возрастом от 3 до 4 лет. 11 Несмотря на привлекательность концепции раннего выявления и лечения РАС, остается много неизвестного.Основополагающие вопросы, касающиеся диагностической стабильности в раннем возрасте, возраста появления клинических симптомов и совпадения клинических симптомов в раннем возрасте между РАС и другими расстройствами, такими как задержка речевого развития или глобальная задержка развития, остаются без ответа. Предыдущий отчет 12 Целевой группы профилактических служб США не одобрял ранний всеобщий скрининг на РАС из-за отсутствия ясности в отношении баланса пользы и вреда раннего скрининга и выявления.
Месяцы, предшествующие первому дню рождения, — замечательное время для развития малыша.В этом возрасте малыши учатся ходить, 13 говорят свое первое слово, 14 и участвуют в ряде совместных действий социального внимания, таких как указание и демонстрация объектов другим, чтобы разделить социальное внимание. 15 Стадия малыша также является самым ранним возрастом, в котором можно обнаружить РАС и начать лечение, 6 , 16 , но стабильность диагноза РАС в этом ключевом возрасте неизвестна.
В предыдущем отчете 17 говорилось, что в большинстве исследований, изучающих диагностическую стабильность РАС до 3-летнего возраста, участвовали несколько более старшие группы пациентов, направляемых в клинику, обычно в возрасте примерно 2 лет.Коэффициенты стабильности в этих исследованиях были высокими (среднее значение 88%, диапазон 63% -100%). 17 В двух исследованиях изучали стабильность в еще более молодом возрасте (18 месяцев), но этот вопрос изучали в рамках мультиплексных семей с использованием модели младенцев-братьев и сестер. Одно из этих исследований показало, что 93% братьев и сестер, которым впервые был поставлен диагноз РАС в 18 месяцев, сохранили этот диагноз в последнем диагностическом возрасте 36 месяцев, 17 , но только 69% братьев и сестер, которым впервые был поставлен диагноз РАС в 24 месяца, сделали это ( т.е. 27 из 39 сохраненных диагнозов). 17 Хотя исследования в совокупности предполагают, что диагноз РАС является умеренно стабильным в молодом возрасте, 17 остается несколько ключевых вопросов. Во-первых, неясно, будут ли найдены оценки стабильности по дизайну младенческих братьев и сестер в общей популяции. Во-вторых, ни одно из предыдущих когортных исследований, направленных в клинику, не включало большие группы детей ясельного возраста без РАС, выявленных таким же образом, как и у малышей с РАС. Такие контрастные группы необходимы для понимания того, как фенотип РАС возникает и перекрывается с клиническими проявлениями других диагностических групп, такими как речь и задержка развития, обычно встречающиеся в клинических условиях.В-третьих, клинические исследования небольшие, обычно от 50 до 100 участников, и могут давать менее стабильные результаты. Более того, дети, направленные в клинику из-за уже подозреваемого РАС, могут иметь искусственно высокие показатели стабильности по сравнению с выборкой, установленной сообществом. 17 В-четвертых, несмотря на потенциальную возможность изучения РАС с рождения с помощью модели «братья и сестры», оценки стабильности сообщались только начиная с 18-месячного возраста, оставляя без ответа вопросы, касающиеся младшего возраста.
К этим пробелам в знаниях чередуются недавние результаты исследований младенцев и сестер 17 , 18 о том, что от 50% до 80% малышей, которым в конечном итоге был поставлен диагноз РАС в возрасте 3 лет, не были идентифицированы как имеющие РАС опытными клиницистами в 18 месяцев. Короче говоря, несмотря на обширные клинические испытания, которые включали в себя золотой стандартный инструмент — График наблюдения за диагностикой аутизма (ADOS), 19 9 1048, эти диагнозы были пропущены. Однако более новое исследование, 20 , предполагает, что такие так называемые случаи с поздним началом могут быть связаны с недостатками, присущими стандартным диагностическим инструментам в раннем возрасте, а не с отсутствием наблюдаемых симптомов РАС как таковых.Определение степени, в которой такие случаи с поздним началом могут присутствовать в общей когорте населения, имеет важное значение, потому что, если показатели будут такими же высокими, как в когортах младенцев, братьев и сестер, это сильно подчеркнет рекомендацию Американской академии педиатрии о повторном скрининге в разном возрасте. Это также сделало бы дальнейшую актуальность поисков ранних поведенческих или биологических тестов на РАС, чтобы легче выявлять РАС в самом раннем возрасте, когда выявление является наиболее сложной задачей. В этом исследовании мы стремились изучить диагностическую стабильность РАС в большой когорте детей ясельного возраста, начиная с 12-месячного возраста, и сравнить эту стабильность со стабильностью детей ясельного возраста с другими расстройствами, такими как задержка развития.
В общей сложности 2241 ребенок в возрасте от 12 до 36 месяцев был направлен для диагностической оценки в экспертный центр оценки аутизма, созданный при Калифорнийском университете в Сан-Диего. Направления были предоставлены через нашу программу раннего обнаружения Get SET Early, 6 , 21 , которая систематически проверяет наличие РАС и других расстройств среди населения в целом на 12-, 18- и 24-месячных проверках здоровья ребенка или через общее сообщество.Типично развивающихся (TD) малышей также набирали из тех же педиатрических кабинетов, которые участвовали в программе Get SET Early (eMethods в Приложении). В общей сложности 1269 из 2241 ребенка ясельного возраста прошли продольную оценку 2 или более раз и стали предметом настоящего исследования. В этом примере примерно 75% пришло из программы Get SET Early и примерно 25% — из обращения к сообществу. Дополнительные квалификационные требования включали интервал в 6 месяцев или более между первой и последней оценкой.На Рисунке 1, а также на электронном рисунке 1 и электронном рисунке 2 в Приложении показаны характеристики когорт. Это исследование проходило под наблюдением институционального наблюдательного совета Калифорнийского университета в Сан-Диего, и письменное информированное согласие было получено от лиц, осуществляющих уход, до включения в исследование. На этапе анализа данных исследования имена пациентов были удалены из наших электронных таблиц, чтобы защитить их личность.
Диагностическое и психометрическое тестирование
Высококвалифицированные, лицензированные психологи с докторской степенью выполнили диагностические и психометрические тесты, включая ADOS-2 (модуль T, 1 или 2 в зависимости от ситуации), 19 Шкалы раннего обучения Маллена, 22 и шкалы адаптивного поведения Вайнленда. 23 Малыши, впервые получившие диагностическое обследование в возрасте до 36 месяцев, проходили диагностическое обследование примерно каждые 12 месяцев до 3 лет. После каждого посещения психологи заполняли форму диагностического заключения и вносили ее в базу данных. Психологи не скрывали свои предыдущие диагнозы во время лонгитюдных тестовых визитов. У малыша было одно из следующего: РАС, особенности РАС, задержка в развитии, задержка речевого развития (LD), другие проблемы, TD или типичный брат или сестра пробанда с РАС.Родители получили обратную связь относительно успеваемости их ребенка после завершения тестирования и направили на лечение в случае необходимости. Описание подготовки психологов, используемых диагностических критериев, процесса контроля качества данных и оценочные значения T-баллов по Маллену, полученные для 9% детей ясельного возраста, набравших ниже стандартного T-балла 20, приведены в eMethods в Приложении. В таблице и на электронном рисунке 2 в Приложении представлена информация об использованной версии «Диагностическое и статистическое руководство по психическим расстройствам» ( DSM ).
Статистика и визуализация данных
Коэффициенты стабильности были сначала рассчитаны в пределах 2-месячных возрастных групп путем определения доли детей ясельного возраста с определенным диагнозом во время первого диагностического визита, у которых этот диагноз был сохранен во время последнего визита.Таблицы диагностических переходов были созданы для общих данных и данных с интервалом в 2 месяца с разбивкой по возрасту. Диагностическая стабильность была смоделирована с использованием логистической регрессии, с полом, возрастом на момент первого диагноза, интервалом между первым и последним диагнозом и диагностической группой при первом посещении в качестве переменных, а результаты представлены в виде отношения шансов (OR) (eTable 1 в Приложении). Чтобы изучить связь возраста при первом диагнозе с коэффициентами стабильности при оптимизации статистической мощности, мы разделили возраст на 4 примерно равные по численности группы: моложе 14 месяцев, от 14 до 17 лет.99 месяцев, от 18 до 23,99 месяцев, 24 месяца и старше. Не было обнаружено значимой связи между полом или интервалом с коэффициентами стабильности. Для изучения связи возраста на момент первого диагноза с коэффициентами стабильности в каждой диагностической группе использовались модели последующего наблюдения с четырьмя возрастными группами в качестве единственных ковариат. Метод B-сплайна с 3 df также использовался для проверки нелинейной непрерывной связи возраста при первом диагнозе с коэффициентами стабильности в каждой группе диагнозов и для визуализации данных.Все анализы были выполнены в среде программирования R (R Foundation for Statistical Computing) (eMethods в Приложении). Принимая во внимание предостережение разработчиков ADOS относительно использования ADOS с детьми ясельного возраста с невербальным умственным возрастом моложе 12 месяцев и теми, кто не является амбулаторным, коэффициенты стабильности 24 также были пересчитаны после удаления таких случаев.
Шаблоны переходов, визуализированные с помощью диагностических тепловых карт
Чтобы визуализировать, как фенотипическое проявление РАС и других расстройств менялось во время визитов, диагностические тепловые карты были созданы с использованием библиотеки ggplot в программном обеспечении R.С использованием этого подхода диагностические заключения были проиллюстрированы внутри от первого диагноза до окончательного диагноза, и каждому диагностическому заключению был присвоен уникальный цвет. Таким образом, можно было визуально расшифровать шаблоны перехода между посещениями для диагностики.
Идентификационное обозначение ДМПП и клинические различия
Для сравнения с исследованиями диагностической стабильности младенцев, братьев и сестер, когорта пациентов с РАС была отнесена к категории пациентов с постоянным диагнозом РАС в раннем возрасте, который определялся как диагноз РАС в возрасте 18 месяцев или ранее, который сохранялся при окончательном диагнозе; стойкий диагноз РАС среднего возраста, который определялся как диагноз РАС после 18 месяцев, который сохранялся при окончательном диагнозе; и поздно выявленные РАС, которые были определены как РАС, не диагностированные при первом диагностическом посещении, независимо от возраста приема.270 детей ясельного возраста, которые изначально были идентифицированы как имеющие ДП и сохранили этот диагноз в возрасте окончательной диагностики, были использованы в качестве контрастной когорты. Односторонний дисперсионный анализ с последующими запланированными контрастами и Cohen d использовался для изучения клинических различий. Также были проведены расширенные сравнения, в которые были включены все диагностические группы (см. Рис. 3 в Приложении).
Характеристики участников
Среди 1269 малышей 918 (72.3%) были мужчинами, средний возраст при первой оценке составлял 17,6 месяцев (межквартильный размах, 14,0-24,4 месяца), среднее количество диагностических посещений составляло 2,7 (межквартильный размах, 2-3), а средний возраст при окончательной оценке составлял 36,2 месяца ( межквартильный размах 33,4-40,9 мес). В таблице приведены демографические данные и результаты клинических тестов для каждой диагностической группы.
Общая стабильность составила 0,84 (95% ДИ, 0,80-0,87) для диагноза РАС и 0,79 (95% ДИ, 0.74-0,83) для диагностики TD (рисунок 2A). Результаты общей модели логистической регрессии показали значительную связь возраста и диагноза при первом посещении со стабильностью (таблица 1 в Приложении). Не было обнаружено значительных различий в стабильности в зависимости от пола (OR, 0,76; 95% ДИ, 0,56–1,04) или интервала между первой и последней диагностической оценкой (OR, 0,99; 95% ДИ, 0,98–1,00). Анализ логистической регрессии показал незначительную разницу в коэффициентах стабильности между ASD и TD (OR, 0.86; 95% ДИ 0,57–1,29). Напротив, значимые различия были обнаружены между ASD и остальными диагностическими группами (OR, 0,11 [95% CI, 0,03–0,32] по сравнению с признаками ASD; OR, 0,15 [95% CI, 0,09–0,25] по сравнению с DD; OR, 0,04 [ 95% ДИ, 0,03–0,06] по сравнению с LD и OR 0,16 [95% ДИ, 0,09–0,28] по сравнению с другими) (eTable 1 в Приложении). Для ASD стабильность была самой низкой в возрасте от 12 до 13 месяцев (коэффициент стабильности 0,50; 95% ДИ 0,32–0,69). Стабильность диагноза РАС увеличилась до 0,79 к 14 месяцам и 0,83 к 16 месяцам (возрастные группы 12 против 14 и 16 месяцев; OR, 4.25; 95% ДИ, 1,59–11,74) (рисунок 3 и рисунок 4, рисунок 5, таблица 2 и таблица 3 в Приложении). Когда считалось, что у детей ясельного возраста с особенностями РАС имеется РАС, коэффициенты стабильности увеличивались до 0,70 (95% ДИ, 0,52-0,85) в возрасте 12 месяцев, 0,85 (95% ДИ, 0,71-0,94) в возрасте 14 месяцев и 0,94 (95% ДИ 0,81–0,99) в возрасте 16 месяцев. Учитывая временный характер многих ранних задержек, общая стабильность 25 была низкой для остальных групп задержек (Рис. 2 и Рис. 3, а также eFigure 4 и eTable 4 в Приложении).Исключены 73 малыша (34 с РАС, 1 с признаками РАС, 24 с ДР, 7 с другими расстройствами, 1 с типичным братом или сестрой и 6 с ДП), невербальный умственный возраст которых, основанный на компоненте визуального восприятия шкалы Маллена, был моложе Более 12 месяцев (средний невербальный умственный возраст 9,6 месяцев) не улучшили коэффициент стабильности РАС в возрасте от 12 до 13 месяцев (таблица 5 и рисунок 6 в Приложении).
Диагностические тепловые карты (рис. 2B) иллюстрируют шаблоны диагностических переходов для детей ясельного возраста, которые были оценены 2, 3 или 4 или более раз.Наиболее распространенным типом перехода был переход от первоначального диагноза LD или задержки развития к РАС. Переход от первоначального определения РАС к окончательному диагнозу TD был редким и произошел только в 1,8% от общего числа случаев (т. Е. У 7 малышей из 400 детей первого года жизни, первоначально обозначенных как ASD). Однако 5 из этих 7 детей ясельного возраста с ложноположительными результатами были первоначально обследованы в самом молодом возрасте (12–13 месяцев) (см. Рис. 4 в Приложении).
Паттерны идентификации РАС и клинические различия
Для детей младшего возраста, 66 детей ясельного возраста (15.9%) были отнесены к группе ранней диагностики, 270 (61,2%) к группе с диагнозом среднего возраста и 105 (23,8%) к группе с поздним выявлением. В целом, тесты F выявили значительную разницу между группами для всех клинических областей (таблица 6 в Приложении). Последующий попарный анализ показал, что эти различия были обусловлены поздно идентифицированной группой, у которой стабильно были лучшие результаты тестов, чем у двух других диагностических групп РАС по всем показателям при первом оценочном визите (диапазон размеров эффекта Коэна d , 0.44-2,35). Однако у детей ясельного возраста с РАС в этой группе были значительно худшие результаты тестов, чем у детей ясельного возраста с ПД (диапазон размеров эффекта Коэна d , 1,43–1,84), что свидетельствует о наличии симптомов. Не было обнаружено клинических различий между группами раннего и среднего диагноза (рис. 4).
Детей с РАС выявляют и лечат на национальном уровне примерно в 4 года. 1 Однако мы обнаружили, что в контексте программы раннего выявления у 6 детей можно достоверно диагностировать РАС на несколько лет раньше, уже в возрасте 14 месяцев.Значение этого открытия выходит за рамки информации, относящейся к диагностической стабильности, и может открыть новые возможности для рассмотрения того, связано ли и как лечение, начатое в этом раннем возрасте, с долгосрочными результатами для затронутых детей.
Первоначальный диагноз ASD был более стабильным, чем любой другой диагноз, включая TD. В нашей когорте 84% детей ясельного возраста, у которых изначально был диагностирован РАС при их первом посещении, сохраняли этот диагноз в возрасте от 3 до 4 лет. Большинство детей ясельного возраста из оставшихся 16% не потеряли полностью задержки, а вместо этого имели более умеренные задержки во время последнего диагностического визита.Наиболее распространенным переходом был переход от РАС к признакам РАС, диагностическая категория, используемая для детей ясельного возраста с признаками РАС, но недостаточная для соответствия критериям DSM . Наименее распространенным переходом был переход от ASD к TD (то есть только у 1,8% детей ясельного возраста, изначально обозначенных как переход от ASD к TD). Поскольку все малыши сразу же направлялись на лечение при обнаружении какой-либо задержки, улучшение тяжести симптомов могло быть связано с положительным влиянием очень раннего лечения, которое, как показывают исследования, может быть более полезным, чем лечение, начатое в более старшем возрасте. 26 -28 С точки зрения государственной политики, это открытие предполагает, что важно начинать лечение сразу после первоначального определения РАС, даже в самом раннем возрасте. Человеческий мозг обладает огромной способностью восстанавливать и реконструировать, особенно в первые послеродовые годы. Несколько исследований, в которых изучали лечение в течение этого преобразующего временного окна, показали, что дети ясельного возраста с РАС, 26 , 27,29 , 30 церебральный паралич, 31 преждевременные роды, 32 -34 и тяжелые потеря слуха 35 испытывают значительные положительные изменения, такие как увеличение на 15 баллов IQ 29 или улучшение восприятия речи и языковых способностей. 36 Предостережение, однако, заключается в том, что диагностические оценки в раннем возрасте должны проводиться практиками, имеющими значительный опыт в раннем развитии РАС. Во многих местах в Соединенных Штатах такого опыта крайне не хватает. 37
Хотя общая стабильность диагноза РАС была высокой, изучение данных в пределах 2-месячных возрастных групп показало, что стабильность была выборочно низкой через 12 месяцев с коэффициентом стабильности 0,50. Более низкий коэффициент стабильности для ASD, особенно в 12 месяцев, вероятно, отражает некоторые ограничения в диагностических инструментах, используемых в этом возрасте, включая ADOS-2 и DSM .В выборке с первым диагнозом РАС, которая включала 400 детей ясельного возраста, только 7 перешли к окончательному диагнозу TD, и 5 из них были в пределах 12-месячного возраста. Исследования разработчиков ADOS-2 предупреждают, что его нельзя использовать с детьми ясельного возраста, чей невербальный умственный возраст моложе 12 месяцев, 24 , но даже когда такие малыши были исключены из анализа, коэффициент стабильности не улучшился. Двенадцать месяцев — это возраст, когда малыши учатся говорить, ходить, сливаться и переключать внимание с предметами и другими людьми, и неудивительно, что этот возраст будет самым сложным с диагностической точки зрения.Когда дети ясельного возраста с признаками РАС были включены в расчет в возрасте 12, 14 и 16 месяцев, коэффициенты стабильности увеличились до 0,70 в 12 месяцев, 0,85 в 14 месяцев и 0,94 в 16 месяцев. Этот вывод, вероятно, связан с возможностью того, что ASD является размерным, а не категориальным расстройством 38 , 39 , и строгие границы отсечения, определенные DSM , могут искусственно повлиять на результаты.
Наше исследование также показало, что дети ясельного возраста с диагнозом LD при их первом посещении в большинстве случаев переходили на тестирование в пределах типичного диапазона к 3–4 годам.Такие преходящие случаи LD обычно отмечались в литературе. 25 Малыши, у которых наблюдалась LD, были направлены на немедленное лечение и, как правило, получали от 1 до 2 часов в неделю логопедом. Наше исследование не было разработано для того, чтобы определить, влияет ли такое раннее лечение на скорость, с которой малыши догоняют ребенка к тому времени, когда им ставится окончательный диагноз. Другая возможность состоит в том, что психометрический тест, который мы использовали (Шкала раннего обучения Маллена), может быть менее надежным в очень молодом возрасте.
Не следует недооценивать важность понимания диагностической стабильности РАС в общей популяции, когорте, установленной сообществом, особенно когда ранний скрининг, начиная с 18 месяцев, рекомендован Американской академией педиатрии, 40 , но большинство скрининговых исследований 9 , 10,41 , 42 подтверждают диагноз только один раз, обычно примерно в возрасте скрининга, оставляя неясным, в какой степени первоначальный диагноз сохраняется в более позднем возрасте.Хотя это не было скрининговым исследованием, и в когорте было примерно 25% случаев, направленных из сообщества, большинство случаев РАС было выявлено с помощью инструмента широкополосного скрининга, Контрольного списка шкал коммуникации и символического поведения для младенцев и малышей, 43 , проводимых в хорошо посещения ребенка.
В этом исследовании с размером выборки 1269 детей ясельного возраста из общей популяции, каждый из которых прошел несколько оценочных посещений, в результате чего было получено в общей сложности более 3000 оценочных посещений, мы обнаружили, что 105 (23.8%), которым в конечном итоге был поставлен диагноз РАС в возрасте от 3 до 4 лет, изначально был пропущен РАС во время первого оценочного визита. Этот процент значительно ниже, чем от 50% до 80% поздних выявленных случаев РАС, о которых сообщалось в исследованиях братьев и сестер младенцев. 17 , 18 Среди пациентов с поздним выявлением РАС у 45 (42,8%) изначально предполагалось наличие только LD. То есть врачи сосредоточили свое внимание на задержках в речи ребенка, а не на субклинических задержках в обществе. Этот вывод согласуется с исследованием младенческих братьев и сестер 17 , в котором сообщалось о более низких, чем ожидалось, языковых баллах по шкале Маллена для раннего обучения в их поздно идентифицированной группе.
Одним из ограничений нашего исследования было то, что врачи, поставившие окончательный диагноз, не были замаскированы под предыдущие диагнозы. Отсутствие маскировки объясняется тем, что процедуры и критерии DSM-5 требуют учета исторической информации о симптомах РАС. Хотя маловероятно, но возможно, что обзор этой информации мог склонить психологов к предвзятости в пользу повышения диагностической стабильности. Свидетельством этому является относительно слабая диагностическая стабильность, обнаруженная в других группах задержки.
Расстройство аутистического спектра — распространенное заболевание, которое начинается в пренатальной жизни. 2 Из-за этого существует потребность в раннем выявлении, вмешательстве и услугах, 5 , и, в ответ, значительные усилия и финансирование были вложены в открытие методов универсального скрининга, выявления и диагностики в раннем возрасте. Следовательно, когда РАС не обнаруживается у младенца или ребенка ясельного возраста, это, вероятно, потому, что оно было пропущено. 20 Наши результаты показывают, что обнаружение и диагностика РАС можно надежно начать уже в 14 месяцев.Наша следующая задача — определить лучшие методы лечения и степень, в которой такое раннее вовлечение приносит пользу малышам и их семьям в долгосрочной перспективе.
Принято к публикации: 15 января 2019 г.
Открытый доступ: Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии CC-BY. © 2019 Pierce K et al. JAMA Педиатрия .
Опубликовано в Интернете: 29 апреля 2019 г. doi: 10.1001 / jamapediatrics.2019.0624
Исправление: Эта статья была исправлена 24 июня 2019 г., чтобы исправить опечатку в абстрактных результатах.
Автор, ответственный за переписку: Карен Пирс, доктор философии, факультет неврологии, Калифорнийский университет, Сан-Диего, 8110 La Jolla Shores Dr, La Jolla, CA ([email protected]).
Вклад авторов: Доктор Пирс имел полный доступ ко всем данным и несет ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Pierce, Bacon, Courchesne.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Пирс, Налаболу, Мур, Куршен.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Пирс, Газестани, Бэкон, Картер Барнс, Ча, Лопес, Пенс-Стофаэрос, Куршен.
Статистический анализ: Газестани.
Получено финансирование: Пирс, Куршен.
Административная, техническая или материальная поддержка: Bacon, Carter Barnes, Cha, Nalabolu, Lopez, Moore, Pence-Stophaeros, Courchesne.
Надзор: Пирс, Куршен.
Раскрытие информации о конфликте интересов: О раскрытии информации не сообщалось.
Финансирование / поддержка: Эта работа была поддержана грантом NNF10CC1016517 от Фонда Ново Нордиск через Центр биологической устойчивости Датского технического университета (д-р Газестани), гранты R01 Mh204446 и R01-MH080134 Национального института психического здоровья ( Д-р Пирс), грант Национального фонда исследований аутизма (д-р Пирс), грант P50-MH081755 от Национального института психического здоровья (д-р Courchesne) и грант Progenity (д-р Courchesne).
Роль спонсора / спонсора: Источники финансирования не играли роли в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Дополнительные материалы: Мы благодарим родителей и детей в Сан-Диего, которые участвовали в нашем исследовании. Педиатры и семейные врачи, работающие в различных медицинских группах, включая Калифорнийский университет, Сан-Диего, Sharp Rees-Stealy, Scripps, Rady-Children’s Primary Care Medical Group, Chula Vista Pediatrics, Graybill Medical Group, Grossmont Pediatrics, Linda Vista Health Care. Center, Mills Pediatrics, Служба здравоохранения Северного округа, San Diego Family Care и Sea Breeze Pediatrics оказали поддержку Get SET Early.
1. Байо Джей, Уиггинс L, Кристенсен DL, и другие. Распространенность расстройств аутистического спектра среди детей в возрасте 8 лет: Сеть мониторинга аутизма и нарушений развития, 11 сайтов, США, 2014 г. MMWR Surveill Summ . 2018; 67 (6): 1-23. DOI: 10.15585 / mmwr.ss6706a1PubMedGoogle ScholarCrossref 3.Miller М, Иосиф AM, Hill М, молодой GS, Швихтенберг AJ, Озонов С.Ответ на имя у младенцев, развивающих расстройство аутистического спектра: проспективное исследование. Дж. Педиатр . 2017; 183: 141-146, e141.
4. Ван MW, зеленый J, Эльсаббаг М, Джонсон М, Чарман Т, Пламмер F; БАЗИС Команда. Качество взаимодействия между младенцами из группы риска и опекуном в 12-15 месяцев связано с 3-летним исходом аутизма. J Детская психическая психиатрия . 2013; 54 (7): 763-771. DOI: 10.1111 / jcpp.12032PubMedGoogle ScholarCrossref 6.Пирс К., Картер C, Вайнфельд М, и другие. Выявление, изучение и лечение аутизма на ранней стадии: подход к годовому осмотру ребенка. Дж. Педиатр . 2011; 159 (3): 458-465, e451-e456.Google ScholarCrossref 7. Уэтерби AM, Броснан-Мэддокс S, мир V, Ньютон L. Проверка Контрольного списка для младенцев и малышей в качестве средства широкополосного скрининга расстройств аутистического спектра в возрасте от 9 до 24 месяцев. Аутизм . 2008; 12 (5): 487-511. DOI: 10.1177/1362361308094501PubMedGoogle ScholarCrossref 10. Робинс DL, Casagrande К., Бартон М, Чен CM, Дюмон-Матье Т, Фейн D. Валидация измененного контрольного списка для выявления аутизма у детей ясельного возраста, пересмотренного с последующим наблюдением (M-CHAT-R / F). Педиатрия . 2014; 133 (1): 37-45. DOI: 10.1542 / peds.2013-1813PubMedGoogle ScholarCrossref 12.Siu А.Л., Биббинс-Доминго К., Гроссман ОКРУГ КОЛУМБИЯ, и другие; Целевая группа превентивных служб США (USPSTF).Скрининг на расстройство аутистического спектра у детей раннего возраста: Рекомендация рабочей группы США по профилактическим услугам. ЯМА . 2016; 315 (7): 691-696. DOI: 10.1001 / jama.2016.0018PubMedGoogle ScholarCrossref 16.Baranek GT, Ватсон LR, Тернер-Браун L, и другие. Предварительная эффективность адаптированного отзывчивого обучения для младенцев с риском расстройства аутистического спектра в выборке сообщества. Лечение Аутизма . 2015; 2015: 386951.PubMedGoogle Scholar17.Ozonoff S, молодой GS, Ланда RJ, и другие.Диагностическая стабильность у маленьких детей из группы риска расстройств аутистического спектра: исследование консорциума по исследованию детей, братьев и сестер. J Детская психическая психиатрия . 2015; 56 (9): 988-998. DOI: 10.1111 / jcpp.12421PubMedGoogle ScholarCrossref 18. Zwaigenbaum L, Брайсон SE, Брайан J, и другие. Стабильность диагностической оценки расстройства аутистического спектра между 18 и 36 месяцами в когорте высокого риска. Autism Res . 2016; 9 (7): 790-800. DOI: 10.1002 / aur.1585PubMedGoogle ScholarCrossref 19.Лорд C, Раттер М., ДиЛавор ПК, Риси S, Готэм К., епископ SL. Модули с 1 по 4. В: График наблюдения при диагностике аутизма . 2-е изд. Торранс, Калифорния: западные психологические службы; 2012.
21. Бродер Фингерт С, Картер A, Пирс K, и другие. Внедрение системных инноваций для улучшения доступа к службам раннего скрининга, диагностики и лечения для детей с расстройствами аутистического спектра: исследование сети «Расстройство аутистического спектра в педиатрии, раннее выявление, участие и услуги». Аутизм . 2018; 1362361318766238.PubMedGoogle Scholar22.Mullen ЭМ. Весы Маллена для раннего обучения . Рочестер, Миннесота: American Guidance Service Inc; 1995.
23.Воробей С, Чиккетти Д, Балла D. Шкалы адаптивного поведения Вайнленда-II: Руководство по форме опроса . Серкл Пайнс, Миннесота: Американская служба гида; 2005.
24. Люистер R, Готэм К., Гатри W, и другие.Модуль «График наблюдения за аутизмом» для малышей: новый модуль стандартизированной диагностики расстройств аутистического спектра. Дж. Autism Dev Disord . 2009; 39 (9): 1305-1320. DOI: 10.1007 / s10803-009-0746-zPubMedGoogle ScholarCrossref 26.Anderson ДК, Лян JW, Господь C. Прогнозирование результатов для молодых взрослых среди более и менее когнитивно способных людей с расстройствами аутистического спектра. J Детская психическая психиатрия . 2014; 55 (5): 485-494. DOI: 10.1111 / jcpp.12178PubMedGoogle ScholarCrossref 28.Rogers SJ, Висмара L, Вагнер А.Л., Маккормик C, молодой G, Озонов S. Лечение аутизма в первый год жизни: пилотное исследование младенческого возраста, вмешательство родителей для младенцев с симптомами. Дж. Autism Dev Disord . 2014; 44 (12): 2981-2995. DOI: 10.1007 / s10803-014-2202-yPubMedGoogle ScholarCrossref 30.Estes А, Мансон J, Роджерс SJ, Гринсон J, зима J, Доусон ГРАММ.Отдаленные результаты раннего вмешательства у 6-летних детей с расстройством аутистического спектра. J Am Acad Детская подростковая психиатрия . 2015; 54 (7): 580-587. DOI: 10.1016 / j.jaac.2015.04.005PubMedGoogle ScholarCrossref 36.Svirsky Массачусетс, Теох SW, Neuburger H. Развитие речи и восприятия речи у врожденных глубоко глухих детей в зависимости от возраста при кохлеарной имплантации. Аудиол Нейроотол . 2004; 9 (4): 224-233. DOI: 10.1159 / 000078392PubMedGoogle ScholarCrossref 37.Мартинес М, Томас KC, Уильямс CS, и другие. Семейный опыт диагностики расстройства аутистического спектра: системные барьеры и факторы, способствующие эффективной диагностике. Дж. Autism Dev Disord . 2018; 48 (7): 2368-2378. DOI: 10.1007 / s10803-018-3493-1PubMedGoogle ScholarCrossref 40.Johnson CP, Майерс SM; Совет Американской академии педиатрии по делам детей с ограниченными возможностями. Выявление и оценка детей с расстройствами аутистического спектра. Педиатрия . 2007; 120 (5): 1183-1215. DOI: 10.1542 / peds.2007-2361PubMedGoogle ScholarCrossref 41.Charman Т, Бэрд G, Симонов E, и другие. Тестирование двух инструментов скрининга на расстройство аутистического спектра в общественных службах здравоохранения Великобритании.
 берцовая
берцовая
