Клиническая эффективность хондропротекторов в комплексной терапии остеоартроза коленных суставов | Пешехонова Л.К., Пешехонов Д.В., Кузовкина Т.Н.
В настоящее время обязательным компонентом комплексной терапии остеоартроза (ОА) являются хондропротекторы, так как патогенетическую основу этого заболевания составляет дисбаланс процессов синтеза и резорбции суставных тканей, преимущественно гиалинового хряща и субхондральной кости [8,11,14,21]. Деструкция хряща чаще обусловлена профессиональной деятельностью человека, перегрузками суставов, спортивными травмами, нарушением обмена веществ, а не возрастным изнашиванием суставов [4,6]. Таким образом, ОА называется гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [1,8].
ОА имеет значительную распространенность, особенно в старших возрастных группах, где частота его встречаемости превышает 50% [20].
По современным представлениям, в основе ОА лежит множество эндогенных и экзогенных факторов. К первым соответственно относятся возраст, пол, дефекты развития, наследственная предрасположенность, а ко вторым – травмы, профессиональная деятельность, спортивная активность и избыточная масса тела. Поскольку многие факторы риска не являются модифицируемыми, ОА имеет тенденцию к прогрессированию заболевания [1,4].
В настоящее время выделяют 2 основные формы ОА: первичный (локализованный или генерализованный) и вторичный (посттравматический, обусловленный врожденными, метаболическими, эндокринными и рядом других заболеваний) [9,12].

Таким образом, современная терапия ОА представляет собой сложную комплексную задачу, включающую коррекцию нагрузок, использование дополнительной опоры, снижение массы тела, увеличение силы мышц, в целом представляющую собой программу физической реабилитации, и медикаментозную терапию, направленную на уменьшение боли и увеличение подвижности суставов [5,15]. Безусловно, методики лечения ОА коленных суставов более сложны, что послужило основанием для формулирования международных рекомендаций специальной Комиссии постоянного комитета Европейской антиревматической лиги (EULAR) по международным клиническим исследованиям 2003 г. В соответствии с этими рекомендациями при лечении ОА коленных суставов необходимо учитывать наличие факторов риска (ожирение, нежелательные механические факторы, повышенную физическую активность), наличие общих факторов риска (возраст, сопутствующие заболевания, прием медикаментозных препаратов различных групп), выраженность болевого синдрома и функциональной недостаточности суставов, наличие признаков воспаления, в том числе синовита, локализацию и степень структурных повреждений [1,9].

По данным доказательной медицины и мнению международных экспертов EULAR, комплексная терапия ОА должна включать препараты замедленного действия (глюкозамин сульфат, хондроитин сульфат, неомыляемые соединения авокадо/сои, диацереин и гиалуроновую кислоту). Сущность этого принципиально нового подхода к лечению ОА обусловлена воздействием этой группы препаратов на метаболические процессы хрящевой ткани и регенерацию репаративных возможностей хондроцитов [5,10,13,22]. Использование хондроитина, глюкозамина и гиалуронана (ГЛ) осуществляется в клинической практике с начала 1980–х гг. В настоящее время накоплена значительная научная база, представленная десятками контролируемых исследований с высоким уровнем доказательности 1А–1В, по данным Американского колледжа ревматологов (ACR) 2000, 2005 [3,9].
В комплексную терапию ОА, как было сказано выше, необходимо включать нефармакологическое лечение с регулярным образовательными программами, физическими упражнениями, поддерживающими средствами (фиксаторами коленного сустава, ортезами, палочками) [12,16].
 К медикаментам симптоматического действия, способными устранять болевой синдром и понижать степень функциональной недостаточности, относятся парацетамол, нестероидные противовоспалительные препараты (НПВП), опиоидные анальгетики, местные аппликации с применением НПВП и капсаицина. При обострениях болевого синдрома в коленном суставе, особенно при наличии сопутствующего синовита, показаны внутрисуставные инъекции длительно действующих кортикостероидов [2,15,18].
К медикаментам симптоматического действия, способными устранять болевой синдром и понижать степень функциональной недостаточности, относятся парацетамол, нестероидные противовоспалительные препараты (НПВП), опиоидные анальгетики, местные аппликации с применением НПВП и капсаицина. При обострениях болевого синдрома в коленном суставе, особенно при наличии сопутствующего синовита, показаны внутрисуставные инъекции длительно действующих кортикостероидов [2,15,18].Лечение хондроитин сульфатом (ХС) оказывает существенное влияние на процессы метаболизма различных структур сустава, воздействуя практически на все основные патогенетические механизмы развития ОА [7,14,21].
 В первую очередь уменьшается гиперэкспрессия провоспалительных медиаторов, способствующих воспалительно–дегенеративным процессам в суставе и апоптозу хондроцитов, восполняющих синтез глюкозаминогликанов. Возможность ХС влиять на метаболизм хряща была продемонстрирована в годичном плацебо–контролируемом исследовании у больных ОА коленных суставов [22], при котором отмечалось достоверное снижение маркеров деградации хряща (кератан сульфата) и маркеров деструкции костной ткани (пиридинолина и дезоксипиридинолина). Не менее значим и симптом–модифицирующий эффект ХС, зарегистрированный как уменьшение боли по сравнению с монотерапией НПВП и улучшение функциональной способности суставов [22].
В первую очередь уменьшается гиперэкспрессия провоспалительных медиаторов, способствующих воспалительно–дегенеративным процессам в суставе и апоптозу хондроцитов, восполняющих синтез глюкозаминогликанов. Возможность ХС влиять на метаболизм хряща была продемонстрирована в годичном плацебо–контролируемом исследовании у больных ОА коленных суставов [22], при котором отмечалось достоверное снижение маркеров деградации хряща (кератан сульфата) и маркеров деструкции костной ткани (пиридинолина и дезоксипиридинолина). Не менее значим и симптом–модифицирующий эффект ХС, зарегистрированный как уменьшение боли по сравнению с монотерапией НПВП и улучшение функциональной способности суставов [22]. Особое место среди хондропротекторов занимают препараты гиалуроновой кислоты – гиалуронана (ГЛ), так как эти препараты вводятся в пораженные суставы [2,3,17]. Высокая частота поражения коленных суставов при ОА определяет необходимость дифференцированного подхода к назначению хондропротекторов: при полиостеоартрозе – системное назначение хондроитина и глюкозамина, а при локальных формах – ГЛ [3,19].

Гиалуронан в комбинации с коллагеном является основным компонентом протеогликана, то есть биополимера соединительной ткани (рис. 2).
Протеогликану присуща способность образовывать твердую среду гиалинового хряща. ГЛ обладает уникальными вязко–эластичными свойствами, присутствуя на поверхности суставного хряща и синовиальной оболочки, действует как любрикант и поглотитель механических сотрясений (рис. 2).
Гиалуронан, помимо любрикантных и демпферных свойств, используется хондроцитами в процессе синтеза протеогликанов гиалинового хряща [13]. Так, на рисунке 3 показаны функциональные и метаболические взаимосвязи синовиальной жидкости и суставного хряща, хондроцитами и хрящевым матриксом, где ведущая роль принадлежит гиалуронану. При остеоартрозе концентрация ГЛ снижается, молекулы синовиальной гиалуроновой кислоты укорачиваются, что уменьшает вязкость синовиальной жидкости (рис. 3).
Таким образом, очевидно показание для введения в пораженный сустав препаратов гиалуронана [3].

В проведенном нами исследовании у больных гонартрозом изучалась клиническая эффективность и переносимость комплексной терапии ОА ХС (как системным хондропротектором) и внутрисуставно вводимым препаратом Синокром (препаратом гиалуронана) в течение 6 мес. В открытое клиническое исследование после предварительно подписанного информированного согласия были включены 60 амбулаторных больных (мужчин 15 и женщин 45) в возрасте 42–68 лет (табл. 1). Пациенты были разделены на 2 группы. Больные 1–й группы получали ХС 500 мг 2 раза/сут. в течение 1–го месяца и 250 мг 2 раза/сут. в течение последующих 5 мес. Больным 2–й группы, принимавшим ХС по той же схеме, дополнительно внутрисуставно трижды с интервалом в 1 неделю вводился Синокром. По показаниям больные обоих групп в индивидуально подобранных дозировках принимали НПВП (диклофенак 100 мг/сут. при отсутствии гастроэнтерологической патологии, мелоксикам 15 мг/сут. при наличии язвенного анамнеза).
 В обеих группах наблюдения преобладали 2 немодифицируемых фактора риска – наличие травмы в анамнезе и возрастной фактор, а также избыточная масса тела как модифицируемый фактор (рис. 4).
В обеих группах наблюдения преобладали 2 немодифицируемых фактора риска – наличие травмы в анамнезе и возрастной фактор, а также избыточная масса тела как модифицируемый фактор (рис. 4).У обследованных больных оценивалась боль по ВАШ (100 мм визуально–аналоговой шкалы) в покое и при ходьбе, утренняя скованность в минутах, определялась функциональная недостаточность суставов (по опроснику WOMAC), оценивался терапевтический эффект, по мнению больного и врача, а также нежелательные явления при проведении терапии. Клинические показатели наблюдались до начала терапии, через 3 и 6 мес.
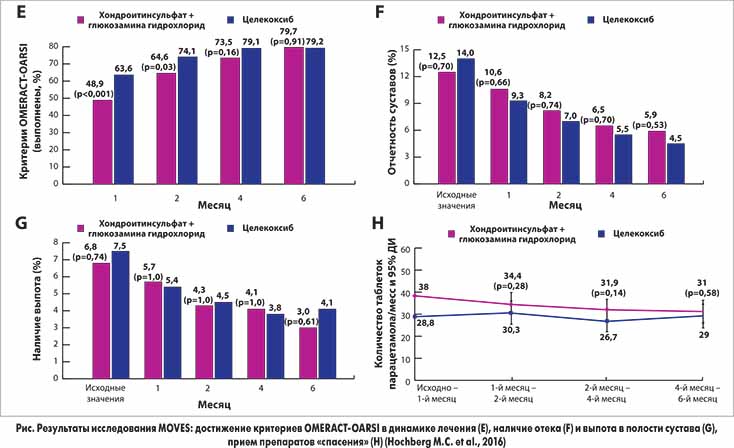
В результате проведенного исследования на фоне приема системной хондропротективной терапии ХС отмечалась положительная динамика при оценке болей по ВАШ как в покое, так и при ходьбе. Однако дополнительное внутрисуставное введение препарата Синокром через 3 мес. терапии показало статистически достоверное отличие от результатов динамики болевого синдрома в 1–й группе. На протяжении последующих 3 мес.
 анальгетический эффект пролонгировался дольше и также статистически достоверно отличался от результата пациентов в первой группе (рис. 5, 6).
анальгетический эффект пролонгировался дольше и также статистически достоверно отличался от результата пациентов в первой группе (рис. 5, 6).Наблюдаемая нами динамика длительности утренней скованности у обследованных пациентов в группах наблюдения статистически достоверно не отличалась (табл. 2).
Для оценки функциональной активности больных нами изучалась динамика индекса WOMAC, которая была положительной у пациентов первой группы наблюдения, получавших системную терапию ХС. В то же время у больных ОА 2–й группы стабилизация состояния и расширение функциональных возможностей наблюдались с 3–го месяца комбинированной терапии, что обеспечивалось выраженным обезболивающим и противовоспалительным эффектом комплексной терапии, существенно и стойко оптимизировало функциональную активность (рис. 7).

Оценивая переносимость комплексной терапии в группах наблюдения, следует отметить, что она была хорошей и отменялась в связи с побочными эффектами в обеих группах наблюдения. У 2 больных 1–й группы и у одной больной 2–й группы отмечались диспепсические явления, которые купировались коррекцией диеты, медикаменты не назначались.
По результатам проведенной терапии 6 больных (20%) 1–й группы и 10 больных (33,33%) 2–й группы смогли полностью отказаться от НПВП.
Таким образом, больным ОА необходимо включать в комплексную терапию хондропротекторы группы хондроитин сульфата и при локализованном поражении дополнительно вводить Синокром, так как указанными медицинскими препаратами обеспечивается эффективное воздействие на критические звенья патогенеза, болевой синдром и выраженность функциональной недостаточности.
Литература
1. Алексеева Л.И., Цветкова Е.С. Остеоартроз: из прошлого в будущее // Научно–практическая ревматология. №2. 2009, приложение. С. 31–37.
№2. 2009, приложение. С. 31–37.
2. Бадокин В.В., Годзенко А.А., Корсакова Ю.Л. Локальная терапия остеоартроза // Лечащий врач. №10. 2007. С. 2–4.
3. Беленький А.Г. Препараты гиалуронана в лечении остеоартроза коленного и тазобедренного суставов Учебное пособие ГОУ ДПО РМАПО Росздрава от 23.04.2007.
4. Берглезов М.А., Андреева Т.М. Остеоартроз (этиология, патогенез) // Вестник травматологии и ортопедии им. Н.Н. Приорова.– 2006.– №4.– С. 79–86.
5. Везикова Н.Н. Оценка эффективности болезнь–модифицирующих препаратов и локальных методов терапии при остеоартрозе коленных суставов. Автореф. дисс. докт. мед. наук. Ярославль, 2005. 30 с.
6. Верткин А.Л., Алексеева Л.И., Наумов А.В. и др. Остеоартроз в практике врача–терапевта // РМЖ. 2008. Т.16. №7. С. 478–480.
7. Горячев Д.В. Место препаратов хондроитин сульфата в арсенале средств для лечения остеартроза // РМЖ. Т.16. №10, 2008. С. 3–7.
8. Клиническая ревматология. СПб., 2005. С. 386–388.
С. 386–388.
9. Клинические рекомендации. Остеоартрит. Диагностика и ведение больных остеоартритом коленных и тазобедренных суставов / Под ред. О.М. Лесняк.– М.: ГЭОТАР–Медиа, 2006. 176 с.
10. Насонова В.А., Алексеева Л.И. Архангельская Г.С. и др. Итоги многоцентрового клинического исследования препарата Структум в России. Новые возможности в лечении остеоартроза и остеохондроза. М., 2006. С. 5–7.
11. Насонова В.А., Эрдес Ш.Ф. О всемирной декаде костно–суставных заболеваний 2000–2010 // Научно–практическая ревматология. 2004. №4. С. 14–16.
12. Национальное руководство. Ревматология / Под ред. Е.Л. Насонова, В.А. Насоновой.– М.: ГЭОТАР–Медиа, 2008. С. 573–588.
13. Павлова В.Н., Капьева Т.Н., Слуцкий Л.И., Павлов Г.Г. Хрящ. М.: Медицина, 1998. 320 с.
14. Проценко Г.А. Хондропротекторы в комплексном лечении деформирующего артроза. Тезисы III съезда ревматологов. Научно–практическая ревматология, 2001. №3. С.98.
15. Рациональная фармакотерапия ревматических заболеваний. М., 2003. Т.3. С. 143–149.
М., 2003. Т.3. С. 143–149.
16. Руководство для врачей. Школа здоровья. Остеоартрит / Под ред. О.М. Лесняк.– М.: ГЭОТАР–Медиа, 2008.– С.81–89.
17. Салихов И.Г., Волкова Э.Р., Якупова С.П. Периартикулярное применение хондропротекторов у больных гонартрозом с признаками поражения сухожильно–связочного аппарата // Consislium medicum. 2006. Т.8. №2. С.59–61.
18. Условия и требования к внутрисуставному и периартикулярному введению ГКС препаратов (метод. указания МЗ РФ №2001/25). М., 2001.
19. Цурко В.В. Местное лечение суставного синдрома при остеартрозе: рациональный выбор препарата и лекарственной формы // Справочник поликлинического врача. №8. 2006. С. 3–8.
20. Цурко В.В. Остеоартроз: гериатрическая проблема // РМЖ. Т.13. №24. 2005. С. 1627–1631.
21. Чичасова Н.В. Место медленнодействующих препаратов в рациональной терапии деформирующего остеоартроза // Consislium medicum. 2005. Т.7. №8. С. 634–638.
22. Чичасова Н.В. Хондроитин сульфат (Структум) в лечении остеоартроза: патогенетическое действие и клиническая эффективность // РМЖ. Т.17. №3. 2009. С. 3–7.
Т.17. №3. 2009. С. 3–7.
Помогут ли хондропротекторы вашим суставам?
Если вы пользуетесь Telegram, обязательно подпишитесь на канал Ногибоги. Там мы делимся не только ссылками на собственные статьи, но и советами, мотивационными историями и интересными фактами. Короче, у нас нескучно.
Хондропротекторы (под которыми обычно понимают глюкозамин и хондроитин) — биологически активная добавка к пище, которая, по обещаниям производителей, проникает в суставной хрящ, уменьшая боль и замедляя его деградацию.
Физиология суставов
Здесь будет даже не физиология, а гистология — нас интересует, как устроены хрящевые ткани, из чего они состоят, как питаются и регенерируют.
Суставные поверхности (для восстановления которых и пьют хондропротекторы) покрыты гиалиновым хрящом. Его основные компоненты — клетки (хондроциты и хондробласты) и аморфное вещество, состоящее из коллагеновых нитей и протеогликановых агрегатов (гиалуроновая кислота + белки). В здоровом хряще также содержится до 7% минеральных веществ.
В здоровом хряще также содержится до 7% минеральных веществ.
Клетки хряща закладываются в эмбриональном периоде — в это время преобладают хондробласты, способные активно делиться. Далее хондробласты специализируются в хондроциты, которые активно производят межклеточное аморфное вещество. Небольшое количество хондробластов сохраняется и у взрослых людей, обеспечивая регенерацию хрящей.
В суставном хряще отсутствуют сосуды, и все питательные вещества он получает путём диффузии из окружающих тканей и синовиальной (суставной) жидкости.
С возрастом, при постоянном травмировании или заболеваниях суставов, аморфное вещество хряща начинает разрушаться и истончаться, количество минеральных веществ в хряще — увеличиваться, а воды — уменьшаться.
То есть суставной хрящ может обновиться, только если хондроциты произведут новое аморфное вещество, которое состоит из коллагена, гиалуроновой кислоты, белков и олигосахаридов.
К сожалению, возможности хондроцитов очень ограничены, и полное восстановление повреждённых хрящей невозможно.
- Замедлить или в идеале остановить разрушение хряща — да, можно.
- Заживить повреждение после травмы — возможно за счёт увеличения в размерах оставшихся неповреждёнными хондроцитов.
- А вот вернуть всё как было или полностью восстанавливаться при постоянном травмировании — увы, нет.
Почему хондропротекторы не работают
Согласно инструкции одного из топовых хондропротекторов, 12% вещества таблетки всасывается в кишечнике, и 25% из всосавшегося проникает в ткани сустава.
Что же говорят исследования? Здесь разные химические формы глюкозамина пометили радиоактивным углеродом, после чего их вводили инъекционно и давали в виде таблеток крысам. Максимальная концентрация в плазме при пероральном введении была 1.7% для одной из форм, для остальных — в плазме оказывались следовые количества.
Да, при инъекционном введении поступление в плазму доходило до 12%, но вряд ли вы будете полгода каждый день колоть себе глюкозамин.
А всё потому, что наш кишечник не просто перекладывает питательные вещества из еды в кровь.
 Там происходит куча довольно сложных процессов: вещества расщепляются до элементарных составляющих, преобразуются, подвергаются воздействию микрофлоры, и только после этого поступают в кровоток. Поэтому от глюкозамина из таблетки остаётся очень немного.
Там происходит куча довольно сложных процессов: вещества расщепляются до элементарных составляющих, преобразуются, подвергаются воздействию микрофлоры, и только после этого поступают в кровоток. Поэтому от глюкозамина из таблетки остаётся очень немного.Ещё одна группа исследователей зашла с другой стороны и внесла глюкозамин в культуру хондроцитов в пробирке. По их результатам, даже при концентрации глюкозамина в 4–7 раз выше той, которая может быть достигнута в организме, всего 9% глюкозамина поступило в клетки извне, остальные 91% были синтезированы в хондроцитах из глюкозы. Также такая высокая концентрация глюкозамина не стимулировала производство хондроитина в клетках.
Но есть же люди, которым помогло!
Да! И тут есть несколько факторов.
Первый — эффект плацебо, которому подвержены порядка 30% людей. А как недавно доказали — дорогие плацебо работают ещё лучше.
Второе: вполне вероятно, что человек, которого беспокоят боли в суставах, кроме приёма хондропротекторов, поменял диету и образ жизни — а как раз эти два фактора очень даже влияют на течение заболеваний суставов.
Исследования с позитивными результатами тоже есть. Вот несколько обзоров публикаций: раз, два, три, четыре, пять. Все они отмечают некоторую клиническую эффективность хондропротекторов, однако соотношение цена-результат, по словам учёных, сомнительное.
В исследованиях, где хондропротекторы были эффективными, они показали только некоторое уменьшение боли. Ширина суставной щели, маркеры воспаления, индексы повреждения сустава не менялись. В одном из исследований показано, что для лучшего результата желательно разбивать суточную дозу на несколько приёмов.
Вот для сравнения несколько обзоров, в которых хондропротекторы вообще не отличались от плацебо по эффективности: раз, два, три, четыре.
Основная проблема с исследованиями хондропротекторов — большинство из них финансируют производители хондропротекторов. Конечно, в таких публикациях результаты более обнадёживающие.
Но при том огромном количестве исследований, с разным дизайном, разными формами введения и химическими формулами — если бы они работали — это бы заметили уже давно.
Тем более, обычно современные исследования показывают лучшие результаты благодаря совершенствованию техники, методов обследования, применению новых схем исследований. С хондропротекторами ничего не поменялось, результативность остаётся сомнительной.
А есть ли альтернативы?
Во-первых, это полноценное и разнообразное питание (чтобы хондроциты получили всё нужное для синтеза аморфного вещества хряща) и правильные нагрузки (при которых сустав работает, но не травмируется).
Довольно перспективен обычный желатин. Он состоит из животного коллагена (да, веганы не одобрят, и агар-агар не заменит, если что).
Вот здесь доказали, что регулярное употребление 4.5 г желатина (неполная чайная ложка) увеличивает концентрацию гидроксипролина (составной части коллагена) в крови. Регулярное — это каждый день в течение 4 недель. Заодно и состояние кожи улучшится, ей тоже нужен коллаген.
Вот ещё одно исследование, которое признаёт коллаген потенциальным лекарством для остеоартрита.
Среди большинства применяемых сейчас биодобавок желатин по эффективности находится где-то между глюкозамином и хондроитином (но учитывая цену, можно его передвинуть повыше).
Действительно работающими признаны Пикногенол и экстракт Boswellia serrata (есть в аптеках). У куркумина и MSM (Methylsulfonylmethane) тоже есть исследования с положительным эффектом, но сами исследования довольно сомнительны. Остальные биодобавки — между сомнительными и совсем неработающими.
Зато хороший эффект показывают регулярные упражнения (с чем у читателей, скорее всего, нет проблем) и при необходимости — снижение веса. И никакой побочки!
Так пить или не пить?
Если у вас есть свободные 1.5–3 тысячи гривен и большое желание позаботиться о своих суставах — почему бы и нет? Побочных эффектов у хондропротекторов практически нет, а улучшение, возможно, будет.
Если у вас сахарный диабет или нарушение толерантности к глюкозе — будьте осторожны, глюкозамин может менять эту самую толерантность в непредсказуемом направлении.
Если всё же хочется позаботиться о суставах, но свободных 3 тысяч нет — ешьте желатин, который обойдётся вам примерно в 60 грн в месяц или 180 — за трёхмесячный курс. По полезности он как раз между глюкозамином и хондроитином.
Если хочется заботиться о суставах доказательно — купите Пикногенол или экстракт Босвеллии зубчатой.
Обращайте внимание на своё состояние при приёме любых биодобавок. Эффект, если он будет, должен обязательно появиться к 3–4 неделе. Не появился — бросайте, для вас это не работает, и пустая трата денег.
И обязательно регулярно занимайтесь спортом и следите за своим весом — это самые эффективные и доступные способы профилактики проблем с суставами.
Что еще почитать:
- Несколько фактов о коленях, которые вам стоит знать
- Какие БАДы работают и могут быть полезны тем, кто занимается спортом
- Помогает ли коллаген в добавках от морщин и болей в суставах
- Гид по спортпиту и добавкам для бегунов: аминокислоты
Хондропротекторы: они работают? (Процедуры)
000″> 1 ноября 2010 г.
Лара К. Максвелл, DVM, PhD, DACVCP
Хондропротекторы доступны в виде инъекционных и пероральных форм. Инъекционные формы классифицируются как лекарственные препараты и регулируются FDA. Настоящее обсуждение будет сосредоточено на более туманной ветви хондропротекторов, нутрицевтиках.
Регламент: Хондропротекторы доступны в виде инъекционных и пероральных форм. Инъекционные формы классифицируются как лекарственные препараты и регулируются FDA. Настоящее обсуждение будет сосредоточено на более туманной ветви хондропротекторов, нутрицевтиках. Пероральные составы считаются нутрицевтиками, термин несколько плохо определенный, используемый для описания соединений, поставляемых экзогенно для облегчения нормальных функций и структур организма. Человеческие и ветеринарные нутрицевтики рассматриваются несколько по-разному, поскольку человеческие соединения классифицируются как пищевые добавки в соответствии с 1994 Закона о пищевых добавках, здравоохранении и образовании (DSHEA), в то время как ветеринарные составы исключены из DSHEA. Поскольку DSHEA разъяснил регулирование нутрицевтиков для человека, отсутствие охвата DSHEA ветеринарных продуктов оставило статус регулирования ветеринарных нутрицевтиков в подвешенном состоянии. Законы штата о кормах могут регулировать большинство продуктов, но большинство продуктов не указаны в списке продуктов, которые Ассоциация американских чиновников по контролю за кормами (AAFCO) «в целом признает безопасными» (GRAS). Как нерегулируемые продукты, нутрицевтики не обязаны соответствовать рекомендациям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в отношении эффективности, чистоты и действенности. Точно так же производители добавок не обязаны следовать надлежащим производственным процедурам (GMP), что приводит к продаже продуктов, которые могут отличаться от заявленных ингредиентов дозой. Тем не менее, как людям, так и ветеринарным нутрицевтикам запрещено делать заявления, которые представляют добавку как лекарство. В соответствии с Законом о пищевых продуктах, лекарствах и косметических средствах лекарство «предназначено для использования в диагностике, лечении, смягчении последствий, лечении или профилактике заболеваний».
Поскольку DSHEA разъяснил регулирование нутрицевтиков для человека, отсутствие охвата DSHEA ветеринарных продуктов оставило статус регулирования ветеринарных нутрицевтиков в подвешенном состоянии. Законы штата о кормах могут регулировать большинство продуктов, но большинство продуктов не указаны в списке продуктов, которые Ассоциация американских чиновников по контролю за кормами (AAFCO) «в целом признает безопасными» (GRAS). Как нерегулируемые продукты, нутрицевтики не обязаны соответствовать рекомендациям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в отношении эффективности, чистоты и действенности. Точно так же производители добавок не обязаны следовать надлежащим производственным процедурам (GMP), что приводит к продаже продуктов, которые могут отличаться от заявленных ингредиентов дозой. Тем не менее, как людям, так и ветеринарным нутрицевтикам запрещено делать заявления, которые представляют добавку как лекарство. В соответствии с Законом о пищевых продуктах, лекарствах и косметических средствах лекарство «предназначено для использования в диагностике, лечении, смягчении последствий, лечении или профилактике заболеваний». Таким образом, в соответствии с DSHEA нутрицевтики могут заявлять на своих этикетках, что они поддерживают нормальную структуру и функции организма, но не могут делать заявления относительно смягчения или предотвращения заболеваний. Это требование к маркировке несколько противоречит тому, как чаще всего используются нутрицевтические хондропротекторы, когда ветеринарные пациенты могут получать эти средства в попытке замедлить прогрессирование остеоартрита и уменьшить боль.
Таким образом, в соответствии с DSHEA нутрицевтики могут заявлять на своих этикетках, что они поддерживают нормальную структуру и функции организма, но не могут делать заявления относительно смягчения или предотвращения заболеваний. Это требование к маркировке несколько противоречит тому, как чаще всего используются нутрицевтические хондропротекторы, когда ветеринарные пациенты могут получать эти средства в попытке замедлить прогрессирование остеоартрита и уменьшить боль.
Действие хондропротекторов: Существует несколько различных типов и классов нутрицевтиков, предположительно воздействующих на хрящи и суставы. Хондропротекторные агенты иногда называют медленно действующими, модифицирующими болезнь агентами против остеоартрита (SADMOA). Многочисленные другие агенты, такие как зеленогубая мускулатура, неомыляемые соединения авокадо/сои, полисульфат пентозана, специальный концентрат молочного белка и бархатный пант лося, также были продвинуты в качестве потенциальных хондропротекторных агентов. Однако из-за нехватки места настоящее обсуждение будет ограничено наиболее часто используемыми агентами, глюкозамином и хондротинсульфатом. . Считается, что агенты SADMOA способствуют синтезу гиалинового хряща, который представляет собой смесь коллагенов, протеогликанов и воды. Вода в хряще является важным компонентом амортизации при нагрузке на сустав и притягивается к хрящу макромолекулами протеогликана. Протеогликан на самом деле представляет собой сложную смесь более мелких компонентов, таких как несколько гликозаминогликанов, хондроитинсульфат и кератинсульфат, прикрепленных к ядру белка и гиалуроновой кислоты. Глюкозамин и хондроитинсульфат являются двумя строительными блоками, включенными в состав суставных протеогликанов, поэтому их добавляют в надежде, что избыточное количество циркулирующих предшественников будет способствовать формированию гиалинового хряща. Другие пероральные нутрицевтики, такие как марганец и аскорбат, вводят в качестве кофакторов для синтеза протеогликанов и коллагена.
Однако из-за нехватки места настоящее обсуждение будет ограничено наиболее часто используемыми агентами, глюкозамином и хондротинсульфатом. . Считается, что агенты SADMOA способствуют синтезу гиалинового хряща, который представляет собой смесь коллагенов, протеогликанов и воды. Вода в хряще является важным компонентом амортизации при нагрузке на сустав и притягивается к хрящу макромолекулами протеогликана. Протеогликан на самом деле представляет собой сложную смесь более мелких компонентов, таких как несколько гликозаминогликанов, хондроитинсульфат и кератинсульфат, прикрепленных к ядру белка и гиалуроновой кислоты. Глюкозамин и хондроитинсульфат являются двумя строительными блоками, включенными в состав суставных протеогликанов, поэтому их добавляют в надежде, что избыточное количество циркулирующих предшественников будет способствовать формированию гиалинового хряща. Другие пероральные нутрицевтики, такие как марганец и аскорбат, вводят в качестве кофакторов для синтеза протеогликанов и коллагена.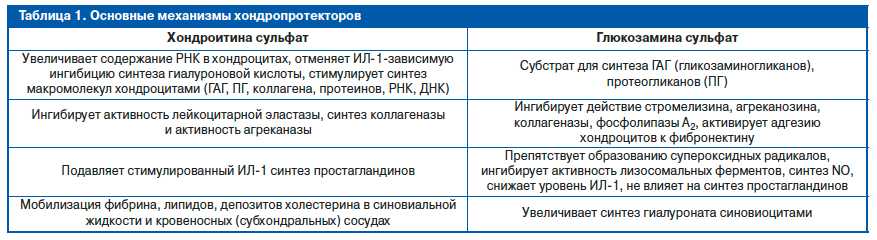 Поскольку катаболизм гиалинового хряща участвует в патогенезе остеоартрита, можно ожидать, что переход от катаболических к анаболическим эффектам улучшит функцию суставов и уменьшит боль, связанную с остеоартритом. Хотя эта цепочка рассуждений обеспечивает рациональное объяснение эффективности пероральных хондропротекторов, исследований in vitro показывают, что другие механизмы, такие как нейтрализация свободных радикалов и прямое противовоспалительное действие, также могут быть вовлечены в хрондропротекцию. Многочисленные исследований in vitro выявили положительное анаболическое и противовоспалительное действие дисахаридов глюкозамина и хондроитина на эксплантаты или клеточные культуры хондроцитов. Противовоспалительные эффекты включают блокаду интерлейкинов, снижение продукции простагландинов, ингибирование металлопротеиназ и снижение количества активных форм кислорода, возможно, сдерживаемое ингибированием ядерной транслокации NF-каппа B1. Эти in vitro исследований в значительной степени впечатляют и демонстрируют рациональный механизм действия SADMOA при модулировании остеоартрита.
Поскольку катаболизм гиалинового хряща участвует в патогенезе остеоартрита, можно ожидать, что переход от катаболических к анаболическим эффектам улучшит функцию суставов и уменьшит боль, связанную с остеоартритом. Хотя эта цепочка рассуждений обеспечивает рациональное объяснение эффективности пероральных хондропротекторов, исследований in vitro показывают, что другие механизмы, такие как нейтрализация свободных радикалов и прямое противовоспалительное действие, также могут быть вовлечены в хрондропротекцию. Многочисленные исследований in vitro выявили положительное анаболическое и противовоспалительное действие дисахаридов глюкозамина и хондроитина на эксплантаты или клеточные культуры хондроцитов. Противовоспалительные эффекты включают блокаду интерлейкинов, снижение продукции простагландинов, ингибирование металлопротеиназ и снижение количества активных форм кислорода, возможно, сдерживаемое ингибированием ядерной транслокации NF-каппа B1. Эти in vitro исследований в значительной степени впечатляют и демонстрируют рациональный механизм действия SADMOA при модулировании остеоартрита. Однако в большинстве исследований in vitro использовались гораздо более высокие концентрации дисахаридов глюкозамина и хондроитина, чем обнаруживаются в плазме после перорального приема, что усложняет непосредственную применимость этих исследований к клинической эффективности.
Однако в большинстве исследований in vitro использовались гораздо более высокие концентрации дисахаридов глюкозамина и хондроитина, чем обнаруживаются в плазме после перорального приема, что усложняет непосредственную применимость этих исследований к клинической эффективности.
Пероральное всасывание хондропротекторов: Фармакокинетические исследования и исследования эффективности были описаны в рецензируемой литературе как для человека, так и для ветеринарии для нескольких из этих агентов, демонстрирующих абсорбцию и активность. SADMOA обычно имеют ограниченную пероральную абсорбцию в виде интактной молекулы вследствие своей структуры. Например, хондроитинсульфат и протеогликаны представляют собой большие заряженные макромолекулы, поэтому они не всасываются в неизменном виде. Однако хондроитинсульфат легко расщепляется на отдельные дисахариды, которые могут обнаруживаться в повышенных концентрациях в плазме после перорального приема у собак. Выведение хондроитиндисахаридов происходит медленнее, чем глюкозамина, при этом накопление происходит при введении нескольких доз. Хотя медленное накопление хондроитина может частично объяснить отсроченное начало действия SADMOA, предполагаемый механизм синтеза хряща, предложенный 9Исследования 0009 in vitro также подтверждают медленное начало действия. Действительно, значительные улучшения у собак с остеоартритом, которым вводили глюкозамин и хондроитин, были зарегистрированы через 70 дней после начала приема добавок. 2 Дополнительные исследования с радиоактивно мечеными соединениями показали, что фрагменты хондроитина всасываются из желудочно-кишечного тракта и могут быть обнаружены в синовиальной жидкости и гиалине. хрящей, демонстрируя как абсорбцию, так и тропность к суставам. Глюкозамин представляет собой гораздо меньшую молекулу, чем хондроитин, и лучше всасывается из желудочно-кишечного тракта в неизмененном виде у изученных видов, в том числе у собак. В одном препарате глюкозамина HCl, вводимом перорально собакам, биодоступность была низкой (12%), но глюкозамин быстро всасывался, при этом максимальная концентрация в плазме достигалась через 1,5 часа.
Хотя медленное накопление хондроитина может частично объяснить отсроченное начало действия SADMOA, предполагаемый механизм синтеза хряща, предложенный 9Исследования 0009 in vitro также подтверждают медленное начало действия. Действительно, значительные улучшения у собак с остеоартритом, которым вводили глюкозамин и хондроитин, были зарегистрированы через 70 дней после начала приема добавок. 2 Дополнительные исследования с радиоактивно мечеными соединениями показали, что фрагменты хондроитина всасываются из желудочно-кишечного тракта и могут быть обнаружены в синовиальной жидкости и гиалине. хрящей, демонстрируя как абсорбцию, так и тропность к суставам. Глюкозамин представляет собой гораздо меньшую молекулу, чем хондроитин, и лучше всасывается из желудочно-кишечного тракта в неизмененном виде у изученных видов, в том числе у собак. В одном препарате глюкозамина HCl, вводимом перорально собакам, биодоступность была низкой (12%), но глюкозамин быстро всасывался, при этом максимальная концентрация в плазме достигалась через 1,5 часа. Хотя глюкозамин быстро метаболизируется до простых сахаров, экзогенно введенный глюкозамин также проявляет тропность к суставному хрящу, что может компенсировать его быстрый метаболизм.
Хотя глюкозамин быстро метаболизируется до простых сахаров, экзогенно введенный глюкозамин также проявляет тропность к суставному хрящу, что может компенсировать его быстрый метаболизм.
Исследования эффективности: Хондропротекторы, вероятно, изучены лучше всех пероральных нутрицевтиков. Хотя большинство этих исследований финансировалось производителями продукта, многочисленные исследования продемонстрировали положительный, хотя зачастую и умеренный эффект у пациентов с остеоартритом. К сожалению, исследования эффективности перорально вводимых агентов, которые проводились в ветеринарии, как правило, имеют небольшое количество субъектов и недостатки в дизайне исследований. Медленно действующий характер SADMOA еще больше усложняет их окончательное изучение. Большинство исследований было сосредоточено на совместном применении глюкозамина и хондроитинсульфата, часто с другими кофакторами, такими как метилсульфонилметан (МСМ). Глюкозамин представляет собой ионную молекулу, поэтому он представлен в виде соли HCl или сульфата. Хотя большинство эмпирических данных свидетельствуют о том, что идентичность соли не имеет клинического значения, существуют некоторые разногласия по этому поводу и мало прямых сравнений влияния состава на исход. В исследованиях использовались как объективные доказательства эффективности, такие как сцинтиграфическое улучшение индуцированного воспалительного заболевания суставов с использованием модели синовита, так и субъективное влияние на остеоартрит, по оценке ветеринаров и владельцев. Результаты эффективности добавок глюкозамина / хондроитина при остеоартрите у собак несколько неоднозначны, причем сами систематические обзоры различаются в зависимости от того, достаточно ли убедительны имеющиеся доказательства, чтобы рекомендовать добавки.
Хотя большинство эмпирических данных свидетельствуют о том, что идентичность соли не имеет клинического значения, существуют некоторые разногласия по этому поводу и мало прямых сравнений влияния состава на исход. В исследованиях использовались как объективные доказательства эффективности, такие как сцинтиграфическое улучшение индуцированного воспалительного заболевания суставов с использованием модели синовита, так и субъективное влияние на остеоартрит, по оценке ветеринаров и владельцев. Результаты эффективности добавок глюкозамина / хондроитина при остеоартрите у собак несколько неоднозначны, причем сами систематические обзоры различаются в зависимости от того, достаточно ли убедительны имеющиеся доказательства, чтобы рекомендовать добавки.
В нескольких исследованиях сравнивалась эффективность добавок глюкозамина/хондроитина для облегчения остеоартрита у собак с эффективностью нестероидных противовоспалительных препаратов (НПВП), таких как карпрофен и мелоксикам. в одном исследовании были обнаружены положительные эффекты, связанные с использованием нутрицевтиков, а в другом не сообщалось о пользе. Однако в обоих исследованиях НПВП эффективнее облегчали боль и хромоту. Этот результат свидетельствует о том, что, вероятно, следует избегать назначения монотерапии глюкозамином/хондроитином собакам с заметно болезненным остеоартритом. Хотя исследования, оценивающие эффективность совместного применения НПВП и SADMOA, отсутствуют, эмпирические данные свидетельствуют о том, что такая комбинация оправдана у болезненных собак с возможным отказом от НПВП после нескольких месяцев совместного приема. Безопасность такой комбинации не оценивалась. Однако SADMOA продемонстрировали очень низкую склонность к возникновению побочных эффектов, в основном ограничивающихся незначительным раздражением желудочно-кишечного тракта. Учитывая разные механизмы действия SADMOA и НПВП, маловероятно, что совместное применение этих двух препаратов для симптоматического обезболивания и хронопротекции вызовет побочные эффекты, помимо известных токсических эффектов, связанных с применением только НПВП у собак. Тем не менее, исследования, изучающие эффективность и безопасность комбинированного подхода, были бы полезны.
Однако в обоих исследованиях НПВП эффективнее облегчали боль и хромоту. Этот результат свидетельствует о том, что, вероятно, следует избегать назначения монотерапии глюкозамином/хондроитином собакам с заметно болезненным остеоартритом. Хотя исследования, оценивающие эффективность совместного применения НПВП и SADMOA, отсутствуют, эмпирические данные свидетельствуют о том, что такая комбинация оправдана у болезненных собак с возможным отказом от НПВП после нескольких месяцев совместного приема. Безопасность такой комбинации не оценивалась. Однако SADMOA продемонстрировали очень низкую склонность к возникновению побочных эффектов, в основном ограничивающихся незначительным раздражением желудочно-кишечного тракта. Учитывая разные механизмы действия SADMOA и НПВП, маловероятно, что совместное применение этих двух препаратов для симптоматического обезболивания и хронопротекции вызовет побочные эффекты, помимо известных токсических эффектов, связанных с применением только НПВП у собак. Тем не менее, исследования, изучающие эффективность и безопасность комбинированного подхода, были бы полезны.
Было опубликовано гораздо больше публикаций об эффективности нутрицевтиков на людях, но в литературе на людях часто присутствуют те же недостатки дизайна исследований, которые досаждают ветеринарным исследованиям. Метаанализы и систематические обзоры, в которых объединены и сравнены многочисленные более мелкие исследования, обнаружили умеренный лечебный эффект от введения глюкозамина и хондроитина. К сожалению, метаанализ также демонстрирует значительную неоднородность между результатами исследований, возможно, из-за таких факторов, как предвзятость публикаций, которые существуют в этих исследованиях, финансируемых промышленностью. Несмотря на эти недостатки, на людях было проведено несколько крупных, хорошо спланированных исследований, финансируемых государством. Например, исследование вмешательства глюкозамина/хондроитина при артрите (GAIT) финансировалось Национальным институтом здравоохранения, в нем приняли участие 1583 субъекта, и оно было разработано для окончательного определения того, является ли глюкозамина гидрохлорид, хондроитинсульфат или комбинация глюкозамина гидрохлорида и хондроитинсульфата эффективным.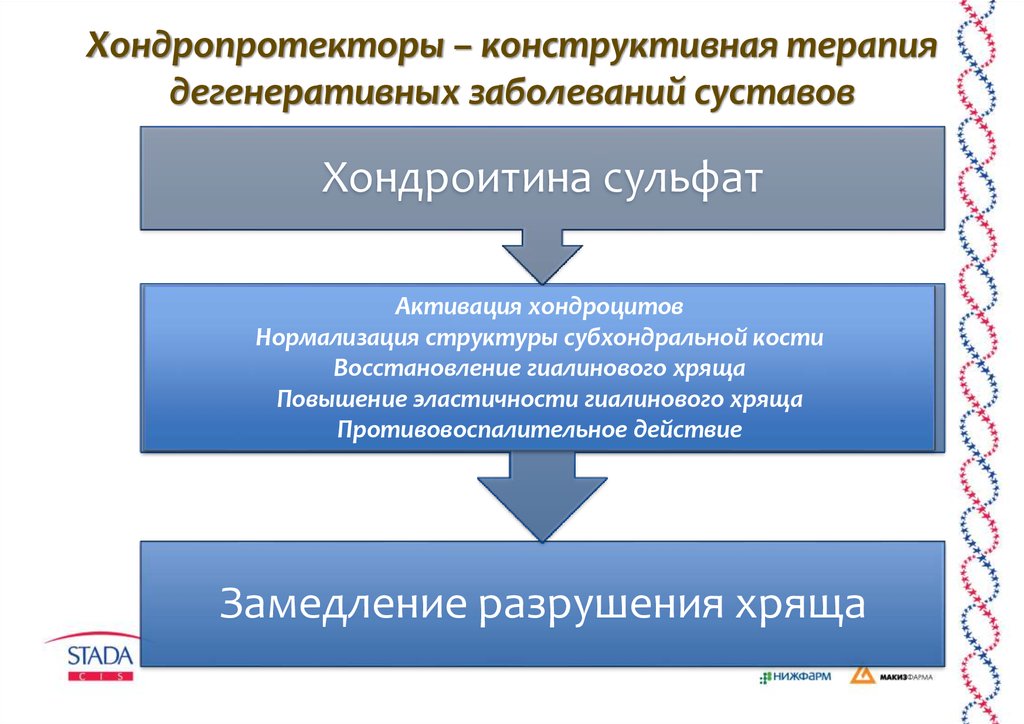 облегчал боль в суставах лучше, чем плацебо. 10 Субъекты были зарегистрированы с остеоартритом колена и получали рандомизированное лечение в течение шести месяцев. Интересно, что это исследование продемонстрировало необычайно высокий эффект плацебо: 60 % испытуемых, получавших плацебо, сообщили о 20 % уменьшении боли в суставах. У людей с легкой и умеренной болью результаты исследования GAIT были отрицательными в отношении изученных первичных конечных точек, хотя между группами лечения были различия для некоторых небольших подгрупп пациентов. Например, 79% пациентов в группе, получавшей глюкозамин в сочетании с хондроитином, которые начали лечение с умеренной или сильной боли, испытали уменьшение боли по крайней мере на 20% по сравнению с 54% пациентов в этой более сильной категории боли, которые получали плацебо. Вывод о том, что глюкозамин + хондроитин был более эффективен у пациентов с более выраженной болью по сравнению с теми, кто начал с более низких показателей боли, противоречит ожиданиям в отношении этой группы нутрицевтиков, которые, как ожидается, будут более эффективны в борьбе с более легким ранним остеоартритом, чем с более прогрессирующим.
облегчал боль в суставах лучше, чем плацебо. 10 Субъекты были зарегистрированы с остеоартритом колена и получали рандомизированное лечение в течение шести месяцев. Интересно, что это исследование продемонстрировало необычайно высокий эффект плацебо: 60 % испытуемых, получавших плацебо, сообщили о 20 % уменьшении боли в суставах. У людей с легкой и умеренной болью результаты исследования GAIT были отрицательными в отношении изученных первичных конечных точек, хотя между группами лечения были различия для некоторых небольших подгрупп пациентов. Например, 79% пациентов в группе, получавшей глюкозамин в сочетании с хондроитином, которые начали лечение с умеренной или сильной боли, испытали уменьшение боли по крайней мере на 20% по сравнению с 54% пациентов в этой более сильной категории боли, которые получали плацебо. Вывод о том, что глюкозамин + хондроитин был более эффективен у пациентов с более выраженной болью по сравнению с теми, кто начал с более низких показателей боли, противоречит ожиданиям в отношении этой группы нутрицевтиков, которые, как ожидается, будут более эффективны в борьбе с более легким ранним остеоартритом, чем с более прогрессирующим. тяжелое заболевание. Сравнивая проведение исследования GAIT с исследованиями, проведенными в ветеринарии, отрезвляюще отмечаю, что положительные результаты для группы с умеренной и сильной болью рассматриваются как предварительные из-за небольшого числа пациентов (354!), включенных в это исследование. раздел исследования.
тяжелое заболевание. Сравнивая проведение исследования GAIT с исследованиями, проведенными в ветеринарии, отрезвляюще отмечаю, что положительные результаты для группы с умеренной и сильной болью рассматриваются как предварительные из-за небольшого числа пациентов (354!), включенных в это исследование. раздел исследования.
ССЫЛКИ
1. Iovu M, Dumais G, du Souich P. Противовоспалительная активность хондроитинсульфата. Остеоартрит хрящей 2008;16 Приложение 3:S14-8.
2. McCarthy G, O’Donovan J, Jones B, et al. Рандомизированное двойное слепое исследование с положительным контролем для оценки эффективности глюкозамина/хондроитинсульфата для лечения собак с остеоартритом. Vet J 2007;174(1):54-61.
3. Регистрация JY. Эффективность сульфата глюкозамина при остеоартрите: финансовый и нефинансовый конфликт интересов. Ревматоидный артрит 2007;56(7):2105-10.
4. Блэк С., Клар С., Хендерсон Р. и др. Клиническая эффективность добавок глюкозамина и хондроитина в замедлении или остановке прогрессирования остеоартрита коленного сустава: систематический обзор и экономическая оценка. Health Technol Assess 2009;13(52):1-148.
Health Technol Assess 2009;13(52):1-148.
5. Vlad SC, LaValley MP, McAlindon TE, et al. Глюкозамин от боли при остеоартрите: почему результаты испытаний различаются? Ревматоидный артрит 2007;56(7):2267-77.
6. Moreau M, Dupuis J, Bonneau NH, et al. Клиническая оценка нутрицевтиков, карпрофена и мелоксикама для лечения собак с остеоартритом. Vet Rec 2003;152(11):323-9.
7. Canapp SO, Jr., McLaughlin RM, Jr., Hoskinson JJ, et al. Сцинтиграфическая оценка собак с острым синовитом после лечения глюкозамина гидрохлоридом и хондроитинсульфатом. Am J Vet Res 1999;60(12):1552-7.
8. Aragon CL, Hofmeister EH, Budsberg SC. Систематический обзор клинических испытаний методов лечения остеоартрита у собак. J Am Vet Med Assoc 2007;230(4):514-21.
9. Сандерсон Р.О., Беата С., Флипо Р.М. и др. Систематический обзор лечения остеоартрита у собак. Vet Rec 2009;164(14):418-24.
10. Clegg DO, Reda DJ, Harris CL, et al. Глюкозамин, хондроитинсульфат и их комбинация при болезненном остеоартрите коленного сустава. N Engl J Med 2006;354(8):795-808.
Глюкозамин, хондроитинсульфат и их комбинация при болезненном остеоартрите коленного сустава. N Engl J Med 2006;354(8):795-808.
Связанный контент:
Медицинский
Связанные статьи >>>
Хондропротекторы у лошадей
Коллаген и метилсульфонилметан (МСМ)
Коллаген
Коллаген представляет собой белковый каркас, присутствующий почти во всех органах. Существует несколько типов коллагена, например, хондроциты (клетки хрящей) в основном синтезируют коллаген типа II, а фибробласты (клетки сухожилий, связок и т. д.) продуцируют коллаген типов I и III.
Коллаген типа II животного происхождения, который в основном содержится в кормовых добавках для лошадей. Его эффективность, способ всасывания и биодоступность еще предстоит доказать.
Метилсульфонилметан (МСМ)
МСМ представляет собой большую молекулу сульфида, обнаруженную в небольших количествах в соединительной ткани. Ему приписывают множество достоинств: противовоспалительное, обезболивающее и антиоксидантное. Исследования о нем весьма противоречивы, и при нынешнем уровне знаний невозможно сделать какие-либо выводы о его эффективности у лошадей.
Ему приписывают множество достоинств: противовоспалительное, обезболивающее и антиоксидантное. Исследования о нем весьма противоречивы, и при нынешнем уровне знаний невозможно сделать какие-либо выводы о его эффективности у лошадей.
Фитотерапия
Множество растительных экстрактов могут оказывать интересное воздействие на костно-мышечная система . Их использование часто связано с многовековой человеческой традицией, но их преимущества начинают изучаться в ветеринарии. Столкнувшись с хроническими проблемами, идеальным отражением которых являются многие хромота , фитотерапия может оказать существенную помощь.
Harpagophytum procumbens
Harpagophytum — стелющееся растение, встречающееся исключительно в южной части Африки. Его прозвище « Коготь Дьявола » происходит от формы его плода, состоящего из древесной оболочки, полной маленьких крючков. Плоды собирают с копыт крупного рогатого скота, вызывая раздражение и нервозность, отсюда и прозвище.
Плоды собирают с копыт крупного рогатого скота, вызывая раздражение и нервозность, отсюда и прозвище.
Harpagophytum — растение, внесенное во французскую фармакопею. Используем его корни, в идеале двух-трехлетнего возраста. Его активное вещество, гарпагозид, принадлежит к семейству гетерозидов. Корень должен содержать минимум 1,2%, чтобы быть одобренным Европейской фармакопеей.
Harpagophytum четко продемонстрировал свои противовоспалительные свойства на нескольких животных моделях через лейкотриеновый путь. Наилучшие результаты были достигнуты при хронических патологиях с эффектами того же порядка, что и у фенилбутазона.
Значительно улучшен комфорт и гибкость суставов. Тем не менее, эффекты не проявляются явно до тех пор, пока примерно через десять дней.
Его основным показанием в ветеринарии является альтернативное лечение хронических патологий опорно-двигательного аппарата у лошадей.
Curcuma Longa
Широко культивируемая в азиатских странах куркума уже много лет включена в традиционную китайскую фармакопею. Как и в случае с имбирем, используется корневая часть, называемая корневищем. Активные ингредиенты принадлежат к двум большим семействам: маслянистые соединения, которые объединяют монотерпены и сесквитерпены (зингиберен, куркумен, α и β турмерон), и куркуминоиды, представляющие собой смесь куркумина и его производных.
Противовоспалительные, антиоксидантные, желчегонные, гепатозащитные и снижающие уровень холестерина свойства связаны с куркумином. В ветеринарии рекомендуется для лечения легких двигательных нарушений и в качестве адъювантного лечения печеночных патологий.
Boswellia serrata
Boswellia serrata — это дерево, произрастающее в Индии, из которого извлекают смолу после надрезания ствола. Эта смола очень богата эфирными маслами, обладающими различными свойствами: противовоспалительным действием (дозозависимое действие на 5-липоксигеназу), анальгетик , усиливает потоотделение, обладает антибактериальным, противодиарейным действием. Уровень научных исследований по использованию смолы босвеллии в ветеринарии относительно низок. Костно-суставные проблемы и респираторные заболевания будут сохранены в качестве потенциальных показаний.
Уровень научных исследований по использованию смолы босвеллии в ветеринарии относительно низок. Костно-суставные проблемы и респираторные заболевания будут сохранены в качестве потенциальных показаний.
Salix alba
Ива белая – обычное дерево в наших регионах, ценящее влажные места. Регулярно встречается вдоль ручьев, разделяющих участки луга. Используем кору веток двух-трехлетнего возраста и сушим.
Белая ива – обычное дерево в наших краях, которое любит влажные места. Регулярно встречается вдоль ручьев, разделяющих участки луга. Используем кору веток двух-трехлетнего возраста и сушим.
Эффективность ивы белой была клинически подтверждена в медицине и признана за ее противовоспалительную и обезболивающую активность. Вот почему он является отличным союзником в лечении болей в суставах и проблем с опорно-двигательным аппаратом.
Zingiber officinalis
Имбирь — это травянистое растение, произрастающее в Азии. Имбирь в основном выращивают в Индии, Малайзии, Китае, Нигерии и Австралии. Мы используем корневую часть растения, также называемую корневищем.
Активные ингредиенты имбиря находятся в виде эфирных масел: α-зингиберен, β-сесквифелландрен, камфен, β-бисаболен, гераниаль и нераль и смолы, содержащей 6-гингеролет и гингероны А и В.
Имбирь способствует секрецию слюны и желудочного сока, угнетает желудочные сокращения, оказывает гепатопротекторное действие и угнетает секрецию некоторых простагландинов. В ветеринарии он в основном используется из-за его противорвотного действия и улучшения желудочно-кишечного комфорта. Его ингибирующее действие на некоторые простагландины оправдывает его применение при нарушениях опорно-двигательного аппарата.
Equisetum arvense
Хвощ полевой распространен в наших регионах.