Белки, жиры и углеводы | Проект Роспотребнадзора «Здоровое питание»
Базовые макронутриенты в продуктах. На прошлом уроке мы узнали, что такое макронутриенты. Это белки, жиры и углеводы — при их окислении организм получает необходимую для поддержания жизни энергию. Но функции у этих веществ разные. Разнится и их количество в граммах, которые должны составлять здоровый рацион.
В ежедневном рационе белки должны составлять 10–15 %, жиры — около 30 %, углеводы — 50–55 %.
Каждый из макронутриентов играет важнейшую роль в организме. Белки, попадая в кровь, расщепляются до аминокислот — и эти кислоты буквально строят наш организм, образовывая и восстанавливая ткани. Дефицит белка способен даже влиять на наше ежедневное настроение. А жиры вносят самый большой вклад в поддержание энергии, высвобождая 9 ккал на 1 грамм. Поэтому, например, полярники нуждаются в пище с большим содержанием жира — это незаменимо для терморегуляции в условиях Крайнего Севера.
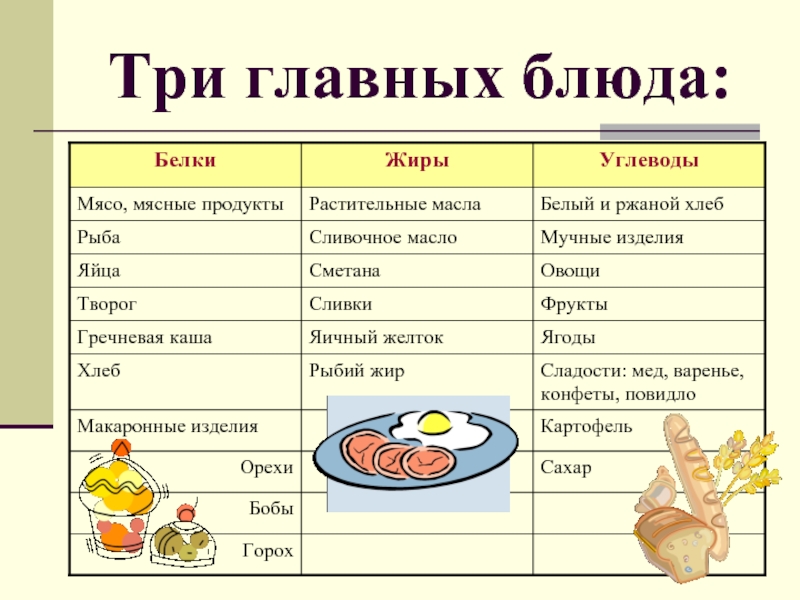
Обратите внимание на продукты, которые содержат базовые макронутриенты.
|
Белки |
Жиры |
Углеводы |
| Мясо | Растительные масла | Хлеб |
| Рыба | Орехи | Макароны |
| Птица | Рыба, рыбий жир | Крупы |
| Яйца | Какао-бобы | Бобовые |
| Творог | Овощи | |
| Сыр | Фрукты | |
| Бобовые | ||
| Молоко |
Из нового урока вы узнаете:
- Какое соотношение БЖУ необходимо взрослым и детям
- Как правильно рассчитать баланс БЖУ в своем рационе и из каких источников их получать
- Почему важно соблюдать баланс БЖУ
- Можно ли заменить часть белка в рационе спортивным питанием
- На какие группы подразделяются углеводы и в чем разница между ними
На что влияют белки, жиры и углеводы: как сбалансировать рацион
Первое правило здорового питания — соблюдать баланс белков, жиров и углеводов. Но почему именно эти три вида веществ?
Теги:
Нетленка
Здоровье
Еда
Питание
Белки
Unsplash
Важно употреблять в пищу сбалансированное количество белков, жиров и углеводов. Каждое из этих веществ отвечает за свои жизеннно важные процессы и вот как они работают
Мы все знаем, что каждое вещество из этой триады — белки, жиры и углеводы — важно для развития организма и поддержания здоровья. Чтобы понять, почему так происходит, для начала выясним, на что распадается в нашем организме каждый из этих видов веществ.
- Белки (10%-35% от общего количества калорий в день) расщепляются на аминокислоты и используются организмом для наращивания мышечной массы и производства других необходимых нам белков
- Жиры (20%-35% от общего количества калорий в день) расщепляются на жирные кислоты и используются для синтеза гормонов
- Углеводы (45%-65% от общего количества калорий в день) расщепляются на глюкозу и обеспечивают клетки энергией
Белок
Поскольку белок является основным строительным блоком большинства клеток, употребление продуктов с высоким содержанием белка может помочь нам быстрее восстановиться после травм или тренировок, нарастить мышечную массу и поддерживать здоровый вес.
Жиры
Существует 3 типа жиров: ненасыщенные, насыщенные и трансжиры. Ненасыщенные жиры считаются здоровыми, потому что они регулируют уровень холестерина в крови, уменьшают воспаление и стабилизируют частоту сердечных сокращений. Насыщенные жиры менее полезны, чем ненасыщенные, и сокращение потребления насыщенных жиров может быть важно для вашего здоровья.
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Трансжиры присутствуют в натуральных молочных и мясных продуктах, а также в подогретом растительном масле в небольших количествах. Трансжиры образуются в больших количествах при гидрировании ненасыщенных жиров, например, при производстве маргарина. Эти масла выдерживают многократный нагрев, что делает их идеальными для использования в продуктах общественного питания. Однако ими не следует злоупотреблять, так как трансжиры повышают уровня плохого холестерина, способствуют развитию резистентности к инсулину и ишемической болезни сердца, а также могут увеличить риск развития атеросклероза.
Углеводы
Наш организм расщепляет углеводы на глюкозу. Глюкоза является основным источником энергии для клеток, тканей и органов тела. Углеводы в пище содержатся в различных формах:
- Сложные углеводы содержатся во фруктах, овощах, орехах, семенах, бобах и цельных злаках.
 Употребление в пищу продуктов, богатых клетчаткой, может помочь вам чувствовать себя сытым и снизить вероятность переедания. Богатые клетчаткой продукты также могут помочь решить проблемы с желудком или кишечником, такие как запор.
Употребление в пищу продуктов, богатых клетчаткой, может помочь вам чувствовать себя сытым и снизить вероятность переедания. Богатые клетчаткой продукты также могут помочь решить проблемы с желудком или кишечником, такие как запор. - Простые углеводы — это различные формы сахара, содержащиеся как во фруктах, так и в кондитерских изделиях, а также в полуфабрикатах, молочных продуктах и газированных напитках. Благодаря небольшому размеру молекулы они быстро расщепляются организмом и повышают уровень глюкозы в крови.
Важные питательные вещества, которые необходимо знать: белки, углеводы и жиры
Белки
Белки часто называют строительными блоками тела. Они используются для построения и восстановления тканей. Они помогают бороться с инфекцией. Ваше тело использует дополнительный белок для получения энергии. Хорошими источниками белка являются морепродукты, нежирное мясо и птица, яйца, фасоль и горох, соевые продукты, несоленые орехи и семена. Белок также содержится в молочных продуктах.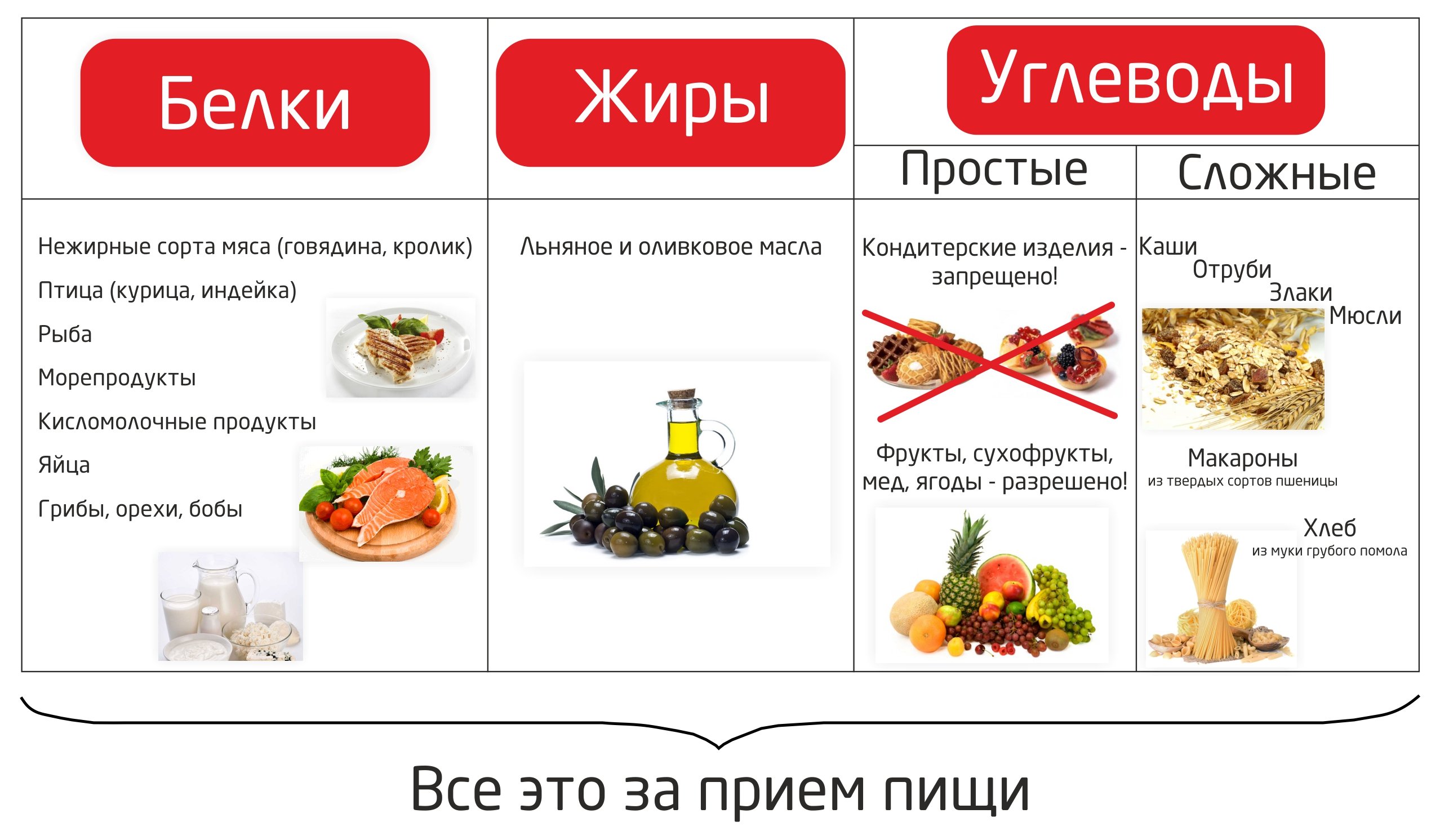 Белок из растительных источников, как правило, содержит меньше жира и холестерина и содержит клетчатку и другие полезные для здоровья питательные вещества.
Белок из растительных источников, как правило, содержит меньше жира и холестерина и содержит клетчатку и другие полезные для здоровья питательные вещества.
Углеводы
Углеводы являются основным источником энергии в организме. Углеводы бывают двух видов: простые и сложные.
- Простые углеводы содержатся во фруктах, овощах и молочных продуктах, а также в подсластителях, таких как сахар, мед и сироп, и таких продуктах, как конфеты, безалкогольные напитки, глазурь или глазурь.
- Сложные углеводы содержатся в хлебе, крупах, макаронах, рисе, фасоли и горохе, а также крахмалистых овощах, таких как картофель, зеленый горошек и кукуруза.
Многие углеводы также содержат клетчатку. Клетчатка — это тип сложных углеводов, которые содержатся в продуктах растительного происхождения: фруктах, овощах, орехах, семенах, бобах и цельных зернах. Употребление пищи с клетчаткой может предотвратить проблемы с желудком или кишечником, такие как запоры. Это также может помочь снизить уровень холестерина и сахара в крови.
Это также может помочь снизить уровень холестерина и сахара в крови.
Жиры
Жиры также дают энергию и помогают чувствовать себя сытым после еды. Масла, шортенинг, сливочное масло и маргарин являются типами жиров, а майонез, заправки для салатов, столовые сливки и сметана содержат много жира. Продукты животного происхождения и некоторые продукты, такие как семена, орехи, авокадо и кокос, также содержат жир. Существуют разные категории жиров — некоторые из них полезнее, чем другие:
- Мононенасыщенные. К ним относятся масло канолы, оливковое масло, арахисовое масло и сафлоровое масло. Они содержатся в авокадо, арахисовом масле, некоторых орехах и семенах.
- Полиненасыщенные. Некоторые из них — кукурузное масло, соевое масло и льняное масло. Они также содержатся в жирной рыбе, грецких орехах и некоторых семенах.
- Насыщенный. Эти жиры содержатся в красном мясе, молочных продуктах, включая сливочное масло, пальмовом и кокосовом маслах.
 Обычные сыры, пицца, зерновые и молочные десерты являются обычными источниками насыщенных жиров в нашей пище.
Обычные сыры, пицца, зерновые и молочные десерты являются обычными источниками насыщенных жиров в нашей пище. - Трансжиры (трансжирные кислоты). Переработанные трансжиры содержатся в маргарине и растительном жире. Трансжиры часто используются в покупной выпечке и жареных блюдах в некоторых ресторанах быстрого питания.
Вы можете отличить мононенасыщенные и полиненасыщенные жиры, потому что они жидкие при комнатной температуре. Эти типы жира, по-видимому, снижают вероятность сердечных заболеваний. Но это не значит, что вы можете есть больше, чем предлагают диетические рекомендации.
Трансжиры и насыщенные жиры обычно твердые при комнатной температуре. Транс-жиры и насыщенные жиры могут подвергнуть вас большему риску сердечных заболеваний, и их следует ограничивать.
ПОДСКАЗКА
Холестерин — жироподобное вещество, содержащееся в некоторых продуктах. Вашему телу нужен холестерин. Но исследования показывают, что употребление большого количества продуктов с высоким содержанием насыщенных жиров связано с более высоким уровнем холестерина в крови, что может увеличить риск сердечных заболеваний.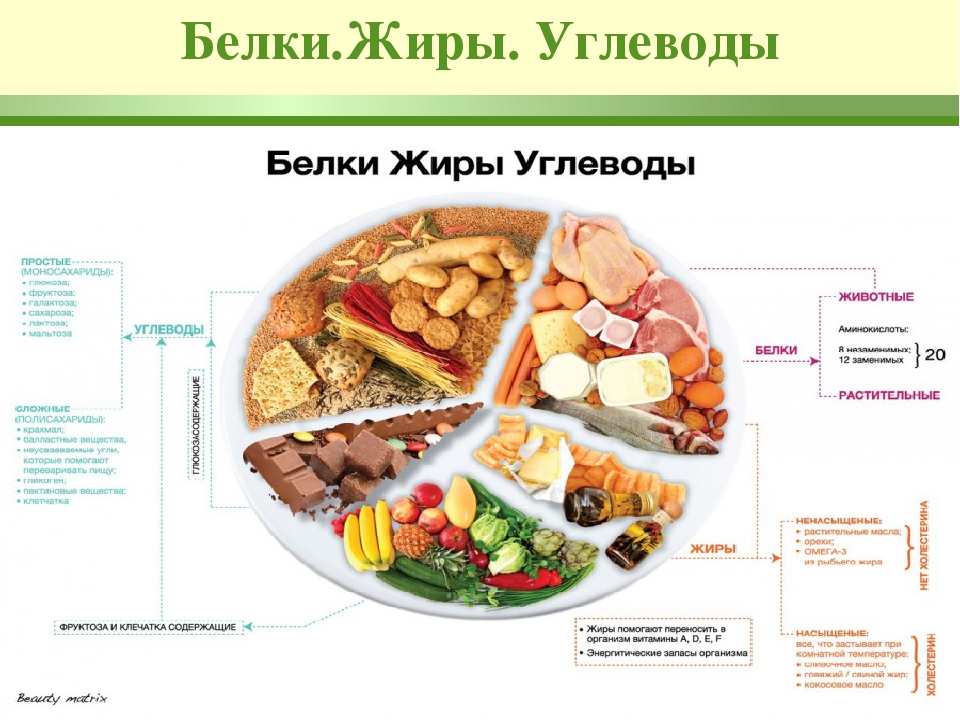 Постарайтесь ограничить уровень холестерина до уровня менее 300 мг в день. Если ваш врач говорит, что вам нужно снизить уровень холестерина, вам может потребоваться ограничить потребление холестерина в пище до уровня менее 200 мг в день.
Постарайтесь ограничить уровень холестерина до уровня менее 300 мг в день. Если ваш врач говорит, что вам нужно снизить уровень холестерина, вам может потребоваться ограничить потребление холестерина в пище до уровня менее 200 мг в день.
Источник: Национальный институт старения; Белки, углеводы и жиры
Структура и функция сложных углеводов — компьютерное моделирование
Сложные углеводы очень распространены в животных, растениях и бактериях. Они входят в состав клеточных мембран, а также субклеточного материала клеток. Они также обнаруживаются в физиологических жидкостях, таких как кровь, слезы, молоко и моча. Недавно было подсчитано, что были определены ковалентные структуры от 4000 до 6000 природных углеводов (DOE, 19).87). Многие сложные углеводы незамещены по восстанавливающим концам и называются полисахаридами; примеры включают олигосахариды молока, целлюлозу клеточных стенок растений и запасные формы, такие как крахмал и гликоген. Многие другие встречающиеся в природе сложные углеводы ковалентно связаны с другими молекулами, такими как белки или липиды, гликозидными связями остатков сахара на их восстанавливающих концах с образованием гликоконъюгатов.
БИОЛОГИЧЕСКАЯ ФУНКЦИЯ
Гликопротеины выполняют множество функций в высших организмах. Коллаген является важным структурным элементом внеклеточного пространства, хрящей, костей и базальных мембран. Муцины играют важную роль в качестве смазывающих и защитных агентов в слизистых выделениях. Важные иммунологические молекулы класса гликопротеинов включают иммуноглобулины, антигены гистосовместимости, антигены групп крови типов АВО и Льюиса, комплемент в механизме свертывания крови и интерферон. Многие белки плазмы человека, такие как фетуин, трансферрин и церулоплазмин, являются гликопротеинами, как и некоторые гормоны, такие как хорионический гонадотропин и тиротропин. Большинство животных и растительных лектинов представляют собой гликопротеины, как и лизосомальные ферменты. Распознавание и связывание лизосомальных ферментов со специфическими рецепторами в аппарате Гольджи и на клеточной поверхности включает один или несколько фосфорилированных остатков маннозы на N-связанных олигосахаридных цепях. Сайты узнавания на клеточной поверхности для связывания и поглощения гормонов и для взаимодействия с другими клетками, вирусами и бактериями также являются гликопротеинами.
Сайты узнавания на клеточной поверхности для связывания и поглощения гормонов и для взаимодействия с другими клетками, вирусами и бактериями также являются гликопротеинами.
Многие функции гликопротеинов на клеточной поверхности также были предложены для нейтральных и кислых гликосфинголипидов. Кроме того, недавно было обнаружено, что некоторые гликосфинголипиды класса ганглиозидов ингибируют митогенный ответ факторов клеточного роста посредством аллостерической модуляции их рецепторов клеточной поверхности (Bremer et al., 1986). Онкогенная трансформация вирусной инфекцией или химическими мутагенами обычно приводит к изменениям структуры гликосфинголипидов на клеточной поверхности, так что количество некоторых типов значительно увеличивается. В некоторых случаях имеются и качественные различия из-за экспрессии генов, молчащих в дифференцированных нормальных клетках. Это особенно важно для опухолевых клеток, где опухолеассоциированные антигены могут служить основой для специфических диагностических анализов на основе моноклональных антител и, в конечном итоге, возможно, для лечения.
Связывание между гликозаминогликанами и другими внеклеточными макромолекулами вносит значительный вклад в структурную организацию матрикса соединительной ткани. Все гликозаминогликаны, за исключением тех, в которых отсутствуют сульфатные или карбоксильные группы, электростатически связываются с коллагеном при нейтральном pH из-за их замечательного анионного характера. Дерматансульфат, который, по-видимому, является основным гликозаминогликаном, синтезируемым клетками гладких мышц артерий, сильно связывается с липопротеинами плазмы, а гепарин также взаимодействует с некоторыми белками плазмы, включая факторы свертывания IX и XI и антитромбин III. Интересно, что стехиометрическое связывание гепарина 1:1 с остатками Lys антитромбина III, как полагают, вызывает конформационное изменение антитромбина III, которое увеличивает связывание антитромбина III с тромбином. Это связывание инактивирует тромбин. Гиалуроновая кислота осаждается на поверхности чашек Петри клетками, растущими в культуре тканей, давая им субстрат для прикрепления в процессе роста. Протеогликаны также участвуют в регуляции клеточного роста, возможно, посредством ядерных эффектов на структуру хроматина и активации ДНК-полимеразы, и могут опосредовать межклеточную коммуникацию и потерю рецепторов клеточной поверхности.
Протеогликаны также участвуют в регуляции клеточного роста, возможно, посредством ядерных эффектов на структуру хроматина и активации ДНК-полимеразы, и могут опосредовать межклеточную коммуникацию и потерю рецепторов клеточной поверхности.
БИОСИНТЕЗ N-СВЯЗАННЫХ ГЛИКОПРОТЕИНОВ И ГЛИКОФИНГОЛИПИДОВ
Роль углеводов в биологических функциях представляет особенно сложную проблему для будущего. Синтез этих гликоконъюгатов происходит во время их внутриклеточного транспорта от места начальной сборки липид-связанного интермедиата (гликопротеины) или церамида (гликосфинголипиды) в эндоплазматическом ретикулуме через аппарат Гольджи на клеточную поверхность, внутриклеточные органеллы или внеклеточные космос. Для их синтеза требуется семейство активированных доноров сахара, называемых сахарными нуклеотидами, которые синтезируются в цитозольной фракции клеток из сахарофосфатов и нуклеозидтрифосфатов. Интересным исключением является сахарный нуклеотид сиаловой кислоты, называемый цитидинмонофосфат сиаловой кислоты (CMP-NeuAc), который синтезируется в ядре из свободной сиаловой кислоты и CTP. Ферменты, участвующие в биосинтезе гликоконъюгатов, представляют собой гликозилтрансферазы, которые катализируют перенос остатков сахаров от нуклеотидов сахара к невосстанавливающему концу растущей углеводной цепи.
Ферменты, участвующие в биосинтезе гликоконъюгатов, представляют собой гликозилтрансферазы, которые катализируют перенос остатков сахаров от нуклеотидов сахара к невосстанавливающему концу растущей углеводной цепи.
Различие между биосинтезом гликоконъюгатов и синтезом белка является ключевым; последний происходит на матрице матричной РНК и поэтому определяется генетическим кодом одного структурного гена. 1 В противоположность этому, синтез гликоконъюгатов осуществляется поэтапным добавлением единиц сахара с использованием разных ферментов на каждом этапе. Следовательно, ни одна последовательность ДНК не участвует в определении первичной структуры сложного углевода, поскольку порядок добавления сахаров зависит от специфичности субстрата и кинетических характеристик различных гликозилтрансфераз, каждая из которых кодируется отдельным структурным геном. . Ясно, что невозможно предсказать первичную структуру сложных углеводов по последовательностям ДНК. Следовательно, трехмерные структуры гликопротеинов, гликосфинголипидов и других сложных молекул, содержащих углеводы, невозможно полностью предсказать без экспериментального структурного анализа углеводов.
Snider (1984) сообщил, что гликопротеины N-связанного типа синтезируются как котрансляционное событие в шероховатой эндоплазматической сети. В то время как полипептидная цепь транслируется на матричной РНК и одновременно проходит через мембрану эндоплазматического ретикулума в цистернальное пространство (просвет), одиночный олигосахарид координированно синтезируется на фосфорилированном полиизопреноидном спирте (долихоле у высших животных и более мелких подобных веществах у насекомых). , дрожжи и растения). Весь олигосахарид-предшественник затем переносится на соответствующие остатки аспарагина в формирующейся полипептидной цепи (вероятно, перед укладкой в третичную структуру) в соответствии с правилами специфичности, которые до конца не поняты. Для переноса требуется последовательность Asn-X-Ser или Asn-X-Thr, но также задействованы дополнительные факторы. Доступность остатка Asn может быть одним из таких факторов, и оценка этой возможности может быть сделана с помощью методов прогнозирования, описанных в этом отчете.
Вторая стадия синтеза N-связанного гликопротеина включает обширную посттрансляционную модификацию связанного с белком олигосахарида-предшественника путем удаления и добавления сахаров. Во многих случаях белковая часть также модифицируется частичным протеолитическим расщеплением и/или добавлением модифицирующих функцию групп к определенным аминокислотным остаткам. Посттрансляционная модификация инициируется в шероховатой эндоплазматической сети удалением трех остатков глюкозы двумя специфическими мембраносвязанными глюкозидазами. Эти остатки глюкозы, по-видимому, имеют единственную функцию обеспечения переноса олигосахаридной цепи от долихолпирофосфата к зарождающимся полипептидным цепям. Будет интересно определить по трехмерным структурам и предсказанным конформациям, как эти группы взаимодействуют с ферментом трансферазой, задействованным на этом этапе. Цепи зрелых олигосахаридов с высоким содержанием маннозы синтезируют путем последующего удаления до четырех остатков маннозила из трех ветвей структуры предшественника.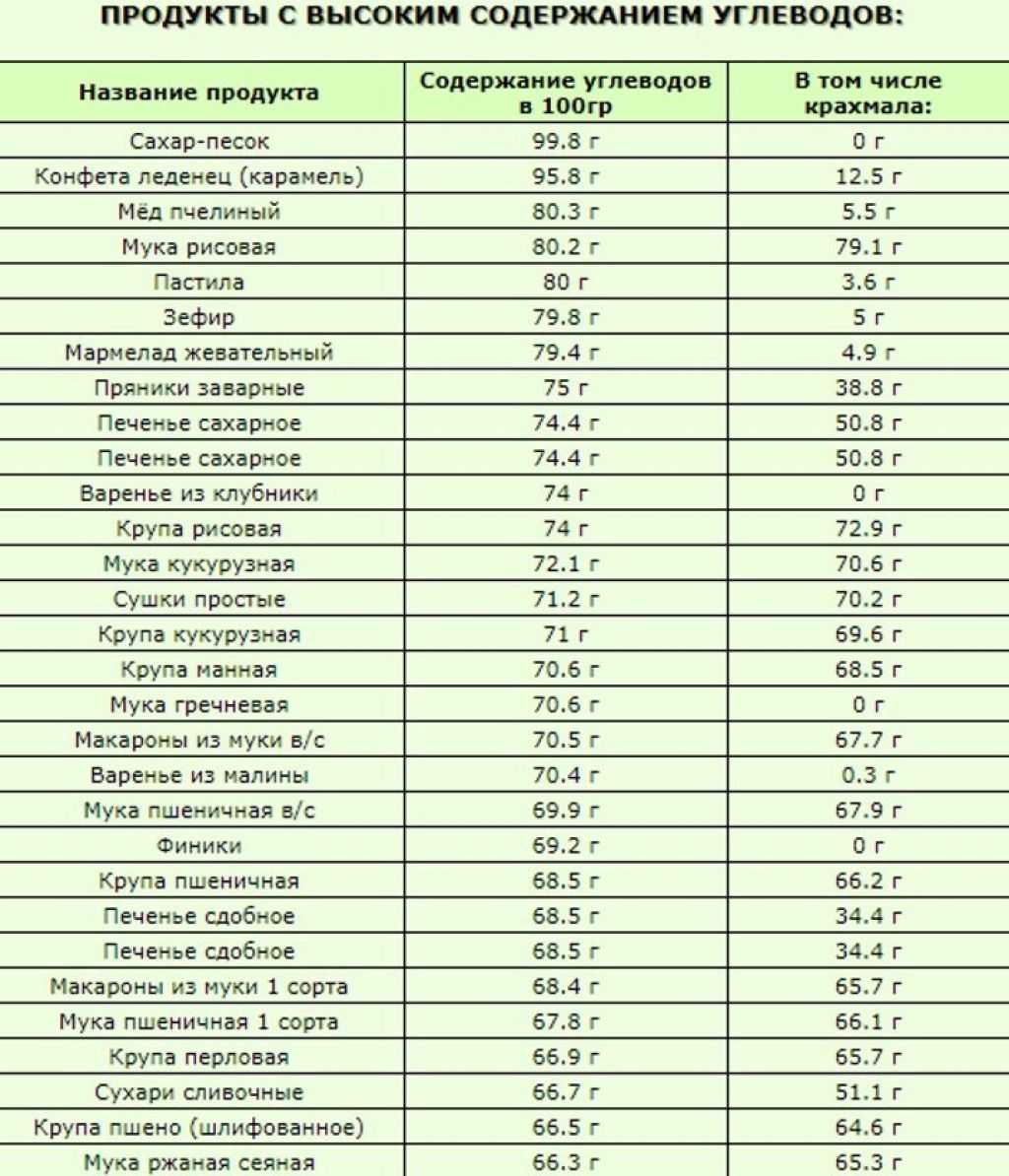 В этом процессе участвуют по крайней мере три различных альфа-маннозидазы в аппарате Гольджи. Эти ферменты и две глюкозидазы являются гидролазами, как и лизосомальные гликозидазы, но их активность максимальна при нейтральном рН, в отличие от лизосомальных ферментов, которые проявляют наибольшую каталитическую активность при кислом рН.
В этом процессе участвуют по крайней мере три различных альфа-маннозидазы в аппарате Гольджи. Эти ферменты и две глюкозидазы являются гидролазами, как и лизосомальные гликозидазы, но их активность максимальна при нейтральном рН, в отличие от лизосомальных ферментов, которые проявляют наибольшую каталитическую активность при кислом рН.
В эукариотических клетках олигосахарид с высоким содержанием маннозы с пятью единицами маннозы (см. ) является прямым предшественником сложных и гибридных структур. Начальным этапом в аппарате Гольджи является добавление остатка N-ацетилглюкозамина к последнему оставшемуся человеку на ветви I (*), после чего оставшиеся два остатка человека на ветвях II и III могут быть удалены альфа-маннозидазами, которые почти определенно отличается от тех, кто участвовал в предыдущих шагах. На этом этапе могут быть сделаны дополнительные разветвления для получения три- и тетраантеннальных структур, а заключительные стадии процессинга осуществляются путем добавления остатков галактозы, N-ацетилглюкозамина, сиаловой кислоты и фукозы для получения зрелых, сложных, N-связанных цепи.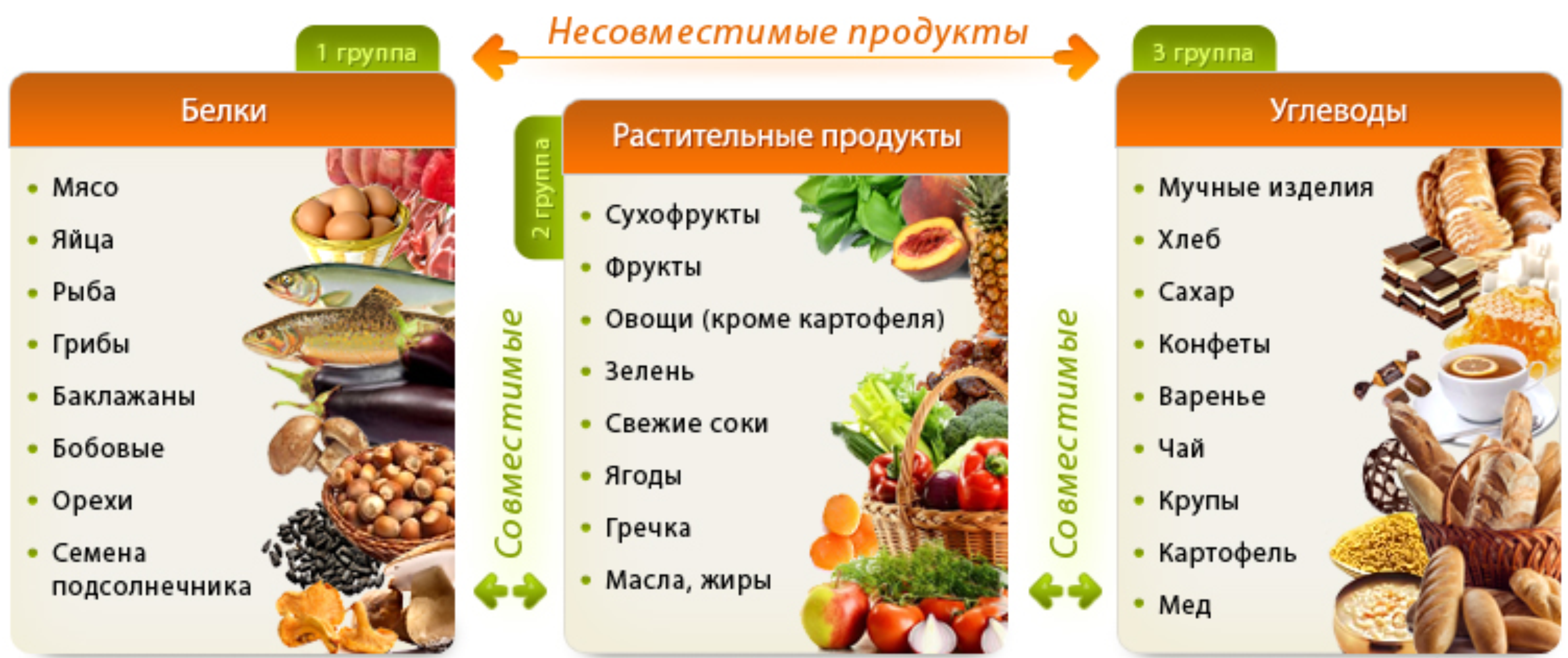 Интересная N-ацетилглюкозаминилтрансфераза может добавлять бета-1,4-связанный остаток GlcNAc к разветвленному бета-связанному остатку маннозы внутренней области ядра (0), чтобы получить «разделенную пополам структуру». Этот этап был предметом интенсивного изучения Карвером и его коллегами, которые интересовались структурной специфичностью фермента с различными конформациями предшественников олигосахаридов (Карвер и Бриссон, 19).84).
Интересная N-ацетилглюкозаминилтрансфераза может добавлять бета-1,4-связанный остаток GlcNAc к разветвленному бета-связанному остатку маннозы внутренней области ядра (0), чтобы получить «разделенную пополам структуру». Этот этап был предметом интенсивного изучения Карвером и его коллегами, которые интересовались структурной специфичностью фермента с различными конформациями предшественников олигосахаридов (Карвер и Бриссон, 19).84).
РИСУНОК 8-1
Промежуточный продукт, частично процессированный аспарагином — связанная углеводная цепь гликопротеина.
Вполне вероятно, что методы прогнозирования будут использоваться в исследованиях путей процессинга и степени процессинга цепей олигосахаридов. Если контроль возникает из-за специфичности фермента в отношении конкретной трехмерной структуры субстрата, может оказаться возможным определить эти предпочтения и, исходя из предсказаний распределения трехмерных структур олигосахарида, присоединенного к гликопротеиновому субстрату, предсказать, насколько далеко углеводная цепь будет обработана.
Лизосомальные ферменты содержат одну или несколько фосфатных групп на маннозных остатках олигосахаридных цепей с высоким содержанием маннозы. Маннозо-6-фосфатные группы являются специфическими маркерами распознавания, которые участвуют в транспорте лизосомальных ферментов из аппарата Гольджи или из клеток в лизосомы. В плазматической мембране были обнаружены два мембраносвязанных маннозо-6-фосфатных рецептора; по крайней мере, один из них также находится в мембранах Гольджи. Хотя специфичность их связывания исследована довольно подробно, другие аспекты не определены: природа взаимодействия фосфорилированных остатков маннозы с рецепторами и трехмерные структуры лизосомальных фермент-рецепторных комплексов.
Другой интересный аспект синтеза лизосомальных ферментов включает определение структурных доменов на свернутых белках, распознаваемых ферментом, который инициирует фосфорилирование остатков маннозы, который представляет собой N-ацетилглюкозамин-фосфотрансферазу (GlcNAc-P трансферазу) в аппарате Гольджи.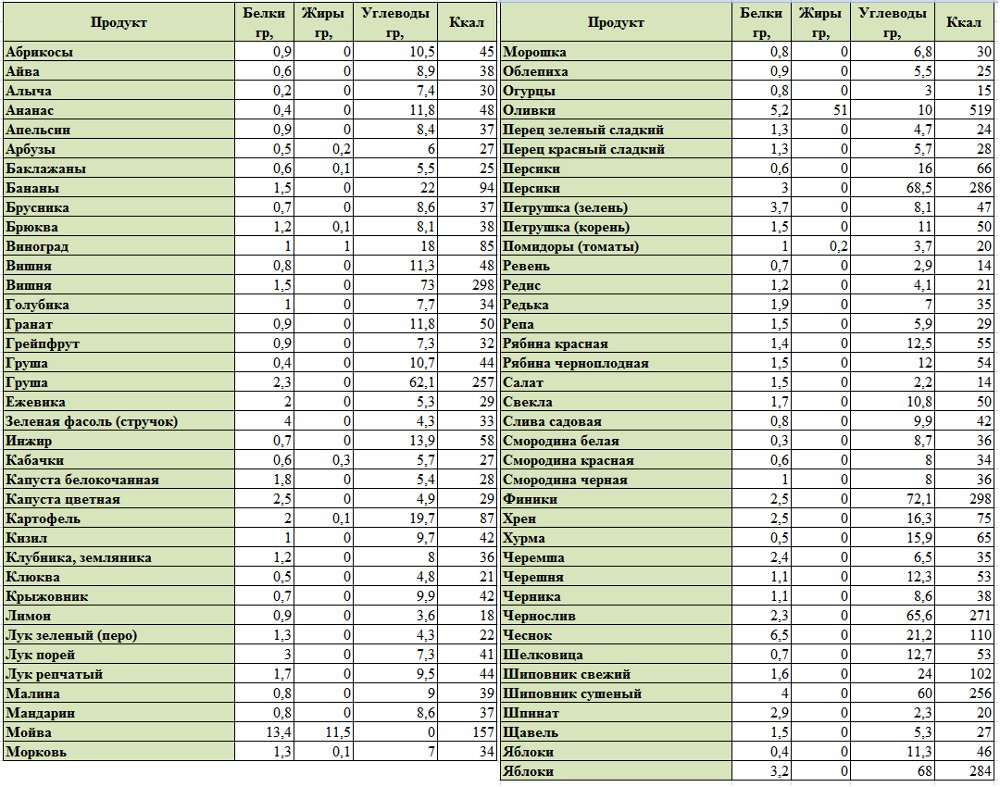 Это механизм, с помощью которого для фосфорилирования отбираются только белки лизосомальных ферментов. Это особенно важно, поскольку одна из форм генетического лизосомного нарушения накопления, называемая муколипидозом II, возникает в результате дефекта связывающего домена GlcNAc-P трансферазы для лизосомальных ферментных белков. Возможно, эту проблему можно решить только с помощью компьютерного моделирования, позволяющего предсказать трехмерные структуры обоих белков.
Это механизм, с помощью которого для фосфорилирования отбираются только белки лизосомальных ферментов. Это особенно важно, поскольку одна из форм генетического лизосомного нарушения накопления, называемая муколипидозом II, возникает в результате дефекта связывающего домена GlcNAc-P трансферазы для лизосомальных ферментных белков. Возможно, эту проблему можно решить только с помощью компьютерного моделирования, позволяющего предсказать трехмерные структуры обоих белков.
Гликосфинголипиды синтезируются аналогичным образом, за исключением того, что церамид выполняет функцию долихола для гликопротеинов, а перенос происходит непосредственно от сахарного нуклеотида к акцепторному гликолипиду. Церамид является акцептором либо глюкозы (из UDP-Glc), либо галактозы (из UDP-Gal), образуя глюкозилцерамид или галактозилцерамид. Эти простые гликосфинголипиды преобладают в плазме и головном мозге человека соответственно, а также служат предшественниками более сложных гликосфинголипидов. В большинстве органов, включая головной мозг, основные пути включают превращение глюкозилцерамида в лактозилцерамид, Gal-бета-1,4-Glc-Cer. Лактозилцерамид является субстратом ряда гликозилтрансфераз, продукты которых являются первыми интермедиатами в синтезе родственных гликосфинголипидов, которые можно классифицировать по их общим структурным характеристикам. Уже охарактеризовано более 100 различных гликосфинголипидов, и все еще открываются новые соединения. Хотя некоторые из гликосфинголипидов могут содержать от 15 до 35 или более остатков сахара, большинство широко встречающихся типов имеют от 4 до 10 остатков в олигосахаридной цепи.
Лактозилцерамид является субстратом ряда гликозилтрансфераз, продукты которых являются первыми интермедиатами в синтезе родственных гликосфинголипидов, которые можно классифицировать по их общим структурным характеристикам. Уже охарактеризовано более 100 различных гликосфинголипидов, и все еще открываются новые соединения. Хотя некоторые из гликосфинголипидов могут содержать от 15 до 35 или более остатков сахара, большинство широко встречающихся типов имеют от 4 до 10 остатков в олигосахаридной цепи.
АНАЛИЗ ПЕРВИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ
Полное понимание взаимодействий между углеводами и белками (ферментами, лектинами, антителами и рецепторами клеточной поверхности) будет зависеть от определения точных трехмерных структур обоих типов молекул. Как было отмечено, первичные структуры олигосахаридных цепей сложных углеводов не могут быть выведены из последовательностей ДНК и поэтому должны быть определены химическим и спектроскопическим анализом. Современные хроматографические методы разделения, наряду с масс-спектрометрией и ядерным магнитным резонансом (ЯМР), позволяют проводить полный анализ первичной структуры на образце в один микромоль. Еще предстоит определить состав; размещение остатков сахара; размер кольца; положения гликозидных связей и их аномерность; и расположение и химическая природа неуглеводных заместителей, таких как липиды, сульфатные и фосфатные группы.
Еще предстоит определить состав; размещение остатков сахара; размер кольца; положения гликозидных связей и их аномерность; и расположение и химическая природа неуглеводных заместителей, таких как липиды, сульфатные и фосфатные группы.
Трехмерные структуры углеводов представляют пространственное расположение отдельных остатков сахара. Наиболее часто встречающиеся сложные углеводы млекопитающих состоят из остатков сахаров, которые существуют в форме пиранозного кольца, наиболее стабильной и жесткой конформацией которого являются формы стула. Когда два остатка сахара ковалентно соединены гликозидной связью, они могут свободно вращаться вокруг гликозидного атома кислорода между двумя кольцами, и поэтому полученный дисахарид может принимать ряд различных конформаций, соответствующих вращениям вокруг этих двух связей. Двугранные углы при гликозидной связи (см. ) принято обозначать греческими символами phi (ϕ) и psi (ψ), где исходной конформацией (ϕ = 0°, ψ = 0°) является тот конформер, в котором C-l Связь -H-1 затмевает O-C’-X’, а связь C-1-O затмевает C’-X’-H-X’.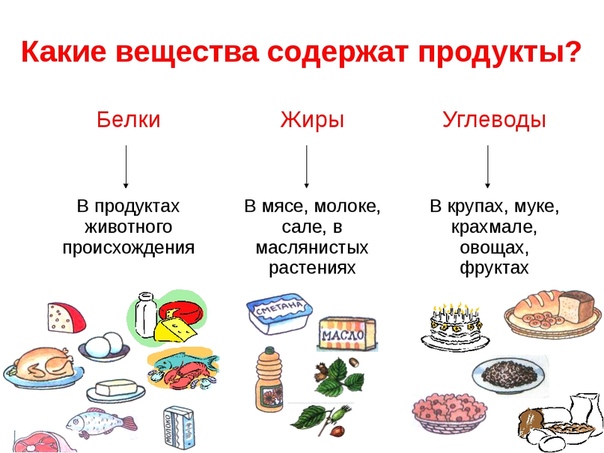
РИСУНОК 8-2
Двугранные углы, определяющие пространственное отношение двух остатков сахара в дисахариде.
Относительная ориентация соседних сахарных остатков в олигосахаридной цепи описывается указанием углов вращения (ϕ, ψ) у каждого гликозидного атома кислорода. Когда эти углы одинаковы для каждой связи, цепь имеет спиральную конформацию с n остатками на виток и h единицами перемещения вдоль оси спирали. Если n и h доступны из рентгеновских данных, то можно вычислить ϕ и ψ и наоборот. Если ϕ и ψ различны среди гликозидных связей в олигосахаридной цепи, трехмерная структура становится непериодической и, при крайних вариациях, принимает конформацию случайного клубка. Информация о возмущениях может быть получена с помощью измерений светорассеяния, вязкости, седиментации и диффузии.
РЕНТГЕНОВСКИЙ АНАЛИЗ КРИСТАЛЛИЧЕСКИХ СТРУКТУР УГЛЕВОДОВ
Из трех основных классов сложных биологических молекул у нас есть наименьшая структурная информация об углеводах с атомным разрешением.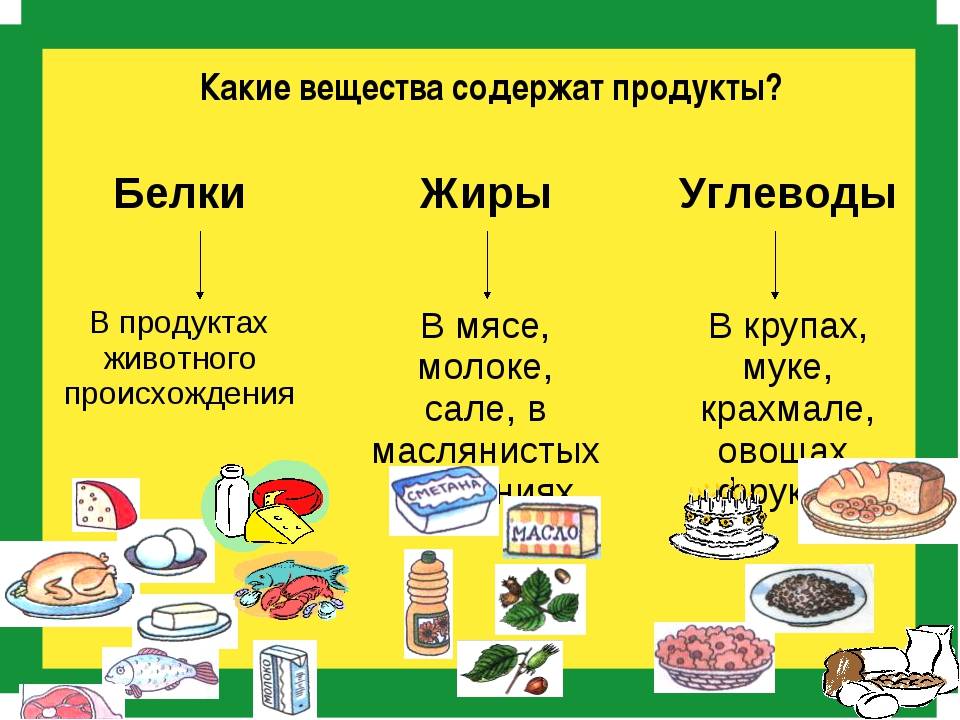 Это связано с тем, что они не были кристаллизованы, и, следовательно, нет соответствующей базы данных о кристаллической структуре, кроме базы данных от простых мономеров до тримеров, на основе которой можно было бы моделировать классические или полуэмпирические квантово-механические расчеты. Типичными примерами являются олигосахариды, специфичные для группы крови, кордовые факторы и липиды A и X. Исключением являются циклодекстрины, которые хорошо кристаллизуются, но конформационно относятся к отдельному классу. Структуры, полученные из структуры волокон полисахаридов, зависят от модели и не являются источником окончательных структурных данных. Стахиоза, олигосахарид, состоящий из четырех сахарных остатков, является крупнейшим нециклическим олигосахаридом, для которого проводится анализ кристаллической структуры, но даже в этом случае связанная с ним структура воды не определена.
Это связано с тем, что они не были кристаллизованы, и, следовательно, нет соответствующей базы данных о кристаллической структуре, кроме базы данных от простых мономеров до тримеров, на основе которой можно было бы моделировать классические или полуэмпирические квантово-механические расчеты. Типичными примерами являются олигосахариды, специфичные для группы крови, кордовые факторы и липиды A и X. Исключением являются циклодекстрины, которые хорошо кристаллизуются, но конформационно относятся к отдельному классу. Структуры, полученные из структуры волокон полисахаридов, зависят от модели и не являются источником окончательных структурных данных. Стахиоза, олигосахарид, состоящий из четырех сахарных остатков, является крупнейшим нециклическим олигосахаридом, для которого проводится анализ кристаллической структуры, но даже в этом случае связанная с ним структура воды не определена.
Проблема кристалличности присуща только частично. Углеводы сольватируются иначе, чем белки, олигонуклеотиды или нуклеиновые кислоты. Однако для получения значительных количеств конфигурационно-однородного материала , необходимого для проведения экспериментов по кристаллизации, было предпринято меньше усилий, чем для белков и нуклеиновых кислот. Другим аспектом кристаллографии гликоконъюгатов является то, что электронная плотность для олигосахаридной части гликопротеинов редко интерпретируется, даже несмотря на то, что было изучено несколько кристаллических гликопротеинов. Это связано с тем, что стандартные программы уточнения не могут работать с олигосахаридами или в месте гликозилирования присутствует микрогетерогенность, поэтому он не учитывается в модели. Таким образом, потенциально ценный источник информации не используется из-за отсутствия надлежащей разработки программ или стратегических подходов к решению проблемы микрогетерогенности.
Однако для получения значительных количеств конфигурационно-однородного материала , необходимого для проведения экспериментов по кристаллизации, было предпринято меньше усилий, чем для белков и нуклеиновых кислот. Другим аспектом кристаллографии гликоконъюгатов является то, что электронная плотность для олигосахаридной части гликопротеинов редко интерпретируется, даже несмотря на то, что было изучено несколько кристаллических гликопротеинов. Это связано с тем, что стандартные программы уточнения не могут работать с олигосахаридами или в месте гликозилирования присутствует микрогетерогенность, поэтому он не учитывается в модели. Таким образом, потенциально ценный источник информации не используется из-за отсутствия надлежащей разработки программ или стратегических подходов к решению проблемы микрогетерогенности.
Стерические соображения о минимальных расстояниях сближения между атомами, полученные из наблюдаемых несвязанных расстояний в различных кристаллических структурах, могут быть использованы для предсказания допустимых конформаций. Этот подход «твердой сферы», первоначально разработанный В.С.Р. Рао в середине 1970-х годов, представляет собой рудиментарный метод теоретических расчетов, который игнорирует электростатические эффекты (водородные связи), но дает качественное предсказание структуры. Впоследствии этот подход был расширен за счет адаптации расчетов энергии, первоначально использовавшихся для пептидов, где потенциальная энергия делится на функции, описывающие дискретные вклады, такие как энергии Ван-дер-Ваальса, электростатические взаимодействия, энергия кручения, энергия водородных связей, деформации связей и углов (Бок , 1983). Данные представлены в виде компьютерных карт энергетических контуров.
Этот подход «твердой сферы», первоначально разработанный В.С.Р. Рао в середине 1970-х годов, представляет собой рудиментарный метод теоретических расчетов, который игнорирует электростатические эффекты (водородные связи), но дает качественное предсказание структуры. Впоследствии этот подход был расширен за счет адаптации расчетов энергии, первоначально использовавшихся для пептидов, где потенциальная энергия делится на функции, описывающие дискретные вклады, такие как энергии Ван-дер-Ваальса, электростатические взаимодействия, энергия кручения, энергия водородных связей, деформации связей и углов (Бок , 1983). Данные представлены в виде компьютерных карт энергетических контуров.
В большей части недавней литературы расчеты конформационной энергии были выполнены с использованием формы параметров Рао с добавленным торсионным потенциалом относительно одной из гликозидных связей (экзоаномерный эффект). Этот подход, получивший название HSEA (экзоаномерный метод твердых сфер) (Bock, 1983), с успехом использовался Лемье и Боком (1983), Карвером и Бриссоном (1984) и другими, хотя он содержит ряд непроверенных предположений.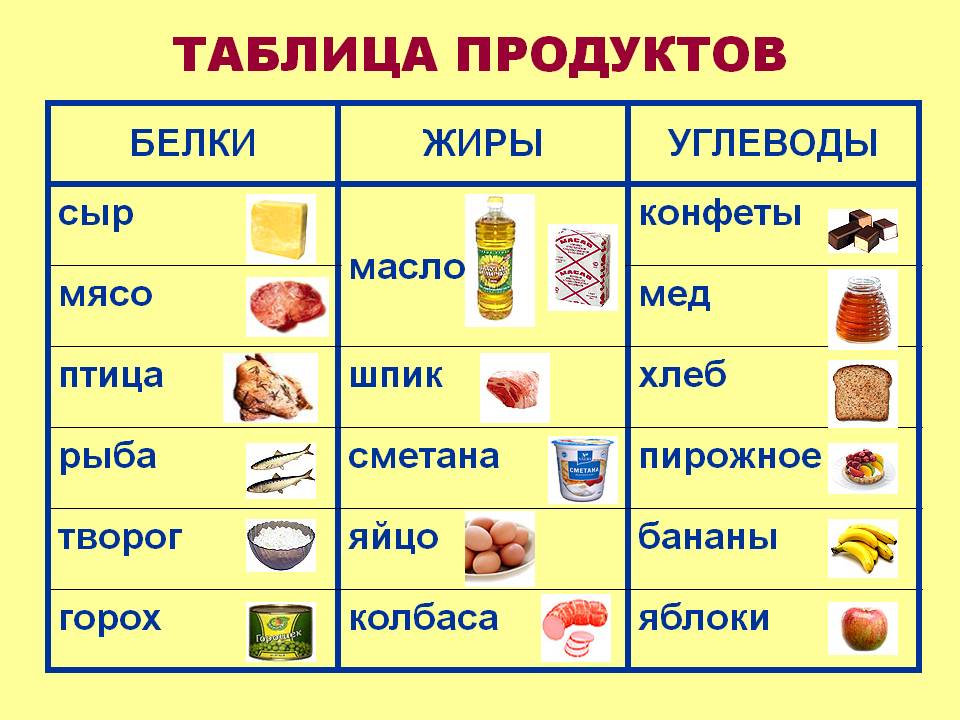 Добавление потенциала водородной связи (метод HEAH) дает результаты минимизации энергии, которые отличаются от результатов, рассчитанных методом HSEA, из которых можно получить геометрию, отличающуюся от геометрии, полученной методом HSEA.
Добавление потенциала водородной связи (метод HEAH) дает результаты минимизации энергии, которые отличаются от результатов, рассчитанных методом HSEA, из которых можно получить геометрию, отличающуюся от геометрии, полученной методом HSEA.
ЯМР РАСТВОРЫ СТРУКТУРЫ УГЛЕВОДОВ
Методы протонного ЯМР предоставляют подробные экспериментальные данные, на основании которых можно определить трехмерные структуры и сравнить их с конформациями, полученными расчетами потенциальной энергии. Карвер и Камминг (1987) создали контурные карты рассчитанных NOE различных олигосахаридов с высоким содержанием маннозы в зависимости от торсионных углов φ и ψ. Затем они связали их с экспериментальными результатами, а также с конформациями минимальной энергии, оцененными с помощью различных расчетов потенциальной энергии (Карвер и Камминг, в печати). Бриссон и Карвер (1983) оценил полезность этого подхода с использованием двух гликопептидов биантеннарного сложного типа (см. ). Поскольку конформации, полученные с помощью NOE, находились в диапазоне, центрированном на конформациях с минимальной энергией, полученных из расчетов потенциальной энергии, был сделан вывод, «что усреднение движения ограничено узким диапазоном около одной стабильной конформации» (Brisson and Carver, 1983). Однако теперь оказывается, что бессмысленно искать единственную конформацию, полученную из NOE, которая удовлетворяет одному минимуму потенциальной энергии, потому что фактически молекулы могут занимать такие минимумы в течение очень небольшой части времени в растворе. «Конформационная гибкость должна быть включена в теоретическую трактовку» (Карвер и Камминг, 19).87), и расчет энергетических поверхностей становится чрезвычайно важным. Последние исследования Камминга и Карвера показывают, что трехмерные структуры, определяемые NOE, могут значительно отличаться от любой конформации с минимальной энергией. Из этого они пришли к выводу, что конформации, полученные из NOE, в таких случаях могут соответствовать «виртуальным» конформациям, как определено Jardetzky (1980), как вычисленные структуры, которые на самом деле принимают лишь немногие молекулы в растворе, если вообще какие-либо.
Однако теперь оказывается, что бессмысленно искать единственную конформацию, полученную из NOE, которая удовлетворяет одному минимуму потенциальной энергии, потому что фактически молекулы могут занимать такие минимумы в течение очень небольшой части времени в растворе. «Конформационная гибкость должна быть включена в теоретическую трактовку» (Карвер и Камминг, 19).87), и расчет энергетических поверхностей становится чрезвычайно важным. Последние исследования Камминга и Карвера показывают, что трехмерные структуры, определяемые NOE, могут значительно отличаться от любой конформации с минимальной энергией. Из этого они пришли к выводу, что конформации, полученные из NOE, в таких случаях могут соответствовать «виртуальным» конформациям, как определено Jardetzky (1980), как вычисленные структуры, которые на самом деле принимают лишь немногие молекулы в растворе, если вообще какие-либо.
РИСУНОК 8-3
Структуры двух частично процессированных аспарагиновых связанных углеводных цепей.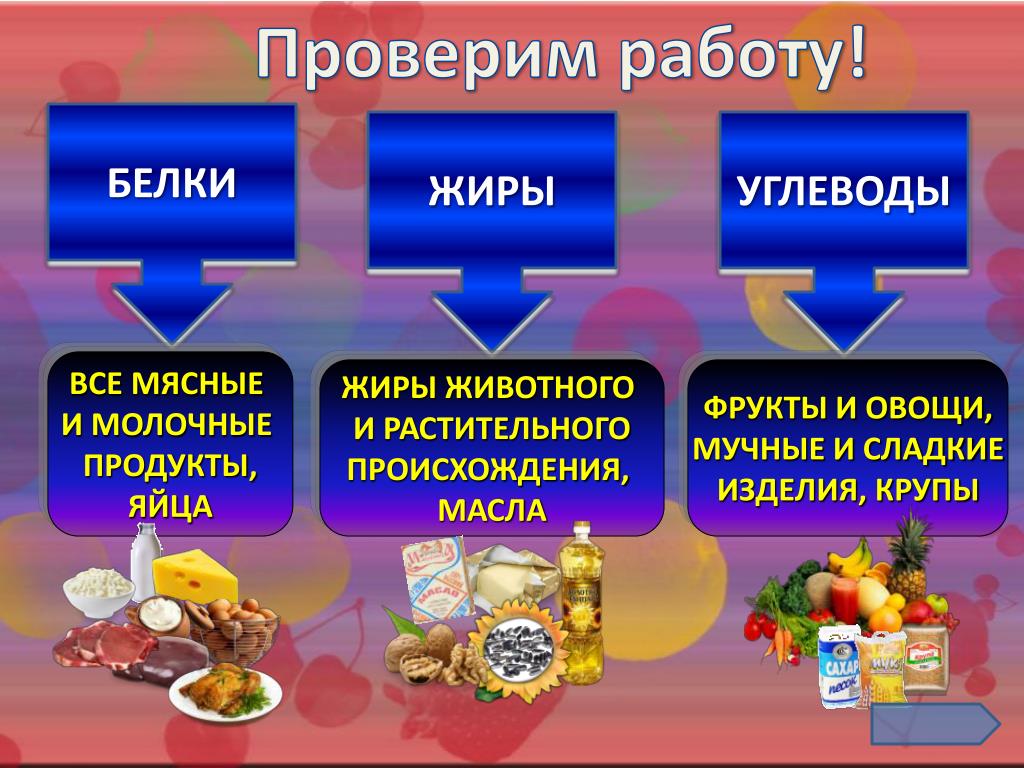 Разделение пополам β1,4GlcNAc B вызывает конформационное отличие от A.
Разделение пополам β1,4GlcNAc B вызывает конформационное отличие от A.
Scarsdale et al. (в печати) использовали программу, основанную на молекулярной механике, в попытке смоделировать конформационное усреднение данных ЯМР. Конформации рассчитывали с использованием комбинации молекулярных потенциалов и данных ЯМР для олигосахаридной части эритроцитарного гликолипида, состоящего из трех нейтральных сахаров и аминосахара. Конформер с наименьшей энергией очень напоминал структуру, предложенную ранее. Однако соответствие данным можно улучшить, если рассмотреть два уравновешивающих конформера. Таким образом, можно определить конформации растворов сложных углеводов даже в нежестких случаях, используя комбинацию расчетов и ограничений, налагаемых экспериментальными данными ЯМР.
Несмотря на поднятые вопросы об интерпретации результатов ЯМР и ценности потенциальной минимизации энергии, была собрана некоторая важная информация о взаимодействиях углеводных антигенов с антителами (Lemieux et al. , 1985), олигосахаридов с лектинами, такими как конканавалин А ( Sekharudu et al., 1986), и олигосахариды с ферментами гликозилтрансферазами (Carver and Cumming, 1987). Дальнейшие уточнения будут зависеть от разработки согласованного набора функций потенциальной энергии, которые можно использовать с экспериментально определенными трехмерными структурами, полученными из NOE, для оценки того, распределяется ли данная молекула между несколькими низкоэнергетическими конформациями или занимает конкретную форму. их подмножество. Твароска и Перес (1986) недавно сравнили несколько расчетов конформационной энергии и предложили общую стратегию для олигосахаридов.
, 1985), олигосахаридов с лектинами, такими как конканавалин А ( Sekharudu et al., 1986), и олигосахариды с ферментами гликозилтрансферазами (Carver and Cumming, 1987). Дальнейшие уточнения будут зависеть от разработки согласованного набора функций потенциальной энергии, которые можно использовать с экспериментально определенными трехмерными структурами, полученными из NOE, для оценки того, распределяется ли данная молекула между несколькими низкоэнергетическими конформациями или занимает конкретную форму. их подмножество. Твароска и Перес (1986) недавно сравнили несколько расчетов конформационной энергии и предложили общую стратегию для олигосахаридов.
Компьютерное время и доступ к соответствующим процессорам массива параллельной обработки являются важными соображениями при определении уровня поддержки исследований в этой области в настоящее время. Доступность машин для очень быстрого расчета межатомных расстояний и вкладов Ван-дер-Ваальса — это вопрос, который должны решать финансирующие агентства. Интересно, что несколько суперкомпьютеров, работающих в настоящее время в кампусах, не используются на полную мощность; возможно, усилия соответствующих консультативных групп в этих центрах должны быть направлены на разработку необходимого программного обеспечения для этих компьютеров и установление политики, которая будет направлять часть их времени на компьютерное моделирование трехмерных структур.
Интересно, что несколько суперкомпьютеров, работающих в настоящее время в кампусах, не используются на полную мощность; возможно, усилия соответствующих консультативных групп в этих центрах должны быть направлены на разработку необходимого программного обеспечения для этих компьютеров и установление политики, которая будет направлять часть их времени на компьютерное моделирование трехмерных структур.
НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА
Структуры, состоящие из более чем одной макромолекулы, взаимодействуют как единое целое в биологических явлениях, таких как катализ многими ферментами, связывание на клеточной поверхности, передача сигнала через клеточные мембраны и другие биологические явления. Любой фермент, состоящий более чем из одной субъединицы, следует рассматривать как надмолекулярную структуру. Когда задействовано большое количество субъединиц и, возможно, они выполняют более одной функции, может потребоваться особое внимание к их относительной пространственной ориентации.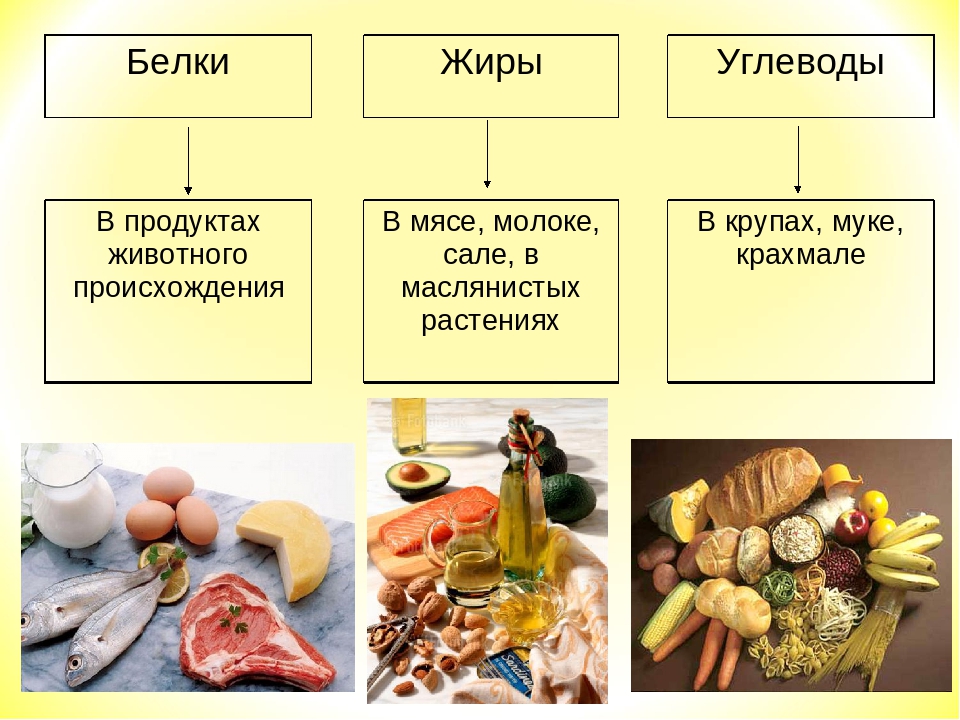

 Употребление в пищу продуктов, богатых клетчаткой, может помочь вам чувствовать себя сытым и снизить вероятность переедания. Богатые клетчаткой продукты также могут помочь решить проблемы с желудком или кишечником, такие как запор.
Употребление в пищу продуктов, богатых клетчаткой, может помочь вам чувствовать себя сытым и снизить вероятность переедания. Богатые клетчаткой продукты также могут помочь решить проблемы с желудком или кишечником, такие как запор. Обычные сыры, пицца, зерновые и молочные десерты являются обычными источниками насыщенных жиров в нашей пище.
Обычные сыры, пицца, зерновые и молочные десерты являются обычными источниками насыщенных жиров в нашей пище.