Артропатия — лечение, симптомы, причины, диагностика
Артропатия это общий термин, который применяется для обозначения поражений суставов дистрофической природы различного генеза (нарушения иннервации, эндокринные заболевания или метаболические нарушения или онкологические процессы, различные инфекции). При невропатической артропатии изменения в суставах возникают вследствие нарушений чувствительности рецепторов, которые могут повреждаться при таких заболеваниях, как сахарный диабет, инфекции, анемия, спина бифида или при таком заболевании, как амилоидоз. При метаболической артропатии, например, подагре или пирофосфатной артропатии, происходит накопление кристаллов в суставах и развитие дистрофических процессов. Артропатия нередко обусловлена травмами суставов, нестабильностью суставов или дегенеративными изменениями в суставах.
Из дегенеративных заболеваний суставов наиболее распространен остеоартроз, при котором происходит постепенная дегенерации структур сустава – сначала изменения происходят в хрящевой ткани, с постепенным истончением, а затем образованием костных разрастаний, вследствие нарушения фрикционных свойств суставного хряща. Кроме того, при наличии нестабильности возможен отрыв кусочков хряща с образованием суставной мыши, что приводит к крепитации или эпизодам блокировки сустава. Артропатия может развиваться также в результате воспалительных заболеваний суставов, таких как ревматоидный артрит, болезнь Бехтерева или аутоиммунных заболеваний (неспецифический язвенный колит болезнь Крона системная красная волчанка или полимиалгия. Артропатия может быть также связана с реактивным артритом, вследствие инфекций причиной, которой могут быть операции, инъекции, укусы насекомых или животных, абсцессы, остеомиелит, сепсис.
Кроме того, при наличии нестабильности возможен отрыв кусочков хряща с образованием суставной мыши, что приводит к крепитации или эпизодам блокировки сустава. Артропатия может развиваться также в результате воспалительных заболеваний суставов, таких как ревматоидный артрит, болезнь Бехтерева или аутоиммунных заболеваний (неспецифический язвенный колит болезнь Крона системная красная волчанка или полимиалгия. Артропатия может быть также связана с реактивным артритом, вследствие инфекций причиной, которой могут быть операции, инъекции, укусы насекомых или животных, абсцессы, остеомиелит, сепсис.
Наиболее подвержены риску развития артропатии пациенты с наличием таких заболеваний, как сахарный диабет или дегенеративные заболеваний суставов. Заболеваемость артропатиями не имеет точных статистических данных, так как появление артропатии вторично по отношению к основному заболеванию.
Симптомы
Основным симптомом артропатии являются боли в суставе или околосуставной области.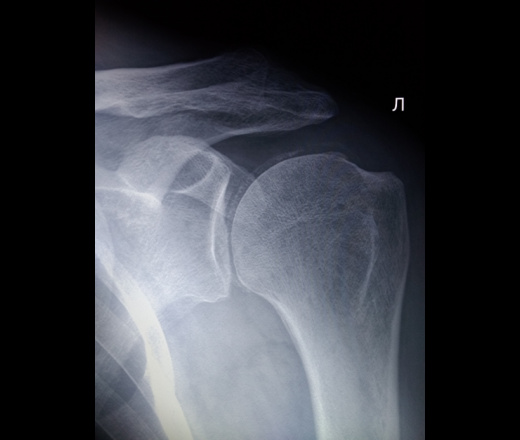 Боли могут быть как в одном суставе, так и нескольких в зависимости от заболевания, которое послужило причиной артропатии. Кроме болевого синдрома возможно появление отечности и припухлости в области сустава, в результате воспалительной реакции. Болевой синдром может усиливаться при нагрузках или спровоцирован обострением основного заболевания или нарушением диеты как, например, при подагре или псевдоподагре. Кроме того, при некоторых формах артропатии возможно нарушение функции сустава, нестабильность сустава (посттравматическая артропатия или невропатическая артропатия). Все симптомы при артропатии неспецифичны и аналогичны тем, что возникают при других заболеваниях суставов.
Боли могут быть как в одном суставе, так и нескольких в зависимости от заболевания, которое послужило причиной артропатии. Кроме болевого синдрома возможно появление отечности и припухлости в области сустава, в результате воспалительной реакции. Болевой синдром может усиливаться при нагрузках или спровоцирован обострением основного заболевания или нарушением диеты как, например, при подагре или псевдоподагре. Кроме того, при некоторых формах артропатии возможно нарушение функции сустава, нестабильность сустава (посттравматическая артропатия или невропатическая артропатия). Все симптомы при артропатии неспецифичны и аналогичны тем, что возникают при других заболеваниях суставов.
Диагностика
В первую очередь, для диагностики артропатии имеет большое значение история заболевания. Наличие травмы в анамнезе, характер и время появление болей. Наличие у пациента сопутствующих соматических заболеваний (сахарный диабет, подагра или ревматоидный артрит). Кроме того, необходима информация о наличии инфекций, оперативных вмешательств, наличие общих симптомов интоксикации (лихорадка, потеря веса, общая слабость). Физикальное обследование позволяет определить наличие локальной болезненности в области сустава, припухлости или отечности, определить возможную амплитуду движений в суставе, наличие крепитации. Кроме того, возможно проведение функциональных тестов для определения возможной нестабильности.
Физикальное обследование позволяет определить наличие локальной болезненности в области сустава, припухлости или отечности, определить возможную амплитуду движений в суставе, наличие крепитации. Кроме того, возможно проведение функциональных тестов для определения возможной нестабильности.
Лабораторные исследования. Анализы крови могут диагностировать наличие воспалительного процесса как, например увеличение СОЭ, С – реактивного белка, изменения в лейкоцитарной формуле, изменения в уровне гемоглобина или количества эритроцитов. Анализы биохимические позволяют определить наличие метаболических нарушений (например, сахарный диабет или подагра). Иммуноферментные анализы позволяют определить наличие специфических антител к инфекциям или к собственным тканям. Возможно также лабораторное исследование пунктата синовиальной жидкости.
Рентгенография позволяет обнаружить истончение суставного хряща, наличие остеофитов, наличие увеличения суставов, подвывихов суставов. МРТ и КТ исследования применяются для дифференциальной диагностики с другими заболеваниями суставов и более качественной визуализации тканей суставов. Сканирование костей с использованием радиоизотопов необходимо в случае подозрения на онкологические заболевания или дифференциации стрессовых переломов.
Сканирование костей с использованием радиоизотопов необходимо в случае подозрения на онкологические заболевания или дифференциации стрессовых переломов.
Лечение
Лечение зависит от конкретного заболевания или причины развития артропатии и привело к развитию болевого синдрома и воспаления в суставах. Нередко компенсация основного заболевания позволяет значительно минимизировать симптоматику со стороны суставов.
Разгрузка сустава необходима при выраженном болевом синдроме или же наличия травмы в анамнезе. Возможно также применение ортезов для снижения нагрузки на сустав.
Медикаментозное лечение. Применение препаратов НПВС оправдано при наличии воспалительной реакции и позволяет приостановить воспалительный процесс в суставах и деструктивные нарушения. Особенно эффективно применение этих препаратов при наличии таких заболеваний, как ревматоидный артрит. При остеоартрозе применение препаратов НПВС помогает уменьшить симптомы, но не прогрессирование заболевания. Применение антибиотиков показано при наличии вторичного поражения суставов инфекциями. Возможно также локальное введение стероидов, как короткого действия, так и пролонгированных. Кроме того, при наличии остеоартроза возможно внутрисуставное введение эндопротезов синовиальной жидкости или производных гиалуроновой кислоты. Возможен прием хондропротекторов курсами, что позволяет в определенной степени притормозить дегенеративные изменения в суставах.
Применение антибиотиков показано при наличии вторичного поражения суставов инфекциями. Возможно также локальное введение стероидов, как короткого действия, так и пролонгированных. Кроме того, при наличии остеоартроза возможно внутрисуставное введение эндопротезов синовиальной жидкости или производных гиалуроновой кислоты. Возможен прием хондропротекторов курсами, что позволяет в определенной степени притормозить дегенеративные изменения в суставах.
Физиотерапия позволяет уменьшить воспалительный процесс, уменьшить болевые проявления, улучшить кровообращение в суставе и околосуставных тканях.
ЛФК. Дозированные физические нагрузки позволяют восстановить мышечный тонус и улучшить стабильность и опорную функцию суставов.
Хирургические методы лечения показаны в случаях тяжелой артропатии. Например, при гипертрофической фасеточной артропатии применяется частичная фасетэктомия или же применяется спондилодез (фиксация) позвонков при наличии выраженной нестабильности. Возможно также полная замена сустава (эндопротезирование) коленного или тазобедренного сустава в тех случаях, когда есть выраженные морфологические изменения в суставах и есть значительные нарушения функций.
Возможно также полная замена сустава (эндопротезирование) коленного или тазобедренного сустава в тех случаях, когда есть выраженные морфологические изменения в суставах и есть значительные нарушения функций.
Прогноз при артропатии зависит от основного заболевания. Симптоматика при системных инфекциях может исчезнуть по мере выздоровления. Если же речь идет о таких заболеваниях как остеоартроз, ревматоидный артрит, или псориатический артрит или подагра, то симптоматика будет появляться и исчезать по мере перехода заболевания из стадии обострения в стадию ремиссии.
Болезнь депонирования кристаллов пирофосфата кальция (пирофосфатная артропатия) | #04/13
В последнее время пристально изучается роль кристаллов пирофосфата кальция (ПФК) дигидрата в развитии патологии опорно-двигательного аппарата. Распространенность болезней, связанных с отложением кристаллов кальция, нарастает с увеличением возраста пациентов, составляя 10–15% у больных 65–75 лет и достигая 40% у лиц старше 80 лет. Понятие частоты встречаемости пирофосфатной артропатии достаточно условно, так как болезнь может маскироваться остеоартрозом (ОА), ревматоидным артритом, подагрой, проявляться в виде недифференцированного артрита, что затрудняет ее своевременную диагностику [1].
Понятие частоты встречаемости пирофосфатной артропатии достаточно условно, так как болезнь может маскироваться остеоартрозом (ОА), ревматоидным артритом, подагрой, проявляться в виде недифференцированного артрита, что затрудняет ее своевременную диагностику [1].
Кристаллы ПФК в хряще и в синовиальной жидкости при ОА определяются у 65% больных гонартрозом [2, 3]. ПФК в большом количестве образуется хондроцитами, но быстро разрушается неорганической пирофосфатазой. В культуре хондроцитов кристаллы ПФК стимулируют митогенез, продукцию матричных металлопротеиназ, простагландинов и провоспалительных цитокинов. Полагают, что при болезни депонирования кристаллов ПФК в суставном хряще локально нарушается обмен пирофосфата: повышается его образование или снижается активность пирофосфатазы. Ингибирование последней при некоторых указанных патологических процессах может быть обусловлено повышенным содержанием железа и меди, которые служат ядрами кристаллизации, вокруг которых формируются кристаллы ПФК.
Диагностика депозиции ПКФ
При подозрении на отложение кристаллов ПФК следует анализировать у пациента факторы риска и сопутствующие болезни, включая ОА, частую микротравматизацию суставов, лучевую нагрузку, нормофосфатемическую гиперфосфатурию и др. У больных в возрасте до 60 лет необходимо диагностировать метаболические болезни с нарушением кальциевого обмена (первичный гиперпаратиреоз, гипомагниемия, гемохроматоз) и семейную предрасположенность, особенно в случаях полиартикулярного поражения.
У больных в возрасте до 60 лет необходимо диагностировать метаболические болезни с нарушением кальциевого обмена (первичный гиперпаратиреоз, гипомагниемия, гемохроматоз) и семейную предрасположенность, особенно в случаях полиартикулярного поражения.
Подтверждают депозицию ПФК поляризационной световой микроскопией в виде характерных кристаллов (параллелепипедной формы, преимущественно внутриклеточных, со слабым светоотражением или его отсутствием) в синовиальной жидкости. Следует учитывать, что при исследовании в поляризованном свете определяется примерно 1/5 часть всех кристаллов ПФК. В последнее время для визуализации кристаллов ПФК предлагается использовать люминесцентную микроскопию с применением кальций-чувствительного флуоресцентного зонда Fluo-4. Данный метод позволяет проводить и проточную цитометрию для быстрого полуколичественного анализа кристаллов.
Рентгенологически выявляемый хондрокальциноз (ХК) подтверждает наличие депозитов ПФК, но его отсутствие не исключает этих депозитов. Рентгенограммы соответствующего качества являются легким и надежным методом возможного обнаружения депозитов ПФК как в суставных, так и периартикулярных тканях [5]. Рентгенологическая картина ХК (рис. 1) напоминает деформирующий остеоартроз, но локализация изменений отличается от него. Отличительный признак ХК — обызвествление хряща как крупных опорных, так и мелких суставов, а также суставной капсулы и мягких тканей. Как правило, в начале болезни наблюдается поражение одного или обоих (медиального и латерального) бедренно-большеберцовых сочленений и тяжелое поражение бедренно-надколенникового сочленения (иногда бывает изолированным). Заподозрить ХК позволяет слабо выраженное обызвествление суставов запястья и суставного диска лучезапястного сустава. Ультразвуковое исследование на приборе высокого разрешения может визуализировать депозиты кристаллов ПФК обычно в виде гиперэхогенных включений внутри гиалинового и/или фиброзного хряща в 68,7% случаев при ХК.
Рентгенограммы соответствующего качества являются легким и надежным методом возможного обнаружения депозитов ПФК как в суставных, так и периартикулярных тканях [5]. Рентгенологическая картина ХК (рис. 1) напоминает деформирующий остеоартроз, но локализация изменений отличается от него. Отличительный признак ХК — обызвествление хряща как крупных опорных, так и мелких суставов, а также суставной капсулы и мягких тканей. Как правило, в начале болезни наблюдается поражение одного или обоих (медиального и латерального) бедренно-большеберцовых сочленений и тяжелое поражение бедренно-надколенникового сочленения (иногда бывает изолированным). Заподозрить ХК позволяет слабо выраженное обызвествление суставов запястья и суставного диска лучезапястного сустава. Ультразвуковое исследование на приборе высокого разрешения может визуализировать депозиты кристаллов ПФК обычно в виде гиперэхогенных включений внутри гиалинового и/или фиброзного хряща в 68,7% случаев при ХК.
Однако отсутствие признаков ХК при рентгенологическом и ультразвуковом методах исследования не должно быть причиной пересмотра диагноза, так как может быть связано со значительным разрушением хряща и небольшими размерами депозитов [1].
Сцинтиграфия и магнитно-резонансная томография (МРТ) в диагностике ХК в настоящее время не применяются, поскольку обызвествление дисков и связок лучше визуализируется при компьтерной томографии (КТ). Предварительный диагноз, как правило, ставят по данным рентгенологического исследования и подтверждают наличием кристаллов в синовиальной жидкости.
Клинические формы болезни депонирования ПФК
Отложение кристаллов ПФК характеризуется большим спектром клинических фенотипов — от бессимптомной формы до острой (псевдоподагра) и хронической (остеоартроз с депозицией кристаллов ПФК, хронический артрит с кристаллами ПФК, ХК).
Острый артрит, или псевдоподагра, составляет 25% случаев болезни депонирования ПФК. Распространенность данной патологии среди взрослых пациентов в возрасте 40–79 лет составляет 2,4–4,5%. Острый артрит — результат образования и депонирования кристаллов ПФК в суставах с развивающимся в этой связи воспалением иммунного характера. Псевдоподагра характеризуется болью, гиперемией и отеком сустава, достигающих пика за 12–36 ч.
Пациенты с идиопатической псевдоподагрой, как правило, старше 55–60 лет. Важную роль в возникновении острой атаки играют изменения электролитного баланса с колебаниями концентрации кальция в сыворотке крови. Как и при истинной подагре, провоцирующими факторами могут быть травма, хирургическое вмешательство, нарушение мозгового кровообращения и инфаркт миокарда. Отмечена сезонность — приступы достоверно чаще возникают весной.
Хронический артрит с кристаллами ПФК составляет 5% болезней депонирования ПФК. Он предполагает наличие суставного синдрома с системным воспалением (подъем уровня С-реактивного белка (СРБ) в крови и увеличение скорости оседания эритроцитов (СОЭ)), утренней скованностью движений, семейным артрологическим анамнезом. Суставной синдром проявляется симметричным поражением пястно-фаланговых (обычно II–III пальцев), коленных, лучезапястных и локтевых суставов. Воспалительный процесс вялотекущий, может длиться недели и месяцы. При осмотре обнаруживают ограничение подвижности сустава и сгибательную контрактуру (псевдоревматоидная форма). У 10% больных, как и у здоровых пожилых людей, определяется ревматоидный фактор в низком титре.
Остеоартроз с депозитами ПФК возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, рентгенологически обычно обнаруживают хондрокальциноз. При этом, в отличие от ОА без отложения кристаллов ПФК, наблюдается больше воспалительных признаков и атипичное поражение (лучезапястный или среднезапястный, плечевой, суставы средней части стопы), менее выраженный остеофитоз и кистовидная перестройка.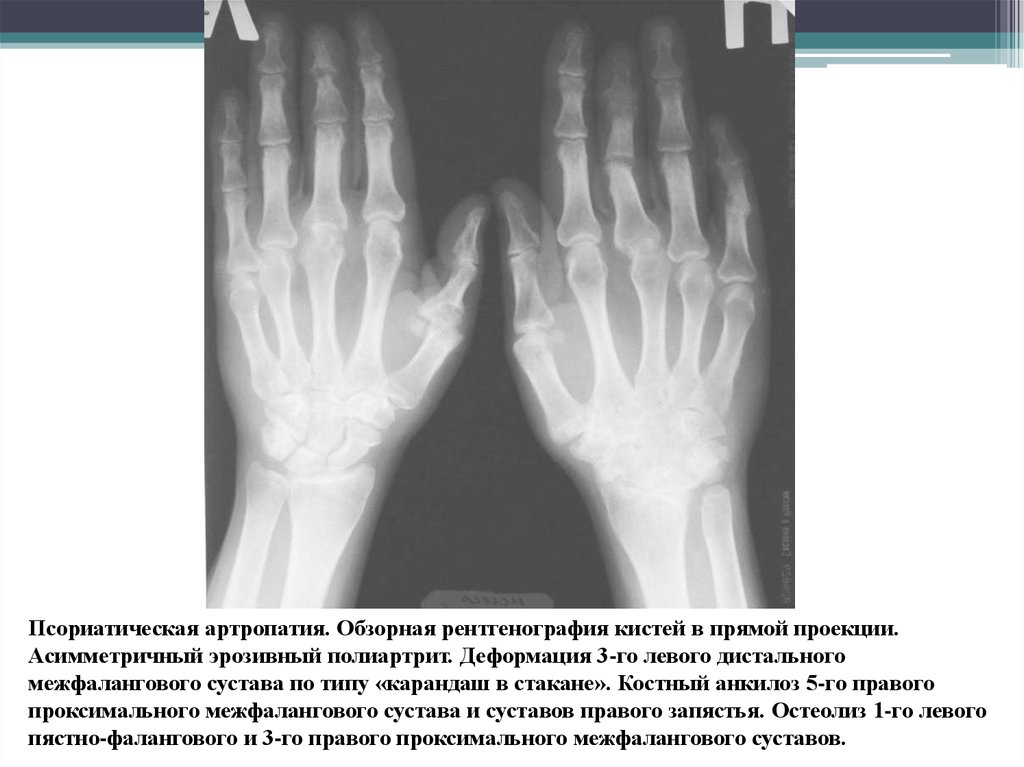
При ОА с депозитами ПФК развиваются выраженные дегенеративные изменения в пястно-фаланговых, лучезапястных, локтевых, плечевых и коленных суставах. Чаще поражается латеральная часть коленного сустава, с двусторонней или односторонней вальгусной деформацией или «стучащими коленями». Нередко наблюдается также изолированный пателлофеморальный ОА. Характерные признаки ОА с депонированием ПФК — сгибательная контрактура пораженных суставов и симметричность процесса. Более чем у 50% больных наблюдаются периодически приступы псевдоподагры.
«Излюбленная» локализация депозитов кристаллов ПФК — мениски коленных суставов (рис. 2, 3). Последние играют жизненно важную роль в передаче нагрузки, амортизации и стабильности сустава. Дегенерация и кальцификация менисков — ключевые особенности ОА коленных суставов. Появляется все больше данных, что мениски коленных суставов не остаются пассивными в процессе развития ОА. Дегенерация менисков способствует сужению межсуставной щели. Кальцификация менисков нарастает с возрастом и коррелирует с поражением хряща у лиц без симптомов артрита в анамнезе.
Хондрокальциноз — кальцификация суставного хряща чаще не сопровождается клиническими проявлениями. Старение — главный фактор риска спорадического ХК.
Артроскопия при ХК позволяет определить отсутствие депозитов ПФК в синовиальной оболочке, морфологические признаки воспаления при этом менее выражены, но участки атрофии обширны. Мелкоточечные депозиты пирофосфата кальция обнаруживаются в суставном хряще у всех больных с ХК. У большинства обследованных старше 40 лет имелись также признаки ОА.
Лечение
В рекомендациях Европейской противоревматической лиги (European League Against Rheumatism, EULAR) [6] сформулированы ключевые пункты для лечения и профилактики болезни депонирования, кристаллов ПФК, включающие немедикаментозное и медикаментозное лечение. Так, в случае острого артрита с кристаллами ПФК оптимальное лечение включает холодовые аппликации, покой, аспирацию синовиальной жидкости и внутрисуставное введение длительно действующих глюкокортикоидов. Эффективны нестероидные противовоспалительные препараты (НПВП) (перорально) и низкие дозы колхицина (0,5 мг 3–4 раза в день с начальной дозы в 2 мг или без нее), но применение последних лимитируется коморбидностью пациентов и токсичностью колхицина.
Так, в случае острого артрита с кристаллами ПФК оптимальное лечение включает холодовые аппликации, покой, аспирацию синовиальной жидкости и внутрисуставное введение длительно действующих глюкокортикоидов. Эффективны нестероидные противовоспалительные препараты (НПВП) (перорально) и низкие дозы колхицина (0,5 мг 3–4 раза в день с начальной дозы в 2 мг или без нее), но применение последних лимитируется коморбидностью пациентов и токсичностью колхицина.
ОА с пирофосфатной кальцификацией протекает с упорным болевым и воспалительным синдромом, что является показанием для постоянной потребности в НПВП. При обсуждении вопроса о выборе НПВП у этих пациентов следует учитывать следующие положения [7]: при пероральном приеме, учитывая наличие «микрокристаллических атак», должна достаточно быстро создаваться терапевтическая концентрация НПВП в крови и синовиальной жидкости, то есть он должен хорошо проникать через синовиальную мембрану. НПВП должен обладать достаточно выраженными противовоспалительными свойствами, подавляя не только синтез провоспалительных цитокинов (интерлейкинов (ИЛ) ИЛ-1 бета и ИЛ-6, фактора некроза опухоли альфа, простогландина Е2) в синовии, но и ингибируя фагоцитарную и хемотаксическую активность моноцитарных макрофагов, а также не оказывать негативного воздействия на метаболизм хондроцитов.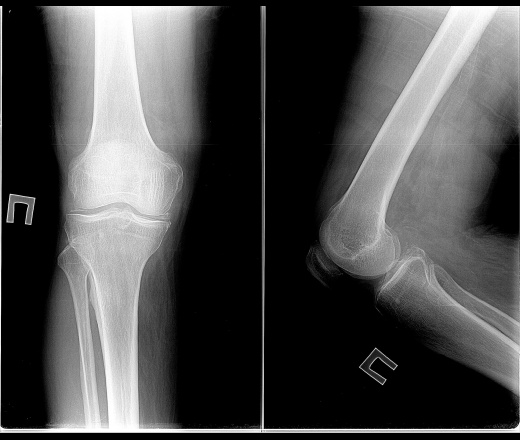 Учитывая преимущественно пожилой возраст данной группы больных, применяемый НПВП должен характеризоваться высоким профилем безопасности, то есть, как минимум, обладать селективностью к циклооксигеназе-2 (ЦОГ-2-селективностью) и не увеличивать риск сердечно-сосудистых осложнений.
Учитывая преимущественно пожилой возраст данной группы больных, применяемый НПВП должен характеризоваться высоким профилем безопасности, то есть, как минимум, обладать селективностью к циклооксигеназе-2 (ЦОГ-2-селективностью) и не увеличивать риск сердечно-сосудистых осложнений.
В фокусе внимания и интереса российских врачей и пациентов, впрочем, как и европейских, уже достаточное время находится препарат из группы НПВП — ацеклофенак (Аэртал), показанный для лечения боли и воспаления при суставном синдроме, в том числе при остеоартрозе и боли в спине. Ведущим механизмом противовоспалительной и анальгетической активности его является преимущественное подавление активности ЦОГ-2.
Ацеклофенак (Аэртал) обладает улучшенной переносимостью из-за слабого угнетения простагландинов слизистой оболочки желудка. Коэффициент ЦОГ-2/ЦОГ-1, то есть средняя ингибирующая концентрация, для Аэртала равняется 0,26 мкМ. Клинические исследования ацеклофенака (Аэртала) показали, что и после перорального приема препарат быстро и хорошо абсорбируется и связывается с белками плазмы до 99%, выделяется с мочой в виде гидроксилированных метаболитов. Пик его плазменной концентрации достигается через 1–3 ч, время жизни препарата составляет 4 часа. Приблизительно 60% плазменного уровня ацеклофенака проникает в синовиальную жидкость, подавляя местную активность, что особенно важно для пожилых пациентов с остеоартрозом. Важно отметить, что не выявлено взаимодействия Аэртала с диуретиками, не отмечено тенденции к повышению артериального давления и осмолярности мочи, а при совместном приеме с ингибиторами ангиотензинпревращающего фермента, антикоагулянтами, антидиабетическими препаратами не выявлено отрицательного клинического взаимовлияния друг на друга.
Пик его плазменной концентрации достигается через 1–3 ч, время жизни препарата составляет 4 часа. Приблизительно 60% плазменного уровня ацеклофенака проникает в синовиальную жидкость, подавляя местную активность, что особенно важно для пожилых пациентов с остеоартрозом. Важно отметить, что не выявлено взаимодействия Аэртала с диуретиками, не отмечено тенденции к повышению артериального давления и осмолярности мочи, а при совместном приеме с ингибиторами ангиотензинпревращающего фермента, антикоагулянтами, антидиабетическими препаратами не выявлено отрицательного клинического взаимовлияния друг на друга.
Наболее значимым из исследований по применению ацеклофенака на сегодня принимается Европейское когортное исследование, включающее 23 407 пациентов с острой и хронической болью воспалительного происхождения и/или вследствие ревматических заболеваний, таких как остеоартроз, ревматоидный артрит, анкилозирующий спондилоартрит с целью получения практического опыта по применению препарата, а также оценки степени удовлетворенности пациентов и врачей проводимой терапией и накопления опыта применения ацеклофенака вне условий контролируемых клинических испытаний. Пациенты были переведены на терапию ациклофенаком либо потому, что предыдущий прием НПВП не был эффективным (45,5%), либо из-за плохой переносимости препарата (35%), или из-за комбинации этих двух причин (19,5%). Ацеклофенак назначали по 100 мг 2 раза в день, диклофенак в эквивалентной дозе — по 75 мг 2 раза в сутки (соотношение больных, принимавших эти препараты, было 3:1). Период лечения составлял 12 мес. При клинической оценке ацеклофенака 90% пациентов и 84% врачей подтвердили его высокую терапевтическую эффективность и были удовлетворены результатами лечения. Обезболивающий эффект препарата наступал быстро и на протяжении всего периода наблюдения продолжал усиливаться. Интенсивность боли при первом визите к врачу была оценена как тяжелая у 41% больных, при втором визите — только у 5%, а при третьем — у 2%. Пациенты с умерено выраженным болевым синдромом на втором визите в 32% случаев отрицали наличие боли, остальные пациенты описывали болевой синдром как легкий. Общее состояние 84% больных на втором визите было оценено врачами как значительное улучшение.
Пациенты были переведены на терапию ациклофенаком либо потому, что предыдущий прием НПВП не был эффективным (45,5%), либо из-за плохой переносимости препарата (35%), или из-за комбинации этих двух причин (19,5%). Ацеклофенак назначали по 100 мг 2 раза в день, диклофенак в эквивалентной дозе — по 75 мг 2 раза в сутки (соотношение больных, принимавших эти препараты, было 3:1). Период лечения составлял 12 мес. При клинической оценке ацеклофенака 90% пациентов и 84% врачей подтвердили его высокую терапевтическую эффективность и были удовлетворены результатами лечения. Обезболивающий эффект препарата наступал быстро и на протяжении всего периода наблюдения продолжал усиливаться. Интенсивность боли при первом визите к врачу была оценена как тяжелая у 41% больных, при втором визите — только у 5%, а при третьем — у 2%. Пациенты с умерено выраженным болевым синдромом на втором визите в 32% случаев отрицали наличие боли, остальные пациенты описывали болевой синдром как легкий. Общее состояние 84% больных на втором визите было оценено врачами как значительное улучшение. При этом оценки врача и пациента полностью совпадали. Авторы отмечают высокую комплаентность (94%), то есть аккуратное выполнение пациентами всех назначений врача на фоне приема этого препарата [8].
При этом оценки врача и пациента полностью совпадали. Авторы отмечают высокую комплаентность (94%), то есть аккуратное выполнение пациентами всех назначений врача на фоне приема этого препарата [8].
Исследование Y. Henrotin и соавт. [9] показало, что ацеклофенак способен подавлять процессы деградации матрикса хряща за счет ингибирования активности ИЛ-1 бета, а за счет этого сохранять в нем физиологическую стимуляцию глюкозаминогликанов и восстанавливать синтез антагониста рецепторов ИЛ-1 бета и как результат их совместного эффекта — подавлять продукцию металлопротеиназ.
А. Yanagawa и cоавт. [10] провели сравнительное исследование с гастроскопическим контролем в динамике, которое показало, что диклофенак в значительной степени нарушает содержание гексозамина и локальный кровоток в слизистой оболочке желудка, а при терапии ацеклофенаком, напротив, содержание гексозамина в слизистой оболочке желудка было достоверно выше при неизмененном локальном кровотоке. Клинико-эндоскопические исследования показали более значимую безопасность ацеклофенака.
Последний метаанализ с 3-этапным отбором исследований состоял из 28 исследований, соответствующих критериям для включения по применению НПВП и анализом осложнений на фоне их приема со стороны верхних отделов желудочно-кишечного тракта. После обработки материала минимальный относительный риск (ОР) наблюдался при применении ацеклофенака, целекоксиба и ибупрофена, а максимальный — пироксикама, кеторолака и азапропазона. Промежуточный ОР был выявлен для рофекоксиба, сулиндака, диклофенака, мелоксикама, нимесулида, кетопрофена, теноксикама, напроксена, индометацина и дифлунизала [11].
В 2010–2011 гг. в России проведено многоцентровое открытое рандомизированное сравнительное исследование эффективности и безопасности ацеклофенака в сравнении с диклофенаком у 200 амбулаторных пациентов с остеоартрозом коленных суставов. I группа (100 пациентов) получала Аэртал 200 мг/сут. II группа (100 пациентов) — диклофенак 100 мг/сут в течение 3 мес. На основании полученных результатов Аэртал сопоставим по эффективности с диклофенаком. Аэртал показал более быстрое влияние на болевой синдром, скованность и выявил более эффективное действие на улучшение функционального состояния суставов, что коррелировало со снижением риска гастроэнтерологических побочных эффектов и значительно меньшей отменой терапии в связи с побочными эффектами [12].
Аэртал показал более быстрое влияние на болевой синдром, скованность и выявил более эффективное действие на улучшение функционального состояния суставов, что коррелировало со снижением риска гастроэнтерологических побочных эффектов и значительно меньшей отменой терапии в связи с побочными эффектами [12].
При недостаточной эффективности терапии острого и/или обострении хронического артрита с кристаллами ПФК может быть использован также короткий курс глюкокортикоидов внутрь, а также пероральное или парентеральное применение адренокортикотропного гормона (по 40–80 ЕД внутримышечно через 12 ч по необходимости, обычно 1–3 инъекции).
При хроническом воспалительном артрите применяют НПВП (при необходимости — гастропротекторную терапию), колхицин (0,5–1 мг в день), низкие дозы глюкокортикоидов, метотрексат и гидроксихлорохин. Предполагается, что метотрексат как противовоспалительный препарат может быть эффективен в дозе 10–20 мг/нед при неуспехе других методов лечения.
Проведенное сравнительное исследование по оценке локальной терапии (1–4-кратное внутрисуставное введение глюкокортикоидов или метатрексата) у пациентов с хроническим резистентным синовитом у больных I группы с остеоартрозом и II группы с остеоартрозом в сочетании с депозицией кристаллов ПФК показало, что у пациентов II группы, в отличие от пациентов I группы, отмечался низкий клинический ответ на локальную перфузионную терапию и внутрисуставное введение кортикостероидов. Во II группе средством выбора может быть локальная терапия метотрексатом [13].
Во II группе средством выбора может быть локальная терапия метотрексатом [13].
Профилактику частых атак артрита с кристаллами ПФК можно проводить низкими дозами колхицина (0,5–1 мг ежедневно) или низкими дозами НПВП (с гастропротекцией при необходимости).
В отличие от подагры, в настоящее время не созданы препараты, модифицирующие формирование кристаллов ПФК или позволяющие их растворять. Бессимптомные депозиты ПФК — не показание для терапии. Теоретически ингибировать кальцификацию можно воздействием либо на отложение кальция (физическая цель), или на клетки (биологическая мишень). Ориентация терапии на клеточный, генетический или эпигенетический уровень будет не только препятствовать образованию и росту отложений кальция, но и конвертировать измененные при ОА клетки хряща и мениска в более физиологически функционирующее состояние.
В заключение о некоторых новых аспектах лекарственной терапии, имеющих отношение к болезни депонирования кристаллов ПФК. В работе M. Fahey и соавт. [14] исследовалось действие дексаметазона на формирование кристаллов ПФК in vitro в культуре свиных хондроцитов при инкубации с АТФ. Оказалось, что дексаметазон дозозависимо увеличивают АТФ-обусловленную минерализацию и активность только трансглутаминазы, а активность щелочной фосфатазы и пирофосфат-фосфогидролазы не изменялась. Логично предположить, что ингибиторы трансглутаминазы подавляли формирование кристаллов ПФК. Эти данные позволяют по-новому взглянуть на важную роль трансглутаминазы и акцентируют внимание на возможной инициирующей роли локальной глюкокортикоидной терапии в отложении кристаллов ПФК.
Fahey и соавт. [14] исследовалось действие дексаметазона на формирование кристаллов ПФК in vitro в культуре свиных хондроцитов при инкубации с АТФ. Оказалось, что дексаметазон дозозависимо увеличивают АТФ-обусловленную минерализацию и активность только трансглутаминазы, а активность щелочной фосфатазы и пирофосфат-фосфогидролазы не изменялась. Логично предположить, что ингибиторы трансглутаминазы подавляли формирование кристаллов ПФК. Эти данные позволяют по-новому взглянуть на важную роль трансглутаминазы и акцентируют внимание на возможной инициирующей роли локальной глюкокортикоидной терапии в отложении кристаллов ПФК.
Колхицин подавляет вызываемое кристаллами ПФК воспаление, а также ингибирует эластазу и матричную металлопротеиназу. Эти два фермента играют важную патогенетическую роль в первичном ОА. Возможно, колхицин может, подавляя их активность, оказывать хондропротекторное действие.
Учитывая патогенез болезни депонирования кристаллов ПФК, представляется перспективным исследование широкого спектра локальной антифлогистической терапии, начиная с таких известных средств, как препараты гиалуроновой кислоты и метотрексата.
Таким образом, болезнь депонирования кристаллов пирофосфата кальция занимает лидирующее положение среди болезней суставов. В основе его лежат активные процессы как дегенеративно-деструктивные, так и репаративные. Они развиваются в ответ на различные повреждения и осуществляются с помощью саморегулирующейся системы со стереотипной динамикой, принципиально не зависящей от типа повреждения. В разные фазы болезни меняются типы клеточного взаимодействия, переходя от одних популяций клеток к другим через межклеточное взаимодействие путем синтеза различных медиаторов, в том числе цитокинов, факторов роста и экспрессии их рецепторов.
Достаточно высокая эффективность ацеклофенака (Аэртала) связана с его уникальной в известной мере способностью многокомпонентно подавлять воспаление, воздействуя в том числе и на цитокиновую активность, а не только на ЦОГ-2 и простагландин Е2. К особенностям действия этого препарата относится и способность его главного метаболита (4-гидроксиацеклофенака) подавлять воспалительную активность хондроцитов при ОА и стимулировать продукцию глюкозоаминогликанов, позволяющую обсуждать его уникальность как препарата, обладающего хондропротективными свойствами [7].
Результаты полученных российских и европейских крупномасштабных исследований позволяют говорить о бесспорных преимуществах терапии ацеклофенаком (Аэрталом) воспалительных и дегенеративно-дистрофических заболеваний, сопровождающихся суставным синдромом в повседневной клинической практике.
Литература
- Ильиных Е. В., Владимиров С. А., Кудаева Ф. М. и соавт. Маска пирофосфатной артропатии: разоблачение // Современ. ревматол. 2011: 2: 35–36.
- Носкова Т. С., Широкова К. Ю., Бахтиярова Т. И., Филимонова Н. С. Болезни отложения кристаллов кальция: клиника и лечение // Клин. геронтол. 2012; 3–4: 59–63.
- Fahey M., Mitton E., Muth E., Rosenthal A. K. Dexamethasone promotes calcium pyrophosphate dihydrate crystal formation by articular chondrocytes // J. Rheumatol. 2009; 36 (1): 163–169.
- Liu Y. Z., Jackson A. P., Cosgrove S. D. Contribution of calcium-containing crystals to cartilage degradation and synovial inflammation in osteoarthritis // Osteoarthritis Cartilage.
 2009; 17 (10): 1333–1340.
2009; 17 (10): 1333–1340. - Носков С. М., Дыбин С. Д., Цурко В. В. Поражение суставов при депонировании кристаллов кальция (микрокристаллическая артропатия) // Практикующий врач, сегодня. 2012; 3: 2–10.
- Zhang W., Doherty M., Pascual E. et al. EULAR recommendations for calcium pyrophosphate deposition. Part II: management // Ann. Rheum. Dis. 2011; 70 (4): 571–575.
- Насонова В. А. Ацеклофенак (аэртал) в клинике ревматолога // Тер. архив. 2005; 5: 87–90.
- Леммел У. М., Лееп Б., Баст Дж., Асландис С. Удовлетворенность пациентов и врачей препаратом ацеклофенак: результаты Европейского обсервационного когортного исследования (опыт применения ацеклофенака при болях воспалительного происхождения в повседневной практике) // РМЖ. 2003; 7: 410–415.
- Henrotin Y. et al. In vitro effects of aceclofenac and its metabolits on the production by chondrocytes of inflammatory mediators // Inflamm.
 Res. 2001; 50: 391–399.
Res. 2001; 50: 391–399. - Yanagawa A., Kudo T., Shimada J. et al. Endoscopic stady of the damaging action of diclofenac Na, aceclofenac and its placebo on the gastric and duodenal mucosa // Jap. J. Rheumatol. 1998; 8: 245–259.
- Castellsague J., Riera-Guardia N., Calingaert B. et al. Individual NSAIDs and upper gastrointestinal complications a systematic review and meta-analysis of observational studies (the SOS project) // Drug Saf. 2012; 35 (12): 1127–1146.
- Шарапова Е. П., Таскина Е. А., Гукосян Д. А. и соавт. Нестероидные противовоспалительные препараты в лечении остеоартроза (сравнительное исследование ацеклофенака с диклофенаком) // Справочник поликлин. врача. 2012; 10: 61–64.
- Носкова Т. С., Дыбин С. Д., Бахтиярова Т. И. и соавт. Локальная терапия хронического синовита коленных суставов у больных остеоартрозом с депозицией кристаллов пирофосфата кальция // Клин. геронтол. 2013; 1–2: 17–21.

- Fahey M., Mitton E., Muth E., Rosenthal A. K. Dexamethasone promotes calcium pyrophosphate dihydrate crystal formation by articular chondrocytes // J. Rheumatol. 2009; 36 (1): 163–169.
С. М. Носков*, доктор медицинских наук, профессор
С. Д. Дыбин*, кандидат медицинских наук
В. В. Цурко**, доктор медицинских наук, профессор
* ГБОУ ВПО ЯГМА МЗ РФ, Ярославль
** ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Контактная информация об авторах для переписки: [email protected]
Публикации в СМИ
- Главная
- Пресс-центр
- Публикации в СМИ
Микрокристаллические артриты — болезни суставов, связанные с отложением в них микрокристаллов: уратов натрия, пирофосфата кальция, гидроксиапатита кальция, оксалатов.
Статистические данные. Хондрокальциноз наблюдают у 1 из 10 человек в возрасте 60–75 лет, старше 80 лет — у 1 из 3, и только у небольшого процента развиваются клинические проявления. Преобладающий возраст — старше 60 лет.
Хондрокальциноз наблюдают у 1 из 10 человек в возрасте 60–75 лет, старше 80 лет — у 1 из 3, и только у небольшого процента развиваются клинические проявления. Преобладающий возраст — старше 60 лет.
Патогенез • При пирофосфатной артропатии на ранних этапах КПФК депонируются в суставном хряще. Острый приступ артрита возникает при выходе КПФК из хряща в суставную полость, чему могут способствовать гипокальциемия (обусловливающая вымывание пирофосфата из хряща), разрушение матрикса (в ходе ферментативных реакций при инфекционных или подагрическом артритах), а также существенные биомеханические нагрузки на сустав. Фагоцитоз кристаллов нейтрофилами сопровождается выделением Пг, коллагеназы и др. Заболевание может сочетаться с гемохроматозом, гиперпаратиреозом, гипотиреозом, алкаптонурией, болезнью Уилсона–Коновалова, амилоидозом. Существуют также наследственные формы • Кристаллы гидроксиапатита кальция откладываются преимущественно в аваскулярных зонах; в качестве пусковых факторов рассматривают травму и ишемию.
Классификация • Подагра — см. Подагра • Пирофосфатная артропатия — заболевание, возникающее вследствие отложения кристаллов пирофосфата кальция (КПФК) в суставных тканях. Термин хондрокальциноз используют для обозначения рентгенологических проявлений заболевания в виде кальцификации суставного хряща • Гидроксиапатитная артропатия — отложение кристаллов гидроксиапатита кальция в суставах, связках, фасциях • Оксалатная артропатия — отложение кристаллов оксалата кальция в суставах, преимущественно у больных с ХПН • Микрокристаллический артрит, индуцированный введением ЛС, наблюдают (редко) как побочный эффект внутрисуставного введения ГК.
Клиническая картина • Пирофосфатная артропатия способна протекать в нескольких вариантах •• Острый артрит, или псевдоподагра (25% случаев): боль, гиперемия, отёк сустава, достигающие пика за 12–36 ч. В 50% случаев наблюдают поражение коленного сустава, хотя возможна любая другая локализация.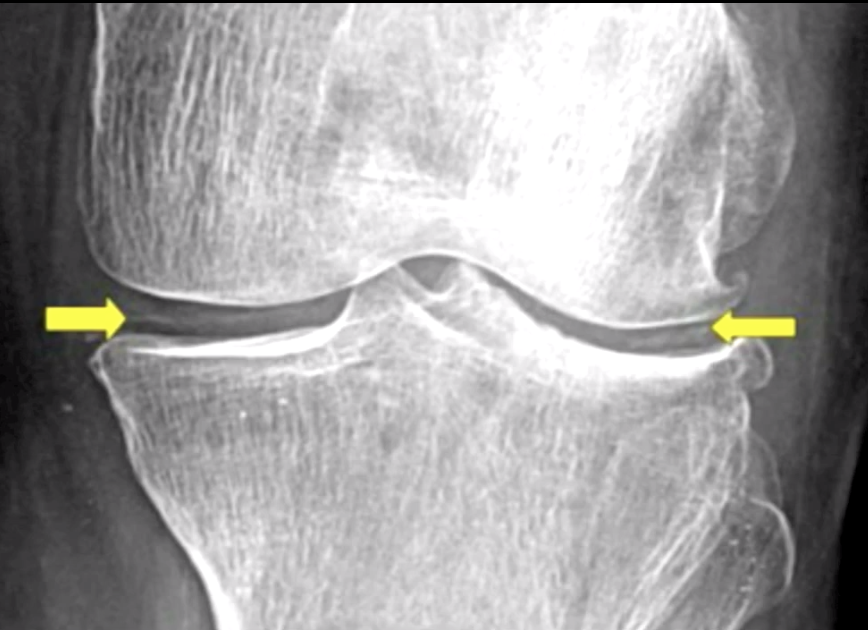 Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза. Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. Полимиалгия ревматическая) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти.
Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза. Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. Полимиалгия ревматическая) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти. «Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.
«Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.
Лабораторные данные • Диагностически ценным является исследование синовиальной жидкости при световой микроскопии в поляризованном свете (один поляризатор помещают перед источником света, другой — между мазком жидкости и глазом; кристаллы, обладающие двулучепреломлением, светятся белым светом) •• кристаллы урата натрия чаще имеют форму игл или палочек, обладают сильным двулучепреломлением •• кристаллы пирофосфата кальция имеют форму ромбов или палочек, обладают слабым двулучепреломлением •• кристаллы оксалата кальция имеют бипирамидальную форму, обладают двулучепреломлением •• кристаллы гидроксиапатита кальция имеют монетообразную или неправильную форму, не обладают двулучепреломлением • Для выявления кальция в синовиальной жидкости в качестве скринингового применяют качественную пробу с ализариновым красным.
Инструментальные данные • Рентгенологическое исследование •• Отложения солей кальция в виде очаговых или линейных теней в суставном хряще, наиболее часто выявляют в коленном, плечевом, тазобедренном суставах, лобковом симфизе; в острый период артрита отсутствуют •• Кальцификация сухожилий и связок при гидроксиапатитной артропатии.
ЛЕЧЕНИЕ
В целом общая тактика напоминает таковую при остром подагрическом артрите.
Режим • Покой для поражённых конечностей, при поражении сухожилий — временная иммобилизация с использованием шин • Влажные тепловые компрессы на поражённые.
Лекарственное лечение • НПВС •• Индометацин или диклофенак по 150–200 мг /сут в течение 12–14 дней • Колхицин по 0,6–1,2 мг/сут для профилактики обострений при рецидивирующем течении. Побочные эффекты: нарушение функций костного мозга, ухудшение почечных функций, холестаз.
Хирургическое лечение • Аспирация синовиальной жидкости • Крупные кристаллы, свободные хрящевые отломки удаляют хирургическим, в т.ч. артроскопическим, путём.
Течение. Острые атаки обычно разрешаются в течение 10 дней.
Синонимы • Пирофосфатная артропатия •• Болезнь отложения кристаллов пирофосфата кальция •• Псевдоподагра • Гидроксиапатитная артропатия •• «Милуокское плечо» •• Кальцифицирующий тендинит.
Сокращение. КПФК — кристаллы пирофосфата кальция.
МКБ-10 • M11 Другие кристаллические артропатии
Код вставки на сайт
<a href=»http://www.sechenov.ru/pressroom/publications/artrity-mikrokristallicheskie1/»><h2>Артриты микрокристаллические</h2></a>
<p><strong>Микрокристаллические артриты</strong> — болезни суставов, связанные с отложением в них микрокристаллов: уратов натрия, пирофосфата кальция, гидроксиапатита кальция, оксалатов.</p>
<p><strong>Статистические данные. </strong>Хондрокальциноз наблюдают у 1 из 10 человек в возрасте 60–75 лет, старше 80 лет — у 1 из 3, и только у небольшого процента развиваются клинические проявления. Преобладающий возраст — старше 60 лет.</p>
<p><strong>Патогенез • </strong>При пирофосфатной артропатии на ранних этапах КПФК депонируются в суставном хряще. Острый приступ артрита возникает при выходе КПФК из хряща в суставную полость, чему могут способствовать гипокальциемия (обусловливающая вымывание пирофосфата из хряща), разрушение матрикса (в ходе ферментативных реакций при инфекционных или подагрическом артритах), а также существенные биомеханические нагрузки на сустав. Фагоцитоз кристаллов нейтрофилами сопровождается выделением Пг, коллагеназы и др. Заболевание может сочетаться с гемохроматозом, гиперпаратиреозом, гипотиреозом, алкаптонурией, болезнью Уилсона–Коновалова, амилоидозом. Существуют также наследственные формы • Кристаллы гидроксиапатита кальция откладываются преимущественно в аваскулярных зонах; в качестве пусковых факторов рассматривают травму и ишемию.</p>
<p><strong>Классификация • </strong>Подагра — см. <em>Подагра </em>• Пирофосфатная артропатия — заболевание, возникающее вследствие отложения кристаллов пирофосфата кальция (КПФК) в суставных тканях.
Острый приступ артрита возникает при выходе КПФК из хряща в суставную полость, чему могут способствовать гипокальциемия (обусловливающая вымывание пирофосфата из хряща), разрушение матрикса (в ходе ферментативных реакций при инфекционных или подагрическом артритах), а также существенные биомеханические нагрузки на сустав. Фагоцитоз кристаллов нейтрофилами сопровождается выделением Пг, коллагеназы и др. Заболевание может сочетаться с гемохроматозом, гиперпаратиреозом, гипотиреозом, алкаптонурией, болезнью Уилсона–Коновалова, амилоидозом. Существуют также наследственные формы • Кристаллы гидроксиапатита кальция откладываются преимущественно в аваскулярных зонах; в качестве пусковых факторов рассматривают травму и ишемию.</p>
<p><strong>Классификация • </strong>Подагра — см. <em>Подагра </em>• Пирофосфатная артропатия — заболевание, возникающее вследствие отложения кристаллов пирофосфата кальция (КПФК) в суставных тканях. Термин хондрокальциноз используют для обозначения рентгенологических проявлений заболевания в виде кальцификации суставного хряща • Гидроксиапатитная артропатия — отложение кристаллов гидроксиапатита кальция в суставах, связках, фасциях • Оксалатная артропатия — отложение кристаллов оксалата кальция в суставах, преимущественно у больных с ХПН • Микрокристаллический артрит, индуцированный введением ЛС, наблюдают (редко) как побочный эффект внутрисуставного введения ГК.</p>
<p><strong>Клиническая картина </strong><strong>• </strong>Пирофосфатная артропатия способна протекать в нескольких вариантах •• Острый артрит, или псевдоподагра (25% случаев): боль, гиперемия, отёк сустава, достигающие пика за 12–36 ч. В 50% случаев наблюдают поражение коленного сустава, хотя возможна любая другая локализация. Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза.
Термин хондрокальциноз используют для обозначения рентгенологических проявлений заболевания в виде кальцификации суставного хряща • Гидроксиапатитная артропатия — отложение кристаллов гидроксиапатита кальция в суставах, связках, фасциях • Оксалатная артропатия — отложение кристаллов оксалата кальция в суставах, преимущественно у больных с ХПН • Микрокристаллический артрит, индуцированный введением ЛС, наблюдают (редко) как побочный эффект внутрисуставного введения ГК.</p>
<p><strong>Клиническая картина </strong><strong>• </strong>Пирофосфатная артропатия способна протекать в нескольких вариантах •• Острый артрит, или псевдоподагра (25% случаев): боль, гиперемия, отёк сустава, достигающие пика за 12–36 ч. В 50% случаев наблюдают поражение коленного сустава, хотя возможна любая другая локализация. Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза. Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. <em>Полимиалгия ревматическая</em>) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти. «Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.</p>
<p><strong>Лабораторные данные •</strong> Диагностически ценным является исследование синовиальной жидкости при световой микроскопии в поляризованном свете (один поляризатор помещают перед источником света, другой — между мазком жидкости и глазом; кристаллы, обладающие двулучепреломлением, светятся белым светом) •• кристаллы урата натрия чаще имеют форму игл или палочек, обладают сильным двулучепреломлением •• кристаллы пирофосфата кальция имеют форму ромбов или палочек, обладают слабым двулучепреломлением •• кристаллы оксалата кальция имеют бипирамидальную форму, обладают двулучепреломлением •• кристаллы гидроксиапатита кальция имеют монетообразную или неправильную форму, не обладают двулучепреломлением • Для выявления кальция в синовиальной жидкости в качестве скринингового применяют качественную пробу с ализариновым красным.
Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. <em>Полимиалгия ревматическая</em>) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти. «Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.</p>
<p><strong>Лабораторные данные •</strong> Диагностически ценным является исследование синовиальной жидкости при световой микроскопии в поляризованном свете (один поляризатор помещают перед источником света, другой — между мазком жидкости и глазом; кристаллы, обладающие двулучепреломлением, светятся белым светом) •• кристаллы урата натрия чаще имеют форму игл или палочек, обладают сильным двулучепреломлением •• кристаллы пирофосфата кальция имеют форму ромбов или палочек, обладают слабым двулучепреломлением •• кристаллы оксалата кальция имеют бипирамидальную форму, обладают двулучепреломлением •• кристаллы гидроксиапатита кальция имеют монетообразную или неправильную форму, не обладают двулучепреломлением • Для выявления кальция в синовиальной жидкости в качестве скринингового применяют качественную пробу с ализариновым красным. </p>
<p><strong>Инструментальные данные • </strong>Рентгенологическое исследование •• Отложения солей кальция в виде очаговых или линейных теней в суставном хряще, наиболее часто выявляют в коленном, плечевом, тазобедренном суставах, лобковом симфизе; в острый период артрита отсутствуют •• Кальцификация сухожилий и связок при гидроксиапатитной артропатии.</p>
<p><strong>ЛЕЧЕНИЕ</strong></p>
<p>В целом <strong>общая тактика </strong>напоминает таковую при остром подагрическом артрите.</p>
<p><strong>Режим •</strong> Покой для поражённых конечностей, при поражении сухожилий — временная иммобилизация с использованием шин • Влажные тепловые компрессы на поражённые.</p>
<p><strong>Лекарственное лечение • </strong>НПВС •• Индометацин или диклофенак по 150–200 мг /сут в течение 12–14 дней • Колхицин по 0,6–1,2 мг/сут для профилактики обострений при рецидивирующем течении.
</p>
<p><strong>Инструментальные данные • </strong>Рентгенологическое исследование •• Отложения солей кальция в виде очаговых или линейных теней в суставном хряще, наиболее часто выявляют в коленном, плечевом, тазобедренном суставах, лобковом симфизе; в острый период артрита отсутствуют •• Кальцификация сухожилий и связок при гидроксиапатитной артропатии.</p>
<p><strong>ЛЕЧЕНИЕ</strong></p>
<p>В целом <strong>общая тактика </strong>напоминает таковую при остром подагрическом артрите.</p>
<p><strong>Режим •</strong> Покой для поражённых конечностей, при поражении сухожилий — временная иммобилизация с использованием шин • Влажные тепловые компрессы на поражённые.</p>
<p><strong>Лекарственное лечение • </strong>НПВС •• Индометацин или диклофенак по 150–200 мг /сут в течение 12–14 дней • Колхицин по 0,6–1,2 мг/сут для профилактики обострений при рецидивирующем течении. Побочные эффекты: нарушение функций костного мозга, ухудшение почечных функций, холестаз.</p>
<p><strong>Хирургическое лечение • </strong>Аспирация синовиальной жидкости • Крупные кристаллы, свободные хрящевые отломки удаляют хирургическим, в т.ч. артроскопическим, путём.</p>
<p><strong>Течение. </strong>Острые атаки обычно разрешаются в течение 10 дней.</p>
<p><strong>Синонимы </strong>• Пирофосфатная артропатия •• Болезнь отложения кристаллов пирофосфата кальция •• Псевдоподагра • Гидроксиапатитная артропатия •• «Милуокское плечо» •• Кальцифицирующий тендинит.</p>
<p><strong>Сокращение. </strong>КПФК — кристаллы пирофосфата кальция.</p>
<p><strong>МКБ-10 </strong>• M11 Другие кристаллические артропатии</p>
Побочные эффекты: нарушение функций костного мозга, ухудшение почечных функций, холестаз.</p>
<p><strong>Хирургическое лечение • </strong>Аспирация синовиальной жидкости • Крупные кристаллы, свободные хрящевые отломки удаляют хирургическим, в т.ч. артроскопическим, путём.</p>
<p><strong>Течение. </strong>Острые атаки обычно разрешаются в течение 10 дней.</p>
<p><strong>Синонимы </strong>• Пирофосфатная артропатия •• Болезнь отложения кристаллов пирофосфата кальция •• Псевдоподагра • Гидроксиапатитная артропатия •• «Милуокское плечо» •• Кальцифицирующий тендинит.</p>
<p><strong>Сокращение. </strong>КПФК — кристаллы пирофосфата кальция.</p>
<p><strong>МКБ-10 </strong>• M11 Другие кристаллические артропатии</p>
Микрокристаллические артриты — болезни суставов, связанные с отложением в них микрокристаллов: уратов натрия, пирофосфата кальция, гидроксиапатита кальция, оксалатов.
Статистические данные. Хондрокальциноз наблюдают у 1 из 10 человек в возрасте 60–75 лет, старше 80 лет — у 1 из 3, и только у небольшого процента развиваются клинические проявления. Преобладающий возраст — старше 60 лет.
Патогенез • При пирофосфатной артропатии на ранних этапах КПФК депонируются в суставном хряще. Острый приступ артрита возникает при выходе КПФК из хряща в суставную полость, чему могут способствовать гипокальциемия (обусловливающая вымывание пирофосфата из хряща), разрушение матрикса (в ходе ферментативных реакций при инфекционных или подагрическом артритах), а также существенные биомеханические нагрузки на сустав. Фагоцитоз кристаллов нейтрофилами сопровождается выделением Пг, коллагеназы и др. Заболевание может сочетаться с гемохроматозом, гиперпаратиреозом, гипотиреозом, алкаптонурией, болезнью Уилсона–Коновалова, амилоидозом. Существуют также наследственные формы • Кристаллы гидроксиапатита кальция откладываются преимущественно в аваскулярных зонах; в качестве пусковых факторов рассматривают травму и ишемию.
Классификация • Подагра — см. Подагра • Пирофосфатная артропатия — заболевание, возникающее вследствие отложения кристаллов пирофосфата кальция (КПФК) в суставных тканях. Термин хондрокальциноз используют для обозначения рентгенологических проявлений заболевания в виде кальцификации суставного хряща • Гидроксиапатитная артропатия — отложение кристаллов гидроксиапатита кальция в суставах, связках, фасциях • Оксалатная артропатия — отложение кристаллов оксалата кальция в суставах, преимущественно у больных с ХПН • Микрокристаллический артрит, индуцированный введением ЛС, наблюдают (редко) как побочный эффект внутрисуставного введения ГК.
Клиническая картина • Пирофосфатная артропатия способна протекать в нескольких вариантах •• Острый артрит, или псевдоподагра (25% случаев): боль, гиперемия, отёк сустава, достигающие пика за 12–36 ч. В 50% случаев наблюдают поражение коленного сустава, хотя возможна любая другая локализация. Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза. Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. Полимиалгия ревматическая) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти.
Длительность атаки — несколько недель. В межприступный период форма и функции суставов в типичных случаях не изменены •• Хронический (псевдоревматоидный) артрит (5% случаев): утренняя скованность, псевдоревматоидные деформации, наличие заболеваний суставов в семейном анамнезе •• Псевдоостеоартроз возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, у пациентов обнаруживают рентгенологические признаки хондрокальциноза. Чаще, чем при остеоартрозе, наблюдают сгибательные контрактуры и варусные деформации нижних конечностей •• Деструктивный артрит по типу артропатии Шарко (спинной сухотки): выраженные деструктивные поражения плечевых, коленных или тазобедренных суставов •• Люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска •• Симптомы ревматической полимиалгии (см. Полимиалгия ревматическая) •• Бессимптомное течение: боли в суставах отсутствуют, патологию выявляют только рентгенологически • Гидроксиапатитная артропатия поражает чаще плечевые и коленные суставы, вращающую манжетку плеча, локтевой разгибатель кисти, лучевой сгибатель кисти. «Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.
«Милуокское плечо»: выпот в плечевом суставе, поражение сухожилия двуглавой мышцы плеча.
Лабораторные данные • Диагностически ценным является исследование синовиальной жидкости при световой микроскопии в поляризованном свете (один поляризатор помещают перед источником света, другой — между мазком жидкости и глазом; кристаллы, обладающие двулучепреломлением, светятся белым светом) •• кристаллы урата натрия чаще имеют форму игл или палочек, обладают сильным двулучепреломлением •• кристаллы пирофосфата кальция имеют форму ромбов или палочек, обладают слабым двулучепреломлением •• кристаллы оксалата кальция имеют бипирамидальную форму, обладают двулучепреломлением •• кристаллы гидроксиапатита кальция имеют монетообразную или неправильную форму, не обладают двулучепреломлением • Для выявления кальция в синовиальной жидкости в качестве скринингового применяют качественную пробу с ализариновым красным.
Инструментальные данные • Рентгенологическое исследование •• Отложения солей кальция в виде очаговых или линейных теней в суставном хряще, наиболее часто выявляют в коленном, плечевом, тазобедренном суставах, лобковом симфизе; в острый период артрита отсутствуют •• Кальцификация сухожилий и связок при гидроксиапатитной артропатии.
ЛЕЧЕНИЕ
В целом общая тактика напоминает таковую при остром подагрическом артрите.
Режим • Покой для поражённых конечностей, при поражении сухожилий — временная иммобилизация с использованием шин • Влажные тепловые компрессы на поражённые.
Лекарственное лечение • НПВС •• Индометацин или диклофенак по 150–200 мг /сут в течение 12–14 дней • Колхицин по 0,6–1,2 мг/сут для профилактики обострений при рецидивирующем течении. Побочные эффекты: нарушение функций костного мозга, ухудшение почечных функций, холестаз.
Хирургическое лечение • Аспирация синовиальной жидкости • Крупные кристаллы, свободные хрящевые отломки удаляют хирургическим, в т.ч. артроскопическим, путём.
Течение. Острые атаки обычно разрешаются в течение 10 дней.
Синонимы • Пирофосфатная артропатия •• Болезнь отложения кристаллов пирофосфата кальция •• Псевдоподагра • Гидроксиапатитная артропатия •• «Милуокское плечо» •• Кальцифицирующий тендинит.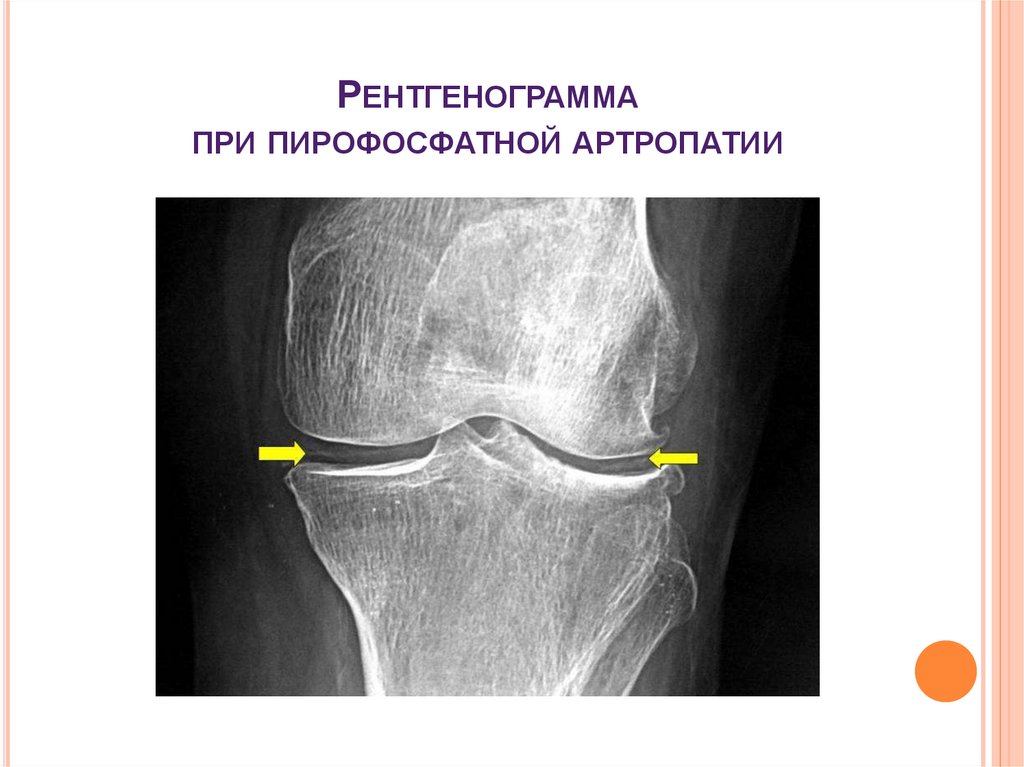
Сокращение. КПФК — кристаллы пирофосфата кальция.
МКБ-10 • M11 Другие кристаллические артропатии
Перейти в раздел:
- Новости
- События
- Видео
- Фотогалерея
- Библиотека
- Газета «Сеченовские вести»
- Журнал «Национальное здравоохранение»
- Условия использования сайта
Хроническая ПФАразвивается вследствие дегенерации суставного хряща, фиброза синовиальной оболочки и околосуставных тканей в результате их длительной импрегнации кристаллами пирофосфата кальция. Клиническая
картинаПФА протекает в виде острых
периодически наступающих приступов
пирофосфатного синовита и (или)
периартрита (острый псевдоподагрический
приступ) и хронической ПФА. Острый приступ псевдоподагры развивается быстро без видимой причины с острыми или подострыми экссудативными явлениями обычно в одном коленном суставе. Появляются боли различной интенсивности, припухание, лихорадка, общее недомогание, озноб, иногда увеличение СОЭ. Все же в большинстве случаев этот приступ развивается не так внезапно, а боли менее интенсивны, чем при подагре. Поражается чаще всего один коленный сустав, но могут быть поражены и другие крупные и мелкие суставы, включая и большой палец стопы. При
наличии кальцификации межпозвоночных
дисков может наблюдаться также и
корешковый синдром. Иногда артрит
выражен настолько интенсивно, что его
принимают за септический, в других
случаях отмечается лишь транзиторная
артралгия. Приступ часто развивается
спонтанно, но может появиться после
операции или какоголибо тяжелого
заболевания (инфаркт, церебральный
криз, флебит и т. Хроническая пирофосфатная артропатия характеризуется постоянными болями, утренней скованностью и умеренной припухлостью суставов. На фоне подобного хронического течения могут возникать острые псевдоподагрические приступы. Локализация процесса такая же, как при острой форме. Чаще всего развивается моноартрит коленного сустава. Эта форма часто ошибочно принимается за остеоартроз, а иногда и за подострый ревматоидный артрит. Течение болезни весьма вариабельно. Е. Vignon и G. Vignon, Ch. Resnik описали несколько клинических форм. Она
характеризуется периодическими
псевдоподагрическими приступами в
виде острого или подострого артрита
коленного сустава, однако иногда
процесс распространяется на соседние
крупные или средние суставы. Пирофосфатная
артропатия протекает длительно
(несколько месяцев или лет) в виде
хронического артрита или полиартрита.
Может иметь место моноартрит (чаще
коленного сустава) с постепенным
поражением других крупных и средних
суставов (или полиартрит с симметричным
поражением крупных и мелких суставов),
утренней скованностью и увеличением
СОЭ. В этих случаях клиническая картина
болезни напоминает ревматоидный
артрит, а у 10% больных определяется по
ложительная реакция на ревматоидный
фактор, а также выявляются остеолиз
в крупных суставах и кистях и утренняя
скованность. Дифференциальный диагноз труден, поскольку хондрокальциноз может наблюдаться у больных с достоверно установленным ревматоидным артритом. Это
хроническая пирофосфатная артропатия.
По своему характеру и течению напоминает
артроз (тупые постоянные боли, небольшая
припухлость и дефигурация суставов,
чаще коленного). Могут поражаться
лучезапястные, пястнофаланговые,
тазобедренные, плечевые, локтевые,
голеностопные суставы и позвоночник.
В последнем случае развивается сужение
места выхода корешков с явлениями
вторичного радикулита. Иногда
развивается полиартропатия с
симметричным поражением суставов,
контрактурами и гемартрозом. В 50 %
случаев на фоне хронического течения
наблюдаются острые псевдоподагрические
приступы. Эту форму ПФА часто ошибочно
принимают за артроз, тем более что на
рентгенограммах имеются идентичные
изменения (сужение суставной щели,
остеосклероз, кисты). Это наиболее тяжелая и прогрессирующая форма, протекающая чаще по типу полиартрита. Поражаются коленные, тазобедренные, плечевые и лучезапястные суставы, реже голеностопные. Однако поражение может распространяться и на все суставы. Лишь в редких случаях эта форма течет как моноартрит. Больные жалуются на сильные и продолжительные боли. Отмечаются выраженная припухлость и дефигурация суставов с хроническим внутрисуставным выпотом, иногда геморрагическим, с нарушением функции суставов и неуклонным прогрессированием. Особенно тяжело протекает поражение тазобедренного сустава. Развивается подострал или хроническая тяжелая коксопашл i очень быстрой деструкцией и лизисом кости, которая почти всегда диагностируется как септический артрит. Ренгтгенологически
наблюдаются выраженная костнохря,
щевая деструкция и диффузная
кальцификация, которую следует искать
в других, менее пораженных суставах,
так как при значительном разрушении
хряща она плохо различима. Она обычно диагностируется только на основании выявления кацьцификации на рентгенограммах. Эта частая (встречается у 20 % больных), но наименее изученная форма, поскольку больные к врачам не обращаются. Все
описанные формы относятся к идиопатической
(несемейной) ПФА. Значительно более
редкой формой является наследственная
(семейная) форма ПФА, описанная D.
Zitnan, S. Sitaj в Чехословакии, A. Regiriato в Чили
и I. Van der Korst в Голландии и в ряде других
стран. По данным авторов, наблюдавших
семьи больных в течение 10-20 лет, тяжелые
формы семейной ПФА проявляются в
возрасте до 30 лет поражением многих
суставов и выраженной прогрессирующей
кальцификацией на рентгенограммах.
После 30летнего возраста появляются
псевдоподагрические приступы
преимущественно в крупных суставах. Легкие формы развиваются в более позднем возрасте — после 50 лет. Характеризуются менее диффузной кальцификацией, наличием моно или олигоартрита и медленным прогрессированием. Этот наследственный тип диффузной формы ПФА никогда не сочетается с другими нарушениями метаболизма, т.е. является чисто наследственным. Наследование связано, повидимому, с несколькими генами, так как способ передачи его различен. По данным чилийских и голландских авторов, а также А. Бьелл, изучившего 26 семей с этим заболеванием, наследуется доминирующий аутосомныи признак с высокой частотой распространения. Эта точка зрения подтверждена J. Zulman и соавт. По
данным D. Сочетанные формы ПФА наблюдаются у лиц, страдающих идиопатическим хондрокальцинозом и имеющих другие метаболические или костносуставные заболевания. Однако до настоящего времени остается неясной патогенетическая связь ПФА с этими заболеваниями, а именно: являются ли они причиной артропатии или лишь благоприятствуют се развшию. ПФА нередко сочетается с болезнями обмена. У 7 % больных ПФА выявляется гипериаратиреоидизм, а у 15-46% больных гиперпаратиреоидизмом наблюдается ПФЛ. Таким
образом, эти заболевания довольно
часто сочетаются, но протекают
автономно. Так, например, сразу же
после паратиреоидэктомии появляются
псевдоподагрические приступы и
прогрессирование кальцификации.
Отсутствие параллелизма в течении
ПФА и гиперпаратиреоидизма делает
сомнительным этиологическую роль
последнего в развитии ПФА. ПФА наблюдается у 25-40% больных гемохроматозом. У них часто развивается псевдоартрозная артропатия пястнофаланговых суставов с уплотнением субхондральной кости, микрокистами и сужением суставной щели. Патогенетическая взаимосвязь между этими двумя заболеваниями остается неясной. Имеются случаи двойного наследования ПФА и гемохроматоза. По
мнению S. de Seze и соавт., железо может
оказывать прямое или косвенное влияние
на обмен пирофосфата, в частности,
изменяя активность пирофосфатазы. В
5-10% случаев ПФА сочетается с подагрой.
При этом в синовиальной жидкости
обнаруживаются одновременно кристаллы
урата и пирофосфата кальция. На
рентгенограммах обнаруживается
локальная кальцификация. Возможно,
что в возникновении острых приступов
артрита определенную роль играют
кристаллы пирофосфата. Некоторые
авторы считают, что инкрустация
суставных тканей уратами благоприятствует
отложению и других кристаллов. Из других метаболических заболеваний, которые сочетаются с диффузной ПФА, отмечают диабет и гипотиреоз, причем в последнем случае псевдоподагрические кризы могут быть спровоцированы гормонотерапией. Имеются сообщения о сочетании с гипофосфатазией — наследственной недостаточностью активности щелочной фосфатазы, что представляет определенный интерес, так как уменьшение активности сывороточной пирофосфатазы ведет к повышению содержания неорганического пирофосфата. Отдельные сообщения касаются сочетаний ПФА с болезнью Вильсона, акромегалией, охронозом. Сочетание
болезни с костносуставными (особенно
с деформирующим остеоартрозом)
процессами выявляется также довольно
часто. Некоторые авторы считают, что
речь идет о случайном сочетании двух
наиболее распространенных заболеваний
пожилого возраста. | ||
Как обнаружить и излечить пирофосфатную артропатию?
Неорганическая соль пирофосфата кальция имеет кристаллическую форму и в нормальном состоянии в суставах не присутствует, но находится в организме человека. При развитии болезни эта соль откладывается в тканях гиалинового хряща, что влечет за собой воспаление, и начинают образовываться кристаллы. С течением времени происходит деформация сустава, появляются проблемы его подвижности и ощущается боль в суставах, что и говорит о прогрессировании заболевания.
Причины и формирование болезни
Во многих случаях болезнь затрагивает людей старше пятидесяти лет. Это может быть связано с появлением различных сопутствующих заболеваний. Какие-либо гендерные особенности у пирофосфатной артропатии отсутствуют.
Это может быть связано с появлением различных сопутствующих заболеваний. Какие-либо гендерные особенности у пирофосфатной артропатии отсутствуют.
Точная причина заболевания на данный момент не известна, поэтому артропатию разделяют на первичную и вторичную. В первом и наиболее частом случае (около 80-90 процентов) она прогрессирует из-за того, что есть генетическая предрасположенность и одновременно может встречаться встречается в нескольких поколениях семьи. А во втором случае она вызывается разнообразными патологиями метаболизма кальция, которые и являются следствием развития пирофосфатной артропатии. Также данные нарушения могут происходить из-за болезни Коновалова-Вильсона, гемохроматоза, первичного гиперпаратиреоза или из-за подобных заболеваний. При этом есть небольшой шанс, что вторичная форма будет развиваться из-за генетических аномалий так же, как и первичная.
Две теории псевдоподагрического криза
Псевдоподагрический криз – это определенный промежуток времени, при котором болезнь обостряется и является наиболее заметной. Он напрямую связан с переходом кристаллов пирофосфата в синовиальную жидкость. В данном варианте соль не дает болезненных ощущений, но развивает острый синовит. Это было доказано после тщательного исследования результатов анализов лечащихся людей. Следуя данной теории, выделяется несколько процессов протекания пирофосфатной анемии:
Он напрямую связан с переходом кристаллов пирофосфата в синовиальную жидкость. В данном варианте соль не дает болезненных ощущений, но развивает острый синовит. Это было доказано после тщательного исследования результатов анализов лечащихся людей. Следуя данной теории, выделяется несколько процессов протекания пирофосфатной анемии:
- Период ремиссии – значительное ослабление симптомов или их полное исчезновение.
- Появление незначительных травм хряща, выделение соли в суставную полость.
- Воспаление сустава.
Также существует вторая теория течения псевдоподагрического криза, заключающаяся в том, что с ростом количества иных химических соединений повышается уровень содержания пирофосфата, и под действием данных соединений возникает кристаллизация ионов кальция.
Как распознать пирофосфатную артропатию?
Пирофосфатная артропатия – это болезнь, длящаяся длительное время, поэтому при ее протекании бывают периоды постепенного ослабления симптомов и их обострения. Основными симптомами данного заболевания являются ощущение боли различной степени, отек сустава, высокая свертываемость крови, повышенная температура, а также наличие корешкового синдрома. Зачастую симптомы у пациентов проявляются по-разному, поэтому выделяется несколько форм течения пирофосфатной артропатии:
Основными симптомами данного заболевания являются ощущение боли различной степени, отек сустава, высокая свертываемость крови, повышенная температура, а также наличие корешкового синдрома. Зачастую симптомы у пациентов проявляются по-разному, поэтому выделяется несколько форм течения пирофосфатной артропатии:
1. Псевдоподагрическая форма.
Псевдоподагрическая форма может затрагивать не только один сустав, но и несколько сочленений, причем и те, которые со стороны выглядят совершенно целыми. Зачастую поврежденными являются коленный и лучезапястный суставы. При таком течении болезни проявляются приступы псевдоподагры.
2. Псевдоревматоидная форма.
Псевдоревматоидная форма – это форма развития болезни, которая появляется у меньшей части пациентов (менее пяти процентов). Для нее характерно ощущение тяжести в суставах. Может провоцировать осложнения и затрагивать здоровые сочленения.
3. Псевдоартрозная форма.
Псевдоартрозная форма – это форма развития пирофосфатной артропатии, которую наблюдают у большинства пациентов (около пятидесяти процентов). Для нее характерно временное ослабление, а потом обострение симптомов. Может вызывать сильные утренние боли и напоминать хронический артрит. Периодически встречаются случаи, когда заболевание касается суставов, которые не подвергаются большим нагрузкам.
4. Деструктивная форма.
Деструктивная форма – самая сложная форма течения болезни, протекающая в виде полиартрита и разрушающая костную ткань. Часто затрагивает пожилых женщин, вызывает воспаление и отек суставов.
5. Латентное лечение.
Латентное лечение – форма течения болезни, при которой симптомы особо не проявляются. Ее можно обнаружить только на рентгенографии, обычно выполненной в связи с различными поводами (травмы и ушибы). Встречается она у 20% больных. Характеризуется выявлением хондрокальциноза.
Диагностика пирофосфатной артропатии и ее лечение
Пирофосфатную артропатию диагностируют при помощи рентгенографии, так как она выдает более достоверные данные. Признаками, которые явно демонстрируют данную болезнь, являются наличие кальцинированных участков в тканях сустава, боли в воспаленном суставе, а также раздражение тканей, находящихся вблизи сустава. Лишь при запущенных случаях болезни рентгенография может не выдавать результатов.
Признаками, которые явно демонстрируют данную болезнь, являются наличие кальцинированных участков в тканях сустава, боли в воспаленном суставе, а также раздражение тканей, находящихся вблизи сустава. Лишь при запущенных случаях болезни рентгенография может не выдавать результатов.
После обнаружения болезни необходимо строго соблюдать рекомендации врача, в первую очередь нацеленные на лечение суставов. Обычно пользуются симптоматическими препаратами, помогающими снять сильные проявления артропатии. Кроме того, могут помочь такие методы, как снижение нагрузки на больной сустав, использование специальных мазей и таблеток, нахождение в лечебном санатории. Так как пирофосфатная артропатия – это болезнь, связанная с генетической предрасположенностью и появляющаяся в юном возрасте, то ее лечение, к сожалению, лишь помогает снять боль, а не избавиться от заболевания полностью.
Автор: К.М.Н., академик РАМТН М.А. БобырьПирофосфатная артропатия — презентация онлайн
1.
 АО «Медицинский Университет Астана» Кафедра внутренних болезней по интернатуреПирофосфатная артропатия.
АО «Медицинский Университет Астана» Кафедра внутренних болезней по интернатуреПирофосфатная артропатия.Выполнила: Садуова Н.Ж.
775 группа ВБ
Проверила: Карина К.К.
Астана, 2015г.
Пирофосфатная
артропатия, или болезнь
отложения кристаллов пирофосфата
кальция, относится, как и подагра, к группе
микрокристаллических артритов.
Заболевание характеризуется множественным
обызвествлением суставных и околосуставных
тканей, главным образом суставного хряща
(хондрокальциноз) вследствие отложения в
них микрокристаллов пирофосфата кальция.
Болезнь проявляется периодическими
острыми приступами артрита (псевдоподагры)
и(или) развитием хронической артропатии.
Патологическая анатомия
Тканевые изменения при ПФА заключаются в
наличии отложений микрокристаллов дегидрата
пирофосфата кальция в суставном хряще и
синовиальной оболочке. Главным местом
отложения кристаллов является средний слой
суставного хряща, где кристаллы видны в виде
мелких жемчужин, которые могут сливаться в
большие образования, расположенные на
поверхности или в глубине хряща.
 При
Приисследовании их в поляризационном микроскопе
или методом микрокристаллорадиографии
устанавливается, что они состоят из кристаллов
пирофосфата кальция, имеющих вид
прямоугольника или ромба с тупыми концами,
чем они отличаются от кристаллов
мононатриевого урата, имеющих форму иголки.
В месте расположения кристаллов
наблюдаются разрушение матрикса хряща и
исчезновение хондроцитов. Вдали от
скоплений кристаллов строение хряща
нормальное. Место начального образования
кристаллов точно неизвестно.
Гистологические исследования показывают,
что кристаллы появляются внутри и вокруг
перихондроцитарных лакун. При изучении с
помощью электронного микроскопа видно, что
кристаллы располагаются между петлями
нормального матрикса без видимого
соприкосновения с клетками. Таким образом,
кристаллы как бы появляются в толще
нормального хряща.
При инкрустации хряща кристаллами появляются
признаки дегенерации, его растрескивание и
эрозирование, что сопровождается уплотнением
субхондральной кости и развитием остеофитов.

Скопление кристаллов обнаруживается также и в
синовиальной оболочке, где они иногда
располагаются группами, напоминая тофусы.
Фагоцитированные кристаллы можно обнаружить
внутри синовиоцитов. Наличие кристаллов
вызывает синовит с образованием на поверхности
синовиальной оболочки фибриноидного
экссудата. Может быть также хронический
неспецифическии синовит с очагами
фибриноидного некроза и
лимфоплазмоцитарными инфильтратами.
В редких случаях может быть фибринозный
синовит, аналогичный синовиту при артрозе.
Изменения в синовиальной оболочке при ПФА
менее постоянные, чем в хряще.
Клиническая картина
Клинические симптомы пирофосфатной
артропатии обусловлены сочетанием двух
патологических процессов:
микрокристаллического синовита и
дегенеративных изменений внутрисуставного
хряща (остеоартроз). Различают следующие
клинические варианты заболевания (Н. В. Бунчук,
1997):
1.Псевдоостеоартроз. Чаще всего поражаются
коленные, лучезапястные, тазобедренные, реже —
голеностопные, локтевые, пястно-фаланговые
суставы.
 Обычно вовлекаются в патологический
Обычно вовлекаются в патологическийпроцесс два-четыре сустава. Больные жалуются на
боли в указанных суставах при движениях,
длительном стоянии. При исследовании суставов
отмечаются небольшая их припухлость,
маловыраженная дефигурация, ограничение
движений.
2.Псевдоподагра. Эта форма характеризуется
внезапным приступообразном началом. Чаще
поражаются один или небольшое количество
различных суставов, но обычно коленные. Появляются
резкие боли, выраженная отечность и покраснение
кожи в области сустава, ограничение движений, при
этом у многих больных отмечается высокая
температура тела. Клиника этой формы очень
напоминает приступ подагры. Острый артрит
продолжается 1-2 недели и полностью проходит. В
течение года приступы артрита неоднократно
рецидивируют.
3.Псевдоревматоидный артрит. При этой форме
отмечается стойкое воспаление многих суставов, в
том числе мелких суставов кистей и стоп. Но в
отличие от РА не развиваются характерная
деформация суставов кисти и эрозии на
рентгенограммах, в крови не выявляется
ревматоидный фактор.

4.Псевдонейропатическая форма. Эта форма
напоминает нейропатическую артропатию при
сирингомиелии или спинной сухотке (tabes dorsalis) и
характеризуется выраженной деструкцией одного или
нескольких крупных суставов.
5.Форма, напоминающая анкилозирующий
спондилоартрит. Эта форма наблюдается очень
редко. Она характеризуется поражением
периферических суставов, болями и ограничением
движений в позвоночнике, рентгенологическими
признаками кальциноза межпозвонковых дисков.
Классической клиники и рентгенологических
признаков сакроилеита нет. Отсутствуют также
синдесмофиты.
6. Моноформа — стойкое поражение одного сустава,
чаще коленного, с наклонностью к формированию
анкилоза.
При пирофосфатной артропатии имеются также
симптомы поражения периартикулярных тканей,
синовиальных сумок (бурситы) и сухожилий.
Диагностические критерии
Излагаются по McCarty (1972):
1.Обнаружение кристаллов пирофосфата кальция (в
синовиальной жидкости, в биоптатах тканей или на секции)
при условии верификации их структуры методом
рентгеновской дифракции.

2.Обнаружение в синовиальной жидкости моно- или
триклин-ных кристаллов, имеющих характерные для
кристаллов кальция пирофосфата оптические свойства
(отсутствие или слабоположительная
двулучепреломляемость и др.), методом поляризационной
микроскопии с использованием компенсатора.
3.Наличие типичного хондрокальциноза на
рентгенограммах.
4.Острый артрит, особенно коленных или других крупных
суставов.
5. Хронический артрит, особенно с поражением коленных,
тазобедренных, лучезапястных, запястных, локтевых,
плечевых или пястно-фаланговых суставов, течение
которого сопровождается острыми атаками.
Диагноз
пирофосфатной артропатии
достоверен при обнаружении первого
критерия или сочетания второго и третьего
критериев. Диагноз считается вероятным,
если только обнаруживаются кристаллы
кальция пирофосфата в синовиальной
жидкости или только хондрокальциноз на
рентгенограммах суставов.
Диагноз считается возможным или
предположительным при выявлении
четвертого и пятого критериев.

Рентгенография суставов
Наиболее характерным признаком является
кальцификация суставного гиалинового хряща
(хондрокальциноз) в виде нежной, линейной
тени, повторяющей контуры суставной
поверхности (двойной контур сустава). При
поражении коленных суставов эти изменения
сопровождаются более грубой кальцификацией
менисков в виде небольших треугольников в
боковых частях межсуставной щели (снимок в
прямой проекции). Обнаруживаются также
очаговые точечные кзльцификаты в области
синовиальной оболочки и капсулы. Кальцификаты
могут быть и в периартикулярных тканях,
сухожилиях и мышцах, а также в крестообразных
связках коленного сустава.
Они обычно множественные и симметричные,
сопровождаются дегенеративными
изменениями сустава, идентичными артрозу,
нередко локализующемуся в лучезапястном и
пястнофаланговом суставах. Наиболее часто
дегенеративные изменения развиваются в
феморопателлярном суставе. Следует
помнить, что при значительной
костнохрящевой деструкции кальцификация
может исчезнуть, и наоборот, в некоторых
случаях она обнаруживается на
рентгенограмме у больных, не имеющих
клинических проявлений ПФА.

Весьма характерный симптом ПФА — поражение
кисти. На рентгенограммах обнаруживают
кальцификацию суставов запястья (в 60%
случаев), кальцификацию треугольной связки
запястья (в 52%) и пястнофаланговых суставов (в
22%). Очень часто в суставах запястья и
лучезапястном суставе выявляются признаки
дегенеративной артропатии (сужение суставной
щели, уплотнение субхондральной кости,
субхондральные кисты), что может указывать на
возможность развития этого заболевания даже
без видимой кальцификации. Дегенеративные
изменения (включая остеофиты) могут
обнаруживаться и в проксимальных
пястнофаланговых суставах.
Поражение
коленного и тазобедренного
суставов наблюдается в 52 % всех случаев
ПФА. При этом поражение тазобедренного
сустава часто сопровождается
кальцификацией симфиза в виде плотной
линии посредине этого сочленения. В 25 %
случаев не обнаруживается поражение
плечевого сустава.
Поражение позвоночника также наблюдается
часто.
 В процесс вовлекается главным
В процесс вовлекается главнымобразом периферическое фиброзное кольцо.
И только при семейных формах
кальцифицируется весь диск.
Дифференциальный диагноз
Часто труден, поскольку ПФА может носить маску
подагры, острого септического артрита и
деформирующего остеоартроза.
Клиническая картина и течение болезни могут
быть такими же, как при подагре. Поэтому
первоначально обычно ставят диагноз подагры.
Однако при повторных исследованиях крови
обнаруживают нормальное содержание мочевой
кислоты, а при исследовании синовиальной
жидкости находят кристаллы не урага натрия, а
пирофосфата кальция. Внимагельное изучение
рентгенограмм нескольких суставов позволяет
выявить кальцификацию суставных тканей
(иногда очень слабо различимую), что
подтверждает диагноз ПФА.
При
остром приступе болезни, особенно
при моноартрите крупного сустава, иногда
можно подозревать септический артрит. В
этих случаях имеют значение наличие у
больного подобных же приступов в
прошлом, довольно быстрое течение
приступа с полным обратным развитием
всех суставных явлений, отсутствие
«септических» сдвигов в крови, заметного
влияния антибиотиков, а также
характерные изменения на
рентгенограммах.

При
пирофосфатной псевдоартрозной
артропатии развивается картина, чрезвычайно
схожая с деформирующим остеоартрозом и с
идентичными признаками на рентгенограмме
(сужение суставной щели, субхондральный
остеосклероз, остеофиты). Однако
локализация поражения кисти иная.
Характерное для ПФА поражение мелких
суставов запястья и пястнофаланговых
суставов обычно отсутствует при артрозе, для
которого типично поражение главным
образом дистальных и проксимальных
межфаланговых суставов.
Эти заболевания можно различать следующим
образом: при ПФА на фоне хронической
артропатии в 50 % случаев наблюдаются
псевдоподагрические приступы, тогда как при
артрозе может быть небольшой реактивный
синовит, развивающийся лишь после
перегрузки сустава, быстро исчезающий в
покое. При подозрении на ПФА следует
внимательно изучить рентгенограммы
нескольких суставов для выявления
диффузной кальцификации (при поражении
кисти, особенно в области треугольной связки
запястья и пястнофаланговых суставов), а
также исследовать синовиальную жидкость на
наличие в ней кристаллов пирофосфата, что и
решает диагноз.

21. Список литературы:
БунчукН.В. Болезнь отложения кристаллов
пирофосфата кальция. Тер. арх., т. 57, №
2, с. 132, 1985.
Насонова В.А. и Астапенко М.Г.
Клиническая ревматология, М., 1989.
Артрит пирофосфата кальция Информация | Гора Синай
Болезнь, связанная с отложением дигидрата пирофосфата кальция; болезнь ДПКВ; Острый/хронический артрит CPPD; псевдоподагра; Пирофосфатная артропатия; Хондрокальциноз
Артрит дигидрата пирофосфата кальция (CPPD) — это заболевание суставов, которое может вызывать приступы артрита. Как и при подагре, в суставах образуются кристаллы. Но при этом артрите кристаллы образуются не из мочевой кислоты.
Воспаление плечевого сустава может вызвать боль и ограничение движений в суставе.
Остеоартрит — это хроническое заболевание суставного хряща и кости, часто возникающее в результате износа сустава, хотя существуют и другие причины, такие как врожденные дефекты, травмы и нарушения обмена веществ. Суставы кажутся больше, тугоподвижны и болезненны, и обычно чем больше они используются в течение дня, тем хуже они себя чувствуют.
Суставы, особенно шарнирные, такие как локтевой и коленный, представляют собой сложные структуры, состоящие из костей, мышц, синовиальной оболочки, хрящей и связок, которые предназначены для того, чтобы нести вес и перемещать тело в пространстве. Колено состоит из бедренной кости (бедренной кости) вверху и большеберцовой кости (голени) и малоберцовой кости внизу. Коленная чашечка (надколенник) скользит через неглубокую бороздку на передней части нижней бедренной кости. Связки и сухожилия соединяют три кости колена, которые содержатся в суставной капсуле (синовиальной оболочке) и защищены хрящом.
Причины
Отложение дигидрата пирофосфата кальция (CPPD) вызывает эту форму артрита. Накопление этого химического вещества образует кристаллы в хрящах суставов. Это приводит к приступам отека суставов и боли в коленях, запястьях, лодыжках, плечах и других суставах. В отличие от подагры плюснефаланговый сустав большого пальца стопы не поражается.
Среди пожилых людей ХБП является частой причиной внезапного (острого) артрита в одном суставе. Атака вызвана:
- Повреждение сустава
- Медицинский стресс
Артрит ДПКВ в основном поражает пожилых людей, поскольку с возрастом увеличивается дегенерация суставов и остеоартрит. Такое повреждение суставов увеличивает склонность к отложению CPPD. Тем не менее, артрит CPPD чаще встречается у людей с:
- Гемохроматозом
- Болезнью паращитовидной железы
- Диализ-зависимой почечной недостаточностью
Симптомы
В большинстве случаев артрит CPPD не вызывает никаких симптомов. Вместо этого рентгеновские снимки пораженных суставов, таких как колени, показывают характерные отложения кальция.
Вместо этого рентгеновские снимки пораженных суставов, таких как колени, показывают характерные отложения кальция.
У некоторых людей с хроническими отложениями CPPD в крупных суставах могут быть следующие симптомы:
- Боль
- Отек
- Повышение температуры тела
- Покраснение
Приступы боли в суставах могут длиться месяцами. Между приступами может не быть никаких симптомов.
У некоторых людей CPPD-артрит вызывает серьезное повреждение сустава.
Артрит CPPD также может возникать в позвоночнике, как в нижней, так и в верхней части. Давление на спинномозговые нервы может вызвать боль в руках или ногах.
Из-за схожести симптомов артрит ДЗПД можно спутать с:
- Подагрическим артритом (подагрой)
- Остеоартритом
- Ревматоидным артритом
Обследования и анализы
Большинство артритов имеют схожие симптомы. Тщательное тестирование суставной жидкости на наличие кристаллов может помочь врачу выявить заболевание.
Тщательное тестирование суставной жидкости на наличие кристаллов может помочь врачу выявить заболевание.
Вы можете пройти следующие тесты:
- Исследование суставной жидкости для выявления лейкоцитов и кристаллов пирофосфата кальция
- Рентген суставов для выявления повреждений суставов и отложений кальция в суставных полостях
- Другие визуализирующие исследования суставов, такие как КТ сканирование, МРТ или УЗИ при необходимости
- Анализы крови для выявления состояний, связанных с артритом, вызванным пирофосфатом кальция
Лечение
Лечение может включать удаление жидкости для снижения давления в суставе. В сустав вводят иглу и отсасывают жидкость. Некоторые распространенные варианты лечения:
- Инъекции стероидов: для лечения сильно опухших суставов
- Пероральные стероиды: для лечения множественных опухших суставов
- Нестероидные противовоспалительные препараты (НПВП): для облегчения боли
- Колхицин: для лечения приступов артрита CPPD
- Артрит нескольких суставов, вызванный ДБПЛ, могут помочь метотрексат или гидроксихлорохин
Перспективы (прогноз)
Большинство людей хорошо переносят лечение, направленное на уменьшение острой боли в суставах. Лекарство, такое как колхицин, может помочь предотвратить повторные приступы. Не существует лечения для удаления кристаллов CPPD.
Лекарство, такое как колхицин, может помочь предотвратить повторные приступы. Не существует лечения для удаления кристаллов CPPD.
Возможные осложнения
Необратимое повреждение сустава может возникнуть без лечения.
Когда обращаться к медицинскому работнику
Обратитесь к своему лечащему врачу, если у вас возникают приступы отека суставов и боли в суставах.
Профилактика
Неизвестно, как предотвратить это заболевание. Однако лечение других проблем, которые могут вызвать артрит CPPD, может сделать состояние менее тяжелым.
Однако лечение других проблем, которые могут вызвать артрит CPPD, может сделать состояние менее тяжелым.
Регулярные контрольные осмотры могут помочь предотвратить необратимое повреждение пораженных суставов.
Андрес М., Сивера Ф., Паскуаль Э. Терапия ДКПЛ: варианты и доказательства. Curr RheumatoolRep. 2018;20(6):31. PMID: 29675606, pubmed.ncbi.nlm.nih.gov/29675606/.
Edwards NL. Заболевания, связанные с отложением кристаллов. В: Goldman L, Schafer AI, ред. Goldman-CecilMedicine. 26-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 257.
ТеркельтаубР. Кристаллокальциевая болезнь: дигидрат пирофосфата кальция и основной фосфат кальция. В: Firestein GS, Budd RC, Gabriel SE, Koretzky GA, McInnes IB, O’DellJR, eds. Учебник по ревматологии Файрштейна и Келли. 11-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 102.
Последнее рассмотрение: 21 января 2020 г.
Рецензировано: Гордоном А. Старкебаумом, доктором медицины, MACR, ABIM Board Certified in Rheumatology, Seattle, WA. Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакционная коллегия.
Болезнь отложений CPPD | UW Orthopaedics and Sports Medicine, Seattle
Следите за нашим блогом
http://shoulderarthritis.blogspot.com/
Основы болезни отложения cppd
CPPD (дигидрат пирофосфата кальция) болезнь отложения кристаллов вызывает боль, отек и иногда покраснение и /или жар в одном или нескольких суставах. Это определяется наличием характерного типа кристаллов: дигидрата пирофосфата кальция (CPPD).
Иногда кристаллы CPPD могут вызывать симптомы, напоминающие ревматоидный артрит и/или остеоартрит. Однако, в отличие от этих других заболеваний, симптомы болезни отложения кристаллов CPPD вызваны крошечными кристаллами CPPD.
Некоторые люди используют другие термины для описания этого состояния. В прошлом многие врачи называли болезнь отложения кристаллов CPPD псевдоподагрой, потому что кристаллы как при подагре, так и при болезни отложения кристаллов CPPD могут вызывать схожие симптомы.
Прогноз
Болезнь отложения кристаллов CPPD представляет собой хроническое (длительное) заболевание с повторяющимися обострениями. Это означает, что это может происходить периодически на протяжении всей вашей жизни. У некоторых людей бывает только один или, самое большее, несколько приступов за всю жизнь. Хотя лекарства от него еще нет, в большинстве случаев его можно довольно хорошо контролировать при правильном лечении.
Болезнь отложения кристаллов CPPD не должна мешать вам вести большинство аспектов вашего обычного образа жизни. Поскольку от него нет лекарства, вам может потребоваться продолжить программу лечения даже в те дни, когда вы чувствуете себя лучше. Если у вас не было серьезного повреждения суставов, вы, вероятно, можете заниматься своими обычными делами с небольшими ограничениями во время обострений.
Заболеваемость
Дигидрат пирофосфата кальция (CPPD) Заболевание, связанное с отложением кристаллов, обычно возникает у людей старше 60 лет. По-видимому, некоторые изменения в суставном хряще у пожилых людей способствуют или способствуют образованию отложений кристаллов. Он одинаково влияет на мужчин и женщин.
Болезнь отложения кристаллов CPPD может возникнуть у молодых людей, если:
- была травма или операция на суставе или
- имеется семейный анамнез заболевания или
- у человека были другие заболевания, повышающие восприимчивость к болезни отложения кристаллов CPPD
Причины
Симптомы болезни отложения кристаллов CPPD вызываются двумя процессами:
- наличием крошечных кристаллов CPPD в суставах и
- реакция организма на эти кристаллы.
В здоровом суставе твердый эластичный материал, называемый хрящом, покрывает конец каждой кости. Хрящ действует как подушка или амортизатор между костями. Суставная ткань заключена в капсулу. Капсула выстлана тонким материалом, называемым синовиальной оболочкой. Мембрана выделяет скользкую или липкую жидкость, называемую синовиальной жидкостью, в закрытое пространство сустава. Эта жидкость помогает тканям сустава двигаться плавно и легко (см. рисунок 1).
Суставная ткань заключена в капсулу. Капсула выстлана тонким материалом, называемым синовиальной оболочкой. Мембрана выделяет скользкую или липкую жидкость, называемую синовиальной жидкостью, в закрытое пространство сустава. Эта жидкость помогает тканям сустава двигаться плавно и легко (см. рисунок 1).
Кристаллы CPPD, хотя сначала были обнаружены в суставном хряще, позже могут появиться в синовиальной оболочке и синовиальной жидкости (см. рис. 2). Вероятно, это результат их высвобождения из хряща. Когда кристаллы присутствуют только в хрящах, они могут не вызывать никаких симптомов. Организм более склонен реагировать на кристаллы, выделяющиеся в суставную жидкость.
Ученые не знают, почему в организме образуются кристаллы CPPD. В некоторых случаях эти кристаллы возникают из-за аномалий в клетках хряща. В других случаях сначала возникает другое заболевание, такое как остеоартрит, которое вызывает аномалии хрящевых клеток или соединительной ткани.
У людей с болезнью отложения кристаллов CPPD иногда возникают другие состояния, которые могут вызвать или усугубить симптомы. Если у вас болезнь отложения кристаллов CPPD, вам также следует провериться на:
Если у вас болезнь отложения кристаллов CPPD, вам также следует провериться на:
- Гемохроматоз : наследственное заболевание, при котором в организме слишком много железа. Это может привести к диабету или проблемам с печенью и сердцем. Эти проблемы можно предотвратить, если вовремя распознать гемохроматоз.
- Гиперпаратиреоз : Состояние, вызванное сверхактивной или гиперактивной паращитовидной железой, при котором в крови слишком много кальция; это может привести к болезни отложения кристаллов CPPD, а также к проблемам с костями и почками.
- Гипотиреоз : Состояние, вызванное недостаточной активностью щитовидной железы, при котором наблюдается низкий уровень гормонов щитовидной железы; это может привести к сильной усталости, увеличению веса, сухости кожи и чувствительности к холоду.
- Гипомагниемия : Состояние низкого уровня магния в крови. Поскольку магний необходим организму для использования пирофосфата, низкий уровень магния может привести к болезни отложения кристаллов CPPD.

Ваш врач может проверить наличие этих и других менее известных заболеваний. Необходимо учитывать возможность их возникновения, поскольку многие из них легко поддаются лечению. Болезнь отложения кристаллов CPPD иногда может быть важным ключом к выявлению других излечимых и предотвратимых состояний.
Существует еще одна возможная причина болезни отложения кристаллов CPPD — наследственность/генетическая предрасположенность. В некоторых случаях болезнь отложения кристаллов CPPD может передаваться по наследству и может быть более распространена в некоторых этнических группах. Хотя болезнь отложения кристаллов CPPD вызывается кристаллами, содержащими кальций, она не вызывается употреблением молока или кальцием в вашем рационе. Это не заразно, поэтому вы не можете передать его другим или заразиться от кого-то еще. В некоторых случаях. хирургическое вмешательство, соматическое заболевание или травма сустава могут спровоцировать приступы боли и припухлости при заболевании.
Нажмите, чтобы увеличить
Рисунок 1. Здоровый суставНажмите, чтобы увеличить
Рисунок 2. Увеличенный вид мест отложениякристаллов CPPD в коленном суставе
Симптомы
Какой бы ни была первоначальная причина, кристаллы CPPD могут вызывать множество различных проблем.
Наиболее выраженные симптомы возникают, когда несколько кристаллов отрываются от места их расположения в хрящевом мениске или синовиальной оболочке и перемещаются в суставную щель. Это перемещение кристаллов в сустав может вызвать внезапную и сильную боль в суставе, а также покраснение, повышение температуры и отек (воспаление). Воспаление — это одна из реакций организма на кристаллы CPPD. Он видит в них «захватчиков» и посылает борющиеся с болезнями лейкоциты, чтобы атаковать их.
Эта боль в суставах может длиться несколько дней или недель. Это напоминает приступ подагры (отсюда и старый термин «псевдоподагра»). Это может произойти в любом суставе, но обычно происходит в колене или запястье. Эта форма заболевания может сопровождаться субфебрилитетом. У многих людей симптомы исчезают даже без лечения, но через какое-то время вновь появляются.
Эта форма заболевания может сопровождаться субфебрилитетом. У многих людей симптомы исчезают даже без лечения, но через какое-то время вновь появляются.
Однако чаще кристаллы CPPD создают менее серьезные, но более длительные проблемы. К ним относятся скованность, отек, жар и боль, которые поражают многие суставы. Это часто происходит в коленях, но также может произойти в запястьях, суставах, бедрах, плечах, локтях, лодыжках или пальцах ног. Боль не внезапная; вместо этого он развивается в течение длительного периода времени и может длиться много недель или месяцев. Боль может усиливаться, чем больше вы двигаете суставами.
Со временем любая форма заболевания может повредить хрящ и/или мениск колена. Когда это происходит, кости трутся друг о друга и вызывают ощущение трения и боли при использовании сустава.
У вас может быть только один из этих шаблонов или оба. В любом случае у вас могут быть периоды, когда ваши симптомы хуже, чем в другое время. У вас также могут быть полностью бессимптомные периоды.
Поскольку для развития болезни отложения кристаллов CPPD часто требуется много времени, у некоторых людей симптомы вообще отсутствуют, даже когда повреждение суставов уже происходит медленно. Доказательства кристаллов CPPD часто можно увидеть на рентгеновских снимках до появления симптомов.
Состояния с похожими симптомами
Симптомы заболевания отложением кристаллов CPPD аналогичны симптомам других заболеваний, таких как:
- Подагра вызывает внезапные приступы боли в суставах из-за другого типа кристаллов. Это чаще всего встречается у основания большого пальца ноги, но может возникнуть где угодно.
- Ревматоидный артрит вызывает хронический отек, жар, утреннюю скованность и боль в суставах, а также может поражать другие ткани. Руки и пальцы задействованы в большинстве случаев.
- Остеоартрит вызывает боль в суставах и отек из-за повреждения хряща в суставе.
Лечение
Если у вас болезнь отложения кристаллов CPPD, ваша программа лечения будет зависеть от того, насколько серьезна ваша болезнь, какие у вас симптомы и есть ли у вас другое заболевание или форма артрита наряду с болезнью отложения кристаллов CPPD.
Целями лечения являются облегчение боли, поддержание полной подвижности суставов и мышечной силы, а также сдерживание воспаления.
Программа лечения может включать комбинацию аспирации суставов, периодических инъекций кортикостероидов в пораженные суставы, лекарств, отдыха, физических упражнений и защиты суставов. Некоторым людям с болезнью отложений CPPD может потребоваться хирургическое вмешательство.
Упражнения и терапия
Упражнения могут помочь укрепить мышцы вокруг суставов, помочь поддерживать полноценную подвижность и использование суставов, а также поддерживать физическую форму тела.
Упражнения на диапазон движений особенно полезны в то время, когда активна болезнь отложения кристаллов CPPD. Это легкие упражнения, выполняемые без отягощений и предназначенные для сохранения подвижности сустава. Больной сустав следует каждый день осторожно перемещать в полном доступном диапазоне движений, уделяя особое внимание концу движения, когда подвижность часто впервые теряется. Использование теплых или холодных аппликаций до или после тренировки может повысить комфорт и эффективность этих упражнений. Ежедневно выполняйте различные двигательные упражнения, чтобы поддерживать или восстанавливать подвижность после консультации с врачом.
Использование теплых или холодных аппликаций до или после тренировки может повысить комфорт и эффективность этих упражнений. Ежедневно выполняйте различные двигательные упражнения, чтобы поддерживать или восстанавливать подвижность после консультации с врачом.
В то время, когда болезнь отложения кристаллов CPPD не активна, можно выполнять укрепляющие упражнения, чтобы обеспечить максимальную функцию и стабильность ваших суставов. Этим упражнениям должен обучать физио- или эрготерапевт или врач, предпочтительно тот, кто знаком с болезнью отложения кристаллов ДКПЛ.
Ходьба, езда на велосипеде и водные упражнения часто рекомендуются людям с болезнью отложения кристаллов CPPD.
Во время водных упражнений плавучесть воды обычно защищает суставы от быстрых или стрессовых движений. Ваш врач или физиотерапевт может помочь вам спланировать программу упражнений и объяснить, какие упражнения следует выполнять во время обострений и ремиссий болезни.
Во время внезапного приступа воспаления из-за заболевания, связанного с отложением кристаллов CPPD, вам может потребоваться дать отдых больному суставу (суставам). Иногда для отдыха и защиты сустава(ов) рекомендуются шины. Шины, трости и другие устройства для защиты суставов могут быть установлены физиотерапевтами или эрготерапевтами.
Иногда для отдыха и защиты сустава(ов) рекомендуются шины. Шины, трости и другие устройства для защиты суставов могут быть установлены физиотерапевтами или эрготерапевтами.
Лекарства
Некоторые лекарства используются для краткосрочного облегчения боли. Другие используются, чтобы держать болезнь под долгосрочным контролем. Нестероидные противовоспалительные препараты (НПВП) являются наиболее часто используемыми препаратами. НПВП уменьшают боль в суставах и отек и обычно облегчают симптомы в течение 3-10 дней. НПВП могут вызывать легкое расстройство желудка у многих людей. По этой причине врачи часто рекомендуют принимать эти препараты с жидкостью (например, с водой или молоком) и во время еды. Если вы принимаете НПВП, проконсультируйтесь со своим врачом о том, как лучше всего принимать лекарство и как он или она хочет контролировать его использование.
Кортикостероиды представляют собой синтетическую форму природного гормона кортизона. Их можно вводить непосредственно в больной сустав или принимать в виде таблеток в течение нескольких дней, чтобы уменьшить боль и отек при приступе. Эти препараты могут быть очень полезными, но могут вызывать серьезные побочные эффекты. Было показано, что колхицин умеренно эффективен для предотвращения болей и отеков в суставах, а также для лечения внезапных приступов боли. Храните колхицин и другие лекарства в недоступном для детей месте.
Эти препараты могут быть очень полезными, но могут вызывать серьезные побочные эффекты. Было показано, что колхицин умеренно эффективен для предотвращения болей и отеков в суставах, а также для лечения внезапных приступов боли. Храните колхицин и другие лекарства в недоступном для детей месте.
По мере улучшения симптомов врач может снизить дозу лекарства. Некоторые люди смогут прекратить прием всех лекарств, в то время как другим придется продолжать принимать некоторые лекарства, чтобы держать болезнь под контролем. Никогда не прекращайте прием лекарства (даже если вы чувствуете себя лучше) без консультации с врачом.
В настоящее время лекарств для устранения кристаллов не существует. Те лекарства, которые доступны в настоящее время, только снимают симптомы.
Примечание о недоказанных средствах: остерегайтесь всего, что называется «быстрым лечением», например лекарств, витаминов и минералов или устройств. Эти продукты не лечат болезнь отложения кристаллов CPPD; они стоят только денег. Некоторые из них могут на самом деле быть вредными или мешать вам получать надлежащий уход. Внимательно следуйте советам своего врача и обсудите любые другие формы лечения, которые вы рассматриваете.
Некоторые из них могут на самом деле быть вредными или мешать вам получать надлежащий уход. Внимательно следуйте советам своего врача и обсудите любые другие формы лечения, которые вы рассматриваете.
Хирургия
У некоторых пациентов хирургическое вмешательство может быть использовано для уменьшения боли и улучшения движений в сильно поврежденном или нестабильном суставе. Некоторые суставы можно частично восстановить, удалив кристаллы CPPD или фрагменты хряща через артроскоп (небольшой эндоскоп, который смотрит в сустав). Некоторые суставы, особенно тазобедренный или коленный, можно заменить искусственным суставом из пластика и металла.
Аспирация суставов
Аспирация суставов — это процесс удаления некоторого количества жидкости из больного сустава(ов). Это не только помогает вашему врачу определить, есть ли у вас заболевание, но также удаляет многие кристаллы CPPD, которые вызывают боль и отек. Удаление кристаллов также может помочь лекарствам работать лучше.
Кредиты
Некоторые из этих материалов могут также быть доступны в брошюре Arthritis Foundation.
Адаптировано из брошюры, первоначально подготовленной для Arthritis Foundation доктором медицинских наук Ральфом Шумахером и доктором медицины Питером Хассельбахером. Этот материал защищен авторским правом.
Исследование состояния
Исследователи продолжают узнавать больше об этой болезни и о том, как она влияет на организм. Они идентифицировали другие типы кристаллов в суставах, которые могут вызывать некоторые заболевания, подобные болезни отложения кристаллов CPPD. Они также изучают взаимосвязь между болезнью отложения кристаллов CPPD и другими заболеваниями. Они пытаются выяснить, как предотвратить образование кристаллов и как ускорить их удаление. Эта работа может привести к новым тестам или методам лечения этого состояния.
Острый кристаллический артрит CPP | Симптомы, причины
- Что такое острый кристаллический артрит CPP?
- Симптомы
- Причины
- Диагноз
- Лечение
- Жизнь с острым кристаллическим артритом CPP
- Пожертвовать
Получить помощь
Что такое острый кристаллический артрит CPP?
Острый артрит кристаллов пирофосфата кальция (CPP) — это состояние, которое может вызвать боль и отек суставов. «Острый» означает, что симптомы развиваются довольно внезапно.
«Острый» означает, что симптомы развиваются довольно внезапно.
Кристаллы кальция встречаются в организме естественным образом. Например, они помогают укрепить наши зубы и кости. Однако у некоторых людей эти кристаллы могут быть и в других частях тела, например, в хрящах, покрывающих концы костей в месте их соединения в суставе.
У многих людей кристаллы кальция в хрящах годами остаются без каких-либо проблем. Но иногда кристаллы отрываются от хрящей (это называется отщеплением) и перемещаются в пространство между костями, называемое суставной полостью. Когда это происходит, это может вызвать болезненное воспаление и отек, поскольку твердые острые кристаллы трутся о более мягкие ткани.
Острый кристаллический артрит CPP иногда называют псевдоподагрой, что означает ложную подагру, поскольку симптомы сходны с подагрой. Однако подагра вызывается кристаллами продукта жизнедеятельности, называемого уратами, а не кристаллами кальция.
Острый кристаллический артрит CPP поражает мужчин и женщин в равной степени, но он редко поражает людей в возрасте до 60 лет. Чаще всего поражается коленный сустав, хотя он может поражать и другие суставы.
Чаще всего поражается коленный сустав, хотя он может поражать и другие суставы.
Многие люди с остеоартритом, особенно коленным, имеют эти кристаллы кальция в суставном хряще. Это называется остеоартритом с отложением кристаллов пирофосфата кальция (остеоартрит с ДКПЛ для краткости), и симптомы, как правило, хуже, чем при остеоартрите без кристаллов.
Симптомы
Симптомы острого кристаллического артрита CPP включают:
- сильную боль и скованность в суставе, которые быстро развиваются и достигают своего пика всего за 12–24 часа
- припухлость и болезненность сустава
- покраснение кожи над суставом
- иногда лихорадка, высокая температура, вызывающая потливость и общее недомогание.
Коленный сустав чаще всего поражается этим заболеванием, но люди также могут заболеть острым кристаллическим артритом запястья, плеча, голеностопного сустава и иногда других суставов. Обычно поражается только один сустав.
Эти симптомы обычно длятся от нескольких дней до двух недель. Ваши суставы могут быть очень болезненными в течение первых нескольких дней. Вы можете заметить, что опухоль уменьшается в течение недели, хотя для восстановления пораженных суставов может потребоваться 2–3 недели.
Причины
Существует несколько факторов, повышающих риск образования кристаллов. К ним относятся:
Возраст
Когда мы становимся старше, в организме происходят химические изменения, которые повышают вероятность образования кристаллов кальция.
Другие состояния здоровья
Существует несколько состояний, которые могут привести к образованию кристаллов кальция в суставах и окружающих тканях, и иногда они могут возникать у молодых людей. Например:
- Если ваши паращитовидные железы, расположенные в передней части шеи, гиперактивны (это называется гиперпаратиреозом), это может привести к образованию кристаллов кальция.
- Состояние, при котором в организме слишком много железа (называемое гемохроматозом), также может привести к острому кристаллическому артриту CPP.

- В более редких случаях недостаток минерального магния (так называемая гипомагниемия) также может вызывать острый кристаллический артрит CPP.
- Если у вас остеоартрит, концентрация пирофосфата кальция увеличивается, что повышает вероятность образования кристаллов.
Гены
Исследования показывают, что редко люди могут наследовать дефектный ген, который иногда приводит к заболеваниям кристаллов кальция.
Что вызывает приступ острого кристаллического артрита CPP?
Боль и припухлость при остром кристаллическом артрите CPP возникают, когда кристаллы выпадают из хряща в полость сустава.
Часто непонятно, почему осыпались кристаллы. Иногда, однако, будет очевидно, что заставило кристаллы рассыпаться. Например, травма колена может высвободить кристаллы, вызывая боль и отек через день или два после этого.
Другим возможным триггером выпадения кристаллов является болезнь, вызывающая лихорадку, например, грипп или инфекция грудной клетки, или сильный стресс для организма, например, операция или сердечный приступ.
Диагностика
Диагностика острого кристаллического артрита CPP может быть затруднена, поскольку кристаллы могут быть маленькими и их трудно найти. И симптомы могут быть очень похожи на другие состояния, такие как подагра или инфекция суставов.
Вам следует обратиться к врачу при первых симптомах боли, припухлости и покраснения над суставом. Они осмотрят ваши суставы и спросят о ваших симптомах, а также проведут тесты, чтобы помочь с диагнозом и исключить другие состояния или инфекцию.
Какие существуют тесты?
Существует несколько тестов, которые могут помочь в постановке диагноза острого кристаллического артрита CPP, в том числе:
- исследование суставной жидкости на наличие кристаллов или признаков инфекции
- рентген и ультразвуковое сканирование для выявления кристаллов кальция в хрящах, избытка жидкости в суставе или повреждения сустава
- анализов крови для проверки:
- воспаление
- слишком много или слишком мало минералов, необходимых для поддержания здоровья, например, кальция, магния или железа
- инфекция
- возможных проблем с почками.

Лечение
Симптомы острого кристаллического артрита CPP обычно исчезают сами по себе через некоторое время. Но поскольку это может быть очень болезненным, вы можете получить лечение, которое поможет облегчить боль и уменьшить воспаление.
Аспирация сустава
Ваш врач может использовать иглу и шприц для забора лишней жидкости из сустава, чтобы уменьшить отек и ослабить давление в суставе, которое может вызвать боль.
Эта процедура довольно проста и быстра, и обычно приносит быстрое облегчение. Ваш врач сначала обезболит область, чтобы она не была слишком болезненной.
Излишнюю жидкость, которая была удалена, можно исследовать под микроскопом на наличие кристаллов кальция.
После удаления лишней жидкости врач обычно вводит небольшое количество стероида в сустав через ту же иглу. Это помогает уменьшить воспаление в слизистой оболочке сустава и предотвратить накопление большего количества жидкости.
Прикладывание льда
Прикладывание пакета со льдом к болезненному участку может облегчить боль и уменьшить отек.
Вы можете купить пакеты со льдом или использовать пакет с замороженным горошком или кубиками льда, завернутый во влажное полотенце для защиты кожи. Вы можете прикладывать лед примерно на 15–20 минут за раз.
Нестероидные противовоспалительные препараты (НПВП)
Нестероидные противовоспалительные препараты (НПВП) можно использовать для облегчения боли и уменьшения воспаления, вызванного кристаллами кальция.
НПВП включают такие препараты, как аспирин или ибупрофен. Некоторые НПВП можно купить в супермаркетах или аптеках, но другие доступны только по рецепту. Они доступны в виде таблеток, кремов и гелей, инъекций или пластырей.
НПВП подходят не всем, поэтому, если вы не уверены, проконсультируйтесь со своим врачом или фармацевтом.
Колхицин
Колхицин можно использовать для лечения острого кристаллического артрита CPP, хотя он подходит не всем. Он работает, уменьшая влияние кристаллов кальция на вашу иммунную систему.
Колхицин действует лучше всего, если его начать принимать в течение 24 часов после начала приступа.
Стероиды
Стероиды помогают облегчить такие симптомы, как отек, боль и скованность. Их обычно назначают, если вы не можете принимать НПВП или колхицин. Назначаемые стероиды представляют собой кортикостероиды, которые отличаются от анаболических стероидов, иногда используемых культуристами и спортсменами.
Стероиды можно принимать в виде:
Жизнь с острым кристаллическим артритом CPP
Наряду с лечением острого кристаллического артрита CPP существуют способы самостоятельно справиться с симптомами. К ним относятся:
Поддержание активности
Как только обострение болезни будет под контролем, попробуйте включить в свой распорядок дня немного физических упражнений. Поддержание активности может укрепить ваши мышцы и облегчить такие симптомы, как боль или усталость, а также полезно для вашего психического здоровья.
Если вы новичок в тренировках или давно не занимались, начните с малого и помните, что любое упражнение лучше, чем ничего. Для начала вам не нужно никакого специального снаряжения, и дома можно выполнять много физических упражнений.
Для начала вам не нужно никакого специального снаряжения, и дома можно выполнять много физических упражнений.
Диета и здоровое питание
Заболевания кристаллов кальция не вызываются употреблением слишком большого количества кальция. На самом деле важно, чтобы в вашем рационе было достаточно кальция, чтобы избежать развития остеопороза, состояния, при котором ваши кости ломаются легче, чем обычно. Вы можете получить кальций из таких продуктов, как сыр и йогурт.
Для вашего общего здоровья и хорошего самочувствия вы должны придерживаться хорошо сбалансированной диеты, которая обеспечит вас всеми необходимыми питательными веществами, такими как кальций, витамин D и железо.
Узнайте больше о правильном питании при артрите и связанных с ним заболеваниях.
Дополнительная информация
Диета
Существует множество советов по диетам и добавкам, которые могут помочь при артрите.
 Мы объясняем, какие продукты, скорее всего, помогут и как похудеть, если вам нужно.
Мы объясняем, какие продукты, скорее всего, помогут и как похудеть, если вам нужно.
Пожертвовать
Пожертвовать, чтобы помочь нам создать больше информации
Пирофосфат кальция Артрит — Нарушения скелетно-мышечной и соединительной ткани
By
Sarah F. Keller
, MD, MA, Cleveland Clinic, отделение ревматических и иммунологических заболеваний
Последний полный обзор/редакция: июль 2022 г. | Последнее изменение содержимого: сентябрь 2022 г.
Нажмите здесь для обучения пациентов
Тематические ресурсы
Артрит с пирофосфатом кальция (артрит CPP) включает внутрисуставное и/или внесуставное отложение кристаллов дигидрата пирофосфата кальция (CPPD). Проявления разнообразны и могут быть минимальными или включать периодические обострения острого артрита, называемого псевдоподагрой или острым полиартритом, и дегенеративную артропатию, которая часто бывает тяжелой. Диагноз требует выявления кристаллов CPPD в синовиальной жидкости. Лечение обострений псевдоподагры проводится внутрисуставными кортикостероидами или пероральными глюкокортикоидами, нестероидными противовоспалительными препаратами (НПВП) или колхицином.
Диагноз требует выявления кристаллов CPPD в синовиальной жидкости. Лечение обострений псевдоподагры проводится внутрисуставными кортикостероидами или пероральными глюкокортикоидами, нестероидными противовоспалительными препаратами (НПВП) или колхицином.
(См. также Общие сведения об артритах, вызванных кристаллами Обзор артритов, вызванных кристаллами Артрит может быть результатом внутрисуставного отложения кристаллов: мононатрия урата кальция пирофосфата дигидрата основного фосфата кальция (апатита) В редких случаях другие, такие как кристаллы оксалата кальция читать далее . )
Отложение кристаллов CPPD (хондрокальциноз, пирофосфатная артропатия), как симптоматическое, так и бессимптомное, становится более распространенным с возрастом.
Бессимптомный хондрокальциноз часто поражает коленные, пястно-фаланговые суставы, тазобедренные, лучезапястные, фиброзные кольца межпозвонковых дисков, лобковый симфиз и позвоночник. Мужчины и женщины страдают примерно в равной степени. Случайное обнаружение хондрокальциноза при обычной рентгенографии или другой визуализации не означает, что пациента следует лечить от артрита ХТБ.
Случайное обнаружение хондрокальциноза при обычной рентгенографии или другой визуализации не означает, что пациента следует лечить от артрита ХТБ.
Причина артрита ХТБ неизвестна. Артрит CPP часто связан с другими состояниями, такими как травма (в том числе хирургическая), гипомагниемия Гипомагниемия Гипомагниемия — это концентрация магния в сыворотке крови 1,8 мг/дл (0,70 ммоль/л). Причины включают неадекватное потребление и абсорбцию магния или повышенную экскрецию из-за гиперкальциемии или лекарств, таких как… читать далее , гиперпаратиреоз Патофизиология Гиперкальциемия — это концентрация общего кальция в сыворотке > 10,4 мг/дл (> 2,60 ммоль/л) или ионизированного кальция в сыворотке > 5,2 мг /дл (> 1,30 ммоль/л). Основные причины включают гиперпаратиреоз, витамин… читать далее , подагра Подагра Подагра — это заболевание, вызванное гиперурикемией (урат в сыворотке > 6,8 мг/дл [> 0,4 ммоль/л]), которое приводит к осаждению кристаллов моноурата натрия в суставах и вокруг них. , чаще всего вызывая рецидивирующий… читать далее , гемохроматоз Наследственный гемохроматоз Наследственный гемохроматоз — это генетическое заболевание, характеризующееся избыточным накоплением железа (Fe), которое приводит к повреждению тканей. Проявления могут включать системные симптомы, заболевания печени… читать далее, гипофосфатазия Врожденная гипофосфатазия Врожденная гипофосфатазия – это отсутствие или низкий уровень щелочной фосфатазы в сыворотке крови вследствие мутаций в гене, кодирующем тканеспецифическую щелочную фосфатазу (TNSALP). Поскольку сыворотка щелочная… читать далее , синдром Гительмана Синдром Барттера и синдром Гительмана Синдром Барттера и синдром Гительмана являются аутосомно-рецессивными почечными заболеваниями, характеризующимися водно-электролитными, мочевыми и гормональными нарушениями, включая почечный калий, натрий, хлорид… читать далее , Сцепленный с Х-хромосомой гипофосфатемический рахит Гипофосфатемический рахит Гипофосфатемический рахит — это заболевание, характеризующееся гипофосфатемией, нарушением всасывания кальция в кишечнике и рахитом или остеомаляцией, не реагирующей на прием витамина D.
, чаще всего вызывая рецидивирующий… читать далее , гемохроматоз Наследственный гемохроматоз Наследственный гемохроматоз — это генетическое заболевание, характеризующееся избыточным накоплением железа (Fe), которое приводит к повреждению тканей. Проявления могут включать системные симптомы, заболевания печени… читать далее, гипофосфатазия Врожденная гипофосфатазия Врожденная гипофосфатазия – это отсутствие или низкий уровень щелочной фосфатазы в сыворотке крови вследствие мутаций в гене, кодирующем тканеспецифическую щелочную фосфатазу (TNSALP). Поскольку сыворотка щелочная… читать далее , синдром Гительмана Синдром Барттера и синдром Гительмана Синдром Барттера и синдром Гительмана являются аутосомно-рецессивными почечными заболеваниями, характеризующимися водно-электролитными, мочевыми и гормональными нарушениями, включая почечный калий, натрий, хлорид… читать далее , Сцепленный с Х-хромосомой гипофосфатемический рахит Гипофосфатемический рахит Гипофосфатемический рахит — это заболевание, характеризующееся гипофосфатемией, нарушением всасывания кальция в кишечнике и рахитом или остеомаляцией, не реагирующей на прием витамина D. Обычно это наследственное… читать далее , семейная гипокальциурическая гиперкальциемия Семейная гипокальциурическая гиперкальциемия Гиперкальциемия концентрация общего кальция в сыворотке > 10,4 мг/дл (> 2,60 ммоль/л) или ионизированного кальция в сыворотке > 5,2 мг/дл (> 1,30 ммоль/л). Основные причины включают гиперпаратиреоз, витамин… читать далее и пожилой возраст. Эти ассоциации предполагают, что отложения кристаллов дигидрата пирофосфата кальция (CPPD) могут быть вызваны дегенеративными или метаболическими изменениями в пораженных тканях.
Обычно это наследственное… читать далее , семейная гипокальциурическая гиперкальциемия Семейная гипокальциурическая гиперкальциемия Гиперкальциемия концентрация общего кальция в сыворотке > 10,4 мг/дл (> 2,60 ммоль/л) или ионизированного кальция в сыворотке > 5,2 мг/дл (> 1,30 ммоль/л). Основные причины включают гиперпаратиреоз, витамин… читать далее и пожилой возраст. Эти ассоциации предполагают, что отложения кристаллов дигидрата пирофосфата кальция (CPPD) могут быть вызваны дегенеративными или метаболическими изменениями в пораженных тканях.
Некоторые случаи являются семейными, обычно передаются по аутосомно-доминантному типу с полным проникновением к 40 годам.
Белок анкирин (ANK) является центральным фактором в производстве избытка внеклеточного пирофосфата, который способствует образованию кристаллов CPPD. Белок ANK является переносчиком внутриклеточного и микровезикулярного пирофосфата во внеклеточное место, где образуются кристаллы CPPD.
Острый, подострый или хронический артрит обычно поражает коленные, лучезапястные или другие крупные периферические суставы; таким образом, болезнь кристаллов пирофосфата кальция может имитировать многие другие формы артрита. Острые приступы похожи на подагру, но отличаются большей интенсивностью, имеют тенденцию быть более длительными и часто труднее поддаются лечению. Симптомы артрита ХТБ могут отсутствовать между обострениями или непрерывными слабовыраженными симптомами в нескольких суставах, как при ревматоидном артрите или остеоартрите. Эти закономерности, как правило, сохраняются на всю жизнь.
Острые приступы похожи на подагру, но отличаются большей интенсивностью, имеют тенденцию быть более длительными и часто труднее поддаются лечению. Симптомы артрита ХТБ могут отсутствовать между обострениями или непрерывными слабовыраженными симптомами в нескольких суставах, как при ревматоидном артрите или остеоартрите. Эти закономерности, как правило, сохраняются на всю жизнь.
Синдром укороченного зуба (с рентгенологически «укороченным» видом зубовидного отростка второго шейного позвонка) представляет собой проявление острого аксиального артрита CPP, при котором могут наблюдаться сильные воспалительные боли в шее и скованность. Его можно принять за ревматическую полимиалгию, гигантоклеточный артериит, серонегативный спондилоартрит, шейный остеомиелит или менингит.
Артрит CPP следует подозревать у пожилых пациентов с артритом, особенно у пациентов с рецидивирующим воспалительным артритом в анамнезе.
Диагноз артрита CPP устанавливается путем выявления ромбовидных или палочковидных кристаллов в синовиальной жидкости. Микроскопическое исследование кристаллов в суставах, которые не имеют двойного лучепреломления или имеют слабое положительное двойное лучепреломление при микроскопии в поляризованном свете. Суставная жидкость при острых обострениях имеет признаки, типичные для воспаления; таким образом, необходимо также исключить сопутствующий инфекционный артрит и подагру (другие распространенные причины воспаления суставной жидкости). Инфекционный артрит исключается на основании результатов окрашивания по Граму и результатов посева. Подагру лучше всего исключить по отсутствию кристаллов уратов в жидкости из воспаленного сустава. Примечательно, что у пациента может быть как подагра, так и артрит CPP. Рентген или УЗИ показаны, если синовиальную жидкость не удается получить на анализ; обнаружение множественной линейной или точечной кальцификации в суставном хряще, особенно в волокнистом хряще, подтверждает диагноз, но не исключает подагру или инфекцию.
Микроскопическое исследование кристаллов в суставах, которые не имеют двойного лучепреломления или имеют слабое положительное двойное лучепреломление при микроскопии в поляризованном свете. Суставная жидкость при острых обострениях имеет признаки, типичные для воспаления; таким образом, необходимо также исключить сопутствующий инфекционный артрит и подагру (другие распространенные причины воспаления суставной жидкости). Инфекционный артрит исключается на основании результатов окрашивания по Граму и результатов посева. Подагру лучше всего исключить по отсутствию кристаллов уратов в жидкости из воспаленного сустава. Примечательно, что у пациента может быть как подагра, так и артрит CPP. Рентген или УЗИ показаны, если синовиальную жидкость не удается получить на анализ; обнаружение множественной линейной или точечной кальцификации в суставном хряще, особенно в волокнистом хряще, подтверждает диагноз, но не исключает подагру или инфекцию.
Прогноз для отдельных вспышек острого артрита ХТБ обычно благоприятный. Тем не менее, может развиться хронический артрит и тяжелая деструктивная артропатия, напоминающая нейрогенную артропатию. Нейрогенная артропатия Нейрогенная артропатия — это быстро деструктивная артропатия из-за нарушения восприятия боли и чувства положения, которое может быть результатом различных основных заболеваний, чаще всего диабета и… читать далее ( суставы Шарко) иногда встречается. В отличие от подагры, хронический артрит CPP сложно лечить, потому что не существует терапии, которая эффективно устраняет или уменьшает количество кристаллов CPPD. Пациентов, особенно молодых, с частыми обострениями ХПДК, следует обследовать на наличие основных триггеров и заболеваний. Этиология Кальций-пирофосфатный артрит (ХПП-артрит) включает внутрисуставное и/или внесуставное отложение кристаллов дигидрата пирофосфата кальция (ДПКД). Проявления разнообразны и… читать дальше .
Тем не менее, может развиться хронический артрит и тяжелая деструктивная артропатия, напоминающая нейрогенную артропатию. Нейрогенная артропатия Нейрогенная артропатия — это быстро деструктивная артропатия из-за нарушения восприятия боли и чувства положения, которое может быть результатом различных основных заболеваний, чаще всего диабета и… читать далее ( суставы Шарко) иногда встречается. В отличие от подагры, хронический артрит CPP сложно лечить, потому что не существует терапии, которая эффективно устраняет или уменьшает количество кристаллов CPPD. Пациентов, особенно молодых, с частыми обострениями ХПДК, следует обследовать на наличие основных триггеров и заболеваний. Этиология Кальций-пирофосфатный артрит (ХПП-артрит) включает внутрисуставное и/или внесуставное отложение кристаллов дигидрата пирофосфата кальция (ДПКД). Проявления разнообразны и… читать дальше .
Intra-articular corticosteroids
Oral corticosteroids (eg, prednisone, methylprednisolone)
Nonsteroidal anti-inflammatory drugs (NSAIDs)
Colchicine
Interleukin-1 (IL-1) антагонисты (например, анакинра)
Лечение острого артрита ХТБ аналогично лечению острой подагры. отложение кристаллов моноурата натрия в суставах и вокруг них, чаще всего вызывающее рецидивы… читать дальше . Симптомы острого синовиального выпота уменьшаются при дренировании синовиальной жидкости и инстилляции суспензии микрокристаллического эфира кортикостероида в суставную щель (например, 40 мг преднизолона ацетата или третичного бутилацетата преднизолона в колено).
отложение кристаллов моноурата натрия в суставах и вокруг них, чаще всего вызывающее рецидивы… читать дальше . Симптомы острого синовиального выпота уменьшаются при дренировании синовиальной жидкости и инстилляции суспензии микрокристаллического эфира кортикостероида в суставную щель (например, 40 мг преднизолона ацетата или третичного бутилацетата преднизолона в колено).
Индометацин, напроксен или другой НПВП Неопиоидные анальгетики Неопиоидные и опиоидные анальгетики являются основными препаратами, используемыми для лечения боли. Антидепрессанты, противосудорожные препараты и другие препараты, воздействующие на центральную нервную систему (ЦНС), также могут использоваться при хронических или… читать далее противовоспалительные дозы часто останавливают острые обострения. Колхицин Лечение острых обострений Лечение острых обострений Подагра — это заболевание, вызванное гиперурикемией (ураты в сыворотке > 6,8 мг/дл [> 0,4 ммоль/л]), которое приводит к осаждению кристаллов моноурата натрия в суставах и вокруг них, что чаще всего вызывает рецидивы . .. читать дальше идентичен таковому при подагре. Колхицин по 0,6 мг перорально 1 или 2 раза в день может уменьшить частоту рецидивирующих острых обострений. Пероральные кортикостероиды эффективны при лечении острых приступов артрита ХТБ и особенно полезны для пациентов, которым противопоказаны пероральные НПВП и колхицин. Тем не менее, если острая вспышка не купируется, может потребоваться более высокая доза в течение более длительного периода времени. Антагонисты интерлейкина-1, такие как анакинра, также могут быть эффективными.
.. читать дальше идентичен таковому при подагре. Колхицин по 0,6 мг перорально 1 или 2 раза в день может уменьшить частоту рецидивирующих острых обострений. Пероральные кортикостероиды эффективны при лечении острых приступов артрита ХТБ и особенно полезны для пациентов, которым противопоказаны пероральные НПВП и колхицин. Тем не менее, если острая вспышка не купируется, может потребоваться более высокая доза в течение более длительного периода времени. Антагонисты интерлейкина-1, такие как анакинра, также могут быть эффективными.
Бессимптомный хондрокальциноз с возрастом чаще встречается, особенно в коленном, тазобедренном, лучезапястном суставах, фиброзном кольце межпозвонковых дисков и лобковом симфизе, но не требует лечения.
Артрит CPP может поражать коленные и крупные периферические суставы и имитировать другие формы артрита (например, подагру, ревматоидный артрит, остеоартрит).
Исследование суставной жидкости на наличие характерных ромбовидных или палочковидных кристаллов в синовиальной жидкости, которые не имеют двойного лучепреломления или имеют слабое положительное двойное лучепреломление, и исключает инфекцию сустава.

При острых симптомах назначают внутрисуставные кортикостероиды, пероральные НПВП, колхицин или пероральные кортикостероиды; Анакинра также может быть эффективной.
| Название лекарства | Выберите сделку |
|---|---|
колхицин | КОЛКРИС |
преднизолон | РАЙОС |
метилпреднизолон | МЕДРОЛ |
анакинра | КИНЕРЕТ |
преднизолон | ORAPRED ODT, PRELONE |
индометацин | ИНДОЦИН |
напроксен | АЛЕВ, НАПРОСЫН |
 ПОТРЕБИТЕЛИ:
Щелкните здесь для потребительской версии
ПОТРЕБИТЕЛИ:
Щелкните здесь для потребительской версииАвторское право © 2022 Merck & Co., Inc., Рэуэй, Нью-Джерси, США и ее филиалы. Все права защищены.
Проверьте свои знания
Пройди тест!Болезнь отложения пирофосфата кальция — PMC
1. McCarty D Jr, Kohn NN, Faires JS. Значение кристаллов пирофосфата кальция в синовиальной жидкости больных артритом: «псевдогастральный синдром». 1. Клинические аспекты. Энн Интерн Мед 1962 год; 56: 711–37. [PubMed] [Академия Google]
2. Житнян Д, Сит’Ай Ш. Суставной хондрокальциноз. I. Клинико-рентгенологическое исследование. Энн Реум Дис 1963 год; 22: 142–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Zhang W, Doherty M, Bardin T, et al.
Рекомендации Европейской лиги по борьбе с ревматизмом в отношении отложений пирофосфата кальция. I. Терминология и диагностика. Энн Реум Дис
2011 г. ; 70: 563–70. [PubMed] [Google Scholar]
; 70: 563–70. [PubMed] [Google Scholar]
4. Масуда И., Исикава К. Клинические признаки приступа псевдоподагры: обзор 50 случаев. Clin Orthop Relat Res 1988; 229: 173–81. [PubMed] [Google Scholar]
5. McCarty D Jr. Диагностическая мимикрия при артрите: паттерны поражения суставов, связанные с отложениями кристаллов дигидрата пирофосфата кальция. Бык Реум Дис 1975 год; 25: 804–9. [Google Scholar]
6. Ли Р.С., Кайзер М.В., Али С.Ю. Отложение микрокристаллов фосфата кальция в межпозвонковом диске человека. Джей Анат 2006 г.; 208: 13–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Yayama T, Kobayashi S, Sato R, et al. Отложение кристаллов пирофосфата кальция в желтой связке дегенерированного поясничного отдела позвоночника: гистопатологические и иммуногистологические данные. Клин Ревматол 2008 г.; 27: 597–604. [PubMed] [Google Scholar]
8. Godfrin-Valnet M, Godfrin G, Godard J, et al.
Восемнадцать случаев синдрома коронованного логова: представление и диагностика. нейрохирургия
2013; 59: 115–20. [PubMed] [Google Scholar]
нейрохирургия
2013; 59: 115–20. [PubMed] [Google Scholar]
9. McCarty D Jr. Паттерны поражения суставов, связанные с отложением кристаллов дигидрата пирофосфата кальция. Бык Реум Дис 1975 год; 25: 804–9. [Google Scholar]
10. Yamakawa K, Iwasaki H, Ohjimi Y, et al. Опухолевая болезнь отложения кристаллов дигидрата пирофосфата кальция: клинико-патологический анализ пяти случаев. Патол Рес Практ 2001 г.; 197: 499–506. [PubMed] [Google Scholar]
11. Ryan L, McCarty D. Болезнь отложения кристаллов пирофосфата кальция: псевдоподагра: суставной хондрокальциноз В: McCarty D, ed. Артрит и родственные состояния: учебник ревматологии. 11-е изд. Филадельфия: Леа и Фебигер, 1989: 1711–1736. [Google Scholar]
12. Derfus BA, Rachow JW, Mandel NS, et al. Везикулы суставного хряща in vitro генерируют кристаллы, подобные дигидрату пирофосфата кальция. Артрит Реум 1992 год; 35: 231–40. [PubMed] [Академия Google]
13. Райан Л.М., Розенталь А.К. Метаболизм внеклеточного пирофосфата. Карр Опин Ревматол
2003 г.; 15: 311–4. [PubMed] [Google Scholar]
Карр Опин Ревматол
2003 г.; 15: 311–4. [PubMed] [Google Scholar]
14. Костелло Дж. К., Розенталь А. К., Куруп И. В., Масуда И., Медхора М., Райан Л. М. Параллельная регуляция внеклеточного АТФ и неорганического пирофосфата: роль факторов роста, модуляторов трансдукции и ANK. Соедините ткань Res 2011 г.; 52: 139–46. [PubMed] [Google Scholar]
15. Розенталь А.К., Гор С.М., Миттон-Фицджеральд Э., Лутц М.К., Дубяк Г.Р., Райан Л.М. Продукт гена прогрессирующего анкилоза ANK регулирует уровни внеклеточного АТФ в первичных суставных хондроцитах. Артрит Рез Тер 2013; 15: Р154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Martinon F, Pétrilli V, Mayor A, Tardivel A, Tschopp J. Кристаллы мочевой кислоты, связанные с подагрой, активируют воспалительные процессы NALP3. Природа 2006 г.; 440: 237–41. [PubMed] [Google Scholar]
17. Pang L, Hayes CP, Buac K, Yoo DG, Rada B. Микрокристаллы дигидрата пирофосфата кальция, связанные с псевдоподагрой, вызывают образование нейтрофильных внеклеточных ловушек. Дж Иммунол
2013; 190: 6488–500. [PubMed] [Google Scholar]
Дж Иммунол
2013; 190: 6488–500. [PubMed] [Google Scholar]
18. Liu-Bryan R, Pritzker K, Firestein GS, Terkeltaub R. Передача сигналов TLR2 в хондроцитах управляет образованием оксида азота, индуцированным кристаллами дигидрата пирофосфата кальция и урата натрия. Дж Иммунол 2005 г.; 174: 5016–23. [PubMed] [Академия Google]
19. Рубен П.М., Венгер Л., Круз М., Чунг Х.С. Индукция матриксной металлопротеиназы-8 в фибробластах человека кристаллами основного фосфата кальция и дигидрата пирофосфата кальция: эффект фосфоцитрата. Соедините ткань Res 2001 г.; 42: 1–12. [PubMed] [Google Scholar]
20. Muehleman C, Li J, Aigner T, et al. Связь между кристаллами и дегенерацией хряща в лодыжке. J ревматол 2008 г.; 35: 1108–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Neame RL, Carr AJ, Muir K, Doherty M. Распространенность хондрокальциноза коленного сообщества в Великобритании: доказательства того, что корреляция с остеоартритом осуществляется через общую связь с остеофитом. Энн Реум Дис
2003 г.; 62: 513–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Энн Реум Дис
2003 г.; 62: 513–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Фелсон Д.Т., Наймарк А., Андерсон Дж., Казис Л., Кастелли В., Минан Р.Ф. Распространенность остеоартрита коленного сустава у пожилых людей: исследование остеоартрита Framingham. Артрит Реум 1987 год; 30: 914–8. [PubMed] [Google Scholar]
23. Fuerst M, Bertrand J, Lammers L, et al. Кальциноз суставного хряща при остеоартрите человека. Артрит Реум 2009 г.; 60: 2694–703. [PubMed] [Google Scholar]
24. McCarty DJ Jr, Hogan JM, Gatter RA, Grossman M. Исследования патологических кальцинатов в хрящах человека. I. Распространенность и типы отложений кристаллов в менисках 215 трупов. J Bone Joint Surg Am 1966; 48: 309–25. [PubMed] [Google Scholar]
25. Wilkins E, Dieppe P, Maddison P, Evison G. Остеоартрит и суставной хондрокальциноз у пожилых людей. Энн Реум Дис 1983 год; 42: 280–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Doherty M, Watt I, Dieppe PA. Локализованный хондрокальциноз коленных суставов после менискэктомии. Ланцет
1982 год; 1: 1207–10. [PubMed] [Google Scholar]
Ланцет
1982 год; 1: 1207–10. [PubMed] [Google Scholar]
27. Jones AC, Chuck AJ, Arie EA, Green DJ, Doherty M. Заболевания, связанные с болезнью отложения пирофосфата кальция. Семин Артрит Реум 1992; 22: 188–202. [PubMed] [Google Scholar]
28. Glass JS, Grahame R. Хондрокальциноз после паратиреоидэктомии. Энн Реум Дис 1976 год; 35: 521–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. McCarty DJ, Pepe PF. Эритроцитарная нейтральная неорганическая пирофосфатаза при псевдоподагре. J Lab Clin Med 1972 год; 79: 277–84. [PubMed] [Google Scholar]
30. Pawlotsky Y, Le Dantec P, Moirand R, et al. Повышенный паратиреоидный гормон 44–68 и костно-суставные изменения у пациентов с генетическим гемохроматозом. Артрит Реум 1999; 42: 799–806. [PubMed] [Google Scholar]
31. Richette P, Ayoub G, Bardin T, Bouvet S, Orcel P, Badran AM. Гипомагниемия и хондрокальциноз при синдроме короткой кишки. J ревматол 2005 г.; 32: 2434–6. [PubMed] [Google Scholar]
32. Punzi L, Calò L, Schiavon F, Pianon M, Rosada M, Todesco S. Хондрокальциноз является особенностью варианта Гительмана синдрома Барттера: новый взгляд на гипомагниемию, связанную с пирофосфатом кальция. болезнь отложения кристаллов дигидрата. Rev Rhum Engl Эд
1998; 65: 571–4. [PubMed] [Google Scholar]
Punzi L, Calò L, Schiavon F, Pianon M, Rosada M, Todesco S. Хондрокальциноз является особенностью варианта Гительмана синдрома Барттера: новый взгляд на гипомагниемию, связанную с пирофосфатом кальция. болезнь отложения кристаллов дигидрата. Rev Rhum Engl Эд
1998; 65: 571–4. [PubMed] [Google Scholar]
33. Ea HK, Blanchard A, Dougados M, Roux C. Хондрокальциноз, вторичный по отношению к гипомагниемии при синдроме Гительмана. J ревматол 2005 г.; 32: 1840–182 гг. [PubMed] [Google Scholar]
34. Ryan L, McCarty D. Болезнь отложения кристаллов пирофосфата кальция; псевдоподагра; суставной хондрокальциноз. В: Маккарти Д., изд. Артрит и родственные ему состояния: учебник ревматологии 10-е изд. Филадельфия: Леа и Фебигер, 1985: 1515–1546. [Академия Google]
35. Jaccard YB, Gerster JC, Calame L. Смешанная артропатия, индуцированная кристаллами урата натрия и пирофосфата кальция: обзор семнадцати случаев. Rev Rhum Engl Эд 1996 год; 63: 331–5. [PubMed] [Google Scholar]
36. Bilezikian JP, Connor TB, Aptekar R, et al.
Псевдоподагра после паратиреоидэктомии. Ланцет
1973 год; 1: 445-6. [PubMed] [Google Scholar]
Bilezikian JP, Connor TB, Aptekar R, et al.
Псевдоподагра после паратиреоидэктомии. Ланцет
1973 год; 1: 445-6. [PubMed] [Google Scholar]
37. Harato K, Yoshida H. Псевдоподагра в коленном суставе часто возникает после перелома бедра и приводит к боли в колене в раннем послеоперационном периоде. J Orthop Surg Res 2015 г.; 10: 4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Hammesfahr JF, Knopf AB, Stitik T. Безопасность внутрисуставных гиалуронатов при боли, связанной с остеоартритом коленного сустава. Am J Orthop (Belle Mead NJ) 2003 г.; 32: 277–83. [PubMed] [Google Scholar]
39. Rho YH, Zhu Y, Zhang Y, Reginato AM, Choi HK. Факторы риска псевдоподагры среди населения в целом. Ревматология (Оксфорд) 2012 г.; 51: 2070–2074 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Ames PR, Rainey MG. Последовательные приступы псевдоподагры после повторного введения гранулоцитарного колониестимулирующего фактора при нейтропении. Мод ревматол
2007 г. ; 17: 445-6. [PubMed] [Академия Google]
; 17: 445-6. [PubMed] [Академия Google]
41. Малник С.Д., Ариэль-Ронен С., Эврон Э., Стогер З.М. Острая псевдоподагра как осложнение памидроната. Энн Фармакотер 1997 год; 31: 499–500. [PubMed] [Google Scholar]
42. Lust G, Faure G, Netter P, Gaucher A, Seegmiller JE. Доказательства генерализованного метаболического дефекта у пациентов с наследственным хондрокальцинозом: повышенный уровень неорганического пирофосфата в культивируемых фибробластах и лимфобластах. Артрит Реум 1981 год; 24: 1517–1521. [PubMed] [Google Scholar]
43. Абхишек А., Доэрти С., Мациевич Р., Мьюир К., Чжан В., Доэрти М. Связь между низкой минеральной плотностью кортикальной кости, кальцинозом мягких тканей, кальцинозом сосудов и хондрокальцинозом: случай- контрольное исследование. Энн Реум Дис 2014; 73: 1997–2002. [PubMed] [Google Scholar]
44. Williams CJ, Pendleton A, Bonavita G, et al.
Мутации в амино-конце ANKH в двух семьях США с болезнью отложения кристаллов дигидрата пирофосфата кальция. Артрит Реум
2003 г.; 48: 2627–31. [PubMed] [Google Scholar]
Артрит Реум
2003 г.; 48: 2627–31. [PubMed] [Google Scholar]
45. Ramos YF, Bos SD, van der Breggen R, et al. Мутация усиления функции в TNFRSF11B, кодирующем остеопротегерин, вызывает остеоартрит с хондрокальцинозом. Энн Реум Дис 2015 г.; 74: 1756–1762. [PubMed] [Академия Google]
46. Дерфус Б.А., Куриан Дж.Б., Батлер Дж.Дж. и соавт. Высокая распространенность патологических кристаллов кальция в предоперационных коленях. J ревматол 2002 г.; 29: 570–4. [PubMed] [Google Scholar]
47. Fuerst M, Niggemeyer O, Lammers L, Schäfer F, Lohmann C, Rüther W. Минерализация суставного хряща при остеоартрите тазобедренного сустава. BMC Расстройство опорно-двигательного аппарата 2009 г.; 10: 166. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Löffler C, Sattler H, Peters L, Löffler U, Uppenkamp M, Bergner R. Отличие подагрического артрита от болезни пирофосфата кальция и других артритов. J ревматол 2015 г.; 42: 513–20. [PubMed] [Академия Google]
49. Миксанек Дж. , Розенталь А.К. Визуализация болезни отложения пирофосфата кальция. Curr Rheumatol Rep
2015 г.; 17(3): 20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Розенталь А.К. Визуализация болезни отложения пирофосфата кальция. Curr Rheumatol Rep
2015 г.; 17(3): 20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Альвареллос А., Спилберг И. Профилактика колхицином при псевдоподагре. J ревматол 1986 год; 13: 804–5. [PubMed] [Google Scholar]
51. Zhang W, Doherty M, Pascual E, et al. Рекомендации EULAR по отложению пирофосфата кальция. II. управление. Энн Реум Дис 2011 г.; 70: 571–5. [PubMed] [Академия Google]
52. Ottaviani S, Brunier L, Sibilia J, et al. Эффективность анакинры при артрите, вызванном кристаллами пирофосфата кальция: отчет о 16 случаях и обзор литературы. Совместная кость позвоночника 2013; 80: 178–82. [PubMed] [Google Scholar]
53. Теркельтауб Р.А., Фурст Д.Е., Беннетт К., Кук К.А., Крокетт Р.С., Дэвис М.В. Высокие и низкие дозы перорального колхицина при ранней острой подагре: 24-часовой результат первого многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого, параллельного группового исследования сравнения доз колхицина. Артрит Реум
2010 г.; 62: 1060–1068. [PubMed] [Академия Google]
Артрит Реум
2010 г.; 62: 1060–1068. [PubMed] [Академия Google]
54. Ротшильд Б., Якубов Л.Е. Проспективное 6-месячное двойное слепое исследование лечения ХЗПД гидроксихлорохином. Компр Тер 1997 год; 23: 327–31. [PubMed] [Google Scholar]
55. Finckh A, Mc Carthy GM, Madigan A, et al. Метотрексат при хронически-рецидивирующей болезни отложения пирофосфата кальция: в рандомизированном перекрестном исследовании значимого эффекта не выявлено. Артрит Рез Тер 2014; 16: 458. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Chollet-Janin A, Finckh A, Dudler J, Guerne PA. Метотрексат как альтернативная терапия хронической болезни отложения пирофосфата кальция: предварительный анализ. Артрит Реум 2007 г.; 56: 688–92. [PubMed] [Google Scholar]
57. Kumar V, Pandit HG, Liddle AD, et al.
Сравнение исходов после УКА у пациентов с хондрокальцинозом и без него: исследование с согласованной когортой. Коленный хирург Спортивный травматол Arthrosc
2015.
Маршировать
19
(Epub перед печатью). [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
Болезнь отложения пирофосфата кальция (CPPD)
Этому объекту 8 лет и 11 месяцев; некоторый контент может быть устаревшим.
Опорно-двигательный аппаратОбезболиваниеРевматология
Пожалуйста, войдите, чтобы сохранить эту статью.
статья по электронной почте
0
комментариев
прочитать позже
Сохранить статью в Mybook
Ряд клинических синдромов связан с отложением кристаллов дигидрата пирофосфата кальция в суставах и вокруг них. Эти синдромы ранее назывались такими терминами, как «псевдоподагра» или «псевдоостеоартрит», но эти термины больше не используются. Вместо этого синдромы сгруппированы под общим термином болезнь отложения пирофосфата кальция (CPPD). Отложение кристаллов пирофосфата кальция приводит к воспалительной реакции в суставе, аналогично тому, как происходит отложение кристаллов моногидрата урата натрия у пациентов с подагрой, и может способствовать значительным хроническим дегенеративным изменениям в суставах. Пациенты с болезнью CPPD могут быть бессимптомными или иметь ряд симптомов и признаков, сходных с подагрой или другими формами воспалительного артрита, что затрудняет точный клинический диагноз. Кроме того, в отличие от подагры, существует относительная нехватка доказательных исследований синдромов, вызванных CPPD, и нет конкретного лекарства, которое может снизить концентрацию кристаллов. Таким образом, лечение направлено только на симптоматическое облегчение.
Пациенты с болезнью CPPD могут быть бессимптомными или иметь ряд симптомов и признаков, сходных с подагрой или другими формами воспалительного артрита, что затрудняет точный клинический диагноз. Кроме того, в отличие от подагры, существует относительная нехватка доказательных исследований синдромов, вызванных CPPD, и нет конкретного лекарства, которое может снизить концентрацию кристаллов. Таким образом, лечение направлено только на симптоматическое облегчение.
- Распространенность болезни CPPD
- Клиническая картина болезни ХБПЛ
- Лечение болезни ДПКВ
- Каталожные номера
В этой статье
В этой статье
Посмотреть/Скачать pdf версию этой статьи
Распространенность болезни CPPD
Существует мало исследований распространенности симптоматической болезни отложения пирофосфата кальция (CPPD). хондрокальциноз,
который представляет собой кальцификацию суставного хряща, чаще всего вызванную CPPD, по оценкам, затрагивает 5% общего
населения, и распространенность увеличивается с возрастом. 1, 2 Болезнь CPPD может быть более распространена у женщин, чем у мужчин,
но доказательства противоречивы. 1, 3 В настоящее время нет данных об этнических различиях между
распространенность болезни CPPD у маори, тихоокеанских народов и новозеландских европейцев. Однако есть некоторые свидетельства того, что
люди азиатского происхождения могут иметь более низкую распространенность болезни CPPD, чем люди европейского происхождения. 4
1, 2 Болезнь CPPD может быть более распространена у женщин, чем у мужчин,
но доказательства противоречивы. 1, 3 В настоящее время нет данных об этнических различиях между
распространенность болезни CPPD у маори, тихоокеанских народов и новозеландских европейцев. Однако есть некоторые свидетельства того, что
люди азиатского происхождения могут иметь более низкую распространенность болезни CPPD, чем люди европейского происхождения. 4
Факторы риска развития ХПБЛ
Факторы риска развития ХБП включают:
- Пожилой возраст – после 50 лет риск развития ХБПЛ примерно удваивается каждые десять лет. 1 В у людей в возрасте до 50 лет ХБПЛ встречается редко, и если диагноз диагностирован в этой возрастной группе, вероятно, существует семейная ассоциация или предрасположенность к метаболическим заболеваниям.
- Предыдущая травма сустава или хирургическое вмешательство
- Подагра в анамнезе – по оценкам, 20 % пациентов с болезнью ХБПБ также имеют гиперурикемию, а 25 % из них у пациентов разовьется подагра 5
- Наследственная/семейная предрасположенность к ХБПЛ – пациенты могут обращаться в более молодом возрасте и с большей вероятностью имеют полиартикулярную
вовлечение (см.
 : «Отложение кристаллов CPP»)
: «Отложение кристаллов CPP») - Эндокринные или метаболические заболевания в анамнезе, такие как гемохроматоз, первичный гиперпаратиреоз, гипофосфатазия, гипомагниемия — считается, что метаболические изменения, возникающие в результате этих состояний, способствуют продвижению пирофосфата кальция. (CPP) отложение кристаллов за счет ингибирования пирофосфатазы или путем прямого воздействия на хрящ. 1, 6
Связь между CPPD и остеоартритом сложна. Эти два состояния имеют общие факторы риска, такие как с возрастом и предыдущей травмой, а отложение кристаллов CPP увеличивается при наличии поврежденного хряща. 1 Однако, CPPD также, по-видимому, инициирует и усугубляет существующее остеоартритное повреждение суставов. 1, 5 Обнаружены кристаллы CPP примерно в одной трети случаев, когда образцы берутся из коленей пациентов с остеоартритом, которые проходят артроскопия. 5
Клиническая картина ХДПЛ
Пациенты с ХБПЛ могут быть бессимптомными (с изменениями, выявляемыми случайно при рентгенологическом исследовании) или могут проявляться
ряд симптомов и признаков, сходных с теми, которые обнаруживаются у пациентов с подагрой или другими формами воспалительного артрита (например,
ревматоидный артрит) или септический артрит. Клинически может быть трудно отличить болезнь CPPD от этих других заболеваний.
состояния, поражающие суставы. CPPD может также сосуществовать с подагрой, остеоартритом и инфекцией суставов и не всегда
быть состоянием, которое вызывает симптомы пациента. 9
Клинически может быть трудно отличить болезнь CPPD от этих других заболеваний.
состояния, поражающие суставы. CPPD может также сосуществовать с подагрой, остеоартритом и инфекцией суставов и не всегда
быть состоянием, которое вызывает симптомы пациента. 9
Отложение кристаллов CPP приводит к воспалительной реакции в суставе аналогично кристаллов моногидрата урата натрия оказывает влияние на больных подагрой. Таким образом, острые симптомы болезни CPPD включают: боль, отек, скованность, эритема, потеря функции и выраженная болезненность пораженного сустава (суставов). 10 Пациенты с ХБПБ заболевание может также проявляться системными признаками, такими как боль в шее, головная боль и лихорадка (по оценкам, до 50% людей с ДЗПД) 6 , что может затруднить дифференциальную диагностику между инфекцией и воспалением.
Болезнь CPPD часто поражает крупные суставы, чаще всего коленный. Другими суставами, которые могут быть вовлечены, являются запястье,
лодыжка, локоть, носок, плечо и бедро. 5 Болезнь CPPD является полиартикулярной примерно у двух третей пациентов, 6 и
это часто происходит в асимметричном образце. Тем не менее, болезнь CPPD может имитировать ревматоидный артрит или ревматическую полимиалгию.
и у пациентов может быть симметричное поражение суставов. В редких случаях возможно отложение кристаллов CPP в других
части скелета, напр. в позвоночнике, лобковом симфизе или височно-нижнечелюстном (ВНЧС) суставе. 3 CPPD на шее может вызвать
синдром коронованного логова, редкая причина острой боли в шее. 11 ХБП также может быть связан с тендинитом, тендосиновитом
и бурсит. 1, 10
5 Болезнь CPPD является полиартикулярной примерно у двух третей пациентов, 6 и
это часто происходит в асимметричном образце. Тем не менее, болезнь CPPD может имитировать ревматоидный артрит или ревматическую полимиалгию.
и у пациентов может быть симметричное поражение суставов. В редких случаях возможно отложение кристаллов CPP в других
части скелета, напр. в позвоночнике, лобковом симфизе или височно-нижнечелюстном (ВНЧС) суставе. 3 CPPD на шее может вызвать
синдром коронованного логова, редкая причина острой боли в шее. 11 ХБП также может быть связан с тендинитом, тендосиновитом
и бурсит. 1, 10
Обеспечение кристальной ясности терминологии
Многие термины, напр. псевдоподагры, псевдоостеоартрита, псевдоревматоидного артрита.
ряд клинических синдромов, связанных с отложением кристаллов дигидрата пирофосфата кальция в суставах.
термин «псевдоподагра» был принят в 1962 после первого описания кристаллов фосфата кальция, обнаруженных в синовиальной оболочке. жидкости пораженных суставов у пациентов с нормальным уровнем уратов в сыворотке крови. 7 Термин был выбран для отражения дискретного
тип индуцированного кристаллами синовита, который напоминал острый приступ подагры. Впоследствии было установлено, что отложение
кристаллов CPP в суставах не только ответственен за острый синовит, но и связан с широким спектром клинических синдромов.
жидкости пораженных суставов у пациентов с нормальным уровнем уратов в сыворотке крови. 7 Термин был выбран для отражения дискретного
тип индуцированного кристаллами синовита, который напоминал острый приступ подагры. Впоследствии было установлено, что отложение
кристаллов CPP в суставах не только ответственен за острый синовит, но и связан с широким спектром клинических синдромов.
В литературе ведутся споры о том, какие термины следует использовать, и недавно была предпринята попытка уточнить номенклатура. Европейская лига против ревматизма (EULAR) Целевая группа CPPD согласовала единую терминологию с целью уменьшения путаницы и непоследовательного использования таких терминов, как «псевдоподагра». Их рекомендации чтобы в клинических исследованиях и практике была принята следующая терминология: 1
- Кристаллы CPP – упрощенный термин для кристаллов дигидрата пирофосфата кальция
- Отложения пирофосфата кальция; CPPD – «зонтичный термин» для всех состояний, связанных с отложением
Кристаллы CPP:
- Бессимптомная ХБПЛ — ХБП без каких-либо явных клинических последствий, чаще всего случайная находка при рентгенологическом исследовании
- Острый кристаллический артрит ХПД (ранее псевдоподагра) – относится к острому, самокупирующемуся синовиту с ХПД
- Остеоартрит с CPPD (ранее псевдоостеоартрит) – CPPD, который возникает в суставе с ранее существовавшим дегенеративным изменения вследствие остеоартрита
- Хронический кристаллический воспалительный артрит CPP (ранее псевдоревматоидный артрит) – хронический воспалительный артрит связанный с CPPD
- Хондрокальциноз – обызвествление суставного хряща, выявляемое при рентгенологическом исследовании.
 Хондрокальциноз обычно
Однако, вызванный CPPD, он может присутствовать в суставе, который в остальном кажется нормальным, или в связи со структурными изменениями.
изменения, характерные для остеоартрита. Термин «хондрокальциноз» следует использовать для описания рентгенологического
изменения кальцификации хряща, а не для описания клинической ситуации у пациента.
Хондрокальциноз обычно
Однако, вызванный CPPD, он может присутствовать в суставе, который в остальном кажется нормальным, или в связи со структурными изменениями.
изменения, характерные для остеоартрита. Термин «хондрокальциноз» следует использовать для описания рентгенологического
изменения кальцификации хряща, а не для описания клинической ситуации у пациента.
Клинические синдромы, связанные с ХБПЛ
Бессимптомная ХБПЛ – у пациентов могут быть случайные рентгенологические признаки, характерные для ХБПЛ (хондрокальциноз) но не имеют явных клинических последствий. Было высказано предположение, однако, что, если взять более полную историю, многие из у этих пациентов в анамнезе есть симптомы со стороны суставов, особенно коленного или лучезапястного. 5
Острый кристаллический артрит CPP – острое начало болезненного отека сустава (или суставов), отражающее самокупирующийся
синовит при ХПД. Острый эпизод болезни CPPD может возникнуть спонтанно или развиться после травмы, хирургического вмешательства или тяжелого
болезнь, похожая на приступ подагры. Повторяющиеся острые приступы болезни CPPD могут вызывать прогрессирование
повреждение сустава. Термин «псевдоподагра» традиционно использовался для обозначения этого острого состояния из-за сходства с
острого приступа подагры, хотя, по оценкам, только примерно у 25% пациентов наблюдается эта классическая картина
болезнь. 5
Повторяющиеся острые приступы болезни CPPD могут вызывать прогрессирование
повреждение сустава. Термин «псевдоподагра» традиционно использовался для обозначения этого острого состояния из-за сходства с
острого приступа подагры, хотя, по оценкам, только примерно у 25% пациентов наблюдается эта классическая картина
болезнь. 5
По сравнению с пациентами с острой подагрой, острые приступы у пациентов с ХБП обычно:
Остеоартрит с CPPD – CPPD, который возникает в суставе, в котором ранее были дегенеративные изменения из-за остеоартрита. Как остеоартрит, так и болезнь CPPD как изолированные состояния часто поражают коленный сустав, однако пациенты с остеоартритом с CPPD, как правило, имеют: 1
- Более интенсивная боль (чем при одном остеоартрите)
- Выраженная болезненность пораженных суставов
- Системные симптомы, напр.
 лихорадка
лихорадка - Атипичное распределение пораженных суставов – остеоартрит сам по себе обычно не поражает такие суставы, как запястье, локтевой, плечевой или голеностопный сустав 6
Хронический кристаллический воспалительный артрит CPP – хронический воспалительный артрит, связанный с CPPD, часто с симметричным распространение на пораженные суставы. Это может чаще наблюдаться у более молодых пациентов (возраст < 50 лет), у которых есть семейная форма CPPD. 6
Сбор анамнеза и обследование не всегда могут привести к окончательному диагнозу.
Заболевание CPPD может имитировать большинство других форм воспалительного артрита, подагры и инфекции суставов. 5 История и клиническое обследование может помочь клиницисту отличить заболевание ХБПЛ от этих других состояний, однако клиническое картина обычно недостаточно отчетлива, чтобы можно было поставить определенный диагноз только на основании клинических данных.
Спросите пациентов о: 6, 10
- Количество и расположение пораженных суставов
- Скорость появления и выраженность боли
- Наличие системных симптомов, например лихорадка — до 50% людей с острым заболеванием CPPD будут иметь лихорадку, и редко у пожилых пациентов может наблюдаться делирий
- Любое острое повреждение сустава
- Если в анамнезе были боль, травма или хирургическое вмешательство в пораженном(ых) суставе(ах)
- Любое недавнее тяжелое заболевание в анамнезе (например, серьезная инфекция, сердечная недостаточность) или недавнее хирургическое вмешательство (в частности
паратиреоидэктомия).
 Эти состояния могут вызвать быстрое снижение уровня кальция в сыворотке крови, что может спровоцировать приступ.
Эти состояния могут вызвать быстрое снижение уровня кальция в сыворотке крови, что может спровоцировать приступ. - Семейный анамнез эпизодов полиартикулярной боли в суставах у молодых родственников, особенно если сам пациент моложе (возраст < 55 лет)
- Сопутствующие заболевания, особенно гемохроматоз или заболевания паращитовидных желез
Отложение кристаллов СРР
Факторы, способствующие отложению кристаллов СРР и повреждению суставов, остаются неясными, однако исследования к пониманию того, как образуются кристаллы CPP. Изменения хрящей в результате старения, травм, генетических факторов и известно, что метаболические или биохимические процессы способствуют развитию CPPD. 3, 6 Появляется увеличение производства неорганического пирофосфата и снижение уровня пирофосфатазы (ферментов, расщепляющих пирофосфат).
Повышенная активность ферментов, расщепляющих аденозинтрифосфат (АТФ), приводит к увеличению внеклеточных неорганических
пирофосфат. Неорганический пирофосфат связывается с кальцием с образованием кристаллов СРР, которые затем откладываются в хрящах.
и синовиальной оболочки суставов.
Неорганический пирофосфат связывается с кальцием с образованием кристаллов СРР, которые затем откладываются в хрящах.
и синовиальной оболочки суставов.
В настоящее время известно, что мутация в гене, кодирующем белок, участвующий в транспорте пирофосфата, имеет ключевую причину роль в семейных формах CPPD, а также, вероятно, участвует в несемейных формах. 8 Ген был идентифицирован как человеческий ген гомолога белка анкилоза (ANKH) и расположен на пятой хромосоме. 8 А семейную форму заболевания следует рассматривать у симптоматического лица в возрасте до 50 лет, у которого Болезнь ДППГ.
Исследования часто могут подтвердить клиническое подозрение на заболевание ХБПЛ
Важно изначально учитывать возможность септического артрита, особенно если у пациента один пораженный сустав.
Исключить септический артрит
При поражении одного сустава следует исключить септический артрит, однако инфекция может возникать одновременно с
лежащее в основе заболевание CPPD. Если сустав можно аспирировать, следует получить синовиальную жидкость и отправить на микроскопию.
и культура. Также может быть высокое количество лейкоцитов (преимущественно нейтрофилов) в синовиальной жидкости, однако это
может возникать как при инфекции, так и при болезни CPPD.
Если сустав можно аспирировать, следует получить синовиальную жидкость и отправить на микроскопию.
и культура. Также может быть высокое количество лейкоцитов (преимущественно нейтрофилов) в синовиальной жидкости, однако это
может возникать как при инфекции, так и при болезни CPPD.
Возможность аспирации сустава зависит от ряда факторов, в том числе от квалификации врача. поражения (некоторые суставы аспирируются легче, чем другие) и любых противопоказаний, включая целлюлит, лежащий на пораженный сустав, наличие суставного протеза или нарушение свертываемости крови. Применение пероральных антикоагулянтов является относительным Противопоказания и решение об аспирации пораженного сустава должны приниматься индивидуально для каждого пациента. 12
Идентификация кристаллов ЦПД в синовиальной жидкости является золотым стандартом диагностики
Золотым стандартом для окончательного диагноза болезни ХПД является идентификация кристаллов ЦПД в синовиальной жидкости. 1 Характерные кристаллы, обнаруживаемые при ДПКЗ, обычно имеют прямоугольную, квадратную, ромбовидную или палочковидную форму и могут быть
видно с помощью микроскопии в поляризованном свете. 5, 6 Другие типы кристаллов, напр. также могут быть видны моноураты натрия.
1 Характерные кристаллы, обнаруживаемые при ДПКЗ, обычно имеют прямоугольную, квадратную, ромбовидную или палочковидную форму и могут быть
видно с помощью микроскопии в поляризованном свете. 5, 6 Другие типы кристаллов, напр. также могут быть видны моноураты натрия.
Анализы крови
Могут потребоваться несколько анализов крови, но ни один из них не имеет такой большой диагностической ценности, как анализ синовиальной жидкости. Рассмотреть возможность запрос: 5, 10
- ОАК – это может показать повышенное количество лейкоцитов, однако это часто не особенно полезно для различения между инфекцией и воспалением
- CRP – аналогичные ограничения существуют при интерпретации повышенного результата CRP
- Уровни уратов в сыворотке – нормальный результат снижает вероятность подагры, однако у некоторых пациентов уровень уратов в сыворотке может быть нормальным.
при острой подагре и до 20% больных с ХБП могут иметь повышенный уровень уратов в сыворотке крови.
 Уровни уратов следует измерять, когда
суставные симптомы не очевидны, чтобы обеспечить повышенную точность.
Уровни уратов следует измерять, когда
суставные симптомы не очевидны, чтобы обеспечить повышенную точность. - Креатинин и электролиты – особенно если рассматривается возможность использования НПВП
Необходимо обследовать пациентов в возрасте до 55 лет и пациентов с выраженным полиартикулярным поражением суставов для основного метаболического заболевания, такого как гипомагниемия, гиперпаратиреоз или гемохроматоз. 1, 3 Доп. исследования могут включать исследования паратгормона, кальция, фосфатов, магния и железа.
Роль радиологии
Обычная рентгенография может помочь подтвердить клиническое подозрение на ДКПЛ, особенно если невозможно получить синовиальную жидкость
искать кристаллы CPP. Рентген также может выявить степень дегенерации сустава. Хондрокальциноз (линейный
или точечная кальцификация гиалинового и волокнистого хрящей) является характерным признаком на обычной рентгенограмме,
с CPPD. 13 Тем не менее, отсутствие хондрокальциноза на рентгенограмме не исключает болезни ХБП. 1 Если
требуется простой рентген, рекомендуемые суставы для визуализации — колени, запястья и передне-задняя проекция
таз. Одно только рентгенологическое исследование коленей, вероятно, приведет к тому, что значительное число пациентов с ХБПЛ будет пропущено. 14
1 Если
требуется простой рентген, рекомендуемые суставы для визуализации — колени, запястья и передне-задняя проекция
таз. Одно только рентгенологическое исследование коленей, вероятно, приведет к тому, что значительное число пациентов с ХБПЛ будет пропущено. 14
Другие формы визуализации, напр. УЗИ, КТ и МРТ играют относительно ограниченную роль у большинства пациентов с Однако они могут быть полезны у пациентов с атипичными или редкими проявлениями заболевания. 13 УЗИ, например, может быть полезен для направления аспирации сустава у некоторых пациентов или может выявить отложения кальция в суставах. хрящ. 13 КТ и МРТ могут быть запрошены во вторичной медицинской помощи для оценки отложения кристаллов CPP при атипичных таких местах, как шея (синдром корончатого логова) или в других областях позвоночника, где это может вызвать компрессию спинного мозга. 10, 13
Лечение болезни ДЦПЛ
В отличие от подагры, в настоящее время не существует эффективного лечения, которое уменьшает или удаляет кристаллы CPP из сустава. 6,
15 Таким образом, лечение не показано пациентам с бессимптомным хондрокальцинозом, обнаруженным при рентгенологическом исследовании. Уход
при остром приступе обеспечивает симптоматическое облегчение, но не изменяет течение болезни. При отсутствии лечения острое
приступ боли в суставах из-за болезни CPPD может длиться от нескольких дней до месяца. 6 Если болезнь
результат основного состояния, т.е. гемохроматоз, первичный гиперпаратиреоз, это следует лечить соответствующим образом,
хотя мало доказательств того, что это улучшает артропатию, вызванную CPPD у пациентов с этими состояниями. 5 Многие
пациенты будут иметь сопутствующий остеоартрит, и общие меры, используемые для лечения этого заболевания, также будут иметь значение, в том числе
обучение, физические упражнения и потеря веса, поддержка суставов и средства подвижности для поддержания подвижности суставов и уменьшения боли и
жесткость.
6,
15 Таким образом, лечение не показано пациентам с бессимптомным хондрокальцинозом, обнаруженным при рентгенологическом исследовании. Уход
при остром приступе обеспечивает симптоматическое облегчение, но не изменяет течение болезни. При отсутствии лечения острое
приступ боли в суставах из-за болезни CPPD может длиться от нескольких дней до месяца. 6 Если болезнь
результат основного состояния, т.е. гемохроматоз, первичный гиперпаратиреоз, это следует лечить соответствующим образом,
хотя мало доказательств того, что это улучшает артропатию, вызванную CPPD у пациентов с этими состояниями. 5 Многие
пациенты будут иметь сопутствующий остеоартрит, и общие меры, используемые для лечения этого заболевания, также будут иметь значение, в том числе
обучение, физические упражнения и потеря веса, поддержка суставов и средства подвижности для поддержания подвижности суставов и уменьшения боли и
жесткость.
Имеются ограниченные данные, подтверждающие использование любого из лекарственных средств, применяемых для лечения болезни CPPD, в частности,
отсутствие рандомизированных контролируемых исследований. Рекомендации по ведению болезни CPPD, как правило, основаны на экспертных рекомендациях.
мнения или экстраполированы из исследований по лечению подагры. 15
Рекомендации по ведению болезни CPPD, как правило, основаны на экспертных рекомендациях.
мнения или экстраполированы из исследований по лечению подагры. 15
Лечение острого приступа
Лечение для уменьшения боли и отека, связанных с острым приступом болезни, связанной с ДБПЛ, включает: 3, 15
- Лед или охлаждающие компрессы
- Временный покой пораженного сустава
- Совместная аспирация
- Пероральные НПВП
- Низкая доза колхицина
- Кортикостероиды (внутрисуставные инъекции или перорально)
Лед или охлаждающие компрессы и остальная часть пораженного сустава, вероятно, временно облегчат боль и могут уменьшить отек.
Аспирация пораженного сустава не только дает жидкость для подтверждения диагноза и исключения инфекции,
это может дать временное облегчение боли из-за уменьшения объема жидкости в суставе. Внутрисуставная инъекция
Кортикостероиды могут быть очень эффективными для уменьшения симптомов у пациентов с одним пораженным суставом, который легко
доступ.
При необходимости пероральный НПВП (с покрытием ИПП, если необходимо) или низкие дозы колхицина могут быть эффективными для снижения острого симптомы. 15 Рекомендации по дозировке колхицина для лечения ХБПЛ различаются. Для купирования острого симптомов, EULAR рекомендует колхицин по 0,5 мг до трех-четырех раз в день с дополнительной нагрузочной дозой 1 мг. 15 Продолжительность лечения зависит от облегчения симптомов и побочных эффектов. 15 Использование колхицина и НПВП будут ограничены индивидуальными факторами пациента, такими как возраст, функция почек, другие сопутствующие заболевания и риск неблагоприятных эффектов или токсичности.
Если НПВП или колхицин не могут быть использованы, короткий курс пероральных кортикостероидов (например, преднизолон 0,5 мг/кг, ежедневно, с быстрым снижением дозы) также может облегчить острые симптомы, особенно у пациентов с тяжелым полиартикулярным поражением суставов. атаки. 3, 15
Лечение хронического ХБПЛ
Выбор лекарственных средств для лечения пациентов с хроническим ХБП основывается, прежде всего, на данных о методах лечения, используемых для лечения
подагры и остеоартрита, а также по заключению экспертов. 15 При необходимости можно опробовать следующие методы лечения
(в порядке предпочтения), у пациентов с хроническим заболеванием ХБПЛ: 15
15 При необходимости можно опробовать следующие методы лечения
(в порядке предпочтения), у пациентов с хроническим заболеванием ХБПЛ: 15
- НПВП (с защитой от ИПП)
- Низкие дозы колхицина, напр. 0,5 – 1 мг в день
- Низкие дозы пероральных кортикостероидов – конкретных рекомендаций по дозировке не дано; обычная поддерживающая доза составляет от 2,5 мг до 15 мг в день 16
Длительное применение этих лекарственных средств связано с различными побочными эффектами; пациенты должны находиться под надлежащим наблюдением. Пациенты, принимающие колхицин, должны немедленно сообщать о любых желудочно-кишечных симптомах. Рассмотреть необходимость мониторинга почек функцию, ОАК (при лейкопении и тромбоцитопении) и креатининкиназу (при колхицин-индуцированной миотоксичности). Также осведомлены о потенциальных лекарственных взаимодействиях.
Для получения дополнительной информации о назначении НПВП см.: «НПВП:
Выбор более безопасного лечения».
Для получения дополнительной информации о назначении стероидов длительного действия см.: «Полимиалгия rheumatica – Практические соображения при назначении кортикостероидов длительного действия», BPJ 53 (июнь 2013 г.).
Было проведено несколько небольших испытаний других лекарственных средств, таких как метотрексат и гидроксихлорохин, у пациентов с хроническое, тяжелое течение ХБП, не поддающееся обычному лечению, однако доказательства их эффективности ограничены. 15, г. 17 Направление к ревматологу рекомендуется для пациентов с хроническим симптоматическим заболеванием CPPD, когда другие методы лечения не увенчались успехом.
Хроническое заболевание или повторяющиеся острые приступы болезни ДПКЗ могут вызывать прогрессирующее поражение суставов. Пациенты с
CPPD в суставах, состояние которых значительно ухудшилось, часто в сочетании с остеоартритом, следует оценивать на предмет
операция по замене сустава так же, как и у пациентов только с остеоартритом.
Лекарства, используемые для профилактики повторных приступов
Имеются некоторые данные о том, что низкие дозы колхицина (0,5 мг, один или два раза в день) могут быть эффективными для снижения числа приступов у больных с частыми рецидивирующими эпизодами, но нет данных о применении НПВП. 15 Любой из эти лекарства могут быть назначены в попытке уменьшить частоту острых приступов, однако целесообразность для отдельного пациента необходимо учитывать и наблюдать за пациентом на предмет побочных эффектов, таких как желудочно-кишечные расстройства. (кровотечение, диарея), изменения функции почек, миопатия и сердечно-сосудистые события.
Потенциальные будущие методы лечения болезни CPPD
Были предположения, что некоторые лекарства и диетические изменения теоретически могут подавлять образование
или увеличить растворение кристаллов CPP, но требуются дополнительные исследования. Изучаемые методы лечения включают:
терапия антиинтерлейкином 1, глюкозамин, магний, пробенецид, диета, богатая витамином С, и диета с низким содержанием цистеина. 3,
5, 15
3,
5, 15
Подтверждение
TСпасибо доценту Николе Далбет , ревматологу DHB Окленда и Школе медицины, Университет Окленда за экспертную оценку этой статьи.
Ссылки
- Zhang W, Doherty M, Bardin T, et al. Рекомендации Европейской лиги по борьбе с ревматизмом в отношении пирофосфата кальция показания Часть I: терминология и диагностика. Энн Реум Дис. 2011;70:563–70.
- Парперис К., Каррера Г., Бейнс К. и др. Распространенность хондрокальциноза (ХК) акромиально-ключичного (АК) сустава на рентгенограммах грудной клетки и корреляции с болезнью отложения кристаллов дегидрата пирофосфата кальция (CPPD). Клин Ревматол. 2013;32(9): 1383–6.
- Абхишек А., Доэрти М. Патофизиология суставного хондрокальциноза – роль АНХ. Нат Рев Ревматол. 2011;7:96–104.
- Zhang Y, Terkeltaub R, Nevitt M, et al. Более низкая распространенность хондрокальциноза у китайцев в Пекине, чем
в белых предметах в Соединенных Штатах.
 Пекинское исследование остеоартрита. Ревмирующий артрит. 2006;54(11):3508–12.
Пекинское исследование остеоартрита. Ревмирующий артрит. 2006;54(11):3508–12. - MacMullen P, McCarthy G. Лечение и лечение псевдоподагры: информация для клинициста. The Adv Musculoskel Дис. 2012;4(2):121–31.
- Лонго Д., Фаучи А., Каспер Д. и др. Глава 333: Подагра и другие артропатии, связанные с кристаллами. Харрисон: Принципы внутренней медицины. 18-е изд. Нью-Йорк: McGraw Hill Medical; 2012. с. 2839–40.
- McCarthy D, Kohn N, Faires J. Значение кристаллов фосфата кальция в синовиальной жидкости больных артритом: «псевдоподагрический синдром». Энн Инт Мед. 1962; 56 (5): 711–37.
- Williams C, Zhang Y, Timms A, et al. Аутосомно-доминантная семейная болезнь отложения дигидрата пирофосфата кальция вызывается мутацией трансмембранного белка ANKH. Am J Hum Genet. 2002;71:985–91.
- Теркельтауб Р. Визуализация суставов для отложения кристаллов пирофосфата кальция: удар по коленям. Артрит Res Ther. 2012;12:128.
- Perera C, Brook A, Tynns K.
 Подагра и другие кристаллические артропатии – Часть 2. Австралийский доктор. 2009 28 августа; 21–9.
Подагра и другие кристаллические артропатии – Часть 2. Австралийский доктор. 2009 28 августа; 21–9. - Гото С., Умехара Дж., Айзава Т., Кокунун С. Синдром коронованного Денса. J Bone Joint Surg Am. 2007; 89: 2732–6.
- Bettencourt R, Linder M. Артроцентез и терапевтическая инъекция суставов: обзор для врача первичной медико-санитарной помощи. Prim Care Clin Office Pract. 2012;37:691–702.
- Dalbeth N, McQueen F. Использование визуализации для оценки подагры и других нарушений отложения кристаллов. Курр Опин Ревматол. 2009; 21: 124–31.
- Abhishek A, Doherty S, Maciewicz R. Хондрокальциноз часто встречается при отсутствии поражения коленного сустава. Артрит Рез тер. 2012;14:R205.
- Чжан В., Доэрти М., Паскуаль Л. и др. Рекомендации Европейской лиги по борьбе с ревматизмом в отношении пирофосфата кальция показания Часть II: управление. Энн Реум Дис. 2011;70:571–5.
- Формуляр Новой Зеландии (NZF). НЗФ v15. НЗФ; 2013. Доступно на: www.

 2009; 17 (10): 1333–1340.
2009; 17 (10): 1333–1340. Res. 2001; 50: 391–399.
Res. 2001; 50: 391–399.

 д.). Продолжительность
приступа обычно от нескольких дней
до 4-6 нед. После приступа в суставах
не остается никаких воспалительных
явлений. Частота приступов весьма
вариабельна — отнескольких недель до
нескольких лет. Иногда приступы
учаща1отся и развивается хронический
синовит.
д.). Продолжительность
приступа обычно от нескольких дней
до 4-6 нед. После приступа в суставах
не остается никаких воспалительных
явлений. Частота приступов весьма
вариабельна — отнескольких недель до
нескольких лет. Иногда приступы
учаща1отся и развивается хронический
синовит.