Антисептик Стимулятор Дорогова — АСД
Препарат АСД-Капли зарегистрирован как БАД. Не является лекарством. Просим обратить Ваше внимание, что АСД работает более эффективно в сочетании с классической гомеопатией.
История создания АСД
Изобретен профессором А.В. Дороговым в 1948г. В то время перед советской наукой была поставлена стратегическая задача исключительной важности: предстояло разработать средство защиты людей и животных от оружия массового поражения. Исследования велись под грифом «совершенно секретно» и курировались лично Берией. Упорный поиск и неустанный труд, кропотливая экспериментальная работа, которая велась в Люберецком районе на базе совхоза «Белая дача», наконец, увенчались успехом. В 194? году была получена первая партия препарата. «Смертию смерть поправ…» Эту фразу из Священного Писания любил повторять Дорогов, разрабатывая свой препарат.
В 1951 году в результате продолжительных клинических испытаний официально разрешено его применение в медицине, препарат АСД фракция 2 был внесен в фармакопейный реестр. В 1952г АСД-2ф препарат прошел продолжительные клинические испытания в Москве в институте профзаболеваний, клинике МПС, 4ом управлении, институте акушерства и гинекологии, в Санкт-Петербургской военно-медицинской академии, в результате которых было выявлено разностороннее восстанавливающее действие препарата на организм человека.
В 1952г АСД-2ф препарат прошел продолжительные клинические испытания в Москве в институте профзаболеваний, клинике МПС, 4ом управлении, институте акушерства и гинекологии, в Санкт-Петербургской военно-медицинской академии, в результате которых было выявлено разностороннее восстанавливающее действие препарата на организм человека.
В 1956 году работы были свернуты, в 1957г не стало проф Дорогова, до 1962г препарат находился под грифом секретности. С 1962- 1994г во Всесоюзном институте экспериментальной ветеринарии вела разработки жена проф Дорогова и в контрольном институте ветеринарных препаратов работала группа ученых.
Вторая жизнь препарата АСД
Возрождение препарата АСД
С 1980 года по настоящее время работами по исследованию препарата занимается дочь Дорогова Алексея Власовича врач-иммунолог Дорогова Ольга Алексеевна. С 1995г запатентованы кремы и бальзамы с АСД. В 1998 года получен патент на препарат АСД фракция 2 (АСД-2ф) как адаптоген, объяснен механизм его действия. 27.03.2012 восстановлена фармакологическая статья, и препарат вышел на медицинский рынок как пищевая добавка.
27.03.2012 восстановлена фармакологическая статья, и препарат вышел на медицинский рынок как пищевая добавка.
День сегодняшний препарата АСД
В клинике классической гомеопатии им. С. Ганемана активно применяется АСД по авторской методике Дороговой Ольги Алексеевны «Активационная терапия». В сочетании с классической гомеопатией это позволяет добиться хороших результатов в лечении различных заболеваний как в остром, так и хроническом их состоянии. Приём ведёт группа опытных врачей гомеопатов, дополнительно прошедших обучение у кандидата медицинских наук Дороговой Ольги Алексеевны.
На сегодняшний день АСД фракция 2 для людей выпускается под названием АСД-Капли.
Состав АСД фракция 2 или как это работает
АСД – продукт возгонки мясо-костной муки при t 130-300 С с последующей конденсацией и разделением на 2 и 3 фракцию. 2 фракция принимается внутрь и для полосканий, на основе 3 фракции изготавливают лечебные бальзамы для наружнего применения и косметическая линия Айсида.
В состав АСД ф2 входит 75% воды и 25% органических и неорганических веществ. Действие препарата обусловлено его составом. Неорганические вещества: азот, углерод, фосфор, аммонийные соли. Органических веществ более 100 компонентов. Некоторые из них:
- Ацетатметиламин – активирует синтез биогенных аминов: серотонина и ацетилхолина.
- Метилмеркаптан – антиоксидант, блокирует окислительные процессы, стабилизирует клеточные мембраны, способствует выведению радиационных веществ и токсичных продуктов из организма.
- Уксусная кислота – активирует коэнзим А в цикле Кребса.
- Тиоловые компоненты – активируют синтез собственного глютатиона, обеспечивают антиоксидантную защиту.
- Метилмочевина – учавствует в обмене липидов.
- Циклопентан – активирует анаболические процессы.
- Декан – участвует в синтезе жирорастворимых витаминов.
АСД регулирует синтез аминокислот, участвующих в образовании регуляторных нейропептидов (эндорфины, энкефалины, АКТГ, соматотропный гормон, периферические нейропептиды) и нейромедиаторов, в результате чего ЦНС обеспечивает правильный контроль за другими системами адаптационного ответа: иммунной, эндокринной и периферических тканевых барьеров, т е работает как адаптоген.
Препарат обладает антибактериальным эффектом за счет солей аммония при местном применении и при приеме внутрь за счет стимуляции специфической и неспецифической защиты (повышение IgG, фагоцитоза, интерферонового статуса).
АСД не несет антигенных детерминант, поэтому не является ни антигеном, ни гаптеном и не вызывает аллергических реакций. Препарат полностью усваивается организмом, не обладает ни токсичными, ни канцерогенными, ни кумулятивными свойствами.
Производство АСД фракция 2
Разработчиков не устраивало качество препарата Армавирской биофабрики, и с 1998г начала работать новая Московская фабрика по выпуску АСД, на которой были разработаны новые технические условия и новые методы контроля качества АСД. Московская биофабрика учитывает все требования, которые профессор Дорогов предъявлял к качеству препарата, и курируется О А Дороговой. В настоящее время продолжаются работы по исследованию препарата и созданию новых фракций.
Что такое Активационная терапия?
Метод Активационной терапии Дороговой О.
 А.
А.Активационная терапия – это метод активизации функциональной активности регуляторных и защитных систем организма, улучшения синхронизации внутри организма и синхронизации организма с факторами внешней среды, повышения резистентности организма, нормализации гомеостаза.
Активационная терапия показана практически всем, одним для оздоровления, другим для профилактики, а третьим для лечения, либо самостоятельного, либо в сочетании с самыми различными видами терапии и хирургических вмешательств.
Дороговой О. А. разработана и запатентована методика действенного способа Активационной терапии препаратом АСД, который прост в применении и не обладает побочными эффектами.
Ольга Алексеевна проводит обучение врачей методу Активационной терапии препаратом АСд на семинарах и мастер-классах, которые регулярно проводятся на базе Клиники классической гомеопатии им. С. Ганемана.
Препарат АСД фракция 2 относится к медицине, в частности к терапии, онкологии, аллергологии, и может быть использован при лечении широкого круга заболеваний, а также их профилактики.
Все болезни реализуются в макроорганизме, и от состояния активности его регуляторных и защитных подсистем зависят уровень здоровья, устойчивость к болезням и нагрузкам, тяжесть заболевания и даже эффективность специфического лечения. Поэтому сегодня особое место отводится активационной терапии — терапии путем вызова и поддержания в организме антистрессорных реакций — главным образом реакций активации высоких уровней реактивности. Вызывая развитие реакции активации, мы тем самым повышаем до верхних границ нормы функциональную активность регуляторных и защитных подсистем организма, улучшаем синхронизацию внутри организма и организма с факторами внешней среды, повышаем резистентность, нормализуем гомеостаз /Гаркави Л.Х. с соавт. Антистрессорные реакции и активационная терапия, 1998 г./.
Принцип активационной терапии — целенаправленный вызов антистрессорных реакций, обусловливающих функциональное состояние организма, характерное для здоровья.
Для активационной терапии нет противопоказаний по состоянию организма.

Известен препарат АСД фракции 2 и 3. Утвержден в 1951 году Фармакологическим комитетом Ученого Медицинского Совета Министерства Здравоохранения СССР. Принят для лечения ряда кожных заболеваний человека /экзема, нейродермит, сикоз, эпидермофития и др./, а также как противовоспалительный препарат /Н. П. Торопова, О.А.Синявская. Экзема и нейродермит у детей. Екатеринбург, 1993 г., стр. 336-339/.
Однако это далеко не полный спектр воздействия на организм препарата АСД.
Известно, что препарат АСД воздействует на нервные холинэргические структуры и повышает функциональную активность холинэргической системы ацетилхолин-ацетилхолинестераза в целом /З.И.Дерябина Сельскохоз. Биология N 6, М., 1980, с. 887-891/.
Он обладает адренэргическим влиянием, проявляет себя как катехоламины и активизирует фермент аденилатциклазу. Предупреждает угнетающее действие гидрокортизона на лимфоидные органы и надпочечники /Б.А.Тимофеев с соавт. Доклады ВАСХНИЛ 2 февраля 1987 г., М., с. 32-34/.
Также известно, что на фоне применения препарата АСД отмечается активация неспецифического и специфического звеньев иммунной защиты. Повышается концентрация пропердина в сыворотке крови, активизируется система комплимента, фагоцитоз, нормализуется количество. В-лимфоцитов, уровень иммуноглобулинов стремится к норме, восстанавливаются взаимоотношения в субпопуляциях Т-лимфоцитов /З. И.Дерябина, А.В.Николаев. Труды ВИЭВ, том 35, М., 1968, с. 336/.
При этом под воздействием препарата АСД увеличивается резервная щелочность крови /А. В. Дорогов, А.П.Волоскова. Труды ВИЭВ, том 35, М., 1968, с. 332/.
В организме создаются оптимальные условия для нейтрализации недоокисленных радикалов. Растет величина легочного газового обмена, увеличение артерио-венозной разности кислорода и кислородной емкости крови, повышается потребление кислорода тканями. Все это активизирует энергетический обмен и окислительные процессы в тканях /А.В.Дорогов, З.И.Дерябина. Труды ВИЭВ, том 35, М., 1968, с. 332-333/.
332-333/.
АСД оказывает стимулирующее действие на биохимические процессы, сопряженные с биологической функцией активных сульфгидрильных групп, и способен интенсифицировать многие стороны обмена углеводов, липидов, белков. Высокое содержание холиновых производных обусловливает его участие в липидном обмене, в процессах метилирования, в формировании структуры и функциональной деятельности клеточных мембран. Под воздействием АСД выявлено достоверное повышение содержания нуклеиновых кислот (РНК) в крови.
Это свидетельствует об усилении процессов биосинтеза белковых веществ в организме. Препарат Дорогова активизирует трофические процессы в тканях, повышает обмен веществ в здоровом организме и восстанавливает обменные процессы в случае их нарушения при различных заболеваниях /З.И.Дерябина Сельскохоз. Биология N 6. М., 1980, с. 887-891/.
Бактерицидность препарата проявляется в высоких концентрациях и при длительных экспозициях. Под воздействием препарата некоторые микробы теряют вирулентность. Общая антисептическая активность включает помимо непосредственного воздействия на микрофлору, эффект повышения бактерицидности крови, активизацию неспецифических факторов иммунной защиты /В.А.Плотникова с соавт. Труды ВГНКИ. Том 28. М., 1978, с. 130-135/.
Общая антисептическая активность включает помимо непосредственного воздействия на микрофлору, эффект повышения бактерицидности крови, активизацию неспецифических факторов иммунной защиты /В.А.Плотникова с соавт. Труды ВГНКИ. Том 28. М., 1978, с. 130-135/.
Вышеуказанные исследования позволяют предположить, что препарат АСД воздействует практически на все звенья защиты живого организма как универсальный адаптоген. В этом состоит технический результат воздействия.
В 1998 году выдан патент РФ за N 2099068 на применение АСД в качестве противоопухолевого средства. Данная работа выполнена в Архангельской медицинской академии, основана на экспериментальном материале. Сведения о клиническом применении и эффективных дозах воздействия отсутствуют.
Препарат АСД с успехом применялся при клинических испытаниях для лечения кожных заболеваний /экзема, эпидермофития, нейродермит, псориаз, сикоз, лишаи/; гипертонической болезни, бронхиальной астме, заболеваниях ЖКТ, гнойных септических заболеваниях, невритах, невралгиях, в стоматологической практике, при туберкулезе и злокачественных опухолевых поражениях желудка, легких, гениталий. Результаты этих испытаний не опубликованы в открытой печати.
Результаты этих испытаний не опубликованы в открытой печати.
При исследовании лечебного действия препарата АСД при различных заболеваниях было установлено, что главный его нормализующий эффект опосредуется через высокие системы защиты — ЦНС, вегетативную нервную систему и нейрогуморальную регуляцию. Последовательно активизируя эндокринную и иммунную системы организма, АСД предупреждает или снижает угнетающее воздействие глюкокортикоидов, тормозит подавление тимико-лимфатической системы и тем самым препятствует развитию иммунопатии при стрессе.
В тканях действие препарата реализуется через активацию ряда ферментных систем. Одним из основных биологических компонентов препарата АСД ф-2 являются холиновые эфиры карбоновых кислот типа ацетилхолина, бутерилхолина, пропионилхолина, которые обладают выраженным ацетилхолиноподобным действием. Ацетилхолин является одним из основных регуляторов жизненных процессов в организме, выполняет не только медиаторную, но и трофическую функцию, участвует во внутриклеточной регуляции обмена путем воздействия на проницаемость клеточных мембран и на активность различных ферментов, усиливает синтез адреналина, РНК, белка, увеличивает поглощение кислорода тканями, способствует активации транспорта РНК, аминокислот, сахаров, электролитов через мембраны эритроцитов, скелетных мышц, кровеносных сосудов. Под влиянием препарата АСД уровень свободного ацетилхолина в крови у кроликов повышается на 9,6%, активность ацетилхолинэстеразы вырастает на 34%, что свидетельствует об активизации функции системы ацетилхолин-ацетилхолинэстеразы и, следовательно, о стимулирующем влиянии препарата на трофические процессы в организме.
Под влиянием препарата АСД уровень свободного ацетилхолина в крови у кроликов повышается на 9,6%, активность ацетилхолинэстеразы вырастает на 34%, что свидетельствует об активизации функции системы ацетилхолин-ацетилхолинэстеразы и, следовательно, о стимулирующем влиянии препарата на трофические процессы в организме.
Препарат АСД оказывает избирательное воздействие на функциональные структуры клеточных мембран, активизируя или ингибируя /в зависимости от концентрации/ фермент N, K-АТФ-азу. Таким образом, в умеренных концентрациях препарат усиливает активный транспорт ионов и метаболических веществ через клеточные мембраны, в высоких концентрациях подавляет функцию метаболического насоса. В препарате АСД содержатся функционально активные сульфгидрильные группы, характеризующиеся высокой реакционной способностью. Сульфгидрильные группы принимают участие в ряде физиологических и биохимических процессов: в нервной деятельности, в мышечном сокращении, делении клеток, регуляции проницаемости мембран митохондрий, фосфорилировании и т. д. /А. Ленинджер, 1976; Ю.М. Торчинский, 1971 г./.
д. /А. Ленинджер, 1976; Ю.М. Торчинский, 1971 г./.
Можно говорить о регуляции в организме процессов обмена углеводов, белков и липидов под воздействием препарата АСД. Он повышает активность фермента РНКазы, увеличивает содержание нуклеиновых кислот, общего белка и гаммаглобулинов в крови.
Все эти механизмы в значительной степени объясняют профилактическое и лечебное действие препарата АСД при широком спектре заболеваний. При выборе терапевтической тактики необходимо учитывать вид заболевания, фазы течения патологического процесса, а также специфику реагирования данного организма.
В течение многих лет разрабатывалась и испытывалась методика применения препарата АСД фракция 2 при самых различных заболеваниях. Выявлены основные принципы выбора дозы и продолжительности курса лечения, которые индивидуальны в каждом конкретном случае и зависят в основном от веса больного, вида заболевания и типа реагирования организма.
Дорогова О. А. утверждает, что применение метода Активационной терапии должно проводиться врачом, владеющим этим методом, т. к. только врач в состоянии профессионально оценить состояние организма пациента и подобрать адекватную схему лечения.
к. только врач в состоянии профессионально оценить состояние организма пациента и подобрать адекватную схему лечения.
В настоящее время Дорогова О. А. проводит обучающие семинары и регулярные мастер-классы по Активационной терапии для врачей на базе Клиники классической гомеопатии им. С. Ганемана. Приглашаем врачей освоить и применять этот уникальный метод в своей жизни и практике.
Дорогова Ольга Алексеевна отвечает на вопросы об АСД
Часть первая
Часть вторая
Часть третья
Часть четвёртая
Что можно сказать в заключение? Препарат АСДф2, конечно, не коктель со вкусом клубники, но пользу приносит реальную и, что важно, практически без побочных эффектов. Гомеопатия всегда эффективно работала и будет работать , не зависимо от того, сочетаем ли мы ее с приемом АСД-2ф или нет. Но практика показывает абсолютный синэргизм этих методик. И Вам самим решать, что важнее для вас — добавить скорость и эффективность к гомеопатическому лечению или же отказаться от этого из-за неприятного вкуса и запаха.
Гомеопатия всегда эффективно работала и будет работать , не зависимо от того, сочетаем ли мы ее с приемом АСД-2ф или нет. Но практика показывает абсолютный синэргизм этих методик. И Вам самим решать, что важнее для вас — добавить скорость и эффективность к гомеопатическому лечению или же отказаться от этого из-за неприятного вкуса и запаха.
Автор: Коллектив клиники
От: 16.04.2016
Генная терапия — новое направление в медицине
Достижения молекулярной биологии и генетики в изучении тонкой структуры генов эукариот, картирование генов на хромосомах млекопитающих, их идентификация и клонирование, обнаружение мутаций в генах, ассоциированных с наследственными и приобретенными заболеваниями, наряду с бурным ростом в области биотехнологий, клеточных технологий и успехами генной инженерии привели к тому, что в конце прошлого века начался бум в исследованиях по анализу молекулярно-биохимических дефектов, ассоциированных с определенной патологией, который привел к пониманию того, что большинство грозных заболеваний человека сопровождается серьезными изменениями в генетическом аппарате клетки.
Генная терапия — это лечение наследственных, мультифакториальных и ненаследственных (инфекционных, злокачественных и др.) заболеваний путем введения генов в соматические клетки пациентов с целью направленного изменения генных дефектов или придания клеткам новых свойств.
История развития генной терапии началась в 1972 г., когда в США, в Стэндфордском университете, Стэнли Коэн и Герберт Бойер обнаружили явление прямого переноса фрагментов ДНК от одной бактерии кишечной палочки к другой при непосредственном контакте этих клеток. А уже в 1974 г. в США была учреждена первая в мире биотехнологическая компания «Genetech», где выращивали новые бактериальные культуры с чужими генами.
В 1976 г. в Университете Пенсильвания, США, Уильям Андерсон предложил использование вирусов в качестве носителей ДНК, а в 1990 г. этот исследователь в клинике Университета Пенсильвания ввел больной Ашанти ДеСильва с синдромом комбинированного иммунодефицита (СКИД) генетически модифицированные геном аденозиндезаминазы ее собственные лимфоциты, в последующие 3 года провел 23 внутривенных трансфузии и получил длительную ремиссию, а затем выздоровление.
В 1990—1999 гг. Департамент здравоохранения США за год после выздоровления Ашанти создает свыше сотни лабораторий по генной терапии, проводит более 400 клинических исследований по генной терапии, в которых принимает участие свыше 4 тыс. пациентов. Однако в 1999 г. в госпитале Университета Пенсильвании, США, происходит событие, которое резко затормозило исследования по генной терапии в США. Это — внезапная смерть 17-летнего Джесси Гелзингер в процессе лечения наследственного заболевания печени.
В то же время метод генной терапии все шире распространялся по миру и к настоящему моменту в мире проведено и проводится более 2210 клинических испытаний по генной терапии.
Спектр заболеваний, при которых проводятся клинические испытания по генной терапии, также чрезвычайно широк (табл. 1). Независимо от нозологии, в области соматической генной терапии имеются общие задачи. Это:
Таблица 1. Клинические испытания в области генной терапии
— выбор наиболее эффективного для лечения гена;
— разработка способов доставки требуемого гена в нужные клетки;
— изучение и обеспечение эффективных подходов и способов нужной регуляции гена;
— вопросы длительности существования и экспрессии введенного гена;
— обеспечение безопасности больного.
Типы генов, используемых при генной терапии, разнообразны, и их выбор определяется патогенетическими механизмами развития заболевания, идентификацией наиболее болезнетворных генов.
Наиболее простая задача в выборе гена стоит при моногенных наследственных заболеваниях, то есть там, где показано, что определенный дефект в данном гене вызывает патологический процесс. Совершенно другая задача по степени сложности в выборе гена для терапии стоит при многофакториальных заболеваниях, таких как злокачественные новообразования, кардиоваскулярные болезни, при которых в патогенезе заболеваний, во-первых, пока много неясного, во-вторых, задействован ряд генов.
Типы генов, описанные для клинических исследований, варьируют очень широко. Среди них 20,2% относятся к генам антигенов, 16,2% — цитокинов, 9,4% — различных рецепторов, 8,6% — факторов иммунодефицита, 7,4% — к «суицидным» генам, 7,4% — к генам факторов роста, 4,2%— ингибиторов репликации, 2,5% — маркеров, 13,2% — к генам других категорий белков, 2,5% — к неизвестным генам [1].
Для эффективной работы выбранный терапевтический ген снабжают сигнальными (регулирующими) элементами, которые необходимы для синтеза полноценной мРНК и целевого белка, а также позволяют управлять специфичностью экспрессии в определенном типе клеток или ткани, длительностью функционирования и нужной регуляцией гена в клетке (рис. 1) [2, 3].
1) [2, 3].
Рис. 1. Схема генно-терапевтической конструкции.
Специфичность экспрессии генов в заданной клетке достигается конструированием векторов, несущих терапевтические гены под контролем промоторов, работающих только в данном типе клеток. К настоящему моменту выявлен ряд тканеспецифичных промоторов, обеспечивающих селективную экспрессию терапевтических трансгенов в клетках определенных органов. В экспериментальной генной терапии сердечно-сосудистых заболеваний в настоящее время используют промоторы, которые обеспечивают преимущественную экспрессию трансгена в миокарде (SM22α-промотор и др.) [4]. Разработан целый ряд тканеспецифичных промоторных систем, в которых использованы гены, высокоэкспрессированные, главным образом, в опухолевых клетках: простатспецифический и простатспецифический мембранный антигены при раке предстательной железы [5], гены, кодирующие сурфактантные белки, А и В, при раке легкого [6, 7], ген мембранно-связанного муцина MUC1/DF3 при раке молочный железы, трахеи, легкого, тонкого или толстого кишечника [8], ген α-фетопротеина — белка, синтезируемого в печени, при раке печени [9], промоторы гена сурвивина человека (hSurv) и гена обратной транскриптазы теломеразы человека (hTERT), обеспечивающих экспрессию трансгена в клетках широкого спектра опухолей [10, 11] (табл.
Таблица 2. Опухолеспецифичные промоторы
Поскольку тканеспецифичные промоторы обладают общим недостатком — низким уровнем экспрессии гетерологичных генов, а также ограниченной областью применения, обусловленной их тканеспецифичностью, в настоящее время идет активный поиск промоторов генов человека, не обладающих тканевой специфичностью — универсальных или гибридных промоторов, направленных исключительно на пролиферирующие клетки и не затрагивающих нормальные дифференцированные клетки.
Одной из сложнейших проблем в генной терапии является доставка требуемого гена в нужные ткани при минимизации его контакта с биологическими средами организма до достижения клетки-мишени, а также обеспечение доставки гена в нужную клетку с целью его эффективной и безопасной работы в ней.
В настоящее время генетический материал доставляется в клетку либо в виде «голой» ДНК («naked DNA»)/плазмиды, в том числе в составе наночастиц и липосом, либо с использованием векторов вирусной и невирусной природы, защищающих ДНК от разрушения и имеющих тропность к определенным тканям (рис. 2) [12].
2) [12].
Рис. 2. Системы доставки генетического материала в клетку. (Адаптировано по: Thomas SM, Grandis JR. The Current State of Head and Neck Cancer Gene Therapy. 2009; Y20: 1565—1575 [12])
Самым простым способом доставки трансгенов является доставка «голой» ДНК/плазмиды. При этом для целей доставки генетического материала в ядро клетки используется арсенал различных средств. Это может быть физический метод доставки ДНК с применением таких приемов, как прямая инъекция «голой» ДНК, электропорация клеток и доставка ДНК через поры в обработанных мембранах, бомбардировка частицами с ДНК с использованием гидродинамической пушки [13].
На долю «голой» и плазмидной ДНК приходится всего 17,4% протоколов клинических испытаний в области генной терапии, что обусловлено их низкой трансфицирующей способностью. Это обстоятельство является большим ограничением для использования такого генетического материала в разработке метода генной терапии, несмотря на наличие у него ряда неоспоримых преимуществ: отсутствие инфекционности, низкая иммуногенность, высокая технологичность (доступность в получении в высокоочищенном состоянии в больших количествах, стандартность, стабильность при хранении и т. д.).
д.).
Альтернативным способом доставки терапевтических генов является использование векторов вирусной, бактериальной и химической природы. Вектор должен эффективно и специфически трансфицировать/трансдуцировать делящиеся и неделящиеся таргетные клетки, экспрессировать трансген в адекватных количествах в течение длительного времени, производиться легко и рентабельно по количеству и качеству, не быть иммуногенным и использоваться для повторного введения гена, являться безопасным при введении и не иметь побочных эффектов.
В качестве векторов для доставки генетического материала в клетку-мишень используют самые разнообразные вирусы, но наиболее распространены векторы на основе аденовируса (ADV), аденоассоциированного вируса, ретро- (RV), лентивируса (LV) и вируса простого герпеса (HSV) (табл. 3). При этом нативные полные вирусные частицы никогда не используются в качестве векторов, так как в этом случае есть опасность встраивания их генетического материала в клетки хозяина с целью приобретения метаболических и биосинтетических продуктов для вирусной транскрипции и репликации. Поэтому вирусы предварительно подвергаются существенной генетической модификации, приводящей к утере их репликационной способности и повышению тропизма к тканям и клеткам.
Поэтому вирусы предварительно подвергаются существенной генетической модификации, приводящей к утере их репликационной способности и повышению тропизма к тканям и клеткам.
Таблица 3. Вирусные векторы для генной терапии
Вирусные векторы достаточно хорошо изучены, они имеют высокую эффективность трансфекции in vivo, для их наработки существуют коммерческие паковочные клеточные линии. Векторы на основе аденовируса и аденоассоциированных вирусов не встраиваются в геном клетки, а остаются эпихромосомными. Это уменьшает опасность мутагенеза, который может быть индуцирован при внедрении вируса в геном. При конструировании специфически направленных аденовирусных векторов эффективной оказалась замена вирусных промоторов, контролирующих основные транскрипционные области, так называемыми транскрипционными регуляторами, в результате чего экспрессия гена и репликация вируса происходят преимущественно в целевых клетках [14, 15].
Ретровирусные векторы интегрируют в геном хозяина, что при генной терапии обеспечивает стабильность и стойкую экспрессию трансгена в дочерних клетках, однако несет риск инсерционного мутагенеза, который может вызывать инактивацию генов-супрессоров опухолевого роста или активации онкогенов [16].
Необходимо отметить, что вирусные векторы обладают и другими недостатками. Так, они могут нести лишь небольшое количество генетического материала (до 30 кб). Кроме того, аденовирусные векторы 1-го поколения, в которых присутствуют все вирусные гены, обладают выраженной иммуногенностью, которая обусловливает развитие как клеточного, так и гуморального иммунного ответа, что приводит к разрушению не только самого вектора, но и клеток, трансдуцированных ими, и как следствие к ограничению срока экспрессии трансгена в 2—3 нед после трансдукции [17]. В настоящее время проблема иммуногенности таких векторов для генной терапии решается путем разработки конструкций, практически полностью лишенных вирусных генов, так называемых «gutless» вирусов или хелперзависимых (HD)/Ad векторов [18]. Исследования in vivo показали перспективность использования HD/Ad векторов для трансдукции клеток сосудистой системы и миокарда [19].
Несмотря на описанные недостатки, вирусный метод доставки трансгенов в клетки успешно развивается и в настоящее время является доминирующим: около 70% клинических исследований посвящено изучению генетических конструкций, снабженных вирусными векторами.
В то же время в последние годы активно разрабатываются невирусные системы доставки генетического материала с использованием высокомолекулярных химических соединений для конденсации с ДНК: липидсвязанные комплексы — липоплексы либо поликатионные комплексы, имитирующие поверхность вируса — полиплексы (табл. 4). Эти наночастицы защищают плазмидную ДНК в межклеточном пространстве от деградации нуклеазами и облегчают проникновение в клетки-мишени. Положительно заряженные комплексы связываются со специфическими рецепторами (при наличии на их поверхности макромолекул, обладающих свойствами специфического лиганда) или непосредственно с поверхностью клетки. Комплексы проникают в клетку по механизму эндоцитоза. После высвобождения из эндосомы и разборки комплекса нуклеиновая кислота проникает через поры в ядро клетки [20].
Таблица 4. Невирусные векторы для генной терапии
Невирусные системы на основе катионных липидов или полимеров имеют ряд преимуществ перед вирусными системами доставки: большой объем несущей ДНК, отсутствие какой-либо вирусной составляющей, а следовательно, низкая иммуногенность, высокая технологичность производства. Однако низкая трансфицирующая способность невирусных векторов и недостаток информации о безопасности у человека тормозят развитие исследований в этом направлении, только 5,2% приходится на клинические испытания, где в качестве системы доставки терапевтических генов используют липоплексы или полиплексы.
Однако низкая трансфицирующая способность невирусных векторов и недостаток информации о безопасности у человека тормозят развитие исследований в этом направлении, только 5,2% приходится на клинические испытания, где в качестве системы доставки терапевтических генов используют липоплексы или полиплексы.
К настоящему моменту сформировалось два типа геннотерапевтического воздействия: индивидуализированный подход ex vivo — трансфекция стволовых гемопоэтических клеток, полученных из периферической крови и трансплантированных затем больному, и in vivo — трансфекция клеток внутри организма, куда генетический материал в составе вектора доставляется в результате внутривенной или внутриартериальной (в печеночную артерию) инфузии, внутримышечного, подкожного, интратуморального, интраназального или сублингвального введения. В практике лечения сердечно-сосудистых заболеваний испытываются прямые игольные инъекции конструкций в миокард, введение вирусных векторов при помощи разнообразных катетеров, использование стентов с покрытиями, обеспечивающими дозированный выход лекарственного средства. В онкологии используют, как правило, внутриопухолевое введение целевого гена в составе различных векторов.
В онкологии используют, как правило, внутриопухолевое введение целевого гена в составе различных векторов.
На долю заболеваний, для которых разрабатываются методы генной терапии, большая часть приходится на злокачественные новообразования. Злокачественная трансформация клетки происходит в результате накопления генетических дефектов, приводящих к их аномальному росту, непосредственной причиной которых является дисбаланс в пролиферации и гибели клеток. Поэтому разработка способов коррекции этих дефектов является основой генной терапии злокачественных новообразований. Подходы к генной терапии рака включают в себя три основные стратегии: введение нормального гена в опухолевые клетки для замены «мутантного» гена, генетическую модификацию, преследующую цель заглушить «мутантный» ген, и генетические подходы, направленные на запуск гибели опухолевых клеток (табл. 5).
Таблица 5. Подходы к генной терапии онкологических заболеваний
Представления о патогенезе злокачественных новообразований, в основе которого, в том числе, лежат активация онкогенов и инактивация генов-супрессоров опухолевого роста, позволяют искать пути подавления или восстановления функции этих генов.
К настоящему моменту известно более 24 генов-супрессоров, среди них наиболее изученным является ген р53, контролирующий клеточный цикл и поврежденный в ≈50% опухолей человека [21]. Так, коррекционная замена мутантного гена p53 в опухолевых клетках геном дикого типа (не содержащим мутаций) с помощью методов генотерапии приводила к восстановлению функций белка p53 и инициации процессов, запускающих программированную гибель злокачественных клеток. Клинические испытания аденовирусного вектора Ad-p53 показали, что восстановление дикого типа р53 путем доставки гена при помощи дефектного по репликации Ad приводило к значительному противоопухолевому эффекту на фоне низкой общей токсичности [22]. Более того, восстановление р53 сопровождалось увеличением чувствительности опухолевых клеток к химио- и радиотерапии [23].
Технология «молчащих» генов — одна из новейших технологий в генотерапии рака, направлена на сайленсинг (silence — молчание) генов, отвечающих за рост и/или деление раковых клеток, так называемых онкогенов. «Заглушить» гены можно за счет адресной доставки малых интерферирующих двухцепочечных РНК (siRNA), которые блокируют экспрессию гена в результате гомологичной рекомбинации (РНК-интерференция) [24, 25]. Также малые РНК, образующие «шпильки» во вторичной структуре (shRNA), могут быть использованы для подавления экспрессии генов путем РНК-интерференции.
«Заглушить» гены можно за счет адресной доставки малых интерферирующих двухцепочечных РНК (siRNA), которые блокируют экспрессию гена в результате гомологичной рекомбинации (РНК-интерференция) [24, 25]. Также малые РНК, образующие «шпильки» во вторичной структуре (shRNA), могут быть использованы для подавления экспрессии генов путем РНК-интерференции.
Направленная доставка siRNA была апробирована в клинических испытаниях: CALAA-01 («Calando Pharmaceuticals») для пациентов с меланомой [26] и ALN-VSPOI («Alnylam Pharmaceuticals») для лечения рака печени и других солидных опухолей [27]. Предварительные результаты исследования CALAA-01 и ALN-VSPOI показали безопасность и хорошую переносимость siRNA, что является подтверждением целесообразности продолжения испытаний для продвижения данного подхода к лечению заболеваний онкологического профиля.
Одним из активно развивающихся направлений генной терапии рака является энзиматическая терапия (Gene-Directed Enzyme Prodrug Therapy, GDEPT), основанная на запуске гибели опухолевых клеток за счет придания им способности превращать вводимый в организм препарат-предшественник в токсичный метаболит. Это достигается введением «суицидных» генов, кодирующих фермент вирусного или бактериального происхождения, который в клетках, где он экспрессируется, конвертирует свой субстрат, превращая его из нетоксичного пролекарства в токсичный для клетки метаболит [28]. Наиболее изученными системами «суицидный» ген/пролекарство являются: ген тимидинкиназы вируса простого герпеса (HSVtk)/ганцикловир, ген цитозиндезаминазы (CD)/5-фторцитозин, цитохром P450 (p450)/циклофосфамид и другие [29]. Основная проблема, препятствующая применению этой стратегии в клинической практике, — довольно низкая эффективность доставки терапевтических генов. Несмотря на это, число проведенных клинических испытаний GDEPT растет с каждым годом [1]. Среди препаратов, предназначенных для GDEPT, можно выделить Sitimagene ceradenovec (Cerepro, «Ark Therapeutics Group Plc», Великобритания и Финляндия) на основе аденовирусного вектора со встроенным «суицидным» геном HSVtk. Этот препарат прошел I/II фазы клинических испытаний (глиома), в которых показана безопасность внутриопухолевой доставки вирусной тимидинкиназы в глиальные клетки, при этом отмечена стабилизации процесса у пациентов [30, 31].
Это достигается введением «суицидных» генов, кодирующих фермент вирусного или бактериального происхождения, который в клетках, где он экспрессируется, конвертирует свой субстрат, превращая его из нетоксичного пролекарства в токсичный для клетки метаболит [28]. Наиболее изученными системами «суицидный» ген/пролекарство являются: ген тимидинкиназы вируса простого герпеса (HSVtk)/ганцикловир, ген цитозиндезаминазы (CD)/5-фторцитозин, цитохром P450 (p450)/циклофосфамид и другие [29]. Основная проблема, препятствующая применению этой стратегии в клинической практике, — довольно низкая эффективность доставки терапевтических генов. Несмотря на это, число проведенных клинических испытаний GDEPT растет с каждым годом [1]. Среди препаратов, предназначенных для GDEPT, можно выделить Sitimagene ceradenovec (Cerepro, «Ark Therapeutics Group Plc», Великобритания и Финляндия) на основе аденовирусного вектора со встроенным «суицидным» геном HSVtk. Этот препарат прошел I/II фазы клинических испытаний (глиома), в которых показана безопасность внутриопухолевой доставки вирусной тимидинкиназы в глиальные клетки, при этом отмечена стабилизации процесса у пациентов [30, 31].
Генная терапия рака, направленная на разрушение опухолевых клеток, возможна с использованием вирусов, которые с помощью специальных генетических манипуляций становятся онколитическими, т. е. селективно воздействуют только на опухолевые клетки, вызывают лизис инфицированных клеток и последующую трансдукцию окружающих опухолевых клеток, что в несколько раз увеличивает их терапевтический индекс. Существуют две основные стратегии получения онколитических вирусов: путем делеции (мутации) основных вирусных генов, функции которых могут быть восполнены только в опухолевых, но не в нормальных клетках (делеционные мутанты), и путем регуляции экспрессии основных вирусных генов за счет помещения их под ткане- или опухолеспецифичные транскрипционные регуляторные элементы (транскрипционная регуляция). Препараты на основе онколитических вирусов разрабатывают с использованием РНК- и ДНК-содержащих вирусов, таких как аденовирус, реовирус, вирус простого герпеса, поксвирус. Так, клинические испытания онколитических вирусов ONYX-015 и Н101 на основе мутантных аденовирусов с делецией в гене Е1В и с делецией в генах Е1В и Е3 соответственно, которые селективно реплицируются в опухолевых клетках с дефектным р53, показали безопасность и эффективность при интратуморальном введении в терапии ряда опухолей [32, 33]. В настоящее время проходят клинические испытания препарата REOLYSIN («Oncolitic Biotech. Inc.», Канада), полученного на основе штамма Т3D реовируса человека. В этих исследованиях показана низкая токсичность при внутриопухолевом и внутривенном его введении в режиме монотерапии, а в сочетании с противоопухолевыми препаратами, такими как гемцитабин для рака поджелудочной железы и легкого, доцетаксел для рака мочевого пузыря, предстательной железы и легкого, паклитаксел с карбоплатином для меланомы, рака легкого и яичников, показана высокая противоопухолевая эффективность [34].
В настоящее время проходят клинические испытания препарата REOLYSIN («Oncolitic Biotech. Inc.», Канада), полученного на основе штамма Т3D реовируса человека. В этих исследованиях показана низкая токсичность при внутриопухолевом и внутривенном его введении в режиме монотерапии, а в сочетании с противоопухолевыми препаратами, такими как гемцитабин для рака поджелудочной железы и легкого, доцетаксел для рака мочевого пузыря, предстательной железы и легкого, паклитаксел с карбоплатином для меланомы, рака легкого и яичников, показана высокая противоопухолевая эффективность [34].
Наиболее успешным онколитическим препаратом является OncoVexGMCSF на основе вируса простого герпеса, который проходит II/III фазы клинических испытаний для лечения меланомы, рака молочной железы, опухолей головы и шеи. В геноме этого вируса сохранен ген тимидинкиназы для проведения GDEPT, но удалены обе копии ICP34.5 гена, отвечающего за вирусную репликацию в нормальных клетках, а в область ICP47 встроен ген GM-CSF. Продуцируемый GM-CSF привлекает дендритные клетки (DC) и может стимулировать выброс цитотоксических Т-лимфоцитов [35].
Продуцируемый GM-CSF привлекает дендритные клетки (DC) и может стимулировать выброс цитотоксических Т-лимфоцитов [35].
Следует отметить, что современная стратегия развития иммунотерапии рака на фоне расширяющихся знаний о функционировании иммунной системы и формировании иммунного ответа является главной предпосылкой для усовершенствования подходов к лечению с привлечением инновационных лекарственных средств, созданных методами генной инженерии, таких как генные вакцины.
Исследования в этой области ведутся в трех направлениях: модификация опухолевых клеток для придания им большей иммуногенности, введение генов опухолеассоциированных антигенов в дендритные клетки, геномодификация лимфоцитов для повышения цитотоксического ответа.
К настоящему моменту разработана «платформа», представляющая собой два рекомбинантных вектора: на основе поксвирусов коровьей оспы (RV) для первичной вакцинации и птичьей оспы (RF) для ревакцинации с тремя костимуляторными молекулами [В7. 1 (CD80), ICAM-1 (CD54) и LFA-3 (CD58), обозначаемыми TRICOM] для повышения иммунного ответа [36—38]. Каждый из этих векторов может содержать трансген для одного или нескольких опухолевых антигенов, например, таких как гены, кодирующие простатспецифический антиген (PSA), раково-эмбриональный антиген (СЕА), мембранно-связанный муцин (MUC-1) и другие. Разработаны вакцины PROSTVAC (RV-, RF-PSA-TRICOM) для иммунотерапии рака предстательной железы [39, 40] и PANVAC (RV-, RF-СЕА-MUC1-TRICOM) для иммунотерапии рака молочной железы, прямой кишки, яичников. Полученные на сегодняшний день результаты применения вакцин выглядят обнадеживающими в плане их переносимости. Однако в плане эффективности наблюдается лишь непродолжительная стабилизация процесса. Несмотря на это, синергизм иммунотерапии и химиотерапии, полученный в ряде клинических испытаний, является подтверждением целесообразности применения вакцин в сочетании с другими методами лечения [41].
1 (CD80), ICAM-1 (CD54) и LFA-3 (CD58), обозначаемыми TRICOM] для повышения иммунного ответа [36—38]. Каждый из этих векторов может содержать трансген для одного или нескольких опухолевых антигенов, например, таких как гены, кодирующие простатспецифический антиген (PSA), раково-эмбриональный антиген (СЕА), мембранно-связанный муцин (MUC-1) и другие. Разработаны вакцины PROSTVAC (RV-, RF-PSA-TRICOM) для иммунотерапии рака предстательной железы [39, 40] и PANVAC (RV-, RF-СЕА-MUC1-TRICOM) для иммунотерапии рака молочной железы, прямой кишки, яичников. Полученные на сегодняшний день результаты применения вакцин выглядят обнадеживающими в плане их переносимости. Однако в плане эффективности наблюдается лишь непродолжительная стабилизация процесса. Несмотря на это, синергизм иммунотерапии и химиотерапии, полученный в ряде клинических испытаний, является подтверждением целесообразности применения вакцин в сочетании с другими методами лечения [41].
Метод, известный как технология химерных антигенных рецепторов, или CAR-технология (от англ. chimeric antigen receptor), в настоящее время является одним из наиболее перспективных и быстро развивающихся направлений в области иммунотерапии злокачественных новообразований [42]. Эта технология заключается в выделении из периферической крови пациента Т-лимфоцитов и их двухкомпонентной модификации в условиях ex vivo: присоединение к их поверхности рецептора, распознающего экспрессируемый большинством лейкемических клеток белок CD19, и введение мощного внутриклеточного механизма, запускающего активный рост и деление клеток в ответ на их взаимодействие с белком-мишенью. Такие генномодифицированные Т-лимфоциты возвращают в кровоток пациента. Предварительные результаты исследований свидетельствуют о том, что этот подход позволяет получить хорошие результаты у 2/3 пациентов, не ответивших на традиционные методы лечения [43—45].
chimeric antigen receptor), в настоящее время является одним из наиболее перспективных и быстро развивающихся направлений в области иммунотерапии злокачественных новообразований [42]. Эта технология заключается в выделении из периферической крови пациента Т-лимфоцитов и их двухкомпонентной модификации в условиях ex vivo: присоединение к их поверхности рецептора, распознающего экспрессируемый большинством лейкемических клеток белок CD19, и введение мощного внутриклеточного механизма, запускающего активный рост и деление клеток в ответ на их взаимодействие с белком-мишенью. Такие генномодифицированные Т-лимфоциты возвращают в кровоток пациента. Предварительные результаты исследований свидетельствуют о том, что этот подход позволяет получить хорошие результаты у 2/3 пациентов, не ответивших на традиционные методы лечения [43—45].
Микроокружение опухоли играет важную роль в прогрессии и метастазировании. Оно включает в себя строму с фибробластами и эндотелиальными клетками сосудов. Вмешательство в эту микросреду также может привести к регрессии опухоли. Наиболее важной «точкой приложения» является ангиогенез. В условиях опухолевого роста активируется выброс проангиогенных цитокинов, таких как сосудистый эндотелиальный фактор роста (VЕGF) и фактор роста фибробластов (FGF). Эти факторы стимулируют рост микрососудов вокруг опухоли с последующей прогрессией и метастазированием. Альтернативой терапии рекомбинантным (гуманизированным) моноклональным антителом бевацизумаб, которое селективно связывает и ингибирует активность VEGF, может стать генная терапия. Предварительные результаты клинических испытаний показали, что доставка антиангиогенных генов, кодирующих белки ангиостатин и эндостатин с помощью аденоассоциированного вектора, вызывает регрессию опухоли с минимальными побочными эффектами [15].
Вмешательство в эту микросреду также может привести к регрессии опухоли. Наиболее важной «точкой приложения» является ангиогенез. В условиях опухолевого роста активируется выброс проангиогенных цитокинов, таких как сосудистый эндотелиальный фактор роста (VЕGF) и фактор роста фибробластов (FGF). Эти факторы стимулируют рост микрососудов вокруг опухоли с последующей прогрессией и метастазированием. Альтернативой терапии рекомбинантным (гуманизированным) моноклональным антителом бевацизумаб, которое селективно связывает и ингибирует активность VEGF, может стать генная терапия. Предварительные результаты клинических испытаний показали, что доставка антиангиогенных генов, кодирующих белки ангиостатин и эндостатин с помощью аденоассоциированного вектора, вызывает регрессию опухоли с минимальными побочными эффектами [15].
Таким образом, генная терапия достигла определенных успехов: разработаны подходы, сконструировано более 2 тыс. препаратов, прошедших доклинические исследования, проведены клинические испытания в ряде областей медицины. К настоящему моменту в мире уже зарегистрировано четыре препарата для генной терапии (табл. 6). Гендицин (Shenzhen SiBiono GenTech) и Oncorine (h201) (Sunway Biotech Co) — это первые генно-терапевтические препараты, допущенные к клиническому применению в Китае в 2003 и 2005 г. соответственно, для лечения плоскоклеточного рака головы и шеи [46]. Препарат Glybera (uniQurо), созданный на основе аденоассоциированного вектора, в геном которого встроен вариант гена липопротеиназы LPLs447x для лечения моногенного заболевания — дефицита липопротеиназы, вызванного мутацией в гене, кодирующем выработку этого фермента, допущенный к применению в 2012 г. Европейским агентством по оценке лекарственных препаратов (EMA) [47]. Препарат неоваскулген, представляющий собой высокоочищенную сверхскрученную плазмиду с геном VEGF165, кодирующий эндотелиальный фактор роста сосудов под контролем цитомегаловирусного промотора, предназначен для лечения пациентов с ишемией нижних конечностей атеросклеротического генеза и зарегистрирован в России в 2011 г.
К настоящему моменту в мире уже зарегистрировано четыре препарата для генной терапии (табл. 6). Гендицин (Shenzhen SiBiono GenTech) и Oncorine (h201) (Sunway Biotech Co) — это первые генно-терапевтические препараты, допущенные к клиническому применению в Китае в 2003 и 2005 г. соответственно, для лечения плоскоклеточного рака головы и шеи [46]. Препарат Glybera (uniQurо), созданный на основе аденоассоциированного вектора, в геном которого встроен вариант гена липопротеиназы LPLs447x для лечения моногенного заболевания — дефицита липопротеиназы, вызванного мутацией в гене, кодирующем выработку этого фермента, допущенный к применению в 2012 г. Европейским агентством по оценке лекарственных препаратов (EMA) [47]. Препарат неоваскулген, представляющий собой высокоочищенную сверхскрученную плазмиду с геном VEGF165, кодирующий эндотелиальный фактор роста сосудов под контролем цитомегаловирусного промотора, предназначен для лечения пациентов с ишемией нижних конечностей атеросклеротического генеза и зарегистрирован в России в 2011 г. [48].
[48].
Таблица 6. Официнальные препараты для генной терапии различных заболеваний
В настоящий момент в России, так же как и за рубежом, продолжается развитие этого метода. Так, во II фазе клинических испытаний находятся цельноклеточные генномодифицированные вакцины аллоген (из клеточной линии меланомы человека mel P/tag7) и мелавак (из клеточной линии меланомы mel Ког/GM-CSF), показавшие безопасность и эффективность при лечении меланомы [49]. На стадии клинических испытаний находится препарат канцеролизин, разработанный на основе аденовируса 5-го типа, у которого был полностью делетирован ген белка Е1 В по аналогии с известным штаммом ONYX-015 (ФГУН ГНЦ «Вектор», Россия) [50]. I фазу клинических испытаний проходит препарат АдеЛакт («НТфарма», Россия), представляющий собой рекомбинантные псевдоаденовирусные частицы, несущие ген лактоферрина человека (hLf). Этот препарат, предназначенный для терапии токсикозов различного генеза III и IV степени, проходил доклинические испытания в Московском научно-исследовательском онкологическом институте им. П.А. Герцена — филиале ФГБУ «НМИРЦ» Минздрава России [51]. На этой же базе идут доклинические испытания АнтионкоРАН-М — препарата для противоопухолевой «суицидной» терапии на основе рекомбинантной ДНК, кодирующей гены тимидинкиназы вируса простого герпеса (HSVtk) и колониестимулирующего фактора (GM-CSF) с невирусной системой доставки, разработанного в результате совместных исследований, проведенных в ФГБУН ИМГ РАН, ФГБУН ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и МГУ им. М.В. Ломоносова [52].
П.А. Герцена — филиале ФГБУ «НМИРЦ» Минздрава России [51]. На этой же базе идут доклинические испытания АнтионкоРАН-М — препарата для противоопухолевой «суицидной» терапии на основе рекомбинантной ДНК, кодирующей гены тимидинкиназы вируса простого герпеса (HSVtk) и колониестимулирующего фактора (GM-CSF) с невирусной системой доставки, разработанного в результате совместных исследований, проведенных в ФГБУН ИМГ РАН, ФГБУН ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и МГУ им. М.В. Ломоносова [52].
Таким образом, использование метода генной терапии может быть результатом уже не столь отдаленного будущего, но говорить о реальных перспективах этого направления в медицине, по-видимому, пока преждевременно. Несмотря на то, что большинство клинических испытаний свидетельствует об относительной безопасности геннотерапевтических препаратов, требуется время для окончательного доказательства их эффективности. Возможно, в будущем метод генной терапии станет основным в лечении наследственных заболеваний, а для заболеваний онкологического профиля генная терапия будет рассматриваться как часть комплексного противоопухолевого лечения.
Конфликт интересов отсутствует.
ACD A: Вкладыш в упаковку / Информация о назначении
Вкладыш в упаковку / этикетка продукта
Общее название: моногидрат лимонной кислоты, моногидрат декстрозы и дигидрат тринатрия цитрата
Лекарственная форма: инъекция, раствор
На этой странице
- Показания и применение 9001
- Способ применения и дозы
- Лекарственные формы и дозы
- Противопоказания
- Предупреждения и меры предосторожности
- Побочные реакции/побочные эффекты
- Использование у определенных групп населения
- Описание
- Клиническая фармакология
- Способ поставки/хранение и обращение
Показания и применение для ACD A
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТНЫЙ ДЕКСТРОЗНЫЙ РАСТВОР USP (ACD) РАСТВОР A представляет собой антикоагулянт для сбора крови и предназначен для использования только с устройствами для афереза. [См. Дозировка и способ применения (2).]
[См. Дозировка и способ применения (2).]
ACD A Дозировка и способ применения
Общая информация о дозировании
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТНЫЙ ДЕКСТРОЗНЫЙ РЕШЕНИЕ USP (ACD) РЕШЕНИЕ A добавляется в наборы трубок во время процедур афереза. Раствор подключают к набору трубок в сборе для афереза. Рекомендуемая доза определяется устройством для афереза и дозируется в трубку, установленную устройством для афереза. Он не предназначен для прямого внутривенного введения.
Инструкции по использованию раствора с устройством для афереза и набором трубок см. в руководстве по эксплуатации устройства.
Администрация
- Убедитесь, что раствор является антикоагулянтным раствором цитрата декстрозы USP (ACD) РЕШЕНИЕ А и имеет срок годности.
- Осмотрите сумку. Не используйте, если контейнер поврежден, протекает или если есть какие-либо видимые признаки порчи.
- Используйте, только если раствор прозрачен и не содержит твердых частиц.

- Защита от острых предметов.
Инструкции по подсоединению АНТИКОАГУЛЯНТНОГО РЕШЕНИЯ ЦИТРАТА ДЕКСТРОЗЫ РЕШЕНИЕ USP (ACD) Пакет к устройству для афереза.
При появлении запроса на подсоединение антикоагулянта к набору трубок устройства для афереза:
- Снимите внешнюю обертку, потянув вниз за паз, и извлеките антикоагулянтный раствор цитрата декстрозы USP (ACD) РЕШЕНИЕ A пакет.
- Перед использованием выполните следующие проверки [См. Предупреждения и меры предосторожности (5).]:
- Проверьте герметичность, слегка сжав пакет. При обнаружении утечек выбросьте мешок.
- Убедитесь, что раствор является АНТИКОАГУЛЯНТНЫМ РЕШЕНИЕМ ЦИТРАТА ДЕКСТРОЗЫ USP (ACD) РЕШЕНИЕ А и имеет срок годности.
- Осмотрите раствор при достаточном освещении. Не следует использовать пакеты с мутностью, дымкой или твердыми частицами.
- Снимите защитный колпачок с порта на пакете.
- Подсоедините пакет к набору трубок устройства для афереза, используя асептическую технику, и повесьте раствор.

- Сломайте хрупкий разъем. Когда вы ломаете хрупкие разъемы, согните их в обоих направлениях, чтобы убедиться, что вы сломали их полностью. Невыполнение этого требования может привести к ограничению потока.
- Действуйте в соответствии с руководством по эксплуатации устройства для афереза.
Лекарственные препараты для парентерального введения следует осматривать визуально на наличие твердых частиц и изменение цвета перед введением, если это позволяют раствор и контейнер.
Лекарственные формы и дозы
500 мл или 750 мл АНТИКОАГУЛЯНТНЫЙ ЦИТРАТНЫЙ РАСТВОР ДЕКСТРОЗЫ USP (ACD) РАСТВОР A представляет собой стерильный раствор в полиолефиновом пакете. Каждые 100 мл содержат: (% массы/объема) лимонной кислоты моногидрат 0,8 г; Моногидрат декстрозы 2,45 г; Дигидрат цитрата натрия 2,2 г; и вода для инъекций.
Противопоказания
ЗАПРЕЩАЕТСЯ ВЛИВАТЬ АНТИКОАГУЛЯНТНЫЙ РЕШЕНИЕ ЦИТРАТА ДЕКСТРОЗЫ USP (ACD) НАПРЯМУЮ ПАЦИЕНТАМ.
Предупреждения и меры предосторожности
- Убедитесь, что антикоагулянтный раствор цитрата декстрозы USP (ACD) SOLUTION A надежно присоединен к линии антикоагулянта (AC) на наборе системных трубок.
 Используйте асептическую технику на протяжении всех процедур для обеспечения безопасности и качества доноров.
Используйте асептическую технику на протяжении всех процедур для обеспечения безопасности и качества доноров. - Не использовать повторно. Выбросьте неиспользованные или частично использованные пакеты с раствором.
Побочные реакции
Цитратные реакции или токсичность могут возникать при вливании и возврате крови, содержащей цитратный антикоагулянт. Реципиента крови, содержащей цитрат, следует контролировать на наличие признаков и симптомов отравления цитратом. Признаки и симптомы отравления цитратами начинаются с парестезий, ощущения «покалывания» вокруг рта или в конечностях, за которыми следуют тяжелые реакции, характеризующиеся гипотензией и возможной сердечной аритмией. Токсичность цитрата может чаще возникать у пациентов с гипотермией, нарушением функции печени или почек или низким уровнем кальция из-за основного заболевания.
ИСПОЛЬЗОВАНИЕ В КОНКРЕТНЫХ НАСЕЛЕНИЯХ
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТ ДЕКСТРОЗА РЕШЕНИЕ USP (ACD) РЕШЕНИЕ A не было адекватно изучено в контролируемых клинических испытаниях с конкретными группами населения.
ACD A Описание
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТНЫЙ ДЕКСТРОЗНЫЙ РАСТВОР USP (ACD) РАСТВОР A предназначен для измерения с помощью устройства для афереза в процедурах афереза, чтобы предотвратить активацию тромбоцитов и коагуляцию, когда кровь движется через экстракорпоральное устройство (набор трубок) при аферезе. процедура.
Раствор стерилен и апирогенен, не содержит бактериостатических и антимикробных агентов.
Формулы активных ингредиентов представлены в таблице 1.
| Ингредиенты | Молекулярная формула | Молекулярный вес |
|---|---|---|
| (% мас./об.) Лимонная кислота, моногидрат | К6Н8О7 | 192.12 |
| Моногидрат декстрозы | C6h22O6 ∙ h3O | 198,17 |
| Дигидрат цитрата натрия | C6H9Na3O9 | 294.10 |
| Вода для инъекций | х3О | 18. 00 00 |
Каждые 100 мл антикоагулянтного раствора цитрата декстрозы USP (ACD) РЕШЕНИЕ A содержат: (% мас./об.) лимонной кислоты моногидрат 0,8 г; Моногидрат декстрозы 2,45 г; Дигидрат цитрата натрия 2,2 г; и вода для инъекций.
Мешок из полиолефина не изготовлен из натурального каучукового латекса или ПВХ.
Сумка изготовлена из многослойной пленки. Он содержит материалы, которые были протестированы, чтобы продемонстрировать пригодность контейнера для хранения фармацевтических растворов. Контактирующий с раствором слой представляет собой эластичный полиолефин. Мешок нетоксичен и биологически инертен. Пакет с раствором представляет собой закрытую систему и не зависит от поступления внешнего воздуха во время введения. Пакет обертывается для обеспечения защиты от физической среды и, при необходимости, для дополнительной защиты от влаги.
ACD A – клиническая фармакология
Механизм действия
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТ ДЕКСТРОЗЫ РЕШЕНИЕ USP (ACD) РЕШЕНИЕ A действует как экстракорпоральный антикоагулянт, связывая свободный кальций в крови. Кальций является необходимым кофактором на нескольких этапах каскада свертывания крови. Следующие ингредиенты являются ключевыми компонентами раствора:
Кальций является необходимым кофактором на нескольких этапах каскада свертывания крови. Следующие ингредиенты являются ключевыми компонентами раствора:
- Лимонная кислота для регулирования pH
- Антикоагулянты цитрата натрия
- Декстроза для изотоничности
Этот раствор не имеет фармакологического действия.
Способ поставки/хранение и обращение
АНТИКОАГУЛЯНТНЫЙ ЦИТРАТНЫЙ ДЕКСТРОЗНЫЙ РАСТВОР USP (ACD) РАСТВОР A представляет собой прозрачный раствор, поставляемый в стерильных и апирогенных полиолефиновых пакетах. Пакеты по 750 мл расфасованы по 12 пакетиков в коробке. Пакеты по 500 мл расфасованы по 18 пакетов в коробке.
| РАЗМЕР | НОМЕР ПО КАТАЛОГУ | НОМЕР НДЦ |
|---|---|---|
| 500 мл | 40815 | 14537-815-50 |
| 750 мл | 40817 | 14537-817-75 |
ХРАНЕНИЕ
Хранить при температуре до 25 °C [см. USP контролируемая комнатная температура].
USP контролируемая комнатная температура].
Избегайте перегрева. Беречь от замерзания.
Выпущено: (август 2017 г.)
Изготовлено
Terumo BCT, Inc.
Lakewood, CO 80215
ОСНОВНАЯ ПАНЕЛЬ ДИСПЛЕЯ — 750 мл Этикетка пакета
Антикоагулянт Цитрат Декстроза
Раствор USP (ACD) Раствор A
№ по каталогу 40817
Полиолефиновый пакет
750 мл
NDC 14537-817-75
Стерильный. Апирогенный. Стерилизован паром.
Не используйте, если раствор не прозрачен и контейнер
не поврежден.
Только прием.
Одноразовый контейнер.
Прочтите листок-вкладыш перед применением.
Только для использования с устройствами для афереза. Полные инструкции см. в руководстве по эксплуатации устройства для афереза
.
Предупреждение: Не для прямого внутривенного вливания.
Рекомендуемое хранение:
Хранить при температуре до 25 °C. (См. USP температура контролируемой комнаты
).
Избегайте перегрева.
Беречь от замерзания.
Каждые 100 мл содержат:
Моногидрат декстрозы USP
2,45 г
Дигидрат цитрата натрия USP
2,20 г
Моногидрат лимонной кислоты USP
0,80 г
В воде для инъекций USP
10811 У. Коллинз Авеню, Лейквуд, штат Колорадо, 80215, США
777967-057
TERUMOBCT
Лот
Срок годности
ОСНОВНАЯ ПАНЕЛЬ ДИСПЛЕЙ — Этикетка пакета 500 мл 5
Полиолефиновый пакет
500 мл
NDC 14537-815-50
Стерильный. Апирогенный. Стерилизован паром.
Не используйте, если раствор не прозрачен и контейнер
не поврежден.
Только прием.
Одноразовый контейнер.
Прочтите листок-вкладыш перед применением.
Только для использования с устройствами для афереза. Полные инструкции см. в руководстве по эксплуатации устройства для афереза
.
Внимание! Не для прямого внутривенного введения.
Рекомендуемое хранение:
Хранить при температуре до 25 °C.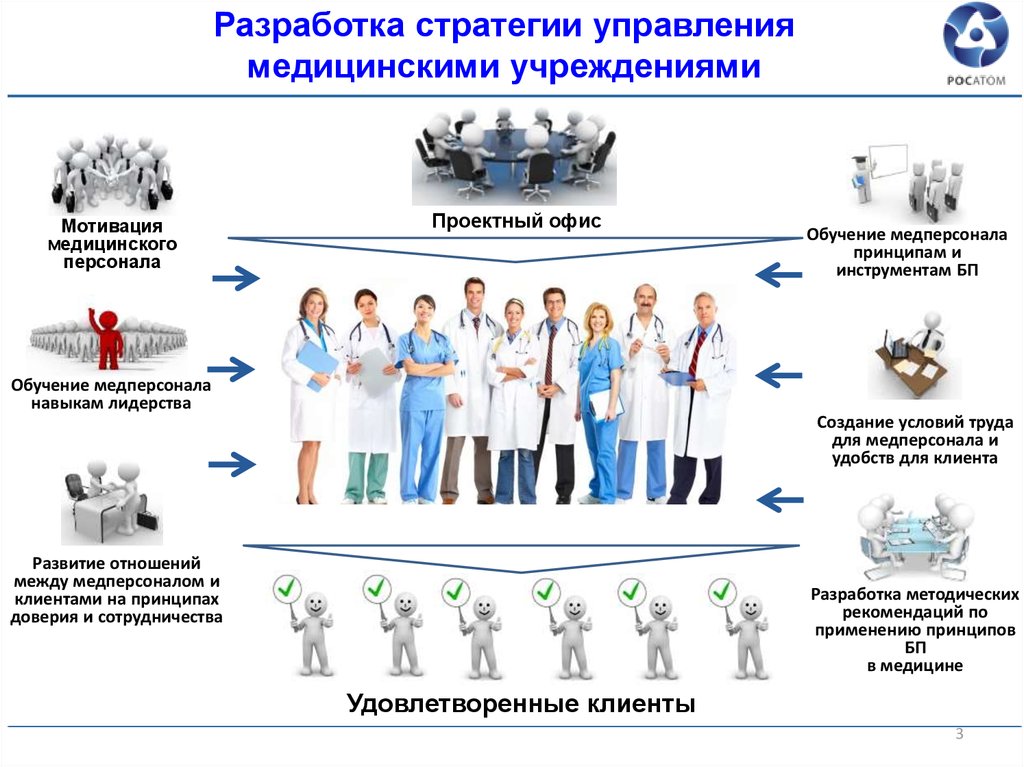 (См. USP температура контролируемой комнаты
(См. USP температура контролируемой комнаты
).
Избегайте перегрева.
Беречь от замерзания.
Каждые 100 мл содержат:
Моногидрат декстрозы USP
2,45 г
Дигидрат цитрата натрия USP
2,20 г
Моногидрат лимонной кислоты USP
0,80 г
В воде для инъекций USP
Изготовлено Terumo BCT, Inc. 0011
Лот
Срок годности
| ACD A моногидрат лимонной кислоты, моногидрат декстрозы и дигидрат цитрата натрия, раствор для инъекций | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| ACD A моногидрат лимонной кислоты, моногидрат декстрозы и дигидрат тринатрия цитрата, раствор для инъекций | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Этикетировщик — Terumo BCT, Ltd. (233649834) |
| Учреждение | |||
| Имя | Адрес | ID/FEI | Операции |
| Терумо БСТ, ООО | 233649834 | ПРОИЗВОДСТВО(14537-817, 14537-815), СТЕРИЛИЗАЦИЯ(14537-817, 14537-815), АНАЛИЗ(14537-817, 14537-815), ЭТИКЕТКА(14537-817, 14537-815) | |
Terumo BCT, Ltd.
Медицинский отказ от ответственности
Хроническая анемия (ACD) – Библиотека медицинской информации
- Красные кровяные клетки
Основы заболеваний
Что такое анемия хронического заболевания?
Наличие анемии означает, что у вас недостаточно эритроцитов. Ваше тело нуждается в этих клетках, чтобы переносить кислород из легких в остальные части тела. Иногда длительное заболевание не позволяет вашему организму вырабатывать достаточное количество эритроцитов. Это называется анемией хронического заболевания или ACD.
Ваше тело нуждается в этих клетках, чтобы переносить кислород из легких в остальные части тела. Иногда длительное заболевание не позволяет вашему организму вырабатывать достаточное количество эритроцитов. Это называется анемией хронического заболевания или ACD.
Чем это вызвано?
Анемия хронического заболевания вызывается изменениями в организме, вызванными хроническим заболеванием. Эти изменения могут включать:
- Проблема с использованием железа для производства эритроцитов, даже если в организме достаточно железа.
- Костный мозг, который не может вырабатывать эритроциты должным образом.
- Эритроциты, которые не живут так долго, как должны.
Одной из основных причин анемии хронического заболевания является продолжающееся воспаление вследствие аутоиммунных заболеваний, таких как ревматоидный артрит, волчанка и воспалительное заболевание кишечника. К другим хроническим заболеваниям, которые могут привести к анемии, относятся диабет, рак, инфекции и тяжелые хронические заболевания почек.
К другим хроническим заболеваниям, которые могут привести к анемии, относятся диабет, рак, инфекции и тяжелые хронические заболевания почек.
Каковы симптомы?
Вы можете обнаружить, что анемия хронического заболевания вызывает легкие симптомы или вообще не вызывает никаких симптомов. Если у вас есть симптомы, вы можете чувствовать головокружение, усталость и слабость. Вы также можете почувствовать учащенное сердцебиение или одышку. Может быть трудно сосредоточиться и ясно мыслить.
Как диагностируется?
Анализ крови, который иногда проводится в рамках планового обследования, позволяет врачу узнать, есть ли у вас анемия. Затем ваш врач может провести другие тесты, чтобы найти причину.
Ваш врач может диагностировать у вас анемию хронического заболевания, если:
- У вас есть хроническое заболевание или проблема со здоровьем, которая, как известно, вызывает анемию.

- Ваши симптомы и результаты анализов не указывают на другие виды анемии, такие как пернициозная анемия, гемолитическая анемия или железодефицитная анемия.
Как лечится анемия хронического заболевания?
Анемия хронического заболевания (ACD) чаще всего лечится путем лечения проблемы со здоровьем, вызвавшей ее. Например, лечение ревматоидного артрита может снизить воспаление, что в свою очередь может привести к улучшению АКД.
При ACD, вызванном раком или хроническим заболеванием почек, лекарства могут помочь организму вырабатывать больше эритроцитов. Эти лекарства называются стимуляторами эритропоэтина или ESA.
Тяжелая анемия лечится переливанием эритроцитов независимо от причины.
Принимайте железо только в том случае, если ваш врач говорит вам об этом.


 Используйте асептическую технику на протяжении всех процедур для обеспечения безопасности и качества доноров.
Используйте асептическую технику на протяжении всех процедур для обеспечения безопасности и качества доноров. 02.2002
02.2002 02.2002
02.2002