Биологические функции аминокислот
Выберите разделВ помощь кондитеруКак применятьПолезно знатьРецептуры и технологииРецептыРецепты кондитера
Этот блог не предназначен для предоставления диагностики, лечения или медицинской консультации. Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
В человеческом организме находится около трехсот аминокислот, биологическая роль которых неоценима. Без достаточного уровня данного жизненного материала организм не может эффективно развиваться. Именно поэтому существуют оптимальные суточные нормы употребления аминокислот, которые обеспечивают сбалансированные обменные процессы и заряжают организм дополнительной энергией.
Все существующие аминокислоты подразделяют на три большие группы: заменимые, незаменимые и те, которые можно заместить частично. Первые организм человека способен синтезировать самостоятельно, вторые – нет, поэтому важно обеспечивать их рациональное потребление вместе с пищей.
Биологические функции аминокислот следующие:
- синтез целого комплекса биологически важных веществ в организме человека для его оптимального роста и развития;
- выполнение строительных обязанностей в теле человека, стимуляция его деятельности;
- активизация умственных способностей, координации, поддержка иммунной системы;
- помощь в распаде холестерина, переработка лишних жировых тканей в энергию;
- предотвращение заболеваний почек, печени, органов кишечного и пищеварительного тракта;
- выполнение антидепресантных, гликогенных действий;
- аминокислоты способствуют регенерации тканей, защищают человеческий организм от усталости;
- стимулирование работы мозга, улучшение память, зрение;
- восполнение недостаточное количество глюкозы;
- помощь в развитии мышечных клеток, образовании коллагена, сохраняют молодость организма;
- быстрое заживление ран, порезов и других видов травм.

Таким образом, уникальные биологические функции аминокислот позволяют организму человека расти, развиваться и нормально функционировать на протяжении всей жизни. Обмен веществ, синтезирование белка, пластические их свойства защищают организм от сбоев и нарушений важных химических реакций. Аминокислоты являются главными и первичным строительным материалом. Они незаменимы во всех процессах жизнедеятельности человека.
Чтобы и вы получили такой ошеломительный эффект, покупайте кондитерские ингредиенты по
промокоду BLOG со скидкой в 10%, который распространяется на все заказы до 15 кг! И до встреч в новых статьях!
Урок 12. аминокислоты. белки — Химия — 10 класс
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
Перечень вопросов, рассматриваемых в теме: урок посвящён аминокислотам, их строению, номенклатуре, знакомству с пептидной группой и пептидной связью, химическими свойствами аминокислот, пептидам и полипептидам, знакомству с глицином как представителем аминокислот, биологической роли аминокислот, белкам, их структуре, химическим свойствам.
Глоссарий
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
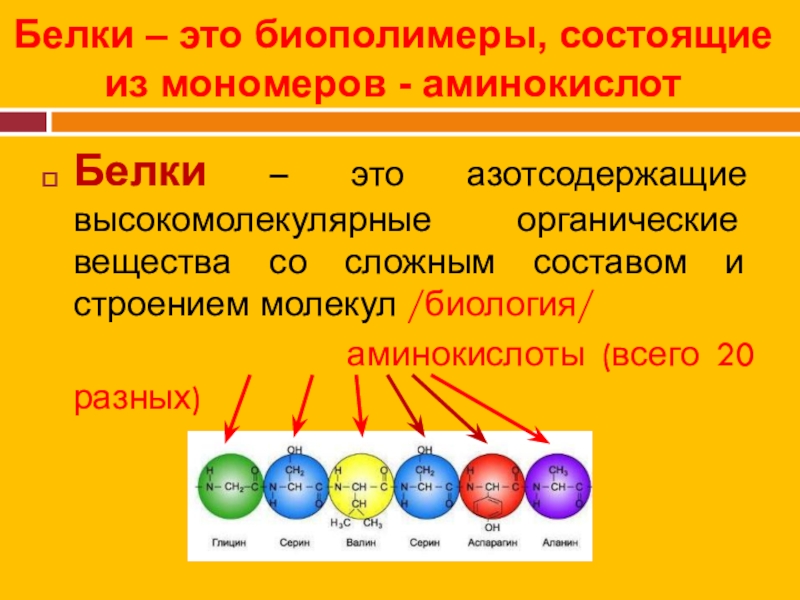
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
Физические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами. В результате реакции образуются сложные эфиры.
Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков

Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
. Ответ запишите с точностью до десятых долей.
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
(28 : 132)·100 = 21,2 %.
Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
Шаг первый: определить количество возможных дипептидов.
Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
Шаг второй: определить количество возможных трипептидов.
Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
Ответ: 3 дипептида и 3 трипептида.
Значения аминокислот — Xr47plus
Биологически активная добавка «XR47PLUS» эффективно борется с естественным старением человека благодаря своему уникальному составу. Она сочетает в себе все необходимое для стимуляции гормона роста в плазме крови.
На этой странице мы детально рассмотрим все компоненты препарата, их преимущества, а также узнаем мнение доктора Томаса Шпюлера о его действии и пользе.
L-Глутамин
Человеческое тело состоит из большого количества белков, которое с течением жизни значительно сокращается. То же самое касается уровня образования гормонов, что приводит к ухудшению выполнения организмом различных функций.
Глутамин – один из важнейших элементов белковой системы, самостоятельно вырабатываемый клетками мышечной ткани. С возрастом люди начинают терять около 3 кг мышечной массы каждое десятилетие, в состав которых входит это вещество.
Глутамин обеспечивает поступление сахара в кровь, помогает выполнять различные функции организма и является основным компонентом коллагена. В основном он играет роль «биологического воина», ведущего борьбу с вредоносными бактериями и непрерывно обезвреживающего их. Редуцированный глутатион способен передавать электроны активным формам кислорода, таким образом совершая процесс деактивации. Также в нем проходит образование цистеина.
Глутатион, как правило, появляется в здоровых клетках и полностью отсутствует в раковых из-за преимущественно кислотной среды. Помимо вышеописанных функций, он является главным источником насыщения клеток кишечника. Их укрепление и предотвращение появления эффекта «дырявого» кишечника (переход содержащихся в нем бактерий в остальную часть организма, боли в животе, воспаления и аллергические реакции) полностью зависит от наличия глутатиона.
Помимо вышеописанных функций, он является главным источником насыщения клеток кишечника. Их укрепление и предотвращение появления эффекта «дырявого» кишечника (переход содержащихся в нем бактерий в остальную часть организма, боли в животе, воспаления и аллергические реакции) полностью зависит от наличия глутатиона.
Благодаря нескольким исследованиям и специальному мета-анализу было доказано, что употребление добавки с незначительным содержанием глутамина способно уменьшить количество повреждений слизистой оболочки и предотвратить их возникновение.
Глицин
Название этого вещества произошло от греческого слова «глико», что переводится как «сладкий». Глицин представляет собой наименьшую аминокислоту и входит в категорию самых ранних белковых компонентов. Миниатюрные размеры помогают ему встраиваться в белок при ограниченных условиях и влиять на его вторичную структуру.
Более 30 % человеческого организма приходится именно на глицин. Он способствует осуществлению многих важных функций мышечных и соединительных тканей, а также играет важную роль в преобразовании трипелхеликса (тройной спиральной структуры коллагена).
Также деятельность глицина имеет большое значение для нервной системы. Он оказывает успокаивающее и стимулирующее воздействие, помогает нормализовать мозговую активность.
L-Аргинин
Название аргинина образовано от греческого слова «аргентум», которое знакомо нам еще со школьных уроков химии и переводится как «серебро». Изначально это вещество было выделено в виде серебряной соли, что полностью оправдывает его имя.
Аргинин относится к так называемым «полузаменимым» аминокислотам, то есть не до конца вырабатываемым организмом. Ее количество следует пополнять приемом извне. В состав аргинина входит наибольшее количество азота в сравнении с другими аминокислотами, участвующих в образовании белков, а потому это вещество играет важную роль в формировании:
мышц;
тканей;
органов.

Он, как и глутамин, имеет большое значение для коллагена, являясь его главным компонентам, укрепляет соединительные ткани. Обе аминокислоты идеально взаимодействуют друг с другом.
Кроме того, монооксид азота, необходимый для нормального кровообращения и деятельности сердца, выделяется именно аргинином. Это вещество представляет собой газ, состоящий из двух атомов и способствующий расширению артерий для улучшения кровотока.
Очередным доказательством его важности являются предсмертные записи Альфреда Нобеля. Ученый упоминал, что химические соединения азота, назначаемые ему докторами, он изучал всю жизнь.
Новейшие исследования, мета-анализы и проверки доказывают активирующее воздействие L-аргинина на здорового человека, а также на страдающих:
атеросклерозом;
эндотелиальной дисфункцией;
повышенным кровяным давлением.
Врачи рекомендуют принимать аргинин с пищей для предотвращения нарушения обмена веществ, которое является причиной заболеваний сердечно-сосудистой системы.
L-Лизин
Еще одной незаменимой пищевой аминокислотой является лизин. В чистом виде он содержится в злаках, но его количества недостаточно для покрытия суточной нормы. Многочисленные проверки показали, что здоровый взрослый человек ежедневно нуждается в 8-45 мг этой аминокислоты на килограмм массы тела.
Поскольку чистый лизин «L-формы» трудно встретить, особенно в период возрастного изменения организма (вещество начинает приобретать «D-форму» и становится бесполезным), весьма целесообразно добавлять его в препарат, способствующий длительному сохранению молодости.
Мнение доктора Томаса Шпюлера, врача-терапевта (терапия внутренних болезней) про биологическую активную добавку XR47Plus. Введение.
Многочисленные исследования и проверки доказали, что центральная роль в обмене веществ человеческого организма отводится гормону роста. Его влияние распространяется на:
Его влияние распространяется на:
соотношение массы и жира;
повышение эластичности кожи;
ускорение роста волос;
аэробную и анаэробную кислородную емкость клеток мышечной ткани.
Также гормон роста отвечает за процессы регенерации в организме. Благодаря его достаточному количеству синяки, ссадины, мелкие раны и царапины заживают гораздо быстрее, чем при его недостатке. Такую же он играет большую роль в поддержании эмоционального равновесия и уровня либидо.
Как правило, человеческий организм перестает вырабатывать гормон роста в возрасте от 25 до 35 лет, поэтому стоит уделить особое внимание его приему в оптимальных количествах во избежание нежелательных эффектов.
Описание препарата
«XR47PLUS» – препарат, включающий в себя L-глутамин, глицин, L-аргинин и L-лизин. Уникальный состав позволяет ему стимулировать гормон роста и противостоять естественному изнашиванию организма.
Добавка изготавливается исключительно из натуральных компонентов, которые можно встретить в продуктах питания. Она не вызывает побочного эффекта благодаря правильно рассчитанным объемам веществ и их нормализированному соотношению.
«XR47PLUS» следует принимать ежедневно за 30 минут до еды. Обязательно на голодный желудок.
Отчет о полученном опыте использования «XR47PLUS»
«Я веду собственную терапевтическую практику в Швейцарии, городе Цюрих. Во время своей деятельности и исключительно в ее рамках я применял препарат «XR47PLUS» для лечения абсолютно разных пациентов. Общим был лишь возраст – я не давал настойку людям младше 25 лет. Также я исключил «XR47PLUS» из списка лекарств, предназначенных для страдающих тяжелыми, острыми заболеваниями.
Назначение препарата имело еще одну цель – регулирование веса. Также он может быть вспомогательным средством для спортсменов-профессионалов, использоваться для поддержания нужного соотношения мышечной и жировой масс. Кроме того, «XR47PLUS» применялся для лечения эректильной дисфункции. На протяжении периода приема добавки побочные эффекты не наблюдались.
Также он может быть вспомогательным средством для спортсменов-профессионалов, использоваться для поддержания нужного соотношения мышечной и жировой масс. Кроме того, «XR47PLUS» применялся для лечения эректильной дисфункции. На протяжении периода приема добавки побочные эффекты не наблюдались.
Вскоре у пациентов наблюдались:
подъем общего самочувствия;
улучшение концентрации;
восстановление стабильности нервной системы;
улучшение сна;
небольшое увеличение мышечной массы;
улучшение состояния кожи;
улучшение эректильной дисфункции.
Подводя итоги, я могу с уверенностью заявить, что «XR47PLUS» – абсолютно безопасный препарат, имеющий широкий спектр применения. Рекомендую его людям, страдающим хронической усталостью и быстрой утомляемостью, принимающим активное участие в спортивных состязаниях и тренировках на выносливость, а также желающим получить полезное средство для поддержания хорошего состояния кожи».
Аминокислоты и их значение в питании
Основными
составными частями и структурными
элементами белковой молекулы являются
аминокислоты. Поступив с пищей, белки
расщепляются до аминокислот, которые
с кровью попадают в клетки и используются
для синтеза белков, специфических для
организма человека. В процессе синтеза
специфических белков имеет значение
не только количество поступивших с
пищей белков, но и соотношение в них
аминокислот. Вследствие того, что белков,
совпадающих по аминокислотному составу
с белками тканей человека в естественных
пищевых продуктах нет, то для синтеза
белков организма следует использовать
разнообразные пищевые белки.
В пищевых продуктах для человека имеют значение 20 аминокислот в L-формах.
В организме человека наблюдается превращение одних аминокислот в другие, которое частично происходит в печени. Однако имеется ряд аминокислот, не образующихся в организме и поступающих только с пищей. Эти аминокислоты называются незаменимыми (эссенциальными) и считаются жизненно необходимыми. К незаменимым аминокислотам относятся триптофан, лизин, метионин, фенилаланин, лейцин, изолейцин, валин, треонин. У детей незаменимой аминокислотой является гистидин, так как он у них не синтезируется до трех лет в необходимом количестве. При отдельных заболеваниях организм человека не способен синтезировать некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин из фенилаланина.
Каждая аминокислота в организме имеет свое значение.
Триптофан необходим для роста организма, поддержания азотистого равновесия, образования белков сыворотки крови, гемоглобина и ниацина (витамина РР).
Лизин участвует в процессах роста, образования скелета, усвоения кальция и т.д.
Метионин участвует в превращении жиров, в синтезе холина, адреналина, активизирует действие некоторых гормонов, витаминов, ферментов и является липотропным веществом, препятствующим жировому перерождению печени
Фенилаланин – участвует в процессе передачи нервных импульсов в составе медиаторов (допамин, норэпифрин).
Лейцин – нормализует сахар крови, стимулирует гормон роста, участвует в процессах восстановления поврежденных тканей костей, кожи, мышц.
Изолейцин – поддерживает азотистый баланс, его отсутствие приводит к отрицательному азотистому балансу.
Валин
– участвует в азотистом обмене, координации
движений и др.
Треонин – участвует в процессах роста, формирования тканей и др.
Биологическая ценность белков пищи
Биологическая ценность — характеризуется содержанием незаменимых аминокислот в пищевых белках, их сбалансированностью и степенью усвоения организмом.
Для полного усвоения белка пищи содержание в нем аминокислот должно быть в определенном соотношении, т.е. быть сбалансированным. Для взрослого человека может быть принята следующая формула сбалансированность незаменимых аминокислот (г/сут): триптофана 1, лейцина 4-6, изолейцина 3-4, валина 3-4, треонина 2-3, лизина 3-5, метионина 2-4, фенилаланина 2-4. Для ориентировочной оценки сбалансированности незаменимых кислот принята упрощенная формула, согласно которой соотношения триптофан : лизин : метионин (вместе с цистином) равно 1:3:3 (г/сут).
В зависимости от биологической ценности различают три группы пищевых белков.
Белки высокой биологической ценности — это белки, содержащие все незаменимые аминокислоты в достаточном количестве, в оптимальной сбалансированности и обладающие легкой перевариваемостью и высокой усвояемостью (более 95%). К ним относятся белки яиц, молочных продуктов, мяса и рыбы.
Белки средней биологической ценности — содержат все незаменимые аминокислоты, но они недостаточно сбалансированы и усваиваются на 70-80%. Так, недостаток лизина — основная причина пониженной ценности белков хлеба. Кукуруза дефицитна по лизину и триптофану, рис — по лизину и треонину. Более полноценен белок картофеля, но количество его в этом продукте невелико — около 2%. Кроме того белки почти всех растительных продуктов трудно перевариваемы, так как они заключены в оболочки из клетчатки, что препятствует действию пищеварительных ферментов, особенно в бобовых, грибах, крупах из цельных зерен.
Неполноценные
белки – в них отсутствует одна или несколько
незаменимых аминокислот, что приводит
к неполному усвоению других аминокислот
и всего белка. К ним относят коллаген,
эластин (содержатся в соединительной,
хрящевой ткани), кератин (волосы, ногти,
шерсть) и др. Так, в эластине и коллагене
отсутствует триптофан и снижено
количество незаменимых аминокислот.
К ним относят коллаген,
эластин (содержатся в соединительной,
хрящевой ткани), кератин (волосы, ногти,
шерсть) и др. Так, в эластине и коллагене
отсутствует триптофан и снижено
количество незаменимых аминокислот.
Наиболее быстро перевариваются в желудочно-кишечном тракте белки молочных продуктов, яиц и рыбы, затем мяса (говядины быстрее, чем свинины и баранины), хлеба и круп (быстрее белки пшеничного хлеба из муки высших сортов и манной крупы). Белки рыбы перевариваются быстрее, чем мяса, так как в рыбе меньше соединительной ткани. Из коллагена получают желатин, который, несмотря на неполноценность, легко усваивается без напряжения секреции пищеварительных желез.
На усвояемость белков влияет технологическая обработка. Так, денатурация белковых молекул, образующаяся при тепловой обработке, взбивании, мариновании улучшает доступ пищеварительных ферментов и улучшает усвоение белков. Чрезмерная тепловая обработка (например, жарка) ухудшает усвояемость белков в результате избыточной денатурации, которая затрудняет ферментативную обработку. Избыточное нагревание отрицательно влияет на аминокислоты. Так, биологическая ценность молочного белка казеина падает на 50% при нагреве до 200оС, При сильном и длительном нагреве продуктов, богатых углеводами, в них уменьшается количество доступного для усвоения лизина. Поэтому рационально предварительное замачивание круп в целях сокращения времени варки. Лучше усваиваются вареное мясо и рыба потому что содержащаяся в них соединительная ткань при варке приобретает желеобразное состояние, белки при этом частично растворяются в воде и легче расщепляются. Измельчение пищевых продуктов облегчает процесс переваривания белков.
Биологическая роль аминокислот | Химия онлайн
Известно около 200 природных аминокислот, но только 20 из них играют важнейшую роль в жизни человека. Эти аминокислоты называют протеиногенными — строящими белки.
Первые аминокислоты были открыты в начале XIX века.
В пищевых продуктах наиболее распространены 22 аминокислоты.
В составе белков найдено 20 различных α-аминокислот (одна из них – пролин, является не амино- , а иминокислотой), поэтому их называют белковыми аминокислотами.
Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты, животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей.
К заменимым относятся аминокислоты, присутствие которых в пище не обязательно для нормального развития организма. В случае их недостаточности они могут синтезироваться из других аминокислот или из небелковых компонентов. Аминокислоты валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан и фенилаланин являются незаменимыми почти для всех видов животных.
Аминокислоты являются наиболее важной составной частью организма. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов.
Они содержатся в ядре, протоплазме и стенках клеток, где выполняют разнообразные функции жизнедеятельности.
Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.
Некоторые аминокислоты служат посредниками при передаче нервных импульсов.
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма.
Главными продуктами разложения аминокислот являются аммиак, мочевина и мочевая кислота. Восполнение потерь аминокислот происходит в основном в результате расщепления белков.
Аминокислоты обеспечивают:— основные метаболические процессы: синтез и утилизация витаминов, липотропное (жиромобилизующее) действие, гликолиз и гликонеогенез;
— процессы детоксикации организма, в том числе при токсикозе беременных; — формирование иммунной системы организма;
— энергетические потребности клеток и, прежде всего, мозга, участвуют в образовании нейромедиаторов, обладают антидепрессантной активностью, улучшают память;
— метаболизм углеводов, участвуют в образовании и накоплении гликогена в мышцах и печени, обеспечивают наращивание мышечной массы, cнижают утомляемость, улучшают работоспособность;
— стимулируют работу гипофиза, увеличивают выработку гормона роста, гормонов щитовидной железы, надпочечников;
— участвуют в образовании коллагена и эластина, способствуют восстановлению кожи и костной ткани, а также заживлению ран;
— принимают участие в кроветворении, и, прежде всего, в выработке гемоглобина.
Интересно знать
Во время беременности повышается потребность женского организма в триптофане и лизине, у грудных детей – в триптофане и изолейцине.
Особенно увеличивается потребность организма в незаменимых аминокислотах после больших потерь крови, ожогов, а также вовремя других процессов, сопровождаемых регенерацией тканей.
Для птиц незаменимой аминокислотой является глицин.
У жвачных животных биосинтез всех незаменимых аминокислот производится микроорганизмами кишечного тракта.
Для человека высокую «биологическую ценность» имеют лишь немногие животные белки, такие, как белок куриного яйца или белок материнского молока. Они содержат незаменимые аминокислоты не только в достаточном количестве, но и в необходимом для человека соотношении.
Низкая ценность многочисленных растительных белков связана с небольшим содержанием в них отдельных незаменимых аминокислот (главным образом лизина и метионина). В белке соевой муки мало метионина, в кукурузе – лизина и триптофана.
В белке соевой муки мало метионина, в кукурузе – лизина и триптофана.
При недостаточном количестве аминокислотных соединений в организме формируется дисбаланс белкового обмена, в результате которого недостающие элементы «извлекаются» из соединительной ткани, мышц, крови и печени.
В первую очередь высвобожденные белки используются для питания мозга и обеспечения работы сердечно-сосудистой системы.
Расходуя собственные аминокислоты и не получая их с пищей, организм начинает слабеть и истощаться, это приводит к сонливости, выпадению волос, анемии, потере аппетита, ухудшению состояния кожи, задержке роста и умственному развитию.
Аминокислоты
Незаменимые аминокислоты. Справка — РИА Новости, 28.02.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей. Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин необходим для синтеза гемоглобина, увеличивает выносливость и способствует восстановлению мышц. К пищевым источникам изолейцина относятся куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Аминокислоты | Сойтэкс
Для нормального роста, развития и обеспечения высокой продуктивности животных аминокислоты должны находиться в рационе в определенном соотношении, поскольку синтез белка в организме происходит только тогда, когда все необходимые аминокислоты поступают в организм одновременно и в нужном количестве. Дефицит незаменимых аминокислот приведет к нарушению синтеза белка. ООО «Сойтэкс» обеспечивает поставку таких аминокислот, как:
Дефицит незаменимых аминокислот приведет к нарушению синтеза белка. ООО «Сойтэкс» обеспечивает поставку таких аминокислот, как:
ЛИЗИН
Лизин – одна из незаменимых аминокислот, применяемых в качестве кормовой добавки в животноводстве и птицеводстве.
Лизин является жизненно необходимым элементом для развития организма животных. Такая аминокислота увеличивает восстанавливающие свойства костных тканей, способствует интенсивному росту молодняка, повышает устойчивость к воздействию вирусных инфекций.
Лизин участвует в синтезе нуклеопротеидов, хромопротеидов (гемоглобин), тем самым регулирует пигментацию шерсти животных. Он также регулирует количество продуктов распада белка в тканях и органах. Кормовой лизин является исходным веществом при образовании карнитина, который играет важную роль в жировом обмене.
ТРЕОНИН
Треонин входит в состав многих белков организма животных и способствует усвоению других аминокислот. Вместе с аспартовой кислотой и метионином участвует в обмене жиров, играет важную роль в образовании коллагена и эластина, а также производстве антител. Он стимулирует высокий прирост молодняка в результате лучшего использования белка в рационе.
Использование кормового треонина позволяет экономически сбалансировать использование пищевого белка в рационе животных и скорректировать наличие в нем аминокислот, необходимых для высокодоходного животноводства.
МЕТИОНИН
Метионин используется в организме как источник серы, для регуляции обмена жиров и белков. Участвует в образовании серина, холина и цистина, необходим для размножения и роста эритроцитов, формирования пера у птицы, препятствует жировому перерождению печени.
Метионин применяется для обогащения и балансирования рациона животных и птицы, приготовления полнорационных кормосмесей и премиксов, комбикормов и кормовых добавок. Добавление метионина позволяет оптимально сбалансировать содержащиеся в рационах незаменимые аминокислоты.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Compilers ‘Toolbox ™ — аминокислоты
| Аминокислоты — строительные блоки белков |
Белок — одно из множества различных азотсодержащих веществ в пищевых продуктах.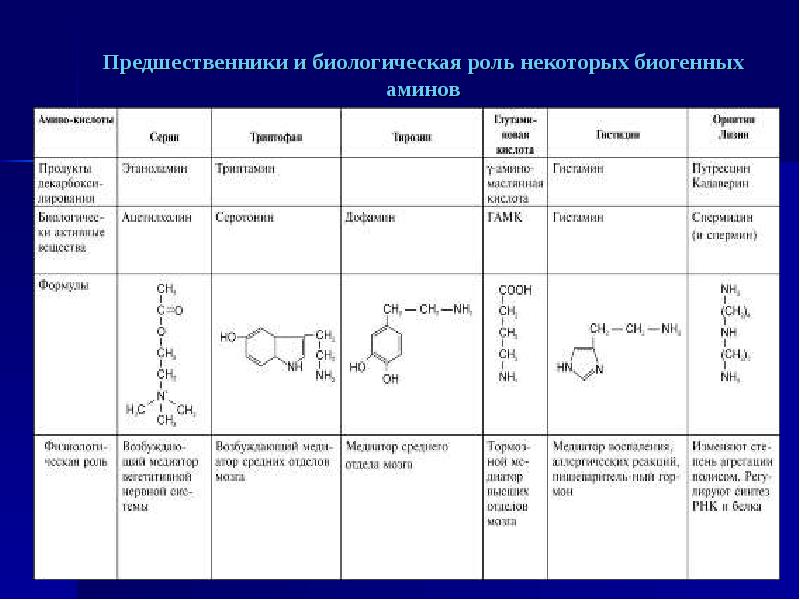 Белки состоят из линейных цепочек аминокислот. Если вы позволите письму
R представляют собой различные аминокислоты в встречающихся группах, все α-амино
кислоты, составляющие основную часть белков, можно обозначить как
Белки состоят из линейных цепочек аминокислот. Если вы позволите письму
R представляют собой различные аминокислоты в встречающихся группах, все α-амино
кислоты, составляющие основную часть белков, можно обозначить как
Обозначение α-аминокислота означает, что аминокислота имеет одну
аминогруппа (-NH 2 ), связанная с С-атомом, ближайшим к
карбоксильная группа (-COOH). Когда аминокислоты объединяются в
белки, группа -COOH одной аминокислоты соединяется с группой другой аминокислоты.
-NH 2 группа, образующая так называемую пептидную связь при высвобождении
вода
α-аминокислоты являются наиболее часто встречающимися аминокислотами в природа.Однако существуют и другие аминокислоты, называемые β-, γ-, δ- и т. Д. аминокислоты в зависимости от положения атома углерода другая аминокислота молекула связана с. Для получения дополнительной информации об аминокислотных структурах см. в Рекомендации IUPAC-IUB 1983 г. [1].
При расчете белка по сумме аминокислотных остатков важно внести поправки на воду, вовлеченную в реакция конденсации, когда образуется пептидная связь. Смотри больше об этом ниже.
| Аминокислоты в питании |
В пищевых белках встречается 20 α-аминокислот. Аминокислоты делятся на группы в соответствии с их свойствами.
Традиционно аминокислоты делятся на две группы в соответствии с к их важности в питании
- незаменимые (или незаменимые) аминокислоты, которые у человека
тело не может синтезировать себя; они содержат лизин,
метионин, треонин, валин, изолейцин, лейцин, фенилаланин,
аргинин и гистидин;
- несущественное (или несущественное), потому что человеческое тело
не может их синтезировать; они включают аланин, аргинин, аспарагин,
аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин,
пролин, серин и тирозин;
Однако это деление аминокислот не совсем понятно,
потому что при определенных условиях некоторые из незаменимых аминокислот
можно считать условно существенным.
Остальные группы состоят в соответствии с характеристиками стороны цепи
- серосодержащие аминокислоты: метионин и цистеин;
- ароматических аминокислот: фенилаланин, триптофан, тирозин;
- алифатических аминокислот: аланин, глицин, изолейцин, лейцин,
пролин, валин;
- кислых аминокислот: аспарагиновая кислота, глутаминовая кислота;
- амидных аминокислот: аспарагин, глутамин;
- основных аминокислот: аргинин, гистидин, лизин;
- гидроксильных аминокислот: серин, треонин;
- и др.
Аминокислоты, образующие белки, всегда являются L-формой амино
кислоты. Согласно [1],
префикс может быть опущен, если указано, что это аминокислота или
очевидно получено из источника белка и поэтому считается
Л.
Поэтому ниже названия аминокислот перечислены без
обозначение, как всегда понималось как L-форма.
| Аминокислоты — что анализируется? |
Подробности аналитического определения аминокислот приведены
описанный в
Гринфилд
и Саутгейт, стр.105-106. А
очень важный шаг в выборке
подготовка перед определением содержания аминокислот в образце
гидролиз белков. Во время гидролиза
белки расщепляются на пептиды и далее на отдельные аминокислоты.
Скорее всего, потеря и разложение аминокислот во время гидролиза,
и это один из основных источников ошибок при определении
аминокислоты. В частности, триптофан и цистеин очень чувствительны к
кислоты и могут быть полностью разрушены, если не будут приняты особые меры предосторожности.
взятый.
В следующей таблице тривиальные названия 20 α-аминокислот: перечислены с их символами и кодами (см. также [1]) вместе с их идентификатором ChEBI [2], средней молекулярной массой и коэффициент перевода аминокислот в аминокислотные остатки:
* Иногда невозможно два точно различить два родственные аминокислоты, поэтому у нас есть особые случаи
- Аспарагин / аспарагиновая кислота (asx, B)
- Глутамин / глутаминовая кислота (glx, X)
и данные для суммы компонентов в этих двух группах обычно выражаются как
аспарагиновая кислота и глутаминовая кислота соответственно.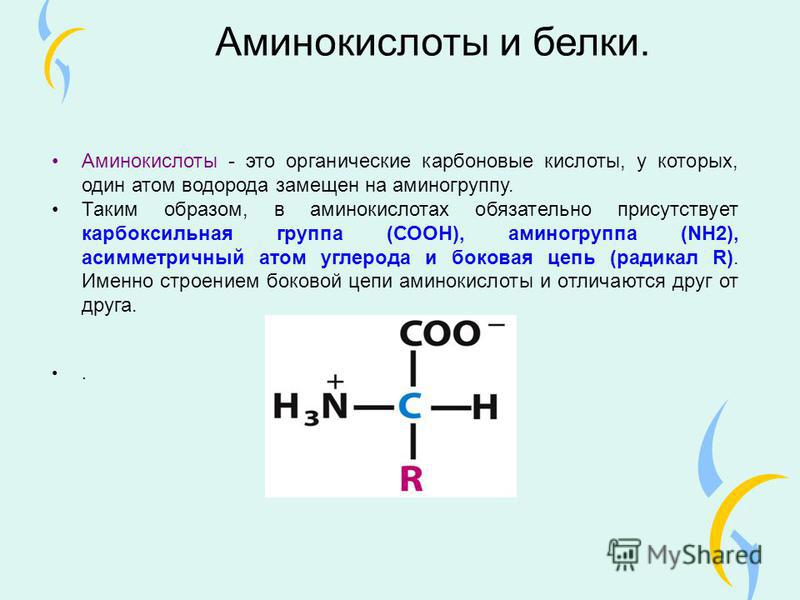
Точно так же часто можно найти данные о цистине (ChEBI: 16283, средняя масса 240,30256) вместо цистеина.
Цистин — это обычная модификация боковой цепи цистеина, образующаяся
окисление двух молекул цистеина и обычно рассматривается как
более стабильный, чем цистеин. Окисление обычно проводят в
чтобы защитить цистеин (и метионин) перед гидролизом.
Средняя молекулярная масса цистина 240,30256 очень близка к удвоенной средней молекулярной массе цистеина.Следовательно, нет
для данных, выраженных как цистин, необходимы специальные положения (пересчеты).
по сравнению с цистеином.
Это оставляет 18 аминокислот, о которых обычно сообщают: аланин, аргинин, аспарагиновая кислота, цистеин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин.
Кроме того, некоторые производные аминокислот, такие как гидроксилизин и гидроксипролин анализируются, например, в мясе и мясных продуктах.Оба компонента в большом количестве присутствуют в соединительной ткани. (коллаген), и результат определения гидроксиамино кислоты используются как мера качества. Высокое содержание гидроксилизина или гидроксипролин — признак употребления мяса низкого качества (большое количество соединительная ткань).
| Аминокислоты — выражение и представление |
При анализе аминокислот традиционно считается также общий азот.
проанализированы в образцах, и аминокислотный профиль, т.е.е. количество
все соответствующие аминокислоты в пище, обычно выражаются в г или
мг (грамм или миллиграмм) аминокислот на грамм азота (или 16 г азота).
Использование содержания азота в каждой пробе в качестве основы для
выражение содержания аминокислот устраняет различия между образцами
еда из-за разного уровня других компонентов, например разные
влажность или жирность.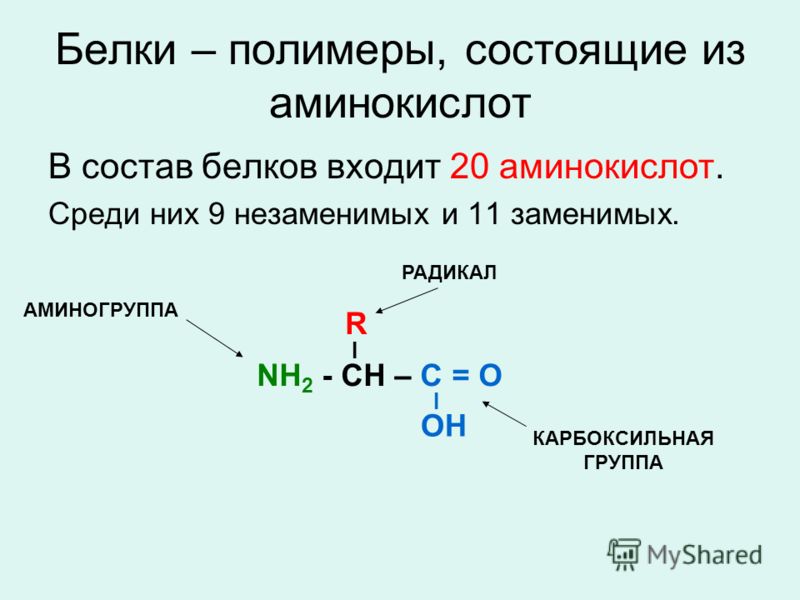
Кроме того, аминокислоты обычно выражаются в г или мг на 100 г. съедобная пища.Однако аминокислотные профили являются основой для этого. выражение, и в большинстве случаев содержание аминокислот рассчитывается из аминокислотный профиль (г или мг на г N) к фактическому содержанию в пище (г или мг на 100 г съедобной порции пищи).
Согласно Гринфилд и Саутгейт, таблица 9.1, предпочтительный блок для аминокислотных значений — мг. Однако во многих случаях может быть больше удобно использовать единицу g — особенно что касается количества значащие цифры.
Максимальное количество значащих цифр аналогично для аминокислоты указаны как 3. Должны к упомянутым выше значительным потерям и деградации, это количество значащие цифры могут быть слишком высокими для более старых данных по аминокислотам. То же самое и при перерасчете данных. Поэтому это предположил, что для более старых данных по аминокислотам могут быть только 2 значащих цифры. использовал.
| Аминокислоты — расчет содержания белка |
В Документ ФАО по продовольствию и питанию 77 [3], предпочтительный метод для Измерение белка указано как
« сумма отдельных аминокислот остатков (молекулярный вес каждой аминокислоты минус молекулярный вес воды) «.
Это наиболее точный метод расчета содержание белка в продуктах питания; однако данные по аминокислотам в настоящее время доступно делать не охватывать все продукты, необходимые в комплексном пищевом составе база данных.
Сумма аминокислотных остатков является более точной мерой. для белка, чем рассчитанное содержание белка на основе Кьельдаля, Дюма или другие аналитические методы определения общей азот.
Фактор, необходимый для расчета аминокислоты.
остаток для каждой аминокислоты перед суммированием приведен в таблице
выше, т. е. сначала рассчитайте аминокислотный остаток для каждой аминокислоты
умножив значение аминокислоты на соответствующее преобразование
фактор, затем суммируйте значения всех аминокислотных остатков.
е. сначала рассчитайте аминокислотный остаток для каждой аминокислоты
умножив значение аминокислоты на соответствующее преобразование
фактор, затем суммируйте значения всех аминокислотных остатков.
| Аминокислоты — Источники данных |
Существует множество источников данных по аминокислотам, но
Для аминокислотных данных характерно то, что в основном сырые продукты имеют
был проанализирован.Простой поиск аминокислот по библиографическому списку.
базы данных обнаружат огромное количество ссылок.
Кроме того, есть сборник составных произведений, таблицы амино.
кислоты, за последние полвека заслуживают упоминания:
Харви Таблицы аминокислот в продуктах питания и кормах [4] вместе с Kuppuswamy et al. Белки в пищевых продуктах [5] и содержание аминокислот Орра и Ватта в пищевых продуктах [6] исчерпывающая основа для собранных работ по аминокислотам в пищевых продуктах опубликовано после 1960 г.
Содержание аминокислот в продуктах питания М. Л. Орр и Б. К. Ватт из
1957 [6] дает сводку данных, доступных для 18 аминокислот в терминах
содержания аминокислот на грамм азота, присутствующего в пище. Для каждого
из 202 продуктов, средний (средний), максимальный и минимальный
показаны значения. Кроме того, количество значений (точек данных)
также показаны выбранные для использования при получении среднего значения.
Во второй таблице указано среднее содержание аминокислот в продуктах на 100 человек.
граммы съедобных порций.Эти значения рассчитываются из среднего
содержание аминокислот приведено в предыдущей таблице.
В Дании Бьорн О. Эггум был очень активен в анализе аминокислот.
с 1960-х по 1990-е годы и опубликовал большое количество научных работ по
аминокислот и качества белка в пище и кормах, и он был
соавтор даже большего. Bjørn Eggum опубликовано в 1968 г. Аминосыреконцентрация и протеинкалитет [7] , таблица
с аминокислотными данными для 17 аминокислот, а также данными о качестве белка
в 90 продуктах питания и кормах.Данные приведены в г на 16 г азота. Амино
значения кислот определяли химическим методом с аминокислотой
анализатор.
Bjørn Eggum опубликовано в 1968 г. Аминосыреконцентрация и протеинкалитет [7] , таблица
с аминокислотными данными для 17 аминокислот, а также данными о качестве белка
в 90 продуктах питания и кормах.Данные приведены в г на 16 г азота. Амино
значения кислот определяли химическим методом с аминокислотой
анализатор.
Содержание аминокислот в пищевых продуктах ФАО и биологические данные о белках [8] опубликовано в 1970 г., содержит данные из научной литературы 18 данные по аминокислотам и качеству белка для 339 пищевых продуктов. В таблицах перечислены значения содержания влаги, азота и белка в г на 100 г съедобная часть, а также коэффициент преобразования азота в белок использовал.Средние значения аминокислот указаны в мг на грамм азота. В в таблицах различают химические методы (а точнее столбец хроматография) и микробиологические методы.
В McCance and Widdowson’s The Composition of Foods , 4 ed. [9] Пол и Саутгейт опубликовали в Разделе 2 таблицу из 18 аминокислот. (мг на грамм азота) для 126 продуктов. Основными источниками данных являются данные ФАО. таблица [8], упомянутая выше, с новыми аналитическими данными по молоку, мясу и разные продукты.В Первом Дополнении [10] к этому публикации рассчитано содержание аминокислот (мг на 100 г съедобная часть) для большинства продуктов в [9].
Helge Søndergaard, опубликовано в 1984 г. Aminosyreindholdet i danske levnedsmidler (содержание аминокислот в датских пищевых продуктах) [11] с данные для 18 аминокислот (мг на 100 г пищевого продукта) в 188 датских пищевых продуктах. Аминокислотный анализ проводили микробиологическими методами.
В диссертации Пирьо Сало-Вяэнянена [12] от 1996 г.
для 18 аминокислот (мг на 100 г съедобной пищи) в 148 финских продуктах питания.Этот
работа интересна еще и тем, что ставит под сомнение установленные
коэффициенты преобразования азота в белок и приходит к выводу, что
использованные коэффициенты слишком высоки, чистая ценность белка (определяемая как сумма
аминокислотных остатков) продуктов питания примерно на 20% ниже, чем содержание белка
рассчитано на основе сырого протеина (Кьельдаль, Дюма и т.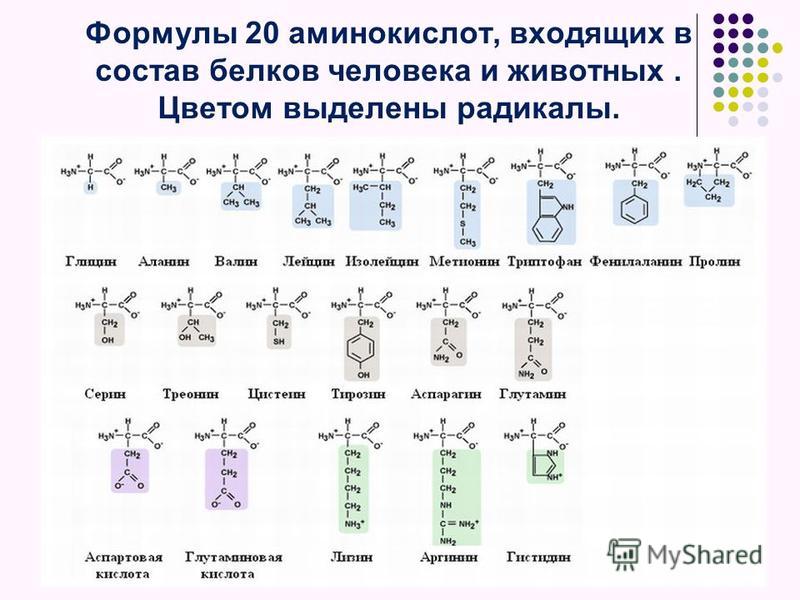 д.).
д.).
С тех пор большая часть работы была сосредоточена на нескольких продуктах / видах в время. Однако стоит упомянуть работу Кима и др. [13], опубликованную в 2009.В документе содержатся данные по аминокислотам для 150 корейских продуктов.
Наборы данных ФАО / INFOODS по зернобобовым [14], рыбе и моллюскам [15] содержат исчерпывающую информацию о проксимальных веществах, минералах и витаминах также информация об аминокислотах, собранная из научной литературы и другие источники. Набор данных по рыбе и моллюскам также включает расчет коэффициентов преобразования азота в белок на уровне видов на основе информации об аминокислотах из литературы.
Данные этих работ будут преобразованы в AminAcidBase ™ база данных по содержанию аминокислот в продуктах питания (в разработке).
1. IUPAC-IUB: Номенклатура и символика аминокислот и пептидов (Рекомендации IUPAC-IUB 1983 г.) «. Pure Appl. Chem. 56 (5): 595–624,
1984.
DOI: 10.1351 / pac198456050595
— полный текст pdf.
2. EMBL-EBI: Химические вещества, представляющие биологический интерес, (ChEBI).Словарь молекулярных объектов, посвященный «небольшим» химическим соединениям.
WWW:
https://www.ebi.ac.uk/chebi/init.do.
3. FAO: Food Energy — методы анализа и преобразования
факторы . Документ ФАО по продовольствию и питанию 77, ФАО, Рим, 2003.
WWW:
ftp://ftp.fao.org/docrep/fao/006/y5022e/y5022e00.pdf.
4. Harvey D: Таблицы аминокислот в пищевых продуктах и Корма . Фарнем Ройал, Бакс., Бюро Содружества. Содружество Бюро питания животных, Техническое сообщение № 19, 1956.
5. Куппусвами С., Сринивасан М. и Субрахманян В.: Белки. в продуктах питания . Нью-Дели, Индийский совет медицинских исследований. Специальный отчет Серия № 33, 1958.
6. Орр, М.Л. и Ватт BK: Содержание аминокислот в продуктах . Дом
Отчет об экономических исследованиях № 4. Департамент США
Сельское хозяйство, Вашингтон, Д.С., декабрь 1957.
Департамент США
Сельское хозяйство, Вашингтон, Д.С., декабрь 1957.
WWW:
http://toolbox.foodcomp.info/References/AminoAcids/USDA —
Аминокислотное содержание продуктов питания — Отчет об исследовании домашнего хозяйства № 4.,
Декабрь 1957.pdf
7. Eggum BO, Landøkonomisk Forsøgslaboratorium: Aminosyre
Концентрация протеинкалитет . Stougaards Forlag, København 1968 (в
Датский с английскими названиями блюд).
WWW:
http://toolbox.foodcomp.info/References/AminoAcids/Eggum —
Аминосыреконцентрация и протеинквалит.Stougaards Forlag, Копенгаген
1968.pdf
8. Служба продовольственной политики и науки о питании ФАО, питание
Подразделение: Содержание аминокислот в пищевых продуктах и биологические данные о белках .
Серия публикаций ФАО по продовольствию и питанию № 21. Продовольственная и сельскохозяйственная организация Объединенных Наций
Организации Объединенных Наций, Рим, 1970 год.
WWW:
http://www.fao.org/DOCREP/005/AC854T/AC854T00.htm
9. Пол А.А. и Саутгейт DAT: McCance & Widdowsons Состав продуктов питания , четвертое исправленное издание.Специальный отчет MRC № 297. Elsevier / North-Holland Biomedical Press, ноябрь 1978 г.,
10. Пол AA, Southgate DAT, Russell J: Первое приложение к McCance & Widdowsons’s The Composition of Foods (Amino кислоты, мг на 100 г пищи, жирные кислоты, г на 100 г пищи). HMSO Her Канцелярия величества, 1980.
11. Søndergaard H: Aminosyreindholdet i danske
levnedsmidler (содержание аминокислот в датских пищевых продуктах).Публикация
номер 98. Statens Levnedsmiddelsinstitut, 1984.
.
WWW:
http://toolbox.foodcomp.info/References/AminoAcids/DOC00153.pdf
12. Salo-Väänänen P: Определение содержания белка в пищевых продуктов по количеству общего азота или аминокислот (Дисс., в Финский). EKT серия 1050. Хельсинкский университет. Кафедра прикладной химии и Микробиология, 1996.
13. Бок Хи Ким, Хэн Шин Ли, Ён Ай Чан, Джи Ён Ли,
Янг Джу Чо, Чо-ил Ким: Разработка аминокислоты
база данных составов для корейских продуктов. Журнал о составе пищевых продуктов
и Анализ 22 (2009) 44–52. DOI: 10.1016 / j.jfca.2008.07.005.
Журнал о составе пищевых продуктов
и Анализ 22 (2009) 44–52. DOI: 10.1016 / j.jfca.2008.07.005.
14. Fernanda Grande, Barbara Stadlmayr, Morgane Fialon, Sergio
Дахдух, Дорис Риттеншобер, Т. Лонгва и У. Рут Шаррондьер:
Глобальная база данных FAO / INFOODS о составе пищевых продуктов для зернобобовых. Версия 1.0 —
uPulses1.0.
Продовольственная и сельскохозяйственная организация Объединенных Наций, Рим, 2017 г. — Пользователь
Гид
—
Техническая спецификация
15.Дорис Риттеншобер, Андерс Мёллер, Барбара Штадлмайр,
Сара Наджера Эспиноса и У. Рут Шаррондьер:
Глобальная база данных FAO / INFOODS о составе пищевых продуктов для рыбы и моллюсков,
версия 1.0 — uFiSh2.0.
Организация ООН по благу и сельскому хозяйству, Рим, 2016 г. — Пользователь
Гид
—
Техническая спецификация
Критическая аминокислотная ценность — КАЧЕСТВО СОИ — СЕВЕРНЫЙ МАРКЕТИНГ СОИ
Что такое CAAV?
CAAV обозначает критерий критической аминокислотной ценности.Это сумма пяти важнейших незаменимых аминокислот (лизина, треонина, триптофана, цистеина, триптофана и метионина) в процентах от сырого протеина (CP).
CAAV — это показатель качества белка, и он не касается количества больше, чем общий показатель CP. Это позволяет покупателю оценить естественный баланс и общие уровни ограничивающих незаменимых аминокислот в соевых бобах или соевом шроте. CAAV не предоставляет конкретной информации по составу. Он обеспечивает порог, при котором вероятность увеличения производительности высока, а добавление дорогих синтетических аминокислот может быть минимизировано.
Как рассчитывается CAAV?
Это формула, используемая для расчета CAAV в соевом шроте:
% лизин +% треонин +% триптофан + (% метионин +% цистеин) , деленное на (/) общее количество аминокислот = критическое значение аминокислот (CAAV)
Почему эти 5 аминокислот?
Лизин, метионин, триптофан и треонин являются первыми ограничивающими незаменимыми аминокислотами.
Цистеин хорошо известен как щадящий эффект метионина.Лизин, метионин, триптофан и треонин доступны как коммерчески производимые синтетические вещества. Суммарное число предполагает большую полноту пищевой ценности.
Каково соотношение сырого протеина (CP) и аминокислот?
Когда аминокислоты выражаются в процентах от общего белка соевых бобов, процентное содержание 5 наиболее ограничивающих аминокислот (5 CAAV) уменьшается с увеличением белка (и увеличивается количество NEAA, особенно глутаминовой кислоты и аргинина). Таким образом, белок соевых бобов с низким содержанием сырого протеина содержит больше незаменимых аминокислот, чем соевые бобы с высоким содержанием сырого протеина.Таким образом, общая взаимосвязь, обнаруженная в этом исследовании между CP и качеством белка, обозначена суммой 5 EAA. Хотя бразильские соевые бобы обычно содержат больше сырого протеина, чем американские соевые бобы, менее белковые американские соевые бобы обогащены лизином, цистеином, метионином и треонином, и можно ожидать, что они будут производить муку более высокого качества, которая может удовлетворить потребности животных в незаменимых аминокислотах при меньших затратах. концентрация белка в пище (N)
Почему CAAV имеет значение?
- CAAV предоставляет простой числовой дескриптор для оценки сравнительной ценности соевого шрота
- CAAV показывает критическую концентрацию аминокислот
- Модификации могут улучшить CAAV как инструмент оценки ценности соевого шрота
- Использование CAAV в качестве инструмента отбора может более последовательно определять соевый шрот в рационах свиней и бройлеров, более ценный по сравнению с сырым белком.
- Информация CAAV способствует выбору соевых шротов с более высокими концентрациями экономически важных аминокислот.
Узнать больше
Отчет о критической аминокислотной ценности, Дэвид Р. Гаст
Оценка состава жирных кислот и аминокислот в бамии (Abelmoschus esculentus), выращенной в разных географических регионах.
Бамия имеет разное применение в качестве продукта питания и лекарственного средства в традиционной медицине. Поскольку оно дает много семян, распространение растения также довольно простое.Хотя выход масла из семян низкий (4,7%), поскольку состав линолевой кислоты в масле семян достаточно высокий (67,5%), его все же можно использовать в качестве источника (UNSAT) ненасыщенных жирных кислот. В этом исследовании образцы бамии, выращенной в четырех разных местах, были проанализированы для измерения состава жирных кислот и аминокислот. Содержание экстракции липидов варьировалось от 4,34% до 4,52% в пересчете на сухую массу. Количественно основными жирными кислотами бамии были пальмитиновая кислота (29,18–43,26%), линолевая кислота (32,22–43%).07%), линоленовая кислота (6,79–12,34%), стеариновая кислота (6,36–7,73%), олеиновая кислота (4,31–6,98%), арахиновая кислота (ND – 3,48%), маргариновая кислота (1,44–2,16%), пентадециловая кислота. кислота (0,63–0,92%) и миристиновая кислота (0,21–0,49%). Аспарагиновая кислота, пролин и глутаминовая кислота были основными аминокислотами в стручках бамии, в то время как цистеин и тирозин были второстепенными аминокислотами. Статистические методы показали, как на содержание жирных кислот и аминокислот в бамии может влиять место отбора пробы.
1. Введение
Бамия ( Abelmoschus esculentus ) широко распространена в тропических и субтропических регионах Африки, Азии, Южной Европы, стран Средиземноморья и Америки.Бамию выращивают в основном как овощ на равнинах Египта. Хорошо растет в теплых климатических условиях (температура выше 26 ° С).
Семена зрелых стручков бамии иногда используются для кормления домашней птицы, а также потребляются после обжарки и в качестве заменителя кофе. Они считаются желудочным стимулятором, спазмолитиком и нервным средством [1]. Семена бамии использовались в небольших масштабах для производства масла. Семена бамии из Греции являются потенциальным источником масла с концентрацией от 15. От 9% до 20,7% [2]. Масло в основном состоит из линолевой кислоты (до 47,4%) [3]. Масло семян бамии — богатый источник ненасыщенных жирных кислот. Значительное внимание привлекло использование натуральных компонентов для снижения сердечно-сосудистых заболеваний, цереброваскулярных заболеваний и смертности от рака. Липидные компоненты вносят большой вклад в пищевую и сенсорную ценность почти всех типов продуктов. Природа предоставляет большое количество жиров, различающихся по своим химическим и функциональным свойствам. В растительных маслах обычно присутствуют четыре класса липидов: триацилглицерины, диацилглицерины, полярные липиды и свободные жирные кислоты.Состав жирных кислот определяет физические свойства, стабильность и пищевую ценность липидов.
От 9% до 20,7% [2]. Масло в основном состоит из линолевой кислоты (до 47,4%) [3]. Масло семян бамии — богатый источник ненасыщенных жирных кислот. Значительное внимание привлекло использование натуральных компонентов для снижения сердечно-сосудистых заболеваний, цереброваскулярных заболеваний и смертности от рака. Липидные компоненты вносят большой вклад в пищевую и сенсорную ценность почти всех типов продуктов. Природа предоставляет большое количество жиров, различающихся по своим химическим и функциональным свойствам. В растительных маслах обычно присутствуют четыре класса липидов: триацилглицерины, диацилглицерины, полярные липиды и свободные жирные кислоты.Состав жирных кислот определяет физические свойства, стабильность и пищевую ценность липидов.
Наиболее естественными запасными липидами являются триацилглицерины. Триацилглицерины — это природные соединения, которые состоят из насыщенных и ненасыщенных жирных кислот, которые различаются длиной их ацильных цепей и количеством и положением двойных связей: насыщенные, моноеновые и полиненасыщенные жирные кислоты, которые различаются по составу жирных кислот. Моноеновые жирные кислоты и полиненасыщенные жирные кислоты структурно отличаются наличием повторяющихся метиленовых звеньев.Эти единицы образуют чрезвычайно гибкую цепь, которая быстро переориентируется через конформационные состояния и составляет влиятельную группу молекул, способствующих здоровью [4]. Белки играют особенно важную роль в питании человека. Содержание аминокислот, пропорции и их усвояемость человеком характеризуют биологическую ценность белка [5]. Бамию называют «идеальным овощем для сельских жителей» из-за ее прочной природы, пищевых волокон и отличного баланса белков семян лизина и аминокислот триптофана (в отличие от белков зерновых и зернобобовых) [6, 7].Незаменимые и заменимые аминокислоты в бамии сопоставимы с соевыми бобами. Следовательно, он играет жизненно важную роль в рационе человека [8].
Целью настоящего исследования было изучить и сравнить общий липидный, жирнокислотный и аминокислотный состав бамии. Кроме того, исследование было разработано для получения всестороннего и подробного профиля различных компонентов стручков бамии, которые могут представлять как промышленные, так и пищевые интересы.
Кроме того, исследование было разработано для получения всестороннего и подробного профиля различных компонентов стручков бамии, которые могут представлять как промышленные, так и пищевые интересы.
2.Материалы и методы
2.1. Растительный материал
Бамии были собраны в разных местах Египта: стручки S-pod (Суэц) возле пустыни, M pod (Mansoura) у реки Нил, K-pod (Кафр-эль-Шейх) у Средиземного моря и D-стручки ( Дакалия) у озера. Стручки сушили на солнце и анализировали их содержимое. В таблице 1 представлена дополнительная информация о географическом происхождении и содержании липидов.
| |||||||||||||||||||||||||||||||||||||
| Значения представляют собой среднее значение трех отдельных образцов, каждый из которых проанализирован в двух экземплярах ± стандартное отклонение.Различные буквы верхнего регистра, соответственно, указывают на значительную разницу (), проанализированную с помощью теста множественных диапазонов Дункана. Содержание определяли с помощью аппарата Сокслета. | |||||||||||||||||||||||||||||||||||||
2.
 2. Экстракция липидов по Сокслету
2. Экстракция липидов по СокслетуЛипиды экстрагировали методом Сокслета [9]. Все растворители были реактивными, закуплены у Sigma Chemical Co. (Сент-Луис, Миссури, США) и использовались без какой-либо дополнительной очистки. Около 15 г бамии измельчали в кофемолке и сразу же дважды экстрагировали 200 мл гексана и нагревали при 35–60 ° C в течение 6 ч со скоростью 2–3 капли / с.Гексан удаляли с помощью роторного испарителя при 40 ° C в вакууме, и экстракты сушили до постоянного веса; затем остаток хранили при –20 ° C в темноте для анализа жирных кислот [10, 11].
2.3. Измерение жирных кислот
Получение метилового эфира жирной кислоты . Метиловые эфиры жирных кислот (МЭЖК) получали согласно [12]. Аликвоту (1 мл) общих липидов упаривали в пробирке для метилирования. Жирные кислоты омыляли 10 мл метанольного раствора гидроксида натрия (0.5 М) в течение 15 мин на кипящей водяной бане при 65 ° С. Для трансметилирования смесь гомогенизировали с 10 мл метанольного раствора BF 3 (20%, мас. / Об.) И реакции позволяли протекать в течение 5 мин. МЭЖК дважды экстрагировали, добавляя к смеси 10 мл петролейного эфира и 10 мл воды.
2.4. Анализ газовой хроматографии и газовой хроматографии-масс-спектрометрии
МЭЖК анализировали с использованием газожидкостной хроматографии (модель HP 6890; Agilent, Пало-Альто, Калифорния, США), снабженной пламенно-ионизационным детектором.Использовали капиллярную колонку из плавленого кварца SP-2560 (внутренний диаметр 100 м × 0,25 мм; толщина пленки 0,2 мкм м; Supelco, Inc., Bellefonte, PA, USA). Параметры колонки были следующими: начальная температура колонки поддерживалась на уровне 40 ° C в течение 5 минут после впрыска, от 20 ° C / мин до 220 ° C и, наконец, температура поддерживалась на уровне 220 ° C в течение 30 минут. Гелий был газом-носителем с давлением на входе в колонку, установленным на 17 фунтов на квадратный дюйм. Температура детектора 250 ° C. Для целей идентификации эти анализы также были выполнены с помощью газового хроматографа (модель HP 6890; Agilent), соединенного с детектором масс-спектрометра 5973 (Agilent), с использованием той же колонки, описанной ранее.
FAME были идентифицированы с использованием стандартов (смесь компонентов Supelco 37 Component FAME; Supelco Bellefonte, PA, USA) и сравнения их масс-спектральных данных с масс-спектральной базой данных в библиотеке Wiley 7.0 (HPMass Spectral Libraries, Пало-Альто, Калифорния, США). США). Пики конъюгированной линолевой кислоты идентифицировали путем сравнения со временем удерживания эталонного стандарта (метиловый эфир конъюгированной линолевой кислоты, смесь цис -9, транс -11 метилового эфира октадекадиеновой кислоты и цис -10, транс -12 метиловый эфир октадекадиеновой кислоты; Sigma Chemical Co.). Содержание жирных кислот выражали как отношение каждой отдельной жирной кислоты к общему количеству всех жирных кислот, присутствующих в образце.
2,5. Измерение аминокислот
Аликвоты образцов, содержащие около 8–12 мг белков, помещали в кювету на 20 мл и смешивали с 9 мл 6 М HCl [13]. После герметизации кюветы образцы подвергали гидролизу при 110 ° C в течение 24 ч по N 2 . Гидролизаты переносили в мерную колбу на 100 мл, смешивали с 9 мл 6 М NaOH и разбавляли 0.02 н. HCl. Затем все образцы фильтровали и загружали в аминокислотный анализатор Hitachi L-8800 (Токио, Япония) для аминокислотного анализа.
2.6. Статистический анализ
Данные повторений всех сортов подвергали дисперсионному анализу (ANOVA) с использованием SPSS 16.0 для Windows. Существенные различия между средними значениями были определены с помощью нового теста с множественными диапазонами Дункана (). Корреляция между всеми исследуемыми параметрами определялась методом главных компонент (PCA) с использованием программы XLSTAT.
3. Результаты и обсуждение
3.1. Результаты анализа жирных кислот
Состав жирных кислот липидов, экстрагированных из высушенных на солнце растений бамии, представлен в таблице 2. Растения бамии имели низкое количество масел. Содержание липидов в стручках бамии существенно не различалось; он варьировался от 4,34 г / 100 г для стручков M до 4,52 г / 100 г для стручков S.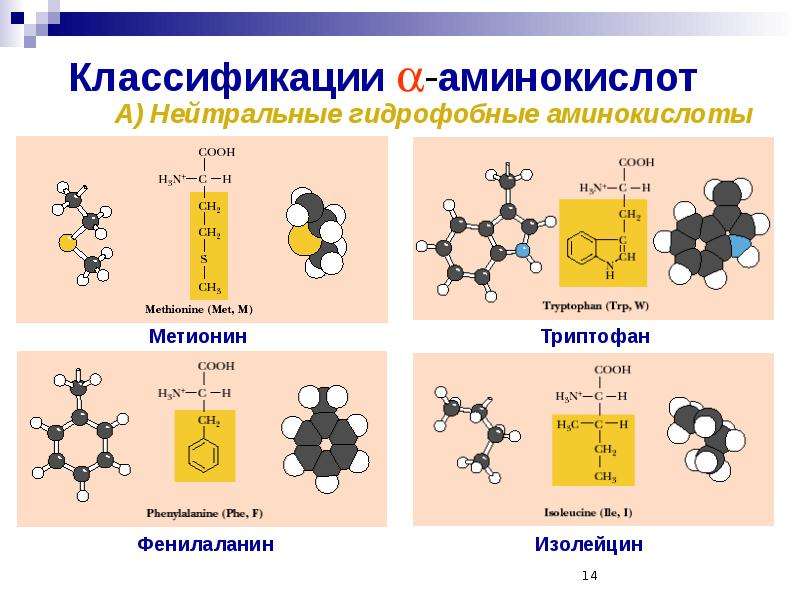 Все изученные стручки бамии имели более высокое содержание жира, чем ранее сообщалось для бамии [14]. Исследование производных FAME показало девять жирных кислот.Общие насыщенные жирные кислоты (НЖК), мононенасыщенные жирные кислоты (МНЖК) и полиненасыщенные жирные кислоты (ПНЖК) показали значительные различия в их содержании. Пальмитиновая кислота (29,18–43,26%) была основной жирной кислотой; способствует естественной регенерации масла. Масло является важным компонентом кожи, обеспечивающим ее защитный барьер. Если слишком мало масла, кожа потрескается и начнет кровоточить, что повысит риск заражения и болезней. Следующей по распространенности жирной кислотой была линолевая кислота (32,22–43,07%), которая была наиболее распространена в стручке S, за ней следовала линоленовая кислота (6.79–12,34%), стеариновая кислота (6,36–7,73%), олеиновая кислота (4,31–6,98%), арахиновая кислота (ND – 3,48%), маргариновая кислота (1,44–2,16%), пентадециловая кислота (0,63–0,92%) , миристиновая кислота (0,21–0,49%). На рис. 1 показаны хроматограммы образца жирной кислоты. Во всех случаях насыщенные жирные кислоты (SAT) преобладали над SFA, в диапазоне от 67% до 117%, и, в частности, PUFA преобладали над MUFA. Были идентифицированы и количественно определены девять жирных кислот. Насколько нам известно, ранее не было сообщений о составе жирных кислот в стручках бамии.Настоящее исследование доказало, что стручки бамии являются источником полезных жирных кислот, таких как полиненасыщенные жирные кислоты линолевая и α, -линоленовая кислота. Линолевая кислота является членом группы незаменимых жирных кислот, называемых омега-6 жирными кислотами, которые называются так потому, что они являются важной пищевой потребностью для всех млекопитающих и способствуют биосинтезу арахидоновой кислоты и, следовательно, некоторых простагландинов. Линолевая кислота используется для изготовления мыла, эмульгаторов и быстросохнущих масел. Он становится все более популярным в косметической промышленности благодаря своим полезным свойствам на коже, включая противовоспалительные, уменьшающие угри и свойства удержания влаги [15].
Все изученные стручки бамии имели более высокое содержание жира, чем ранее сообщалось для бамии [14]. Исследование производных FAME показало девять жирных кислот.Общие насыщенные жирные кислоты (НЖК), мононенасыщенные жирные кислоты (МНЖК) и полиненасыщенные жирные кислоты (ПНЖК) показали значительные различия в их содержании. Пальмитиновая кислота (29,18–43,26%) была основной жирной кислотой; способствует естественной регенерации масла. Масло является важным компонентом кожи, обеспечивающим ее защитный барьер. Если слишком мало масла, кожа потрескается и начнет кровоточить, что повысит риск заражения и болезней. Следующей по распространенности жирной кислотой была линолевая кислота (32,22–43,07%), которая была наиболее распространена в стручке S, за ней следовала линоленовая кислота (6.79–12,34%), стеариновая кислота (6,36–7,73%), олеиновая кислота (4,31–6,98%), арахиновая кислота (ND – 3,48%), маргариновая кислота (1,44–2,16%), пентадециловая кислота (0,63–0,92%) , миристиновая кислота (0,21–0,49%). На рис. 1 показаны хроматограммы образца жирной кислоты. Во всех случаях насыщенные жирные кислоты (SAT) преобладали над SFA, в диапазоне от 67% до 117%, и, в частности, PUFA преобладали над MUFA. Были идентифицированы и количественно определены девять жирных кислот. Насколько нам известно, ранее не было сообщений о составе жирных кислот в стручках бамии.Настоящее исследование доказало, что стручки бамии являются источником полезных жирных кислот, таких как полиненасыщенные жирные кислоты линолевая и α, -линоленовая кислота. Линолевая кислота является членом группы незаменимых жирных кислот, называемых омега-6 жирными кислотами, которые называются так потому, что они являются важной пищевой потребностью для всех млекопитающих и способствуют биосинтезу арахидоновой кислоты и, следовательно, некоторых простагландинов. Линолевая кислота используется для изготовления мыла, эмульгаторов и быстросохнущих масел. Он становится все более популярным в косметической промышленности благодаря своим полезным свойствам на коже, включая противовоспалительные, уменьшающие угри и свойства удержания влаги [15]. Исследования показали, что α -линоленовая кислота, полиненасыщенная жирная кислота омега-3, связана с более низким риском сердечно-сосудистых заболеваний [16]. Простагландины и тромбоксаны — это родственные соединения, известные как эйкозаноиды, которые обладают большим разнообразием биологической активности, включая посредничество в противовоспалительных процессах, снижение артериального давления, расслабление коронарных артерий и ингибирование агрегации тромбоцитов [17].
Исследования показали, что α -линоленовая кислота, полиненасыщенная жирная кислота омега-3, связана с более низким риском сердечно-сосудистых заболеваний [16]. Простагландины и тромбоксаны — это родственные соединения, известные как эйкозаноиды, которые обладают большим разнообразием биологической активности, включая посредничество в противовоспалительных процессах, снижение артериального давления, расслабление коронарных артерий и ингибирование агрегации тромбоцитов [17].
3.2. Результаты аминокислотного анализаАминокислотный профиль растений бамии показан в таблице 3, в которой перечислены концентрации 17 аминокислот. Среди этих аминокислот было обнаружено 11 незаменимых аминокислот. Основными аминокислотами были аспарагиновая кислота (2.91–4,92 г / 100 г), за которыми следуют пролин, глутаминовая кислота, аргинин, лейцин, аланин, лизин, серин и фенилаланин. Метионин, изолейцин, гистидин, цистеин и тирозин были второстепенными аминокислотами в стручках бамии. Основные кислоты составляли более 76,45% от общего количества аминокислот, присутствующих в белках бамии. Общее количество заменимых аминокислот было выше, чем количество незаменимых аминокислот. Было обнаружено, что M pod и K pod богаты изолейцином, лизином и валином с комбинированной концентрацией 1.32 г / 100 г для M pod и 1,46 г / 100 г для K pod. Однако значительные различия () в содержании аргинина, аспарагиновой кислоты и пролина наблюдались между M pod и K pod. Количество серосодержащих аминокислот (метионина и цистина) составляло 0,24, 0,23, 0,30 и 0,19 г / 100 г для стручков S, K, M и D соответственно, а общее содержание ароматических аминокислот составляло 0,66–0,96. г / 100 г. D pod показал самое низкое значение, а M pod показал самое высокое значение. На рис. 2 представлены хроматограммы образцов аминокислот.
3.3. Результаты анализа основных компонентов.PCA использовали для анализа содержания жирных кислот и аминокислот. На рисунках 3 и 4 представлены графики оценок и корреляционных нагрузок соответственно. График оценок PCA показывает большую изменчивость четырех разновидностей бамии (S, M, K и D) в зависимости от их местоположения.Нагрузки — это коэффициенты исходных переменных, которые определяют каждый главный компонент [18]. Процент инерции и коррелированные переменные для осей 1 и 2 показаны в таблице 4. Оси 1 объясняют 60,85% общей инерции. Ось 2 объясняла 24,82% инерции и была положительной по аргинину, гистидину, пролину и аспарагиновой кислоте. Инерция была отрицательной из-за линолевой кислоты. Графики оценок на Рисунке 3 показали, что облако данных было в основном двумерным. Что касается объясняющих переменных, на Рисунке 4 показаны две группы разновидностей.В первый кластер вошли разновидности стручков S и K. Второй кластер (разновидности стручков D и M) был индивидуализирован.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 71
71 28
28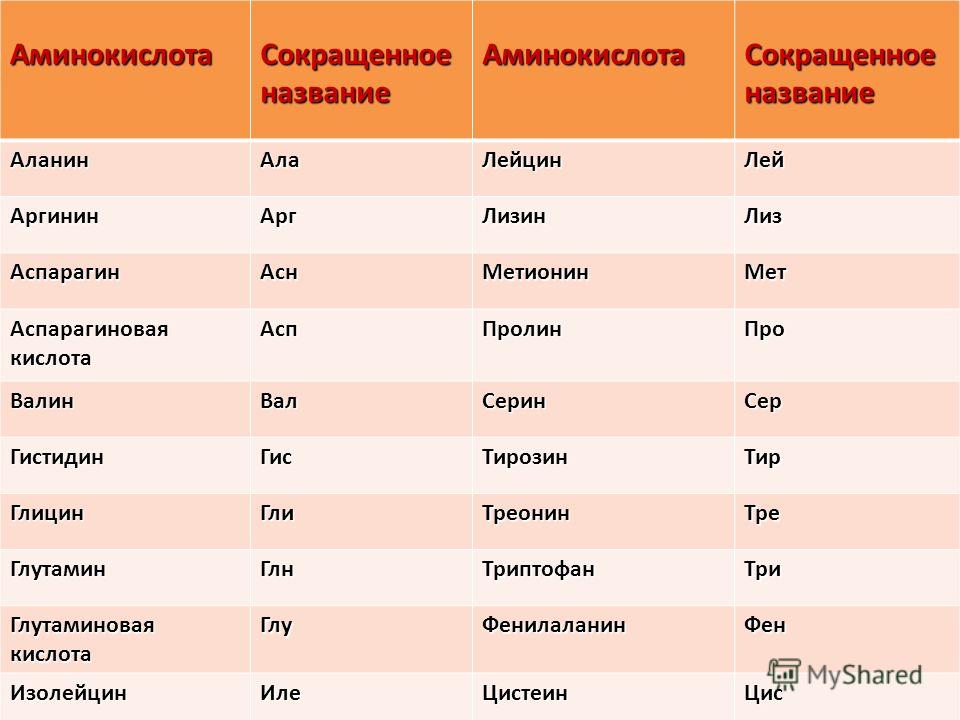 Данные с разными заглавными буквами надстрочного индекса в одном и том же столбце разнообразия, соответственно, указывают на значительную разницу (), проанализированную с помощью теста множественных диапазонов Дункана. Н.Д .: Не обнаружено.
Данные с разными заглавными буквами надстрочного индекса в одном и том же столбце разнообразия, соответственно, указывают на значительную разницу (), проанализированную с помощью теста множественных диапазонов Дункана. Н.Д .: Не обнаружено.  Данные с разными заглавными буквами надстрочного индекса в одном и том же столбце разнообразия, соответственно, указывают на значительную разницу (), проанализированную с помощью теста множественных диапазонов Дункана.
Данные с разными заглавными буквами надстрочного индекса в одном и том же столбце разнообразия, соответственно, указывают на значительную разницу (), проанализированную с помощью теста множественных диапазонов Дункана.  66
66 Незаменимые и заменимые аминокислоты в бамии сопоставимы с соевыми бобами. Таким образом, бамию можно использовать как хороший источник белков для питания человека. Семена можно подвергнуть экстракции маслом для получения дополнительных преимуществ. Бамию можно использовать в производстве мыла, эмульгаторов и быстросохнущих масел, и она становится все более популярной в косметической промышленности.
Незаменимые и заменимые аминокислоты в бамии сопоставимы с соевыми бобами. Таким образом, бамию можно использовать как хороший источник белков для питания человека. Семена можно подвергнуть экстракции маслом для получения дополнительных преимуществ. Бамию можно использовать в производстве мыла, эмульгаторов и быстросохнущих масел, и она становится все более популярной в косметической промышленности.
 2004; Gumus et al. 2009; Oksuz et al. 2011), и мы обнаружили более высокие значения, чем некоторые исследования (Guner et al. 1998; Erkan et al. 2010b; Polat et al. 2009; Tulgar and Berik 2012). Мы посчитали, что дифференциация значений влажности зависит от вида, сезона, режима питания, размера, сезона нереста, пола и площади вылова.
2004; Gumus et al. 2009; Oksuz et al. 2011), и мы обнаружили более высокие значения, чем некоторые исследования (Guner et al. 1998; Erkan et al. 2010b; Polat et al. 2009; Tulgar and Berik 2012). Мы посчитали, что дифференциация значений влажности зависит от вида, сезона, режима питания, размера, сезона нереста, пола и площади вылова.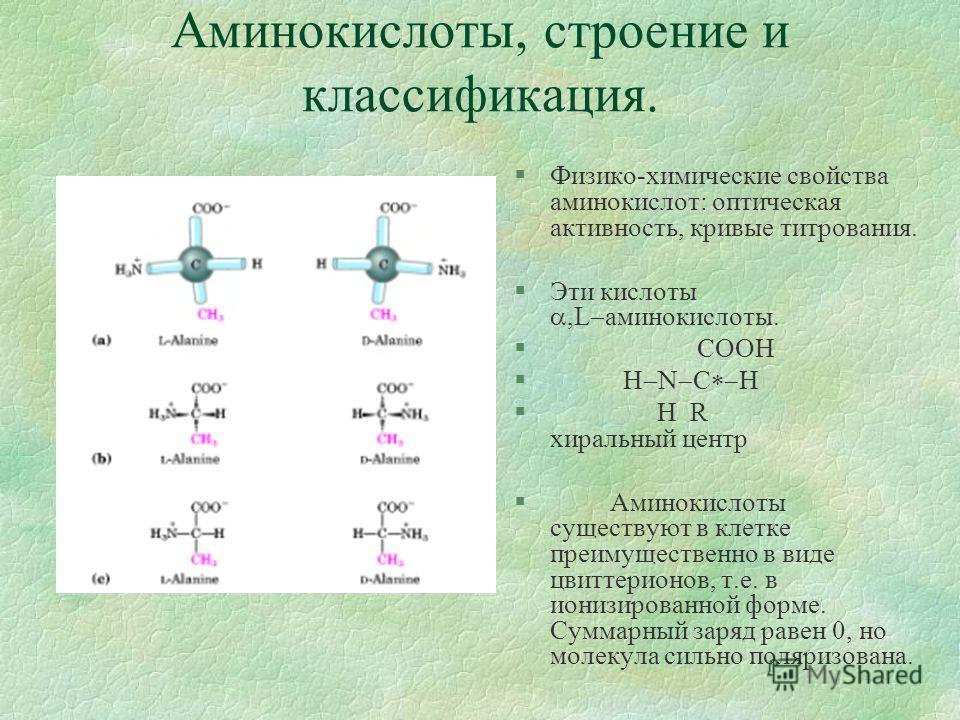 23 и 1,66%.
23 и 1,66%.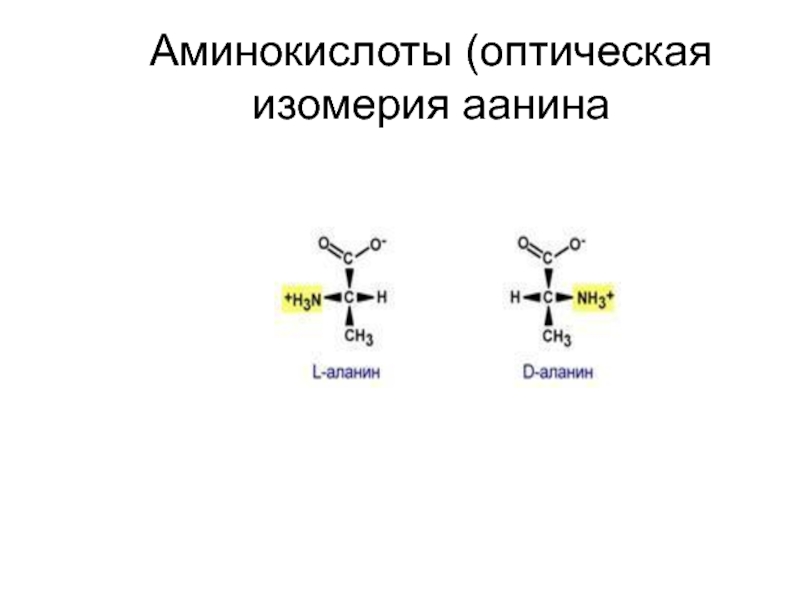 moluccensis и 10,38% в M. surmuletus в своем исследовании. Они отметили, что, хотя эти виды принадлежат к одному семейству и одной среде обитания, они могут иметь различное содержание жира. Эрсой (2006) исследовала питательный состав U. Moluccensis , пойманного в сентябре, декабре, марте и мае, и определила содержание сырого жира как 3,26, 0,64, 2,20 и 0,51% соответственно. Polat et al. (2009) в своем исследовании определили содержание сырого жира в M. barbatus 3.68% весной, 5,33% зимой и 5,76% осенью. Они думали, что падение содержания сырого жира в течение весеннего сезона должно было быть связано с поступлением сырой энергии, необходимой для развития икры во время формирования гонадогенеза, которая достигла наивысшей точки непосредственно перед нерестом. Озогул и др. (2011) в своем исследовании изучали сезонные изменения содержания сырого жира в U. pori и M. barbatus . Они определили содержание сырого жира U. pori между 1,07 и 2.10% и содержание сырого жира M. barbatus от 1,07 до 3,00%. Они утверждали, что изменения в жирности связаны с сезоном кормления и нереста.
moluccensis и 10,38% в M. surmuletus в своем исследовании. Они отметили, что, хотя эти виды принадлежат к одному семейству и одной среде обитания, они могут иметь различное содержание жира. Эрсой (2006) исследовала питательный состав U. Moluccensis , пойманного в сентябре, декабре, марте и мае, и определила содержание сырого жира как 3,26, 0,64, 2,20 и 0,51% соответственно. Polat et al. (2009) в своем исследовании определили содержание сырого жира в M. barbatus 3.68% весной, 5,33% зимой и 5,76% осенью. Они думали, что падение содержания сырого жира в течение весеннего сезона должно было быть связано с поступлением сырой энергии, необходимой для развития икры во время формирования гонадогенеза, которая достигла наивысшей точки непосредственно перед нерестом. Озогул и др. (2011) в своем исследовании изучали сезонные изменения содержания сырого жира в U. pori и M. barbatus . Они определили содержание сырого жира U. pori между 1,07 и 2.10% и содержание сырого жира M. barbatus от 1,07 до 3,00%. Они утверждали, что изменения в жирности связаны с сезоном кормления и нереста. Сырой белок был обнаружен в январе значительно ( P <0,05) выше, чем в другие месяцы, тогда как значения сырого протеина были обнаружены в марте и апреле значительно ( P <0,05) ниже (Таблица 2). Мы думали, что различия в содержании сырого протеина в основном связаны с периодом нереста и плотностью питания.
Сырой белок был обнаружен в январе значительно ( P <0,05) выше, чем в другие месяцы, тогда как значения сырого протеина были обнаружены в марте и апреле значительно ( P <0,05) ниже (Таблица 2). Мы думали, что различия в содержании сырого протеина в основном связаны с периодом нереста и плотностью питания. 1999; Ersoy 2006), а более низкие значения белка были обнаружены в некоторых исследованиях (Guner et al. 1998; Kalogeropoulos et al. 2004; Gumus et al. 2009; Tulgar and Berik 2012). В сезонных исследованиях (Ersoy 2006; Polat et al. 2009; Ozogul et al. 2011; Tulgar and Berik 2012) в целом значимые ( P <0,05) разные значения были определены в качестве нашего ежемесячного исследования. Когда мы изучили содержание сырого протеина в U. moluccensis в нашем исследовании, мы пришли к выводу, что это важный источник протеина во все месяцы (хотя содержание протеина уменьшалось в марте и апреле, когда приближался сезон нереста).
1999; Ersoy 2006), а более низкие значения белка были обнаружены в некоторых исследованиях (Guner et al. 1998; Kalogeropoulos et al. 2004; Gumus et al. 2009; Tulgar and Berik 2012). В сезонных исследованиях (Ersoy 2006; Polat et al. 2009; Ozogul et al. 2011; Tulgar and Berik 2012) в целом значимые ( P <0,05) разные значения были определены в качестве нашего ежемесячного исследования. Когда мы изучили содержание сырого протеина в U. moluccensis в нашем исследовании, мы пришли к выводу, что это важный источник протеина во все месяцы (хотя содержание протеина уменьшалось в марте и апреле, когда приближался сезон нереста). Они заявили, что количество сырого жира и жирных кислот необходимо учитывать при определении пищевой ценности рыбы. Kalogeropoulos et al. (2004) обнаружили, что основными жирными кислотами в M. barbatus являются пальмитиновая кислота, пальмитолеиновая кислота, олеиновая кислота, EPA и DHA. Polat et al.(2009) определили, что преобладающими жирными кислотами были пальмитиновая кислота, стеариновая кислота, олеиновая кислота, пальмитолеиновая кислота, EPA и DHA в M. barbatus во все сезоны, и они сообщили, что компоненты жирных кислот менялись в зависимости от сезона и количества DHA + EPA и положительно влияет на предпочтения потребителей. Озогул и др. (2011) обнаружили, что жирные кислоты U. pori и M. barbatus сезонно менялись из-за ряда экологических и биологических эффектов, а значения EPA и DHA были высокими во все сезоны.Оксуз и др. (2011) обнаружили, что наиболее распространенными жирными кислотами в U. moluccensis и M. surmuletus были пальмитиновая кислота, стеариновая кислота, олеиновая кислота, пальмитолеиновая кислота, EPA и DHA. Они сообщили, что количество омега-3 больше, чем количество омега-6 у обоих видов, важных для здоровья человека. Эркан (2013) изучил распределение омега-3 жирных кислот в потребляемых водных продуктах в Турции и обнаружил, что наиболее распространенными жирными кислотами в рыбьем жире являются пальмитиновая кислота, стеариновая кислота, пальмитолеиновая кислота, олеиновая кислота, EPA и DHA.
Они заявили, что количество сырого жира и жирных кислот необходимо учитывать при определении пищевой ценности рыбы. Kalogeropoulos et al. (2004) обнаружили, что основными жирными кислотами в M. barbatus являются пальмитиновая кислота, пальмитолеиновая кислота, олеиновая кислота, EPA и DHA. Polat et al.(2009) определили, что преобладающими жирными кислотами были пальмитиновая кислота, стеариновая кислота, олеиновая кислота, пальмитолеиновая кислота, EPA и DHA в M. barbatus во все сезоны, и они сообщили, что компоненты жирных кислот менялись в зависимости от сезона и количества DHA + EPA и положительно влияет на предпочтения потребителей. Озогул и др. (2011) обнаружили, что жирные кислоты U. pori и M. barbatus сезонно менялись из-за ряда экологических и биологических эффектов, а значения EPA и DHA были высокими во все сезоны.Оксуз и др. (2011) обнаружили, что наиболее распространенными жирными кислотами в U. moluccensis и M. surmuletus были пальмитиновая кислота, стеариновая кислота, олеиновая кислота, пальмитолеиновая кислота, EPA и DHA. Они сообщили, что количество омега-3 больше, чем количество омега-6 у обоих видов, важных для здоровья человека. Эркан (2013) изучил распределение омега-3 жирных кислот в потребляемых водных продуктах в Турции и обнаружил, что наиболее распространенными жирными кислотами в рыбьем жире являются пальмитиновая кислота, стеариновая кислота, пальмитолеиновая кислота, олеиновая кислота, EPA и DHA. 2011). В качестве причины изменения указаны сезонные условия, возраст, размер, площадь вылова и период нереста.В нашем исследовании мы также учли, что вышеупомянутые факторы влияют на различия в количестве жирных кислот.
2011). В качестве причины изменения указаны сезонные условия, возраст, размер, площадь вылова и период нереста.В нашем исследовании мы также учли, что вышеупомянутые факторы влияют на различия в количестве жирных кислот. Озден и Эркан (2008) исследовали аминокислотный состав трех культивируемых видов ( Dicentrarchus labrax , Sparus aurata и Dentex dentex ) и определили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота и лизин. Они сообщили, что аспарагиновая кислота и глутаминовая кислота важны для растворимости ферментов и защиты ионного характера активности ферментов.Адейай (2009) в своем исследовании изучил аминокислотный состав Clarias anguillaris , Oreochromis niloticus, и Cynoglossus senegalensis видов, и он определил, что глутаминовая кислота, аспарагиновая кислота и лейцин являются наиболее распространенными аминокислотами. Он сообщил, что эти виды являются ценными источниками аминокислот. Erkan et al. (2010a) исследовали аминокислотный состав Trachurus trachurus и обнаружили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота и лизин.Erkan et al. (2010b) изучили аминокислотный состав Engraulis encrasicolus , Pomatomus saltatrix , Sarda sarda , M. surmelutus, и Merlangius merlangus и обнаружили, что лизин, глютаминовая кислота, лейцин, аргинин аспарагиновая кислота была наиболее распространенной аминокислотой. Oluwaniyi et al. (2010) изучили аминокислотный состав видов Clupea harengus , Scomber scombrus , Trachurus trachurus, и Urophycis tenuis .Они сообщили, что наиболее распространенными аминокислотами являются глутаминовая кислота, аспарагиновая кислота, лизин и лейцин. Zhao et al. (2010) изучили содержание аминокислот в Pampus punctatissimus , важном источнике рыболовства в Китае, и обнаружили, что глутаминовая кислота, лизин, лейцин и аспарагиновая кислота являются наиболее распространенными аминокислотами. Озден и Эркан (2011) изучили содержание аминокислот в некоторых продуктах рыболовства и обнаружили, что значения аминокислот меняются в зависимости от вида.
Озден и Эркан (2008) исследовали аминокислотный состав трех культивируемых видов ( Dicentrarchus labrax , Sparus aurata и Dentex dentex ) и определили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота и лизин. Они сообщили, что аспарагиновая кислота и глутаминовая кислота важны для растворимости ферментов и защиты ионного характера активности ферментов.Адейай (2009) в своем исследовании изучил аминокислотный состав Clarias anguillaris , Oreochromis niloticus, и Cynoglossus senegalensis видов, и он определил, что глутаминовая кислота, аспарагиновая кислота и лейцин являются наиболее распространенными аминокислотами. Он сообщил, что эти виды являются ценными источниками аминокислот. Erkan et al. (2010a) исследовали аминокислотный состав Trachurus trachurus и обнаружили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота и лизин.Erkan et al. (2010b) изучили аминокислотный состав Engraulis encrasicolus , Pomatomus saltatrix , Sarda sarda , M. surmelutus, и Merlangius merlangus и обнаружили, что лизин, глютаминовая кислота, лейцин, аргинин аспарагиновая кислота была наиболее распространенной аминокислотой. Oluwaniyi et al. (2010) изучили аминокислотный состав видов Clupea harengus , Scomber scombrus , Trachurus trachurus, и Urophycis tenuis .Они сообщили, что наиболее распространенными аминокислотами являются глутаминовая кислота, аспарагиновая кислота, лизин и лейцин. Zhao et al. (2010) изучили содержание аминокислот в Pampus punctatissimus , важном источнике рыболовства в Китае, и обнаружили, что глутаминовая кислота, лизин, лейцин и аспарагиновая кислота являются наиболее распространенными аминокислотами. Озден и Эркан (2011) изучили содержание аминокислот в некоторых продуктах рыболовства и обнаружили, что значения аминокислот меняются в зависимости от вида. Peng et al. (2013) определили, что наиболее распространенными аминокислотами в тунце ( Thunnus albacares и Thunnus obesus ) являются аспарагиновая кислота, глутаминовая кислота и лизин.Они заявили, что названная рыба является хорошим источником питательных веществ с точки зрения глутаминовой кислоты, необходимой для пролиферации клеток. Kaya et al. (2014) исследовали содержание аминокислот Salmo trutta forma fario , которые охотятся и выращивают на фермах, и обнаружили, что значения глутаминовой кислоты, аспарагиновой кислоты и лизина были выше, чем у других аминокислот. Они обнаружили, что различия в общих значениях аминокислот в целом были значительными ( P <0,05) по видам и возрасту, и они заявили, что различия в значениях аминокислот были связаны с сезоном нереста, условиями питания и живыми животными. область.Baki et al. (2015) сравнили содержание аминокислот в натуральном и культивированном сибасе ( Dicentrarchus labrax ) в своем исследовании и обнаружили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота, лейцин и лизин. Suseno (2015) сообщил, что наиболее распространенными аминокислотами в тунце ( Thunnus sp.) Были глутаминовая кислота, аргинин, лейцин и лизин. Salma et al. (2016) обнаружили, что наиболее распространенными аминокислотами, обнаруженными в скумбрии ( Scomber scombrus ), были глутаминовая кислота, аспарагиновая кислота и лизин.
Peng et al. (2013) определили, что наиболее распространенными аминокислотами в тунце ( Thunnus albacares и Thunnus obesus ) являются аспарагиновая кислота, глутаминовая кислота и лизин.Они заявили, что названная рыба является хорошим источником питательных веществ с точки зрения глутаминовой кислоты, необходимой для пролиферации клеток. Kaya et al. (2014) исследовали содержание аминокислот Salmo trutta forma fario , которые охотятся и выращивают на фермах, и обнаружили, что значения глутаминовой кислоты, аспарагиновой кислоты и лизина были выше, чем у других аминокислот. Они обнаружили, что различия в общих значениях аминокислот в целом были значительными ( P <0,05) по видам и возрасту, и они заявили, что различия в значениях аминокислот были связаны с сезоном нереста, условиями питания и живыми животными. область.Baki et al. (2015) сравнили содержание аминокислот в натуральном и культивированном сибасе ( Dicentrarchus labrax ) в своем исследовании и обнаружили, что наиболее распространенными аминокислотами были аспарагиновая кислота, глутаминовая кислота, лейцин и лизин. Suseno (2015) сообщил, что наиболее распространенными аминокислотами в тунце ( Thunnus sp.) Были глутаминовая кислота, аргинин, лейцин и лизин. Salma et al. (2016) обнаружили, что наиболее распространенными аминокислотами, обнаруженными в скумбрии ( Scomber scombrus ), были глутаминовая кислота, аспарагиновая кислота и лизин. 05) нравится нам.
05) нравится нам. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.