какие нужны и как принимать
Автор Егор Новиков На чтение 4 мин. Просмотров 5.1k. Опубликовано
Лечение остеохондроза направлено не только на устранение последствий заболевания. Мало заниматься йогой или укреплять мышечный корсет. Для предотвращения дегенеративных процессов в позвоночнике лучше использовать витамины при остеохондрозе шейного отдела. Какие витамины лучше всего влияют на укрепление суставов, какие снимают болевой синдром, а какие могут обратить болезнь в ремиссию.
Виды витаминов
Какие витамины принимать при остеохондрозе? Обычно это:
- Ретинол;
- Килциферол;
- Никотиновая кислота;
- Другие витамины группы B;
- Токоферол;
- Витамины С.
В сумме они дают комплексный эффект, снижая давление и перетирание суставов. Некоторые из них значительно уменьшают болевые ощущения. А при правильном применении и соблюдении баланса, болезнь и вовсе можно остановить. К сожалению, обратить остеохондроз вспять практически невозможно. Однако при применении соответствующих витаминов, лекарств для улучшения состояния состава, а также выполнении всех необходимых упражнений, включающих не только стандартную йогу, но и даже умеренные занятия в тренажерном зале, помогут решить проблему.
К сожалению, обратить остеохондроз вспять практически невозможно. Однако при применении соответствующих витаминов, лекарств для улучшения состояния состава, а также выполнении всех необходимых упражнений, включающих не только стандартную йогу, но и даже умеренные занятия в тренажерном зале, помогут решить проблему.
Ретинол
Витамины этой группы при остеохондрозе умиляют проникающую способность токоферола. Как это помогает при остеохондрозе? Очень просто, в совокупности ретинол и токоферол усиливают проникающую способность суставов воспринимать питательные вещества. При общей способности организма к регенерации
Кальциферол
Витамины этой группы при остеохондрозе поясничного отдела. Во-первых кальциферол является мощным антиоксидантом, а во-вторых он помогает усваивать кальций не выводя его пищеварительной системой. Как результат – улучшенное усвоение кальция и крепкие кости. А именно недостаток кальция и является причиной возникновения самой болезни.
А именно недостаток кальция и является причиной возникновения самой болезни.
Никотиновая кислота
Витамины этой группы при шейном остеохондрозе помогают расслабить нервную систему и оптимизировать её ресурсы для улучшения общего состояния. Группа B6 обладает мощным антиоксидантным действием, как результат организм собирает все силы для борьбы с возникшей болезнью
Витамины группы B
Уменьшает болевые ощущения от перетертых позвонков. Группа B расслабляет нервную систему, уменьшая чувствительность к боли – это помогает справиться с последствиями уже возникшего шейного остеохондроза в обыденной жизни.
Токоферол
Улучшает проникающую способность ретинола и кальция. В совокупности вместе они улучшают восприимчивость суставов к кальцию, уменьшают риск возникновения камней в почках, и что самое главное позволяют обратить дегенерацию позвонков.
Витамины для симптоматического лечения остеохондроза должны включать в себя и токоферол и кальциферол, и витамины группы Б
Витамины С
Антиоксидант. Он повышает восприимчивость организма, улучшает анаболические процессы и активизирует сопротивляемость внешним воздействиям. Как результат – замедление дегенеративных последствий разрушения позвоночника и болезней, возникающие из-за общего ослабления организма.
Он повышает восприимчивость организма, улучшает анаболические процессы и активизирует сопротивляемость внешним воздействиям. Как результат – замедление дегенеративных последствий разрушения позвоночника и болезней, возникающие из-за общего ослабления организма.
Как пить?
Естественно, что каждый витамин обладает своими особенностями. Некоторые из них нужно принимать исключительно после пищи, другие наоборот на голодный желудок. Существуют даже спирторастворимые группы витаминов. Есть два варианта стандартного лечения:
- Применение каждого витамина в соответствии с его требованиями – это проблемно в условиях современной жизни, когда таблетки нужно принимать строго по расписанию. Но в отличие от других методов, такой прием витаминов помогает лучшей усвояемости, и соответственно достигается наилучший эффект.
- Прием поливитаминов. Обычно это должно быть 2–3 банки разных поливитаминов, которые сбалансировано питают организм всеми необходимыми веществами и микроэлементами.
 Как это может помочь в решении проблемы остеохондроза? Такой метод несколько менее эффективный, однако прием всего 1–2-ух видов лекарств в соответствии с расписанием гораздо более легкий, чем следить за свои рационом и принимать 9–12 разных типов таблеток строго по времени.
Как это может помочь в решении проблемы остеохондроза? Такой метод несколько менее эффективный, однако прием всего 1–2-ух видов лекарств в соответствии с расписанием гораздо более легкий, чем следить за свои рационом и принимать 9–12 разных типов таблеток строго по времени.
Важно понимать, что витамины это вспомогательные средства для лечения остеохондроза, и даже если вы пропустили один или два приема, особого эффекта не будет. Однако систематический прием лекарств, и правильное сбалансированное белками и аминокислотами питание, помогает справиться с последствиями дегенеративных разрушений позвоночника.
Побочные эффекты
Важно соблюдать дозировку витаминов, т.к. при залечивании остеохондроза шейного отдела можно заработать гипервитаминоз. Если для многих это кажется сказкой, то дисбаланс витаминов в организме нарушает порядок катаболических процессов.
Краткий гипервитаминоз это не грозит ничем страшным, однако при длительном злоупотреблении витаминами существенно повышается риск возникновения доброкачественных и злокачественных опухолей.
Также гипервитаминоз может привести к специфическим заболеваниям всех систем и тканей организма. В частности в зависимости от дисбаланса витаминов может произойти:
- Увеличение кровяного давления;
- Ухудшение аллергического противостояния;
- Отложение камней в почках;
- Образование холестериновых бляшек;
- Ухудшению работы нервной системы.
Использование витаминов при лечении остеохондроза, помогает справиться с последствиями дегенеративных процессов в организме. Однако стоит придерживаться ограничений в приеме. Витамины не единственное что нужно применять при заболеваниях позвоночника. Не забывайте про упражнения, укрепляющие связки и мышечный корсет. Такие упражнения помогают справиться с симптомами и последствиями остеохондроза. Во-вторых такие упражнения во многом снижают нагрузку на позвоночник, что позволяет избежать дальнейших дегенеративных
Патогенетическое обоснование применения высоких доз витаминов группы В при хронической спондилогенной дорсопатии uMEDp
Патологической основой для формирования хронической боли в спине является комплекс дегенеративных процессов в межпозвонковых дисках и поверхностях мелких и крупных суставов позвоночника – остеохондроз, остеоартроз, спондилез, остеопороз. Прогрессированию заболевания способствуют повторные травмы, избыточная статическая или динамическая нагрузка, наследственная предрасположенность.
Прогрессированию заболевания способствуют повторные травмы, избыточная статическая или динамическая нагрузка, наследственная предрасположенность.
Рис. 1. Дифференцированная терапия хронической боли
Развитие остеохондроза может привести со временем к формированию грыжи диска. Так, межпозвонковый диск постепенно деформируется, теряет воду и смещается к периферии, формируя протрузию (выпячивание) в просвет позвоночного канала. Смещаясь в сторону позвоночного канала или межпозвонкового отверстия, грыжа может компримировать прилегающий спинномозговой корешок, что ведет к возникновению корешкового синдрома (радикулопатии). Компрессия корешка сопровождается формированием болевого синдрома, имеющего нейропатический характер. Повреждение корешка обусловлено не только его механическим сдавлением, но также и асептическим воспалением, отеком и демиелинизацией, в генезе которых определенная роль может принадлежать иммунным нарушениям.
Радикулопатия считается хронической, если продолжается более 4 недель и характеризуется моторными и сенсорными нарушениями в шее, руках и ногах, в зависимости от локализации поврежденного спинального корешка.
Вследствие ряда особенностей клинического течения радикулопатий – прогрессирующего или хронического характера заболевания, резистентности к лечебному воздействию и склонности к рецидивированию, необходимость повторных госпитализаций данных больных сопровождается длительной утратой трудоспособности [1–3].
В зависимости от патофизиологических особенностей процесса, различают ноцицептивную и нейропатическую боль. Ноцицептивной считается боль, обусловленная действием конкретного повреждающего фактора (механическая травма, ожог, воспаление и т. д.) на периферические болевые рецепторы при сохранности всех отделов нервной системы. Под нейропатической подразумевается боль, возникающая при органическом поражении различных отделов нервной системы, участвующих в контроле боли. Крупные эпидемиологические исследования свидетельствуют о том, что у 20–35% пациентов с дискогенной радикулопатией преобладает нейропатический компонент имеющегося болевого синдрома [4, 6].
Механизм формирования хронической боли опосредуется афферентными сигналами от болевых рецепторов (ноцицепторов), расположенных в сухожилиях и фасциях спины, поступающими в спинной мозг через синапсы. Вырабатываемые в ответ провоспалительные цитокины (интерлейкины) и простагландины активируют интактные рецепторы, расположенные вне болевой зоны.
Эффективность лечения спондилогенной дорсопатии в значительной степени зависит от конкретных патогенетических механизмов. Комплексная патогенетическая терапия направлена на купирование болевого синдрома, устранение мышечно-тонических нарушений и миогенных триггерных зон, поддержание метаболических процессов.
Комплексная патогенетическая терапия направлена на купирование болевого синдрома, устранение мышечно-тонических нарушений и миогенных триггерных зон, поддержание метаболических процессов.
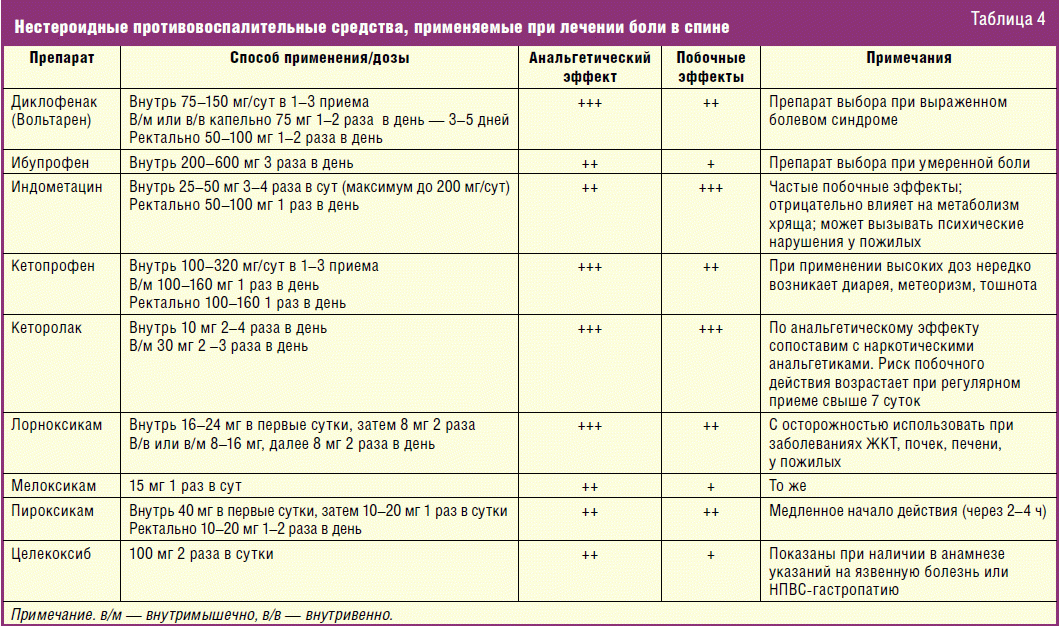
В терапии нейропатической боли широко применяется медикаментозное лечение, включающее назначение антидепрессантов, противоэпилептических препаратов, опиоидных анальгетиков. Имеются данные об определенной эффективности витаминов группы В. На сегодняшний день отсутствует достаточное количество убедительных данных об эффективности применения консервативных немедикаментозных методов лечения (например, физиотерапии, физических упражнений, чрескожной электронейростимуляции).
В случае ноцицептивной боли эффективным является назначение нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов. Длительность применения НПВП зависит от выраженности и продолжительности дорсопатии. При остро возникшей боли в спине бывает достаточно кратковременного (в течение нескольких дней) применения НПВП. При наличии интенсивной, особенно корешковой боли длительность лечения может достигать 3–4 недель. Одним из серьезных последствий приема НПВП является их негативное воздействие на желудочно-кишечный тракт с повышенным риском язвообразования. При нейропатической боли применение НПВП малоэффективно.
При наличии интенсивной, особенно корешковой боли длительность лечения может достигать 3–4 недель. Одним из серьезных последствий приема НПВП является их негативное воздействие на желудочно-кишечный тракт с повышенным риском язвообразования. При нейропатической боли применение НПВП малоэффективно.
Повышение эффективности лечения как нейропатических, так и ноцицептивных болевых синдромов связано с высокими лечебными дозами витаминов группы В (В Ранее традиционно использовался способ попеременного введения растворов тиамина (витамина В1), пиридоксина (витамина В6) и цианокобаламина (витамина В12) – по 1–2 мл внутримышечно с ежедневным чередованием каждого препарата – в течение 2–4 недель. Недостатками такой схемы лечения являются неэффективные дозы вводимых препаратов, необходимость частых болезненных инъекций, приводящая к низкому комплаенсу.
Ранее традиционно использовался способ попеременного введения растворов тиамина (витамина В1), пиридоксина (витамина В6) и цианокобаламина (витамина В12) – по 1–2 мл внутримышечно с ежедневным чередованием каждого препарата – в течение 2–4 недель. Недостатками такой схемы лечения являются неэффективные дозы вводимых препаратов, необходимость частых болезненных инъекций, приводящая к низкому комплаенсу.
Появление трехкомпонентного нейротропного комплекса Мильгамма® и Мильгамма® композитум (Верваг Фарма ГмбХ, Германия) сделало возможным повысить приверженность пациентов назначенной терапии. Каждая ампула Мильгаммы® содержит по 100 мг тиамина, пиридоксина и 1000 мкг цианокобаламина, а также лидокаин, обеспечивающий местный анестезирующий эффект при внутримышечном введении препарата. Антиноцицептивное действие препарата объясняется угнетением локального синтеза медиаторов воспаления, а также модуляцией взаимодействия медиаторов с рецепторным аппаратом. Кроме того, цианокобаламин положительно влияет на процессы регенерации нервных волокон и миелиновой оболочки, что является одной из ключевых мишеней терапии хронической радикулопатии. Витамин B6 участвует в регуляции обмена ключевых нейромедиаторов и аминокислот, оказывает влияние на трофические процессы в нервной ткани: повышение синтеза протеинов под действием витаминов группы В создает условия для более успешной регенерации нервных волокон. Тиамин обеспечивает нормальную регуляцию углеводного обмена в периферической нервной ткани и также способен тормозить прохождение болевой импульсации на уровне задних рогов спинного мозга и таламуса [11–13].
Кроме того, цианокобаламин положительно влияет на процессы регенерации нервных волокон и миелиновой оболочки, что является одной из ключевых мишеней терапии хронической радикулопатии. Витамин B6 участвует в регуляции обмена ключевых нейромедиаторов и аминокислот, оказывает влияние на трофические процессы в нервной ткани: повышение синтеза протеинов под действием витаминов группы В создает условия для более успешной регенерации нервных волокон. Тиамин обеспечивает нормальную регуляцию углеводного обмена в периферической нервной ткани и также способен тормозить прохождение болевой импульсации на уровне задних рогов спинного мозга и таламуса [11–13].
В качестве поддерживающей терапии целесообразно проведение регулярных курсов лечения витаминами группы В. Учитывая нейротропное действие Мильгаммы®, препарат желательно применять как в остром, так и в хроническом периоде болевого синдрома. Пероральная форма препарата Мильгамма® композитум содержит бенфотиамин, который обладает высокой биодоступностью по сравнению с водорастворимой формой – тиамином. Также в состав препарата входит пиридоксин. Оба компонента взаимно усиливают нейротропное действие, способствуя восстановлению нарушенной чувствительности и сохранению структуры нервных волокон. Рекомендованная схема приема при спондилогенной дорсопатии включает в себя назначение инъекций Мильгаммы® на протяжении 10 дней с последующим переходом на пероральный прием драже Мильгамма® композитум в течение 14 дней.
Также в состав препарата входит пиридоксин. Оба компонента взаимно усиливают нейротропное действие, способствуя восстановлению нарушенной чувствительности и сохранению структуры нервных волокон. Рекомендованная схема приема при спондилогенной дорсопатии включает в себя назначение инъекций Мильгаммы® на протяжении 10 дней с последующим переходом на пероральный прием драже Мильгамма® композитум в течение 14 дней.
В недавно законченном исследовании [7] было показано, что применение Мильгаммы® в составе комплексной терапии достоверно снижает интенсивность болевого синдрома, увеличивает двигательную активность больных, улучшает показатели качества жизни, в частности сон и эмоционально-аффективные проявления. Регулярное (не менее 2 раз в год) применение Мильгаммы® композитум препятствует хронизации болевого синдрома при радикулопатии.
В ходе другого исследования была подтверждена эффективность препарата у данного контингента больных и показан продолжительный эффект и после его отмены [10]. В исследование было включено 38 пациентов с умеренным или выраженным болевым синдромом на фоне радикулопатии (оценка по ВАШ не менее 4 баллов) и длительностью обострения не менее 1 месяца. В обеих группах исключался прием витаминов группы B в течение 2 месяцев. Первая группа включала в себя 19 пациентов, которым назначалась Мильгамма® и Мильгамма® композитум в сочетании с диклофенаком. Больные второй группы (19 пациентов) получали только диклофенак. Между группами не было достоверных различий по возрасту, полу, длительности заболевания, длительности обострения и интенсивности болевого синдрома. Диагноз радикулопатии выставлялся при наличии корешкового болевого синдрома и как минимум одного симптома выпадения (например, снижение соответствующего сухожильного рефлекса). Из терапии исключались физиотерапевтические методы лечения, рефлексотерапия и массаж. Пациенты первой группы получали следующую схему лечения: в первые 10 дней внутримышечные инъекции Мильгаммы® и диклофенака в дозе 75 мг в сутки с целью снижения выраженности болевого синдрома.
В исследование было включено 38 пациентов с умеренным или выраженным болевым синдромом на фоне радикулопатии (оценка по ВАШ не менее 4 баллов) и длительностью обострения не менее 1 месяца. В обеих группах исключался прием витаминов группы B в течение 2 месяцев. Первая группа включала в себя 19 пациентов, которым назначалась Мильгамма® и Мильгамма® композитум в сочетании с диклофенаком. Больные второй группы (19 пациентов) получали только диклофенак. Между группами не было достоверных различий по возрасту, полу, длительности заболевания, длительности обострения и интенсивности болевого синдрома. Диагноз радикулопатии выставлялся при наличии корешкового болевого синдрома и как минимум одного симптома выпадения (например, снижение соответствующего сухожильного рефлекса). Из терапии исключались физиотерапевтические методы лечения, рефлексотерапия и массаж. Пациенты первой группы получали следующую схему лечения: в первые 10 дней внутримышечные инъекции Мильгаммы® и диклофенака в дозе 75 мг в сутки с целью снижения выраженности болевого синдрома. В последующем для снижения риска возможных рецидивов пациенты получали Мильгамму® композитум по 1 драже 3 раза в день в течение 2 недель. В контрольной группе лечение ограничивалось применением только диклофенака, который также вводился внутримышечно в фиксированной дозе 75 мг в сутки, а далее назначался внутрь по потребности. Оценка состояния больных проводилась в момент включения в исследование, на 10‑й и 24‑й дни, а также через 3 месяца после окончания терапии. Использовались шкалы ВАШ, шкала вертебрального синдрома и невропатической боли, а также специально разработанный телефонный опросник, который включал в себя следующие пункты: выраженность болевого синдрома в пояснице, выраженность болевого синдрома в ноге и степень ограничения подвижности. Продолженную фазу (до конца 6‑го месяца) завершили 30 (79%) пациентов, из них 16 (84%) в основной группе и 14 (73%) в контрольной группе. Результаты исследования продемонстрировали лучшую динамику симптомов в основной группе пациентов. Так, к 10‑му дню суммарная оценка по ШБС (шкала боли в спине) в основной группе снизилась в среднем на 35%, в контрольной группе – на 30%, к 24‑му дню суммарная оценка по ШБС снизилась на 49% в основной группе, а в группе сравнения – на 43%.
В последующем для снижения риска возможных рецидивов пациенты получали Мильгамму® композитум по 1 драже 3 раза в день в течение 2 недель. В контрольной группе лечение ограничивалось применением только диклофенака, который также вводился внутримышечно в фиксированной дозе 75 мг в сутки, а далее назначался внутрь по потребности. Оценка состояния больных проводилась в момент включения в исследование, на 10‑й и 24‑й дни, а также через 3 месяца после окончания терапии. Использовались шкалы ВАШ, шкала вертебрального синдрома и невропатической боли, а также специально разработанный телефонный опросник, который включал в себя следующие пункты: выраженность болевого синдрома в пояснице, выраженность болевого синдрома в ноге и степень ограничения подвижности. Продолженную фазу (до конца 6‑го месяца) завершили 30 (79%) пациентов, из них 16 (84%) в основной группе и 14 (73%) в контрольной группе. Результаты исследования продемонстрировали лучшую динамику симптомов в основной группе пациентов. Так, к 10‑му дню суммарная оценка по ШБС (шкала боли в спине) в основной группе снизилась в среднем на 35%, в контрольной группе – на 30%, к 24‑му дню суммарная оценка по ШБС снизилась на 49% в основной группе, а в группе сравнения – на 43%. Оценка симптомов невропатической боли с помощью шкалы NPS показала, что только на фоне комбинированной терапии, включавшей Мильгамму®, по сравнению с исходным уровнем достоверно уменьшились такие характеристики боли, как интенсивность, острота и переносимость. Кроме того, на фоне комбинированной терапии, включавшей Мильгамму®, отмечены более значительный регресс симптомов натяжения и восстановление двигательных функций. При оценке по Шкале общего клинического впечатления на фоне применения комбинированной терапии, включающей Мильгамму®, на 10‑й день исследования значительный эффект отмечен у 6 пациентов (25%), в контрольной – только у 2 пациентов (10%). Следует отметить, что на эффективность терапии не влияли возраст, исходная интенсивность и длительность боли, наличие симптомов выпадения, выраженность болевого синдрома. Спустя 3 месяца болевой синдром в пояснице и/или ноге отсутствовал или был минимальным у 10 пациентов 1‑й группы (63% от числа завершивших 1‑ю фазу исследования) и у 7 (50%) пациентов 2‑й группы (p
Оценка симптомов невропатической боли с помощью шкалы NPS показала, что только на фоне комбинированной терапии, включавшей Мильгамму®, по сравнению с исходным уровнем достоверно уменьшились такие характеристики боли, как интенсивность, острота и переносимость. Кроме того, на фоне комбинированной терапии, включавшей Мильгамму®, отмечены более значительный регресс симптомов натяжения и восстановление двигательных функций. При оценке по Шкале общего клинического впечатления на фоне применения комбинированной терапии, включающей Мильгамму®, на 10‑й день исследования значительный эффект отмечен у 6 пациентов (25%), в контрольной – только у 2 пациентов (10%). Следует отметить, что на эффективность терапии не влияли возраст, исходная интенсивность и длительность боли, наличие симптомов выпадения, выраженность болевого синдрома. Спустя 3 месяца болевой синдром в пояснице и/или ноге отсутствовал или был минимальным у 10 пациентов 1‑й группы (63% от числа завершивших 1‑ю фазу исследования) и у 7 (50%) пациентов 2‑й группы (p
Полученные данные свидетельствуют о том, что достаточные дозы нейротропных витаминов в составе препаратов Мильгамма® и Мильгамма® композитум могут потенцировать обезболивающий эффект НПВС и способствовать более быстрому регрессу болевого синдрома у больных со спондилогенной дорсопатией и вертеброгенной радикулопатией. Результаты исследования свидетельствуют о высокой эффективности комплекса витаминов группы В при радикулопатии. Добавление к 10‑дневному курсу внутримышечного введения Мильгаммы® 14‑дневного курса перорального приема препарата Мильгамма® композитум способствует более полному проявлению терапевтического потенциала препаратов. И, наконец, полученные данные подтверждают эффективность комбинированного курса лечения Мильгаммой® не только в краткосрочной, но и в среднесрочной (3‑месячной) перспективе, что важно для предупреждения хронизации боли.
Результаты исследования свидетельствуют о высокой эффективности комплекса витаминов группы В при радикулопатии. Добавление к 10‑дневному курсу внутримышечного введения Мильгаммы® 14‑дневного курса перорального приема препарата Мильгамма® композитум способствует более полному проявлению терапевтического потенциала препаратов. И, наконец, полученные данные подтверждают эффективность комбинированного курса лечения Мильгаммой® не только в краткосрочной, но и в среднесрочной (3‑месячной) перспективе, что важно для предупреждения хронизации боли.
Таким образом, применение высоких доз витаминов группы В является эффективным при нейропатическом болевом синдроме, спондилогенной дорсопатии и дискогенной радикулопатии. Устранение боли – это, с одной стороны, подавление синтеза медиаторов воспаления в очаге повреждения, с другой – ограничение ноцицептивной импульсации из зоны повреждения в центральную нервную систему. Мильгамма® – нейротропный препарат, восстанавливающий структуру и функцию нервных волокон и обладающий анальгетическим действием. Фармакологические свойства препарата создают клинические предпосылки для его широкого применения у пациентов с нейропатической болью в спине. Особенно показан препарат пациентам с частыми обострениями радикулопатии. Рекомендуется повторять курсы терапии 2 раза в год, включая 10‑дневное назначение внутримышечных инъекций и последующий переход на пероральную форму – Мильгамма® композитум по 1 драже 3 раза в день в течение 2 недель.
Фармакологические свойства препарата создают клинические предпосылки для его широкого применения у пациентов с нейропатической болью в спине. Особенно показан препарат пациентам с частыми обострениями радикулопатии. Рекомендуется повторять курсы терапии 2 раза в год, включая 10‑дневное назначение внутримышечных инъекций и последующий переход на пероральную форму – Мильгамма® композитум по 1 драже 3 раза в день в течение 2 недель.
Дефицит витамина D: недостающий этиологический фактор в развитии ювенильного рассекающего остеохондроза?
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта: (изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Вольтерс Клювер
Полнотекстовые ссылки
. 2019 Январь; 39 (1): 51-54.
doi: 10.1097/BPO.0000000000000921.
Геррит С Майер 1 , Джордже Лазович 1 , Уве Маус 1 , Клаус Э. Рот 2 , Константин Хорас 3 , Йорн Б. Сигер 4
Сигер 4
Принадлежности
- 1 Университетская клиника ортопедической хирургии, Больница Пия, Университет Карла фон Осецкого, Ольденбург.
- 2 Кафедра ортопедической хирургии, Университет Иоганна Гутенберга, Майнц.
- 3 Отделение ортопедической хирургии, König Ludwig Haus, Университет Юлиуса-Максимилиана, Вюрцбург.
- 4 Кафедра ортопедической хирургии, Университет Юстуса Либиха, Гиссен, Германия.
- PMID: 28009798
- DOI:
10.
 1097/BPO.0000000000000921
1097/BPO.0000000000000921
Геррит С. Майер и др. J Pediatr Orthop. 2019 Январь
. 2019 Январь; 39 (1): 51-54.
doi: 10.1097/BPO.0000000000000921.
Авторы
Геррит С Майер 1 , Джордже Лазович 1 , Уве Маус 1 , Клаус Э. Рот 2 , Константин Хорас 3 , Йорн Б. Сигер 4
Принадлежности
- 1 Университетская клиника ортопедической хирургии, Больница Пия, Университет Карла фон Осецкого, Ольденбург.

- 2 Кафедра ортопедической хирургии, Университет Иоганна Гутенберга, Майнц.
- 3 Отделение ортопедической хирургии, König Ludwig Haus, Университет Юлиуса-Максимилиана, Вюрцбург.
- 4 Кафедра ортопедической хирургии, Университет Юстуса Либиха, Гиссен, Германия.
- PMID: 28009798
- DOI: 10.1097/BPO.0000000000000921
Абстрактный
Фон: Дефицит витамина D может привести к рахиту и гипокальциемии в младенческом и детском возрасте. Растет интерес к роли витамина D в отношении здоровья костей у детей. Рассекающий остеохондроз (ОД) — распространенное заболевание, поражающее различные суставы. На сегодняшний день точная этиология ОП остается невыясненной. Цель этого исследования состояла в том, чтобы оценить возможную связь дефицита витамина D и ювенильной ОЗ.
Растет интерес к роли витамина D в отношении здоровья костей у детей. Рассекающий остеохондроз (ОД) — распространенное заболевание, поражающее различные суставы. На сегодняшний день точная этиология ОП остается невыясненной. Цель этого исследования состояла в том, чтобы оценить возможную связь дефицита витамина D и ювенильной ОЗ.
Методы: Проведен ретроспективный обзор карт за период с 2010 по 2015 г. всех ортопедических пациентов с исходным диагнозом ювенильного ОЗ, поступивших на оперативное лечение по поводу ОЗ. Были получены демографические данные пациента, история болезни, информация о спортивной активности (при наличии) и уровне витамина D (25-OH-D) в сыворотке на дату поступления. Для статистического сравнения мы измерили исходную распространенность недостаточности витамина D у ортопедических пациентов соответствующего возраста, поступающих в отделение детской ортопедии.
Полученные результаты: Всего в исследование было включено 80 пациентов. В целом, у 97,5% (n=78) протестированных пациентов в группе передозировки уровень витамина D в сыворотке крови был ниже рекомендуемого порога 30 нг/мл (среднее значение 10,1 нг/мл (±6,7 нг/мл)). Более 60% (n=49) страдали дефицитом витамина D, у 29 пациентов (37%) уровень в сыворотке крови был ниже 10 нг/мл, что соответствует серьезному дефициту витамина D. Следует отметить, что только у 2 пациентов (2,5%) уровень витамина D в сыворотке крови превышал рекомендуемый порог в 30 нг/мл. Не было обнаружено статистических различий в отношении уровня спортивной активности до появления симптомов (P = 0,09).). Статистический анализ выявил значительную разницу в уровне витамина D между пациентами с ПД и пациентами без ПД (P = 0,026).
В целом, у 97,5% (n=78) протестированных пациентов в группе передозировки уровень витамина D в сыворотке крови был ниже рекомендуемого порога 30 нг/мл (среднее значение 10,1 нг/мл (±6,7 нг/мл)). Более 60% (n=49) страдали дефицитом витамина D, у 29 пациентов (37%) уровень в сыворотке крови был ниже 10 нг/мл, что соответствует серьезному дефициту витамина D. Следует отметить, что только у 2 пациентов (2,5%) уровень витамина D в сыворотке крови превышал рекомендуемый порог в 30 нг/мл. Не было обнаружено статистических различий в отношении уровня спортивной активности до появления симптомов (P = 0,09).). Статистический анализ выявил значительную разницу в уровне витамина D между пациентами с ПД и пациентами без ПД (P = 0,026).
Выводы: Мы обнаружили неожиданно высокую распространенность дефицита витамина D у несовершеннолетних с диагнозом OD со значительно более низким средним уровнем 25-OH-D по сравнению с контрольной группой. Эти результаты позволяют предположить, что дефицит витамина D потенциально связан с развитием OD. Таким образом, дефицит витамина D может быть важным кофактором многофакторного развития ювенильной ОЗ. По этой причине добавление витамина D может быть не только потенциальной дополнительной терапией, но и возможным профилактическим фактором у пациентов с ювенильной ОЗ. Однако для подтверждения этих предварительных данных необходимы будущие проспективные исследования.
Эти результаты позволяют предположить, что дефицит витамина D потенциально связан с развитием OD. Таким образом, дефицит витамина D может быть важным кофактором многофакторного развития ювенильной ОЗ. По этой причине добавление витамина D может быть не только потенциальной дополнительной терапией, но и возможным профилактическим фактором у пациентов с ювенильной ОЗ. Однако для подтверждения этих предварительных данных необходимы будущие проспективные исследования.
Уровень доказательств: Уровень III — это исследование случай-контроль.
Похожие статьи
Дефицит витамина D у больных идиопатическим и травматическим расслаивающим остеохондритом таранной кости.
Fraissler L, Boelch SP, Schäfer T, Walcher M, Arnholdt J, Maier G, Jakob F, Rudert M, Horas K. Фрайсслер Л.
 и соавт.
Стопа лодыжки Int. 2019Ноябрь; 40 (11): 1309-1318. дои: 10.1177/1071100719864325. Epub 2019 2 августа.
Стопа лодыжки Int. 2019.
PMID: 31370694
и соавт.
Стопа лодыжки Int. 2019Ноябрь; 40 (11): 1309-1318. дои: 10.1177/1071100719864325. Epub 2019 2 августа.
Стопа лодыжки Int. 2019.
PMID: 31370694Связана ли недостаточность или дефицит витамина D с развитием расслаивающего остеохондрита?
Брунс Дж., Вернер М., Сойка М. Брунс Дж. и др. Knee Surg Sports Traumatol Artrosc. 2016 май; 24(5):1575-9. doi: 10.1007/s00167-014-3413-7. Epub 2014 5 ноября. Knee Surg Sports Traumatol Artrosc. 2016. PMID: 25371231
Статус витамина D у египетских пациентов с ювенильной системной красной волчанкой.
Гарф К.Е., Марзук Х., Фараг Ю., Рашид Л., Гарф А.Е. Гарф К.Е. и соавт. Ревматол Интерн. 2015 сен;35(9):1535-40.
 doi: 10.1007/s00296-015-3245-x. Epub 2015 15 марта.
Ревматол Интерн. 2015.
PMID: 25773657
doi: 10.1007/s00296-015-3245-x. Epub 2015 15 марта.
Ревматол Интерн. 2015.
PMID: 25773657Эффективность и безопасность витамина D в отношении здоровья костей.
Крэнни А., Хорсли Т., О’Доннелл С., Вейлер Х., Пуил Л., Оои Д., Аткинсон С., Уорд Л., Мохер Д., Хэнли Д., Фанг М., Язди Ф., Гэрритти С., Сэмпсон М., Барроумен Н., Церцвадзе А, Мамаладзе В. Крэнни А. и др. Evid Rep Technol Assess (полный представитель). 2007 г., август; (158): 1-235. Evid Rep Technol Assess (полный представитель). 2007. PMID: 18088161 Бесплатная статья ЧВК. Обзор.
Уровни витамина D у ирландских детей с переломами: проспективное исследование случай-контроль с 5-летним наблюдением.
Мур Д.М., О’Салливан М.
3 Обзор. , Кили П., Ноэль Дж., О’Тул П., Кеннеди Дж., Мур Д.П., Келли П.
Мур Д.М. и соавт.
Врач хирург. 2022 апр; 20(2):71-77. doi: 10.1016/j.surge.2021.02.015. Epub 2021 24 апр.
Врач хирург. 2022.
PMID: 33
, Кили П., Ноэль Дж., О’Тул П., Кеннеди Дж., Мур Д.П., Келли П.
Мур Д.М. и соавт.
Врач хирург. 2022 апр; 20(2):71-77. doi: 10.1016/j.surge.2021.02.015. Epub 2021 24 апр.
Врач хирург. 2022.
PMID: 33
Посмотреть все похожие статьи
Цитируется
Рассекающий остеохондрит коленного сустава: эпидемиология, этиология и естественное течение.
Турати М., Ангхильери Ф.М., Бигони М., Ригамонти Л., Терсье С., Николау Н., Аккадблед Ф. Турати М. и соавт. Джей Чайлд Ортоп. 2023 февраль;17(1):40-46. дои: 10.1177/18632521221149063. Epub 2023 28 января. Джей Чайлд Ортоп. 2023. PMID: 36755551 Бесплатная статья ЧВК. Обзор.
Актуальная информация о рассекающем остеохондрозе коленного сустава.

Тудиско К., Бернарди Г., Манисера М.Т., Де Майо Ф., Горголини Г., Фарсетти П. Тудиско С. и др. Ортоп Рев (Павия). 2022 17 декабря; 14 (5): 38829. doi: 10.52965/001c.38829. Электронная коллекция 2022. Ортоп Рев (Павия). 2022. PMID: 36540072 Бесплатная статья ЧВК.
Ретроградное сверление при остеохондральном поражении таранной кости у пациентов несовершеннолетнего возраста.
Икута Ю., Накаса Т., Ота Ю., Канемицу М., Сумии Дж., Некомото А., Адачи Н. Икута Ю. и др. Ортоп голеностопного сустава. 30 апреля 2020 г.; 5(2):2473011420916139. дои: 10.1177/2473011420916139. Электронная коллекция 2020 апр. Ортоп голеностопного сустава. 2020. PMID: 35097373 Бесплатная статья ЧВК.
Роль витамина D и дефицита витамина D в ортопедии и травматологии — описательный обзор литературы.

Майер Г.С., Вайссенбергер М., Рудерт М., Рот К.Е., Хорас К. Майер Г.С. и соавт. Энн Трансл Мед. 2021 Июн;9(11):942. дои: 10.21037/атм-21-779. Энн Трансл Мед. 2021. PMID: 34350257 Бесплатная статья ЧВК. Обзор.
Лечение двустороннего расслаивающего остеохондрита блока у пациента с незрелым скелетом.
Эйхман Э.А., Харрис Б.Т., Буррус М.Т. Эйхман Э.А. и соавт. BMJ Case Rep. 2021 27 января; 14 (1): e239849. doi: 10.1136/bcr-2020-239849. Представитель BMJ, 2021 г. PMID: 33504536 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
термины MeSH
вещества
Полнотекстовые ссылки
Вольтерс Клювер
Укажите
Формат: ААД АПА МДА НЛМ
Отправить по номеру
минералы и кормовые ингредиенты могут помочь свести к минимуму остеохондроз
Ряд минералов и кормовых ингредиентов, используемых по отдельности или в комбинации, может помочь свести к минимуму остеохондроз. Группа исследователей из Канзасского государственного университета (KSU) пришла к выводу, что предварительные данные свидетельствуют о том, что кормление определенными минеральными добавками или кормовыми ингредиентами может снизить частоту хромоты у свиноматок. Хромота или остеохондроз затрагивают приблизительно 85-90% всех свиней. Остеохондроз,
Группа исследователей из Канзасского государственного университета (KSU) пришла к выводу, что предварительные данные свидетельствуют о том, что кормление определенными минеральными добавками или кормовыми ингредиентами может снизить частоту хромоты у свиноматок. Хромота или остеохондроз затрагивают приблизительно 85-90% всех свиней. Остеохондроз,
Джо Вансикл | 15 января 2007 г.
Ряд минералов и кормовых ингредиентов, используемых отдельно или в комбинации, могут помочь свести к минимуму остеохондроз.
Группа исследователей Канзасского государственного университета (KSU) пришла к выводу, что предварительные данные свидетельствуют о том, что кормление определенными минеральными добавками или кормовыми ингредиентами может снизить частоту хромоты у свиноматок.
Хромота или остеохондроз поражает примерно 85-90% всех свиней. Остеохондроз, одна из двух основных причин выбраковки свиноматок, представляет собой неспособность хряща полностью развиться в кость, оставляя участок хряща открытым.
Состояние очень болезненное из-за большого количества нервных окончаний, которые необходимы для поддержания равновесия и движения, говорит Джим Нельсен, специалист по свиноводству KSU Extension и один из авторов исследовательской группы.
Но он предупреждает, что в этом отчете представлены очень предварительные данные, и потребуются дополнительные исследования, прежде чем можно будет дать окончательные рекомендации.
Для получения более подробной информации об этом исследовании, включенном в отчет о ходе проведения Дня свинины КГУ за 2006 год, перейдите на сайт www.asi.ksu.edu/swine и прокрутите вниз до раздела «Отчеты о Дне свиньи».
Выявление хромоты
Два основных изменения в хряще, выявленные при остеохондрозе, — это потеря двух важных типов белков в хряще: протеогликанов и коллагена II типа. При недостатке этих двух белков способность хряща к самовосстановлению снижается.
Этот дефицит вызывает структурные изменения основного хряща, что приводит к образованию аномалий, снижающих способность суставной поверхности выдерживать вес животного (см. рисунок).
рисунок).
Несколько исследований не выявили связи между скоростью роста и остеохондрозом.
KSU провел эксперимент по изучению пищевых ингредиентов в метаболизме хрящей и костей на предмет их роли в количестве и тяжести поражений, вызванных остеохондрозом, у свиней на доращивании.
Исследование
Восемьдесят PIC-свинок весом 86 фунтов были подвергнуты тестированию в ходе 84-дневного исследования и назначены на один из восьми видов лечения: ).
Замена CWG 3,5% рыбьим жиром, который является источником жирных кислот, играющих важную роль в развитии иммунной системы. Рыбий жир снижает экспрессию генов соединений, участвующих в воспалительных реакциях.
Содержит пролин и глицин, которые служат заменимыми аминокислотами, входящими в состав основных частей коллагена, волокнистого белка, содержащегося в соединительной ткани и костях.
Дополнение аминокислот лейцином, изолейцином и валином, которые являются высококонцентрированными белками, содержащимися в хрящах. Эти элементы могут быть вовлечены в предотвращение чрезмерной потери белка из-за периодов стресса.
Эти элементы могут быть вовлечены в предотвращение чрезмерной потери белка из-за периодов стресса.
Добавление кремния в количестве 1000 частей на миллион, вещества, стимулирующего образование коллагена для увеличения минеральной плотности костей.
Обеспечение 250 частей на миллион. и 100 частей на миллион. меди и марганца, соответственно, которые, как доказано, стабилизируют и поддерживают структуру кости.
Дополнение рациона питания метионином и треонином, которые, как было доказано, способствуют выработке коллагена.
Комбинация ингредиентов, протестированных в рационах 2-7.
В конце испытания свиней взвесили и доставили в мясную лабораторию КГУ, где левые задние ноги свинок были проанализированы на наличие поражений, вызванных остеохондрозом.
Левая бедренная кость была проверена на наличие аномалий хряща, а суставы были проверены на наличие аномалий и поражений хряща.
Оценка костей и суставов
Как показано в Таблице 1, свиньи, получавшие рационы, содержащие рыбий жир или кремний, как правило, имели более высокие баллы тяжести внешних аномалий по сравнению со свиньями, получавшими другие виды диетического питания.
Свиньи, получавшие высокие уровни метионина/треонина, меди, марганца или кремния, как правило, имели более низкие показатели тяжести поражения хряща по сравнению с контрольной группой или другими диетическими группами.
Более того, свиньи, получавшие рацион с высоким содержанием метионина/треонина или комбинированный рацион, содержащий все ингредиенты, как правило, имели более низкие общие показатели тяжести заболевания, чем свиньи, получавшие контрольный рацион или рыбий жир, говорит Нельсен.
Кроме того, у свиней, получавших дополнительный медь-марганец, метонин/треонин или рацион, содержащий все ингредиенты, были зарегистрированы более низкие общие баллы тяжести по сравнению с десятками свиней, получавших контрольный рацион или рацион с рыбьим жиром.
Свиньи, получавшие рацион с добавлением аминокислот, имели более низкие показатели внешней и общей тяжести по сравнению с другими группами, но свиньи, получавшие рацион, содержащий минералы (кремний или медь и марганец), как правило, имели более низкие показатели повреждения хряща и более низкие общие показатели тяжести.
Резюме
Высокие уровни метионина/треонина имеют тенденцию снижать общую оценку тяжести, в то время как кормовые ингредиенты в сочетании с кремнием, медью и марганцем могут уменьшать тяжесть поражений, вызванных остеохондрозом.
Считается, что метионин/треонин оказывает косвенное влияние на метаболизм хряща. Метионин может способствовать росту хрящей, а треонин может превращаться в глицин, что связано с выработкой коллагена.
«Кормовые ингредиенты, такие как метионин/треонин, медь и марганец, кремний или комбинация этих ингредиентов, которые участвуют в метаболизме хрящей и костей, могут помочь снизить заболеваемость остеохондрозом, либо положительно влияя на метаболизм хрящей/костей, либо предотвращая избыточная деградация хряща», — говорит Нельсен.
Другими учеными КГУ, внесшими свой вклад в эту исследовательскую работу, были: Н.З. Франц; Г.А. Эндрюс, доктор ветеринарной медицины; М. Д. Токач; Дж. М. Деруши; С. С. Дритц, DVM; и Р. Д. Гудбэнд.
| Лечение | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Пункт | Контроль | Рыбий жир | Pro/ Гли | BCAA i | Кремний | Cu/Mn | Meth/Thr | Все b | Всего животных/лечение | 10 | 10 | 10 | 10 | 10 | 9 | 10 | 10 |
| Животные с поражениями | 9 | 9 | 9 9 0436 | 9 | 6 | 7 | 7 | 7 | ||
| Общий балл | ||||||||||
| Всего лиц b | 5,9 | 90 437 6,23,6 | 5,6 | 3,4 | 3,9 | 4,4 | 4,3 | |||
| Всего аномалий c | 8,7 | 8,8 | 5,6 | 7,0 | 5,9 | 5,7 904 36 | 5,7 | 5,7 | ||
| . | 3,9 FG | 3,3 FG | 3,0 г | 2,8 г | ||||||
| Общий балл 8 | 15,0 фг | 8,8 гх | 12,4 фг | 8,4 гх | 6,4 ч | 6,6 90 067 h | 7,0 h | |||
| a Каждое значение является средним из 9 или 10 повторений , с одной свиньей на загон, первоначально 86 фунтов и конечный вес. 290 фунтов | ||||||||||
| b Всего лиц с повреждениями суставного хряща и зоны роста, оценка 12 поверхностей среза. | ||||||||||
| c Сумма внешних аномалий, суставных поверхностей и поверхностей пластинок роста. | ||||||||||
| d Сумма баллов тяжести для наружных поверхностей, суставных хрящей и пластинок роста. | ||||||||||
e Рассчитывается как количество аномалий, умноженное на серьезность для каждого местоположения, а затем суммируется. | ||||||||||
 Как это может помочь в решении проблемы остеохондроза? Такой метод несколько менее эффективный, однако прием всего 1–2-ух видов лекарств в соответствии с расписанием гораздо более легкий, чем следить за свои рационом и принимать 9–12 разных типов таблеток строго по времени.
Как это может помочь в решении проблемы остеохондроза? Такой метод несколько менее эффективный, однако прием всего 1–2-ух видов лекарств в соответствии с расписанием гораздо более легкий, чем следить за свои рационом и принимать 9–12 разных типов таблеток строго по времени.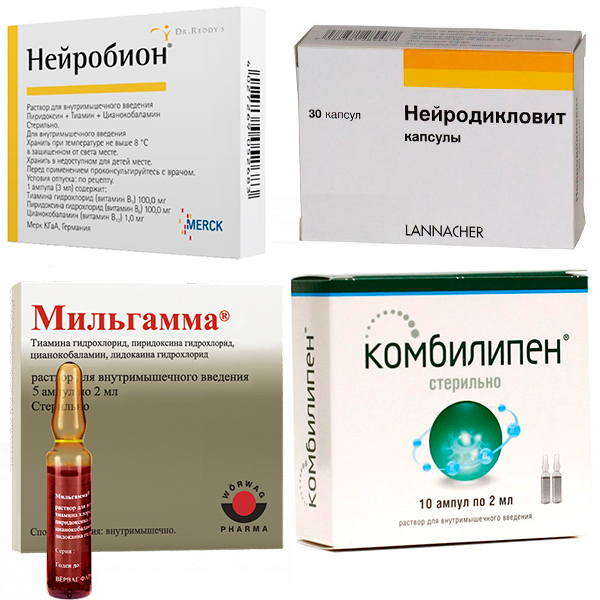
 1097/BPO.0000000000000921
1097/BPO.0000000000000921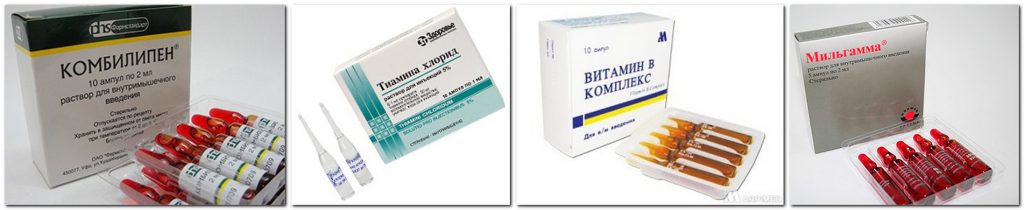
 и соавт.
Стопа лодыжки Int. 2019Ноябрь; 40 (11): 1309-1318. дои: 10.1177/1071100719864325. Epub 2019 2 августа.
Стопа лодыжки Int. 2019.
PMID: 31370694
и соавт.
Стопа лодыжки Int. 2019Ноябрь; 40 (11): 1309-1318. дои: 10.1177/1071100719864325. Epub 2019 2 августа.
Стопа лодыжки Int. 2019.
PMID: 31370694 doi: 10.1007/s00296-015-3245-x. Epub 2015 15 марта.
Ревматол Интерн. 2015.
PMID: 25773657
doi: 10.1007/s00296-015-3245-x. Epub 2015 15 марта.
Ревматол Интерн. 2015.
PMID: 25773657 , Кили П., Ноэль Дж., О’Тул П., Кеннеди Дж., Мур Д.П., Келли П.
Мур Д.М. и соавт.
Врач хирург. 2022 апр; 20(2):71-77. doi: 10.1016/j.surge.2021.02.015. Epub 2021 24 апр.
Врач хирург. 2022.
PMID: 33
, Кили П., Ноэль Дж., О’Тул П., Кеннеди Дж., Мур Д.П., Келли П.
Мур Д.М. и соавт.
Врач хирург. 2022 апр; 20(2):71-77. doi: 10.1016/j.surge.2021.02.015. Epub 2021 24 апр.
Врач хирург. 2022.
PMID: 33