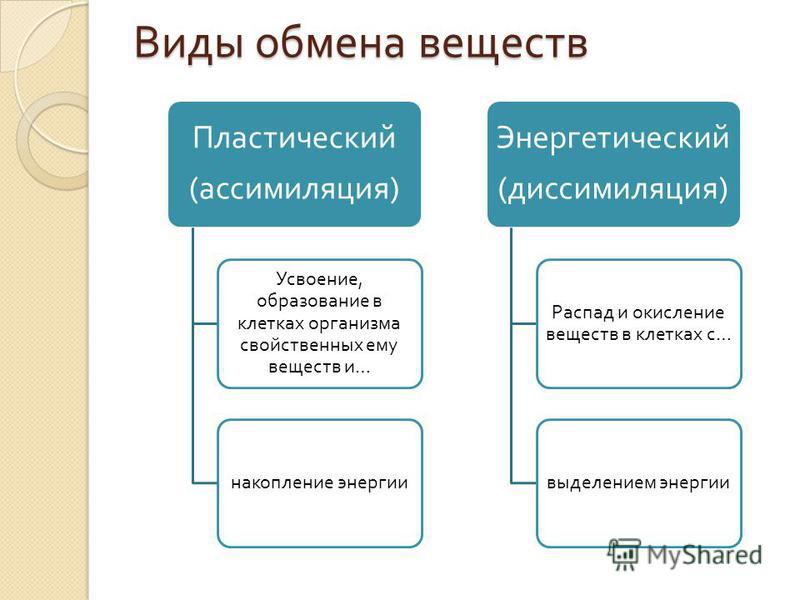
Роль тиамина в поддержании повседневных функций и оптимального здоровья
Человеческое тело нуждается в различных витаминах, чтобы функционировать должным образом. Одной из наиболее важных групп витаминов, которые помогают поддерживать здоровье, являются витамины группы В, в которую входят витамины В1, В2, В3, В5, В6, В7, В9 и В12.
Витамины группы В участвуют в поддержании когнитивной функции, нервной системы и здоровья мозга, а также кроветворения.
Витамин В1, также называемый тиамином, содержится во многих продуктах, и жизненно важен для нормального функционирования организма.
Тиамин обеспечивает нормальную деятельность нервной, сердечно-сосудистой и мышечной систем. Он также важен для осуществления различных ферментативных процессов и углеводного обмена.
Пищевые источники тиамина включают в себя спаржу, говядину, свинину, печень, сухое молоко, орехи, овес, апельсины, яйца, семена (подсолнечник и лен), бобовые (чечевица и горох), дрожжи, брокколи, лук, зеленую фасоль, морковь, капусту, помидоры, зеленый горошек, зелень свеклы, брюссельскую капусту, шпинат, баклажаны. Ряд пищевых продуктов (рис, макароны, хлеб, крупы, хлопья и мука) специально обогащают тиамином.
Ряд пищевых продуктов (рис, макароны, хлеб, крупы, хлопья и мука) специально обогащают тиамином.
На самом деле, практически все пищевые продукты содержат некоторое количество тиамина. Считается, что 50 % продуктов, регулярно используемых в пищу, могут быть отнесены к хорошим, очень хорошим или отличным источникам витамина B1. В этом контексте может показаться странным, что дефицит витамина В1 является одним из наиболее распространенных в различных странах.
Причина такого высокого риска дефицита, несмотря на доступность витамина B1 в пищевых продуктах, кроется в обработке/переработке пищевых продуктов. Витамин В1 подвержен разрушению при современной системе производства продуктов питания. На каждом этапе пути, от хранения до переработки и приготовления пищи, продукты теряют большую часть витамина В1.
Тиамин разрушается под воздействием тепла. Традиционные методы приготовления продуктов и использование микроволновой печи, в том числе для разогрева блюд, уменьшают содержание витамина B1 в пище примерно на 20-50%. При температуре 205°C тиамин практически полностью разрушается в течение одного часа.
При температуре 205°C тиамин практически полностью разрушается в течение одного часа.
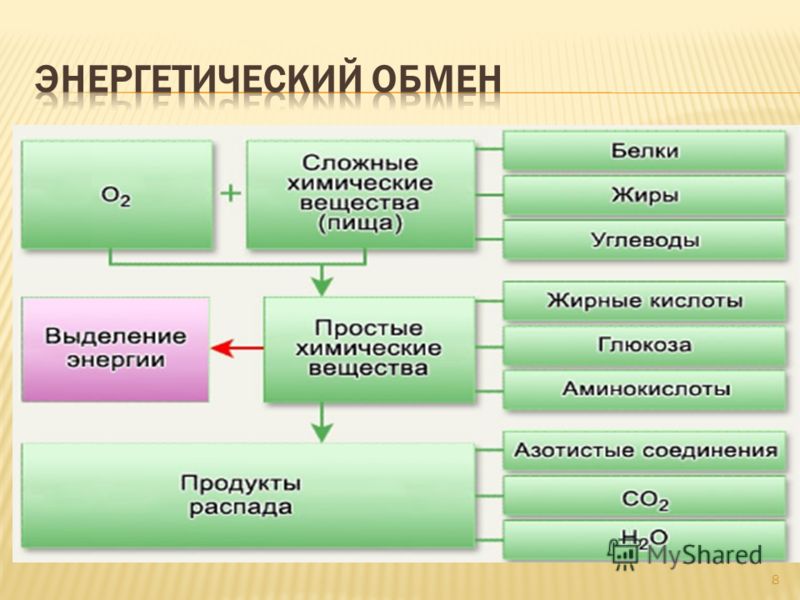
Как и другие витамины группы В, витамин В1 важен при производстве энергии из углеводов и жиров, содержащихся в пище. Тиамин благотворно влияет на состояние людей с заболеваниями сердца, нарушениями обмена веществ, катарактой, глаукомой и др. Многие исследования подтверждают, что тиамин может улучшать когнитивные функции пациентов с болезнью Альцгеймера. Тиамин иногда называют «антистрессовым» витамином, он может поддерживать позитивный психический настрой, предотвращать потерю памяти, улучшать способности к обучению, бороться со стрессом и повышать энергию. Также витамин В1 может предотвращать катаракту, ожирение и нарушения обмена веществ у крыс. Некоторые исследователи считают, что витамин В1 может улучшить состояние пациентов при нарушении обмена веществ.
Таким образом, витамин B1 играет центральную роль в энергетическом обмене, а его недостаток нарушает почти все важные функции в организме. Известно, что тяжелый и длительный дефицит витамина B1 – хотя он и встречается крайне редко — влияет на нервную систему, сердечную и пищеварительную системы, а также на другие системы организма.
Известно, что тяжелый и длительный дефицит витамина B1 – хотя он и встречается крайне редко — влияет на нервную систему, сердечную и пищеварительную системы, а также на другие системы организма.
Учитывая, что мозг является одним из самых энергозатратных органов человеческого организма, неудивительно, что дефицит витамина B1 обычно приводит к большим проблемам в центральной нервной системе. Также тиамин играет ключевую роль в структуре и целостности клеток мозга. Если дефицит тиамина очень выраженный, или возникает в критический период развития мозга, повреждение может быть довольно серьезным.
Люди, перенесшие бариатрические операции, имеющие такие заболевания, как ВИЧ/СПИД, хронический алкоголизм, сердечная недостаточность, люди с заболеваниями желудочно-кишечного тракта, диабетом, или употребляющие диуретик фуросемид (Lasix), а также пожилые люди, подвержены риску дефицита тиамина.
Дефицит тиамина может привести к появлению специфических расстройств, таких как синдром бери-бери, приводящий к поражению нервной и сердечно-сосудистой систем, отекам; синдром Вернике-Корсакова — состоянию, которое проявляется в форме двигательных нарушений, параличей глаз, бреда.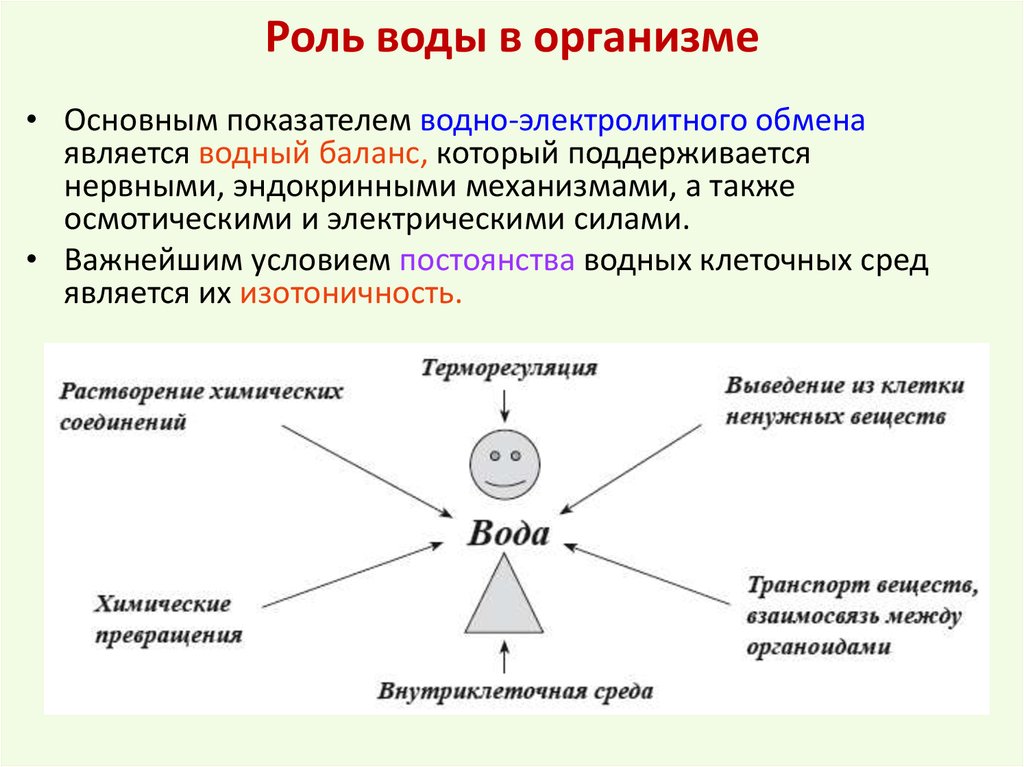
Другие проявления дефицита витамина B1 обычно включают в себя симптомы депрессии, эмоциональной нестабильности, нежелательное поведение, боязливость, возбуждение, слабость, головокружение, бессонница, потеря памяти, периферическую невропатию, сонофобию, боли в спине, мышечную атрофию, миалгии, тошноту, рвоту и запоры.
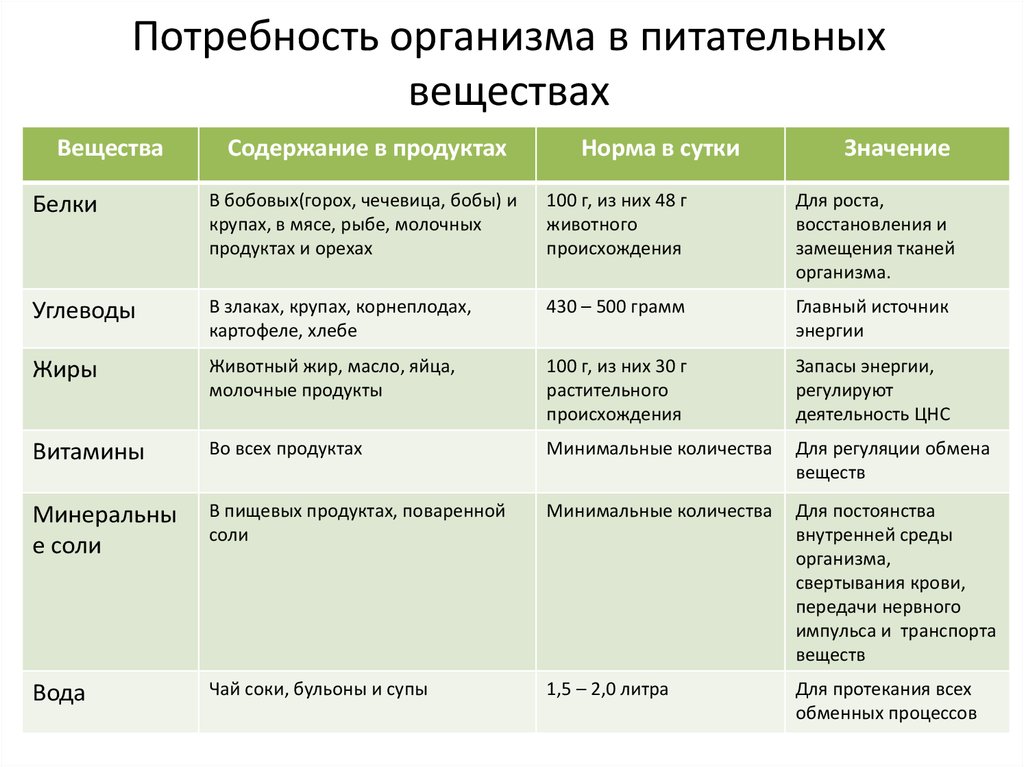
Уточненная физиологическая потребность в тиамине для взрослых составляет 1,5 мг в сутки, для детей – от 0,3 до 1,5 мг в сутки. Верхний допустимый уровень потребления не установлен.
Большинство людей получают необходимую суточную дозу витамина B1, употребляя здоровую пищу. Также можно использовать биологически активные добавки к пище, содержащие витамины группы В. Поскольку витамины группы В растворимы в воде, вероятность передозировать их достаточно низкая, наш организм выделяет избыточное количество витаминов группы В, в том числе тиамина, с мочой.
Перед применением биологически активных добавок необходимо проконсультироваться с врачом.
Источник: https://ods.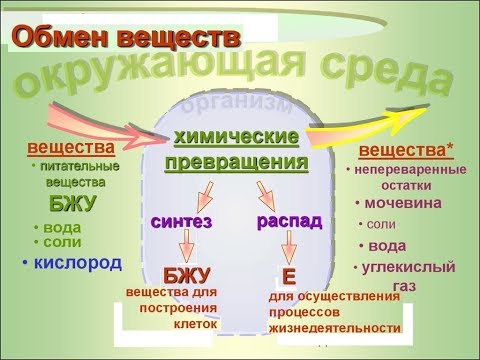 od.nih.gov/factsheets/Thiamin-HealthProfessional/
od.nih.gov/factsheets/Thiamin-HealthProfessional/
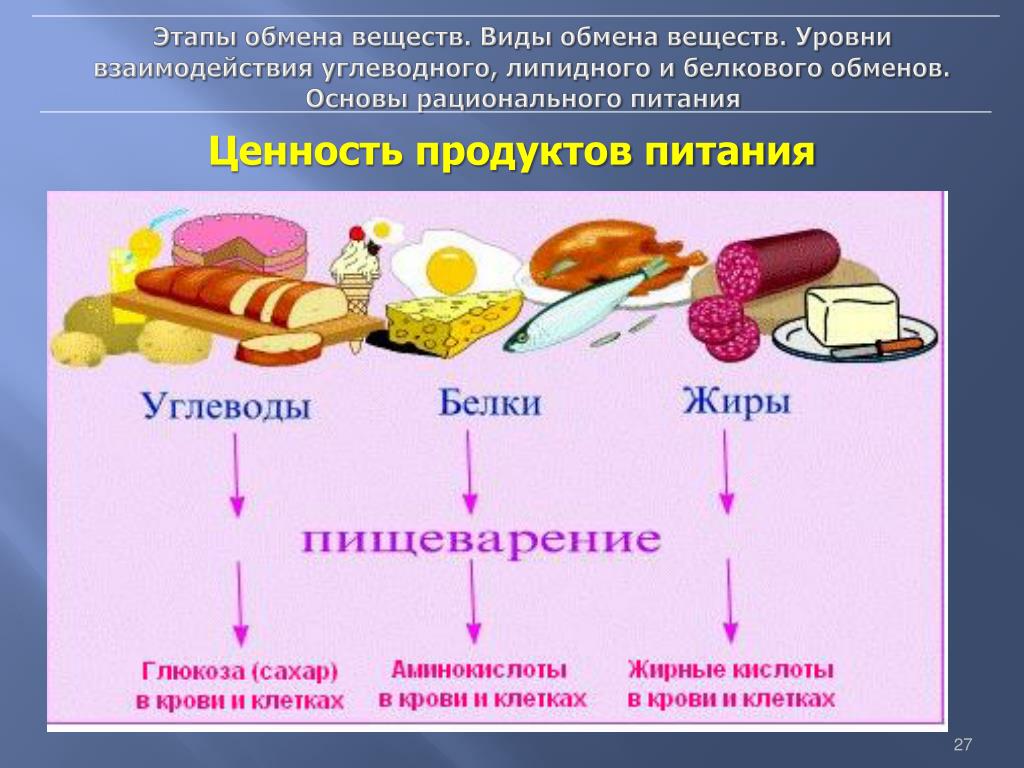
Незаменимые жирные кислоты. Белки. Незаменимые аминокислоты.
Обновлено: 05.10.2022
Среди пищевых веществ есть такие, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми, или эссенциальными.Они обязательно должны поступать с пищей. Отсутствие в рационе любого из них приводит к заболеванию, а при длительном недостатке – и к смерти. В настоящее время науке о питании известно около 50 незаменимых пищевых веществ, которые не могут образоваться в организме и единственным источником их является пища. К незаменимым элементампищичеловекаотносят следующие четыре категории:незаменимые жирные кислоты,незаменимые аминокислоты,витаминыи минеральные соли.
В ходе эволюции человек утратил способность синтезировать почти половину из двадцати аминокислот, входящих в состав белков. К их числу относят те аминокислоты, синтез которых включает много стадий и требует большого количества ферментов, кодируемых многими генами. Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят:
Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят:
Валин (содержится в зерновых,мясе,грибах, молочных продуктах,арахисе,сое)
Изолейцин(содержится в миндале, кешью, курином мясе, турецком горохе (нут), яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.)
Лейцин(содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.)
Лизин(содержится в рыбе, мясе, молочных продуктах, пшенице, орехах.)
Метионин(содержится вмолоке, мясе, рыбе, яйцах, бобах,фасоли, чечевице и сое.)
Треонин(содержится в молочных продуктах и яйцах, в умеренных количествах в орехах и бобах.)
Триптофан(содержится в овсе,бананах, сушёныхфиниках, арахисе, кунжуте, кедровых орехах, молоке,йогурте, твороге, рыбе, курице, индейке, мясе.)
Фенилаланин(содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке. Также является составной частью синтетического сахарозаменителя —аспартама, активно используемого в пищевой промышленности.)
Также является составной частью синтетического сахарозаменителя —аспартама, активно используемого в пищевой промышленности.)
Аргинин(содержится в семенах тыквы, свинине, говядине, арахисе, кунжуте, йогурте, швейцарском сыре.)
Две аминокислоты — аргинин и гистидин — у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты — тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
Как было показано выше, основным источником аминокислот для клеток организма являются белки пищи. В различных пищевых продуктах содержание белка колеблется в широких пределах. Распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
В различных пищевых продуктах содержание белка колеблется в широких пределах. Распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Некоторые их них содержат полный набор незаменимых аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Растительные белки, особенно пшеницы и других злаковых, полностью не перевариваются, так как защищены оболочкой, состоящей из целлюлозы и других полисахаридов, которые не гидролизуются пищеварительными ферментами. Некоторые белки по аминокислотному составу близки к белкам тела человека, но не используются в качестве пищевых, так как имеют фибриллярное строение, малорастворимы и не расщепляются протеазами ЖКТ. К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность — 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность — 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
Линолевая кислота(ω-6 жирная кислота), а такжеарахидоновая кислотаилиноленовая кислотаотносятся к так называемым незаменимымжирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов —триглицеридовифосфатидов. В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многихрастительных масели животных жиров, напримерсоевого,хлопкового,подсолнечного,льняного,конопляногомасел,китового жира. Линолевая кислота является незаменимым питательным веществом, без которого организм не может вырабатывать простагландин Е1(простагландин Е1 -одно из важнейших средств защиты организма от преждевременного старения, заболеваний сердца, различных форм аллергии, рака и многих-многих других).
В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многихрастительных масели животных жиров, напримерсоевого,хлопкового,подсолнечного,льняного,конопляногомасел,китового жира. Линолевая кислота является незаменимым питательным веществом, без которого организм не может вырабатывать простагландин Е1(простагландин Е1 -одно из важнейших средств защиты организма от преждевременного старения, заболеваний сердца, различных форм аллергии, рака и многих-многих других).
Незаменимые жирные кислоты. Белки. Незаменимые аминокислоты.
Незаменимые жирные кислоты (НЖК) обязательно должны содержаться в потребляемой нише, поскольку организм не способен самостоятельно их синтезировать. Недостаток таких кислот приводит к возникновению болезней. Строго говоря, незаменимыми являются только две жирные кислоты — линолевая и а-линоленовая. Обе они являются полиненасыщенными жирными кислотами (ПНЖК) и существуют в цые-форме. Линолевая кислота имеет две двойных связи, а линоленовая — три. Эти кислоты имеют ряд важных функций:
Эти кислоты имеют ряд важных функций:
1. Незаменимые жирные кислоты используются для образования фосфолипидов, которые входят в состав мембран.
2. Незаменимые жирные кислоты кислоты участвуют в транспорте, расщеплении и выведении холестерола. Холестерол является важным компонентом мембран и необходим для синтеза стероидов, в том числе половых гормонов и витамина D. Однако избыток холестерола может быть опасным для здоровья, поскольку он способствует развитию атеросклероза (жировые отложения в артериях), который в свою очередь ведет к сердечно-сосудистым заболеваниям. Таким образом, необходима четкая регуляция метаболизма холестерола. Линолевая и некоторые другие ПНЖК снижают уровень холестерола в крови, тогда как насыщенные жирные кислоты, напротив повышают его. Наилучшая рекомендация в данном случае — по возможности меньшее потребление с пищей насыщенных жирных кислот.
3. Линоленовая кислота уменьшает свертывание крови, связанное с атеросклерозом, а также снижает риск развития повторного инфаркта миокарда.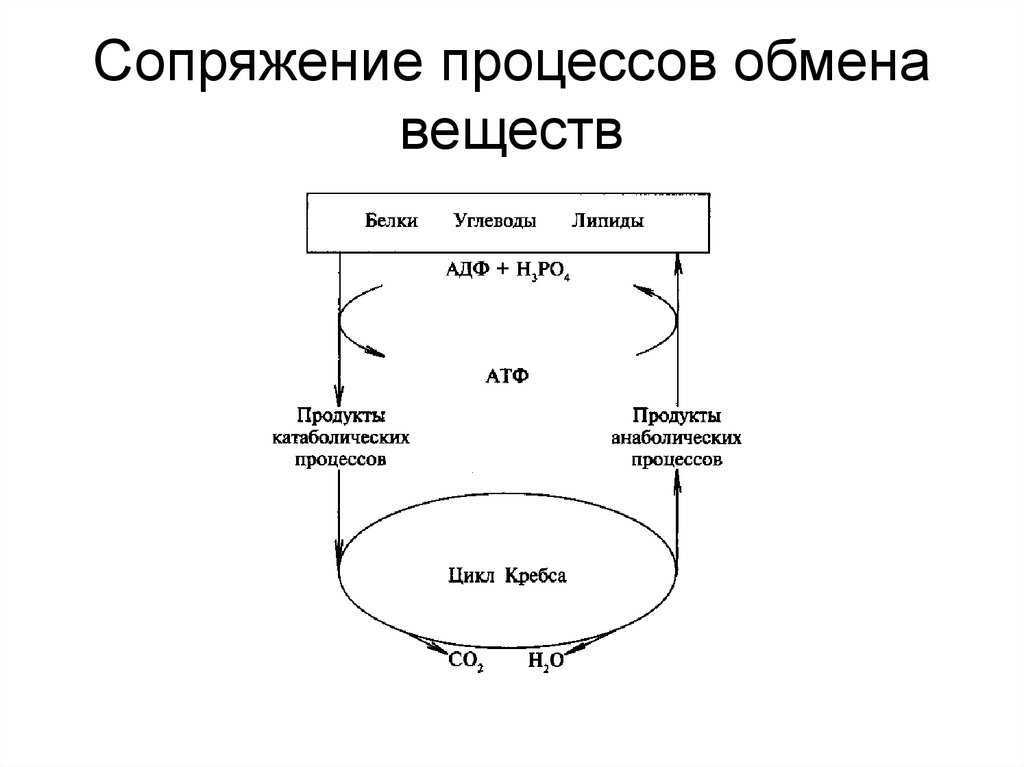
4. Незаменимые жирные кислоты необходимы для синтеза других весьма важных жирных кислот, например простагландинов, обладающих широким спектром физиологических эффектов. Например, они влияют на активность некоторых гормонов, стимулируют воспалительные ответы и регулируют приток крови к органам. Они участвуют в родовом процессе и входят в состав противозачаточных таблеток как антипрогестероновос средство, предотвращающее имплантацию оплодотворенного яйца.
5. Линоленовая кислота является одной из жирных кислот, необходимых для нормального развития и функционирования сетчатки глаза и головного мозга.
Дефицит незаменимых жирных кислот встречается редко, поскольку в организме существует их запас в виде жира, а их ежедневное потребление в виде жиров обычно более чем достаточно.
Белки
Белки в основном необходимы для роста и репаративных процессов. Эти соединения несут самые разнообразные функции. Если диета содержит недостаточное количество углеводов и жиров, то белки могут служить источником энергии.
Белки состоят из аминокислот. Обычно в состав белков входят 20 различных аминокислот, причем подобно жирам, аминокислоты можно разделить на два типа — незаменимые и заменимые.
Незаменимые аминокислоты обязательно должны содержаться в пише, поскольку они либо совсем не синтезируются организмом, либо синтезируются с такой малой скоростью, что это не отвечает потребностям организма. Недостаток этих аминокислот может служить причиной развития разных болезней. Восемь из 20 аминокислот незаменимы для взрослых и 10 — для детей. Заменимые аминокислоты могут синтезироваться в организме из незаменимых. Белки, в составе которых много незаменимых аминокислот, называются белками первого класса или высококачественными белками. К таким белкам относят широко известные животные белки, содержащиеся в молоке и молочных продуктах, мясе, рыбе и яйцах. Вегетарианцам в качестве белка первого класса можно рекомендовать белок сои. Другие белки относят ко второму классу или низкокачественным белкам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота — незаменимая жирная кислота.
Заменимые и незаменимые аминокислоты. Использование белков на энергетические нужды
а) Заменимые и незаменимые аминокислоты. 10 аминокислот, в норме присутствующие в белках животного происхождения, могут быть синтезированы в клетках, в то время как другие 10 не синтезируются или синтезируются в слишком маленьких количествах, не обеспечивающих потребности организма. Группа аминокислот, которые не могут синтезироваться в организме, получила название незаменимых аминокислот. Использование термина «незаменимые аминокислоты» не означает, что другие 10 аминокислот не нужны для образования белка. Этот термин подчеркивает только то, что незаменимые аминокислоты должны обязательно входить в состав продуктов, включенных в пищевой рацион.
Синтез заменимых аминокислот зависит от образования соответствующих кетокислот, которые являются их предшественниками. Например, пировиноградная кислота, которая в большом количестве образуется при гликолитическом расщеплении глюкозы, является кетокислотой — предшественницей аминокислоты аланина. Далее посредством трансаминирования аминогруппа передается а-кетокислоте, a кислород кетокислоты — донору аминогруппы. Эта реакция показана на рисунке ниже.
Синтез аланина из пировиноградной кислоты путем трансаминирования
Обратите внимание, что аминогруппа передается пировиноградной кислоте от глутамина. Он в большом количестве присутствует в тканях, и одна из его основных функций — быть хранилищем аминогрупп. Кроме этого вещества источником аминогрупп могут быть аспарагин, глутаминовая кислота, аспартамовая кислота.
Трансаминирование осуществляется несколькими ферментами, в том числе аминотрансферазами, которые являются производными пиридоксина — одного из витаминов группы В (В6).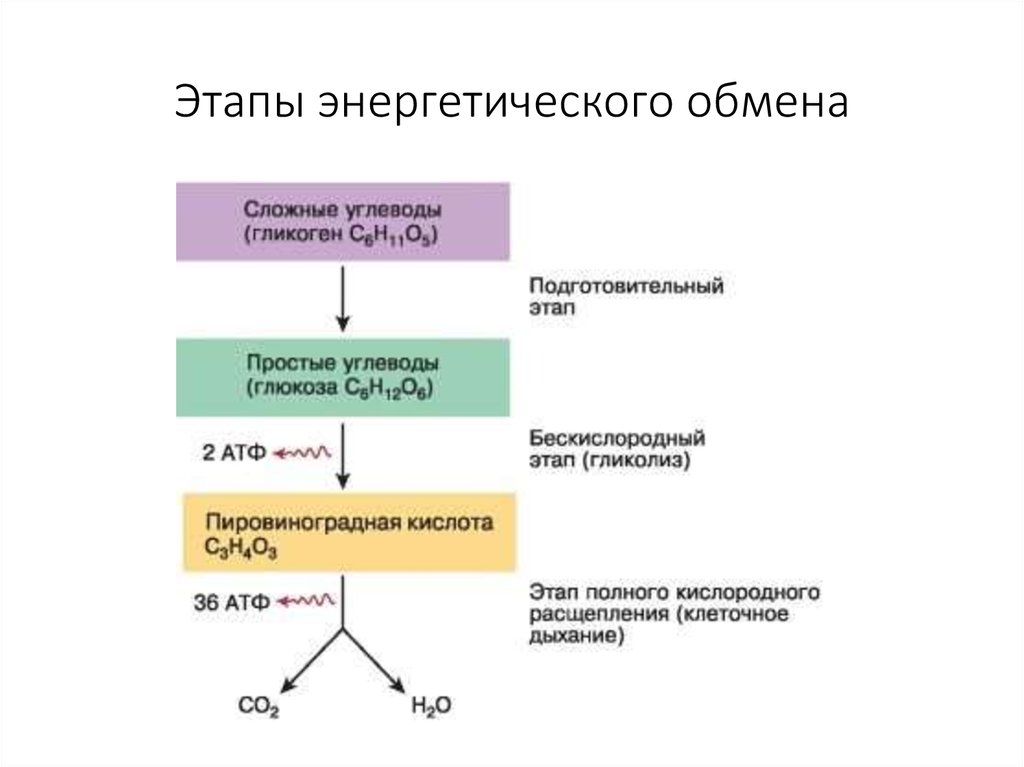 Без этого витамина синтез аминокислот затрудняется, что снижает нормальную продукцию белка.
Без этого витамина синтез аминокислот затрудняется, что снижает нормальную продукцию белка.
Аминокислоты. 10 незаменимых аминокислот, которые не могут синтезироваться в достаточных количествах в организме и должны поступать с пищей, уже готовые.
Использование белков на энергетические нужды
Если клетки вместили такое количество белка, которое соответствует их предельной возможности, то белки, присутствующие в жидких средах организма, начинают расщепляться и использоваться на энергетические нужды либо запасаться, в первую очередь, в виде жиров и, во вторую очередь, в виде гликогена. Расщепление белков осуществляется преимущественно в печени и начинается процессом дезаминирования.
а) Дезаминирование. Это процесс отдачи аминогруппы аминокислотой, в основе которого лежит трансаминирование, т.е. перенос аминогруппы к какому-либо акцептору, что по направлению является реакцией, обратной трансаминированию. В большинстве случаев дезаминирование осуществляется по схеме реакции трансаминирования:
Согласно этой схеме, аминогруппа аминокислоты переносится к α-кетоглутаровой кислоте, которая после этого становится глутаминовой кислотой. Глутаминовая кислота может передавать аминогруппу каким-то веществам либо высвобождать ее в виде аммиака. В процессе утраты аминогруппы глутаминовая кислота вновь становится α-кетоглутаровой кислотой, и цикл может повторяться снова. Чтобы запустить этот процесс, избыток аминокислот в клетках, особенно в клетках печени, должен индуцировать активацию большого количества аминотрансфераз — ферментов, ответственных за начало большинства реакций дезаминирования.
Глутаминовая кислота может передавать аминогруппу каким-то веществам либо высвобождать ее в виде аммиака. В процессе утраты аминогруппы глутаминовая кислота вновь становится α-кетоглутаровой кислотой, и цикл может повторяться снова. Чтобы запустить этот процесс, избыток аминокислот в клетках, особенно в клетках печени, должен индуцировать активацию большого количества аминотрансфераз — ферментов, ответственных за начало большинства реакций дезаминирования.
б) Образование мочевины в печени. Аммиак, выделяющийся при дезаминировании аминокислот, извлекается из крови практически полностью, превращаясь в печени в мочевину. 2 молекулы аммиака и 1 молекула углекислого газа взаимодействуют в соответствии с уравнением окончательной реакции:
Это чрезвычайно токсичное вещество, особенно для мозга, и поэтому такая ситуация приводит к состоянию печеночной комы.
Основные стадии образования мочевины таковы:
После образования мочевина диффундирует из печени в жидкие среды организма и экскретируется почками.
в) Окисление дезаминированных аминокислот. После дезаминирования аминокислот образующиеся кетокислоты в большинстве случаев могут окисляться с выделением энергии для метаболических нужд организма. При этом обычно осуществляются два последовательных процесса:
(1) кетокислоты превращаются в химические вещества, которые могут включаться в цикл лимонной кислоты;
(2) затем эти вещества, расщепляясь в цикле лимонной кислоты, служат источниками энергии аналогично ацетил-КоА, образующегося при метаболизме углеводов и жиров.
В целом при окислении 1 г белка образуется аденозинтрифосфата несколько меньше, чем при окислении 1 г глюкозы.
Глюконеогенез и кетогенез. Конечные продукты, образующиеся при дезаминировании аминокислот, подобны веществам, обычно используемым клетками печени для синтеза глюкозы или жирных кислот. Например, дезаминированный аланин представляет собой пировиноградную кислоту, которая может превращаться в глюкозу или гликоген. Возможен иной путь: превращение в ацетил-КоА, который затем может полимеризоваться в жирные кислоты. Так, 2 молекулы ацетил-КоА, объединяясь, образуют ацетоуксусную кислоту, являющуюся одним из кетоновых тел.
Так, 2 молекулы ацетил-КоА, объединяясь, образуют ацетоуксусную кислоту, являющуюся одним из кетоновых тел.
Превращение аминокислот в глюкозу или гликоген называют глюконеогенезом, а превращение в кето- или жирные кислоты — кетогенезом. Из 20 аминокислот 18 имеют химическую структуру, позволяющую им превращаться в глюкозу, а 19 из них могут превращаться в жирные кислоты.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Незаменимые компоненты пищи. Незаменимые аминокислоты. Пищевая ценность белков. Незаменимые жирные кислоты.
Витамины. Их классификация. Гипо- и гипервитаминозы: причины их возникновения и меры профилактики.
Витамин а и β-каротин. Химическая природа и биологическое значение витамина а. Участие витамина а в акте зрения. Клинические проявления гиповитаминоза а.
Витамин d3: основные источники, образование кальцитриола, механизм действия на обмен кальция. Причины рахита.
Витамин е (токоферол). Участие в обмене веществ.
 Антиоксидантная функция токоферола. Признаки е-авитаминоза.
Антиоксидантная функция токоферола. Признаки е-авитаминоза.Витамин к (нафтохинон). Участие в процессе свертывания крови. Медицинское применение.
Витамин b1 (тиамин). Коферментная форма и участие в обмене веществ. Признаки Bi-гиповитаминоза.
Витамин в2 (рибофлавин). Химическое строение, коферментные формы, участие в обмене веществ. Признаки гиповитаминоза.
Витамин в6 (пиридоксин). Коферментные формы и участие в обмене веществ.
Витамин рр (никотиновая кислота). Химическое строение, коферментные формы, участие в обмене веществ. Признаки гиповитаминоза.
Фолиевая кислота и витамин в12 (кобаламин). Химическая природа и роль в обмене веществ. Клинические проявления недостатка этих витаминов.
Витамин с (аскорбиновая кислота). Химическое строение, биологические функции. Клинические проявления гиповитаминоза.
Структурная организация мембран. Основные компоненты мембран. Строение липидов мембран. Строение и свойства липидного бислоя.

Избирательная проницаемость мембран. Механизмы переноса веществ через мембраны.
Понятие о катаболизме и анаболизме. Цикл адф-атф. Основные пути фосфори- лирования адф и использования атф.
-Структурная организация цепи переноса электронов. Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании.
Сопряжение окисления с фосфорилированием адф в дыхательной цепи. Дыхательный контроль. Коэффициент р/о. Разобщение дыхания и фосфорилирования.
Регуляция цепи переноса электронов (дыхательный контроль). Терморегуляторная функция тканевого дыхания.
Энергетический заряд клетки. Нарушения энергетического обмена: гипоэнерге- тические состояния. Гипоксия как причина гипоэнергетических состояний.
НАД-зависимые дегидрогеназы и их важнейшие субстраты. Строение окисленной и восстановленной форм НАД. Транспорт восстановительных эквивалентов по дыхательной цепи. Движущая сила этого процесса. Коэффициент Р/О.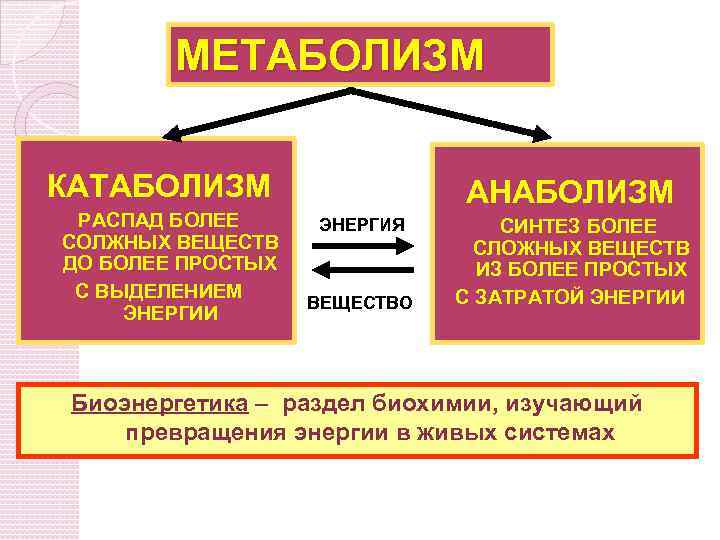
ФАД-зависимые дегидрогеназы и их субстраты. Транспорт восстановительных эквивалентов по дыхательной цепи. Движущая сила этого процесса. Коэффициент Р/О.
Основные стадии освобождения энергии питательных веществ. Специфический и общий пути катаболизма углеводов, белков и жиров. Общий путь катаболизма как основной источник дегидрируемых субстратов для ЦПЭ.
Пировиноградная кислота: пути образования и использования в организме.
Окислительное декарбоксилирование пировиноградной кислоты. Строение пируватдегидрогеназного комплекса. Связь с цпэ. Регуляция.
Цитратный цикл. Последовательность реакций. Связь с цпэ, регуляция биологическая роль.
Углеводы пищи: строение, переваривание. Примеры нарушения переваривания углеводов.
Аэробный распад глюкозы. Последовательность реакций до образования пирувата. Физиологическое значение. Роль аэробного распада глюкозы в мозге.
Анаэробный гликолиз. Последовательность реакций, распространение, физиологическое значение.
Роль анаэробного гликолиза и аэробного процесса при мышечной работе.
Глюконеогенез из молочной кислоты. Глюкозо-лактатный цикл.
Глюконеогенез из аминокислот и глицерина. Биологическое значение.
Аплостерические механизмы регуляции гликолиза и глюконеогенеза в печени. Роль фруктозо-2,6-дифосфата.
Строение, свойства и распространение гликогена. Биосинтез и мобилизация гликогена, зависимость от ритма питания.
Гормональная регуляция обмена гликогена в печени и мышцах.
Наследственные нарушения обмена гликогена.
Изменения обмена глюкозы в печени (синтез и распад гликогена, гликолиз и глюконеогенез) в зависимости от ритма питания и мышечной активности. Роль гормонов в переключении процессов.
Особенности обмена глюкозы в разных органах и клетках: эритроцитах, мозге, мышцах, жировой ткани, печени.
Пентозофосфатный путь превращения глюкозы. Распространение, физиологическое значение.
Значение пентозофосфатного пути превращения глюкозы в эритроцитах.
.Значение пентозофосфатного пути превращения глюкозы в клетках жировой ткани и печени.
Переваривание жиров, ресинтез жиров. Хиломикроны, строение, функция. Г иперхиломикронемия.
Желчные кислоты, строение, функции, синтез. Кишечно-печеночная циркуляция. Желчно-каменная болезнь.
р-окисление жирных кислот. Последовательность реакций, регуляция, биологическое значение.
Биосинтез жирных кислот. Последовательность реакций, регуляция, биологическое значение.
Синтез жиров из углеводов в печени и жировой ткани. Влияние инсулина.
Мобилизация жиров из жировой ткани, биологическая роль, гормональная регуляция.
Депонирование и мобилизация жиров, зависимость от ритма питания. Ожирение.
Лонп, образование, состав, транспортная функция.
Синтез и использование кетоновых тел. Последовательность реакций; биологическая рйль кетоновых тел. Последствия кетонемии.
Холестерин, биологическая роль. Синтез, последовательность реакций до мевалоновой кислоты, регуляция синтеза.
Лнп, образование, транспортные функции. Гиперхолестеринемия.
Лвп, образование, транспортные функции. Роль лхат.
Гиперхолестеринемия: причины, последствия. Биохимические основы патогенеза атеросклероза и основные подходы к лечению.
Полноценные и неполноценные белки. Значение полноценного белкового питания для человека. Переваривание белков в желудочно-кишечном тракте: ферменты, механизм активации, биологическое значение.
Непрямое дезаминирование аминокислот: ферменты, коферменты, биологическое значение процессов. Диагностическое значение определения активности ами- нотрансфераз (трансаминаз).
Катаболизм аминокислот: образование и обезвреживание аммиака в тканях. Токсичность аммиака. Причины и следствия гипераммониемии.
Биосинтез мочевины: последовательность реакций, регуляция, биологическое значение. Гипераммониемия: причины и проявления.
Образование аммиака в почках. Биологическое значение.
Пути обмена безазотистого остатка аминокислот.
 Гликогенные, кетогенные и смешанные аминокислоты. Глюконеогенез из аминокислот. Значение процесса, регуляция.
Гликогенные, кетогенные и смешанные аминокислоты. Глюконеогенез из аминокислот. Значение процесса, регуляция.Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот из глюкозы.
Обмен серина и глицина. Роль н4-фолата и его производных в обмене аминокислот и нуклеотидов.
Обмен метионина: реакции трансметилирования, примеры, биологическое значение. “Путь спасения» метионина.
Метаболизм фенилаланина в организме. Фенилкетонурия: причины, проявления, способы диагностики и профилактики.
Катаболизм тирозина: основные этапы, конечные продукты. Алкаптонурия: причины и проявления.
, Катаболизм гистидина: основные этапы, конечные продукты. Гистидинемия: причины,проявления.
Синтез катехоламинов. Роль витамина В6 и метионина в синтезе катехоламинов. Биологическая роль. Инактивация катехоламинов. Диагностическое значение определения ванилилминдальной кислоты в моче.
Гистамин: образование, биологическая роль. Инактивация гистамина.
Гамк: образование, биологическая роль, инактивация.
Основные этапы синтеза пуриновых нуклеотидов, регуляция. Происхождение атомов пуринового ядра. “Путь спасения” пуриновых оснований. Синдром Леша-Нихана.
Катаболизм пуриновых нуклеотидов: основные этапы, конечные продукты. Причины и проявления гиперурикемии. Подагра.
Биосинтез пиримидиновых нуклеотидов. Последовательность реакций, регуляция. Оротацидурия.
Биосинтез дезоксирибонуклеотидов: субстраты, основные этапы синтеза. Биосинтез тмф, роль н4-фолата в этом процессе. Ингибиторы синтеза дезоксирибонуклеотидов как лекарственные препараты.
-Образование и обезвреживание билирубина. Виды желтух. Диагностическое значение определения билирубина в биологических жидкостях.
Трансмембранная передача сигналов в клетку. Прямой и мембранновнутриклеточный механизмы передачи гормональных сигналов.
Вторичные гормональные посредники (цАмф и цГмф): образование, механизм действия. Примеры метаболических путей, регулируемых этими посредниками.

Вторичные гормональные посредники (посредники липидной природы и Са 2+ ): образование, механизм действия. Примеры метаболических путей, регулируемых этими посредниками.
Читайте также:
- Принятие решений заместителем по умолчанию
- Борьба с мухами цеце. Борьба с трипаносомозом на местности
- Страхование по долгосрочному уходу
- Классификация лимфогранулематоза — морфологические варианты
- Грудные отведения и центральная терминаль Wilson. Усиленные отведения от конечностей
Микроэлементы. Общая информация
Химические элементы в свободном состоянии и в виде множества химических соединений входят в состав всех клеток и тканей человеческого организма. Они являются строительным материалом, важнейшими катализаторами различных биохимических реакций, непременными и незаменимыми участниками процессов роста и развития организма, обмена веществ, адаптации к меняющимся условиям окружающей среды.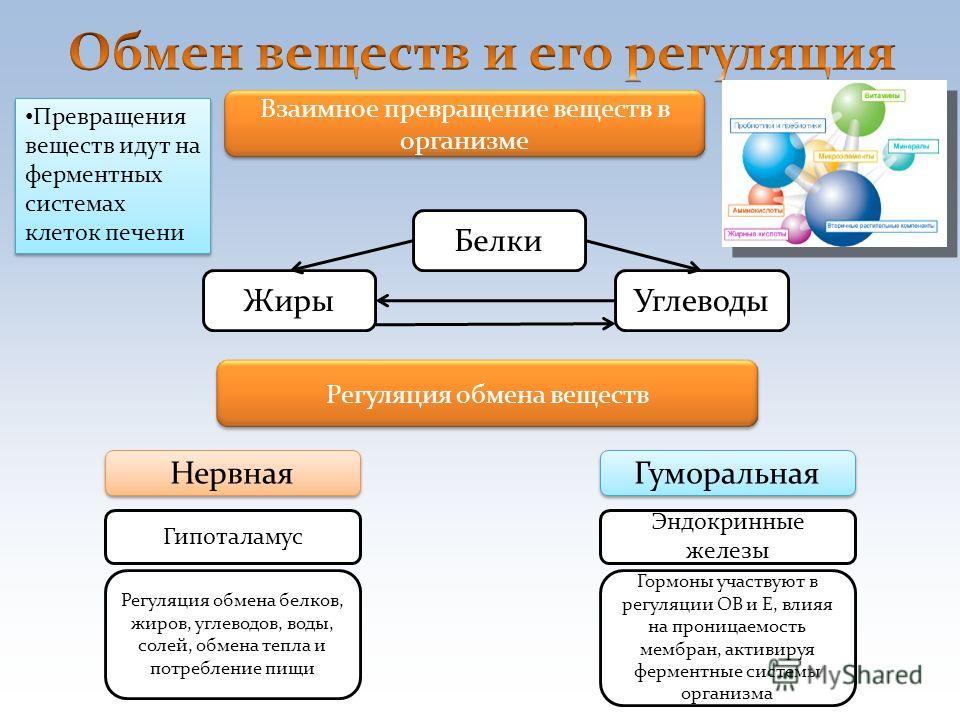
Физиологическое действие различных элементов зависит от их дозы. Поэтому токсичные элементы (мышьяк, ртуть, сурьма, кадмий и др.) при низких концентрациях могут действовать на организм как лекарство (оказывая тем самым саногенетическое воздействие), тогда как натрий, калий, кальций, железо, магний и ряд других элементов в высоких концентрациях могут обладать выраженным токсическим эффектом.
Для осуществления жизненно важных функций у каждого элемента существует оптимальный диапазон концентраций. При дефиците или избыточном накоплении элементов в организме могут происходить серьезные изменения, обуславливающие нарушение активности прямо или косвенно зависящих от них ферментов.
В организме химические элементы находятся преимущественно в виде соединений, избыточное образование или распад которых может приводить к нарушению так называемого металло-лигандного гомеостаза, а в дальнейшем и к развитию патологических изменений. Элементы – металлы и лиганды (например, глутаминовая, аспарагиновая, липоевая, аскорбиновая кислоты) могут выступать в качестве активаторов или ингибиторов различных ферментов, что обусловливает их существенную роль в развитии и терапии различных заболеваний.
Для систематизации сведений о содержании и физиологической роли химических элементов в организме в последние десятилетия был предложен ряд классификаций. Не рассматривая их подробно, остановимся лишь на некоторых принципиальных моментах.
Один из принципов классификации – разделение химических элементов на группы, в зависимости от уровня их содержания в организме человека.
Первую группу такой классификации составляют «макроэлементы», концентрация которых в организме превышает 0,01%. К ним относятся O, C, H, N, Ca, P, K, Na, S, Cl, Mg. В абсолютных значениях (из расчета на среднюю массу тела человека в 70 кг), величины содержания этих элементов колеблются в пределах от сорока с лиш ним кг (кислород) до нескольких г (магний). Некоторые элементы этой группы называют «органогенами» (O, H, С, N, P, S) в связи с их ведущей ролью в формировании структуры тканей и органов.
Вторую группу составляют «микроэлементы» (концентрация от 0,00001% до 0,01%). В эту группу входят: Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, B, Rb. Эти элементы содержатся в организме в концентрациях от сотен мг до нескольких г. Однако, несмотря на малое содержание, микроэлементы не случайные ингредиенты биосубстратов живого организма, а компоненты сложной физиологической системы, участвующей в регулировании жизненных функций организма на всех этапах его развития.
В эту группу входят: Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, B, Rb. Эти элементы содержатся в организме в концентрациях от сотен мг до нескольких г. Однако, несмотря на малое содержание, микроэлементы не случайные ингредиенты биосубстратов живого организма, а компоненты сложной физиологической системы, участвующей в регулировании жизненных функций организма на всех этапах его развития.
В третью группу включены «ультрамикроэлементы», концентрация которых ниже 0,000001%. Это Se, Co, V, Cr, As, Ni, Li, Ba, Ti, Ag, Sn, Be, Ga, Ge, Hg, Sc, Zr, Bi, Sb, U, Th, Rh. Содержание этих элементов в теле человека измеряется в мг и мкг. На данный момент установлено важнейшее значение для организма многих элементов из этой группы, таких как, селен, кобальт, хром и др.
В основе другой классификации лежат представления о физиологической роли химических элементов в организме. Согласно такой классификации макроэлементы, составляющие основную массу клеток и тканей, являются “структурными” элементами. К «эссенциальным» (жизненно-необходимым) микроэлементам относят Fe, I, Cu, Zn, Co, Cr, Mo, Se, Mn, к “условно-эссенциальным” – As, B, Br, F, Li, Ni, Si, V. Жизненная необходимость или эссенциальность (от англ. essential – “необходимый”), является важнейшим для жизнедеятельности живых организмов свойством химических элементов. Химический элемент считается эссенциальным, если при его отсутствии или недостаточном поступлении в организм нарушается нормальная жизнедеятельность, прекращается развитие, становится невозможной репродукция. Восполнение недостающего количества такого элемента устраняет клинические проявления его дефицита и возвращает организму жизнеспособность.
К «эссенциальным» (жизненно-необходимым) микроэлементам относят Fe, I, Cu, Zn, Co, Cr, Mo, Se, Mn, к “условно-эссенциальным” – As, B, Br, F, Li, Ni, Si, V. Жизненная необходимость или эссенциальность (от англ. essential – “необходимый”), является важнейшим для жизнедеятельности живых организмов свойством химических элементов. Химический элемент считается эссенциальным, если при его отсутствии или недостаточном поступлении в организм нарушается нормальная жизнедеятельность, прекращается развитие, становится невозможной репродукция. Восполнение недостающего количества такого элемента устраняет клинические проявления его дефицита и возвращает организму жизнеспособность.
К “токсичным” элементам отнесены Al, Cd, Pb, Hg, Be, Ba, Bi, Tl, к “потенциально-токсичным” – Ag, Au, In, Ge, Rb, Ti, Te, U, W, Sn, Zr и др. Результатом воздействия этих элементов на организм является развитие синдромов интоксикаций (токсикопатий).
Оценка элементного статуса человека является основным вопросом определения влияния на здоровье человека дефицита, избытка или нарушения тканевого перераспределения макро- и микроэлементов.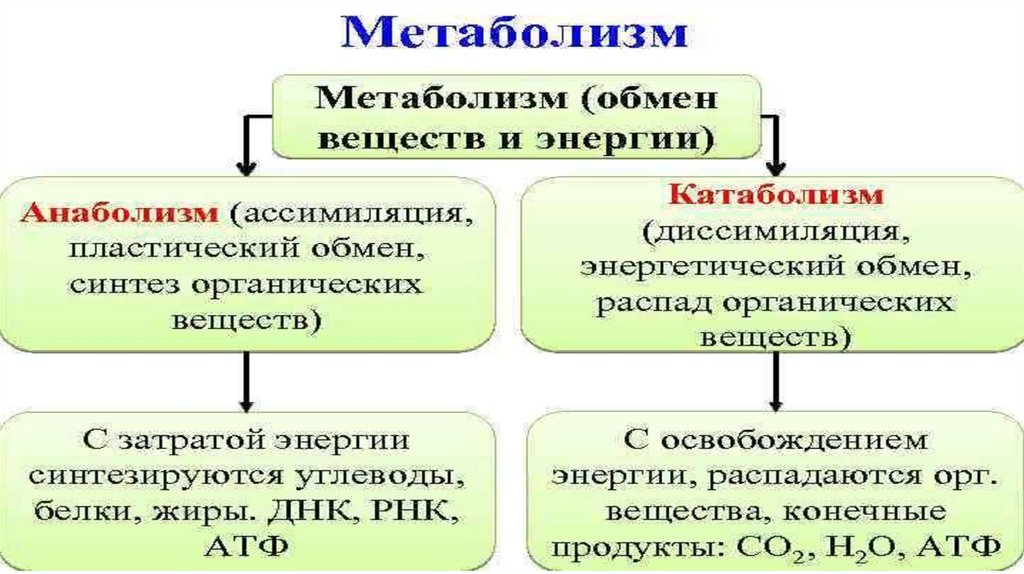
- при мониторинге состояния здоровья, оценке уровня работоспособности и эффективности лечения;
- при формировании групп риска по гипо- и гиперэлементозам;
- при подборе рациональной диеты как здоровому, так и больному человеку;
- в скрининг-диагностических исследованиях больших групп населения;
- при картировании территорий по нозологическим и системным формам патологии у детей и других возрастных групп населения;
- при оценке взаимозависимости многосторонних связей цепи “человек–среда обитания”;
- при составлении карт экологического природного и техногенного неблагополучия регионов;
- при изучении воздействия на организм вредных привычек;
- экспертно-криминалистических исследованиях (идентификация личности в судебной медицине, метод выбора в подтверждение исследований по молекуле ДНК и генному коду).
Методы определения микроэлементов в биосубстратах Масс-спектрометрия с индуктивно связанной аргоновой плазмой (ИСП-МС), атомно-абсорбционная спектрофотометрия с электротермической атомизацией (ААС-ЭТА).
Условия взятия и хранения материала для исследования
Взятие и подготовка крови для получения плазмы и сыворотки проводится по общепринятым методикам. Если при заборе проб используют перчатки, то они должны быть не опудренные и не содержать латекса (напр., нитриловые). Кровь может быть получена из локтевой вены или из пальцев рук (капиллярная). Объем отобранной крови должен составлять не менее 1 мл. Образцы сыворотки или плазмы крови хранятся в обычном холодильнике до 3–5 сут (от 0 до 4 °С) либо замораживаются (до -18 °С), либо лиофилизуются, или высушиваются в сушильном шкафу (для длительного хранения). Для длительного хранения образцы помещаются в одноразовые полипропиленовые пробирки с герметичными крышками.
Взятие биологических образцов крови и мочи проводят в соответствии с МУК 4.1.1482-08, МУК 4.1.1483-08.
Физиология, метаболизм — StatPearls — NCBI Bookshelf
Введение
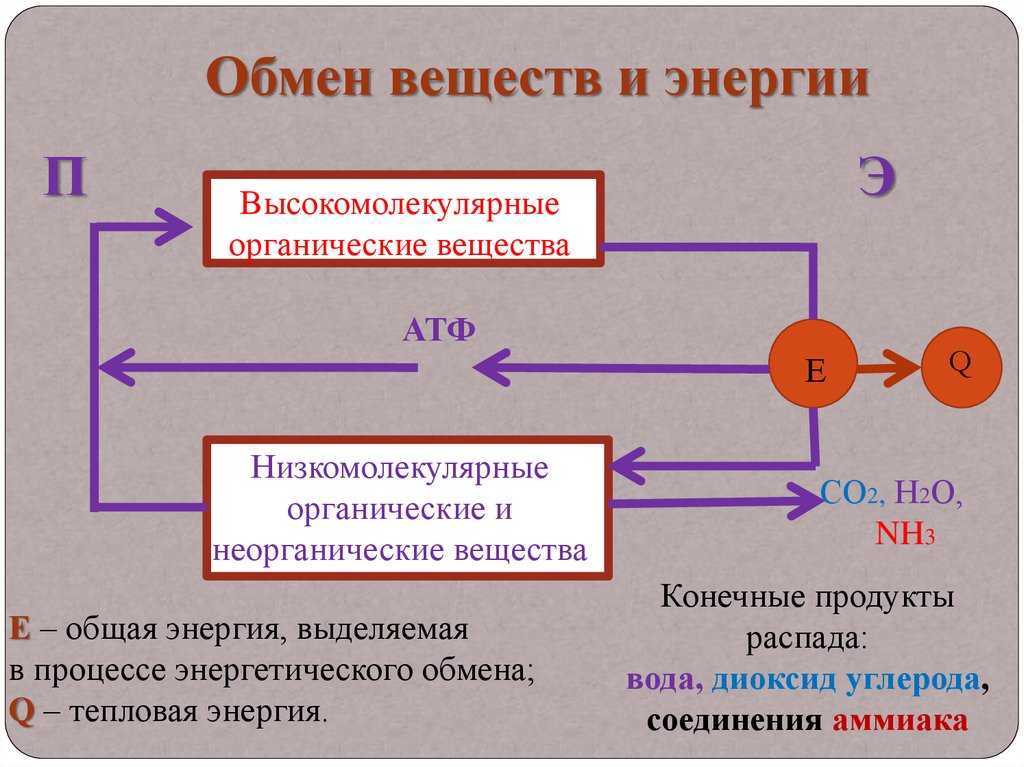
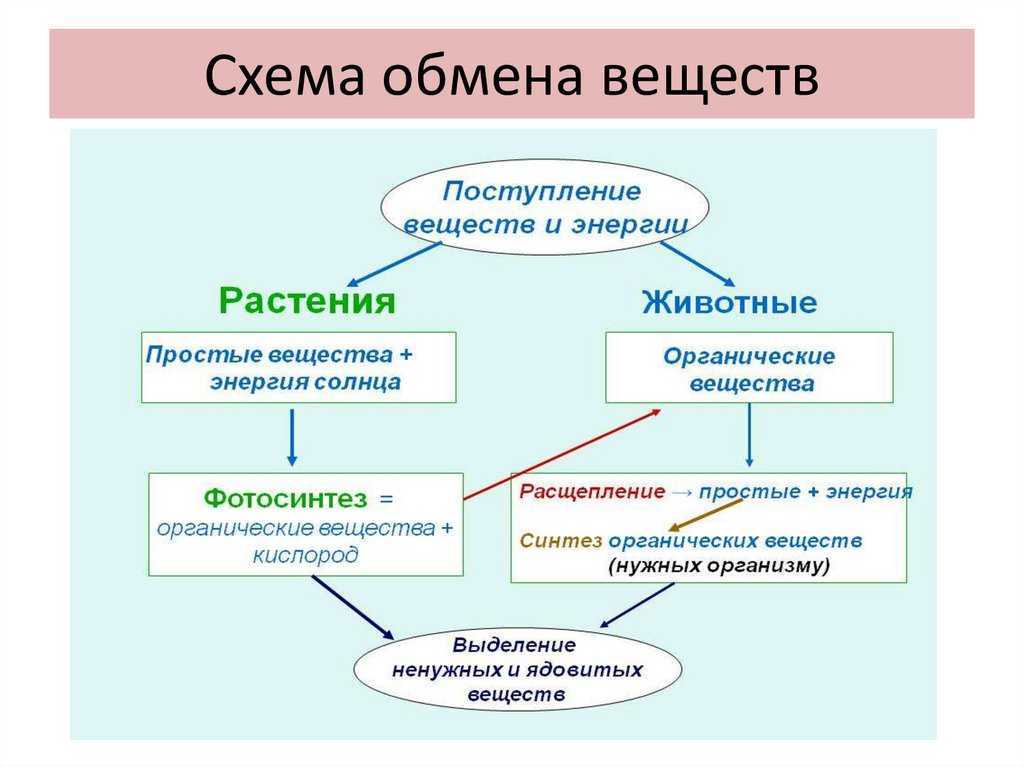
Метаболизм относится ко всей сумме реакций, происходящих в организме в каждой клетке и обеспечивающих тело энергией. Эта энергия используется для процессов жизнедеятельности и синтеза нового органического материала. Каждый живой организм использует окружающую среду, чтобы выжить, забирая питательные вещества и вещества, которые служат строительными блоками для движения, роста, развития и размножения. Все они опосредованы ферментами, которые представляют собой белки со специализированными функциями в анаболизме и катаболизме. Скорость производства энергии называется скоростью основного обмена и зависит от таких факторов, как пол, раса, физические упражнения, диета, возраст и такие заболевания, как сепсис или рак.
Эта энергия используется для процессов жизнедеятельности и синтеза нового органического материала. Каждый живой организм использует окружающую среду, чтобы выжить, забирая питательные вещества и вещества, которые служат строительными блоками для движения, роста, развития и размножения. Все они опосредованы ферментами, которые представляют собой белки со специализированными функциями в анаболизме и катаболизме. Скорость производства энергии называется скоростью основного обмена и зависит от таких факторов, как пол, раса, физические упражнения, диета, возраст и такие заболевания, как сепсис или рак.
Вопросы, вызывающие озабоченность
Химические реакции, посредством которых происходит обмен веществ, почти одинаковы во всех живых организмах, включая животных, растения, бактерии и грибы. Все эти химические реакции опосредованы белками, которые действуют как катализаторы в определенных условиях окружающей среды, таких как рН и температура. Синтез многих катализаторов, обеспечивающих химические реакции в нашем организме, берет свое начало в ДНК. Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Дезоксирибонуклеиновая кислота представляет собой молекулу, находящуюся внутри ядра, состоящую из четырех оснований, называемых аденином, гуанином, цитозином и тимином. РНК — это молекула, используемая некоторыми живыми организмами вместо ДНК, и компоненты этой молекулы включают рибозу и урацил вместо тимина. Окружающая среда, в основном растения, использует солнечный свет для преобразования воды и углекислого газа для синтеза углеводов. Живые организмы поступают наоборот, потребляя углеводы и другие органические материалы для производства энергии.
Термодинамика
Невозможно говорить об обмене веществ, не взглянув на законы термодинамики. Особого внимания заслуживают первые два закона. Первые два закона термодинамики гласят, что энергия не может быть ни создана, ни уничтожена и что результатом физических и химических изменений является увеличение энтропии во Вселенной. Энергия, которая действительно полезна, или свободная энергия, — это такая энергия, которая способна совершать работу при любой разнице температур. Менее полезные формы энергии высвобождаются в виде тепла.[1]
Менее полезные формы энергии высвобождаются в виде тепла.[1]
Клеточный
Химический носитель энергии называется АТФ. Синтез АТФ происходит внутри внутриклеточной органеллы, ограниченной внешней и внутренней мембранами. Диссоциация воды на молекулу водорода и гидроксильную группу, происходящая во внутренней среде организма, необходима для синтеза АТФ. Катаболические реакции, о которых пойдет речь в этой статье, высвобождают значительное количество протонов, большая часть которых транспортируется в митохондрии для производства АТФ. Эти протоны транспортируются через ряд комплексов во внутренней мембране митохондрий, чтобы активировать АТФазу, используя энергию, высвобождаемую механизмом транспорта электронов.
Организмы перерабатывают пищу, которую они едят, в три этапа. Первый этап включает в себя преобразование сложных молекул в простые молекулы; это включает расщепление сложных белков на олигопептиды и свободные аминокислоты для облегчения всасывания, расщепление сложных сахаров на дисахариды или моносахариды и расщепление липидов на глицерин и свободные жирные кислоты. Эти процессы называются пищеварением и составляют лишь около 0,1% производства энергии, которая не может быть использована клеткой. Во второй фазе все эти небольшие молекулы подвергаются неполному окислению. Окисление означает удаление электронов или атомов водорода. Конечным продуктом этих процессов являются вода и углекислый газ, а также три основных вещества, а именно: ацетилкофермент А, оксалоацетат и альфа-оксоглутарат. Из них наиболее распространенным соединением является ацетилкофермент А, который образует 2/3 углерода в углеводах и глицерине, весь углерод в жирных кислотах и половину углерода в аминокислотах. Третья и последняя фаза этого процесса происходит в цикле, называемом циклом Кребса, открытом сэром Гансом Кребсом. В этом цикле ацетилкоэнзим А и оксалоацетат объединяются и образуют цитрат. В этой ступенчатой реакции происходит высвобождение протонов, которые передаются в дыхательную цепь для синтеза АТФ.
Эти процессы называются пищеварением и составляют лишь около 0,1% производства энергии, которая не может быть использована клеткой. Во второй фазе все эти небольшие молекулы подвергаются неполному окислению. Окисление означает удаление электронов или атомов водорода. Конечным продуктом этих процессов являются вода и углекислый газ, а также три основных вещества, а именно: ацетилкофермент А, оксалоацетат и альфа-оксоглутарат. Из них наиболее распространенным соединением является ацетилкофермент А, который образует 2/3 углерода в углеводах и глицерине, весь углерод в жирных кислотах и половину углерода в аминокислотах. Третья и последняя фаза этого процесса происходит в цикле, называемом циклом Кребса, открытом сэром Гансом Кребсом. В этом цикле ацетилкоэнзим А и оксалоацетат объединяются и образуют цитрат. В этой ступенчатой реакции происходит высвобождение протонов, которые передаются в дыхательную цепь для синтеза АТФ.
Дисбаланс между анаболизмом и катаболизмом может привести к ожирению и кахексии соответственно.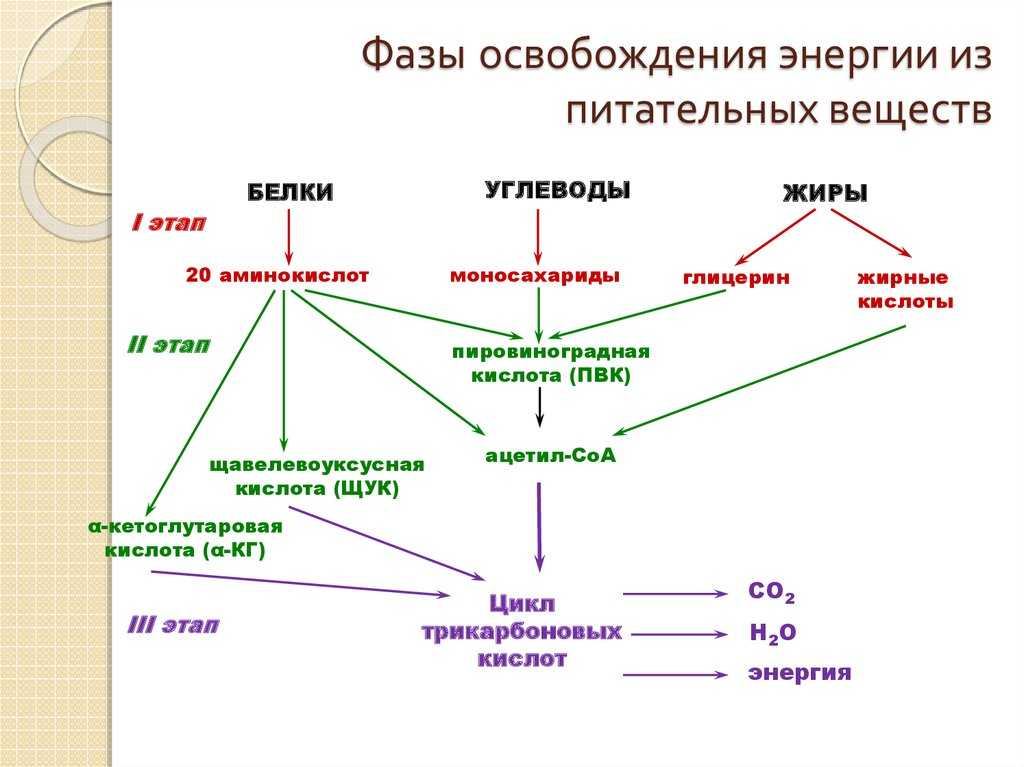 Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Метаболическая энергия переносится высокоэнергетическими фосфатными группами, такими как АТФ, ГТФ и креатинфосфат; или переносчиками электронов, такими как НАДН, ФАДН и НАДФН.[2][3]
Вовлеченные системы органов
Поджелудочная железа является ключевым метаболическим органом, который регулирует количество углеводов в крови либо путем высвобождения значительного количества инсулина для снижения уровня глюкозы в крови, либо путем высвобождения глюкагона для его повышения. Утилизация углеводов и липидов организмом называется циклом Рэндла, регулируется инсулином.
Печень является органом, отвечающим за переработку абсорбированных аминокислот и липидов из тонкого кишечника. Он также регулирует цикл мочевины и основные метаболические процессы, такие как глюконеогенез и отложение гликогена.[4]
Функция
Характеристики углеводов включают растворимость, относительно легкость транспортировки, нетоксичность молекул, которые служат источником энергии при снижении уровня кислорода.
Наиболее энергоемкими молекулами являются липиды, и они являются основной энергетической молекулой для млекопитающих и тканей. Поскольку они нерастворимы, они плохо переносятся кровью, не используются анаэробно и требуют большего количества кислорода для извлечения из них энергии (2,8 АТФ/молекула кислорода). Они не могут проникнуть через гематоэнцефалический барьер, и эритроциты или почечные клетки не могут их использовать. Аминокислоты действуют как субстраты для производства глюкозы только в условиях длительного голодания, демонстрируя истощение запасов гликогена.
Метаболизм этих трех основных субстратов сводится к одной молекуле, ацетил-КоА, в митохондриях. Метаболизм этой промежуточной молекулы генерирует 3 NADH, 1 FADH, 1 GTP и 2 CO2, все из которых участвуют в дыхательной цепи в митохондриях для синтеза АТФ.[5]
Механизм
Метаболизм углеводов
Основное внимание уделяется одному конкретному виду сахара — глюкозе. После поглощения клеткой молекулы глюкозы она немедленно метаболизируется в глюкозо-6-фосфат, который не может покинуть клетку. Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Фермент, катализирующий эту реакцию, называется гексокиназой (в печени и поджелудочной железе) или глюкокиназой во всех других тканях. Этот метаболит используется почти во всех метаболических процессах, включая гликолиз и гликогенез. Углеводы хранятся в виде гранул гликогена для быстрой мобилизации глюкозы при необходимости.
Гликоген представляет собой полимер глюкозы, собранный гликогенсинтазой, с точками ветвления через каждые десять молекул глюкозы, что придает гликогену древовидную структуру, что способствует мобилизации глюкозы. Некоторые ткани используют гликоген для собственного поддержания, например скелетные мышцы; некоторые другие ткани используют гликоген для поддержания стабильного уровня глюкозы в сыворотке, например, печень. Печень может хранить почти 100 г гликогена, который поставляет глюкозу в течение 24 часов; скелетные мышцы запасают 350 г, которых достаточно для 60-минутного сокращения мышц. Глюкоза метаболизируется путем гликолиза во всех клетках с образованием пирувата.
Пируват может иметь три судьбы внутри клетки: он может транспортироваться в митохондрии и генерировать ацетил-КоА, он может оставаться в цитозоле и генерировать лактат или может использоваться в гликонеогенезе ферментом аланинаминотрансферазой (АЛТ). Судьба пирувата в тканях будет зависеть от гормональной регуляции, доступности кислорода и конкретной ткани. Например, в печени избыток пирувата метаболизируется до ацетил-КоА, который затем используется для синтеза липидов, тогда как в мышцах он подвергается полному окислению до СО2.
Глюкозо-6-фосфат также можно использовать в пентозофосфатном пути. Этот путь синтезирует нуклеотиды, синтез специфических липидов и поддерживает глутатион в его активной форме. Этот процесс регулируется глюкозо-6-фосфатдегидрогеназой.
Углеводный обмен регулируется в основном инсулином, так как он стимулирует гликолиз и гликогенез. Катехоламины, глюкагон, кортизол и гормон роста стимулируют глюконеогенез и гликогенолиз. [6]
[6]
Метаболизм липидов
Жирные кислоты служат для производства энергии в окислительных тканях. Некоторые из них являются амфипатическими, потенциально токсичными и транспортируются в связанном виде с альбумином. Кишечник всасывает жирные кислоты в виде мицелл; они поглощаются энтероцитами в стенке кишечника. Оказавшись внутри, эти молекулы жира расщепляются на более мелкие молекулы, свободные жирные кислоты и глицерин, которые в задней части конъюгируются с образованием триглицеридов. Они связаны с белками, образуя хиломикроны вне энтероцита.
Эти хиломикроны очень богаты холестерином и триглицеридами, которые по системе воротной вены транспортируются в печень. Печень будет обрабатывать эти сложные молекулы, чтобы извлечь фракцию холестерина и триглицеридов. Печень секретирует новую форму сложной молекулы, называемой ЛПОНП, которая транспортирует эндогенные липиды и жир к периферическим тканям, экспрессирующим гормоночувствительную липазу и липопротеинлипазу.
Этот фермент превращает ЛПОНП в ЛПНП, который содержит больше холестерина, чем другие молекулы, и в конечном итоге поглощается тканями-мишенями. Весь этот процесс называется «прямой метаболизм холестерина». Когда в периферических тканях слишком много жира или холестерина, они перемещаются в липопротеине, называемом ЛПВП, который попадает в желчевыводящую систему для экскреции. Этот процесс называется «обратным метаболизмом холестерина». Оба регулируются инсулином, который стимулирует липазы в организме, но подавляет липолиз.][10]
Метаболизм аминокислот
Мы потребляем почти 100 г белка в день. В организме содержится почти 10 кг белка, который метаболизируется по 300 г в день. Структурными единицами, составляющими белки, являются аминокислоты. Некоторые из них являются незаменимыми (это означает, что организм не может их синтезировать и должен получать с пищей), а некоторые являются заменимыми аминокислотами (которые организм может синтезировать). Белки поглощаются энтероцитами в виде аминокислот. Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Аминокислоты содержат группу азота и двухуглеродный скелет, называемый 2-оксокислотой.
Метаболизм аминокислот приводит к образованию аммония, который является токсичной молекулой, особенно для ЦНС. Аммоний может метаболизироваться в печени для экскреции в цикле орнитина (мочевины). Метаболизм аминокислот происходит в результате двух видов химических реакций. Первый называется трансаминированием, в котором участвуют аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). Эти две реакции требуют трехуглеродного скелета для замены аминогруппы; скелетом этих двух ферментов является альфа-кетоглутарат. В реакции, регулируемой АЛТ, аланин переносит аминогруппу на альфа-кетоглутарат с образованием пирувата и глутамата. При регулируемой АСТ реакции происходит обратная ситуация. Он использует пожертвованную аминогруппу из глутамата для создания аспартата, чтобы пожертвовать второй атом амино в цикл мочевины. Второй реакцией является дезаминирование, при котором глутаматдегидрогеназа метаболизирует глутамат с образованием альфа-кетоглутарата и аммиака, который должен быть детоксицирован циклом мочевины.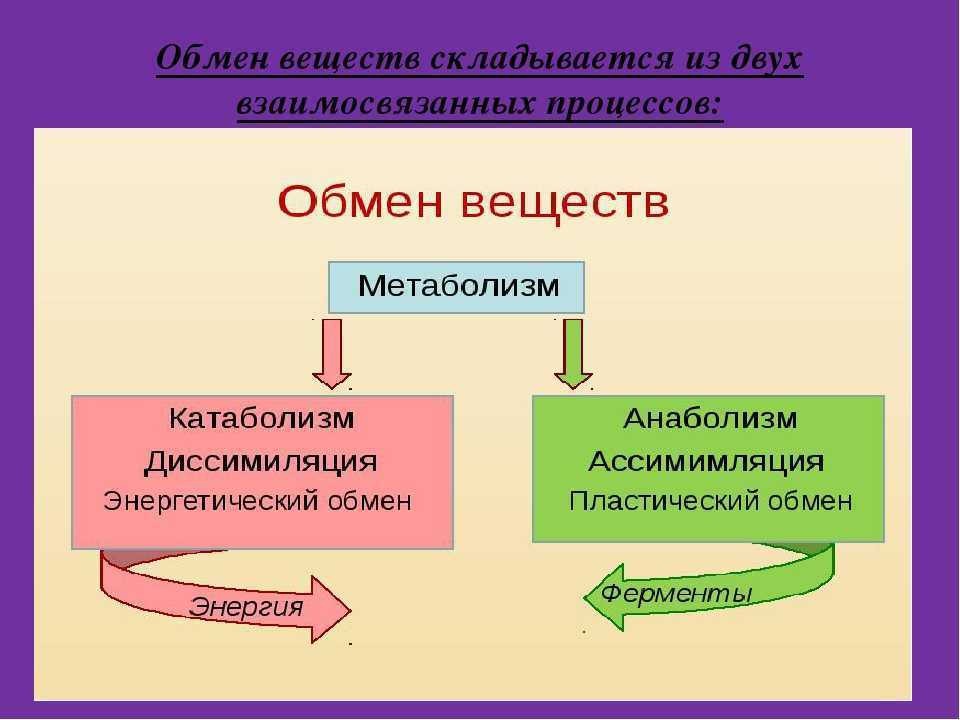
После дезаминирования скелет подвергается промежуточному метаболизму. Метаболизм аминокислот может давать семь типов скелетов, а именно: альфа-кетоглутарат, оксалоацетат, сукцинил-КоА, фумарат, пируват, ацетил-КоА и ацетоацетил-КоА. Первые пять имеют три или более атомов углерода и полезны для гликонеогенеза, последние два имеют только два атома углерода и непригодны для гликонеогенеза. Вместо этого они используются для синтеза липидов.
Как и все другие метаболические пути, инсулин является основным регулятором. Напротив, регулятором метаболизма аминокислот является кортизол и гормон щитовидной железы, который опосредует разрушение мышц.
Клиническая значимость
Сахарный диабет
Поджелудочная железа определяет концентрацию глюкозы в крови и некоторых аминокислот, таких как аргинин и лейцин. Высокий уровень этих веществ указывает на питательное насыщение, и это сообщение посылается организму поджелудочной железой в виде инсулина. Инсулин является уникальным метаболическим гормоном, отвечающим за распределение питательных веществ в организме, а это означает, что дефицит инсулина вызывает плейотропные изменения в метаболизме человека.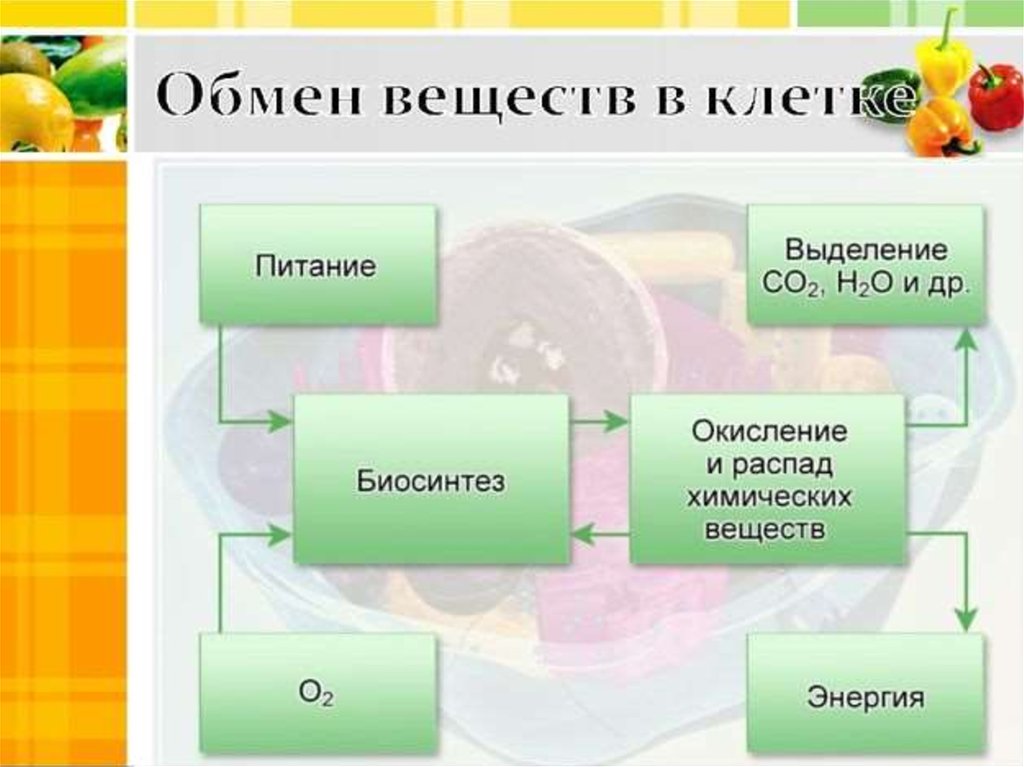 При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
При дефиците инсулина торможение катаболических реакций меньше; это приводит к чистой мобилизации субстратов из тканей. Поджелудочная железа определяет статус метаболитов, периферические ткани определяют статус концентрации инсулина. Когда периферические ткани ощущают снижение уровня инсулина, они начинают катаболизироваться, и начинают мобилизоваться субстраты. Печень реагирует на низкий уровень инсулина увеличением синтеза глюкозы с помощью глюконеогенеза и гликогенолиза. Как видно из метаболизма аминокислот, основным субстратом глюконеогенеза является аланин, образующийся в результате мышечного распада и протеолиза. Жировая ткань также реагирует, усиливая липолиз, что приводит к накоплению жирных кислот и глицерина. Повышенная доставка неэтерифицированных жирных кислот (НЭЖК) в печень увеличивает кетогенез.[14]
Сепсис, травма и ожоги
Катаболизм также может инициироваться чрезмерной воспалительной реакцией, характеризующейся активацией и экспрессией провоспалительных цитокинов, таких как TNF-альфа, IL-6 и IL-1.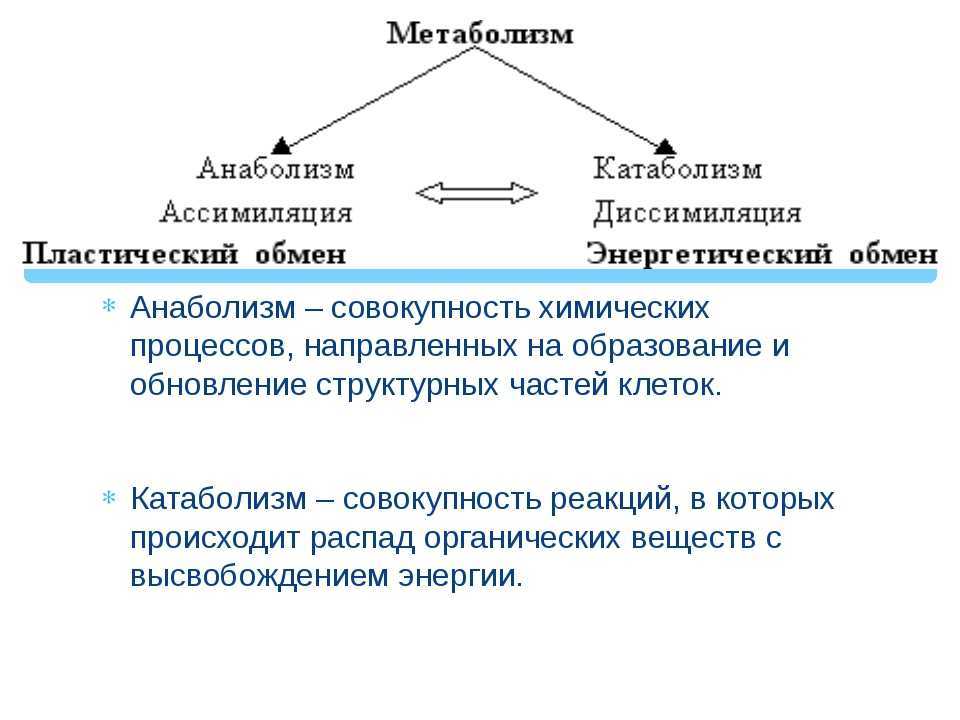 Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Этот процесс называется синдромом системной воспалительной реакции (SIRS). Он имеет три фазы метаболизма; фаза прилива или шока, катаболическая фаза и анаболическая фаза. В этих сценариях происходит значительная мобилизация субстрата по всему телу.[15]
Дефицит G6PDH
Дефицит широко распространен в экваториальных регионах. Он связан с Х-хромосомой и снижает уровень НАДФН, следовательно, снижает уровень активной формы глутатиона и увеличивает окислительный стресс для эритроцитов; это приводит к гемолизу, представленному как кризис, в зависимости от инсульта. Он проявляется в виде телец Хайнца и пузырчатых клеток в мазке периферической крови.[16]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Прокомментируйте эту статью.
Ссылки
- 1.
Liu X, Chen T, Jain PK, Xu W. Выявление термодинамических свойств элементарных химических реакций на уровне одной молекулы.
 J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]
J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]- 2.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени. Сахарный диабет Ожирение Metab. 2011 Октябрь; 13 Приложение 1: 118-25. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
- 3.
Сабо И., Зоратти М. Митохондриальные каналы: потоки ионов и многое другое. Physiol Rev. 2014 Apr;94(2):519-608. [PubMed: 24692355]
- 4.
Hue L, Taegtmeyer H. Новый взгляд на цикл Рэндла: новая голова для старой шляпы. Am J Physiol Endocrinol Metab. 2009 г., сен; 297 (3): E578-91. [Бесплатная статья PMC: PMC2739696] [PubMed: 19531645]
- 5.
KREBS HA. Цикл трикарбоновых кислот. 1948–1949 Харви Лект. Серия 44: 165-99. [PubMed: 14849928]
- 6.
Дашти М. Краткий обзор биохимии: углеводный обмен. Клин Биохим. 2013 Октябрь;46(15):1339-52.
 [PubMed: 23680095]
[PubMed: 23680095]- 7.
Абумрад Н.А., Дэвидсон НЕТ. Роль кишечника в липидном гомеостазе. Physiol Rev. 2012 г., июль; 92 (3): 1061-85. [Бесплатная статья PMC: PMC3589762] [PubMed: 22811425]
- 8.
Goldstein JL, Brown MS. Рецептор ЛПНП. Артериосклеры Тромб Васк Биол. 2009 г.29 апреля (4): 431-8. [Бесплатная статья PMC: PMC2740366] [PubMed: 19299327]
- 9.
Яворски К., Саркади-Надь Э., Дункан Р.Э., Ахмадян М., Сул Х.С. Регуляция метаболизма триглицеридов. IV. Гормональная регуляция липолиза в жировой ткани. Am J Physiol Gastrointest Liver Physiol. 2007 июль; 293(1):G1-4. [Бесплатная статья PMC: PMC2887286] [PubMed: 17218471]
- 10.
Пирс В., Кароббио С., Видаль-Пуиг А. Различные оттенки жира. Природа. 2014 05 июня; 510 (7503): 76-83. [В паблике: 24899307]
- 11.
Deutz NE, Wolfe RR. Существует ли максимальный анаболический ответ на прием белка во время еды? Клин Нутр.
 2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]
2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]- 12.
Finn PF, Dice JF. Протеолитические и липолитические реакции на голодание. Питание. 2006 июль-август; 22 (7-8): 830-44. [PubMed: 16815497]
- 13.
Ванденберг Р.Дж., Райан Р.М. Механизмы транспорта глутамата. Physiol Rev. 9 октября 2013 г.3(4):1621-57. [PubMed: 24137018]
- 14.
Заккарди Ф., Уэбб Д.Р., Йейтс Т., Дэвис М.Дж. Патофизиология сахарного диабета 1 и 2 типа: взгляд на 90 лет. Postgrad Med J. 2016 Feb; 92 (1084): 63-9. [PubMed: 26621825]
- 15.
Чеккони М., Эванс Л., Леви М., Родс А. Сепсис и септический шок. Ланцет. 2018 07 июля; 392 (10141): 75-87. [PubMed: 29937192]
- 16.
Штайнер М., Людеманн Дж., Краммер-Штайнер Б. Фавизм и дефицит глюкозо-6-фосфатдегидрогеназы. N Engl J Med. 2018 15 марта; 378 (11): 1068. [В паблике: 29
Цели обучения
К концу этого раздела вы сможете:
- Объяснять, что такое метаболические пути
- Назовите первый и второй законы термодинамики
- Объясните разницу между кинетической и потенциальной энергией
- Опишите эндергонические и экзергонические реакции
- Обсудите, как ферменты функционируют как молекулярные катализаторы
Посмотрите видео о гетеротрофах.

Ученые используют термин биоэнергетика для описания концепции потока энергии (рис. 4.2) через живые системы, такие как клетки. Клеточные процессы , такие как построение и разрушение сложных молекул , происходят посредством ступенчатых химических реакций . Некоторые из этих химических реакций протекают самопроизвольно и высвобождают энергию, тогда как для протекания других требуется энергия. Точно так же, как живые существа должны постоянно потреблять пищу, чтобы пополнять свои запасы энергии, клетки должны постоянно производить больше энергии, чтобы пополнить ту, которая используется многими постоянно происходящими химическими реакциями, требующими энергии. Вместе, все химические реакции , происходящие внутри клеток, включая те, которые потребляют или вырабатывают энергию, называются клеточным метаболизмом .
Рисунок 4.2 В конечном счете, большинство форм жизни получают энергию от солнца. Растения используют фотосинтез для захвата солнечного света, а травоядные поедают растения для получения энергии. Плотоядные поедают травоядных, а возможное разложение растительного и животного материала способствует накоплению питательных веществ.
Плотоядные поедают травоядных, а возможное разложение растительного и животного материала способствует накоплению питательных веществ.Рассмотрим метаболизм сахара. Это классический пример одного из многих клеточных процессов, использующих и производящих энергию. Живые существа потребляют сахара в качестве основного источника энергии, потому что молекулы сахара имеют большое количество энергии, хранящейся в их связях. По большей части фотосинтезирующие организмы, такие как растения, производят эти сахара. Во время фотосинтеза растения используют энергию (первоначально солнечного света) для преобразования углекислого газа (CO 2 ) на молекулы сахара (например, глюкоза: C 6 H 12 O 6 ). Они потребляют углекислый газ и производят кислород в качестве побочного продукта. Эта реакция резюмируется как:
6CO 2 + 6H 2 O + энергия ——-> C 6 H 12 O 6 + 6O 2
Поскольку этот процесс включает в себя синтез молекулы, запасающей энергию, для его продолжения требуется затрата энергии.
 В световых реакциях фотосинтеза энергия обеспечивается молекулой под названием аденозинтрифосфат (АТФ) , которая является основной энергетической валютой всех клеток. Точно так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения непосредственной работы. Напротив, молекулы-аккумуляторы энергии, такие как глюкоза, потребляются только для того, чтобы расщепляться для использования своей энергии. Реакция, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, может быть обобщена как реакция, обратная фотосинтезу. В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как:
В световых реакциях фотосинтеза энергия обеспечивается молекулой под названием аденозинтрифосфат (АТФ) , которая является основной энергетической валютой всех клеток. Точно так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения непосредственной работы. Напротив, молекулы-аккумуляторы энергии, такие как глюкоза, потребляются только для того, чтобы расщепляться для использования своей энергии. Реакция, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, может быть обобщена как реакция, обратная фотосинтезу. В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как:C 6 H 12 O 6 + 6O 2 ——> 6CO 2 + 6H 2 O + энергия
Обе эти реакции включают много стадий.
Процессы создания и расщепления молекул сахара иллюстрируют два примера метаболических путей.
 Метаболический путь представляет собой серию химических реакций, в которых исходная молекула шаг за шагом модифицируется через ряд метаболических промежуточных продуктов, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, и второй, производящий энергию, — называются анаболические пути (строительство полимеров) и катаболические пути (расщепление полимеров на их мономеры) соответственно. Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Метаболический путь представляет собой серию химических реакций, в которых исходная молекула шаг за шагом модифицируется через ряд метаболических промежуточных продуктов, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, и второй, производящий энергию, — называются анаболические пути (строительство полимеров) и катаболические пути (расщепление полимеров на их мономеры) соответственно. Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).Важно знать, что химические реакции метаболических путей не происходят сами по себе. Каждый этап реакции облегчается или катализируется белком, называемым ферментом. Ферменты важны для катализа всех типов биологических реакций — те, которые требуют энергии, а также те, которые высвобождают энергию.
Рис. 4.3. Катаболические пути — это те, которые вырабатывают энергию за счет расщепления более крупных молекул. Анаболические пути — это те, которые требуют энергии для синтеза более крупных молекул. Оба типа путей необходимы для поддержания энергетического баланса клетки.
Термодинамика относится к изучению энергии и передачи энергии с участием физической материи. Материя, относящаяся к конкретному случаю передачи энергии, называется системой, а все, что находится вне этой материи, — окружающей средой. Например, при нагревании кастрюли с водой на плите система включает плиту, кастрюлю и воду. Энергия передается внутри системы (между плитой, кастрюлей и водой). Существует два типа систем: открытые и закрытые. В открытой системе возможен обмен энергией с окружающей средой. Система плиты открыта, потому что тепло может отдаваться воздуху. Замкнутая система не может обмениваться энергией с окружающей средой.
Биологические организмы являются открытыми системами. Между ними и их окружением происходит обмен энергией, поскольку они используют энергию солнца для фотосинтеза или потребляют молекулы, хранящие энергию, и выделяют энергию в окружающую среду, выполняя работу и выделяя тепло.
 Как и все вещи в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии во всех системах во Вселенной и между ними.
Как и все вещи в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии во всех системах во Вселенной и между ними.В целом энергия определяется как способность выполнять работу или создавать какие-либо изменения. Энергия существует в разных формах. Например, электрическая энергия, световая энергия и тепловая энергия — это разные виды энергии. Чтобы понять, как энергия поступает в биологические системы и выходит из них, важно понимать два физических закона, управляющих энергией.
Первый закон термодинамики гласит, что общее количество энергии во Вселенной постоянно и сохраняется. Другими словами, во Вселенной всегда было и всегда будет одинаковое количество энергии. Энергия существует во многих различных формах . Согласно первому закону термодинамики, энергия может передаваться с места на место или преобразовываться в различные формы 90 235, но ее нельзя создать или уничтожить 90 236 . Передачи и преобразования энергии происходят вокруг нас все время.
 Лампочки преобразуют электрическую энергию в световую и тепловую энергию. Газовые плиты преобразуют химическую энергию природного газа в тепловую энергию. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.
Лампочки преобразуют электрическую энергию в световую и тепловую энергию. Газовые плиты преобразуют химическую энергию природного газа в тепловую энергию. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.Задача всех живых организмов состоит в том, чтобы получать энергию из своего окружения в формах, которые они могут передавать или преобразовывать в полезную энергию для выполнения работы. Живые клетки эволюционировали, чтобы справиться с этой задачей. Химическая энергия, хранящаяся в органических молекулах, таких как сахара и жиры, передается и трансформируется посредством ряда клеточных химических реакций в энергию внутри молекул АТФ. Энергия молекул АТФ легко доступна для выполнения работы. Примеры типов работы, которую должны выполнять клетки, включают построение сложных молекул, транспортировку материалов, обеспечение движения ресничек или жгутиков и сокращение мышечных волокон для создания движения.

На рис. 4.4 показаны некоторые примеры передачи и преобразования энергии из одной системы в другую и из одной формы в другую. Пища, которую мы потребляем, обеспечивает наши клетки энергией, необходимой для выполнения функций организма, точно так же, как световая энергия дает растениям средства для создания необходимой им химической энергии. (кредит «мороженое»: модификация работы Д. Шэрон Прюитт; кредит «дети»: модификация работы Макса из Провиденса; кредит «лист»: модификация работы Кори Занкера)Основные задачи живой клетки по получению, преобразованию и использованию энергии для выполнения работы могут показаться простыми. Однако второй закон термодинамики объясняет, почему эти задачи сложнее, чем кажутся. Все передачи и преобразования энергии никогда не бывают полностью эффективными . При каждой передаче энергии некоторое количество энергии теряется в непригодной для использования форме. В большинстве случаев такой формой является тепловая энергия.
 Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, которая не является работой. Например, когда включается лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии. Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, которая не является работой. Например, когда включается лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии. Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.Важным понятием в физических системах является порядок и беспорядок. Чем больше энергии теряет система в своем окружении, тем менее упорядоченной и более случайной является система. Ученые называют мерой случайности или беспорядка в системе энтропию . Высокая энтропия означает высокий беспорядок и низкую энергию. Молекулы и химические реакции также имеют разную энтропию. Например, энтропия увеличивается по мере того, как молекулы с высокой концентрацией в одном месте диффундируют и распространяются. Второй закон термодинамики гласит, что энергия всегда будет теряться в виде тепла при передаче или превращении энергии.

Живые существа обладают высокой степенью упорядоченности и требуют постоянного расхода энергии для поддержания состояния низкой энтропии.
Когда объект находится в движении, с ним связана энергия. Подумайте о разрушающем шаре. Даже медленно движущийся шар-разрушитель может нанести большой ущерб другим объектам. Энергия, связанная с движущимися объектами, называется кинетической энергией (рис. 4.5). Мчащаяся пуля, идущий человек и быстрое движение молекул в воздухе (выделяющее тепло) — все они обладают кинетической энергией.
А что, если тот самый неподвижный шар-вредитель поднять краном на два этажа над землей? Если подвешенный разрушающий шар неподвижен, связана ли с ним энергия? Ответ положительный. Энергия, необходимая для подъема шара-разрушителя, не исчезла, а теперь запасена в шаре-разрушителе благодаря его положению и действующей на него силе тяжести. Этот вид энергии называется потенциальной энергией (рис. 4.5). Если мяч упадет, потенциальная энергия будет преобразована в кинетическую энергию до тех пор, пока вся потенциальная энергия не будет исчерпана, когда мяч покоится на земле.
Рис. 4.5 Неподвижная вода обладает потенциальной энергией; движущаяся вода, например, в водопаде или быстро текущей реке, обладает кинетической энергией. (кредит «плотина»: модификация работы «Паскаль»/Flickr; кредит «водопад»: модификация работы Фрэнка Гуалтьери) Разрушительные шары также качаются, как маятник; во время качелей происходит постоянное изменение потенциальной энергии (наибольшей в верхней части качелей) на кинетическую энергию (наибольшей в нижней части качелей). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или энергию человека, собирающегося прыгнуть с парашютом из самолета.
Разрушительные шары также качаются, как маятник; во время качелей происходит постоянное изменение потенциальной энергии (наибольшей в верхней части качелей) на кинетическую энергию (наибольшей в нижней части качелей). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или энергию человека, собирающегося прыгнуть с парашютом из самолета.Потенциальная энергия связана не только с расположением материи, но и со структурой материи. Даже пружина на земле обладает потенциальной энергией, если ее сжать; то же самое делает и натянутая резинка. На молекулярном уровне связи, удерживающие атомы молекул вместе, существуют в определенной структуре, обладающей потенциальной энергией. Помните, что анаболические клеточные пути требуют энергии для синтеза сложных молекул из более простых, а катаболические пути высвобождают энергию при расщеплении сложных молекул.
 Тот факт, что энергия может высвобождаться при разрыве определенных химических связей, подразумевает, что эти связи обладают потенциальной энергией. На самом деле существует потенциальная энергия, хранящаяся в связях всех пищевых молекул, которые мы едим, и которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи.
Тот факт, что энергия может высвобождаться при разрыве определенных химических связей, подразумевает, что эти связи обладают потенциальной энергией. На самом деле существует потенциальная энергия, хранящаяся в связях всех пищевых молекул, которые мы едим, и которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи.Посмотрите видео о килокалориях.
Концепция в действии
Посетите сайт и выберите «Маятник» в меню «Работа и энергия», чтобы увидеть изменение кинетической и потенциальной энергии маятника в движении.
Узнав, что химические реакции высвобождают энергию, когда разрушаются энергосберегающие связи, следующий важный вопрос заключается в следующем: как определяется и выражается энергия, связанная с этими химическими реакциями? Как можно сравнить энергию, выделяющуюся в одной реакции, с энергией другой реакции? Измерение свободной энергии используется для количественной оценки этих передач энергии.
 Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.
Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.Если в ходе химической реакции выделяется энергия, то изменение свободной энергии, обозначаемое как ∆G (дельта G), будет отрицательным числом. Отрицательное изменение свободной энергии также означает, что продукты реакции имеют меньшую свободную энергию, чем реагенты, потому что они выделяют некоторую свободную энергию во время реакции. Реакции, которые вызывают отрицательное изменение свободной энергии и, следовательно, высвобождение свободной энергии, называются экзергоническими реакциями. Подумайте: ex ergonic означает, что энергия равна ex подключение системы.
 Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.
Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.Если химическая реакция поглощает энергию, а не высвобождает энергию в балансе, то ∆G для этой реакции будет положительным значением. В этом случае продукты имеют больше свободной энергии, чем реагенты. Таким образом, продукты этих реакций можно рассматривать как запасающие энергию молекулы. Эти химические реакции называются эндергоническими реакциями и являются неспонтанными . Эндергоническая реакция не будет происходить сама по себе без добавления свободной энергии.
На рис. 4. 6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)
6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)Посмотрите на каждый из показанных процессов и решите если он эндергонический или экзергонический.
Существует еще одна важная концепция, которую следует учитывать в отношении эндергонических и экзергонических реакций. Экзергонические реакции требуют небольшого количества энергии для запуска, прежде чем они смогут продолжить свои этапы высвобождения энергии. Эти реакции имеют чистое высвобождение энергии, но все же требуют некоторого подвода энергии в начале. Это небольшое количество энергии, необходимое для протекания всех химических реакций, называется энергией активации.
Концепция в действии
Посмотрите анимацию перехода от свободной энергии к переходному состоянию реакции.

Вещество, которое способствует протеканию химической реакции, называется катализатором, а молекулы, катализирующие биохимические реакции, называются ферментами. Большинство ферментов являются белками и выполняют важнейшую задачу снижения энергии активации химических реакций внутри клетки. Большинство критических для живой клетки реакций протекают слишком медленно при нормальных температурах, чтобы быть полезными для клетки. Без ферментов до ускорить эти реакции , жизнь не может продолжаться. Ферменты делают это, связываясь с молекулами реагентов и удерживая их таким образом, чтобы облегчить процессы разрыва и образования химических связей. Важно помнить, что ферменты не изменяются, является ли реакция экзергонической (спонтанной) или эндергонической. Это потому, что они не изменяют свободную энергию реагентов или продуктов. Они лишь уменьшают энергию активации, необходимую для протекания реакции (рис. 4.7). Кроме того, сам фермент не изменяется в ходе реакции, которую он катализирует.
Рисунок 4.7 Ферменты снижают энергию активации реакции, но не изменяют свободную энергию реакции. После катализа одной реакции фермент может участвовать в других реакциях.
После катализа одной реакции фермент может участвовать в других реакциях.Химические реагенты, с которыми связывается фермент, называются субстратами фермента. В зависимости от конкретной химической реакции может быть один или несколько субстратов. В некоторых реакциях один реагент-субстрат распадается на несколько продуктов. В других случаях два субстрата могут объединяться, образуя одну большую молекулу. Два реагента также могут вступить в реакцию и оба измениться, но они покинут реакцию как два продукта. Место внутри фермента, где связывается субстрат, называется ферментным 9-узлом.0235 активный сайт . Активный сайт — это место, где происходит «действие». Поскольку ферменты представляют собой белки, в активном центре имеется уникальная комбинация боковых цепей аминокислот. Каждая боковая цепь характеризуется различными свойствами. Они могут быть большими или маленькими, слабокислыми или основными, гидрофильными или гидрофобными, положительно или отрицательно заряженными или нейтральными.
 Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).
Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).Активные сайты подвержены влиянию местной среды. Повышение температуры окружающей среды обычно увеличивает скорость реакции, катализируемой ферментами или иным образом. Однако температуры за пределами оптимального диапазона снижают скорость, с которой фермент катализирует реакцию. Горячие температуры в конечном итоге вызовут денатурацию ферментов, необратимое изменение трехмерной формы и, следовательно, функции фермента. Ферменты также подходят для наилучшего функционирования в пределах определенного диапазона pH и концентрации соли, и, как и в случае с температурой, экстремальный pH и концентрация соли могут вызвать денатурацию ферментов.
В течение многих лет ученые считали, что связывание фермента с субстратом происходит простым способом «замок и ключ». Эта модель утверждала, что фермент и субстрат идеально сочетаются друг с другом за один мгновенный шаг.
 Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом.
Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом.Концепция в действии
Просмотрите анимацию индуцированной посадки.
Когда фермент связывается со своим субстратом, образуется фермент-субстратный комплекс. Этот комплекс снижает энергию активации реакции и способствует ее быстрому протеканию одним из многих возможных путей. На базовом уровне ферменты способствуют химическим реакциям, в которых участвует более одного субстрата, объединяя субстраты в оптимальной для реакции ориентации. Другой способ, с помощью которого ферменты способствуют реакции своих субстратов, заключается в создании оптимальной среды в активном центре для протекания реакции.
 Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.
Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.Комплекс фермент-субстрат также может снижать энергию активации, нарушая структуру связи, чтобы ее было легче разорвать. Наконец, ферменты также могут снижать энергию активации, участвуя в самой химической реакции. В этих случаях важно помнить, что фермент всегда возвращается в исходное состояние по завершении реакции. Одним из отличительных свойств ферментов является то, что они в конечном счете остаются неизменными в реакциях, которые они катализируют. После того, как фермент катализирует реакцию, он высвобождает свой продукт (продукты) и может катализировать новую реакцию.
Рисунок 4.8. Модель индуцированного соответствия представляет собой корректировку модели «замок и ключ» и объясняет, как ферменты и субстраты претерпевают динамические модификации во время переходного состояния, чтобы увеличить сродство субстрата к активному центру.
Казалось бы идеальным сценарий, при котором все ферменты организма существовали бы в изобилии и функционировали оптимально во всех клеточных условиях, во всех клетках, во все времена. Однако различные механизмы гарантируют, что этого не произойдет. Клеточные потребности и условия постоянно варьируются от клетки к клетке и меняются внутри отдельных клеток с течением времени. Необходимые ферменты клеток желудка отличаются от ферментов клеток хранения жира, клеток кожи, клеток крови и нервных клеток. Кроме того, клетки органов пищеварения работают гораздо усерднее, перерабатывая и расщепляя питательные вещества в течение времени, которое следует за приемом пищи, по сравнению со многими часами после приема пищи. Поскольку эти клеточные потребности и условия различаются, должны различаться количество и функциональность различных ферментов.
Поскольку скорость биохимических реакций контролируется энергией активации, а ферменты снижают и определяют энергию активации химических реакций, относительное количество и функционирование различных ферментов в клетке в конечном итоге определяют, какие реакции будут протекать и с какой скоростью.
 Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.
Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.Ферменты также можно регулировать таким образом, чтобы стимулировать или снижать активность ферментов. Существует много видов молекул, которые ингибируют или стимулируют функцию фермента, и различные механизмы, с помощью которых они это делают. В некоторых случаях ингибирования фермента молекула ингибитора достаточно подобна субстрату, чтобы она могла связываться с активным центром и просто блокировать связывание субстрата. Когда это происходит, фермент ингибируется путем конкурентного ингибирования , потому что молекула ингибитора конкурирует с субстратом за связывание с активным центром.
С другой стороны, при неконкурентном ингибировании молекула ингибитора связывается с ферментом в месте, отличном от активного сайта, называемого аллостерическим сайтом , но все же умудряется блокировать связывание субстрата с активным сайтом.
Рис. 4.9. Аллостерическое ингибирование работает, косвенно индуцируя конформационные изменения в активном центре, так что субстрат больше не подходит. Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).).
Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).). Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.
Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.Через призму коренных народов
Растения не могут убегать или прятаться от своих хищников и разработали множество стратегий, чтобы отпугнуть тех, кто их съест. Подумайте о шипах, раздражителях и вторичных метаболитах: это соединения, которые напрямую не помогают растению расти, но созданы специально для защиты от хищников. Вторичные метаболиты — наиболее распространенный способ, с помощью которого растения отпугивают хищников. Некоторыми примерами вторичных метаболитов являются атропин, никотин, ТГК и кофеин. Люди обнаружили, что эти соединения вторичного метаболита являются богатым источником материалов для лекарств. Подсчитано, что 90% лекарств в современной фармации имеют свои «корни» в этих вторичных метаболитах.
Лечение травами первых людей открыло миру эти вторичные метаболиты. Например, коренные народы издавна использовали кору ивы и ольхи для приготовления чая, тонизирующего средства или припарки для уменьшения воспаления.
 Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Рис. 4.10. Кора тихоокеанской ивы содержит соединение салицин.Кора ивы и ольхи содержит соединение салицин. У большинства из нас это соединение есть в аптечке в виде салициловой кислоты или аспирина. Доказано, что аспирин уменьшает боль и воспаление, а в наших клетках салицин превращается в салициловую кислоту.
Так как же это работает? Салицин или аспирин действуют как ингибиторы ферментов. В воспалительной реакции два фермента, ЦОГ1 и ЦОГ2, играют ключевую роль в этом процессе. Салицин или аспирин специфически модифицируют аминокислоту (серин) в активном центре этих двух родственных ферментов. Эта модификация активных центров не позволяет нормальному субстрату связываться, поэтому воспалительный процесс прерывается. Как вы прочитали в этой главе, это делает его конкурентоспособным ингибитором ферментов.
Разработчик фармацевтических препаратов
Рисунок 4.11 Задумывались ли вы когда-нибудь, как разрабатываются фармацевтические препараты? (кредит: Дебора Остин)Ферменты являются ключевыми компонентами метаболических путей.
 Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).
Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).Возьмем, к примеру, статины. Статины — это название, данное одному классу препаратов, которые могут снижать уровень холестерина. Эти соединения являются ингибиторами фермента ГМГ-КоА-редуктазы, фермента, который синтезирует холестерин из липидов в организме. Ингибируя этот фермент, можно снизить уровень холестерина, синтезируемого в организме. Точно так же ацетаминофен, широко продаваемый под торговой маркой Тайленол, является ингибитором фермента циклооксигеназы. Хотя он используется для облегчения лихорадки и воспаления (боли), его механизм действия до сих пор полностью не изучен.
Как обнаруживаются наркотики? Одной из самых больших проблем при открытии лекарств является определение мишени для лекарства.
 Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов in vitro до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин.
Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов in vitro до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин.Многие ферменты не работают оптимально или вообще не работают, если они не связаны с другими специфическими небелковыми вспомогательными молекулами.
Рисунок 4.12. Витамины являются важными коферментами или предшественниками коферментов и необходимы для правильного функционирования ферментов. Мультивитаминные капсулы обычно содержат смеси всех витаминов в разном процентном соотношении. Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Ингибирование обратной связи в метаболических путях
Молекулы могут регулировать функцию ферментов разными способами. Однако остается главный вопрос: что это за молекулы и откуда они берутся? Как вы узнали, некоторые из них являются кофакторами и коферментами. Какие другие молекулы в клетке обеспечивают ферментативную регуляцию, такую как аллостерическая модуляция, конкурентное и неконкурентное ингибирование? Возможно, наиболее важными источниками регуляторных молекул в отношении ферментативного клеточного метаболизма являются продукты самих клеточных метаболических реакций. Наиболее эффективным и элегантным способом клетки научились использовать продукты своих собственных реакций для ингибирования активности ферментов по принципу обратной связи.
Рисунок 4.13 Метаболические пути представляют собой ряд реакций, катализируемых несколькими ферментами. Ингибирование с обратной связью, когда конечный продукт пути ингибирует восходящий процесс, является важным регуляторным механизмом в клетках. Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше.
Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше.Производство как аминокислот, так и нуклеотидов контролируется посредством ингибирования по принципу обратной связи. Кроме того, АТФ является аллостерическим регулятором некоторых ферментов, участвующих в катаболическом расщеплении сахара — процессе, который создает АТФ. Таким образом, когда АТФ в изобилии, клетка может предотвратить производство АТФ. С другой стороны, АДФ служит положительным аллостерическим регулятором (аллостерическим активатором) для некоторых из тех же ферментов, которые ингибируются АТФ.
 Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.
Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.Клетки выполняют функции жизни посредством различных химических реакций. Метаболизм клетки относится к комбинации химических реакций, происходящих в ней. Катаболические реакции расщепляют сложные химические вещества на более простые и связаны с выделением энергии. Анаболические процессы строят сложные молекулы из более простых и требуют энергии.
При изучении энергии термин «система» относится к материи и окружающей среде, участвующим в передаче энергии. Энтропия есть мера беспорядка системы. Физические законы, описывающие передачу энергии, — это законы термодинамики. Первый закон гласит, что общее количество энергии во Вселенной постоянно. Второй закон термодинамики гласит, что каждая передача энергии связана с некоторой потерей энергии в непригодной для использования форме, такой как тепловая энергия. Энергия бывает разных форм: кинетической, потенциальной и свободной.
 Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.
Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.Ферменты — это химические катализаторы, ускоряющие химические реакции за счет снижения энергии их активации. Ферменты имеют активный центр с уникальной химической средой, которая подходит для определенных химических реагентов для этого фермента, называемых субстратами. Считается, что ферменты и субстраты связываются в соответствии с моделью индуцированного соответствия. Действие фермента регулируется для сохранения ресурсов и оптимального реагирования на окружающую среду.
Глоссарий
энергия активации: количество начальной энергии, необходимой для протекания реакции
активный центр: специфический участок фермента, где связывается субстрат изменение в активном центре, предотвращающее связывание с субстратом
анаболический: описывает путь, который требует затрат чистой энергии для синтеза сложных молекул из более простых
биоэнергетика: концепция потока энергии через живые системы
катаболический: описывает путь, по которому сложные молекулы расщепляются на более простые с образованием энергии в качестве дополнительного продукта реакции
конкурентное ингибирование: общий механизм регуляции активности фермента, при котором молекула, отличная от субстрата фермента, способна связываться с активным центром и предотвращать связывание самого субстрата, тем самым подавляя общую скорость реакции фермента
эндергонический: описывает химическую реакцию, в результате которой образуются продукты, хранящие больше химической потенциальной энергии, чем реагенты.

фермент: молекула, катализирующая биохимическую реакцию. с меньшей химической потенциальной энергией, чем у реагентов, плюс высвобождение свободной энергии
ингибирование по принципу обратной связи: механизм регуляции активности фермента, при котором продукт реакции или конечный продукт ряда последовательных реакций ингибирует фермент на некоторое время. более ранний шаг в серии реакций
тепловая энергия: энергия, передаваемая из одной системы в другую, которая не является работой
кинетическая энергия: вид энергии, связанный с движущимися объектами , включая те, которые используют энергию, и те, которые выделяют энергию
неконкурентное ингибирование: общий механизм регуляции активности фермента, при котором регуляторная молекула связывается с сайтом, отличным от активного центра, и предотвращает связывание активным центром субстрата; таким образом, молекула ингибитора не конкурирует с субстратом за активный центр; аллостерическое торможение является формой неконкурентного торможения
потенциальная энергия: тип энергии, относящийся к способности выполнять работу
субстрат: молекула, на которую действует фермент
License
Concepts of Biology — 1st Canadian Edition Чарльза Молнара и Джейн Гейр распространяется по лицензии Creative Commons Attribution 4.
 0 International License, если не указано иное.
0 International License, если не указано иное.Поделиться этой книгой
Поделиться в Твиттере
6.1: Энергия и обмен веществ – Роль энергии и обмена веществ
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13100
- Безграничный
- Безграничный
Цели обучения
- Объяснить важность метаболизма
Энергия и метаболизм
Все живые организмы нуждаются в энергии для роста и размножения, поддержания своих структур и реакции на окружающую среду. Метаболизм — это набор поддерживающих жизнь химических процессов, которые позволяют организмам преобразовывать химическую энергию, хранящуюся в молекулах, в энергию, которая может использоваться для клеточных процессов.
 Животные потребляют пищу для восполнения энергии; их метаболизм расщепляет углеводы, липиды, белки и нуклеиновые кислоты, чтобы обеспечить химическую энергию для этих процессов. Растения преобразуют световую энергию солнца в химическую энергию, хранящуюся в молекулах в процессе фотосинтеза.
Животные потребляют пищу для восполнения энергии; их метаболизм расщепляет углеводы, липиды, белки и нуклеиновые кислоты, чтобы обеспечить химическую энергию для этих процессов. Растения преобразуют световую энергию солнца в химическую энергию, хранящуюся в молекулах в процессе фотосинтеза.Биоэнергетика и химические реакции
Ученые используют термин биоэнергетика для обсуждения концепции потока энергии через живые системы, такие как клетки. Клеточные процессы, такие как построение и разрушение сложных молекул, происходят посредством пошаговых химических реакций. Некоторые из этих химических реакций протекают самопроизвольно и высвобождают энергию, тогда как для протекания других требуется энергия. Все химические реакции, протекающие внутри клеток, включая те, которые используют энергию, и те, которые высвобождают энергию, являются клеточным метаболизмом.
Рисунок \(\PageIndex{1}\): Большая часть энергии прямо или косвенно поступает от солнца: Большинство форм жизни на Земле получают энергию от солнца. Растения используют фотосинтез для захвата солнечного света, а травоядные едят эти растения для получения энергии. Плотоядные поедают травоядных, а редуценты переваривают растительную и животную пищу.
Растения используют фотосинтез для захвата солнечного света, а травоядные едят эти растения для получения энергии. Плотоядные поедают травоядных, а редуценты переваривают растительную и животную пищу.Клеточный метаболизм
Каждая задача, выполняемая живыми организмами, требует энергии. Энергия необходима для выполнения тяжелой работы и физических упражнений, но люди также используют много энергии, думая и даже во сне. Для каждого действия, требующего энергии, происходит множество химических реакций, обеспечивающих химической энергией системы организма, включая мышцы, нервы, сердце, легкие и мозг.
Живые клетки каждого организма постоянно используют энергию для выживания и роста. Клетки расщепляют сложные углеводы на простые сахара, которые клетка может использовать для получения энергии. Мышечные клетки могут потреблять энергию для построения длинных мышечных белков из небольших молекул аминокислот. Молекулы могут модифицироваться и транспортироваться по клетке или распространяться по всему организму.
 Точно так же, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для распада молекул.
Точно так же, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для распада молекул.Многие клеточные процессы требуют постоянного поступления энергии, обеспечиваемой клеточным метаболизмом. Сигнальные молекулы, такие как гормоны и нейротрансмиттеры, должны быть синтезированы, а затем транспортированы между клетками. Болезнетворные бактерии и вирусы попадают в клетки и разрушаются. Клетки также должны экспортировать отходы и токсины, чтобы оставаться здоровыми, и многие клетки должны плавать или перемещать окружающие материалы посредством биения клеточных придатков, таких как реснички и жгутики.
Рисунок \(\PageIndex{1}\): Еда дает энергию для таких действий, как полет. Колибри нужна энергия для поддержания продолжительных периодов полета. Колибри получает энергию от приема пищи и преобразования питательных веществ в энергию посредством ряда биохимических реакций. Летающие мышцы у птиц чрезвычайно эффективны в производстве энергии.
 J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]
J Phys Chem B. 25 июля 2019 г.; 123 (29): 6253-6259. [PubMed: 31246466]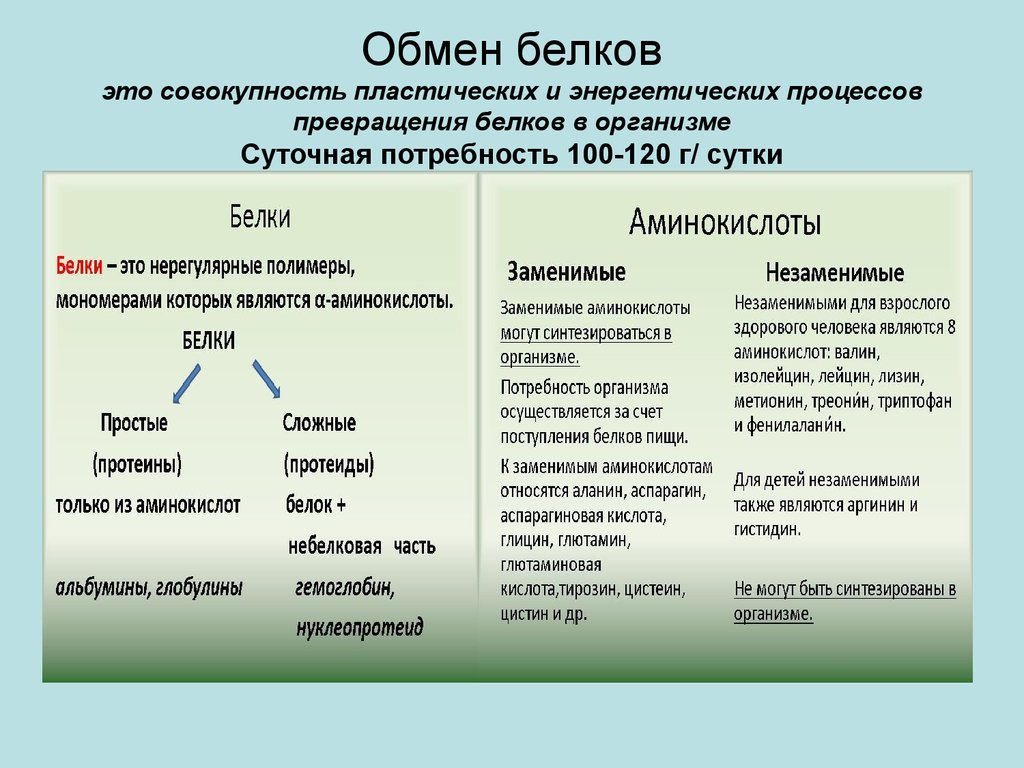 [PubMed: 23680095]
[PubMed: 23680095] 2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]
2013 апр; 32 (2): 309-13. [Бесплатная статья PMC: PMC3595342] [PubMed: 23260197]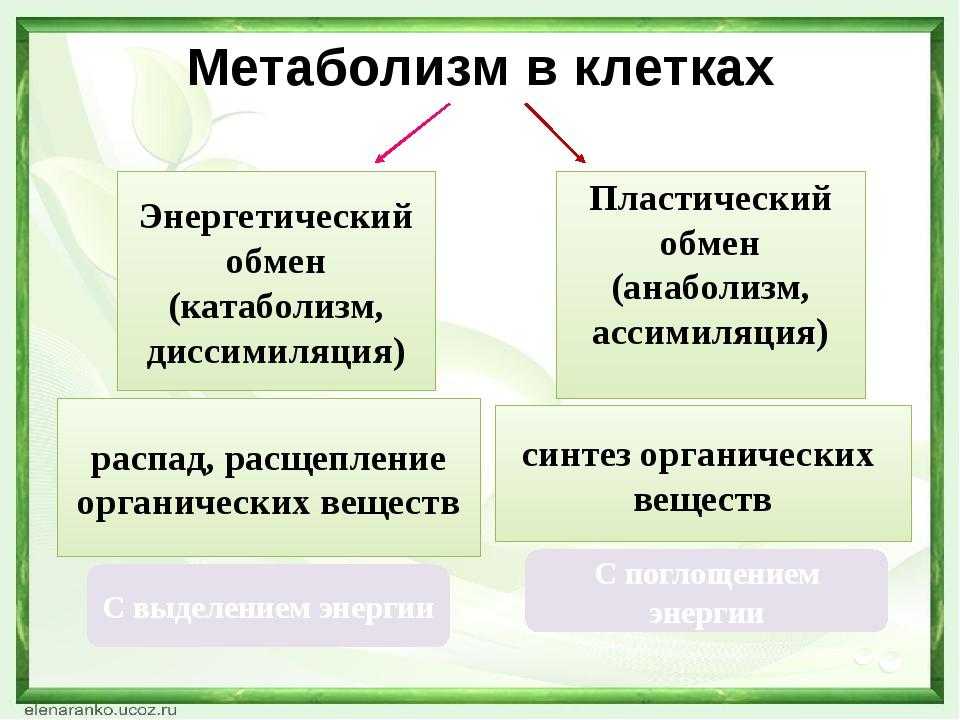
 Плотоядные поедают травоядных, а возможное разложение растительного и животного материала способствует накоплению питательных веществ.
Плотоядные поедают травоядных, а возможное разложение растительного и животного материала способствует накоплению питательных веществ. В световых реакциях фотосинтеза энергия обеспечивается молекулой под названием аденозинтрифосфат (АТФ) , которая является основной энергетической валютой всех клеток. Точно так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения непосредственной работы. Напротив, молекулы-аккумуляторы энергии, такие как глюкоза, потребляются только для того, чтобы расщепляться для использования своей энергии. Реакция, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, может быть обобщена как реакция, обратная фотосинтезу. В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как:
В световых реакциях фотосинтеза энергия обеспечивается молекулой под названием аденозинтрифосфат (АТФ) , которая является основной энергетической валютой всех клеток. Точно так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения непосредственной работы. Напротив, молекулы-аккумуляторы энергии, такие как глюкоза, потребляются только для того, чтобы расщепляться для использования своей энергии. Реакция, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, может быть обобщена как реакция, обратная фотосинтезу. В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как: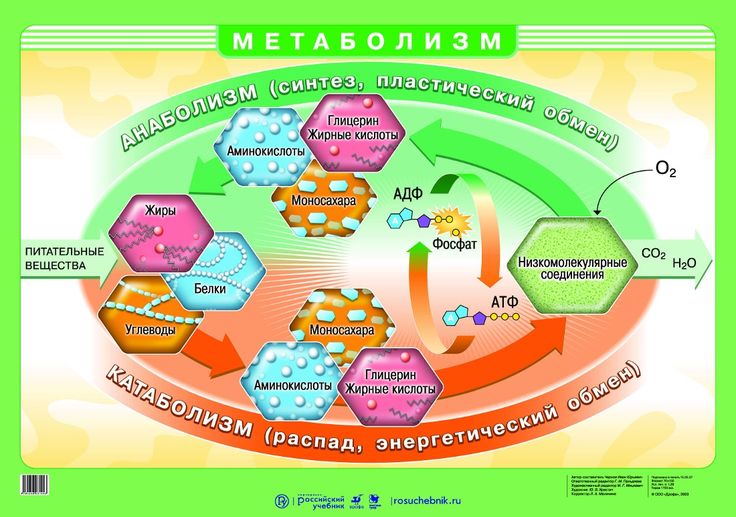 Метаболический путь представляет собой серию химических реакций, в которых исходная молекула шаг за шагом модифицируется через ряд метаболических промежуточных продуктов, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, и второй, производящий энергию, — называются анаболические пути (строительство полимеров) и катаболические пути (расщепление полимеров на их мономеры) соответственно. Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Метаболический путь представляет собой серию химических реакций, в которых исходная молекула шаг за шагом модифицируется через ряд метаболических промежуточных продуктов, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, и второй, производящий энергию, — называются анаболические пути (строительство полимеров) и катаболические пути (расщепление полимеров на их мономеры) соответственно. Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
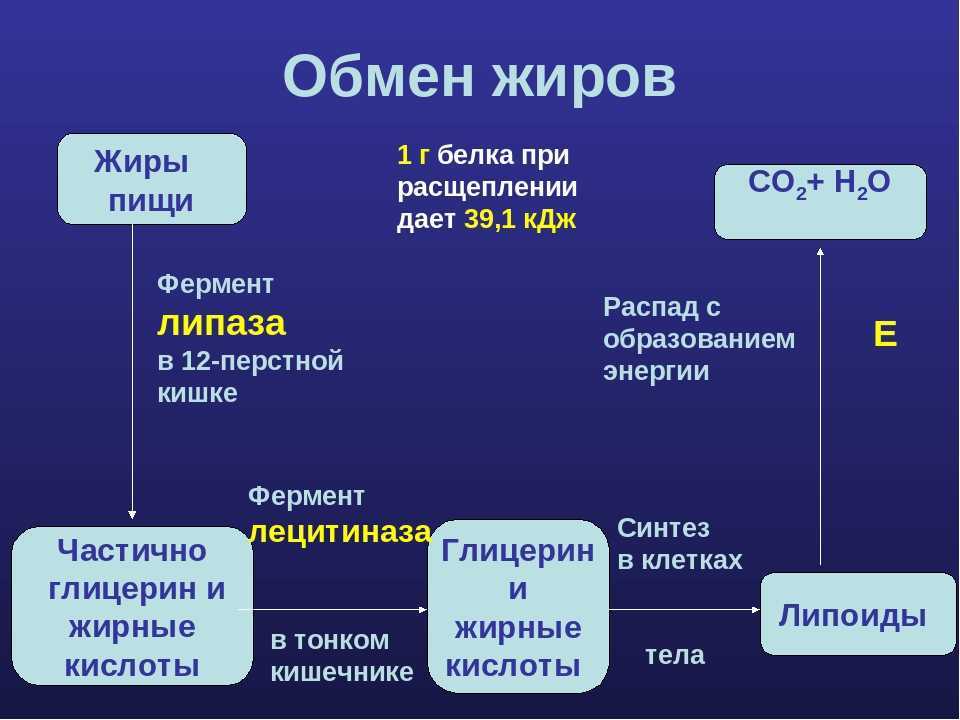 Как и все вещи в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии во всех системах во Вселенной и между ними.
Как и все вещи в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии во всех системах во Вселенной и между ними.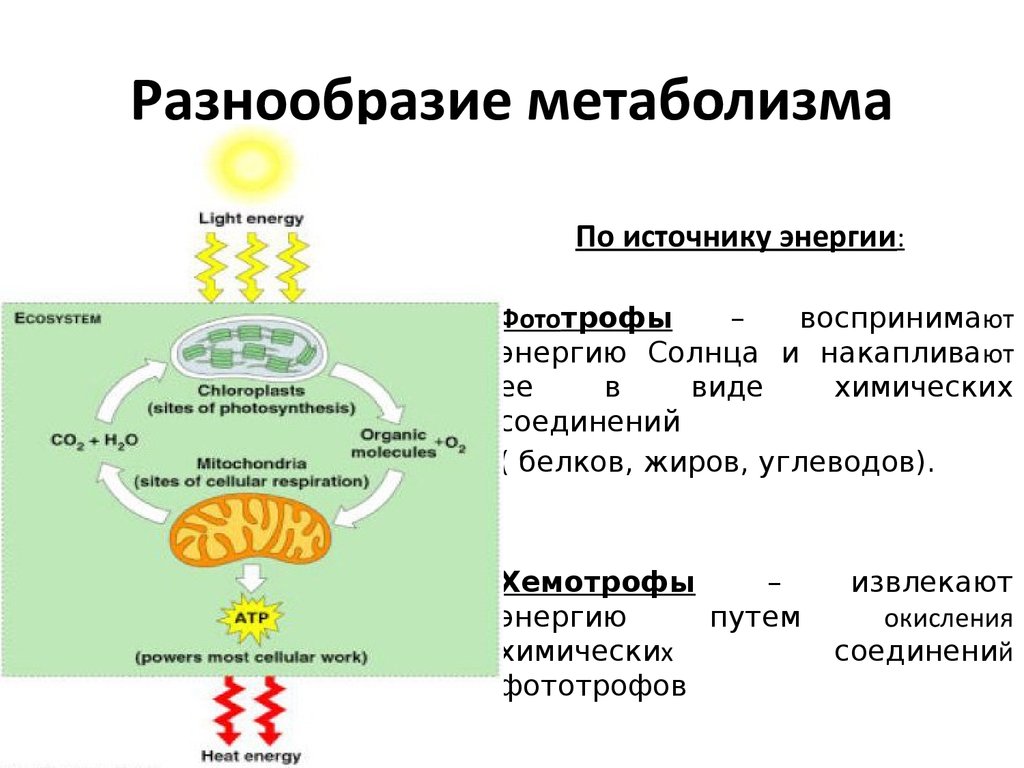 Лампочки преобразуют электрическую энергию в световую и тепловую энергию. Газовые плиты преобразуют химическую энергию природного газа в тепловую энергию. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.
Лампочки преобразуют электрическую энергию в световую и тепловую энергию. Газовые плиты преобразуют химическую энергию природного газа в тепловую энергию. Растения осуществляют одно из наиболее биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.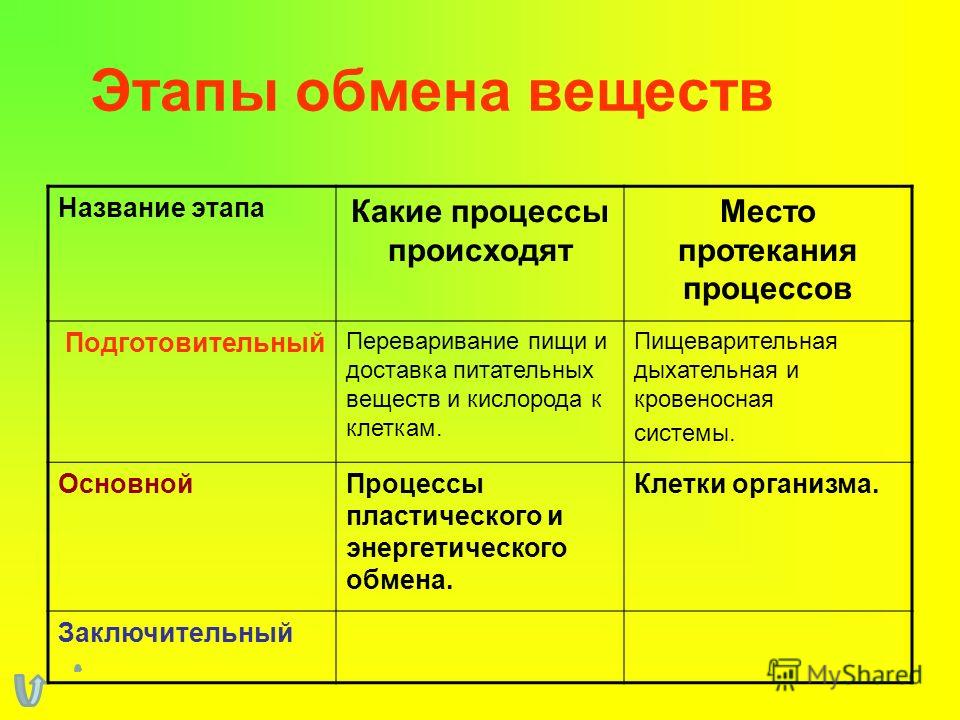
 Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, которая не является работой. Например, когда включается лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии. Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, которая не является работой. Например, когда включается лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии. Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
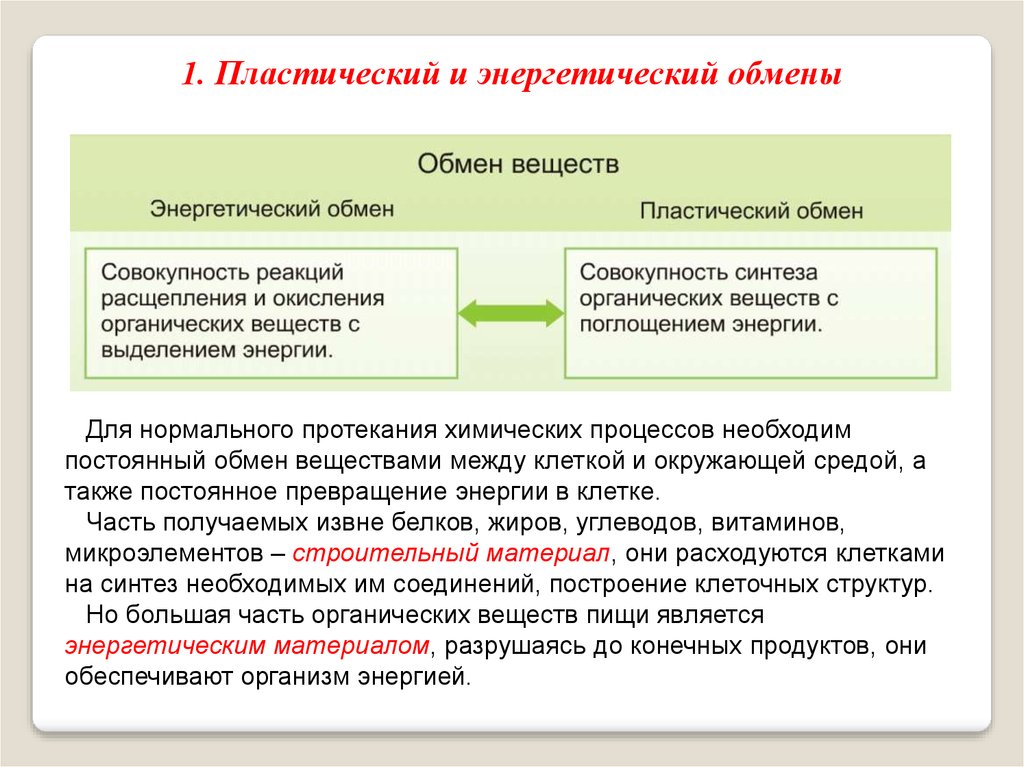 Разрушительные шары также качаются, как маятник; во время качелей происходит постоянное изменение потенциальной энергии (наибольшей в верхней части качелей) на кинетическую энергию (наибольшей в нижней части качелей). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или энергию человека, собирающегося прыгнуть с парашютом из самолета.
Разрушительные шары также качаются, как маятник; во время качелей происходит постоянное изменение потенциальной энергии (наибольшей в верхней части качелей) на кинетическую энергию (наибольшей в нижней части качелей). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или энергию человека, собирающегося прыгнуть с парашютом из самолета. Тот факт, что энергия может высвобождаться при разрыве определенных химических связей, подразумевает, что эти связи обладают потенциальной энергией. На самом деле существует потенциальная энергия, хранящаяся в связях всех пищевых молекул, которые мы едим, и которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи.
Тот факт, что энергия может высвобождаться при разрыве определенных химических связей, подразумевает, что эти связи обладают потенциальной энергией. На самом деле существует потенциальная энергия, хранящаяся в связях всех пищевых молекул, которые мы едим, и которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи. Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.
Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.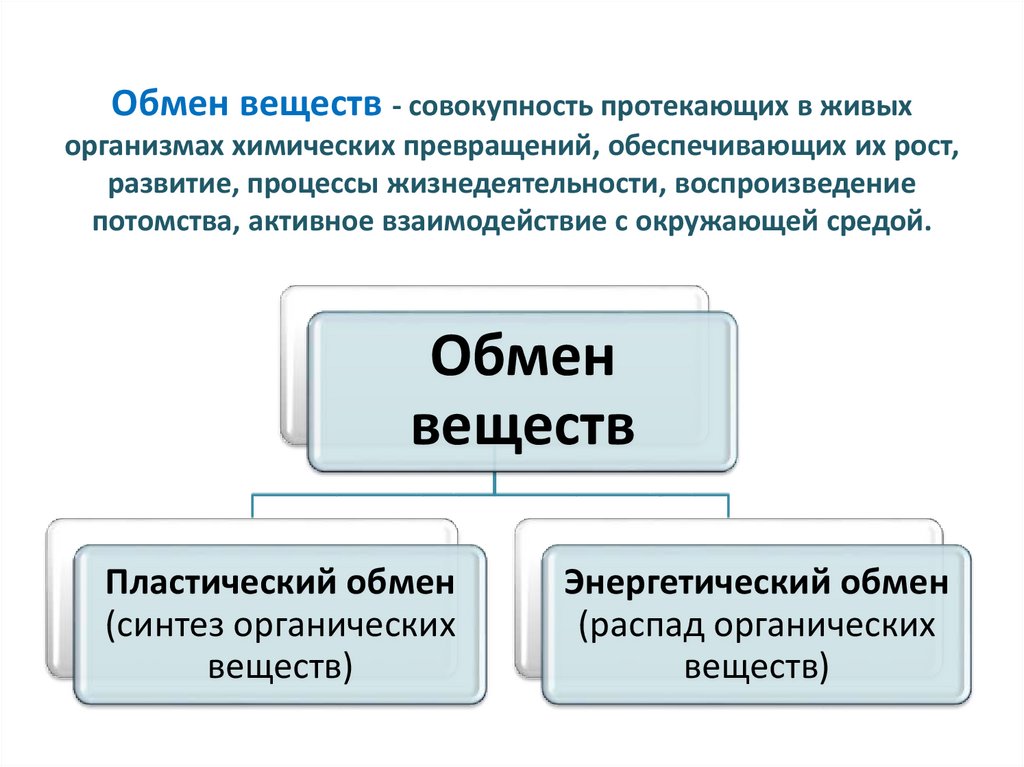 Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.
Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.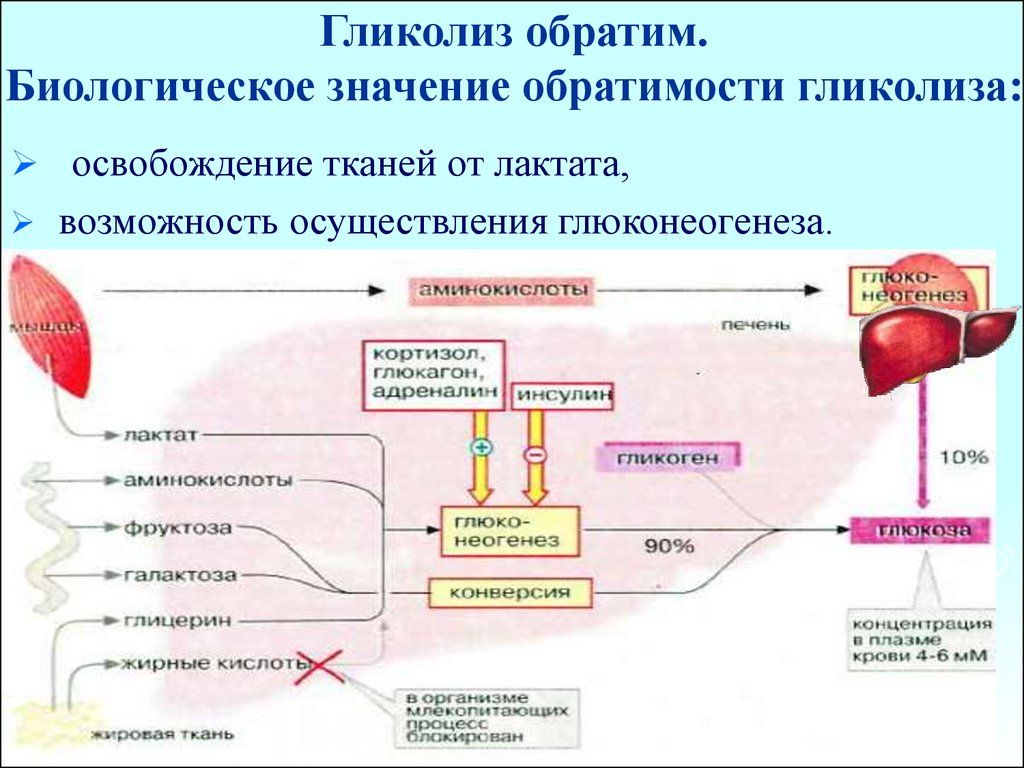 6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)
6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)
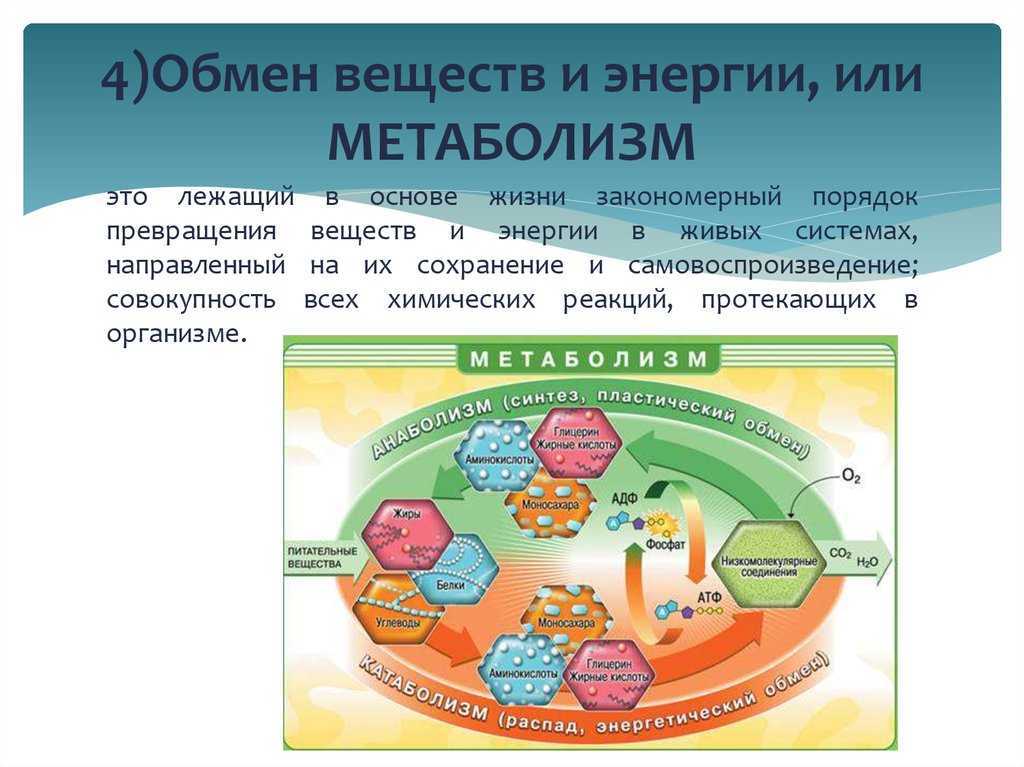 После катализа одной реакции фермент может участвовать в других реакциях.
После катализа одной реакции фермент может участвовать в других реакциях. Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).
Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).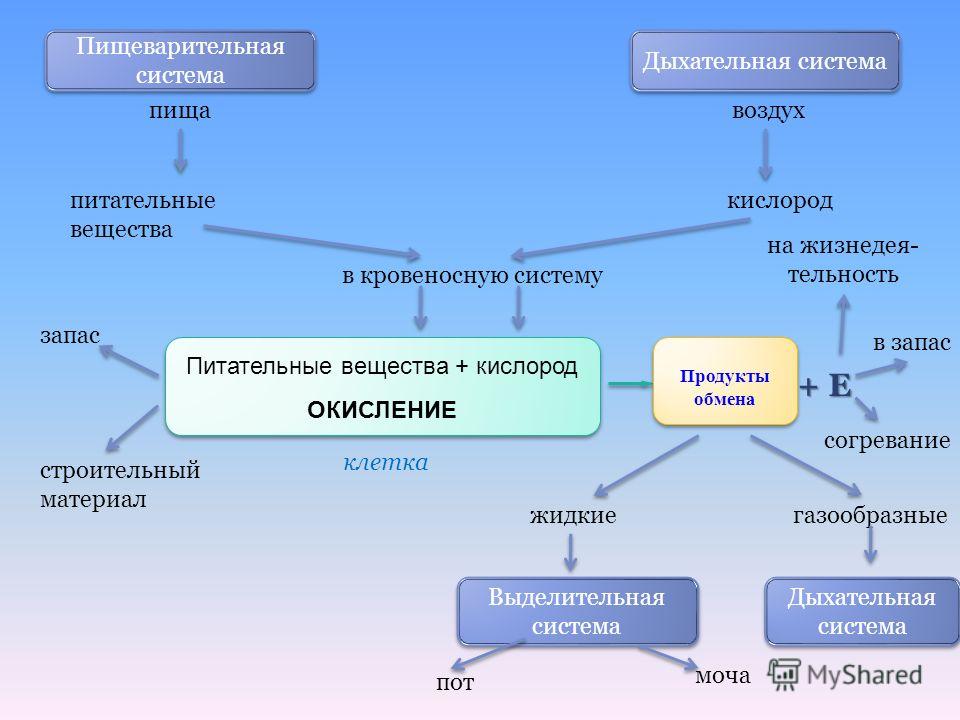 Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом.
Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом. Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.
Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.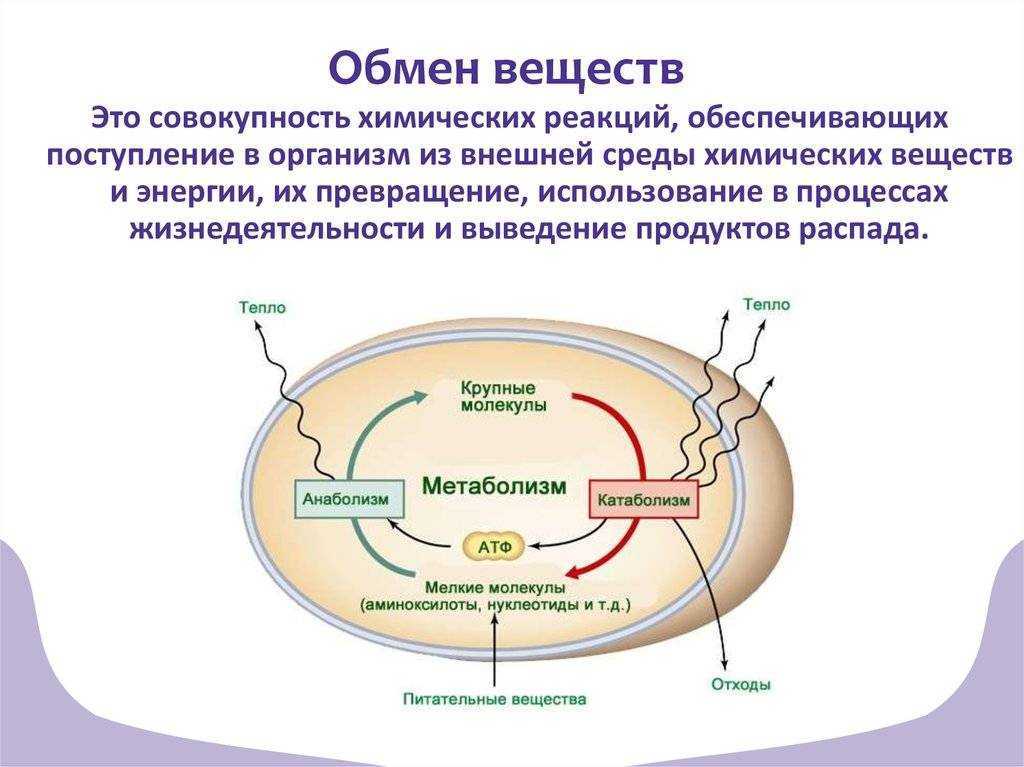
 Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.
Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами. Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).).
Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).).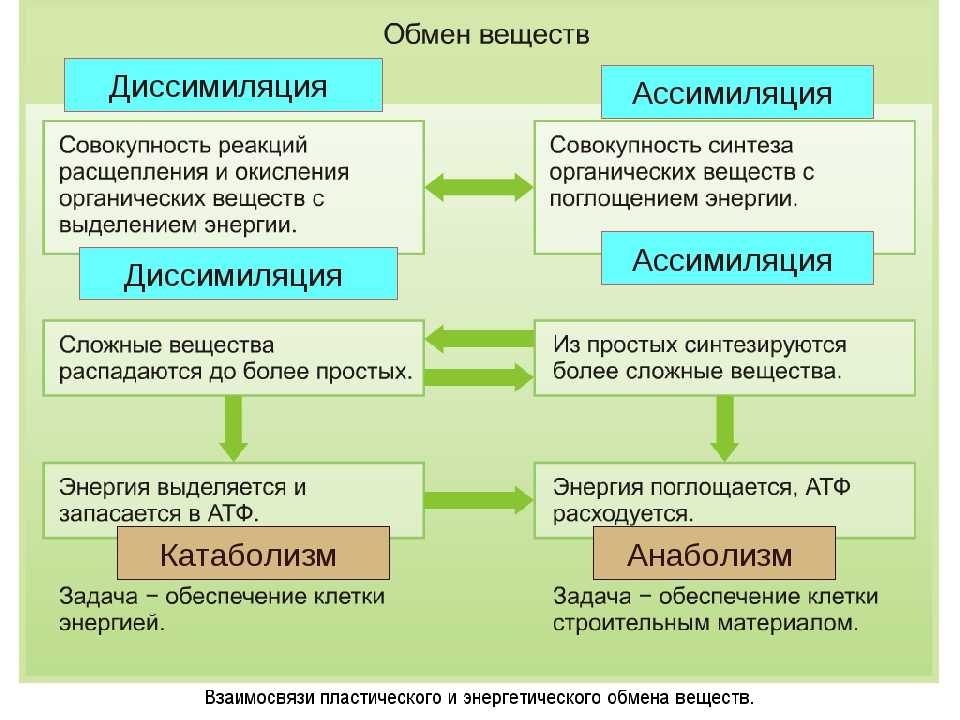 Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.
Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.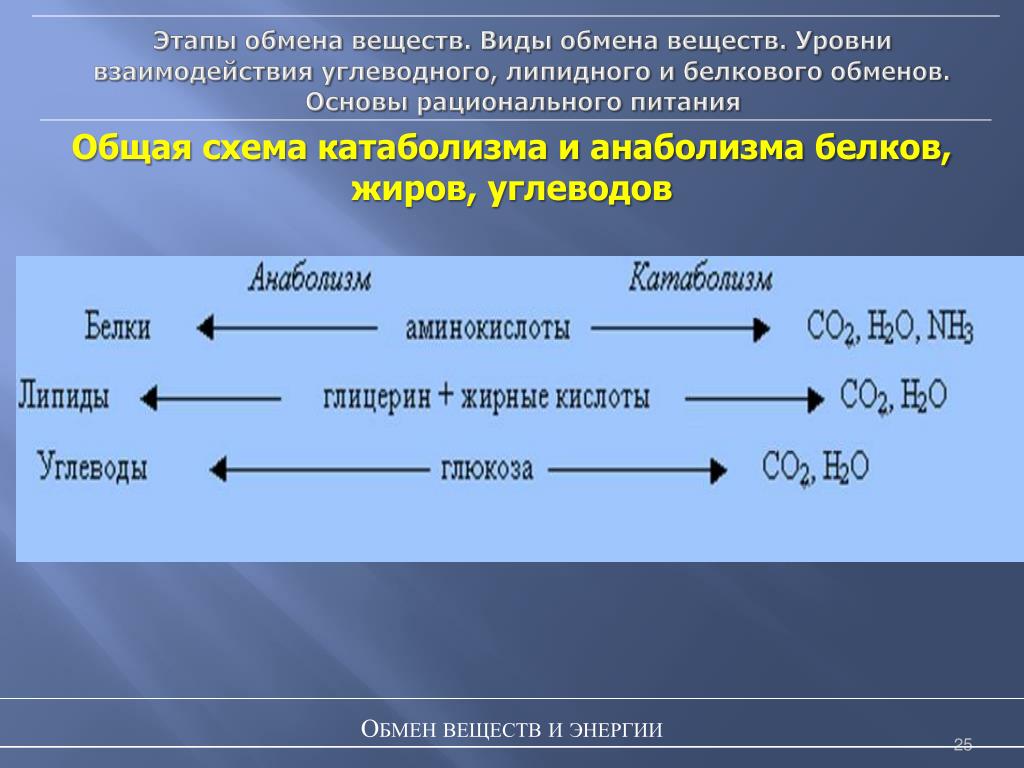 Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.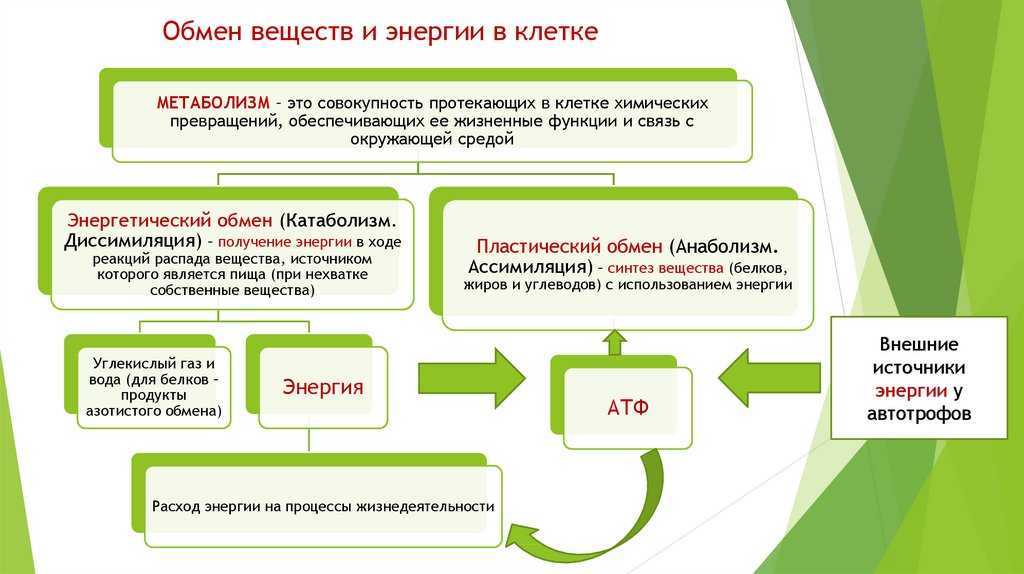 Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).
Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).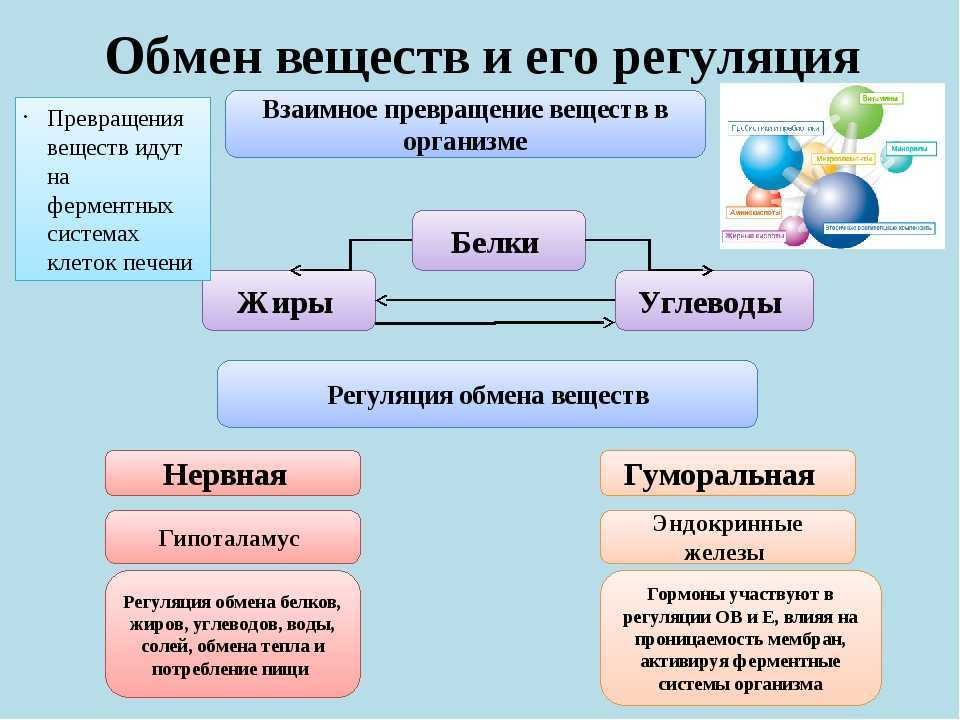 Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов in vitro до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин.
Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов in vitro до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин. Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
 Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше.
Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше. Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.
Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.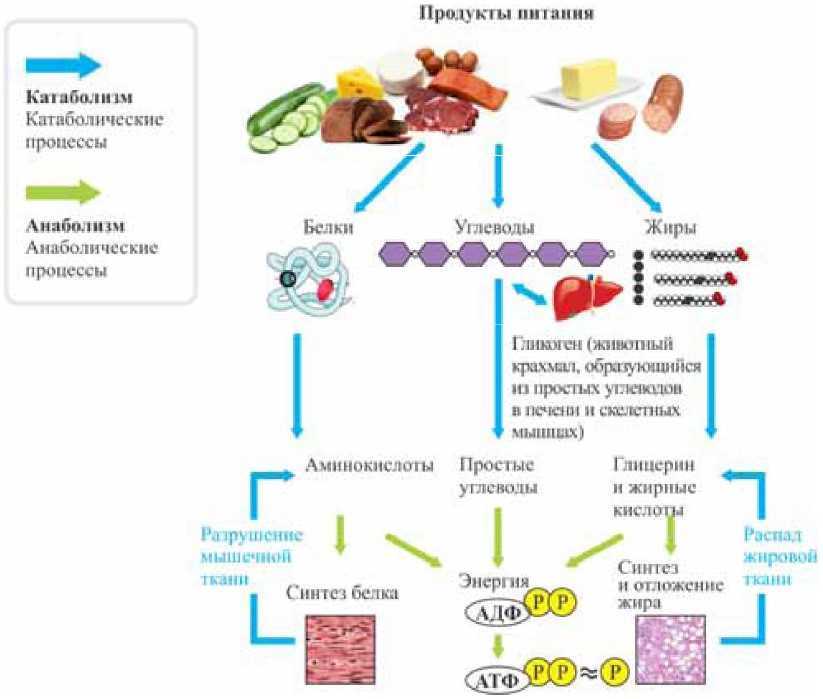 Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.
Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.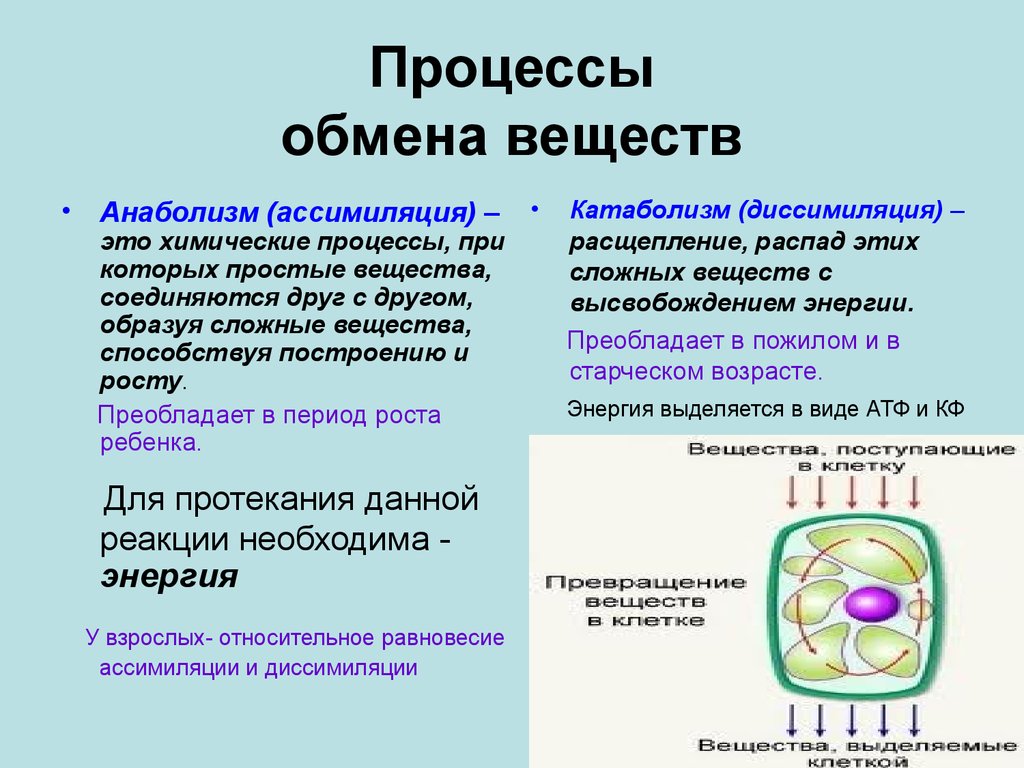
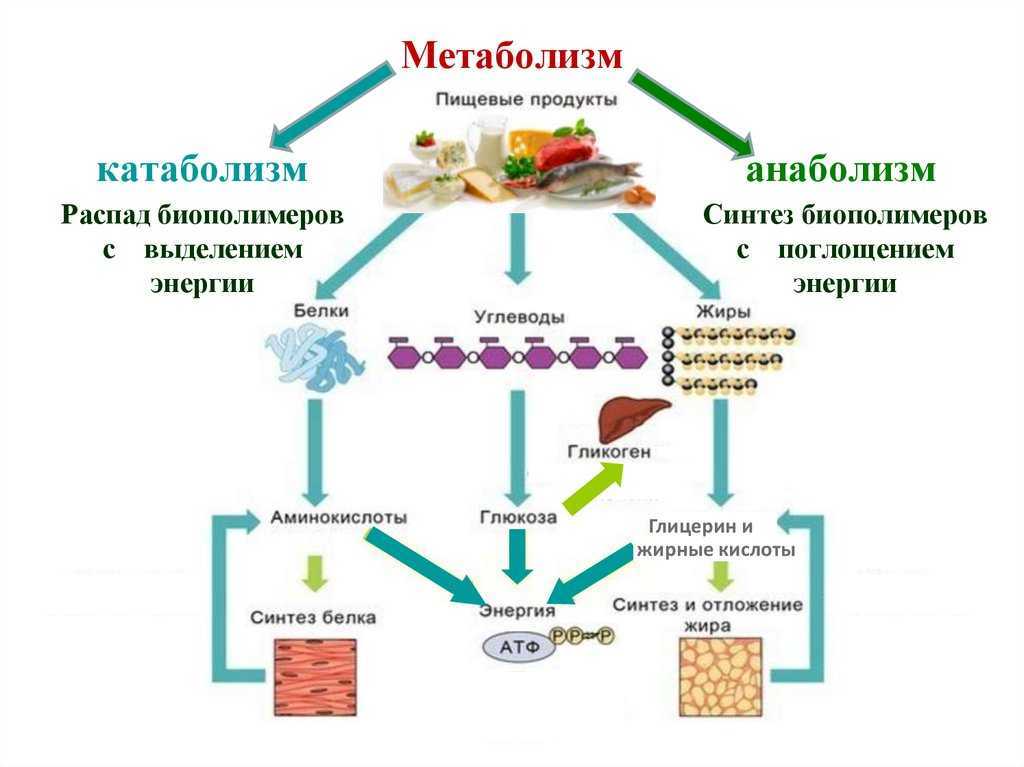 0 International License, если не указано иное.
0 International License, если не указано иное. Животные потребляют пищу для восполнения энергии; их метаболизм расщепляет углеводы, липиды, белки и нуклеиновые кислоты, чтобы обеспечить химическую энергию для этих процессов. Растения преобразуют световую энергию солнца в химическую энергию, хранящуюся в молекулах в процессе фотосинтеза.
Животные потребляют пищу для восполнения энергии; их метаболизм расщепляет углеводы, липиды, белки и нуклеиновые кислоты, чтобы обеспечить химическую энергию для этих процессов. Растения преобразуют световую энергию солнца в химическую энергию, хранящуюся в молекулах в процессе фотосинтеза.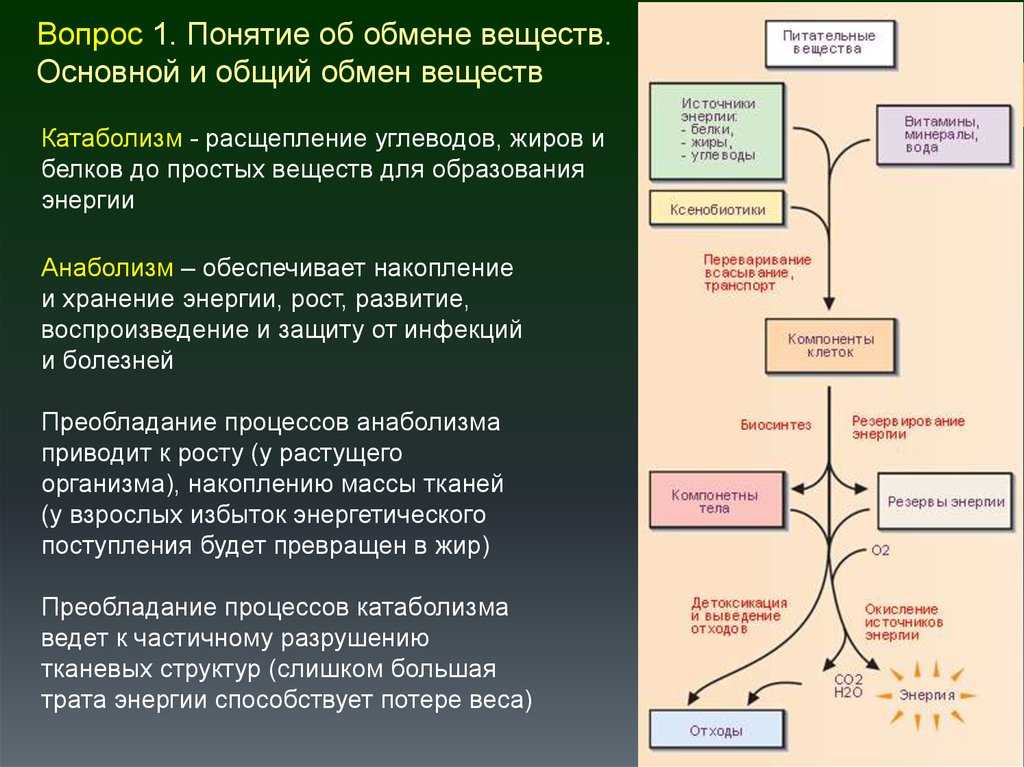 Растения используют фотосинтез для захвата солнечного света, а травоядные едят эти растения для получения энергии. Плотоядные поедают травоядных, а редуценты переваривают растительную и животную пищу.
Растения используют фотосинтез для захвата солнечного света, а травоядные едят эти растения для получения энергии. Плотоядные поедают травоядных, а редуценты переваривают растительную и животную пищу. Точно так же, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для распада молекул.
Точно так же, как энергия требуется как для строительства, так и для сноса здания, энергия требуется как для синтеза, так и для распада молекул.