Хирургия релаксации диафрагмы
В основе релаксации диафрагмы (РД) лежит нарушение ее иннервации различного генеза, приводящее к дегенеративным изменениям мышечной части грудобрюшной преграды. В последние годы с развитием кардиохирургии, повышением агрессивности онкологических операций на грудной клетке и шее наметилась тенденция к увеличению числа пациентов с релаксацией диафрагмы. В результате травмы диафрагмального нерва любого происхождения развивается вторичная невротическая дистрофия мышц, диафрагма резко истончается, растягивается и теряет не только свою дыхательную, но и разделительную функции. Сохраняется группа пациентов с так называемой идиопатической релаксацией, т. е. когда не удается выявить причину нарушения иннервации диафрагмы. До настоящего времени взгляды на тактику лечения РД остаются противоречивыми, что во многом связано с относительной редкостью заболевания и малым количеством наблюдений, публикуемых отдельными авторами. Вопросы выбора оперативного доступа, способа хирургической коррекции и сроки, в которые она должна выполняться после манифестации заболевания, остаются предметом обсуждения.
Цель настоящего исследования — определение оптимальной тактики хирургического лечения больных с приобретенной РД.
Материал и методы
В исследовании представлен ретроспективный анализ хирургического лечения 25 больных приобретенной релаксацией диафрагмы в отделении хирургии легких и средостения РНЦХ им. акад. Б.В. Петровского и отделении торакальной хирургии УКБ№ 1 Первого МГМУ им. И.М. Сеченова в период с 1963 по 2016 г. Проанализированы основные демографические и клинические характеристики, диагностические и операционные данные, а также послеоперационный период. Отдаленный результат оценивали путем анкетирования пациентов по почте и телефону.
Среди 25 пациентов было 15 (60%) мужчин и 10 (40%) женщин.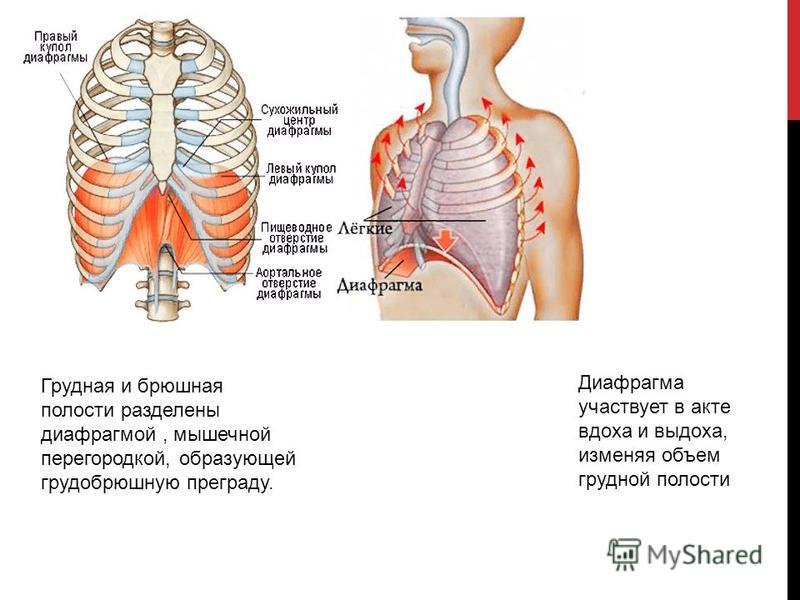 Возраст больных варьировал от 39 до 65 лет и в среднем составил 52,1 года (табл. 1). Таблица 1. Распределение пациентов по полу и возрасту (n=25) Большинство больных были трудоспособного возраста.
Возраст больных варьировал от 39 до 65 лет и в среднем составил 52,1 года (табл. 1). Таблица 1. Распределение пациентов по полу и возрасту (n=25) Большинство больных были трудоспособного возраста.
У всех пациентов релаксация диафрагмы носила односторонний характер. У 18 (72%) человек был поражен правый купол диафрагмы, у 7 (28%) левый купол. Установить причину релаксации диафрагмы удалось только у 8 (32%) больных. Среди них 5 пациентов перенесли различные операции на шее или органах грудной клетки, а у 3 больных в анамнезе была закрытая травма груди. У 17 (68%) пациентов выявить причину релаксации не удалось и она расценена как идиопатическая (табл. 2). Таблица 2. Этиология релаксации диафрагмы
У всех пациентов имелись различные клинические проявления заболевания, среди которых основной была жалоба на одышку. Ее интенсивность варьировала от одышки при физической нагрузке до нехватки воздуха в покое. Отмечали кашель у 14 (56%) пациентов, сердцебиение у 9 (36%), боль в грудной клетке у 9 (36%), слабость у 7 (28%).
Представленное исследование охватывало период больше 50 лет, в связи с чем протокол обследования больных менялся с развитием диагностических возможностей. В основе инструментальной диагностики лежали лучевые методы исследования. Рентгенографию и рентгеноскопию органов грудной клетки выполнили всем пациентам (табл. 3). Таблица 3. Результаты рентгенологического исследования пациентов (n=25)
Абсолютно у всех больных диагностировали высокое расположение купола диафрагмы (рис. 1). Рис. 1. Компьютерные томограммы. Определяется высокое расположение левого купола диафрагмы. а — под высоко расположенной диафрагмой определяются внутренние органы брюшной полости, содержащие воздух; б — определяется междолевая борозда. Нижняя доля резко уменьшена в размере из-за ее сдавливания диафрагмой. Преобладали пациенты, у которых вершина купола диафрагмы располагалась на уровне переднего отрезка III или IV ребра (табл. 4). Таблица 4. Выраженность релаксации диафрагмы
1). Рис. 1. Компьютерные томограммы. Определяется высокое расположение левого купола диафрагмы. а — под высоко расположенной диафрагмой определяются внутренние органы брюшной полости, содержащие воздух; б — определяется междолевая борозда. Нижняя доля резко уменьшена в размере из-за ее сдавливания диафрагмой. Преобладали пациенты, у которых вершина купола диафрагмы располагалась на уровне переднего отрезка III или IV ребра (табл. 4). Таблица 4. Выраженность релаксации диафрагмы
В 60—70-е годы XX века в дополнение к рентгенографии и рентгеноскопии выполняли рентгенокимографию диафрагмы. При этом отмечали уменьшение амплитуды движений пораженного купола диафрагмы и неправильный характер дыхательных зубцов. Однако этот метод был недостаточно точным. Со временем он потерял свою значимость и в дальнейшем его не использовали.
Рентгеноконтрастное исследование желудочно-кишечного тракта провели только 3 (12%) пациентам с левосторонней локализацией релаксации. При этом диагностировали увеличение газового пузыря и смещение вверх располагающегося под диафрагмой желудка, что подтверждало диагноз релаксации.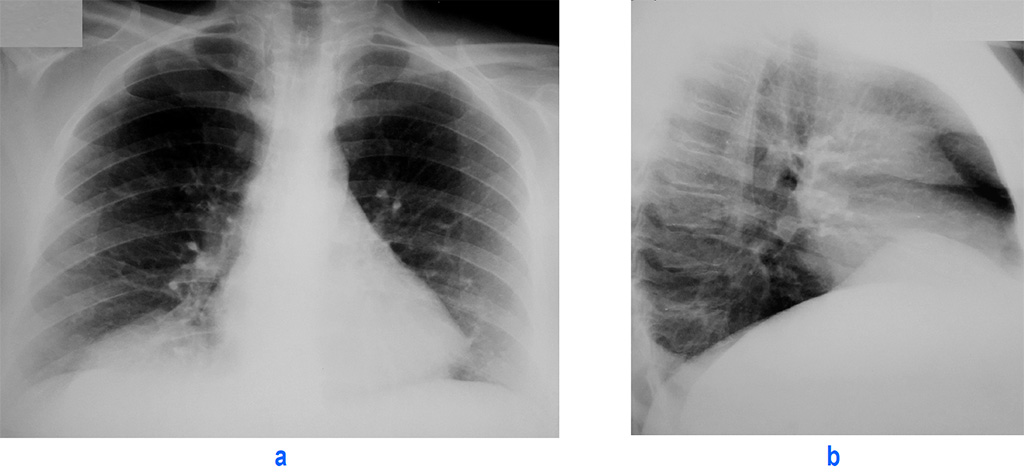
С 1981 г. всем пациентам выполняли компьютерную томографию, которая стала основным методом диагностики. Метод позволял оценить толщину мышечной части диафрагмы, а также с уверенностью исключить посттравматический дефект купола диафрагмы и установить правильный диагноз. Современная мультиспиральная компьютерная томография (МСКТ) позволяет правильно спланировать план операции и выбрать оптимальный срок хирургического вмешательства.
Наличие одышки у всех пациентов подтвердили инструментальными методами диагностики. Во всех случаях при спирометрии выявили нарушение функции внешнего дыхания. Среднее снижение жизненной емкости легких составило 35,4%, а ОФВ1 — 41,1%.
Всех пациентов оперировали открытым способом через торакотомный доступ. Используемая нами методика реконструкции купола диафрагмы была предложена Б.В. Петровским в 1957 г. Мы ее применяем с определенной модернизацией, связанной с появлением новых укрепляющих материалов. Укладка пациента на операционном столе была классической — на здоровом боку с отведенной рукой. Выполняли боковую или заднебоковую торакотомию в VII или VIII межреберье. После разведения операционной раны обнаруживали истонченный купол диафрагмы, иногда и поджатый край ателектазированного легкого (рис. 2). Рис. 2. Фото этапов операции. Торакотомия слева. Определяется истонченный купол диафрагмы, через который видны органы брюшной полости (а). Рассечение истонченной диафрагмы (б). Через истонченную диафрагму просвечивались органы брюшной полости. В случае наличия сращений между диафрагмой и диафрагмальной поверхностью легкого последние разделялись острым путем с использованием электрокоагуляции. С целью мобилизации легкого и лучшей визуализации всего купола диафрагмы пересекали легочную связку. Диафрагму гофрировали до предполагаемого физиологического положения. Это помогало определить место рассечения купола и смоделировать будущую пластику с формированием дупликатуры. Диафрагму брали на держалки и рассекали в сагиттальном направлении до мест ее прикрепления к грудной стенке таким образом, что образовывались два диафрагмальных лоскута (рис.
Выполняли боковую или заднебоковую торакотомию в VII или VIII межреберье. После разведения операционной раны обнаруживали истонченный купол диафрагмы, иногда и поджатый край ателектазированного легкого (рис. 2). Рис. 2. Фото этапов операции. Торакотомия слева. Определяется истонченный купол диафрагмы, через который видны органы брюшной полости (а). Рассечение истонченной диафрагмы (б). Через истонченную диафрагму просвечивались органы брюшной полости. В случае наличия сращений между диафрагмой и диафрагмальной поверхностью легкого последние разделялись острым путем с использованием электрокоагуляции. С целью мобилизации легкого и лучшей визуализации всего купола диафрагмы пересекали легочную связку. Диафрагму гофрировали до предполагаемого физиологического положения. Это помогало определить место рассечения купола и смоделировать будущую пластику с формированием дупликатуры. Диафрагму брали на держалки и рассекали в сагиттальном направлении до мест ее прикрепления к грудной стенке таким образом, что образовывались два диафрагмальных лоскута (рис.
После низведения органов брюшной полости в привычное положение приступали к пластике диафрагмы (рис. 4). Рис. 4. Фото этапов операции. Тот же больной. Органы погружены в брюшную полость. Внутренний лоскут диафрагмы фиксирован к основанию наружного лоскута (а).

Внутригоспитальной летальности не было. В послеоперационном периоде осложнения возникли у 6 (20%) больных. В их числе у 4 (16%) диагностировали плеврит на стороне операции, что потребовало пункционного лечения. У 1 (4%) больного возникло нагноение послеоперационной раны, которое было купировано местным лечением. Серьезное осложнение диагностировали у одной пациентки с релаксацией левого купола диафрагмы. У нее имелась сопутствующая грыжа пищеводного отверстия диафрагмы. На 3-и сутки после операции возникла клиника ущемления желудка, что в дальнейшем привело к формированию желудочно-плеврального свища. Консервативная терапия в виде дренирования плевры и парентерального питания первоначально имела хороший результат. Больную выписали. Однако спустя несколько дней состояние ее ухудшилось и в стационаре по месту жительства ее экстренно оперировали. Выполнили попытку разобщения свища и ушивание желудка. В дальнейшем пациентка перенесла несколько операций, направленных на разобщение желудочно-пищеводно-плеврального свища.
В отдаленном периоде рецидивов релаксации не было. Отдаленные результаты с детальным обследованием, включая сравнение функции внешнего дыхания до и после операции, удалось проследить только у пациентов, оперированных по поводу релаксации диафрагмы в течение последних 15—20 лет (12 пациентов). Сроки наблюдения у них составили от 8 мес до 12 лет. Поскольку основным клиническим проявлением релаксации диафрагмы была одышка, то основной акцент в изучении отдаленных результатов сделали в изучении этого синдрома. Провели оценку изменения функции внешнего дыхания и выраженности одышки по шкале MRC до и после операции. При этом большинство больных отметили уменьшение одышки, что подтвердили объективными методами диагностики — увеличение показателей ЖЕЛ и ОФВ1 в отдаленном периоде (табл. 5). Таблица 5. Показатели функции внешнего дыхания и степень одышки по MRC пациентов до и после операции
Провели оценку изменения функции внешнего дыхания и выраженности одышки по шкале MRC до и после операции. При этом большинство больных отметили уменьшение одышки, что подтвердили объективными методами диагностики — увеличение показателей ЖЕЛ и ОФВ1 в отдаленном периоде (табл. 5). Таблица 5. Показатели функции внешнего дыхания и степень одышки по MRC пациентов до и после операции
Для оценки качества жизни в отдаленном периоде использовали опросник SF-36, который позволяет дать количественную характеристику физического, эмоционального, социального компонентов качества жизни. Опросник SF-36 относится к неспецифическим опросникам и зарекомендовал себя как надежный, валидный и чувствительный метод. Опросник содержит 36 пунктов, которые сгруппированы в восемь шкал: физическое функционирование (Physical Functioning — PF), ролевая деятельность (Role-Physical Functioning — RP), телесная боль (Bodily pain — BP), общее здоровье (General Health — GH), жизнеспособность (Vitality — VT), социальное функционирование (Social Functioning — SF) и психическое здоровье (Mental Health — MH).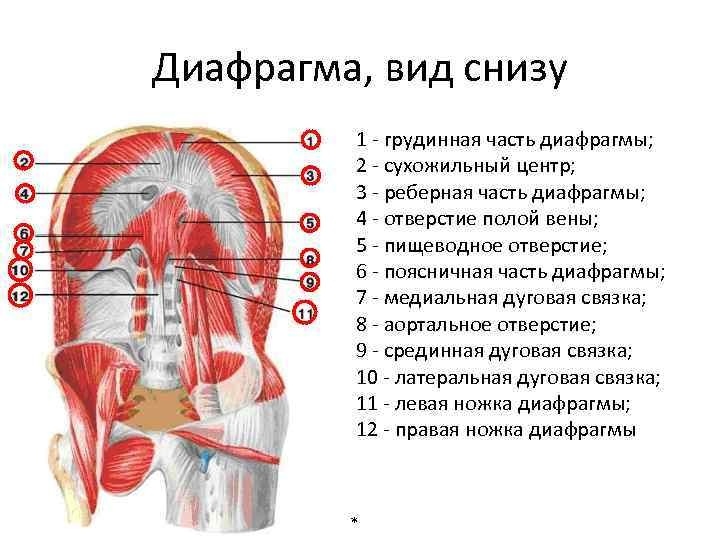 Показатели каждой шкалы варьируют от 0 до 100, где последнее представляет полное здоровье. Все шкалы формируют два показателя: душевный и физический компоненты здоровья. Результаты представляются в виде оценок в баллах по 8 шкалам, составленных таким образом, что более высокая оценка указывает на более высокий уровень качества жизни.
Показатели каждой шкалы варьируют от 0 до 100, где последнее представляет полное здоровье. Все шкалы формируют два показателя: душевный и физический компоненты здоровья. Результаты представляются в виде оценок в баллах по 8 шкалам, составленных таким образом, что более высокая оценка указывает на более высокий уровень качества жизни.
Анкетированию подвергли 12 пациентов, оперированных с 2000 по 2016 г. Были получены следующие средние результаты: физическое функционирование — 64,4, ролевая деятельность — 56,3, телесная боль — 61,8, общее здоровье — 58,5, жизнеспособность — 76,9, социальное функционирование — 89,1, эмоциональное состояние — 58,3, психическое здоровье — 81,5. Общий показатель для “физического компонента здоровья” в среднем составил 39,7 балла, для “психического компонента здоровья” — 57,2 балла. Эти показатели находятся на высоком уровне. Несмотря на то что исходного анкетирования не проводили, стоит отметить, что отдельно взятые и обобщенные показатели качества жизни в отдаленном периоде соответствовали средним показателям в общей популяции (табл.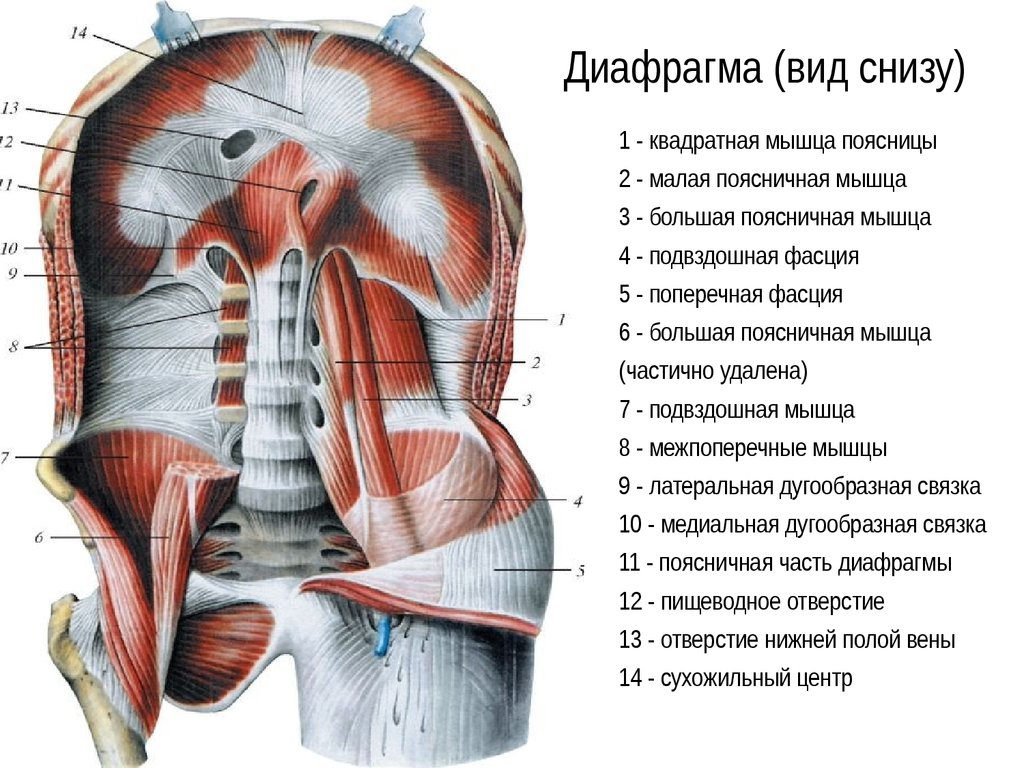 6). Таблица 6. Показатели качества жизни оперированных пациентов и в общей популяции (M±SD) Примечание. * — статистическая значимость при p<0,05.
6). Таблица 6. Показатели качества жизни оперированных пациентов и в общей популяции (M±SD) Примечание. * — статистическая значимость при p<0,05.
Лишь показатель физического функционирования (PF) оказался несколько сниженным, что может быть обусловлено ограничением в выполнении умеренных и тяжелых физических нагрузок оперированными больными.
Обсуждение
Впервые РД описал Petit в 1774 г. на секции пациента, длительное время страдавшего одышкой, усиливающейся после еды [53]. Wieting в 1906 г. первым предложил термин «релаксация диафрагмы» для обозначения этого патологического состояния [67]. Идея пластики диафрагмы путем резекции истонченного участка и создания дупликатуры принадлежит H. Wood. На практике ее реализовал J. Morley в 1920 г., который сообщил об успешной операции при релаксации диафрагмы у девочки 12 лет [46]. После иссечения истонченного участка диафрагмы проведено сшивание ее краев.
Наиболее частыми причинами РД являются злокачественные опухоли, прорастающие в диафрагмальный нерв, или его ятрогенная травма при операции [5, 12, 36, 38, 43, 61, 63]. Распространенные онкологические заболевания органов грудной клетки или шеи с вовлечением в процесс диафрагмального нерва были критериями исключения из нашего исследования, так как у них невозможно проследить отдаленный результат лечения. Реже нарушение иннервации диафрагмы происходит при сдавлении нерва аневризмой аорты, повреждениях при диабете, васкулите, герпесе [41, 58]. Подобных больных у нас не было. Нарушение иннервации диафрагмы центрального генеза — распространенный склероз, синдром Арнольда—Киари, сирингомиелия, нейрофиброматоз, перелом позвоночника на высоком уровне, сопровождающийся тетраплегией, также могут приводить к релаксации диафрагмы [7, 49, 63]. Возможны и различные идиопатические причины [2, 3, 15, 54, 65, 69]. Это составило самую многочисленную группу наших пациентов (17 человек). У них не было указаний на какую-либо травму, в том числе операционную. Повреждение диафрагмального нерва во время операции с развитием в дальнейшем релаксации и атрофии диафрагмы диагностировали у 5 пациентов (см.
Распространенные онкологические заболевания органов грудной клетки или шеи с вовлечением в процесс диафрагмального нерва были критериями исключения из нашего исследования, так как у них невозможно проследить отдаленный результат лечения. Реже нарушение иннервации диафрагмы происходит при сдавлении нерва аневризмой аорты, повреждениях при диабете, васкулите, герпесе [41, 58]. Подобных больных у нас не было. Нарушение иннервации диафрагмы центрального генеза — распространенный склероз, синдром Арнольда—Киари, сирингомиелия, нейрофиброматоз, перелом позвоночника на высоком уровне, сопровождающийся тетраплегией, также могут приводить к релаксации диафрагмы [7, 49, 63]. Возможны и различные идиопатические причины [2, 3, 15, 54, 65, 69]. Это составило самую многочисленную группу наших пациентов (17 человек). У них не было указаний на какую-либо травму, в том числе операционную. Повреждение диафрагмального нерва во время операции с развитием в дальнейшем релаксации и атрофии диафрагмы диагностировали у 5 пациентов (см. табл. 1). В 1 случае имела место операция на шее, в 3 — на органах грудной клетки (у 2 больных при доброкачественных опухолях средостения, у 2 — кардиохирургическая операция). Особую группу составляют пациенты, у которых релаксация диафрагмы развилась после кардиохирургических операций. В этих случаях повреждение диафрагмального нерва может быть обусловлено не только прямым механическим или электрохирургическим повреждением нерва, но и гипотермическим воздействием на него при операциях на открытом сердце после наружного охлаждения внутри перикарда. Возможно ишемическое повреждение нерва, возникшее в результате нарушения кровоснабжения при термическом повреждении внутренней грудной артерии при ее выделении для коронарного шунтирования [5, 6, 8, 12, 24, 36, 39, 56, 60, 71]. Чаще подобные осложнения носят односторонний характер. Показания для пластики диафрагмы у этих больных крайне редкие. В 80% случаев через год у них происходит самостоятельное восстановление функции диафрагмального нерва [36, 63, 64].
табл. 1). В 1 случае имела место операция на шее, в 3 — на органах грудной клетки (у 2 больных при доброкачественных опухолях средостения, у 2 — кардиохирургическая операция). Особую группу составляют пациенты, у которых релаксация диафрагмы развилась после кардиохирургических операций. В этих случаях повреждение диафрагмального нерва может быть обусловлено не только прямым механическим или электрохирургическим повреждением нерва, но и гипотермическим воздействием на него при операциях на открытом сердце после наружного охлаждения внутри перикарда. Возможно ишемическое повреждение нерва, возникшее в результате нарушения кровоснабжения при термическом повреждении внутренней грудной артерии при ее выделении для коронарного шунтирования [5, 6, 8, 12, 24, 36, 39, 56, 60, 71]. Чаще подобные осложнения носят односторонний характер. Показания для пластики диафрагмы у этих больных крайне редкие. В 80% случаев через год у них происходит самостоятельное восстановление функции диафрагмального нерва [36, 63, 64].
Релаксация диафрагмы приводит к значительным изменениям в физиологических процессах дыхания, которые включают в себя образование ателектазов, вентиляционно-перфузионные нарушения, смещение средостения в противоположную сторону, парадоксальное движение диафрагмы, перераспределение легочного кровотока в противоположную сторону. G. Elshafie и соавт. [18] полагают, что перерастяжение одного из куполов диафрагмы значительно снижает подвижность контралатеральной половины, приводя тем самым к еще более грубым функциональным нарушениям.
Б.В. Петровский [3] в 1965 г. выделил 4 типа клинического течения релаксации диафрагмы: 1) бессимптомную форму; 2) форму со стертыми клиническими проявлениями; 3) форму с выраженными клиническими проявлениями; 4) осложненную форму. Несмотря на большое разнообразие возможных симптомов, большинство случаев протекает бессимптомно [2, 7, 31, 69]. Наиболее часто возникают респираторные симптомы, являющиеся результатом потери диафрагмой дыхательной функции. У всех наших пациентов была одышка различной степени выраженности. Бессимптомного течения заболевания мы не наблюдали. По-видимому, это связано с тем, что больные, не предъявлявшие жалоб, не обращались к хирургам, даже при случайно выявленной Р.Д. Реже возникают неспецифические симптомы, связанные с нарушением сердечно-сосудистой системы и желудочно-кишечного тракта, среди которых наиболее часто встречаются дисфагия, тяжесть после еды, тошнота, рвота. Эта группа симптомов, как правило, возникает у пациентов с левосторонней локализацией релаксации диафрагмы. Мы полностью подтверждаем последнее положение — различные гастроэнтерологические жалобы были только у больных с релаксацией левого купола диафрагмы.
У всех наших пациентов была одышка различной степени выраженности. Бессимптомного течения заболевания мы не наблюдали. По-видимому, это связано с тем, что больные, не предъявлявшие жалоб, не обращались к хирургам, даже при случайно выявленной Р.Д. Реже возникают неспецифические симптомы, связанные с нарушением сердечно-сосудистой системы и желудочно-кишечного тракта, среди которых наиболее часто встречаются дисфагия, тяжесть после еды, тошнота, рвота. Эта группа симптомов, как правило, возникает у пациентов с левосторонней локализацией релаксации диафрагмы. Мы полностью подтверждаем последнее положение — различные гастроэнтерологические жалобы были только у больных с релаксацией левого купола диафрагмы.
Диагностика РД основывается на лучевых методах. Для нее характерны высокое расположение пораженного купола, а также нарушение подвижности диафрагмы. При этом ее движения могут сохранять правильный, физиологичный характер, однако амплитуда их, как правило, резко снижена. Возможно возникновение и парадоксальных движений, которые определяются в виде опускания пораженного купола диафрагмы при выдохе и его подъем при вдохе.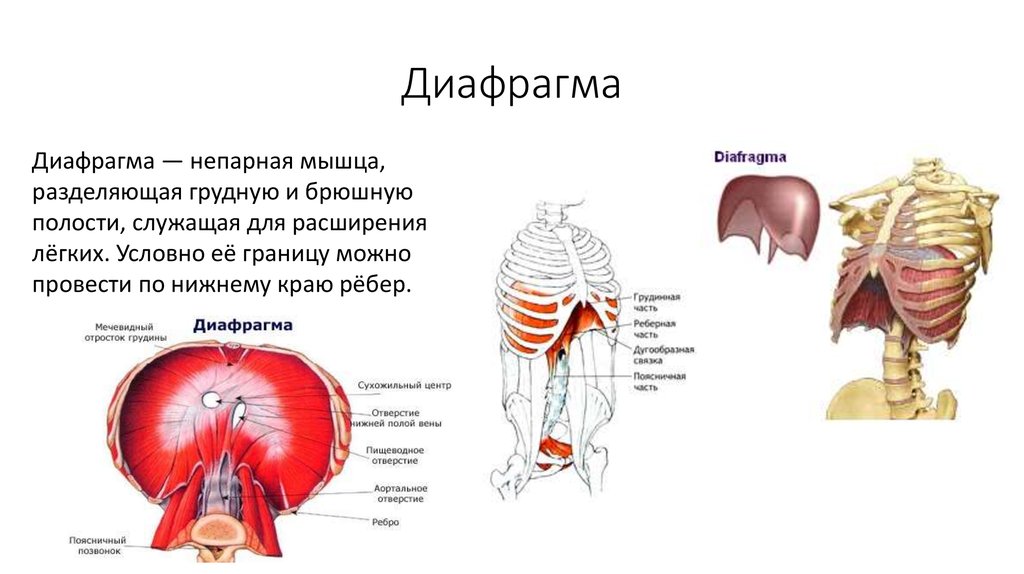
Основным методом диагностики в настоящее время является спиральная компьютерная томография высокого разрешения. Она помогает получить исчерпывающие данные о степени растяжения диафрагмы, ее истончения, а также соотношения с прилегающими органами брюшной полости. Этот метод позволяет провести дифференциальный диагноз с посттравматической диафрагмальной грыжей, основным симптомом которой является наличие патологического отверстия в куполе. При этом края диафрагмы не имеют признаков дегенерации, а их толщина соответствует нормальной диафрагме.
Следует констатировать, что до настоящего момента не сложилось унифицированного подхода к тактике лечения Р.Д. Работы, посвященные хирургическому лечению РД, немногочисленны. Большинство авторов обладают небольшим количеством наблюдений, а выбор способа пластики диафрагмы, как правило, определяется эмпирически [14, 16, 21, 25, 26, 35, 41, 57, 61, 70]. Выбор варианта хирургического доступа и способа укрепления диафрагмы основывается на субъективных критериях, когда врач выбирает наиболее привычный ему тот или иной вариант операции.
Одышка, возникающая при незначительной физической нагрузке, значительно ограничивающая физическую активность больного, является основным показанием к хирургическому лечению [9, 18, 50]. Момент, в который хирургическое лечение становится необходимым, широко обсуждается. Рядом авторов рекомендуется оперативное лечение через 3—6 мес после возникновения РД, особенно в случае выраженных клинических проявлений [55]. Иного мнения придерживается E. Summerhill [59], описав восстановление нормального уровня диафрагмы у 11 из 16 пациентов в срок от 5 до 25 мес. Аналогичные результаты отмечены J. Mouroux [48], который избирал выжидательную тактику в течение 18—24 мес, указывая на возможность спонтанного восстановления. В литературе можно встретить единичные наблюдения профилактических френопликаций, выполненных во время операций, требующих резекции диафрагмального нерва [10, 40, 62]. По данным T. Tokunaga и соавт. [62], использовавших френопликацию у 13 пациентов в ходе расширенных онкологических операций, эта мера позволяет эффективно предотвращать респираторные нарушения в послеоперационном периоде. Мы считаем, что оперативное лечение показано при резком истончении диафрагмы, выявляемое при МСКТ, что может свидетельствовать о серьезных дегенеративных изменениях и невозможности ее восстановления. Длительность наблюдения за высоким расположением диафрагмы должна быть не менее 1 года, после чего есть основание для операции. При таких сроках надежды на самостоятельное восстановление иннервации диафрагмы минимальны, особенно учитывая дегенеративные изменения мышечной части грудобрюшной преграды.
Мы считаем, что оперативное лечение показано при резком истончении диафрагмы, выявляемое при МСКТ, что может свидетельствовать о серьезных дегенеративных изменениях и невозможности ее восстановления. Длительность наблюдения за высоким расположением диафрагмы должна быть не менее 1 года, после чего есть основание для операции. При таких сроках надежды на самостоятельное восстановление иннервации диафрагмы минимальны, особенно учитывая дегенеративные изменения мышечной части грудобрюшной преграды.
Работы, посвященные операциям, направленным на восстановление проводимости диафрагмального нерва, крайне редки. M. Kaufman [34] у 68 пациентов с односторонней релаксацией диафрагмы использовал различные варианты операций на диафрагмальном нерве (декомпрессия, протезирование, невротизация). При этом автор отмечает хорошие результаты лечения, сравнимые с результатами лечения больных, которым выполнялась френопликация. Однако эти операции целесообразны в случае сохранения диафрагмой хотя бы минимальной активности, выявляемой при электромиографическом исследовании.
Дискутабельной остается проблема рационального способа пластики диафрагмы при Р.Д. Восстановление нормального уровня истонченной диафрагмы и ее укрепление могут быть достигнуты как за счет собственных тканей, так и с использованием различных укрепляющих материалов. В настоящее время появилась тенденция к расширению показаний к пластике диафрагмы за счет ее собственных тканей [1, 9, 19, 22, 28, 35, 42, 52, 66, 68]. Они достаточно просты, малотравматичны и дают удовлетворительные непосредственные результаты [11]. Предложены различные технические приемы реконструкции диафрагмы: резекция истонченного участка диафрагмы, гофрирование без рассечения диафрагмы, использование матрацных или непрерывных швов, механического шва с помощью эндостеплера [17, 20, 28, 30, 35, 45, 47].
Многочисленные варианты френопликации воспроизводятся как открытым способом, так и видеоторакоскопически. С момента первого описания F. Gharagozloo и соавт. [23] в 1995 г. торакоскопической френопликации и T. Hüttl [32] в 2004 г. лапароскопического доступа появляются сообщения, посвященные малоинвазивным вмешательствам в различных вариантах [33, 35, 37]. R. Freeman [19] приводит наибольший опыт использования френопликации, описывая серию из 41 пациента, среди которых у 30 пациентов был выбран малоинвазивный доступ и 11 подверглись традиционной торакотомии. Улучшение показателей функции внешнего дыхания на 19—23% отмечено у всех больных, за исключением 2 больных с избыточной массой тела и 3 больных с длительно (более 4 лет) существующей релаксацией диафрагмы. Аналогичные результаты сообщают S. Groth и соавт. [27] в ретроспективном анализе лечения 25 пациентов, подвергшихся лапароскопической френопликации. Однако стоит отметить, что имеются рецидивы РД после пластики диафрагмы собственными дегенеративно измененными тканями, особенно в случае полной релаксации. S. Higgs [29] и S. Groth [26] признают эффективность таких операций лишь при ограниченной форме РД и в случае отсутствия выраженных морфологических дегенеративных изменений диафрагмы.
Hüttl [32] в 2004 г. лапароскопического доступа появляются сообщения, посвященные малоинвазивным вмешательствам в различных вариантах [33, 35, 37]. R. Freeman [19] приводит наибольший опыт использования френопликации, описывая серию из 41 пациента, среди которых у 30 пациентов был выбран малоинвазивный доступ и 11 подверглись традиционной торакотомии. Улучшение показателей функции внешнего дыхания на 19—23% отмечено у всех больных, за исключением 2 больных с избыточной массой тела и 3 больных с длительно (более 4 лет) существующей релаксацией диафрагмы. Аналогичные результаты сообщают S. Groth и соавт. [27] в ретроспективном анализе лечения 25 пациентов, подвергшихся лапароскопической френопликации. Однако стоит отметить, что имеются рецидивы РД после пластики диафрагмы собственными дегенеративно измененными тканями, особенно в случае полной релаксации. S. Higgs [29] и S. Groth [26] признают эффективность таких операций лишь при ограниченной форме РД и в случае отсутствия выраженных морфологических дегенеративных изменений диафрагмы. Мы придерживаемся радикальной тактики лечения. У нас не было пациентов с ограниченной Р.Д. Являясь последователями школы академика Б.В. Петровского, считаем, что при истинной релаксации диафрагмы с дегенеративными изменениями ее мышечной части использование только собственных тканей, без их укрепления различными материалами, повышает риск рецидива. Большинство рецидивов заболевания, описанных в литературе, были связаны именно с френопликацией. Каким образом ее выполняли, не имеет значения — открытым способом или торакоскопически. Мы считаем, что не следует повторять ошибки открытой хирургии, имевшие место много лет назад, перенося их в тораковидеоскопическую область.
Мы придерживаемся радикальной тактики лечения. У нас не было пациентов с ограниченной Р.Д. Являясь последователями школы академика Б.В. Петровского, считаем, что при истинной релаксации диафрагмы с дегенеративными изменениями ее мышечной части использование только собственных тканей, без их укрепления различными материалами, повышает риск рецидива. Большинство рецидивов заболевания, описанных в литературе, были связаны именно с френопликацией. Каким образом ее выполняли, не имеет значения — открытым способом или торакоскопически. Мы считаем, что не следует повторять ошибки открытой хирургии, имевшие место много лет назад, перенося их в тораковидеоскопическую область.
Одним из первых использование укрепляющего материала при пластике РД описал D. Monahan [44] в 1951 г., использовав сетку из тантала, которая была пришита поверх дупликатуры диафрагмы. В 1957 г. Б.В. Петровский [3] описал оригинальный способ пластики диафрагмы, заключавшийся в расположении поливинилалкогольной губки между двумя листками рассеченной диафрагмы, которые сшивались по типу дупликатуры. К настоящему времени в литературе предложено большое количество различных синтетических и биологических материалов, используемых для укрепления диафрагмы при ее релаксации [4, 13, 7, 51]. Большинство работ носят характер единичных наблюдений или небольших серий. A. Balci и соавт. [7] сообщили о 28 пациентах с РД, среди которых 9 выполнена только френопликация и у 19 больных, помимо френопликации, диафрагма укреплена сетчатым протезом из пролена и политетрафторэтилена. В обеих группах отмечен хороший функциональный результат операций. Частота осложнений была выше в группе френопликаций (22% против 10%). Авторы описывают один рецидив РД через 6 мес после операции у пациентки, которой была выполнена френопликация. C. Palanivelu и соавт. [51] у 3 пациентов с левосторонней релаксацией диафрагмы применили полипропиленовую сетку, которая была фиксирована по всему периметру поверх дупликатуры, выполненной лапароскопически. Рецидивов релаксации в отдаленном периоде автор не описывает.
К настоящему времени в литературе предложено большое количество различных синтетических и биологических материалов, используемых для укрепления диафрагмы при ее релаксации [4, 13, 7, 51]. Большинство работ носят характер единичных наблюдений или небольших серий. A. Balci и соавт. [7] сообщили о 28 пациентах с РД, среди которых 9 выполнена только френопликация и у 19 больных, помимо френопликации, диафрагма укреплена сетчатым протезом из пролена и политетрафторэтилена. В обеих группах отмечен хороший функциональный результат операций. Частота осложнений была выше в группе френопликаций (22% против 10%). Авторы описывают один рецидив РД через 6 мес после операции у пациентки, которой была выполнена френопликация. C. Palanivelu и соавт. [51] у 3 пациентов с левосторонней релаксацией диафрагмы применили полипропиленовую сетку, которая была фиксирована по всему периметру поверх дупликатуры, выполненной лапароскопически. Рецидивов релаксации в отдаленном периоде автор не описывает.
Аутопластическое укрепление диафрагмы с использованием различных мышечных и мышечно-апоневротических лоскутов из-за высокой травматичности и высокого риска осложнений в настоящее время практически не используют.
Таким образом, релаксация диафрагмы является дегенеративным заболеванием, приводящим к значительным изменениям в физиологических процессах дыхания и зачастую существенно ограничивающая физическую активность больного. В основе диагностики лежат лучевые методы, включающие компьютерную томографию высокого разрешения, которая позволяет получить исчерпывающие данные о степени дегенеративных изменений, уровня расположения соответствующего купола диафрагмы, с уверенностью исключить ее посттравматический дефект и установить правильный диагноз. В настоящее время отсутствует единый подход к лечению Р.Д. Зачастую срок выполнения оперативного вмешательства, выбор оперативного доступа и способа коррекции основаны на личных предпочтениях хирурга. Мы считаем, что ее следует выполнять не ранее, чем через 1 год после первого выявления высокого расположения купола диафрагмы. Работ, посвященных хирургическому лечению РД с высоким уровнем доказательности, практически нет. Как следствие, оценить преимущества того или иного способа коррекции представляется затруднительным. Очевидна необходимость разработки единого подхода к тактике лечения пациентов с РД и оценки результатов лечения в отдаленный период.
Очевидна необходимость разработки единого подхода к тактике лечения пациентов с РД и оценки результатов лечения в отдаленный период.
Авторы заявляют об отсутствии конфликта интересов.
e-mail: [email protected]
e-mail: [email protected]
Тренировка дыхательных мышц у детей и взрослых с нервно-мышечными заболеваниями
Вопрос обзора
Оказывает ли тренировка дыхательных мышц благотворное влияние на детей и взрослых с нервно-мышечными заболеваниями?
Актуальность
Нейромышечные заболевания — очень широкий термин, который охватывает многие заболевания, которые прямо или косвенно воздействуют на мышцы или нервы. Дети и взрослые с нервно-мышечными заболеваниями могут предъявлять жалобы на мышечную слабость, потерю контроля над движением и мышечное истощение. Некоторые нейромышечные заболевания вызывают слабость дыхательных мышц (диафрагма и вспомогательные мышцы дыхания). Снижение функции дыхательных мышц при этих заболеваниях влияет на повседневную деятельность и качество жизни. Тренировка дыхательных мышц потенциально может рассматриваться как дополнительная терапия для людей с подозрением или подтвержденной слабостью дыхательных мышц.
Снижение функции дыхательных мышц при этих заболеваниях влияет на повседневную деятельность и качество жизни. Тренировка дыхательных мышц потенциально может рассматриваться как дополнительная терапия для людей с подозрением или подтвержденной слабостью дыхательных мышц.
Характеристика исследований
В этот обзор включили 11 исследований с участием 250 рандомизированных участников с нервно-мышечными заболеваниями. Шесть исследований включили 112 молодых мужчин (в том числе детей) с мышечной дистрофией Дюшенна, которая является наследственной мышечной болезнью. В одном из испытаний участвовали 23 взрослых человека с другими мышечными заболеваниями (мышечная дистрофия Беккера и мышечная дистрофия поясницы и конечностей). В трех исследованиях участвовали 88 человек с боковым амиотрофическим склерозом, прогрессирующим состоянием, которое поражает нервы, контролирующие движение. В одном из испытаний участвовали 27 человек с миастенией гравис, состояние, которое влияет на сигналы между нервами и мышцами.
Основные результаты
Исследования показали, что тренировка дыхательных мышц может привести к некоторому улучшению функции легких у людей с боковым амиотрофическим склерозом и мышечной дистрофией Дюшенна. Однако по этому результату не было согласованности между исследованиями. Физическая функция и качество жизни были оценены только в одном исследовании у пациентов с боковым амиотрофическим склерозом, которое показало, что тренировка дыхательных мышц (ТДМ) может не давать четкого эффекта. В одном из испытаний сообщили о неблагоприятных событиях, однако определенность доказательств была слишком низкой для того, чтобы можно было сделать выводы. В исследованиях не сообщалось о числе незапланированных госпитализаций в связи с внезапной инфекцией или обострением хронической дыхательной недостаточности.
Определенность доказательств
Определённость доказательств, рассмотренных в рамках этого обзора, была низкой или очень низкой. Низкая определенность означает, что наша уверенность в эффекте тренировки дыхательных мышц ограничена, а истинный эффект может существенно отличаться. Когда доказательства имеют очень низкую степень определенности, истинный эффект, скорее всего, будет существенно отличаться. Учитывая низкую или очень низкую определенность данных, представленных в исследованиях, мы считаем, что существует необходимость в более хорошо проведенных исследованиях для оценки эффективности тренировки дыхательной мускулатуры у людей с нервно-мышечными заболеваниями.
Низкая определенность означает, что наша уверенность в эффекте тренировки дыхательных мышц ограничена, а истинный эффект может существенно отличаться. Когда доказательства имеют очень низкую степень определенности, истинный эффект, скорее всего, будет существенно отличаться. Учитывая низкую или очень низкую определенность данных, представленных в исследованиях, мы считаем, что существует необходимость в более хорошо проведенных исследованиях для оценки эффективности тренировки дыхательной мускулатуры у людей с нервно-мышечными заболеваниями.
Доказательства актуальны на ноябрь 2018 года.
Заметки по переводу:
Перевод: Зиганшин Айрат Усманович. Редактирование: Зиганшина Лилия Евгеньевна. Координация проекта по переводу на русский язык: Кокрейн Россия — Cochrane Russia, Cochrane Geographic Group Associated to Cochrane Nordic. По вопросам, связанным с этим переводом, пожалуйста, обращайтесь к нам по адресу: [email protected]
Диафрагмальная слабость и паралич — PubMed
Обзор
. 1989;167(6):323-41.
1989;167(6):323-41.
дои: 10.1007/BF02714961.
П. Г. Уилкокс 1 , Р. Л. Парди
принадлежность
- 1 Респираторное отделение, Больница Центра медицинских наук Университета Британской Колумбии, Ванкувер, Канада.
- PMID: 2509822
- DOI: 10.1007/BF02714961
Обзор
PG Wilcox et al. Легкое. 1989.
. 1989;167(6):323-41.
дои: 10. 1007/BF02714961.
1007/BF02714961.
Авторы
П. Г. Уилкокс 1 , Р Л Парди
принадлежность
- 1 Респираторное отделение, Больница Центра медицинских наук Университета Британской Колумбии, Ванкувер, Канада.
- PMID: 2509822
- DOI: 10.1007/BF02714961
Абстрактный
Диафрагмальная слабость подразумевает снижение силы диафрагмы. Диафрагмальный паралич является крайней формой слабости диафрагмы. Диафрагмальный паралич является редкой клинической проблемой, в то время как слабость диафрагмы, хотя и нечастая, вероятно, часто не распознается, поскольку соответствующие тесты для выявления ее наличия не выполняются. Слабость диафрагмы может быть результатом аномалий в любом месте ее нервно-мышечной оси, хотя чаще всего она возникает из-за заболеваний диафрагмальных нервов или миопатий, поражающих саму диафрагму. Наличие слабости диафрагмы можно заподозрить по жалобам на одышку (особенно при физической нагрузке) или ортопноэ; наличие учащенного поверхностного дыхания или, что более важно, парадоксального движения живота внутрь во время вдоха при физикальном обследовании; ограничительный образец при тестировании функции легких; приподнятая гемидиафрагма на рентгенограмме грудной клетки; парадоксальное движение вверх 1 полудиафрагмы при рентгеноскопии; или снижение максимального статического давления на вдохе. Однако диагноз слабости диафрагмы подтверждается снижением максимального статического трансдиафрагмального давления (Pdimax). Диагноз паралича диафрагмы подтверждается отсутствием сложного потенциала действия диафрагмы при стимуляции диафрагмального нерва. Причин слабости и паралича диафрагмы много.
Слабость диафрагмы может быть результатом аномалий в любом месте ее нервно-мышечной оси, хотя чаще всего она возникает из-за заболеваний диафрагмальных нервов или миопатий, поражающих саму диафрагму. Наличие слабости диафрагмы можно заподозрить по жалобам на одышку (особенно при физической нагрузке) или ортопноэ; наличие учащенного поверхностного дыхания или, что более важно, парадоксального движения живота внутрь во время вдоха при физикальном обследовании; ограничительный образец при тестировании функции легких; приподнятая гемидиафрагма на рентгенограмме грудной клетки; парадоксальное движение вверх 1 полудиафрагмы при рентгеноскопии; или снижение максимального статического давления на вдохе. Однако диагноз слабости диафрагмы подтверждается снижением максимального статического трансдиафрагмального давления (Pdimax). Диагноз паралича диафрагмы подтверждается отсутствием сложного потенциала действия диафрагмы при стимуляции диафрагмального нерва. Причин слабости и паралича диафрагмы много. В этом обзоре мы обрисовываем подход, который мы сочли полезным при попытке определить конкретную причину. Чаще всего причиной является либо диафрагмальная невропатия, либо диафрагмальная миопатия. Часто невропатия или миопатия поражают другие нервы или мышцы, которые легче исследовать для определения конкретной патологической основы, и, по ассоциации, предполагается, что слабость или паралич диафрагмы являются вторичными по отношению к тому же патологическому процессу.
В этом обзоре мы обрисовываем подход, который мы сочли полезным при попытке определить конкретную причину. Чаще всего причиной является либо диафрагмальная невропатия, либо диафрагмальная миопатия. Часто невропатия или миопатия поражают другие нервы или мышцы, которые легче исследовать для определения конкретной патологической основы, и, по ассоциации, предполагается, что слабость или паралич диафрагмы являются вторичными по отношению к тому же патологическому процессу.
Похожие статьи
Оптоэлектронная плетизмография как альтернативный метод диагностики односторонней слабости диафрагмы.
Будархам Дж., Прадон Д., Прижан Х., Фалез Л., Дюран М.С., Мерик Х., Петитжан М., Лофасо Ф. Боудархэм Дж. и соавт. Грудь. 2013 г., сен; 144 (3): 887–895. doi: 10.1378/сундук.12-2317. Грудь. 2013. PMID: 23519378
Детерминанты движения диафрагмы при одностороннем параличе диафрагмы.

Силлия П., Капелло М., Де Тройер А. Силлия П. и др. J Appl Physiol (1985). 2004 г., январь; 96 (1): 96–100. doi: 10.1152/japplphysiol.00761.2003. Epub 2003 29 августа. J Appl Physiol (1985). 2004. PMID: 12949010
Сила диафрагмы у пациентов с недавним параличом половины диафрагмы.
Laroche CM, Mier AK, Moxham J, Green M. Ларош С.М. и соавт. грудная клетка. 1988 март; 43(3):170-4. doi: 10.1136/thx.43.3.170. грудная клетка. 1988 год. PMID: 3261460 Бесплатная статья ЧВК.
Паралич диафрагмы.
Куреши А. Куреши А. Semin Respir Crit Care Med. 2009 июнь; 30 (3): 315-20. doi: 10.1055/s-0029-1222445. Epub 2009 18 мая. Semin Respir Crit Care Med. 2009. PMID: 19452391 Обзор.

[Оценка дыхательных мышц].
Фитинг JW. Установка JW. Schweiz Med Wochenschr. 1998 г., 15 августа; 128 (33): 1212-6. Schweiz Med Wochenschr. 1998. PMID: 9757485 Обзор. Немецкий.
Посмотреть все похожие статьи
Цитируется
Ультразвук диафрагмы в кардиохирургии: современное состояние.
Фейссойл А., Мансенкал Н., Нгуен Л.С., Орликовски Д., Прижан Х., Бергуниу Дж., Аннан Д., Лофасо Ф. Фейссойл А. и др. Лекарства (Базель). 2022 11 января; 9 (1): 5. doi: 10.3390/лекарства
05. Лекарства (Базель). 2022. PMID: 35049938 Бесплатная статья ЧВК. Обзор.
Ультразвуковая оценка движения диафрагмы при миофибриллярной миопатии BAG-3: клинический случай.

Чжан Л, Ур. Л, Чен Х, Сюй Х, Ни Дж. Жан Л. и соавт. Медицина (Балтимор). 7 января 2022 г .; 101 (1): e28484. doi: 10.1097/MD.0000000000028484. Медицина (Балтимор). 2022. PMID: 35029900 Бесплатная статья ЧВК.
Оценка стабильной хронической обструктивной болезни легких с помощью ультразвука.
Эврин Т., Коркут С., Озтюрк Сонмез Л., Шарпак Л., Катипоглу Б., Смерека Дж., Гювен Р., Акпинар Э.Э. Эврин Т. и соавт. Эмерг Мед Инт. 201915 сентября; 2019: 5361620. дои: 10.1155/2019/5361620. Электронная коллекция 2019. Эмерг Мед Инт. 2019. PMID: 31637058 Бесплатная статья ЧВК.
РНК с малыми шпильками и фармакологический нацеливание на нейтральную сфингомиелиназу предотвращают слабость диафрагмы у крыс с сердечной недостаточностью и сниженной фракцией выброса.

Кобленц П.Д., Ан Б., Хейворд Л.Ф., Ю Дж.К., Христу Д.Д., Феррейра Л.Ф. Кобленц П.Д. и соавт. Am J Physiol Lung Cell Mol Physiol. 20191 апреля; 316(4):L679-L690. doi: 10.1152/ajplung.00516.2018. Epub 2019 31 января. Am J Physiol Lung Cell Mol Physiol. 2019. PMID: 30702345 Бесплатная статья ЧВК.
Неудачные френики: неясная причина одышки при нагрузке: отчет о болезни и обзор литературы.
Рафик А., Иджаз М., Тарик Х., Вакде Т., Дункалф Р. Рафик А. и др. Медицина (Балтимор). 2016 июль; 95 (29): e4263. doi: 10.1097/MD.0000000000004263. Медицина (Балтимор). 2016. PMID: 27442657 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
использованная литература
- Кью Мед.
 1974 Октябрь; 43 (172): 551-68
—
пабмед
1974 Октябрь; 43 (172): 551-68
—
пабмед
- Кью Мед.
- J Appl Physiol Respir Environ Exerc Physiol. 1982 сент; 53 (3): 750-5 — пабмед
- Ам преподобный Респир Дис. 1989 Январь; 139 (1): 277-81 — пабмед
- J Neurol Нейрохирург Психиатрия.
 1967 окт; 30 (5): 420-6
—
пабмед
1967 окт; 30 (5): 420-6
—
пабмед
- J Neurol Нейрохирург Психиатрия.
- Грудь. 1984 Октябрь; 86 (4): 568-72 — пабмед
Типы публикаций
термины MeSH
Слабость диафрагмы как причина одышки после анатомически отдаленных операций
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
История болезни
Слабость диафрагмы как причина одышки после анатомически отдаленных операций
- A J Moore1,
- J Moxham2,
- M I Polkey1
- 1 Отделение респираторной медицины, Royal Brompton Hospital, London SW9 NP30228
- 2 Отделение респираторной медицины, больница Королевского колледжа, Лондон SE5 9RS, Великобритания
- Адрес для связи:
Dr A J Moore
Отделение респираторной медицины, больница Royal Brompton, Великобритания; a. mooreic.ac.uk
mooreic.ac.uk
Abstract
Представлены истории болезни двух пациентов, у которых после операции на анатомически отдаленном участке развилась одышка. Тестирование дыхательных мышц показало слабость диафрагмы у обоих пациентов.
- Парализ диафрагмы
- Neuralgic Amyotrophy
- Респираторные мышцы
http://dx.doi.org/10.1136/THX.2004.022764
Статистика. или всю эту статью, пожалуйста, используйте приведенную ниже ссылку, которая приведет вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- паралич диафрагмы
- невралгическая амиотрофия
- дыхательные мышцы
Слабость диафрагмы вследствие медицинского вмешательства чаще всего возникает в результате физической травмы диафрагмальных нервов или мышц диафрагмы. Признанные примеры включают операции на голове и шее или катетеризацию центральных вен, 1, 2 , а также нейропраксию, вызванную использованием ледяной шуги во время кардиоторакальной хирургии. 3
3
Послеоперационная невропатия плечевого сплетения может возникнуть при отсутствии прямой хирургической травмы, и известно, что могут быть вовлечены также диафрагмальные нервы. 4 Однако изолированная диафрагмальная невропатия после анатомически отдаленной операции ранее не описывалась. Здесь мы представляем двух пациентов, у которых после операции на анатомически отдаленном участке развилась одышка. Тестирование дыхательных мышц показало слабость диафрагмы у обоих пациентов.
МЕТОДЫ
Были использованы следующие общепринятые методы диагностики.
Спирометрия
Форсированная жизненная емкость легких (ФЖЕЛ) и объем форсированного выдоха за 1 секунду (ОФВ 1 ) были зарегистрированы с использованием клиновидного сильфонного спирометра (Vitalograph, Бакингемшир, Великобритания).
Тесты дыхательных мышц
Общая сила мышц вдоха и выдоха оценивалась с помощью методов, описанных в совместном заявлении ATS/ERS по тестированию дыхательных мышц 5 , с использованием стандартного лабораторного оборудования, ранее описанного в другом месте. 6 Вкратце, максимальное статическое ротовое давление на вдохе (MIP) и выдохе (MEP) измеряли с помощью фланцевого мундштука, прикрепленного к короткой жесткой трубке с двухходовым клапаном, имеющим 2-миллиметровую утечку для предотвращения закрытия голосовой щели. MIP измеряли по остаточному объему (RV) и MEP по общей емкости легких (TLC). Силу диафрагмы оценивали по трансдиафрагмальному давлению, измеренному во время максимального вдоха и с помощью переднелатеральной магнитной стимуляции диафрагмального нерва. Это было выполнено с использованием стимулятора Magstim 200 HP (Magstim Co, Whitland, UK) с 45-мм катушкой, помещенной над каждым диафрагмальным нервом по очереди для оценки силы каждой полудиафрагмы, а затем с обеих сторон. Субъекты отдыхали в течение 20 минут перед стимуляцией, чтобы свести к минимуму потенциацию подергиваний, затем осуществлялась сверхмаксимальная стимуляция при 100% выходной мощности, в то время как пациент находился в расслабленном состоянии на уровне FRC с закрытым ртом и носовыми зажимами.
6 Вкратце, максимальное статическое ротовое давление на вдохе (MIP) и выдохе (MEP) измеряли с помощью фланцевого мундштука, прикрепленного к короткой жесткой трубке с двухходовым клапаном, имеющим 2-миллиметровую утечку для предотвращения закрытия голосовой щели. MIP измеряли по остаточному объему (RV) и MEP по общей емкости легких (TLC). Силу диафрагмы оценивали по трансдиафрагмальному давлению, измеренному во время максимального вдоха и с помощью переднелатеральной магнитной стимуляции диафрагмального нерва. Это было выполнено с использованием стимулятора Magstim 200 HP (Magstim Co, Whitland, UK) с 45-мм катушкой, помещенной над каждым диафрагмальным нервом по очереди для оценки силы каждой полудиафрагмы, а затем с обеих сторон. Субъекты отдыхали в течение 20 минут перед стимуляцией, чтобы свести к минимуму потенциацию подергиваний, затем осуществлялась сверхмаксимальная стимуляция при 100% выходной мощности, в то время как пациент находился в расслабленном состоянии на уровне FRC с закрытым ртом и носовыми зажимами. У каждого пациента регистрировали не менее трех удовлетворительных подергиваний.
У каждого пациента регистрировали не менее трех удовлетворительных подергиваний.
Пациент 1
Мужчина 46 лет перенес неосложненную колэктомию сигмовидной кишки по поводу доброкачественной аденомы. Послеоперационное восстановление прошло без осложнений, но через 2 месяца у него появилась одышка и хрипы при физической нагрузке. Одышка особенно усиливалась в положении лежа на спине или в воде. У него не было примечательной истории болезни, и он был умеренным курильщиком. Рентгенография грудной клетки показала приподнятую правую полудиафрагму (см. онлайн-приложение на http://www.thoraxjnl.com/supplemental). Дооперационная рентгенограмма грудной клетки не была доступна в качестве исходного уровня для сравнения, но рентгенограмма, сделанная в период непосредственного послеоперационного восстановления, показывает, что правая половина диафрагмы находится в нормальном положении (изображение доступно в онлайн-приложении по адресу http://www.thoraxjnl.com/supplemental).
Пациент 2
58-летняя женщина была госпитализирована с клиническим подозрением на легочную эмболию. Вентиляционно-перфузионное сканирование показало высокую вероятность легочной эмболии. В детстве у нее был полиомиелит, но ей не требовалась респираторная поддержка, и за 1 год до госпитализации у нее была нормальная рентгенограмма грудной клетки. В рамках обследования по поводу тромбоэмболии легочной артерии ей было проведено ультразвуковое сканирование брюшной полости. При этом выявлена опухоль в верхнем полюсе правой почки. Через 3 месяца ей сделали геминефрэктомию, и гистологическое исследование подтвердило почечно-клеточный рак. После операции она жаловалась на одышку, которая была приписана ее анестезии. Эта одышка сохранялась, и в результате ей сделали КТ-ангиографию легких и фиброоптическую бронхоскопию. Ни одно из этих исследований не выявило причины ее одышки. Через год она по-прежнему жаловалась на одышку при физической нагрузке, в положении лежа или на наклонах вперед. Физикальное обследование показало парадоксальное движение живота. Рентгенограмма грудной клетки выявила приподнятую левую гемидиафрагму, которой не было до операции (см.
Вентиляционно-перфузионное сканирование показало высокую вероятность легочной эмболии. В детстве у нее был полиомиелит, но ей не требовалась респираторная поддержка, и за 1 год до госпитализации у нее была нормальная рентгенограмма грудной клетки. В рамках обследования по поводу тромбоэмболии легочной артерии ей было проведено ультразвуковое сканирование брюшной полости. При этом выявлена опухоль в верхнем полюсе правой почки. Через 3 месяца ей сделали геминефрэктомию, и гистологическое исследование подтвердило почечно-клеточный рак. После операции она жаловалась на одышку, которая была приписана ее анестезии. Эта одышка сохранялась, и в результате ей сделали КТ-ангиографию легких и фиброоптическую бронхоскопию. Ни одно из этих исследований не выявило причины ее одышки. Через год она по-прежнему жаловалась на одышку при физической нагрузке, в положении лежа или на наклонах вперед. Физикальное обследование показало парадоксальное движение живота. Рентгенограмма грудной клетки выявила приподнятую левую гемидиафрагму, которой не было до операции (см. рис. 1 и онлайн-приложение).
рис. 1 и онлайн-приложение).
Рисунок 1
Приподнятая левая половина диафрагмы у пациента 2. ком/доп. Исходные характеристики и спирометрические параметры показаны в таблице S1, а результаты тестирования дыхательных мышц — в таблице S2.
В дополнение к рентгенограмме на рис. 1 онлайн-приложение также содержит серию дополнительных изображений. На первой (рис. S1) показана приподнятая половина диафрагмы у пациента 1. Чтобы сравнить ее и рентгенограмму грудной клетки пациента 2 (рис. 1) с «исходным уровнем», в качестве контрольных изображений включены еще три рентгенограммы, одна для пациента 1 ( рис. S2) и два для пациента 2 (рис. S3 и S4).
Тесты дыхательных мышц у пациента 1 показали общую силу инспираторных и экспираторных мышц в пределах нормы, но трансдиафрагмальное давление при вдохе (SnPdi) было низким и составляло 43,4 см H 2 O (норма >80). Магнитная стимуляция диафрагмального нерва продемонстрировала слабость правой половины диафрагмы с правым трансдиафрагмальным давлением (TwPdi) 1,6 см H 2 O (норма >7). Реакция на магнитную стимуляцию слева была нормальной с TwPdi 10,5 см H 2 О (норма >8).
Реакция на магнитную стимуляцию слева была нормальной с TwPdi 10,5 см H 2 О (норма >8).
У пациента 2 были признаки двусторонней слабости диафрагмы. Измерения ее общей силы дыхательных мышц были снижены, а SnPdi значительно уменьшился на 16,8 см H 2 O. Магнитная стимуляция ее диафрагмальных нервов выявила TwPdi слева 2,8 см H 2 O и справа 1,7 см. H 2 O (нормальные диапазоны, как указано выше).
ОБСУЖДЕНИЕ
У обоих пациентов были явные признаки диафрагмальной нейропатии и слабости диафрагмы, которая была односторонней у пациента 1 и двусторонней у пациента 2. Места операции были анатомически удалены от диафрагмы, поэтому прямая травма диафрагмы или диафрагмального нервов было маловероятно, а слабость сохранялась долгое время после периоперационного периода при электролитных нарушениях 7 или назначение препаратов с отрицательными инотропными свойствами 8 .
Иногда после пункции центральной вены может возникнуть паралич диафрагмы. Рентгенограмма грудной клетки пациента 1 (рис. S2) сразу после операции показывает правый внутренний яремный катетер на месте. Однако в это время диафрагма находилась в нормальном положении, и симптомы появились только через 2 месяца после этого. Поэтому мы не считаем, что эта линия вызвала повреждение диафрагмального нерва, и это мнение подтверждается доступной литературой, которая предполагает, что повреждение диафрагмального нерва происходит после сложной или травматической катетеризации центральной вены или при многократных попытках найти внутреннюю яремную вену, и что симптомы возникают во время введения. 9, 10
Рентгенограмма грудной клетки пациента 1 (рис. S2) сразу после операции показывает правый внутренний яремный катетер на месте. Однако в это время диафрагма находилась в нормальном положении, и симптомы появились только через 2 месяца после этого. Поэтому мы не считаем, что эта линия вызвала повреждение диафрагмального нерва, и это мнение подтверждается доступной литературой, которая предполагает, что повреждение диафрагмального нерва происходит после сложной или травматической катетеризации центральной вены или при многократных попытках найти внутреннюю яремную вену, и что симптомы возникают во время введения. 9, 10
Контрольные рентгенограммы грудной клетки пациентки 2 были сделаны до ее поступления в больницу с легочной эмболией и после этой госпитализации с легочной эмболией. На первом рисунке (рис. S3) нет признаков приподнятой гемидиафрагмы, и, таким образом, в качестве базового изображения предполагается, что ее история полиомиелита в детстве, которая пощадила дыхательные мышцы, не повлияла на ее диафрагмальные нервы. Вторая исходная рентгенограмма (рис. S4) была сделана после легочной эмболии и показывает признаки небольшого плеврального выпота в соответствии с этим диагнозом. Паралич диафрагмы не связан с плевральными выпотами, поэтому мы считаем разумным, что паралич возник после операции.
Вторая исходная рентгенограмма (рис. S4) была сделана после легочной эмболии и показывает признаки небольшого плеврального выпота в соответствии с этим диагнозом. Паралич диафрагмы не связан с плевральными выпотами, поэтому мы считаем разумным, что паралич возник после операции.
Невралгическая амиотрофия, однако, является состоянием, которое может объяснить симптомы и признаки, наблюдаемые у обоих пациентов после операции. Это самокупирующееся состояние неизвестной этиологии, характеризующееся плечевой невропатией. Обычно, но не всегда, это связано с внезапной болью в области плеча, сопровождаемой слабостью и атрофией мышц руки в области иннервации длинных грудных, надлопаточных, подмышечных и лучевых нервов. 11 Диафрагмальные нервы могут поражаться при невралгической амиотрофии, 4, 12 , но это обычно сочетается с описанным выше «плечевым поясным» синдромом боли. В редких случаях может возникать изолированное поражение диафрагмального нерва, но ранее анатомически отдаленная хирургия не описывалась как триггер этого состояния.
В своей первоначальной серии, описывающей невралгическую амиотрофию плечевого сплетения, Парсонейдж и Тернер отметили, что почти половина пациентов уже находилась в больнице с другими заболеваниями. 13 К ним относятся инфекции (например, малярия) и травматические состояния (например, огнестрельные ранения). Меньшая часть из них, однако, были пациентами, выздоравливающими после операции, и из тех пациентов, у которых действительно был хирургический триггер (12 из 136 случаев), все они перенесли анатомически отдаленную операцию (обычно грыжесечение). Как и у наших пациентов, после операции развилась невралгическая амиотрофия, а вовлечение диафрагмы в этой серии отмечено не было.
Пациенты с изолированной диафрагмальной невропатией часто первоначально обращаются к пульмонологу. Восстановление силы диафрагмы более вариабельно, чем восстановление функции верхних конечностей, и обычно занимает 2–5 лет. 12 Хотя известно, что ни одно лечение не ускоряет выздоровление, выявление состояния имеет смысл хотя бы для того, чтобы избавить пациента от ненужных исследований. Обычные рентгенограммы грудной клетки являются плохим показателем функции диафрагмы, и при подозрении на диагноз или у пациентов, у которых трудно определить причину одышки, мы рекомендуем проводить стимуляцию диафрагмального нерва для количественной оценки силы диафрагмы.
Обычные рентгенограммы грудной клетки являются плохим показателем функции диафрагмы, и при подозрении на диагноз или у пациентов, у которых трудно определить причину одышки, мы рекомендуем проводить стимуляцию диафрагмального нерва для количественной оценки силы диафрагмы.
ССЫЛКИ
- ↵
Ригг А. , Хьюз П., Лопес А., и др. Паралич правого диафрагмального нерва как осложнение постоянного центрального венозного катетера. Thorax1997;52:831–3.
- ↵
McCaul JA , Hislop WS. Преходящий гемидиафрагмальный паралич после операции на шее: отчет о случае и обзор литературы. JR Coll Surg Edinb2001;46:186–8.
- ↵
Diehl JL , Lofaso F, Deleuze P, и др. Клинически значимая дисфункция диафрагмы после операций на сердце. J Thorac Cardiovasc Surg1994;107:487–98.
- ↵
Lahrmann H , Grisold W, Authier FW, и др.
 Невралгическая амиотрофия с поражением диафрагмального нерва. Мышечный нерв1999;22:437–42.
Невралгическая амиотрофия с поражением диафрагмального нерва. Мышечный нерв1999;22:437–42. - ↵
ATS/ERS . Заявление о тестировании дыхательных мышц. Am J Respir Crit Care Med2002;166:518–624.
- ↵
Polkey M , Kyroussis D, Hamnegard CH, и др. Прочность диафрагмы при хронической обструктивной болезни легких. Am J Respir Crit Care Med1996;154:1310–7.
- ↵
Gravelyn TR , Brophy N, Siegert C, и др. Слабость дыхательных мышц, связанная с гипофосфатемией, в общей популяции стационарных больных. Ам Дж Мед1988;84:870–6.
- ↵
Shaw IC , Mills GH, Turnbull D. Влияние пропофола на давление в дыхательных путях, вызванное магнитной стимуляцией диафрагмальных нервов. Интенсивная терапия Med2002; 28: 891–7.

- ↵
Аката Т , Нода Ю, Нагата Т, и др. Полудиафрагмальный паралич после катетеризации подключичной вены. Acta Anaesthesiol Scand1997;41:1223–5.
- ↵
Hadeed HA , Браун Д. Паралич полудиафрагмы как осложнение катетеризации внутренней яремной вены: отчет о случае. J Oral Maxillofac Surg1988;46:409–11.
- ↵
Англия JD . Варианты невралгической амиотрофии. Мышечный нерв1999;22:435–6.
- ↵
Hughes PD , Polkey MI, Moxham J, и др. Длительное восстановление силы диафрагмы при невралгической амиотрофии. Eur Respir J1999;13:379–84.
- ↵
Parsonage MJ , Олдрен Тернер JW. Невралгическая амиотрофия плечевого пояса.
