Карта сайта
|
|
РАЗРУШАЕТСЯ ЛИ БЕЛОК ВО ВРЕМЯ ТЕРМООБРАБОТКИ?
Белковые
продукты Все товары
Категории:
- Сывороточный протеин
- Казеин
- Растительный протеин
- Яичный протеин
- Многокомпонентный
Популярные товары:
- GOLD STANDARD 100% WHEY
- NATURALLY FLAVORED 100% WHEY
- GOLD STANDARD 100% CASEIN
- SERIOUS MASS
- GOLD STANDARD 100% ISOLATE
Сила и
восстановление Все товары
Категории:
- Перед тренировкой
- После тренировки
- Аминокислоты
- Креатин
- Гейнеры
Популярные товары:
- AMINO ENERGY NATURALLY FLAVORED
- Essential Amino Energy + UC-II COLLAGEN
- AMINO ENERGY + ELECTROLYTES
- L — CARNITINE 500 TABS
- ESSENTIAL AMINO ENERGY
Здоровье и
долголетие Все товары
Категории:
- Диетические продукты
- Специальные добавки
- Мультивитамины
Популярные товары:
- OPTI-MEN
- OPTI-WOMEN
- L — CARNITINE 500 TABS
- ZMA
- FISH OIL SOFTGELS
Где купить
продукцию
Optimum
Nutrition
Change Region
USUKDEIEFR
Уважаемые покупатели! Обращаем ваше внимание, что указанные сроки доставки ориентировочные! День оформления заказа, его обработки и отгрузки в расчёт не принимаются! Team ON
Другие статьи
- Остерегайтесь подделок
- Изменение состава продукции
- Больше, чем просто новая упаковка!
- Вместо трёх загадочных букв ZMA!
- Новые крышки Opti-men & Opti-women
- Белые крышки и банки
- Яблочные оладьи
- Шаг в сторону экологии!
- Защитная мембрана
- Идеальные казеиновые блины
Основы фитнеса
06. 01.2023
01.2023
Говоря разрушается, мы имеем в виду денатурацию протеина в процессе термической обработки. <br>
Денатурация — это разрушение сложной цепочки белковой молекулы под действием дестабилизирующего температурного фактора. <br>
А вот с витаминами и минералами все немного сложнее, так как они при температурном воздействии легко разрушаются. <br>
Но протеин мы пьем не ради витаминов, а ради содержащихся в нем аминокислот, с которыми ничего плохого не происходит и качество их усвоения и ценность не теряется.
 <br>
<br>Идея, что с протеином что-то может быть не так под влиянием температуры, возникла в попытке сделать с помощью протеина и кипятка протеиновый чай. Получалось что-то невнятное. <br>
Воздействие высокой температуры приводит к образованию нерастворимого коллоидного фосфата кальция, который выпадает в осадок. И получается пенка на молоке вместо протеинового чая. <br>
Но вся эта технология прекрасно используется в сыроварении и нисколько не мешает нам наслаждаться этим вкусным продуктом. Поэтому протеиновый горячий чай пить можно, но не нужно. <br>
А выпекать блины и кексы с протеином нужно!<br>
Автор статьи: Артём Диянов <br>
Обзор анализа межбелковых взаимодействий | Thermo Fisher Scientific
Белки контролируют все биологические системы клетки, и хотя многие белки выполняют свои функции независимо, подавляющее большинство белков взаимодействуют друг с другом для обеспечения надлежащей биологической активности. Характеристика белок-белковых взаимодействий с помощью таких методов, как ко-иммунопреципитация (co-IP), пулл-даун-анализ, перекрестное связывание, перенос метки и дальнезападный блот-анализ, имеет решающее значение для понимания функции белка и биологии клетки.
Характеристика белок-белковых взаимодействий с помощью таких методов, как ко-иммунопреципитация (co-IP), пулл-даун-анализ, перекрестное связывание, перенос метки и дальнезападный блот-анализ, имеет решающее значение для понимания функции белка и биологии клетки.
Посмотреть все продукты для анализа белковых взаимодействий
Содержание страницы
- Введение в белок-белковые взаимодействия
- Типы белок-белковых взаимодействий
- Ко-иммунопреципитация (ко-IP)
- Pull-down анализы
- Анализ взаимодействия сшивающих белков
- Анализ взаимодействия белков переноса метки
- Дальний вестерн-блоттинг
- Рекомендуем прочитать
Посмотреть и выбрать продукты
- Руководство по выбору сшивающего агента
Введение в белок-белковые взаимодействия
Белки являются рабочими лошадками, которые облегчают большинство биологических процессов в клетке, включая экспрессию генов, рост клеток, пролиферацию, поглощение питательных веществ, морфологию, подвижность, межклеточную коммуникацию и апоптоз.
Критические аспекты, необходимые для понимания функции белка, включают:
- Последовательность и структура белка
- Эволюционная история и консервативные последовательности — идентифицирует ключевые регуляторные остатки профиль — раскрывает специфичность клеточного типа и то, как регулируется экспрессия
- Посттрансляционные модификации — фосфорилирование, ацилирование, гликозилирование и убиквитинирование указывают на локализацию, активацию и/или функцию
- Взаимодействие с другими белками — функцию можно экстраполировать, зная функцию партнеров по связыванию
- Внутриклеточная локализация — может указывать на функцию белка
белки. Однако, поскольку большинство белков взаимодействуют с другими белками для правильного функционирования, их следует изучать в контексте их взаимодействующих партнеров, чтобы полностью понять их функцию. С публикацией генома человека и развитием области протеомики понимание того, как белки взаимодействуют друг с другом, и определение биологических сетей стало жизненно важным для понимания того, как белки функционируют внутри клетки.
Однако, поскольку большинство белков взаимодействуют с другими белками для правильного функционирования, их следует изучать в контексте их взаимодействующих партнеров, чтобы полностью понять их функцию. С публикацией генома человека и развитием области протеомики понимание того, как белки взаимодействуют друг с другом, и определение биологических сетей стало жизненно важным для понимания того, как белки функционируют внутри клетки.
Справочник по приготовлению белков
Из этого 32-страничного руководства вы узнаете больше об обессоливании, замене буфера, концентрировании и/или удалении загрязняющих веществ из образцов белков, иммунопреципитации и других методах очистки и очистки белков с помощью различных инструментов Thermo Scientific для биологии белков.
- Иммунопреципитация (ИП), ко-ИП и хроматин-ИП
- Метки для очистки рекомбинантных белков
- Безопасный диализ образцов белков с использованием диализных кассет и устройств Slide-A-Lyzer
- Быстрое обессоление образцов с высоким извлечением белка с использованием вращающихся обессоливающих колонок и планшетов Zeba
- Эффективное извлечение определенных загрязнителей с помощью смол, оптимизированных для удаления детергентов или эндотоксинов
- Быстрое концентрирование разбавленных образцов белка с помощью концентраторов белка Pierce Узнать больше
- Ко-иммунопреципитация (Co-IP)
- Pull-Down Assays
- Анализ взаимодействия белков переноса метки
- Far-Western Blot Analysis
Отдельные продукты
- Руководство по выбору сшивающего агента
Типы белок-белковых взаимодействий слабый.
 Стабильные взаимодействия связаны с белками, которые очищаются в виде мультисубъединичных комплексов, причем субъединицы этих комплексов могут быть одинаковыми или разными. Гемоглобин и ядерная РНК-полимераза являются примерами многосубъединичных взаимодействий, которые образуют устойчивые комплексы.
Стабильные взаимодействия связаны с белками, которые очищаются в виде мультисубъединичных комплексов, причем субъединицы этих комплексов могут быть одинаковыми или разными. Гемоглобин и ядерная РНК-полимераза являются примерами многосубъединичных взаимодействий, которые образуют устойчивые комплексы.Предполагается, что временные взаимодействия контролируют большинство клеточных процессов. Как следует из названия, временные взаимодействия носят временный характер и обычно требуют набора условий, способствующих взаимодействию, таких как фосфорилирование, конформационные изменения или локализация в отдельных областях клетки. Переходные взаимодействия могут быть сильными или слабыми, быстрыми или медленными. Находясь в контакте со своими партнерами по связыванию, временно взаимодействующие белки участвуют в широком спектре клеточных процессов, включая модификацию белков, транспорт, фолдинг, передачу сигналов, апоптоз и клеточный цикл. Следующий пример иллюстрирует взаимодействия белков, которые регулируют апоптотические и антиапоптотические процессы.

Тяжелое белок-белковое взаимодействие BAD. Панель A: окрашенный кумасси гель SDS-PAGE рекомбинантных легких и тяжелых BAD-GST-HA-6xHIS, очищенных от лизатов HeLa IVT (L), с использованием тандемной аффинности глутатионовой смолы (E1) и кобальтовой смолы (E2). Указан проток (FT) из каждой колонки. Панель B: Схема фосфорилирования BAD и белковых взаимодействий во время выживания и гибели клеток (т.е. апоптоза). Панель C: покрытие последовательности белка BAD, показывающее идентифицированные сайты согласованного фосфорилирования Akt (красный прямоугольник). Панель D: МС-спектры меченого стабильным изотопом BAD-пептида HSSYPAGTEDDEGmGEEPSPFr.Белки связываются друг с другом за счет комбинации гидрофобных связей, сил Ван-дер-Ваальса и солевых мостиков в специфических доменах связывания на каждом белке. Эти домены могут быть небольшими связывающими щелями или большими поверхностями и могут иметь длину всего в несколько пептидов или охватывать сотни аминокислот.
 Сила связывания зависит от размера связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильному межбелковому взаимодействию, является лейциновая молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α-белке. -спирали, выступающие между соседними спиральными пептидными цепями. Из-за плотной молекулярной упаковки лейциновые застежки обеспечивают стабильное связывание мультибелковых комплексов, хотя все лейциновые застежки не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность взаимодействие.
Сила связывания зависит от размера связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильному межбелковому взаимодействию, является лейциновая молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α-белке. -спирали, выступающие между соседними спиральными пептидными цепями. Из-за плотной молекулярной упаковки лейциновые застежки обеспечивают стабильное связывание мультибелковых комплексов, хотя все лейциновые застежки не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность взаимодействие.Два домена гомологии Src (SH), Sh3 и Sh4, являются примерами обычных доменов временного связывания, которые связывают короткие пептидные последовательности и обычно обнаруживаются в сигнальных белках. Домен Sh3 распознает пептидные последовательности с фосфорилированными остатками тирозина, которые часто указывают на активацию белка.
 Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой опосредованное лигандом фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и ГТФазами для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность различных белковых взаимодействий определяется соседними аминокислотными остатками в соответствующем мотиве.
Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой опосредованное лигандом фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и ГТФазами для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность различных белковых взаимодействий определяется соседними аминокислотными остатками в соответствующем мотиве.Биологические эффекты белок-белковых взаимодействий
Результат взаимодействия двух или более белков с определенной функциональной целью может быть продемонстрирован несколькими различными способами. Измеримые эффекты белковых взаимодействий были описаны следующим образом:
- Изменяют кинетические свойства ферментов, которые могут быть результатом незначительных изменений в связывании субстрата или аллостерических эффектов
- Обеспечение каналов субстрата путем перемещения субстрата между доменами или субъединицами , что в конечном итоге приводит к желаемому конечному продукту
- Создание нового сайта связывания, обычно для небольших эффекторных молекул
- Инактивация или разрушение белка
- Изменение специфичности белка в отношении его субстрата посредством взаимодействия с различными партнерами по связыванию, например, демонстрация новой функции, которую не может выполнять ни один из белков по отдельности
- Выполняют регулирующую роль как в восходящем, так и в последующем событии
Общие методы анализа белок-белковых взаимодействий
Обычно для проверки, характеристики и подтверждения белковых взаимодействий необходимо сочетание методов.
 Ранее неизвестные белки могут быть обнаружены по их ассоциации с одним или несколькими известными белками. Анализ белковых взаимодействий может также раскрыть уникальные, непредвиденные функциональные роли хорошо известных белков. Открытие или проверка взаимодействия — первый шаг на пути к пониманию того, где, как и при каких условиях взаимодействуют эти белки in vivo и функциональные последствия этих взаимодействий.
Ранее неизвестные белки могут быть обнаружены по их ассоциации с одним или несколькими известными белками. Анализ белковых взаимодействий может также раскрыть уникальные, непредвиденные функциональные роли хорошо известных белков. Открытие или проверка взаимодействия — первый шаг на пути к пониманию того, где, как и при каких условиях взаимодействуют эти белки in vivo и функциональные последствия этих взаимодействий.Хотя различных методов и подходов к изучению белок-белковых взаимодействий слишком много, чтобы описать их здесь, в таблице ниже и в остальной части этого раздела основное внимание уделяется общим методам анализа белок-белковых взаимодействий и типам взаимодействий, которые можно изучать с помощью каждый метод. Таким образом, стабильные белок-белковые взаимодействия легче всего выделить с помощью физических методов, таких как ко-иммунопреципитация и пулл-даун-анализ, поскольку белковый комплекс не разрушается с течением времени. Слабые или временные взаимодействия можно идентифицировать с помощью этих методов, сначала ковалентно сшивая белки, чтобы заморозить взаимодействие во время co-IP или pull-down.
 В качестве альтернативы перекрестное связывание вместе с переносом метки и анализом дальнезападного блоттинга можно проводить независимо от других методов для идентификации белок-белковых взаимодействий.
В качестве альтернативы перекрестное связывание вместе с переносом метки и анализом дальнезападного блоттинга можно проводить независимо от других методов для идентификации белок-белковых взаимодействий.Общие методы анализа различных типов белковых взаимодействий
Method Protein–protein interactions Co-immunoprecipitation (co-IP) Stable or strong Pull-down assay Stable or strong Анализ взаимодействия перекрестно связывающихся белков Временный или слабый Анализ взаимодействия белков переноса метки Временное или слабое Дальний вестерн-блоттинг Умеренно стабильный Ко-иммунопреципитация (ко-ИП) .
 Co-IP проводится практически так же, как иммунопреципитация (IP) одиночного белка, за исключением того, что белок-мишень, осажденный антителом, также называемый «приманкой», используется для совместного осаждения комплекса связывающий партнер/белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается с антителом, иммобилизованным на подложке. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинга. При соосаждении ассоциированных белков обычно делается предположение, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это лишь предположение, которое подлежит дальнейшей проверке.
Co-IP проводится практически так же, как иммунопреципитация (IP) одиночного белка, за исключением того, что белок-мишень, осажденный антителом, также называемый «приманкой», используется для совместного осаждения комплекса связывающий партнер/белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается с антителом, иммобилизованным на подложке. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинга. При соосаждении ассоциированных белков обычно делается предположение, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это лишь предположение, которое подлежит дальнейшей проверке.Коиммунопреципитация циклина B и Cdk1 . Магнитные шарики Thermo Scientific Pierce Protein A/G связываются с антителом Cdk1 в комплексе с Cdk1. Циклин B связывается с Cdk1 и захватывается вместе со своим партнером по связыванию.

Узнать больше
- Ко-иммунопреципитация (Co-IP)
- Обзор электрофореза белков
- Обзор вестерн-блоттинга
- Иммунопреципитация белков (IP), ко-иммунопреципитация (Co-IP9)0011
Pull-down анализы
Pull-down анализы сходны по методологии с ко-иммунопреципитацией из-за использования гранулированной подложки для очистки взаимодействующих белков. Разница между этими двумя подходами, однако, заключается в том, что в то время как co-IP использует антитела для захвата белковых комплексов, анализы pull-down используют белок-приманку для очистки любых белков в лизате, которые связываются с приманкой. Анализы pull-down идеально подходят для изучения сильных или стабильных взаимодействий или тех, для ко-иммунопреципитации которых нет антител.
Общая схема ниспадающего анализа. Анализ с вытягиванием вниз представляет собой мелкомасштабный метод аффинной очистки, аналогичный иммунопреципитации, за исключением того, что антитело заменяется какой-либо другой аффинной системой.
 В этом случае аффинная система состоит из глутатион-S-трансферазы (GST)-, полигис- или стрептавидин-меченого белка или связывающего домена, который захватывается глутатион-, хелатом металла (кобальта или никеля) или покрытыми биотином агарозными шариками. , соответственно. Иммобилизованный белок с меткой слияния действует как «приманка» для захвата предполагаемого партнера по связыванию (то есть «добычи»). В типичном анализе методом pull-down иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных стадий промывки комплексы селективно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга.
В этом случае аффинная система состоит из глутатион-S-трансферазы (GST)-, полигис- или стрептавидин-меченого белка или связывающего домена, который захватывается глутатион-, хелатом металла (кобальта или никеля) или покрытыми биотином агарозными шариками. , соответственно. Иммобилизованный белок с меткой слияния действует как «приманка» для захвата предполагаемого партнера по связыванию (то есть «добычи»). В типичном анализе методом pull-down иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных стадий промывки комплексы селективно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга. Узнайте больше
- Отсталкивающие анализы
- Обзор сродства очистки
- GST-меченные белки-Производство и очистка
- HIS-меченные белки-Производство и очистка
Протекает протеиновый анализ
9001 Белковые взаимодействия преходящи, происходят только на короткое время как часть одного каскада или другой метаболической функции внутри клеток. Сшивание взаимодействующих белков — это подход к стабилизации или постоянному присоединению компонентов взаимодействующих комплексов. Как только компоненты взаимодействия ковалентно сшиты, другие этапы (например, лизис клеток, аффинная очистка, электрофорез или масс-спектрометрия) могут быть использованы для анализа взаимодействия белок-белок при сохранении исходного взаимодействующего комплекса.
Сшивание взаимодействующих белков — это подход к стабилизации или постоянному присоединению компонентов взаимодействующих комплексов. Как только компоненты взаимодействия ковалентно сшиты, другие этапы (например, лизис клеток, аффинная очистка, электрофорез или масс-спектрометрия) могут быть использованы для анализа взаимодействия белок-белок при сохранении исходного взаимодействующего комплекса.Гомобифункциональные, реагирующие с аминами сшивающие агенты могут быть добавлены к клеткам для сшивания вместе потенциально взаимодействующих белков, которые затем могут быть проанализированы после лизиса с помощью вестерн-блоттинга. Сшивающие агенты могут быть мембранопроницаемыми, например, DSS, для сшивания внутриклеточных белков, или они могут быть немембранопроницаемыми, например, BS3, для сшивания белков клеточной поверхности. Кроме того, некоторые сшивающие агенты могут быть расщеплены восстановителями, такими как DSP или DTSSP, для обращения сшивок.
В качестве альтернативы гетеробифункциональные сшивающие агенты, содержащие фотоактивируемую группу, такие как продукт SDA или сульфо-SDA, можно использовать для захвата временных взаимодействий, которые могут возникнуть, например, после определенного стимула.
 Фотоактивация также может происходить после метаболического мечения фотоактивируемыми аминокислотами, такими как L-фотолейцин или L-фотометионин.
Фотоактивация также может происходить после метаболического мечения фотоактивируемыми аминокислотами, такими как L-фотолейцин или L-фотометионин.Сайты сшивки между белками могут быть картированы с высокой точностью с помощью масс-спектрометрии, особенно если используется расщепляемый МС сшиватель, такой как DSSO или DSBU.
Узнайте больше
- Анализ взаимодействия сшивающего белка
- in vivo Руководство по выбору сшивания
- БЕЛЕЙНА бис(сульфосукцинимидил)суберат), формат без взвешивания
- DSP (дитиобис(сукцинимидилпропионат)), реагент Ломана
- DTSSP (3,3′-дитиобис(сульфосукцинимидилпропионат))
- SDA (NHS-диазирин) (сукцинимидил 4,4′-азипентаноат)
- Сульфо-SDA (сульфо-NHS-диазирин) (сульфосукцинимидил 4,4′-азипентаноат)
- L-Photo-Leucine
- L-Photo -Метионин
- DSSO (дисукцинимидилсульфоксид)
- DSBU (дисукцинимидилдимасляная мочевина)
Анализ взаимодействия белка переноса метки
Перенос метки включает сшивание взаимодействующих молекул (т.
 связь между приманкой и добычей, так что этикетка остается прикрепленной к добыче. Этот метод особенно ценен из-за его способности идентифицировать белки, которые слабо или временно взаимодействуют с интересующим белком. Новые неизотопные реагенты и методы продолжают делать этот метод более доступным и простым для любого исследователя.
связь между приманкой и добычей, так что этикетка остается прикрепленной к добыче. Этот метод особенно ценен из-за его способности идентифицировать белки, которые слабо или временно взаимодействуют с интересующим белком. Новые неизотопные реагенты и методы продолжают делать этот метод более доступным и простым для любого исследователя.Экспериментальная стратегия переноса биотиновой метки Sulfo-SBED и анализа методом вестерн-блоттинга.
Узнать больше
- Анализ взаимодействия белков с переносом метки
Дальний вестерн-блоттинг антитела, поэтому анализ дальнего вестерн-блоттинга отличается от вестерн-блоттинга , так как белок-белковые взаимодействия выявляются путем инкубации белков, подвергшихся электрофорезу, с очищенным меченым белком-приманкой вместо антитела, специфичного к целевому белку, соответственно. Термин «дальний» был принят, чтобы подчеркнуть это различие.
Схема дальнего вестерн-блоттинга для анализа белок-белковых взаимодействий.
 В этом примере меченый белок-приманка используется для зондирования переносящей мембраны или геля на наличие белка-жертвы. После связывания антитело, конъюгированное с ферментом (пероксидаза хрена; HRP), которое нацелено на метку-приманку, используется для маркировки взаимодействия, которое затем обнаруживается с помощью ферментативной хемилюминесценции. Этот общий подход можно скорректировать, используя немеченый белок-приманку, который обнаруживается с помощью антител, биотинилированный белок-приманка, который обнаруживается с помощью конъюгированного с ферментом стрептавидина, или радиоактивно меченный белок-приманка, который обнаруживается при воздействии на пленку.
В этом примере меченый белок-приманка используется для зондирования переносящей мембраны или геля на наличие белка-жертвы. После связывания антитело, конъюгированное с ферментом (пероксидаза хрена; HRP), которое нацелено на метку-приманку, используется для маркировки взаимодействия, которое затем обнаруживается с помощью ферментативной хемилюминесценции. Этот общий подход можно скорректировать, используя немеченый белок-приманку, который обнаруживается с помощью антител, биотинилированный белок-приманка, который обнаруживается с помощью конъюгированного с ферментом стрептавидина, или радиоактивно меченный белок-приманка, который обнаруживается при воздействии на пленку. Учить больше
- Обзор вестерн-блоттинга
- Иммунопреципитация белка (IP), коиммунопреципитации (Co-IP) и поддержки пульдоуна
Select Products
- Far-Westn чтение
- Golemis E (2002) Белковые взаимодействия: Руководство по молекулярному клонированию.
 Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор. p ix, 682.
Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор. p ix, 682. - Phizicky EM, Fields S (1995) Белок-белковые взаимодействия: методы обнаружения и анализа. Microbiol Rev 59:94–123.
Краткое введение в белок-белковое взаимодействие (PPI) — блог Creative Proteomics
Белки, биомолекулы или макромолекулы выполняют широкий спектр функций в организмах. Почти все клеточные процессы требуют, чтобы белки специфически распознавали множество различных партнеров по взаимодействию. Они могут выполнять свои роли, взаимодействуя с другими молекулами, включая ДНК, РНК, белки и малые молекулы. Взаимодействия белков и белков (PPI), которые относятся к преднамеренным физическим контактам, установленным между двумя или более белками в результате биохимических событий и/или электростатических сил.
Биологические эффекты белок-белковых взаимодействий
Белково-белковые взаимодействия играют важную роль в различных биологических процессах, включая межклеточные взаимодействия, развитие клеточного цикла, передачу сигналов и метаболические пути.
 Phizicky и Fields отметили важные свойства ИПП, в том числе:
Phizicky и Fields отметили важные свойства ИПП, в том числе:- ИПП могут изменять кинетические свойства ферментов, что может привести к незначительным изменениям в связывании субстрата или аллостерическим эффектам.
- PPI могут действовать как общий механизм, обеспечивающий канализацию субстрата путем перемещения субстрата между доменами или субъединицами.
- ИПП могут создавать новый сайт связывания для небольших эффекторных молекул.
- PPI может инактивировать или подавлять белок.
- PPI может изменить специфичность белка в отношении его субстрата за счет взаимодействия с различными партнерами по связыванию.
- В восходящем или нисходящем событии PPI могут играть регулирующую роль.
Типы межбелковых взаимодействий
Физическое взаимодействие белков можно разделить на различные типы взаимодействий в зависимости от многих факторов, включая состав, сродство и время жизни.
На основе композиций эти группы комплексов можно разделить на гомоолигомерные и гетероолигомерные комплексы.
 Гомоолигомер образуется, когда PPI возникает между идентичными цепями, тогда как гетероолигомер образуется, когда PPI возникает между неидентичными цепями. Например, гомодимер цитохрома с’ представляет собой гомодимер (два белковых комплекса). Кроме того, GroEL состоит из 14 идентичных субъединиц по 57 кДа, каждая из которых образует два гептамерных кольца, расположенных «спина к спине». Некоторые ферменты, белки-носители, каркасные белки и факторы регуляции транскрипции выполняют свои функции как гомоолигомеры.
Гомоолигомер образуется, когда PPI возникает между идентичными цепями, тогда как гетероолигомер образуется, когда PPI возникает между неидентичными цепями. Например, гомодимер цитохрома с’ представляет собой гомодимер (два белковых комплекса). Кроме того, GroEL состоит из 14 идентичных субъединиц по 57 кДа, каждая из которых образует два гептамерных кольца, расположенных «спина к спине». Некоторые ферменты, белки-носители, каркасные белки и факторы регуляции транскрипции выполняют свои функции как гомоолигомеры.Облигатные и необлигатные комплексы различаются по аффинности . Облигатное взаимодействие означает, что составляющие (протомеры, мономеры) комплекса нестабильны сами по себе in vivo . Компоненты необлигатных взаимодействий могут существовать независимо. Например, показано, что белки Ku, участвующие в репарации ДНК, связываются с ДНК в виде облигатных гомодимеров. Белок H-Ras, белок G, может взаимозаменяемо образовывать необлигатные комплексы с белками, активирующими гуанозинтрифосфатазу (ГТФазу) (GAP).

Согласно сроку службы существуют временные и постоянные взаимодействия. Компоненты временного взаимодействия временно связываются и диссоциируют in vivo , в то время как постоянные взаимодействия обычно очень стабильны и необратимы. Например, димер цитокина IL-5 представляет собой постоянное белок-белковое взаимодействие. Кроме того, PPI можно разделить на взаимодействия домен-домен и домен-пептид на основе складок. Комплексы домен-пептид в большинстве случаев являются временными, поскольку они образуются в результате узнавания глобулярного домена, короткого линейного мотива (LM) и небольшого интерфейса, на котором происходит взаимодействие.
Подводя итог, можно сказать, что все обязательные PPI являются постоянными, но не все постоянные взаимодействия являются обязательными. Необязательные взаимодействия являются временными, но некоторые необязательные взаимодействия являются постоянными, например, некоторые взаимодействия фермент-ингибитор.
 Категория сильных переходных процессов включает белковые взаимодействия, которые переходят из несвязанного/слабосвязанного состояния в сильно связанное состояние, которое обычно запускается эффекторной молекулой.
Категория сильных переходных процессов включает белковые взаимодействия, которые переходят из несвязанного/слабосвязанного состояния в сильно связанное состояние, которое обычно запускается эффекторной молекулой.Рис. 1. Соотношение типов белок-белковых взаимодействий по аффинности и стабильности. (Акунер Озбабаджан СЭ, et al ., 2011)
Белок и белковые взаимодействия при разработке лекарственных средств
Несмотря на значительную роль ИПП в клеточных функциях, они могут играть важную роль в качестве терапевтических мишеней. Направленная модуляция ИПП с помощью малых молекул является одним из наиболее многообещающих подходов с более чем 50 ИПП, на которые успешно нацелены малые молекулы. Большинство из них являются ингибиторами ИПП, но стабилизация ИПП также является стратегией целенаправленной модуляции ИПП.
Как показано на рисунке 2, соединения по-разному воздействуют на ИПП. Что касается ингибиторов PPI, они могут проявлять конкурентный эффект на PPI, предотвращая связывание природного партнера по связыванию, что было названо конкурентным режимом.
 Другой способ заключается в связывании соединения с сайтом, который не является непосредственно частью интерфейса PPI, но останавливает белок в конформации с низким сродством, так что связывание природного партнера по связыванию затруднено. Возможен также коннекционный или аллостерический способ стабилизации. Путем связывания соединения в аллостерическом режиме стабилизации белок может связываться со своим природным лигандом в конформации с высоким сродством для усиления PPI. Другой формой стабилизации является соединительный способ действия, который представляет собой прямое связывание в ободке интерфейса с одновременным контактированием обоих белков-партнеров.
Другой способ заключается в связывании соединения с сайтом, который не является непосредственно частью интерфейса PPI, но останавливает белок в конформации с низким сродством, так что связывание природного партнера по связыванию затруднено. Возможен также коннекционный или аллостерический способ стабилизации. Путем связывания соединения в аллостерическом режиме стабилизации белок может связываться со своим природным лигандом в конформации с высоким сродством для усиления PPI. Другой формой стабилизации является соединительный способ действия, который представляет собой прямое связывание в ободке интерфейса с одновременным контактированием обоих белков-партнеров.Рисунок 2. Влияние соединения на белок-белковое взаимодействие. (Skwarczynska M & Ottmann C, 2015)
Существуют различные методы обнаружения белковых взаимодействий, включая двухгибридный скрининг дрожжей, аффинную очистку в сочетании с масс-спектрометрией и т. д. Если вы хотите узнать больше о методах обнаружения белок-белковых взаимодействий, обратите внимание на наш следующий блог.

- Golemis E (2002) Белковые взаимодействия: Руководство по молекулярному клонированию.
 Стабильные взаимодействия связаны с белками, которые очищаются в виде мультисубъединичных комплексов, причем субъединицы этих комплексов могут быть одинаковыми или разными. Гемоглобин и ядерная РНК-полимераза являются примерами многосубъединичных взаимодействий, которые образуют устойчивые комплексы.
Стабильные взаимодействия связаны с белками, которые очищаются в виде мультисубъединичных комплексов, причем субъединицы этих комплексов могут быть одинаковыми или разными. Гемоглобин и ядерная РНК-полимераза являются примерами многосубъединичных взаимодействий, которые образуют устойчивые комплексы.
 Сила связывания зависит от размера связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильному межбелковому взаимодействию, является лейциновая молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α-белке. -спирали, выступающие между соседними спиральными пептидными цепями. Из-за плотной молекулярной упаковки лейциновые застежки обеспечивают стабильное связывание мультибелковых комплексов, хотя все лейциновые застежки не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность взаимодействие.
Сила связывания зависит от размера связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильному межбелковому взаимодействию, является лейциновая молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α-белке. -спирали, выступающие между соседними спиральными пептидными цепями. Из-за плотной молекулярной упаковки лейциновые застежки обеспечивают стабильное связывание мультибелковых комплексов, хотя все лейциновые застежки не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность взаимодействие. Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой опосредованное лигандом фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и ГТФазами для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность различных белковых взаимодействий определяется соседними аминокислотными остатками в соответствующем мотиве.
Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой опосредованное лигандом фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и ГТФазами для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность различных белковых взаимодействий определяется соседними аминокислотными остатками в соответствующем мотиве. Ранее неизвестные белки могут быть обнаружены по их ассоциации с одним или несколькими известными белками. Анализ белковых взаимодействий может также раскрыть уникальные, непредвиденные функциональные роли хорошо известных белков. Открытие или проверка взаимодействия — первый шаг на пути к пониманию того, где, как и при каких условиях взаимодействуют эти белки in vivo и функциональные последствия этих взаимодействий.
Ранее неизвестные белки могут быть обнаружены по их ассоциации с одним или несколькими известными белками. Анализ белковых взаимодействий может также раскрыть уникальные, непредвиденные функциональные роли хорошо известных белков. Открытие или проверка взаимодействия — первый шаг на пути к пониманию того, где, как и при каких условиях взаимодействуют эти белки in vivo и функциональные последствия этих взаимодействий. В качестве альтернативы перекрестное связывание вместе с переносом метки и анализом дальнезападного блоттинга можно проводить независимо от других методов для идентификации белок-белковых взаимодействий.
В качестве альтернативы перекрестное связывание вместе с переносом метки и анализом дальнезападного блоттинга можно проводить независимо от других методов для идентификации белок-белковых взаимодействий.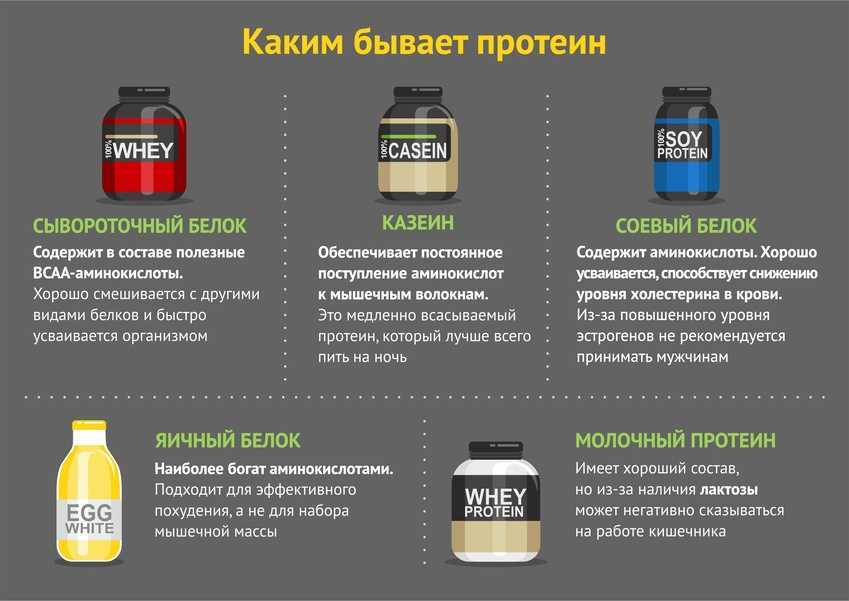 Co-IP проводится практически так же, как иммунопреципитация (IP) одиночного белка, за исключением того, что белок-мишень, осажденный антителом, также называемый «приманкой», используется для совместного осаждения комплекса связывающий партнер/белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается с антителом, иммобилизованным на подложке. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинга. При соосаждении ассоциированных белков обычно делается предположение, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это лишь предположение, которое подлежит дальнейшей проверке.
Co-IP проводится практически так же, как иммунопреципитация (IP) одиночного белка, за исключением того, что белок-мишень, осажденный антителом, также называемый «приманкой», используется для совместного осаждения комплекса связывающий партнер/белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается с антителом, иммобилизованным на подложке. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинга. При соосаждении ассоциированных белков обычно делается предположение, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это лишь предположение, которое подлежит дальнейшей проверке.
 В этом случае аффинная система состоит из глутатион-S-трансферазы (GST)-, полигис- или стрептавидин-меченого белка или связывающего домена, который захватывается глутатион-, хелатом металла (кобальта или никеля) или покрытыми биотином агарозными шариками. , соответственно. Иммобилизованный белок с меткой слияния действует как «приманка» для захвата предполагаемого партнера по связыванию (то есть «добычи»). В типичном анализе методом pull-down иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных стадий промывки комплексы селективно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга.
В этом случае аффинная система состоит из глутатион-S-трансферазы (GST)-, полигис- или стрептавидин-меченого белка или связывающего домена, который захватывается глутатион-, хелатом металла (кобальта или никеля) или покрытыми биотином агарозными шариками. , соответственно. Иммобилизованный белок с меткой слияния действует как «приманка» для захвата предполагаемого партнера по связыванию (то есть «добычи»). В типичном анализе методом pull-down иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных стадий промывки комплексы селективно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга.  Сшивание взаимодействующих белков — это подход к стабилизации или постоянному присоединению компонентов взаимодействующих комплексов. Как только компоненты взаимодействия ковалентно сшиты, другие этапы (например, лизис клеток, аффинная очистка, электрофорез или масс-спектрометрия) могут быть использованы для анализа взаимодействия белок-белок при сохранении исходного взаимодействующего комплекса.
Сшивание взаимодействующих белков — это подход к стабилизации или постоянному присоединению компонентов взаимодействующих комплексов. Как только компоненты взаимодействия ковалентно сшиты, другие этапы (например, лизис клеток, аффинная очистка, электрофорез или масс-спектрометрия) могут быть использованы для анализа взаимодействия белок-белок при сохранении исходного взаимодействующего комплекса. Фотоактивация также может происходить после метаболического мечения фотоактивируемыми аминокислотами, такими как L-фотолейцин или L-фотометионин.
Фотоактивация также может происходить после метаболического мечения фотоактивируемыми аминокислотами, такими как L-фотолейцин или L-фотометионин. связь между приманкой и добычей, так что этикетка остается прикрепленной к добыче. Этот метод особенно ценен из-за его способности идентифицировать белки, которые слабо или временно взаимодействуют с интересующим белком. Новые неизотопные реагенты и методы продолжают делать этот метод более доступным и простым для любого исследователя.
связь между приманкой и добычей, так что этикетка остается прикрепленной к добыче. Этот метод особенно ценен из-за его способности идентифицировать белки, которые слабо или временно взаимодействуют с интересующим белком. Новые неизотопные реагенты и методы продолжают делать этот метод более доступным и простым для любого исследователя. В этом примере меченый белок-приманка используется для зондирования переносящей мембраны или геля на наличие белка-жертвы. После связывания антитело, конъюгированное с ферментом (пероксидаза хрена; HRP), которое нацелено на метку-приманку, используется для маркировки взаимодействия, которое затем обнаруживается с помощью ферментативной хемилюминесценции. Этот общий подход можно скорректировать, используя немеченый белок-приманку, который обнаруживается с помощью антител, биотинилированный белок-приманка, который обнаруживается с помощью конъюгированного с ферментом стрептавидина, или радиоактивно меченный белок-приманка, который обнаруживается при воздействии на пленку.
В этом примере меченый белок-приманка используется для зондирования переносящей мембраны или геля на наличие белка-жертвы. После связывания антитело, конъюгированное с ферментом (пероксидаза хрена; HRP), которое нацелено на метку-приманку, используется для маркировки взаимодействия, которое затем обнаруживается с помощью ферментативной хемилюминесценции. Этот общий подход можно скорректировать, используя немеченый белок-приманку, который обнаруживается с помощью антител, биотинилированный белок-приманка, который обнаруживается с помощью конъюгированного с ферментом стрептавидина, или радиоактивно меченный белок-приманка, который обнаруживается при воздействии на пленку.  Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор. p ix, 682.
Колд-Спринг-Харбор (Нью-Йорк): Лабораторное издательство Колд-Спринг-Харбор. p ix, 682. Phizicky и Fields отметили важные свойства ИПП, в том числе:
Phizicky и Fields отметили важные свойства ИПП, в том числе: Гомоолигомер образуется, когда PPI возникает между идентичными цепями, тогда как гетероолигомер образуется, когда PPI возникает между неидентичными цепями. Например, гомодимер цитохрома с’ представляет собой гомодимер (два белковых комплекса). Кроме того, GroEL состоит из 14 идентичных субъединиц по 57 кДа, каждая из которых образует два гептамерных кольца, расположенных «спина к спине». Некоторые ферменты, белки-носители, каркасные белки и факторы регуляции транскрипции выполняют свои функции как гомоолигомеры.
Гомоолигомер образуется, когда PPI возникает между идентичными цепями, тогда как гетероолигомер образуется, когда PPI возникает между неидентичными цепями. Например, гомодимер цитохрома с’ представляет собой гомодимер (два белковых комплекса). Кроме того, GroEL состоит из 14 идентичных субъединиц по 57 кДа, каждая из которых образует два гептамерных кольца, расположенных «спина к спине». Некоторые ферменты, белки-носители, каркасные белки и факторы регуляции транскрипции выполняют свои функции как гомоолигомеры.
 Категория сильных переходных процессов включает белковые взаимодействия, которые переходят из несвязанного/слабосвязанного состояния в сильно связанное состояние, которое обычно запускается эффекторной молекулой.
Категория сильных переходных процессов включает белковые взаимодействия, которые переходят из несвязанного/слабосвязанного состояния в сильно связанное состояние, которое обычно запускается эффекторной молекулой. Другой способ заключается в связывании соединения с сайтом, который не является непосредственно частью интерфейса PPI, но останавливает белок в конформации с низким сродством, так что связывание природного партнера по связыванию затруднено. Возможен также коннекционный или аллостерический способ стабилизации. Путем связывания соединения в аллостерическом режиме стабилизации белок может связываться со своим природным лигандом в конформации с высоким сродством для усиления PPI. Другой формой стабилизации является соединительный способ действия, который представляет собой прямое связывание в ободке интерфейса с одновременным контактированием обоих белков-партнеров.
Другой способ заключается в связывании соединения с сайтом, который не является непосредственно частью интерфейса PPI, но останавливает белок в конформации с низким сродством, так что связывание природного партнера по связыванию затруднено. Возможен также коннекционный или аллостерический способ стабилизации. Путем связывания соединения в аллостерическом режиме стабилизации белок может связываться со своим природным лигандом в конформации с высоким сродством для усиления PPI. Другой формой стабилизации является соединительный способ действия, который представляет собой прямое связывание в ободке интерфейса с одновременным контактированием обоих белков-партнеров.