Загрязняющие вещества 4 класса опасности — Челябинский гидрометеоцентр
| Главная>
Мониторинг среды>
Загрязняющие вещества>
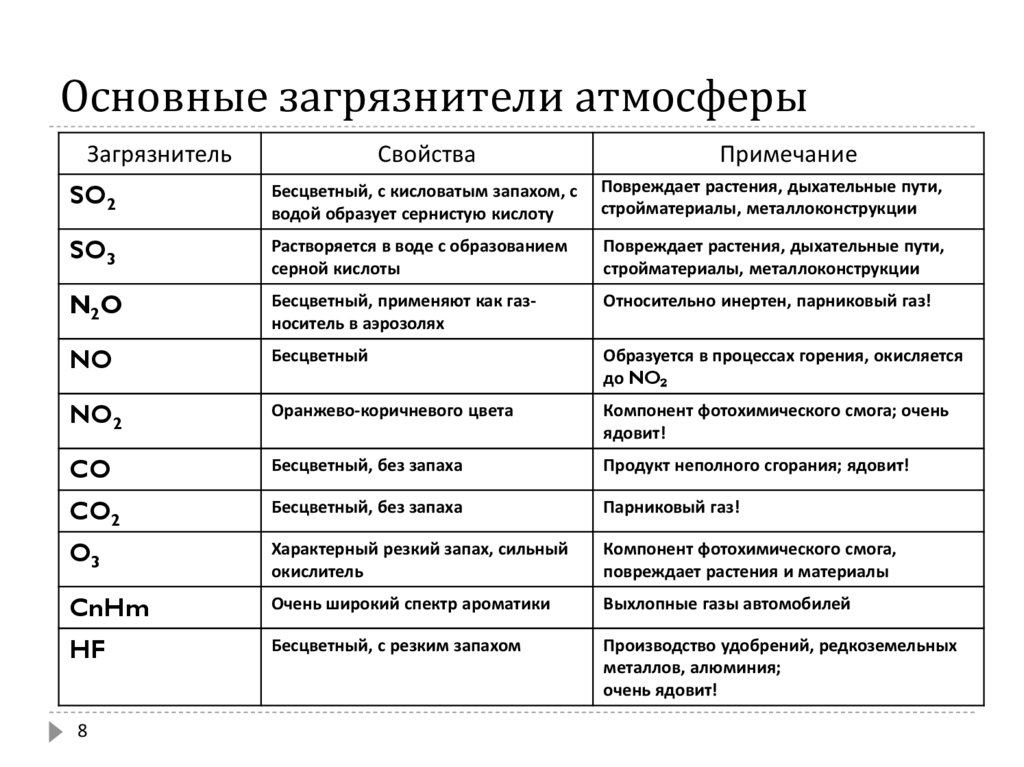
Загрязняющие вещества 4 класса опасности Оксид углерода (угарный газ). Оксид углерода – бесцветный газ, не имеющий запаха, немного легче воздуха, плохо растворим в воде, имеет температуру кипения: – 191,5°С. На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО2.
Источники поступления в окружающую среду. Монооксид углерода входит в состав атмосферы (10%). В атмосферу оксид углерода попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220х106 тонн оксида углерода в результате фоторазложения красных, сине-зеленых и др. Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн. тонн стали образуется 320-400 тонн оксида углерода. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт. В результате деятельности человека в атмосферу ежегодно поступает 350-600х106 тонн угарного газа. Около 56-62% этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать величины 12%).
Поведение в окружающей среде. При обычных условиях монооксид углерода инертен. Он химически не взаимодействует с водой. Растворимость СО в воде около 1:40 по объему. В растворе способен восстанавливать соли золота и платины до свободных металлов уже при обычной температуре. Не реагирует СО также с щелочами и кислотами. Взаимодействует с едкими щелочами только при повышенных температурах и высоких давлениях. Убыль оксида углерода в окружающей среде происходит за счет его разложения почвенными грибами. Кроме того, при избытке кислорода в почвах тяжелого механического состава, богатых органическими веществами, имеет место переход СО в СО2.
Воздействие на организм человека. Оксид углерода чрезвычайно ядовит. Допустимое содержание СО в производственных помещениях составляет 20 мг/м3 в течение рабочего дня, 50 мг/м3 в течение 1 часа, 100 мг/м3 в течение 30 минут, в атмосферном воздухе города максимальная разовая (за 20 мин) – 5 мг/м3, среднесуточная ПДК – 3 мг/м3. СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода, имея двойную химическую связь, соединяется с гемоглобином более прочно, чем молекула кислорода. Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд. СО нарушает фосфорный обмен. Нарушение азотистого обмена вызывает зотемию, изменение содержания белков плазмы, снижение активности холинэстеразы крови и уровня витамина В6. Угарный газ влияет на углеводный обмен, усиливает распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови. Больше всего при отравлении страдает ЦНС. При вдыхании небольшой концентрации (до 1 мг/л) – тяжесть и ощущение сдавливания головы, сильная боль во лбу и висках, головокружение, дрожь, жажда, учащение пульса, тошнота, рвота, повышение температуры тела до 38-40°С. Слабость в ногах свидетельствует о распространении действия на спинной мозг. Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным. Класс опасности вещества — 4.
Аммиак. Аммиак – бесцветный газ с резким запахом, температура плавления – 80°С, температура кипения – 36°С, хорошо растворяется в воде, спирте и ряде других органических растворителей.
Нахождение в природе. В природе образуется при разложении азотсодержащих органических соединений.Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Антропогенные источники поступления в окружающую среду. Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы.
Влияние на организм человека. Этот газ токсичен. Человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья. При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Хроническое воздействие сублетальных доз аммиака приводит к вегетативным расстройствам, повышению возбудимости парасимпатического отдела нервной системы, жалобы на слабость, недомогание, насморк, кашель, боли в груди. Класс опасности вещества – 4. «назад» |
Воздействие оксида углерода на организм человека
Оксид углерода (СО) является бесцветным газом без запаха, который снижает способность гемоглобина переносить и поставлять кислород.
Распространение
 Естественным путем образуется 90 % атмосферной СО, а в результате деятельности человека производится 10 %. На двигатели транспортных средств приходится от 55 до 60 % всего количества СО искусственного происхождения. Выхлопной газ бензинового двигателя (электрическое зажигание) является обычным источником образования СО. Выхлопной газ дизельного двигателя (компрессионное воспламенение) содержит приблизительно 0.1 % СО, если двигатель работает надлежащим образом, однако неправильно отрегулированный, перегруженный или технически плохо обслуживаемый дизельный двигатель может выбрасывать значительные количества СО. Тепловые или каталитические дожигатели в выхлопных трубах значительно снижают количество СО. Другими основными источниками CO являются литейные производства, установки каталитического крекинга на нефтеперерабатывающих предприятиях, процессы дистилляции угля и древесины, известеобжигательные печи и печи восстановления на заводах крафт-бумаги, производство синтетического метанола и других органических соединений из оксида углерода, спекание загрузочного сырья доменной печи, производство карбида, производство формальдегида, заводы технического углерода, коксовые батареи, газовые предприятия и заводы по переработке отходов.
Естественным путем образуется 90 % атмосферной СО, а в результате деятельности человека производится 10 %. На двигатели транспортных средств приходится от 55 до 60 % всего количества СО искусственного происхождения. Выхлопной газ бензинового двигателя (электрическое зажигание) является обычным источником образования СО. Выхлопной газ дизельного двигателя (компрессионное воспламенение) содержит приблизительно 0.1 % СО, если двигатель работает надлежащим образом, однако неправильно отрегулированный, перегруженный или технически плохо обслуживаемый дизельный двигатель может выбрасывать значительные количества СО. Тепловые или каталитические дожигатели в выхлопных трубах значительно снижают количество СО. Другими основными источниками CO являются литейные производства, установки каталитического крекинга на нефтеперерабатывающих предприятиях, процессы дистилляции угля и древесины, известеобжигательные печи и печи восстановления на заводах крафт-бумаги, производство синтетического метанола и других органических соединений из оксида углерода, спекание загрузочного сырья доменной печи, производство карбида, производство формальдегида, заводы технического углерода, коксовые батареи, газовые предприятия и заводы по переработке отходов.
Любой процесс, при котором может произойти неполное сгорание органического материала является потенциальным источником оксида углерода.
Оксид углерода, как считается, является единственной наиболее распространенной причиной отравлений, как в промышленных условиях, так и в домашних. Тысячи людей ежегодно умирают в результате интоксикации CO. Предполагается что число жертв не смертельного отравления, страдающих от постоянного расстройства нервной системы, превышает эту цифру. Величина опасности для здоровья, фатального и не фатального характера, которая исходит от оксида углерода, является огромной, и отравлений, по всей видимости, происходит намного больше, чем это в настоящий момент выявляется.
Существенная часть от всей рабочей силы любой из стран подвергается значительному воздействию СО на рабочих местах. СО — вездесущая опасность в автомобильной промышленности, в гаражах и на станциях технического обслуживания. Водители дорожного транспорта могут подвергаться опасности в том случае, если существует течь, через которую выхлопные газы могут проникать в кабину водителя.
 Существует огромное количество видов деятельности, при которых работники могут подвергнуться воздействию СО, например, механики гаражей, сжигатели древесного угля, рабочие коксовых печей, рабочие доменных печей, кузнецы, шахтеры, туннельные рабочие, газовые работники, котельные рабочие, рабочие гончарных печей, повара, пекари, пожарники, рабочие, занятые в производстве формальдегидов, и многие другие. Производство сварочных работ в баках, цистернах и других закрытых пространствах может привести к выделению опасных количеств СО, если отсутствует эффективная вентиляция.
Существует огромное количество видов деятельности, при которых работники могут подвергнуться воздействию СО, например, механики гаражей, сжигатели древесного угля, рабочие коксовых печей, рабочие доменных печей, кузнецы, шахтеры, туннельные рабочие, газовые работники, котельные рабочие, рабочие гончарных печей, повара, пекари, пожарники, рабочие, занятые в производстве формальдегидов, и многие другие. Производство сварочных работ в баках, цистернах и других закрытых пространствах может привести к выделению опасных количеств СО, если отсутствует эффективная вентиляция.Токсичные воздействия
Небольшие количества СО производятся человеческим организмом в результате катаболизма гемоглобина и других кровесодержащих пигментов, ведя к эндогенной насыщенности крови приблизительно от 0.3 до 0.8 % карбоксигемоглобином (COHb). Концентрация эндогенного COHb увеличивается при гемолитических анемиях и после значительных ушибов или возникновения гематом, которые вызывают увеличение катаболизма гемоглобина.
Биологический период полураспада концентрации COHb в крови у сидячих взрослых людей составляет приблизительно от 3 до 4 часов. Процесс удаления CO со временем замедляется и чем более низким является начальный уровень COHb, тем медленнее уровень его выделения.
Острое отравление
Появление симптомов зависит от концентрации CO в воздухе, времени воздействия, степени физических усилий и индивидуальной восприимчивости. Если воздействие носит массивный характер, человек может почти мгновенно потерять сознания с возникновением немногих или вообще без всяких предостерегающих симптомов или признаков. Воздействие концентрации от 10,000 до 40,000 течение нескольких минут приводит к смерти. Уровни концентрации в промежутке между 1,000 и 10,000 вызывает симптомы головной боли, головокружения и тошноты в течение 13-15 минут и потерю сознания и смерть, если воздействие продолжается от 10 до 45 минут Чем ниже уровни концентрации, тем больше проходит до начала возникновения симптомов: уровень концентрации 500 вызывают головную боль по прошествии 20-ти минут, а уровень концентрации 200 — по прошествии приблизительно 50 мин. Соотношение между концентрациями карбоксигемоглобина и главными симптомами демонстрируется в таблице 104.161.
Соотношение между концентрациями карбоксигемоглобина и главными симптомами демонстрируется в таблице 104.161.
———————————————————————————
Таблица 104.161 Основные признаки и симптомы при различных концентрациях карбоксигемоглобина
Концентрация (%) | Основные признаки и симптомы |
0.3-0.7 | Отсутствие признаков и симптомов. Нормальный эндогенный уровень. |
2.5-5 | Отсутствие симптомов. Компенсационное увеличение кровотока к некоторым жизненно важным органам. У пациентов с серьезной сердечно-сосудистой недостаточностью может отсутствовать компенсационный резерв. Боль в груди у пациентов страдающих стенокардией вызывается меньшим количеством физических усилий. |
5-10 | Визуальный световой порог несколько увеличился. |
10-20 | Легкая головная боль. Аномалии визуально вызванного ответа. Возможна небольшая одышка при физических усилиях. Может быть летален для плода. Может быть летален для пациентов с серьезной сердечной недостаточностью. |
20-30 | Слабая или умеренная головная боль и пульсации в висках. Прилив крови к коже. Тошнота. Потеря ловкости рук. |
30-40 | Серьезная головная боль, головокружение, тошнота и рвота. Слабость. Раздражительность и нарушения суждений. Обморок при физических усилиях. |
40-50 | То же что и выше, но в более серьезный форме и с большей вероятностью коллапса и обморока. |
50-60 | Возможна кома с прерывистыми конвульсиями и дыханием Чейн-Стокса. |
60-70 | Кома с прерывистыми конвульсиями. Угнетение респираторной системы и сердечная деятельности. Возможен летальный исход. |
70-80 | Слабый пульс и замедление дыхания. Угнетение дыхательного центра, которое может вызвать смерть. |
Основной признак жертвы отравления классически описывается как красно-вишневый цвет. На ранних стадиях пациент может казаться бледным. Позже, кожа, ногтевые ложа и слизистые оболочки могут стать вишнево красными из-за высокой концентрации карбоксигемоглобина и низкой концентрации уменьшенного гемоглобина в крови. Этот симптом может быть обнаружен при более чем 30 % концентрации COHb, но этот признак не является надежным и регулярным признаком отравления CO. Пульс пациента ускоряется и становится скачкообразным. Гиперпноэ незначительна или вообще не может быть отмечена до тех пор, пока уровень концентрации COHb не становится очень высоким.
Там где признаки и симптомы, описанные выше, обнаруживаются у человека, работа которого связана с возможностью воздействия на него углеродистой одноокиси, необходимо немедленно предположить отравление газом. Дифференциальный диагноз от отравления лекарственного средства, острого отравления алкоголем, церебрального или кардиального инфаркта, или диабетической или уремической комы может быть труден, и воздействие оксида углерода часто не распознается или просто упускается из виду. Диагноз отравления оксида углерода не может быть поставлен, пока не установлено, что организм содержит неестественно высокое количество CO. Оксид углерода легко обнаруживается в пробе крови или, если человек имеет здоровые легкие, расчет кровяной концентрации COHb может быть произведен достаточно быстро при исследовании образца выдохнутого внутреннего альвеолярного воздуха, который находится в равновесном состоянии с концентрацией COHb в крови.
Если рассматривать CO, то к критическим органам относятся мозг и сердце, так как работа их обоих зависит от непрерывного снабжения кислородом. Углеродистая одноокись затрудняет работу сердца двумя путями: работа сердца усиливается для того, чтобы покрыть недостаток периферийного снабжения кислородом, в то время как приток кислорода к нему самому уменьшается из-за CO. Оксид углерода, таким образом, может стать причиной инфаркта миокарда.
Углеродистая одноокись затрудняет работу сердца двумя путями: работа сердца усиливается для того, чтобы покрыть недостаток периферийного снабжения кислородом, в то время как приток кислорода к нему самому уменьшается из-за CO. Оксид углерода, таким образом, может стать причиной инфаркта миокарда.
При остром отравлении могут наступить неврологические и сердечно сосудистые осложнения, симптомы которых становятся очевидными при выходе пациента из первоначальной комы. Следствием серьезного отравления может стать отек легких (избыток жидкости в легочных тканях). Через несколько часов или дней, иногда вследствие аспирации, может развиться пневмония. Также могут иметь место временные заболевания гликозурией и протеинурией также могут иметь место. В редких случаях острая почечная недостаточность может стать причиной осложнения выздоровления при отравлении. Время от времени встречаются и кожные проявления отравления.
После серьезной интоксикации CO пациент может страдать от отека головного мозга с необратимым повреждением мозга различной степени тяжести. Первичное восстановление может сопровождаться последующим невропсихиатрическим рецидивом, через несколько дней или даже недель после отравления. Патологические исследования безнадежных случаев заболеваний показывают преобладающее поражение белового вещества нервной системы по сравнению с поражением нейронов у тех жертв, которые выживали в течение нескольких дней после отравления. Степень поражения мозга после отравления CO определяется интенсивностью и продолжительностью воздействия. Приходя в сознание после серьезного отравления CO, в 50 % случаев жертвы сообщали о ненормальном ментальном состоянии, которое проявлялось в качестве раздражительности, нетерпеливости, продолжительных приступов бреда, депрессии или беспокойстве.
Первичное восстановление может сопровождаться последующим невропсихиатрическим рецидивом, через несколько дней или даже недель после отравления. Патологические исследования безнадежных случаев заболеваний показывают преобладающее поражение белового вещества нервной системы по сравнению с поражением нейронов у тех жертв, которые выживали в течение нескольких дней после отравления. Степень поражения мозга после отравления CO определяется интенсивностью и продолжительностью воздействия. Приходя в сознание после серьезного отравления CO, в 50 % случаев жертвы сообщали о ненормальном ментальном состоянии, которое проявлялось в качестве раздражительности, нетерпеливости, продолжительных приступов бреда, депрессии или беспокойстве.
Повторяющееся воздействие. Оксид углерода не накапливается в организме. Он полностью выводится после каждого периода воздействия, если человек пребывает достаточное количество времени на свежем воздухе. Однако возможно, что повторяющиеся небольшие или умеренные отравления, которые не вызывают потерю сознания, приведут к омертвлению клеток мозга и в конечном счете к повреждению центральной нервной системы с большим количеством возможных симптомов типа головной боли, головокружения, раздражительности, ухудшения памяти и т. п.
п.
Индивидуумы, неоднократно подвергавшиеся воздействию умеренных концентраций CO, возможно адаптированы до некоторой степени к противостоянию его воздействиям. Механизмы адаптации, как считается, схожи с развитием толерантности по отношению к гипоксии на больших высотах.
Оксида углерода легко проникает через плаценту и воздействует на зародыш, который чувствителен к любой нехватке кислорода, причем это воздействие может быть настолько серьезным, чтобы подвергнуть опасности нормальное развитие плода.
Группы риска.
Особенно чувствительными к воздействию CO являются индивидуумы, чья способность транспортировки кислорода уже снижена из-за анемии или гемоглабиноза; те, кто нуждается в дополнительном притоке кислорода из-за лихорадки, гипертиреоза или беременности; пациенты с системной гипоксией из-за респираторной недостаточности; и пациенты с ишемической болезнью сердца и с церебральным или общим артериосклерозом. Дети и подростки, у которых легкие работают быстрее, чем у взрослых, достигают уровня интоксикации COHb скорее, чем здоровые взрослые. А также курильщики, чей стартовый уровень COHb выше, чем таковой у некурящих, гораздо быстрее могут приблизиться к опасным концентрациям COHb при сильном воздействии.
А также курильщики, чей стартовый уровень COHb выше, чем таковой у некурящих, гораздо быстрее могут приблизиться к опасным концентрациям COHb при сильном воздействии.
Загрязнение воздуха угарным газом – Техасская комиссия по качеству окружающей среды
Вы здесь:
Загрязнение воздуха угарным газом Общая информация о планировании угарного газа (CO) и TCEQ, которая соответствует Национальным стандартам качества окружающего воздуха (NAAQS) для CO. https://www.tceq.texas.gov/airquality/sip/criteria-pollutants/sip-co https://www.tceq.texas.gov/@@site-logo/TCEQ-1072×1072.png
Общая информация по угарному газу (CO) и планированию TCEQ с учетом национальных стандартов качества окружающего воздуха (NAAQS) для CO.
Что такое окись углерода?
Последнее планирование качества воздуха, соответствующее Национальным стандартам качества окружающего воздуха CO
.Связанные веб-страницы и публикации
Получите дополнительную информацию о SIP в Техасе и свяжитесь с TCEQ
Что такое угарный газ?
CO представляет собой бесцветный газ без запаха, образующийся в результате неполной реакции воздуха с топливом. Загрязнение CO происходит в основном из-за выбросов, производимых двигателями, работающими на ископаемом топливе, включая автомобили, внедорожные двигатели и транспортные средства (например, строительное оборудование и лодки). Более высокие уровни CO обычно возникают в районах с интенсивным движением транспорта. Другие источники выбросов CO включают промышленные процессы (такие как обработка металлов и химическое производство), сжигание древесины в жилых помещениях и естественные источники, такие как лесные пожары. Дровяные печи, газовые плиты, сигаретный дым, невентилируемые газовые и керосиновые обогреватели являются источниками CO внутри помещений. Самые высокие уровни CO обычно возникают в более холодные месяцы года, когда условия инверсии (когда загрязнение воздуха задерживается у земли под слой теплого воздуха) встречаются чаще.
Дровяные печи, газовые плиты, сигаретный дым, невентилируемые газовые и керосиновые обогреватели являются источниками CO внутри помещений. Самые высокие уровни CO обычно возникают в более холодные месяцы года, когда условия инверсии (когда загрязнение воздуха задерживается у земли под слой теплого воздуха) встречаются чаще.
CO может оказывать вредное воздействие на здоровье, уменьшая доставку кислорода к органам и тканям организма. Воздействие более низких уровней CO наиболее серьезно для тех, кто страдает сердечными заболеваниями, и может вызвать боль в груди, снизить способность к физическим упражнениям или — при повторяющемся воздействии — может способствовать другим сердечно-сосудистым последствиям.
Даже здоровые люди могут страдать от высокого уровня CO. У людей, которые вдыхают высокие уровни CO, могут возникнуть проблемы со зрением, снижение способности работать или учиться, снижение ловкости рук и трудности при выполнении сложных задач. При очень высоких уровнях CO ядовит и может привести к смерти.
Последнее планирование качества воздуха, соответствующее Национальным стандартам качества окружающего воздуха CO
Последнее обновление: 5 сентября 2019 г. существующие первичные стандарты CO: восьмичасовой стандарт 9 частей на миллион и часовой стандарт 35 частей на миллион. Последние придорожные мониторы были развернуты в районах Даллас-Форт-Уэрт и Хьюстон-Галвестон-Бразория в апреле 2015 года, а дополнительные мониторы были установлены в Остине и Сан-Антонио в декабре 2016 года9.0003
Переназначение СО Эль-Пасо для достижения
13 февраля 2008 г. TCEQ представила пересмотр SIP с запросом на изменение назначения области недостижения СО Эль-Пасо для достижения стандарта СО. Агентство по охране окружающей среды предложило утвердить план и соответствующий бюджет по выбросам автотранспортных средств в Федеральном реестре (73 FR 45162) 4 августа 2008 года. Это действие было опубликовано как прямое окончательное правило, а дата вступления в силу нового определения была 3 октября 2008 г. Дополнительную информацию см. в документе Эль-Пасо и План реализации штата.
Дополнительную информацию см. в документе Эль-Пасо и План реализации штата.
Связанные веб-страницы и публикации
- Общая страница EPA по угарному газу
- NAAQS для угарного газа
- Список версий Texas SIP
Получите дополнительную информацию о SIP в Техасе и свяжитесь с TCEQ
Контакты SIP TCEQ
Глобальный баланс монооксида углерода. 18 (8), 534–540.
КАС Google Scholar
Критерии качества воздуха для угарного газа: 1970 г., Публикация Национального управления по контролю за загрязнением воздуха № AP-62. Служба гигиены окружающей среды, Служба общественного здравоохранения. Министерство здравоохранения, образования и социального обеспечения США, Вашингтон, округ Колумбия, март 1970 г.
Google Scholar
Робинсон, Э. и Роббинс, Р. Э.: 1968, Источники, распространенность и судьба газообразных загрязнителей атмосферы. Проект Стэнфордского научно-исследовательского института Pr-6755. Менло-Парк, Калифорния,
Э.: 1968, Источники, распространенность и судьба газообразных загрязнителей атмосферы. Проект Стэнфордского научно-исследовательского института Pr-6755. Менло-Парк, Калифорния,
Google Scholar
Гроб, К.: 1968, «Газообразные компоненты табачного дыма», в книге «На пути к менее вредной сигарете», монография № 28. Национальный институт рака. Национальный институт рака, Бетесда, Мэриленд, с. 215.
Google Scholar
Федеральная торговая комиссия: 1969, личное сообщение.
Google Scholar
Джаффе, Л. С.: 1970, «Источники, характеристики и судьба атмосферного монооксида углерода», доклад, представленный на конференции по биологическим эффектам монооксида углерода, Нью-Йоркская академия наук, январь 1970 г.
Google Scholar
Flury, F. и Zernik, F.: 1931, Schädliche Gase, Dämpfe, Nebel, Rauch and Staubarten, Julius Springer, Berlin.
и Zernik, F.: 1931, Schädliche Gase, Dämpfe, Nebel, Rauch and Staubarten, Julius Springer, Berlin.
Google Scholar
Уайт, Дж. Дж.: 1932, «Угарный газ и его связь с самолетами», Медицина ВМС США. Бык. 30, 151.
Google Scholar
Мижотт, М.В. и Невен, Л.: 1952, «Недавний прогресс в наблюдении за солнечным спектром Юнгфрауйоха», мем. соц. Рой. Сей. Льеж 12, 165.
CAS Google Scholar
Бейтс, Д. Р. и Уизерспун, А. Э.: 1952, «Фотохимия некоторых второстепенных компонентов атмосферы Земли», Ежемесячные уведомления Рой. Астрон. соц. 112, 101–124.
КАС Google Scholar
Лейтон, Пенсильвания: 1961, «Фотохимия загрязнения воздуха, IX», в Phys. Chem., Серия монографий, Academic Press, Нью-Йорк.
Google Scholar
Альтшуллер А. П. и Буфалини Дж. Дж.: 1965, «Фотохимические аспекты загрязнения воздуха: обзор», Photochem. Фотобиол. 4, 97–146.
Перекрёстная ссылка Google Scholar
Уилкс, С.С.: 1959, «Угарный газ в зеленых растениях», Science 129, 964–966.
Перекрёстная ссылка КАС Google Scholar
Сигель, С. М., Ренвик, Г., и Розен, Л. А.: 1962, «Образование монооксида углерода во время прорастания семян и роста рассады», Science 137, 683–684.
Перекрёстная ссылка КАС Google Scholar
Лоевус, М. В. и Делвич, К. С.: 1963, «Производство монооксида углерода водорослями», Физиология растений. 38 (4), 371–374.
Перекрёстная ссылка КАС Google Scholar
Чепмен, Д. Дж. и Точер, Р. Д.: 1966, «Присутствие и образование монооксида углерода в некоторых известных водорослях», Кан. J. Ботаника 44, 1438–1442.
Дж. и Точер, Р. Д.: 1966, «Присутствие и образование монооксида углерода в некоторых известных водорослях», Кан. J. Ботаника 44, 1438–1442.
Перекрёстная ссылка Google Scholar
Вестлейк, Д. В., Роксбург, Дж. М., и Талбот, Г.: 1961, «Микробное производство монооксида углерода из флавоноидов», Nature 189, 510–511.
Перекрёстная ссылка КАС Google Scholar
Бархам, Э. Г.: 1963, «Сифонофоры и слой глубокого рассеяния», Science 140, 826–828.
Перекрёстная ссылка КАС Google Scholar
Бархам, Э. Г. и Уилтон, Дж. В.: 1964, «Производство монооксида углерода батипелагическим сифонофором», Science 144, 860–862.
Перекрёстная ссылка Google Scholar
Виттенберг, Дж. Б.: 1960, Источник угарного газа в поплавке Physalia Physalis, португальского военного корабля, J. Exp. биол. 37, 698–705.
Б.: 1960, Источник угарного газа в поплавке Physalia Physalis, португальского военного корабля, J. Exp. биол. 37, 698–705.
КАС Google Scholar
Коберн, Р.Ф., Блейкмор, В.С., и Форстер, Р.Э.: 1963, «Эндогенное производство окиси углерода в человеке», J. Clin. Инвестировать. 42, 1172–1178.
перекрестная ссылка КАС Google Scholar
Суиннертон, Дж. В., Линненбом, В. Дж., и Ламонтег, Р. А.: 1970, «Океан: естественный источник угарного газа», Science 167, 984–987.
Перекрёстная ссылка КАС Google Scholar
Дикинсон, Дж. Э.: 1961, Качество воздуха округа Лос-Анджелес. Отчет о техническом прогрессе, том. II. Район контроля загрязнения воздуха Лос-Анджелеса, Лос-Анджелес, Калифорния,
Google Scholar
Бриф, Р. С., Джонс, А. Р., и Йодер, Дж. С.: 1960, «Свинец, угарный газ и дорожное движение, корреляционное исследование», J. Air Pollution Control Assoc. 10, 384–388.
С., Джонс, А. Р., и Йодер, Дж. С.: 1960, «Свинец, угарный газ и дорожное движение, корреляционное исследование», J. Air Pollution Control Assoc. 10, 384–388.
Google Scholar
Министерство торговли: 1967, Загрязнение автомобилей и воздуха: Программа прогресса, часть I I. Подгруппа отчитывается перед комиссией по транспортным средствам с электроприводом. Технический консультативный совет по торговле. Типография правительства США, Вашингтон, округ Колумбия
Google Scholar
Департамент здравоохранения, образования и социального обеспечения: 1966 г., проекты непрерывного мониторинга воздуха. 1962-1967 годы Сводка среднемесячных и максимальных значений. Публикация Национального управления по контролю за загрязнением воздуха № APTD 69 — 1. Служба общественного здравоохранения, Арлингтон, Вирджиния,
. Google Scholar
McCormick, R.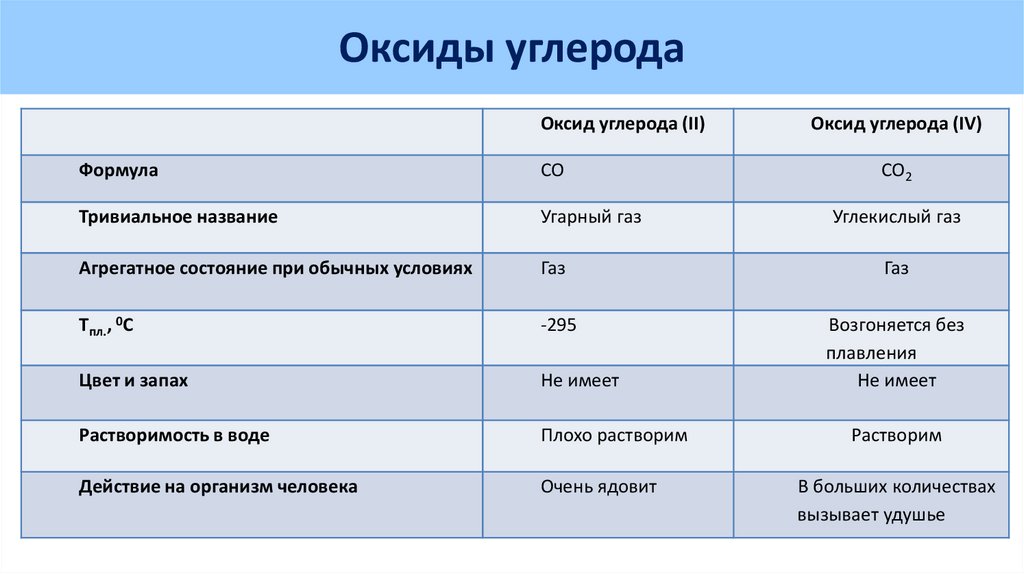 A. and Xintaras, C.: 1962, «Изменение концентраций угарного газа в зависимости от интервала отбора проб, дорожного движения и метеорологических факторов», J. Appl. метеорол. 1 (2), 237–243.
A. and Xintaras, C.: 1962, «Изменение концентраций угарного газа в зависимости от интервала отбора проб, дорожного движения и метеорологических факторов», J. Appl. метеорол. 1 (2), 237–243.
Перекрёстная ссылка Google Scholar
Лоутер, П.Дж., Комминс, Б.Т., и Хендерсон, М.: 1962, «Угарный газ в городском воздухе: промежуточный отчет», Ann. Профессиональная гигиена. 5, 241–248.
Google Scholar
Chovin, P.: 1967, «Угарный газ: анализ исследований выхлопных газов в Париже», Envir. Рез. 1, 198–216.
Перекрёстная ссылка КАС Google Scholar
Джонсон, К.Л., Дворецкий, Л.Х., и Хеллер, А.Н.: 1968, «Угарный газ и загрязнение воздуха автомобильными выбросами в Нью-Йорке», Science 160 (3823), 67–68.
Перекрёстная ссылка КАС Google Scholar
Георгий, Х. В. и Вебер, Э.: 1962, «Untersuchung der Kohlenoxyd-emission in einer Grosstadt» [Исследования выбросов окиси углерода в большом городе], междунар. J. Загрязнение воздуха водой 6, 179–195.
В. и Вебер, Э.: 1962, «Untersuchung der Kohlenoxyd-emission in einer Grosstadt» [Исследования выбросов окиси углерода в большом городе], междунар. J. Загрязнение воздуха водой 6, 179–195.
Google Scholar
Tebbens, B.D.: 1968, «Газовые загрязнители воздуха», в Air Pollution, vol. I (под редакцией AC Stern), второе издание, Academic Press, Нью-Йорк, гл. 2, стр. 31–32.
Google Scholar
Брайс, Р. М. и Рослер, Дж. Ф.: 1966, «Воздействие угарного газа на пассажиров транспортных средств, движущихся в условиях интенсивного движения», J. Air Pollution Control Assoc. 16, 597–600.
КАС Google Scholar
Линн, Д. А., Табор, Э., Отт, В., и Смит, Р.: 1967, Настоящее и будущее воздействие угарного газа на пригородных поездах. Документ № 67–5, представленный на 60-м ежегодном собрании Ассоциации по борьбе с загрязнением воздуха, Кливленд, Огайо.
Google Scholar
Ларсен, Р. И. и Берк, Х.: 1969, Воздействие угарного газа в окружающей среде. Документ 69–167, представленный на 62-м ежегодном собрании Ассоциации по борьбе с загрязнением воздуха, Нью-Йорк, 19 июня.69.
Google Scholar
Конли, С. Дж., Кенлайн, П. А., Камминс, Р. Л., и Конопински, В. Дж.: 1967, «Выхлопы автомобилей на трех выбранных участках», Arch. Окружающая среда. Здоровье 14, 429–446.
КАС Google Scholar
Уоллер, Р. Э., Комминс, Б. Т., и Лоутер, П. Дж.: 1961, «Загрязнение воздуха в дорожных туннелях», Британия. J. Ind. Med. 18, 250–259.
КАС Google Scholar
Тромпео Г., Турлетти Г. и Джарруссо О. Т.: 1964, «Концентрация CO в подземных гаражах», Расс. Мед. Инд. 33, 392–393.
Мед. Инд. 33, 392–393.
КАС Google Scholar
Фишер, Э. Р. и Маккарти, М. мл.: 1966, «Исследование реакции электронно-возбужденных молекул кислорода с окисью углерода», J. Chem. физ. 45, 781–784.
Перекрёстная ссылка Google Scholar
Grave, W.M. and Long, F.J.: 1954, «Кинетика и механизмы двух противоположных реакций равновесия: CO+h30 = CO2 + h3», J. Am. хим. соц. 76, 2602–2607.
Перекрёстная ссылка Google Scholar
The Merck Index of Chemicals and Drugs, седьмое издание, 1960 г.: окись углерода, (под редакцией П. Г. Стечера), Merck and Company, Inc., Rahway, NJ, p. 212.
Google Scholar
Гарвин, Д.: 1954, «Окисление угарного газа в присутствии озона», J. Am. хим. соц. 76, 1523–1527
Am. хим. соц. 76, 1523–1527
CrossRef КАС Google Scholar
Harteck, P. and Dondes, S.: 1957, «Реакции окиси углерода и озона», J. Phys. хим. 26, 1734–1737.
Перекрёстная ссылка КАС Google Scholar
Зациорский М., Кондратеев В., Солнишкова С.: 1940, «Излучение пламени СО + О3 и механизм этой реакции», Зн. Физ. Ким. 14, 1521–1527.
Google Scholar
Браун, Ф. Б. и Крист, Р. Х.: 1941, «Дальнейшие исследования окисления оксидов азота: скорость реакции между монооксидом углерода и диоксидом азота», J. Chem. физ. 9, 840–846.
Перекрёстная ссылка КАС Google Scholar
Penndorf, R.: 1949, Вертикальное распределение атомарного кислорода в верхних слоях атмосферы», J. Geophys. Рез. 54, 1–38.
Geophys. Рез. 54, 1–38.
Перекрёстная ссылка Google Scholar
Хеллер, А. Н. и Уолтерс, Д. Ф.: 1965, «Влияние изменения моделей использования энергии на качество воздуха в сообществе», J. Air Pollution Control Assoc. 15, 423–428.
Google Scholar
Юнге, Ц. Э.: 1963, Химия воздуха и радиоактивность, Academic Press, Нью-Йорк.
Google Scholar
Локк, Дж. Л. и Герцберг, Л.: 1953, «Поглощение монооксидом углерода в инфракрасном солнечном спектре», Кан. Дж. Физ. 31, 504–516.
Перекрёстная ссылка КАС Google Scholar
Роббинс, Р. К., Борг, К. М., и Робинсон, Э.: 1968, «Угарный газ в атмосфере» J. Air Pollution Control Assoc. 18, 106–110.
КАС Google Scholar
Кавана, Л. Э., Шадт, К. Ф., и Робинсон, Э.: 1969, «Атмосферные углеводороды и угарный газ, измеренные в Пойнт-Барроу, Аляска», Окружающая среда. Сей. Технол. 3, 251–257.
Э., Шадт, К. Ф., и Робинсон, Э.: 1969, «Атмосферные углеводороды и угарный газ, измеренные в Пойнт-Барроу, Аляска», Окружающая среда. Сей. Технол. 3, 251–257.
Перекрёстная ссылка Google Scholar
Куммлер, Р. Х., Гренда, Р. Н., Баурер, Т., Бортнер, М. Х., Дэвис, Дж. Х., и МакДауэлл, Дж.: 1969, «Спутниковое решение аномалии стока угарного газа». Документ представлен на 50-м ежегодном собрании Американского геофизического союза, Вашингтон, округ Колумбия (J. Geophys. Res., в печати).
Google Scholar
Вайншток, Б.: 1969, «Угарный газ: время пребывания в атмосфере», Science 166, 224–225.
Google Scholar
Хааген-Смит, А. Дж. и Уэйн, Л. Г.: 1968, «Атмосферные реакции и процессы очистки», глава 6, в Air Pollution, vol. I (под редакцией А. К. Стерна), 2-е издание, Academic Press, Нью-Йорк, с. 181.
К. Стерна), 2-е издание, Academic Press, Нью-Йорк, с. 181.
Google Scholar
Хартек, П. и Ривз, Р. Р., мл.: 1967, Некоторые специфические фотохимические реакции в атмосфере». Доклад № 20. Доклад на симпозиуме по химии природной атмосферы. Американское химическое общество. 154-е ежегодное собрание. Чикаго, 111.
Google Scholar
Schnellen, CG: 1947, Onderzoekingen over de metaangisting, докторская диссертация, Technische Wetenschap, Делфт, Роттердам (Нидерланды).
Google Scholar
Стивенсон, М.: 1949, Бактериальный метаболизм, третье издание, Longmans, Green and Company, Нью-Йорк.
Google Scholar
Kaserer, H.: 1906, ‘Die Oxydation des Wasserstoffes durch Microorganismen’, Zentr. Бактериол., Параситенк., Абт. 11 (16), 681–696.
Бактериол., Параситенк., Абт. 11 (16), 681–696.
Google Scholar
Рабинович, Э. И.: 1945, Фотосинтез и родственные процессы, Interscience Publishers, Нью-Йорк.
Google Scholar
Waksman, S.A.: 1929, Принципы почвенной микробиологии, Williams and Wilkins Company, Балтимор.
Google Scholar
Дюсет Г. и Розенберг А. Дж.: 1962, «Дыхание листьев», Ann. Преп. Завод Физиол 13, 171–200.
Перекрёстная ссылка КАС Google Scholar
Burris, R.H.: 1966, «Биологическая фиксация азота», Ann. Преподобный Завод Физиол. 17, 155–184.
Перекрёстная ссылка КАС Google Scholar
Карр, Д. Дж.: 1961, «Химическое влияние окружающей среды», в энцикл. Завод Физиол. 16, 773–775.
Дж.: 1961, «Химическое влияние окружающей среды», в энцикл. Завод Физиол. 16, 773–775.
Google Scholar
Тобиас, К. А., Лоуренс, Дж. Х., Роутон, Ф. Дж. В., Рут, В. С., и Грегерсон, М. И.: 1945, «Выведение окиси углерода из организма человека с возможным превращением CO в CO2», Am. Дж. Физиол. 145, 253–263.
КАС Google Scholar
Дуглас, Э.: 1967, «Растворимость монооксида углерода в морской воде», J. Phys. хим. 71, 1931–1933.
Перекрёстная ссылка КАС Google Scholar
Суиннертон, Дж. В., Линненбом, В. Дж., и Чик, К. Х.: 1969 г., «Распределение метана и угарного газа между атмосферой и природными водами», Environ. Сей. Технол. 3 (9), 836–838.
Перекрёстная ссылка КАС Google Scholar
Скирроу, Г. : 1965, «Растворенные газы — углекислый газ», в Химической океанографии, том. I (под редакцией Дж. П. Райли и Г. Скирроу), Academic Press, Нью-Йорк, стр. 312–317, гл. 7.
: 1965, «Растворенные газы — углекислый газ», в Химической океанографии, том. I (под редакцией Дж. П. Райли и Г. Скирроу), Academic Press, Нью-Йорк, стр. 312–317, гл. 7.
Google Scholar
Мэдли, Д. Г. и Стрикленд-Констебл, Р. Ф.: 1953, «Кинетика окисления древесного угля закисью азота», Trans. Фарадей Сок. 49, 1312–1324.
Перекрёстная ссылка КАС Google Scholar
Смит, Р. Н. и Муи, Дж.: 1955, «Каталитическое окисление монооксида углерода закисью азота на углеродных поверхностях», J. Phys. хим. 59, 814–819.
Перекрёстная ссылка Google Scholar
Strickland-Constable, RF: 1938, «Роль поверхностных оксидов в окислении углерода», Trans. Фарадей Сок. 34, 1074–1080.
Перекрёстная ссылка КАС Google Scholar
Krouse, A. : 1961, «Механизм каталитического окисления CO с помощью N2O», Bull. акад. Полон. сей., сер. Сей. хим. 9, 5.
: 1961, «Механизм каталитического окисления CO с помощью N2O», Bull. акад. Полон. сей., сер. Сей. хим. 9, 5.
Google Scholar
Гарднер Р. А. и Петруччи Р. Х.: 1960, «Хемосорбция монооксида углерода на металлах», J. Am. хим. соц. 82, 5051–5053.
Перекрёстная ссылка КАС Google Scholar
Для дальнейшего чтения
A. C. Stern (ed.), Air Pollution, Second Edition, Vols. I и II, Academic Press, Нью-Йорк, 1968.
Google Scholar
Очистка окружающей среды: химическая основа действий, 1969. Отчет Подкомитета по улучшению окружающей среды. Комитет по химии и связям с общественностью, Американское химическое общество, Вашингтон, округ Колумбия
Google Scholar


 Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3. Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути.
Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.