Синтетические базисные противовоспалительные препараты в эпоху биологической терапии ревматоидного артрита | Каратеев Д.Е., Лучихина Е.Л.
Для лечения ревматоидного артрита (РА), тяжелого аутоиммунного ревматического заболевания, характеризующегося персистирующим синовитом и системными воспалительными реакциями, применяется несколько основных групп медикаментозных средств: нестероидные противовоспалительные препараты (НПВП), базисные противовоспалительные препараты (БПВП), генно–инженерные биологические препараты (ГИБП), глюкокортикоиды (ГК). Каждая из этих групп играет соответствующую роль при разработке тактики и стратегии ведения больного.
БПВП (известны также как «базисные препараты», или «медленно действующие противовоспалительные препараты», или «болезнь–модифицирующие препараты» (disease–modifying anti–rheumatic drugs (DMARDs)) являются одним из наиболее длительно применяющихся классов противовоспалительных препаратов для лечения РА. Так, соли золота используются при РА с 1930–х гг. [1,2]. Главной характеристикой, отличающей БПВП от, например, НПВП, является их способность не только уменьшать выраженность симптомов воспаления, но и предотвращать деструкцию хрящевой и костной ткани, что выражается в торможении прогрессирования таких рентгенологических проявлений, как сужение суставных щелей и костные эрозии. По этому признаку к БПВП должны быть отнесены как синтетические препараты (метотрексат (МТ), лефлуномид (ЛЕФ) и сульфасалазин (ССЗ)), так и ГИБП; длительное время идут дискуссии вокруг «базисных» свойств ГК. Все же в настоящее время под термином БПВП обычно подразумевают традиционные синтетические базисные противовоспалительные препараты.
[1,2]. Главной характеристикой, отличающей БПВП от, например, НПВП, является их способность не только уменьшать выраженность симптомов воспаления, но и предотвращать деструкцию хрящевой и костной ткани, что выражается в торможении прогрессирования таких рентгенологических проявлений, как сужение суставных щелей и костные эрозии. По этому признаку к БПВП должны быть отнесены как синтетические препараты (метотрексат (МТ), лефлуномид (ЛЕФ) и сульфасалазин (ССЗ)), так и ГИБП; длительное время идут дискуссии вокруг «базисных» свойств ГК. Все же в настоящее время под термином БПВП обычно подразумевают традиционные синтетические базисные противовоспалительные препараты.
Оптимизация терапии БПВП и внедрение ГИБП, начиная с ингибиторов фактора некроза опухоли (ФНО), а затем и препаратов для других терапевтических целей, существенно изменили подходы к терапии РА, включая изменение стратегии (ранняя агрессивная терапия) и целей лечения (достижение клинической ремиссии) [3,4].
 При этом важным моментом становятся взаимоотношения терапии БПВП и ГИБП.
При этом важным моментом становятся взаимоотношения терапии БПВП и ГИБП. Традиционно ГИБП используются у больных с недостаточной эффективностью МТ, лефлуномида (ЛЕФ) или других БПВП. В то же время наблюдается отчетливая тенденция к лечению ранней стадии заболевания этими препаратами в целях улучшения клинической эффективности и предотвращения структурных повреждений. Это обосновано многими исследованиями при раннем РА, которые показали обнадеживающие результаты [5–7]. Доказано, что комбинация ГИБП+МТ и ГИБП+ЛЕФ превосходит монотерапию базисными препаратами по эффективности в отношении ответа на терапию, активности болезни, функциональных нарушений, качества жизни и снижения темпов рентгенологического прогрессирования, при удовлетворительном профиле безопасности и быстром снижении выраженности симптоматики. Ряд исследователей подтверждают большую эффективность сочетания ГИБП+ЛЕФ, в частности, ритуксимаб + ЛЕФ [49]. Все эти факты свидетельствуют о том, что раннее лечение ГИБП дает лучшие результаты.
Тем не менее большинство клинических рекомендаций, включая рекомендации Европейской лиги против ревматизма (EULAR) и российские клинические рекомендации [8,9], предусматривают, что у пациентов с умеренным и тяжелым РА должен быть зафиксирован факт неудачи лечения с применением одного или более традиционных БПВП, в монотерапии или в комбинации до начала биологической терапии.
Для этого есть свои основания. Активная терапия синтетическими БПВП на очень ранней стадии РА, а также стратегия, основанная на «жестком контроле» состояния больного, позволяют получить результаты, сопоставимые с таковыми при терапии комбинацией БПВП и ГИБП [10,11]. Далеко не все пациенты достигают существенного (на уровне ACR50 [9,12]) улучшения на фоне терапии комбинацией ГИБП и МТ, при этом ее эффективность в клинической практике ниже, чем в рандомизированных клинических исследованиях [13]. При лечении большинством ГИБП (в первую очередь моноклональными антителами) наблюдается развитие вторичной резистентности в основном за счет выработки антител к препарату [14,15], существует озабоченность по поводу долгосрочной безопасности, в основном из–за риска серьезных инфекций и злокачественных новообразований.
 Наконец, стоимость биологических препаратов в качестве первой линии лечения, вероятно, является основным лимитирующим фактором [16].
Наконец, стоимость биологических препаратов в качестве первой линии лечения, вероятно, является основным лимитирующим фактором [16].В пользу раннего назначения комбинации БПВП и ГИБП также имеется несколько дополнительных аргументов. Лечение РА, направленное на контроль активности заболевания, должно как можно скорее привести к его ремиссии. БПВП могут быть достаточно эффективны у определенных групп пациентов, но клиническое действие этих препаратов по сравнению с действием ингибиторов ФНО развивается (до полного лечебного эффекта) медленно – от нескольких недель до 3–6 мес. [17]. Применение ГИБП, кроме этого, позволяет сократить потребность в назначении ГК, что может быть важно. Многие пациенты не отвечают на синтетические БПВП в течение этого времени, может также наблюдаться феномен «ускользания эффекта», а в некоторых случаях, несмотря на хороший клинический ответ, может продолжаться рентгенологическое прогрессирование [18,19]. Эти факты являются причиной того, что клинические рекомендации EULAR [8] допускают назначение комбинированной терапии БПВП+ГИБП в качестве первой схемы лечения при наличии факторов неблагоприятного прогноза.

Таким образом, хотя в большинстве клинических рекомендаций говорится о необходимости назначения ГИБП после установленного факта недостаточной эффективности синтетических БПВП, оптимальные методы комбинированной терапии БПВП и ГИБП являются предметом обсуждения, поскольку имеется множество аргументов «за» и «против» (рис. 1). Скорее всего, путь к оптимизации в данном случае лежит через персонификацию назначения путем разработки методов для оценки прогноза заболевания и ответа на терапию.
Монотерапия или комбинация?
Нет определенности по вопросу о комбинированной терапии синтетическими БПВП, которая активно развивалась в конце «добиологической эры» (1990–е гг.) [20]. Ряд исследований показал, что комбинации синтетических БПВП более эффективны, чем монотерапия БПВП, особенно при раннем РА. Наибольшее распространение получила так называемая «тройная терапия» (комбинация МТ + ССЗ + гидроксихлорохин). В 2–летнем исследовании у 180 больных РА «тройная терапия» была значительно эффективнее, чем «двойная» (комбинация 2 препаратов) или монотерапия [21].
 Финские ревматологи [22] продемонстрировали, что при раннем РА «тройная терапия» имела преимущества перед монотерапией БПВП при краткосрочном и долгосрочном наблюдении. В известном стратегическом исследовании BeST было, в частности, показано, что при недостаточном ответе на монотерапию МТ переход на «тройную терапию» может быть довольно эффективен [23].
Финские ревматологи [22] продемонстрировали, что при раннем РА «тройная терапия» имела преимущества перед монотерапией БПВП при краткосрочном и долгосрочном наблюдении. В известном стратегическом исследовании BeST было, в частности, показано, что при недостаточном ответе на монотерапию МТ переход на «тройную терапию» может быть довольно эффективен [23]. Другие комбинации, такие как МТ + ЛЕФ, могут быть эффективны, но ассоциированы с определенным возрастанием числа случаев лекарственной токсичности.
 В целом в рекомендациях EULAR [8] признается нецелесообразность применения комбинированных схем в качестве терапии первого ряда.
В целом в рекомендациях EULAR [8] признается нецелесообразность применения комбинированных схем в качестве терапии первого ряда.Метотрексат, лефлуномид
и другие БПВП
С 1980–х гг., когда были проведены первые рандомизированные исследования МТ, этот препарат стал наиболее хорошо изученным и популярным среди БПВП [26]. К моменту внедрения МТ в лечение РА базисная терапия достаточно широко применялась, и МТ постепенно заменил препараты золота, поскольку действовал быстрее и лучше переносился [27]. С тех пор МТ считается «якорным» препаратом среди синтетических БПВП. Было продемонстрировано, что МТ способен снижать активность заболевания так же, как и ингибиторы ФНО в монотерапии, но в меньшей степени подавляет рентгенологическое прогрессирование [28].
Резистентность к МТ представляет собой серьезную проблему. Если ставить перед собой такие задачи, как достижение стойко низкой активности или клинической ремиссии, то недостаточная эффективность либо непереносимость МТ может встречаться в 40–50% случаев.

Подкожное введение МТ также способствует повышению его эффективности, так как существенно повышает биодоступность препарата. У пациентов с недостаточным ответом на МТ per os переход на подкожный путь введения привел к значительному улучшению результатов в исследовании Braun и соавт. (2008) [29]. Правильный подбор дозы МТ способствует повышению краткосрочной и долгосрочной эффективности лечения. Для достижения наилучшего и более быстрого результата с наименьшим количеством побочных эффектов (на основе систематического обзора литературы и мнения экспертов) рекомендуется начинать терапию сразу с относительно высокой дозы (20–25 мг/нед.) или с 7,5–10 мг/нед.
 с быстрой эскалацией дозы по 2,5 мг/нед. до 20–25 мг/нед. с переходом на подкожное введение в случае недостаточного ответа [30].
с быстрой эскалацией дозы по 2,5 мг/нед. до 20–25 мг/нед. с переходом на подкожное введение в случае недостаточного ответа [30].Роль других традиционных БПВП остается значительной. В первую очередь это касается лефлуномида (ЛЕФ), обладающего высокой клинической эффективностью, не уступающей таковой у МТ [31,32]. ЛЕФ клинически эффективен как при назначении в начале курса нагрузочной дозы 100 мг в течение 3 дней, так и при использовании постоянной дозировки 20 мг в течение всего курса лечения [50].
Крупные метаанализы опубликованных материалов [33,34] показали, что ЛЕФ может превосходить ССЗ по выраженности клинического ответа, в некоторых случаях опережает МТ по влиянию на показатели качества жизни и в равной степени тормозит развитие эрозивного процесса в суставах при сопоставимой или, в некоторых случаях, лучшей переносимости и безопасности. Как уже упоминалось, препарат может эффективно применяться в комбинации с МТ (с определенными предосторожностями в отношении безопасности) [35,36].

Данные рандомизированных контролируемых исследований, сравнивавших ЛЕФ с другими наиболее часто применяющимися синтетическими БПВП (МТ и ССЗ), представлены в таблице 1.
Крупное американское исследование ULTRA включало 482 пациента с развернутой стадией РА [37,38]. Доля пациентов, ответивших на лечение (в соответствии с критериями ACR20 [8,12]), через 12 мес. была выше при применении ЛЕФ, чем при применении МТ (52 и 46% соответственно), но различие статистически не значимо. Соотношение ответа по критериям ACR50 и ACR70 также не различалось. В группе ЛЕФ наблюдалось менее выраженное прогрессирование заболевания по индексу Sharp, чем в группе, в которой применялся МТ. Через 2 года также отмечалось увеличение числа пациентов, отвечающих критериям ACR20, при лечении ЛЕФ по сравнению с группой терапии МТ (79 против 67%; р=0,049). Оценка прогрессирования по Sharp через 2 года достоверно не различалась.
В другом исследовании (в течение 12 мес. с пролонгацией на второй год), сравнивавшем ЛЕФ с МТ, участвовали 999 пациентов [39].
 Через 12 мес. доля пациентов (отвечавших критериям ACR20), применявших ЛЕФ, была ниже, чем доля пациентов, применявших МТ (50,5 против 64,8% соответственно; p<0,001), но эти различия не были достоверными при продолжении наблюдения в течение 2 лет (64,3 против 71,7%; р>0,05). Рентгенологические результаты через 12 и 24 мес. оценивались по методу Ларсена и были статистически эквивалентными (практически отсутствие прогрессирования в обеих группах).
Через 12 мес. доля пациентов (отвечавших критериям ACR20), применявших ЛЕФ, была ниже, чем доля пациентов, применявших МТ (50,5 против 64,8% соответственно; p<0,001), но эти различия не были достоверными при продолжении наблюдения в течение 2 лет (64,3 против 71,7%; р>0,05). Рентгенологические результаты через 12 и 24 мес. оценивались по методу Ларсена и были статистически эквивалентными (практически отсутствие прогрессирования в обеих группах). Международное 24–недельное двойное слепое рандомизированное контролируемое исследование, сравнивавшее лечение ЛЕФ 20 мг/сут. и ССЗ 2 г/сут. [40–42], показало отсутствие различий клинического ответа и прогрессирования в течение рандомизированного периода и через 1 год наблюдения. Через 2 года число больных, сохранивших ответ на лечение по критериям ACR20, было значительно больше при применении ЛЕФ, чем при применении ССЗ (82 против 60% соответственно; р=0,0085).
Н.В. Чичасова и соавт. [43] в своем открытом исследовании выявили чрезвычайно высокий процент (94%) больных РА, ответивших на лечение ЛЕФ.
 Ю.А. Олюнин [44] в открытом исследовании зафиксировал высокую скорость наступления клинического эффекта при терапии ЛЕФ (улучшение достигалось уже через 4 нед.) и его стойкость. И.Б. Беляева [45] в открытом сравнительном исследовании показала, что терапия ЛЕФ была ассоциирована с минимальным рентгенологическим прогрессированием (по сравнению с ССЗ) и минимальной частотой отмен препарата (по сравнению с ССЗ и МТ). Наше исследование [46] показало, что при очень раннем РА ЛЕФ позволяет добиться очень быстрого и выраженного клинического эффекта, включая достижение клинической ремиссии в более чем 40% случаев. Высокая эффективность ЛЕФ при раннем РА, лишь немного уступающая эффективности комбинации МТ и ГК, была подтверждена в другом нашем исследовании [47].
Ю.А. Олюнин [44] в открытом исследовании зафиксировал высокую скорость наступления клинического эффекта при терапии ЛЕФ (улучшение достигалось уже через 4 нед.) и его стойкость. И.Б. Беляева [45] в открытом сравнительном исследовании показала, что терапия ЛЕФ была ассоциирована с минимальным рентгенологическим прогрессированием (по сравнению с ССЗ) и минимальной частотой отмен препарата (по сравнению с ССЗ и МТ). Наше исследование [46] показало, что при очень раннем РА ЛЕФ позволяет добиться очень быстрого и выраженного клинического эффекта, включая достижение клинической ремиссии в более чем 40% случаев. Высокая эффективность ЛЕФ при раннем РА, лишь немного уступающая эффективности комбинации МТ и ГК, была подтверждена в другом нашем исследовании [47].Возможность терапии, помимо МТ, также ЛЕФ, который обладает определенными достоинствами и применение которого у некоторых групп больных может быть предпочтительным, имеет большое значение для ревматологической практики. Следует отметить, что, согласно клиническим рекомендациям Американской коллегии ревматологии (ACR, 2012), ЛЕФ может рассматриваться среди препаратов первого ряда лечения РА вместе с МТ [48].
 Таким образом, имеются значительные возможности для оптимизации и получения впечатляющих результатов лечения с помощью терапии синтетическими БПВП даже без применения ГИБП.
Таким образом, имеются значительные возможности для оптимизации и получения впечатляющих результатов лечения с помощью терапии синтетическими БПВП даже без применения ГИБП.Литература
1. Forestier J. Rheumatoid arthritis and its treatment by gold salts // J Lab Clin Med. 1935. Vol. 20. Р. 827.
2. Hartfall S.J., Garland H.G., Goldie W. Gold treatment of arthritis: A review of 900 cases // Lancet. 1937. Vol. 233. Р. 838.
3. Насонов Е.Л. Лечение ревматоидного артрита: современное состояние проблемы // РМЖ. 2006. № 8. С. 573–577.
4. Каратеев Д.Е., Лучихина Е.Л. Современные принципы лечения ревматоидного артрита: акцент на раннюю агрессивную терапию // Эффект. фармакотер. ревматол. травматол. ортопед. 2011. № 1. С. 12–17.
5. St Clair, E.W., van der Heijde D.M., Smolen J.S. et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: A randomized, con– trolled trial // Arthritis Rheum. 2004. Vol. 50. Р. 3432–3443.
50. Р. 3432–3443.
6. Emery P., Breedveld F.C., Hall S. et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): A rando– mised, double–blind, parallel treatment trial // Lancet. 2008. Vol. 372. Р. 375–382.
7. Breedveld F.C., Weisman M.H., Kavanaugh A.F. et al. The PREMIER study: A multicenter, ran– domized, double–blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment // Arthritis Rheum. 2006. Vol. 54. Р. 26–37.
8. Smolen J., Landewé R., Breedveld F. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease–modifying antirheumatic drugs // Ann. Rheum. Dis. 2010. Vol. 69. Р. 964–975.
9. Клинические рекомендации. Ревматология / Под ред.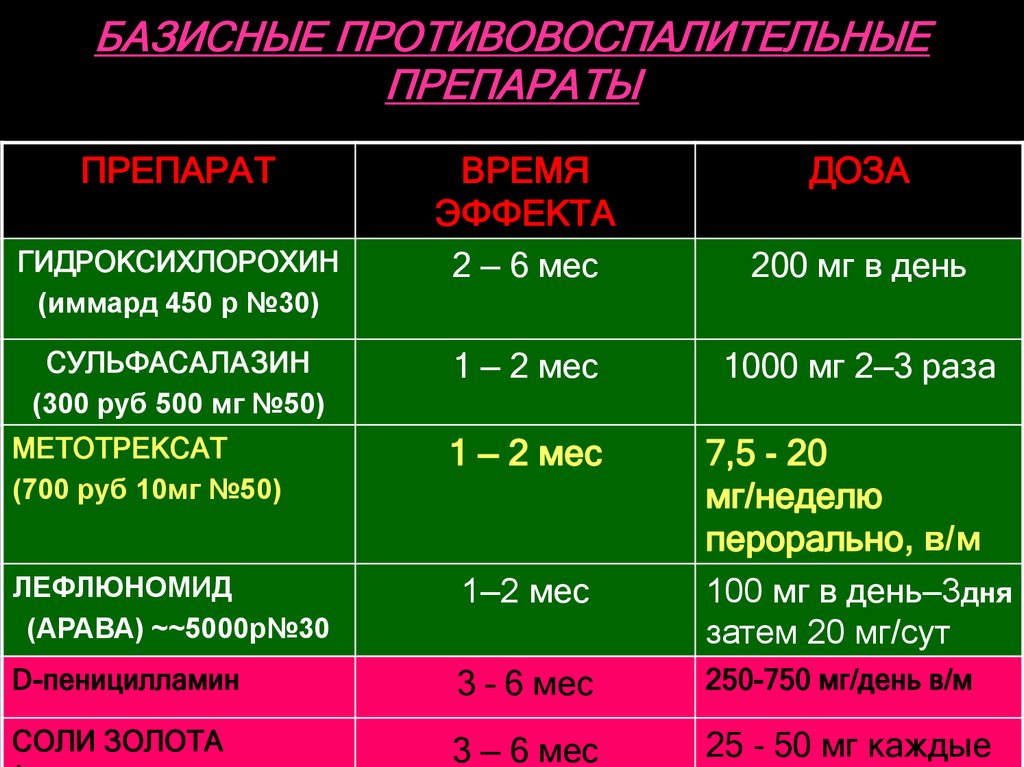 Е.Л. Насонова. М.: ГЭОТАР–Медиа, 2010.
Е.Л. Насонова. М.: ГЭОТАР–Медиа, 2010.
10. Mottonen T., Hannonen P., Korpela M. et al. Delay to institution of therapy and induction of remission using single–drug or combination–disease–modifying anti–rheumatic drug therapy in early rheumatoid arthritis // Arthritis Rheum. 2002. Vol. 46. Р. 894–898.
11. Grigor C., Capell H., Stirling A. et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single–blind ran– domised controlled trial // Lancet. 2004. Vol. 364 (9430). Р. 263–269.
12. Ревматология: национальное руководство / Под ред. Е.Л. Насонова М.: ГЭОТАР–Медиа, 2008. 720 с.
13. Pincus T., Yazici Y., van Vollenhoven R. Why are only 50% of courses of anti–tumor necrosis factor agents continued for only 2 years in some set– tings? Need for longterm observations in standard care to complement clinical trials // J Rheumatol. 2006. Vol. 33. Р. 2372–2375.
14. Wolbink G.J., Aarden L.A., Dijkmans B. A. Dealing with immunogenicity of biologicals: Assessment and clinical relevance // Curr Opin Rheumatol. 2009. Vol. 21. Р. 211–215.
A. Dealing with immunogenicity of biologicals: Assessment and clinical relevance // Curr Opin Rheumatol. 2009. Vol. 21. Р. 211–215.
15. Каратеев Д.Е. Вопросы иммуногенности биологических препаратов: теория и практика // Совр. ревматология. 2009. № 1. С. 67–72.
16. Boers M. Cost–effectiveness of biologics as first–line treatment of rheumatoid arthritis: Case closed? // Ann. Intern. Med. 2009. Vol. 151. Р. 668–669.
17. Feely M.G., O’Dell J.R. Update on the use of conventional disease–modifying antirheumatic drugs in the management of rheumatoid arthritis // Curr. Opin. Rheumatol. 2010. Vol. 22. Р. 316–320.
18. Molenaar E.T., Voskuyl A.E., Dinant H.J. et al. Progression of radiologic damage in patients with rheumatoid arthritis in clinical remission // Arthritis Rheum. 2004. Vol. 50. Р. 36–42.
19. Brown A.K., Conaghan P.G., Karim Z. et al. An explanation for the apparent dissociation between clinical remission and continued structural deterioration in rheumatoid arthritis // Arthritis Rheum. 2008. Vol. 58. Р. 2958–2967.
2008. Vol. 58. Р. 2958–2967.
20. Каратеев Д.Е. Фармакотерапия раннего ревматоидного артрита // Фарматека. 2006. № 6. С. 92–97.
21. Calguneri M., Pay S., Caliskaner Z. et al. Combination therapy versus monotherapy for the treatment of patients with rheumatoid arthritis // Clin. Exp. Rheumatol. 1999. Vol. 17. Р. 699–704.
22. Rantalaiho V., Korpela M., Hannonen P. et al. The good initial response to therapy with a combination of traditional disease–modifying antirheumatic drugs is sustained over time: The eleven–year results of the Finnish rheumatoid arthritis combination therapy trial // Arthritis Rheum. 2009. Vol. 60. Р. 1222–1231.
23. Van der Kooij S.M., de Vries–Bouwstra J.K., Goekoop–Ruiterman Y.P., van Zeben D., Kerstens P.J., Gerards A.H. et al. Limited efficacy of conventional DMARDs after initial methotrexate fail– ure in patients with recent onset rheumatoid arthritis treated according to the disease activity score // Ann Rheum Dis. 2007. Vol. 66. Р. 1356–1362.
66. Р. 1356–1362.
24. Moreland L.W., O’Dell J.R., Paulus H.E. et al. A randomized comparative effectiveness study of oral triple therapy versus etanercept plus methotrexate in early aggressive rheumatoid arthritis: the treatment of early aggressive rheumatoid arthritis trial // Arthritis Rheum. 2012. Vol. 64. Р. 2824–2835.
25. Van Vollenhoven R.F., Ernestam S., Geborek P. et al. Addition of infliximab compared with addition of sulfasalazine and hydroxychloroquine to methotrexate in patients with early rheumatoid arthritis (Swefot trial): 1–year results of a randomised trial // Lancet. 2009. Vol. 374 (9688). Р. 459–466.
26. Coury F.F., Weinblatt M.E. Clinical trials to establish methotrexate as a therapy for rheumatoid arthritis // Clin. Exp. Rheumatol. 2010. Vol. 28 (5 Suppl 61). Р. 9–12.
27. Benedek T.G. Methotrexate: from its introduction to non–oncologic therapeutics to anti–TNF–α // Clin Exp Rheumatol. 2010 Sep–Oct. Vol. 28 (5 Suppl 61). Р. 3–8.
28. Braun J., Rau R. An update on methotrexate // Curr Opin Rheumatol. 2009. Vol. 21. Р. 216–223.
29. Braun J., Kastner P., Flaxenberg P. et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis: Results of a six–month, multi– center, randomized, double–blind, controlled, phase IV trial // Arthritis Rheum. 2008. Vol. 58. Р. 73–81.
30. Visser K., Katchamart W., Loza E. et al. Multinational evidence–based recommendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis: Integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E Initiative // Ann. Rheum. Dis. 2009. Vol. 68. Р. 1086–1093.
31. Strand V., Cohen S., Schiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch. Int. Med. 1999. Vol. 159. Р. 2542–2550.
159. Р. 2542–2550.
32. Иголкина Е.В., Чичасова Н.В. Возможности лефлуномида в лечении ревматоидного артрита // РМЖ. 2007. № 15. С. 664–669.
33. Osiri M., Shea B., Robinson V. et al. Leflunomide for treating rheumatoid arthritis // Cochrane Database Syst Rev. 2003 (1):CD002047.
34. Donahue K.E., Gartlehner G., Jonas D.E. et al. Systematic Review: Comparative Effectiveness and Harms of Disease–Modifying Medications for Rheumatoid Arthritis // Ann Intern Med. 2008. Vol. 148. Р. 124–134.
35. Maddison Р., Kiely Р., Kirkham B. et al. Leflunomide in rheumatoid arthritis: recommendations through a process of consensus // Rheumatology. 2005. Vol. 44. Р. 280–286.
36. Каратеев Д.Е., Насонов Е.Л., Чичасова Н.В. Новые возможности применения лефлуномида при ревматоидном артрите – ранняя и комбинированная терапия // РМЖ. 2005. № 3. С. 1573–1576.
37. Strand V., Cohen S., Schiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch. Intern. Med. 1999. Vol. 159. Р. 2542–2550.
Intern. Med. 1999. Vol. 159. Р. 2542–2550.
38. Sharp J.T., Strand V., Leung H. et al. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis: results from three randomized controlled trials of leflunomide in patients with active rheumatoid arthritis // Arthritis Rheum. 2000. Vol. 43. Р. 495–505.
39. Emery P., Breedveld F.C., Lemmel E.M. et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology (Oxford). 2000. Vol. 39. Р. 655–665.
40. Smolen J.S., Kalden J.R., Scott D.L. et al. Efficacy and safety of leflunomide
compared with placebo and sulphasalazine in active rheumatoid arthritis: a double– blind, randomised, multicentre trial // Lancet. 1999. Vol. 353 (9149). Р. 259–266.
41. Smolen J.S. Efficacy and safety of the new DMARD leflunomide: comparison to placebo and sulfasalazine in active rheumatoid arthritis // Scand J Rheumatol. 1999. Vol. 112 (Suppl.). Р. 15–21.
112 (Suppl.). Р. 15–21.
42. Larsen A., Kvien T.K., Schattenkirchner M. et al. Slowing of disease progression in rheumatoid arthritis patients during longterm treatment with leflunomide or sulfasalazine // Scand J Rheumatol. 2001. Vol. 30. Р. 135–142.
43. Чичасова Н.В., Бродецкая К.А., Иголкина Е.В. Опыт длительного применения лефлуномида у больных активным ревматоидным артритом // РМЖ. 2005. № 13. С. 518–524.
44. Олюнин Ю.А. Базисное лечение лефлуномидом при ревматоидном артрите // Тер. архив. 2004. № 10. С. 80–84.
45. Мазуров В.И., Беляева И.Б. Сравнительная оценка лечебного эффекта сульфасалазина, метотрексата и лефлуномида при раннем ревматоидном артрите // Вестн. СПб. гос. мед. акад. 2006. № 3. С. 129–132.
46. Каратеев Д.Е. Лефлуномид в современной патогенетической терапии раннего ревматоидного артрита // РМЖ. 2007. № 15 (26). С. 2042–2046.
47. Федоренко Е.В., Сигидин Я.А., Каратеев Д.Е., Лучихина Е.Л., Насонов Е.Л. Сравнительная эффективность современных методов терапии раннего ревматоидного артрита (предварительные результаты) // Научно–практ. ревматол. 2008. № 4. С. 36–40.
ревматол. 2008. № 4. С. 36–40.
48. Singh J.A., Furst D.E., Bharat A. et al. 2012 Update of the 2008 American College of Rheumatology Recommendations for the Use of Disease–Modifying Antirheumatic Drugs and Biologic Agents in the Treatment of Rheumatoid Arthritis // Arthritis Care & Research. 2012. Vol. 64. Р. 625–639.
49. Chatzidionysiou K. et al. Effectiveness of disease–modifying antirheumatic drug co-therapy with methotrexate and leflunomide in rituximab–treated rheumatoid arthritis patients: results of a 1–year follow–up study from the CERERRA collaboration. // Ann Rheum Dis. 2012 Mar; Vol. 71(3) P. 374–7. Epub 2011 Oct 4.
50. Балабанова Р.М. Эффективность и безопасность препарата лефлуномида (Арава) при ревматических заболеваниях. // РМЖ. 2010. №11.
Базисная терапия ревматоидного артрита
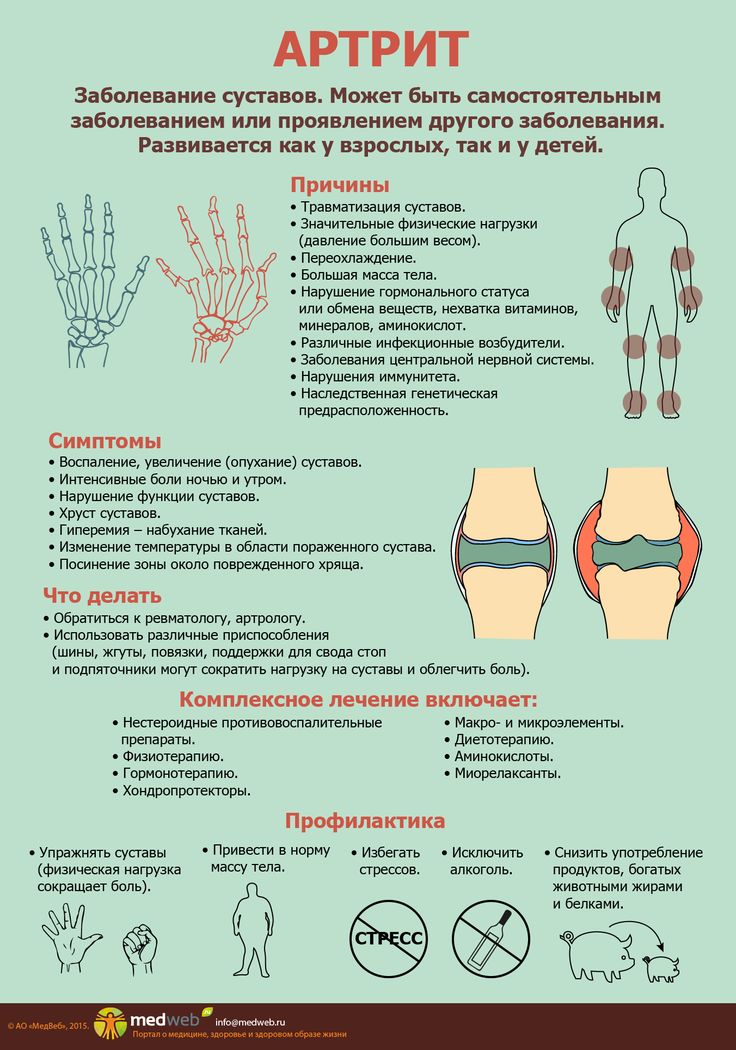
Базисная терапия системных заболеваний соединительной тканиГлавным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Метотрексат (методжект) Считается «золотым стандартом» лечения ревматоидного и псориатического артрита, всвязи с его высокой эффективностью, хорошей переносмостью и удобством приема Для базисного лечения ревматоидного артрита метотрексат принимают только 1 раз в неделю. В первый раз выбирают конкретный день недели и с этих пор на протяжении всего курса лечения, метотрексат принимают только в этот день . Доза подбирается постепенно, в зависимости от активности процесса и переносимости препарата Терапевтический эффект обычно проявляется через 2-6 недель от начала приема и достигает максимума обычно за полгода, год. В день приема метотрексата желательно обойтись без употребления НПВП.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд (инфликсимаб) — быстродействующий и довольно эффективный базисный препарат. Его применяют в тех случаях, когда другие базисные препараты не дают должного эффекта.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения. Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
При очень длительном применении делагил и плаквенил способны влиять на активность ревматоидного процесса. К сожалению, со временем выяснилось, что эти препараты действуют медленно: лечебный эффект развивается спустя полгода — год непрерывного приема лекарства. Эффект незначитеьный по сравнению с другими базисными препаратами. Назначаются обычно при небольшой активности аутоимунного процесса при артритах, а также в при системной красной волчанке, васкулитах. Достоинством является хорошая переносимость и малое количество побочных эффектов.
3. Сульфаниламиды.
Сульфасалазин (салазопирин EN-Табс) — антимикробные препараты, успешно применяемые в базисном лечении недифференцированных артритов , анкилозирующего спондиллита, ревматоидного артрита.
По силе лечебного действия сульфаниламиды совсем немного уступают цитостатикам, вполне сопоставимы по эффективности с метотрексатом и пеницилламином, и явно превосходят по силе действия делагил и плаквенил. Главным преимуществом сульфаниламидов является их хорошая переносимость — при длительном приеме побочные эффекты развиваются только у 10-20% больных. Однако, для достижения лечебного эффекта данной группой препаратов, необходим весьма длительный промежуток времени – около 3-х месяцев, а «пик формы» достигается спустя 6-12 месяцев от начала лечения.
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Клинический эффект Купренила при ССД проявляется в первую очередь положительной динамикой кожных поражений — уменьшением плотного отека, индурации и пигментации кожи. Снижается выраженность синдрома Рейно, уменьшаются или исчезают артралгии и миалгии. Отмечается также положительная динамика висцеральных проявлений заболевания .
Однако, следует учитывать, что пеницилламин является довольно токсичным препаратом, который значительно чаще вызывает осложнения — при его применении побочные реакции возникают в 30-40% случаев.
Лечение ревматоидного артрита — Больница Brigham and Women’s Hospital
Ревматоидный артрит — это аутоиммунное заболевание, при котором определенные клетки иммунной системы дают сбой и атакуют здоровые суставы. Поражающий 1,3 миллиона американцев, это наиболее распространенный вид хронического артрита, вызванный иммунной системой.
Симптомы варьируют от боли и скованности в суставах до лихорадки, потери аппетита и образования узелков, которые растут под кожей возле суставов. Хотя лекарства нет, ранняя диагностика и эффективное лечение ревматоидного артрита могут помочь справиться с симптомами и замедлить повреждение суставов. Распространенным методом лечения ревматоидного артрита являются БПВП (противоревматические препараты, модифицирующие заболевание), которые назначаются одновременно с НПВП (нестероидными противовоспалительными препаратами). Другим вариантом являются низкие дозы преднизолона или других кортикостероидов. Эти методы лечения значительно облегчают симптомы у большинства пациентов. Для пациентов с тяжелым повреждением суставов операция по восстановлению или замене сустава может помочь пациентам вернуться к комфортной и продуктивной жизни.
Для пациентов, нуждающихся в диагностике и лечении ревматоидного артрита в ведущем исследовательском центре и поставщике медицинских услуг, Brigham and Women’s Hospital (BWH) в Бостоне предлагает Центр лечения артрита и заболеваний суставов мирового уровня.
Узнайте больше об услугах по лечению ревматоидного артрита в BWH.
BWH предлагает лечение ревматоидного артрита мирового класса.
Центр артрита и заболеваний суставов BWH предоставляет уход и лечение мирового класса для более чем 100 причин артрита, включая волчанку, подагру и псевдоподагру, заболевания позвоночника и иммунной системы, как это происходит при ревматоидном артрите.
Центр имеет долгую историю инноваций и сосредоточения внимания на артрите — он возник как больница Роберта Брека Бригама, первая учебная больница в США, специализирующаяся исключительно на ревматоидном артрите и других связанных с ним заболеваниях. Инновационные исследования и терапевтические разработки Центра помогли продвинуть лечение ревматоидного артрита и других заболеваний суставов и принесли BWH звание одного из ведущих поставщиков ревматологических услуг, включая лечение ревматоидного артрита, в США
В Центре работает одна из самых больших и разносторонних команд ревматологов и аллергологов в стране, которые регулярно сотрудничают с другими специалистами BWH в области физиатрии, обезболивания, радиологии костей и суставов и других служб для оказания комплексной помощи более чем 30 000 пациентов с артритом ежегодно.
Другие услуги, предлагаемые Центром артрита и болезней суставов, включают:
- Лечение и хирургия остеоартрита
- Лечение остеопороза
- Детская ревматология для взрослых
- Аллергологические и иммунологические услуги
- Лечение склеродермии
- Лечение спондилита
BWH Исследования в области лечения ревматоидного артрита
Являясь ведущим научно-исследовательским центром в области ревматологии, воспалений и иммунитета, BWH внесла свой вклад в достижения, которые значительно изменили практику ревматологии и лечения ревматоидного артрита. Исследователи BWH, например, помогли разработать блокаду TNF — высокоэффективное средство для лечения ревматоидного артрита и одно из самых захватывающих медицинских открытий за последнее десятилетие.
Узнайте больше о лечении ревматоидного артрита в BWH, а также о других ревматологических услугах, таких как лечение волчанки, терапия псориатического артрита и многое другое.
Обновление лечения и лекарств на ранней стадии ревматоидного артрита
Принятое определение «раннего ревматоидного артрита» (также называемого «ранним ревматоидным артритом») значительно изменилось за последние годы, особенно примерно с 2015 года. В начале 1980-х годов, если у вас был ревматоидный артрит в течение менее двух лет, что было определено как «ранний РА». К 2010 г. были разработаны новые критерии, которые позволили диагностировать ранний РА в течение шести месяцев после первоначальной жалобы в зависимости от характера заболевания. Почему только полгода? Ревматологи узнали, что чем раньше мы вмешаемся, тем лучше исход для пациентов.
- Как врачи ставят диагноз ревматоидного артрита?
- Текущие рекомендации по лечению, решения и опасения
- Как Американский колледж ревматологов (ACR) разрабатывает рекомендации по лечению РА?
- Каков наиболее распространенный способ лечения раннего РА в соответствии с рекомендациями ACR?
- Как врачи измеряют активность заболевания при раннем РА?
- Разнообразие методов лечения ревматоидного артрита и будущие методы лечения
- Прививки для больных РА
Как врачи ставят диагноз ревматоидного артрита?
Мы изучаем рентгеновские снимки и несколько лабораторных анализов и учитываем продолжительность симптомов у пациента, а также тип и количество опухших и/или болезненных суставов. Мы также следим за тем, чтобы результаты лабораторных исследований и клинические данные не были связаны с отдельным основным воспалительным заболеванием (кроме РА) или с какой-либо другой причиной, такой как инфекция, кристаллы в суставе или повреждение хряща, вызванное предшествующим заболеванием. рана.
Мы также следим за тем, чтобы результаты лабораторных исследований и клинические данные не были связаны с отдельным основным воспалительным заболеванием (кроме РА) или с какой-либо другой причиной, такой как инфекция, кристаллы в суставе или повреждение хряща, вызванное предшествующим заболеванием. рана.
Ревматоидный артрит развивается у генетически предрасположенных людей, которые затем вступают в контакт с триггером(ами) окружающей среды. Мы не знаем, что это за триггеры, но мы начинаем больше понимать генетические компоненты. Наличие определенных генов может увеличить риск раннего РА. Тем не менее, не у всех с ранним РА есть эти гены. Кроме того, у некоторых людей есть гены, но у них не развивается ревматоидный артрит.
Текущие рекомендации по лечению, решения и опасения
Американский колледж ревматологов разработал рекомендации по лечению ревматоидного артрита в целом, а также раннего ревматоидного артрита. Существует четыре домена для оценки:
- распределение суставов (какие суставы поражены болезнью)
- результаты анализа крови
- продолжительность симптомов
- независимо от наличия воспаления суставов
Каждой категории присваивается балл; при сумме баллов шесть и более баллов диагноз РА подтверждается.
В комплексной схеме лечения рекомендации ACR затрагивают шесть основных тем, включая использование:
- небиологических препаратов, таких как метотрексат
- стероиды
- биологические препараты, такие как этанерцепт (Энбрел) или адалимумаб (Хумира)
- вакцины
- скрининг на туберкулез (ТБ)
- лабораторный мониторинг для модифицирующих заболевание противоревматических препаратов (DMARD), таких как метотрексат, гидроксихлорохин (плаквенил) и сульфасалазин (азульфидин)
Как Американский колледж ревматологов (ACR) разрабатывает рекомендации по лечению РА?
Группа, состоящая из пациентов, клиницистов и политиков, взвешивает каждую рекомендацию на основе имеющихся данных. Когда комиссия уверена, что преимущества лечения перевешивают потенциальный вред, это лечение становится настоятельной рекомендацией. Однако, если есть неопределенность в отношении пользы и вреда, то это становится условной рекомендацией.
Каков наиболее распространенный способ лечения раннего РА в соответствии с рекомендациями ACR?
Если у человека был ранний диагноз РА в течение менее шести месяцев и он соответствует критериям диагноза РА, его будут лечить обычным синтетическим противоревматическим препаратом, модифицирующим болезнь (БМАРП). Почти всегда в качестве исходного БПВП выбирают метотрексат, если только нет особой причины не использовать его. Дальнейший план лечения, даже через шесть месяцев, остается прежним и всегда уравновешивает безопасность лекарств с уровнем улучшения состояния человека.
Клиницисту важно оценить активность заболевания у пациента и иметь для этого стандартный метод. Таким образом, существуют объективные инструменты, которые врачи используют для измерения активности болезни. Эти инструменты:
- Оценка активности заболевания (DAS)
- Анкета для оценки состояния здоровья
- Рутинная оценка данных индекса пациента 3 (RAPID3)
DAS, также называемый DAS 28, учитывает и оценивает болезненность и припухлость в 28 суставах. DAS 3,3 указывает на легкое заболевание, а 5,6 балла и более указывает на тяжелое заболевание. Эту шкалу можно использовать для определения эффективности конкретных методов лечения. Если после лечения у пациента по-прежнему сохраняется умеренная или высокая активность заболевания, врач может добавить дополнительную терапию, например биопрепарат.
DAS 3,3 указывает на легкое заболевание, а 5,6 балла и более указывает на тяжелое заболевание. Эту шкалу можно использовать для определения эффективности конкретных методов лечения. Если после лечения у пациента по-прежнему сохраняется умеренная или высокая активность заболевания, врач может добавить дополнительную терапию, например биопрепарат.
Биопрепарат представляет собой вещество, полученное из живого организма или его продуктов. Эти препараты используются для профилактики, диагностики или лечения заболеваний. В случае ревматоидного артрита применяемые биологические агенты часто представляют собой антитела. Например, есть пять биологических препаратов в классе лекарств, которые блокируют воспалительное химическое вещество, называемое ФНО, а также есть несколько классов биологических препаратов, отличных от ФНО, которые действуют по-разному. Их можно использовать отдельно или в сочетании с лечением метотрексатом, чтобы снизить активность заболевания до низкого уровня или, в идеале, до уровня ремиссии.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) заботится о безопасности лекарств не меньше, чем об их эффективности, если не больше. Чтобы лекарство было одобрено FDA, FDA должно тщательно сбалансировать общий риск и пользу. Специфический и чувствительный анализ риска и пользы проводится для всех пациентов, участвовавших в клинических испытаниях препарата, и на всех стадиях заболевания пациентов. Затем FDA рассмотрит случаи различных побочных эффектов у пациентов, принимающих лекарство. Сюда входят рак, вирусные инфекции, болезни сердца или сердечная недостаточность, а также инфекции. В случае РА последний из них вызывает наибольшую озабоченность.
Это правда, что люди с РА, даже без лечения, могут подвергаться более высокому риску заражения. Тем не менее, обширные исследования показали, что многочисленные лекарства (например, биологические агенты) снижают гиперактивность иммунной системы, которая вызывает РА, без неприемлемого увеличения риска инфицирования пациента.
Как врачи измеряют активность заболевания при раннем РА?
Биомаркеры
Биомаркеры (биологические маркеры) представляют собой измеряемые индикаторы того, насколько активно заболевание или насколько вероятно его прогрессирование. Тест, который измеряет уровень воспаления, такой как скорость оседания или тест на С-реактивный белок (СРБ), может быть неспецифическим биомаркером более активного заболевания у пациента. Анализ крови (например, на антитела, используемые для диагностики ревматоидного артрита, ревматоидный фактор и антитела к ЦЦП) иногда может быть биомаркером повышенной вероятности того, что у пациента разовьется повреждение суставов, если болезнь не лечить.
Биомаркеры можно использовать для прогностических целей, таких как ревматоидный фактор пациента, предсказывающий, будут ли они испытывать большее повреждение суставов, если их состояние не лечить. Нам все еще нужны более совершенные тесты, чтобы предсказать, как будет себя вести отдельный пациент с ранним РА в будущем, но уже сейчас мы получаем некоторую пользу от имеющихся у нас биомаркеров.
Микробиом
Микробиом относится к огромному количеству микробов в нашем теле, которые сосуществуют с нами. Они защищают нас от микробов и расщепляют пищу, превращая ее в энергию. У каждого человека вырабатывается свой собственный микробиом, и этот микробиом различен в разных частях тела. Например:
- На микробиом кишечника влияет то, что вы едите, активность вашего заболевания и какое лечение вы получаете. Так что в каком-то смысле это правда, что вы то, что вы едите. У тех, кто ест йогурт, и у тех, кто его не ест, будут очень разные микробиомы кишечника. Микробиомы кишечника важны, потому что они помогают нашей пищеварительной системе и способности синтезировать витамины.
- Микробиомы кожи помогают поддерживать баланс между внешней средой и тем, что находится внутри вашего тела. Это известно как эпителиальный гомеостаз, и это жизненно важно для нашего выживания. Нам еще многое предстоит узнать о микробиоме, но мы знаем, что изменения влияют на восприимчивость к болезням и активность болезни.

Лечение и терапия
Лечение людей с ревматоидным артритом варьируется в зависимости от анамнеза (например, рака, гепатита В или С, застойной сердечной недостаточности (ЗСН)), перенесенных серьезных инфекций, а также текущего состояния пациента. Например, пациент с активным гепатитом С будет лечиться от гепатита С до получения биологических препаратов, таких как блокаторы ФНО. Другим примером может быть пациент со многими тяжелыми инфекциями в анамнезе, который может получить модифицирующее заболевание средство, которое, как было показано, не увеличивает инфекцию, такое как гидроксихлорохин (плаквенил) или сульфасалазин (азульфидин).
Биоаналоги
Биоаналог (сокращение от «биологически аналогичный») — это клинический эквивалент фирменного препарата. Биоаналоги молекулярно и клинически очень похожи на продукт, который они призваны заменить (так называемый «эталонный продукт»). Их можно рассматривать как «генерический биологический дженерик». Однако в то время как непатентованные лекарства, такие как прегабалин без торговой марки для замены Лирика или ацетаминофен без торговой марки для замены тайленола, должны быть химически идентичными , биоаналоги должны быть только идентичными . 0149 аналогичен эталонному продукту.
0149 аналогичен эталонному продукту.
FDA оценивает биоаналоги, чтобы определить, достаточно ли они идентичны оригиналу в отношении безопасности и эффективности. Если это так, агент будет одобрен для использования. Например, биоаналогом инфликсимаба (Remicade), одобренным FDA в США, является CT-P13 (продается под названиями Inflectra, Remsima). Существует множество биоаналогов для различных лекарств и состояний.
По мере того, как на рынок выходит все больше и больше таких препаратов, возникает ряд вопросов:
- Что повлияет на решение использовать эти препараты по сравнению с другими?
- Кто их получит?
- Если фирменное лекарство одобрено для лечения нескольких заболеваний (например, РА, а также колита), можем ли мы предположить, что биоаналог будет работать одинаково хорошо при обоих состояниях, если его испытать только при одном из них?
- Будет ли переход с фирменного препарата на биоаналог обязательным или необязательным для пациента в зависимости от страхового покрытия?
Еще многое предстоит выяснить о том, как биоаналоги будут использоваться в Соединенных Штатах.
Разнообразие методов лечения ревматоидного артрита и будущие методы лечения
Блокаторы ФНО, такие как этанерцепт (Энбрел), были упомянуты выше. Xeljanz (тофацитиниб) от Pfizer, а также два других препарата — барицитиниб (Olumiant) от Lilly и упадацитиниб (Rinvoq) от AbbVie — действуют аналогичным образом. Это примеры пероральных препаратов, в которых используется новый механизм, который может помочь людям с ревматоидным артритом. Тофацитиниб и родственные ему препараты называются ингибиторами JAK, имея в виду конкретное химическое вещество (янус-киназу), которое он блокирует.
У нас также есть блокаторы ИЛ-6, такие как тоцилизумаб (Актемра) и сарилумаб (Кевзара), и блокаторы активации Т-клеток, такие как абатацепт (Оренсия). У нас есть ингибиторы В-клеток, такие как ритуксимаб (Ритуксан).
К счастью, в настоящее время изучается несколько других механизмов остановки воспаления при РА. Это отличная новость для людей с ревматоидным артритом, поскольку одни и те же методы лечения не работают для всех людей, а лечение, вызывающее побочные эффекты у одного человека, может хорошо переноситься другим.
