Калий
К содержанию
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e— → K
2Cl— − 2e— → Cl2 При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH— − 4e— → 2H2O + O2 Вода из расплава быстро испаряется.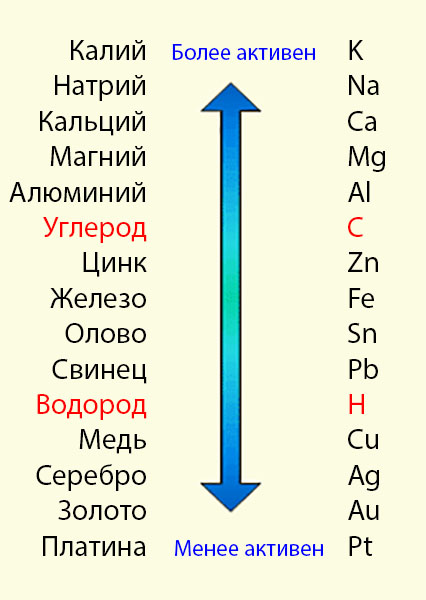 Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Источник: Википедия
Другие заметки по химии
Полезная информация?
Калий | это… Что такое Калий?
| 19 | Калий |
K 39,098 | |
| [Ar]4s1 | |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
Содержание
|
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д. Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФ
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
,
с халькогенами (100—200 °C, E = S, Se, Te):
.
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2

В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Основная статья: Гидроксид калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.

- Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
Кристаллы перманганата калия
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.

- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Основная статья: Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
- Натрий
- Щелочные металлы
- Банановый эквивалент
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011.
 Проверено 26 января 2010.
Проверено 26 января 2010.
Литература
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др. Элементы IA-группы. Калий // Химические свойства неорганических веществ: Уч. пособие для вузов. — 4-е изд. — М.: КолосС, 2003. — С. 29—40. — ISBN 5-9532-0095-1
Ссылки
- Калий на Webelements
- Калий в Популярной библиотеке химических элементов
 И. Менделеева И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Potasio en la Dieta: MedlinePlus en español
El Potasio ES Un Mineral Que el cuerpo necesita para funcionar normalmente. Es ип типо де electrolito. Ayuda a la función de los nervios y a la contracción de los músculos y a que su ritmo heartico se mantenga Constante. También allowe Que los Nutritiones fluyan a las células y expulsar los desechos de estas. Una Dieta Rica en Potasio ayuda a contrarrestar algunos de los efectos nocivos del sodio sobre la presión arterial.
Es ип типо де electrolito. Ayuda a la función de los nervios y a la contracción de los músculos y a que su ritmo heartico se mantenga Constante. También allowe Que los Nutritiones fluyan a las células y expulsar los desechos de estas. Una Dieta Rica en Potasio ayuda a contrarrestar algunos de los efectos nocivos del sodio sobre la presión arterial.
La mayoría de las personas obtiene el potasio que necesita de lo que come y bebe. Las maines fuentes de Potasio en la Dieta incluyen:
- Verduras de hoja verde como espinacas y col rizada
- Фрутос-де-лас-видес, комо-лас-увас-и-лас-морас
- Vegetales de raíz o Tuberculos como las zanahorias y las papas
- Cítricas Frutas como naranjas y toronjas
Los riñones ayudan a mantener la cantidad adecuada de potasio en su cuerpo. Si usted tiene enfermedad почечная хроника, los riñones no pueden eliminar el potasio adicional de la sangre. Algunos medicamentos también pueden elevar su nivel de potasio. Es posible дие necesite уна диета особенный пункт reducir ла cantidad де Potasio дие потреблять.
Es posible дие necesite уна диета особенный пункт reducir ла cantidad де Potasio дие потреблять.
- Потасио (Officina de Suplementos Dieteticos de los NIH) Тамбиен на английском языке
- Потасио на диете (Медицинская энциклопедия) Тамбиен на английском языке
- ¿Es возможный que los diuréticos disminuyan tu nivel de potasio? (Майский фонд образования и медицины) Тамбиен на английском языке
- Lista de alimentos con alto contenido de potasio (sepa cuáles evitar si no debe ingerir potasio) (Sistema de Salud de la Universidad de Michigan) — PDF
Какие продукты вредны для вашего мозга?
Отзыв от Jennifer Robinson, MD, 28 января 2023 г.
Вы наедаетесь разноцветными ягодами, грызете орехи и обедаете лососем — все это хорошие шаги, если ваша цель — улучшить здоровье мозга. Но как насчет продуктов, которые могут повысить риск проблем с настроением или памятью, особенно с возрастом? Узнайте, какие потенциально проблемные предметы должны реже появляться на вашей тарелке (или вообще исчезать).
Эти продукты, наряду со многими упакованными закусками, содержат большое количество трансжиров. Возможно, вы знаете, что трансжиры вредны для сердца и сосудов. Исследования показали, что они также могут нарушать работу мозга. Исследование, проведенное в журнале Neurology, показало, что пожилые люди с самым высоким уровнем элаидиновой кислоты (распространенный тип трансжиров) в крови были наиболее склонны к развитию деменции.
В то время как один бокал вина или пива вряд ли испортит ваш разум, алкоголь напрямую влияет на коммуникационные пути мозга. Чем больше вы пьете, тем труднее вам обрабатывать новую информацию или запоминать вещи. Алкоголь также может вызвать у вас смущение или депрессию.
Алкоголь также может вызвать у вас смущение или депрессию.
Если вы хотите сохранить остроту своего мозга в старости, держитесь подальше от суперсладких напитков. Исследования показали, что люди, которые пьют много газированных напитков, сладкого чая и других сладких напитков, гораздо чаще имеют проблемы с памятью. Эти напитки, которые часто содержат тип сахара, называемый фруктозой, могут даже привести к тому, что некоторые части вашего мозга станут меньше.
Если обычные безалкогольные напитки вредны для вас, то напитки без сахара полезны, верно? Не так быстро: исследования показывают, что люди, которые выпивают хотя бы одну диетическую газировку в день, почти в три раза чаще страдают от инсульта или развития деменции. Ученые считают, что вредным ингредиентом могут быть искусственные подсластители.
Люди, которые едят много жареной, обработанной пищи, как правило, хуже справляются с тестами, измеряющими их мыслительные способности. Вероятная причина: жареная и жирная пища. Эти греховные удовольствия вызывают воспаление, которое может повредить кровеносные сосуды, снабжающие мозг кровью, и повредить сам мозг.
Эти греховные удовольствия вызывают воспаление, которое может повредить кровеносные сосуды, снабжающие мозг кровью, и повредить сам мозг.
Эти вкусные лакомства жареные и с добавлением сахара, плохая комбинация, когда речь идет о здоровье мозга. Вы получаете двойной удар по воспалению от процесса жарки во фритюре и избытка сахара. Исследования связывают высокий уровень сахара в крови с деменцией. Хуже того: большинство пончиков содержат трансжиры — еще один ингредиент, который не нужен вашему мозгу.
Рафинированные углеводы, даже те, которые не очень сладкие на вкус, могут повысить уровень сахара в крови. За этим часто следует авария, из-за которой вы можете чувствовать себя затуманенным. Исследования показывают, что слишком много рафинированных углеводов может увеличить риск болезни Альцгеймера, особенно у некоторых людей, которые генетически предрасположены к ней. Отдавайте предпочтение цельнозерновому хлебу, коричневому рису и цельнозерновой пасте, когда вы едите углеводы.
В нем много насыщенных жиров, которые вредны как для сердца, так и для мозга. На самом деле, ограничение красного мяса является ключевым принципом MIND Diet, основанной на исследованиях программы питания, направленной на сохранение памяти и остроты мышления. Хотите источник белка, который лучше для вашего мозга? Рыба, нежирная птица и бобы являются более полезными вариантами.
За сливочный вкус приходится платить. Эти молочные продукты полны насыщенных жиров. Последователи диеты MIND избегают сливочного масла, сыра и других жирных молочных продуктов. Когда дело доходит до здоровья мозга, нежирные молочные продукты, как правило, являются более здоровым выбором. Вы можете получать молоко, йогурт, творог и другие молочные продукты в нежирных формах.
Большинство экспертов в области здравоохранения являются большими любителями рыбы, но они любят лосося и другие виды рыбы, которые содержат полезный жир, называемый омега-3 жирными кислотами. Рыба-меч, ахи-тунец и другая крупная рыба теряют очки, потому что в них, как правило, много ртути. Это нейротоксин, то есть токсичный для вашего мозга, который может привести к более высокому риску потери памяти и ухудшению мыслительных навыков у пожилых людей.
Это нейротоксин, то есть токсичный для вашего мозга, который может привести к более высокому риску потери памяти и ухудшению мыслительных навыков у пожилых людей.
Внимательно прочитайте состав на этикетке. Многие из этих продуктов содержат удивительно большое количество кукурузного сиропа с высоким содержанием фруктозы. Это то же самое, что и в газировке. Это связано с различными проблемами со здоровьем, включая потерю памяти и снижение производительности мозга. Вместо этого попробуйте смешивать свои собственные заправки для салатов.
ИЗОБРАЖЕНИЯ ПРЕДОСТАВЛЕНЫ:
1) Rawpixel / Getty Images
2) JoLin / Getty Images
3) Marilyn Nieves / Getty Images
4) jeka1984 / Getty Images
5) WebMD
6) archmercigod / Thinkstock
7) VikaRayu / Thinkstock
8) SasaJo / Thinkstock
9) Victority / Getty Images
10) bhofack2 / Getty Images
11) Victority / Getty Images
12) Jack Andersen / Getty Images
ИСТОЧНИК :
Американская академия питания и диетологии: «Диета MIND».


 Проверено 26 января 2010.
Проверено 26 января 2010.