Фтор. Биологическое значение, соединения и применение
Похожие презентации:
Получение галогенов. Биологическое значение и применение галогенов и их соединений
Галогены VII группы. Биологическая роль и применение в медицине
Медико-биологическое значение соединений алюминия
Получение, биологическая роль, применение галогенов
Влияние фтора на организм человека
Медико-биологическое значение неметаллов. Йод
Галогены. Применение галогенов и их соединений
Химия и биологическая роль элементов VIIА-группы
Зубные пасты
Хлор и его соединения
Фтор
Биологическое значение,соединения и
применение.
Фтор (F, лат. fluorum) — химический элемент 17-й группы, второго
периода периодической системы (по устаревшей короткой форме
периодической системы принадлежит к главной подгруппе VII группы, или к
группе VIIA) с атомным номером 9. Самый химически активный неметалл и
сильнейший окислитель, самый лёгкий элемент из группы галогенов.
простое вещество при нормальных условиях фтор представляет собой
двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом,
напоминающим озон или хлор. Токсичен.
Биологическое значение
В качестве микроэлемента фтор входит в
состав всех организмов. У животных и
человека фтор присутствует в костной
ткани (у человека — 0,2-1,2%) и, особенно,
в дентине и эмали зубов. В организме
среднего человека (масса тела 70 кг)
содержится 2,6 г фтора; суточная
потребность составляет 2-3 мг и
удовлетворяется, главным образом, с
питьевой водой
Фтор также используют в зубной пасте.
Недостаток фтора приводит к кариесу
зубов. Поэтому соединения фтора
добавляют в зубные пасты, иногда
вводят в состав питьевой воды.
Избыток фтора в воде, однако, тоже
вреден для здоровья. Он приводит к
флюорозу — изменению структуры
эмали и костной ткани, деформации
костей.
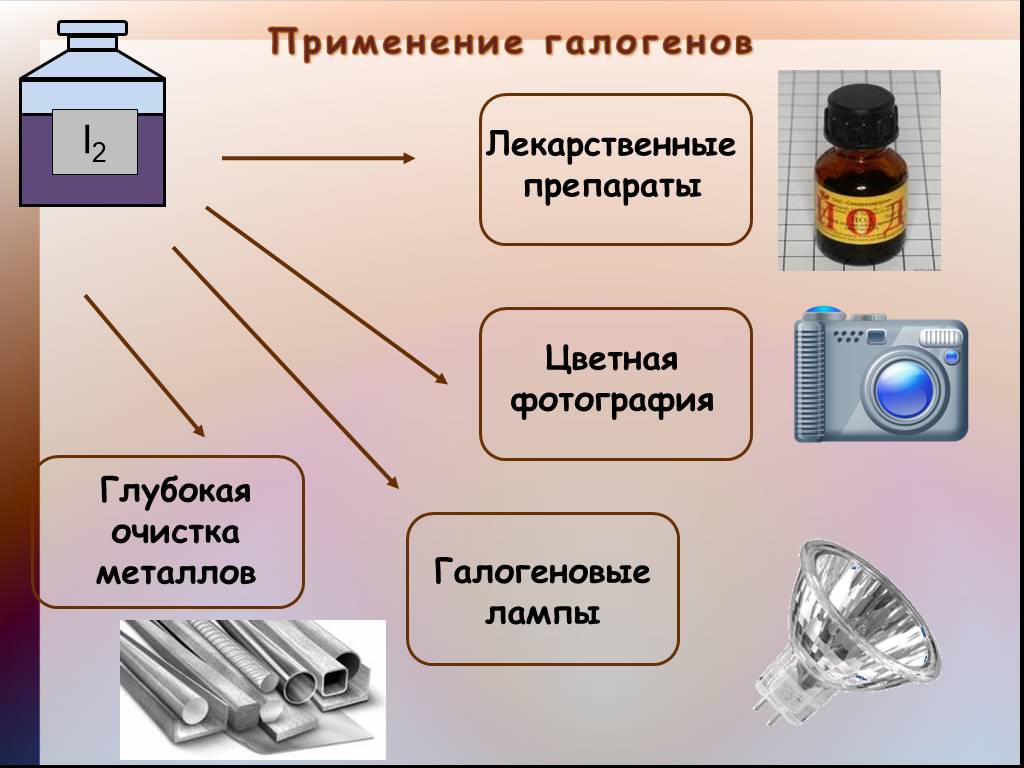
Применение фтора и его соединений:
Фтор широко применяют как фторирующий агент при получении различных
фторидов (SF6, BF3, WF6 и других) , в том числе и соединений инертных газов
ксенона (Xe) и криптона (Kr).

В ядерной промышленности фтор применяют для перевода урана в
гексафторид UF6, который затем разделяют на изотопы. (²³⁵UF₆ и ²³⁸UF₆)
Жидкий фтор и его соединения (OF2, ClF3, BrF5) применяют в качестве
окислителей ракетного топлива.
Фтор используется в качестве изолятора в электронике.
Крупный потребитель фтороводородной кислоты – алюминиевая
промышленность. Раствор HF применяется для прозрачного травления
силикатного стекла, травления кремния в полупроводниковой
промышленности, в составе травильных, травильно-полировальных
смесей, растворов для электрохимической обработки нержавеющей стали и
специальных сплавов, для растворения силикатов при различного рода
Различные фторсодержащие соединения применяют как
средства химической борьбы с вредителями сельского
хозяйства.
Соединения фтора невозможны лишь с неоном, аргоном
и гелием. Все 3 газа легки и инертны. Не из газов, фтору
не поддается алмаз. Есть ряд элементов, реакции с
которыми возможны лишь при повышенной температуре.

Так, пара хлор-фтор взаимодействует лишь при 200-250ти градусах Цельсия.
Применение в медицине:
Фторированные
углеводороды (например
перфтордекалин)
применяются в медицине
как кровезаменители.
Существует множество
лекарств, содержащих фтор
в структуре (фторотан,
фторурацил, флуоксетин,
галоперидол и др.).
Конец
English Русский Правила
Биологическая роль фтора
Фтор является очень важным микроэлементом. Фтор жизненно необходим для нормального роста и развития. В организме фтор участвует во многих важных биохимических реакциях — активирует аденилатциклазу, ингибирует липазы, эстеразу, лактатдегидрогеназы и т.д.
Фтор участвует в образовании костной ткани и формировании эмали и дентина зубной ткани. Фтор также имеет очень сильно выраженный противокариесный эффект, который объясняется замещением гидроксильной группы (OH-) гидроксиапатита эмали на фтор.
Некоторые
авторы приводят данные о том, что фтор
также подавляет кислотообразующие
бактерии.
Недостаточное поступление в организм этого микроэлемента вызывает остеопороз и кариес.
При избыточном поступлении фтора в организм развивается заболевание, известное под названием флюороз. Заболевание возникает при концентрации фтора в питьевой воде больше чем 1 мг/л. Оно проявляется потемнением эмали зубов, в пятнистости зубной эмали.
В районах, где фтора в воде меньше 0,5 мг/л, производят ее фторирование, при избытке фтора необходимо дефторирование питьевой воды.
Биологическая роль брома
Бром относят к условно-эссенциальным элементам. Физиологическая роль брома мало изучена.
Бромид натрия (NaBr) участвует в активации пепсина, активизирует некоторые ферменты, в частности, липазы и амилазы поджелудочной железы, которые участвуют в переваривании жиров и углеводов.
Ионы брома угнетают деятельность щитовидной железы, являясь антагонистами йодидов, и при хроническом воздействии замедляют их усвоение.
Бромиды
участвуют в регуляции ЦНС, усиливая
процессы торможения.
Препараты, созданные на основе брома подавляют сексуальное либидо и снижают потенцию, благодаря чему применяются для подавления полового влечения. Бром — очень ядовитое вещество. Поэтому на самом деле еще ни один врач не прописал ни одному больному в качестве успокоительного средства чистый бром. То, что в быту называется бромом, на самом деле есть раствор одной из его солей – бромида натрия NаВr, да и то в ничтожной концентрации.
Биологическая роль хлора
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
Ионы
хлора жизненно необходимы растениям.
Хлор участвует в энергетическом обмене
у растений, активируя окислительное
фосфорилирование. Он необходим для
образования кислорода в процессе
фотосинтеза изолированными хлоропластами,
стимулирует вспомогательные процессы
фотосинтеза, прежде всего те из них,
которые связаны с аккумулированием
энергии. Xлор положительно влияет на
поглощение корнями кислорода, соединений
калия, кальция, магния.
Учитывая связь хлора и натрия, следует отметить, что поступление в организм этих элементов тесно взаимосвязано. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена.
Под
воздействием ГАМК (нейромедиатор) ионы
хлора оказывают тормозящий эффект на
нейроны путем снижения потенциала
действия. В желудке ионы хлора создают
благоприятную среду для действия
протеолитических ферментов желудочного
сока. Хлорные каналы представлены во
многих типах клеток, митохондриальных
мембранах и скелетных мышцах. Эти каналы
выполняют важные функции в регуляции
объема жидкости, трансэпителиальном
транспорте ионов и стабилизации
мембранных потенциалов, участвуют в
поддержании рН клеток.
В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований.
пище и воде является причиной йододефицитных заболеваний.
Планетарная среда, богатая фтором, как возможная среда обитания для жизни
1. Лиде Д.Р. Справочник по химии и физике. КПР Пресс; Бока-Ратон, Флорида, США: 2001. [Google Scholar]
2. Голдсмит Д., Оуэн Т. Поиски жизни во Вселенной. университетские научные книги; Саусалито, Калифорния, США: 2003. [Google Scholar]
3. Кирк К.Л. Биохимия галогенорганических соединений. Том 9Б. пленум; Нью-Йорк, штат Нью-Йорк, США: 1991. стр. 127–150. [Google Scholar]
4. О’Хаган Д., Шаффрат К., Кобб С.Л., Гамильтон Дж.Т.Г., Мерфи К.Д. Биохимия: биосинтез фторорганической молекулы. Природа. 2002;416:279. doi: 10.1038/416279a. [PubMed] [CrossRef] [Google Scholar]
5. Гриббл Г.В. Разнообразие встречающихся в природе броморганических соединений. хим. соц. Ред. 1999; 28:335–346. doi: 10.1039/a
хим. соц. Ред. 1999; 28:335–346. doi: 10.1039/a
1d. [CrossRef] [Google Scholar]
6. Гриббл Г.В. Фторорганические соединения природного происхождения. В: Neilson AH, редактор. Фторорганические соединения. Спрингер-Верлаг; Берлин/Гейдельберг, Германия: 2002. стр. 121–136. [Google Scholar]
7. О’Хаган Д., Рзепа Х.С. Некоторые влияния фтора в биоорганической химии. хим. коммун. 1997: 645–652. [Google Scholar]
8. Харпер Д.Б., О’Хаган Д. Фторированные натуральные продукты. Нац. Произв. Представитель 1994; 11: 123–133. doi: 10.1039/np9941100123. [PubMed] [CrossRef] [Google Scholar]
9. Шульце-Макух Д., Ирвин Л.Н. Жизнь во Вселенной: ожидания и ограничения. 2-е изд. Спрингер-Верлаг; Берлин/Гейдельберг, Германия: 2008. [Google Scholar]
10. Фирсофф В.А. Жизнь за пределами Земли. Основные книги; Нью-Йорк, штат Нью-Йорк, США: 1963. [Google Scholar]
11. Олах Г.А. Пересечение общепринятых границ за полвека исследований. Дж. Орг. хим. 2005; 70:2413–2429. doi: 10.1021/jo040285o. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1021/jo040285o. [PubMed] [CrossRef] [Google Scholar]
12. Вандерборг Н.Е. Оценка отклика мембранного электрода из фторида лантана в кислых растворах. Таланта. 1968; 15: 1009–1013. doi: 10.1016/0039-9140(68)80108-0. [PubMed] [CrossRef] [Google Scholar]
13. Heidelberger C., Chaudhuri N.K., Danneberg P., Mooren D., Griesbach L., Duschinsky R., Schnitzer R.J., Pleven E., Scheiner J. Фторированные пиримидины, новый класс противоопухолевых соединений. Природа. 1957;179:663–666. дои: 10.1038/179663a0. [PubMed] [CrossRef] [Google Scholar]
14. Кирк К.Л. Фтор в медицинской химии: недавнее терапевтическое применение фторированных малых молекул. Дж. Флуор. хим. 2006; 127:1013–1029. doi: 10.1016/j.jfluchem.2006.06.007. [CrossRef] [Google Scholar]
15. Purcer S., Moore P.R., Swallow S., Gouverneur V. Фтор в медицинской химии. хим. соц. 2008; 37:320–330. doi: 10.1039/b610213c. [PubMed] [CrossRef] [Google Scholar]
16. Gung B.W., Patel M., Xue X. Порог переноса заряда в ароматических взаимодействиях? Количественное исследование взаимодействий π-стекинга. Дж. Орг. хим. 2005; 70:10532–10537. doi: 10.1021/jo051808a. [PubMed] [CrossRef] [Академия Google]
Дж. Орг. хим. 2005; 70:10532–10537. doi: 10.1021/jo051808a. [PubMed] [CrossRef] [Академия Google]
17. Сехас М.А., Кинни В.А., Чен С., Винтер Дж.Г., Алмонд Х.Р., Балсс К.М., Марьянофф К.А., Шмидт У., Бреаслав М., Махан А., Лейси Э., Марьянофф Б.Е. Тромбогенные пептиды-миметики коллагена: самосборка фибрилл на основе тройной спирали, управляемая гидрофобными взаимодействиями. проц. Натл. акад. науч. США. 2008; 105:8513–8518. doi: 10.1073/pnas.0800291105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Lai J.S., Kool E.T. Селективное спаривание полифторированных оснований ДНК. Варенье. хим. соц. 2004; 126:3040–3041. дои: 10.1021/ja039571с. [PubMed] [CrossRef] [Google Scholar]
19. Каметти М., Крус Б., Метранголо П., Милани Р., Реснати Г. Эффект флюоризации в биомолекулярных приложениях. хим. соц. 2012; 41:31–42. doi: 10.1039/c1cs15084g. [PubMed] [CrossRef] [Google Scholar]
20. Gladysz J.A., Jurisch M. Luorous Chemistry. Том 308. Springer-Verlag; Берлин/Гейдельберг, Германия: 2012.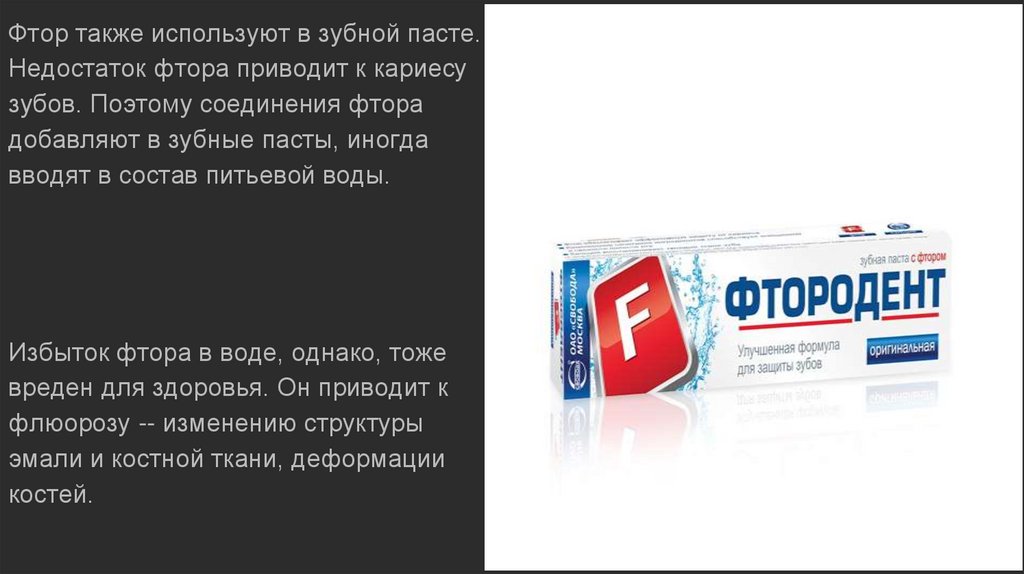 Структурные, физические и химические свойства фтористых соединений; стр. 1–23. Серия Темы современной химии. [PubMed] [Академия Google]
Структурные, физические и химические свойства фтористых соединений; стр. 1–23. Серия Темы современной химии. [PubMed] [Академия Google]
21. Сантаэлла К., Вирлинг П., Рисс Дж.Г. Высокостабильные липосомы, полученные из перфторалкилированных глицерофосфохолинов. Ангью. хим. Междунар. Эд. 1991; 30: 567–568. doi: 10.1002/anie.199105671. [CrossRef] [Google Scholar]
22. Santaella C., Vierling P., Riess J.G., Gulik-Krzywicki T., Gulik A., Monasse B. Полиморфное фазовое поведение перфторалкилированных фосфатидилхолинов. Биохим. Биофиз. Акта. 1994;1190:25–39. doi: 10.1016/0005-2736(94)
-0. [PubMed] [CrossRef] [Академия Google]23. Santaella C., Vierling P. Молекулярный порядок и подвижность в липосомальной мембране, изготовленной из высокофторированных фосфолипидов. хим. физ. Липиды. 1995; 77: 173–177. [Google Scholar]
24. Gege C., Schneider M.F., Schumacher G., Limozin L., Rothe U., Bendas G., Tanaka M., Schmidt R.R. Функциональные микродомены гликолипидов с частично фторированными мембранными якорями: влияние на клетку адгезия. ХимФизХим. 2004; 5: 216–224. doi: 10.1002/cphc.200300947. [PubMed] [CrossRef] [Академия Google]
ХимФизХим. 2004; 5: 216–224. doi: 10.1002/cphc.200300947. [PubMed] [CrossRef] [Академия Google]
25. Марш Э.Н.Г. Фторированные белки: от дизайна и синтеза до структуры и стабильности. Акк. хим. Рез. 2014 г.: 10.1021/ar500125m. [PubMed] [CrossRef] [Google Scholar]
26. Йодер Н.К., Кумар К. Фторированные аминокислоты в дизайне белков. хим. соц. 2002; 31:335–341. doi: 10.1039/b201097f. [PubMed] [CrossRef] [Google Scholar]
27. Биффингер Дж. К., Ким Х. В., ДиМагно С. Г. Полярная гидрофобность фторированных соединений. ХимБиоХим. 2004; 5: 622–627. doi: 10.1002/cbic.200300910. [PubMed] [CrossRef] [Google Scholar]
28. Будиса Н. Разработка генетического кода — расширение репертуара аминокислот для создания новых белков. Уайли; Weinheim, Germany: 2005. [Google Scholar]
29. Merkel L., Budisa N. Органический фтор как полипептидный строительный элемент: In vivo экспрессия фторированных пептидов, белков и протеомов. Орг. биомол. хим. 2012; 10:7241–7261. doi: 10.1039/c2ob06922a. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1039/c2ob06922a. [PubMed] [CrossRef] [Google Scholar]
30. Доббс А.П., Кимберли М.Р. Химия фтористых фаз: новая промышленная технология. Дж. Флуор. хим. 2002; 118:3–17. дои: 10.1016/S0022-1139(02)00202-6. [CrossRef] [Google Scholar]
31. Marsh E.N.G. К яйцу с антипригарным покрытием: разработка фтористых белков. хим. биол. 2000; 7: Р153–Р157. doi: 10.1016/S1074-5521(00)00139-3. [PubMed] [CrossRef] [Google Scholar]
32. Шульце-Макух Д., Хак С., Антонио М.Р.С., Али Д., Хосейн Р., Сонг Ю.С., Ян Дж., Зайкова Э., Беклес Д.М., Гуинань Э., Лехто Х.Дж., Халлам С.Дж. Микробная жизнь в жидкой асфальтовой пустыне. Астробиология. 2011; 11: 241–258. [PubMed] [Google Scholar]
33. Biava H., Budisa N. Эволюция фторированных ферментов: новая тенденция стабилизации биокатализаторов. англ. Жизнь наук. 2014; 14:340–351. doi: 10.1002/elsc.201300049. [CrossRef] [Google Scholar]
34. Реннерт О.М., Анкер Х.С. О включении 5′,5′,5′-трифторлейцина в белки E. coli . Биохимия. 1963; 2: 471–476. doi: 10.1021/bi00903a013. [PubMed] [CrossRef] [Google Scholar]
Биохимия. 1963; 2: 471–476. doi: 10.1021/bi00903a013. [PubMed] [CrossRef] [Google Scholar]
35. О’Хаган Д. Понимание химии фторорганических соединений. Введение в связь C – F. хим. соц. 2008; 37:308–319. [PubMed] [Google Scholar]
36. Salwiczek M., Nyakatura E.K., Gerling U.I.M., Ye S., Koksch B. Фторированные аминокислоты: совместимость с нативными белковыми структурами и влияние на белок-белковые взаимодействия. хим. соц. 2012; 41:2135–2171. дои: 10.1039/c1cs15241f. [PubMed] [CrossRef] [Google Scholar]
37. Jäckel C., Salwiczek M., Koksch B. Фтор в нативной белковой среде – как пространственное требование и полярность фторалкильных групп влияют на укладку белка. Ангью. хим. Междунар. Эд. 2006;45:4198–4203. [PubMed] [Google Scholar]
38. Pratt EA, Ho C. Включение фтортриптофана в белки Escherichia coli . Биохимия. 1975; 14:3035–3040. doi: 10.1021/bi00684a037. [PubMed] [CrossRef] [Академия Google]
39. Renner C., Alefelder S., Bae J.H., Budisa N. , Huber R., Moroder L. Фторпролины как инструменты для дизайна и инженерии белков. Ангью. хим. Междунар. Эд. 2001;40:923–925. doi: 10.1002/1521-3773(20010302)40:5<923::AID-ANIE923>3.0.CO;2-#. [PubMed] [CrossRef] [Google Scholar]
, Huber R., Moroder L. Фторпролины как инструменты для дизайна и инженерии белков. Ангью. хим. Междунар. Эд. 2001;40:923–925. doi: 10.1002/1521-3773(20010302)40:5<923::AID-ANIE923>3.0.CO;2-#. [PubMed] [CrossRef] [Google Scholar]
40. Kitevski-LeBlanc J.L., Prosser R.S. Текущие приложения 19 F ЯМР для изучения структуры и динамики белков. прог. Нук. Маг. Рез. 2012; 62:1–33. [PubMed] [Академия Google]
41. Буэр Б.К., Левин Б.Дж., Марш Э.Н.Г. Влияние фторирования на термодинамику фолдинга белков. Варенье. хим. соц. 2012; 134:13027–13034. doi: 10.1021/ja303521h. [PubMed] [CrossRef] [Google Scholar]
42. Дьюэл Х.С., Дауб Э., Робинсон В., Хонек Дж.Ф. Выяснение воздействия растворителя, реактивности боковой цепи и стерических требований остатка трифторметионина в рекомбинантном белке. Биохимия. 2001;40:13167–13176. doi: 10.1021/bi011381b. [PubMed] [CrossRef] [Академия Google]
43. Далви В. Х., Россский П. Я. Молекулярные истоки гидрофобности фторуглеродов. проц. Натл. акад. науч. США. 2010;107:13603–13607. doi: 10.1073/pnas.0915169107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 2010;107:13603–13607. doi: 10.1073/pnas.0915169107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Lee K.-H., Lee H.-Y., Slutsky M.M., Anderson J.T., Marsch E.N.G. Эффект фтора в белках: дизайн de novo и характеристика белка пучка из четырех α-спиралей, содержащего гексафторлейцин. Биохимия. 2004;43:16277–16284. дои: 10.1021/bi049086с. [PubMed] [CrossRef] [Google Scholar]
45. Билгичер Б., Фичера А., Кумар К. Спиральная катушка с фтористым сердечником. Варенье. хим. соц. 2001; 123:4393–4399. [PubMed] [Google Scholar]
46. Buer B.C., Meagher J.L., Stuckey J.A., Marsh E.N.G. Структурная основа повышенной стабильности высокофторированных белков. проц. Натл. акад. науч. США. 2012;109:4810–4815. doi: 10.1073/pnas.1120112109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Будиса Н. Пролегомены к будущим усилиям по генной инженерии кода путем расширения репертуара аминокислот. Ангью. хим. Междунар. Эд. 2004;43:6426–6463. doi: 10.1002/anie.200300646. [PubMed] [CrossRef] [Академия Google]
Междунар. Эд. 2004;43:6426–6463. doi: 10.1002/anie.200300646. [PubMed] [CrossRef] [Академия Google]
48. Джонсон Дж.А., Лу Ю.Ю., ван Девентер Дж.А., Тиррелл Д.А. Остаточно-специфическое включение неканонических аминокислот в белки: последние разработки и приложения. Курс. мнение хим. биол. 2010; 14:774–780. doi: 10.1016/j.cbpa.2010.09.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Budisa N., Pipitone O., Siwanowicz I., Rubini M., Pal P.P., Holak T.A., Gelmi M.L. Усилия по дизайну «тефлоновых» белков: трансляция in vivo с трифторированными аналогами лейцина и метионина. хим. Биодайверы. 2004; 1:1465–1475. doi: 10.1002/cbdv.2004
. [PubMed] [CrossRef] [Google Scholar]50. Шульце-Макух Д., Ирвин Л.Н. Экзотические формы жизни во Вселенной. Натурвиссеншафтен. 2006; 93: 155–172. [PubMed] [Google Scholar]
51. Вонг Дж.Т.Ф. Эволюция генетического кода. микробиол. науч. 1988; 5: 174–181. [PubMed] [Google Scholar]
52. Кастинг Дж. Ф., Зиферт Дж. Л. Жизнь и эволюция атмосферы Земли. Наука. 2002; 296:1066–1068. doi: 10.1126/science.1071184. [PubMed] [CrossRef] [Академия Google]
Ф., Зиферт Дж. Л. Жизнь и эволюция атмосферы Земли. Наука. 2002; 296:1066–1068. doi: 10.1126/science.1071184. [PubMed] [CrossRef] [Академия Google]
53. Будиса Н. Ксенобиология, новые для природы синтетические клетки и генетический брандмауэр. Курс. Орг. хим. 2014;18:936–943. doi: 10.2174/138527281808140616154301. [CrossRef] [Google Scholar]
54. Marlière P. Чем дальше, тем безопаснее: манифест для безопасной навигации синтетических видов от старого живого мира. Сист. Синтез. биол. 2009; 3:77–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Marlière P., Patrouix J., Döring V., Herdewijn P., Tricot S., Cruveiller S., Bouzon M., Mutzel R. Химическая эволюция бактериальный геном. Ангью. хим. Междунар. Эд. 2011;50:7109–7114. [PubMed] [Google Scholar]
56. Асеведо-Роча К.Г., Будиса Н. На пути к химически модифицированным организмам, наделенным генетическим брандмауэром. Ангью. хим. Междунар. Эд. 2011;50:6960–6962. [PubMed] [Google Scholar]
Изучение химии фтора на междисциплинарном стыке химии и биологии
1. Begue JP, Bonnet-Delpon D. J Fluorine Chem. 2006; 127:992. [Google Scholar]
Begue JP, Bonnet-Delpon D. J Fluorine Chem. 2006; 127:992. [Google Scholar]
2. Isanbor C, O’Hagan D. J Fluorine Chem. 2006; 127:303. [Академия Google]
3. Одзима И. Фтор в медицинской химии и химической биологии. Уайли-Блэквелл; Chichester: 2009. [Google Scholar]
4. Polina Cormier E, Das M, Ojima I. In: Fluor in Medical Chemistry and Chemical Biology. Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 525. [Google Scholar]
5. MedAdNews. 2007;13:200. См. также http://business.highbeam.com/437048/article-1G1-167388389/med-ad-news-200-bestselling-prescription-medicinescompanies. [Академия Google]
6. Мюллер К., Фаэх С., Дидерих Ф. Наука. 2007; 317:1881. [PubMed] [Google Scholar]
7. O’Hagan D, Schaffrath C, Cobb SL, Hamilton JTG, Murphy CD. Природа. 2002; 416:279. [PubMed] [Google Scholar]
8. Martino R, Malet-Martino M, Gilard V. Curr Drug Metab. 2000; 1:271. [PubMed] [Google Scholar]
9. Wadhwani P, Strandberg E. In: Фтор в медицинской химии и химической биологии. Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 463. [Google Академия]
Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 463. [Google Академия]
10. Kilbourn MR, Shao X. In: Фтор в медицинской химии и химической биологии. Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 361. [Google Scholar]
11. Унеяма К. Фторорганическая химия. Блэквелл; Оксфорд: 2006. [Google Scholar]
12. Солошонок В.А. фторсодержащие синтоны; ACS Symp Ser 911. Американское химическое общество; Вашингтон, округ Колумбия: 2005. [Google Scholar]
13. Солошонок В.А., Миками К., Ямадзаки Т., Уэлч Дж.Т., Хонек Дж.Ф. Современная фторорганическая химия: новые синтетические направления, технологии, материалы и биологические приложения; Симптом САУ, серия 949. Том. 949 Американское химическое общество; Вашингтон, округ Колумбия: 2007. [Google Scholar]
14. Кирш П. Современная фторорганическая химия: синтез, реакционная способность, приложения. Вайли–ВЧ; Штутгарт: 2004. [Google Scholar]
15. Хияма Т. Фторорганические соединения: химия и применение.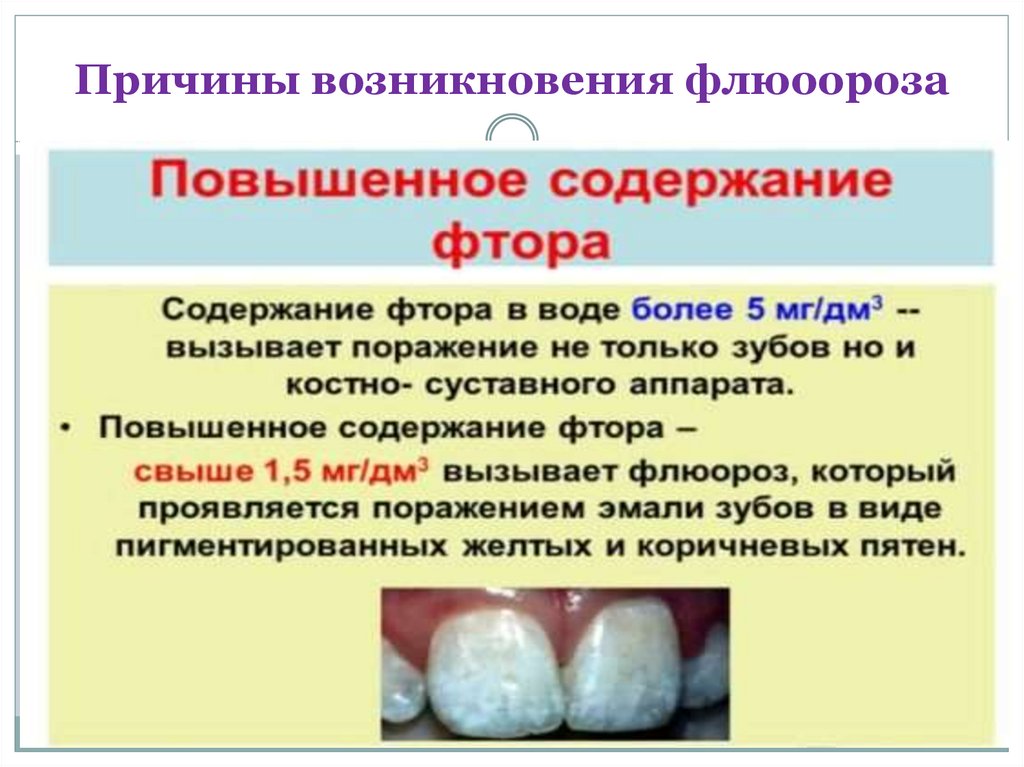 Спрингер-Верлаг; Штутгарт: 2000. [Google Scholar]
Спрингер-Верлаг; Штутгарт: 2000. [Google Scholar]
16. Солошонок В.А. Энантиоконтролируемый синтез фторорганических соединений: стереохимические проблемы и биомедицинские цели. Уайли; Нью-Йорк: 1999. [Google Scholar]
17. Китазуме Т., Ямадзаки Т. Экспериментальные методы в органической химии фтора. Коданша, издательство Gordon and Breach Science Publisher; Tokyo: 1998. [Google Scholar]
18. Hudlicky M, Pavlath AE. Химия органических соединений фтора II: критический обзор. Американское химическое общество; Washington, D.C: 1995. [Google Scholar]
19. Кухар В.П., Солошонок В.А. Фторсодержащие аминокислоты: синтез и свойства. Уайли; Чичестер: 1994. [Google Scholar] 9.0003
20. Кларк Л., Голлан Р. Наука. 1966; 152:1755. [PubMed] [Google Scholar]
21. Ojima I, Tsai CY, Tzamarioudaki M, Bonafoux D. In: Organic Reactions. Оверман Л.Э., редактор. Том. 56. Уайли; Нью-Йорк: 2000. с. 1. [Google Scholar]
22. Пино П., Пьяченти Ф., Бьянки М. В кн.: Органические синтезы с помощью карбонилов металлов. Вендер И., Пино П., редакторы. Том. 2. Wiley-Interscience; Нью-Йорк: 1977. с. 43. [Google Scholar]
Вендер И., Пино П., редакторы. Том. 2. Wiley-Interscience; Нью-Йорк: 1977. с. 43. [Google Scholar]
23. Корнилс Б. В кн.: Новые синтезы с окисью углерода. Фальбе Дж., редактор. Спрингер-Верлаг; Берлин: 1980. с. 1. [Google Scholar]
24. Ojima I. Chem Rev. 1988; 88:1011. [Google Scholar]
25. Филлер Р. Биохимия с участием углерод-фторовых связей. Американское химическое общество; Вашингтон, округ Колумбия: 1976. [Google Scholar]
26. Filler R. CHEMTECH. 1973. с. 752. [Google Scholar]
27. Смит Ф.А. ХЕМТЕХ. 1973. с. 422. [Google Scholar]
28. Filler R, Kobayashi Y. Биомедицинские аспекты химии фтора. Эльзевир Биомедикал; Амстердам: 1982. [Google Scholar] 9.0003
29. Fuchikami T, Ojima I. J Am Chem Soc. 1982;104:3527. [Google Scholar]
30. Ojima I, Kato K, Okabe M, Fuchikami T. J Am Chem Soc. 1987;109:7714. [Google Scholar]
31. Ojima I, Fuchikami T. 4370504 US Pat. 1983
32. Пино П., Пьяченти Ф., Бьянки М., Лаззарони Р. Чим Инд (Милан) 1968; 50:106. [Google Scholar]
Чим Инд (Милан) 1968; 50:106. [Google Scholar]
33. Schwager I, Knifton JF. 2 322 751 Гер Оффен. 1973Chem Abstr. 1974;80:70327м. [Google Scholar]
34. Бут Б.Л., Эльза М.Дж., Филдс Р., Хазелдин Р.Н. J Organomet Chem. 1971;27:119. [Google Scholar]
35. Ojima I. l’actualite chimique. 1987. с. 171. [Google Scholar]
36. Фальбе Дж. Новые синтезы с окисью углерода. Спрингер-Верлаг; Berlin: 1980. [Google Scholar]
37. Fuchikami T, Ohishi K, Ojima I. J Org Chem. 1983; 48:3803. [Google Scholar]
38. Уэлч Дж.Т. Тетраэдр. 1987;43:3123. [Google Scholar]
39. Империали Б. В кн. Достижения в биотехнологических процессах. Мизрахи А., редактор. Том. 10. Алан Р. Лисс Инк; Нью-Йорк: 1988. с. 97. [Google Scholar]
40. Imperialli B, Abeles RH. Биохимия. 1986; 26:3760. [Google Scholar]
41. Ламден Л., Бартлетт П.А. Biochem Biophys Res Commun. 1983; 112:1085. [PubMed] [Google Scholar]
42. Thaisrivongs S, Pals DT, Kati WM, Turner SR, Thomasco LM, Watt M. J Med Chem. 1986; 29:2080. [PubMed] [Google Scholar]
J Med Chem. 1986; 29:2080. [PubMed] [Google Scholar]
43. Feuerstein G, Lozovsky D, Cohen LA, Labroo VM, Kirk K, Kopkin IJ, Faden AI. Нейропептиды. 1984; 4:303. [PubMed] [Академия Google]
44. Ojima I, Kato K, Nakahashi K, Fuchikami T, Fujita M. J Org Chem. 1989;54:4511. [Google Scholar]
45. Ямагучи С., Мошер Х.С. J Org Chem. 1973; 38:1870. [Google Scholar]
46. Валборски Х.М., Баум М., Лонкрини Д.Ф. J Am Chem Soc. 1955;77:3637. [Google Scholar]
47. Meng H, Clark CA, Kumar K. In: Fluor in Medical Chemistry and Chemical Biology. Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 411. [Google Scholar]
48. diPAMP = (1R,2R)-1,2-бис[(о-анизилфенил)фосфино]этан. См. Knowles WS, Sabacky MJ, Vineyard BD, Weinkauff DJ. J Am Chem Soc. 1976;97:2567. [Google Scholar]
49. Fujita M, Ojima I. Tetrahedron Lett. 1983; 24:4573. [Google Scholar]
50. Кнорре Д.Г., Лаврик О.И., Петрова Т.Д., Саваченко Т.И., Якобсон Г.Г. ФЭБС лат. 1971; 12:204. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
51. Невинский Г.А., Фаворова О.О., Лаврик О.И., Петрова Т.Д., Кочкина Л.Л., Саваченко Т.И. ФЭБС лат. 1974; 43:135. [PubMed] [Google Scholar]
52. Pless SA, Galpin JD, Niciforovic AP, Ahern CA. Природа Хим Биол. 2011;7:617. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Будиса Н. Разработка генетического кода. Wiley-ВЧ; Weinheim: 2006. [Google Scholar]
54. Henne AL, Naer MJ. J Am Chem Soc. 1951;73:1042. [Google Scholar]
55. Fuchikami T, Yamanouchi A, Ojima I. Synthesis. 1984:766. [Google Scholar]
56. Ito H, Miller DC, Willson CG. Макромолекулы. 1982;15:915. [Google Scholar]
57. Koishi T, Tanaka I, Yasumura T, Ojima I, Fuchikami T. Jpn Pat. 1992: 1676867. [Google Scholar]
58. Одзима И., Фучиками Т. 1418495 японских патентов. 1988
59. Ojima I, Fuchikami T. 1640707 Jpn Pat. 1992
60. Ito H, Truong HD, Okazaki M, Miller DC, Fender N, Brock PJ, Wallraff GM, Larson CE, Allen RD. J Photopolym Sci Technol. 2002; 15:591. [Google Scholar]
J Photopolym Sci Technol. 2002; 15:591. [Google Scholar]
61. Shirai M, Takashiba S, Tsunooka M. J Photopolym Sci Technol. 2003;16:545. [Google Scholar]
62. Cracowski JM, Montembault V, Hardy I, Bosc D, Améduri B, Fontaine L. J Polym Sci A — Polym Chem. 2008;46:4383. [Академия Google]
63. Одзима И., Накахаси К. Хей 449298. Япония Кокаи Токкио Кохо. 1990
64. Ojima I, Nakahashi K. 5276137 US Pat. 1994
65. Шенберг А., Хек Р.Ф. J Org Chem. 1974; 39:3327. [Google Scholar]
66. Fuchikami T, Ojima I. Tetrahedron Lett. 1982; 23:4099. [Google Scholar]
67. Heidelberger C, Barsons DG, Remy DC. J Am Chem Soc. 1962; 84:3597. [Google Scholar]
68. Ojima I, Fuchikami T. Jpn Pat. 1992: 1634611. [Google Scholar]
69. O’Brien W, Taylor J. Invest Ophthalmol Vis Sci. 1991;32:2455. [PubMed] [Google Scholar]
70. Ojima I, Okabe M, Kato K, Kwon HB, Horvlth IT. J Am Chem Soc. 1988; 210:150. [Google Scholar]
71. Horváth IT, Bor G, Garland M, Pino P. Металлоорганические соединения. 1986; 5:1441. [Google Scholar]
Металлоорганические соединения. 1986; 5:1441. [Google Scholar]
72. Bor G. Pure Appl Chem. 1986; 58:543. [Google Scholar]
73. Spindler F, Bor G, Dietler U, Pino P. J Organomet Chem. 1981; 213:303. [Google Scholar]
74. Cushman DW, Cheung HS, Sabo EF, Ondetti MA. Биохимия. 1977;16:5484. [PubMed] [Google Scholar]
75. Ондетти М.А., Рубин Б., Кушман Д.В. Наука. 1977; 196:441. [PubMed] [Google Scholar]
76. Patchett AA, Harris E, Tristram EW, Wyvratt MJ, Taub D, Peterson ER, Ikeler TJ, ten Broeke J, Payne LG, Ondeyka DL, Thorsett ED, Greenlee WJ, Lohr NS , Хоффсоммер Р.Д., Джошуа Х., Руйл В.В., Ротрак Дж.В., Астер С.Д., Мэйкок А.Л., Робинсон Ф.М., Хиршманн Р., Свит К.С., Ульм Э.Х., Гросс Д.М., Вассил Т.К., Стоун К.А. Природа. 1980;288:280. [PubMed] [Академия Google]
77. Filler R. J. Fluorine Chem. 1986; 33:361. [Google Scholar]
78. Ojima I, Jameison FA, Peté B, Radunz H, Schittenhelm C, Lindner HJ, Smith A. Drug Design Discov. 1994; 11:91. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
79. Ojima I, Jameison FA. Bioorg Med Chem Lett. 1991; 1:581. [Google Scholar]
80. Холмквист Б., Баннинг П., Риордан Дж. Ф. Анальная биохимия. 1979;95:540. [PubMed] [Google Scholar]
81. Smith AE, Lindner HJ. J Компьютерное проектирование мол. 1991;5:235. [PubMed] [Академия Google]
82. Хансен П.Е., Морган Б.А. Пептиды – анализ, синтез, биология. В: Undenfriend S, Meienhofer J, редакторы. Опиоидные пептиды: биология, химия и генетика. Том. 6. Академическая пресса; Уолтем: 1984. с. 269. [Google Scholar]
83. Патерсон С.Дж., Робсон Л.Е., Костерлиц Х.В. Пептиды – анализ, синтез, биология. В: Undenfriend S, Meienhofer J, редакторы. Опиоидные пептиды: биология, химия и генетика. Том. 6. Академическая пресса; Уолтем: 1984. с. 147. [Google Академия]
84. Ватанабэ Дж., Токуяма С., Такахаши М., Кането Х., Маэда М., Кавасаки К., Тагучи Т., Кобаяши Ю., Ямамото Ю., Шимокава К. J Pharmacobio-Dyn. 1991;14:101. [PubMed] [Google Scholar]
85. Thorsett ED, Wyvratt MJ. В: Нейропептиды и их пептидазы. Тернер А.Дж., редактор. Эллис Хорвуд — ВЧ; Чичестер: 1987. с. 229. [Google Scholar]
Thorsett ED, Wyvratt MJ. В: Нейропептиды и их пептидазы. Тернер А.Дж., редактор. Эллис Хорвуд — ВЧ; Чичестер: 1987. с. 229. [Google Scholar]
86. Тернер А.Дж. В: Нейропептиды и их пептидазы. Тернер А.Дж., редактор. Эллис Хорвуд — ВЧ; Чичестер: 1987. с. 183. [Google Академия]
87. МакКелви Дж.Ф. Энн Рев Нейроски. 1986; 9:415. [PubMed] [Google Scholar]
88. Ojima I, Jameison FA, Conway JD, Nakahashi K, Hagiwara M, Miyamae T, Radunz HE. Bioorg Med Chem Lett. 1992; 2:219. [Google Scholar]
89. Одзима И. В кн.: Фторорганические соединения в медицинской химии и биомедицинских применениях. Филлер Р., Кобаяши Ю., Ягупольский Л.М., ред. Эльзевир; Амстердам: 1993. с. 241. [Google Scholar]
90. Джуаристи Э. Энантиоселективный синтез β-аминокислот. Wiley-ВЧ; Нью-Йорк: 1997. [Google Scholar]
91. Коул, округ Колумбия. Тетраэдр. 1994;50:9517. [Google Scholar]
92. Ojima I, Delaloge F. In: Peptidomimetics Protocols. Камьерски В, редактор. Хумана Пресс; Нью-Джерси: 1998. с. 137. [Google Scholar]
с. 137. [Google Scholar]
93. Kingston DGI. хим.комм. 2001; 10:867. [Google Scholar]
94. Ojima I, Lin S, Wang T. Curr Med Chem. 1999;6:927. [PubMed] [Google Scholar]
95. Георг GITCTIODV. Таксановые противораковые агенты: фундаментальная наука и текущий статус. Американское химическое общество; Вашингтон, округ Колумбия: 1995. с. 583. [Google Scholar]
96. Umezawa H, Aoyagi T, Suda H, Hamada M, Takeuchi T. J Antibiot. 1976; 29:97. [PubMed] [Google Scholar]
97. Pearson WHH. J Org Chem. 1989;54:4235. [Google Scholar]
98. Роерс Р., Вердин Г.Л. Тетраэдр Летт. 2001;42:3563. [Google Scholar]
99. Нагаи М., Кодзима Ф., Наганава Х., Хамада М., Аояги Т., Такеучи Т. Дж. Антибиот. 1997;50:82. [PubMed] [Google Scholar]
100. Okino T, Matsuda H, Murakami M, Yamaguchi K. Tetrahedron Lett. 1993;34:501. [Google Scholar]
101. Мимото Т., Хаттори Н., Такаку Х., Кисануки С., Фукадзава Т., Терашима К., Като Р., Нодзима С., Мисава С. , Уэно Т., Имаи Дж., Эномото Х., Танака С., Сакикава Х., Шинтани М., Хаяши Х., Кисо Ю. Chem Pharm Bull. 2000;48:1310. [PubMed] [Google Scholar]
, Уэно Т., Имаи Дж., Эномото Х., Танака С., Сакикава Х., Шинтани М., Хаяши Х., Кисо Ю. Chem Pharm Bull. 2000;48:1310. [PubMed] [Google Scholar]
102. Kiso Y, Matsumoto S, Mimoto H, Kato T, Nojima R, Takaku S, Fukazawa H, Kimura T, Akaji T. Arch Pharm. 1998:87. [PubMed] [Google Scholar]
103. Ojima I, McCarthy JM, Welch JT. Биомедицинские границы химии фтора, ACS Symp Series 639. Американское химическое общество; Вашингтон, округ Колумбия: 1996. [Google Scholar]
104. Ojima I. ChemBioChem. 2004; 5:628. [PubMed] [Google Scholar]
105. Hook DF, Gessier F, Noti C, Kast P, Seebach D. ChemBioChem. 2004; 5:691. [PubMed] [Google Scholar]
106. Ojima I, Inoue T, Chakravarty S. J Fluorine Chem. 1999;97:3. [Google Scholar]
107. Ojima I, Inoue T, Slater JC, Lin S, Kuduk SC, Chakravarty S, Walsh JJ, Gilchrist L, McDermott AE, Cresteil T, Monsarrat B, Pera P, Bernacki RJ. В: Асимметричная фторорганическая химия: синтез, применение и будущие направления; ACS Symp Ser 746. Рамачандран П.В., редактор. Американское химическое общество; Вашингтон, округ Колумбия: 1999. с. 158. [Google Scholar]
Рамачандран П.В., редактор. Американское химическое общество; Вашингтон, округ Колумбия: 1999. с. 158. [Google Scholar]
108. O’Hagan DSC, Cobb SL, Hamilton JTG, Cormac D, Murphy CD. Природа. 2002; 416:279. [PubMed] [Google Scholar]
109. Gerhard U, Thomas S, Mortishire-Smith R. J Pharm Biol Analysis. 2003;32:531. [PubMed] [Google Scholar]
110. Канеко С., Ямадзаки Т., Китазуме Т. J Org Chem. 1993;58:2302. [Google Scholar]
111. Abouabdellah A, Begue JP, Bonnet-Delpon D, Nga TTT. J Org Chem. 1997;62:8826. [Google Scholar]
112. Uneyama K, Hao J, Amii H. Tetrahedron Lett. 1998;39:4079. [Google Scholar]
113. Солошонок В.А., Солошонок И.В., Кухар В.П., Сведас В.К. J Org Chem. 1998; 63:1878. [Google Scholar]
114. Fustero S, Pina B, Salavert E, Navarro A, Ramírez de Arellano MC, Simon Fuentes A. J Org Chem. 2002;67:4667. [PubMed] [Google Scholar]
115. Ojima I. Acc Chem Res. 1995; 28:383. [Google Scholar]
116. Ojima I, Delaloge F. Chem Soc Rev. 1997; 26:377. [Google Scholar]
Chem Soc Rev. 1997; 26:377. [Google Scholar]
117. Дешмукх А.Р., Бхавал Б.М., Кришнасвами Д., Гованде В.В., Шинкре Б.А., Джаянти А. Curr Med Chem. 2004;11:1889. [PubMed] [Google Scholar]
118. Alcaide B, Almendros P. Curr Med Chem. 2004; 11:1921. [PubMed] [Google Scholar]
119. Palomo C, Aizpurua JM, Ganboa I, Oiardide M. Curr Med Chem. 2004; 11:1837. [PubMed] [Google Scholar]
120. Камат А., Одзима И. Тетраэдр. 2012;68:10640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Brieva R, Crich JZ, Sih CJ. J Org Chem. 1993; 58:1068. [Google Scholar]
122. Kuznetsova L, Ungureanu IM, Pepe A, Zanardi I, Wu X, Ojima I. J Fluorine Chem. 2004; 125:487. [Академия Google]
123. Ожима И., Кузнецова Л., Унгуряну И.М., Пепе А., Занарди И., Чен Дж. В кн.: Фторсодержащие синтоны, ACS Symp Ser 911. Солошонок В.А., изд. Американское химическое общество / Издательство Оксфордского университета; Вашингтон, округ Колумбия: 2005. с. 544. [Google Scholar]
124. Ojima I, Slater JC, Pera P, Veith JM, Abouabdellah A, Begue JP, Bernacki RJ. Bioorg Med Chem Lett. 1997; 7:133. [Google Scholar]
Ojima I, Slater JC, Pera P, Veith JM, Abouabdellah A, Begue JP, Bernacki RJ. Bioorg Med Chem Lett. 1997; 7:133. [Google Scholar]
125. Трост Б.М. Acc Chem Res. 2002; 35:695. [PubMed] [Google Scholar]
126. Ojima I, Sun CM, Park YH. J Org Chem. 1994;59:1249. [Google Scholar]
127. Ojima I, Wang T, Delaloge F. Tetrahedron Lett. 1998; 39:3663. [Google Scholar]
128. Ojima I, Wang T, Ng EW. Тетраэдр Летт. 1998; 39:923. [Google Scholar]
129. Ровинский Е.К. Ежегодный обзор медицины. 1997; 48:353. [PubMed] [Google Scholar]
130. Bristol-Myers Squibb. 2003 г. http://packageinserts.bms.com/pi/pi_taxol.pdf.
131. Национальный институт рака. 2012 г. http://www.cancer.gov/cancertopics/druginfo/docetaxel.
132. Шифф П.Б., Фант Дж., Хорвиц С.Б. Природа. 1979; 277:665. [PubMed] [Google Scholar]
133. Jordan MA, Toso RJ, Wilson L. Proc Natl Acad Sci USA. 1993;90:9552. [Бесплатная статья PMC] [PubMed] [Google Scholar]
134. Ojima I, Kuduk SD, Chakravarty S, Ourevitch M, Bégué JP. J Am Chem Soc. 1997;119:5519. [Google Scholar]
Ojima I, Kuduk SD, Chakravarty S, Ourevitch M, Bégué JP. J Am Chem Soc. 1997;119:5519. [Google Scholar]
135. Georg GI, Harriman GCB, Vander Velde DG, Boge TC, Cheruvalth ZS, Datta A, Hepperle M, Park H, Himes RH, Jayasinghe L. In: Taxane Anticancer Agents: Basic Science and Current Status. , ACS Symp Series 583. Георг Г.И., Чен Т.Т., Одзима И., Вьяс Д.М., редакторы. Американское химическое общество; Вашингтон, округ Колумбия: 1995. с. 217. [Google Scholar]
136. Guéritte-Voegelein F, Mangatal L, Guénard D, Potier P, Guilhem J, Cesario M, Pascard C. Acta Crstallogr. 1990; С46:781. [Google Scholar]
137. Williams HJ, Scott AI, Dieden RA, Swindell CS, Chirlian LE, Francl MM, Heerding JM, Krauss NE. Может J Chem. 1994: 252. [Google Scholar]
138. Williams HJ, Scott AI, Dieden RA, Swindell CS, Chirlian LE, Francl MM, Heerding JM, Krauss NE. Тетраэдр. 1993;49:6545. [Академия Google]
139. Вандер Вельде Д.Г., Георг Г.И., Грюневальд Г.Л., Ганн К.В., Митчер Л. А. J Am Chem Soc. 1993;115:11650. [Google Scholar]
А. J Am Chem Soc. 1993;115:11650. [Google Scholar]
140. Mastropaolo D, Camerman A, Luo Y, Brayer GD, Camerman N. Proc Natl Acad Sci USA. 1995;92:6920. [Бесплатная статья PMC] [PubMed] [Google Scholar]
141. Палома Л.Г., Гай Р.К., Врасидло В., Николау К.С. хим. биол. 1994; 2:107. [PubMed] [Google Scholar]
142. Gottesman MM, Fojo T, Bates SE. Нат Рев Рак. 2002; 2:48. [PubMed] [Google Scholar]
143. Ojima I, Slater JC, Michaud E, Kuduk SD, Bounaud PY, Vrignaud P, Bissery MC, Veith J, Pera P, Bernacki RJ. J Med Chem. 1996;39:3889. [PubMed] [Google Scholar]
144. Ojima I, Chen J, Sun L, Borella C, Wang T, Miller M, Lin S, Geng X, Kuznetsova L, Qu C, Gallagher G, Zhao X, Zanardi I, Xia S, Horwitz S, Clair JS, Guerriero J, Bar-Sagi D, Veith J, Pera P, Bernacki R. J Med Chem. 2008;51:3203. [Бесплатная статья PMC] [PubMed] [Google Scholar]
145. Ojima I, Wang T, Miller ML, Lin S, Borella CP, Geng X, Pera P, Bernacki RJ. Bioorg Med Chem Lett. 1999;9:3423. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
146. Ojima I, Kuduk S, Slater J, Gimi R, Sun CM. Тетраэдр. 1996;52:209. [Google Scholar]
147. Кузнецова Л.В., Пепе А., Унгуряну И.М., Пера П., Бернаки Р.Дж., Одзима И. J. Fluorine Chem. 2008;129:817. [Бесплатная статья PMC] [PubMed] [Google Scholar]
148. Ojima I, Slater JC. Хиральность. 1997; 9:487. [PubMed] [Google Scholar]
149. Гут И., Ожима И., Вацлавикова Р., Симек П., Горский С., Линхарт И., Соучек П., Кнодрова Е., Кузецова Л., Чен Дж. Ксенобиотика. 2006; 36:772. [PubMed] [Google Scholar]
150. Vuilhorgne M, Gaillard C, Sanderlink GJ, Royer I, Monsarrat B, Dubois J, Wright M. In: Taxane Anticancer Agents: Basic Science and Current Status, ACS Symp Ser 583. Georg GI, Chen TT, Ojima I, Vyas DM, редакторы. Американское химическое общество; Вашингтон, округ Колумбия: 1995. с. 98. [Google Scholar]
151. Кузнецова Л., Сун Л., Чен Дж., Чжао Х., Зейтц Дж., Дас М., Ли Ю., Вейт Дж., Пера П., Бернаки Р., Ся С., Хорвиц С. , Одзима И. Дж. Фтор хим. 2012;143:177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Одзима И. Дж. Фтор хим. 2012;143:177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
152. Пепе А., Кузнецова Л., Сун Л., Одзима И. В кн.: Фтор в медицинской химии и химической биологии. Одзима I, редактор. Уайли-Блэквелл; Чичестер: 2009. с. 117. [Google Scholar]
153. Li Y, Poliks B, Cegelski L, Poliks M, Gryczynski Z, Piszcek G, Jagtap PG, Studelska DR, Kingston DGI, Schaefer J, Bane S. Биохимия. 2000;39:281. [PubMed] [Google Scholar]
154. Geney R, Sun L, Pera P, Bernacki Ralph J, Xia S, Horwitz Susan B, Simmerling Carlos L, Ojima I. Chem Biol. 2005;12:339. [PubMed] [Google Scholar]
155. Рао С., Хе Л., Чакраварти С., Одзима И., Орр Г.А., Хорвиц С.Б. Дж. Биол. Хим. 1999; 274:37990. [PubMed] [Google Scholar]
156. Ногалес Э., Вольф С.Г., Даунинг К.Х. Природа. 1998; 391:199. [PubMed] [Google Scholar]
157. Paik Y, Yang C, Metaferia B, Tang S, Bane S, Ravindra R, Shanker N, Alcaraz AA, Johnson SA, Schaefer J, O’Connor RD, Cegelski L, Snyder JP, Кингстон DGI. J Am Chem Soc. 2007;129:361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Am Chem Soc. 2007;129:361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
158. Lowe J, Li H, Downing KH, Nogales E. J Mol Biol. 2001; 313:1045. [PubMed] [Google Scholar]
159. Sun L, Simmerling C, Ojima I. ChemMedChem. 2009; 4:719. [Бесплатная статья PMC] [PubMed] [Google Scholar]
160. Одзима И., Кузнецова Л.В., Сун Л. В кн.: Текущая фторорганическая химия. Новые синтетические направления, технологии, материалы и биологические приложения; Симптом АКС. сер. 949. Солошонок В., Миками К., Ямадзаки Т., Уэлч Дж. Т., Хонек Дж., редакторы. Американское химическое общество/издательство Оксфордского университета; Вашингтон, округ Колумбия: 2007. с. 288. [Google Академия]
161. Jaracz S, Chen J, Kuznetsova L, Ojima I. Bioorg Med Chem. 2005;13:5043. [PubMed] [Google Scholar]
162. Фарохзад О.К., Ченг Дж., Теплый Б.А., Шерифи И., Джон С., Кантофф П.В., Ричи Дж.П., Лангер Р. Прок, Национальная академия наук США. 2006;103:6315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
163. Chu TC, Marks JW, III, Lavery LA, Faulkner S, Rosenblum MG, Ellington AD, Matthew Levy M. Cancer Res. 2006;66:5989. [PubMed] [Google Scholar]
Chu TC, Marks JW, III, Lavery LA, Faulkner S, Rosenblum MG, Ellington AD, Matthew Levy M. Cancer Res. 2006;66:5989. [PubMed] [Google Scholar]
164. Ducry L, Stump B. Bioconjugate Chem. 2010;21:5. [PubMed] [Академия Google]
165. Xia W, Low P. J Med Chem. 2010;53:6811. [PubMed] [Google Scholar]
166. Ojima I, Zuniga E, Berger W, Seitz J. Future Med Chem. 2012; 4:33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
167. Cobb S, Murphy C. J Fluorine Chem. 2009; 130:132. [Google Scholar]
168. Рейвич М., Куль Д., Вольф А., Гринберг Дж., Фелпс М., Идо Т., Казелла В., Фаулер Дж., Хоффман Э., Алави А., Сом П., Соколофф Л. Цирк. рез. 1979; 44:127. [PubMed] [Google Scholar]
169. Ametamey S, Honer M, Schubiger P. Chem Rev. 2008; 108:1501. [PubMed] [Академия Google]
170. Kimura Y, Simeon F, Atazawa HJ, Mozley P, Pike V, Innis R, Fugita M. Eur J Nucl Med Mol I. 2010; 37:1943. [Google Scholar]
171. Мейер Б., Манн Н., Льюис Дж., Миллиган Г. , Синклер А., Хоу П. Липиды. 2003; 38:391. [PubMed] [Google Scholar]
, Синклер А., Хоу П. Липиды. 2003; 38:391. [PubMed] [Google Scholar]
172. Sauer L, Dauchy R, Blask D. Cancer Res. 2000;60:5289. [PubMed] [Google Scholar]
173. Грамматикос С., Суббайя П., Виктор Т., Миллер В. Брит Дж. Рак. 1994;70:219. [Бесплатная статья PMC] [PubMed] [Google Scholar]
174. Bradley M, Webb N, Anthony F, Devanesan P, Wittman P, Hemamalini S, Chander M, Baker S, He L, Horowitz S, Swindell C. Clin Cancer Res. 2001;7:3229. [PubMed] [Google Scholar]
175. Seitz J, Ojima I. In: Доставка лекарств в онкологии — от концепций исследований к терапии рака. Kratz F, Senter P, Steinhagen H, редакторы. Том. 3. Вайлей-ВЧ; Вайнхайм: 2011. с. 1323. [Google Scholar]
176. Sparreboom A, Wolff A, Verweij J, Zabelina Y, van Zomeren DM, McIntire G, Swindell C, Donehower R, Baker S. Clin Cancer Res. 2003;9:151. [PubMed] [Google Scholar]
177. Kuznetsova L, Chen J, Sun X, Wu A, Pepe J, Veith P, Pera R, Bernacki R, Ojima I. Bioorg Med Chem Lett. 2006; 16:974.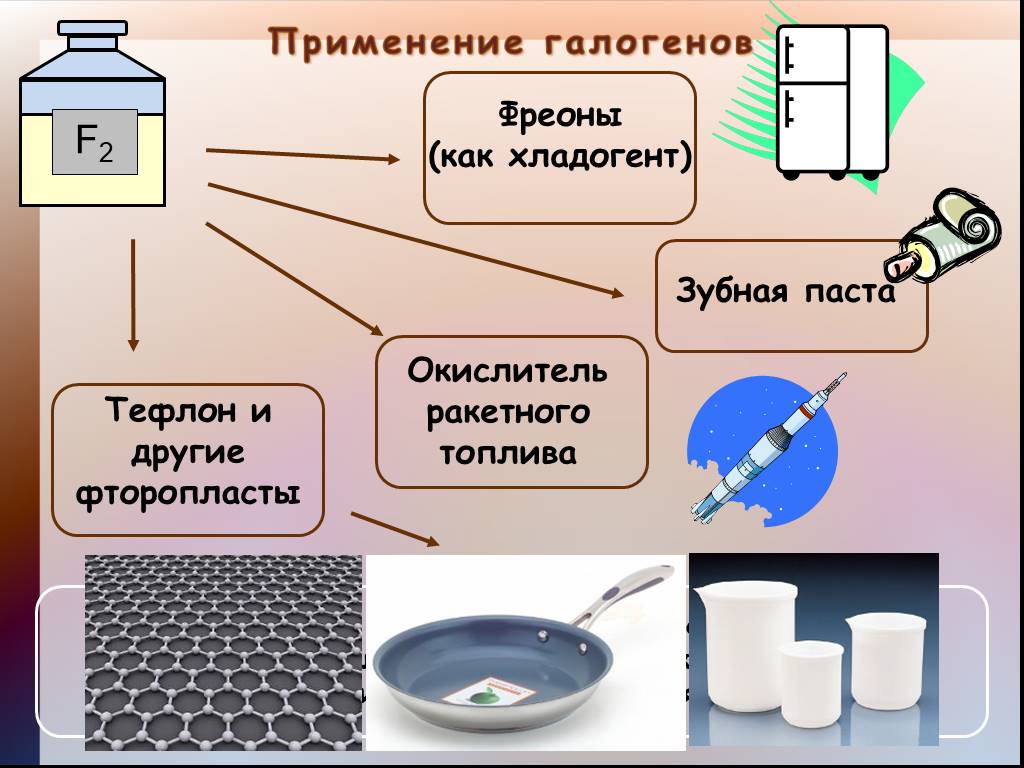 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
178. Chen J, Jaracz S, Zhao X, Chen S, Ojima I. Expert Opin Drug Deliv. 2005; 2:873. [PubMed] [Google Scholar]
179. Чари RVJ. Adv Drug Deliv Rev. 1998; 31:89. [PubMed] [Google Scholar]
180. Доронина С.О., Мендельсон Б.А., Бови Т.Д., Червени К.Г., Элли С.К., Мейер Д.Л., Офлазогу Э., Токи Б.Е., Сандерсон Р.Дж., Забински Р.Ф., Вал А.Ф., Сентер П.Д. Биоконъюгат хим. 2006; 17:114. [PubMed] [Академия Google]
181. Beck A, Haeuw JF, Wurch T, Goetsch L, Bailly C, Corvaia N. Discov Med. 2010;10:329. [PubMed] [Google Scholar]
182. Ojima I, Geng X, Wu X, Qu C, Borella C, Xie H, Wilhelm S, Leece B, Bartle L, Goldmacher V, Chari R. J Med Chem. 2002;45:5620. [PubMed] [Google Scholar]
183. Kigawa J, Minagawa Y, Kanamori Y, Itamochi H, Cheng X, Okada M, Oisho T, Terakawa N. Рак. 1998;82:697. [PubMed] [Google Scholar]
184. Chen J, Chen S, Zhao X, Kuznetsova L, Wong S, Ojima I. J Am Chem Soc. 2008;130:16778. [Бесплатная статья PMC] [PubMed] [Google Scholar]
185. Ojima I. Acc Chem Res. 2008;41:108. [PubMed] [Google Scholar]
Ojima I. Acc Chem Res. 2008;41:108. [PubMed] [Google Scholar]
186. Chen S, Zhao X, Chen J, Chen J, Kuznetsova L, Wong S, Ojima I. Bioconjugate Chem. 2010;21:979. [Бесплатная статья PMC] [PubMed] [Google Scholar]
187. Russell-Jones G, McTavish K, McEwan J, Rice J, Nowotnik D. J Inorg Biochem. 2004; 98:1625. [PubMed] [Google Scholar]
188. Leamon CP, Reddy JA. Adv Drug Deliv Rev. 2004; 56:1127. [PubMed] [Google Scholar]
189. Zempleni J. Ann Rev Nutr. 2005; 25:175. [PubMed] [Академия Google]
190. Zempleni J, Wijeratne S, Hassan Y. Biofactors. 2009;35:36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
191. Bianco A, Kostarelos K, Prato M. Curr Opin Chem Biol. 2005; 9:674. [PubMed] [Google Scholar]
192. Prato M, Kostarelos K, Bianco A. Acc Chem Res. 2008;41:60. [PubMed] [Google Scholar]
193. Gillies E, Frechet J. Drug Discov Today. 2005;10:35. [PubMed] [Google Scholar]
194. Gaertner H, Cerini F, Kamath A, Rochat AF, Siegrist CA, Menin L, Hartley O.