Электрофорез с лидазой в центре реабилитации Юсуповской больницы. Электрофорез по доступной цене в Москве
Содержание↓[показать]
Физиотерапевтические процедуры широко применяются в качестве дополнительного метода к основному лечению, а также в ходе реабилитации. К данной группе методов относится электрофорез с лидазой.
Данная методика применяется в клинике реабилитации Юсуповской больницы при лечении различных заболеваний. Доступная стоимость процедуры сочетается с профессионализмом специалистов и доброжелательным отношением персонала, что делает пребывание в Юсуповской больнице не только комфортным, но и полезным для организма.
Электрофорез лидазы: механизм действия
Специалисты, работающие в области эстетической медицины, сталкиваются с решением различных задач, наиболее трудоемкой из которых является работа со шрамами. Электрофорез с лидазой используется для лечения келоидных и гипертрофических рубцов. Данная процедура также используется для лечения гинекологических заболеваний.
Данная процедура также используется для лечения гинекологических заболеваний.
Механизм действия электрофореза основывается на влиянии на пораженные ткани и органы постоянным током малой величины, в результате чего в организме ускоряются обменные процессы, и происходит быстрая регенерация клеток. Лидаза является ферментом, под действием которого увеличивается проницаемость тканей, улучшается кровообращение и спадают отеки. Электрофорез позволяет доставлять действующее вещество лидазы через кожу. Данный способ не предполагает повреждения целостности кожи, однако он позволяет получить положительный результат.
Многие женщины, которым показана данная процедура, задают специалистам вопрос о том, безопасен и эффективен ли электрофорез с лидазой при месячных. В период менструации допускается использование данной процедуры, однако важно, чтобы участок воздействия был четко локализован.
Специалисты центра реабилитации Юсуповской больницы используют при проведении электрофореза с лидазой качественное европейское оборудование, отличающееся безопасностью и отсутствием неприятных ощущений. Важным преимуществом обращения в Юсуповскую больницу для прохождения курса процедур является доступная стоимость услуг, которая сочетается с профессионализмом врачей и уважительным отношением персонала.
Важным преимуществом обращения в Юсуповскую больницу для прохождения курса процедур является доступная стоимость услуг, которая сочетается с профессионализмом врачей и уважительным отношением персонала.
Электрофорез с лидазой: противопоказания
Перед проведением электрофореза с лидазой специалисты центра реабилитации Юсуповской больницы проводят комплексную диагностику, направленную на выявление возможных противопоказаний.
Основные противопоказания для проведения электрофореза с лидазой:
- заболевания и повреждения кожного покрова;
- злокачественные образования;
- повышенная температура тела;
- аллергическая реакция на лидазу;
- заболевания сердца и сосудов;
- бронхиальная астма;
- болезни эндокринной системы;
- туберкулез легких;
- высокая чувствительность к электрическим разрядам.
В период беременности и лактации использование данной процедуры также следует ограничить. Лидаза для электрофореза, цена которой является доступной, не доставляет неприятных ощущений, так и воздействие электрическим током, однако в данный период женщина является наиболее чувствительной и уязвимой.
В Юсуповской больнице работают опытные врачи-физиотерапевты, которые регулярно повышают свою квалификацию, поэтому при обращении в центр реабилитации пациенты могут быть уверены в том, что предоставляемые услуги соответствуют мировым стандартам качества.
Преимущества обращения в Юсуповскую больницу
Юсуповская больница является медицинским учреждением, в котором врачи соблюдают традиции внимательного и уважительного отношения к пациентам, а также оказывают широкий спектр медицинских услуг. Электрофорез с лидазой является одной из наиболее востребованных услуг в физиотерапии, поэтому специалисты центра реабилитации успешно ее проводят при обращении пациентов.
Многопрофильная Юсуповская больница обладает следующими преимуществами:
- высокий уровень услуг и обслуживания. Посещение Юсуповской больницы является комфортным и эффективным для каждого пациента. Опытные специалисты оказывают различные виды медицинских услуг, что позволяет работать даже с теми пациентами, от которых отказались в других клиниках;
- современное оборудование для лечения и диагностики.
 При проведении электрофореза используются аппараты европейского производства, которые регулярно проходят обслуживание;
При проведении электрофореза используются аппараты европейского производства, которые регулярно проходят обслуживание; - профессионализм сотрудников. В Юсуповской больнице работают боле 150 тщательно отобранных сотрудников, их которых 12 человек являются докторами наук, 36 сотрудников имеют кандидатскую степень;
- комфортные условия пребывания. Кабинеты в Юсуповской больнице оснащены удобной мебелью, беспроводным интернетом и необходимыми расходными материалами;
- информационное сопровождение каждого пациента.
Электрофорез с лидазой является одной из множества процедур, проводимых в клинике реабилитации. Для ее использования необходимо записаться на прием к врачу-физиотерапевту по телефону Юсуповской больницы.
ФИЗИОТЕРАПИЯ ДЛЯ КОСМЕТОЛОГИИ | Пансионат имени А.И. Майстренко
1.Лечение контрактур, келоидных, послеоперационных,
послеожоговых рубцов:
-Фонофорез с ферменколом или контратубексом или карипаин- кремом на область рубца. Контактно, лабильно.0,4-0,6 Вт/см2 ; на область лица 0,2-0,4 Вт/см2, режим непрерывный 15 минут, № 20
Контактно, лабильно.0,4-0,6 Вт/см2 ; на область лица 0,2-0,4 Вт/см2, режим непрерывный 15 минут, № 20
-Электрофорез Карипаина(+) 1 флакон Карипаина разводится в 5–10 мл физиологического раствора непосредственно перед процедурой. В раствор добавляется 2–3 капли Димексида. Раствор наносится на фильтровальную бумагу белого цвета, размещенную на прокладках электрода. Размеры электрода-прокладки 10 х 15 см. Сила тока 3-5 мА,Время 15-20 мин .Курс 20-30 процедур. В течении года 2-3 курса
-Электрофорез Лидазы(+) 64 Ед с кислотным буфером. Раствор наносится на фильтровальную бумагу белого цвета, размещенную на прокладках электрода. Сила тока 3-5 мА, Время 15-20 мин .Курс 20-30 процедур. В течении года 2-3 курса.
Между курсами рубец смазывается одним из дефиброзирующих средств.
-Лазеротерапия «РИКТА»
Для предупреждения образования рубцов, через 10 дней после снятия швов.
Обработка проводится на дистанции 0,5-1 см. Скорость сканирования 1 см в секунду. Начинать следует с воздействия на окружающие рану “здоровые” участки кожи, постепенно приближаясь к центру раны. Для усиления эффекта лечения лучше дополнительно проводить чрез кожное воздействие на кровь в регионе, максимально приближенном к зоне поражения.
Скорость сканирования 1 см в секунду. Начинать следует с воздействия на окружающие рану “здоровые” участки кожи, постепенно приближаясь к центру раны. Для усиления эффекта лечения лучше дополнительно проводить чрез кожное воздействие на кровь в регионе, максимально приближенном к зоне поражения.
Требуемое число процедур- до 7-10 на курс, по 1 процедуре в день. После каждой процедуры можно применять традиционные повязки. При неполном заживлении можно провести повторный курс с интервалом в 1 месяц.
2.ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ КОЖИ:
-Дарсонвализация. Методика дистантная лабильная. Грибовидный электрод на расстоянии 1-2 см медленными круговыми движениями перемещают вдоль морщин в направлении ото лба к спинке и крыльям носа и нижней челюсти, огибая угол рта и уплотнения тканей. Используют искровой разряд средней мощности. Продолжительность процедуры 5-12 минут. Ежедневно. По мере привыкания интенсивность и продолжительность увеличивается.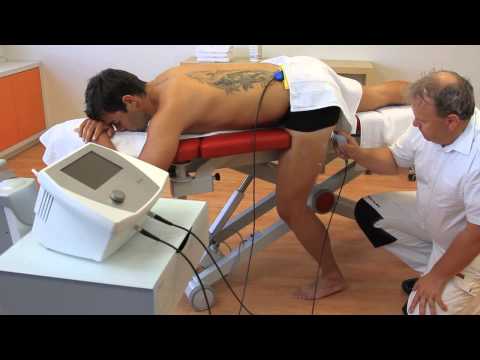 Курс 8-12 процедур. Повторный курс можно назначить через месяц.
Курс 8-12 процедур. Повторный курс можно назначить через месяц.
-Лазеротерапия «Рикта».
Косметические процедуры в области лица и шеи проводятся сканирующим методом вдоль линий на частоте 50 Гц.
Воздействие в области лица проводится в течение 10 минут, в области шеи 5 минут. Начинать сканирование необходимо с задней поверхности шеи по направлению к плечам и в область лопаток.
Следует обратить внимание на то, что при имеющемся заболевании щитовидной железы процедуры в области шеи противопоказаны.
Необходимо отметить, что все косметические процедуры нужно проводить на чистой, сухой коже до наложения кремов.
Противопоказано одновременное проведение лечения заболеваний волос и кожных покровов лица и шеи, т.к. общее время воздействия в области головы не должно превышать 10 минут.
-Витамин Е— электрофорез на область морщин. Один электрод размером 4х6 см смоченный в 0,5 мл 2% р-ра витамина Е , растворенного в 25% растворе ДМСО, помещают в области морщин на лице и соединяют с анодом (+), катод (-) размещают на заднешейный отдел. Сила тока 1-2 мА. Время 20 минут. Курс до 30 процедур. 2-3 раза в год.
Сила тока 1-2 мА. Время 20 минут. Курс до 30 процедур. 2-3 раза в год.
-Лидаза-электрофорез, используют полумаску Бергонье с вырезанной по форме фильтровальной бумагой. Смачивают раствором лидазы (+) (0,1 г на 30 мл дистиллированной воды ,подкисленной до рН 5,0-5,2) помещают на одну половину лица, под бумагу смоченную водой и отжатую прокладку. Сила тока 3-5 мА. Время процедуры 15 минут. На следующий день на другой половине лица. Курс 18-20 процедур.
3.ВЫПАДЕНИЕ ВОЛОС,АЛОПЕЦИЯ:
-Дарсонвализация волосистой части головы, Используют гребешковый электрод, контактно, лабильно от лба к затылку. Мощность малая. Ежедневно или через день. Курс 15-20 процедур.
-Электрофорез кальция хлорида 5% (+) на шейно-воротниковую зону. Катод (-) на поясничной области. Сила тока 3-5 мА, время 15 минут. №10-12 ежедневно.
—ЛАЗЕРОТЕРАПИЯ «Рикта»:
Лечение проводится сканирующими движениями со скоростью 1 см в секунду с максимальным приближением излучателя к поверхности кожных покровов волосистой части головы (1).
Оптимальным при этом является использование излучателя типа ДУШ-2 (лазерная расческа). На правление движений представлены на рисунке . Все время воздействия в области головы не должно превышать 10 минут. Частота воздействия 1000 Гц.
В качестве дополнительной терапии необходимо проводить неинвазивное воздействие на кровь в области пульсации сонных артерий (2) по 2 минуты с каждой стороны на частоте. Для достижения желаемого эффекта необходимо проведение 3-6 курсов терапии по 15 сеансов в каждом.
-Электрофорез никотиновой кислоты 1% (-) на шейно-воротниковую зону. Анод (+) на поясничной области. Сила тока 3-5 мА, время 15 минут. №10-12 ежедневно.
4. ПИОДЕРМИЯ,АКНЕ:
Не используют при остром и осложненном течении заболевания.
-КУФ — локальное облучение.С 1 биодозы +1/2 биодозы до 2 биодоз, № 5 через день.
-Лечение акне должно проходить параллельно с Универсальной Реабилитационной Программой (УРП), так как это заболевание чаще является следствием гормональной перестройки.
После проведения УРП осуществляется местное лечение сканирующим методом над пораженными участками на частоте 50 Гц. Время воздействия: лицо — до 10 минут, грудь — 10 минут, спина — 10 минут. Необходимо проводить от одного до трёх курсов по 10-12 сеансов.
Электрофорез — «Электрофорез с лидазой. Фото ДО и ПОСЛЕ. Рассасывающая терапия послеоперационного рубца, рассасывание гематомы, серомы и спаек. »
Мне сделали операцию, и если говорить честно, то не совсем удачно.
После операции я прошла, на мой взгляд, всё или почти все.
У меня было внутреннее кровотечение, температура 38,5, долгий воспалительный процесс и, как следствие, две гематомы по 50 мм перед мочевым пузырем, серома шва подапоневрозного пространства 60 мм. (После компрессов с йодицерином серома изменилась до 35 мм. и перестала уменьшаться).
В общем, целый букет неожиданных для меня последствий после полостной операции.
Следует отметить, что, кроме всего этого, треть шва у меня была выполнена топорно. Под этой третью как раз образовалась эта злополучная серома.
Под этой третью как раз образовалась эта злополучная серома.
Такое чувство, что хирург сильно захотел в туалет и поручил меня зашивать практиканту.
Кожа после операции нависала фартуком над этой частью шва, а также под швом, хотя я не толстая.
Кожа вокруг раны была очень отечная, болезненная и синяя, швы вместе с нитками, которыми меня зашили, были синими.
В общем, зрелище очень печальное.
Я принимала антибактериальную терапию, рассасывающие таблетки, но это ничего хорошего не дало.
После относительно успешной медикаментозной терапии врач мне порекомендовал электропроцедуры.
Честно говоря, я не очень верила в их эффект, но решила пройти путь лечения до конца, я была готова на все, чтоб себе помочь.
Начала я с фонофореза с гидрокортизоновой мазью, а также магнита.
После двух недель их применения узи не показало изменений.
Я прошла трехнедельный курс данной терапии.
После этого врач не хотела мне назначать новое лечение, мотивируя тем, что у меня слабое сердце, но душевная медсестра — замечательный человечек и опытный сотрудник с 35- летним стажем прям настояла на электрофорезе с лидазой.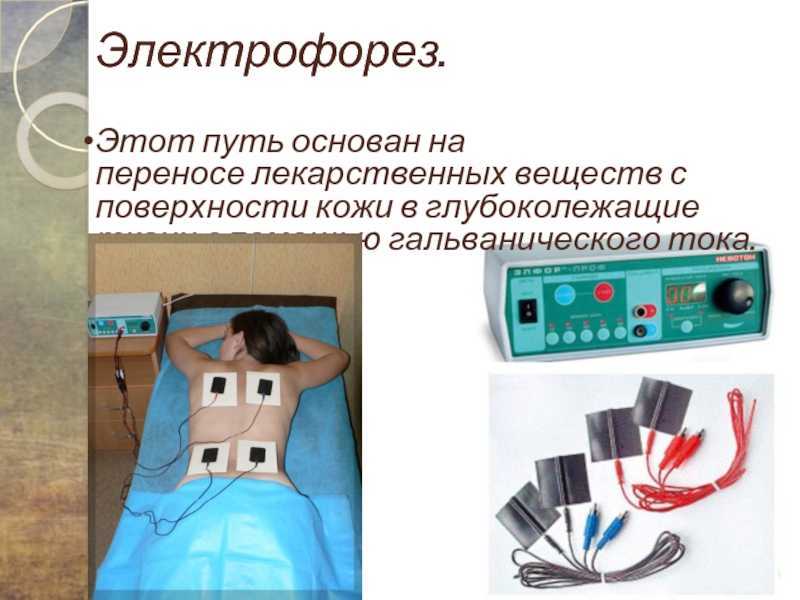
Я купила две пластинки с лидазой по пять флаконов в каждой, общей ценой в 175 гривен (450 руб).
Также понадобился буферный раствор для ее лучшего проникновения в кожу.
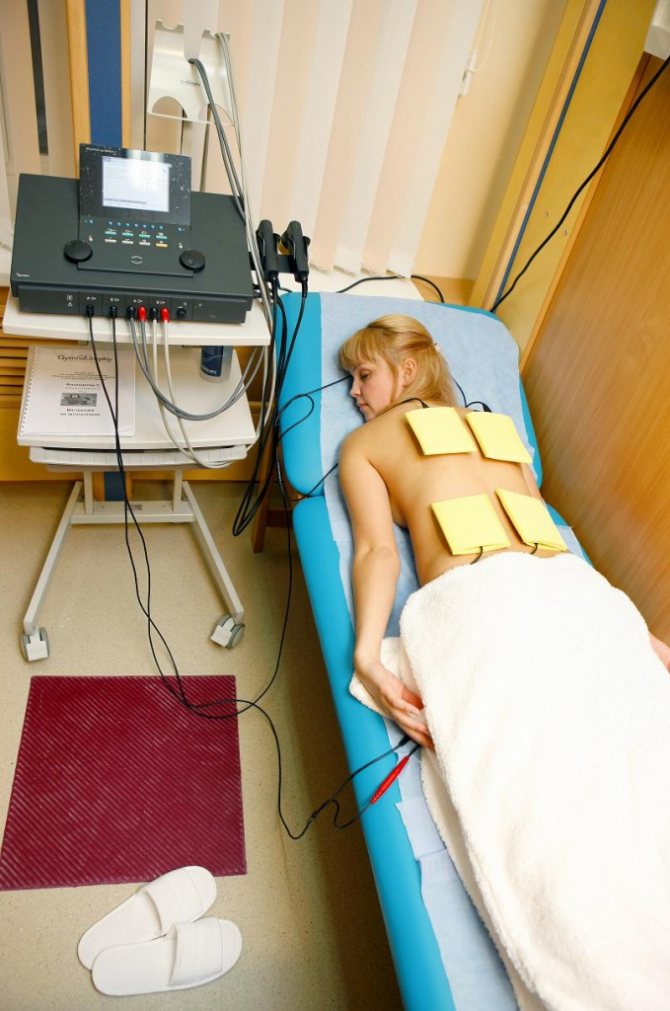
Для процедуры электрофорез с лидазой накладываются два влажных отреза байковой ткани и в них вкладываются электроды.
Плюс (+) на место, которое подлежит рассасыванию, а минус (-) под спину.
Лидаза смешивается с буферным раствором во флакончике и выливается на влажную ткань с электродом (+).
Аппарат подключается к сети.
Процедура длится 20 -30 минут, вторую часть процедур я проходила по 30 минут.
При подключении напряжения в местах наложения электродов должно чувствоваться легкое покалывание.
После процедуры желательно минут 15 отдохнуть, лежа, не выходя на холод.
Процедура проводится вот таким аппаратом.
Кушетка должна быть в меру жесткой, чтобы накладки под спиной не деформировалась.
Во время процедуры накладки прижимаются к телу подушками с песком.
Таким образом, я прошла 10 процедур ежедневно, с перерывами на выходных.
Параллельно я принимала Вот такие свечи
*********************************************************************
ИТОГ:
- Отечность около шва рассосалась.
- Нитки в шве рассосались досрочно и рубец стал розового цвета вместо синего, еще на протяжении курса с гидрокортизоном.
- Кожа над швом перестала нависать над ним и выровнялась, перестав напоминать нависающий фартук.
- Серома размером 35 мм под швом в подапоневрозном пространстве рассосалась.
- Гематома слева полностью рассосалась.
- Гематома справа из плотного круглого уплотнения размягчилась и изменилась на продолговатую форму, продолжаю наблюдать.
Вид шва до электропроцедур:
Шов на протяжении электропроцедур:
——————————————————————————————
После окончания электрофореза мой шов выглядит гладким, без бугров, синяков и отеков. Уплотнения, где были дренажи и наружные углубления в коже в виде спаек, разгладились.
Уплотнения, где были дренажи и наружные углубления в коже в виде спаек, разгладились.
Данная процедура способствует проникновению лекарства в глубокие слои кожи.
По опыту медсестры, электрофорез с лидазой эффективнее, чем инъекции с той же лидазой.
Хочу обратить внимание, что результат проявляется постепенно, а не сразу. Но он очевиден.
Я совсем не ожидала результата от электропроцедур.
Рада, что электрофорез с лидазой оказался эффективной рассасывающей терапией после операции.
Цена процедуры- благотворительный взнос в терминал больницы в размере 40 гривен за 10 процедур.
Рекомендую ли я электрофорез?
Конечно да.
Желаю вам никогда не болеть.
Пусть в вашей жизни встречаются только заботливые, добрые и душевные люди.
Вот здесь я делюсь опытом, как я избавилась от кист яичников (жми)
Параллельно мне назначили вот эти лекарства:
Свечи https://irecommend.ru/content/svechi-rektalnye-dis…
Рассасывающие таблетки
https://irecommend. ru/content/serrata-tabletki-dei…
ru/content/serrata-tabletki-dei…
https://irecommend.ru/content/mne-ponravilsya-1317 — очень эффективный пробиотик, который был назначен после операции.
https://irecommend.ru/content/flukonazol-teva-luch… — противогрибковое средство
Спасибо за Лайк 👍
Обработка NaCl на физико-биохимический обмен и накопление фенолов в проростках ячменя
. 2020 30 ноября; 331:127282.
doi: 10.1016/j.foodchem.2020.127282. Epub 2020 10 июня.
Миан Ван 1 , Юсюань Дин 1 , Цяоэ Ван 2 , Пей Ван 3 , Юнбин Хан 4 , Чжэньсинь Гу 5 , Жунцян Ян 6
Принадлежности
- 1 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика.

- 3 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу, 210095, Китайская Народная Республика. Электронный адрес: [email protected].
- 4 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика. Электронный адрес: [email protected].
- 5 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 6 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика. Электронный адрес: [email protected].
- PMID: 32559597
- DOI: 10.1016/ж.пищевая химия.2020.127282
Миан Ван и соавт. Пищевая хим. .
. 2020 30 ноября; 331:127282.

Авторы
Миан Ван 1 , Юсюань Дин 1 , Цяоэ Ван 2 , Пэй Ван 3 , Юнбин Хан 4 , Чжэньсинь Гу 5 , Жунцян Ян 6
Принадлежности
- 1 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика.
- 2 Пекинская ключевая лаборатория исследований и развития растительных ресурсов, Пекинский университет технологий и бизнеса, Пекин 100048, Китайская Народная Республика. Электронный адрес: wangqe@th.
 btbu.edu.cn.
btbu.edu.cn. - 3 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика. Электронный адрес: [email protected].
- 4 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика. Электронный адрес: [email protected].
- 5
- 6 Колледж пищевых наук и технологий, Нанкинский сельскохозяйственный университет, Нанкин, Цзянсу 210095, Китайская Народная Республика.
 Электронный адрес: [email protected].
Электронный адрес: [email protected].
- PMID: 32559597
- DOI: 10.1016/ж.пищевая химия.2020.127282
Абстрактный
Фенолы являются важными вторичными метаболитами растений с сильным антиоксидантным действием. Прорастание семян и экзогенная стимуляция могут активировать эндогенные ферменты для увеличения содержания фенолокислот и флавоноидов. Семена ячменя проращивали при обработке NaCl (1-20 мМ) для оценки накопления фенолов в этом исследовании. Результаты показали, что обработка NaCl значительно усиливала рост проростков, особенно длину бутонов. Обработка NaCl активировала экспрессию генов и белков фенилаланин-аммиаклиазы (PAL), циннамат-4-гидроксилазы (C4H) и 4-кумарат-КоА-лигазы (4CL), что привело к усилению их активности. В результате содержание фенолокислот и флавоноидов увеличилось на 11,19%.% и 32,54% соответственно, при этом больше всего пострадали галловая кислота, протокатехин, физетин, мирицетин и кверцетин. Кроме того, обработка NaCl повышала способность 2,2′-азино-бис(3-этилбензотиазолин-6-сульфоновой кислоты) (ABTS) и 1,1-дифенил-2-пикрилгидразила (DPPH) поглощать свободные радикалы. Следовательно, NaCl стимулировал синтез фенольных компонентов за счет усиления экспрессии генов, белков и активности ключевых ферментов.
В результате содержание фенолокислот и флавоноидов увеличилось на 11,19%.% и 32,54% соответственно, при этом больше всего пострадали галловая кислота, протокатехин, физетин, мирицетин и кверцетин. Кроме того, обработка NaCl повышала способность 2,2′-азино-бис(3-этилбензотиазолин-6-сульфоновой кислоты) (ABTS) и 1,1-дифенил-2-пикрилгидразила (DPPH) поглощать свободные радикалы. Следовательно, NaCl стимулировал синтез фенольных компонентов за счет усиления экспрессии генов, белков и активности ключевых ферментов.
Ключевые слова: флавоноиды; Метаболизм; обработка NaCl; Феноловая кислота.
Copyright © 2020 Elsevier Ltd. Все права защищены.
Заявление о конфликте интересов
Декларация о конкурирующих интересах Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье.
Похожие статьи
Стресс NaCl на физико-биохимический метаболизм и антиоксидантную способность пророщенного голозерного ячменя (Hordeum vulgare L.).
Ма И, Ван П, Чен З, Гу З, Ян Р. Ма Ю и др. J Sci Food Agric. 2019 15 марта; 99 (4): 1755-1764. doi: 10.1002/jsfa.9365. Epub 2018 30 октября. J Sci Food Agric. 2019. PMID: 30226277
Роль Ca 2+ в метаболизме фенольных соединений проростков ячменя (Hordeum vulgare L.) при стрессе NaCl.
Ма И, Ван П, Чжоу Т, Чен З, Гу З, Ян Р. Ма Ю и др. J Sci Food Agric. 201930 августа; 99 (11): 5176-5186. doi: 10.1002/jsfa.9764. Эпаб 2019 24 мая. J Sci Food Agric. 2019. PMID: 31021402
ГАМК усиливает физико-биохимический метаболизм и антиоксидантную способность пророщенного голозерного ячменя в условиях стресса NaCl.

Ма И, Ван П, Чен З, Гу З, Ян Р. Ма Ю и др. Дж. Физиол растений. 2018 дек; 231:192-201. doi: 10.1016/j.jplph.2018.09.015. Epub 2018 27 сентября. Дж. Физиол растений. 2018. PMID: 30278315
Общие полифенолы и биологическая активность семян и ростков некоторых бобовых.
Чон СУ. Чон СУ. Курр Фарм Дез. 2013;19(34):6112-24. дои: 10.2174/1381612811319340005. Курр Фарм Дез. 2013. PMID: 23448441 Обзор.
Специализированные фенольные соединения в семенах: строение, функции и регуляторы.
Corso M, Perreau F, Mouille G, Lepiniec L. Корсо М. и др. Растениевод. 2020 июль; 296:110471. doi: 10.1016/j.plantsci.2020.110471. Epub 2020 19 марта. Растениевод. 2020. PMID: 32540001 Обзор.

Посмотреть все похожие статьи
Цитируется
Комбинированный протеомный и метаболомный анализ молекулярного механизма, лежащего в основе реакции на солевой стресс при прорастании семян ячменя.
Chen Y, Wang J, Yao L, Li B, Ma X, Si E, Yang K, Li C, Shang X, Meng Y, Wang H. Чен Ю и др. Int J Mol Sci. 2022 10 сентября; 23(18):10515. дои: 10.3390/ijms231810515. Int J Mol Sci. 2022. PMID: 36142428 Бесплатная статья ЧВК.
Опосредованное CRISPRi подавление гена циннамат-4-гидроксилазы (C4H) усиливает биосинтез флавоноидов в Nicotiana tabacum .
Карлсон CKS, Мохд Нур С.Н., Халид Н., Тан Б.К. Карлсон CKS и др. Биология (Базель). 2022 27 июля; 11 (8): 1127.
 doi: 10.3390/biology11081127.
Биология (Базель). 2022.
PMID: 36009753
Бесплатная статья ЧВК.
doi: 10.3390/biology11081127.
Биология (Базель). 2022.
PMID: 36009753
Бесплатная статья ЧВК.Влияние γ-аминомасляной кислоты на метаболизм фенолов в проростках ячменя при обработке низким содержанием NaCl.
Ван М., Чжу И., Ван П., Гу З., Ян Р. Ван М и др. Антиоксиданты (Базель). 2021 сен 6;10(9)):1421. doi: 10.3390/antiox10091421. Антиоксиданты (Базель). 2021. PMID: 34573053 Бесплатная статья ЧВК.
термины MeSH
- 1
- Создать новую коллекцию
- Добавить в существующую коллекцию
- Моя библиография
- 1 Национальный институт здравоохранения и медицинских исследований, INSERM, подразделение 1037, Центр исследований и онкологии в Тулузе, CEDEX 1, 31 037 Тулуза, Франция.
- 2 Университет Тулузы III-Поль Сабатье, CEDEX 9, 31 062 Тулуза, Франция.

- PMID: 33198194
- PMCID: PMC7697007
- DOI: 10.3390/ijms21228515
- 1 Национальный институт здравоохранения и медицинских исследований, INSERM, подразделение 1037, Центр исследований и онкологии в Тулузе, CEDEX 1, 31 037 Тулуза, Франция.

- 2 Университет Тулузы III-Поль Сабатье, CEDEX 9, 31 062 Тулуза, Франция.
- PMID: 33198194
- PMCID: PMC7697007
- DOI: 10.3390/ijms21228515
Синдром Кларка-Барайцера связан с бессмысленным изменением аутосомного гена TRIP12.
Луи Р.Дж., Фриз М.Дж., Скиннер С., Барайтсер М., Кларк Р.Д., Шварц С.Е., Стивенсон Р.Е. Луи Р.Дж. и др. Am J Med Genet A. 2020 март; 182 (3): 595-596. doi: 10.1002/ajmg.a.61443. Epub 2019 8 декабря. Am J Med Genet A. 2020. PMID: 31814248 Аннотация недоступна.
Гаплонедостаточность гена убиквитин-протеинлигазы Е3 TRIP12 вызывает умственную отсталость с расстройствами аутистического спектра или без них, задержку речи и дисморфические черты.

Чжан Дж., Гамбин Т., Юань Б., Шафрански П., Розенфельд Дж. А., Балви М. А., Альсвайд А., Аль-Газали Л., Шамси А. М., Комара М., Али Б. Р., Родер Э., Маколи Л., Рой Д. С., Манчестер Д. К., Магулас П., Кинг Л.Е., Ханниг В., Бонно Д., Деномме-Пишон А.С., Шариф М., Беснар Т., Безье С., Конье Б., Андриё Дж., Чжу В., Хе В., Ветрини Ф., Уорд П.А., Чунг С.В., Би В., Энг CM, Lupski JR, Yang Y, Patel A, Lalani SR, Xia F, Stankiewicz P. Чжан Дж. и др. Хам Жене. 2017 Апрель; 136 (4): 377-386. doi: 10.1007/s00439-017-1763-1. Epub 2017 1 марта. Хам Жене. 2017. PMID: 28251352 Бесплатная статья ЧВК.
HECT-домен TRIP12 убиквитинирует субстраты пути деградации слияния убиквитина.
Пак Ю, Юн С.К., Юн Дж.Б. Парк Ю и др. Дж. Биол. Хим. 2009 16 января; 284 (3): 1540-9. doi: 10.1074/jbc.M807554200. Epub 2008 21 ноября. Дж. Биол.
 Хим. 2009.
PMID: 181
Хим. 2009.
PMID: 181Цереброфронтофациальный синдром Барайтсера-Винтера.
Yates TM, Turner CL, Firth HV, Berg J, Pilz DT. Йейтс ТМ и др. Клин Жене. 2017 июль;92(1):3-9. дои: 10.1111/cge.12864. Epub 2016 30 ноября. Клин Жене. 2017. PMID: 27625340 Обзор.
Дефицит CUL4B у людей: понимание клинических последствий нарушения функции убиквитинлигазы Cullin 4-RING E3.
Керцендорфер С., Харт Л., Колнаги Р., Карпентер Г., Алькантара Д., Аутвин Э., Карр А.М., О’Дрисколл М. Керцендорфер С. и соавт. Механическое старение Dev. 2011 авг;132(8-9): 366-73. doi: 10.1016/j.mad.2011.02.003. Epub 2011 23 февраля. Механическое старение Dev. 2011. PMID: 21352845 Обзор.
- Номура Н.
 , Нагасе Т., Миядзима Н., Сазука Т., Танака А., Сато С., Секи Н., Каварабаяси Ю., Исикава К.-И., Табата С. Прогнозирование кодирующих последовательностей неопознанного человека Гены. II. Кодирующие последовательности 40 новых генов (KIAA0041-KIAA0080), полученные путем анализа клонов кДНК из линии клеток человека KG-1. Рез. ДНК 1994;1:223–229. doi: 10.1093/dnares/1.5.223.
—
DOI
—
пабмед
, Нагасе Т., Миядзима Н., Сазука Т., Танака А., Сато С., Секи Н., Каварабаяси Ю., Исикава К.-И., Табата С. Прогнозирование кодирующих последовательностей неопознанного человека Гены. II. Кодирующие последовательности 40 новых генов (KIAA0041-KIAA0080), полученные путем анализа клонов кДНК из линии клеток человека KG-1. Рез. ДНК 1994;1:223–229. doi: 10.1093/dnares/1.5.223.
—
DOI
—
пабмед
- Номура Н.
- Хьюбрегтс Дж.М., Шеффнер М., Боденон С., Хоули П.М. Семейство белков, структурно и функционально связанных с убиквитин-протеинлигазой Е6-АР. проц. Натл. акад. науч. США. 1995;92:2563–2567.
 doi: 10.1073/pnas.92.7.2563.
—
DOI
—
ЧВК
—
пабмед
doi: 10.1073/pnas.92.7.2563.
—
DOI
—
ЧВК
—
пабмед
- Хьюбрегтс Дж.М., Шеффнер М., Боденон С., Хоули П.М. Семейство белков, структурно и функционально связанных с убиквитин-протеинлигазой Е6-АР. проц. Натл. акад. науч. США. 1995;92:2563–2567.
- Ли Дж.В., Чой Х.С., Гюрис Дж., Брент Р., Мур Д.Д. Два класса белков зависят от наличия или отсутствия гормона щитовидной железы для взаимодействия с рецептором гормона щитовидной железы. Мол. Эндокринол. 1995; 9: 243–254. — пабмед
- Пак Ю.
 , Юн С.К., Юн Дж.-Б. TRIP12 функционирует как убиквитинлигаза E3 APP-BP1. Биохим. Биофиз. Рез. коммун. 2008; 374: 294–298. doi: 10.1016/j.bbrc.2008.07.019.
—
DOI
—
пабмед
, Юн С.К., Юн Дж.-Б. TRIP12 функционирует как убиквитинлигаза E3 APP-BP1. Биохим. Биофиз. Рез. коммун. 2008; 374: 294–298. doi: 10.1016/j.bbrc.2008.07.019.
—
DOI
—
пабмед
- Пак Ю.
- Кадзиро М., Цучия М., Кавабэ Ю.-И., Фурумаи Р., Ивасаки Н., Хаяси Ю., Катано М., Накадзима Ю., Гото Н., Ватанабэ Т. и др. Активность убиквитинлигазы E3 Trip12 необходима для эмбриогенеза мыши. ПЛОС ОДИН. 2011;6:e25871. doi: 10.1371/journal.pone.0025871. — DOI — ЧВК — пабмед
- нет/Университет Тулузы III — Поль Сабатье
- нет / Ligue Contre le Cancer
- нет/Fondation Toulouse Cancer-Santé
- нет / Региональная лига борьбы с раком (комитет Верхняя Гаронна, комитет Арьеж)
- нет/Institut National de la Santé et de la Recherche Médicale
вещества
E3 Убиквитинлигаза TRIP12: регуляция, структура и физиопатологические функции
Сохранить цитату в файл
Формат: Резюме (текст) PubMedPMIDAbstract (текст) CSV
Добавить в коллекции
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? воскресеньепонедельниквторниксредачетвергпятницасуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Обзор
. 2020 12 ноября; 21 (22): 8515.
дои: 10. 3390/ijms21228515.
3390/ijms21228515.
Манон Брюне 1 2 , Клэр Варгас 1 2 , Дориан Ларьё 1 2 , Жером Торрисани 1 2 , Марлен Дюфрен 1 2
Принадлежности
Принадлежности
Бесплатная статья ЧВК
Обзор
Manon Brunet et al. Int J Mol Sci. .
Бесплатная статья ЧВК
. 2020 12 ноября; 21 (22): 8515.
дои: 10.3390/ijms21228515.
Авторы
Манон Брюне 1 2 , Клэр Варгас 1 2 , Дориан Ларьё 1 2 , Жером Торрисани 1 2 , Марлен Дюфрен 1 2
Принадлежности
Абстрактный
Белок 12, взаимодействующий с рецептором гормона щитовидной железы (TRIP12), принадлежит к 28-членному семейству убиквитинлигазы E3, гомологичной E6-AP C-концу (HECT). Впервые описанный как взаимодействующий с рецептором гормона щитовидной железы, биологическое значение TRIP12 было выявлено эмбриональной летальностью мышиной модели, несущей инактивирующую мутацию в гене TRIP12 . Дальнейшие исследования показали участие TRIP12 в регуляции основных биологических процессов, таких как прогрессирование клеточного цикла, репарация повреждений ДНК, ремоделирование хроматина и дифференцировка клеток путем убиквитин-опосредованной деградации ключевых белковых субстратов. Кроме того, сообщалось об изменениях экспрессии TRIP12 при раке, которые могут служить прогностическими маркерами терапевтического ответа. 9Ген 0374 TRIP12 также упоминается как причинный ген, связанный с интеллектуальными расстройствами, такими как синдром Кларка-Барайцера, и явно связан с расстройством аутистического спектра. Цель обзора — предоставить исчерпывающий и комплексный обзор различных аспектов TRIP12, начиная от его регуляции, молекулярных функций и физиопатологических последствий.
Дальнейшие исследования показали участие TRIP12 в регуляции основных биологических процессов, таких как прогрессирование клеточного цикла, репарация повреждений ДНК, ремоделирование хроматина и дифференцировка клеток путем убиквитин-опосредованной деградации ключевых белковых субстратов. Кроме того, сообщалось об изменениях экспрессии TRIP12 при раке, которые могут служить прогностическими маркерами терапевтического ответа. 9Ген 0374 TRIP12 также упоминается как причинный ген, связанный с интеллектуальными расстройствами, такими как синдром Кларка-Барайцера, и явно связан с расстройством аутистического спектра. Цель обзора — предоставить исчерпывающий и комплексный обзор различных аспектов TRIP12, начиная от его регуляции, молекулярных функций и физиопатологических последствий.
Ключевые слова: убиквитинлигаза Е3; ПОЕЗДКА12; раки; интеллектуальные расстройства.
Заявление о конфликте интересов
w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:p1=»http://pubmed.gov/pub-one»> Авторы заявляют об отсутствии конфликта интересов.Цифры
Рисунок 1
Схематическое изображение гормона щитовидной железы…
Рисунок 1
Схематическое изображение белка, взаимодействующего с рецептором гормона щитовидной железы 12 ( TRIP12 ) мРНК…
фигура 1 Схематическое изображение мРНК белка 12, взаимодействующего с рецептором гормона щитовидной железы ( TRIP12 ) (NM_004238.3) и белка TRIP12 (изоформа c, NP_004229.1) с функциональными доменами, ассоциированными с киназой фосфорилированными остатками и цистеиновым каталитическим сайтом (желтая звезда). UTR: нетранслируемая область, CDS: кодирующая последовательность, PAS: сигнал полиаденилирования, AAA: полиаденилированный хвост, ATG: инициирующий кодон трансляции, Stop: стоп-кодон трансляции, NLS: сигнал ядерной локализации, S: остаток серина, а.о.: амино кислота, IDR: внутренне неупорядоченные области, ARM: повторы Armadillo, HECT: гомологичны C-концу E6-AP.
UTR: нетранслируемая область, CDS: кодирующая последовательность, PAS: сигнал полиаденилирования, AAA: полиаденилированный хвост, ATG: инициирующий кодон трансляции, Stop: стоп-кодон трансляции, NLS: сигнал ядерной локализации, S: остаток серина, а.о.: амино кислота, IDR: внутренне неупорядоченные области, ARM: повторы Armadillo, HECT: гомологичны C-концу E6-AP.
Рисунок 2
Схематическое изображение кратного…
Рисунок 2
Схематическое изображение множественного выравнивания изоформ TRIP12 человека с использованием COBALT…
фигура 2 Схематическое изображение множественного выравнивания изоформ TRIP12 человека с использованием инструмента множественного выравнивания COBALT (см. Раздел «Программное обеспечение и базы данных»). Изоформа i TRIP12 (2068 а.о.) была определена как эталонная последовательность (мастер-последовательность). Две наиболее изученные изоформы b и c (и размер) выделены жирным шрифтом. Остатки, выделенные зеленым цветом, идентичны, а красным — разные. Различные домены TRIP12 указаны над выравниванием.
Изоформа i TRIP12 (2068 а.о.) была определена как эталонная последовательность (мастер-последовательность). Две наиболее изученные изоформы b и c (и размер) выделены жирным шрифтом. Остатки, выделенные зеленым цветом, идентичны, а красным — разные. Различные домены TRIP12 указаны над выравниванием.
Рисунок 3
Схематическое изображение белковых доменов…
Рисунок 3
Схематическое изображение белковых доменов в ортологах TRIP12. Границы домена были определены с помощью…
Рисунок 3 Схематическое изображение белковых доменов в ортологах TRIP12. Границы домена были определены с помощью анализа InterProScan. Процент идентичности определяли с помощью Emboss matcher (см. раздел Программное обеспечение и базы данных) попарного выравнивания последовательностей (используя Homo sapiens последовательность белка TRIP12 в качестве ссылки [43]).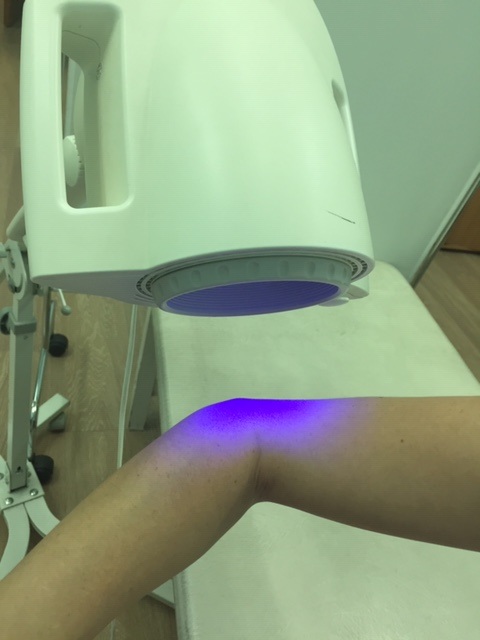 *: Последовательность кДНК Schmidtea mediterranea была скорректирована вручную для проведения анализа.
*: Последовательность кДНК Schmidtea mediterranea была скорректирована вручную для проведения анализа.
Рисунок 4
Посттрансляционные модификации TRIP12 (изоформа…
Рисунок 4
Посттрансляционные модификации TRIP12 (изоформа с), адаптированные из PhosphoSitePlus ® (см. раздел Программное обеспечение…
Рисунок 4 Посттрансляционные модификации TRIP12 (изоформа с), адаптированные из PhosphoSitePlus ® (см. Раздел Программное обеспечение и базы данных). Общее количество ссылок представляет собой количество записей, в которых этот сайт модификации был назначен с использованием масс-спектрометрии протеомного обнаружения и с использованием других методов. S означает серин, T означает треонин, Y означает тирозин, а K означает лизин.
Рисунок 5
Схематическое изображение человеческого взаимодействия с TRIP12…
Рисунок 5
Схематическое представление TRIP12-взаимодействующей белок-белковой сети человека ( n = 76) и функциональной…
Рисунок 5 Схематическое изображение белок-белковой сети человека, взаимодействующей с TRIP12 ( n = 76) и анализ функционального обогащения с использованием программного обеспечения STRING (см. раздел Программное обеспечение и базы данных). Узлы сети представляют белки. Красные узлы представляют белки, относящиеся к процессу метаболизма клеточных макромолекул (термин GO: 0044260), а фиолетовые узлы представляют белки, относящиеся к положительной регуляции процесса метаболизма соединений, содержащих азотистые основания (термин GO: 0045935). Края представляют собой белок-белковые молекулярные действия (указаны на рисунке). Форма линии указывает на прогнозируемый способ действия (указанный на рисунке). Источники активного взаимодействия: анализ текста, эксперименты, базы данных, совместное выражение, соседство и совместное возникновение. Минимальная требуемая оценка взаимодействия: средняя достоверность (0,400). Зеленые и оранжевые кружки обозначают белки, участвующие в «регуляции транскрипции» и «системе убиквитинирования/деубиквитинирования» соответственно.
Края представляют собой белок-белковые молекулярные действия (указаны на рисунке). Форма линии указывает на прогнозируемый способ действия (указанный на рисунке). Источники активного взаимодействия: анализ текста, эксперименты, базы данных, совместное выражение, соседство и совместное возникновение. Минимальная требуемая оценка взаимодействия: средняя достоверность (0,400). Зеленые и оранжевые кружки обозначают белки, участвующие в «регуляции транскрипции» и «системе убиквитинирования/деубиквитинирования» соответственно.
Рисунок 6
Схематическое изображение TRIP12, ARF,…
Рисунок 6
Схематическое изображение путей TRIP12, ARF и P53. Слева TRIP12 управляет…
Рисунок 6 Схематическое изображение путей TRIP12, ARF и P53. Слева TRIP12 контролирует ARF и косвенно деградацию убиквитинирования P53 протеасомой, в то время как TRIP12 участвует в развитии клеточного цикла [58,75,9].6,115]. Справа ARF защищен от TRIP12, когда он связан с нуклеофозмином (NPM)/нуклеостемином (NS) и локализован в ядрышке. Более того, в нуклеоплазме TRIP12 секвестрируется различными белками (в присутствии NS или TRADD и в условиях высокого уровня c-MYC), блокируя его взаимодействие с ARF. ARF связывает и ингибирует MDM2, что приводит к накоплению P53 и остановке клеточного цикла.
Слева TRIP12 контролирует ARF и косвенно деградацию убиквитинирования P53 протеасомой, в то время как TRIP12 участвует в развитии клеточного цикла [58,75,9].6,115]. Справа ARF защищен от TRIP12, когда он связан с нуклеофозмином (NPM)/нуклеостемином (NS) и локализован в ядрышке. Более того, в нуклеоплазме TRIP12 секвестрируется различными белками (в присутствии NS или TRADD и в условиях высокого уровня c-MYC), блокируя его взаимодействие с ARF. ARF связывает и ингибирует MDM2, что приводит к накоплению P53 и остановке клеточного цикла.
Рисунок 7
Схематическое изображение TRIP12 в…
Рисунок 7
Схематическое представление TRIP12 в пути репарации повреждений ДНК (DDR) в ответ…
Рисунок 7 Схематическое изображение TRIP12 в пути репарации повреждений ДНК (DDR) в ответ на двухцепочечный разрыв ДНК (DSB) [14,39,115,118,119,120,121]. В ответ на двухцепочечные разрывы (DSB) ATM, RNF8 и RNF168 рекрутируются на повреждение и запускают распространение убиквитинирования h3A и h3AX вдали от начальных повреждений ДНК. TRIP12 контролирует ядерный пул RNF168 для убиквитинирования хроматина после разрыва ДНК. Действительно, TRIP12 убиквитинирует и индуцирует деградацию RNF168 протеасомой. TRIP12 контролирует убиквитинирование убиквитин-специфической пептидазы 7 (USP7), что, в свою очередь, стабилизирует его.
В ответ на двухцепочечные разрывы (DSB) ATM, RNF8 и RNF168 рекрутируются на повреждение и запускают распространение убиквитинирования h3A и h3AX вдали от начальных повреждений ДНК. TRIP12 контролирует ядерный пул RNF168 для убиквитинирования хроматина после разрыва ДНК. Действительно, TRIP12 убиквитинирует и индуцирует деградацию RNF168 протеасомой. TRIP12 контролирует убиквитинирование убиквитин-специфической пептидазы 7 (USP7), что, в свою очередь, стабилизирует его.
Рисунок 8
Схематическое изображение опубликованного TRIP12…
Рисунок 8
Схематическое изображение опубликованных мутаций гена TRIP12 при интеллектуальных расстройствах. Мутации в синем…
Рисунок 8 Схематическое изображение опубликовано Мутации гена TRIP12 при интеллектуальных расстройствах. Мутации в синем цвете — это миссенс, мутации в оранжевом — нонсенс, мутации в черном — сдвиг рамки. Мутации, отмеченные зеленым цветом, расположены в донорных сайтах сплайсинга. Из [10,142,143,144,145].
Мутации в синем цвете — это миссенс, мутации в оранжевом — нонсенс, мутации в черном — сдвиг рамки. Мутации, отмеченные зеленым цветом, расположены в донорных сайтах сплайсинга. Из [10,142,143,144,145].
Рисунок 9
Изменения номера копии (CNA) и…
Рисунок 9
Изменения числа копий (CNA) и мутации Ген TRIP12 в раке человека…
Рисунок 9 Изменения числа копий (CNA) и мутации гена TRIP12 при раке человека в cBioPortal (см. раздел «Программное обеспечение и базы данных»), полученные из 176 неповторяющихся исследований, содержащих более 100 случаев как с мутациями, так и с данными CNA (27 235 пациентов и 28 253 образцы). Представлены только типы рака с более чем 1% измененных случаев.
Рисунок 10
Схематическое изображение мутаций на…
Рисунок 10
Схематическое изображение мутаций гена TRIP12 при раке человека в cBioPortal…
Рисунок 10 Схематическое изображение мутаций гена TRIP12 при раке человека в cBioPortal (см. Раздел «Программное обеспечение и базы данных»), полученное из 176 недублированных исследований, содержащих более 100 случаев как с мутациями, так и с данными CNA (27 235 пациентов и 28 253 образца). Кружки диаграммы мутаций окрашены в соответствии с соответствующими типами мутаций, указанными в легенде. В случае разных типов мутаций в одной позиции цвет кружка определяется относительно наиболее часто встречающегося типа мутации. Усеченные мутации включают бессмысленные, непрерывные, делецию со сдвигом рамки, вставку со сдвигом рамки и сайт сплайсинга. Мутации в кадре включают делецию внутри кадра и вставку в кадр.
Мутации в кадре включают делецию внутри кадра и вставку в кадр.
Рисунок 11
TRIP12 Уровень экспрессии мРНК в…
Рисунок 11
TRIP12 Уровень экспрессии мРНК при 27 различных типах рака адаптировано из Gepia2…
Рисунок 11 TRIP12 Уровень экспрессии мРНК при 27 различных типах рака адаптировано с веб-сайта Gepia2 (см. раздел Программное обеспечение и базы данных). Учитывались только совпадающие пары опухоль/нормальная ткань с более чем 25 случаями. Каждая точка представляет собой нормальный (зеленый) или опухолевый (красный) образец. Горизонтальная черная полоса представляет среднее значение. Уровень мРНК TRIP12 был получен с помощью секвенирования РНК и выражен в виде количества транскриптов на миллион (ТРМ). Типы рака, при которых мРНК TRIP12 статистически дифференциально экспрессируется (тест ANOVA со значением q <0,01), отмечены звездочкой.
Типы рака, при которых мРНК TRIP12 статистически дифференциально экспрессируется (тест ANOVA со значением q <0,01), отмечены звездочкой.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Посмотреть все похожие статьи
использованная литература
Типы публикаций
термины MeSH
вещества
Дополнительные понятия
Грантовая поддержка
Полнотекстовые ссылки
Многопрофильный институт цифровых публикаций (MDPI) Бесплатная статья ЧВК
Укажите
Формат: ААД АПА МДА НЛМ
Отправить по телефону
Убиквитинлигаза E3 TRIP12 | Энциклопедия MDPI
Белок 12, взаимодействующий с рецептором гормона щитовидной железы (TRIP12), принадлежит к семейству убиквитинлигазы Е3, состоящему из 28 членов, гомологичному С-концу E6-AP (HECT). Впервые описанный как взаимодействующий с рецептором гормона щитовидной железы, биологическое значение TRIP12 было выявлено в эмбриональной летальности мышиной модели, несущей инактивирующую мутацию в гене TRIP12. Дальнейшие исследования показали участие TRIP12 в регуляции основных биологических процессов, таких как прогрессирование клеточного цикла, репарация повреждений ДНК, ремоделирование хроматина и дифференцировка клеток путем убиквитин-опосредованной деградации ключевых белковых субстратов. Кроме того, сообщалось об изменениях экспрессии TRIP12 при раке, которые могут служить прогностическими маркерами терапевтического ответа. Ген TRIP12 также упоминается как причинный ген, связанный с интеллектуальными расстройствами, такими как синдром Кларка-Барайцера, и явно связан с расстройством аутистического спектра. Цель обзора — предоставить исчерпывающий и комплексный обзор различных аспектов TRIP12, начиная от его регуляции, молекулярных функций и физиопатологических последствий.
Впервые описанный как взаимодействующий с рецептором гормона щитовидной железы, биологическое значение TRIP12 было выявлено в эмбриональной летальности мышиной модели, несущей инактивирующую мутацию в гене TRIP12. Дальнейшие исследования показали участие TRIP12 в регуляции основных биологических процессов, таких как прогрессирование клеточного цикла, репарация повреждений ДНК, ремоделирование хроматина и дифференцировка клеток путем убиквитин-опосредованной деградации ключевых белковых субстратов. Кроме того, сообщалось об изменениях экспрессии TRIP12 при раке, которые могут служить прогностическими маркерами терапевтического ответа. Ген TRIP12 также упоминается как причинный ген, связанный с интеллектуальными расстройствами, такими как синдром Кларка-Барайцера, и явно связан с расстройством аутистического спектра. Цель обзора — предоставить исчерпывающий и комплексный обзор различных аспектов TRIP12, начиная от его регуляции, молекулярных функций и физиопатологических последствий.
 Введение
Введение Белок 12, взаимодействующий с рецептором гормона щитовидной железы, кДНК была клонирована из миелоидной клеточной линии человека KG-1 и названа неопознанным геном человека KIAA0045. Выведенная кодирующая последовательность KIAA0045 показала частичную идентичность последовательности белка UFD4 S. cerevisiae (Ubiquitin Fusion Degradation 4) [1] . В другом исследовании белок 12, взаимодействующий с рецептором тиреоидного гормона (TRIP12), был идентифицирован как член структурно и функционально родственной убиквитинлигазы E3 на основе идентификации домена, гомологичного карбоксильному концу белка, ассоциированного с E6 (домен HECT), который является белком, который индуцирует убиквитин-зависимую деградацию Р53 в присутствии белка Е6 из папилломавируса [2] .
TRIP12 позже был охарактеризован как белок, взаимодействующий с рецептором гормона щитовидной железы, с помощью системы взаимодействия дрожжей-ловушек для выделения белков, которые взаимодействуют с доменом связывания лиганда/димеризации/активации транскрипции крысиного TR-β1 (Thyroid Receptor-β1) [3 ] .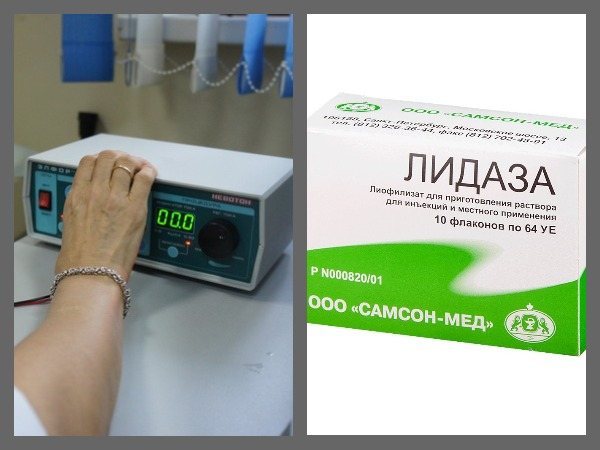 Было выделено пятнадцать кДНК, кодирующих белки, взаимодействующие с рецепторами гормонов щитовидной железы (TRIP). Все TRIP взаимодействовали с рецептором гормона щитовидной железы (TR), но только при наличии гормона щитовидной железы T3 (от TRIP1 до TRIP11) или только при отсутствии T3 (от TRIP12 до TRIP15). Белковые последовательности пятнадцати TRIP не родственны, но сходство последовательностей с известными белками и функциональными мотивами было обнаружено для девяти из них на основе анализа выравнивания бластов без демонстрации функциональной значимости. Было обнаружено, что последовательность TRIP12 демонстрирует 55% идентичность с С-концом E6-ассоциированного белка, и более чем через десять лет после его идентификации было продемонстрировано, что TRIP12 функционирует как убиквитинлигаза E3 9.0007 [4] . Позднее были предоставлены доказательства функциональной роли других белков TRIP (дополнительная таблица). Среди них TRIP12 является единственным членом семейства TRIP, обладающим активностью убиквитинлигазы E3.
Было выделено пятнадцать кДНК, кодирующих белки, взаимодействующие с рецепторами гормонов щитовидной железы (TRIP). Все TRIP взаимодействовали с рецептором гормона щитовидной железы (TR), но только при наличии гормона щитовидной железы T3 (от TRIP1 до TRIP11) или только при отсутствии T3 (от TRIP12 до TRIP15). Белковые последовательности пятнадцати TRIP не родственны, но сходство последовательностей с известными белками и функциональными мотивами было обнаружено для девяти из них на основе анализа выравнивания бластов без демонстрации функциональной значимости. Было обнаружено, что последовательность TRIP12 демонстрирует 55% идентичность с С-концом E6-ассоциированного белка, и более чем через десять лет после его идентификации было продемонстрировано, что TRIP12 функционирует как убиквитинлигаза E3 9.0007 [4] . Позднее были предоставлены доказательства функциональной роли других белков TRIP (дополнительная таблица). Среди них TRIP12 является единственным членом семейства TRIP, обладающим активностью убиквитинлигазы E3.
Биологическое значение TRIP12 было выявлено по эмбриональной летальности мышиной модели, несущей инактивирующую мутацию в гене TRIP12 [5] . Несколько молекулярных функций TRIP12 в важных клеточных процессах и сигнальных путях были продемонстрированы в последние годы. Накопленные данные указывают на то, что TRIP12 убиквитинирует ключевые белки для клеточного гомеостаза, регулирует экспрессию генов (см. раздел 5) и играет важную роль в развитии рака и неврологических заболеваний. На сегодняшний день в PubMed упоминается более 58 публикаций, связанных с TRIP12, половина из них — за последние 5 лет. Недавно мы внесли свой вклад в расширение знаний о роли TRIP12, обнаружив новый субстрат, необходимый для дифференцировки ацинарных клеток поджелудочной железы [6] и продемонстрировав, что TRIP12 является новым ассоциированным с хроматином белком, имеющим несколько значений для развития клеточного цикла и поддержания целостности генома [7] . Благодаря своему участию в нескольких важных физиологических и патологических процессах, TRIP12 в настоящее время представляет интерес для исследований молекулярных механизмов и в качестве потенциальной новой терапевтической мишени.
2. Функции TRIP12 в убиквитин-опосредованном протеолизе
Подробное описание процесса убиквитинирования, различных семейств убиквитинлигаз и функций прекрасно рассмотрено в другом месте [8] [9] [10] [11] . В этом разделе мы предоставим обзор важной информации о действиях TRIP12 в убиквитин-зависимых протеолитических путях.
2.1. Вездесущность
Убиквитинирование является важным процессом, требующим АТФ, ведущим к модификации белка путем ковалентной конъюгации убиквитина, который представляет собой высококонсервативный полипептид из 76 аминокислот (≈8,5 кДа) [9] . Хотя убиквитинирование наиболее известно тем, что направляет белки на деградацию с помощью протеасомы 26S, оно потенциально связано со всеми клеточными процессами. Каноническая конъюгация убиквитина включает присоединение С-концевого глицина 76 (G76) убиквитина (Ub) к ε-аминогруппе лизина на белковом субстрате. Субстраты могут быть модифицированы либо одним убиквитином на одном (моноубиквитинирование), либо несколькими сайтами (мульти-моноубиквитинирование), либо цепями убиквитина 9.0007 [11] . В случае поли(или мульти)цепей убиквитина С-конец G76 одной молекулы убиквитина связан с группой ε-NH 2 одного из семи лизинов (К6, К11, К27, К29, К33, К48). , или K63) предыдущего убиквитина. Цепи поли-Ub могут иметь различную длину и топологию, что приводит к различным последствиям для судьбы модифицированного белкового субстрата. Например, K48-связанное полиубиквитинирование запускает белки для протеолитического разрушения протеасомой, тогда как не-K48 связывает белки-мишени для различных клеточных функций и ответов [10] [11] .
Субстраты могут быть модифицированы либо одним убиквитином на одном (моноубиквитинирование), либо несколькими сайтами (мульти-моноубиквитинирование), либо цепями убиквитина 9.0007 [11] . В случае поли(или мульти)цепей убиквитина С-конец G76 одной молекулы убиквитина связан с группой ε-NH 2 одного из семи лизинов (К6, К11, К27, К29, К33, К48). , или K63) предыдущего убиквитина. Цепи поли-Ub могут иметь различную длину и топологию, что приводит к различным последствиям для судьбы модифицированного белкового субстрата. Например, K48-связанное полиубиквитинирование запускает белки для протеолитического разрушения протеасомой, тогда как не-K48 связывает белки-мишени для различных клеточных функций и ответов [10] [11] .
Убиквитинирование обеспечивается трехступенчатым согласованным действием трех ферментов. Ub-активирующий фермент (E1) катализирует образование тиол-эфирной связи между C-концевым лизином G76 Ub и активным остатком цистеина (C) E1; молекула убиквитина переносится на цистеин убиквитин-конъюгирующего фермента (Е2). Лигазы E3 подразделяются на три основных класса: RING (действительно интересный новый ген), RBR (RING-между RING-RING) и лигазы HECT. Для лигаз HECT и RBR E3 перенос Ub на лизин-аминогруппу субстрата включает тиоэфирное промежуточное соединение с консервативным цистеином в каталитическом сайте домена HECT или домена Rcat соответственно [8] . Лигазы RING E3 катализируют прямой перенос убиквитина от конъюгата E2-убиквитина, связанного тиоэфирной связью, к субстрату [8] . В некоторых случаях требуется взаимодействие дополнительной убиквитинлигазы Е4, которая может кодировать независимую активность лигазы или усиливать процессивность Е3. Чтобы действовать как катализаторы, E3 привлекают свои субстраты для деградации, распознавая определенную часть в последовательности белка или дегрон. Конъюгацию убиквитина можно отменить с помощью деубиквитинирующих ферментов (DUB) [12] .
Лигазы E3 подразделяются на три основных класса: RING (действительно интересный новый ген), RBR (RING-между RING-RING) и лигазы HECT. Для лигаз HECT и RBR E3 перенос Ub на лизин-аминогруппу субстрата включает тиоэфирное промежуточное соединение с консервативным цистеином в каталитическом сайте домена HECT или домена Rcat соответственно [8] . Лигазы RING E3 катализируют прямой перенос убиквитина от конъюгата E2-убиквитина, связанного тиоэфирной связью, к субстрату [8] . В некоторых случаях требуется взаимодействие дополнительной убиквитинлигазы Е4, которая может кодировать независимую активность лигазы или усиливать процессивность Е3. Чтобы действовать как катализаторы, E3 привлекают свои субстраты для деградации, распознавая определенную часть в последовательности белка или дегрон. Конъюгацию убиквитина можно отменить с помощью деубиквитинирующих ферментов (DUB) [12] .
2.2. Известные субстраты TRIP12
Согласно литературным данным, TRIP12 регулирует стабильность и способствует протеолизу девяти белковых субстратов: ASXL1 (Additional Sex Combs Like 1) [13] , USP7 (убиквитин-специфическая пептидаза 7) [14] Фактор транскрипции 1a) [6] , SOX6 (фактор транскрипции SRY-Box 6) [15] , RNF168 (белок безымянного пальца 168) [16] , BAF57 (BRG1-ассоциированный фактор 57), также известный как SMARCE1 (связанный с SWI/SNF, связанный с матрицей, актин-зависимый регулятор хроматина, подсемейство E, член 1) [17] , P14/ARF (P14/альтернативная рамка считывания), также известный как CDKN2A (ингибитор циклин-зависимой киназы 2A), для которого TRIP12 был назван ULF (убиквитинлигаза для ARF) [18] , APP-BP1 ( Амилоидный белок-связывающий белок 1), также известный как NAE1 (NEDD8-активирующий фермент E1, субъединица 1) [4] и PARP1 (поли-(АДФ-рибоза)полимераза 1) [19] . Эти белки выполняют важные функции в биологических и/или патологических процессах, которые будут описаны в разделе 5.
Эти белки выполняют важные функции в биологических и/или патологических процессах, которые будут описаны в разделе 5.
HECT-домен TRIP12 (подробно описанный в разделе 3.4) необходим для деградации этих белков, но роль TRIP12 как непосредственно взаимодействующей лигазы E3 все еще сомнительна для ASXL1 [13] и RNF168 [16] , для которых экспериментально подходы, доказывающие повсеместное распространение TRIP12, отсутствуют. TRIP12 полиубиквитинирует свои субстраты, за исключением APP-BP1, который моноубиквитинирован [4] . Полиубиквитинирование APP-BP1 требует дополнительной активности E4 [4] . Опосредованное TRIP12-K48-связанное полиубиквитинирование было продемонстрировано только для USP7 [14] и PTF1a [6] . В то время как взаимодействие между лигазой E3 и ее субстратами было подтверждено, домены взаимодействия TRIP12 были картированы лишь в нескольких случаях. Хотя в этих исследованиях использовались разные изоформы TRIP12, все они подчеркивали роль консенсусных доменов взаимодействия белок/белок TRIP12. За взаимодействие с APP-BP1 отвечает область (611–1259 а.о. изоформы с), включающая домен WWE, но не повторяющаяся ARM.0007 [4] . Последовательность из 577 а.о. (234–810 а.о. изоформы а), предшествующая доменам WWE, взаимодействует с USP7 [14] . Кроме того, TRIP12 взаимодействует с парилированным PARP1 через свой домен WWE (797–911 а.о. изоформы а). TRIP12 недавно рассматривается как идентифицированная PAR-направленная убиквитинлигаза (PTUbL), контролирующая оборот PARP1 [19] Наконец, мы продемонстрировали, что PTF1a связывает область, содержащую повторы ARM и домен WWE (446–1552 а.о. изоформы c) [19]. 6] .
За взаимодействие с APP-BP1 отвечает область (611–1259 а.о. изоформы с), включающая домен WWE, но не повторяющаяся ARM.0007 [4] . Последовательность из 577 а.о. (234–810 а.о. изоформы а), предшествующая доменам WWE, взаимодействует с USP7 [14] . Кроме того, TRIP12 взаимодействует с парилированным PARP1 через свой домен WWE (797–911 а.о. изоформы а). TRIP12 недавно рассматривается как идентифицированная PAR-направленная убиквитинлигаза (PTUbL), контролирующая оборот PARP1 [19] Наконец, мы продемонстрировали, что PTF1a связывает область, содержащую повторы ARM и домен WWE (446–1552 а.о. изоформы c) [19]. 6] .
Взаимодействующие домены или убиквитинированные остатки были идентифицированы для некоторых белков, регулируемых TRIP12. Было обнаружено, что последовательность из 80 а.о. внутри и по бокам центральной спиральной области BAF57 является критической для стабилизации BAF57 и содержит остатки лизина, необходимые для убиквитинирования [20] . N-концевая часть фактора, ассоциированного с рецептором фактора некроза опухоли (TRAF), также известного как домен гомологии меприна и TRAF-C (MATH) в USP7, отвечает за его взаимодействие с TRIP12 9 .0007 [14] . Мы обнаружили, что лизин 312 PTF1a необходим для его TRIP12-опосредованной деградации [6] . Ранее сообщалось, что опухолевой супрессор ARF представляет собой природный белок без лизина, который подвергается N-концевому полиубиквитинированию [21] .
N-концевая часть фактора, ассоциированного с рецептором фактора некроза опухоли (TRAF), также известного как домен гомологии меприна и TRAF-C (MATH) в USP7, отвечает за его взаимодействие с TRIP12 9 .0007 [14] . Мы обнаружили, что лизин 312 PTF1a необходим для его TRIP12-опосредованной деградации [6] . Ранее сообщалось, что опухолевой супрессор ARF представляет собой природный белок без лизина, который подвергается N-концевому полиубиквитинированию [21] .
Интересно, что TRIP12 нацеливается на несколько белков, которые не связаны со своими партнерами по физиологическому связыванию. Это относится к BAF57, который является субъединицей комплекса ремоделирования хроматина SWI/SNF (SWItch/Sucrose Non-Fermentable) (подробно описанного в разделе 5.4.) [17] . Большинство, если не все субъединицы SWI/SNF собраны в комплекс, для которого важно поддержание стехиометрии и в клетке не существует свободных субъединиц; в противном случае они деградируют. Стабилизация и защита BAF57 от деградации, опосредованной протеасомами, осуществляется посредством белок-белкового взаимодействия с субъединицей [22] BAF155. Было показано, что TRIP12 конкурирует с BAF155 за BAF57 и разрушает только несвязанную форму BAF57 [20] . Такой же тип взаимодействия был обнаружен для убиквитинирования субъединицы фермента неддилирования Е1 APP-BP1 9.0007 [4] . Фактически, TRIP12 не взаимодействует с APP-BP1 в гетеродимерной форме, связанной с Uba3 (убиквитин-подобный модификатор-активирующий фермент 3), который является специфически активным E1 пути NEDD8. Аналогичная схема описана для ARF, который стабилизируется и защищается от убиквитинирования TRIP12 при секвестрации нуклеофозмином и TRADD (NFR1-Associated Death Domain Protein) в ядрышке (подробно в разделе 5.2.) [18] [23] . Косвенные данные свидетельствуют об аналогичном механизме действия для деградации RNF168 [16] . Действительно, дестабилизация RNF168, вызванная молчанием его партнера по связыванию HERC2 (HECT и домен RLD, содержащий убиквитин-протеинлигазу E3 E3), может быть смягчена истощением TRIP12.
Стабилизация и защита BAF57 от деградации, опосредованной протеасомами, осуществляется посредством белок-белкового взаимодействия с субъединицей [22] BAF155. Было показано, что TRIP12 конкурирует с BAF155 за BAF57 и разрушает только несвязанную форму BAF57 [20] . Такой же тип взаимодействия был обнаружен для убиквитинирования субъединицы фермента неддилирования Е1 APP-BP1 9.0007 [4] . Фактически, TRIP12 не взаимодействует с APP-BP1 в гетеродимерной форме, связанной с Uba3 (убиквитин-подобный модификатор-активирующий фермент 3), который является специфически активным E1 пути NEDD8. Аналогичная схема описана для ARF, который стабилизируется и защищается от убиквитинирования TRIP12 при секвестрации нуклеофозмином и TRADD (NFR1-Associated Death Domain Protein) в ядрышке (подробно в разделе 5.2.) [18] [23] . Косвенные данные свидетельствуют об аналогичном механизме действия для деградации RNF168 [16] . Действительно, дестабилизация RNF168, вызванная молчанием его партнера по связыванию HERC2 (HECT и домен RLD, содержащий убиквитин-протеинлигазу E3 E3), может быть смягчена истощением TRIP12. TRIP12-убиквитинированный лизин 312 PTF1a расположен рядом с доменом, взаимодействующим с RBP (супрессор голых млекопитающих), необходимым для транскрипционной активности PTF1a. Можно предположить, что свободный PTF1a может убиквитинироваться, тогда как связывание с RBP может предотвращать опосредованную TRIP12 деградацию PTF1a. Таким образом, TRIP12 выступает в качестве регулятора баланса между связанными и несвязанными формами своих белковых субстратов, чтобы поддерживать их в комплексных формах.
TRIP12-убиквитинированный лизин 312 PTF1a расположен рядом с доменом, взаимодействующим с RBP (супрессор голых млекопитающих), необходимым для транскрипционной активности PTF1a. Можно предположить, что свободный PTF1a может убиквитинироваться, тогда как связывание с RBP может предотвращать опосредованную TRIP12 деградацию PTF1a. Таким образом, TRIP12 выступает в качестве регулятора баланса между связанными и несвязанными формами своих белковых субстратов, чтобы поддерживать их в комплексных формах.
2.3. Роль TRIP12 в деградации слияния убиквитина и пути N-дегрона
TRIP12 является продолжением лигазы UFD4 HECT E3, которая катализирует убиквитинирование субстратов деградации слияния убиквитина (UFD) в дрожжах [24] . Эти субстраты представляют собой искусственные слитые белки, состоящие из N-концевой нерасщепляемой части убиквитина, которая действует как дегрон. Путь UFD заключается в полиубиквитинировании нерасщепляемого N-концевого убиквитина. Было показано, что TRIP12 опосредует деградацию аберрантной формы убиквитина, названной UBB 9.0007 +1 [25] . UBB +1 представляет собой физиологический субстрат UFD человека, полученный в результате делеции динуклеотида в мРНК гена убиквитина B. UBB +1 накапливается в головном мозге при нейродегенеративных заболеваниях [26] . Сообщалось, что HECT E3 HUWE1 (домен HECT, UBA и WWE, содержащий убиквитин-протеинлигазу 1 E3) взаимодействует с TRIP12 для деградации UBB +1 [27] . Хотя сохранение пути UFD от дрожжей к человеку свидетельствует о его важности для протеолиза в клетках, за исключением UBB +1 , других нативных субстратов не обнаружено. В большинстве исследований используются искусственные субстраты для конкретных приложений. В частности, усиление иммунного ответа после убиквитинирования антигенов УФО открывает интересные перспективы в разработке противоопухолевых вакцин [28] .
Было показано, что TRIP12 опосредует деградацию аберрантной формы убиквитина, названной UBB 9.0007 +1 [25] . UBB +1 представляет собой физиологический субстрат UFD человека, полученный в результате делеции динуклеотида в мРНК гена убиквитина B. UBB +1 накапливается в головном мозге при нейродегенеративных заболеваниях [26] . Сообщалось, что HECT E3 HUWE1 (домен HECT, UBA и WWE, содержащий убиквитин-протеинлигазу 1 E3) взаимодействует с TRIP12 для деградации UBB +1 [27] . Хотя сохранение пути UFD от дрожжей к человеку свидетельствует о его важности для протеолиза в клетках, за исключением UBB +1 , других нативных субстратов не обнаружено. В большинстве исследований используются искусственные субстраты для конкретных приложений. В частности, усиление иммунного ответа после убиквитинирования антигенов УФО открывает интересные перспективы в разработке противоопухолевых вакцин [28] .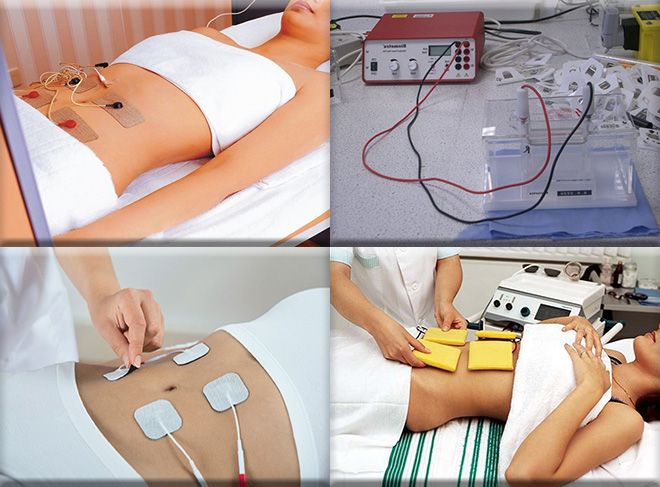
 При проведении электрофореза используются аппараты европейского производства, которые регулярно проходят обслуживание;
При проведении электрофореза используются аппараты европейского производства, которые регулярно проходят обслуживание;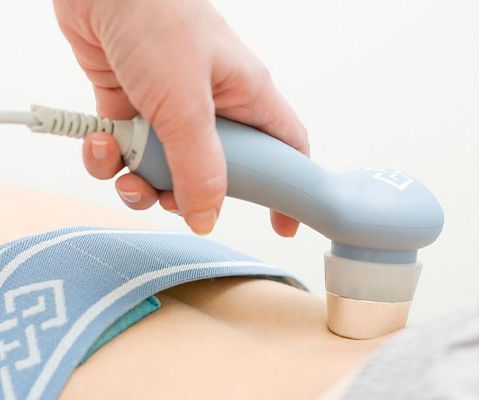
 Электронный адрес:
Электронный адрес:  btbu.edu.cn.
btbu.edu.cn. Электронный адрес:
Электронный адрес: 
 doi: 10.3390/biology11081127.
Биология (Базель). 2022.
PMID: 36009753
Бесплатная статья ЧВК.
doi: 10.3390/biology11081127.
Биология (Базель). 2022.
PMID: 36009753
Бесплатная статья ЧВК.


 Хим. 2009.
PMID: 181
Хим. 2009.
PMID: 181 , Нагасе Т., Миядзима Н., Сазука Т., Танака А., Сато С., Секи Н., Каварабаяси Ю., Исикава К.-И., Табата С. Прогнозирование кодирующих последовательностей неопознанного человека Гены. II. Кодирующие последовательности 40 новых генов (KIAA0041-KIAA0080), полученные путем анализа клонов кДНК из линии клеток человека KG-1. Рез. ДНК 1994;1:223–229. doi: 10.1093/dnares/1.5.223.
—
DOI
—
пабмед
, Нагасе Т., Миядзима Н., Сазука Т., Танака А., Сато С., Секи Н., Каварабаяси Ю., Исикава К.-И., Табата С. Прогнозирование кодирующих последовательностей неопознанного человека Гены. II. Кодирующие последовательности 40 новых генов (KIAA0041-KIAA0080), полученные путем анализа клонов кДНК из линии клеток человека KG-1. Рез. ДНК 1994;1:223–229. doi: 10.1093/dnares/1.5.223.
—
DOI
—
пабмед doi: 10.1073/pnas.92.7.2563.
—
DOI
—
ЧВК
—
пабмед
doi: 10.1073/pnas.92.7.2563.
—
DOI
—
ЧВК
—
пабмед , Юн С.К., Юн Дж.-Б. TRIP12 функционирует как убиквитинлигаза E3 APP-BP1. Биохим. Биофиз. Рез. коммун. 2008; 374: 294–298. doi: 10.1016/j.bbrc.2008.07.019.
—
DOI
—
пабмед
, Юн С.К., Юн Дж.-Б. TRIP12 функционирует как убиквитинлигаза E3 APP-BP1. Биохим. Биофиз. Рез. коммун. 2008; 374: 294–298. doi: 10.1016/j.bbrc.2008.07.019.
—
DOI
—
пабмед