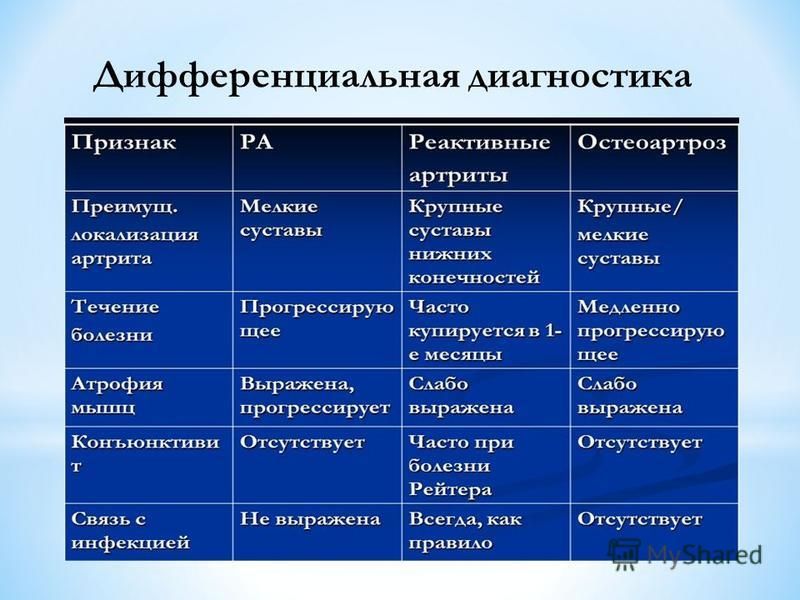
«Гастроэнтерологическая» ревматология: дифференциальная диагностика ранних артритов | Галушко
1. Насонов ЕЛ. Рекомендации EULAR по диагностике и лечению раннего артрита: 2016. Научно-практическая ревматология. 20)17;55(2):138-50. Doi: 10.14412/1995-4484-2017-138-150
2. Machado P, Castrejon I, Katchamart W, et al. Multinational evidence based recommendations on how to investigate and followup undifferentiated peripheral inflammatory arthritis: integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E Initiative. Ann Rheum Dis. 2011 Jan;70(1): 15-24. doi: 10.1136/ard.2010.130625. Epub 2010 Aug 19.
3. June RR, Aggarwal R. The use and abuse of diagnostic/classification criteria. Best Pract Res Clin Rheumatol. 2014 Dec;28(6):921-34. doi: 10.1016/j.berh.2015.04.004. Epub 2015 May 23.
4. Kuriya B, Cheng CK, Chen HM, et al. Validation of a prediction rule for development of rheumatoid arthritis in patients with early undifferentiated arthritis. Ann Rheum Dis. 2009 Sep;68(9):1482-5. doi: 10.1136/ard.2008.092676. Epub 2008 Nov 17.
Ann Rheum Dis. 2009 Sep;68(9):1482-5. doi: 10.1136/ard.2008.092676. Epub 2008 Nov 17.
5. Murav’ev YuV. Diagnostic and classification criteria in rheumatology: when should the criteria be used and how do they differ? Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2017;55(1):8-11. (In Russ.). doi: 10.14412/1995-4484-2017-8-11
6. Насонов ЕЛ, Гордеев АВ, Галушко ЕА. Ревматические заболевания и мультиморбидность. Терапевтический архив. 2015; 87(5):4-9.
7. Эрдес ШФ, Галушко ЕА. Медико-социальное значение патологии суставов и позвоночника среди взрослого населения РФ. Боль. 2009;(3):19-26.
8. Peluso R, DiMinno M, Iervolino S, et al. Enteropathic spondyloarthritis: from diagnosis to treatment. Clin Dev Immunol. 2013; 2013:631408. doi: 10.1155/2013/631408. Epub 2013 Apr 15.
9. Van Praet L, Jacques P, van den Bosch F, Elewaut D. The transition of acute to chronic bowel inflammation in spondyloarthritis. Nat Rev Rheumatol. 2012 Apr 17;8(5):288—95. doi:10.1038/nrrheum.2012.42
doi:10.1038/nrrheum.2012.42
10. Галушко ЕА, Гордеев АВ. Современный взгляд на патогенез спондилоартритов — молекулярные механизмы. Научно-практическая ревматология. 2015;53(3): 299-307. doi: 10.14412/1995-4484-2015-299-307
11. Белов БС, Шубин СВ, Балабанова РМ, Эрдес ШФ. Реактивные артриты. Научно-практическая ревматология. 2015;53(4): 414—20. doi: 10.14412/1995-4484-2015-414-420
12. Каратеев АЕ, Галушко ЕА. Поражение кишечника у больных спондилоартритами. Научно-практическая ревматология. 2015;53(2):190—9.. doi: 10.14412/1995-4484-2015-190-199
13. Галушко ЕА, Гордеев АВ. Концепция «болезни барьерного органа» в патогенезе спондилоартритов. Научно-практическая ревматология. 2016;54(2):199-205. doi: 10.14412/1995-4484-2016-199-205
14. Iqbal T, Zaidi MA, Wells GA, Karsh J. Celiac disease arthropathy and autoimmunity. J Gastroenterol Hepatol. 2013 Jan;28(1): 99-105. doi: 10.1111/j.1440-1746.2012.07272.x.
15. Lerner A, Matthias T. Rheumatoid arthritis-celiac disease relationship: joints get that gut feeling. Autoimmun Rev. 2015 Nov; 14(11):1038-47. doi: 10.1016/j.autrev.2015.07.007. Epub 2015 Jul 17.
Autoimmun Rev. 2015 Nov; 14(11):1038-47. doi: 10.1016/j.autrev.2015.07.007. Epub 2015 Jul 17.
16. Lerner A, Matthias T. Celiac disease: intestinal, heart and skin inter-connections. Int J Celiac Dis. 2015;(3):28—30.
17. Lerner А, Wusterhausen P, Ramesh A, et al. The Gut Feeling of the Joints: Celiac Disease and Rheumatoid Arthritis Are Related. Int J Celiac Dis. 2019;7(1):21-5.
18. Schuppan D, Zimmer KP. The diagnosis and treatment of celiac disease. Dtsch Arztebl Int. 2013 Dec 6;110(49):835-46. doi: 10.3238/arztebl.2013.0835.
19. Denham JM, Hill ID. Celiac disease and autoimmunity: review and controversies. Curr Allergy Asthma Rep. 2013 Aug;13(4):347-53. doi: 10.1007/s11882-013-0352-1.
20. Jutley G, Raza K, Buckley CD. New pathogenic insights into rheumatoid arthritis. Curr Opin Rheumatol. 2015 May; 27(3):249-55. doi: 10.1097/BOR.0000000000000174.
21. Magro F, Langner C, Driessen A, et al. European consensus on the histopathology of inflammatory bowel disease. JCrohns Colitis. 2013 Nov;7(10):827-51. doi: 10.1016/j.crohns.2013.06.001. Epub 2013 Jul 17.
JCrohns Colitis. 2013 Nov;7(10):827-51. doi: 10.1016/j.crohns.2013.06.001. Epub 2013 Jul 17.
22. Wollheim FA: Collagenous colitis and rheumatology. Curr Rheumatol Rep. 2000 Jun; 2(3):183-4.
23. Tysk C, Bohr J, Nyhlin N, et al. Diagnosis and management of microscopic colitis. World J Gastroenterol. 2008 Dec 28; 14(48):7280-8.
24. Delco F, Tchambaz L, Schlienger R, et al. Dose adjustment in patients with liver disease. Drug Saf. 2005;28(6):529-45.
25. Yang F, Wang Q, Jia J, Ma XJ. Autoimmune Hepatitis: East Meets West. J Gastroenterol Hepatol. 2015 Aug;30(8): 1230-6. doi: 10.1111/jgh.12952.
26. Gatselis NK, Zachou K, Koukoulis GK, Dalekos GN. Autoimmune hepatitis, one disease with many faces: etiopathogenetic, cliniclaboratory and histological characteristics. World J Gastroenterol. 2015 Jan 7;21(1): 60-83. doi: 10.3748/wjg.v21.i1.60.
27. Watt FE, James OF, Jones DE. Patterns of autoimmunity in primary biliary cirrhosis patients and their families: a population-based cohort study. QJM. 2004 Jul;97(7): 397-406.
QJM. 2004 Jul;97(7): 397-406.
28. Muratori L, Granito A, Muratori P, et al. Antimitochondrial antibodies and other antibodies in primary biliary cirrhosis: diagnostic and prognostic value. Clin Liver Dis. 2008 May; 12(2):261-76; vii. doi: 10.1016/j.cld.2008.02.009.
29. Kawata K, Kobayashi Y, Gershwin M, Bowlus CL. The Immunophysiology and Apoptosis of Biliary Epithelial Cells: Primary Biliary Cirrhosis and Primary Sclerosing Cholangitis. Clin Rev Allergy Immunol. 2012 Dec;43(3):230-41. doi: 10.1007/s12016-012-8324-0.
30. Lindor KD, Gershwin ME, Poupon R, et al. Primary biliary cirrhosis. Hepatology. 2009 Jul;50(1):291-308. doi: 10.1002/hep.22906.
31. Narvaez J, Bianchi MM, Santo P, et al. Pancreatitis, panniculitis, and polyarthritis. Semin Arthritis Rheum. 2010 Apr;39(5):417-23. doi: 10.1016/j.semarthrit.2008.10.001. Epub 2008 Dec 13.
32. Boswell SH, Baylin GJ. Metastatic fat necrosis and lytic bone lesions in a patient with painless acute pancreatitis. Radiology. 1973 Jan;106(1):85-6.
1973 Jan;106(1):85-6.
33. Ferri V, Ielpo B, Duran H, et al. Pancreatic disease, panniculitis, polyarthrtitis syndrome successfully treated with total pancreatectomy: Case report and literature review. Int J Surg Case Rep. 2016;28:223-226. doi: 10.1016/j.ijscr.2016.09.019. Epub 2016 Sep 28.
34. Егорова ОН, Белов БС, Пушкова ОВ, Раденска-Лоповок СГ. Панникулиты: проблемы дифференциальной диагностики. Научно-практическая ревматология. 2013;51(3):341—5. doi: 10.14412/1995-4484-2013-1511
35. Azar L, Chatterjee S, Schils J. Pancreatitis, polyarthritis and panniculitis syndrome. Joint Bone Spine. 2014 Mar;81(2): 184. doi: 10.1016/j.jbspin.2013.08.003. Epub 2013 Sep 27.
Дифференциальная диагностика артритов у детей
Modern pediatrics. Ukraine. 2019.5(101):112-122; doi 10.15574/SP.2019.101.112
Бойко Я. Е.
КНП Львовского областного совета «Западноукраинский специализированный детский медицинский центр», г. Львов, Украина
Львовский национальный медицинский университет имени Данила Галицкого, г. Львов, Украина
Львов, Украина
Для цитирования: Бойко ЯЕ. (2019). Дифференциальная диагностика артритов у детей. Современная педиатрия. Украина. 5(101): 112-122. doi 10.15574/SP.2019.101.112
Статья поступила в редакцию 11.04.2019 г., принята в печать 05.09.2019 г.
Артриты в детском возрасте развиваются не только при ревматическимих заболеваниях. Многие соматические болезни могут дебютировать появлением артрита или артралгии как неспецифического проявления заболевания. Также артрит может быть проявлением редкого генетического заболевания. Сложность диагностики этих болезней заключается в том, что ребенок не может самостоятельно выражать жалобы, поэтому клинический осмотр является ключевым в диагностике заболевания. В статье описаны основные принципы клинического анализа и диагностики артритов у детей. Представлены заболевания, которые зачастую являются их причиной: ревматические, онкологические, генетические и метаболические.
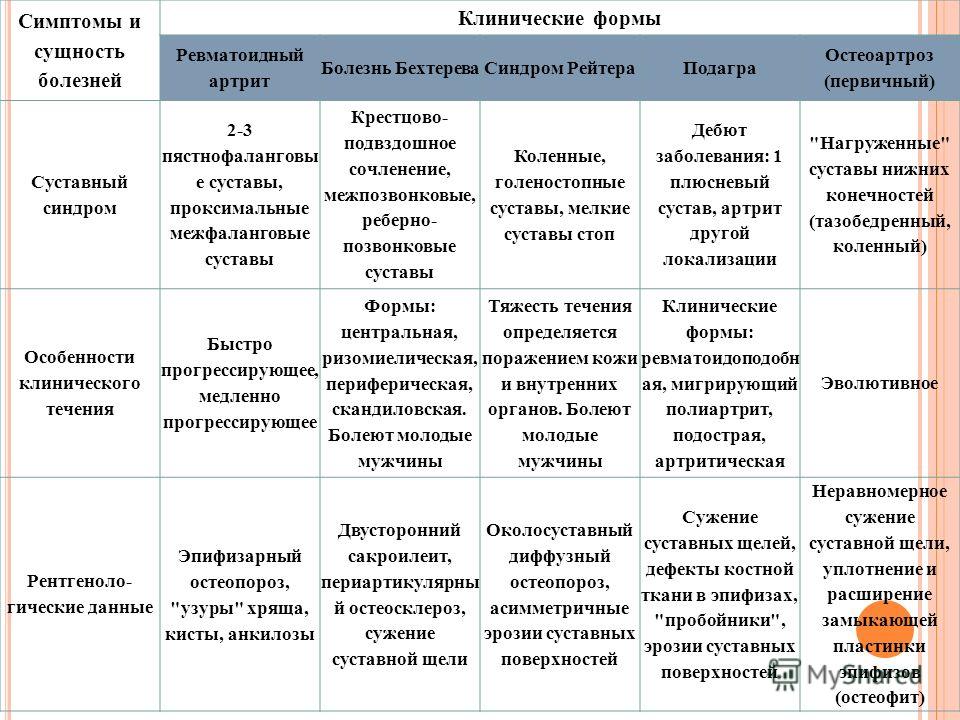 К болезням, которые проявляются артритом и связаны с другими органными/системными манифестациями, принадлежат системный ЮИА, системные аутоиммунные болезни и аутовоспалительные заболевания. 10–20% детей жалуются на хронические или рецидивирующие мышечно-скелетные боли невоспалительного происхождения. Наиболее частой их причиной является гипермобильность суставов, как следствие избыточного диапазона движений, которая часто наблюдается у здоровых детей. Термин «синдром гипермобильности суставов» употребляется при наличии гипермобильности суставов, сопровождающейся мышечно-суставными болями, не имеющими другой причины. «Боли роста» наблюдают у 6–49,4% детей в возрасте от 4 до 14 лет. Своевременный диагноз заболевания, вызывающего артрит, позволяет назначить правильное лечение и предупредить развитие последствий болезни.
К болезням, которые проявляются артритом и связаны с другими органными/системными манифестациями, принадлежат системный ЮИА, системные аутоиммунные болезни и аутовоспалительные заболевания. 10–20% детей жалуются на хронические или рецидивирующие мышечно-скелетные боли невоспалительного происхождения. Наиболее частой их причиной является гипермобильность суставов, как следствие избыточного диапазона движений, которая часто наблюдается у здоровых детей. Термин «синдром гипермобильности суставов» употребляется при наличии гипермобильности суставов, сопровождающейся мышечно-суставными болями, не имеющими другой причины. «Боли роста» наблюдают у 6–49,4% детей в возрасте от 4 до 14 лет. Своевременный диагноз заболевания, вызывающего артрит, позволяет назначить правильное лечение и предупредить развитие последствий болезни.Ключевые слова: артриты, дифференциальная диагностика, дети, заболевания, лечение.
ЛИТЕРАТУРА
1.
2. Botton E, Saraux A, Laselve H, Jousse S, Le Goff P. (2003). Musculoskeletal manifestations in cystic fibrosis. Joint Bone Spine. 70: 327—335. https://doi.org/10.1016/S1297-319X(03)00063-0
3. Bussone G, Mouthon L. (2009). Autoimmune manifestations in primary immune deficiencies. Autoimmun Rev. 8(4): 332—336. https://doi.org/10.1016/j.autrev.2008.11.004; PMid:19028607
4. Esposito S, Bosis S, Sabatini C, Tagliaferri L, Principi N. (2013). Borrelia burgdorferi infection and Lyme disease in children. Int J Infect Dis. 17: e153-e158. https://doi.org/10.1016/j.ijid.2012.09.014; PMid:23141587
5. Gewitz MH, Baltimore RS, Tani LY, Sable CA, Shulman ST, Carapetis J et al.; American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young.
6. Grahame R, Bird HA, Child A. (2000). The revised (Brighton 1998) criteria for the diagnosis of benign joint hypermobility syndrome (BJHS). J Rheumatol. 27(7): 1777—1779.
7. Ibba S, Piga M, Congia M, Cauli A, Mathieu A. (2016). Pachidermoperiostosis as a cause of massive joint effusion with polyarticular involvement mimicking juvenile idiopathic arthritis: A case report. Joint Bone Spine. 83(1): 113—114. https://doi.org/10.1016/j.jbspin.2015.03.001; PMid:26184532
8. Krause K, Feist E, Maurer M, Kallinich T. (2011). Cryopyrin-assoziierte periodische Syndrome (CAPS) — Prototypen autoinflammatorischer Erkrankungen. Kinder- und Jugendmedizin. 6: 349—357. https://doi.org/10.1055/s-0038-1629166
9. Lowe RM, Hashkes PJ. (2008). Growing pains: a noninflammatory pain syndrome of early Childhood. Nat Clin Pract Rheumatol. 4(10): 542—549. https://doi.org/10.1038/ncprheum0903; PMid:18762787
Lowe RM, Hashkes PJ. (2008). Growing pains: a noninflammatory pain syndrome of early Childhood. Nat Clin Pract Rheumatol. 4(10): 542—549. https://doi.org/10.1038/ncprheum0903; PMid:18762787
10. McErlane F, Gillon C, Irvine T, Davidson JE, Casson D, Dalzell AM, Beresford MW. (2008). Arthopathy in paediatric inflammatory bowel disease: a cross-sectional observational study. Rheumatol. 47: 1251—1252. https://doi.org/10.1093/rheumatology/ken217; PMid:18550638
11. Milner D, Fasth A, Etzioni A. (2008). Autoimmunity in severe combined immunodeficiency (SCID): lessons from patients and experimental models. J Clin Immunol. 28: S29—S33. https://doi.org/10.1007/s10875-007-9159-y; PMid:18193342
12. Morishita K, Petty RE. (2011). Musculoskeletal manifestations of mucopolysaccharidoses. Rheum (Oxford). 50(5): v19—25. https://doi.org/10.1093/rheumatology/ker397; PMid:22210666
13. Petty RE, Laxer RM, Lindsley CB, Wedderburn LR. (2015). Textbook of pediatric rheumatology, 7th edn. Philadelphia: Saunders: 739.
Philadelphia: Saunders: 739.
14. Rose CD, Wouters CH, Meiorin S, Doyle TM, Davey MP, Rosenbaum JT, Martin TM. (2006). Pediatric granulomatous arthritis: an international registry. Arthritis Rheum. 54: 3337—3344. https://doi.org/10.1002/art.22122; PMid:17009307
15. Viswanathan V, Khubchandani RP. (2008). Joint hypermobility and growing pains in children. Clin Exp Rheumatol. 26(5): 962—966.
Ювенильный идиопатический артрит: диагностика и дифференциальная диагностика
Korean J Pediatr. 2010 ноябрь; 53 (11): 931–935.
Опубликовано онлайн 2010 ноябрь 30. DOI: 10.3345/kjp.2010.53.11.931
, M.D. и, M.D.
Авторская информация Примечания Copyright и лицензионная информация о ответственности
Идиопатический идиопатический аритрит (JIA). гетерогенная группа, состоящая из нескольких подтипов заболеваний, характеризующихся началом артрита в возрасте до 16 лет и продолжительностью симптомов не менее 6 недель. Предыдущая классификация ЮИА включала семь различных категорий, тогда как нынешняя классификация была составлена Международной лигой Ассоциации ревматологов и заменила прежние термины «ювенильный хронический артрит» и «ювенильный ревматоидный артрит», использовавшиеся в Европе или Европе. Северная Америка, соответственно, с единой номенклатурой ЮИА. Как упоминалось выше, ЮИА определяется как артрит неизвестной этиологии, который проявляется в возрасте до 16 лет и сохраняется не менее 6 недель, при этом исключаются другие известные состояния. Клинические симптомы ЮИА могут быть весьма разнообразными. Некоторые симптомы, характерные для артрита, не обязательно являются диагностическими для ЮИА и могут иметь множественную этиологию, которую можно дифференцировать при тщательном изучении анамнеза пациента. Заболевание может развиваться в течение нескольких дней, а иногда и недель, что затрудняет постановку диагноза на момент постановки диагноза. Чтобы поставить клинический диагноз ЮИА, первым шагом является исключение артрита известной этиологии.
Предыдущая классификация ЮИА включала семь различных категорий, тогда как нынешняя классификация была составлена Международной лигой Ассоциации ревматологов и заменила прежние термины «ювенильный хронический артрит» и «ювенильный ревматоидный артрит», использовавшиеся в Европе или Европе. Северная Америка, соответственно, с единой номенклатурой ЮИА. Как упоминалось выше, ЮИА определяется как артрит неизвестной этиологии, который проявляется в возрасте до 16 лет и сохраняется не менее 6 недель, при этом исключаются другие известные состояния. Клинические симптомы ЮИА могут быть весьма разнообразными. Некоторые симптомы, характерные для артрита, не обязательно являются диагностическими для ЮИА и могут иметь множественную этиологию, которую можно дифференцировать при тщательном изучении анамнеза пациента. Заболевание может развиваться в течение нескольких дней, а иногда и недель, что затрудняет постановку диагноза на момент постановки диагноза. Чтобы поставить клинический диагноз ЮИА, первым шагом является исключение артрита известной этиологии. Следует отметить, что несвоевременное лечение из-за чрезмерной задержки диагностики может привести к серьезным повреждениям суставов и других органов и ухудшению созревания скелета. Таким образом, раннее выявление ЮИА имеет решающее значение для обеспечения быстрого лечения и предотвращения долгосрочных осложнений, включая вероятность инвалидности в детском возрасте.
Следует отметить, что несвоевременное лечение из-за чрезмерной задержки диагностики может привести к серьезным повреждениям суставов и других органов и ухудшению созревания скелета. Таким образом, раннее выявление ЮИА имеет решающее значение для обеспечения быстрого лечения и предотвращения долгосрочных осложнений, включая вероятность инвалидности в детском возрасте.
Ключевые слова: Артрит, ювенильный идиопатический, детский, Дифференциальный диагноз
Ювенильный идиопатический артрит (ЮИА) состоит из гетерогенной группы нескольких подтипов заболеваний, которые характеризуются дебютом артрита в возрасте до 16 лет с симптомами которые сохраняются более 6 недель. Возникновение хронического артрита у детей описано с 1800-х годов. Джордж Фредерик Стилл, английский педиатр, описал 22 ребенка из больницы для больных детей на Грейт-Ормонд-стрит с хроническим артритом1). До сих пор считается, что 12 из этих детей имели отличительные признаки ревматоидного артрита. После этого сообщения было описано много детей с ревматоидным артритом, и стало очевидным, что заболевание, которое мы теперь называем ЮИА или ювенильным ревматоидным артритом (ЮРА), является особенно непредсказуемой и гетерогенной группой заболеваний. Предыдущая классификация ЮИА описывала 7 категорий заболевания2), а используемая в настоящее время классификация была составлена Международной лигой ассоциаций ревматологов (ILAR). Согласно обновленной системе ILAR, прежние термины «ювенильный хронический артрит (ЮХА)» и «ЮРА», используемые в Европе или Северной Америке соответственно, заменены собирательным термином ЮИА. Более того, как упоминалось выше, эта система определяет ЮИА как артрит неизвестной этиологии, начинающийся в возрасте до 16 лет и сохраняющийся в течение не менее 6 недель, при исключении других известных состояний. Как следствие определения, ЮИА не диагностируется до 6 недель от начала заболевания, и окончательная классификация в одну из его 7 подгрупп обычно проводится через 6 месяцев2).
После этого сообщения было описано много детей с ревматоидным артритом, и стало очевидным, что заболевание, которое мы теперь называем ЮИА или ювенильным ревматоидным артритом (ЮРА), является особенно непредсказуемой и гетерогенной группой заболеваний. Предыдущая классификация ЮИА описывала 7 категорий заболевания2), а используемая в настоящее время классификация была составлена Международной лигой ассоциаций ревматологов (ILAR). Согласно обновленной системе ILAR, прежние термины «ювенильный хронический артрит (ЮХА)» и «ЮРА», используемые в Европе или Северной Америке соответственно, заменены собирательным термином ЮИА. Более того, как упоминалось выше, эта система определяет ЮИА как артрит неизвестной этиологии, начинающийся в возрасте до 16 лет и сохраняющийся в течение не менее 6 недель, при исключении других известных состояний. Как следствие определения, ЮИА не диагностируется до 6 недель от начала заболевания, и окончательная классификация в одну из его 7 подгрупп обычно проводится через 6 месяцев2).
Классификация ЮИА обеспечивает важную основу для его исследования, а также для помощи в определении соответствующего лечения и прогнозировании естественного анамнеза заболевания. Целью системы классификации ILAR для ЮИА является объяснение относительно однородных, взаимоисключающих категорий идиопатического артрита у детей на основе преобладающих клинико-лабораторных признаков2). Текущие категории ЮИА показаны на 2).
Таблица 1
Международная лига ревматологических ассоциаций (ILAR) Классификация ювенильного идиопатического артрита (ЮИА)2)
Открыть в отдельном окне
Одной из основных целей классификации ILAR является взаимное исключение подтипов. Таким образом, был определен следующий список возможных исключений для каждой категории:
а) Псориаз или псориаз в анамнезе у пациента или родственника первой степени родства.
b) Артрит у HLA-B27-положительного мужчины, начинающийся после шестилетнего возраста.
c) Анкилозирующий спондилоартрит, артрит, связанный с энтезитом, сакроилеит с воспалительным заболеванием кишечника или острый передний увеит или наличие в анамнезе одного из этих заболеваний у родственника первой степени родства.
d) Наличие ревматоидного фактора IgM и не менее двух раз с интервалом не менее 3 мес.
д) Наличие у больного системного ЮИА
РФ, ревматоидный фактор
1. Клиника и дифференциальная диагностика
Клиническая симптоматика ЮИА может быть вариабельной. Несколько симптомов, указывающих на артрит, не обязательно являются диагностическими для ЮИА и могут иметь множественную этиологию, которую можно дифференцировать при тщательном изучении анамнеза3). Полиартикулярная болезнь суставов имеет многофакторную этиологию и может проявляться вирусным заболеванием или быть началом хронического заболевания. При этом лежащий в ее основе этиологический процесс может быть инфекционным или постинфекционным с ревматологическим заболеванием или проявлением системного заболевания. Это заболевание может развиваться в течение нескольких дней, а иногда и недель, что затрудняет постановку диагноза на момент постановки диагноза4). Таким образом, для точной диагностики ЮИА первым шагом является исключение артрита известной этиологии4) (4).
Таблица 2
Дифференциальный диагноз ювенильного идиопатического артрита у детей
Открыть в отдельном окне
У ребенка с острым моноартритом дифференциальный диагноз должен включать септический артрит, травму и гематологические заболевания5). Кратковременный болезненный выпот в суставах может быть вызван травмой. Было высказано предположение, что ЮИА может быть наиболее частой причиной хронического олигоартрита. У ребенка с олигоартикулярным ЮИА пораженный сустав опухший и часто теплый, но обычно не очень болезненный, болезненный или красный5). Кроме того, если сустав очень болезненный и гиперемированный, или если у ребенка лихорадка, септический артрит, скорее всего, является правильным диагнозом6). Таким пациентам следует провести тест на быструю аспирацию суставов для исключения септического артрита и остеомиелита. Начало полиартрита у девочки предподросткового или подросткового возраста потенциально предполагает диагноз системной красной волчанки (СКВ).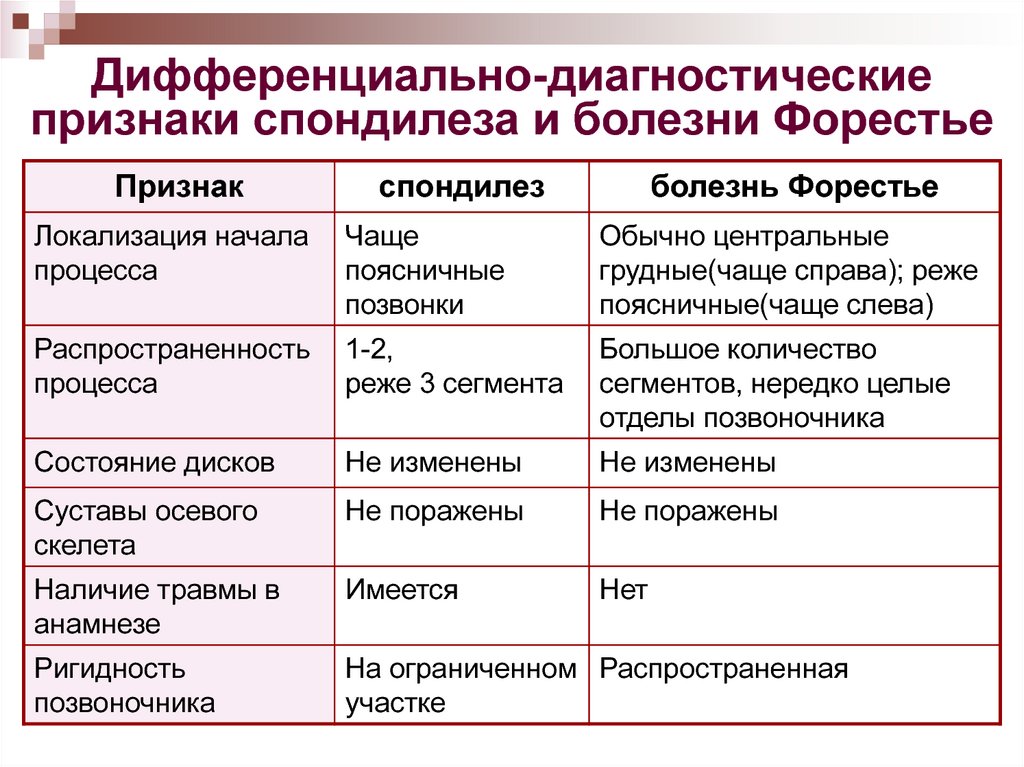 Артрит при СКВ может следовать за артритом при ЮИА, но без проведения серологических исследований его правильный диагноз может быть трудно поставить до тех пор, пока не будут обнаружены более характерные клинические симптомы СКВ.
Артрит при СКВ может следовать за артритом при ЮИА, но без проведения серологических исследований его правильный диагноз может быть трудно поставить до тех пор, пока не будут обнаружены более характерные клинические симптомы СКВ.
Дифференциальный диагноз у ребенка с подозрением на системный ЮИА часто затруднен, особенно в начале или на ранних стадиях заболевания, когда у ребенка может быть высокая лихорадка с признаками системного воспаления, но нет артрита или других специфических признаки, позволяющие поставить окончательный диагноз7). У детей с системным ЮИА вначале может быть заподозрено острое инфекционное заболевание или септицемия. Однако наличие артрита и/или ревматоидной сыпи помогает установить точный диагноз системного ЮИА. Напротив, лабораторные тесты могут иметь небольшое значение в диагностике системного ЮИА. Лихорадка у детей с инфекционными заболеваниями септического типа; этот тип лихорадки клинически более запутан и обычно не возвращается к исходному уровню каждый день, как это происходит при лихорадке, связанной с ЮИА.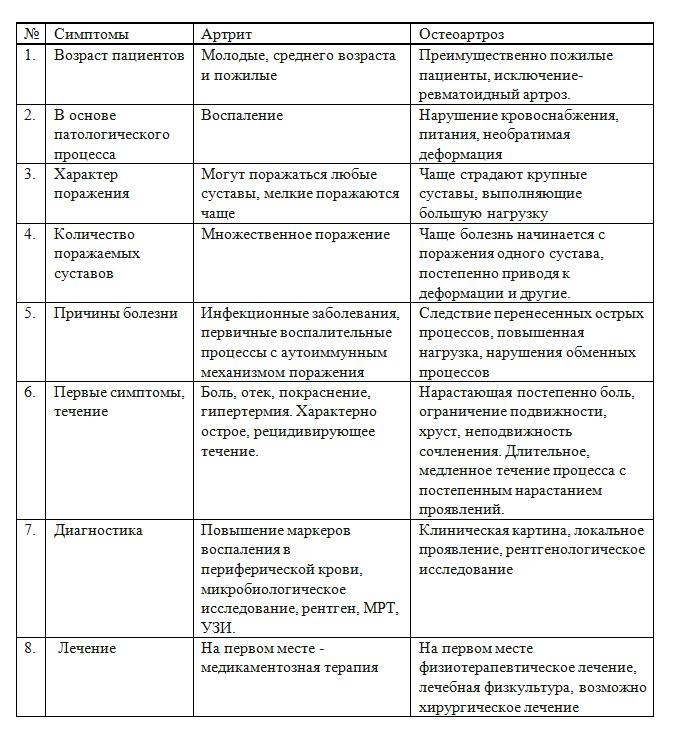 То есть диагностическим симптомом системного ЮИА является высокая лихорадка8), которая может возникать в любое время дня, но обычно появляется в конце дня или вечером в сочетании с сыпью. Напротив, температура человека, страдающего ЮИА, утром может быть ниже нормы. Более того, лихорадка, связанная с ЮИА, часто может сопровождаться ознобом. Дети обычно плохо себя чувствуют во время лихорадки, но на удивление чувствуют себя хорошо в течение остального дня.
То есть диагностическим симптомом системного ЮИА является высокая лихорадка8), которая может возникать в любое время дня, но обычно появляется в конце дня или вечером в сочетании с сыпью. Напротив, температура человека, страдающего ЮИА, утром может быть ниже нормы. Более того, лихорадка, связанная с ЮИА, часто может сопровождаться ознобом. Дети обычно плохо себя чувствуют во время лихорадки, но на удивление чувствуют себя хорошо в течение остального дня.
В нашем опыте обследования пациентов с подозрением на ЮИА с 1990 по 2000 г. 51 случай был исключен из других диагнозов, включая артрит, связанный с инфекцией (61%), злокачественные новообразования (6%), другие ревматологические заболевания (26%), и синдром иммунодефицита (4%)9).
2. Лабораторное обследование
Как вкратце упоминалось выше, диагноз ЮИА в основном является клиническим. Ни один лабораторный тест или комбинация исследований не могут подтвердить диагноз ЮИА. Тем не менее, лабораторные исследования могут быть использованы для подтверждения воспаления, поддержки клинического диагноза ЮИА, мониторинга токсичности терапии и лучшего понимания патогенеза заболевания.
Гематологические нарушения обычно отражают степень воспалительного заболевания. Полезные лабораторные исследования включают подсчет клеток крови (CBC) и маркеров воспаления, таких как скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ). Однако уровни СОЭ и СРБ при активном ЮИА вариабельны. В целом, СОЭ является полезной мерой активного заболевания в начале и во время последующих посещений ребенка с ЮИА, особенно при полиартикулярном или системном начале. Кроме того, СОЭ иногда помогает контролировать терапевтическую эффективность. Общий анализ крови может показать анемию хронического заболевания, если имело место длительное воспаление. ЮИА-ассоциированная анемия связана с хроническим заболеванием (низкий уровень железа в сыворотке крови, низкая общая железосвязывающая способность, достаточный запас гемосидерина), хотя дефицит железа также может играть важную роль. Установлено, что транспорт железа в плазме крови и количество железа, доступного для эритропоэза, снижается у лиц с системными заболеваниями.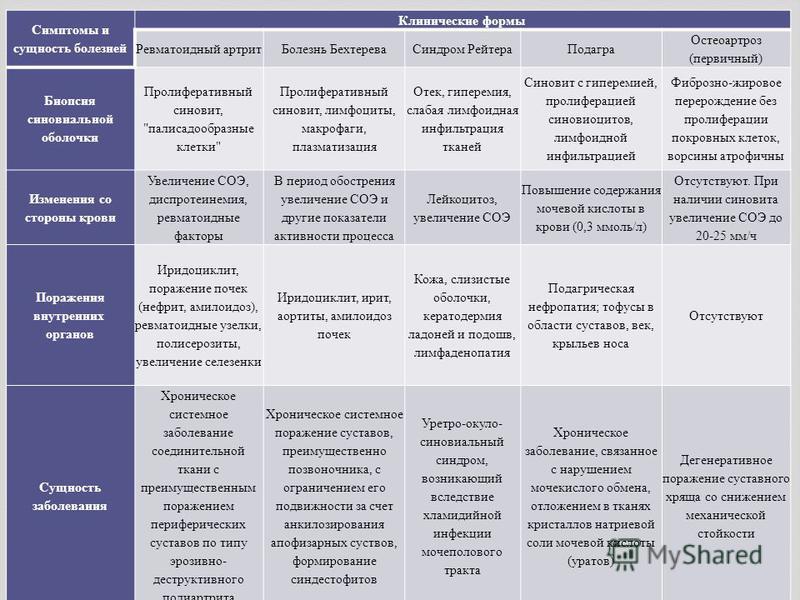 Лейкоцитоз часто встречается у детей с активным заболеванием, а количество тромбоцитов у них может резко возрасти в случаях тяжелого системного или полиартикулярного поражения5). Концентрации сывороточных иммуноглобулинов IgG, IgA и IgM ранее определяли у 200 пациентов с ювенильным ревматоидным артритом, у которых было выявлено нарушение распределения этих иммуноглобулинов при ЮИА10). Сообщается, что уровни иммуноглобулинов в сыворотке коррелируют с активностью заболевания и реакцией острой фазы10, 11).
Лейкоцитоз часто встречается у детей с активным заболеванием, а количество тромбоцитов у них может резко возрасти в случаях тяжелого системного или полиартикулярного поражения5). Концентрации сывороточных иммуноглобулинов IgG, IgA и IgM ранее определяли у 200 пациентов с ювенильным ревматоидным артритом, у которых было выявлено нарушение распределения этих иммуноглобулинов при ЮИА10). Сообщается, что уровни иммуноглобулинов в сыворотке коррелируют с активностью заболевания и реакцией острой фазы10, 11).
В исследовании диагностической ценности серологических исследований ревматоидного фактора (РФ) у детей было показано, что РФ-тесты, вероятно, будут положительными у детей как с ЮИА, так и с заболеваниями, отличными от ЮИА12). Таким образом, оценка ФР бесполезна в качестве диагностического инструмента для ЮИА. Однако дети с высокими титрами РФ, вероятно, представляют собой подгруппу, отличную от большего числа детей с серонегативным заболеванием. РЧ-тест следует проводить у пациентов с полиартритом, так как его наличие имеет прогностическое значение13). Наличие антиядерных антител (АНА) обуславливает риск развития бессимптомного увеита, особенно у лиц с олигоартикулярным началом заболевания, хотя оценка АНА должна проводиться у всех пациентов с ЮИА14, 15). Антитела к циклическому цитруллинированному пептиду (анти-ЦЦП) обычно не тестируются у пациентов с ЮИА, но могут указывать на тяжелое заболевание16). Человеческий лейкоцитарный антиген (HLA) B27 следует исследовать у детей с симптомами артрита, связанного с энтезитом, что может указывать на предрасположенность к развитию аксиального артрита. Кроме того, если есть опасения, что артрит является частью основного заболевания соединительной ткани или вакулита, то может быть полезно проверить уровни двухцепочечной ДНК, экстрагируемого ядерного антигена (ENA), C3, C4 и иммуноглобулина. Наконец, поскольку большинству ревматологических тестов не хватает желаемой специфичности, результаты всегда следует интерпретировать в контексте конкретного пациента4, 17, 18).
Наличие антиядерных антител (АНА) обуславливает риск развития бессимптомного увеита, особенно у лиц с олигоартикулярным началом заболевания, хотя оценка АНА должна проводиться у всех пациентов с ЮИА14, 15). Антитела к циклическому цитруллинированному пептиду (анти-ЦЦП) обычно не тестируются у пациентов с ЮИА, но могут указывать на тяжелое заболевание16). Человеческий лейкоцитарный антиген (HLA) B27 следует исследовать у детей с симптомами артрита, связанного с энтезитом, что может указывать на предрасположенность к развитию аксиального артрита. Кроме того, если есть опасения, что артрит является частью основного заболевания соединительной ткани или вакулита, то может быть полезно проверить уровни двухцепочечной ДНК, экстрагируемого ядерного антигена (ENA), C3, C4 и иммуноглобулина. Наконец, поскольку большинству ревматологических тестов не хватает желаемой специфичности, результаты всегда следует интерпретировать в контексте конкретного пациента4, 17, 18).
Обычные рентгенограммы являются наиболее доступным, быстрым и недорогим методом оценки сустава. Ультрасонография часто является лучшим способом выявления внутрисуставной жидкости, особенно в таких суставах, как тазобедренный и плечевой, где жидкость трудно обнаружить клинически19). Все более широкое использование стандартной магнитно-резонансной (МРТ) визуализации и достижения в области более функциональных методов МРТ за последнее десятилетие улучшили оценку заболеваний суставов при ЮИА. По сравнению с ультразвуковым исследованием или обычной рентгенографией, МРТ позволяет выявить воспалительные изменения в суставах и повреждение хрящей. МРТ также позволяет точно оценить более поздние проявления ЮИА, включая эрозии, потерю суставной щели, повреждение хрящей и поражение связок19., 20) (). Кроме того, сканирование костей с использованием технеция-99m также полезно для выявления ранней стадии воспалительного артрита21) (). К сожалению, в настоящее время ни один метод не отвечает всем требованиям визуализации, но методы выявления ЮИА значительно улучшаются22).
Ультрасонография часто является лучшим способом выявления внутрисуставной жидкости, особенно в таких суставах, как тазобедренный и плечевой, где жидкость трудно обнаружить клинически19). Все более широкое использование стандартной магнитно-резонансной (МРТ) визуализации и достижения в области более функциональных методов МРТ за последнее десятилетие улучшили оценку заболеваний суставов при ЮИА. По сравнению с ультразвуковым исследованием или обычной рентгенографией, МРТ позволяет выявить воспалительные изменения в суставах и повреждение хрящей. МРТ также позволяет точно оценить более поздние проявления ЮИА, включая эрозии, потерю суставной щели, повреждение хрящей и поражение связок19., 20) (). Кроме того, сканирование костей с использованием технеция-99m также полезно для выявления ранней стадии воспалительного артрита21) (). К сожалению, в настоящее время ни один метод не отвечает всем требованиям визуализации, но методы выявления ЮИА значительно улучшаются22).
Открыть в отдельном окне
Магнитно-резонансная томография пациента с ювенильным идиопатическим артритом показывает синовиальную пролиферацию и скопление выпота. Показано толстое заметное усиление вдоль синовиальной оболочки коленного сустава.
Показано толстое заметное усиление вдоль синовиальной оболочки коленного сустава.
Открыть в отдельном окне
Сканирование костей всего тела с использованием технеция-99м показывает повышенное поглощение кости в очагах поражения у пациента с ювенильным идиопатическим артритом.
ЮИА — наиболее распространенное ревматическое заболевание, поражающее детей и являющееся серьезной причиной как краткосрочной, так и долгосрочной инвалидности. В частности, ЮИА определяется как артрит неизвестной этиологии, и его диагностика требует клинического исключения других известных состояний. Чрезмерная задержка в назначении расширенного лечения ЮИА может привести к необратимому повреждению суставов и других органов и ухудшению созревания скелета. Таким образом, раннее выявление ЮИА имеет решающее значение для обеспечения его быстрого лечения и предотвращения отдаленных осложнений, включая вероятность инвалидизации в детском возрасте.
1. Еще ГФ. О форме хронической болезни суставов у детей. 1896. Clin Orthop Relat Res. 1990: 4–10. [PubMed] [Google Scholar]
1896. Clin Orthop Relat Res. 1990: 4–10. [PubMed] [Google Scholar]
2. Petty RE, Southwood TR, Manners P, Baum J, Glass DN, Goldenberg J, et al. Международная лига ревматологических ассоциаций, классификация ювенильного идиопатического артрита: вторая редакция, Эдмонтон, 2001. J Rheumatol. 2004; 31: 390–392. [PubMed] [Google Scholar]
3. Борос С., Уайтхед Б. Ювенильный идиопатический артрит. Врач Ауст Фам. 2010;39: 630–636. [PubMed] [Google Scholar]
4. Сингх С., Мехра С. Подход к полиартриту. Индийский J Педиатр. 2010;77:1005–1010. [PubMed] [Google Scholar]
5. Кэссиди Дж.Т., Петти Р.Э. Учебник детской ревматологии. 4-е изд. Филладельфия: У. Б. Сондерс; 2001. с. 258. [Google Scholar]
6. Fink CW, Dich VQ, Howard J, Jr, Nelson JD. Инфекции костей и суставов у детей. Ревмирующий артрит. 1977; 20: 578–583. [PubMed] [Google Scholar]
7. Миллер Л.С., Сиссон Б.А., Такер Л.Б., Шаллер Дж.Г. Продолжительные лихорадки неизвестного генеза у детей: формы проявления и исходы. J Педиатр. 1996;129:419–423. [PubMed] [Google Scholar]
J Педиатр. 1996;129:419–423. [PubMed] [Google Scholar]
8. McMinn FJ, Bywaters EG. Различия между лихорадкой при болезни Стилла и ревматической лихорадкой. Энн Реум Дис. 1959; 18: 293–297. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Kim DS. Ювенильный ревматоидный артрит. Корейский J Педиатр. 2007; 50:1173–1179. [Google Scholar]
10. Кэссиди Дж.Т., Петти Р.Э., Салливан Д.Б. Нарушения распределения концентрации иммуноглобулинов в сыворотке крови при ювенильном ревматоидном артрите. Джей Клин Инвест. 1973;52:1931–1936. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Hoyeraal HM, Mellbye OJ. Гуморальный иммунитет при ювенильном ревматоидном артрите. Энн Реум Дис. 1974; 33: 248–254. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Eichenfield AH, Athreya BH, Doughty RA, Cebul RD. Полезность ревматоидного фактора в диагностике ювенильного ревматоидного артрита. Педиатрия. 1986; 78: 480–484. [PubMed] [Google Scholar]
13. Shin YS, Choi JH, Nahm DH, Park HS, Cho JH, Suh CH. Ревматоидный фактор является маркером тяжести заболевания при корейском ревматоидном артрите. Yonsei Med J. 2005; 46: 464–470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Shin YS, Choi JH, Nahm DH, Park HS, Cho JH, Suh CH. Ревматоидный фактор является маркером тяжести заболевания при корейском ревматоидном артрите. Yonsei Med J. 2005; 46: 464–470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Петти Р.Э., Смит Дж.Р., Розенбаум Дж.Т. Артрит и увеит у детей. Взгляд детской ревматологии. Am J Офтальмол. 2003; 135: 879–884. [PubMed] [Google Scholar]
15. Shin JI, Kim KH, Chun JK, Lee TJ, Kim KJ, Kim HS и др. Распространенность и характер антиядерных антител у корейских детей с ювенильным идиопатическим артритом по критериям ILAR. Scand J Ревматол. 2008; 37: 348–351. [PubMed] [Google Scholar]
16. Kuna AT, Lamot L, Miler M, Harjacek M, Simundic AM, Vrkic N. Антитела к мутированному цитруллинированному виментину и антитела к циклическим цитруллинированным пептидам при ювенильном идиопатическом артрите. Clin Chem Lab Med. 2009 г.;47:1525–1530. [PubMed] [Google Scholar]
17. Kunnamo I, Kallio P, Pelkonen P, Hovi T. Клинические признаки и лабораторные тесты в дифференциальной диагностике артрита у детей.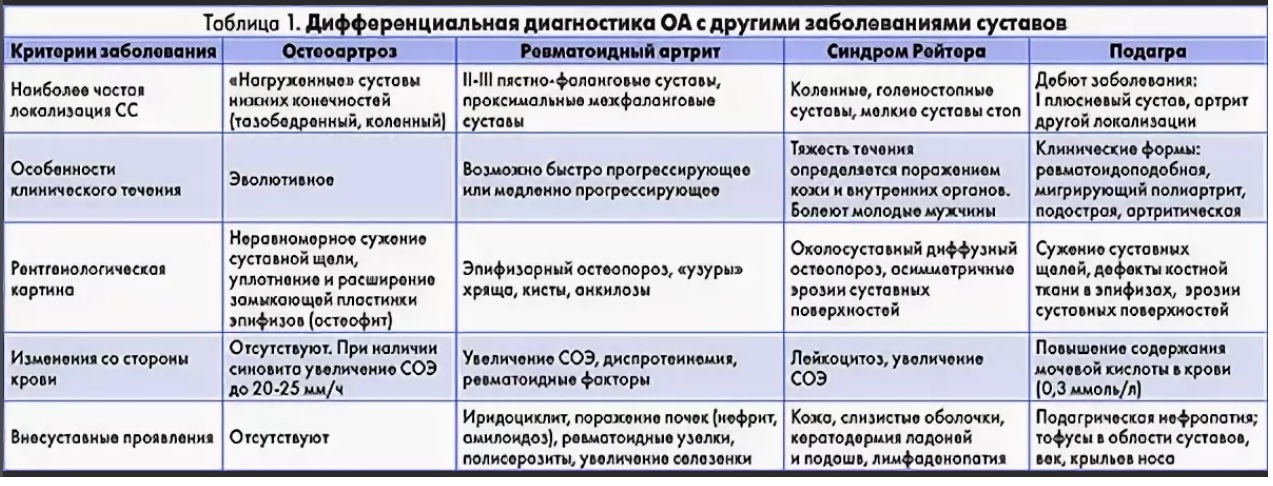 Am J Dis Чайлд. 1987; 141:34–40. [PubMed] [Google Scholar]
Am J Dis Чайлд. 1987; 141:34–40. [PubMed] [Google Scholar]
18. Aeschlimann A, Schlumpf U. [Лабораторная диагностика моноартрита: сколько, зачем, когда?] Schweiz Rundsch Med Prax. 1993; 82: 419–427. [PubMed] [Google Scholar]
19. Fedrizzi MS, Ronchezel MV, Hilario MO, Lederman HM, Sawaya S, Goldenberg J, et al. УЗИ в ранней диагностике поражения тазобедренного сустава при ювенильном ревматоидном артрите. J Ревматол. 1997;24:1820–1825. [PubMed] [Google Scholar]
20. Lamer S, Sebag GH. МРТ и УЗИ у детей с ювенильным хроническим артритом. Евр Дж Радиол. 2000;33:85–93. [PubMed] [Google Scholar]
21. Qing C, Lei Y, Ma L, Xie P, Deng H. [Клиническое исследование диагностики раннего ревматоидного артрита с использованием визуализации костей с помощью 99mTc-MDP] Sheng Wu Yi Xue Gong Чэн Сюэ Цза Чжи. 2008; 25:1193–1196. [PubMed] [Google Scholar]
22. McKay GM, Cox LA, Long BW. Визуализация ювенильного идиопатического артрита: оценка модальностей. Радиол Техно. 2010;81:318–327. [PubMed] [Академия Google]
2010;81:318–327. [PubMed] [Академия Google]
Руководство для врачей по дифференциальной диагностике
Ревматоидный артрит и ревматическая полимиалгия являются двумя наиболее распространенными системными ревматическими заболеваниями у взрослых. Ревматическая полимиалгия (ПМР) возникает исключительно у людей старше 50 лет, в отличие от ревматоидного артрита (РА), который обычно начинается в возрасте от 30 до 50 лет. Однако другие характеристики симптомов часто перекрываются, что затрудняет дифференциальную диагностику. Ниже приведены два гипотетических случая пациента, за которыми следует обсуждение того, как диагностировать и лечить каждый на основе того, что известно на сегодняшний день о каждом состоянии.
Случай 1
Состояние здоровья 62-летней женщины было хорошим, пока в течение предыдущих 3 недель у нее не появились боли и скованность в шее и плечах, а также в бедрах и нижней части спины. Ее симптомы постепенно ухудшались и теперь мешают ей спать и заниматься повседневными делами. Скованность особенно сильная по утрам, и она сообщает, что «мне требуется час, чтобы расслабиться и приготовить завтрак». У нее не было лихорадки, кожной сыпи или других системных симптомов, но она сообщает об истощении. За последний месяц у нее был плохой аппетит, и она похудела на 5 фунтов. Единственное лекарство, которое она принимала, это антигипертензивное. В течение последних нескольких недель она принимала два или три безрецептурных ибупрофена примерно три раза в день с небольшим улучшением ее симптомов.
Скованность особенно сильная по утрам, и она сообщает, что «мне требуется час, чтобы расслабиться и приготовить завтрак». У нее не было лихорадки, кожной сыпи или других системных симптомов, но она сообщает об истощении. За последний месяц у нее был плохой аппетит, и она похудела на 5 фунтов. Единственное лекарство, которое она принимала, это антигипертензивное. В течение последних нескольких недель она принимала два или три безрецептурных ибупрофена примерно три раза в день с небольшим улучшением ее симптомов.
Общий медицинский осмотр ничем не примечательный. Осмотр опорно-двигательного аппарата (MSK) не выявил явного отека или тепла в конечностях. У пациентки уменьшился диапазон движений в шее, плечах и бедрах, появилась болезненность в области плеч. Неврологическое обследование было нормальным.
Лабораторные данные включали гематокрит 33, но в остальном общий анализ крови и биохимический профиль были нормальными. СОЭ 68 мм/ч, СРБ повышен. Анализы на ревматоидный фактор и антинуклеарные антитела оказались отрицательными.
Случай 2
65-летняя женщина испытывает периодические боли и скованность в коленях, запястьях и плечах в течение последних 3-4 месяцев. Сначала ее симптомы приходили и уходили, но последние 3 недели она испытывает постоянную боль где-то в теле. Она думает, что ее колени и руки опухли, и сообщает, что по утрам чувствует сильную скованность в течение нескольких часов. У нее плохой аппетит, и она отмечает: «Я постоянно истощена». Высыпаний и других системных симптомов не было. Общее состояние ее здоровья хорошее, хотя она имеет небольшой избыточный вес.
Общий физикальный осмотр ничем не примечательный. Обследование MSK выявляет тепло, болезненность и возможную опухоль на обоих запястьях, коленях и лодыжках. Ее сила и неврологическое обследование в норме. Лабораторные тесты показывают гематокрит 31, повышенное количество тромбоцитов и нормальные лейкоциты, повышенную СОЭ 50, повышенный СРБ и отрицательный ревматоидный фактор и антинуклеарные антитела.
Начальная клиническая оценка: какой наиболее вероятный диагноз в случаях 1 и 2?
Первичный дифференциальный диагноз в двух представленных случаях — ревматическая полимиалгия или ревматоидный артрит.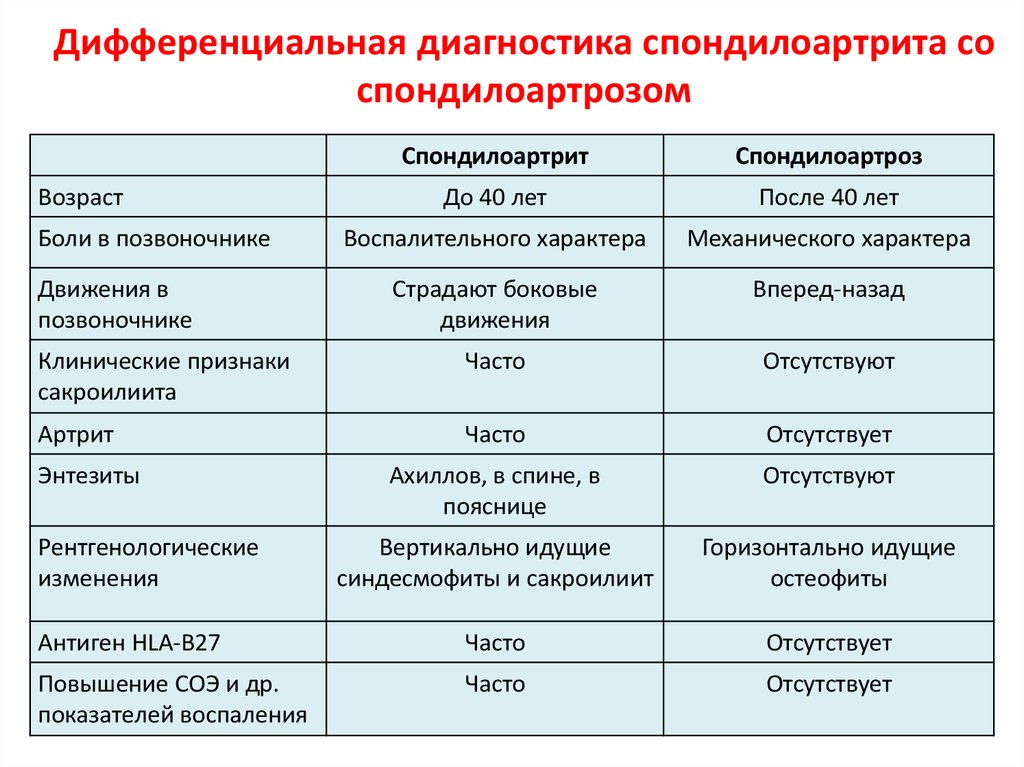 У обоих пациентов есть много сходных черт. Обе женщины примерно одного возраста и в целом с хорошим здоровьем. Каждый из них проявляется диффузной болью в MSK, значительной скованностью и утомляемостью. Боль и скованность очень выражены по утрам и усиливаются в покое или при длительном бездействии. Продолжительность этих симптомов от 3 недель до 3 месяцев исключает возможность инфекционного артрита или артрита, вызванного кристаллами (подагра или псевдоподагра), и значительно снижает вероятность раковой артропатии (паранеопластический синдром).
У обоих пациентов есть много сходных черт. Обе женщины примерно одного возраста и в целом с хорошим здоровьем. Каждый из них проявляется диффузной болью в MSK, значительной скованностью и утомляемостью. Боль и скованность очень выражены по утрам и усиливаются в покое или при длительном бездействии. Продолжительность этих симптомов от 3 недель до 3 месяцев исключает возможность инфекционного артрита или артрита, вызванного кристаллами (подагра или псевдоподагра), и значительно снижает вероятность раковой артропатии (паранеопластический синдром).
Оба пациента также сообщают о снижении аппетита. От половины до одной трети пациентов с ПМР и РА будут испытывать системные симптомы, включая утомляемость, недомогание, анорексию, потерю веса или субфебрилитет. Результаты лабораторных анализов также очень похожи: оба случая демонстрируют умеренную анемию, тромбоцитоз , повышенные реагенты острой фазы (включая СОЭ и СРБ) и отрицательные серологические тесты. Все они представляют собой неспецифические маркеры хронического воспаления, характерные как для ПМР, так и для РА.
Наиболее важным отличительным признаком между этими двумя пациентами является отек и воспаление суставов, затрагивающих колени, запястья и лодыжки, описанные в Случае 2. Множественное воспаление суставов очень необычно для ПМР, но характерно для РА.
ПМР почти всегда проявляется симметричной болезненностью и скованностью в проксимальных мышцах шеи, плеч и тазобедренного пояса. Суставы, вовлеченные в случай 1 (шея, плечи, бедра), предполагают ПМР; тогда как колени, запястья и лодыжки в Случае 2 предполагают РА.
В случае 2 суставные симптомы вначале были более эпизодическими, что также свидетельствует в пользу диагноза РА. ПМР обычно начинается более резко, в течение нескольких дней или недель. Оба случая, вероятно, будут демонстрировать ограниченный диапазон движений (ДД) в пораженных суставах, но при ПМР пассивный ДД обычно сохраняется. Положительный серологический анализ, то есть либо ревматоидный фактор, либо антитела к ЦЦП, мог бы свидетельствовать о РА, но эти результаты отрицательны у 20-40% пациентов с РА.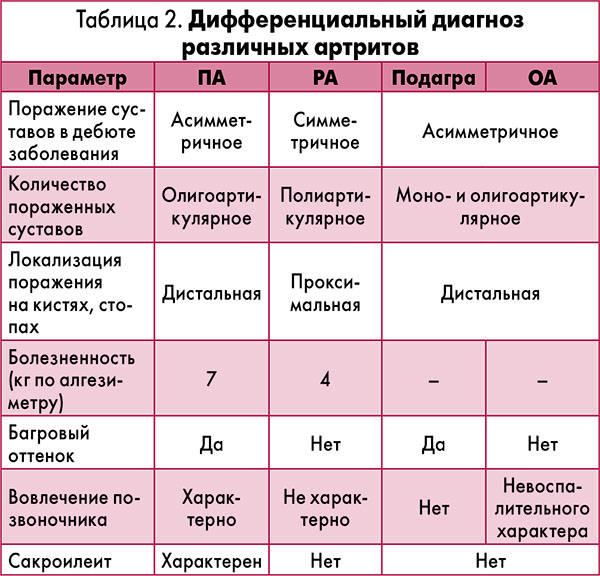
Гигантоклеточный артериит у пациентов с ПМР
У любого пациента с подозрением на ревматическую полимиалгию необходимо подозревать сопутствующий гигантоклеточный (височный) артериит (ГКА). ГКА, который может привести к острой слепоте, аортиту и другим сосудисто-нервным осложнениям, встречается у 10-20% пациентов с ПМР.¹ ГКА может возникать одновременно с ПМР, но также может возникать позже в ходе болезни ПМР.
Каждый пациент с ПМР должен быть расспрошен о впервые появившейся головной боли, визуальных симптомах и перемежающейся хромоте челюстей или конечностей, а также должен быть тщательно обследован на предмет болезненности кожи головы, шумов или отсутствия пульса. Если есть серьезные опасения по поводу ГКА, следует незамедлительно направить пациента к ревматологу, а иногда и к офтальмологу и/или неврологу, а также рассмотреть возможность визуализации сосудов головы/шеи и биопсии височной артерии (см. рис. 1).
Дальнейшее обследование и ведение пациентов
Дополнительные лабораторные тесты, помогающие дифференцировать РА и ПМР у пациентов, отсутствуют. Антитела к ЦЦП, более чувствительные и специфичные, чем ревматоидный фактор, могут быть назначены в Случае 2, а обычные рентгенограммы кистей и запястий были бы уместны, хотя рентгенограммы суставов через 3 месяца часто ничем не примечательны. В случае 1 симметричная боль в проксимальных мышцах могла быть связана с миопатией, хотя мышечная сила и неврологическая оценка были ничем не примечательны. Тем не менее, мышечные ферменты, включая КФК, могут быть рассмотрены.
Антитела к ЦЦП, более чувствительные и специфичные, чем ревматоидный фактор, могут быть назначены в Случае 2, а обычные рентгенограммы кистей и запястий были бы уместны, хотя рентгенограммы суставов через 3 месяца часто ничем не примечательны. В случае 1 симметричная боль в проксимальных мышцах могла быть связана с миопатией, хотя мышечная сила и неврологическая оценка были ничем не примечательны. Тем не менее, мышечные ферменты, включая КФК, могут быть рассмотрены.
Поскольку убедительно доказано, что ПМР является наиболее вероятным диагнозом в Случае 1, следует начать испытание преднизолона в дозе от 10 до 20 мг один раз в день утром. Реакция на низкую дозу преднизолона при ПМР, как правило, настолько драматична, что ее можно использовать для подтверждения клинического диагноза. Большинство пациентов с ПМР чувствуют себя намного лучше, а показатели СОЭ и СРБ обычно значительно снижаются в течение недели.
Пациента 2 с вероятным диагнозом РА следует направить к ревматологу для подтверждения диагноза и назначения препаратов, модифицирующих болезнь.
Характерные признаки, помогающие отличить ревматическую полимиалгию от ревматоидного артрита
И РА, и ПМР чаще встречаются у женщин, но РА обычно начинается в возрасте от 30 до 50 лет. ПМР почти никогда не возникает у людей моложе 50 лет, а обычный возраст начала составляет от 60 до 80 лет. Классически ревматоидный артрит поражает мелкие суставы рук и ног, но также часто поражает колени, запястья и лодыжки. PMR обычно затрагивает шею, плечи и бедра и никогда не затрагивает ступни. Таблица I дополнительно различает характеристики симптомов.
Наиболее полезным отличительным признаком, как и в двух представленных здесь случаях, является наличие воспаления суставов (синовита) при РА. Однако от 10% до 30% пациентов с ПМР могут иметь небольшие выпоты в суставах, например, в коленях. Любая припухлость или воспаление суставов при ПМР имеют тенденцию быть легкими и самокупирующимися. Эрозивный артрит мелких суставов, отличительный признак РА, никогда не возникает при ПМР. Тугоподвижность и боль в области плеч и бедер при ПМР вторичны по отношению к субдельтовидному/субакромиальному бурситу и тендиниту тазового пояса, а не к синовиту.²
Тугоподвижность и боль в области плеч и бедер при ПМР вторичны по отношению к субдельтовидному/субакромиальному бурситу и тендиниту тазового пояса, а не к синовиту.²
Подкожные узелки, обычно вокруг локтей и предплечий, практически патогномоничны для РА, но присутствуют только в 20% случаев. Внесуставные проявления РА, включая легочные или неврологические поражения, встречаются примерно у 10% пациентов и также не являются частью клинической картины ПМР. Положительный ревматоидный фактор или анти-ЦЦП-антитела присутствуют у 50-70% пациентов с РА и отсутствуют при ПМР. Как обсуждалось выше, ответ на низкие дозы преднизолона настолько выражен и быстр, что его можно использовать в диагностических целях при ПМР³˒⁴ 9.0003
РА с началом в пожилом возрасте или ПМР
Дифференциальный диагноз ПМР или РА становится более сложным, когда РА начинается у пожилых пациентов. Примерно у 30% пациентов с РА первые симптомы появляются в возрасте старше 60 лет.⁵
Еще в 1985 году я участвовал в одном из первых исследований того, что мы назвали ревматоидным артритом с началом в пожилом возрасте (EORA), определяемым как РА. начиная с возраста 60 лет.⁶ При сравнении EORA с РА с более ранним началом (YORA) мы обнаружили более резкое начало заболевания, меньшее количество заболеваний мелких суставов и меньшее количество подкожных узелков или положительных тестов на ревматоидный фактор. У четверти EORA клиническая картина была почти неотличима от PMR (см. Таблицу II).
начиная с возраста 60 лет.⁶ При сравнении EORA с РА с более ранним началом (YORA) мы обнаружили более резкое начало заболевания, меньшее количество заболеваний мелких суставов и меньшее количество подкожных узелков или положительных тестов на ревматоидный фактор. У четверти EORA клиническая картина была почти неотличима от PMR (см. Таблицу II).
С тех пор ряд исследований подтвердили наши выводы о большем PMR-типе проявления и лучшем прогнозе при EORA по сравнению с YORA.⁷ Однако у многих пациентов с EORA клинические проявления идентичны таковым у более молодых пациентов, включая серопозитивность. .⁸
Какой терапевтический подход выбрать при ПМР и РА?
Ревматическая полимиалгия Лечение первой линии
Поскольку ПМР так хорошо реагирует на низкие дозы кортикостероидов, врачам первичной медико-санитарной помощи рекомендуется начинать такую диагностическую задачу, когда ПМР настоятельно рассматривается. Рекомендуются дозы от 10 до 20 мг один раз в день утром, и у пациентов должно наблюдаться заметное уменьшение симптомов со значительным снижением СОЭ/СРБ в течение нескольких недель. Обычно дозу снижают до 10 мг/сутки в течение 4-8 недель, а затем медленно по 1 мг каждые 4 недели до отмены. У большинства пациентов с ПМР можно полностью снизить дозу в течение одного года.
Обычно дозу снижают до 10 мг/сутки в течение 4-8 недель, а затем медленно по 1 мг каждые 4 недели до отмены. У большинства пациентов с ПМР можно полностью снизить дозу в течение одного года.
Факторы ГКА
Если диагноз менее определен или предполагается наличие ГКА, пациента следует направить к ревматологу, и направление следует рассматривать как неотложную медицинскую помощь ввиду потенциальной слепоты или необратимой потери функции . Пациентов с подозрением на ГКА обычно начинают с высоких доз кортикостероидов, таких как преднизолон 60 мг/день, в ожидании более точных тестов, таких как биопсия и визуализирующие исследования.
Лечение ревматоидного артрита первой линии
Любой пациент с вероятным ревматоидным артритом должен быть направлен к ревматологу, в идеале в течение нескольких недель после предполагаемого диагноза. Имеются убедительные доказательства того, что своевременное обращение к ревматологу важно для исхода заболевания у пациентов с РА.
Пациентам с подтвержденным диагнозом РА обычно начинают лечение препаратами, модифицирующими заболевание, и быстрое начало сильнодействующей терапии важно для достижения оптимального результата.
Заключение
Наиболее важными данными, помогающими клиницистам отличить ревматическую полимиалгию от ревматоидного артрита, являются история болезни пациента и данные физического осмотра, указывающие на отек и воспаление суставов, которые не являются характерными признаками ПМР.
Другие признаки, отсутствующие при ПМР, но которые могут присутствовать при РА:
множественное поражение мелких суставов
подкожные узелки
положительный ревматоидный фактор и/или анти-ЦЦП антитела
Особенно трудно отличить ПМР от РА, который начинается у пожилых пациентов и часто проявляется выраженной скованностью суставов и утомляемостью. Обратите внимание, что повышенные острофазовые реагенты, как правило, одинаковы у пациентов с ПМР и РА. Наконец, маловероятно, что у любого пациента в возрасте от 50 до 55 лет будет ПМР.
Наконец, маловероятно, что у любого пациента в возрасте от 50 до 55 лет будет ПМР.
Учет этих важных различий при обследовании пациентов может помочь поставщикам медицинских услуг поставить правильный диагноз и направить пациентов на эффективное лечение.
См. также основные моменты совещания ACR 2020 по лечению ревматоидного заболевания у взрослых и детей.
Кроусон К.С., Маттесон Э.Л. Современные оценки распространенности гигантоклеточного артериита и ревматической полимиалгии, 2015 г. Semin Arthritis Rheum. 2017; 47:253.
Henckarts L, Gheysens O, Vanderschueren S, et al. Использование позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой в диагностике ревматической полимиалгии — проспективное исследование 99 пациентов. Реум (Оксфорд). 2018;57:1908.
Гонсалес-Гей М.А., Маттесон Э.Л., Кастанеда С. Ревматическая полимиалгия. Ланцет . 2017; 390:1700.
Lee DM, Weinblatt ME.