Белки, жиры, углеводы: таблицы продуктов и правильное сочетание | Lisa.ru — сайт для женщин о звездах, моде, красоте и отношениях
Знать калорийность БЖУ не менее важно, чем то, в каких продуктах эти вещества содержатся — так становится намного понятнее, почему от одних продуктов мы легко худеем, а от других — никак, да еще и вредим здоровью.
Источник здесь и далее: unsplash.comУглеводы
Белки
Жиры
Энергетическая ценность белков, жиров, углеводов
Как сочетать БЖУ, чтобы худеть (таблица)
Вся пища состоит из углеводов, белков, жиров или смеси этих питательных веществ. При этом в рационе необходимо каждое из этих питательных веществ, чтобы помочь организму нормально функционировать. Вопрос лишь в том, сколько именно и чего должно быть в твоей тарелке.
У каждого из них свои задачи:
- Углеводы являются основным источником топлива или энергии для организма.
- Белок помогает наращивать мышечную ткань и восстанавливать организм после повреждений или стресса.

- Жиры дают энергию на долгий срок, являются запасом для организма на случай ухудшения окружающей ситуации.
А теперь поговорим о каждом подробнее и назовем примеры продуктов, богатых углеводами жирами и белками.
Углеводы
Они являются основным источником топлива или энергии для нашего организма. Углеводы действуют как бензин в автомобиле. Внутри нас они превращаются в глюкозу. Наши работающие мышцы и мозг нуждаются в этой глюкозе, чтобы хорошо работать. Без них — никак.
Но Необходимо употреблять нужное количество углеводов, без крайностей, чтобы быть здоровым и при этом контролировать уровень сахара в крови.
Продукты, в которых содержатся углеводы
Фрукты и овощи
Все фрукты (кроме авокадо) и крахмалистые овощи содержат углеводы. Примеры:
Зерновые
Молочные продукты
Бобовые
Сладости
Поэтому необходимо ограничить размер своей порции и количество сладостей.
Белки
Белок помогает наращивать ткани и восстанавливать ваше тело после повреждений или стресса. Белок не повышает уровень сахара в крови.
Белок не повышает уровень сахара в крови.
Продукты, содержащие большее количество белка
Жиры
Жиры не повышают уровень сахара в крови, они необходимы для хорошего здоровья.
Существует три основных типа жиров: ненасыщенные, насыщенные и трансжиры.
1. Ненасыщенные жиры
Поступают из растений, рыбы.Слишком большое его количество способно привести к образованию бляшек в кровеносных сосудах.
Продукты с ненасыщенными жирами
2. Насыщенные жиры
Жиры, содержащиеся в основном в организме животных, известны как насыщенные. Они способны повышать уровень ЛПНП (плохого) холестерина.
Продукты с ними
Трансжиры
Это искусственные жиры или жиры промышленного (фабричного) производства. Они очень вредны для здоровья. Трансжиры могут повышать уровень ЛПНП (плохого) холестерина и снижать уровень ЛПВП (хорошего).
Продукты с трансжирами
Энергетическая ценность белков, жиров и углеводов
Таблицы продуктов, богатых углеводами, жирами и белками, мы показали. Однако важно помнить, что у каждого из этих составляющих есть своя энергетическая ценность — то есть количество энергии, которое будет вырабатывать организм для их усвоения.
Однако важно помнить, что у каждого из этих составляющих есть своя энергетическая ценность — то есть количество энергии, которое будет вырабатывать организм для их усвоения.
- Белки — 17,6 кДж/г (4,2 ккал).
- Углеводы — 17,6 кДж/г (4,2 ккал).
- Жиры — 38,9 кДж/г (9,2 ккал).
Как видишь, Поэтому много жиров можно есть тем, кто занимается тяжелой физической работой или активным спортом.
В остальных случаях в рационе должны преобладать белки и углеводы.
Как сочетать БЖУ, чтобы худеть
Можно терять вес с помощью самых разных способов питания. Некоторые очень хорошо справляются с диетой с высоким содержанием белка, в то время как другие предпочитают придерживаться Средиземноморской, вегетарианской или просто максимально низкокалорийной диеты.
Но для результата можно не выбирать какую-то из диет, а просто правильно сочетать элементы питания. Плюс — важно добавить физическую активность, хотя это не главное, но все же важное дополнение.
Мы собрали таблицу, где указано, сколько необходимо употреблять белки, жиры, углеводы в граммах в зависимости от общей суточной калорийности твоего рациона.
Таблица начинается с 1000 калорий в день, но важно отметить, что минимальное количество калорий, рекомендуемое для взрослых, составляет 1800 калорий в день для женщин, ведущих сидячий образ жизни, и 2400 калорий в день для мужчин, ведущих сидячий образ жизни. Только дети и подростки могут употреблять меньше калорий, при этом удовлетворять свои потребности в питании.
В целом взрослым рекомендуется употреблять 10%-35% калорий из белков, 45%-65% из углеводов и 20%-35% — из жиров, при этом лишь 10% от общего количества калорий должно приходить из насыщенных жиров.
Перед использованием таблицы лучше проконсультироваться с диетологом и выбрать те показатели, которые подходят именно тебе.
Низкокалорийное питание
Питание нормальной и высокой калорийности
«Трапеза чемпионки»: какие продукты нельзя сочетать
21.01.2015 16:09 Тема: Здоровое питание 21846
Фото: Антонина Лазукова
Чтобы извлечь максимальную пользу из питания, независимо от того, набираете вы массу или худеете, важно правильно сочетать продукты.
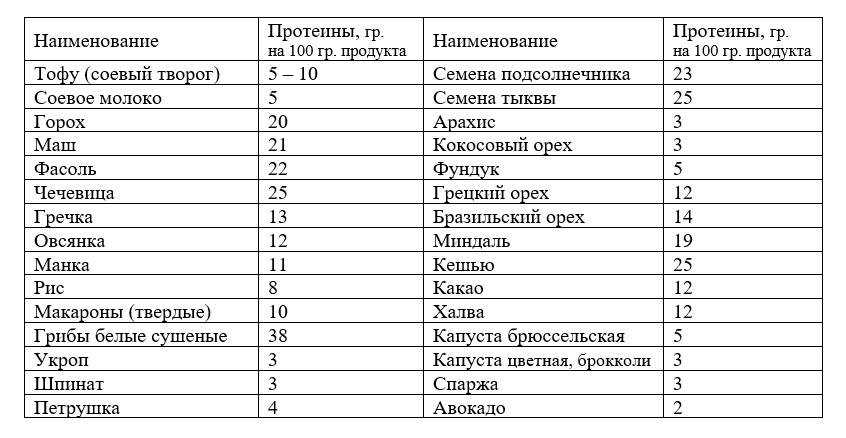
Белки
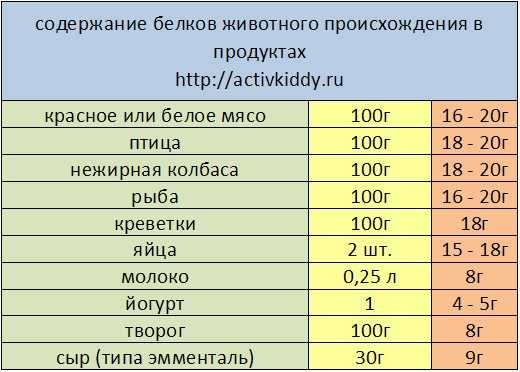
К продуктам, в которых находится наибольшее количество протеинов, относятся яйца, творог, курица, мясо, рыба. В отличие от растительных белков животные легче усваиваются организмом.
Для переваривания такой пищи в желудке должна быть кислая среда, поэтому нельзя запивать белковые продукты водой. Процесс переваривания занимает 3-4 часа, поэтому следующий приём пищи должен быть не раньше положенного перерыва. Белки лучше усваиваются вместе с овощами, поэтому в качестве гарнира к рыбе или мясу нужно использовать салаты.
Углеводы
Макароны, крупы, картофель и хлеб перевариваются в щелочной среде. Углеводы отлично усваиваются, если их не смешивать с белковыми продуктами. На переваривание требуется 1,5-2 часа. Также углеводы нельзя запивать водой, пить следует не ранее чем через полчаса после приёма пищи.
Фрукты
В правильном питании фрукты играют роль заменителя сладостей, а также служат источником быстрых углеводов. Их стоит есть отдельно от остальных продуктов, а принимать основную пищу следует не ранее чем через полчаса после фруктов. Между собой можно смешивать фрукты, которые относятся к группе сладких, например, финики, инжир, бананы, сухофрукты. Также их можно сочетать с молочными продуктами, например, с творогом. Полукислые фрукты, такие как яблоки, персики, груши, виноград, манго можно смешивать между собой, но дополнять молочными продуктами нежелательно.
Их стоит есть отдельно от остальных продуктов, а принимать основную пищу следует не ранее чем через полчаса после фруктов. Между собой можно смешивать фрукты, которые относятся к группе сладких, например, финики, инжир, бананы, сухофрукты. Также их можно сочетать с молочными продуктами, например, с творогом. Полукислые фрукты, такие как яблоки, персики, груши, виноград, манго можно смешивать между собой, но дополнять молочными продуктами нежелательно.
Овощи
Овощи хорошо сочетаются с белками, но не следует смешивать их с фруктами и молоком. Сложные овощи, такие как цветная капуста, кабачки, баклажаны, тыква, сочетаются с продуктами, содержащими крахмал и другими овощами, но с белками и фруктами их употреблять нежелательно.
Вывод
Первое, второе и десерт не вписываются в правильное питание, поэтому, например, обед можно разделить на три приёма пищи. В 12 съесть фрукт, через час картофель с цветной капустой, через полчаса попить чай, а еще через час съесть мясо с овощами. Таким образом, вы не проголодаетесь до ужина.
Таким образом, вы не проголодаетесь до ужина.
Кстати, следующее блюдо, приготовленное специально для раздела «К-Спорт» чемпионкой России и абсолютной чемпионкой Европы среди юниорок в категории бодифитнес Антониной Лазуковой, идеально подходит для белкового обеда или ужина.
Куриные рулетики с кальмаром
Ингредиенты: 1 кг куриного филе, 500 г кальмара, 1 яйцо, половина луковицы, соль и перец по вкусу.
Пищевая ценность 100 г: калорийность — 104,4 ккал, белки — 19,4 г; жиры — 2,6 г; углеводы — 0,9 г.
Все продукты, использованные для приготовления блюда, приобретены в магазинах торговой сети «Вестер».
Kaлининград.Ru
Ключевые слова: диета.
Подписывайтесь на Калининград.Ru в соцсетях и мессенджерах! Узнавайте больше о жизни области, читайте только самые важные новости в Viber , получайте ежедневный дайджест главного за сутки в основном канале в Telegram и наслаждайтесь уютной атмосферой и фактами из истории региона — во втором телеграм-канале
Нашли ошибку в тексте? Выделите мышью текст с ошибкой и нажмите [ctrl]+[enter]
Комментарии
Обсуждайте новости Калининграда и области в наших социальных сетях
Материалы по теме: Здоровое питание
Популярное
- Рядом с «Вагонкой» в Калининграде начали обустраивать спортивную площадку
- Янтарный комбинат выставит на аукцион 25 самородков-гигантов
- Зданию начала XX века в Калининградском зоопарке вернут исторический облик
- Все новости
Архив новостей
| « | Март 2023 | » | ||||
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 | 31 | ||
Видео
|
© Информационно-аналитический портал Калининграда. Учредитель ООО «В-Медиа». Главный редактор: Чистякова Л.С. Электронная почта: [email protected], телефон + 7 (4012) 507508. Свидетельство о регистрации СМИ ЭЛ No ФС77-84303 от 05.12.2022г. Выдано федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор). Перепечатка информации возможна только с указанием активной гиперссылки. Материалы в разделах «PR», «Новости бизнеса» и «Другие новости» публикуются на правах рекламы. |
Телефон редакции: (4012) 507-508 Пользовательское соглашение Политика конфиденциальности |
|
18+ Реклама на Калининград.RuРедакция Обратная связь |
Developed by Калининград.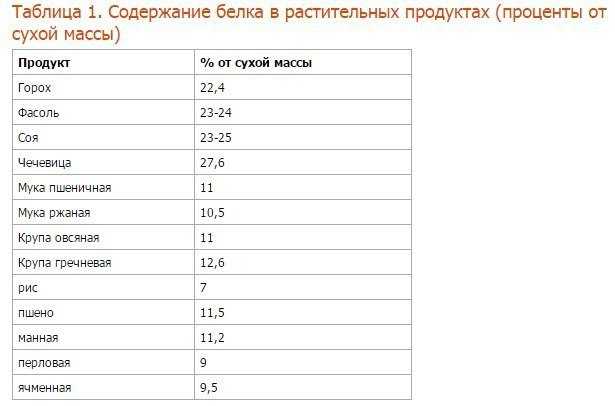 Ru
Ru
Обзор методов анализа белков | Thermo Fisher Scientific
Количественное определение концентрации белка является неотъемлемой частью любого лабораторного рабочего процесса, включающего выделение, очистку, маркировку или анализ белка. Тесты Pierce Protein Assays предоставляют широкий спектр возможностей для точного определения концентрации белка на основе времени анализа, чувствительности, совместимости, линейности стандартной кривой и вариаций между белками. Хотя в этой статье в качестве примеров используются продукты для анализа белков Pierce, обсуждаемые принципы и химические процессы в целом применимы к большинству доступных колориметрических или флуорометрических методов анализа белков.
Explore BCA Assay Kits Explore Bradford Assay Kits Техническое руководство по анализу белков
Содержание страницы
- Introduction
- Selecting a protein assay
- Selecting a protein standard
- Sample preparation for protein assays
- Protein-to-protein variation
- Protein-protein variation of protein assays
- Calculations and data analysis
- Количественный анализ пептидов
Введение
Количественное определение белка часто необходимо перед обработкой образцов белка для выделения, разделения и анализа с помощью хроматографических, электрофоретических и иммунохимических методов. В зависимости от требуемой точности, количества и чистоты доступного белка для определения концентрации белка подходят разные методы.
В зависимости от требуемой точности, количества и чистоты доступного белка для определения концентрации белка подходят разные методы.
Самый простой и прямой метод определения концентрации белка в растворе заключается в измерении поглощения при 280 нм (УФ-диапазон). Аминокислоты, содержащие ароматические боковые цепи (например, тирозин, триптофан и фенилаланин), сильно поглощают УФ-излучение. Белки и пептиды поглощают УФ-свет пропорционально содержанию в них ароматических аминокислот и общей концентрации. Другой метод, традиционно используемый при анализе аминокислот с помощью ВЭЖХ, заключается в мечении всех первичных аминов (т. е. N-конца и боковой цепи остатков лизина) окрашенным или флуоресцентным красителем, таким как нингидрин или о-фталевый альдегид (OPA). Подходы с прямым поглощением УФ-света и реагентом ВЭЖХ имеют определенные недостатки, которые делают эти методы непрактичными для использования с типичными образцами белка в рабочих процессах протеомики. Метод УФ-абсорбции не идеален для белковых смесей, так как разные белки имеют различное содержание ароматических аминокислот, что меняет характеристики поглощения.
Чтобы преодолеть эти недостатки, было разработано несколько колориметрических и флуоресцентных методов анализа белков на основе реагентов, которые используются почти во всех лабораториях, занимающихся исследованиями белков. Образцы белка добавляются к реагенту, вызывая изменение цвета или усиление флуоресценции пропорционально добавленному количеству. Концентрацию белка определяют по стандартной кривой, состоящей из известных концентраций очищенного эталонного белка. Эти методы анализа белка можно разделить на две группы в зависимости от типа используемой химии.
Таблица 1. Типы, преимущества, недостатки и примеры методов анализа белка.
| Method | Advantages | Disadvantages | Example assay reagents |
|---|---|---|---|
| UV absorption |
|
| |
| Методы биурета: Хелатирование белкового коппера и вторичное обнаружение пониженной меди |
|
| BCA-анализы Лоури Анализы |
| Методы на основе колориметрического красителя: Бесвязка белка и прямое обнаружение в цвете |
|
| Bradford (Coomassie) |
| Методы флуоресцентного красителя: Связывание белка с красителем и прямое обнаружение увеличения флуоресценции, связанного со связанным красителем не является критическим фактором, поэтому тесты могут быть адаптированы для автоматизированной обработки в высокопроизводительных приложениях |
| Флуоресцентный анализ EZQ Анализ белков Qubit |
Выбор анализа белка
Ни один реагент не может считаться идеальным или лучшим методом анализа белка.
Цель состоит в том, чтобы выбрать метод, который требует наименьших манипуляций или предварительной обработки образцов для включения веществ, мешающих анализу. Каждый метод имеет свои определенные преимущества и недостатки. Поскольку ни один реагент не может считаться идеальным или лучшим методом анализа белка для всех обстоятельств, большинство исследователей имеют в своих лабораториях более одного типа анализа белка.
Важные критерии выбора теста включают:
- Совместимость с типом образца и компонентами
- Диапазон анализа и требуемый объем образца
- Однородность между белками (см. ниже)
- Скорость и удобство для количества тестируемых образцов
- Необходимо наличие спектрофотометра или планшет-ридера для измерения цвета (абсорбции) при анализе
Некоторыми распространенными веществами, которые потенциально могут мешать методам анализа белка, являются восстановители (например, DTT) и детергенты (например, Triton X-100). Как правило, образцы, содержащие восстановители или хелатообразователи меди, предпочтительно анализируют с помощью анализов на основе красителя Кумасси (метод Бредфорда). Это связано с тем, что анализы на основе красителя Кумасси, такие как анализы Пирса Кумасси (Брэдфорд) и Пирс Кумасси Плюс (Брэдфорд), совместимы с восстанавливающими агентами и не требуют реакций связывания меди с белком. Для тех образцов, которые содержат детергенты, анализы белка на основе меди, такие как анализ Pierce Rapid Gold BCA, являются лучшим выбором, поскольку они не ингибируются низкими или умеренными количествами детергента.
Помимо совместимости образцов, анализы белков также обычно группируются по диапазону концентраций белка, которые они могут обнаружить. Для образцов, в которых ожидается низкая концентрация белка (<20 мкг/мл), может потребоваться использование альтернативного протокола анализа для микропланшетов или специализированного анализа, такого как анализ белка Pierce Micro BCA, который специально разработан для разбавлять образцы. Если общая концентрация белка в образцах высока (> 2000 мкг/мл), часто можно использовать разбавление образца для преодоления любых проблем с известными мешающими веществами. Иногда образец содержит вещества, которые делают его несовместимым ни с одним из методов анализа белка. Предпочтительным методом борьбы с этими типами мешающих веществ является их простое удаление.
Тесты Pierce Rapid Gold BCA Protein Assay и Coomassie (Bradford) Protein Assay дополняют друг друга и обеспечивают два основных метода для размещения большинства образцов. Различные вспомогательные реагенты и альтернативные версии этих двух анализов удовлетворяют многие другие потребности в конкретных образцах.
- Загрузить: Таблица совместимости анализов белков
- Изучить: Руководство по выбору анализов белков
Выбор стандарта белка
Поскольку белки различаются по своему аминокислотному составу, каждый из них по-разному реагирует на каждый тип белкового анализа. Таким образом, лучшим выбором в качестве эталонного стандарта является очищенная известная концентрация белка, наиболее распространенного в образцах. Этого обычно невозможно достичь, и это редко удобно или необходимо. Во многих случаях цель состоит в том, чтобы просто оценить концентрацию общего белка, и допустима небольшая вариабельность между белками.
Если высокоочищенная версия интересующего белка недоступна или слишком дорога для использования в качестве стандарта, альтернативой является выбор белка, который будет давать очень похожую кривую цветового отклика в выбранном методе анализа белка и доступны для любой лаборатории в любое время. Как правило, бычий сывороточный альбумин (БСА) хорошо подходит для стандарта белка, поскольку он широко доступен в высокой степени чистоты и относительно недорог. В качестве альтернативы, бычий гамма-глобулин (BGG) является хорошим стандартом при определении концентрации антител, поскольку BGG дает кривую цветового отклика, которая очень похожа на кривую иммуноглобулина G (IgG).
В качестве альтернативы, бычий гамма-глобулин (BGG) является хорошим стандартом при определении концентрации антител, поскольку BGG дает кривую цветового отклика, которая очень похожа на кривую иммуноглобулина G (IgG).
Для наибольшей точности оценки концентрации общего белка в неизвестных образцах важно включать стандартную кривую каждый раз при проведении анализа. Это особенно верно для методов анализа белка, которые дают нелинейные стандартные кривые. Решение о количестве стандартов и повторов, используемых для определения стандартной кривой, зависит от степени нелинейности стандартной кривой и требуемой степени точности. Как правило, для построения стандартной кривой требуется меньше точек, если цветовая характеристика является линейной. Как правило, стандартные кривые строятся с использованием не менее двух повторов для каждой точки на кривой.
- Узнайте больше: Анализ данных анализа белков
- Узнайте: Стандарты анализа белков
Подготовка проб для анализа белков
Перед анализом образца на содержание общего белка его необходимо солюбилизировать, обычно в забуференном водном растворе. Часто принимаются дополнительные меры предосторожности, чтобы подавить рост микробов или избежать случайного загрязнения образца посторонними частицами, такими как пыль, волосы, кожа или кожный жир.
Часто принимаются дополнительные меры предосторожности, чтобы подавить рост микробов или избежать случайного загрязнения образца посторонними частицами, такими как пыль, волосы, кожа или кожный жир.
В зависимости от исходного материала, используемого перед проведением анализа на белок, образец будет содержать различные небелковые компоненты. Осведомленность об этих компонентах имеет решающее значение для выбора подходящего метода анализа и оценки причины аномальных результатов. Например, ткани и клетки обычно лизируют буферами, содержащими поверхностно-активные вещества (детергенты), биоциды (антимикробные агенты) и ингибиторы протеаз. Также могут быть включены различные соли, денатуранты, восстановители и хаотропы. После фильтрации или центрифугирования для удаления клеточного дебриса типичные образцы по-прежнему будут содержать нуклеиновые кислоты, липиды и другие небелковые соединения.
На каждый тип анализа белка отрицательно влияют вещества того или иного рода. Компоненты раствора белка считаются мешающими веществами в анализе белка, если они искусственно подавляют ответ, усиливают ответ или вызывают повышенный фон в произвольно выбранной степени (например, 10% по сравнению с контролем).
Неточность, возникающую из-за небольшого количества мешающего вещества, можно устранить, приготовив стандарт белка в том же буфере, что и анализируемый белок. Для более высоких несовместимых уровней мешающих веществ необходимы другие стратегии:
- Выберите другой метод анализа белка или версию того же метода анализа, который включает компоненты для преодоления помех.
- Провести диализ или обессолить образец для удаления мелких мешающих веществ (т. е. менее 1000 дальтон), таких как восстановители.
- Осадите белок в ТХУ или другом подходящем реагенте, удалите раствор, содержащий мешающий компонент, а затем повторно растворите белок для анализа. На этом рисунке представлен обзор того, как методы белкового диализа используются для удаления веществ, которые могут загрязнять образцы белка и мешать последующим приложениям.
Рис. 1. На приведенной здесь схеме показано, как можно использовать диализную кассету для очистки от белков. 3 мл 1 мг/мл IgG в 0,1 М трис-буфере, рН 7, внутри диализной кассеты помещают в 1000 мл 100 мМ PBS с рН 7,6. Старый диализат выбрасывают и заменяют 1000 мл 100 мМ PBS с pH 7,6. IgG слишком велик, чтобы проникнуть в поры мембраны; следовательно, количество IgG внутри кассеты остается постоянным. Концентрация трис-буфера падает ниже 0,01 М внутри кассеты по мере того, как трис-буфер диффундирует наружу, а в него диффундирует буфер PBS. Опять старый диализат выбрасывают и заменяют 1000 мл 100 мМ PBS с pH 7,6. IgG внутри кассеты остается постоянным. Буфер Tris внутри кассеты падает почти до неопределяемого уровня. Буфер внутри кассеты представляет собой 100 мМ PBS с pH 7,6.
3 мл 1 мг/мл IgG в 0,1 М трис-буфере, рН 7, внутри диализной кассеты помещают в 1000 мл 100 мМ PBS с рН 7,6. Старый диализат выбрасывают и заменяют 1000 мл 100 мМ PBS с pH 7,6. IgG слишком велик, чтобы проникнуть в поры мембраны; следовательно, количество IgG внутри кассеты остается постоянным. Концентрация трис-буфера падает ниже 0,01 М внутри кассеты по мере того, как трис-буфер диффундирует наружу, а в него диффундирует буфер PBS. Опять старый диализат выбрасывают и заменяют 1000 мл 100 мМ PBS с pH 7,6. IgG внутри кассеты остается постоянным. Буфер Tris внутри кассеты падает почти до неопределяемого уровня. Буфер внутри кассеты представляет собой 100 мМ PBS с pH 7,6.
- Загрузить: Удаление мешающих веществ
- Загрузить: Техническое руководство по очистке белков
Межбелковая вариация
Каждый белок в образце дает уникальную реакцию в данном анализе белка. Такая межбелковая вариация относится к различиям в количестве окрашивания (абсорбции), полученным при одновременном анализе одной и той же массы различных белков одним и тем же методом. Эти различия в цветовой реакции связаны с различиями в аминокислотной последовательности, изоэлектрической точке (pI), вторичной структуре и наличии определенных боковых цепей или простетических групп.
Эти различия в цветовой реакции связаны с различиями в аминокислотной последовательности, изоэлектрической точке (pI), вторичной структуре и наличии определенных боковых цепей или простетических групп.
В зависимости от типа образца и цели проведения анализа вариации между белками являются важным фактором при выборе метода анализа белка и выбора соответствующего стандарта анализа (например, BSA или BGG). Методы анализа белков, основанные на аналогичной химии, имеют сходные межбелковые вариации.
Рис. 2. Стандартные кривые. Пример стандартных кривых с использованием очищенного BSA и BGG с набором для анализа белков Pierce BCA, иллюстрирующих различия в интенсивности окраски двух разных белков.
Белково-белковая вариация белковых анализов
Белковые анализы различаются по своей химической основе для обнаружения специфичных для белка функциональных групп. Некоторые методы анализа обнаруживают пептидные связи, но ни один анализ не делает этого исключительно.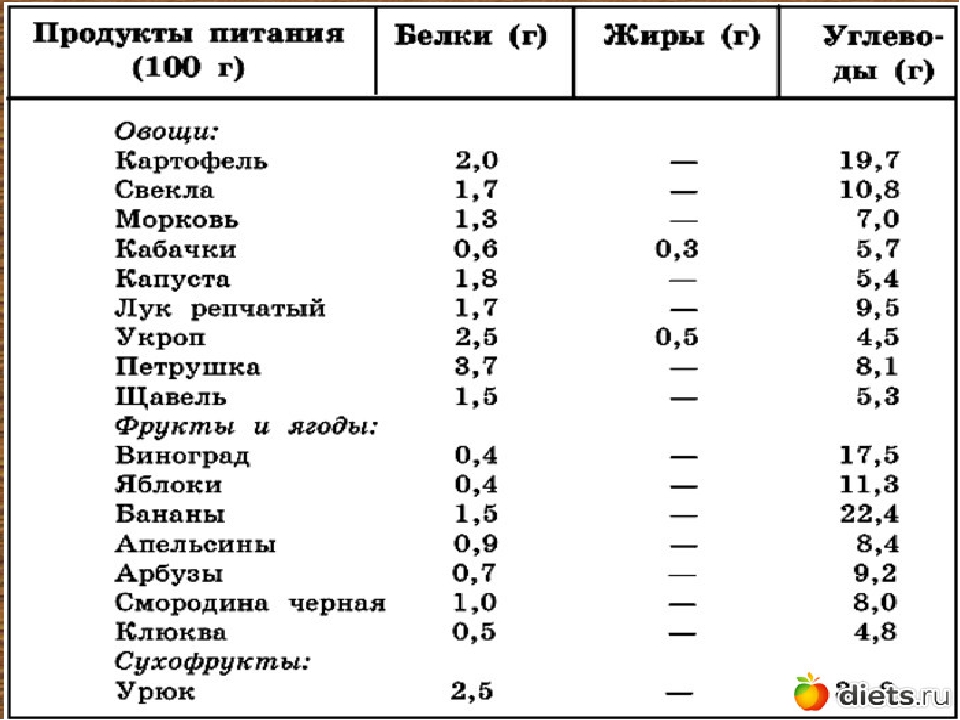 Вместо этого каждый белковый анализ обнаруживает одну или несколько различных конкретных аминокислот с большей чувствительностью, чем другие. Следовательно, белки с разным аминокислотным составом дают окраску с разной скоростью или интенсивностью в любом заданном анализе белка.
Вместо этого каждый белковый анализ обнаруживает одну или несколько различных конкретных аминокислот с большей чувствительностью, чем другие. Следовательно, белки с разным аминокислотным составом дают окраску с разной скоростью или интенсивностью в любом заданном анализе белка.
В следующей таблице сравнивается межбелковая изменчивость цветового отклика нескольких анализов белков Thermo Scientific Pierce. Эти данные служат в качестве общего руководства для оценки различий в реакции между образцами белка. Однако, поскольку сравнения проводились с использованием одной концентрации белка и буфера, их не следует использовать в качестве точных калибровочных факторов.
Эта информация о вариабельности полезна при выборе стандарта белка. Например, когда анализируемый образец представляет собой очищенное антитело, бычий гамма-глобулин (BGG, белок № 5) будет более точным стандартом, чем бычий сывороточный альбумин (BSA, белок № 1). Эти данные также указывают на важность указания того, какой стандарт анализа использовался при сообщении результатов анализа белка.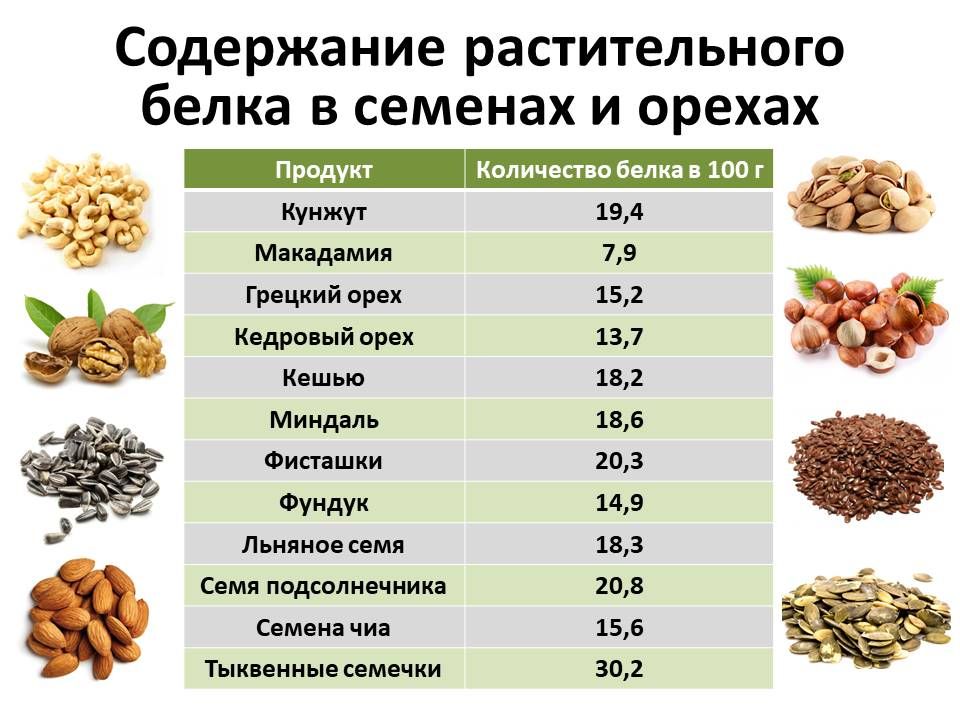
Для каждого из представленных здесь анализов белков было проанализировано 14 белков с использованием стандартного протокола для пробирок. Рассчитывали чистую (с поправкой на контрольную пробу) среднюю абсорбцию для каждого белка. Чистая абсорбция для каждого белка выражается как отношение к чистой абсорбции для BSA (например, отношение 0,80 означает, что белок дает 80% цвета, полученного для эквивалентной массы BSA). Все концентрации белка составляли 1000 мкг/мл, за исключением анализа Micro BCA, в котором концентрация составляла 10 мкг/молоко.
Таблица 2. Обзор анализов белков.
| Results | BCA (Note 1) | Micro BCA | Modified Lowry | Coomassie plus | Coomassie (Bradford) | Пирс 660 нм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Относительная однородность | Высокая | Высокая | High | Medium | Low (Note 2) | Low | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient of variation | 14. 7% 7% | 11.4% | 11.9% | 28.8% | 38.2% | 37% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard deviation | 0.15 | 0.12 | 0.13 | 0.21 | 0.26 | 0.27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Average ratio | 1.02 | 1.05 | 1.09 | 0.73 | 0.68 | 0.74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tested Proteins | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Albumin, bovine serum | 1.00 | 1.00 | 1.00 | 1.00 | 1.00 | 1.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Альдолаза, кроличья мышца | 0,85 | 0,80 | 0,94 | 0,74 | 0,76 | 0,83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3. Альфа-Шаймотрипейн Альфа-Шаймотрипейн | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Альфа-Шаймотрипсин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Альфа-Шаймотрипсин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Альфа-Шаймот.0300 0.99 | 1.17 | 0.52 | 0.48 | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Cytochrome C, horse heart | 0.83 | 1.11 | 0.94 | 1.03 | 1.07 | 1.22 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Gamma Globulin, Bovine | 1,11 | 0,95 | 1,14 | 0,58 | 0,56 | 0,51 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. IgG, Bovine | 98898989898989898989898989898989000.. |  0058 0058 0.63 | 0.58 | — | 7. IgG, human | 1.09 | 1.03 | 1.13 | 0.66 | 0.63 | 0.57 | 8. IgG, mouse | 1.18 | 1.23 | 1.20 | 0.62 | 0.59 | 0.48 | 9. IgG, rabbit | 1.12 | 1.12 | 1.19 | 0.43 | 0.37 | 0.38 | 10. IgG, sheep | 1.17 | 1.14 | 1.28 | 0.57 | 0.53 | — | 11. | 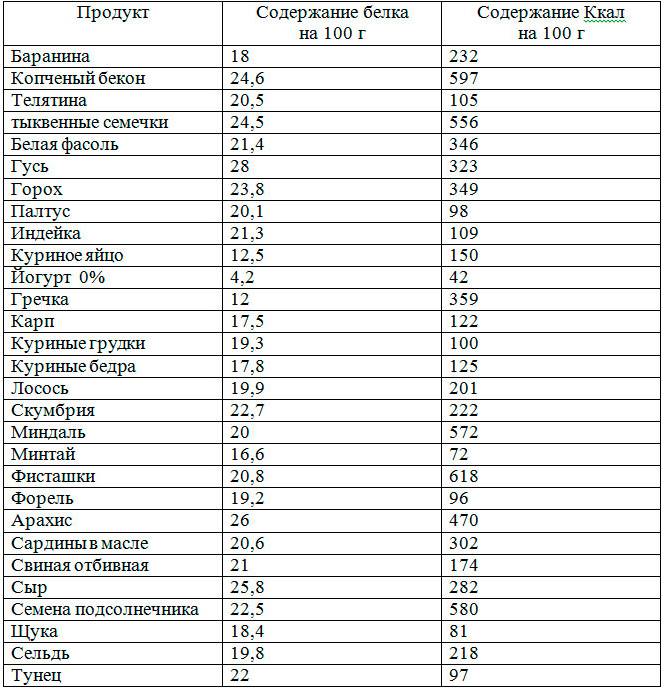 Insulin, bovine pancreas Insulin, bovine pancreas 1.08 | 1.22 | 1.12 | 0.67 | 0.60 | 0.81 | 12. Myoglobin, horse heart | 0.74 | 0.92 | 0.90 | 1.15 | 1.19 | 1.18 | 13. Ovalbumin | 0.93 | 1.08 | 1.02 | 0.68 | 0.32 | 0.54 | 14. Transferrin, human | 0.89 | 0.98 | 0.92 | 0.90 | 0.84 | 0.8 | 15 . alpha-Lactalbumin | — | — | — | — | — | 0. |  82 82 16. Lysozyme | — | — | — | — | — | 0,79 | 17. Ингибитор трипсина, соевый бобы | — | — | — | — | — | 0,388 | 9003.1058 9005 888.9005 888.9005 888.9005 888.9005.138.9005.1058 | 9005. Примечания: 1. Анализ совместимости с восстановителем (BCA-RAC) также показал низкий коэффициент вариации. 2. Тест Bio-Rad Bradford Protein Assay, протестированный с теми же белками, что и наш анализ Coomassie (Bradford), показал очень высокий коэффициент вариации (46%), что соответствует очень низкой относительной однородности. | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Расчеты и анализ данных
В большинстве анализов белков концентрация белка в образце определяется путем сравнения результатов анализа с ответами серий разведений стандартов, концентрации которых известны.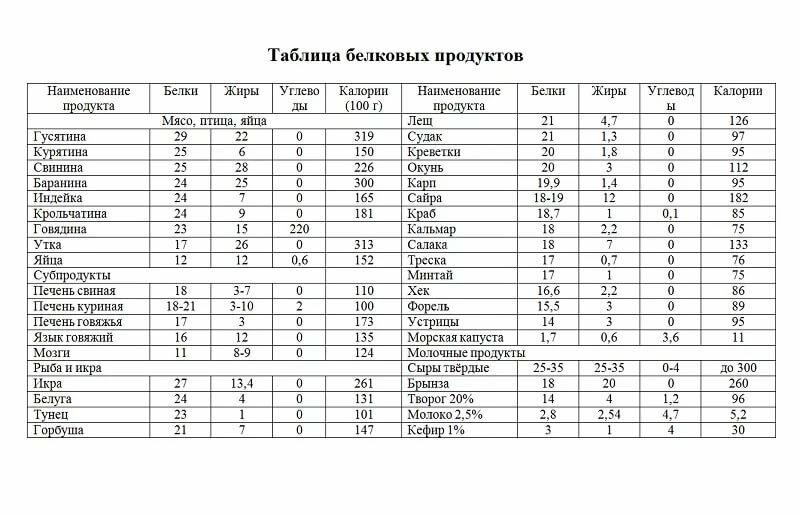 Образцы белка и стандарты обрабатываются таким же образом, смешивая их с реагентом для анализа и используя спектрофотометр для измерения оптической плотности. Отклики стандартов используются для построения или расчета стандартной кривой. Затем значения абсорбции неизвестных образцов интерполируются на график или формулу стандартной кривой для определения их концентраций.
Образцы белка и стандарты обрабатываются таким же образом, смешивая их с реагентом для анализа и используя спектрофотометр для измерения оптической плотности. Отклики стандартов используются для построения или расчета стандартной кривой. Затем значения абсорбции неизвестных образцов интерполируются на график или формулу стандартной кривой для определения их концентраций.
Очевидно, что наиболее точные результаты возможны только при одинаковой обработке неизвестных и стандартных образцов. Это включает их анализ в одно и то же время и в одних и тех же буферных условиях, если это возможно. Поскольку задействованы разные этапы пипетирования, повторения необходимы, если кто-то хочет рассчитать статистику (например, стандартное отклонение, коэффициент вариации) для учета случайной ошибки.
Рисунок 3. Сравнение точечных и линейных стандартных кривых. Интерполяция и расчет для тестового образца, имеющего оптическую плотность 0,6, приводят к значительно отличающимся значениям концентрации белка. В этом случае точечный метод явно дает более точную опорную линию для расчета тестовой выборки.
В этом случае точечный метод явно дает более точную опорную линию для расчета тестовой выборки.
Хотя большинство современных спектрофотометров и устройств для чтения планшетов имеют встроенное программное обеспечение для анализа данных белкового анализа, технические специалисты часто неправильно понимают некоторые факторы. Потратив несколько минут на изучение и правильное применение принципов этих расчетов, можно значительно улучшить свои возможности в разработке анализов, дающих максимально точные результаты (см. соответствующие технические советы и ссылки).
- Загрузить: Определение длины волны для измерения белковых анализов
- Загрузить: Как использовать стандартную кривую
Количественный анализ пептидов
Для рабочих процессов, использующих протеомику с использованием масс-спектрометрии, важно измерять концентрацию пептида после этапов расщепления белка, обогащения и/или очистки C18, чтобы нормализовать вариации между образцами.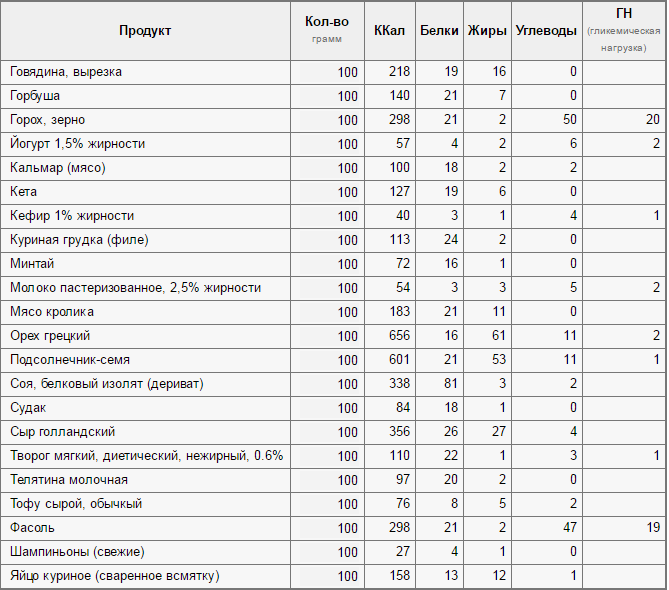 В частности, для экспериментов, использующих изобарическую маркировку, очень важно обеспечить маркировку равных количеств образца перед смешиванием, чтобы получить точные результаты.
В частности, для экспериментов, использующих изобарическую маркировку, очень важно обеспечить маркировку равных количеств образца перед смешиванием, чтобы получить точные результаты.
Подобно методам анализа белков, для определения концентрации пептидов доступны различные варианты. Исторически сложилось так, что для измерения концентраций пептидов использовались УФ-видимая (А280) или колориметрическая методика анализа белка на основе реагентов. Часто используются анализы как BCA, так и микро-BCA. Хотя эти стратегии хорошо работают для образцов белков, эти реагенты не предназначены для точного обнаружения пептидов. В качестве альтернативы, количественные анализы пептидов — в колориметрическом или флуориметрическом формате — доступны для специфического количественного определения смесей пептидов. При принятии решения об использовании формата колориметрического или флуорометрического микропланшета для количественного анализа пептидов необходимо учитывать следующие важные критерии:
- Совместимость с типом образца, компонентами и рабочими процессами
- Диапазон анализа и требуемый объем образца
- Скорость и удобство для количества тестируемых образцов
- Наличие спектрофотометра или флуорометра, необходимого для измерения результатов анализа
В этих репрезентативных данных сравниваются результаты, полученные с помощью колориметрического и флуориметрического анализов.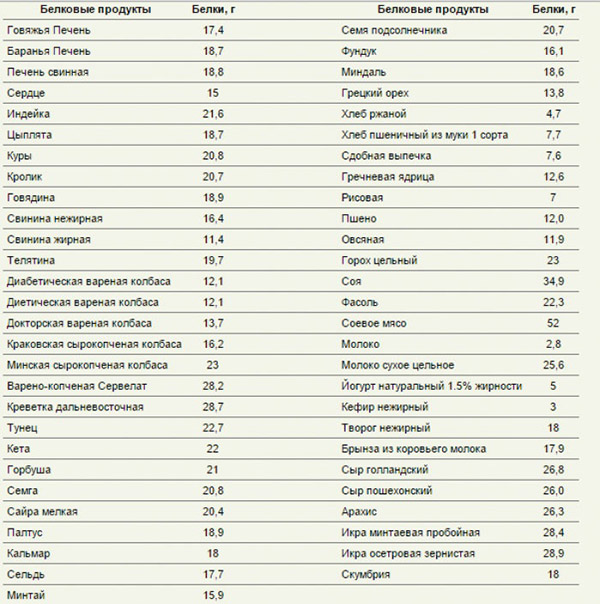
Рисунок 4. Количественное сравнение колориметрического и флуорометрического анализов пептидов. Расщепления триптических пептидов получали из двенадцати клеточных линий. Концентрации расщепленных пептидов определяли с использованием наборов для количественного колориметрического анализа пептидов Thermo Scientific Pierce и наборов для количественного флуорометрического анализа пептидов Pierce в соответствии с инструкциями. Каждый образец анализировали в трех повторностях, и концентрацию каждого гидролизата рассчитывали с помощью стандартной кривой, построенной с использованием стандарта анализа гидролизата белка.
Рекомендуемое чтение
- Брэдфорд, MM. (1976) Быстрый и чувствительный метод количественного определения количества белка в микрограммах, использующий принцип связывания белка с красителем. Аналитическая биохимия. 72, 248-254.
- Smith, P.K., Krohn R.I., Hermanson G.T., et al. (1987) Измерение белка с использованием бицинхониновой кислоты.
 Аналитическая биохимия. 150, 76-85.
Аналитическая биохимия. 150, 76-85. - Крон, Р.И. (2002). Колориметрическое определение и количественный анализ общего белка, Текущие протоколы клеточной биологии, A.3H.1-A.3H.28, John Wiley & Sons, Inc.
- Крон, Р.И. (2001). Колориметрическое определение общего белка, текущие протоколы пищевой аналитической химии, B1.1.1-B1.1.27, John Wiley & Sons, Inc.
- Lowry, OH, Rosebrough, NJ, Farr, AL, et al. (1951) Измерение белка с помощью фолинофенольного реагента. Журнал биологической химии. 193, 265-75.
- Леглер Г., Мюллер-Платц К.М., Ментгес-Хетткамп М. и др. (1985) На химической основе определения белка Лоури. Аналитическая биохимия. 150, 278-87.
Статьи по Теме
- Технический документ: анализ белка BCA Pierce Rapid Gold
- Технический совет: коэффициент экстинкции и концентрация белка
Преобразование азота в белок – более 6
%PDF-1.4 % 1 0 объект > эндообъект 9 0 объект /Заголовок /Предмет /Автор /Режиссер /CreationDate (D:20230225123208-00’00’) /Комментарии () /Компания (UMR INRA/INAPG PNCA) /Ключевые слова () /ModDate (D:201



 Анализы на основе красителя кумасси
Анализы на основе красителя кумасси Аналитическая биохимия. 150, 76-85.
Аналитическая биохимия. 150, 76-85.